

2020年6月JP Morgan Healthcare会議2022年1月10日展示99.1

前向き陳述本プレゼンテーションには、1995年の私証券訴訟改革法で指摘された“前向き陳述”が含まれている。前向きな陳述は歴史的事実でもなく、未来の業績の保証でもない。逆に、それらは現在の業務の未来、未来の計画と戦略、臨床結果と他の未来の状況に対する私たちの信念、期待、仮説に基づいている。本プレゼンテーションに含まれる歴史的事実陳述を除いて、他のすべての陳述は、ATEA製薬会社(“会社”)の将来の経営および財務状況に関する陳述を含み、私たちが予想している現金滑走路、業務戦略、現在と予想される候補製品、予想されるマイルストーン事件、候補製品の潜在的な利益と市場機会、計画中の臨床試験は、予想される起動、登録、規制提出およびデータ読み出しスケジュールを含むが、臨床前活動、製品承認、製造可用性、市場承認製品の受け入れ度、研究開発コストを含む。現在と未来の協力;そして投資家の見通しと機会。場合によっては、“可能”、“将”、“すべき”、“予想”、“計画”、“予想”、“br}”、“可能”、“意図”、“目標”、“プロジェクト”、“予想”、“信じ”、“推定”、“予測”、“潜在的”または“継続”などの用語または他の同様の表現によって識別することができる。本プレゼンテーションにおける情報は,本稿で述べた前向き陳述を含むが,本プレゼンテーションの発表日までの観点を代表している.これらの声明は約束でも保証でもない, しかし、既知と未知のリスク、不確定性とその他の重要な要素に関連し、著者らの実際の結果、業績或いは成果は展望性表現中の明示或いは暗示の任意の期待結果、業績或いは成果と大きく異なる可能性がある。薬物開発過程と規制承認過程に固有の不確実性、特にフェノブビル(AT-527)、ルザスビルとAT-752を含む実際の結果をもたらす可能性のあるリスクおよび不確定要素は、私たちの第三者への依存であり、私たちは常にこれらの第三者を完全にコントロールしているわけではないかもしれない;新冠肺炎とC型肝炎治療および新冠肺炎とデング熱ワクチンの競争;新冠肺炎の大流行に関連するリスク;そして、米国証券取引委員会(“米国証券取引委員会”)に提出された最新の10-Q表四半期報告および米国証券取引委員会に提出された他の文書に記載されている他の重要なリスクおよび不確実性を提供する。新しいリスク要素と不確定要素は時々出現する可能性があり、すべてのリスク要素と不確定要素を予測することは不可能である。したがって、私たちはあなたにこのような前向きな陳述に過度に依存しないように注意します。法的要件が適用されない限り、私たちは、任意の新しい情報、未来のイベント、状況の変化、または他の理由による、本明細書に含まれる任意の前向きな陳述を公開または修正するつもりはありません。このような任意の前向き陳述の正確性については、 (明示的または暗示的)は何も保証されない。本プレゼンテーションで使用した業界情報市場データと業界情報は、いずれも管理職の業界に対する理解と管理層に対する誠意の見積もりに基づいている。私たちはまだ利用可能な範囲で, 管理層に基づいて、いくつかの第三者ソースによって作成された独立業界調査と出版物、および他の公開されて得られる情報を審査する。本プレゼンテーションで使用するすべての市場データや業界情報は,多くの仮定や制限を扱っているので,このような見積りを過度に重視しないように注意されたい.我々はこれらのソースが信頼できると信じているにもかかわらず,これらの情報の正確性や完全性を保証することはできず,我々はこれらの情報を独立に確認していない.本プレゼンテーションに含まれる推定市場地位,市場機会,市場規模情報は全体的に信頼できると考えられるが,これらの情報(一部は管理層の見積もりや信念から)は本質的に不確実で不正確である.このような陳述または予測の正確性については、当社またはその任意の関連会社は、いかなる陳述または保証もしない。各種の要素、上述の要素を含むため、私たちの未来の業績と私たちの業界の未来の業績の予測、仮説と推定は必ず高度な不確定性とリスクの影響を受ける。これらの要素と他の要素は結果が私たちの推定と信念および独立した各方面が作成した推定に表現された結果とは大きく異なる可能性がある。免責声明

一本鎖RNAウイルスの治療適応 臨床前1期2期3冠ウイルス科新冠肺炎Bemnifosbuvir(AT-527)ヌクレオチド*新冠肺炎とプロテアーゼ阻害剤Bemnifosbuvirヌクレオチドの併用C型肝炎ウイルス(C型肝炎)BemnifosbuvirヌクレオチドC型肝炎ウイルスデング熱ウイルスRuzasvir*(NS 5 A阻害剤)AT-752ヌクレオチドパラミクソウイルス科気道合胞体ウイルス(RSV)候補製品特許プラットフォームを併用して深度抗ウイルス導管Bemnifosb uvir(AT-527):2022年の多くの価値駆動マイルストーンの推進計画において、新冠肺炎とプロテアーゼBosnifosb vi主幹virの第一選択選択因子は2022年余りの価値駆動マイルストーンの推進計画において、新冠肺炎とプロテアーゼ阻害剤Bemnifosb uvir(AT-527)を産生する。2025年9月30日現在の現金および現金等価物の価値は8.397億ドルの突出しており、BemnifosbuvirはAT-527の一般名であることを示している*Bemnifosbuvirは二重プロドラッグヌクレオチド類似体である**メルク社のすべての用途の世界的独占許可

新冠肺炎ベネホビルを全面的に使用する

ビンニホブビルの新冠肺炎のビジョン: 第一種連合療法の主幹ビンネフォブビル(AT-527)は新冠肺炎経口ヌクレオチドの重要な挑戦を解決し、このヌクレオチドは注目/興味のあるSARS-CoV-2変異標的ウイルスRNAポリメラーゼの抗ウィルス活性を有する。高度に保守的な酵素はウイルス複製に重要である は二重標的が高耐性バリアを産生する独特な機序を持っている:Niran抑制鎖終結(RdRp)は非臨床研究において哺乳動物細胞にウイルスゲノムの突然変異非変異を導入しておらず、ハイリスク患者の複製とPh 2に示された非奇形快速持続的な抗ウイルス活性に対してBemnifosvir Niran RdRp Nsp 12機能域SARS-CoV-2 N-51 932-C 366 249 RdRp=RNA依存性RNAポリメラーゼNiran= nidVirus RdRp関連の転移ヌクレオチド酵素新冠肺炎(T)の連合治療として確立された多種のウイルス基幹薬物として確立された
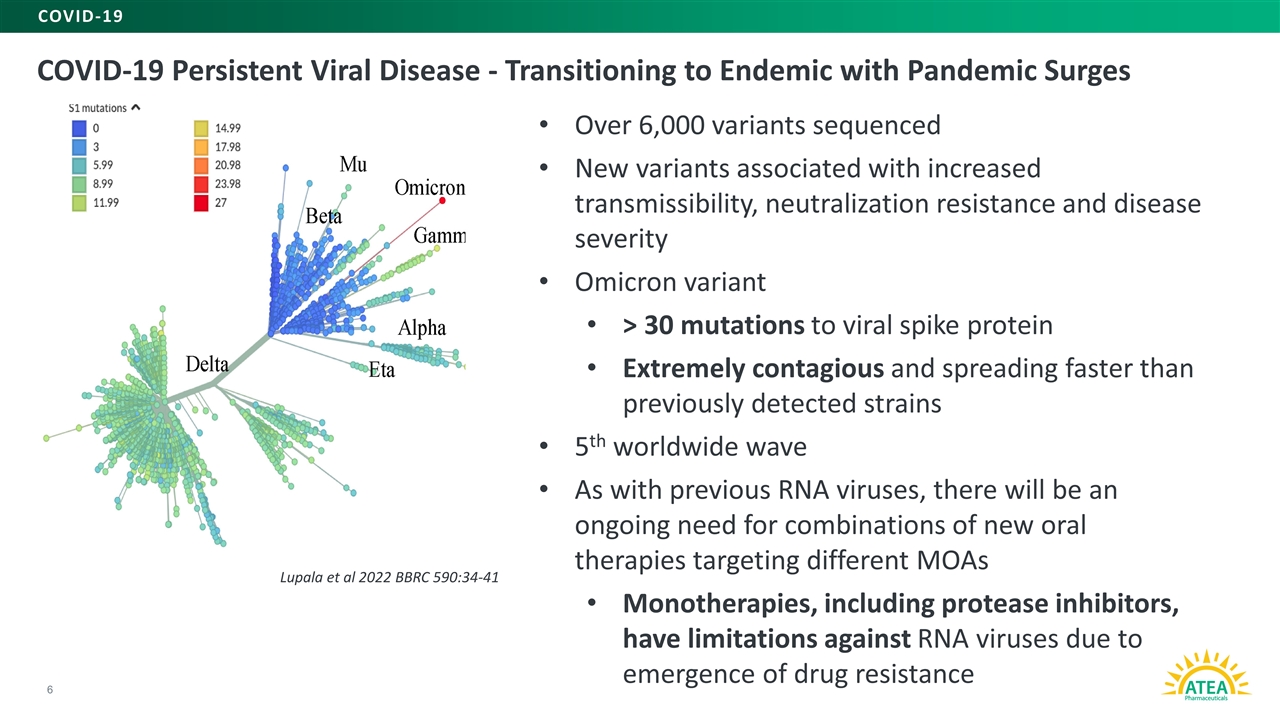
新冠肺炎持続性ウイルス病-大流行の急増に伴い地方性への転換6新冠肺炎は6,000種類を超える変異は増加した伝播性、中和抵抗力と疾病の重症度に関連する新しい変異に対してシークエンシングを行ったオミック変異>30種類の突然変異によるウイルススパイク蛋白は極めて伝染性があり、以前に検出された毒株よりも速い速度で第5波の全世界波を伝播し、以前のrnaウイルスと同様に、異なるMOA単一療法に対する新しい経口療法の組み合わせを持続的に必要とし、蛋白加水分解酵素阻害剤を含み、薬剤耐性Lupalaら2022 BC 590:34-41がrnaウイルスに制限がある

7 AT-511(フェニニホブビル遊離塩基) 体外抗SARS-CoV-2変異株変異株相対効力*AT-511 EC 90[ミュータント/アメリカ-ワシントン-1]原始A米国-WA 1/2020年1アルファB.1.1.7イングランド/204820464/2020年2.8(n=3)ガンマP.1日本/TY 7-503/2021年3.2(n=3)Epsilon B.1.427 米国/CA/VRLC 009/2021 1.0(n=2)Delta B.1.617..2米国/PHC 658/2021 1.2(n=3)オミック≡B.1.1.529米国/MD-HP 20874/2021**AT-51EC 90=0.64±0.36ミクロン(n=14)(0.15-1.55ミクロン)初代HAE細胞における抗米国-WA-1のウイルス収量測定br}*同一測定においてEC 90変異株間のEC 90差異を並列測定したインビトロ測定変異範囲内**オミックのリボ核酸ポリメラーゼは、他の変異株と比較して新たな変異はなかった
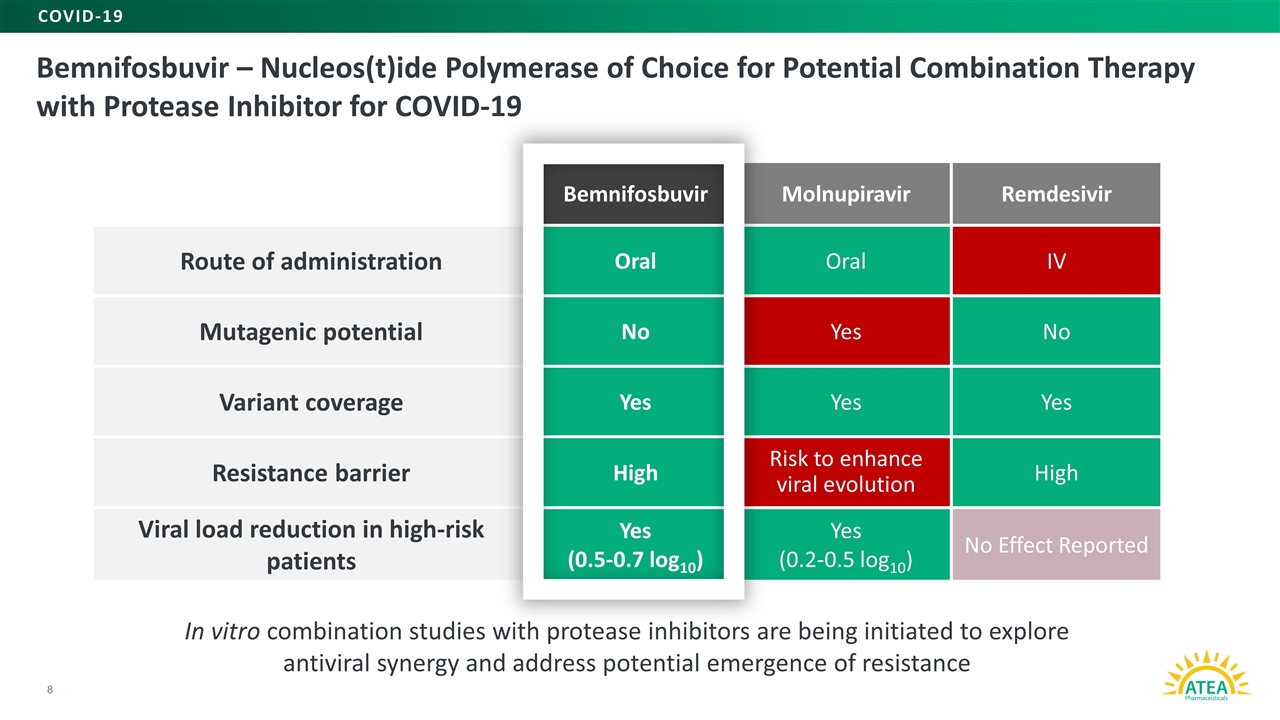
8プロテアーゼ阻害剤との体外共同研究を開始して、抗ウイルスの協同作用を探索し、そして新冠肺炎とプロテアーゼ阻害剤の潜在的な連合治療の潜在的選択フェニルフォブビル-リボ核酸(T)ポリメラーゼの選択 ベンノホビル経口IV投与経路変異潜在能力を解決しているかどうかは無変異カバーが薬剤耐性バリア高リスク促進ハイリスク患者のウイルス負荷量の低下は (0.5-0.7 log 10)は(0.2-0.5 log 10)新冠肺炎は治療効果がない報告

9臨床開発更新と計画Bemnifosbuvir

Bemnifosbuvirの安全性と抗ウィルス活性の概要brはこれまでに完成した臨床開発要点の第一段階の研究により、75%を超える患者の体内薬物濃度はEC 90を超えることを示した。気管支肺胞洗浄研究により、薬物レベルは気道で達成された血漿レベルに近いことが証明された。br}の2つの第二段階の研究により、ハイリスク患者は迅速かつ持続的な抗ウィルス活性を有することが示された。通常安全かつ耐性の良好なチトクロームP 3 A基質との併用投与は投与量調整を行う必要がない10新冠肺炎2022:引き続き第二段階のデータセットを豊富にし、共同研究を支持する
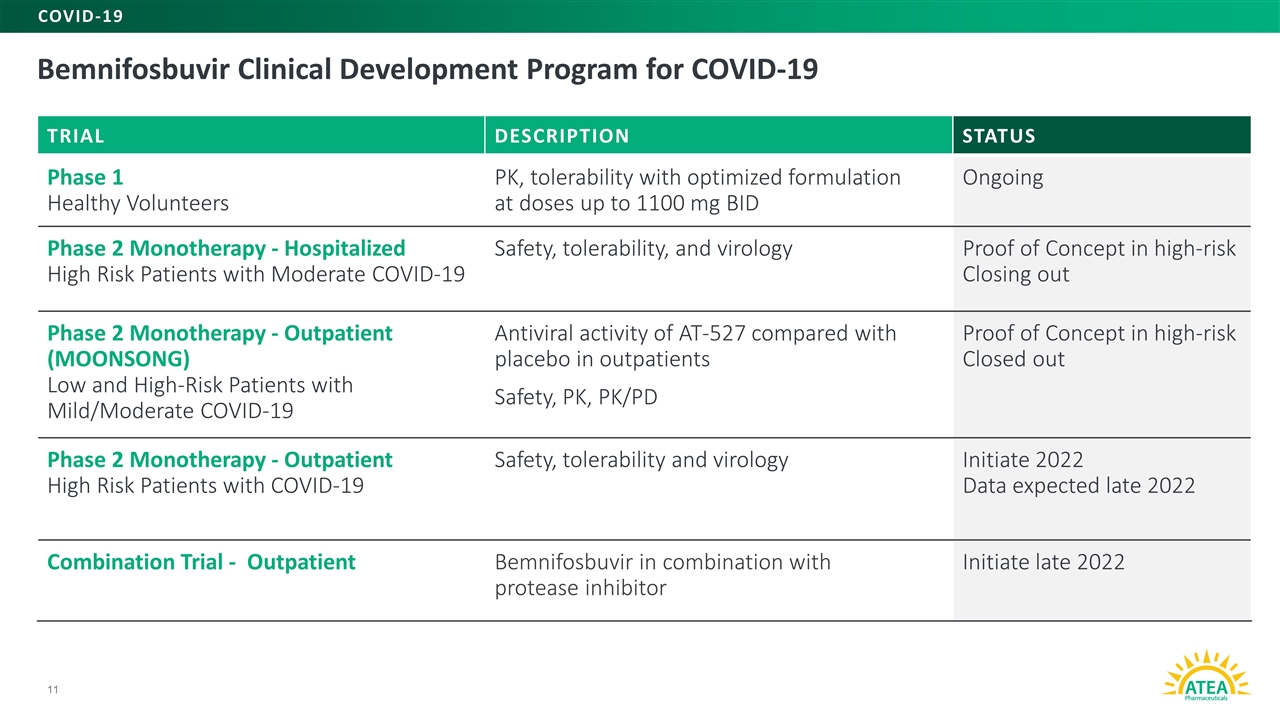
Bemnifosbuvir臨床開発計画新冠肺炎11試験説明状態第一段階健康ボランティアPK、1100 mgまでのBid耐性最適化処方が行われている第二段階単一治療-入院中の新冠肺炎安全性のハイリスク患者、耐性とウイルス学的概念はハイリスク終了の第二段階単一治療-外来(MOONSONG)新冠肺炎抗ウイルス活性がAT-527の低リスクと高リスク患者はプラセボ患者と比較し、外来患者の安全性、PK、PK/PD概念は高リスク終了の第二段階単一治療-外来高リスク患者の新冠肺炎安全、PK、br}Pdの概念検証を証明した。耐性とウイルス学起動2022年データ2022年末連合試験予定−外来患者ベネブビルと蛋白加水分解酵素阻害剤の併用開始2022年末新冠肺炎
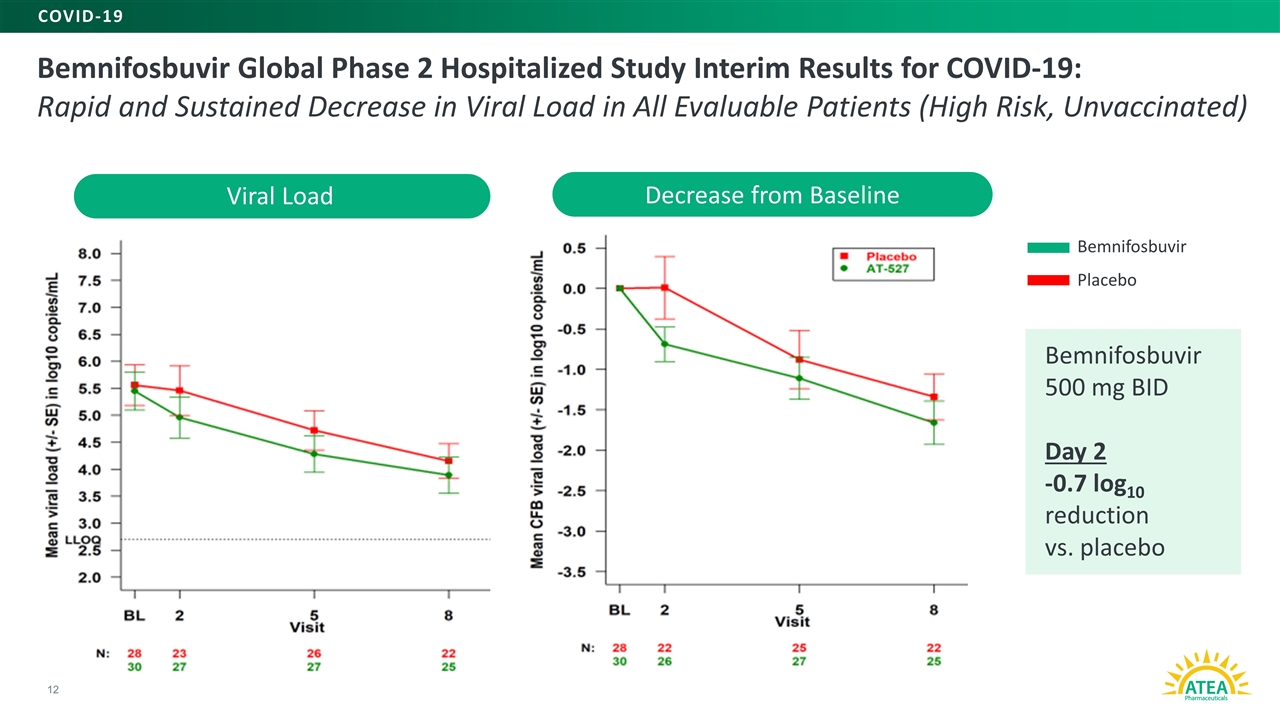
新冠肺炎の入院研究中期結果:すべての評価可能な患者(ワクチン未接種のハイリスク患者)のウイルス負荷量は迅速かつ持続的に低下し、12はプラセボ新冠肺炎より500 mg減少し、毎日2-0.7 log 10はプラセボウイルス負荷量より減少した

13 Bemnifosbuvir 2期MOONSONG 探索的分析感染性ウイルス:ハイリスク患者の有効かつ迅速な抗ウイルス活性は、活性薬物/プラセボ間のベースラインウイルス力価の差を考慮して、A群とB群との間の用量反応感染ウイルス力価がベースライン変化*行列A(550 mg、2回)より高いリスク亜群*ベースライン調整後 (ANCOVA)を示す。**ヒューリスティックサブクラスタ分析。新冠肺炎はハイリスク患者の3日目のウイルス負荷を有効に低下させた:-0.3 log 10プラセボと比較して ベニフォブウェル隊列B(1,100 mg,毎日2回):-0.9 log 10とプラセボベニフォブビルプラセボ感染ウイルス力価のベースラインよりの変化*キューB(1,100 mg,毎日2回)ハイリスク亜群**

本ニホブビルに対する新冠肺炎の展望:第一選択併用療法計画の第二段階外来試験のヌクレオチドは、以前の第二段階試験における高リスク患者に対する陽性結果に基づいて200名もの軽中度新冠肺炎を有する高リスク外来患者200名に確立され、迅速に溶解と吸収可能な配合を用いて高リスク外来患者のデータセットを豊富にし、同時に共同試験データを開始する準備をしており、2022年末の共同試験には、安全と抗ウイルス活性が証明された2種類の研究薬や研究薬と承認薬の新冠肺炎の組み合わせが含まれている可能性が予想される

C型肝炎:グローバル戦略

16有効なDAA組合せApproxを使用しても、C型肝炎ウイルス関連死亡率は増加した。70%の長期静脈注射麻薬中毒者はアメリカでC型肝炎ウイルスに感染し、新しいラウンドの早期/急性C型肝炎感染は8週間またはそれ以上の治療時間を必要とする。一流の組み合わせは10億ドルを超える可能性があり、アメリカのC型肝炎感染は引き続き2020年の世界C型肝炎市場41億ドルを増加させる*;2020年アメリカは全世界のDAA売上高の約50%を占める*ソース:GIlead 2020投資家報告、AbbVie 2020投資家報告、メルク2020年C型肝炎投資家報告

メルク許可証の17項目の全世界独占許可はすべてのヒト適応次世代汎遺伝子有効抗ウイルス活性がマイクログラムモル範囲内で体外研究によりC型肝炎ウイルス感染患者におけるウイルス負荷量の低下>3 log 10単一療法として体外でベノブビルとの顕著な相乗作用を証明した>1,250名のC型肝炎ウイルス感染患者は体外でRuzasvirを併用し、毎日の投与量は最大180 mgに達し、治療コースは24週間に及ぶRZRは良好な安全性を示し、薬物相互作用の可能性は低く、薬物相互作用の可能性は低い Profileは毎日1回の経口高効率汎用NS 5 A阻害剤を支持し、患者の良好な安全性と薬物相互作用のために使用された。ベネホブビルと結合した理想的な体外相乗作用:MacSynergy(ImQuest)で分析されたC型肝炎ウイルスGT 1 bレプリコン(Huh−Luc/neo−et)で行われた分析 AT−511はベネホブウェイC型肝炎の遊離塩基である

184.5 log 10±0.3 IU/ml GT 3感染患者では4.6 log 10±0.5 IU/ml代償性肝硬変(GT 1,2,3)単一療法としてのベネフォブビルは、1期および2期の臨床試験において、これまでにない抗ウイルス活性および良好な安全性を示した。過去のbr用量ベニフォブビル550 mg qd用量gt 1 bとgt 3と比較して肝硬変NC=非肝硬変bemnifosbuvir~10倍の活性は、実験室株および臨床的に分離されたC型肝炎ウイルス1-5型と完全に有効なsof耐性関連株(S 282 T)の良好な臨床安全性pk曲線を維持し、1日1回の用量>480名の被験者(健康ボランティアおよびC型肝炎ウイルスまたは新冠肺炎患者を含む)を10個のbr臨床試験で許容した。安全性と耐性が良好なC型肝炎患者は550 mg用量のフェニルニホブビルに曝露し、8-12週間持続し、薬物関連性SAEs C型肝炎ではない

19 Bemnifosbuvir+Ruzasvir:第二段階 2022年に開始される予定の連合準備資産第二段階連合計画評価:便利かつ短い8週間コース(早期/急性感染に対して短い可能性がある)代償性肝疾患と非代償性肝疾患を有する急性および慢性C型肝炎患者Bemnifosbuvirはこれまで開発されてきたC型肝炎ウイルスに対して最も有効なヌクレオチド阻害剤Ruzasvirは高度に有効な第二段階準備薬物候補薬物であり、一流の汎遺伝子固定用量連合C型肝炎ウイルス Bemnifbuvir+Ruzasvir潜在的最適遺伝子肝炎の開発計画になる可能性がある。Ruzasvirの競争概況は便利で持続時間が短く,初めてRBVなしで非代償性疾患を治療する潜在患者になる可能性がある

20デング熱AT−752の臨床概念検証計画

4種類の血清型による苦痛、衰弱した蚊伝播疾病感染後3-14日の高熱2-7日デング熱:高い死亡率と高度に医療需要を満たされていない21人がハイリスク地区に生活している*デング熱範囲内の強力な治療効果は現在拡大推定されており、毎年深刻なデング熱死亡率に感染すると推定されている。2.5%死亡率)AT-752:有望な製品プロファイルプリンヌクレオチドプロドラッグは、試験されたすべての血清型MOAに対して強力なインビトロ活性を有する:デング熱ウイルス動物モデルにおいてインビボ抗ウイルス活性を有するデング熱ウイルスポリメラーゼの開発に成功し、FDAによるAT-752の承認は、米国の優先審査*東南アジア、西太平洋、東地中海、ラテンアメリカ、およびプエルトリコの100以上の国/地域をもたらす可能性がある。アメリカだけで230万人が死亡し、1200人が死亡し、抗ウイルス治療はなく、支持的治療(鎮痛剤、賢明な液体療法)デング熱のみを提供し、2017年6月に承認され、2021年6月にACIPデング熱ワクチンが承認され、9-16歳以前にデング熱に感染した人は、プエルトリコ~4 B~400 M 12-44%50万デング熱を含む流行地域に生活している

AT-752 第1段階研究1 SADと3つのMADキュー22目標:安全性とPK(食物効果を埋め込む)第1部分:単回増量量キュー第2部分:多用量QD/BID/TID組み入れ基準:健康ボランティア、連続投与量増加国: オーストラリアAT-752用量MADランダムプラセボ二重盲検経口投与:7日に4 Q/21に達してAT-752用量SAD AT-752投与量SAD AT-752は健康な被験者に単剤或いは複数回投与した後の耐性は良好で安全性は良好であり、関連する実験室パラメータは変化がなく、不良イベント或いは深刻な不良イベントのために大多数の不良イベントを早期に中断しなかった軽度N=64デング熱
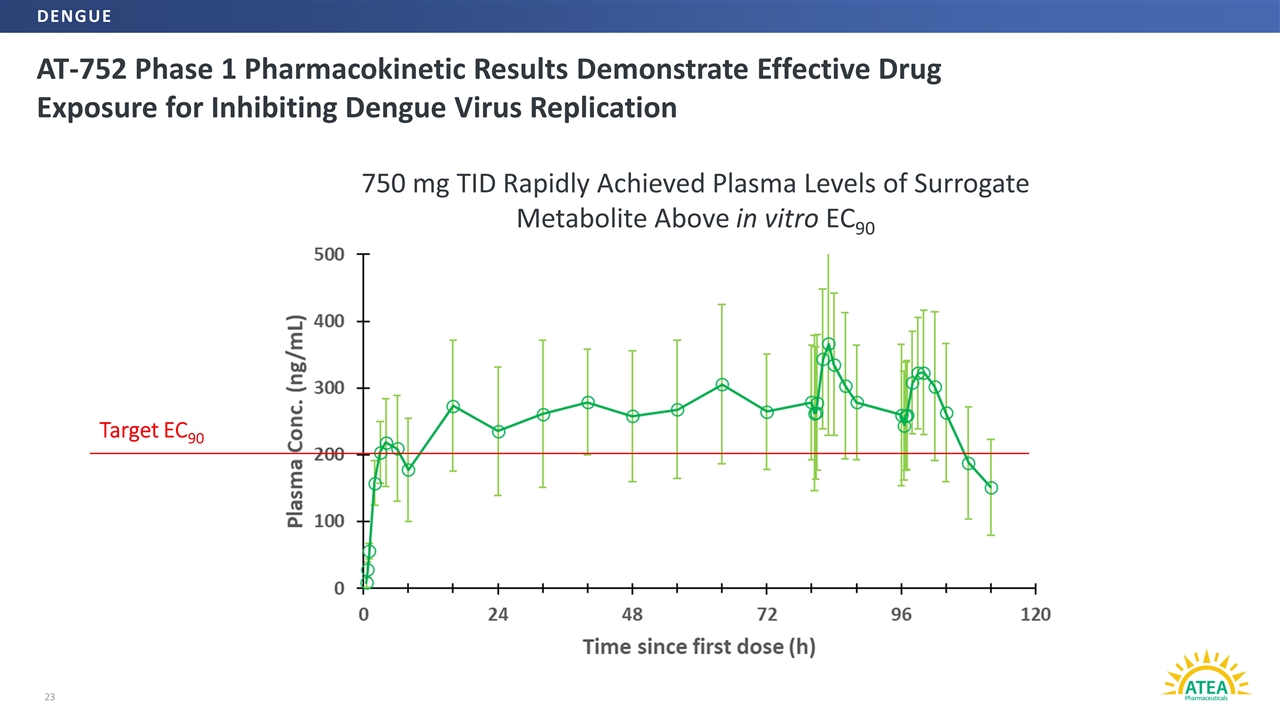
AT-752ステージ1薬物動態学的結果は、有効な薬物曝露がデング熱ウイルス複製を抑制する23目標EC 90 750 mg TIDが体外で代謝物代替の血漿レベルに迅速に到達し、EC 90デング熱よりも高いことを示した

24人群:健康被験者、18~55歳場所:米国設計:1日目:12名の被験者ランダム3:1経口AT-752または一致プラセボ2日目:0.5 mLDENV-1-LVHC(6.5 x 103 PFU/mL)AT-752を用いてデング熱ヒト挑戦感染モデルデング熱終点を攻撃:qRT-PCR平均定量ウイルス負荷量(ピーク、持続時間およびAUC)ウイルス接種後28日までqRT-PCR開始1 H 2022結果予想2022年下半期のウイルス負荷量は陽性であった
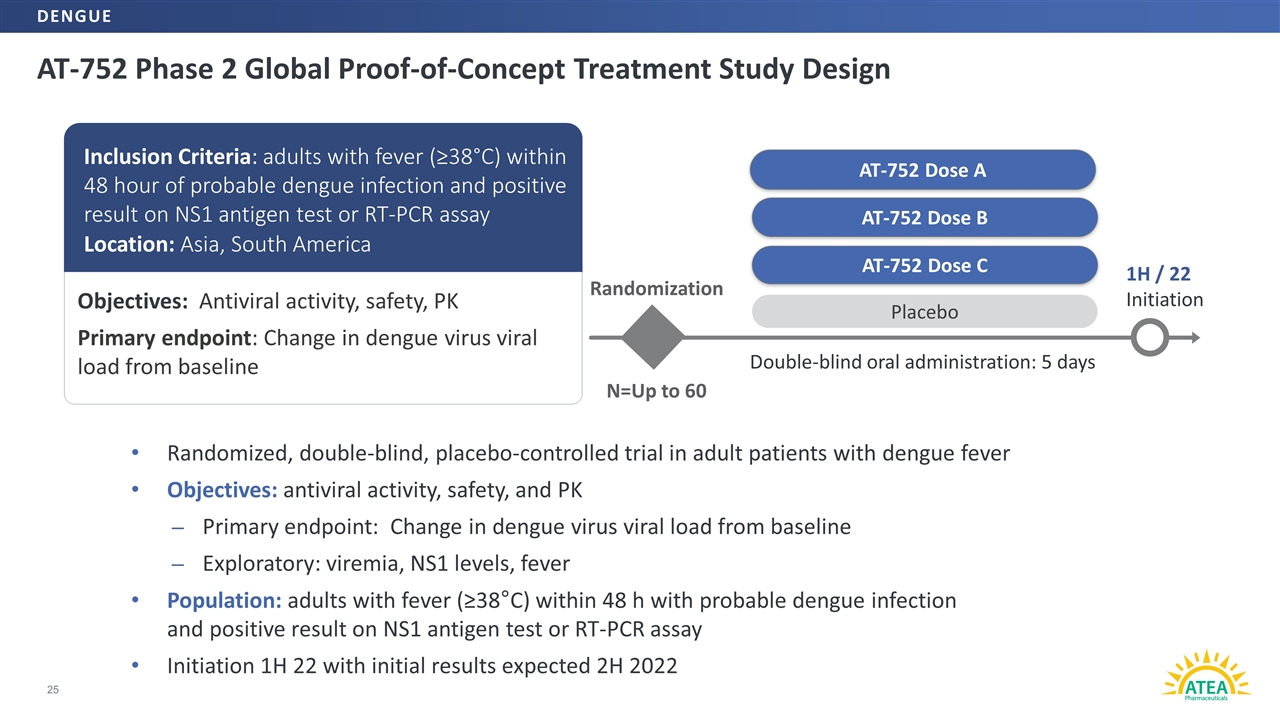
AT-752二期全世界概念的治療研究設計25個AT-752用量Bランダム対照N=最大60個のプラセボ二重盲検経口投与:5日1 H/22開始AT-752用量C目標:抗ウイルス活性、安全性、PK主要終点:ベースライン組み入れ標準中のデングウイルス負荷量の変化:デング熱感染後48時間以内に発熱が疑われる成人(VI 38°C)とNS 1抗原検出或いはRT-PCR法陽性地点:アジア、南アメリカランダム対照、成年デング熱患者に対するプラセボ対照試験目標:抗ウイルス活性、安全性とPKの主な終点:ベースラインと比較したデング熱ウイルス負荷量の変化探索性:ウイルス血症、非典型肺炎ウイルスレベル、発熱人群:成人は48時間以内に発熱(Σ38°C)、デング熱感染が疑われ、ns 1抗原測定或いは逆転写ポリメラーゼ連鎖反応測定陽性結果は1 H 22を起動し、初歩的な結果は2022年下半期のデング熱と予想される

結語26
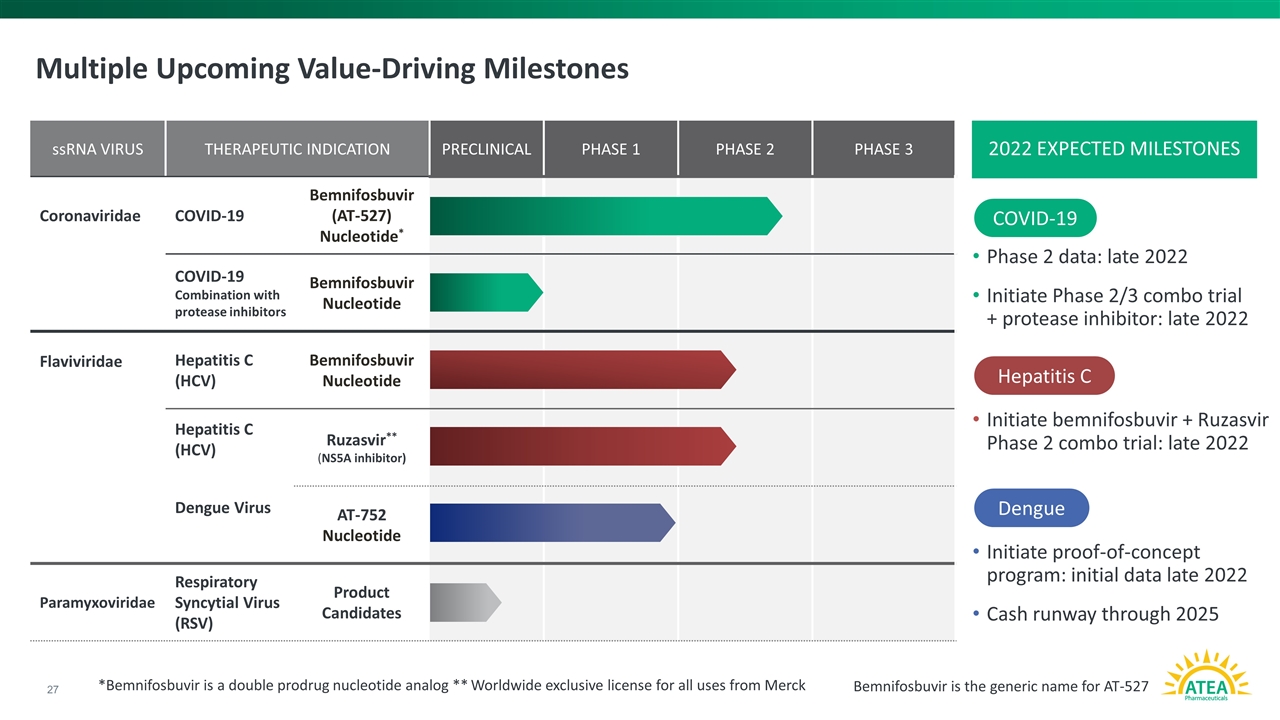
複数の到来する価値駆動マイルストーン2期データ:2022年末スタート2/3期共同試験+プロテアーゼ阻害剤:2022年末にビンノフォブビル+ルザスビル2期共同試験を開始:2022年末に概念検証計画を開始:2022年末初期データC型肝炎ウイルスデング熱一本鎖RNAウイルス治療適応臨床前1期2期3冠ウイルス科新冠肺炎ビンノサビルヌクレオチド黄曲利達C型肝炎ウイルスヌクレオチドC型肝炎デング熱ウイルス*(NS 5 A)臨床前1期2期3冠ウイルス科新冠肺炎ビンニホホトフラジフラジフラビウム C型肝炎ヌクレオチドC型肝炎デング熱ウイルス*(NS 5 A)臨床前1期2期3冠ウイルス科新冠肺炎ビンテージヌクレオチドフラトリダ C型肝炎ヌクレオチドC型肝炎デング熱ウイルス阻害剤)AT-752ヌクレオチドパラミクソウイルス科呼吸器合胞体ウイルス(RSV)候補製品BemnifosbuvirはAT-527の一般名である*Bemnifosbuvir は2プロドラッグ類似体である**メルク2022の予想されるマイルストーンのすべての用途の世界的独占的許可

ボストン夏通り125番地アメリカマサチューセッツ州02110 8572848891 www.ateapharma.com