
2022年第1四半期の財務結果と会社更新2022年5月9日添付ファイル99.1

このスライドには、修正された1995年の“プライベート証券訴訟改革法”によって指摘された展望的陳述が含まれているが、これらに限定されない:私たちのパートナーが完全にまたは条件付きマーケティング許可の下で使用が許可された場合、COMIRNAYと呼ばれ、特に私たちのパートナーが提供した初歩的な推定に基づいて導出された数字;私たちは、各国政府に初めて販売した後、政府当局、個人健康保険会社および他の第三者支払人との価格設定およびカバー範囲交渉;将来の新冠肺炎ワクチンの初期用量または増強用量の商業需要と医療需要;他の新冠肺炎ワクチンの競争あるいは私たちの他の候補製品に関連する競争は、異なる作用機序と異なる製造と流通制限を有する製品を含み、その基礎は治療効果、コスト、貯蔵と流通の利便性、承認された用途範囲、副作用プロファイルおよび免疫反応の持続性である;私たちの新冠肺炎ワクチンおよび承認された研究薬物が市場に受け入れられる速度と程度である。私たちの研究と開発計画及び私たちの現在と未来の臨床前研究と臨床試験の開始、時間、進捗、結果とコストは、研究或いは試験と関連準備作業の開始と完成時間に関する声明を含む, 試験結果が発表された期間と私たちの研究開発計画;私たちは候補製品の規制承認の時間と私たちの能力を獲得し、維持した;私たちはファイザー社と協力して新冠肺炎ワクチン(潜在的増強用量BNT 162 b 2および/または修正遺伝子配列を有するBNT 162 b 2変異体の潜在的増強用量を含む)、BNT 16 b 2が新たに出現したウイルス変異体による新冠肺炎を予防する能力;私たちは研究機会を発見し、研究薬を発見し、開発する能力;私たちの第三者協力者は私たちの候補薬物の開発および研究薬物に関連する研究開発活動の能力と意思を継続した。新冠肺炎の大流行が私たちの発展計画、サプライチェーン、パートナー、財務業績に与える影響;私たちの新冠肺炎ワクチンと私たちが開発または製造した他の製品と候補製品の使用による予見できない安全問題と人身被害クレーム;私たちはこれらの計画のために臨床候補を選択する時間と臨床試験の開始、および任意のデータ読み取りを含むマラリア、結核、およびHIV計画を推進する能力;世界保健機関、欧州委員会、および他の組織がインフラ整備を支援する性質と持続時間;アフリカ大陸の持続可能なワクチン生産と供給ソリューションの発展とこれらの解決策の性質と実行可能性;私たちの研究開発収入、商業収入、販売コスト、研究開発費用、販売とマーケティング費用、一般と行政費用、資本支出、所得税の推定, これらの要素には、発行された株の品質、私たちおよびパートナーが承認された後に私たちの候補製品(新冠肺炎ワクチンを含む)を商業化およびマーケティングする能力、私たちの開発と拡張を管理する能力、アメリカと外国の規制発展、新冠肺炎ワクチンの目標生産レベルと候補製品を含む私たちの生産能力と生産製品の能力を効果的に向上させること、および他の私たちの現在知られていない要素がある。場合によっては、前向き表現は、すべての前向き表現がこれらの語を含むわけではないが、“可能”、“可能”、“すべき”、“予想”、“意図”、“計画”、“目標”、“予想”、“信じ”、“推定”、“予測”、“潜在”、“継続”またはこれらの用語の否定または他の同様の用語によって識別することができる。本プレゼンテーション中の展望的陳述は約束でも保証でもなく、既知および未知のリスク、不確実性および他の要素に関連するので、これらの前向き陳述に過度に依存してはならない。その中の多くの要素はBioNTechの制御範囲内ではなく、実際の結果はこれらの前向き陳述に明示または示唆された結果とは大きく異なる可能性がある。2022年3月31日までの3ヶ月間のリスクおよび不確定要因、およびバイオテクノロジー会社が米国証券取引委員会に提出した後続ファイルに記載されているリスクおよび不確定要因を、本プレゼンテーションの“リスク要因”のタイトルで見るべきであり、これらの文書は、米国証券取引委員会のウェブサイトでhttp://www.sec.gov/を参照することができる。法律に別の要求がない限り、BioNTechは新しい情報が発生したときに、本プレゼンテーションに含まれるいかなる前向きな陳述も更新または修正することはなく、いかなる責任も負いません, 未来の発展や他の側面。これらの前向き陳述はBioNTechの現在の予想に基づいており,本稿の発表日までの状況のみを代表している。2

安全情報3 COMIRNatY(ファイザー-生物科学技術新冠肺炎ワクチン)はすでに欧州委員会の条件付きマーケティング許可を獲得し、5歳からコロナウイルス病2019(新冠肺炎)を予防することができる。このワクチンは2剤を主な治療コースとし,3週間間隔である。さらに、CMAは、2回目の接種後少なくとも6ヶ月間の12歳以上の個人を含む強化用量(第3接種)に拡大された。免疫機能が低下した個体では,2回目の接種後少なくとも28日に3回目の一次コースを接種することができる。欧州医薬品局のヒト薬物委員会はCOMIRATYオスミウムの厳密な評価を完了しており,ワクチンの品質,安全性,有効性に関する十分に有力なデータが現在利用可能であることで一致している。重要なセキュリティ情報:·アレルギー反応が報告されている。ワクチン接種後にアレルギー反応が出現した場合には、いつでも適切な治療と監督を提供しなければならない。·Comirnatyワクチン接種後,心筋炎や心膜炎のリスクが増加した。これらの状況はワクチン接種後わずか数日で発生することができ、主に14日以内に発生する。2回目のワクチン接種後に観察される頻度はより高く,若い男性にもよく見られる。既存のデータから,ワクチン接種後の心筋炎と心膜炎の経過は一般的な心筋炎や心膜炎とあまり変わらないことが示唆されている。·血管迷走神経反応(失神)、過換気またはストレスに関連する反応(例えば、めまい、動悸、心拍数加速、血圧変化、感覚異常など)を含む不安に関連する反応, 感覚減退と発汗)はワクチン接種過程自体と関係がある可能性がある。ストレスに関連した反応は一時的であり、自ら解決される。個人が症状をワクチン接種提供者に依頼して評価することを提案しなければならない。倒れて怪我をしないように予防措置をとることが重要です。·急性重症発熱症または急性感染を有する個人は、ワクチン接種を延期しなければならない。軽微な感染および/または微熱の存在は、ワクチン接種を遅延させてはならない。·他の筋肉注射と同様に、抗凝固治療を受けた個人または血小板減少症または血友病のような任意の凝固障害を有する人は、筋肉注射後に出血または鬱傷が生じる可能性があるので、ワクチンを慎重に接種しなければならない。·ワクチンの有効性および安全性は、免疫抑制治療を受けている人を含む免疫障害個人では評価されていない。免疫機能が低下した個体ではComirnatyの奏効率が低い可能性がある。いずれのワクチンと同様に,COMIRATYオスミウムを用いたワクチン接種はすべてのワクチン受容者を保護しない可能性がある。個人は2回目のワクチン接種後7日後に完全に保護されるかもしれない。·臨床研究では、16歳以上の参加者の副作用は、注射部位痛(>80%)、疲労(>60%)、頭痛(>50%)、筋肉痛と身震い(>30%)、関節痛(>20%)であった, 発熱と注射部位は腫脹(>10%)であり,通常は軽度あるいは中等度であり,ワクチン接種後数日以内に消失する。低い反応性イベント発生頻度は大きな年齢と相関していた。·COMIRATY®の5歳から15歳までの全体的なセキュリティプロファイルは、16歳以上の参加者に見られるものと同様です。·5歳から11歳までの児童に最もよく見られる副作用は注射部位の痛み(>80%)、疲労(>50%)、頭痛(>30%)、注射部位の赤腫(>20%)、筋肉痛と身震い(>10%)である。·12歳から15歳までの臨床試験参加者の中で、最もよく見られる副作用は、注射部位の痛み(>90%)、疲労と頭痛(>70%)、筋肉痛と身震い(>40%)、関節痛および発熱(>20%)である。·妊娠中期と晩期にComirnatyワクチンを接種した妊婦の大量観察データは、不良妊娠結果の増加を示さなかった。妊娠3カ月前にワクチンを接種した後の妊娠結果に関するデータは現在限られているが,流産リスクの増加は見られない。動物研究は妊娠、胚胎/胎児発育に直接或いは間接的な有害影響があることを表明しなかった, 出産や出生後に発育する。Comirnatyは妊娠中に使用できます。·母乳育児の新生児/乳児には何の影響も与えないと予想されるが,母乳育児の女性がComirnatyに全身接触していることは無視できるからである。ワクチン接種後の母乳育児からの女性の観察データは,母乳育児の新生児/乳児に悪影響のリスクがないことを示している。母乳育児中にComirnatyを使用することができる。他の医薬製品との相互作用や他のワクチンと同時にCOMIRNAYオスミウムを服用することはまだ研究されていない。·COMIRATY®セキュリティに関する完全な情報は、EMAウェブサイトでEUの全言語で提供されている承認された製品特性の概要およびパッケージチラシを常に参照してください。黒等辺三角形≡は、任意の副作用を捕捉するために追加的な監視が必要であることを表す。これは新しいセキュリティ情報を迅速に識別することを可能にするだろう。個人は彼らが得る可能性のあるどんな副作用も報告することで助けを提供することができる。副作用はEudraVigilanceに報告するか,電子メールMedinfo@biontech.de,電話+49 6131 9084 0,またはウェブサイトwww.biontech.deを介してBioNTechに直接報告することができる

安全情報4アメリカが許可した®(新冠肺炎ワクチン)は、重症急性呼吸症候群コロナウイルス2(SARS-CoV-2)による16歳以上の個人が2019年のコロナウイルス病(新冠肺炎)に罹患することを予防するために、アメリカ食品と薬物管理局が許可した新冠肺炎ワクチンである。EU法案によると、それはまた5歳以上の個人に2剤の一次系ワクチンを提供することを許可され、ある免疫障害が確定した5歳と5歳以上の個人に第3回の一次系ワクチンを提供し、ファイザー-バイオテクノロジー新冠肺炎ワクチン或いはCOMIRNAY初級シリーズ接種を完了した12歳以上の個人に単剤補強剤を提供し、異なる新冠肺炎ワクチンの一次接種を完了した18歳以上の個人に単剤補強剤を提供する。任意の許可された新冠肺炎ワクチンを接種した第1剤補強剤を接種した50歳以上の個人に第2剤強化接種を行った。12歳および12歳以上で何らかの免疫妥協を有すると判定され、任意の許可された新冠肺炎ワクチンの第1剤強化接種を受けた個人に2回目の強化接種を行った。補強剤スケジュールは、一次シリーズのためのワクチンのタグ情報に基づく。重要な安全情報個人はワクチンを接種すべきではなく,条件は:·前のワクチンの後に深刻なアレルギー反応が出現する·このワクチンの任意の成分に対して深刻なアレルギー反応がある個人はそのすべての医療状況をワクチン接種提供者に通知すべきである, ·何らかのアレルギーがある·心筋炎(心筋炎)や心膜炎(心臓外ライナーの炎症)·発熱·出血性疾患や血液希釈剤服用中·免疫機能障害や免疫系に影響を与える薬剤を服用している·妊娠,計画妊娠や授乳中·別の新冠肺炎ワクチンを受けた·ワクチン注射で倒れたことがある·ワクチンはすべての人を守れない可能性がある。ワクチンの副作用としては,·ワクチンが重篤なアレルギー反応を引き起こす可能性は低く,重篤なアレルギー反応は通常ワクチン接種後数分から1時間以内に発生することが報告されている。このため、ワクチン接種提供者は、個人がワクチン接種後にワクチン接種場所に残ってo重篤なアレルギー反応の兆候を監視することを要求する可能性があり、呼吸困難、顔面および喉の腫脹、心拍加速、全身重篤な皮疹、めまいおよび虚弱o個人が重篤なアレルギー反応を経験した場合、9-1-1または最寄りの病院に電話すべきである·ワクチンを接種した人の中には心筋炎(心筋炎症)や心膜炎(心臓外ライナーの炎症)が発生している可能性がある。40歳以下の男性では女性や年上の男性の方がよく見られます。これらの人の多くは,第2剤ワクチン接種後数日以内に症状が出現し始めている。このような状況が発生する可能性は非常に低い。個別の人はワクチンを接種した後、次のような病状があれば、すぐに医者を求めなければならない:o胸痛o呼吸が急であるo心臓が急であると感じ、ばたばたする, ·深刻なアレルギー反応;注射部位の痛み、疲労、頭痛、筋肉痛、身震い、関節痛、発熱、注射部位の腫脹、注射部位の発赤、吐き気、不快感、リンパ節腫大(リンパ結病)、食欲減退、下痢、嘔吐、腕の痛み、およびワクチン注射に関連する失神·これらはワクチンの可能な副作用ではない可能性がある。深刻で予期せぬ副作用が起こるかもしれない。ワクチンの可能な副作用はまだ臨床試験で研究されている。ワクチン接種プロバイダまたはヘルスケア提供者に電話して、悩ましい副作用や副作用が消失しないことを知り、他のワクチンがFDAに提出されていないため、そのワクチン接種に関するデータはFDAに提出されていない。このようなワクチンを他のワクチンと一緒に接種することを考える個人は,彼らの医療提供者と彼らの選択を議論すべきである。患者は常に彼らの医療提供者に有害事象に関する医療アドバイスを求めるべきである。個人が米国食品·薬物管理局(FDA)と疾病コントロール·予防センター(CDC)にワクチンの負の副作用を報告することを奨励する。Http://www.vAers.hhs.govまたは1-800-822-7967に電話してください。また,副作用はwww.pfizerSafetyreporting.comや1−800−438−1985に電話してファイザー社に報告することも可能である。

会社展望Ryan Richardson、首席戦略官Jens Holstein財務業績、CFOパイプ更新zlem Türeci、CMO 2022年第1四半期のハイライトUgur Sahin、CEO 5
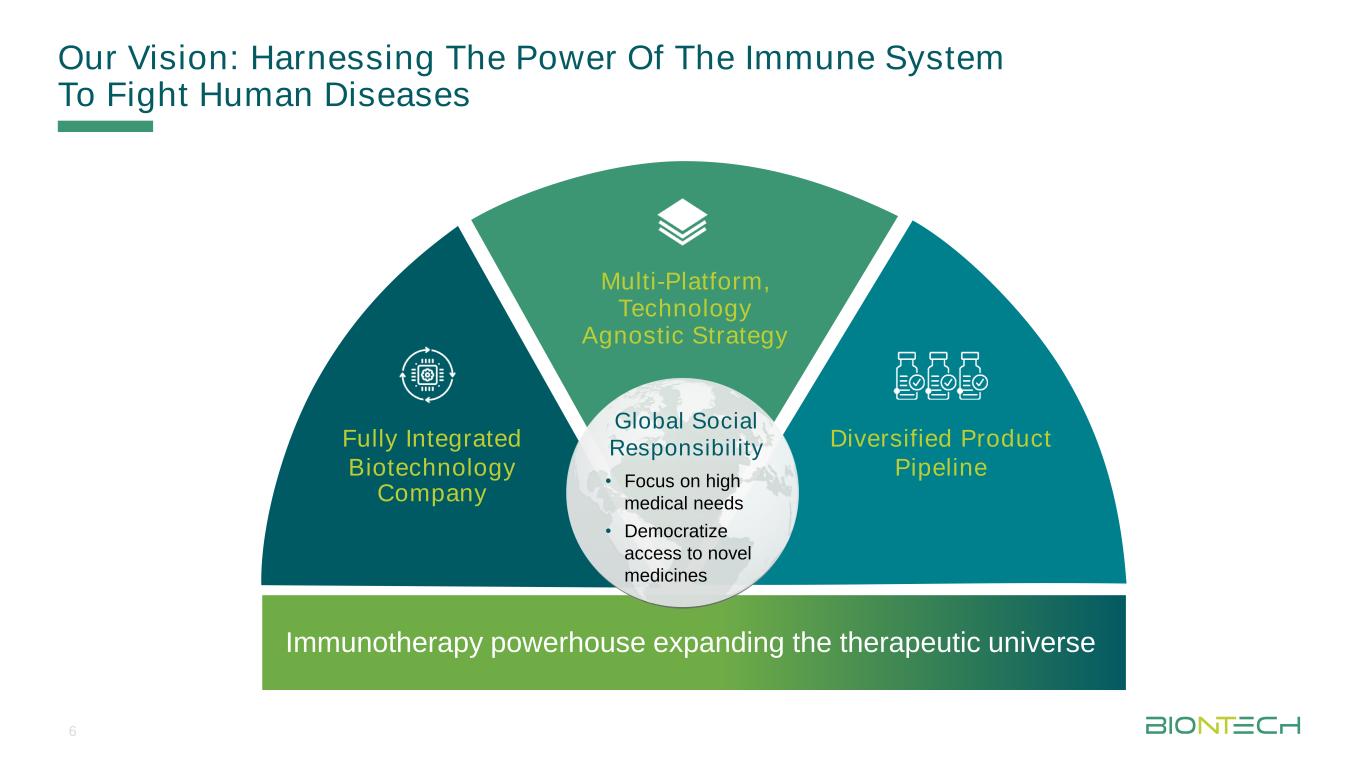
我々のビジョン:免疫システムの力を利用してヒト疾患と戦うマルチプラットフォーム,技術不明の戦略多様化した製品パイプライン完全集積バイオテクノロジー会社免疫治療大手治療分野のグローバル社会責任拡大·高医療ニーズに注目·新薬獲得を民主化する6
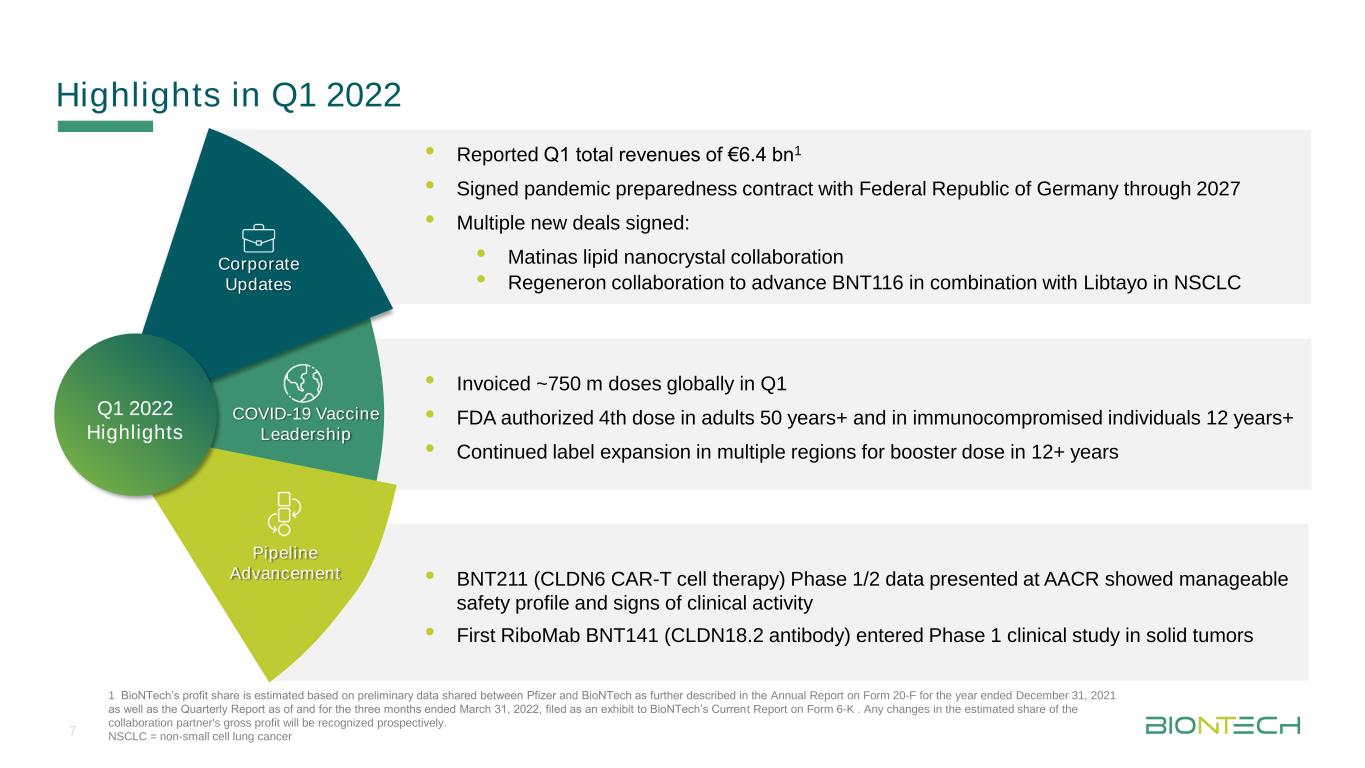
タイトル母版フォーマット2022年第1四半期ハイライト·報告第1四半期総収入6.4 BN 1·ドイツ連邦共和国と大流行防疫契約を結んで2027年まで·複数の新協定に調印:·Matinas脂質ナノ結晶協力·Regeneron協力推進BNT 116とNSCLC中のLibtayo·第1四半期に約7.5億剤·FDA認可50歳以上の成人と12年以上の免疫不全個体使用第4剤·12+年内に引き続き複数地域でラベル強化用量を拡大·BNT 211(CLDN 6 CAR−T細胞療法)1/2期データAACR上で管理可能な安全概況と臨床活動兆候を初めて示すRiboMab BNT 141(CLDN 18.2抗体)が固形腫瘍第一段階臨床研究会社に入って新冠肺炎ワクチンリードパイプライン進展2022年第一四半期のハイライト1生物科学技術会社の利益シェアはファイザー会社と生物科学技術会社が共有した初歩的なデータに基づいて推定したものであり、詳細は12月31日までの20-F表の年次報告を参照する。および2022年3月31日および2022年3月31日までの3カ月間の四半期報告は,BioNTechの現在Form 6−K報告の証拠品とした。協力パートナーの毛利益の推定シェアのどんな変化も前向きに確認されるだろう。非小細胞肺癌=非小細胞肺癌7

標題母版フォーマットは世界的に積極的に新冠肺炎を積極的に管理し、175を超える国と地域に3.4剤近くのBN 1ワクチンを累計交付し、2022年末までに中低所得国に合計20億剤のワクチンを提供する約束·最適化配合·小児科ラベル拡張·児童補強剤5~
の提出を実現した

タイトルフォーマットは一波また一波の革新を経て、私たちは私たちのビジョン新冠肺炎ワクチン腫瘍学伝染病新疾病領域に向かって今日転換を推進して…近いうちと中期…長期5つの無作為第二段階試験1つの発売ワクチン10+臨床前計画1段階1計画16計画20個の臨床試験の中で:複数の計画は今後3-5年以内に複数の製品を発売する可能性があり、世代の中で一度に機会に医学を変える

会社展望Ryan Richardson、首席戦略官Jens Holstein財務業績、CFOパイプ更新zlem Türeci、CMO 2022年第1四半期のハイライトUgur Sahin、CEO 10

タイトル母版フォーマットは3年間の新冠肺炎ワクチン研究開発戦略を経て、大流行を推進して1生物ワクチンを準備する。オミック感染は交差変異中和と記憶B細胞形成を推進した;2022年4月1日。Http://www.biorxiv.org/Content/10.1101/2022.04.01.486695 v 1.full.pdf vocで可能である。変種オミック適応T細胞に注目して汎コロナウイルス被覆を増強し、各種の後続と次世代ワクチン方法接種後の単価/多価オミック感染を探索し、交差中和とB細胞免疫1·オミックスパイクへの暴露はSARS-CoV-2 VOCに対する強力かつ広範な中和活性を増強できる·変種間共有エピトープを識別する事前に形成された記憶B細胞の強い思い出と拡張データにより、COMIRNAY後のオミック適応ワクチンは類似した株間免疫を提供でき、動態的なSARS-CoV-2免疫11を理解するために安全性を評価することができることを表明した。変異適応ワクチンの耐性と免疫原性評価単価あるいは二価変異適応ワクチンの臨床試験に出現するデータは、監督管理機関とCOMIRNAY景観研究製品研究製品開発目的の最新進展を審査·検討する

滴定フォーマット持続力価オミック適応ワクチンまたはオミック変異3剤または3+4剤4剤オミック適応ワクチン3剤の一次レジメンオミック適応ワクチン評価異なる単価ワクチン方案·N~650、>55年·2剤:30μgと60μg BNT 162 b 2 BNT 162 b 2ワクチンナイーブ被験者2 31は二価野生型/オミック適応ワクチンとオミック適応ワクチンを評価し、オミック適応ワクチン生物技術の安全性、耐性および免疫原性を評価した。Https://Investors.biontech.de/News-Release/News-Release-Details/ファイザーと生物科学技術-Initiate-Study-Evaluate-オミック-Based-Covidから取得できる.2022年1月に訪問;ClinicalTrials.gov。以下のサイトから取得できます:https://www.Clinicaltrials.gov/ct 2/show/NCT 04955626。2022年3月に訪問。12·N~1500、18~55歳·ワクチン経験豊富で幼稚な被験者

腫瘍学:多様なパターンや適応にまたがる進展1 BNT 115は現在研究者による第1段階試験で行われている。2遺伝子技術会社との連携3セノフィ社との連携。4 Genmabと連携します。SMIM、小分子免疫調節剤薬物類プラットフォーム候補製品適応(標的)臨床前1期2期3期mRNA FixVac(共有癌抗原の固定組み合わせ)BNT 111末期黒色腫BNT 112前立腺癌BNT 113 HPV 16+頭頸部癌BNT 1151卵巣癌1 BNT 116 NSCLC iST(患者特異的癌抗原免疫療法)自己遺伝子cevumeran(BNT 122)2 1メラノーマアジュバント直腸癌固形腫瘍内免疫療法SAR 441000(BNT 131)3固形腫瘍(IL-12 sc,IL 15-sushi,GM-CSF,インターフェロンα)リボ核酸抗体BNT 141多固形腫瘍(CLDN 18.2)BNT 142多固形腫瘍(CD 3+CLDN 6)核サイトカイン(メッセンジャーリボ核酸コードサイトカイン)BNT 151多固形腫瘍(最適化IL-2)BNT 152,BNT 153多固形腫瘍(IL-7,IL-2)細胞治療CAR-T細胞+Carvac BNT 211多固形腫瘍(CLDN 6)BNT 212膵臓他の腫瘍(CLDN 18.2)新規抗原に基づくT細胞BNT 221(neo-PTC-01)多固形腫瘍TCR工学T細胞は、全腫瘍抗体次世代CP免疫調節剤GEN 1046(BNT 311)4転移性非小細胞肺癌(PD-L 1 x 4-1 BB)多固形腫瘍(PD-L 1 x 4-1 BB)GEN 1042(BNT 312)4多固形腫瘍(CD 40 x 4-1 BB)標的腫瘍抗体BNT 321(MVT-5873)膵臓癌(SLEA)SMIM Tol l様結合BNT固形腫瘍(TLR 7)13

BNT 111プラットフォームプログラムBNT 113 Autogene cevumeran BNT 1221 BNT 3112 Autogene cevumeran BNT 1221 R/R黒色腫HNT 1221 R/R黒色腫HNT 1221+HNSCCアジュバント結腸直腸癌R/R NSCLC 1 L黒色腫·抗PD 1との併用は予後を改善する可能性がある·HPV 16癌蛋白E 6とE 7·標的各患者特有の20個の新しい抗原·標的各患者特有の20個の新しい抗原·データ更新予想2 H 2022 R/R、難治/再発をコードする;HPV 16、ヒト乳頭腫ウイルス16型陽性;NSCC、頭頚部扁平上皮細胞;NSCC頚部扁平上皮細胞、N頸部扁平上皮細胞NK細胞、ナチュラルキラー細胞、CPI、チェックポイント抑制因子1は遺伝子テークと協力し、2は遺伝子モノクロナル抗体と協力する。なぜFixVac iNeST二重特異性既製mRNAワクチン個性化mRNA免疫治療·4種類の腫瘍関連抗原をコードし、90%以上の皮膚黒色腫患者を被覆する·アメリカ高速チャネル設計と孤児薬物指定·抗PD 1との併用抗腫瘍効果の潜在力·試験成功1 L iNeSTと抗PD(L)1を併用して抗PD 1-初治末期癌を治療する可能性·残留癌細胞の潜在力を解決-無再発生存·条件付き4-1 BB共刺激に注目し続け、同時にPD(L)1軸の次世代免疫治療·T細胞およびNK細胞の機能を増強し、腫瘍病変14に対して
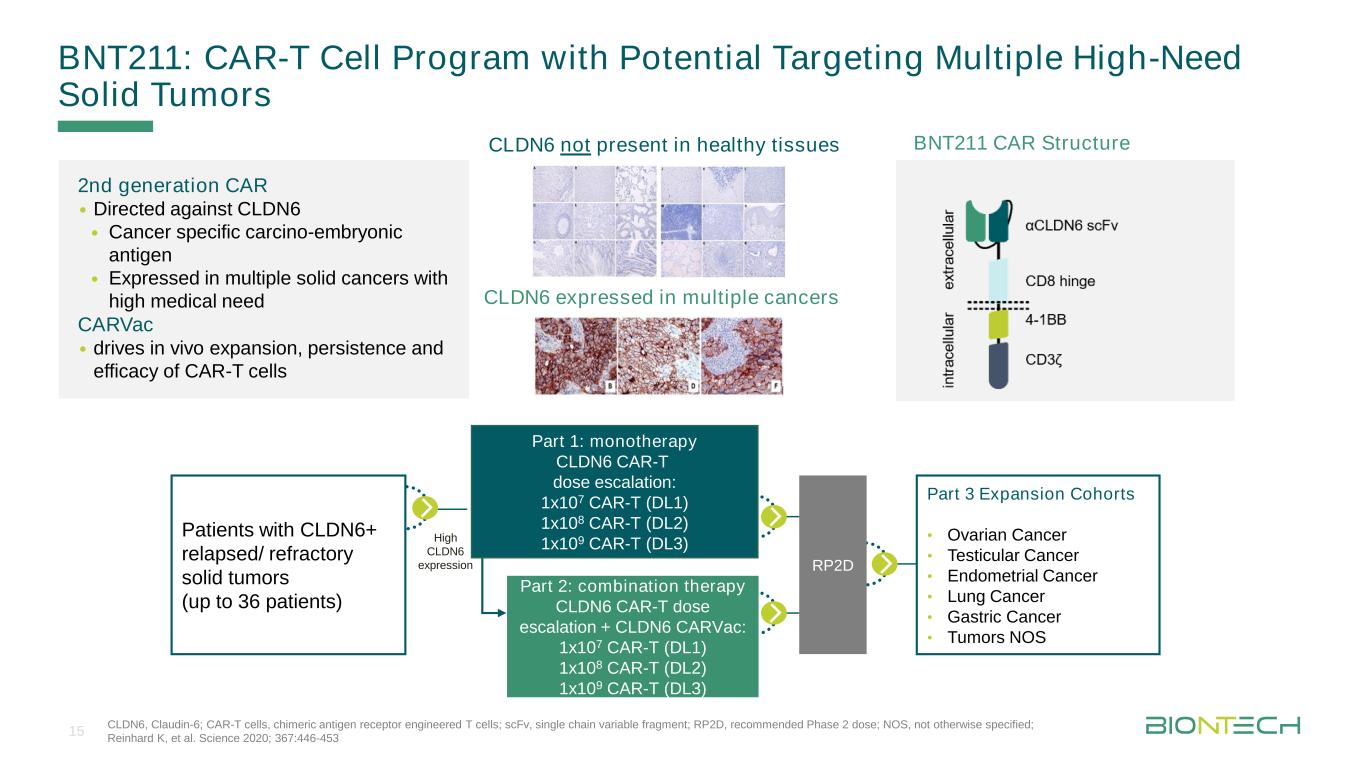
Ticelmaster Format Durch KlenbebeitenBNT 211:Car-T細胞プログラムと潜在的標的化複数の高需要固形腫瘍CLDN 6、Claudin-6;CAR-T細胞、キメラ抗原受容体工学T細胞;scFv、一本鎖可変断片;RP 2 D、推奨される2期用量;NOS、別途指定されていない;Reinhard Kなど。科学2020367:446-453 BNT 211 Car構造CLDN 6は、健康組織には存在せず、CLDN 6は多発性癌において第二世代CLDN 6を発現する·CLDN 6·癌特異的癌胎児抗原に対する·高度な医療ニーズを有する多実体癌におけるCARVac発現·体内駆動拡張。CLDN 6+再発/難治性固形腫瘍患者CAR-T細胞の持続性と治療効果(最大36例の患者)第3部分増幅列·卵巣癌·精巣癌·子宮内膜癌·肺癌·胃癌·腫瘍NOS高発現CLDN 6 RP 2 D第1部分:単一療法CLDN 6 CAR-T投与量増加:1 x 107 CAR-T(DL 1)1 x 108 CAR-T(DL 2)1 x 109 CAR-T(DL 3)第2部分:CLDN 6 CAR-T投与量増加+CLDN 6 CARVAC:1 x 107 CAR-T(DL 1)1 x 108 CAR-T(DL 3)15

単一治療或いはCARVacとの併用として、滴定フォーマットは持続的に単一療法或いはCARVacとしてこれまで評価された用量レベルで耐性が良好(1×107と1×108 CAR-T)·1×108 CAR-T用量で、70%の患者が1-2級CRSを見て、tocilizumab管理·2 DLT観察を投与することにより、2人の患者は完全に回復し、臨床的利益を示した·MTDはまだ達成されていない·すべての患者は強力なCAR-T移植を実現した:評価可能な患者の中で、ORRは43%、DCRは86%(n=14;であった。1×107と1×108 CAR-T)·6例のPR、5例のSD+、1例のSD(睾丸、卵巣と他の腫瘍、注射後6週間)·5例の精巣癌患者は1×108 CAR-T時に良好な治療効果があった:OOR 80%、DCR 100%であった。1つのCR、3つのPR、1つのSD·CARVacはCAR-T移植を支持し、そして生理的拡張と生存経路の上昇を媒介する·いくつかの患者は持続的なCAR-T持続性(注入後>150日)·初PRを示した患者は更なる深化の反応BNT 211:CAR-Tが固形腫瘍における治療効果と安全性を奨励した:AACRデータ遮断点:3月10,2022年DL 1:1 x 107 CAR-T;DL 2:1 x 108 CAR-T CLDN 6,Claudin-6;DLT,用量制限毒性;MTD,最大耐容量;CRS,細胞因子放出症候群;CR,完全応答;DCR,率;DL;疾患;DL;ORR,総有効率;PR,部分有効;SD,安定した疾患安全効果16
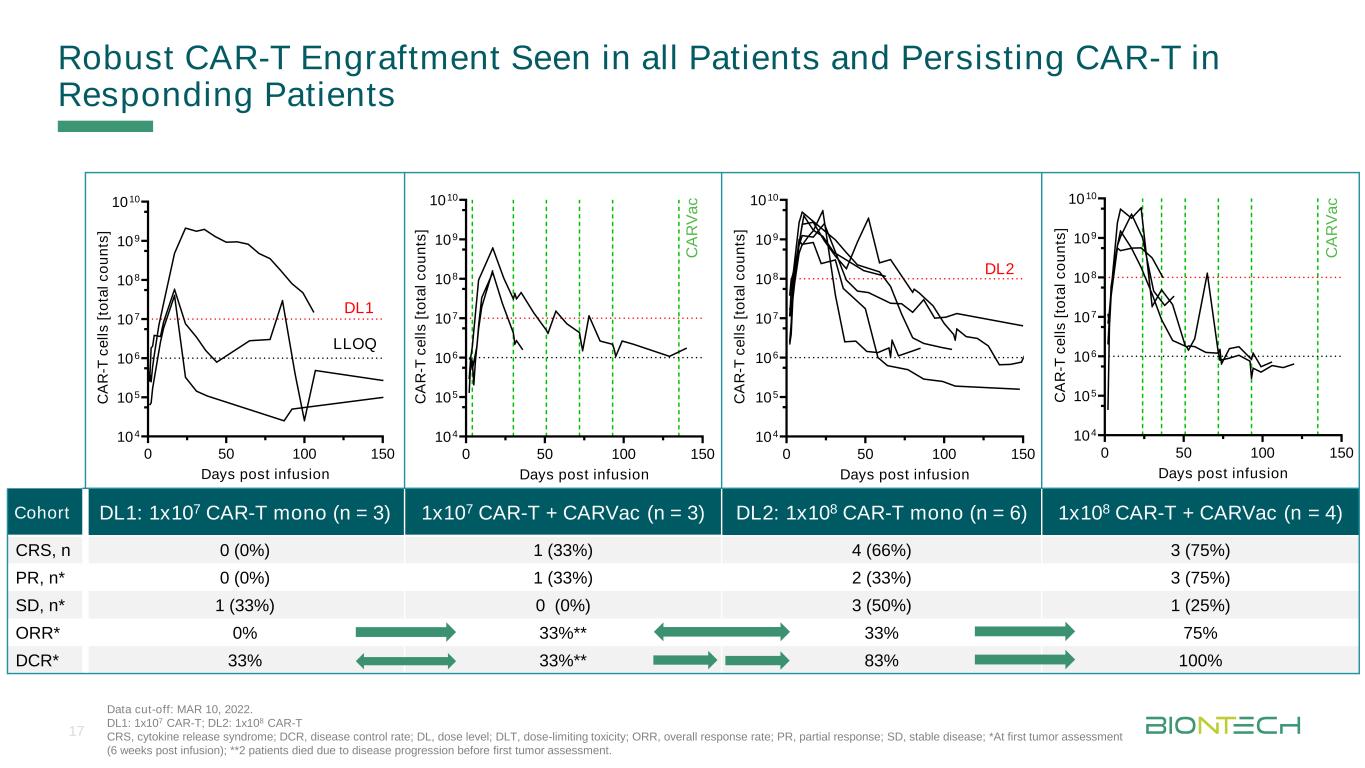
滴定フォーマットは輸液後10日間0 50 100 150 104 105 106 107 108 109 1010[Ta l c o o u n tsへ] 0 50 100 150 104 105 106 107 108 109 1010 Days post infusion C A R -T c e ll s [Ta l c o o u n tsへ] 0 50 100 150 104 105 106 107 108 109 1010 Days post infusion C A R -T c e ll s [Ta l c o o u n tsへ] 0 50 100 150 104 105 106 107 108 109 1010 Days post infusion C A R -T c e ll s [Ta l c o o u n tsへ]キューDL 1:1 x 107 CAR-T Mono(n=3)1 x 107 CAR-T+CARVac(n=3)DL 2:1 x 108 CAR-T Mono(n=6)1 x 108 CAR-T+CARVac(n=4)CRS,n 0(0%)1(33%)4(66%)3(75%)PR,n*0(0%)1(33%)2(33%)3(75%)SD,N*1(33%)0(0%)3(50%)1(25%)ORR*0%33%**33%75%DCR*33%33%**83%100%すべての患者に穏健なCAR-Tグラフトが見られ、応答患者における持続CAR-Tのデータ締め切り:2022年3月10日。DL 1:1 x 107 CAR-T;DL 2:1 x 108 CAR-T CRS、サイトカイン放出症候群;DCR、疾病コントロール率;DL、用量レベル;DLT、用量制限毒性;OOR、総応答率;PR、部分応答率;SD、病状安定;*初回腫瘍評価(輸液後6週間);**2名の患者は最初の腫瘍評価前に疾患進展で死亡した。LLOQ DL 1 DL 2 C A Va c C A RVa c 17
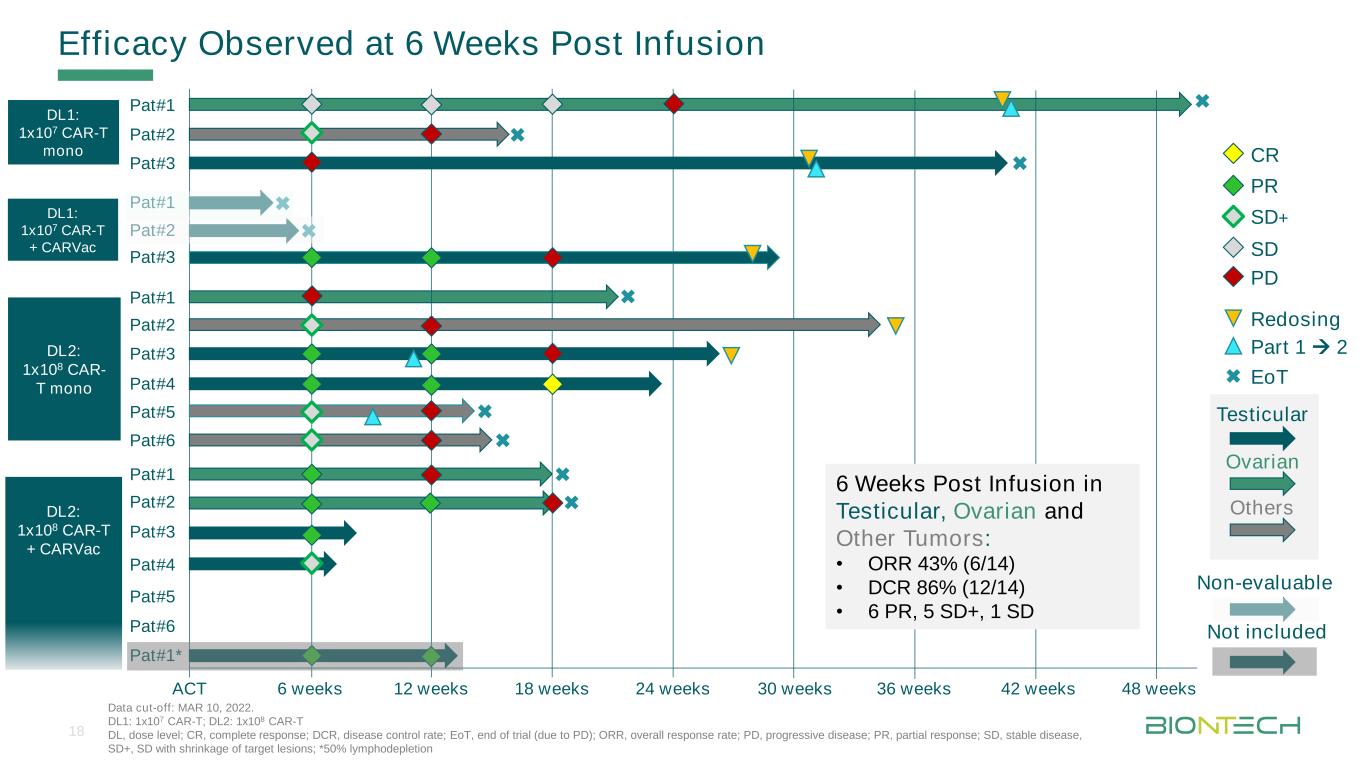
注入後6週間のデータ締め切り時間:2022年3月10日に治療効果を観察した。DL 1:1 x 107 CAR-T;DL 2:1 x 108 CAR-T DL、用量レベル;CR、完全緩和;DCR、疾病コントロール率;EoT、試験終了(PDによる);OOR、総有効率;PD、進行性疾患;PR、部分反応;SD、安定疾患、SD+、目標皮膚損傷縮小;*50%リンパ郭清法6週12週18週24週PR SD+PD CR PAT#1 PAT#2 PAT#3 30週36週PAT#1 DL 1:1 x 107 CAR-T Mono DL 1:1 x 107 CAR-T Mono DL 2:1 x 108 CAR-T Mono DL 2:1 x 108 CAR-T Mono 42週EoT Part 1≡2 PAT#2 PAT#3 PAT#4 PAT#1 PAT#2 PAT#6 PAT#5 DL 2:1 x 108 CAR-T+CARVAC#6 PAT#3*PAT#3PAT#4精巣卵巣は他に精巣内注射6週間後に評価できない他は含まれていない。卵巣その他腫瘍:·OOR 43%(6/14)·DCR 86%(12/14)·PR 6例、SD+5例、SD 18例
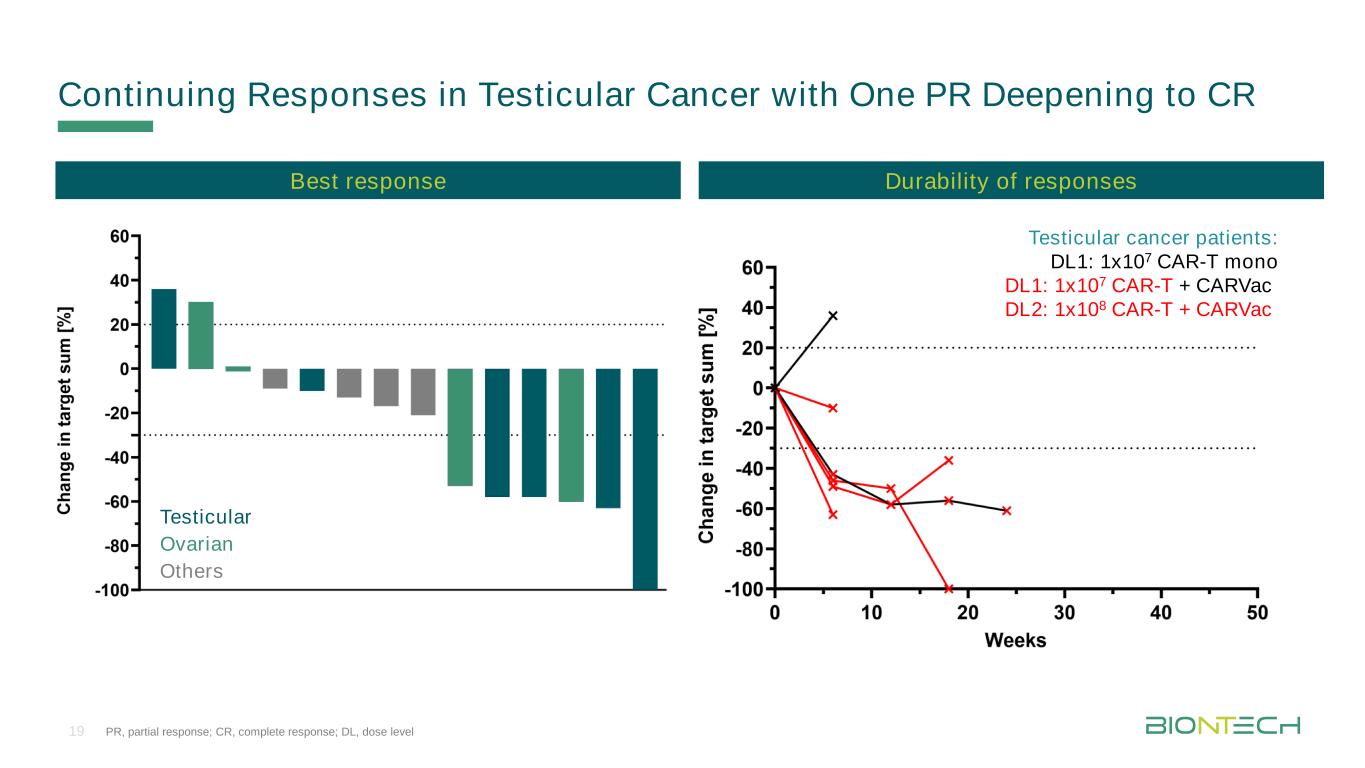
精巣癌患者の持続反応:DL 1:1 x 107 CAR-T Mono DL 1:1 x 107 CAR-T+CARVac DL 2:1 x 108 CAR-T+CARVac精巣卵巣の他の19個のPR、部分反応;CR、完全反応;DL、用量レベル
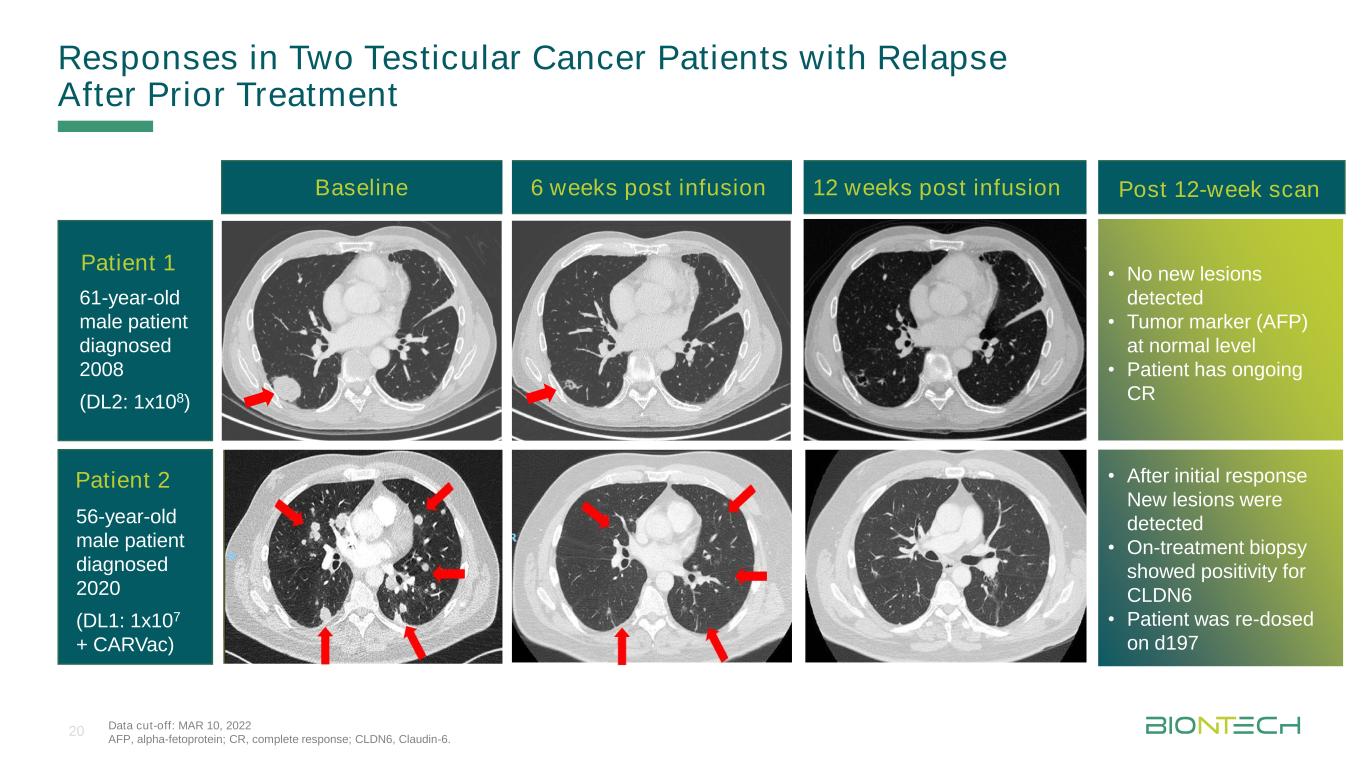
治療前資料遮断点:3月10日、2022年AFP、フェトプロテイン;CR、完全応答;CLDN 6、Claudin-6。注入後6週間ベースライン輸液後12週患者1名56歳男性患者2名2020年(DL 1:1 x 107+CARVac)61歳男性患者2008年(DL 2:1 x 108)·予備反応後に新たな病変を発見·治療中に生組織検査でCLDN 6陽性を示した·患者はd 197で再投与·新たな病変は認められなかった·腫瘍マーカー(AFP)は正常レベル·患者は12週間後にCR 20スキャンスキャンを行った

会社展望Ryan Richardson、首席戦略官Jens Holstein財務業績、CFOパイプ更新zlem Türeci、CMO 2022年第1四半期のハイライトUgur Sahin、CEO 21

タイトルメインフォーマットDurch Klken Bearbeiten 64億ユーロ48億ユーロ62億ユーロ+127億ユーロ2022年第1四半期総収入1営業業績希釈1現金および貿易売掛金ユーロ14.24 22 1 BioNTechの利益シェアは、ファイザーとBioNTechが共有する予備データから推定され、2021年12月31日までの年次報告20-F表および2022年3月31日までの3ヶ月間の四半期報告でさらに記載されており、BioNTech現在の報告書の添付ファイルとしてBioNTechに提出されている。協力パートナーの毛利益の推定シェアのどんな変化も前向きに確認されるだろう

タイトル主フォーマット持続新冠肺炎ワクチン第1四半期の商業収入が強い2022年第1四半期-BioNTechは2022年財政年度指導パートナーに新冠肺炎ワクチンBioNTech製製品を直接BioNTech地域の顧客に新冠肺炎ワクチンを直接販売する2022年第1四半期に新冠肺炎ワクチンを輝瑞と復星国際製薬地域で販売する毛利益シェア(100%毛率)23ユーロ64億ユーロ2022年第1四半期46億ユーロ12億ユーロ1バイオテクノロジー社の利益シェアはファイザー社とBioNTech公司が共有した初歩的なデータに基づいており、12月31日までの年次報告20-Fを詳細に参照されたい。および2022年3月31日および2022年3月31日までの3カ月間の四半期報告は,BioNTechの現在Form 6−K報告の証拠品とした。協力パートナーの毛利益の推定シェアのどんな変化も前向きに確認されるだろう
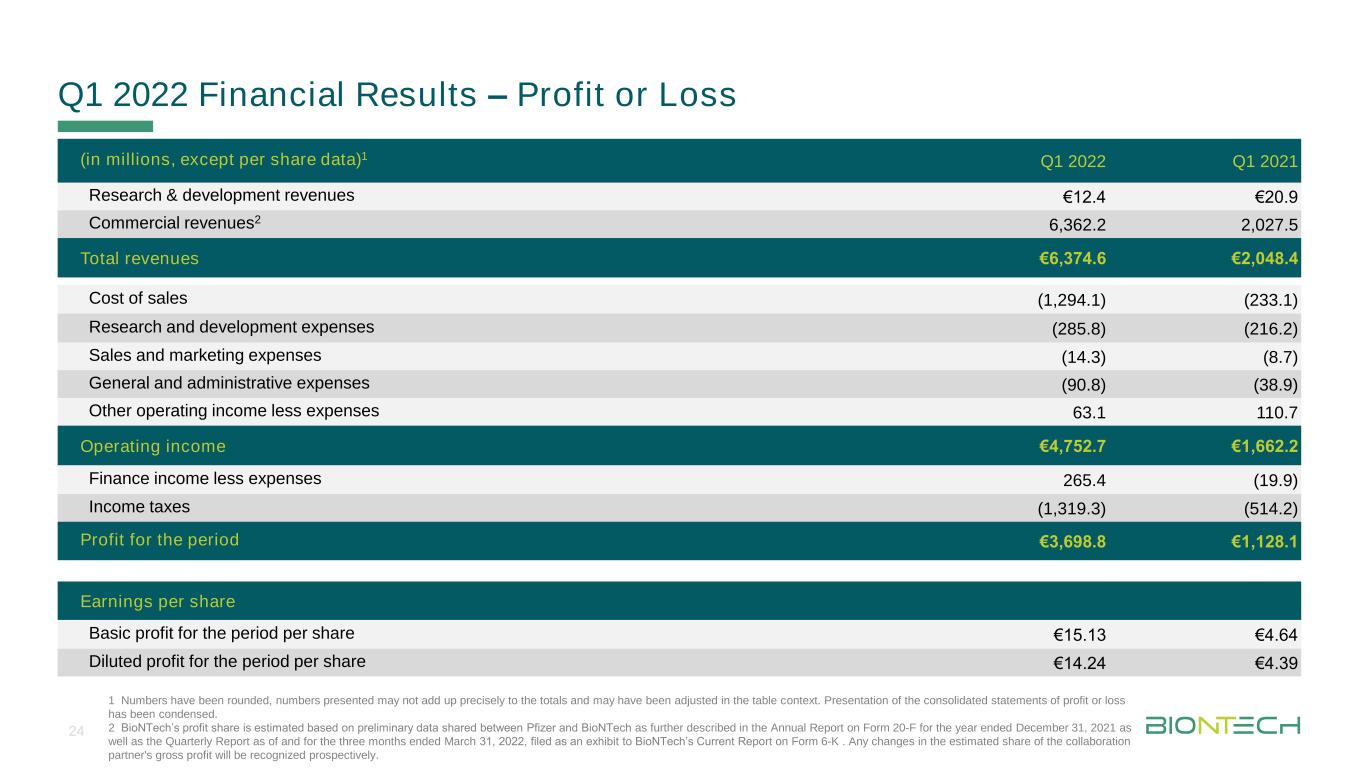
タイトルメインフォーマットDURCH Klken Bear Beiten 2022第1四半期の財務業績-利益または損失(単位:百万、2021年第1四半期研究開発収入12.4ユーロ20.9ユーロ商業収入2,362.2 2,027.5総収入ユーロ6,374.6ユーロ2,048.4販売コスト(1,294.1)(233.1)研究開発費(285.8)(216.2)販売およびマーケティング費用(14.3)(8.7)一般および行政費用(90.8)(38.9)その他営業収入から費用63.1 110.7営業収入4,752.7ユーロ1,662.2ユーロ財務収入から支出265.4(19.9)所得税(1,319.3)(514.2)を差し引いた同時期の1株当たり収益3,698.8ユーロ1,128.1同時期の基本1株当たり利益15.13ユーロ4.64希釈後の1株当たり利益14.24ユーロ4.39 1数字は四捨五入されている。列挙された数字の合計は総数と一致しない可能性があり、テーブルで調整されている可能性がある。総合損益表の列報は既に簡素化された.2 BioNTechの利益シェアは,ファイザーとBioNTechが共有した予備データから推定され,2021年12月31日現在のForm 20−F年度報告および2022年3月31日までの3カ月間の四半期報告(BioNTech現在Form 6−K報告の証拠物として)にさらに記載されている。協力パートナーの毛利益の推定シェアのどんな変化も前向きに確認されるだろう。24個
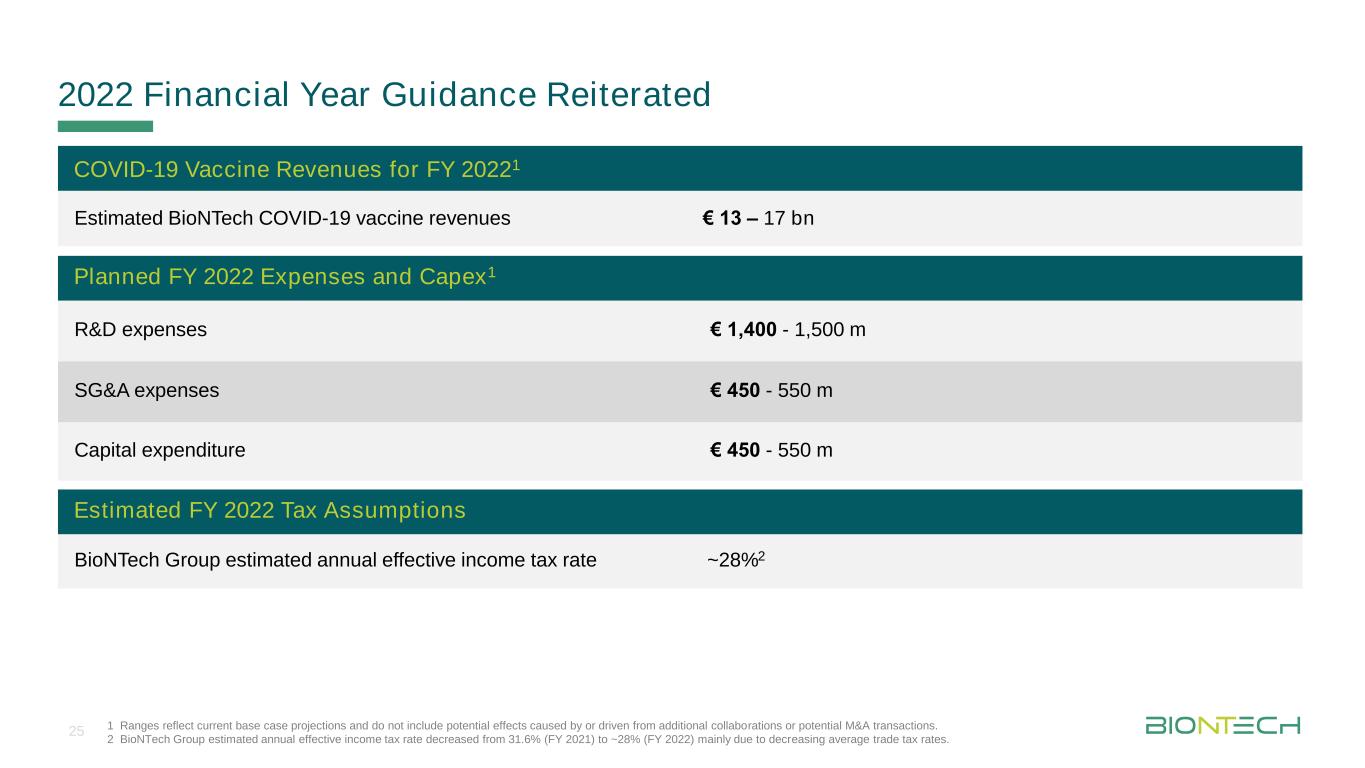
タイトルマスタフォーマットDURCH Klken Bear Beiten 2022会計年度指導は、追加の協力または潜在的なM&A取引によるまたは駆動の潜在的な影響を含まない現在の基本的な状況予測を反映する範囲を再確認する。2 BioNTech Groupは、平均貿易税率の低下により、年間有効所得税税率が2021年度の31.6%から2022年度の約28%に低下すると推定している。新冠肺炎ワクチン収入20221年度バイオ科学技術新冠肺炎ワクチン収入130億~170億ユーロ2022年計画支出とCapex 1研究開発支出1400~15億ユーロSG&A支出4.5億~5.5億ユーロ資本支出4億5千万~5億5千万ユーロ2022年度推定税収想定生物科学技術グループ推定年度有効所得税税率~28%225

会社展望Ryan Richardson、首席戦略官Jens Holstein財務業績、CFOパイプ更新zlem Türeci、CMO 2022年第1四半期のハイライトUgur Sahin、CEO 26
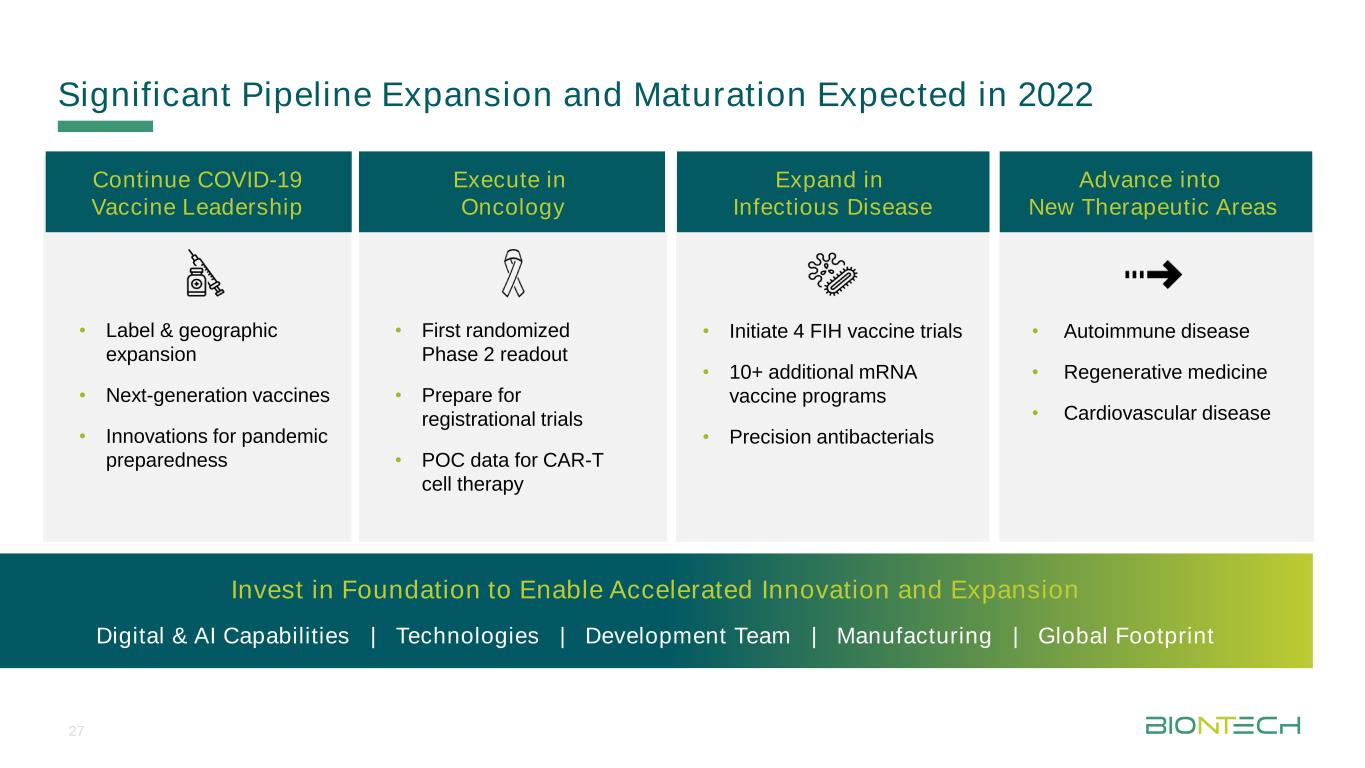
TicelMaster Formatは、2022年に4つのFIHワクチン試験·10+追加メッセンジャーリボ核酸ワクチン計画·精密抗菌薬の感染症分野での拡大·初のランダム第2段階読み取り·登録試験準備·CAR−T細胞治療のPOCデータを腫瘍学分野で継続新冠肺炎ワクチンリード·ラベルと地理拡張·次世代ワクチン·大流行防疫革新投資財団を実行して加速革新と拡張デジタルと人工知能能力|技術|開発チーム|製造|グローバルフットプリント·自己免疫疾患·再生薬·心血管疾患が新たな治療領域に進出27

タイトル母版フォーマット持続Klken Bearbeiten新冠肺炎ワクチン展望2022年を目前に控えたデータBNT 162 b 2計時·16歳から65歳成人第四剤データ2進行中·6ケ月からbr}児童三剤案データ

2022年には単純ヘルペスウイルス2型,単純ヘルペスウイルス2型;FPD,最初の患者投与;CLDN,Claudin;非小細胞肺癌1と輝瑞協力、2貝母細胞増殖因子と協力し、3遺伝子技術伝染病との協力タイミング·帯状疱疹ワクチン1 2 H·結核病ワクチン2 H·HSV 2ワクチン2 H·マラリアワクチン2 H 4伝染病初の人体試験開始腫瘍学·BNT 141-RiboMab、固形腫瘍FPD 1月·BNT 142-RiboMab、固形腫瘍1 H·BNT 116-FixVac連合/Libtayo、NSCLC 2 H≡3学初例人体試験開始データ更新·BNT 161-インフルエンザmRNA 1·BNT 1223 2-NeST組み合わせ/pembtayab,1 L 20 H 22/BNT 1段階CANT 1/BNT 2-CAST組み合わせ/pemtayab,1 L 20 H 22/BNT 1段階多発性固形腫瘍2 H 3データ更新29

30節約日仮想資本市場日株主総会2022年6月29日2022年6月1日30
