
| 招股说明书 | 依据第424(B)(4)条提交 |
| 注册号码333-275320 |

400,000股普通股
预融资 认股权证最多购买3600,000股普通股
系列 购买最多400万股普通股的普通权证
B系列普通股认股权证将购买最多400万股普通股
普通权证相关的800万股普通股
3600,000股普通股,作为预先出资的认股权证的基础
我们 在“合理努力”的基础上发行400,000股普通股,每股票面价值0.0001美元(“普通股”),A系列普通权证购买4,000,000股普通股(“A系列普通股 认股权证”),B系列普通权证购买最多4,000,000股普通股(“B系列普通股 认股权证”),与A系列普通权证一起,以每股1.25美元的合并公开发行 价格发行“普通权证”,并随附A系列普通权证和B系列普通权证。每股普通股与A系列普通股认股权证和B系列普通股认股权证一起出售,A系列普通股认股权证购买一股普通股,B系列普通股认股权证购买一股普通股。普通权证的行使价为每股1.25美元,并可在发行时行使。A系列普通权证于发行5周年时终止,B系列普通权证于发行18个月后终止。本招股说明书还涉及根据普通权证的行权而发行的普通股的发行。在本次发行期间,每股公开发行价和附带的普通权证的合并价格将是固定的。
我们 还向投资者提供预融资认股权证,购买最多3,600,000股普通股(以及在行使预融资认股权证后可发行的普通股股票),如果投资者在此次发售中购买我们普通股的股份 将导致该投资者及其关联公司和某些关联方实益拥有超过4.99%(或在投资者选择时,9.99%)的已发行普通股。在本次发售完成后,有机会 购买。代替将导致投资者实益所有权超过4.99%(或在投资者选择时为9.99%)的普通股,预资金权证将以0.0001美元的行使价购买一股我们的普通股, 我们称之为预资资权证。每份预先出资的认股权证在发行时即可行使,并将在全部行使时到期 。每份预先出资的认股权证将与购买一股普通股的A系列普通权证和购买一股普通股的B系列普通权证一起出售,该等普通权证的条款将与我们每股普通股一起出售的普通权证的条款相同 。每一份预筹资权证和随附的普通权证的公开发行价等于本次发行中向公众出售的普通股和随附普通权证的每股价格减去0.0001美元。 每份预资资权证和随附的普通权证的合并公开发行价将在本次发行期间固定。 本招股说明书还涉及在行使预融资权证和向预融资权证的购买者发行普通股时可发行的普通股股票。
普通股和/或预筹资权证及附随认股权证的股份只能在本次发行中一并购买,但将分开发行 ,并可在发行时立即分开。在您投资我们的证券之前,您应该仔细阅读这份招股说明书。
我们的普通股在纳斯达克全球市场的纳斯达克股票市场有限责任公司(“纳斯达克”)上市,代码为“ZVSA”。 2023年12月5日,我们的普通股在纳斯达克上最后一次报价出售价格为2.17美元。在此发行的预融资权证或普通权证尚无公开交易市场,我们预计市场不会发展。 如果没有活跃的交易市场,预融资权证和普通权证的流动性将受到限制。此外,我们 不打算在纳斯达克、任何其他国家证券交易所或任何其他交易系统上上市预融资权证或普通权证。
我们 已与AG.P./Alliance Global Partners作为我们的配售代理参与此次发售 。配售代理已同意尽其合理的最大努力安排出售本招股说明书提供的证券。配售代理不购买或出售我们提供的任何证券,并且不要求配售代理安排购买或出售任何特定数量或金额的证券。我们已同意向配售代理支付下表中列出的配售代理费,前提是我们出售了本招股说明书提供的所有证券。 不存在以托管、信托或类似安排获得资金的安排。没有最低证券股份数量或最低总收益金额,这是本次发行结束的条件。我们出售的证券可能少于在此提供的所有证券,这可能会显著减少我们收到的收益,如果我们不出售在此提供的所有证券,此次发行的投资者将不会获得退款。由于没有托管帐户,也没有最低证券数量或收益金额,因此投资者可能已对我们进行了投资,但我们没有在此次发行中筹集到足够的收益,不足以满足本招股说明书中所述收益的预期用途。我们将承担与此次产品相关的所有费用。我们的某些高级管理人员、董事和员工也可以选择以与其他购买者相同的条款和条件参与此次发售。请参阅“分销计划“从本招股说明书的第142页开始,了解有关这些安排的更多信息。
您 应阅读本招股说明书,以及标题“在那里您可以找到更多信息,“在您投资我们的任何证券之前,请仔细考虑。
2023年10月31日,我们的股东批准了我们的普通股流通股的反向拆分,拆分的比例在 10股1股到50股1股的范围内,按董事会确定的比例和日期生效。我们的 董事会随后决定,反向股票拆分的比例为35比1。在获得批准后,我们向特拉华州州务卿提交了第二份修订和重述的公司注册证书的 修正案,以 实施反向股票拆分,生效时间为下午4:01。东部时间2023年12月4日。作为反向 股票拆分的结果,我们的普通股中每35股,无论是已发行的还是已发行的,在我们向特拉华州州务卿提交的我们对第二次修订和重述的公司注册证书的修订提交和生效之前,被自动合并并转换(无需任何进一步行动)为一股已缴足且不可评估的普通股。没有发行与反向股票拆分相关的零碎股份。如果普通股的股份是直接持有的,则普通股的每一股零碎股份都将 四舍五入为普通股的最接近的完整份额。反向股票拆分 将普通股的流通股总数从反向拆分前的43,515,401股减少到反向拆分后的1,243,297股(受反向股票拆分产生的 股四舍五入的调整)。
本登记声明中出现的所有财务信息、 股份编号、期权编号、认股权证编号、其他衍生证券编号和行使价,包括Larkspur(如下定义)证券的股份,已进行调整以实施反向 股票拆分。
根据联邦证券法的定义,我们 是一家“新兴成长型公司”,因此,我们可能会选择遵守某些已降低的上市公司在未来备案时的报告要求。
投资我们的证券涉及高度风险。在购买任何证券之前,您应仔细阅读标题为“风险因素“从本招股说明书第11页开始。
每股及随附普通股 认股权证 | 每份预付资金认股权证和随附的普通权证 | 总计 | ||||||||||
| 公开发行价 | $ | 1.2500 | $ | 1.2499 | $ | 4,999,640 | ||||||
| 安置代理费(1) | $ | 0.0750 | $ | 0.750 | $ | 299,978 | ||||||
| 给我们的收益(未计费用)(2) | $ | 1.1750 | $ | 1.1749 | $ | 4,699,662 | ||||||
(1) 代表相当于投资者在本次发行中支付的总购买价6.0%的现金费用。我们还同意向 配售代理报销与其产品相关的某些费用。请参阅“配送计划从本招股说明书第142页开始,了解配售代理将获得的补偿说明。
(2) 不包括以现金形式行使普通权证的收益(如有)。
证券交易委员会和任何州证券委员会都没有批准或不批准这些证券,也没有确定本招股说明书是否真实或完整。任何相反的陈述都是刑事犯罪。
普通股股份、预融资权证和普通权证预计将于2023年12月11日左右交付给购买者。
Sole 安置代理
AGP。
本招股说明书的 日期为2023年12月6日。
目录表
| 页面 | |
| 关于这份招股说明书 | 1 |
| 商标 | 2 |
| 选定的定义 | 3 |
| 关于前瞻性陈述的警告性声明 | 4 |
| 招股说明书摘要 | 6 |
| 供品 | 9 |
| 风险因素 | 11 |
| 收益的使用 | 67 |
| 稀释 | 68 |
| 我们普通股和股息信息的市场价格 | 70 |
| 生意场 | 71 |
| 管理层对财务状况和经营成果的讨论与分析 | 106 |
| 管理 | 120 |
| 高管薪酬 | 125 |
| 证券的实益所有权 | 140 |
| 配送计划 | 142 |
| 某些关系和关联方交易 | 145 |
| 股本说明 | 152 |
| 我们提供的证券说明 | 167 |
| 法律事务 | 171 |
| 专家 | 172 |
| 在那里您可以找到更多信息 | 173 |
| 财务信息索引 | F-1 |
您 应仅依赖此招股说明书中包含的信息。未授权任何人向您提供与本招股说明书中包含的信息 不同的信息。本招股说明书的日期为本招股说明书封面所列日期。您不应 假设本招股说明书中包含的信息在该日期以外的任何日期都是准确的。
| i |
关于 本招股说明书
我们 未授权任何人提供任何信息或作出任何陈述,但本招股说明书或由我们或代表我们编制的任何免费书面招股说明书或我们已向您推荐的招股说明书中包含的信息或陈述除外。我们 对他人可能向您提供的任何其他信息的可靠性不承担任何责任,也不能提供任何保证。此 招股说明书仅提供仅出售在此提供的证券的要约,且仅在合法的情况下且在司法管辖区内 。本招股说明书或任何适用的免费书面招股说明书中包含的信息仅在其日期有效,无论其交付时间或我们证券的任何销售。自该日期以来,我们的业务、财务状况、运营结果和前景可能已发生变化 。
本招股说明书中提供的信息包含统计数据和估计,包括与我们所参与市场的市场规模和竞争地位有关的数据和估计,这些数据和估计是从我们自己的内部估计和研究,以及从行业和一般出版物以及由第三方进行的研究、调查和研究中获得的。行业出版物、研究和调查一般都表明,它们是从据信可靠的来源获得的。虽然我们相信我们公司内部的研究是可靠的,并且我们市场和行业的定义是适当的,但这项研究或这些定义都没有得到任何独立的 来源的验证。
对于美国以外的投资者:我们没有,配售代理也没有做任何事情,以允许在美国以外的任何司法管辖区进行此次发行或拥有或分发本招股说明书。 持有本招股说明书的美国境外人员必须告知自己,并遵守与在美国境外发售证券和分发本招股说明书有关的任何限制。
本招股说明书包含本文所述部分文件中包含的某些条款的摘要,但请参考实际文件以获取完整信息。所有的摘要都被实际文件完整地限定了。本招股说明书所指的部分文件的副本已存档、将存档或将通过引用合并为注册说明书的证物 ,您可以获得这些文件的副本,如下所述。您 可以在此处找到更多信息。”
除 明确说明或文意另有所指外,本招股说明书中对“公司、“The”注册人,” “我们,” “我们“和”我们的“指ZyVersa(以及旧ZyVersa的业务,在业务合并生效后, 成为ZyVersa的业务)。
| 1 |
商标
本 文档包含对属于其他实体的商标和服务标记的引用。仅为方便起见,本招股说明书中提及的商标和商品名称可能不带®或™符号,但此类引用并不以任何方式表明, 适用许可人不会根据适用法律在最大程度上主张其对这些商标和商品名称的权利。我们无意使用或展示其他公司的商号、商标或服务标志,以暗示与任何其他公司有关系,或由任何其他公司背书或赞助。
| 2 |
已选择 个定义
除非 本招股说明书中另有说明或上下文另有要求,否则:
“尽最大努力保证“指我们在本公司于根据我们于2023年1月27日向美国证券交易委员会提交的经修订的S-1表格注册声明(文件编号333-269442),尽力而为。
“尽最大努力 提供“指的是根据我们于2023年1月27日向美国证券交易委员会提交的S-1表格注册声明(文件编号333-269442),尽最大努力提供。
“业务组合 “指企业合并,包括《企业合并协议》拟进行的合并和其他交易。
“业务 合并协议“指日期为2022年7月20日的某些业务合并协议,由证券持有人代表ZyVersa、Larkspur和合并子公司签订,并经不时修改;
“结业“ 指企业合并的完成;
“截止日期 “指企业合并完成之日,即2022年12月12日;
“普通股 股票“指我们的普通股,面值0.0001美元;
“首次公开募股(IPO)“ 指Larkspur的首次公开募股于2021年12月23日完成。
“诱因 认股权证“指于2023年9月向现有权证持有人发行的新诱导权证,行权价为4.75美元。
“2023年7月提供服务指我们于2023年7月26日完成的公开发售。
“2023年7月的认股权证“指我们在2023年7月发行的认股权证。
“拉克斯普“ 指实施业务合并之前的特拉华州公司Larkspur Health Acquisition Corp.;
“合并“ 指合并Sub与Old ZyVersa并并入Old ZyVersa,Old ZyVersa作为ZyVersa的全资子公司继续存在;
“合并 子公司“指Larkspur Health Merge Sub,Inc.,该公司是特拉华州的一家公司,也是Larkspur的全资子公司;
“旧的 ZyVersa“指ZyVersa治疗公司,佛罗里达州的一家公司,在业务合并生效后;
“旧的ZyVersa担保“指因业务合并而向Old ZyVersa权证持有人 注销及转换Old ZyVersa的每份已发行认股权证而发行的45,032股本公司普通股可行使的认股权证。
“管道 投资者”指已签署PIPE认购协议的投资者;
“管道 个共享“指在PIPE投资中出售给PIPE投资者的Larkspur A系列可转换优先股的股份;
“管道 订阅协议“指Larkspur与管道投资者之间签订的证券购买协议,日期为2022年7月20日,经修订(并可能根据其条款不时进一步修订、修改、补充或豁免),据此Larkspur同意以每股1,000美元的收购价向管道投资者发行总计12,500股Larkspur A系列可转换优先股和认股权证,金额相当于该系列A优先股转换后可向管道投资者发行的普通股标的股份的100%;
“管道 授权书“指与PIPE股份一起出售给PIPE投资中PIPE投资者的私募权证;
“管道“ 或”管道投资“指PIPE投资者购买总额为8,635,000美元的私募,以换取紧接 PIPE认购协议中规定的条款和条件结束之前的Larkspur A系列优先股和认股权证的股份;
“私募认股权证 “指与首次公开招股有关而发行的非公开认股权证;
“公共 认股权证“指与首次公开招股有关而向投资者发行的公开认股权证;
“证券持有人 代表“指企业合并协议中指定的Old ZyVersa的股东代表;
“系列 A优先股“指35股A系列优先股转换为500股普通股,转换价格为每股70.00美元/股,以及715股由独立持有人持有但尚未转换的A系列优先股。
“B股系列 “指5,062股Larkspur的B系列可转换优先股,可转换为Larkspur的普通股,发行给持有人以清偿某些债务和交易成本;
“赞助商“指特拉华州有限责任公司Larkspur Health LLC;以及
“ZyVersa“ 或”公司“指的是ZyVersa治疗公司,一家特拉华州的公司,在业务合并生效后。
| 3 |
有关前瞻性陈述的警示性 声明
本招股说明书包含前瞻性陈述,因此不是历史事实。这包括但不限于有关财务状况、业务战略以及我们未来运营的管理计划和目标的陈述。这些陈述 构成预测、预测和前瞻性陈述,并不是业绩的保证。这样的陈述可以通过它们与历史或当前事实没有严格联系这一事实来识别。在本招股说明书中使用的词语,如“预期”、“相信”、“继续”、“可能”、“估计”、“预期”、“打算”、“可能”、“可能”、“计划”、“可能”、“可能”、“潜在”、“预测”、“项目”、“ ”应该、“努力”、“将会”以及类似的表达方式可能识别前瞻性陈述,但 没有这些词语并不意味着声明没有前瞻性。本招股说明书和通过引用并入本招股说明书的任何文件中的前瞻性陈述可能包括,例如,关于:
| ● | 我们 实现业务合并预期收益的能力; | |
| ● | 与我们业务相关的成本; | |
| ● | 我们的 财务和业务表现,包括财务预测和业务指标; | |
| ● | 我们的 在未来实现和保持盈利能力的能力 | |
| ● | 我们的 有效地增长和扩大业务的能力; | |
| ● | 我们目前的计划和运营受到干扰的风险; | |
| ● | 商业或经济中断的潜在可能性,包括当前和未来的流行病造成的中断,如新冠肺炎大流行,包括其突变或变体,以及对商业和财务状况的影响; | |
| ● | 维持我们的证券在纳斯达克上上市的能力,以及我们证券的潜在流动性和交易; | |
| ● | 认识到我们业务的预期收益的能力,这可能会受到增长和管理我们的研发和临床活动以及留住关键员工的能力的影响。 | |
| ● | 适用法律或法规变更的影响; | |
| ● | 我们的 未来的资本需求以及现金来源和使用,包括获得资本来源或筹集资金的能力 未来; | |
| ● | 我们的网络强度、我们技术的有效性以及通过我们平台提供的产品的质量; | |
| ● | 我们业务的预测财务信息、增长率、战略和市场机会; | |
| ● | 我们的 维持我们现有的许可协议和其他合作安排的能力; | |
| ● | 我们的 能够获得和维护我们候选产品的监管批准,以及任何相关限制和限制 未来的产品; | |
| ● | 我们的研发策略和活动的成功、成本和时间; | |
| ● | 我们的 成功推出我们的候选产品并被市场接受的能力; | |
| ● | 与竞争对手竞争的能力、评估和策略; |
| 4 |
| ● | 我们的 吸引和留住人才的能力,以及我们的薪酬策略和领导力的有效性; | |
| ● | 我们的 保持我们的许可证和在严格监管的制药行业运营的能力; | |
| ● | 预防和防范网络安全攻击的能力; | |
| ● | 我们的 依赖第三方服务提供商处理支付、Web和移动操作系统、软件、背景调查, 保险政策; | |
| ● | 我们的 建立和维持有效的财务报告内部控制制度的能力; | |
| ● | 任何已知和未知的诉讼和监管程序的结果,包括任何事件、变更或其他情况的发生, 包括可能对我们提起、可能影响我们业务的任何法律诉讼的结果; | |
| ● | 我们的 维护和保护我们的品牌和知识产权的能力;以及 | |
| ● | 其他 标题为“风险因素.” |
这些 前瞻性陈述基于截至本招股说明书发布之日可获得的信息以及当前的预期、预测和假设,涉及大量判断、风险和不确定性。因此,前瞻性陈述不应被视为代表我们在任何后续日期的观点,我们不承担任何义务更新前瞻性陈述 以反映它们作出之日后的事件或情况,无论是由于新信息、未来事件或其他原因, 除非适用的证券法可能要求。
| 5 |
招股说明书 摘要
此 摘要重点介绍了此招股说明书中的精选信息,可能不包含对您作出投资决策 非常重要的所有信息。在投资我们的证券之前,您应仔细阅读整个招股说明书,包括本招股说明书中包含的财务报表和相关说明,以及本招股说明书中其他部分的“风险因素”、 “业务”和“管理层对财务状况和经营结果的讨论和分析” 标题下列出的信息。另请参阅标题为“在哪里可以找到更多信息”的小节。除明确说明或文意另有所指外,本招股说明书中的“公司”、“注册人”、“本公司”、“本公司”及“本公司”均指ZyVersa(及Old ZyVersa的业务,在业务合并生效后成为ZyVersa的业务)。
概述
我们 是一家临床阶段的生物制药公司,利用专有技术为患有慢性肾脏疾病或炎症性疾病的患者开发药物,这些患者的医疗需求尚未得到满足。我们的使命是开发优化健康结果和提高患者生活质量的药物。
我们 拥有两个全球许可的专利药物开发平台,每个平台都是由迈阿密大学米勒医学院(以下简称迈阿密大学)的研究科学家发现的。这些开发平台 包括:
| ● | 胆固醇外流调节剂TM,VAR200(2-羟丙基-β-环糊精或“2HPβCD”)是一种临床上正在开发中的治疗肾脏疾病的注射剂。VAR 200于2015年12月15日从L研究有限责任公司获得许可。L研究公司是由迈阿密大学的研究科学家创立的,他们发现了VAR 200用于肾脏疾病。 | |
| ● | IC 100是一种用于治疗炎症性疾病的临床前开发中的单抗炎症体ASC抑制剂。IC 100于2019年4月18日从InflamaCore,LLC获得许可。InflamaCore,LLC是由迈阿密大学的研究科学家创建的,他们发明了IC 100。 |
我们 相信我们的每一种候选产品都有潜力在各自的治疗领域治疗多种适应症。我们的战略是专注于适应症扩展,以最大限度地发挥商业潜力。
我们的肾脏管道最初专注于罕见的慢性肾小球疾病。我们对VAR 200的主要指征是局灶性节段性肾小球硬化(FSGS)。2020年1月21日,我们提交了VAR 200的新药研究申请(“IND”),美国食品和药物管理局(“FDA”)已允许我们的开发计划基于活性成分(2HPβCD)的风险/益处概况,在FSGS患者 中进行2a期试验。在对患有FSGS的患者启动2a期试验之前,我们计划在2024年第一季度支持一项开放标签概念验证试验,届时我们预计将获得8名糖尿病肾病患者的数据。这将能够在患者进行治疗的过程中评估药物效果,并将为开发我们的2a阶段方案提供见解。VAR 200具有代表FSGS、Alport综合征和糖尿病肾病的动物模型的药理学概念验证数据,其中每一种都可以根据我们的适应症扩展策略进行开发。
我们的炎症体ASC抑制剂计划IC 100正处于临床前开发阶段。我们的重点是推动1C 100在2024年第二季度提交当前计划的 IND,然后启动第一阶段试验。IC 100具有代表急性呼吸窘迫综合征(ARDS)和多发性硬化症(MS)的动物模型的药理学概念验证数据。我们计划在下一波临床前发展中进行多达六种适应症的额外动物研究,例如免疫球蛋白A(“IgA”)肾病、帕金森氏病、早期阿尔茨海默病、亨廷顿病和充血性心力衰竭。 我们预计将根据我们临床前计划的数据选择一个或多个IC 100的主要适应症。
我们的 管道
我们管道的目标是针对具有高度未满足医疗需求的肾脏和炎症适应症,我们相信可以通过我们的作用机制解决这些问题。我们打算通过为VAR 200和IC 100开发多个适应症 ,以及通过潜在的肾脏和抗炎候选产品的许可,进一步增强和扩大我们的产品组合。
| 6 |
业务 战略
我们 寻求被公认为领先的生物制药公司,处于创新前沿,为有高度未满足医疗需求的患者提供服务。 我们致力于通过开发生物制药产品来恢复健康并改变患者的生活。我们的策略 是:
| ● | 推进VAR 200的开发. | |
| ● | 推进我们的IC 100临床前计划. | |
| ● | 利用我们的适应症扩展战略,通过在各自的治疗领域开发多个适应症,最大限度地发挥我们每个产品平台的商业潜力. | |
| ● | 维护我们的候选产品的开发和商业化权利. | |
| ● | 扩展我们的候选产品组合 . | |
| ● | 继续 加强和扩大我们的知识产权组合. |
上文中反映的 日期和事件仅为估计值,无法保证所包含的事件 将在呈现的预期时间轴上完成,或根本不会完成。此外,无法保证我们将成功开发 我们的任何候选产品,或我们未来可能开发的任何其他产品或候选产品,或我们未来可能开发的任何候选产品 将获得FDA的任何适应症批准。
市场 和商业机会
我们 认为,我们的主要候选产品具有治疗医疗需求显著未满足的疾病的潜力,包括(i) 我们的主要候选肾脏产品VAR 200,正在开发用于多种肾脏适应症的潜在治疗,如局灶性节段性肾小球硬化症(FSGS)和Alport综合征(孤儿适应症)和糖尿病肾病;和(ii)我们的主要抗炎产品 候选产品,IC 100,用于治疗多种炎症性疾病,包括,但不限于多发性硬化症和急性呼吸窘迫综合征。VAR 200尚未被FDA授予FSGS或Alport综合征的孤儿药指定。
风险因素
我们的业务受到许多风险和不确定性的影响,包括标题为“风险因素“ 紧随此招股说明书摘要,该摘要阐明了我们在成功实施战略和业务增长方面面临的挑战 。以下考虑因素(除其他外)可能会抵消我们的竞争优势或对我们的业务战略产生负面影响,这可能会导致我们证券的股价下跌并导致您的全部或部分投资损失 。
| ● | 我们当前或未来的候选产品可能永远不会获得批准或获得商业市场认可; | |
| ● | 我们 是一家处于发展阶段的公司,经营历史有限,没有收入,有许多因素可能会影响我们的业务前景 ; | |
| ● | 截至 日期,我们没有数据支持监管部门批准我们的任何药品,我们没有任何产品在任何司法管辖区获准商业销售,我们也没有从产品销售中获得任何收入; | |
| ● | 我们 将需要额外资金来开发我们的候选产品并将其商业化。如果我们无法筹集足够的资金,我们 将被迫推迟、减少或取消我们的产品开发计划; | |
| ● | 我们的业务依赖于我们候选产品的成功开发、监管批准和商业化,特别是VAR 200和IC 100; | |
| ● | 我们的 候选产品如果获得批准,将面临激烈的竞争,如果我们不能有效竞争,可能会阻止我们实现显著的市场渗透; | |
| ● | 我们 可能无法实现我们业务的预期收益,任何收购、战略关系、合资或投资都可能扰乱我们的业务,损害我们的经营业绩和财务状况; | |
| ● | 如果 我们不能成功地管理我们的增长和扩大我们的业务,我们的声誉、品牌、业务和运营结果可能会受到损害 ; | |
| ● | 我们 在竞争激烈的人才市场中存在依赖关键管理成员和其他关键人员以及吸引、留住和培养合格人才的风险; | |
| ● | 我们 可能面临诉讼风险,并可能因此面临责任和对我们的专业声誉的损害; | |
| ● | 我们的业务受到广泛的国内和国外法规的约束,这可能会使我们面临巨大的成本和合规要求; | |
| ● | 我们 可能面临与我们作为1933年《证券法》含义内的新兴成长型公司的地位相关的风险,作为 修订后(“证券法”); | |
| ● | 未能实现并保持对财务报告的有效内部控制可能导致我们无法准确或及时地报告我们的财务状况或经营结果,这可能对我们的业务和股票价格产生重大不利影响; | |
| ● | 我们 可能无法继续经营下去。 | |
| ● | 如果我们对关键会计政策的估计或判断被证明是不正确的,我们的经营业绩可能会受到不利影响 ; | |
| ● | 作为一家上市公司的要求可能会使我们的资源紧张,导致诉讼,并分散管理层的注意力; | |
| ● | 我们普通股的活跃交易市场可能永远不会发展或持续; | |
| ● | 我们普通股的价格可能会波动,这可能会给投资者造成重大损失; |
| 7 |
| ● | 我们总流通股的很大一部分被限制立即转售,但可能在不久的 将来向市场出售,这可能导致我们普通股的市场价格大幅下跌,即使我们的业务表现良好; | |
| ● | 不能保证旧的ZyVersa认股权证、管道认股权证或公共认股权证将在现金中;它们可能到期而毫无价值 因此我们可能无法从行使认股权证中获得现金收益; | |
| ● | 在行使认股权证和转换优先股时发行我们的普通股将大大稀释我们普通股的现有持有者的权益。 | |
| ● | 如果您在此次发行中购买证券,您的投资将立即遭到稀释; | |
| ● | 我们的 与融资、收购、投资、股票激励计划相关的额外股本的潜在发行,作为应付或其他应付账款的对价,将稀释所有其他股东的权益; | |
| ● | 我们的 管理层将在使用此次发行的净收益方面拥有广泛的自由裁量权,并可能以您不同意的方式和可能不会产生回报的方式投资或使用收益。 | |
| ● | 预筹资权证或特此提供的权证没有公开市场。 | |
| ● | 预筹资权证或在本次发售中购买的认股权证的持有人 将不享有普通股股东的权利,直到该等持有人 行使其预资资权证或认股权证并收购我们的普通股。 | |
| ● | 本公司于此发行的认股权证属投机性。 | |
| ● | 此 是尽力而为的产品,不要求出售最低金额的证券,并且我们可能不会筹集我们的业务计划(包括我们的近期业务计划)所需的资金。 | |
| ● | 第三方声称我们侵犯或滥用他们的专有技术可能会使我们承担重大责任,并可能迫使 我们重新设计我们的服务和产品或产生重大成本;以及 | |
| ● | 如果我们不能有效地保护我们的知识产权,我们的业务将受到损害。 |
企业信息
于2022年12月12日(“完成日期”),吾等根据该特定业务合并协议的条款,由证券持有人代表Old ZyVersa、Larkspur及合并附属公司 完成先前公布的业务合并,并于完成日期(I)Larkspur于截止日期(I)将其名称更改为“ZyVersa治疗公司”,及(Ii)合并 附属公司合并至Old ZyVersa(“合并”)。随着Old ZyVersa成为合并中幸存的公司,并在使该合并生效 后,Old ZyVersa成为ZyVersa的全资子公司。
我们的主要执行办公室位于佛罗里达州33326,韦斯顿,208室北商业大道2200号,我们的电话号码是。我们的网站地址是http://www.zyversa.com.本招股说明书不包含本招股说明书中包含的信息或通过我们网站 以其他方式访问的信息。
最近的发展
反向 股票拆分
2023年10月31日,我们的股东批准了我们的普通股流通股的反向拆分,拆分的比例在 10股1股到50股1股的范围内,按董事会确定的比例和日期生效。我们的 董事会随后决定,反向股票拆分的比例为35比1。在获得批准后,我们向特拉华州州务卿提交了第二份修订和重述的公司注册证书的 修正案,以 实施反向股票拆分,生效时间为下午4:01。东部时间2023年12月4日。作为反向 股票拆分的结果,我们的普通股中每35股,无论是已发行的还是已发行的,在我们向特拉华州州务卿提交的我们对第二次修订和重述的公司注册证书的修订提交和生效之前,被自动合并并转换(无需任何进一步行动)为一股已缴足且不可评估的普通股。没有发行与反向股票拆分相关的零碎股份。如果普通股的股份是直接持有的,则普通股的每一股零碎股份都将 四舍五入为普通股的最接近的完整份额。反向股票拆分 将普通股的流通股总数从反向拆分前的43,515,401股减少到反向拆分后的总流通股1,243,297股(受反向股票拆分产生的零碎股份 四舍五入的调整)。
本招股说明书中出现的所有财务信息、股份编号、期权编号、认股权证编号、其他衍生证券编号和行权价格,包括Larkspur证券的股票,均已进行调整 以实施反向股票拆分。
纳斯达克缺乏症
纳斯达克此前曾 通知本公司,其上市证券的买入价在过去30个工作日内每股收盘价低于1.00美元,因此不符合上市规则第5450(A)(1)条(“规则”)。根据上市规则 5810(C)(3)(A),本公司获给予180个历日,或直至2023年12月6日,以恢复遵守该规则。
2023年11月14日,纳斯达克 向本公司发布信函称,截至2023年11月13日,确定本公司证券连续十个交易日的收盘价 为0.1美元或更低。因此,本公司须遵守上市规则 5810(C)(3)(A)(Iii)项下拟订立的条文。因此,纳斯达克决定自2023年11月16日起将公司证券从纳斯达克全球市场退市,除非公司及时要求在纳斯达克听证会小组(“小组”)举行听证会。因此,纳斯达克及时要求并安排在陪审团面前举行听证会,因此,在听证会后陪审团的决定发布以及陪审团可能批准的任何延期届满之前,纳斯达克的任何退市行动将被搁置 。在听证会上,公司将提交其计划,以证明遵守规则的情况,并要求延长时间 。公司实施了上述反向股票拆分,试图重新遵守规则 。不能保证将举行听证,也不能保证如果举行听证,小组将作出有利的决定。
| 8 |
产品
下面的 摘要包含有关此产品的基本信息。摘要并不打算是完整的。您应阅读本招股说明书中其他部分包含的完整 文本和更具体的详细信息。
| 提供的普通股 : | 400,000股 | |
| 预先出资的 认股权证: | 我们 还向投资者提供预先出资的认股权证,以购买最多3,600,000股普通股,如果投资者在此次发行中购买我们普通股的股票,将导致该投资者及其关联公司和某些相关 方实益拥有超过4.99%(或在投资者选择时,9.99%)的已发行普通股, 在本次发行完成后,有机会购买,代替普通股,否则将导致投资者的实益所有权超过4.99%(或,在购买者的选择下,超过9.99%),预资金权证将以0.0001美元的行使价购买我们普通股的一股,我们称之为预资金权证。每份预先出资的权证在发行时即可行使 ,并在全部行使时到期。每一份预先出资的认股权证将与A系列普通权证一起出售,以购买1股我们的普通股,并与B系列普通权证一起出售,以购买1股我们的普通股。每份预筹资权证和附带普通权证的合并公开发行价格等于本次发行中出售的普通股和附带普通权证的每股合并公开发行价减去0.0001美元。本招股说明书还涉及在行使预筹资认股权证时可发行的普通股。请参阅“我们提供的证券说明“ 了解更多信息。 | |
| 认股权证 提供: | 4,000,000 A系列普通令和4,000,000份B系列普通令。 每股普通股或预先融资的股票将与A系列普通令状和B系列普通令状一起提供。 A系列普通股将在发行开始至自该日期起五年结束的期间内行使。 B系列普通股将在发行开始至发行后十八个月结束的期间内行使 约会普通股的行使价为每股1.25美元。本招股说明书还与可发行普通股股份的发行有关 行使普通令状后见“股本说明“以获取更多信息。 | |
| 本次发行后发行的普通股: | 1,643,297股,假设本次发行中没有行使任何预融资权证或普通权证。 |
| 9 |
| 使用收益的 | 我们 估计此次发行的净收益约为435万美元, 假设本次发行的所有证券均已售出,扣除配售代理费和我们预计应支付的发售费用后。然而,这是一个合理的最大努力要约,没有最低证券数量或收益金额作为成交条件 ,我们可能不会出售根据本招股说明书 提供的全部或任何证券;因此,我们在此次发行中获得的净收益可能会大幅减少。例如,如果我们仅销售最高报价的25%、50%或75%, 我们的净收益将分别约为829,915美元、2,004,831美元或3,179,746美元。 我们只有在行使普通权证 行使价格为1.25美元的情况下,才会从行使与本次发售相关的普通权证 获得额外收益。请参阅“收益的使用”。
我们 目前打算将此次发行的净收益用于营运资金和其他一般公司用途,包括 支付应付账款以及支付某些员工的未付工资和奖金。请参阅“使用收益的 “在这份招股说明书中。 | |
| 股票代码 符号: | 我们的普通股在纳斯达克上挂牌交易,代码为“ZVSA”。预筹资金的权证或普通权证尚无既定的公开交易市场,我们预计不会发展这样的市场。我们不打算申请在任何证券交易所或其他国家认可的交易系统上市预融资权证或普通权证。如果没有活跃的交易市场,预融资权证和普通权证的流动性将受到限制。 | |
| 风险 因素: | 参见 “风险因素“以及本招股说明书中包含的其他信息,以讨论您在投资我们的证券之前应考虑的因素。 |
发行后发行的已发行普通股数量以截至2023年12月5日的1,243,297股已发行普通股为基础,截至该日,不包括以下内容:
| ● | 在行使与Larkspur首次公开募股相关的私募认股权证时可发行6,867股,加权平均行权价为每股402.50美元; | |
| ● | 166,439股于行使认股权证时可发行的股份,加权平均行使价为每股402.50美元; | |
| ● | 行使PIPE认股权证时可发行的139,403股,加权平均行权价为每股70.00美元; | |
| ● | 314,751股可在行使与我们的尽力而为发售相关的尽力而为权证时发行的股票,加权平均行权价为每股31.34美元,其中39,373股尽力而为权证重新定价,行权价 从行权价35.00美元降至5.78美元,作为2023年7月发售的一部分; | |
| ● | 715股作为标的的管材股份; | |
| ● | 20,665股B系列股票; | |
| ● | 45,032股Old ZyVersa认股权证,其中41,627股目前可通过行使公司向Old ZyVersa持有人发行并由本公司承担的认股权证发行,加权平均行权价为245.72美元,3,405股将在 实现某些里程碑时发行; | |
| ● | 根据我们的2014年股权激励计划(“2014年计划”)发行的股票期权行使时可发行56,999股,加权行权价为378.56美元; | |
| ● | 根据我们的2022年综合股权激励计划(“2022年计划”)发行的股票期权行使时可发行的41,523股, 加权行权价15.25美元; | |
| ● | 根据2023年奖励计划发行的股票期权在行使时可发行3,230股,加权平均行权价为每股74.45美元; | |
| ● | 2023年7月认股权证行使时可发行的160,182股,加权平均行权价为每股5.78美元; | |
| ● | 203,464股于行使诱导权证时可发行的股份,加权平均行使价为4.75美元 |
除非 明确说明或上下文另有要求,否则本招股说明书中的所有信息均假定未行使本招股说明书提供的普通权证或预先出资认股权证。
| 10 |
风险因素
投资我们的证券涉及高度风险。在做出投资决策之前,您应仔细考虑下面介绍的风险。我们的业务、前景、财务状况或经营业绩可能会受到任何这些风险的损害,以及我们目前不知道或我们目前认为无关紧要的其他风险。由于上述任何一种风险,我们证券的交易价格可能会下跌 ,因此,您可能会损失全部或部分投资。“风险因素”中的某些陈述是前瞻性陈述。请参阅“关于前瞻性陈述的告诫声明”。
与我们的业务、财务状况和资金需求相关的风险
我们当前和未来的候选产品可能永远不会获得批准或获得商业市场认可。
我们的成功取决于市场的信心,即我们能够为高度未得到满足的医疗需求的患者开发候选产品,优化 健康结果并提高患者的生活质量。如果我们当前和未来的候选产品或与我们的协作者共同开发的产品未能按预期开发或执行,可能会严重影响我们的业务。我们和我们的合作伙伴可能无法成功 实现我们当前或未来候选产品的商业市场接受度,原因包括:
| ● | 我们在产品创新和商业增长方面的投资的影响; | |
| ● | 我们 向学术机构、生物制药公司和医学界展示我们平台的效用及其相对于现有技术的潜在优势的能力; | |
| ● | 我们和我们的合作者遵守FDA和其他法规要求的能力;以及 | |
| ● | 我们候选产品的开发速度以及在学术机构、关键意见领袖和倡导团体中的声誉。 |
此外,由于研发计划的变化、财务限制、监管环境、有关我们候选产品的负面宣传或竞争产品,这些都是我们无法控制的情况,因此我们的业务可能会受到负面影响。 我们可能无法成功解决这些或其他可能影响市场对我们候选产品和技术接受的因素。 如果我们的候选产品未能开发、获得批准或获得市场的商业认可,可能会对我们的业务、财务状况和运营结果造成严重损害。
我们 是一家处于发展阶段的公司,运营历史有限,没有收入,有许多因素可能会影响我们的 前景。
我们 是一家处于发展阶段的制药公司,经营历史有限,没有收入。我们业务计划的成功可能性必须考虑到在发展和扩大早期业务以及我们所处的监管和竞争环境方面经常遇到的问题、巨额费用、困难、并发症和延误。 制药和生物制药产品开发是一项投机性很高的工作,涉及很大程度的风险,而且 是一项资本密集型业务。因此,您应根据我们公司等处于发展阶段的制药公司经常遇到的成本、不确定性、延误和困难来考虑我们的前景,并请注意,我们不能向您保证我们 将能够成功应对这些风险。
到目前为止,我们的业务主要局限于我们的组织和融资活动,谈判我们的许可协议,以及开展VAR 200和IC 100的开发活动。我们尚未证明我们有能力成功完成大型关键临床试验、获得监管批准、制造商业规模的产品或安排第三方代表我们这样做,或开展成功实现产品商业化所需的销售和营销活动,或管理运营中的上市公司。由于我们的经营历史有限,我们对可能出现并影响我们业务的趋势的洞察力有限,在制定应对这些趋势和我们公司等处于发展阶段的制药公司所面临的其他挑战的方法时可能会出错 。如果不能充分应对这些趋势和挑战,可能会导致我们的业务、运营结果和财务状况受损或失败。此外,我们有限的经营历史可能会使我们的股东很难对我们未来成功或生存的可能性做出任何 预测。
| 11 |
可能影响我们前景的与我们的业务相关的因素 可能包括其他因素,例如:
| ● | 我们 有能力获得额外资金来开发和商业化我们的候选产品; | |
| ● | 在实施我们的发展计划的监管审查和审批方面出现任何延误; | |
| ● | 推迟临床试验的开始、登记和时间安排。 | |
| ● | 我们的临床前和临床试验在临床前和临床发展的所有阶段都取得了成功; | |
| ● | 在监管部门审查和批准我们的候选产品方面出现任何延误; | |
| ● | 我们 为我们寻求在美国和外国司法管辖区开发的候选产品获得并保持监管部门批准的能力; | |
| ● | 潜力 我们候选产品的副作用可能会延迟或阻碍商业化,限制我们候选产品的适应症, 如果获得批准,则需要制定风险评估和缓解策略("REMS"),导致药物获得批准 从市场上撤下或使我们受到罚款和处罚以及第三方索赔; | |
| ● | 市场 接受我们的候选产品(如果批准上市); | |
| ● | 我们的 依赖第三方生产和供应我们的候选产品; | |
| ● | 我们的 依赖临床研究组织(“CRO”)进行我们的临床试验; | |
| ● | 我们的 依赖合同制造组织(“CMO”)生产我们的产品用于临床目的和商业化; | |
| ● | 我们的 建立或维持合作、许可或其他安排的能力; | |
| ● | 我们的 识别、收购和整合其他业务、产品和/或技术的能力; | |
| ● | 我们的 能够建立和维护有效的销售和营销基础设施,或者通过创建商业基础设施 或通过战略合作; | |
| ● | 竞争 现有产品或可能出现的新产品; | |
| ● | 患者或医疗保健提供者获得我们候选产品的覆盖范围或充分报销的能力; | |
| ● | 我们的 我们的许可方成功获取、维护、捍卫和执行知识产权的能力很重要 我们的业务; | |
| ● | 我们的 能够利用我们合作伙伴的专有技术平台来发现和开发其他候选产品; | |
| ● | 我们 有能力吸引和留住关键人员以有效管理我们的业务; | |
| ● | 我们 管理一家运营中的上市公司并继续遵守美国证券交易委员会的规则和要求、在此基础上颁布的法规以及纳斯达克的上市要求的能力; | |
| ● | 我们的 有能力建设我们的金融基础设施,改善我们的会计制度和控制; | |
| ● | 潜力 产品责任索赔; | |
| ● | 潜力 与危险材料有关的责任;以及 | |
| ● | 我们的 有能力获得并保持足够的保险政策。 |
| 12 |
我们 从未盈利过。到目前为止,我们没有数据支持监管部门批准我们的任何候选药物产品,我们没有 在任何司法管辖区获得商业销售批准的产品,我们也没有从产品销售中获得任何收入。因此,我们减少亏损和实现盈利的能力未经证实,我们可能永远无法实现或维持盈利。
我们 从未盈利过,在可预见的未来也不会盈利。截至2023年9月30日,我们在后继期和前续期的累计净亏损约为1.52亿美元。我们已将大部分财务资源 投入到我们的组织和融资活动中,并就我们的许可协议以及其他战略合作伙伴关系和合作进行谈判。我们没有通过收到市场批准完成任何候选产品的开发,因此我们没有从产品销售中获得任何收入。由于与制药 产品开发相关的众多风险和不确定性,我们无法准确预测增加费用的时间或金额,或者我们何时或是否能够实现或保持盈利。随着我们继续VAR 200的临床开发以及IC 100和其他候选产品的临床前开发,我们预计会产生更多费用,我们可能会寻求开发这些产品,并可能在美国和其他地方寻求营销批准。我们还预计,与创建额外基础设施相关的费用将会增加(包括招聘 额外人员),以开始临床试验,并继续开发VAR 200和IC 100以及我们可能寻求开发的其他候选产品,并将其商业化。因此,在可预见的未来,我们预计将继续出现净亏损和负现金流。这些净亏损和负现金流已经并将继续对我们股东的权益和营运资本产生不利影响。
迄今为止,我们已通过出售股本证券为我们的运营提供资金。我们未来净亏损的数额将部分取决于我们支出的未来增长率和我们创造收入的能力。如果我们无法开发和商业化 VAR 200、IC 100或我们可能寻求开发的任何其他候选产品,无论是单独还是与合作者合作,或者如果 任何获得市场营销批准的候选产品的收入不足,我们可能无法筹集额外资金,也无法 实现盈利。即使我们确实实现了盈利,我们也可能无法维持或提高盈利能力。
我们 可能无法继续经营下去。
我们 是一家处于发展阶段的制药公司,没有商业产品。我们的主要候选产品正在 开发过程中,需要大量额外的临床前和临床开发和投资,才有可能 商业化。因此,自成立以来,我们没有从运营中产生任何收入,到目前为止,我们发生了大量净亏损。此外,我们的现金状况远远不足以支持我们的业务计划,将需要大量额外资金来实施这些计划,包括研究和开发我们的主要候选产品,为这些候选产品寻求监管 批准,以及在美国和其他市场进行商业化。我们独立注册的会计师事务所的报告包含一段解释性段落,表示怀疑我们是否有能力继续作为持续经营的企业 。这些情况使人对我们作为一个持续经营的企业继续下去的能力产生了极大的怀疑。我们尤其相信,我们目前的现金和现金等价物仅足以满足我们到2023年第四季度的预期现金需求 。如果我们无法继续经营下去,我们可能不得不清算我们的资产,我们在清算或解散时收到的资产价值 可能显著低于我们财务报表中反映的价值。此外,我们缺乏现金资源,以及我们可能无法继续经营下去,可能会对我们的股本价值和我们筹集新资本或与第三方建立关键合同关系的能力产生重大不利影响。
| 13 |
我们 发现财务报告的内部控制存在重大缺陷。如果我们不能弥补重大弱点 并以其他方式维持有效的财务报告内部控制系统,我们的财务报告的可靠性、投资者对我们的信心和我们的普通股价值可能会受到不利影响。
作为一家上市公司,我们必须保持对财务报告的内部控制,并报告此类内部控制中的任何重大弱点。萨班斯-奥克斯利法案第404条(“第404条”)要求我们评估和确定财务报告内部控制的有效性,并提供财务报告内部控制的管理报告。重大缺陷是指财务报告的内部控制存在缺陷或缺陷的组合,使得年度或中期财务报表的重大错报有可能无法得到及时预防或发现和纠正。
在对2022财年的审计中,我们发现财务报告的内部控制存在重大缺陷,因为我们没有 设计和实施对重大且复杂的非常规交易的会计处理的有效控制。
我们的管理层计划建立程序,持续监控和评估我们对财务报告的内部控制的有效性,并致力于采取进一步行动和实施必要的增强或改进,包括解决上述重大弱点所需的改进或改进。管理层希望在资源允许的情况下,尽快开始评估其财务报告内部控制的设计和运作有效性,包括制定和实施其补救计划。但是,在适用的控制措施运行了足够长的一段时间并且管理层通过测试得出结论认为这些 控制措施正在有效运行之前,不会认为实质性缺陷已得到补救。
如果 我们的措施不足以成功弥补重大弱点并以其他方式建立和维护有效的财务报告内部控制系统 ,我们财务报告的可靠性、投资者对我们的信心以及我们普通股的价值可能会受到重大不利影响。有效的财务报告内部控制对于我们 提供可靠和及时的财务报告是必要的,并与适当的披露控制和程序一起设计,以合理地 发现和防止欺诈。任何未能实施所需的新的或改进的控制措施,或在实施过程中遇到的困难,都可能导致我们无法履行我们的报告义务。只要我们是美国证券法规定的“较小的报告公司”,我们的独立注册会计师事务所就不需要证明我们根据第404条对财务报告进行的内部 控制的有效性。对财务报告的内部控制有效性进行独立评估可以发现我们管理层评估可能无法发现的问题。我们对财务报告的内部控制 中未发现的重大缺陷可能会导致财务报表重述,并要求我们产生补救费用。
此外, 我们并不期望对财务报告的披露控制或内部控制能够防止所有错误和所有欺诈行为。控制 系统,无论设计和操作多么好,都只能提供合理而非绝对的保证,以保证控制系统的 目标将得到满足。此外,控制系统的设计必须反映资源限制这一事实,并且必须考虑控制的效益 相对于控制成本。由于所有控制系统的固有局限性, 控制措施的评估无法提供检测到所有控制问题和欺诈事件(如果有的话)的绝对保证。我们的 控制系统未能防止错误或欺诈,可能会对我们造成重大不利影响。
我们 将需要额外的资金来开发和商业化我们的候选产品。如果我们无法筹集到足够的资金,我们将被迫推迟、减少或取消我们的产品开发计划。
开发 医药产品,包括进行临床前研究和临床试验,费用高昂。我们预计,我们的研发费用 将随着我们正在进行的活动而增加,特别是当我们开始VAR 200的临床试验和IC 100的临床前开发 时。我们没有承诺或安排任何额外融资,以资助VAR 200、IC 100或我们可能寻求开发的任何其他候选产品的开发和商业化工作。我们将需要筹集大量的额外资金,以开发VAR 200、IC 100以及我们可能寻求开发的任何其他候选产品并将其商业化。由于VAR 200或IC 100的成功开发是不确定的,我们无法估计完成其开发和 商业化所需的实际资金。
在 我们可以从VAR 200、IC 100或我们可能寻求开发的任何其他候选产品中获得足够的收入之前,我们预计将通过公开或私募股权发行、债务融资或公司合作和许可安排为未来的现金需求提供资金。 当我们需要额外的资金时,我们可能无法以我们可以接受的条款获得这些资金,或者根本没有。如果没有足够的资金 ,我们可能会被要求推迟、缩小或缩减我们的业务。就我们通过发行股权证券或可转换为股权证券的证券筹集额外资金的程度而言,我们当时现有股东的所有权可能会被稀释,稀释程度可能会很大,具体取决于我们可能能够出售证券的价格。此外,如果我们 通过产生债务来筹集额外资本,我们可能会受到限制我们业务活动的额外契约的约束 ,债务工具的持有人可能拥有优先于我们的股权投资者的权利和特权,并且偿还此类债务工具下的 利息和本金偿还义务可能会转移原本可用于支持研发、临床或商业化活动的资金。因此,我们可能无法参与我们 寻求建立的协作。如果我们通过合作和许可安排筹集额外资金,则可能需要 放弃对我们的技术或候选产品的某些权利,或按可能对我们不利的条款授予许可。只要条件有利,我们 可能会寻求进入公共或私人资本市场,即使我们当时并不迫切需要 额外的资本。此外,已在我们的转售登记表上注册的证券(声明为2023年10月20日生效)可能会限制我们以优惠条款筹集额外资本的能力,因为此类证券具有稀释效应。此外,如果我们普通股的价格仍然低于在该转售登记声明中登记的认股权证的行权价格 ,则持有人不得行使该等认股权证,因此,我们将不会从该行使 中获得任何收益。
我们的 未来资金需求(无论是近期还是长期)将取决于许多因素,包括但不限于:
| ● | 我们候选产品的临床前和临床试验的启动、进展、时间、成本和结果; | |
| ● | 如果 FDA要求我们对我们寻求开发的候选产品进行额外的研究,以超出我们预期的研究; | |
| ● | 我们可能建立的任何未来合作、许可或其他安排的条款和时间; | |
| ● | 监管批准的结果、时间和成本; | |
| ● | 竞争的技术和市场发展的影响; | |
| ● | 建立商业规模外包制造能力的成本和时间; | |
| ● | 市场 如果我们获得监管部门的批准,将接受我们的候选产品; | |
| ● | 为候选产品建立销售、营销和分销能力的成本(如果我们获得监管部门的批准); 和 | |
| ● | 我们收购、授权或投资于业务、产品或技术的程度。 |
| 14 |
我们 受各种美国反腐败法律以及其他反贿赂和反回扣法律法规的约束。
我们 受美国1977年修订的《反海外腐败法》(下称《反海外腐败法》)以及我们开展业务所在司法管辖区的其他反腐败、反贿赂、反洗钱法律的约束。这些法律一般禁止我们和我们的员工 为了获得或保留业务、将业务导向任何人或获得任何不正当利益而以不正当方式影响政府官员或商业团体。《反海外腐败法》和其他适用的反贿赂和反腐败法律也可能要求我们对代表我们行事的第三方业务合作伙伴、代表和代理人实施的腐败和贿赂行为承担责任。我们 和我们的第三方业务合作伙伴、代表和代理可能与政府机构或国有或附属实体的官员和员工 有直接或间接的互动,我们可能要为这些第三方业务合作伙伴和中介以及员工、代表、承包商和代理的腐败或其他非法活动负责,即使我们没有明确 授权此类活动。这些法律还要求我们保存准确的账簿和记录,并保持内部控制和合规程序,以防止任何此类行为。虽然我们有政策和程序来解决此类法律的合规性问题,但我们不能 保证我们的员工和代理商不会采取违反我们的政策或适用法律的行为,我们可能最终要为此承担责任,并且随着我们在国际业务的扩张以及我们在外国司法管辖区的销售和 业务的增加,我们违反这些法律的风险增加。任何违反《反海外腐败法》或其他适用的反贿赂、反腐败和反洗钱法律的行为都可能导致举报人投诉、媒体负面报道、调查、征收巨额法律费用、丧失出口特权、严厉的刑事或民事制裁或暂停或取消美国政府合同的资格、管理层的注意力大幅转移、股票价格下跌或对我们业务的整体不利影响,所有这些都可能对我们的声誉、业务、财务状况和经营业绩产生不利影响。
我们的财务状况和运营结果可能会受到新冠肺炎疫情的不利影响。
疫情或流行病的发生 根据其规模,可能会对我们经营业务和开发候选产品的地区、州和地方经济造成不同程度的破坏。当前的新冠肺炎疫情已经并可能继续对我们的业务价值、经营业绩和财务状况产生实质性的不利影响。国际、 联邦、州和地方公共卫生和政府当局为控制和抗击新冠肺炎在全球各地区的爆发和传播而采取的非常行动,包括旅行禁令、隔离、“呆在家里”命令、暂停利息累算和对某些联邦支持的学生贷款收取 以及许多个人和企业大幅限制日常活动的类似命令 导致了总体上消费者活动的减少。尽管新冠肺炎疫情造成的经济放缓和高失业率的程度和持续时间目前仍不确定,特别是在新的病毒株出现并对疫苗接种工作构成潜在挑战的情况下,但持续的显著经济放缓可能会对我们的财务状况、流动性和运营结果产生重大不利影响。
涉及开发、监管审批和商业化的风险
大流行病、流行病或传染病爆发(如COVID—19)可能会导致我们候选产品的开发中断 。
Public health crises such as pandemics or similar outbreaks could adversely impact our business. In December 2019, a novel strain of a virus named SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2), or coronavirus, which causes COVID-19, surfaced in Wuhan, China and has since spread worldwide. The coronavirus pandemic is evolving, and to date has led to the implementation of various responses, including government-imposed quarantines, travel restrictions and other public health safety measures. The extent to which the coronavirus impacts our operations or those of our third-party partners, including our preclinical studies or clinical trial operations, will also depend on future developments, which are highly uncertain and cannot be predicted with confidence, including the duration of the outbreak, new information that will emerge concerning the severity of the coronavirus and the actions to contain the coronavirus or treat its impact, among others. The continued spread of COVID-19 globally could adversely impact our preclinical or clinical trial operations in the U.S. and abroad, including our ability to recruit and retain patients and principal investigators and site staff who, as healthcare providers, may have heightened exposure to COVID-19. For example, similar to other biopharmaceutical companies, we may experience delays in enrolling our current and/or planned clinical trials. COVID-19 may also affect employees of third-party CROs located in affected geographies that we rely upon to carry out our clinical trials. In addition, the patient populations that our lead and other core product candidates target may be particularly susceptible to COVID-19, which may make it more difficult for us to identify patients able to enroll in our future clinical trials and may impact the ability of enrolled patients to complete any such trials. Any negative impact COVID-19 has to patient enrollment or treatment or the execution of our product candidates could cause costly delays to clinical trial activities, which could adversely affect our ability to obtain regulatory approval for and to commercialize our product candidates, increase our operating expenses, and have a material adverse effect on our financial results.
| 15 |
此外, 计划临床试验的及时入组取决于临床试验中心,这些中心可能受到全球健康问题(如流行病)的不利影响。我们计划在当前受冠状病毒影响的地区对候选产品进行临床试验 。冠状病毒爆发的某些因素会延迟或以其他方式对我们候选产品临床试验的入组以及我们的业务产生不利影响,这些因素包括:
| ● | 医疗保健资源可能从临床试验的实施转移到关注流行病问题,包括 作为临床试验研究者的医生、作为临床试验中心的医院和医院工作人员的注意 支持开展我们的前瞻性临床试验; |
| ● | 限制 可能中断关键试验和业务活动(如临床试验中心启动和监查)的旅行,国内 员工、承包商或患者前往临床试验中心的国际旅行,包括任何政府规定的旅行限制 或可能影响患者、员工或承包商前往参加我们临床试验的能力或意愿的临时措施 网站或安全签证或入境许可,失去与潜在合作伙伴的面对面会议和其他互动,任何 可能延迟或不利影响我们前瞻性临床试验的进行或进展; |
| ● | 对我们第三方制造商运营的潜在负面影响; |
| ● | 中断 在全球运输中,影响我们产品原材料、临床试验材料(如患者样本)的运输, 在我们的前瞻性临床试验中使用的研究药物和调节药物以及其他供应品;以及 |
| ● | 业务 可能的工作场所、实验室和办公室关闭以及对员工在家工作的依赖增加造成的中断, 正在进行的实验室实验和操作中断或延误、人员短缺、旅行限制或公共交通 中断,其中任何一种都可能对我们的业务运营造成不利影响或延迟与当地监管机构的必要互动,道德操守 委员会和其他重要机构和承包商。 |
我们 已采取临时预防措施,旨在帮助将病毒对我们员工的风险降至最低,包括让 所有员工远程工作,暂停员工在全球范围内的所有非必要旅行,以及阻止员工出席行业活动和面对面的工作相关会议,这可能会对我们的业务产生负面影响。我们目前无法预测企业和政府机构(如SEC或FDA)计划和潜在关闭或中断的范围 和严重程度。
| 16 |
我们的 业务依赖于我们候选产品的成功开发、监管批准和商业化,特别是 VAR 200和IC 100。
我们业务的成功,包括我们为公司提供资金并在未来产生任何收入的能力,将主要取决于 我们候选产品的成功开发、监管批准和商业化或合作。将来,我们 也可能只依赖于我们的一个候选产品,或我们可能获得许可、收购或开发的任何未来候选产品。 我们候选产品的临床前、临床和商业成功取决于多个因素,包括:
| ● | 能够以可接受的条件筹集额外资本,或根本筹集额外资本; |
| ● | 及时的 完成我们的临床前和临床试验,这可能比我们目前的预期慢得多或成本更高,并且 将在很大程度上取决于第三方承包商的表现; |
| ● | 如果 FDA或类似的外国监管机构要求我们进行除这些以外的其他临床前或临床试验 计划支持我们的候选产品或任何未来候选产品的批准和商业化; |
| ● | FDA和类似的外国监管机构接受我们的建议适应症和与我们候选产品的建议适应症相关的主要终点评估。 |
| ● | 我们的 能够证明我们的安全性和有效性,使FDA和类似的外国监管机构满意 候选产品或任何未来候选产品; |
| ● | 我们的 在药代动力学研究中可检测到的制剂中鉴定活性化合物的能力; |
| ● | 与我们的候选产品或未来获批产品相关的潜在副作用的发生率、持续时间和严重程度 产品,如果有的话; |
| ● | 及时收到FDA和类似外国监管机构的必要上市批准; |
| ● | 实现 并维护并(如适用)确保我们的第三方承包商实现并维护我们的合同规定 义务和适用于我们的候选产品或任何未来候选产品或已批准的所有监管要求 产品,如果有的话; |
| ● | 与我们签订合同的第三方生产候选产品的临床试验和商业供应品的能力,或 任何未来候选产品,在监管机构中保持良好信誉,并开发、验证和保持商业可行性 符合当前良好生产规范或cGMP或良好农业和采集的生产工艺 或GACP; |
| ● | a 在临床前和临床开发期间以及我们的候选产品获批后,安全性特征持续可接受 或任何未来的候选产品; |
| ● | 我们的 有能力在美国和国际上成功地将我们的候选产品或任何未来的候选产品商业化, (a)在该等国家和地区批准单独或与他人合作销售、销售和分销; |
| ● | 验收 由医生、患者和支付方对我们候选产品或任何未来候选产品的益处、安全性和有效性进行评估, 如果获得批准,包括与替代治疗和竞争治疗有关的; |
| ● | 我们的 能够遵守多项批准后监管要求; |
| ● | 我们的 以及我们的合作伙伴在候选产品或任何未来产品中建立和实施知识产权的能力 候选产品; |
| ● | 我们的 以及我们的合作伙伴避免第三方专利干扰或知识产权侵权索赔的能力;以及 |
| ● | 我们的 能够获得许可证或获得我们相信能够成功开发的其他候选产品或商业阶段产品 和商业化。 |
VAR 200可能无法获得FDA指定为FSGS孤儿药。FDA于2018年9月 17日收到了我们的孤儿药认定申请。无法授予孤儿药认定,原因是(1)用于支持申请的FSGS临床前模型反映了 FSGS的预防而非治疗,后者是VAR 200的拟定适应症,以及(2)FDA认为根据所用假设和计算,提供的患病率估计值 被低估。我们计划在VAR 200的临床 数据可用时,重新申请孤儿药认定,并使用其他信息支持FSGS的流行率。
| 17 |
如果我们不能及时或根本实现上述一个或多个因素(其中许多是我们无法控制的),我们可能会遇到重大延误和成本增加,或者无法获得监管部门的批准或将我们的候选产品商业化。 即使获得监管部门的批准,我们也可能永远无法成功地将我们的任何候选产品商业化。因此, 我们不能向您保证,我们将能够通过销售我们的候选产品或任何未来的候选产品来产生足够的收入以继续运营。
我们的候选产品IC 100的临床前药物开发非常昂贵、耗时且不确定。我们的临床前试验可能无法 充分展示感兴趣的治疗领域的药理活性;在其他身体系统中造成意想不到的短期或长期影响;或产生可能改变或风险益处评估的意外毒性。具有反映IC100作用机制的一类化合物尚未进入临床试验,其药理类的作用也尚不清楚。这些因素和其他 因素可能会阻碍或推迟进一步的发展。
形成我们开发和开发候选产品的基础的 科学发现相对较新。支持基于我们的方法开发试剂的可行性的科学证据是初步的,也是有限的。IC 100代表了一种新的治疗模式,成功的开发可能需要更多的研究和努力来优化其治疗潜力。IC 100可能无法在实验室或临床前研究中向患者展示其治疗特性,并可能以不可预见的、无效的甚至有害的方式与人类生物系统相互作用。如果我们不能成功地开发IC 100并将其商业化,我们可能永远不会盈利,我们的股本价值可能会下降。
IC 100是一种相对新颖的技术,因此很难预测开发时间和成本,以及随后获得 监管部门批准的时间和成本。
我们 将我们的研究和开发努力集中在有限数量的初始目标疾病适应症上。不能保证 我们在开发当前或未来的适应症时不会遇到问题或延迟,也不能保证此类问题或延迟不会导致意外成本,也不能保证任何此类开发问题都能得到解决。在IC 100上生成的临床前数据以及拟议的临床开发计划需要FDA根据调查性新药申请进行审查和许可。我们尚未生成支持此类申请的数据,临床前研究的结果将需要FDA在启动临床研究之前进行审查,而临床研究可能不会获得批准。
我们 在使用和扩展我们的开发平台以构建候选产品管道方面可能无法成功。
我们IC 100战略的一个关键要素是使用我们经验丰富的管理和科学团队来评估各种人类疾病的IC 100,以建立一个候选产品渠道。尽管到目前为止,我们的研究和开发工作已经产生了潜在的候选产品,但我们可能无法继续识别和开发其他候选产品。即使我们成功地继续建立我们的渠道,我们确定的潜在候选产品也可能不适合临床开发。 例如,这些潜在候选产品可能会被证明具有有害的副作用或其他特征,表明它们不太可能获得上市批准和市场认可。如果我们不能根据我们的方法成功开发候选产品并将其商业化,我们将无法在未来期间获得产品收入,这可能会对我们的财务状况造成重大的 损害。不能保证我们将在临床前和临床开发中取得成功,在任何情况下,获得监管批准的过程都需要花费大量的时间和财力。
| 18 |
我们候选产品的临床 药物开发非常昂贵、耗时且不确定。我们的临床试验可能无法充分 证明我们候选产品的安全性和有效性,这可能会阻碍或延迟监管部门的批准和商业化。
我们候选产品的临床药物开发非常昂贵、耗时、难以设计和实施,而且其结果本身就不确定。在获得监管机构对候选产品商业销售的批准之前,我们必须通过临床试验证明候选产品用于目标适应症既安全又有效,这是不可能预测的。大多数开始临床试验的候选产品从未获得监管部门的商业化批准。我们的候选产品处于不同的开发阶段,在任何测试阶段或在 试验过程中的任何时间,都可能出现多个临床试验失败的情况。我们预计这些候选产品的临床试验将持续数年,但可能需要比预期更长的时间才能完成。并不是我们所有的候选产品都经过了人体测试,首次在人体上使用可能会产生意想不到的效果。我们还没有完成所有的临床试验,以获得我们任何候选产品的批准。
我们 可能会在当前和未来的候选产品临床试验中遇到延误,并且不知道未来的临床试验(如果有)是否会按时开始、是否需要重新设计、是否按时入组足够数量的患者或是否会按时完成(如果有的话)。 此外,我们、我们目前或将来可能与之合作的任何合作伙伴、FDA、机构审查委员会(以下简称"IRB") 或其他监管机构(包括州和地方机构以及外国的对应机构)可随时暂停、延迟、 要求修改或终止我们的临床试验,原因包括:
| ● | 发现 安全性或耐受性问题,例如严重或意外毒性或副作用或暴露于其他不可接受的环境 研究参与者经历的健康风险或其他安全性问题; |
| ● | 缺少 临床试验期间任何候选产品的有效性或我们的候选产品未能达到指定终点; |
| ● | 慢 受试者招募率和入组率高于预期,或无法入组足够数量的临床患者 由多种因素导致的试验,包括其他公司对其候选产品进行的临床试验的普遍性 针对相同适应症,或针对患者不常寻求治疗的适应症进行临床试验; |
| ● | 延迟 或由于COVID—19疫情导致的延迟或其他限制,我们的临床试验遇到困难; |
| ● | 难以留住已开始临床试验但可能因治疗的不良副作用而随时退出的受试者, 疗效不足、对临床试验过程感到疲劳或任何其他原因; |
| ● | 难度 在获得IRB批准,以便在每个临床试验中心进行研究; |
| ● | 延迟 生产或获得,或无法生产或获得足够数量的临床试验材料; |
| ● | 不足 我们的生产工艺或产品配方或交付方法的变更; |
| ● | 更改 适用的法律、法规和监管政策; |
| ● | 延迟 或未能就临床试验合同或预期合同研究方案中的可接受条款达成一致 组织(“CRO”)、临床试验中心和其他第三方承包商; |
| ● | 无法 增加足够数量的临床试验中心; |
| ● | 不确定性 关于正确的配方和剂量; |
| ● | 失败 由我们、我们的员工、我们的CRO或他们的员工或其他第三方承包商遵守合同和适用的法规 要求或以及时或可接受的方式履行其服务; |
| ● | 失败 由我们、我们的员工、我们的CRO或他们的员工或我们可能与之合作的任何合作伙伴或他们的员工遵守 与临床试验的实施或处理、储存、安全和 相关的适用FDA或其他监管要求 药品和生物制品的记录保存; |
| ● | 日程安排与参与的临床医生和临床机构发生冲突; |
| ● | 未能设计适当的临床试验方案; |
| ● | 数据不足,无法支持监管部门的审批; |
| ● | 医疗研究人员不能或不愿意遵循我们的临床方案;或 |
| ● | 难度 在治疗期间或治疗后与受试者保持联系,这可能导致数据不完整。 |
我们 或我们可能合作的任何合作伙伴可能会在临床试验中遭受重大挫折,类似于 制药和生物技术行业的许多其他公司的经历,即使在早期试验中获得了令人鼓舞的结果。如果 我们或我们的潜在合作伙伴放弃或延迟了与我们候选产品相关的临床开发工作, 我们可能无法有效执行我们的业务计划,我们的业务、财务状况、经营成果和前景将受到损害 。
| 19 |
更改候选产品制造或配方的方法 可能会导致额外成本或延迟。
随着 候选产品从临床前研究到后期临床试验,以获得潜在的批准和商业化, 开发计划的各个方面(如生产方法和配方)在此过程中经常发生变化 以优化工艺和结果。这些变更有可能无法实现这些预期目标。任何 这些变更都可能导致我们的候选产品性能不同,并影响计划的临床试验或 使用变更后的材料进行的其他临床试验的结果。此类变更还可能需要额外的测试、FDA通知或FDA 批准。这可能会延迟临床试验的完成,需要进行桥接临床试验或重复一个或多个临床试验。
根据适用的法规要求,我们 可能无法获得VAR 200或IC 100的法规批准。 FDA和外国监管机构在批准过程中有很大的自由裁量权,包括延迟、限制或拒绝 候选产品批准的能力。延迟、限制或拒绝任何监管批准将对商业化、 我们的创收潜力、我们的业务和经营成果造成不利影响。
We currently have no products approved for sale, and we may never obtain regulatory approval to commercialize any of our current or future product candidates. The research, testing, manufacturing, safety surveillance, efficacy, quality control, recordkeeping, labeling, packaging, storage, approval, sale, marketing, distribution, import, export and reporting of safety and other post-market information related to our drug products are subject to extensive regulation by the FDA and other regulatory authorities in the United States and in foreign countries, and such regulations differ from country to country. We are not permitted to market any of our current product candidates in the United States until we receive approval of a NDA, BLA or other applicable regulatory filing from the FDA. We are also not permitted to market any of our current product candidates in any foreign countries until we or our partners receive the requisite approval from the applicable regulatory authorities of such countries. To gain approval to market a new drug such as VAR 200 or IC 100, the FDA and/or foreign regulatory authorities must receive, among other things, preclinical and clinical data that adequately demonstrate the safety, purity, potency, efficacy and compliant manufacturing of the drug product for the intended indication applied for in a NDA, BLA or other applicable regulatory filing. The development and approval of new drug products involves a long, expensive and uncertain process, and delay or failure can occur at any stage. A number of companies in the pharmaceutical and biopharmaceutical industry have suffered significant setbacks in nonclinical development, clinical trials, including in Phase 3 clinical development, even after promising results in earlier preclinical studies or clinical trials. These setbacks have been caused by, among other things, findings made while clinical trials were underway and safety or efficacy observations made in clinical trials, including previously unreported adverse events. Success in clinical trials does not ensure that later clinical trials will be successful, or that nonclinical studies will be successful. The results of clinical trials by other parties may not be indicative of the results in trials we or our partners may conduct.
| 20 |
FDA和外国监管机构在药物开发和批准过程中有很大的自由裁量权,包括 出于多种原因推迟、限制药物开发或限制或拒绝候选产品的批准。FDA或适用的外国监管机构 可以:
| ● | 不同意 设计或实施一项或多项临床试验; |
| ● | 不是 认为候选产品在其拟定适应症方面是安全有效的,或者认为候选产品的安全性或其他 感知风险超过其临床或其他受益; |
| ● | 不是 发现来自临床前研究和临床试验的数据足以支持批准,或者临床试验的结果可能 不符合FDA或相关外国监管机构批准所要求的统计学或临床意义水平; |
| ● | 不同意 通过我们对临床前研究或临床试验数据的解释,或通过解释 我们可能与之合作的任何合作伙伴; |
| ● | 确定 从临床前或临床试验中收集的数据可能不足以支持IND或NDA或其他 适用的监管备案; |
| ● | 要求 其他临床前研究或临床试验; |
| ● | 标识 我们当前或未来候选产品在配方、质量控制、标签或规格方面的缺陷; |
| ● | 要求在儿科患者中进行临床试验,以确定对药物更敏感的人群的药代动力学或安全性; |
| ● | 批准取决于昂贵的批准后额外临床试验的表现; |
| ● | 批准 我们当前或任何未来的候选产品,使其具有比我们最初要求的更有限的适应症或更窄的患者群体 或带有可能影响市场的强烈警告; |
| ● | 不批准我们认为对我们的候选产品成功商业化是必要或可取的标签; |
| ● | 不是 批准第三方制造商或与我们签订合同的测试实验室的制造工艺、控制或设施; |
| ● | 考虑 我们的产品是一种设备,而不是一种需要不同审批程序和生产需求的药物; |
| ● | 考虑 我们的一种产品是组合产品,而不是需要额外临床试验或增加数量的单一药物 每项研究的患者;或 |
| ● | 更改 我们的批准政策或采用新法规,使我们的临床数据或监管文件不足以批准。 |
任何 延迟、限制或拒绝我们的任何候选产品的任何适用监管批准将延迟或对我们候选产品的商业化产生不利影响 ,并将损害我们的业务、财务状况、经营成果和前景。
| 21 |
即使 我们当前的候选产品或任何未来的候选产品获得了监管部门的批准,它们也可能无法获得医生和患者广泛的应用, 商业成功所需。
我们当前或未来的任何候选产品,如果获得批准,其商业成功将在很大程度上取决于医生、患者和支付者对所得产品的广泛采用和 用于获批适应症,并且可能无法获得商业成功。 我们当前或未来候选产品的采用程度和比率(如果获得批准)将取决于多个因素,包括:
| ● | 产品获批的临床适应症以及患者对治疗这些适应症的获批产品的需求; |
| ● | 与其他可用疗法相比,我们产品的有效性; |
| ● | 为我们的任何候选产品提供覆盖范围和从管理式护理计划和其他医疗保健支付方获得的充分补偿 可获批准; |
| ● | 与替代治疗相关的候选产品的治疗成本以及产品支付意愿(如果获得批准), 患者的一部分; |
| ● | 验收 被医生、诊所主要经营者和患者视为安全有效的治疗方法; |
| ● | 医生 以及患者愿意采用新疗法而不是其他可用疗法来治疗批准的适应症; |
| ● | 克服 医生或患者可能对特定治疗方法的任何偏见,用于治疗获批适应症; |
| ● | 固有 医生和医务人员培训和管理我们的候选产品; |
| ● | 患者 对我们候选产品的结果和管理以及整体治疗经验的满意度; |
| ● | 与替代疗法相比,我们的候选产品可能为医生提供的收入和盈利能力; |
| ● | 副作用的发生率和严重程度; |
| ● | 限制 或FDA批准的候选产品标签中包含的警告; |
| ● | 任何 FDA要求进行风险评估和缓解策略,或REMS; |
| ● | 我们的销售、营销和分销工作的有效性; |
| ● | 我们 有能力维持充足的供应量以满足需求; |
| ● | 对我们候选产品的负面宣传或对竞争产品的正面宣传;以及 |
| ● | 潜在的 产品责任索赔。 |
如果我们当前或未来的任何候选产品被批准使用,但未能达到商业成功所需的医生和患者的广泛采用 ,我们的运营结果和财务状况将受到不利影响,这可能会推迟、阻止 或限制我们创造收入和继续业务的能力。
| 22 |
我们的 候选产品如果获得批准,将面临激烈的竞争,如果我们不能有效竞争,可能会阻碍我们实现显著的市场渗透。
制药行业的特点是技术快速进步、竞争激烈,并高度重视开发专利疗法。许多制药公司、仿制药公司、生物技术公司以及学术和研究机构都在从事医疗保健产品的开发、专利申请、制造和营销,与我们正在开发的产品具有竞争力,包括Travere、辉瑞、Goldfinch Bio、勃林格-英格尔海姆、阿斯特拉-捷利康、赛诺菲、诺华、罗氏和其他公司。 我们的许多竞争对手拥有更强大的财务资源、营销能力、销售队伍、制造能力、研发能力、临床试验专业知识、知识产权组合、获得专利和监管批准的经验以及对产品候选和其他资源的批准。一些提供竞争产品的公司还拥有广泛的其他产品、庞大的直销队伍以及与我们的目标医生的长期客户关系,这可能会阻碍我们的市场渗透努力。此外,如果我们的某些候选产品获得批准,可能会与一些患者的可自由支配预算份额竞争,并在临床实践中争取医生的关注。
我们 预计,如果我们的候选产品获得监管部门的批准,我们将面临来自其他批准的 疗法的激烈竞争。如果获得批准,我们的候选产品还可能与不受监管、未经批准、标签外和非处方药竞争。 如果获得批准,我们的某些候选产品将针对已批准的适应症提出新的治疗方法,并将 与现有疗法竞争,其中一些疗法广为人知,并为医生和患者所接受。要在这个市场上成功竞争,我们必须证明我们批准的产品的相对成本、安全性和有效性(如果有的话)是现有疗法和其他新疗法的一个有吸引力的 替代方案。这种竞争可能会导致我们候选产品的市场份额减少,并对我们候选产品的定价造成下行压力,这可能会损害我们的业务、财务状况、经营业绩和前景 。
我们 预计我们的候选产品将面临通用或类似类型的产品竞争,这可能会对我们的业务、财务状况、经营业绩和前景产生不利影响。
在 我们的任何候选产品的专利保护到期或丧失时,或者当我们的任何候选产品的专利保护到期或失去时,尽管我们的任何候选产品的仿制药竞争对手对该仿制药或其等价物提起了未决的专利侵权诉讼,但该产品已获批准,且其销售价格可能显著低于我们已批准的产品 ,我们可能会在短时间内损失该产品的很大一部分销售额,这将对我们的业务、财务状况、运营结果和前景产生不利影响。
我们将商业化的任何候选产品或我们可能与之合作的任何合作伙伴都将接受持续的 和持续的监管审查。
即使在我们或我们的合作伙伴获得美国监管机构对候选产品的批准(如果有)之后,我们或我们的合作伙伴仍将继续 接受监管审查和合规义务。例如,对于我们的候选产品,FDA可能会对产品可能上市的批准的指定用途或批准条件施加重大限制 。候选产品的批准 可能包含对可能代价高昂的批准后研究和监测的要求,包括第四阶段临床试验或REMS,以监测产品的安全性和有效性。我们还将继续接受FDA的义务和持续的监管审查,涉及我们的候选产品的制造、加工、标签、包装、分销、不良事件报告、储存、广告、促销和记录等。这些要求包括提交安全性和其他上市后信息和报告、注册以及继续遵守cGMP要求、FDA的良好临床实践、或GCP、或良好农业和采集规范或GACP、要求和良好实验室规范或GLP要求,这些要求是FDA在临床和临床前开发中对所有候选产品以及我们在批准后进行的任何临床试验执行的法规和指南。如果候选产品在其他国家/地区获准销售,我们 可能会受到这些国家/地区的法律和政府监管机构施加的类似限制和要求。
| 23 |
如果 我们、我们的合作伙伴、候选产品或候选产品的制造设施未能遵守适用的法规 要求,监管机构可以:
| ● | 强加 限制产品的销售或生产,暂停或撤销产品批准或撤销必要的许可证; |
| ● | 要求修改宣传材料或要求我们向医疗从业者提供正确的信息; |
| ● | 要求 我们或我们的合作伙伴签署同意令,其中可能包括施加各种罚款,报销检查费用, 规定的具体行动和不遵守规定的处罚期限; |
| ● | 问题 警告信、说明原因通知书或描述涉嫌违规行为的无标题信件,这些信件可能公开; |
| ● | 开始 刑事调查和起诉; |
| ● | 强加 禁止、暂停或取消必要的批准或其他许可证; |
| ● | 强加 其他民事或刑事处罚; |
| ● | 暂停 任何正在进行的临床试验; |
| ● | 推迟或拒绝批准我们或我们的潜在合作伙伴提交的未决申请或已批准申请的补充申请; |
| ● | 拒绝允许药品或易制毒化学品进出口到美国或从美国出口; |
| ● | 暂停运营或对运营施加限制,包括成本高昂的新制造要求;或 |
| ● | 扣押或扣留产品,或要求我们或我们的合作伙伴启动产品召回。 |
FDA和其他适用政府机构的法规、政策或指导意见可能会发生变化,可能会颁布新的或附加的法规或政府 法规,以阻止或推迟监管部门对我们候选产品的审批,或者进一步限制或规范审批后的活动。我们无法预测美国或国外未来的立法或行政行动可能产生的不利政府监管的可能性、性质或程度。如果我们不能实现并保持法规遵从性, 我们可能不被允许营销我们的候选产品,这将对我们创造收入和实现或 保持盈利的能力产生不利影响。
我们 未来可能会在美国和FDA以外的地方为我们的候选产品进行临床试验,适用的外国监管机构可能不接受此类试验的数据。
我们 未来可能会选择在美国以外进行一项或多项临床试验,包括在加拿大、欧洲和南美洲。尽管FDA或适用的外国监管机构可以接受来自在美国或适用司法管辖区以外进行的临床试验的数据,但FDA或适用的外国监管机构接受此类研究数据可能受某些条件的限制。如果外国临床试验的数据打算用作美国上市审批的基础,FDA将不会仅根据外国数据批准申请,除非这些数据适用于美国人口和美国医疗实践;研究由公认能力的临床研究人员进行;并且数据被认为 有效,无需FDA进行现场检查,或者如果FDA认为有必要进行此类检查,FDA能够 通过现场检查或其他适当方式验证数据。许多外国监管机构都有类似的要求。 此外,此类外国研究将受到进行研究的外国司法管辖区适用的当地法律的约束。 不能保证FDA或适用的外国监管机构会接受在美国或适用司法管辖区以外进行的试验数据。如果FDA或适用的外国监管机构不接受此类数据,可能会 导致需要额外的试验,这将是昂贵和耗时的,并会延误我们业务计划的各个方面。
| 24 |
我们的 候选产品可能会导致不良副作用或具有其他意想不到的特性,可能会延迟或阻止其监管 审批、限制已批准标签的商业形象或导致审批后的监管行动。
我们的任何候选产品都可能在临床开发期间或(如果批准)在批准的产品上市后出现不可预见的副作用 。候选产品引起的不良副作用可能会导致我们、我们可能与之合作的任何合作伙伴或监管机构中断、修改、延迟或暂停临床试验,并可能导致更严格的标签或FDA或类似外国机构的监管批准延迟 。临床试验的结果可能揭示出严重且不可接受的副作用的严重性和流行率。在这种情况下,试验可能暂停或终止,FDA或类似的外国监管机构可以命令我们或我们的潜在合作伙伴停止任何或所有目标适应症的候选产品 的进一步开发或拒绝批准。与药物相关的副作用可能会影响患者招募或入选患者完成试验的能力或导致产品责任索赔。任何此类事件都可能损害我们的业务、财务状况、经营业绩和前景。
此外, 如果我们或其他人发现我们的候选产品在获得美国或外国监管机构批准或其他含有相同或相关活性成分的产品后导致的不良副作用或其他以前未知的问题,可能会导致一些潜在的负面后果 ,包括:
| ● | 监管部门可能会撤回对该产品的批准; |
| ● | 监管部门可能要求召回产品,或者我们或我们的潜在合作伙伴可能会自愿召回产品; |
| ● | 监管当局可以要求在产品标签中增加警告或禁忌症,缩小产品标签中的适应症范围,或向医生和药店发出现场警报; |
| ● | 我们 可能需要创建一份药物指南,概述此类副作用的风险,以便分发给患者,或者制定一项REMS; |
| ● | 我们 在如何推广产品方面可能有限制; |
| ● | 我们 可能被要求改变产品的给药方式或以其他方式修改产品;FDA或适用的外国监管机构可能要求进行额外的临床试验或昂贵的上市后测试和监测,以监控产品的安全性或有效性; |
| ● | FDA或适用的外国监管机构可能需要额外的临床试验或昂贵的上市后测试和监测 以监测产品的安全性或有效性 |
| ● | 该产品的销售额 可能大幅下降; |
| ● | 我们 可能会被起诉,并对给患者造成的伤害承担责任;以及 |
| ● | 我们的 品牌和声誉可能受到影响。 |
由不良副作用或其他以前未知的问题引起的任何 上述事件可能会阻碍我们或我们的潜在合作伙伴 实现或维持受影响候选产品的市场接受度,并可能大幅增加 我们候选产品的商业化成本。
| 25 |
我们 可能会面临产品责任风险,如果我们的索赔成功,如果我们的保险 覆盖范围不足,我们可能会承担重大责任。
由于对候选产品进行临床测试,我们 面临产品责任的内在风险,如果我们将任何产品商业化,将面临更大的 风险。即使产品获得FDA批准进行商业销售,并且 在FDA或适用的外国监管机构许可和监管的工厂中生产,也存在此风险。我们的产品和候选产品 旨在影响重要的身体功能和过程。与 我们的候选产品相关的任何副作用、制造缺陷、误用或滥用都可能导致患者受伤甚至死亡。我们不能保证我们将来不会面临产品 责任诉讼,也不能保证我们的保险范围足以覆盖我们在任何 此类情况下的责任。
此外,即使我们的候选产品只是看起来造成了伤害,我们也可能会对我们提出责任索赔。消费者、医疗保健提供者、制药公司或其他销售或以其他方式 与我们候选产品接触的其他人,可能会对我们提出产品 责任索赔。如果我们不能成功地保护自己免受产品责任索赔 ,我们将承担重大责任和声誉损害。此外,无论价值或最终结果如何,产品责任 索赔可能导致:
| ● | 临床试验参与者退出; |
| ● | 终止临床试验地点或整个试验项目; |
| ● | 无法 获得监管部门对我们候选产品的批准; |
| ● | 无法将我们的候选产品商业化; |
| ● | 减少了对我们候选产品的 需求; |
| ● | 商誉受损 ; |
| ● | 产品 召回或从市场上撤回,或标签、营销或促销限制; |
| ● | 任何相关诉讼或类似纠纷的巨额费用; |
| ● | 将管理层的注意力和其他资源从我们的主要业务中分心; |
| ● | 实质性 向患者或其他针对我们的索赔人提供的金钱赔偿,但可能不在保险范围内;或 |
| ● | 收入损失 。 |
我们 目前保留产品责任保险,该保险可能不足以涵盖我们所有与产品责任相关的费用 或损失,并且可能无法涵盖我们可能遭受的任何费用或损失。此外,保险范围正变得越来越昂贵, 而且,在未来,我们可能无法以合理的成本、足够的金额或适当的条款维持保险范围 ,以保护我们免受因产品责任而造成的损失。如果我们的任何产品 候选产品获得监管部门批准,我们将需要增加产品责任保险范围,这将是很昂贵的,而且我们可能无法以商业上合理的条款或根本无法获得这种增加的产品责任保险 。一个成功的产品责任索赔或一系列索赔可能导致 我们的股价下跌,如果判决超过我们的保险范围,可能减少我们的现金,并可能损害我们的业务、财务状况、经营成果和前景。
| 26 |
如果 我们的任何候选产品获得上市批准,并且发现我们不当地推广了标签外使用,或者如果医生 滥用我们的产品或标签外使用我们的产品,我们可能会受到禁止销售或营销产品、 产品责任索赔和巨额罚款、处罚和制裁的约束,我们的品牌和声誉可能会受到损害。
The FDA and other regulatory agencies strictly regulate the marketing and promotional claims that are made about drug and biologic products. In particular, a product may not be promoted for uses or indications that are not approved by the FDA or such other regulatory agencies as reflected in the product’s approved labeling and comparative safety or efficacy claims cannot be made without direct comparative clinical data. If we are found to have promoted off-label uses of any of our product candidates, we may receive warning or untitled letters and become subject to significant liability, which would materially harm our business. Both federal and state governments have levied large civil and criminal fines against companies for alleged improper promotion and have enjoined several companies from engaging in off-label promotion. If we become the target of such an investigation or prosecution based on our marketing and promotional practices, we could face similar sanctions, which would materially harm our business. In addition, management’s attention could be diverted from our business operations, significant legal expenses could be incurred and our brand and reputation could be damaged. The FDA has also requested that companies enter into consent decrees or permanent injunctions under which specified promotional conduct is changed or curtailed. If we are deemed by the FDA to have engaged in the promotion of our products for off-label use, we could be subject to FDA regulatory or enforcement actions, including the issuance of an untitled letter, a warning letter, injunction, seizure, civil fine or criminal penalties. It is also possible that other federal, state or foreign enforcement authorities might take action if they consider our business activities constitute promotion of an off-label use, which could result in significant penalties, including criminal, civil or administrative penalties, damages, fines, disgorgement, exclusion from participation in government healthcare programs and the curtailment or restructuring of our operations.
但是,当医生 独立专业医学判断认为合适时,我们 不能阻止医生在这些适应症之外使用我们的候选产品。医生还可能滥用我们的候选产品或使用不当的 技术,可能导致不良结果、副作用或伤害,从而可能导致产品责任索赔。如果我们的候选产品 被误用或使用不当技术,我们可能会受到医生或患者高昂的诉讼。此外, 将我们的候选产品用于FDA批准的适应症以外的适应症可能无法有效治疗此类疾病,这 可能会损害我们在医生和患者中的声誉。
我们 可以选择在开发期间或审批后的任何时间不继续开发或商业化我们的任何候选产品,这将减少或消除我们对这些候选产品的潜在投资回报。
在 任何时候,我们可能会出于各种原因决定停止任何候选产品的开发或不继续将一个或多个已获批准的候选产品商业化,包括出现使我们的产品过时的新技术、来自竞争对手产品的竞争、或更改或未遵守适用的法规要求。如果我们终止我们已投入大量资源的计划 ,我们将不会从投资中获得任何回报,并且我们将错过将这些资源分配到潜在更高效用途的预期机会 。
我们 或我们当前和未来的合作伙伴在未来可能会受到产品召回的影响,这可能会损害我们的品牌和声誉,并且 可能会对我们的业务产生负面影响。
如果我们的任何候选产品被批准上市、不符合规格或被认为会导致受伤或疾病,或者如果我们被指控违反了 政府法规,包括与制造、标签、促销、销售或分销相关的法规,我们 或我们当前和潜在的合作伙伴可能会受到产品召回、撤回或扣押的影响。未来的任何召回、撤回或扣押都可能对消费者对我们品牌的信心造成重大负面影响,并导致对我们 批准的产品的需求减少。此外,召回、撤回或扣押我们批准的任何产品将需要管理层的高度关注,可能会导致巨额和意想不到的支出,并将损害我们的业务、财务状况和运营 结果。
| 27 |
如果 我们或我们可能合作的任何合作伙伴无法为我们获得监管批准的任何候选产品或我们可能寻求商业化的任何产品实现并保持覆盖范围和足够的报销水平,他们的商业成功可能会受到严重阻碍。
对于 只能通过处方获得的任何候选产品,我们或我们可能与之合作的任何合作伙伴的成功销售取决于第三方付款人是否提供保险和足够的报销。为治疗病情而开药的患者通常依靠第三方付款人来报销与其 处方药相关的全部或部分费用。政府医疗保健计划(如Medicare和Medicaid)和私人第三方付款人提供的保险范围和足够的报销对于新产品的接受度至关重要。覆盖范围的决定可能取决于临床和经济标准,当已经有更成熟或更低成本的治疗替代方案可用或随后 可用时,这些标准不支持新药产品。如果我们的任何候选产品没有显示出有吸引力的功效配置文件,他们可能没有资格享受保险和报销 。即使我们获得了特定产品的保险,由此产生的报销付款率也可能不够高,或者 可能需要患者认为不可接受的高得令人无法接受的共同付款。患者不太可能使用我们的产品,除非提供保险并且 报销足以支付我们产品的大部分成本。
此外,我们候选产品的市场将在很大程度上取决于第三方付款人的药物处方或第三方付款人提供承保和报销的药物清单。行业竞争将被纳入此类 配方,往往会给制药公司带来下行定价压力。此外,当有价格较低的仿制药或其他 替代品时,第三方付款人可以拒绝在其处方中包括特定的 品牌药物,或以其他方式限制患者使用品牌药物。
此外, 第三方付款人,无论是国外的还是国内的,或者政府的还是商业的,都在开发越来越复杂的方法来控制医疗成本。此外,在美国,尽管私人第三方付款人倾向于遵循联邦医疗保险,但第三方付款人之间没有统一的药品保险和报销政策。因此,药品 产品的承保范围和报销范围因付款人而异。因此,承保范围确定过程通常是一个耗时且成本高昂的过程,需要我们为每个付款人分别提供科学和临床支持,以使用我们的候选产品,而不能保证获得承保范围和足够的报销。
此外, 我们认为,未来的保险和报销可能会在美国和国际市场受到更多限制。我们可能获得监管批准的任何候选产品的第三方保险和报销可能无法在美国或国际市场 获得或得到足够的补偿,这可能会损害我们的业务、财务状况、运营业绩和前景。
最近颁布和未来的医疗立法或监管改革措施,包括政府对定价和报销的限制, 可能会增加我们获得上市批准的难度和成本,并可能对我们的业务和运营结果产生负面影响 。
在 美国和一些外国司法管辖区,已经并将继续有多项关于医疗保健系统的立法和法规变更以及 拟议的变更,这些变更可能会阻止或推迟候选产品的上市审批,限制或监管审批后活动,并影响我们以盈利方式销售任何获得营销审批的候选产品的能力。
已提出立法和监管建议,以扩大审批后要求,并限制药品 产品的销售和促销活动。我们不知道是否会颁布更多的法律变更,也不知道FDA的法规、指南或解释 是否会更改,也不知道这些更改会对我们的候选产品的上市审批产生什么影响(如果有的话)。此外,美国国会对FDA审批过程的更严格审查可能会显著推迟或阻止上市审批,因为 还会使我们受到更严格的产品标签和上市后测试以及其他要求的影响。
| 28 |
In the United States, under the Medicare Modernization Act, or MMA, Medicare Part D provides coverage to the elderly and disabled for outpatient prescription drugs by approving and subsidizing prescription drug plans offered by private insurers. The MMA also authorizes Medicare Part D prescription drug plans to use formularies where they can limit the number of drugs that will be covered in any therapeutic class. The Part D plans use their formulary leverage to negotiate rebates and other price concessions from drug manufacturers. Also under the MMA, Medicare Part B provides coverage to the elderly and disabled for physician-administered drugs on the basis of the drug’s average sales price, a price that is calculated according to regulatory requirements and that the manufacturer reports to Medicare quarterly. Both Congress and the Centers for Medicare & Medicaid Services (“CMS”), the agency that administers the Medicare program, from time to time consider legislation, regulations, or other initiatives to reduce drug costs under Medicare Parts B and D. For example, under the ACA, drug manufacturers are required to provide a 50% discount on prescriptions for branded drugs filled while the beneficiary is in the Medicare Part D coverage gap, also known as the “donut hole.” There have been legislative proposals to repeal the “non-interference” provision of the MMA to allow CMS to leverage the Medicare market share to negotiate larger Part D rebates. Further cost reduction efforts could decrease the coverage and price that we receive for our drug candidates and could seriously harm our business. Private payors often follow Medicare coverage policy and payment limitations in setting their own reimbursement rates, and any reduction in reimbursement under the Medicare program may result in a similar reduction in payments from private payors.
2010年《患者保护和平价医疗法案》(简称"ACA")旨在扩大医疗保险的获取范围,减少 或限制医疗支出的增长。此外,《平价医疗法案》对生产 或进口品牌处方药产品的公司征收了高额年费。它还增加了药品制造商必须支付给州医疗补助 计划的回扣金额,要求医疗补助回扣在管理医疗补助使用时支付,并增加了品牌产品固体口服剂型的"产品线 扩展"(如缓释制剂)的额外回扣。法律还包含大量 条款,影响欺诈和滥用合规性和透明度,这可能要求我们修改我们与医疗保健从业人员的业务惯例,并产生大量成本以确保合规性。
在美国和其他地方的 决策者和支付者中,对促进医疗保健系统的变革有着浓厚的兴趣, 的既定目标是控制医疗保健成本、提高医疗质量和/或扩大医疗保健的可获得性。在美国,制药行业一直是这些努力的一个特别重点,并受到重大立法倡议的重大影响。
例如,在美国,ACA极大地改变了政府和私人保险公司为医疗保健提供资金的方式 ,并显著影响了制药行业。ACA的许多条款影响生物制药行业,包括 为了使生物制药产品获得联邦医疗保险B部分和医疗补助计划项下的补偿或直接销售 给美国政府机构,制造商必须向有资格参加《公共卫生服务法案》("PHS")项下的药品定价 计划的实体提供折扣。自其颁布以来,对ACA的某些方面提出了司法和国会的质疑和修正。《ACA》的实施仍然存在不确定性,包括《ACA》可能会进一步修订,以及对《ACA》的法律挑战或废除《ACA》的努力。
此外,自 ACA颁布以来,美国已经提出并采纳了其他影响制药行业的立法变更。例如,2022年的《降低通货膨胀法》包括,除其他事项外,授权CMS 每年为有限数量的高成本单一来源药物谈判一个“最高公平价格”的条款,以及另一项条款 ,要求制药公司在价格上涨快于通胀时向Medicare支付回扣。此外,各州已经通过 或正在考虑通过法律,要求制药公司在提价前提供通知,并证明涨价的理由 。我们预计未来将采取额外的医疗改革措施,其中任何一项措施都可能限制 联邦和州政府为医疗产品和服务支付的金额,进而可能大幅降低某些开发项目的预计价值 并降低我们的盈利能力。
| 29 |
鉴于 处方药和生物制剂成本的上涨,美国 政府对药品定价做法也加强了审查。此类审查导致了最近的几项国会调查,并提出并颁布了联邦 和州立法,旨在提高产品定价的透明度,审查定价 和制造商患者计划之间的关系,以及改革政府计划产品报销方法。在联邦一级,现在离任的特朗普政府提出了许多处方药成本控制措施。同样,新的拜登政府 已经将降低处方药价格作为其优先事项之一。拜登政府尚未提出任何具体计划,但我们预计这些计划将在近期内出台。在州一级,立法机构正在越来越多地通过立法和 实施旨在控制药品和生物制品定价的法规,包括价格或患者报销 限制、折扣、对某些产品准入和营销成本披露的限制以及透明度措施,在某些情况下, 旨在鼓励从其他国家进口和大宗采购。
其他 拟议变更的示例包括但不限于扩大批准后要求、变更《孤儿药法》以及 限制药品销售和促销活动。我们无法确定是否会颁布额外的立法变更,或者是否会变更政府法规、指南或解释,或者这些变更 会对我们候选药物或产品(如有)的上市批准、销售、定价或报销产生什么影响。我们预计,这些 和未来可能采取的其他医疗改革措施可能会导致更严格的覆盖标准,并对我们收到的任何获批药物的价格造成额外的 下行压力。医疗保险或其他政府 计划的任何报销减少都可能导致私人支付者支付的类似减少。成本控制措施或其他 医疗改革的实施可能会阻碍我们创造收入、实现盈利或将我们的药物商业化。
此外,FDA可能会以可能严重影响我们业务 和产品的方式修订或重新解释FDA法规和指南。任何新的法规或指南,或对现有法规或指南的修订或重新解释,都可能会增加 我们当前或未来的任何候选产品的成本或延长FDA审查时间。我们无法确定 法规、法规、政策或解释的变更何时发布、颁布或采用,将如何影响我们未来的业务。此类 更改除其他外,可能需要:
| ● | 在获得批准之前要进行额外的 临床试验; |
| ● | 更改制造方法 ; |
| ● | 召回、更换或停产我们的一个或多个产品;以及 |
| ● | 其他 记录保存。 |
此类 更改可能需要大量时间并带来巨大成本,或者可能会降低我们候选产品的潜在商业价值 。此外,延迟收到或未能获得任何其他产品的监管许可或审批将损害我们的业务、财务状况和运营结果。
我们 还可能受到医疗法律、法规和执法的约束,如果我们不遵守这些法律,可能会对我们的业务、运营和财务状况产生不利影响。
与欺诈和滥用以及患者权利有关的某些联邦和州医疗保健法律法规现在和将来都适用于我们的业务。我们受到联邦政府和我们或我们的合作伙伴开展业务所在州的监管。 可能影响我们运营能力的法律和法规包括:
| ● | 联邦《反回扣条例》,除其他事项外,禁止任何个人或实体在知情的情况下故意提供、索要、收受或提供任何报酬(包括任何回扣、贿赂或回扣),直接或间接、公开或隐蔽地以现金或实物形式诱使个人推荐或购买、租赁或订购任何商品、设施或服务, 可全部或部分支付。在联邦医疗保健计划下,如联邦医疗保险和医疗补助计划 ; |
| ● | 联邦民事和刑事虚假报销法和民事金钱惩罚法,包括,例如,联邦民事虚假报销法, 对个人或实体施加刑事和民事处罚,包括民事举报人或准诉讼, 除其他事项外,故意向联邦政府提交或导致向联邦政府提交虚假或欺诈性的付款申请,或进行虚假陈述以避免、减少或隐瞒向联邦政府付款的义务 ; |
| ● | 1996年《联邦健康保险携带和责任法案》(HIPAA),制定了新的联邦刑法,禁止明知和故意执行或试图执行诈骗任何医疗福利计划的计划,或 通过虚假或欺诈性的借口、陈述或承诺,获得任何医疗福利计划拥有的或在其监管或控制下的任何金钱或财产,而无论付款人(例如,公共或私人),明知和故意挪用或窃取医疗福利计划,故意阻碍对医疗保健犯罪的刑事调查 ,明知或故意以任何伎俩或手段伪造、隐瞒或掩盖与医疗保健有关的医疗福利、项目或服务的交付或支付的重大事实,或作出任何重大虚假陈述 ; |
| ● | HIPAA,经《经济和临床健康信息技术法案》及其实施条例修订的《HIPAA》,在保护个人可识别健康信息的隐私、安全和传输方面,对包括医疗保健提供者、健康计划和医疗信息交换所在内的受覆盖实体及其各自的商业伙伴施加了保护隐私、安全和传输个人可识别健康信息的义务; |
| ● | 《平价医疗法案》下的联邦医生阳光要求,该法案要求药品、设备、生物制品和医疗用品的制造商每年向医疗保险和医疗补助服务中心报告与向医生和教学医院提供的付款和其他价值转移有关的信息,以及医生及其直系亲属持有的所有权和投资权益;以及 |
| ● | 州法律等同于上述每一项联邦法律,例如反回扣和虚假索赔法律,可能适用于由任何第三方付款人(包括商业保险公司)报销的物品或服务;州法律要求制药公司遵守 制药行业自愿合规指南和联邦政府颁布的适用合规指南,或以其他方式限制可能向医疗保健提供者和其他潜在转介来源提供的付款;州法律,要求药品制造商报告与向医疗保健提供者支付或以其他方式转移价值或营销支出有关的信息;州法律,在某些情况下管理健康信息的隐私和安全,其中许多法律在很大程度上彼此不同,可能不会产生相同的效果,从而使合规工作复杂化。 |
| 30 |
由于这些法律的广度,以及法定例外和可用安全港的狭窄,我们的一些商业活动可能会受到一项或多项此类法律的挑战。此外,最近的医疗改革立法加强了这些法律。例如,《平价医疗法案》等修订了联邦《反回扣法规》和某些医疗欺诈刑事法规的意图要求。个人或实体不再需要实际了解法规或违反法规的具体意图。此外,《平价医疗法案》规定,根据联邦民事虚假申报法的规定,政府可以断言,包括因违反联邦《反回扣条例》而产生的物品或服务的索赔构成虚假或欺诈性索赔。
实现并持续遵守这些法律可能被证明是代价高昂的。此外,任何针对我们违反这些法律的行为,即使我们 成功防御,也可能导致我们产生巨额法律费用,并将我们管理层的注意力从我们业务的 运营上转移。如果我们的业务被发现违反了上述任何法律或适用于我们的任何其他政府法律或法规,我们可能会受到惩罚,包括行政、民事和刑事处罚、损害赔偿、罚款、交还、被排除在联邦和州医疗保健计划之外、个人监禁或削减或重组我们的业务,任何这些都可能对我们的业务运营能力和我们的财务业绩产生不利影响。
我们的业务涉及使用危险材料,我们和我们的第三方供应商和制造商必须遵守环境 法律和法规,这些法律法规可能成本高昂,并限制我们的业务方式。
我们的第三方供应商和制造商的制造活动涉及我们拥有的危险材料的受控储存、使用和处置,包括我们候选产品的组件和其他危险化合物。我们和我们的制造商以及 供应商受有关这些危险材料的使用、制造、储存、处理和处置的法律法规的约束。 在某些情况下,这些危险材料和使用过程中产生的各种废物储存在我们供应商或制造商的 设施中,等待使用和处置。我们和我们的供应商和制造商不能完全消除污染风险,这可能会导致我们的商业化努力、研发努力和业务运营中断,对我们的服务提供商和其他人造成伤害,并造成环境破坏,导致昂贵的清理工作,并根据管理这些材料和指定废物的使用、存储、处理和处置的适用法律和法规承担责任 。尽管我们相信我们的第三方供应商和制造商用于处理和处置这些材料的安全 程序通常符合这些法律法规规定的标准,但我们不能保证确实如此,也不能消除这些材料的意外污染或伤害风险。在这种情况下,我们可能要对由此产生的任何损害承担责任,而这种责任可能会超出我们的资源范围。我们目前不承保生物或危险废物保险。
我们的 员工、独立承包商、主要调查人员、顾问、供应商、CRO和我们可能合作的任何合作伙伴 可能从事不当行为或其他不当活动,包括不遵守监管标准和要求。
我们 面临我们的员工、独立承包商、主要调查人员、顾问、供应商、CRO和我们可能合作的任何合作伙伴 可能从事欺诈或其他非法活动的风险。这些人员的不当行为可能包括故意、 鲁莽或疏忽的行为或违反下列法律或法规的未经授权的活动:法律或法规,包括要求向FDA或外国监管机构报告 真实、完整和准确信息的法律;制造标准;联邦、州和 外国医疗欺诈和滥用法律及数据隐私;或要求真实、完整和准确报告财务信息或数据的法律。特别是,医疗保健行业的销售、营销和其他业务安排受旨在防止欺诈、回扣、自我交易和其他滥用行为的广泛法律的约束。这些法律可能限制或禁止广泛的商业活动,包括研究、制造、分销、定价、折扣、营销和促销、销售佣金、客户激励计划和其他商业安排。受这些法律约束的活动还涉及不当使用在临床试验过程中获得的信息,或非法挪用药品,这可能会导致监管制裁或 因未能遵守此类法律或法规而引发的其他行动或诉讼,并严重损害我们的声誉。 此外,联邦采购法对与政府合同相关的不当行为进行了实质性处罚,并要求 某些承包商保持商业道德和行为准则。如果对我们提起任何此类诉讼,而我们未能成功地为自己辩护或维护我们的权利,这些诉讼可能会对我们的业务产生重大影响,包括 施加民事、刑事和行政处罚、损害赔偿、罚款、可能被排除在联邦医疗保险、医疗补助和其他联邦医疗保健计划、合同损害、声誉损害、利润和未来收益减少以及业务削减 ,任何这些都可能对我们的业务运营能力和我们的经营业绩产生不利影响。
| 31 |
实际 或被指控不遵守适用的雇佣法律和法规可能需要进行运营变革,破坏我们的竞争地位,或对我们的业务产生其他重大不利影响。
我们的 业务受各种就业法律和法规的约束,将来可能会受到其他此类要求的约束。 虽然我们认为我们在很大程度上遵守了适用的雇佣法律和法规,但如果要求发生变化, 我们可能需要修改我们的运营或利用资源来保持遵守此类法律和法规。此外, 我们可能会面临各种与雇佣有关的索赔,包括个人诉讼、集体诉讼和政府执法行动 ,这些诉讼涉及涉嫌雇佣歧视、员工分类和相关扣留、工资小时争议、劳工标准或 医疗保健和福利问题。此类索赔,无论有效性如何,都可能对我们的业务、财务状况、现金流或其他经营成果产生重大不利影响。
我们未来的增长在一定程度上取决于我们打入海外市场的能力,在那里我们将受到额外的监管负担和其他风险和不确定性的影响。
我们 未来的盈利能力将部分取决于我们在海外市场上将候选产品商业化的能力,我们打算 依靠与第三方的合作。如果我们在国外市场上将VAR 200或IC 100或其他候选产品商业化, 我们将面临额外的风险和不确定性,包括:
| ● | 我们的 客户能够在国外市场为我们的候选产品获得市场准入和适当的报销; |
| ● | 我们无法直接控制商业活动,因为我们依赖第三方; |
| ● | 遵守复杂多变的外国监管、税务、会计和法律要求的负担; |
| ● | 不同 影响市场接受的外国医疗习惯和习俗 |
| ● | 进口或出口许可要求; |
| ● | 应收账款收款时间较长 ; |
| ● | 发货的交货期更长; |
| ● | 语言障碍 技术培训; |
| ● | 减少国外一些国家对知识产权的保护; |
| ● | 外国货币汇率波动;以及 |
| ● | 在发生合同纠纷时,受外国法律管辖的合同条款的解释。 |
我们候选产品的海外销售也可能受到政府管制、政治和经济不稳定、贸易限制和关税变化的不利影响,其中任何一项都可能对我们的运营结果产生不利影响。
由于 与特殊目的收购公司的业务合并,监管义务可能会对我们产生不同于 其他上市公司的影响。
我们 通过完成与特殊目的收购公司Larkspur的业务合并而成为一家上市公司。 由于业务合并以及由此考虑的交易,我们的监管义务已经并可能继续对我们产生与其他上市公司不同的影响。例如,美国证券交易委员会和其他监管机构可能会发布额外的指导意见,或者对像我们这样已经完成与SPAC业务合并的公司进行进一步的监管审查。管理这种已经并可能继续发展的监管环境可能会分散管理层对我们业务运营的注意力, 会对我们在需要时筹集额外资本的能力产生负面影响,或者对我们的普通股价格产生不利影响。
| 32 |
我们 面临自然灾害和人为灾难、流行病以及恶意和恐怖行为的风险,这些风险可能会对我们的业务、财务状况和运营结果产生重大不利影响。
自然和人为灾难、流行病以及恶意和恐怖行为带来的风险可能会对我们的行动结果产生实质性的不利影响 。虽然我们已采取措施识别和缓解这些风险,但此类风险无法预测,也无法完全防范 。此外,此类事件可能导致整体宏观经济波动,特别是大范围地理区域的经济活动减少或停止,对我们在这些地理区域内的业务营销或运营或总体经济环境产生不利影响,进而可能对我们的业务、运营和财务状况产生不利影响。
特别是,已被世界卫生组织宣布为全球大流行的新冠肺炎疫情对美国和全球的金融市场和经济状况产生了重大负面影响。因此,我们的运营受到了, ,并可能进一步受到负面影响。因此,我们的业务、财务状况和运营结果已经受到影响,并可能受到进一步的重大不利影响。
全球经济和供应链的中断 可能会对我们的业务、财务状况和运营结果产生实质性的不利影响。
2020年和2021年对全球经济的干扰阻碍了全球供应链,导致交付期延长,还增加了关键组件成本和运费。我们已经或可能必须采取措施,通过与我们赖以开展业务的第三方密切合作,在交付期内将这些中断的影响降至最低,并增加成本。尽管我们已采取或可能必须采取行动将中断对全球经济的影响降至最低,但不能保证全球供应链中不可预见的未来事件不会对我们的业务、财务状况和运营结果产生重大不利影响。
此外,通货膨胀会增加临床试验成本、我们候选产品的研发成本以及开展业务的管理和其他成本,从而对我们产生不利影响。我们可能会遇到劳动力价格和其他开展业务的成本上涨的情况。在通货膨胀的环境下,成本增长可能会超出我们的预期,导致我们使用现金和其他流动资产的速度比预期更快。如果发生这种情况,我们可能需要筹集额外资本来为我们的运营提供资金,而这些资金可能无法获得足够的金额或合理的条款,如果有的话,可能会比预期更早。
不利的全球环境,包括经济不确定性,可能会对我们的财务业绩产生负面影响。
全球情况、金融市场的混乱、税制改革对美国造成的任何负面财务影响或对现有贸易协定或税务惯例的 更改,都可能对我们的业务产生不利影响。
此外,全球宏观经济环境可能受到以下因素的负面影响:新冠肺炎或其他流行病或流行病、全球经济市场的不稳定、美国增加的贸易关税和与其他国家的贸易争端、全球信贷市场的不稳定、供应链薄弱、英国退出欧盟导致的地缘政治环境的不稳定、俄罗斯入侵乌克兰和其他政治紧张局势以及对外国政府债务的担忧。这些挑战已经并可能继续在当地经济和全球金融市场造成不确定和不稳定。
| 33 |
与我们依赖第三方相关的风险
我们 过去一直依赖并希望继续依赖第三方CRO和其他第三方来执行和监督我们的临床 试验和产品开发的其他方面。如果这些第三方不符合我们的要求或以其他方式按要求执行试验 ,我们可能无法履行合同义务,或在预期或根本无法获得监管部门批准,或无法将候选产品 商业化。
We have in the past relied and expect to continue to rely on third-party CROs to conduct and oversee our clinical trials and other aspects of product development. We also rely upon various medical institutions, clinical investigators and contract laboratories to conduct our trials in accordance with our clinical protocols and all applicable regulatory requirements, including the FDA’s regulations and GCPs, which are an international standard meant to protect the rights and health of patients and to define the roles of clinical trial sponsors, administrators and monitors, and state regulations governing the handling, storage, security and recordkeeping for drug and biologic products. These CROs and other third parties play a significant role in the conduct of these trials and the subsequent collection and analysis of data from the clinical trials. We rely heavily on these parties for the execution of our clinical trials and preclinical studies, and control only certain aspects of their activities. We and our CROs and other third-party contractors are required to comply with GCP, GLP, and GACP requirements, which are regulations and guidelines enforced by the FDA and comparable foreign regulatory authorities for products in clinical development. Regulatory authorities enforce these GCP, GLP and GACP requirements through periodic inspections of trial sponsors, principal investigators and trial sites. If we or any of these third parties fail to comply with applicable GCP, GLP and GACP requirements, the clinical data generated in our clinical trials may be deemed unreliable and the FDA or other regulatory authority may require us to perform additional clinical trials before approving our or our partners’ marketing applications. We cannot assure you that upon inspection by a given regulatory authority, such regulatory authority will determine that any of our clinical or preclinical trials complies with applicable GCP and GLP requirements. In addition, our clinical trials must generally be conducted with product produced under cGMP regulations. Our failure to comply with these regulations and policies may require us to repeat clinical trials, which would delay the regulatory approval process.
我们的 CRO不是我们的员工,我们无法控制他们是否为我们的临床试验投入了足够的时间和资源。我们的 CRO还可能与其他商业实体(包括我们的竞争对手)有关系,他们也可能为他们进行临床 试验或其他药物开发活动,这可能会损害我们的竞争地位。我们面临潜在的未经授权披露 或CRO盗用我们的知识产权的风险,这可能会降低我们的商业秘密保护,并允许我们的潜在竞争对手 访问和利用我们的专有技术。如果我们的CRO未能成功履行其合同职责或义务, 未能在预期期限内完成,或者如果他们获得的临床数据的质量或准确性由于 未能遵守我们的临床方案或监管要求或任何其他原因而受到影响,我们的临床试验可能会被延长、延迟或 终止,我们可能无法获得监管部门的批准,或成功地将我们开发的任何候选产品商业化。 因此,我们的财务业绩和我们开发的任何候选产品的商业前景都会受到损害,我们的成本可能会增加 ,我们的创收能力可能会被推迟。
如果 我们的任何CRO或临床试验中心出于任何原因终止参与我们的某项临床试验,我们可能无法 与替代CRO或临床试验中心达成协议,或以商业上合理的条款达成协议。此外,如果 我们与临床试验中心的关系终止,我们可能会失去参加 我们正在进行的临床试验的患者的随访信息,除非我们能够将这些患者的护理转移到另一家合格的临床试验中心。此外, 我们临床试验的主要研究者可能不时担任我们的科学顾问或顾问,并可能获得与此类服务相关的 现金或股权补偿。如果这些关系和任何相关补偿导致了感知的 或实际的利益冲突,FDA可能会质疑在适用的临床试验中心生成的数据的完整性。
| 34 |
我们 完全依赖第三方承包商为我们的候选产品(包括 某些独家供应商和制造商)供应、生产和分销临床药物供应,如果我们的任何候选产品获得监管部门批准,我们打算依靠第三方进行商业供应、生产和分销 ,我们希望依靠第三方进行临床前产品的供应、生产和分销 ,任何未来候选产品的临床和商业供应。
我们 目前没有,也不计划获得供应、生产或分销临床前、 临床或商业数量的原料药或产品的基础设施或能力。我们开发候选产品的能力取决于,我们商业化供应产品的能力 部分取决于,我们能否从第三方成功获得原材料和原料药以及其他 候选产品中使用的物质和材料,以及能否由第三方生产成品 符合法规要求,并以足够的数量用于临床前和临床试验和商业化。如果 我们未能与这些第三方建立和维持供应关系,我们可能无法继续开发或商业化 我们的候选产品。
我们 依赖并将继续依赖某些第三方作为其供应材料或其 制造的成品的唯一来源。我们现有的供应商或制造商可能:
| ● | 失败 因设施意外损坏或破坏,及时或按要求数量向我们提供产品,或 设备或其他; |
| ● | 失败 提高生产能力,及时以更高的产量生产大量药品和组分 或成本效益的方式,或完全,以充分满足我们的商业需求; |
| ● | 是 由于依赖独家供应商和制造商的问题,无法满足我们的生产需求; |
| ● | 供应 我们的产品不符合监管要求; |
| ● | 成为 因业务中断或破产而无法获得; |
| ● | 失去 作为批准来源的监管地位; |
| ● | 是 无法或不愿在现有供应协议及时到期时、以可接受的条款或根本到期时续签; 或 |
| ● | 停止 生产或制造必要的药物或产品。 |
在发生上述任何情况时,如果我们没有替代供应商或制造商,我们将需要花费大量管理时间和费用来识别、鉴定流程并将其转移给替代供应商或制造商。将技术转移到其他站点可能需要额外的流程、技术和验证研究,这些过程、技术和验证研究成本高昂,可能需要相当长的时间,可能不会成功,并且在大多数情况下需要FDA的审查和批准。任何寻找和鉴定新供应商或制造商的需求都可能显著延迟我们候选产品的生产,对我们营销候选产品的能力产生不利影响 ,并对我们的业务产生不利影响。我们可能无法及时、按可接受的条款或根本无法获得更换。此外, 我们和我们的制造商目前没有大量的药品和其他材料库存。 药物或其他材料的供应或我们的候选产品生产的任何中断都可能对我们的业务、财务状况、经营业绩和前景产生重大不利影响。
我们 无法直接控制我们的合同供应商和制造商是否有能力保持足够的产能和能力来满足我们的需求,包括质量控制、质量保证和合格人员。虽然我们最终负责确保遵守cGMP和GACP等法规要求,但我们依赖我们的合同供应商和制造商 日常遵守cGMP或GACP来生产原材料、原料药和成品。我们的合同供应商和制造商用于生产原料药和其他物质和材料或成品用于商业销售的设施必须通过 检查,并获得FDA和其他相关监管机构的批准。我们的合同供应商和制造商必须遵守FDA通过其设施检查计划和审查提交的技术信息执行的cGMP和GACP要求。 如果任何产品或产品候选或组件的安全因未能遵守适用法律或其他 原因而受到损害,我们可能无法成功将受影响的产品或候选产品商业化或获得监管部门的批准, 我们可能需要对由此造成的伤害承担责任。这些因素中的任何一个都可能导致我们候选产品的临床前研究、临床试验或监管提交或批准的延迟或终止,并可能导致更高的成本或导致我们无法及时有效地将我们批准的产品商业化,或者根本无法实现。
| 35 |
此外,这些合同制造商还与其他公司合作,为此类公司供应和制造材料或产品,这也使我们的供应商和制造商面临生产此类材料和产品的监管风险。因此, 无法满足生产这些材料和产品的监管要求也可能影响合同供应商或制造商设施的监管审批。如果FDA或类似的外国监管机构不批准 这些设施用于供应或制造我们的候选产品,或者如果它在未来撤回批准,我们可能需要 寻找替代供应或制造设施,这将对我们开发、获得监管机构批准或营销我们的候选产品的能力产生负面影响。
我们对合同制造商和供应商的依赖进一步暴露了他们或有权访问其设施的第三方可能会访问并挪用我们的商业秘密或其他专有信息的可能性。
如果 我们无法建立和维护协作,我们可能不得不更改我们的开发和商业化计划。
我们候选产品的开发和潜在商业化将需要大量额外现金来支付费用。为了 进一步开发我们的候选产品,我们可能会与制药和生物技术公司合作开发这些候选产品,并可能将其商业化。我们在寻找合适的合作伙伴方面面临着激烈的竞争。我们是否就合作达成最终协议将取决于我们对合作伙伴资源和经验的评估 、拟议合作的条款和条件以及拟议合作伙伴对一系列因素的评估。 这些因素可能包括临床试验的设计或结果;FDA或其他监管机构批准的可能性;主题候选产品的潜在市场;制造和向患者交付此类候选产品的成本和复杂性 ;竞争产品的潜力;与我们的知识产权所有权有关的任何不确定性;以及行业和市场状况。合作伙伴还可以为类似的候选产品或技术考虑可供协作的替代产品或技术 ,以及此类协作是否会比我们的候选产品更具吸引力 。根据未来的许可协议,我们还可能受到限制,不能与潜在合作伙伴就某些条款达成协议。 协作非常复杂,谈判和记录都很耗时。此外,大型制药公司之间最近发生了大量的商业合并,导致未来潜在合作伙伴的数量减少。
我们未来可能进行的 合作可能涉及以下风险:
| ● | 合作者 在决定将用于这些合作的努力和资源方面可能有很大的酌处权; |
| ● | 协作者 可能未按预期履行义务; |
| ● | 更改 合作者的战略重点或可用资金,或外部因素(如收购)可能会转移资源 或创造竞争性的优先事项; |
| ● | 合作者 可能会延迟发现和临床前开发,为我们选定的靶点的产品开发提供足够的资金, 停止或放弃候选产品的发现和临床前开发,重复或进行新的发现和临床前开发 对于候选产品; |
| 36 |
| ● | 合作者 可以独立开发或与第三方开发直接或间接与我们的产品或产品竞争的产品 如果合作者认为有竞争力的产品比我们的产品更有可能成功开发; |
| ● | 产品 与我们合作发现的候选产品可能会被我们的合作者视为与他们自己的候选产品有竞争力 或产品,这可能导致合作者停止投入资源开发我们的候选产品; |
| ● | 分歧 与合作者之间的分歧,包括对所有权、合同解释或首选开发路线的分歧, 可能导致候选产品的发现、临床前开发或商业化延迟或终止,可能导致 我们在候选产品方面的额外责任,或可能导致诉讼或仲裁,其中任何一种 既耗时又昂贵; |
| ● | 合作者 可能无法正确维护或捍卫我们的知识产权或授权给我们的知识产权,或者可能使用我们的 专有信息,导致诉讼可能危及我们的知识产权或专有权或无效 信息或使我们面临潜在诉讼; |
| ● | 合作者 可能侵犯第三方的知识产权,这可能使我们面临诉讼和潜在责任;以及 |
| ● | 为了协作者的方便,可能会终止合作 ,如果终止,我们可能需要筹集额外资金以 进一步开发适用的候选产品或将其商业化。 |
协作 通常会对各方施加详细的义务。如果我们违反了我们的义务,我们可能会面临重大后果,包括 可能终止合作,并且我们对合作伙伴候选产品的权利将失去,我们已经投入了大量 时间和金钱。
我们 可能无法及时、以可接受的条款或根本无法就合作进行谈判。如果我们无法做到这一点,我们可能不得不 减少候选产品的开发、减少或推迟我们的开发计划或我们的一个或多个其他开发计划、 推迟我们潜在的商业化或增加我们的支出并自费进行开发或商业化活动 。如果我们选择增加支出来资助自己的开发或商业化活动,我们可能需要获得 额外的资本,而我们可能无法以可接受的条款或根本无法获得这些资本。如果我们没有足够的资金,我们可能无法 进一步开发我们的候选产品或将其推向市场并产生产品收入。
与管理我们的增长、员工和运营有关的风险
我们 未来将需要进一步增加我们组织的规模和复杂性,我们在执行增长战略和管理任何增长方面可能会遇到困难。
我们的 管理层、人员、系统和设施目前不足以支持我们的业务计划和近期的未来增长。 我们将需要进一步扩大我们的化学和生产团队、临床团队、管理、运营、财务和其他资源 ,以支持我们计划中的研究、开发和商业化活动。
要 有效管理我们的运营、增长和各种项目,我们需要:
| ● | 继续 改进我们的业务、财务、管理和监管合规控制以及报告系统和程序; |
| ● | 吸引和留住足够数量的优秀员工; |
| ● | 发展市场营销、销售和分销能力; |
| 37 |
| ● | 有效且经济高效地管理我们的候选产品的商业化活动; |
| ● | 与开发和商业化合作伙伴建立和维护关系; |
| ● | 有效管理我们的临床前和临床试验; |
| ● | 以经济高效的方式管理我们的第三方供应和制造运营,同时将我们当前候选产品的生产能力 提高到商业水平;以及 |
| ● | 有效管理我们的开发工作,同时履行对合作伙伴和其他第三方的合同义务。 |
此外,从历史上看,我们一直并将继续利用兼职外部顾问为我们执行多项任务,包括与临床前和临床试验相关的任务。我们的增长战略还可能需要扩大我们对顾问的使用 以实施这些任务和未来的其他任务。我们的某些业务职能依赖顾问,需要对这些顾问进行有效的 管理,以确保他们成功履行合同义务并在预期期限内完成任务。 不能保证我们能够根据需要以经济合理的条款管理我们现有的顾问或找到其他称职的外部顾问,或者根本不能。如果我们不能通过招聘新员工和扩大顾问的使用来有效管理我们的增长和扩大我们的组织,我们可能无法成功执行有效执行我们计划的研发和商业化活动所需的任务,因此可能无法实现我们的研发和 商业化目标。
如果 我们无法吸引和留住管理层和其他关键人员,我们可能无法继续成功开发或商业化我们的候选产品,或以其他方式实施我们的业务计划。
我们在竞争激烈的制药行业中的竞争能力取决于我们能否吸引和留住高素质的管理、科学、医疗、销售和营销人员以及其他人员。我们高度依赖我们的管理层,包括斯蒂芬·C·格洛弗、彼得·沃尔夫、巴勃罗·A·古兹曼、医学博士和凯伦·A·卡什米尔。失去这些个人的服务可能会阻碍、 推迟或阻止我们产品管道的成功开发、完成我们计划的临床试验、将我们的候选产品商业化、或获得许可或获得新资产,并可能对我们成功实施业务计划的能力产生负面影响。如果我们失去了这些人员中的任何一个人的服务,我们可能无法及时 找到合适的替代人员,或者根本无法找到合适的替代人员,因此我们的业务可能会受到损害。我们不为这些个人的生命或我们任何其他员工的生命 维护“关键人物”保险单。为了留住我们公司有价值的员工,除了 工资和现金奖励外,我们还提供随时间授予的股票期权。随着时间的推移,授予员工的股票期权的价值将受到我们无法控制的股票价格变动的重大影响,并且随时可能不足以抵消其他公司的报价 。
我们 未来可能无法吸引或留住合格的管理层和其他关键人员,因为生物技术、制药和其他企业之间对合格人才的竞争非常激烈,尤其是在我们总部所在的佛罗里达州韦斯顿地区。 我们可能难以吸引有经验的人员到我们的公司,并可能需要花费大量财务资源 来招聘和留住员工。与我们竞争合格人才的许多其他制药公司 比我们拥有更多的财务和其他资源、不同的风险状况和更长的行业历史。它们还可以提供更多样化的机会和更好的职业晋升机会。如果我们无法吸引和留住实现业务目标所需的人员 ,我们可能会遇到限制,这将损害我们实施业务战略和实现业务目标的能力。
此外,我们还拥有科学和临床顾问,帮助我们制定开发和临床策略。这些顾问 不是我们的员工,可能与其他实体签订了承诺、咨询或咨询合同,这可能会限制他们对我们的可用性 。此外,我们的顾问可能会与其他公司达成协议,协助这些公司开发可能与我们竞争的产品或技术。
| 38 |
竞争激烈的就业市场在我们发展壮大并努力吸引和留住高技能劳动力的同时,也带来了挑战和潜在风险。
我们员工的竞争非常激烈,包括高技能的技术和产品专业人员,这反映了劳动力市场的紧张。 这可能会带来风险,因为我们正在竞争有经验的候选人,特别是如果竞争能够提供更有吸引力的财务 雇佣条款。这一风险延伸到我们目前的员工群体。此外,我们已经受到并可能进一步受到持续的新冠肺炎疫情的影响,这可能会导致有才华的员工跳槽,并可能使吸引和留住熟练专业人员的工作更具挑战性。随着我们业务的发展,我们还可能投入大量的时间和费用来吸引和发展我们的员工,这也会增加他们对其他可能寻求招聘他们的公司的价值。人员更替可能会导致巨大的更换成本和工作效率损失。此外,美国的移民政策可能会使符合条件的外国公民更难获得或保持H-1B类别的工作签证。这些H-1B签证限制可能会使我们更难和/或更昂贵地聘请我们执行增长战略所需的熟练专业人员,并可能对我们的业务产生不利影响。
我们 目前营销能力有限,没有销售组织。如果我们不能靠自己或通过第三方建立销售和营销能力 ,我们将无法成功地将我们的候选产品商业化(如果获得批准),或产生 产品收入。
我们 目前营销能力有限,没有销售组织。如果我们的候选产品获得批准,要在美国、加拿大、欧盟和我们寻求进入的其他司法管辖区实现商业化,我们必须建立我们的营销、销售、分销、管理和其他非技术能力,或者与第三方安排执行这些服务,而我们可能无法 成功做到这一点。虽然我们的管理团队在医药产品的营销、销售和分销方面有经验 之前在其他公司工作过,但作为一家公司,我们在医药产品的营销、销售和分销方面没有经验 ,建立和管理销售组织涉及重大风险,包括我们招聘、留住 和激励合格人员的能力,产生足够的销售线索,为销售和营销人员提供充分的培训,以及 有效管理分散在各地的销售和营销团队的能力。如果我们的内部销售、营销和分销能力发展出现任何失败或延迟,都将对这些产品的商业化产生不利影响。我们可以选择与拥有直销队伍和已建立的分销系统的其他第三方合作,以扩充我们自己的销售队伍和分销系统,或者代替我们自己的销售队伍和分销系统。如果我们不能以可接受的条款或根本不能达成这样的安排,我们可能无法成功地将我们的候选产品商业化。如果我们不能成功地将我们的候选产品 单独或通过与一个或多个第三方合作实现商业化,我们的业务、财务状况、经营业绩和前景都将受到影响。
我们的 未能成功授权、收购、开发和营销其他候选产品或已获批准的产品将削弱我们发展业务的能力 。
我们 打算授权、收购、开发和营销其他产品和候选产品,我们可能会授权或收购商业阶段的产品或从事其他战略交易。由于我们的内部研发能力有限,我们可能会 依赖制药公司、学术科学家和其他研究人员向我们销售或许可产品或技术。这一战略的成功在一定程度上取决于我们识别和挑选有前景的候选药品和产品的能力, 与现有所有者谈判许可或收购协议的能力,以及为这些安排提供资金的能力。
提议、谈判和实施许可证或获取候选产品或经批准的产品的流程既漫长又复杂。其他公司,包括那些拥有大量财务、营销、销售和其他资源的公司,可能会与我们竞争候选产品和已批准产品的许可或收购。我们的资源有限,无法识别和执行第三方产品、业务和技术的收购或授权,并将其集成到我们当前的基础设施中。 此外,我们可能会将资源投入到从未完成的潜在收购或许可机会上,或者我们可能无法实现此类努力的预期好处。我们可能无法按照我们 认为可接受的条款或根本无法获得其他候选产品的权利。
| 39 |
此外, 我们获得的任何候选产品在商业销售之前可能需要额外的开发工作,包括临床前或临床 测试和FDA和适用的外国监管机构的批准。所有候选产品都容易出现药品开发中常见的失败风险,包括候选产品可能不会被证明足够安全且 有效,无法获得监管机构的批准。此外,我们不能保证我们收购的任何经批准的产品将以有利可图的方式生产或销售或获得市场认可。
我们可能考虑的其他 潜在交易包括各种不同的业务安排,包括剥离、战略合作伙伴关系、合资企业、重组、资产剥离、业务合并和投资。任何此类交易可能需要我们产生非经常性费用或其他费用,可能会增加我们的短期和长期支出,并可能带来重大的整合挑战或中断我们的管理 或业务,这可能会对我们的运营和财务业绩产生不利影响。例如,这些交易涉及许多潜在的运营和财务风险,包括:
| ● | 暴露于未知债务的风险; |
| ● | 中断我们的业务,转移我们管理层的时间和注意力,以开发收购的产品、候选产品或技术。 |
| ● | 发生大量债务或股权证券的稀释发行,以支付收购费用; |
| ● | 庞大的收购和整合成本; |
| ● | 资产或减值费用的减记 ; |
| ● | 增加了 摊销费用; |
| ● | 将任何被收购企业的运营和人员与我们的运营和人员合并的难度和成本; |
| ● | 由于管理层和所有权的变化,与任何被收购企业的主要供应商、合作伙伴或客户的关系减值 ; 和 |
| ● | 无法 留住我们的关键员工或任何被收购企业的员工。 |
因此,不能保证我们将进行或成功完成上述性质的任何交易,并且我们完成的任何交易 都可能损害我们的业务、财务状况、经营业绩和前景。
| 40 |
制造和供应我们的候选产品中使用的原料药和其他物质和材料是一项复杂且具有技术挑战性的工作, 制造、测试、质量保证和分销供应链中的许多环节都可能出现故障, 产品制造和分销后可能存在潜在缺陷。
原料药、其他物质和材料以及药品成品的制造和供应在技术上具有挑战性。超出我们直接控制范围的变化可能会影响我们候选产品的质量、数量、价格和成功交付,并可能阻碍、推迟、限制或阻止我们候选产品的成功开发和商业化 。错误和处理不当并不少见,可能会影响成功的生产和供应。其中一些风险包括:
| ● | 我们的制造商没有遵守cGMP或GACP要求,或者在生产或准备运输过程中对产品处理不当; |
| ● | 我们的合同供应商和制造商无法有效且经济高效地提高和保持高产量和批次质量, 一致性和稳定性; |
| ● | 我们 无法开发FDA批准的生物检测来发布任何未来的产品; |
| ● | 难以确定最佳的药物输送物质和技术、生产和储存方法以及包装和运输流程; |
| ● | 运输 和进出口风险,特别是考虑到我们供应链的全球性; |
| ● | 延迟 分析结果或我们赖以进行质量控制和未来产品发布的分析技术失败; |
| ● | 自然灾害、流行病、劳资纠纷、财务困难、缺乏原材料供应、设施和设备问题或其他 形式对我们合同制造商和供应商业务运营的干扰;以及 |
| ● | 潜在的 产品发布后可能变得明显的缺陷,可能导致产品召回和销毁。 |
这些因素中的任何一个都可能导致与我们的临床试验、监管提交、所需审批或候选产品商业化相关的延迟或更高成本,这可能会损害我们的业务、财务状况、运营结果和前景。
我们的 经营业绩可能波动很大,这使得我们未来的经营业绩难以预测,并可能导致我们的经营 业绩低于预期。
到目前为止,我们的业务主要限于研究和开发我们的候选产品,并对我们的候选产品进行临床前研究和临床试验。我们的任何候选产品都尚未获得监管部门的批准。因此,您对我们未来成功或生存能力的任何预测可能都不会像我们拥有更长的运营历史或市场上获得批准的产品那样准确。 此外,我们的经营业绩可能会因各种其他因素而波动,其中许多因素是我们无法控制的,可能很难预测,包括以下因素:
| ● | 推迟我们的候选产品的开始、注册和临床测试的时间; |
| ● | 我们的候选产品或竞争候选产品的临床试验的时机和成功或失败,或行业竞争格局中的任何其他变化,包括我们的竞争对手或合作伙伴之间的整合; |
| ● | 临床开发中对候选产品的监管审查和批准方面的任何延误; |
| ● | 与我们的候选产品相关的研究和开发活动的时间、成本和投资水平,可能会 不时发生变化; |
| ● | 制造我们的候选产品的成本,可能会根据FDA的指导方针和要求以及生产数量而有所不同; |
| ● | 我们 有能力获得额外资金来开发我们的候选产品; |
| ● | 我们将获得或可能产生的用于获取或开发其他候选产品和技术的支出 ; |
| ● | 如果我们的候选产品获得批准,对它们的需求水平可能会有很大差异; |
| ● | 我们的候选产品的潜在副作用,可能会推迟或阻止商业化,或导致批准的药物退出市场 ; |
| ● | 如果获得批准,患者或医疗保健提供者获得我们的候选产品的覆盖范围或足够的补偿的能力; |
| ● | 我们对第三方制造商供应或制造我们的候选产品的依赖; |
| 41 |
| ● | 我们的 能够及时建立有效的销售、营销和分销基础设施; |
| ● | 市场接受我们的候选产品(如果获得批准),以及我们预测这些候选产品的需求的能力; |
| ● | 我们 在美国以外获得批准并将我们的候选产品商业化的能力; |
| ● | 我们建立和维护协作、许可或其他安排的能力; |
| ● | 我们保护知识产权的能力和第三方的能力; |
| ● | 与潜在诉讼或其他纠纷有关的费用和结果; |
| ● | 我们有能力充分支持未来的增长; |
| ● | 我们 有能力吸引和留住关键人员以有效管理我们的业务; |
| ● | 与危险材料相关的潜在责任; |
| ● | 我们 有能力维持足够的保险单;以及 |
| ● | 未来 我们的会计政策中的会计声明或变更。 |
我们的经营业绩和流动性需求可能会受到市场波动和经济低迷的负面影响。
我们的 经营业绩和流动性可能会受到美国和世界其他地方的普遍经济状况的负面影响 。自由选择的医疗产品和程序市场可能特别容易受到不利的经济条件 。某些患者可能认为我们的某些候选产品是可自行决定的,如果无法全额报销此类产品 ,则对这些产品的需求可能与我们目标患者人群的可自行决定的支出水平有关。基于 国内和国际经济状况和担忧,国内 和国际股票和债券市场已经经历并可能继续经历加剧的波动和动荡。如果这些经济状况和担忧持续或恶化,且 市场继续动荡,我们的经营业绩和流动性可能在许多方面受到这些因素的不利影响, 包括对我们某些产品的需求减弱,以及在必要时使我们更难筹集资金,以及我们的股价 可能下跌。此外,虽然我们计划主要在美国销售我们的产品,但我们将来可能拥有拥有广泛全球业务的合作伙伴,从而间接地使我们面临风险。
如果我们的内部计算机系统出现故障,我们的业务和运营将受到影响。
尽管 实施了安全措施,但我们的计算机系统以及我们当前和未来的合作伙伴、承包商和顾问的计算机系统 很容易受到计算机病毒、未经授权的访问、自然灾害、恐怖主义、战争、电信和电气故障 的损害。虽然迄今为止,我们尚未经历任何此类重大系统故障、事故或安全漏洞,但如果此类事件 发生并导致我们的运营中断,则可能导致我们的制造活动、开发 计划和业务运营发生重大中断。例如,已完成或将来的临床试验中的生产记录或临床试验数据丢失,可能导致我们的监管审批工作延迟,并显著增加我们恢复或复制数据的成本 。如果任何中断或安全漏洞会导致我们的数据或应用程序丢失或损坏,或 机密或专有信息的不当披露,我们可能会承担责任,并且我们的产品和候选产品的进一步商业化和开发 可能会被延迟。
| 42 |
我们 越来越依赖信息技术,我们的系统和基础设施面临一定的风险,包括网络安全 和数据泄露风险。
我们的信息技术系统发生重大中断或信息安全遭到破坏,可能会对我们的业务产生不利影响。在正常的业务过程中,我们收集、存储和传输大量机密信息,因此我们必须以安全的方式 确保此类机密信息的机密性和完整性。我们的信息技术 系统以及与我们签订合同的第三方供应商的系统的规模和复杂性使得此类系统可能容易受到服务中断和安全破坏的影响,原因包括我们的员工、合作伙伴或供应商的疏忽或故意行为、恶意第三方的攻击,或者我们或第三方维护的系统基础设施的故意或意外物理损坏。对这些机密、专有或商业秘密信息进行保密对于我们的竞争业务地位非常重要。虽然我们 已采取措施保护此类信息并投资于信息技术,但不能保证我们的努力将 防止系统中的服务中断或安全漏洞,或可能对我们的业务运营产生不利影响或导致关键或敏感信息丢失、传播或误用的机密信息的未经授权或无意中的错误使用或泄露。违反我们的安全措施或意外丢失、无意披露、未经批准的传播、挪用或滥用商业秘密、专有信息或其他机密信息,无论是由于盗窃、黑客攻击、欺诈、 欺骗或其他形式的欺骗或任何其他原因,都可能使其他人生产竞争产品、使用我们的专有技术或信息,或对我们的业务或财务状况产生不利影响。此外,任何此类中断、安全漏洞、机密信息的丢失或泄露都可能对我们造成财务、法律、业务和声誉损害,并可能对我们的业务、财务状况、运营结果或现金流造成重大不利影响。
由于 我们主要是远程工作人员,我们可能会面临更高的业务连续性和网络风险,这可能会严重损害我们的业务 和运营。
COVID—19大流行使我们改变了我们的业务做法,迁移到主要是远程工作场所,我们的员工通过家庭或其他网络远程访问我们的服务器以履行他们的工作职责。虽然我们的大部分操作都可以 远程执行,并且目前正在有效地运行,但无法保证这种情况会持续下去,也无法保证我们在远程工作时 将继续保持同样有效,因为我们的团队分散,许多员工可能有其他个人需求需要处理 ,(例如照顾因学校关闭或家庭成员生病而导致的儿童),雇员本身可能会生病 而无法工作。随着条件的改善和限制的取消,返回工作岗位过程中也存在类似的不确定性 。此外,虽然我们采取了额外的保护措施来保护数据安全和隐私,但远程工作人员会给我们的用户基础架构和第三方带来额外的 压力,这些压力很难缓解。这些风险包括影响 工作连续性和效率的家庭互联网可用性,以及对第三方通信工具(如即时消息和在线 会议平台)的额外依赖性。
与我们知识产权相关的风险
未能充分保护我们的知识产权可能会对我们的业务、财务状况和经营成果造成不利影响。
我们的业务依赖于我们的知识产权和专有技术,而知识产权和专有技术的保护对我们业务的成功至关重要。 我们依靠商标、版权和商业秘密法律、许可协议、知识产权转让协议、 和保密程序来保护我们的知识产权。此外,我们依靠专有信息(如行业 秘密、技术诀窍和机密信息)来保护可能无法申请专利的知识产权,或者我们认为通过不需要公开披露的方式保护最好的知识产权。我们通常试图通过要求代表我们开发知识产权的员工和顾问签订保密协议和发明转让协议,以及与我们共享信息的第三方签订保密协议来保护我们的知识产权、技术和机密信息。这些协议 可能无法有效防止未经授权使用或披露我们的机密信息、知识产权或技术,并且在未经授权使用或披露我们的机密信息或技术或侵犯我们的知识产权的情况下, 可能无法提供足够的补救措施。例如,我们可能无法达成必要的协议,即使签订了这些协议,这些协议 也可能被故意违反或以其他方式无法阻止披露、第三方侵犯或挪用我们的专有 信息,其期限可能受到限制,并且可能无法在未经授权披露或使用 专有信息的情况下提供足够的补救措施。此外,我们的专有信息可能会被我们的竞争对手 或其他第三方知道或独立开发。如果我们的员工、顾问、承包商和其他第三方在为我们工作时使用他人拥有的知识产权,则可能会就相关或由此产生的专有技术和发明的权利产生争议。执行和确定我们的知识产权和其他专有权利的范围可能需要昂贵且耗时的诉讼,如果不能获得或维护对我们专有信息的保护,可能会对我们的竞争业务 地位产生不利影响。
| 43 |
尽管 我们努力保护我们的所有权,但其他方可能无意或故意披露、获取或使用我们的技术 或系统,这可能使未经授权的方复制我们平台或其他软件、技术和功能的某些方面,或 获取和使用我们认为专有的信息。此外,未经授权的方还可能试图或成功尝试通过各种方法获得我们的知识产权、机密信息和商业秘密,包括通过从我们的网站或移动应用程序中抓取 公共数据或其他内容、网络安全攻击以及保护 这些数据的法律或其他方法可能不充分。监视未经授权使用和披露我们的知识产权、专有技术或机密信息 可能是困难和昂贵的,我们无法确定我们采取的步骤将防止滥用或侵犯我们的知识产权或专有权利 。
我们 为我们在业务中使用的网站注册了域名,例如 www.zyversa.com和其他变种。本招股说明书中包含的网站地址不包括或通过引用将本公司网站上的信息并入本招股说明书。
竞争对手 已经并可能继续采用与我们类似的服务名称,从而损害我们建立品牌标识的能力,并可能导致 用户困惑。此外,与我们的商标相似的其他商标的所有者可能会提起商号或商标侵权索赔 。此外,未来可能需要向美国专利商标局或美国及海外的其他政府机构和行政机构提起诉讼或诉讼,以强制执行我们的知识产权,并确定他人专有权利的有效性和范围。我们发起的任何有关第三方侵犯我们知识产权的诉讼都可能代价高昂且耗时,并可能导致我们的知识产权无效或无法强制执行,否则可能会给我们带来负面后果。即使我们就此类侵权行为起诉其他方 ,此类诉讼也可能对我们的业务产生不利后果。此外,我们可能无法及时或成功地申请专利或注册我们的商标或以其他方式保护我们的知识产权,这可能会对我们的市场份额、财务状况和运营结果造成负面影响。我们为保护、维护或执行我们的专有权所做的努力在未来可能不会受到尊重,或者可能会被无效、规避或挑战,并可能导致巨额成本和资源转移 ,这可能会对我们的业务、财务状况和经营业绩产生不利影响。
我们 可能无法继续使用我们在业务中使用的域名,或阻止第三方获取和使用侵犯、类似或以其他方式降低我们品牌、商标或服务标记价值的域名。
我们 已注册在我们的业务中使用或与我们的业务相关的域名。如果我们失去使用域名的能力,无论是由于商标主张、未能续订适用注册或任何其他原因,我们可能被迫使用新域名销售我们的产品,这可能会对我们造成重大损害,或者为了购买相关域名的权利而产生巨额费用 。由于各种原因,我们可能无法在美国以外获得首选域名,包括因为 这些域名已被其他人持有。此外,我们的竞争对手和其他公司可以尝试通过使用与我们的域名类似的域名来利用我们的品牌认知度。我们可能无法阻止第三方获取和使用侵犯、类似或以其他方式降低我们的品牌或商标或服务标记的价值的域名。保护、维护和执行我们在域名中的权利可能需要诉讼,这可能会导致巨额成本和资源转移,这可能会对我们的业务、财务状况和运营业绩产生不利影响。
| 44 |
最近的 专利改革立法可能会增加围绕我们专利申请的起诉以及我们未来专利的执行 或辩护的不确定性和成本。
我们 获得专利的能力是高度不确定的,因为迄今为止,一些法律原则仍未得到解决,在美国专利中允许的权利要求的广度或解释方面,还没有一致的 政策,并且支持和解释专利权利要求所必需的专利和专利申请的具体内容,由于 相关法律、科学、和事实问题。美国 和其他国家的专利法或专利法解释的变更可能会降低我们知识产权的价值或缩小我们的专利保护范围。
For example, on September 16, 2011, the Leahy-Smith America Invents Act, or the Leahy-Smith Act, was signed into law. The Leahy-Smith Act includes a number of significant changes to United States patent law. These include provisions that affect the way patent applications will be prosecuted and may also affect patent litigation. The United States Patent and Trademark Office (the “USPTO”) has developed new and untested regulations and procedures to govern the full implementation of the Leahy-Smith Act, and many of the substantive changes to patent law associated with the Leahy-Smith Act, and in particular, the first to file provisions, became effective in March 2013. The Leahy-Smith Act has also introduced procedures making it easier for third parties to challenge issued patents, as well as to intervene in the prosecution of patent applications. Finally, the Leahy-Smith Act contains new statutory provisions that require the USPTO to issue new regulations for their implementation, and it may take the courts years to interpret the provisions of the new statute. It is too early to tell what, if any, impact the Leahy-Smith Act will have on the operation of our business and the protection and enforcement of our intellectual property. However, the Leahy-Smith Act and its implementation could increase the uncertainties and costs surrounding the prosecution of our patent applications and the enforcement or defense of our future patents. Further, the U.S. Supreme Court has ruled on several patent cases in recent years, either narrowing the scope of patent protection available in certain circumstances or weakening the rights of patent owners in certain situations. In addition to increasing uncertainty with regard to our ability to obtain patents in the future, this combination of events has created uncertainty with respect to the value of patents, once obtained. Depending on actions by the U.S. Congress, the federal courts and the USPTO, the laws and regulations governing patents could change in unpredictable ways that would weaken our ability to obtain new patents or to enforce patents that we have owned or licensed or that we might obtain in the future. An inability to obtain, enforce, and defend patents covering our proprietary technologies would materially and adversely affect our business prospects and financial condition.
Similarly, changes in patent laws and regulations in other countries or jurisdictions or changes in the governmental bodies that enforce them or changes in how the relevant governmental authority enforces patent laws or regulations may weaken our ability to obtain new patents or to enforce patents that we may obtain in the future. Further, the laws of some foreign countries do not protect proprietary rights to the same extent or in the same manner as the laws of the United States. As a result, we may encounter significant problems in protecting and defending our intellectual property both in the United States and abroad. For example, if the issuance to us, in a given country, of a patent covering an invention is not followed by the issuance, in other countries, of patents covering the same invention, or if any judicial interpretation of the validity, enforceability, or scope of the claims, or the written description or enablement, in a patent issued in one country is not similar to the interpretation given to the corresponding patent issued in another country, our ability to protect our intellectual property in those countries may be limited. Changes in either patent laws or in interpretations of patent laws in the United States and other countries may materially diminish the value of our intellectual property or narrow the scope of our patent protection.
| 45 |
我们 可能无法在全球范围内保护我们的知识产权。
在世界各地所有国家对我们的候选产品进行专利申请、起诉和保护将是非常昂贵的。 在某些国家,特别是发展中国家,对专利性的要求可能有所不同。此外,某些外国 的法律对知识产权的保护程度不像美国的法律那样。因此,我们可能无法 阻止第三方在美国以外的所有国家实践我们的发明。竞争对手可能会在我们尚未获得专利保护的司法管辖区使用我们的技术 来开发自己的产品,此外,可能会向我们有专利保护的地区出口侵权 产品,但对侵权活动的执法力度不够。这些产品可能会与我们的产品竞争 ,我们的专利或其他知识产权可能不有效或不足以阻止它们竞争。
Many companies have encountered significant problems in protecting and defending intellectual property rights in foreign jurisdictions. The legal systems of certain countries, particularly certain developing countries, do not favor the enforcement of patents and other intellectual property protection, particularly those relating to pharmaceuticals, which could make it difficult for us to stop the infringement of our patents or marketing of competing products in violation of our proprietary rights generally. Proceedings to enforce our patent rights in foreign jurisdictions could result in substantial costs and divert our efforts and attention from other aspects of our business, could put our patents at risk of being invalidated or interpreted narrowly and our patent applications at risk of not issuing, and could provoke third parties to assert claims against us. We may not prevail in any lawsuits that we initiate and the damages or other remedies awarded, if any, may not be commercially meaningful. In addition, certain countries in Europe and certain developing countries have compulsory licensing laws under which a patent owner may be compelled to grant licenses to third parties. In those countries, we may have limited remedies if our patents are infringed or if we are compelled to grant a license to our patents to a third party, which could materially diminish the value of those patents. This could limit our potential revenue opportunities. Accordingly, our efforts to enforce our intellectual property rights around the world may be inadequate to obtain a significant commercial advantage from the intellectual property that we own or license. Finally, our ability to protect and enforce our intellectual property rights may be adversely affected by unforeseen changes in foreign intellectual property laws.
获得和维护我们的专利保护取决于遵守政府专利机构提出的各种程序、文件提交、费用支付和其他要求 ,如果不符合这些要求,我们的专利保护可能会减少或取消。
任何已发布专利的定期 维护费和年金费应在 专利有效期内分几个阶段向USPTO和外国专利代理机构支付。美国专利商标局和各种外国政府专利机构要求在专利申请过程中遵守一些程序、文件、费用支付和其他类似规定。虽然在许多情况下,意外失效可以根据适用规则通过支付逾期费或通过其他方式予以补救,但在某些情况下,不遵守 可能导致专利或专利申请的放弃或失效,从而导致 相关司法管辖区专利权的部分或全部丧失。可能导致专利或专利申请放弃或失效的违规事件包括 未能在规定时限内回应官方行动、未支付费用以及未能适当合法化和提交正式 文件。如果我们或我们的许可方未能保留涵盖我们候选产品的专利和专利申请,我们的竞争对手 可能会进入市场,这将对我们的业务产生不利影响。
如果 我们未能遵守我们在知识产权许可协议下的义务,我们可能会失去对我们业务非常重要的许可权 。
我们 是某些许可协议的一方,这些协议对我们施加了各种尽职调查、里程碑、版税、保险和其他义务。如果 我们未能遵守这些义务,相应的许可方可能有权终止许可,在这种情况下,我们可能 无法开发或销售受影响的候选产品。失去这些权利可能会对我们的业务、 财务状况、经营成果和前景造成重大不利影响。有关这些许可证安排的详细信息,请参阅业务- 战略联盟和安排.”
| 46 |
如果 我们因侵犯第三方知识产权而被起诉,费用高昂且耗时,而且不利的结果 可能会对我们的业务产生重大不利影响。
我们的 商业成功取决于我们开发、制造、营销和销售候选产品的能力,以及在不侵犯第三方所有权的情况下使用我们的专有技术 。我们不能保证营销和销售此类候选产品以及使用 此类技术不会侵犯现有或未来的专利。在与我们的候选产品相关的领域中,存在着大量由第三方拥有的美国和外国颁发的专利和未决专利申请 。随着生物技术和制药行业的扩张 以及更多专利的颁发,其他人可能会声称我们的候选产品、技术或交付方法 或使用侵犯其专利权的风险增加。此外,包括我们在内的行业参与者并不总是清楚哪些专利涵盖各种 药物、生物制剂、药物输送系统或其使用方法,以及哪些专利可能有效和可执行。因此,由于 在我们的领域中已颁发大量专利和提交了大量专利申请,可能存在第三方声称 他们拥有涵盖我们候选产品、技术或方法的专利权的风险。
此外,第三方的专利可能被我们的候选产品或专有技术侵犯或被指控侵犯。由于美国的某些专利申请可能在专利颁发之前保密, 由于美国和许多外国司法管辖区的专利申请通常在提交后18个月才公布,而且科学文献中的出版物通常落后于实际发现,因此我们不能确定其他人 没有就我们自己和授权内已颁发的专利或我们正在处理的申请所涵盖的技术提交专利申请。我们的竞争对手 可能已经提交了专利申请,并可能在未来提交,涵盖我们的候选产品或与我们类似的技术。任何此类专利申请可能优先于我们自己的和授权内的专利申请或专利,这可能进一步要求我们获得涵盖此类技术的已颁发专利的 权利。如果另一方提交了类似于我们拥有或授权给我们的发明的美国专利申请,则我们或在许可技术的情况下,许可人可能必须在美国参与干扰程序,以确定发明的优先权。
我们 可能面临或受到拥有专利或其他知识产权的第三方的未来诉讼的威胁,这些第三方声称我们的候选产品或专有技术侵犯了这些第三方的知识产权,包括根据《哈奇-瓦克斯曼法》第四款提起的诉讼。这些诉讼可能声称存在此类药物的现有专利权,此类诉讼可能代价高昂,并可能对我们的运营结果产生不利影响,并转移管理人员和技术人员的注意力,即使我们没有侵犯此类专利或针对我们的专利最终被认定为无效。 法院可能会裁定我们侵犯了第三方的专利,并将命令我们停止专利涵盖的活动 。此外,法院可能会命令我们为侵犯对方专利而向对方支付损害赔偿金。
由于专利侵权索赔,或为了避免潜在索赔,我们可能会选择或被要求向第三方寻求许可。 这些许可可能不按商业上可接受的条款提供,或者根本不适用。即使我们能够获得许可证,许可证 也可能要求我们支付许可费和/或版税,而授予我们的权利可能是非排他性的,这可能会导致我们的竞争对手获得相同的知识产权,或者此类权利可能是限制性的,并限制我们现在和未来的活动 。最终,如果由于实际或威胁的专利侵权索赔,我们或被许可人无法以可接受的条款获得许可,我们或被许可人可能会被阻止将产品商业化,或被迫停止我们业务的某些方面 。
除了可能对我们提出的侵权索赔外,我们还可能成为其他专利诉讼和其他诉讼的一方,包括 美国专利商标局宣布或批准的干扰、派生、重新审查或其他授权后诉讼,以及 外国关于我们当前或其他产品知识产权的类似诉讼。
在生物技术和制药行业中,一般都有大量涉及专利和其他知识产权的诉讼。到目前为止,还没有人对我们提起过侵权诉讼。如果第三方声称我们侵犯了其知识产权,我们可能会面临许多问题,包括:
| ● | 侵权 和其他知识产权索赔,无论案情如何,提起诉讼都可能既昂贵又耗时,并可能转移我们管理层对核心业务的注意力。 |
| ● | 大量的侵权损害赔偿,如果法院判定争议产品或技术侵犯或侵犯第三方的权利,我们可能需要支付 ,如果法院认定侵权是故意的,我们可能被勒令支付三倍损害赔偿金 和专利权人的律师费; |
| 47 |
| ● | a 法院禁止我们销售或授权产品或使用技术,除非第三方授权其知识产权 我们的财产权,这是不需要做的; |
| ● | 如果 如果许可证可从第三方获得,我们可能需要支付大量的版税或前期费用,或向知识产权授予交叉许可证 我们的产品或技术的产权;以及 |
| ● | 重新设计我们的产品或流程,使其不会侵权,这可能是不可能的,也可能需要大量的金钱支出和 时间。 |
我们的一些竞争对手 可能比我们更有效地承担复杂专利诉讼的费用,因为他们拥有大量 的资源。此外,任何诉讼的发起和持续产生的任何不确定性都可能损害我们筹集额外资金的能力,或以其他方式对我们的业务、财务状况、经营业绩和前景造成不利影响。
由于 我们依赖某些第三方许可人和合作伙伴,并且在未来将继续这样做,如果我们的许可人或合作伙伴 因侵犯第三方的知识产权而被起诉,我们的业务、财务状况、经营成果和前景 可能会以与我们被直接起诉相同的方式受到影响。除了面临诉讼风险外,我们还同意赔偿某些 第三方许可人和合作伙伴,使其免受因我们的专有技术引起的侵权索赔,我们已经或可能 与我们的一些许可方和合作伙伴签订了费用分摊协议,这些协议可能要求我们支付专利诉讼的部分费用 对这些第三方提起诉讼,无论指称的侵权行为是否由我们的专有技术引起。在某些情况下, 这些费用分摊协议还可能要求我们承担比仅基于我们的技术承担的更大的侵权损害赔偿责任。
发生上述任何情况都可能对我们的业务、财务状况或经营业绩产生不利影响。
我们 可能会卷入诉讼,以保护或执行我们的专利或其他知识产权或我们的许可方的专利, 这可能是昂贵和耗时的。
竞争对手 可能会侵犯我们的知识产权,包括我们的专利或我们许可方的专利。因此,我们可能需要提交 侵权索赔以阻止第三方侵权或未经授权的使用。这可能既昂贵又耗时,尤其是对于我们这样规模的公司。此外,在侵权诉讼中,法院可以裁定我们的专利无效或不可强制执行, 或者可以以我们的专利主张不包括我们的技术 或未满足对侵权者授予禁令所需的因素为理由,拒绝阻止另一方使用所涉技术。对任何诉讼或其他诉讼的不利裁决可能会使我们的一项或多项专利面临被无效、狭义解释或修改的风险,从而使它们 不涵盖我们的候选产品。此外,这种不利的裁决可能会使我们的专利申请面临无法发布的风险, 或者发布的范围有限且可能不足以涵盖我们的候选产品或阻止其他公司销售类似的产品 。
对于 我们或我们的许可人或潜在合作伙伴的专利申请,可能需要向USPTO提起干涉、 衍生或其他诉讼来确定发明的优先权或专利性。我们提起的诉讼或USPTO程序可能会失败,或者 可能会被第三方援引来对我们不利。即使我们取得了成功,国内或国外的诉讼或美国专利商标局或外国专利局 的诉讼程序也可能导致大量成本和分散我们的管理。我们可能无法单独或与我们的许可人或潜在的 合作伙伴一起防止盗用我们的所有权,特别是在法律可能不像美国那样充分保护此类权利的国家 。
此外, 由于知识产权诉讼或其他诉讼程序需要大量的发现,因此在此类诉讼或其他诉讼程序中,我们的一些机密信息可能会因披露而泄露。 此外,在此类诉讼或诉讼程序的过程中,可能会公开宣布听证结果、 动议或其他临时程序或事态发展,或公开访问相关文件。如果投资者认为这些结果是负面的,我们普通股或认股权证的市场价格可能会受到严重损害。
| 48 |
我们 对第三方的依赖要求我们分享我们的商业秘密,这增加了我们的商业秘密被盗用 或泄露的可能性,而且与员工和第三方签订的保密协议可能无法充分防止商业秘密的泄露 和保护其他专有信息。
我们 认为专有的商业秘密或机密技术和非专利技术对我们的业务非常重要。我们可能依赖商业秘密 或机密技术来保护我们的技术,特别是当我们认为专利保护价值有限时。
为保护此类信息不被竞争对手披露或窃取,我们的政策是要求我们的员工、顾问、合作者、承包商和顾问在开始研究或披露专有信息之前与我们签订保密协议以及材料转让协议、咨询 协议或其他类似协议。这些协议通常 限制第三方使用或披露我们的机密信息的权利,包括我们的商业秘密。但是,现任或前任员工、顾问、合作者、承包商和顾问可能会无意或故意向竞争对手泄露我们的机密信息,保密协议可能无法在未经授权泄露机密信息的情况下提供足够的补救措施。共享商业秘密和其他机密信息的需要增加了此类商业秘密 被我们的竞争对手知晓、被无意中纳入其他人的技术中、或在违反这些协议的情况下被披露或使用的风险。鉴于我们的专有地位在一定程度上基于我们的技术诀窍和商业秘密,竞争对手发现我们的商业秘密或其他未经授权的使用或披露将损害我们的竞争地位,并可能对我们的业务和运营结果产生不利影响。强制要求第三方非法获取并使用商业秘密或机密专有技术是昂贵、耗时且不可预测的。保密协议的可执行性因司法管辖区而异。
此外,这些协议通常会限制我们的员工、顾问、合作者、承包商和顾问发布可能与我们的商业秘密有关的数据的能力,尽管我们的协议可能包含某些有限的发布权。尽管我们努力保护我们的商业秘密,但我们的竞争对手可能会通过违反我们与第三方的协议、通过我们的任何第三方合作者独立开发或发布信息来发现我们的商业秘密。竞争对手发现我们的商业机密将损害我们的竞争地位,并对我们的业务产生不利影响。
我们 可能会受到以下指控的影响:我们的员工、顾问或独立承包商错误地使用或向我们披露了他们的前雇主或他们的以前或现在的客户的所谓商业机密。
由于 在生物技术和制药行业很常见,我们的某些员工以前受雇于其他生物技术 或制药公司,包括我们的竞争对手或潜在竞争对手。此外,我们聘请顾问帮助我们开发我们的产品和候选产品,其中许多人以前受雇于或可能以前受雇于或正在为其他生物技术或制药公司提供咨询服务,包括我们的竞争对手或潜在的 竞争对手。我们可能会受到指控,称这些员工和顾问或我们无意中或以其他方式使用或泄露了他们的前雇主或他们的前或现在客户的商业秘密或其他专有信息。虽然我们目前还不知道有任何此类索赔被指控,但如果发生此类索赔,可能需要提起诉讼来对抗任何此类索赔。 即使我们成功地抗辩了任何此类索赔,任何此类诉讼都可能旷日持久、代价高昂,分散我们管理团队的注意力,投资者和其他第三方并不看好我们,并可能导致不利的结果。
如果我们的专利期在我们的产品获得批准之前或之后不久到期,或者如果仿制药或生物相似药物制造商成功挑战我们的专利,我们的业务可能会受到实质性损害。
专利 的有效期有限。在美国,如果及时支付所有维护费,专利的自然失效时间通常为自其在美国最早的非临时申请日期起计的二十(20)年。可能有各种延期,但专利的有效期及其提供的保护是有限的。即使获得了涵盖我们候选产品、其制造或用途的专利,但一旦专利有效期过期,我们可能会面临来自竞争性药物的竞争,包括仿制药或生物相似药物。
| 49 |
根据我们候选产品的FDA上市批准的时间、期限和条件,我们的一项或多项美国专利 可能有资格根据1984年的《药品价格竞争和专利期限恢复法》(简称《哈奇-瓦克斯曼法》)和欧盟的类似立法获得有限的专利期延长。《哈奇-瓦克斯曼法案》允许涵盖经批准产品的专利的专利期延长最多 至五年,以补偿在产品开发和FDA监管审查过程中失去的有效专利期。专利期限的延长不能超过自产品批准之日起的14年 ,并且只能延长一项适用于经批准的药物的专利。但是,如果我们未能在适用的截止日期内提出申请、未能在相关专利到期前提出申请或未能 满足适用的要求,我们可能得不到延期。此外,延期的长度可能比我们要求的要短。如果我们无法获得专利 延期,或者任何此类延期的期限比我们要求的要短,我们可以对该产品执行专利权的期限将缩短,我们的竞争对手可能会比我们预期的更早获得批准,将竞争产品推向市场。此外,我们在任何专利期延展期内排除的权利的范围可能是有限的,也可能不包括竞争对手的产品或 产品的使用。因此,我们来自适用产品的收入可能会减少,可能会大幅减少。
考虑到新药候选药物的开发、测试和监管审查所需的时间,保护此类候选药物的专利可能会在这些候选药物商业化之前或之后不久到期。因此,我们的专利和专利申请可能无法 为我们提供足够的权利来排除其他人将与我们相似或相同的产品商业化。上述任何一项 都可能对我们的竞争地位、业务、财务状况、经营结果和前景产生重大不利影响。
仿制药或生物类似药的制造商 可能会在法庭或专利局对我们专利的范围、有效性或可转让性提出质疑, 我们可能无法成功执行或捍卫这些知识产权,因此可能无法开发 或专门销售相关产品,这将对该产品的任何潜在销售产生重大不利影响。当我们已颁发的专利或可能由我们待决专利申请颁发的专利到期时,我们将无法向潜在竞争对手主张此类专利权,我们的业务和经营成果可能会受到不利影响。
如果我们的商标和商号得不到充分保护,我们可能无法在我们感兴趣的市场建立知名度 ,我们的业务可能会受到不利影响。
我们的 未注册商标或商品名称可能会受到质疑、侵权、规避或宣布为通用商标或被确定为侵犯 其他商标。我们可能无法保护我们对这些商标和商号的权利,而我们需要在我们感兴趣的市场中建立起潜在合作者或客户的名称认知 。有时,竞争对手可能采用与我们相似的商品名称或商标,从而阻碍我们建立品牌标识的能力,并可能导致市场混乱。此外,其他注册商标或包含我们未注册商标或商号变体 的商标所有者可能会提出 商号或商标侵权索赔。从长远来看,如果我们无法成功注册我们的商标和商号并根据我们的商标和商号建立名称识别,那么我们可能无法有效竞争,我们的 业务可能会受到不利影响。我们执行或保护我们与商标、商业秘密、域名 、版权或其他知识产权相关的所有权的努力可能无效,并可能导致巨额成本和资源转移 ,并可能对我们的财务状况或运营结果造成不利影响。
我们的 专有信息可能会丢失,或者我们可能会遭受安全漏洞。
在 日常业务过程中,我们在数据 中心和网络中收集和存储敏感数据,包括知识产权、临床试验数据、专有 业务信息、临床试验受试者和员工的个人数据和个人身份信息。安全处理、维护和传输这些信息对我们的运营至关重要。尽管 我们采取了安全措施,但我们的信息技术和基础设施仍可能容易受到黑客攻击,或因员工 错误、渎职或其他中断而遭到破坏。尽管据我们所知,迄今为止,我们还没有遇到任何此类重大安全漏洞, 任何此类漏洞都可能危及我们的网络,并且存储在网络中的信息可能会被访问、公开披露、丢失或被盗。 任何此类访问、披露或其他信息丢失都可能导致法律索赔或诉讼、 保护个人信息隐私的法律责任、重大监管处罚、扰乱我们的运营、损害我们的声誉并导致 对我们和我们开展临床试验的能力失去信心,这可能会对我们的声誉造成不利影响,并延迟我们候选产品的临床开发 。
| 50 |
与上市公司相关的风险
我们的 管理团队管理上市公司的经验有限,可能无法成功管理我们向上市公司地位的过渡。
我们管理团队的大多数 成员在管理上市公司、与上市公司投资者互动以及遵守与上市公司相关的日益复杂的法律方面的经验有限。我们的管理团队可能无法成功或有效地 管理向上市公司的过渡,而上市公司将受到 联邦证券法规定的重大监管监督和报告义务,并受到证券分析师和投资者的持续审查。这些新的义务和组成部分 需要我们的高级管理层高度关注,可能会分散他们对 业务的日常管理的注意力,这可能会损害我们的业务、经营成果和财务状况。
作为一家上市公司,我们 产生了显著增加的费用和行政负担,这可能会对我们的业务、财务状况和经营业绩产生不利影响。
作为一家上市公司,我们面临着更多的法律、会计、行政和其他成本和费用,这是我们作为私营公司没有发生的 ,在我们不再是一家“新兴成长型公司”后,这些费用可能会增加得更多。萨班斯-奥克斯利法案,包括第404节的要求,以及后来由美国证券交易委员会实施的规则和条例,2010年的多德-弗兰克华尔街改革和消费者保护法及其颁布和即将颁布的规则和条例,美国上市公司会计准则委员会和证券交易所以及纳斯达克的上市标准,要求上市公司承担额外的报告和其他义务。
遵守上市公司的要求会增加成本,并使某些活动更加耗时。其中许多要求 将要求我们执行以前未执行的活动。例如,我们成立了新的董事会委员会,签订了新的保险单,并采用了新的内部控制和披露控制程序。此外,还将产生与 美国证券交易委员会报告要求相关的费用。此外,如果在遵守这些要求方面发现任何问题(例如, 如果管理层或我们的独立注册会计师事务所发现财务报告的内部控制存在重大弱点),我们可能会产生纠正这些问题的额外成本,这些问题的存在可能会对我们的声誉 或投资者对我们的看法产生不利影响,并且获得董事和高级管理人员责任保险的成本可能会更高。与我们上市公司身份相关的风险可能会使我们更难吸引和留住合格的人员加入我们的董事会或担任高管 。此外,作为一家上市公司,我们可能会受到股东激进主义的影响,这可能会导致巨额成本,分散管理层的注意力,并以我们目前没有预料到的方式影响我们运营业务的方式。由于在本招股说明书和上市公司要求的备案文件中披露信息,我们的业务和财务状况将变得更加可见,这可能会导致威胁或实际的诉讼,包括竞争对手和其他第三方的诉讼。如果此类索赔成功, 我们的业务和运营结果可能会受到实质性的不利影响,即使索赔不会导致诉讼或得到对我们有利的解决方案,这些索赔以及解决这些索赔所需的时间和资源可能会分散我们管理层的资源 ,并对我们的业务和运营结果产生不利影响。这些规则和法规规定的额外报告和其他义务将增加法律和财务合规成本以及相关法律、会计和行政活动的成本。 这些增加的成本将要求我们转移大量原本可以用于扩大业务和实现战略目标的资金。股东和第三方的倡导努力还可能促使治理和报告要求发生更多变化,这可能会进一步增加成本。
| 51 |
上市公司的 要求可能会使我们的资源紧张,分散管理层的注意力,并影响我们吸引和留住合格董事会成员的能力。
我们 须遵守经修订的1934年《证券交易法》(以下简称《交易法》)、《萨班斯-奥克斯利法案》及其下颁布的任何规则以及纳斯达克的报告要求。这些规则和法规的要求增加了我们的法律和财务合规成本,使某些活动更加困难、耗时或成本高昂,并增加了对我们的系统和资源的需求 。《萨班斯-奥克斯利法案》(Sarbanes-Oxley Act)要求我们保持有效的披露控制和程序以及财务报告的内部控制。为了维持并在必要时改进我们的信息披露控制和程序以及财务报告的内部控制以达到这一标准,将需要大量资源和管理监督,因此,管理层的注意力可能会从其他业务事项上转移。这些规章制度还会使我们更难吸引和留住合格的独立董事会成员。此外,这些规章制度 使我们获得董事和高级管理人员责任保险变得更加困难和昂贵。我们可能被要求接受降低的 承保范围或产生更高的费用才能获得承保。遵守上市公司报告要求的成本增加 ,以及我们可能无法满足这些要求,可能会对我们的运营、业务、财务状况 或运营结果产生重大不利影响。
为了履行作为上市公司的义务,我们需要聘请具有适当上市公司经验的合格会计和财务人员。
作为一家新成立的上市公司,我们将需要改进和保持有效的信息披露和财务控制,并在我们的公司治理实践中做出改变。我们可能需要招聘更多具有适当上市公司经验和技术会计知识的会计和财务人员,招聘和留住这些人员可能会有困难。即使我们能够雇用合适的人员,我们现有的运营费用和运营也将受到雇用他们的直接成本以及与从研发工作中转移管理资源相关的间接后果的影响。
我们 是一家新兴成长型公司,任何决定只遵守适用于新兴成长型公司的某些减少的报告和披露要求 都可能会降低我们的普通股对投资者的吸引力。
根据《就业法案》的定义,我们 是一家新兴成长型公司。只要我们继续是一家新兴成长型公司,我们就可以选择利用适用于其他上市公司但不适用于“新兴成长型公司”的各种报告要求的豁免,包括:
| ● | 不要求独立注册会计师事务所根据萨班斯-奥克斯利法案第404节对我们的财务报告进行内部控制; |
| ● | 简化 在我们的定期报告和10—K表格的年度报告中披露有关高管薪酬的义务;以及 |
| ● | 豁免 就高管薪酬和股东批准任何黄金降落伞举行非约束性咨询投票的要求 以前未批准的款项。 |
因此, 股东可能无法访问他们认为重要的某些信息。我们作为新兴增长型公司的地位将在发生以下任何一种情况时终止:
| ● | 每年收入最少为10.7亿元的财政年度的最后一天; |
| ● | 我们有资格成为“大型加速申报人”的日期,其中至少有7亿美元的股权证券由非关联公司持有; |
| ● | 我们在任何三年期内发行超过10亿美元的不可转换债务证券的日期;或 |
| ● | 在Larkspur IPO五周年后结束的财年最后一天。 |
| 52 |
根据《就业法案》,新兴成长型公司还可以推迟采用新的或修订的会计准则,直到这些准则 适用于私营公司。我们可能会选择利用这一延长的过渡期,因此,我们的财务报表可能无法与类似情况的上市公司进行比较。
如果我们选择依赖新兴成长型公司提供的任何豁免,我们 无法预测投资者是否会发现我们的普通股吸引力降低。如果一些投资者因为我们依赖任何这些豁免而发现我们的普通股吸引力下降,我们的普通股可能会出现 不那么活跃的交易市场,我们普通股的市场价格可能会更加波动,可能会下降。
如果我们未能对财务报告保持有效的披露控制和内部控制系统,我们编制及时准确的财务报表或遵守适用法规的能力可能会受损,这可能会对投资者 对我们的信心产生不利影响,从而影响我们普通股的市场价格。
作为一家上市公司,我们将被要求遵守《萨班斯—奥克斯利法案》的要求,其中包括我们 维持有效的披露控制和程序以及对财务报告的内部控制。我们将继续制定和完善 我们的披露控制措施和其他程序,以确保我们在提交给SEC的报告中披露的信息 在SEC规则和表格中规定的时间段内得到记录、处理、汇总和报告,并确保根据《交易法》要求在报告中披露的信息得到累积并传达给我们的管理层,包括我们的首席执行官和财务官。
我们 必须继续改进财务报告的内部控制。我们将被要求对我们的财务报告内部控制的有效性进行正式评估,一旦我们不再是一家新兴成长型公司,我们可能会被要求 包括由我们的独立注册会计师事务所出具的关于财务报告内部控制的证明报告。为了在规定的时间内实现这些要求的合规,我们将参与一个流程 来记录和评估我们对财务报告的内部控制,这既昂贵又具有挑战性。在这方面,我们 将需要继续投入内部资源,可能聘请外部顾问,并采用详细的工作计划,以评估和记录我们对财务报告的内部控制的充分性,通过测试验证控制 是否如文件所述发挥作用,并实施持续的报告和改进财务报告的内部控制流程 。存在这样的风险,即我们无法在规定的时间内或根本无法得出结论,即我们对财务报告的内部控制是有效的,符合萨班斯-奥克斯利法案第404条的要求。此外,我们的测试,或我们的独立注册会计师事务所随后进行的测试,可能会揭示我们在财务报告方面的内部控制 存在其他被认为是重大弱点的缺陷。
任何 未能实施和保持有效的披露控制和程序以及财务报告的内部控制,包括确定一个或多个重大弱点,都可能导致投资者对我们 财务报表和报告的准确性和完整性失去信心,这可能会对我们普通股的市场价格产生不利影响。此外,我们可能 受到我们普通股上市的证券交易所、美国证券交易委员会和其他监管机构的制裁或调查。
在这方面,在2022财年的审计期间,我们发现财务报告的内部控制存在重大弱点 ,因为我们没有设计和实施对重大和复杂的非常规交易的会计进行有效控制。 见“风险因素--我们发现财务报告的内部控制存在重大缺陷。如果我们不能 弥补重大弱点并以其他方式维持有效的财务报告内部控制系统,我们财务报告的可靠性、投资者对我们的信心和我们普通股的价值可能会受到不利影响.”
我们 可能会受到证券诉讼的影响,这是昂贵的,可能会转移管理层的注意力。
我们普通股的每股价格可能会波动,在过去,经历过股票市场价格波动的公司会受到证券诉讼,包括集体诉讼。此类诉讼可能导致 巨额费用和转移管理层的注意力和资源,这可能对我们的业务、财务状况和运营结果产生实质性的不利影响。诉讼中任何不利的裁决也可能使我们承担重大责任。
由于 我们是通过传统的承销首次公开发行以外的方式成为上市公司的,我们的股东可能面临 额外的风险和不确定性。
由于我们通过完善业务合并而不是通过传统的承销首次公开募股的方式成为一家上市公司,因此没有独立的第三方承销商出售我们普通股的股票,因此,我们的 股东将无法受益于通常由独立承销商在公开证券发行中执行的独立审查和调查类型。尽职调查审查通常包括对公司、任何顾问及其各自附属公司的背景进行独立调查,审查发售文件,并对业务计划和任何潜在的财务假设进行独立分析。
虽然 我们对Old ZyVersa进行了与业务合并有关的尽职调查和调查,但缺乏独立的 尽职调查和调查增加了投资我们证券的风险,因为我们的尽职调查和调查 可能没有发现对潜在投资者很重要的事实。
此外,由于我们没有通过传统的承销首次公开募股方式成为上市公司,证券 或行业分析师可能不会提供或不太可能提供我们的保险。投资银行也可能不太可能同意 代表我们承销二次发行,而如果我们通过传统的 承销首次公开募股成为一家上市公司,他们可能会不太了解我们,因为分析师和 媒体的报道更加有限。未能获得我们普通股市场的研究覆盖或支持,可能会对我们开发普通股流动性市场的能力产生不利影响。
| 53 |
与本次发行和我们证券所有权相关的风险
我们普通股的 活跃交易市场可能永远不会发展或维持下去。
虽然 我们的普通股在纳斯达克上市,但我们股票的市场表现出不同水平的交易活动。如果一个活跃的交易 市场没有发展,或发展了但没有维持,由于有限的 公众持股量,您可能难以出售我们的任何普通股。我们无法预测我们普通股的交易价格。在未来的一个或多个时期,我们的 运营结果和产品管道的进展可能无法满足公众市场分析师和投资者的期望, 并且,由于这些和其他因素,我们的普通股价格可能会下跌。因此,我们不能向您保证您有能力 在需要时或以等于或高于您购买股份的价格出售您的普通股股份,或根本不出售。
我们普通股的市场价格可能会波动,这可能会给投资者带来重大损失。
我们普通股的 交易价格一直且可能继续高度波动,并可能会因各种因素(其中一些因素超出了我们的控制范围)而发生大幅度波动。
我们普通股的市场价格可能会因各种因素而波动,包括:
| ● | 开发和批准我们的候选产品; | |
| ● | 我们候选产品的发布和商业化时间(如果获得批准),以及此类发布和 商业化符合证券分析师和投资者的期望; | |
| ● | 实际 或我们经营业绩的预期波动,包括季度和年度业绩的波动; | |
| ● | 操作 费用超出预期; | |
| ● | 我们的任何产品开发和研究计划失败或中断; |
| 54 |
| ● | 更改 学术和研究实验室和机构的研究结构或资金,包括会影响 购买我们的仪器或消耗品的能力; | |
| ● | 现有或新的竞争性业务或技术的成功; | |
| ● | 公告 关于我们竞争对手的新研究项目或产品; | |
| ● | 发展 专利申请、授权专利或者其他知识产权的争议; | |
| ● | 关键人员的招聘或离职; | |
| ● | 诉讼 以及涉及我们、我们行业或两者的政府调查; | |
| ● | 法规 或美国和其他国家的法律发展; | |
| ● | 波动性 以及一般生命科学技术部门,或蛋白质组学或基因组学部门的市场条件的变化; | |
| ● | 投资者 对我们或我们行业的看法; | |
| ● | 与我们的任何研发项目或产品相关的费用水平; | |
| ● | 实际 或预期我们的财务业绩或开发时间表的估计发生变化,财务业绩的变化 或那些被认为与我们相似的公司的公司,或证券分析师的估计或建议发生变化,如果 任何,涵盖我们的普通股或被认为与我们相似的公司; | |
| ● | 如果 我们的财务业绩符合证券分析师或投资者的期望; | |
| ● | 宣布或预期额外的融资努力; | |
| ● | 销售 我们或我们的内部人士或其他股东持有我们的普通股; | |
| ● | 市场僵局或禁售协议到期; | |
| ● | 一般 经济、工业和市场状况;以及 | |
| ● | 流行病, 例如COVID-19大流行、自然灾害或重大灾难性事件。 |
无论我们的经营业绩如何,这些 市场和行业因素可能会大幅降低我们普通股的市场价格。
最近, 一般的股票市场,特别是生命科学技术公司的市场,经历了重大的价格和 交易量波动,这些波动通常与其股票正在经历这些价格和交易量波动的公司的经营业绩变化无关或不成比例。广泛的市场和行业因素可能会严重影响 我们普通股的市场价格,而不管我们的实际经营业绩如何。这些波动在我们的普通股和权证的交易市场上可能更加明显 。在公司证券市场价格出现这种波动的时期之后,证券 集体诉讼往往会针对该公司提起。
由于 我们普通股价格的潜在波动,我们将来可能会成为证券诉讼的目标。证券 诉讼可能导致大量成本,并分散管理层对我们业务的注意力和资源。
| 55 |
无法保证我们能够遵守纳斯达克的持续上市标准。
如果 纳斯达克因未能达到纳斯达克的上市标准而使我们的普通股在其交易所退市,我们和我们的股东可能面临重大的不利后果,包括:
| ● | 我们证券的市场报价有限; | |
| ● | 降低了我们证券的流动性; | |
| ● | a 确定我们的普通股是一种"廉价股",这将要求交易我们普通股的经纪商遵守 更严格的规则,并可能导致我们证券在二级交易市场的交易活动减少; | |
| ● | a 有限的新的和分析员覆盖范围;以及 | |
| ● | A 未来发行额外证券或获得额外融资的能力下降。 |
我们 未能遵守纳斯达克的持续上市要求,可能导致我们的普通股退市。
我们的 普通股目前在纳斯达克全球市场上市交易。我们必须满足 纳斯达克的持续上市要求,以维持我们的普通股在纳斯达克全球市场的上市。
2023年6月9日,公司收到纳斯达克的一封信函,表明根据公司普通股过去连续30个工作日的收盘出价,公司目前不符合维持每股1.00美元的最低出价的要求,以在纳斯达克全球市场继续上市,根据纳斯达克上市规则5550(a)(2)(“通知”)的规定。
根据纳斯达克上市规则第5810(C)(3)(A)条,我们 获得了180个历日的合规期,自通知之日起或至2023年12月6日,以重新遵守最低成交报价要求。
2023年11月14日,纳斯达克 向本公司发布信函称,截至2023年11月13日,确定本公司证券连续十个交易日的收盘价 为0.1美元或更低。因此,本公司须遵守上市规则 5810(C)(3)(A)(Iii)项下拟订立的条文。因此,纳斯达克决定于2023年11月16日将本公司的证券从纳斯达克全球市场退市,除非本公司及时要求在纳斯达克听证会小组(下称“小组”)举行听证会。因此,公司 及时要求并安排了小组听证会,纳斯达克的任何退市行动将被搁置,等待小组在听证会后发布决定以及小组可能批准的任何延长期届满。 在听证会上,公司将提交其计划,以证明其遵守规则的情况,并请求延长 这样做的时间。2023年10月31日,在公司股东周年大会上,公司股东批准了对公司第二份修订后的公司注册证书的修正案 ,对公司已发行的普通股进行反向股票拆分,比例不低于10股1股,不大于1股50股,具体比例 由公司董事会自行决定。该公司以35股1股的比例实施了这种 反向股票拆分,试图重新遵守规则。
不能保证将举行听证,也不能保证如果举行听证,专家组将作出有利的决定。
如果我们没有从评审团获得有利的决定,我们将被摘牌。
此外, 2023年9月1日,本公司收到纳斯达克的一封信,称在过去的连续30个营业日,本公司 不符合继续在纳斯达克全球市场上市的公开持有股票(“MVPHS”)最低市值为5,000,000美元的要求,如纳斯达克上市规则5450(b)(1)(C)所述。
| 56 |
根据纳斯达克上市规则第5810(C)(3)(D)条,本公司有180个历日,或至2024年2月28日,以恢复 遵守MVPHS的最低要求。要重新获得合规,公司普通股的最低MVPHS必须 在180个日历日合规期内至少连续十个工作日达到或超过5,000,000美元。
如果公司未能在2024年2月28日之前重新遵守MVPHS的最低要求,纳斯达克将向公司发出书面通知,通知其证券将被摘牌。或者,本公司也可以考虑申请将本公司的证券转让给纳斯达克资本市场。
公司打算从现在起至2024年2月28日监控其普通股的MVPHS,如果其普通股的交易水平不是很可能重新合规,公司将考虑可供公司使用的各种选择。
如果我们未来无法继续满足所有适用的纳斯达克全球市场要求,而纳斯达克决定将我们的普通股退市 ,退市可能会大幅减少我们普通股的交易量;由于失去与纳斯达克相关的市场效率和失去州证券法的联邦优先购买权,我们的普通股的市场流动性受到不利影响 ;对我们以可接受的条款获得融资的能力产生不利影响(如果有的话);并可能导致投资者、供应商、客户和员工潜在失去信心 ,减少业务发展机会。此外,我们普通股的市场价格可能会进一步下跌,股东可能会损失部分或全部投资。
除非 我们的普通股继续在国家证券交易所上市,否则它将受到所谓的 “便士股票” 限制销售行为的规则。
如果我们无法维持我们的普通股在纳斯达克或其他国家证券交易所的上市,如果我们的普通股的市值低于每股5.00美元,我们的普通股 可能会受到所谓的“细价股”规则的约束。 美国证券交易委员会通过的规定将细价股定义为包括任何市值低于每股5.00美元的股票, 受某些例外情况的限制,包括在国家证券交易所交易的股票例外。《美国证券交易委员会条例》对经纪自营商销售低价股的行为施加了 限制性销售要求,这些经纪自营商将低价股出售给美国证券交易委员会相关规则所定义的已建立客户和经认可的 投资者以外的人。这些额外的要求可能会阻碍经纪自营商对被归类为细价股的证券进行交易,这可能会严重限制此类证券的市场价格和流动性,以及购买者在二级市场出售此类证券的能力。这意味着,如果我们无法维持我们的普通股在国家证券交易所上市,股东在二级市场出售普通股的能力可能会受到不利影响 。
如果涉及细价股的交易不受美国证券交易委员会规则的约束,经纪自营商必须在交易前向每位投资者提交一份与细价股市场相关的披露明细表。经纪-交易商还必须披露支付给经纪-交易商及其注册代表的佣金、细价股票的当前报价,如果经纪-交易商是唯一的做市商,则经纪-交易商必须披露这一事实以及经纪-交易商对市场的假定控制。最后,必须发送每月对帐单 ,披露客户帐户中持有的细价股的最新价格信息,以及有关细价股的有限市场的信息。
我们 可能需要减记或注销、重组和减值或其他可能对我们的财务状况和普通股股价产生重大负面影响的费用 ,这可能会导致您的部分或全部投资损失。
我们 可能被迫在以后减记或注销资产、重组业务或产生减值或其他费用,从而导致 报告损失。可能会出现意想不到的风险,已知的风险可能会以以前没有预料到的方式出现。尽管这些 费用可能是非现金项目,不会对我们的流动性产生立竿见影的影响,但我们报告这种性质的费用的事实可能会导致市场对我们或我们的证券的负面看法。此外,这种性质的指控可能会导致我们违反杠杆或我们可能受到的其他契约。因此,我们的股东可能会因为任何此类减记或减记而遭受其 股票价值的缩水。
| 57 |
编制备考财务信息时使用的 假设可能不准确,其他因素可能会影响我们未来的财务状况 或经营成果。我们的财务状况或经营业绩的任何潜在下降都可能导致 我们的股价发生重大变化。
我们于2023年1月27日提交了对我们于2023年12月16日提交的当前8-K/A表格(“原始8-K/A”)的修正案(“修正案”);该修正案纯粹是为了完全取代原始8-K/A表格中包含的未经审计的形式简明的综合财务信息,该信息包括在我们的S-4表格中与业务组合有关的注册声明中。未经审核的备考简明综合财务资料先前反映管理层根据业务合并完成时可得的资料所作的估计,并会随着获得额外资料及进行分析而有所变动 。我们在分析完成后更新了未经审计的备考简明合并财务信息 ,以反映业务合并为ZyVersa治疗公司(“Old ZyVersa”)的远期合并,因为已确定Old ZyVersa为可变权益实体。未经审核的备考简明综合财务资料及其相关附注 反映对本公司收购的Old ZyVersa的资产净值作出的公允价值调整,该等净资产主要包括进行中的研究 及开发中的无形资产,该等无形资产为无限期的。由于未经审计的备考简明合并财务信息的变化,我们可能面临潜在的诉讼或其他纠纷,其中可能包括涉及我们股东的诉讼、援引联邦和州证券法的索赔、合同索赔或因此类变更而产生的其他索赔。截至本招股说明书发布之日,我们不知道有任何此类索赔、诉讼或纠纷。但是,我们不能保证此类索赔、诉讼或 纠纷不会在未来发生。任何此类索赔、诉讼或纠纷,无论胜诉与否,都可能对我们的业务、运营结果和财务状况产生重大不利影响。
我们 受到可能影响普通股市场价格的业务不确定性的影响。
关于我们业务或运营的不确定性 可能会影响我们与各自供应商、用户、分销商、许可人、 和被许可人之间的关系。任何此类影响都可能对我们和我们普通股的市场价格产生不利影响。这些不确定性可能导致 与我们打交道的各方寻求改变与他们的现有业务关系,并推迟或推迟有关我们的决策。 现有业务关系的变更(包括终止或修改)可能会对我们的收入、收益 和现金流以及我们普通股的市价产生负面影响。
此外, 事务可能需要投入时间和资源,否则这些时间和资源本可以用于其他可能对我们有利的机会。此外,业务合并可能会产生潜在的责任,包括由于与业务合并相关的未决和未来的股东诉讼。这些事项中的任何一项都可能对我们的业务、财务状况或运营结果产生不利影响。
| 58 |
第三方 可以终止或更改与我们的现有合同或关系。
与分销商、关联公司、房东、许可人和其他业务合作伙伴和我们目前有关系的第三方签订的合同 可能会终止、缩小关系范围或以其他方式对他们与我们的关系造成重大不利影响。追求此类权利 可能会导致我们遭受潜在未来收入损失,或因违反此类协议而产生责任,并失去对我们业务至关重要的权利。任何此类中断都可能限制我们实现业务预期收益的能力。此类中断的不利影响也可能影响我们的业务和运营或 我们普通股的市场价格。
我们 在完成业务合并和整合Larkspur和Old ZyVersa的业务时, 产生了大量交易费用和成本。
我们 就业务合并及完成业务合并协议及相关交易协议拟进行的交易 产生重大非经常性费用。虽然我们假设业务合并将 产生一定水平的费用,但有许多超出我们控制范围的因素已经影响并可能继续 影响我们合并后业务的该等费用的总额或时间。业务合并后,在开展业务过程中可能会继续产生额外的意外成本 。
如果我们受到任何证券诉讼或股东维权活动的影响,我们的业务和运营可能会受到负面影响, 这可能会导致我们产生巨额费用,阻碍我们业务和增长战略的执行,并影响我们的股价。
在过去,随着一家公司证券市场价格的波动,经常会对该公司提起证券集体诉讼。股东激进主义可以采取多种形式,也可以在各种情况下出现,最近一直在增加。我们普通股股价的波动或其他原因可能会导致我们在未来成为证券诉讼或股东维权的目标。证券诉讼和股东激进主义,包括潜在的代理权竞争, 可能会导致巨额成本,并将管理层和董事会的注意力和资源从我们的业务中转移出去。 此外,此类证券诉讼和股东激进主义可能会给我们的未来带来明显的不确定性,对我们与服务提供商的关系产生不利影响,并使吸引和留住合格人员变得更加困难。我们还可能被要求支付与任何证券诉讼和维权股东事宜相关的巨额法律费用和其他费用。此外,我们的股票价格可能会受到重大波动或受到任何证券诉讼和股东行动的事件、风险和不确定性的不利影响 。
向某些持有人授予注册权,包括根据PIPE认购协议,以及未来此类 权利的行使可能会对我们普通股的市场价格产生不利影响。
业务合并完成后,经修订及重订的注册权协议由吾等及若干其他订约方 订立,取代Larkspur先前的注册权协议。根据经修订及重订的登记权利协议,受其约束的可登记证券持有人及其获准受让人及受让人将享有有关其普通股股份的惯常登记权利(包括索取权、搁置权及搭载权,但须受合作及削减条款规限)。根据就完成PIPE投资订立的登记权协议, 我们在业务合并后向美国证券交易委员会提交了一份登记声明,就PIPE投资而言,我们将以PIPE证券为基础的普通股进行二次发行。此外,根据该等登记权协议,吾等同意我们将尽商业上合理的最大努力(I)使该登记声明在其后即时宣布生效 及(Ii)维持该登记声明的效力,直至不再有任何须登记证券 未清偿为止。此外,PIPE认购协议规定,这些持有者将拥有某些“搭载”注册权利,将其证券包括在我们提交的其他注册声明中。我们还同意向B系列股票的 持有人授予登记权,据此这些持有人将获得与B系列股票相关的普通股股票的习惯登记权(包括索取权、搁置权和搭载权,受合作和削减条款的限制)。
| 59 |
如果 证券或行业分析师没有发表关于我们的研究,或者发表关于我们、我们的业务 或我们的市场的不准确或不利的研究,或者如果他们对我们普通股的建议产生不利影响,我们的 普通股的交易价格或交易量可能会下降。
我们普通股的交易市场将在一定程度上受到证券或行业分析师可能发布有关我们、我们的业务、我们的市场或我们的竞争对手的研究和报告的影响。如果一位或多位证券分析师以不利评级启动研究,或下调我们的普通股评级,对我们的竞争对手提供更有利的推荐,或发布关于我们业务的不准确或不利的研究 ,我们的普通股价格可能会下跌。如果很少有证券分析师开始报道我们,或者如果其中一个或多个分析师停止报道我们,或未能定期发布有关我们的报告,我们可能会在金融市场失去可见性 ,对我们证券的需求可能会减少,这可能会导致我们普通股的价格和交易量下降。
我们总流通股的很大一部分可能会在不久的将来向市场出售,这可能会导致我们普通股的市场价格大幅下跌,即使我们的业务表现良好。
我们普通股的市场价格可能会因为在市场上大量出售我们普通股的股票,或者 认为这些出售可能发生的感觉而下降。截至2023年12月5日,我们共有1,243,297股已发行普通股(根据反向股票拆分产生的零碎股份的四舍五入进行调整)。在受某些股份约束的锁定期满 之后的任何时间,某些股东将有权根据我们修订和重订的《登记权利协议》享有有关根据证券法登记该等股份的要约和出售的某些权利,包括要求我们提交登记声明以登记其股份的要约和出售。
作为2023年7月发行的一部分,B系列股票的转换价格 降至每股普通股245.00美元的底价,管道认股权证的行权价 降至每股普通股70美元的底价,39,373份尽力而为 认股权证的行权价从行权价35美元降至5.78美元。只要我们普通股的市场价格在重新设定管道权证和尽力而为权证的行权价格后高于底价,该证券的持有者就可以行使此类证券并出售普通股的标的 股票,从中获利。如果我们普通股的市场价格低于持有人认股权证的行使价,则持有人不太可能行使其认股权证。因此,在这种调整之后,此类证券的持有者可能更有可能行使或将证券转换为我们的普通股并出售该普通股,从而对我们的普通股的市场价格造成额外的负面 压力和其他稀释效应。
保荐人股份登记于2023年10月20日完成,使500多万股我们的普通股 可在短期内向市场出售。保荐人股票的成本基础低于我们因Larkspur IPO和业务合并而发行的普通股,因此保荐人 股票持有人可能愿意以低于我们普通股其他持有人的价格出售此类证券。保荐人股份及根据本公司于2023年10月20日生效的S-1表格登记声明所登记的其他证券的供应,可能会对本公司普通股的市价产生负面影响。
此外,我们还提交了一份登记声明,登记根据我们的股权补偿计划为未来发行预留的股票。 在该登记声明生效后,在满足适用的归属限制以及上述市场僵持协议和锁定协议到期或豁免的情况下,根据此类计划授予的未偿还股票期权、限制性股票单位奖励和认股权证或授予其他股权奖励而发行的股票将可立即在公开市场上转售。
随着限制终止或根据注册权出售我们的普通股 可能会使我们在未来以我们认为合适的价格出售股权证券 变得更加困难。这些出售还可能导致我们普通股的交易价格 下跌,使您更难以您认为合适的时间和价格出售我们普通股的股票。
| 60 |
我们 在可预见的未来不打算支付现金股息。
我们 目前打算保留我们的未来收益(如有),以资助我们的业务的进一步发展和扩展,并且不打算 在可预见的将来支付现金股息。任何未来支付股息的决定将由我们的 董事会酌情决定,并将取决于我们的财务状况、经营业绩、资本要求、未来协议中包含的限制 和融资工具、业务前景以及我们的董事会认为相关的其他因素。
我们的 股东未来可能会遭遇稀释。
由于收购的股权发行、资本市场交易或其他原因,包括但不限于我们可能授予我们的董事、高级管理人员和员工的股权奖励、行使我们的认股权证,当前股东持有的我们普通股的 百分比在未来可能被稀释。
此外, 本次发行中注册的股票数量可能会对我们以我们可以接受的价格发行额外股票的能力产生负面影响 ,发行金额足以让我们执行我们的业务战略。在公开市场上出售我们的大量普通股。这些出售,或市场上认为持有大量普通股的人打算出售股票的看法,可能会降低我们普通股的市场价格。此外,在公开市场上转售或预期转售或可能转售大量普通股,可能会对普通股的市场价格 产生不利影响,并使我们的股东更难在他们认为 合适的时间和价格出售所持股份。由于保荐人股份与Larkspur首次公开招股及业务合并相关发行的股份相比成本基准较低,保荐人股份持有人可决定以低于其他投资者的价格出售该等股份。因此,根据本注册声明进行发行所产生的不利市场和价格压力可能会持续很长一段时间。
经当时未发行的认股权证中至少50%的持股权证持有人批准,我们 可以修改认股权证的条款,修改方式可能对公开认股权证持有人不利。因此,可以提高认股权证的行使价格,缩短行使权证的期限,并减少在行使认股权证时可购买的普通股数量,所有这些都不会影响每份认股权证的 批准。
我们购买普通股作为Larkspur首次公开募股的一部分的认股权证是根据作为认股权证代理的大陆股票转让和信托公司与我们之间的权证 协议以注册形式发行的。认股权证协议规定,这些认股权证的条款 可在未经任何持有人同意的情况下修改,以纠正任何含糊之处或更正任何有缺陷的条款,但须 至少50%当时尚未发行的公共认股权证持有人批准,才能作出任何对公共认股权证注册持有人的利益造成不利影响的更改 。因此,如果当时未发行的公共认股权证中至少50%的持有人同意修改,我们可以不利于持有人的方式修改公共认股权证的条款。虽然我们在获得当时至少50%的已发行公开认股权证同意的情况下,修订公开认股权证的条款的能力是无限的,但此类修订的例子 可以包括提高认股权证的行使价、将认股权证转换为现金、缩短行使期或减少在行使认股权证时可购买的普通股数量。
我们 可以在对认股权证持有人不利的时间赎回未到期的认股权证,从而使该等认股权证变得一文不值。
我们 有能力在某些已发行的公共认股权证可行使后和到期前的任何时间,以每股认股权证0.35美元的价格赎回 ,前提是我们的普通股或普通股(视情况而定)在我们向认股权证持有人发送赎回通知的日期前30个交易日内的任何20个交易日内的最后售价等于或超过每股630.00美元(经股票拆分、股份资本化、重组、资本重组和类似调整后)。我们不会赎回此等认股权证,除非根据证券法 就可于行使此等认股权证时发行的普通股发行作出的有效登记声明生效,且有关该等普通股的现行招股说明书 在整个30天的赎回期间内可供查阅,但如认股权证可在无现金基础上行使,且该等无现金行使可获豁免根据证券法登记,则本公司将不会赎回此等认股权证。如果且当认股权证变为可赎回时,如果在行使认股权证时发行的股票不能根据适用的州蓝天法律获得注册或资格豁免,或者我们无法根据所有适用的州证券法注册标的证券或使其符合出售资格,则我们可能无法行使赎回权。赎回未赎回认股权证可能迫使其持有人(I)行使 权证,并在可能对其不利的情况下支付其行使价,(Ii)在持有人原本可能希望持有认股权证的情况下,以当时的市场价格出售认股权证,或(Iii)接受名义赎回价格,而在要求赎回未偿还认股权证时,名义赎回价格很可能大幅低于该等认股权证的市值。
| 61 |
我们的认股权证可能会对我们普通股的市场价格产生不利影响。
购买166,439股普通股的认股权证,作为Larkspur首次公开发售的单位的一部分,同时,Larkspur首次公开募股结束, 以私募方式发行了总计9,156个单位(每份包括一股普通股和可按每股402.50美元购买一股普通股的可赎回认股权证的四分之三)。认股权证使持有人 有权购买Larkspur普通股的股份,这些股份在业务合并完成后转换为我们的普通股。我们 还发行了认股权证,购买PIPE Investment中最多141,868股普通股,可在尽力而为要约每股70.00美元(其中包括139,403股普通股)后按调整后的行权价格行使。此外,我们还发行了尽力而为认股权证,以购买最大努力发售的314,751股普通股,行使价为每股35.00美元,其中39,373股尽力而为认股权证重新定价,行权价从行权价35.00美元降至5.78美元。作为2023年7月发售的一部分,Old ZyVersa认股权证最多购买45,032股我们的普通股,诱导权证最多购买203,464股,行权价为每股4.75美元,以及2023年7月的认股权证,其中160,182股仍可发行,行权价为每股5.78美元。此类认股权证在行使时,将增加已发行和已发行普通股的数量,并降低普通股的价值。
不能保证旧的ZyVersa认股权证、管道权证、私募认股权证、公开认股权证、2023年7月的认股权证、诱导权证或尽力而为的认股权证将在现金中;它们可能到期一文不值,因此我们可能无法从行使认股权证获得现金收益。
截至本协议日期,我们拥有(I)公开认股权证购买166,439股普通股,可按每股402.50美元的行使价行使,其于2027年12月12日到期或赎回,(Ii)Old ZyVersa认股权证购买最多45,032股我们的普通股,(Iii)私募认股权证购买6,867股我们的普通股,可按每股402.50美元的行使价行使,(Iv)管道认股权证,购买最多139,403股我们的普通股,可按每股70.00美元的行使价 行使,2027年12月12日到期;以及(V)尽力权证购买314,751股我们的普通股,可按加权平均行权价每股31.34美元行使,其中39,373股尽力权证重新定价,行权价从行权价35.00美元降至5.78美元,作为公司2023年7月发售的一部分, 本公司出售总计93,031股普通股,以及购买270,607股普通股代替普通股的预资金权证,以及购买最多363,646股普通股的普通权证。合并公开发行价为每股5.78美元及附带普通权证,或每份预筹资权证及附带普通权证5.77美元。自2023年7月发行以来,所有购买270,607股普通股的预先出资的权证均已行使,购买最多203,464股普通股的权证已重新定价 至行使价4.75美元,而2023年7月的认股权证目前仍保留160,182份,行使价为每股5.78美元行使Old ZyVersa认股权证、管道权证、私募认股权证、公共认股权证、尽力权证、2023年7月认股权证和诱导权证,以及我们可能从其行使中获得的任何收益在很大程度上取决于我们普通股的价格以及行权时认股权证的行权价格与普通股价格之间的价差。 例如,如果我们的普通股价格超过每股402.50美元,我们的私募认股权证和公开认股权证的持有者更有可能行使他们的认股权证。如果我们普通股的价格低于每股402.50美元, 这些持有者不太可能行使他们的认股权证。截至2023年12月5日,我们普通股的收盘价为每股2.17美元。不能保证我们所有的认股权证在到期前都会在现金中。我们的公共认股权证和私募认股权证在某些条件下(如认股权证协议中所述)可由我们按每份认股权证0.35美元的价格赎回。我们的管状认股权证不可赎回,并可在无现金的基础上行使。因此,我们可能永远不会从行使认股权证中获得任何现金收益。此外,作为旧ZyVersa认股权证、公开认股权证、私募认股权证、诱导权证和管道认股权证的普通股股份已在本公司提交的转售登记声明中登记 ,因此不再承担转售义务。
在行使认股权证和转换优先股时发行我们的普通股将大大稀释我们普通股的现有持有者。
截至本协议日期,我们拥有(I)公开认股权证购买166,439股普通股,可按每股402.50美元的行使价行使,其于2027年12月12日到期或赎回,(Ii)Old ZyVersa认股权证购买最多45,032股我们的普通股,(Iii)私募认股权证购买6,867股我们的普通股,可按每股402.50美元的行使价行使,(Iv)管道认股权证,购买最多139,403股我们的普通股,可按每股70.00美元的行使价 行使,2027年12月12日到期;以及(V)尽力权证购买314,751股我们的普通股,可按加权平均行权价每股31.34美元行使,其中39,373股尽力权证重新定价,行权价从行权价35.00美元降至5.78美元,作为公司2023年7月发售的一部分, 公司出售总计93,031股普通股,以及购买270,607股普通股代替普通股的预资金权证,以及购买最多363,646股普通股的普通权证。合并公开发行价为每股5.78美元及附带普通权证,或每份预筹资权证及附带普通权证5.77美元。自2023年7月发行以来,购买270,607股普通股的所有预筹认股权证均已行使,购买最多203,464股普通股的认股权证已重新定价 至行权价4.75美元,目前从2023年7月发行起仍保留160,182股认股权证,行权价为每股5.78美元。截至2023年12月5日,我们普通股的收盘价为2.17美元。如果我们的普通股高于旧ZyVersa认股权证、公开认股权证、私募认股权证、诱导权证的行使价,以及管道认股权证和此等认股权证的持有人行使并发行普通股,我们现有普通股持有人的普通股将被大幅稀释。 此外,与旧ZyVersa认股权证、公开认股权证、私人配售认股权证、诱因认股权证和管道认股权证相关的普通股股份已在本公司提交的转售登记声明中登记,因此不再承担转售义务。
此外,保荐人股份、A系列优先股和B系列股票已在本公司 备案的回售登记书中登记,并于2023年10月20日被美国证券交易委员会宣布生效(档号333-268934)。在公开市场上出售大量此类普通股 或可能行使此类认股权证的事实可能会对我们普通股的市场价格产生不利影响。
| 62 |
我们 使用了我们尽最大努力提供的净收益的很大一部分赎回了几乎所有的PIPE股票,这可能会 对我们的业务和股东产生不利影响。
完成我们尽力而为的发售所得净收益的很大一部分用于赎回几乎所有的 管道股票。根据A系列指定证书,我们以发行价的120%赎回了管道股份。因此,我们尽最大努力完成发售所得的净收益按发行价的120%用于赎回PIPE股份, 这比持有人购买该等PIPE股份的金额高出约20%的利润。只有吾等在有关发售中收取的款项净额(扣除吾等应付的有关发售费用后)才会用作营运资金及其他一般公司用途,而该等发售所得款项超过赎回基本上所有 PIPE股份所需的金额。我们通过出售2022年12月12日完成的与我们的业务合并相关的管道股票收到的总收益约为1,100万美元,我们向投资者支付的赎回此类证券的价格约为1,050万美元。尽管我们打算将此类发行的剩余收益用于营运资金和其他一般公司用途,但赎回PIPE股票将影响我们 可用于其他用途和执行我们的业务战略的现金。我们预计将在后续发行中通过发行股权或与股权挂钩的证券来筹集额外资本。如果我们无法通过以对我们有利的条款发行股权或股权挂钩证券来筹集额外资本,我们可能没有足够的流动性来执行我们的业务战略,这可能会对我们的业务、我们普通股的价值和我们的股东产生不利影响。有关更多信息,请参阅标题为“管理层对财务状况和经营结果的讨论和分析-流动性和资本资源-业务后合并 资本需求、“和其他风险因素。”风险因素.”
我们的 章程规定,除有限的例外情况外,高等法院将是某些 股东诉讼事项的唯一和专属法院,这可能会限制我们的股东在与我们或我们的董事、 管理人员、员工或股东之间的纠纷中获得选定的司法法院的能力。
我们的 第二次修订和重述的公司注册证书(“章程”)要求,在法律允许的最大范围内, 以我们的名义提起的衍生诉讼,针对董事、高级管理人员和员工违反受托责任的诉讼以及其他类似的 诉讼,可以向大法官法院提起,或者,如果该法院缺乏主题管辖权,位于特拉华州的另一个联邦或州法院。购买或以其他方式获得本公司股本股份的任何权益的任何个人或实体应被视为 已通知并同意本公司章程中的法院条款。此外,我们的章程和修订和重申的细则 将规定,美国联邦地区法院应是解决根据证券法和交易法提出诉讼理由的任何投诉的唯一论坛。虽然专属法院条款并不限制 股东根据《证券法》提出索赔的能力,但它可能限制股东在司法法院提出索赔的能力 ,他们认为有利的,并可能增加股东的某些诉讼费用,这可能会阻碍根据 《证券法》对我们、我们的董事和管理人员提出索赔。
2020年3月,特拉华州最高法院发布了一项判决, Salzburg等人。V.Sciabacucchi该法院认定,根据特拉华州法律,一项专门的法院条款规定,根据《证券法》,索赔应提交联邦法院,在表面上是有效的。目前还不清楚 是否会对这一决定提出上诉,或者本案的最终结果会是什么。我们打算执行这一规定,但我们不知道其他司法管辖区的法院是否会同意或执行这一决定。
本 法院选择条款可能限制股东在其认为有利于与我们或我们任何董事、高级管理人员、其他员工或股东发生纠纷的司法法院提出索赔的能力,这可能会阻碍就此类索赔提起诉讼。 或者,如果法院认定《宪章》中包含的法院选择条款在 诉讼中不适用或无法执行,我们可能会在其他司法管辖区因解决此类诉讼而产生额外费用,这可能会损害我们的业务、 经营成果和财务状况。
此外, 不确定法院条款的选择是否具有强制性。《证券法》第22条为联邦和州法院 对所有为执行《证券法》或其下的规则和条例所规定的任何义务或责任而提起的诉讼 确立了共同管辖权。鉴于这种不确定性,提出索赔的投资者可能面临某些额外风险,包括成本增加和 诉讼结果的不确定性。
我们组织文件中的反收购条款可能会延迟或阻止控制权的变更。
本公司章程和章程的某些 条款可能具有反收购效力,并可能延迟、推迟或阻止股东可能认为符合其最佳利益的合并、收购、要约收购、 收购尝试或其他控制权变更交易,包括那些可能导致本公司股东所持股份溢价高于市价的尝试 。
| 63 |
除其他事项外,这些 规定:
| ● | 我们董事会发行一个或多个系列优先股的能力; | |
| ● | 一个分类版块; | |
| ● | 提前 通知股东提名董事和股东将在我们的年度会议上审议的事项; | |
| ● | 召开特别股东大会的某些限制; | |
| ● | 限制可以召开股东特别会议的人员; | |
| ● | 限制股东通过书面同意采取行动的能力;以及 | |
| ● | 我们的董事会有明确的权力制定、更改或废除我们的章程。 |
这些 反收购条款可能会使收购变得更加困难或受挫,或者阻止第三方收购我们,即使第三方的要约可能被我们的许多股东认为是有益的。此外,这些规定可能会使股东更难更换负责任命管理层成员的董事会成员,从而挫败或阻止 我们的股东试图更换或罢免我们目前的管理层。因此,我们的股东获得股票溢价的能力可能会受到限制。这些规定还可能阻止代理权竞争,并使您 和其他股东更难选举您选择的董事,并导致我们采取您希望的其他公司行动。请参阅“我们的股本说明 。”
由我们的董事和高级管理人员索赔 可能会减少我们的可用资金,以满足针对我们的成功的第三方索赔 ,并可能减少我们的可用资金。
我们的组织文件规定,我们将在特拉华州 法律允许的最大程度上对我们的董事和高级管理人员进行赔偿。
此外,在特拉华州公司法第145条允许的情况下,我们的附则和与我们的董事和高级管理人员签订的赔偿协议规定:
| ● | 我们 将赔偿我们的董事和高级管理人员以这些身份为我们服务或应我们的要求为其他商业企业服务, 在特拉华州法律允许的最大范围内。特拉华州法律规定,如果该人 诚信行事,且该人合理认为符合或不违背注册人的最大利益 而就任何刑事法律程序而言,无合理因由相信该人的行为属违法; | |
| ● | 在适用法律允许的情况下,我们 可以酌情对员工和代理人进行赔偿; | |
| ● | 我们 将被要求向我们的董事和高级管理人员垫付与诉讼辩护相关的费用,但如果最终确定该人没有资格获得赔偿,则该等董事或高级管理人员应承诺偿还预付款; | |
| ● | 根据我们的章程,我们 不会就某人对我们或我们的其他受赔人提起的诉讼 承担赔偿义务,除非是我们董事会授权的诉讼或为强制执行索赔权利而提起的诉讼; | |
| ● | 章程赋予的权利并非排他性的,我们有权与我们的董事、高级职员、雇员和代理人订立赔偿协议,并购买保险以赔偿此等人士;以及 | |
| ● | 我们 不能追溯修改我们的章程条款,以减少我们对董事、高级管理人员、员工和 代理人的赔偿义务。 |
| 64 |
如果您在此次发行中购买证券,您的投资将立即受到稀释。
您的 将因此次发售而立即遭受重大稀释。普通股及附属普通权证的每股合并公开发售价格及每股预筹资权证及附属普通权证的合并公开发售价格将大幅高于本次发售后普通股的预计调整每股有形账面净值 。因此,如果您在此次发行中购买证券,您将支付您所收购的普通股的每股有效价格 ,大大超过我们在此次发行后的预计每股有形账面净值。根据普通股及随附的普通权证每股1.25美元的发行价,并假设本次发售中不出售任何预筹资助权证, 本次发售中不会行使普通权证,且该等普通权证不会产生任何价值,且该等认股权证分类及入账为权益,则阁下将立即摊薄每股2.54美元,相当于本次发售生效后我们的备考金额与调整后每股有形账面净值之间的差额。
我们的 与融资、收购、投资、股票激励计划相关的额外股本的潜在发行, 作为应付或其他应付账款的对价,将稀释所有其他股东的权益。
我们的 与融资、收购、投资、股票激励计划相关的额外股本的潜在发行, 作为应付或其他应付账款的对价,将稀释我们的股东。我们预计未来将发行额外的股本,这将导致对所有其他股东的摊薄。我们预计将根据我们的股票激励计划向员工、董事和顾问授予股权奖励。我们未来还可能通过股权融资筹集资金,并可能以股本形式支付某些应付账款。作为我们业务战略的一部分,我们可能会收购或投资于互补的公司、产品或技术,并发行股权证券来支付任何此类收购或投资。任何此类额外股本的发行都可能导致股东的所有权权益显著稀释,我们普通股的每股价值也会下降。
此外,由于最近完成了尽力而为的发售,我们产生了额外的摊薄,原因是此类发售的价格以及B系列股票的转换价和管道权证的行使价被重置为适用的底价。此外,由于最近完成的2023年7月发售,由于此类发售的价格和部分尽力而为认股权证的行使价被重置为降价,我们产生了额外的摊薄。行使PIPE认股权证时可发行普通股的股数也调整为等于转换PIPE股份时可发行普通股的100%。在尽力而为的发售中发行证券,以及在行使或转换B股和PIPE认股权证(视情况而定)后可能发行额外的普通股 可能会导致股东经历重大的 稀释。
此外, 只要我们普通股的市场价格高于管道权证和尽力而为权证行权价格重置后的底价,该等证券的持有人就可以行使该等证券并出售普通股的标的股份以赚取利润。如果我们普通股的市场价格低于持有人认股权证的行权价格,则持有人不太可能 行使其认股权证。因此,在这种调整之后,此类证券的持有者可能更有可能将这些证券转换为我们普通股的股票并出售该股票,从而对我们普通股的市场价格造成额外的负面压力 以及其他稀释效应。
此外, 本次发行中注册的股票数量可能会对我们以我们可以接受的价格发行额外股票的能力产生负面影响 ,发行金额足以让我们执行我们的业务战略。我们预计将在后续发行中通过发行股权或股权挂钩证券来筹集额外资本。尽力而为发售(2023年7月发售)的完成,以及未来的任何 发售,或在行使或转换B系列股票、 管道认股权证、尽力而为认股权证和诱导权证(视情况而定)后可能增发普通股,可能会对我们按对我们有利或不会对现有股东造成重大稀释的条款筹集额外资本的能力产生不利影响。如果我们无法通过以对我们有利的条款发行股权或股权挂钩证券来筹集额外资本,我们可能没有足够的流动性来执行我们的业务 战略。此外,尽力而为发售、2023年7月发售或任何未来发售的完成,或可能在行使或转换B系列股份、管道认股权证、尽力认股权证及诱导权证(视情况而定)时发行额外普通股 ,可能会对我们普通股的市场价格产生不利影响,因为在尽力而为发售、2023年7月发售或任何未来发售中出售的额外股份,或在行使或转换B系列股份、管道认股权证及最佳努力认股权证(视情况而定)时发行的额外股份,代表我们普通股的很大一部分已发行和流通股 ,在未来的任何发行中出售的普通股的价格可能低于我们普通股的当前市场价格,或在适用的情况下行使或转换B系列股票、管道认股权证和最大努力认股权证后发行的普通股, 最佳努力认股权证可能会显著稀释我们普通股的现有持有者。
| 65 |
我们的 管理层将在使用此次发行的净收益方面拥有广泛的自由裁量权,并可能以您不同意的方式和可能不会产生回报的方式投资或使用收益。
我们的 管理层将拥有广泛的自由裁量权来运用此次发行的净收益,包括用于标题为“收益的使用,“作为投资决策的一部分,您将没有机会评估净收益是否得到了适当的使用。由于将决定我们使用此次发行的净收益的因素的数量和可变性,它们的最终用途可能与其当前的预期用途不同。如果我们的管理层 未能有效地使用这些资金,可能会损害我们的业务。在使用之前,我们可能会将此次发行的净收益投资于投资级计息证券。这些投资可能不会给我们的证券持有人带来有利的回报。
在此发行的预融资权证或普通权证没有公开市场。
在此发售的预融资权证或普通权证尚无既定的公开交易市场,我们预计 不会发展这样的市场。此外,我们不打算申请在任何国家证券交易所或其他国家认可的交易系统上市预融资权证或普通权证。如果没有活跃的市场,预先出资的权证和普通权证的流动性将受到限制。
在本次发行中购买的预资金权证或普通权证的持有人 在 该等持有人行使其预资资权证或认股权证并收购我们的普通股之前,将不享有作为普通股股东的权利。
在预融资权证或普通权证的持有者在行使时获得本公司普通股股份之前,该等持有人 将不享有与预融资权证或普通权证相关的普通股股份的权利。 在行使预融资权证或普通权证时,持有人仅有权就记录日期在行使日期之后的事项行使普通股股东的权利。
本公司发行的普通认股权证属投机性性质。
本公司发行的普通股认股权证并不赋予其持有人任何普通股所有权权利,例如投票权或收取股息的权利,而只是代表在有限时间内以固定价格取得普通股股份的权利。此外,本次发售后,普通权证的市值(如有)将不确定,且无法 保证认股权证的市值将等于或超过其推定发行价。普通权证将不会在任何市场或交易所上市或报价交易。不能保证我们普通股的市场价格将 永远等于或超过普通权证的行使价,因此普通权证可能到期时毫无价值。
此 是尽力而为的产品,不要求出售最低金额的证券,我们可能不会筹集我们认为业务计划(包括我们的近期业务计划)所需的资本额。
配售代理已同意尽其合理的最大努力征求购买本次发行中的证券的要约。配售代理没有义务从我们手中购买任何证券,也没有义务安排购买或出售任何特定数量或金额的证券。完成本次发售没有必须出售证券的最低数量的要求。 由于本次发售的完成没有最低发售金额的要求,因此我们的实际发售金额、配售代理费和收益目前无法确定,可能会大大低于上述最高金额。 我们可能会少于在此发售的所有证券,这可能会显著减少我们收到的收益金额,如果我们出售的证券数量不足以支持我们的 持续运营(包括我们近期的持续运营),则此次发行的投资者将不会获得退款。因此,我们可能不会在短期内筹集我们认为的运营所需的资本额 ,并且可能需要筹集额外的资金,这些资金可能无法获得或无法以我们可以接受的条款获得 。
我们的反向股票拆分可能会减少我们普通股的流动性 。
我们于2023年12月4日实施了35股1股的反向股票拆分。我们普通股的流动性可能会受到反向股票拆分的不利影响 因为反向股票拆分后流通股数量减少。此外,反向股票 拆分增加了持有我们普通股的零头(不到100股)的股东数量,这可能会使这些 股东经历出售其股票的成本增加和实现此类出售的更大困难。
股票反向拆分后,我们普通股的市场价格可能无法吸引包括机构投资者在内的新投资者,也可能无法满足这些投资者的投资要求。因此,我们普通股的交易流动性可能不会改善。
尽管我们相信更高的普通股市场价格可能有助于激发更大或更广泛的投资者兴趣,但不能保证反向股票拆分,包括我们在2023年12月4日实施的35股1股反向拆分,将导致股价 吸引新的投资者,包括机构投资者。此外,不能保证我们普通股的市场价格将满足这些投资者的投资要求。因此,我们普通股的交易流动性可能不一定会改善。我们在2023年12月4日实施35股1股的反向股票拆分的主要目的是,由于普通股已发行和已发行股票数量的减少,我们的普通股价格在反向股票拆分后立即出现 预期的上涨,将有助于我们满足纳斯达克上市规则规定的最低投标价格要求 。不能保证反向股票拆分,包括我们在2023年12月4日实施的35股反向股票拆分,将导致我们普通股市场价格的任何持续比例上升,这 取决于许多因素,包括我们的业务和财务业绩、一般市场状况以及未来的成功前景 ,这些与我们已发行普通股的数量无关。在股票反向拆分后的一段时间内,公司普通股的市场价格下跌并不少见。
| 66 |
使用收益的
我们 估计,在扣除配售代理费和估计应支付的发售费用后,假设不行使普通权证,并假设在此发售的所有证券 在本次发售中出售我们的普通股股份、预筹资权证和普通权证的净收益将约为435万美元。但是, 这是合理的尽力而为发售,没有最低证券数量或收益金额作为成交条件,而且我们可能不会出售根据本招股说明书发售的全部或任何证券;因此,我们在此次发售中获得的净收益可能会大幅减少 。例如,如果我们只销售最高报价的25%、50%或75%,我们的净收益将分别约为829,915美元、2,004,831美元或3,179,746美元。如果以现金为基础的普通权证全部行使,我们将获得大约1000万美元的额外收益。
我们 目前打算将此次发行的净收益用于营运资金和其他一般公司用途,包括支付 应付未付账款以及支付某些员工的未付工资和奖金。
我们实际支出的金额和时间将取决于许多因素,包括我们的临床开发努力、我们的运营成本和本招股说明书中“风险因素”项下描述的其他因素。因此,我们的管理层将可以灵活运用此次发售的净收益 。投资者将没有机会评估我们根据如何使用收益做出决定所依据的经济、金融或其他信息。
| 67 |
稀释
如果您投资于我们的证券,您的所有权权益将被稀释,稀释程度为我们普通股和附带普通权证的合并公开发行 每股价格与本次发售生效后立即调整的普通股每股有形账面净值之间的差额。
截至2023年9月30日,我们的有形净账面赤字约为1,110万美元,或每股普通股约8.93美元。每股有形账面净亏损等于我们的总有形资产减去总负债除以普通股流通股数量。
在 本次发行中假设以每股1.25美元的公开发行价出售400,000股普通股和随附的普通权证以及随附的普通权证和预融资权证,以每股预筹资助权证和随附的普通权证1.2499美元的公开发行价购买最多3,600,000股普通股后,在扣除配售代理费和估计应支付的发售费用后,并假设本次发售中的预资金权证以现金方式全面行使,而不行使本次发售中的普通权证,由于此类普通权证没有任何价值,而此类普通权证被归类为股权并计入股权,我们截至2023年9月30日的调整后有形 账面价值约为670万美元,或每股普通股约1.29美元。这一数额意味着我们现有股东的调整后有形账面净值立即增加每股7.64美元,对参与此次发行的投资者立即稀释每股2.54美元。我们通过从参与此次发行的投资者支付的每股综合公开发行价和附带的普通权证中减去我们的调整后每股有形账面净值来确定对参与此次发行的投资者的每股摊薄 。
下表以每股为单位说明了对新投资者的摊薄:
| 每股公开发行价格和附带的普通认股权证 | $ | 1.25 | ||||||
| 截至2023年9月30日的有形账面净赤字 | $ | (8.93 | ) | |||||
| 可归因于此次发行的每股有形账面净值的增加 | $ | 7.64 | ||||||
| 本次发售生效后调整后的每股有形账面净值 | $ | (1.29 | ) | |||||
| 在此次发行中向新投资者稀释每股收益 | $ | (2.54 | ) |
| 68 |
以上讨论和表格基于截至2023年9月30日的已发行普通股1,243,297股,不包括 以下内容:
| ● | 在行使与Larkspur首次公开募股相关的私募认股权证时可发行6,867股,加权平均行权价为每股402.50美元; | |
| ● | 166,439股于行使认股权证时可发行的股份,加权平均行使价为每股402.50美元; | |
| ● | 行使PIPE认股权证时可发行的139,403股,加权平均行权价为每股70.00美元; | |
| ● | 314,751股可在行使我们的Best Effort发行的尽力而为认股权证时发行的股票,加权平均行权价为每股31.34美元,其中39,373股尽力而为权证重新定价,作为2023年7月发售的一部分,行权价从行权价35.00美元降至5.78美元; | |
| ● | 715股作为标的的管材股份; | |
| ● | 20,665股B系列股票; | |
| ● | 45,032股Old ZyVersa认股权证,其中41,627股目前可在公司向Old ZyVersa 持有人发行并由公司承担的权证行使时发行,加权平均行权价为245.72美元,3,405股将在 实现某些里程碑时发行; | |
| ● | 根据我们的2014年计划发行的股票期权行使时可发行的56,999股,加权行权价为378.56美元; | |
| ● | 根据我们的2022年综合股权激励计划发行的股票期权行使时可发行41,523股,加权行权价为15.25美元; | |
| ● | 根据2023年奖励计划发行的股票期权在行使时可发行3,230股,加权平均行权价为每股74.45美元; | |
| ● | 2023年7月认股权证行使时可发行的160,182股,加权平均行权价为每股5.78美元;以及 | |
| ● | 203,464股于行使诱导权证时可发行的股份,加权平均行使价为4.75美元。 |
除非明确说明或上下文另有要求,否则本招股说明书中的所有信息 均假定未行使本招股说明书提供的普通权证。
| 69 |
我们普通股和股利信息的市场价格
市场 我们普通股的价格
我们的普通股目前在纳斯达克全球市场纳斯达克股票市场有限责任公司(“纳斯达克”)上市,代码为“ZVSA”。 在业务合并完成之前,拉克斯珀的单位、普通股和公募权证分别以“LSPRU”、“LSPR”和“LSPRW”的代码在纳斯达克资本市场上市。拉克斯珀的单位和公募认股权证不再在纳斯达克资本市场上市。
2023年12月5日,我们普通股的收盘价为每股2.17美元。
截至2023年12月5日,我们普通股的记录持有人约有500人。这些数字不包括受益的 所有者通过被指定人的名字持有我们的证券。
分红政策
我们 从未就我们的股本宣布或支付任何现金股息,目前我们也不打算在可预见的未来支付任何现金股息。我们希望保留未来的收益,如果有的话,为我们业务的发展和增长提供资金。未来是否决定向我们的普通股支付股息将由我们的董事会酌情决定,并将取决于我们的财务状况、经营业绩、当前和预期的现金需求、扩张计划以及董事会认为相关的其他因素。
| 70 |
生意场
除 明确说明或文意另有所指外,本招股说明书中提及的“公司”、“注册人”、“我们”、“我们”及“我们”均指ZyVersa(以及旧ZyVersa的业务,在业务合并生效后成为ZyVersa的业务 )。
概述
我们 是一家临床阶段的生物制药公司,利用专有技术为患有慢性肾脏疾病或炎症性疾病的患者开发药物,这些患者的医疗需求尚未得到满足。我们的使命是开发优化健康结果和提高患者生活质量的药物。
我们 拥有两个全球许可的专利药物开发平台,每个平台都是由迈阿密大学米勒医学院(以下简称迈阿密大学)的研究科学家发现的。这些开发平台 包括:
| ● | 胆固醇外流调节剂TM,VAR200(2-羟丙基-β-环糊精或“2HPβCD”)是一种临床开发中的治疗肾脏疾病的注射用药物。VAR 200于2015年12月15日从L研究有限责任公司获得许可。L研究公司是由迈阿密大学的研究科学家创立的,他们发现了VAR 200用于肾脏疾病。 | |
| ● | IC 100是一种用于治疗炎症性疾病的临床前开发中的单抗炎症体ASC抑制剂。IC 100于2019年4月18日从InflamaCore,LLC获得许可。InflamaCore,LLC是由迈阿密大学的研究科学家创建的,他们发明了IC 100。 |
我们 相信我们的每一种候选产品都有潜力在各自的治疗领域治疗多种适应症。我们的战略是专注于适应症扩展,以最大限度地发挥商业潜力。
我们的肾脏管道最初专注于罕见的慢性肾小球疾病。我们对VAR 200的主要指征是局灶性节段性肾小球硬化(FSGS)。2020年1月21日,我们提交了VAR 200的新药研究申请(“IND”),美国食品和药物管理局(“FDA”)已允许我们的开发计划基于活性成分(2HPβCD)的风险/益处概况,在FSGS患者 中进行2a期试验。在启动对FSGS患者的2a期试验之前,我们计划在2024年第一季度支持一项开放标签概念验证试验,我们预计将在那里获得8名糖尿病肾病患者的数据。这将能够在患者进行治疗时评估药物效果 ,并将为开发我们的2a阶段方案提供见解。VAR 200具有代表FSGS、Alport综合征和糖尿病肾病的动物模型的药理学概念验证数据,其中每一种都可以根据我们的适应症扩展策略进行开发。
我们的炎症体ASC抑制剂计划IC 100正处于临床前开发阶段。我们的重点是推动1C 100在2024年第二季度提交当前计划的 IND,然后启动第一阶段试验。IC 100具有代表急性呼吸窘迫综合征(ARDS)和多发性硬化症(MS)的动物模型的药理学概念验证数据。我们计划在下一波临床前开发中进行多达六种适应症的额外动物研究,例如免疫球蛋白A(“IgA”)肾病、帕金森氏病、亨廷顿病、充血性心力衰竭和早期阿尔茨海默病。 我们预计将根据我们临床前计划的数据选择IC 100的一个或多个主要适应症。
关于慢性肾脏病(CKD)
慢性肾脏疾病(“CKD”)是一个日益严重的公共卫生问题,全世界有7500万人受到影响,美国约有3700万人受到影响。国家肾脏基金会估计,美国约有8000万成年人面临患肾脏疾病的风险。由于商业上没有改善疾病的药物疗法,相当大比例的肾脏患者进展为终末期肾病(“ESRD”),需要透析或移植才能存活。根据疾病控制和预防中心的数据,2018年,美国约有131,600人开始接受ESRD治疗,目前美国有近786,000人患有ESRD(在这786,000人中,约71% 接受透析,29%接受肾脏移植)。此外,与慢性肾脏疾病相关的经济负担可能是巨大的 ,因为根据国家肾脏基金会的数据,2018年联邦医疗保险按服务收费的支出为1300亿美元。 我们认为CKD造成的高发病率和沉重的金钱负担创造了对有效的疾病修饰药物 疗法的需求。
| 71 |
慢性肾脏病 与预后不良有关,根据国家生命统计报告,2017年,慢性肾脏病是美国第九大死因。为了解决这一重大的健康问题,2019年7月10日,白宫和卫生与公众服务部启动了推进美国肾脏健康(AAKH)倡议,以推进美国的肾脏疾病预防和护理,该倡议有三个目标:(1)通过更好的诊断、治疗和预防性护理来减少患肾衰竭的患者数量;(2)最大限度地提供家庭透析护理;以及(3)扩大可供移植的肾脏池。我们相信,通过调节导致肾脏损伤和功能障碍的多余肾细胞内胆固醇的清除,VAR 200有可能帮助实现AAKH计划的第一个目标,即减少发生肾功能衰竭的患者数量。
我们的主要肾脏适应症是FSGS,这是一种进行性肾脏疾病,没有批准的药物疗法。大约40%-60%的FSGS患者在10-20年内发展为终末期肾病,需要透析并最终进行肾脏移植才能存活。FSGS是一种孤儿疾病,在美国大约有40,000人受到影响。它的特点是肾滤过系统或“肾小球足细胞”受损,导致局部(即,仅影响某些肾小球)和节段性(即,仅影响部分肾小球)瘢痕形成。在FSGS患者的活检组织和具有代表性的FSGS动物模型中,已看到胆固醇和脂质在肾小球的积聚, 与结构损害和肾功能受损有关。肾小球受损会导致蛋白质泄漏到尿液中,这种情况被称为蛋白尿。随着尿中蛋白质水平的增加,患者会出现一系列特殊的症状,称为肾病综合征。蛋白尿与肾脏疾病的进展密切相关,肾病综合征通常预示着不良的预后。大约70%的FSGS患者在确诊时出现肾病综合征。通过调节从肾小球中清除多余的胆固醇,我们相信VAR 200具有保存肾脏结构和功能的潜力,从而减少导致FSGS进展的蛋白尿。
关于 炎症疾病
慢性 炎性疾病已被公认为当今世界最重要的死亡原因之一,全球所有 死亡病例中超过50%归因于炎症相关疾病,例如缺血性心脏病、中风、癌症、糖尿病、慢性 肾病、非酒精性脂肪肝("NAFLD")以及自身免疫性和神经变性疾病。炎症体的过度和持续激活与这些类型的慢性疾病的病理生理学有关。
炎症体由3种蛋白质组成:(I)几种类型的感受器分子中的一种,(Ii)含有caspase招募结构域(“asc”)的凋亡相关斑点样蛋白,以及(Iii)促炎症caspase-1(“促caspase-1”)。它们是根据它们相关的传感器分子来命名的,如NLRP1、NLRP2、NLRP3、NLRC4、AIM2和PYRIN。许多炎症性疾病往往与多种类型的炎症体的激活有关。例如,多发性硬化症与AIM2、NLRP1、NLRP3和NLRC4的激活有关。炎性小体的ASC成分 是一个很有前途的药物靶点,因为它是上面提到的六种最常见类型的炎性小体的成分。我们认为,这比针对特定的传感器蛋白更有利,后者是一种炎症体的一种成分,是几个潜在竞争对手的焦点。除了在启动炎症反应所需的炎性小体的形成和激活方面发挥关键作用外,ASC还在与ASC斑点的细胞外释放相关的炎症的永久化中发挥作用。通过针对ASC,我们相信IC 100具有有效控制多种炎症性疾病炎症的潜力。
我们的 管道
我们管道的目标是针对具有高度未满足医疗需求的肾脏和炎症适应症,我们相信可以通过我们的作用机制解决这些问题。我们打算通过为VAR 200和IC 100开发多个适应症 ,以及通过潜在的肾脏和抗炎候选产品的许可,进一步增强和扩大我们的产品组合。
| 72 |
我们的 当前的管道包括以下内容:
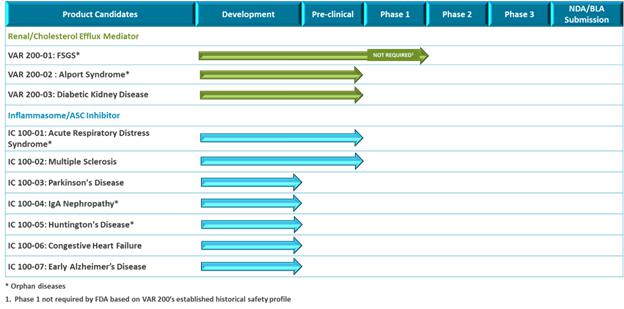
| 1. | 开发 阶段:开发药物制剂以确保满足适当的药物递送参数的阶段。 | |
| 2. | 临床前 阶段:进行体外(实验室)和体内(动物)研究以收集证据证明临床试验合理性的阶段 在人类身上。 | |
| 3. | FDA 根据VAR 200的既定历史安全性特征,同意VAR 200不需要进行I期试验。 |
对于VAR 200,我们的主要肾脏指征是FSGS(VAR 200-01)。对于IC 100,我们将在计划于2024年第二季度提交IND之前选择一个或多个销售线索指示。这将基于现有和未来临床前研究的数据。
由于慢性炎症导致了无数不同的疾病和状况,我们相信IC 100具有治疗多种炎症性疾病的潜力。以下是IC 100‘S电流管道的市场 摘要。
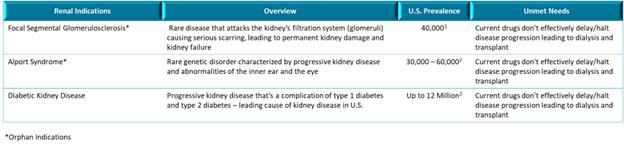
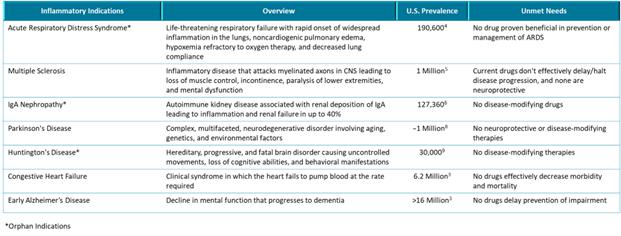
| 1. | 金塔尼利亚 E,et al. Front Genet. 2021年12月 | |
| 2. | 国家 多发性硬化症协会 | |
| 3. | IgA 肾病市场DelveInsight报告,2021年10月 |
| 4. | 国家 癌症研究所 | |
| 5. | 帕金森病 基础 | |
| 6. | 亨廷顿疾病市场。DelveInsight报告,2021年10月 | |
| 7. | 疾病控制和预防中心 |
| 73 |
业务 战略
我们 寻求被公认为领先的生物制药公司,处于创新前沿,为有高度未满足医疗需求的患者提供服务。 我们致力于通过开发生物制药产品来恢复健康并改变患者的生活。我们的策略 是:
| ● | 推进VAR 200的开发。我们打算通过支持在2024年第一季度对8名糖尿病肾病患者进行概念验证研究来推进VAR 200的开发,随后启动2a期临床试验。这项概念验证试验将能够在患者进行试验的同时评估他们的药物效果。关键 所学知识将用于2a阶段试验的设计。 | |
| ● | 推进我们的IC 100临床前计划。我们计划推进IC 100临床前计划,以便在2024年第二季度提交IND。 我们目前有小鼠和非人类灵长类动物(NHP)的非GLP毒理学数据表明,高达300 mg/kg的剂量没有不良反应,以及代表急性呼吸窘迫综合征和多发性硬化症的动物模型中IC 100的药理学概念验证数据。我们计划在小鼠和NHP上进行GLP毒理学研究,并在多达6个其他适应症(如IgA肾病、帕金森氏病、早期阿尔茨海默病、亨廷顿病和充血性心力衰竭)中进行额外的动物研究。这将使最佳选择一个或多个铅适应症将 带入临床。 | |
| ● | 充分利用我们的适应症扩展战略,通过在各自的治疗领域开发多个适应症,最大限度地发挥我们每个产品平台的商业潜力。我们目前的生产线包括三种胆固醇的潜在适应症 外排介质TMVAR 200、VAR 200(包括FSGS、Alport综合征和糖尿病肾病)和IC 100炎症体ASC抑制物平台的八个潜在适应症(包括ARDS、多发性硬化症、IgA肾病、帕金森氏症、亨廷顿病、充血性心力衰竭和早期阿尔茨海默病)。我们打算利用我们从两个产品平台的临床前和临床计划中获得的知识,以确定扩大适应症的其他机会。 | |
| ● | 维护 开发和商业化我们候选产品的权利。我们打算保留开发和商业化的权利 我们在美国的候选产品,同时寻求与其他制药公司的战略联盟和合作 加速发展,分担风险,补充资源,最大限度地发挥美国以外的潜力。 | |
| ● | 扩展 我们的候选产品组合。我们计划通过利用我们在开发和商业化方面的专业知识来扩展我们的产品组合 以识别和批准具有重大临床和商业潜力的其他候选药物。除了适应症 我们的VAR 200和IC 100平台的扩展,我们的业务战略包括确定和抓住机会获取开发 以及与肾脏和炎症疾病治疗有关的技术的商业化权利。 | |
| ● | 继续 以加强和扩大我们的知识产权组合。VAR 200的知识产权由一个投资组合组成 在美国和其他国家的已发布和正在申请的专利。我们有2个涵盖肾小球疾病的专利家族, 糖尿病肾病同样,我们计划为FSGS和Alport综合征寻求孤儿药指定,这将 如果这些司法管辖区获得批准,则在美国提供7年独家经营权,在欧盟提供10年独家经营权。知识分子 IC 100的财产包括在美国和其他国家的已发布和正在申请的专利组合。we have 5 专利系列涵盖物质组成,生物标志物和使用方法。此外,我们计划寻求孤儿专属权 我们为IC 100开发的任何罕见疾病适应症对于这两个产品平台,我们的专有地位通过其他 技术诀窍和商业秘密。我们计划在适当情况下积极寻求获得最广泛的知识产权保护 申请专利或其他适用知识产权保护,涵盖新产品或增强产品 专利技术和开发中的新制剂、给药方案和给药途径。 |
上文中反映的 日期和事件仅为估计值,无法保证所包含的事件 将在呈现的预期时间轴上完成,或根本不会完成。此外,无法保证我们将成功开发 我们的任何候选产品,或我们未来可能开发的任何其他产品或候选产品,或我们未来可能开发的任何候选产品 将获得FDA的任何适应症批准。
| 74 |
我们的 候选产品
胆固醇 外排调节剂 TM,Var 200(2-羟丙基-β-环糊精,2HPβCD)
胆固醇外流调节剂VAR 200是一种临床开发中的可注射药物,用于治疗慢性肾小球疾病,最初专注于FSGS。根据我们的适应症扩展战略,可能会寻求Alport综合征和糖尿病肾脏疾病的适应症。
开发VAR 200的目的是保护肾脏结构和功能,并通过中介清除损害肾小球的多余胆固醇来减少导致肾小球疾病进展的蛋白尿 。在启动对FSGS患者的2a期试验之前, 我们计划在2024年第一季度支持一项开放标签的概念验证试验,我们预计将在那里获得8名糖尿病肾病患者的数据。这将能够在患者进行治疗时评估药物效果 ,并将为开发我们的2a阶段方案提供见解。VAR 200具有代表FSGS、Alport综合征和糖尿病肾病的动物模型的药理学概念验证数据,其中每一种都可以根据我们的适应症扩展策略进行开发。
胆固醇和脂质蓄积在肾小球疾病(包括FSGS、Alport综合征和糖尿病肾病)中的作用
在 慢性肾小球疾病中,胆固醇在肾小球足细胞中积聚,部分原因是细胞外转运受损, 胆固醇转运蛋白ABCA 1和ABCG 1表达降低导致"外排"。肾小球脂质蓄积的证明是 , 体外培养足细胞研究、人体活检数据和各种肾脏疾病的动物模型,包括FSGS、Alport综合征和糖尿病肾病。如下图所示,脂质积聚导致足细胞结构扭曲、足细胞足突受损, 和足细胞脱落和丢失,从而损害肾脏滤过,导致蛋白尿和疾病进展。我们假设, 脂质稳态和足细胞完整性的恢复有可能减缓正在进行的肾损伤进展至肾衰竭, 并延迟透析和最终移植的需要。
| 75 |
VAR 200作用机制
VAR 200的活性成分2H β CD由7个糖分子组成,形成一个3—D环,具有疏水核心 和亲水外部。VAR 200通过与肾小球膜的亲水组分相互作用,被动和主动介导胆固醇流出 。
被动 胆固醇流出
被动 胆固醇流出伴随着2HP β CD二聚体的形成而发生,该二聚体与细胞膜表面结合,并将胆固醇以包合物的形式掺入 其疏水核心。2HP β CD/胆固醇包合物从细胞膜表面释放 将胆固醇带入溶液,转移至胆固醇受体,如高密度脂蛋白("HDL")。
活动 胆固醇流出
主动 胆固醇流出通过介导游离胆固醇代谢为氧固醇而发生。氧化固醇激活肝脏X受体 ("LXR")—转录因子,导致诱导细胞胆固醇流出途径,包括上调胆固醇流出转运蛋白ABCA 1和ABCG 1,它们将细胞外的游离胆固醇转运至胆固醇受体,如HDL。
临床前支持Cholestol Efflux MediatorTMVAR 200
我们 相信VAR 200具有既定的受益/风险概况,得到我们的支持 体内此外,我们相信,来自代表FSGS、Alport综合征和糖尿病肾脏疾病的动物模型的数据表明,VAR 200可促进足细胞中胆固醇的清除,保护肾脏的过滤系统免受损害,并减少蛋白 溢出到尿液或“蛋白尿”中。这些类型的结果被认为是延缓或防止肾脏疾病进展的关键。
VAR 200和FSGS
在两种FSGS小鼠模型中评价VAR 200,一种是实验性活化T细胞核因子("NFAT")FSGS模型和一种 阿霉素("ADR")诱导的FSGS模型,其特征在于比 NFAT模型更温和、进展更少的肾病形式。
活化T细胞核因子(NFAT)模型
在 一项旨在检查改变的足细胞胆固醇稳态在NFAT介导的足细胞损伤中的作用以及VAR 200治疗效果 的研究中,研究人员以4,000 mg/kg的剂量对6周龄的NFATc 1皮下注射VAR 200NUC在用多西环素诱导前24小时给小鼠注射,然后每隔一天持续4天。单个转基因("ST")小鼠用作对照。
| 76 |
与 未处理的双转基因小鼠(下图中以"DT"表示)相比,VAR 200(下图中以"CD"表示)显著降低了FSGS小鼠肾皮质中的胆固醇。这与蛋白尿(白蛋白/肌酸比)显著降低 相关,如下所示。
阿霉素 (ADR)诱导模型
在 第二个FSGS模型中,研究人员向5周龄的BALB/c小鼠注射了一剂11 mg/kg的阿霉素。随后, 在24小时后通过皮下渗透泵以40 mg/kg的剂量给予VAR 200,持续10周。未诱导小鼠作为对照。
与未处理ADR诱导小鼠相比,VAR 200(下图中以"CD"表示)显著减少系膜扩张,系膜扩张通常与 脂质沉积相关,如下所示。这与VAR 200处理的ADR诱导小鼠中蛋白尿 (白蛋白/肌酸)和血尿素氮("BUN")的显著降低相关,如下所示。
| 77 |
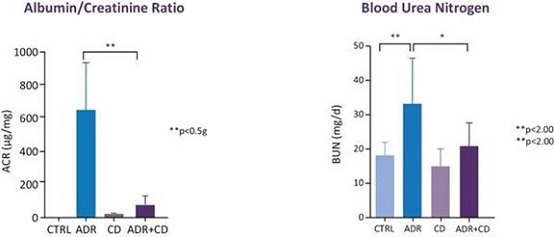
VAR 200和Alport综合征
在另一项研究中,为了评估VAR 200对Alport综合征是否有保护作用,研究人员以4000 mg/kg每周皮下注射VAR 200给四周大的雌性Col4a3基因敲除小鼠(Col4a3 −/−),持续4周。野生型Col4a3("Col43 +/+") 小鼠用作对照。
与未处理Alport综合征小鼠相比,VAR 200(在下图中以"CD"表示)显著降低Alport综合征小鼠肾脏中性脂质、胆固醇酯和胆固醇 晶体的累积,如下所示。
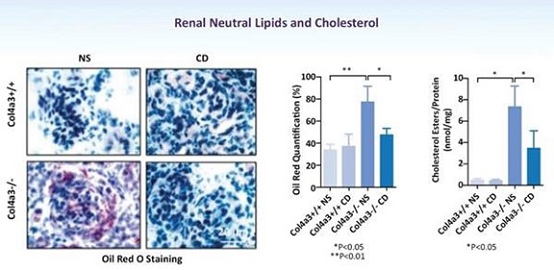
| 78 |
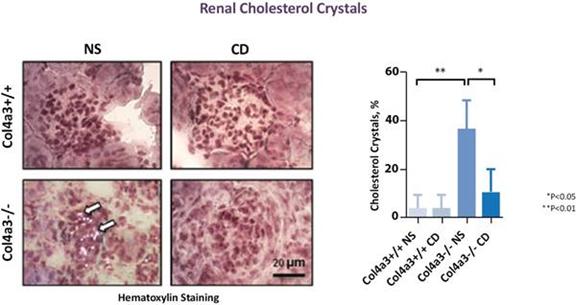
与未经治疗的Alport综合征小鼠相比,经VAR 200治疗的Alport综合征小鼠的细胞内脂肪水平降低与肾脏损害 (减少系膜扩张、纤维化和足突消失)显著减少相关,并且肾功能得以维持,与未经治疗的Alport综合征小鼠相比,蛋白尿(白蛋白/肌酐)、血尿素氮和血清肌酐均降低,这一点如下所示。
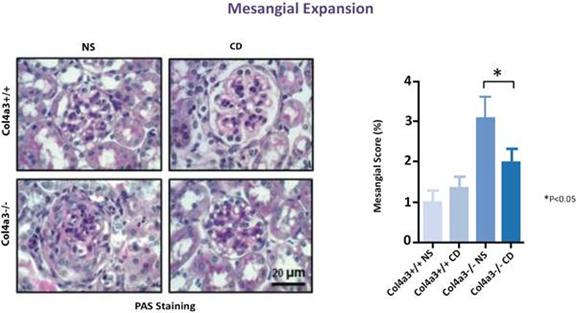
| 79 |
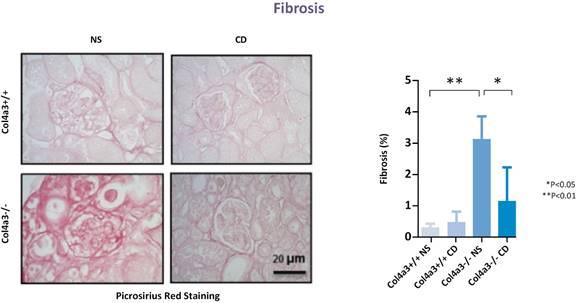
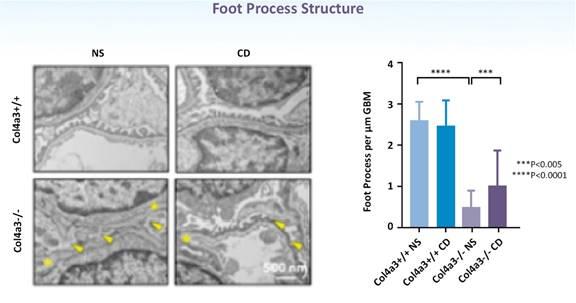
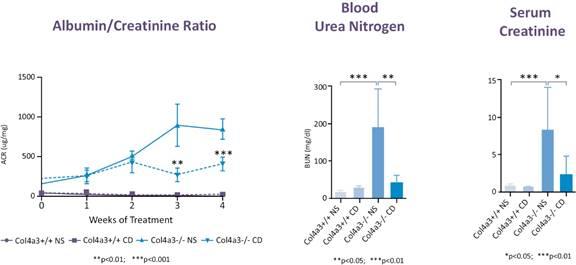
VAR 200与糖尿病肾病
在 另一项旨在确定VAR 200是否可以隔离细胞内胆固醇并保护足细胞免受糖尿病肾病中胆固醇依赖性损伤 的研究中,研究人员对4周龄BTBR ob/ob纯合子小鼠(一种进行性肾病的糖尿病模型)进行治疗, 每周3次皮下注射VAR 200,剂量为4,000 mg/kg,持续5个月。杂合子小鼠作为对照。
与未处理的 糖尿病小鼠相比,VAR 200(下图中以"CD"表示)显著降低了肾皮质中的总胆固醇。这与治疗后2个月开始的未治疗糖尿病小鼠肾损伤(系膜扩张)显著减少和蛋白尿(白蛋白/肌酐)减少 相关,从3个月 至研究结束,水平显著降低,如下所示。
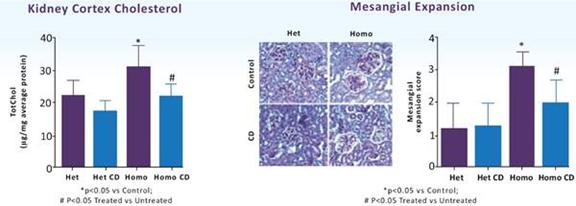
| 80 |
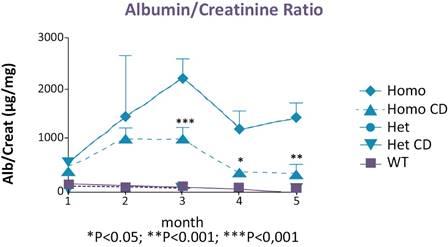
基于 以上总结的3种不同肾脏疾病动物模型的结果,我们认为VAR 200有可能诱导和维持肾病综合征肾病患者的蛋白尿部分或完全缓解,从而降低肾脏疾病进展的速率。
炎症体ASC抑制剂IC 100
IC 100是一种用于治疗多种炎症性疾病的临床前开发中的单抗抗炎症体ASC抑制剂。IC 100的开发目的是通过阻断先天炎症反应的启动和持续,以阻止疾病进展和提高生活质量,从而介导在多种炎症性疾病中致病的慢性异常炎症。
对于IC 100,尚未确定 线索指示。我们的重点是推动IC 100在2024年第二季度按计划提交IND申请 ,之后我们打算启动第一阶段试验。IC 100拥有代表ARDS和MS的动物模型的药理学概念验证数据 我们计划在小鼠和NHP中进行GLP毒理学研究,并在下一波临床前开发中对多达6种额外的适应症进行额外的动物研究,如IgA肾病、帕金森病、早期阿尔茨海默病、亨廷顿病和充血性心力衰竭。将根据我们临床前计划的数据为IC 100选择一个或多个铅适应症。
炎症体在炎症疾病中的作用
炎症体的过度 和持续激活与炎症性疾病的病理生理学有关。炎性体是多蛋白复合物,可启动对病原体或内部危险信号的免疫反应。它们由三种碱性蛋白质组成:(i)几种类型的传感器分子中的一种(例如,NLRP1、NLRP2、NLRP3、NLRC4、AIM 2和Pyrin),(ii)衔接蛋白,ASC,和(iii)半胱天冬酶原 1。每个传感器分子响应不同的病原体或内部危险信号。
如下图所示,在有害病原体或细胞损伤存在的情况下,细胞内的感应器分子(如NLRP3)被触发,刺激适配器ASC的招募,而ASC又招募 前caspase-1以形成炎症体。炎性小体是组织中心,招募额外的ASC,并以Pron样的 结构聚合,形成一个巨大的丝状信号平台,称为ASC SPECK。ASC SPOKS为前caspase-1募集提供了支架, 它触发了前caspase-1到活性caspase-1的转换,进而将细胞因子Pro-IL-1?转化为其活性形式,从而启动炎症反应。激活的caspase-1还驱动Gasdermin D的裂解,从而触发下垂, 一种程序性细胞死亡形式,释放活跃的细胞因子和ASC斑点进入细胞外空间,并持续激活 前IL-1ü,增强和维持邻近细胞和组织的炎症反应。尽管炎性小体触发先天免疫反应对于抵御病原体是必不可少的,但炎性小体持续的过度激活可能会导致许多炎症条件和疾病的基础的慢性炎症。许多炎症性疾病与多种类型的炎症体的激活有关。例如,多发性硬化症与AIM2、NLRP1、NLRP3和NLRC4的激活有关。
| 81 |
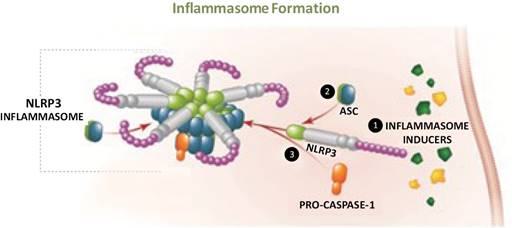
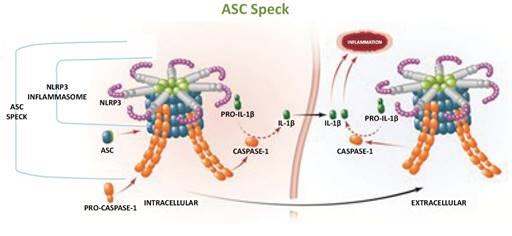
IC 100行动机制
IC 100被设计为结合衔接蛋白ASC中的关键氨基酸,所述关键氨基酸控制ASC募集到炎性体复合物和ASC Speck形成:
| ● | 通过抑制ASC重新聚集到炎症体复合体中,抑制炎症体的形成,从而阻断炎性物质下跌的启动; | |
| ● | 通过破坏ASC细胞内和细胞外斑点的形成,破坏性的炎症持续被阻止。 |
| 82 |
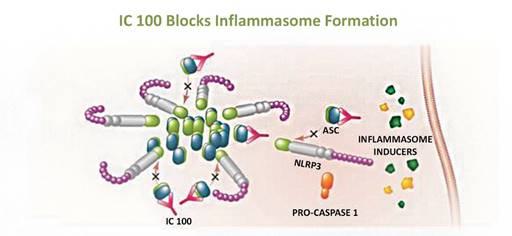
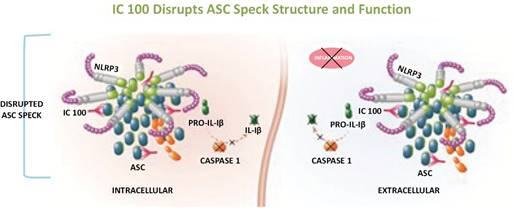
炎症体 一种情况下的激活可能影响另一种情况
最近发表在《翻译研究》上的一篇论文表明,由一种独特的炎症条件触发的炎症体活动和信号蛋白可以影响并潜在地与另一种炎症条件相互作用。作者提供了大量证据表明,创伤性脑损伤(TBI)和阿尔茨海默病(AD)是通过多种类型的炎症体(NLRP3、NLRP1和AIM2)的激活而联系在一起的。在每种情况下,炎症体的激活都会导致细胞死亡,并向邻近细胞释放活性细胞因子和ASC斑点,从而使一种情况可能加剧另一种情况。例如,有中度脑外伤病史的人患AD的风险是前者的2.3倍。同样,颅脑损伤患者的炎症体激活通过IL-18以及病理性ASC SPECK与淀粉样β蛋白和磷酸化tau的相互作用可能加剧AD的病理,这些都是AD的特征。作者报道,由于ASC在增强和维持邻近细胞的炎症方面的独特作用,以及它与淀粉样β蛋白和磷酸化tau的病理相互作用,因此ASC是治疗脑外伤和AD的有前途的治疗靶点。在随后的一项研究中,研究人员评估了通过使用IC 100抑制ASC来阻断炎症体活性是否可以减少脑损伤后AD小鼠升高的炎症反应。数据表明,100导致损伤后1周AD小鼠受损皮质中炎症体介导的细胞因子IL-1β减少。这与使用IC 100进行的临床前研究是一致的,这些研究显示创伤性脑损伤和与年龄相关的脑炎症(与阿尔茨海默病等疾病相关)模型中炎症活动减少,组织学和/或功能结果改善,将在下面的 下一节中重点介绍。
临床前 IC 100支持
在小鼠和非人类灵长类动物中进行的非GLP毒理学研究表明,IC 100具有良好的安全性。在这两个物种中,剂量在300毫克/千克以下的患者均未发生与药物相关的不良反应。同样,表观遗传筛选显示出比许多生物制品更低的免疫原性潜力。根据我们在代表MS的动物模型中进行的临床前研究,炎症在没有免疫抑制的情况下被减轻。 除了上面提到的创伤性脑损伤和年龄相关炎症(早期认知障碍)的研究外, IC 100还拥有代表ARDS和MS的动物模型的药理学概念验证数据,以及代表脊髓损伤的动物模型的机械概念验证数据 。
IC 100和MS
在 一项确定IC 100是否能防止MS进展的研究中,研究人员通过用髓鞘少突胶质细胞糖蛋白肽35—55("MOG35—55")免疫,在C57 BL/6小鼠中诱导了活动性实验性自身免疫性脑脊髓炎 ("EAE")。在临床症状出现前,第8天通过腹膜内("IP")注射10、30或45 mg/kg的IC 100 ,随后每4天给药一次,持续32天。车辆作为对照。
IC 100穿透脊髓并减少脊髓激活的小胶质细胞CD 4+、CD 8+和髓细胞的数量。这与 基于MS临床评分,延迟发作和功能显著改善相关,如下所示。
| 83 |
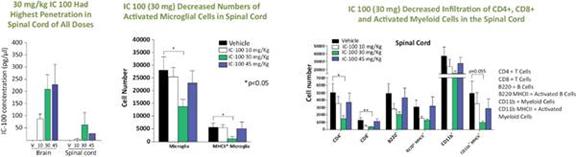
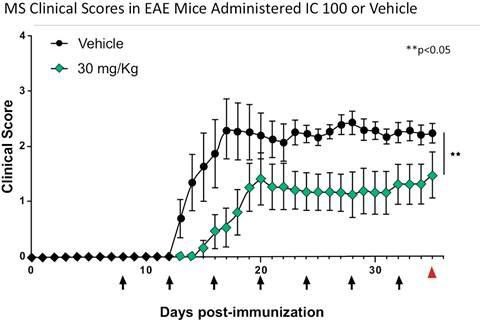
IC 100和ARDS
在 另一项旨在确定IC 100是否可以改善ARDS的组织病理学结局的研究中,研究人员通过从创伤性脑损伤小鼠体内递送细胞外囊泡("EV"),随后在EV递送1小时后IV 给予IC 100功能原型5 mg/kg,在未处理小鼠中诱导急性肺损伤和随后的 ARDS;24小时后处死动物。将数据 与未处理组、假手术组(生理盐水)组、未处理组或依诺肝素3 mg/kg实验组进行比较。
IC 100抑制肺中的炎性体和细胞因子活化,与未处理的阳性对照动物相比, 100通过Caspase—1、ASC、IL—1 β、AIM 2、HMGB1的降低证明。这与组织学结局改善和急性肺损伤 评分降低相关,表明肺损伤严重程度降低。
| 84 |
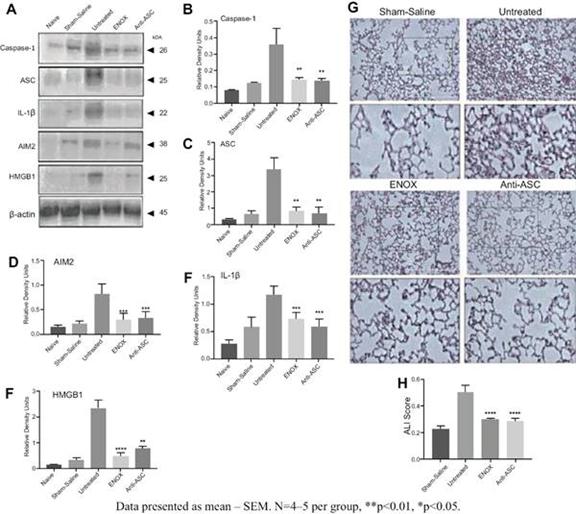
| 85 |
IC 100机械概念验证数据
脊髓损伤
为了 确定ASC中和在脊髓损伤中的作用,研究人员在中度颈脊髓损伤("SCI")的Fischer大鼠损伤后20分钟给予50 mcg抗ASC工具抗体IV和IP 。抗ASC中和 抗体降低半胱天冬酶—1活化和细胞因子水平,改善组织病理学结果和减少脊髓损伤体积, 并改善功能结果(例如,运动技能)与控制相比。
基于 在各种炎性疾病动物模型中的有希望的结果,我们认为IC 100有潜力介导与炎性疾病相关的持续 破坏性炎症并改善结局。
创伤性脑损伤
在两种不同的动物模型上评价了ASC中和在创伤性脑损伤中的作用,即穿透性弹道样脑损伤模型和液体冲击伤模型。
在穿透弹道样脑损伤模型中,研究人员在接受穿透弹道样脑损伤的SD大鼠中,在损伤后4小时以5 mg/kg的速度静脉注射IC 100的功能原型。与赋形剂对照组相比,IC100可降低炎性小体的激活,表现为caspase-1活性降低,小胶质细胞和浸润性白细胞出现松弛。
在流体冲击损伤模型中,研究人员在接受流体冲击损伤的SD大鼠中,在损伤后15微克立即静脉注射抗ASC工具抗体。免疫球蛋白G(“Ig G”)作为对照。ASC的中和干扰了NLRP1炎症体信号转导,导致caspase-1较Ig G显著降低。这与挫伤体积的显著减少有关。
年龄相关性炎症(早期认知障碍)
为确定IC-100对老年小鼠(即18月龄)的炎症反应的影响,以10 mg/kg的剂量给老龄小鼠(即18月龄)的老年小鼠注射IC-100。接受生理盐水对照组的老龄小鼠和未治疗的幼年小鼠(即3个月大的小鼠)作为对照。IC100减少炎症体蛋白水平(即NLRP1、Asc、Capase-1)和与IL-1β减少相关的Asc斑点,表明IC100减少了老龄小鼠皮质中的炎症体激活。
ASC 作为生物标志物
生物标志物 是预测、诊断和监测疾病进展的宝贵工具。它们还可用于针对可能 对特定治疗有反应的患者,并监测这些治疗随时间推移的持续疗效。
迈阿密大学的研究人员 评估了血清炎性体蛋白作为炎性疾病的潜在生物标志物,并将ASC 确定为潜在候选物。与健康人相比,各种炎症性疾病患者的血清ASC水平升高。 此外,与作为多发性硬化患者生物标志物的半胱天冬酶—1相比,ASC对半胱天冬酶—1的敏感性相似, 但特异性显著高于半胱天冬酶—1。
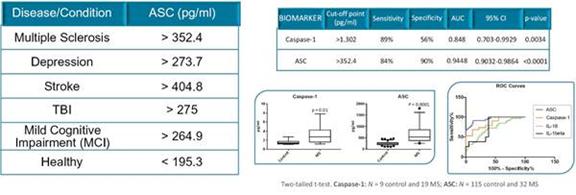
已证明ASC 水平与疾病结局和疾病严重程度相关,例如:
| ● | 在脑损伤患者中,损伤后前5天内的ASC蛋白水平可预测创伤后5个月的预后。 | |
| ● | 在将MS患者划分为轻度或中度疾病的患者中,中度患者的血清ASC水平高于轻度患者。 |
| 86 |
市场 和商业机会
我们 认为,我们的主要候选产品具有治疗医疗需求显著未满足的疾病的潜力,包括(i) 我们的主要候选肾脏产品VAR 200,正在开发用于多种肾脏适应症的潜在治疗,如局灶性节段性肾小球硬化症(FSGS)和Alport综合征(孤儿适应症)和糖尿病肾病;和(ii)我们的主要抗炎产品 候选产品,IC 100,用于治疗多种炎症性疾病,包括,但不限于多发性硬化症和急性呼吸窘迫综合征。VAR 200尚未被FDA授予FSGS或Alport综合征的孤儿药指定。
胆固醇 外排调节剂TMVar 200个商机
FSGS 市场
尚未确定针对FSGS的疾病特定药物疗法的总目标市场,因为没有批准的针对该疾病的药物疗法 (请参阅下一节,讨论当前的治疗限制)。根据NephCure Kidney International的数据,FSGS是一种孤儿症状,据估计在美国约有40,000人受到影响,每年有超过5,400例新诊断病例。FSGS最常见于45岁及以上的成年人,在美国黑人中的发病率是高加索美国人的四倍。
当前 FSGS治疗方法和局限性
目前,还没有针对FSGS的针对疾病的商业治疗方法,也没有已知的治疗方法。目前的治疗方法 侧重于保持足够的营养,控制血压和血脂,最大限度地减少尿蛋白损失, 防止浮肿并发症,从而稳定肾功能。最常见的药物治疗包括治疗浮肿的利尿剂、减少蛋白尿的血管紧张素转换酶抑制剂和血管紧张素转换酶抑制剂、其他降压药和降脂药物。类固醇和钙调神经磷酸酶抑制剂也可用于诱导蛋白尿的部分缓解。
我们 认为,对于有效的FSGS特异性治疗存在显著未满足的需求,这些治疗可延缓疾病进展、预防终末期肾病 、改善患者生活质量并降低卫生经济负担。
Alport 综合征(AS)
作为孤儿,肾脏疾病是一种进行性遗传性疾病,通常与听力损失和眼睛异常有关。它是由编码IV型胶原家族成员的基因突变引起的,最终导致肾脏基底膜或“肾小球”、内耳或“耳蜗”、 和眼睛的脂肪堆积和疤痕形成。强直性脊柱炎的一个关键的早期特征是尿液中的血液,或“血尿”,肾脏功能进行性下降,最终导致肾功能衰竭。影响双耳的听力损失发生在儿童晚期或青春期早期,通常是在肾衰竭发作之前。患者也可能有晶状体畸形(晶状体前圆锥)和视网膜颜色异常,但这些异常很少会导致视力丧失。AS患者预后较差。
AS 市场
由于没有FDA批准的针对AS疾病的 药物疗法(请参阅下一节讨论当前的治疗限制),因此尚未建立针对AS的疾病特定药物疗法的总目标市场。AS代表 所有地理和种族群体。尽管普通人群的总体发病率尚不清楚,但美国的数据显示,3%的儿童和0.2%的成人患有终末期肾脏疾病。根据美国国家罕见病组织的数据,美国AS的基因频率估计为1:5,000到1:10,000人,这表明大约有30,000到60,000人受到影响。
当前 AS治疗方法和局限性
目前还没有针对AS的针对疾病的商业治疗方法。目前的治疗方法侧重于最大限度地减少尿中蛋白质的损失,并防止浮肿并发症,以帮助稳定肾功能。对于有明显蛋白尿的AS患者,推荐使用血管紧张素转换酶(“ACE”)抑制剂或血管紧张素受体阻滞剂(“ARB”)治疗。我们认为,对于能够延缓疾病进展、防止终末期肾脏疾病和听力损失,并提高患者生活质量的有效的AS特异性治疗,仍有大量未得到满足的需求。
| 87 |
糖尿病 肾病
自20世纪50年代以来,肾脏 疾病或"肾病"已被认为是糖尿病的常见并发症。目前,糖尿病肾病 是美国和其他西方社会慢性肾病的主要原因。就个体糖尿病患者的发病率和死亡率而言,这也是最重要的 长期并发症之一。在美国,糖尿病占所有终末期肾病(“ESRD”)病例的30%至40%。蛋白尿是发病率和死亡率的预测因子。 蛋白尿患者的相对死亡率高出40倍。微量白蛋白尿(尿液中少量白蛋白) 独立预测心血管疾病,蛋白质、白蛋白溢出到尿液中(或"微量白蛋白尿和 大量白蛋白尿")会增加糖尿病患者因任何原因造成的死亡率。
糖尿病 肾病市场
尚未建立糖尿病肾病的疾病特异性药物治疗的 总可寻址市场,因为没有批准的 特定于该疾病的药物治疗(请参见下一节讨论当前治疗局限性)。患有糖尿病超过20年的患者中,高达50%的患者患有糖尿病肾病。据疾病控制和预防中心估计,美国有多达1200万人。
当前 糖尿病肾病治疗方法和局限性
高血糖或“高血糖”已被证明是糖尿病肾病进展的主要决定因素,因此良好的血糖控制是管理这种情况的关键。与其他肾脏疾病一样,目前还没有针对肾脏的药物疗法。使用血管紧张素转换酶抑制剂和ARB控制血压是护理的标准。新的治疗指南建议对2型糖尿病、糖尿病肾病患者使用钠-葡萄糖共转运体2(“SGLT2”)抑制剂,在当前任何血糖控制水平下,估计每1.73m2的肾小球滤过率(“≥”)为30毫升/分钟。SGLT2抑制剂已被证实可改善这一人群的肾脏和心血管结局。
我们 认为,对于能够延缓疾病进展、预防终末期肾脏疾病并提高患者生活质量的有效的糖尿病肾病特效治疗,存在着巨大的未得到满足的需求。
IC 100机会
抗炎 生物制品市场
全球抗炎生物制剂市场在2019年的价值为648.4亿美元,预计到2027年将达到1498亿美元。
多发性硬化症(MS)
多发性硬化症(MS)是一种潜在的大脑和脊髓致残性疾病,其发生是由于免疫系统攻击覆盖神经纤维的保护性髓鞘,导致大脑和身体其他部分之间的沟通问题。最终, 疾病会导致神经的永久性损伤或恶化。
MS的体征 和症状差异很大,取决于神经损伤的程度和受影响的特定神经。常见症状包括 一个或多个肢体麻木或无力、某些颈部运动时的电击感、震颤、缺乏协调或不稳 步态。有些重度MS患者可能会失去独立行走的能力或根本丧失行走的能力,而另一些患者可能会经历长时间的缓解 而没有任何新症状。视力问题在MS患者中也很常见,包括部分或完全视力丧失(通常 一次一只眼睛)、延长复视或视力模糊。其他症状可能包括言语不清、疲劳、头晕和刺痛 或身体部位疼痛。大约30%的患者在20至25年内发生严重残疾。
| 88 |
MS 市场
2019年,根据Cowan and Company的一份2020年报告,美国MS疾病修饰药物实现了144亿美元的销售额。根据当前 估计,根据美国多发性硬化症协会的数据,MS影响了美国100万人,全球280万人。根据国家多发性硬化症协会的数据,大约85%的MS患者患有复发缓解型MS,并经历了几天或几周内出现的新症状或复发,通常部分或完全改善。这些 复发之后是疾病缓解的平静期,可以持续数月甚至数年。大约60%至70%的复发缓解型MS患者最终出现症状稳定进展,有或没有缓解期,称为继发性进展型MS。一些 患有MS的患者经历了逐渐发作和体征和症状稳定进展而没有任何复发。这被称为初级渐进式 MS。
当前 MS治疗方法和局限性
当前MS的 治疗包括免疫调节疗法("IMT")以解决潜在免疫疾病,以及缓解 或改善症状的疗法。IMT的目标是减少复发频率和减缓疾病进展。虽然市场上有许多 疾病改善药物,但大多数药物仅被批准用于复发型MS。只有一种 IMT被FDA批准用于治疗原发性进展型MS。我们认为,对于有效治疗进展型MS的药物有着巨大的需求,我们认为IC 100有可能解决这一未满足的需求。
急性呼吸系统疾病综合征(ARDS)
ARDS 是一种危及生命的呼吸衰竭形式,其特征为肺部广泛炎症迅速发作、非心源性 肺水肿、氧疗难治的低氧血症、胸部X线片上弥漫性异常和肺顺应性降低。患者 需要延长ICU住院时间和住院时间,消耗大量医疗资源。预后差,并发症多,死亡率高;幸存者在康复后的数年内有明显的功能障碍。急性呼吸窘迫综合征最常见的原因是 COVID—19、肺炎、胃内容物吸入和败血症。
ARDS 市场
由于目前未使用药物治疗进行治疗(请 参见下一节讨论当前治疗局限性),目前尚未建立起针对ARDS的药物治疗总体市场。根据Quintanilla等人(2021年出版物),在美国,每年大约有90,600名患者感染ARDS,死亡率高达45%。在全球范围内,ARDS占重症监护病房住院人数的10%,每年有超过300万名ARDS患者。虽然急性呼吸窘迫综合征的发病率并不因性别而异,但随着年龄的增长而增加。
当前 ARDS治疗方法和局限性
目前没有市售的治疗ARDS的药物。目前对ARDS的治疗主要集中在基础疾病、支持性护理、使用低潮量的无创或机械通气以及保守的液体管理。我们相信IC 200有潜力 治疗急性呼吸窘迫综合征中广泛存在的炎症.
其他 发展候选人
我们 将继续寻求识别并获得与肾脏和炎症疾病相关的其他技术的商业化权利。
| 89 |
战略联盟和安排
L & F Research LLC许可协议
吾等 与L研究有限公司(“L研究”)订立经修订后于2015年12月15日生效的许可协议(“L研究许可协议”),据此,L研究根据VAR 200的专利及知识产权及专有技术授予吾等一项独家、享有版税、全球可再许可的许可,用于治疗、抑制或预防人类肾脏疾病及其症状,包括FSGS。L&F研究公司是由迈阿密大学米勒医学院的VAR200发明家和研究人员 创立的,他们从迈阿密大学获得了知识产权。根据L许可协议,吾等(I)于签署时向L研究支付预付许可费 200,000美元;(Ii)同意在实现某些开发里程碑时向L研究支付额外款项 ,总额最高可达2,150万美元;及(Iii)同意在实现某些净销售里程碑时,就任何由此产生的 产品的净销售额向L研究支付特许权使用费,根据某些年度净销售门槛从5%至10%不等。此外,于签署L及F许可协议后,吾等向L研究发行四(4)份认股权证(“L F认股权证”),可按L F许可协议及L F认股权证所载的若干条款及条件,合共行使25,113股我们的普通股。
2022年12月23日,我们与L研究 有限责任公司(“L研究”)签订了“放弃许可协议下某些权利的第二修正案”(“第二修正案”),修订了之前披露的、日期为2022年3月2日的ZyVersa治疗公司、佛罗里达州一家公司(“Old ZyVersa”)和L&F Research之间的许可协议下某些权利的放弃(“放弃协议”)。第二修正案进一步延长至2023年3月31日,即L研究放弃终止许可协议的权利并根据许可协议行使任何其他补救措施的期间,涉及根据L许可协议应向L研究支付的1,500,000美元的里程碑 付款(“里程碑付款”)。于2023年2月28日, 我们与L研究签订了修订及重述协议(“重述”),修订并重申经修订的放弃协议。重述规定,对于里程碑付款,L研究放弃其终止L&F许可协议并根据协议行使任何其他补救措施的权利,直至(A)2023年3月31日,关于该等里程碑付款的1,000,000美元(“放弃A”),和(B)2024年1月31日,关于该等里程碑付款的500,000美元(“放弃”)。豁免A取决于(I)本公司就L研究公司(借款方)与Old ZyVersa研究公司(贷款方)之间日期为2020年12月13日的承付票(日期为2020年12月13日)的未偿还本金总额351,579美元的宽免(“票据”),及(Ii)本公司将于2023年3月31日或之前向L研究公司支付648,421美元的现金付款。豁免B取决于本公司向L研究公司支付500,000美元现金,于(X)2024年1月31日或之前及(Y)本公司从发行新股本收到至少30,000,000美元净收益之日起十个工作日内完成。L许可协议的所有其他条款仍然有效 。
L & F许可协议将在L & F 许可协议项下所有特许权使用费支付义务最后到期时终止,我们有权在提前60天通知后终止L & F许可协议。
如果另一方严重违反协议,且未在通知后60天内纠正违约情况,则任何一方均可终止 L & F许可证。如果我们未能根据协议支付款项,L & F Research可在10天 通知后终止协议。此外,如果我们 直接或通过给予第三方的协助,启动任何干扰或反对程序,质疑 的有效性或可执行性,或反对任何延长或授予补充保护证书,L & F Research有权在书面通知我们后立即终止L & F许可协议, 任何许可方专利权(如协议中的定义)。
如果 我们未在投产里程碑完成日期(根据协议中的定义)完成投产里程碑, L & F Research可在90天书面通知我们后选择(a)终止整个协议;或(b)终止 协议的排他性条款并将许可证转换为非排他性。但是,在L & F Research终止 协议或终止排他性之前,如果由于不可抗力事件或 重大变更(如协议中所定义),我们未能在指定时间内实现特定的交付里程碑,则双方将真诚协商,商定相关交付里程碑的修订日期。如果我们不能就不可抗力事件或 重大变更达成一致意见,即在未能满足原始生产里程碑完成日期之日或我们通知发生不可抗力事件或重大变更后15天 (以较迟者为准),L & F Research可行使其终止权。
InflamaCORE, LLC许可协议
我们 与InflamaCORE,LLC(“InflamaCORE”)签订了一份于2019年4月18日生效的许可协议(“InflamaCORE许可协议”),根据该协议,InflamCORE向我们授予了一项独家的、全球性的、可再许可的专利、知识产权、技术和技术许可,用于IC 100的开发和商业化,用于所有疾病和疾病的治疗和诊断用途。InflamaCORE是由迈阿密米勒医学院IC 100发明者和研究人员创建的,他们从迈阿密大学和瑞士细胞系开发公司Selexis SA获得了知识产权许可。根据InflamaCORE许可协议,我们(I)在签署时向InflamaCORE支付了346,321.08美元的预付许可费;(Ii)同意在实现某些开发里程碑时向InflamaCORE支付额外款项,总额最高可达2250万美元;(Iii)同意在实现某些净销售里程碑时向InflamaCORE支付版税,根据净销售额的水平从5%到10%不等;(Iv)同意在实现某些净销售额里程碑(从净销售额的3%到6%不等)后,向迈阿密大学支付某些最终产品的净销售额的特许权使用费;以及(V)获得包括Selexis细胞系技术在内的所有第三方技术的再许可,并同意向InflamaCORE支付其Selexis许可的义务。根据Selexis许可证,我们向Selexis支付了50,000瑞士法郎的预付许可费。我们还有义务向Selexis支付(通过偿还InflamaCORE) (I)每年10,000瑞士法郎的维护费,(Ii)在实现某些开发里程碑时支付的款项,最高总额约为110万瑞士法郎,以及(Iii)按净销售额支付相当于较低个位数的特许权使用费。此外,于签署InflamaCORE许可协议后,并根据InflamaCORE许可协议,吾等(I)向迈阿密大学 发行5,714股普通股,(Ii)并向InflamaCORE发行四(4)份认股权证(“InflamaCORE认股权证”),可根据InflamaCORE许可协议及InflamaCORE认股权证所载若干条款及条件,合共行使5,675股本公司普通股。
| 90 |
InflamaCORE许可协议将在InflamaCORE 许可协议项下的所有版税支付义务最后到期时终止,我们有权在发出60天通知后终止InflamaCORE许可协议。如果另一方严重违反本协议,且未在 通知后60天内纠正违约行为,则任何一方均可 终止许可证。如果我们未能根据协议支付款项,InflamaCORE可提前10天通知终止协议。此外, 协议可由一方在另一方破产或无力偿债时终止。
InflamaCORE许可协议终止后,授予我们的许可将自动终止并恢复到InflamaCORE。
制造业
我们 目前没有拥有或运营任何设施来配制、制造、测试、储存、包装或分销VAR 200、IC 100和我们正在开发或可能寻求开发的任何其他候选产品,并且目前没有能力进行此类活动。 我们目前依靠第三方来制造、储存和测试VAR 200、IC 100以及我们可能寻求 开发的任何其他候选产品。我们将依赖第三方供应商和生产组织来提供我们所有所需的原材料和原料药 ,以及配制、生产、测试、储存、包装和分销临床试验数量的VAR 200、IC 100和我们可能寻求开发的任何其他候选产品 。我们计划继续发展我们的第三方供应商和制造组织网络, 但将来,如果有技术需求或 战略或财务利益,我们可能会决定考虑投资于我们自己的制造和供应能力。
我们 有内部人员,并利用具有丰富技术、制造、分析和质量经验的顾问来监督 我们的合同制造和测试活动。制造业受到广泛的法规的约束,这些法规规定了程序和文件 要求,包括但不限于记录保存、制造过程和控制、人员、质量控制和质量 保证。我们的系统、程序和承包商必须遵守这些法规,并通过定期 监控和正式审计进行评估。
研究和开发
我们 在2020年的研发活动上花费了大约650万美元,在截至2021年12月31日的一年中花费了210万美元,从2022年1月1日到2022年12月12日的前一段时间花费了540万美元,从2022年12月13日到2022年12月31日的后继期花费了40万美元,在截至2023年9月30日的九个月里花费了300万美元。
销售 和市场营销
我们 目前没有市场营销、销售或分销能力。要将任何获准商业销售的产品商业化,我们 必须开发自己的销售、营销和分销基础设施,或与拥有此类商业 基础设施和相关营销和销售经验的第三方合作。我们希望能够在 任何预期的产品发布之前,随着时间的推移建立我们的商业基础设施,我们可能依赖与战略合作伙伴的许可、联合销售和联合推广协议 来实现我们的产品的商业化。如果我们建立商业基础设施来支持VAR 200、 IC 100和我们可能寻求开发的任何其他候选产品的潜在市场营销,则预期此类商业基础设施将包括由销售管理、内部销售支持、内部营销团队和分销支持支持的有针对性的 销售队伍。为了 建立适当的商业基础设施,在批准VAR 200、IC 100和我们可能寻求开发的任何其他候选产品之前,我们需要投入大量的财务和管理资源。
竞争
制药和生物技术行业竞争激烈。这些竞争对手包括许多公共和私营公司、大学、 政府机构和其他积极参与产品研发的研究组织,这些产品可能与我们寻求开发或解决类似适应症的候选产品相似。许多竞争对手拥有比我们拥有的更多的财政、技术和人力资源,并且可能更有能力开发、制造和销售他们的产品。我们还预计 寻求开发与我们产品类似的产品和疗法的公司数量可能会随着时间的推移而增加。制药和生物技术行业的竞争因素 包括产品功效、安全性、易用性、价格、证明的成本效益、 营销效果、服务、声誉和获取技术信息。我们开发和寻求商业化的任何产品 可能无法在一个或多个这些考虑因素方面与我们竞争对手的产品竞争。
| 91 |
例如, 目前还有几家其他公司在临床开发针对FSGS的药物,靶向炎症、纤维化、 和血管收缩。在我们的竞争对手中,有一些产品处于不同的开发阶段,包括处于开发阶段2和 阶段3的化合物。然而,我们认为VAR 200可能是目前正在开发的唯一一种解决肾小球脂质积聚的药物 。目前肾脏疾病的治疗算法包括多种药物治疗,以解决导致肾脏疾病的各种途径 。我们认为VAR 200可能与其他治疗方式联合使用,解决 其他致病途径。
此外, 还有许多其他公司开发靶向炎性体途径的药物,其中一些公司正在进行多个适应症的临床试验 。在这些竞争对手中,我们了解到许多处于不同开发阶段的产品,包括正在进行或已完成II期临床试验的产品,包括痛风、施尼茨勒综合征、COVID—19呼吸系统症状、症状性膝关节骨关节炎、家族性感冒自身炎症综合征、角膜上皮缺损、干/湿黄斑变性、糖尿病视网膜疾病和黑色素瘤等适应症。此外,还有许多I期临床试验正在进行,包括CAPS、轻度COVID—19、收缩性心力衰竭和实体瘤等适应症 以及健康受试者。我们认为IC 100可能是 唯一靶向炎性体ASC组分的单克隆抗体,其可潜在地抑制多种类型的炎性体 以防止炎症的发生和持续。
知识产权
我们 寻求通过专利、监管排他性和专有技术的组合来保护我们的产品和技术。我们的 目标是为我们的产品、配方、工艺、方法和其他专有 技术获得、维护和实施专利保护,保护我们的商业秘密,并在不侵犯其他方(无论是在美国还是在其他国家)的所有权的情况下运营。我们的政策是在适当的情况下,通过合同安排和专利(如适用)的组合,积极寻求 在美国和国外 为我们当前的组合物和方法以及任何未来开发中的组合物和方法、专有信息、 和专有技术获得尽可能广泛的知识产权保护。然而,即使是专利保护,也不一定总是能够完全保护那些试图规避我们的 专利的竞争对手。关于其他情况,见题为"一节。风险因素—与我们的知识产权有关的风险。
根据L&F许可协议,我们拥有与2-hydroxypropyl-beta-cyclodextrin (“2HPβCD”)用于治疗人类肾脏疾病(包括FGS)相关的发明的独家、可再许可的全球许可,如某些使用方法专利和根据专利合作条约(“专利合作条约”)的规定在美国和部分外国(加拿大、中国、欧洲、日本和墨西哥)提交的未决申请中所述。目前,有3项美国专利和7项外国授权或允许的申请。这些专利以及从 待决申请中颁发的任何专利的有效期预计至少为2033年,不会有任何专利期调整或延长。
根据InflamaCORE许可协议,我们拥有与识别、诊断和治疗炎症小体及其组件所介导的炎症反应和炎症相关的发明的独家、可分许可的全球许可,包括但不限于IC 100,这是一种人源化的IgG4抗体,针对细胞凋亡相关斑点样蛋白(ASC)的派林域的特定氨基酸序列。IC 100的专利组合包括5个专利系列,涵盖物质组成、生物标记物和使用方法专利及其在美国和选定国家/地区(澳大利亚、巴西、加拿大、智利、中国、哥伦比亚、欧洲、印度、印度尼西亚、以色列、日本、马来西亚、墨西哥、菲律宾、新加坡、南非、韩国、泰国、越南)的相关国家申报文件。目前,已颁发的美国专利有5项,国外已批准或允许的申请有3项,待批申请有56项。这些专利以及从待决申请中颁发的任何专利的有效期预计至少为2028年, 没有任何专利期调整或延长。
| 92 |
目前,ZyVersa没有与L & F或InflamaCORE许可协议相关的专利或专利申请。
即使 我们已经授权了已发布的专利,但如果受到第三方的质疑 ,也不能保证专利的有效性得到维护。我们无法保证我们的任何知识产权将为我们提供任何免受竞争的保护。
2023年2月24日,我们提交了两项商标申请:(1)Cholesterol Exfflux Mediator™和(2)Lipid Exfflux Mediator™ ,用于治疗肾脏疾病和疾病的药物制剂。尚未就开发中的产品或技术的任何名称或徽标提交其他商标保护申请 。我们计划在适当的情况下在美国境内和境外寻求商标保护。我们打算将这些注册标记用于 我们的药物研究和开发(包括专有技术)以及我们的候选产品。
监管事项
在美国,FDA根据联邦食品、药物和化妆品法案(FDCA)、公共卫生服务法(PHSA)和其他联邦法律和法规对药品、生物制品和医疗器械进行监管。这些受FDA监管的产品也受州和地方法规以及外国适用的法律或法规的约束。 FDA和州、地方、地方司法管辖区和外国的类似监管机构对受FDA监管的产品的研究、开发、测试、制造、质量控制、标签、包装、储存、分销、记录保存、批准、 批准后监测、广告、促销、营销、抽样和进出口提出了实质性要求。
政府 法规
我们未来可能寻求开发或收购的与VAR 200、IC 100和任何其他候选产品相关的任何产品开发活动都将受到多个政府机构的广泛监管,包括FDA和其他联邦、州和 地方法规以及其他国家/地区的类似监管机构,它们规范制药 产品和设备的设计、研究、临床 和非临床开发、测试、制造、储存、分销、进口、出口、标签、广告和营销。通常,在销售一种新药之前,必须获得大量证明其质量、安全性和有效性的数据,组织成每个监管机构特定的格式,提交给监管机构进行审查并获得监管机构的批准。 这些数据通常是在两个不同的开发阶段产生的:临床前和临床。VAR 200、IC 100和我们未来可能寻求开发或收购的任何其他候选产品,必须获得FDA通过新药申请(“NDA”)、生物许可申请(“BLA”)或其他适用的审批程序的批准,才能在美国合法上市 。
临床开发阶段通常可以分为三个可能重叠的连续阶段:第一阶段、第二阶段和第三阶段临床试验 。在第一阶段,通常,少量健康志愿者暴露于单次递增剂量,然后再暴露于候选产品的多次递增剂量 。这些研究的主要目的是评估药物的新陈代谢、药理作用、副作用耐受性和安全性。第二阶段试验通常涉及对受疾病影响的患者进行研究,以确定产生预期益处所需的剂量。同时,还收集了安全性和进一步的药代动力学和药效学信息。在某些情况下,FDA可能不认为有必要或不要求进行正式的第一阶段和第二阶段试验。当FDA认为原料药的安全性和有效性很好时,通常就是这种情况。在第三阶段的研究中,药物或治疗会被提供给大群人,以确认其有效性、监测副作用、将其与常用的治疗方法进行比较,并收集信息以使 药物或治疗得以安全使用。在既定的监管路径下,原料药与FDA已知的原料药相同或相似的药品通常比该机构全新的化合物进入更精简的开发计划。
批准后 研究,有时称为4期临床试验,可在初步上市批准后进行。这些研究可用于从预期治疗条件下的患者的治疗中获得更多经验,或获得药物的其他适应症 。在某些情况下,FDA可能会强制执行第4阶段研究。
| 93 |
美国药品和生物制品的发展
在美国,获得监管批准以及随后遵守适当的联邦、州、地方和外国法律法规的过程需要花费大量的时间和财力。在产品开发过程、审批过程或批准后的任何时间未能遵守适用的美国要求,可能会 申请人受到行政或司法制裁。这些制裁可能包括FDA拒绝批准待决申请、 撤回批准、临床封存、警告信、产品召回或从市场上撤回、产品扣押、完全或部分暂停生产或分销、禁令、罚款、拒绝政府合同、恢复原状、退还或 民事或刑事处罚。
在美国开始对新药或生物制品进行人体临床研究之前,临床前实验室和动物试验通常是根据FDA的《良好实验室规范》进行的。赞助商必须将临床前试验的结果与生产信息、分析数据、任何可用的临床数据和文献以及拟议的临床方案 一起作为研究新药(IND)申请的一部分提交给FDA。其他国家也要求提交类似的文件。 IND中必须提供的数据量取决于研究的阶段。第一阶段研究通常比较大的第三阶段研究需要更少的数据。在开始临床试验之前,必须向FDA提交临床计划。如果FDA对临床计划或拟议研究的安全性有顾虑,他们可以随时暂停或终止该研究。研究必须按照良好的临床实践进行,并定期报告研究进展和任何不良经历。研究也受到独立机构审查委员会的审查,这些委员会负责监督特定研究人员地点的研究 并保护人类研究对象。独立机构评审委员会也可在启动后暂停或终止研究。 因此,提交IND不能保证FDA批准临床试验开始,或一旦开始,不会出现可能导致试验暂停或终止的问题。
美国药品和生物制品的审查和批准
完成第三阶段试验后,将对试验数据进行分析,以确定安全性和有效性。然后,将完整的开发数据以保密协议或BLA的形式提交给FDA,同时提交产品的建议标签以及将用于确保产品质量的制造和测试流程和设施的信息。NDA和BLA申请是药品 赞助商正式建议FDA批准在美国销售和营销的新药品的工具。NDA或BLA 必须包含安全性、纯度、效力和有效性的证明,这需要广泛的临床前和临床测试。在IND的动物研究和人类临床试验期间收集的数据将成为NDA或BLA的一部分。
FDA对NDA或BLA的审查和评估可能需要几年时间才能完成。FDA可以对新产品的生产设施进行审批前检查,以确定它们是否符合cGMP要求,并可能审计 临床和临床前试验的数据。
FDA可以在批准时附加条件,包括要求风险评估和缓解策略(“REMS”)以确保该制剂的安全使用。如果FDA得出结论认为需要REMS,则申请的赞助者必须提交建议的REMS,其中可能包括用药指南、医生沟通计划或确保安全使用的要素,如受限分发方法、患者登记和其他风险最小化工具。
IND与药物和生物制品的临床试验
在开始药物或生物制品的人体临床试验之前,必须向FDA提交一份IND,其中包含临床前研究的结果以及其他信息,如有关产品化学、制造和控制的信息以及建议的方案。IND是FDA授权给人类服用研究药物或生物制品的请求。 IND在FDA收到后30天自动生效,除非FDA在30天内对临床试验的进行提出担忧或问题。在这种情况下,IND赞助商必须在临床试验开始之前解决FDA的任何悬而未决的问题。在药物开发期间进行的每个后续临床试验都必须单独提交给现有的IND。
| 94 |
建议进行临床试验的每个研究中心的独立机构审查委员会(“IRS”)必须在该研究中心开始试验之前审查并 批准试验的研究计划。必须获得每位 试验受试者的知情书面同意。
人类 药物和生物制品的临床试验通常按顺序进行,这些阶段可能会重叠:
| ● | 阶段 I:研究药物/生物最初给健康的人类受试者或有目标疾病或状况的患者 ,以确定药物在人体内的新陈代谢和药理作用,副作用,如果可能,获得关于有效性的早期证据 。在第一阶段临床试验期间,可以获得关于研究药物/生物的药代动力学和药理作用的足够信息,以允许设计控制良好和科学有效的第二阶段临床试验。 | |
| ● | 阶段 第二阶段:进行临床试验是为了评估药物/生物制剂对特定适应症或目标人群中有限数量患者的有效性,以确定可能的不良反应和安全风险,确定药物/生物制剂对特定目标疾病的疗效,并确定剂量耐受性和最佳剂量。赞助商可在开始规模更大、成本更高的第三阶段临床试验之前进行多个第二阶段临床试验 以获取信息。 | |
| ● | 第三阶段:当第二阶段临床试验证明药物/生物制剂的剂量范围似乎有效且具有可接受的安全性,并为第三阶段临床试验的设计提供足够的信息时,第三阶段临床试验可以在多个临床地点扩大的 患者群体中开始。它们旨在进一步评估剂量、有效性和安全性, 建立研究药物/生物的总体效益-风险关系,并为产品标签 和FDA批准提供充分的基础。在大多数情况下,FDA需要两个充分且受控良好的III期临床试验,以证明该药物在多个临床试验地点扩大的患者群体中的疗效。 |
所有 临床试验必须按照FDA法规进行,包括药物临床试验质量管理规范("GCP")要求, 这些法规旨在保护试验参与者的权利、安全和福祉,定义临床试验申办者、管理人员 和监查员的角色,并确保临床试验数据的完整性。监管机构(包括FDA、IRB、数据安全监测委员会 或申办者)可随时基于各种原因暂停或终止临床试验,包括发现受试者 暴露于不可接受的健康风险或临床试验未按照FDA要求进行。
在 新药或生物制剂的开发过程中,申办者有机会在某些时候与FDA会面。这些时间点可以 在提交IND之前、II期临床试验结束时以及提交NDA或BLA之前。可请求在其他时间举行会议 。这些会议可为申办方提供机会,共享迄今为止收集的数据信息, FDA提供建议,申办方和FDA就下一阶段的开发达成协议。申办者通常会利用 II期临床试验结束会议讨论其II期临床试验结果,并提出他们认为将支持新药/生物制剂批准的关键III期注册试验的计划。
试验用药物产品是同一剂型中两种不同药物的组合,必须符合另一项规则 ,该规则要求每种组分对制剂声称的作用有贡献。这通常需要进行更大规模的研究 ,对药物的每一种成分进行测试。
临床试验信息披露
FDA监管产品(包括药物、生物制品和器械)临床试验的申办者 需要注册和披露某些 临床试验信息。与产品、患者人群、研究阶段、研究中心和研究者以及临床试验的其他方面相关的信息,作为注册的一部分予以公开。申办者还有义务在完成临床试验后讨论其结果 。临床试验结果的披露可以推迟到正在研究的新产品或新适应症 获得批准。竞争对手可以使用这些公开可用的信息来获取有关 开发计划进展的知识。
| 95 |
新药申请(NDA)和生物制品许可证申请(BLA)审批流程
我们的 药物或生物制品必须分别通过NDA和BLA批准程序获得FDA的批准,然后才能 在美国合法上市。FDA要求在美国上市的药物或生物制品的这些程序通常涉及 :
| ● | 完成非临床实验室测试,如果是NDA,则完成根据良好实验室实践或其他适用法规进行的动物研究和配方研究; | |
| ● | 提交IND申请 ; | |
| ● | 根据GCP进行的人体临床试验,以确定拟用于其预期用途的药物或生物制品的安全性和有效性。 | |
| ● | 在所有关键临床试验完成后,向FDA提交NDA或BLA(视情况适用); | |
| ● | FDA对生产设施的审批前检查和对临床试验地点的审计;以及 | |
| ● | FDA 批准保密协议或BLA(如果适用)。 |
为了获得在美国上市的药物或生物制品的批准,必须向FDA提交一份上市申请,其中 提供数据,证明试验药物在拟定适应症中的安全性和有效性,并使FDA满意。准备和提交NDA或BLA的费用是巨大的。每份NDA或BLA提交都需要支付用户费用 (2019财年超过250万美元),除非适用豁免或豁免。经批准的BLA的制造商或赞助商 还需缴纳年度设立费。该申请包括从相关非临床研究、 或临床前研究和临床试验中获得的所有相关数据,包括阴性或不明确的结果以及阳性结果,以及与产品化学、生产、控制和拟定标签相关的详细 信息,以及其他信息。数据可以 来自公司申办的旨在测试产品使用的安全性和有效性的临床试验,或来自许多 替代来源,包括由符合GCP要求的研究者发起的研究。
公司 还必须开发有关药物或生物制品特性的其他信息,并最终确定NDA 或BLA申办者按照现行药品生产质量管理规范("cGMP")要求生产产品的工艺。 生产工艺必须能够始终如一地生产候选产品的质量批次,并且生产商必须 开发检测成品药物或生物制品的方法。此外,必须选择和测试适当的包装, 必须进行稳定性研究,以证明候选产品在 有效期内不会发生不可接受的变质。
药物或生物制品开发、非临床研究和临床试验的结果,以及生产过程 、对药物或生物制品进行的试验、拟定标签和其他相关信息的描述,作为申请产品上市的NDA或BLA的一部分, 提交给FDA 。
FDA审查提交的所有NDA或BLA,以确保它们在接受其 备案之前足够完整,可进行实质性审查。FDA可以要求提供更多信息,而不是接受NDA或BLA进行备案。在这种情况下,必须重新提交NDA或BLA 以及附加信息。重新提交的申请在FDA接受申请之前也要接受审查。FDA 在收到NDA或BLA后有60天的时间进行初步审查,以根据FDA的阈值确定,即申请是否被接受提交 ,即申请足够完整,允许进行实质性审查。
一旦 NDA或BLA提交被接受备案,FDA将开始对NDA或BLA进行深入审查,以确定 申报产品是否安全有效地用于其预期用途,以及产品是否按照cGMP生产,以确保产品的特性、强度、质量和纯度。FDA已同意 NDAs和BLA审查的具体绩效目标,并寻求在提交相应申请后12个月内审查标准NDAs或BLA,并在8个月内审查生物制品 。FDA可能会将审查过程延长三个月,以考虑 某些迟交的信息或旨在澄清提交文件中已经提供的信息的信息。
| 96 |
FDA评估NDA或BLA后,将发布批准函或完整的回复函。批准函授权 药物或生物制品的商业销售,并附有针对特定适应症的特定处方信息。完整的回复 函表明申请尚未准备好审批。完整的回复函可能需要额外的临床数据和/或 额外的关键临床试验,和/或与临床试验、 临床前研究或生产相关的其他重要、昂贵且耗时的要求。即使提交了此类附加信息,FDA也可能最终决定NDA或 BLA不符合批准标准。FDA还可以将新药物或生物制品或出现安全性或有效性难题的药物或 生物制品的申请提交给咨询委员会,通常是一个由 临床医生和其他专家组成的小组,以供审查、评估和建议是否批准申请,如果批准, 在什么条件下批准。FDA不受咨询委员会建议的约束,但会仔细考虑此类建议 ,并在做出决定时通常遵循此类建议。
在 批准NDA或BLA之前,FDA通常会检查产品生产的工厂。FDA将不会批准 产品,除非FDA确定生产工艺和设施符合cGMP要求,并足以 确保产品在要求的质量标准范围内一致生产。FDA在评估NDA或BLA和生产设施后,发布批准函或完整的回复函。如果FDA确定申请、生产过程或生产设施不可接受,其完整的回复函通常会概述缺陷,并且通常 会要求提供额外的测试或信息,其中可能包括额外的大规模临床测试或信息,以便 FDA重新考虑申请。这可能会大大推迟对申请的进一步审查。
如果 FDA发现某个临床试验机构未按照GCP法规进行临床试验,FDA可以决定将该临床试验机构生成的数据 排除在NDA或BLA中提供的主要疗效分析之外。此外,尽管 提交了任何要求的额外信息,FDA最终可能会决定申请不符合批准的监管标准。
If, or when, those deficiencies have been addressed to the FDA’s satisfaction in a resubmission of the NDA or BLA, the FDA will issue the approval letter. The FDA has committed to reviewing such resubmissions in 2 or 6 months depending on the type of information included. An approval letter authorizes commercial marketing and distribution of the product with specific prescribing information for specific indications. As a condition of approval, the FDA may require substantial post-approval testing and surveillance to monitor the product’s safety or efficacy after a product is approved, including additional clinical trials and may impose other conditions, including labeling restrictions, which can materially affect the product’s potential market and profitability. These so-called Phase IV or post-approval clinical trials may be a condition for continuing drug approval. The results of Phase IV clinical trials can confirm the effectiveness of a product candidate and can provide important safety information. In addition, the FDA now has express statutory authority to require sponsors to conduct post-marketing trials to specifically address safety issues identified by the agency. Once granted, product approvals may be withdrawn if compliance with regulatory standards is not maintained or problems or safety issues are identified following initial marketing.
FDA还有权要求REMS确保药物或生物制品的益处大于其风险。赞助商也可以自愿提出REMS作为NDA提交的一部分。作为NDA或BLA审查的一部分,确定是否需要REMS。REMS的要素可能包括“亲爱的医生函”、用药指南、更详细的有针对性的教育计划,以及在某些情况下确保安全使用的要素(“ETASU”),这是限制最严格的REMS。ETASU可包括但不限于针对处方或配药的特殊培训或认证、仅在某些情况下的配药、特殊监测和患者登记簿的使用。这些要素是作为保密协议或BLA批准的一部分进行协商的,在某些情况下,批准日期可能会推迟。一旦实施,REMS将接受定期评估和 修改。
对已批准申请中确立的某些条件进行更改 ,包括适应症、标签、设备组件或制造流程或设施的更改 ,可能需要提交和FDA批准新的NDA或BLA,或NDA或BLA补充物,才能实施更改 。新适应症的NDA或BLA补充剂通常需要与原始申请中类似的临床数据,并且FDA在审查NDA或BLA补充剂时使用与审查NDA或BLA相同的程序和行动。
| 97 |
即使候选产品获得监管部门的批准,批准也可能仅限于特定的疾病状态、患者群体和剂量,或者可能以警告、预防或禁忌症的形式,或以繁琐的风险管理计划、分销限制或上市后试验要求的形式,包含对使用的重大限制。此外,即使在获得监管部门批准 之后,发现以前未知的产品问题可能会导致该产品受到限制,甚至完全从市场上撤出。此外,可能会建立新的政府要求,包括由 新立法产生的要求,或者FDA的政策可能会改变,这可能会推迟或阻止监管部门批准我们正在开发的产品。此外,我们无法预测未来美国或外国政府的行动可能会产生哪些不利的政府法规 。
《哈奇-瓦克斯曼法案》
根据修订后的1984年《药品价格竞争和专利期限恢复法》(俗称《哈奇-瓦克斯曼法案》),在临床开发和FDA监管审查期间丢失的产品美国专利期的一部分可以恢复。Hatch-Waxman修正案还提供了一个程序,用于在FDA批准的药物产品中列出与已批准产品有关的专利,并带有治疗等效性评估(通常称为橙色手册),以及寻求批准 引用已列出专利的产品的申请的竞争对手,以进行与此类专利有关的认证。此外,《哈奇-瓦克斯曼修正案》 规定了针对FDA接受或批准某些竞争对手申请的法定保护,称为非专利排他性。
专利期限恢复
专利期限恢复可以通过为涵盖新产品或其用途的专利返还最多五年的专利寿命来补偿药物开发和监管审查过程中损失的时间。这段时间通常是IND的生效日期(在专利颁发之后)和保密协议提交日期之间的时间的一半,加上保密协议提交日期和申请获得批准之间的时间 ,前提是发起人尽职调查。然而,专利期限恢复不能将专利的剩余期限延长 自产品批准之日起总共14年,并且只能延长适用于经批准的 药物的一项专利,并且必须在专利到期之前申请延长。美国专利商标局与FDA协商后,审查和批准任何专利期延长或恢复的申请。
橙色 图书清单
在通过保密协议寻求药物批准的过程中,申请人被要求向FDA列出其权利要求涵盖申请人的产品的每一项专利。一旦药物获得批准,NDA持有者在药物申请或其他方面列出的每一项专利都会在FDA的橙皮书中公布。橙色手册中列出的药物反过来可以被潜在的仿制药竞争对手引用,以支持 批准简化新药申请(“ANDA”)。ANDA允许销售含有与上市药物相同强度和剂型的有效成分(S),并已通过生物等效性测试 证明在治疗上与上市药物相同的药物产品。除了生物等效性测试的要求外,ANDA申请者不需要 进行临床前研究或临床试验的结果,以证明其药物产品的安全性或有效性。 根据ANDA批准的药物通常被称为上市药物的“仿制药”,并且通常可以由药剂师在为原始上市药物开出的处方下替代。任何申请人提交ANDA申请以寻求批准橙皮书中所列药物的仿制药或涉及橙册中所列药物的505(B)(2)NDA时,必须向FDA证明:(I)作为申请标的的药物产品的专利信息尚未提交给FDA;(Ii) 此类专利已到期;(Iii)此类专利到期的日期;或(Iv)该专利无效或不会因制造、使用或销售申请所申请的药品而受到侵犯。最后一项认证称为第(Br)段IV认证。必须向作为认证标的的专利的每个所有者以及ANDA或505(B)(2)申请所指的经批准的保密协议的持有人提供第四款认证的通知。申请人还可以选择 提交“第八节”声明,证明其建议的标签不包含(或刻出)与专利使用方法有关的任何语言,而不是证明列出的使用方法专利。如果参考NDA持有者和专利所有人在收到第四款认证通知后45天内对橙书所列专利之一提出专利挑战,则FDA不得批准申请,直到收到第四款认证通知后30个月,即专利到期时,即与申请人有关的侵权案件做出有利于申请人的裁决时,或法院可能下令的较短或较长期限。这一禁令通常被称为30个月的缓期。 ANDA或505(B)(2)申请也将在橙色手册中列出的品牌参考药物的任何适用非专利排他性到期之前不会获得批准。因此,ANDA或505(B)(2)NDA的批准可能会被推迟很长一段时间,这取决于申请人所做的专利认证和参考药品赞助商发起专利诉讼的决定。
| 98 |
市场排他性
市场 FDCA下的排他性条款还可能推迟某些药物申请的提交或批准。《哈奇-瓦克斯曼法》(Hatch-Waxman Act) 为某些经批准的药物产品设立了监管排他期,在此期间,FDA不能批准(或在某些情况下 接受)依赖品牌参考药物的ANDA或505(B)(2)申请。例如,FDCA为第一个获得新化学实体(“NCE”)NDA批准的申请人提供了五年的美国境内非专利营销排他性 。 如果FDA以前没有批准过任何其他含有相同活性部分的新药,则该药物是NCE,该活性部分是负责该药物物质作用的分子或离子。在排他期内,FDA可能不接受由另一家公司为该药物的另一版本提交的ANDA或505(B)(2) NDA进行审查,但申请人不拥有或拥有对批准所需的所有数据的法定参照权。然而,如果申请包含第四段认证,则可以在四年后提交申请。 《哈奇-瓦克斯曼法案》还规定,如果FDA认为申请人进行或赞助的一项或多项新的 临床研究(生物利用度或生物等效性研究除外)对批准申请至关重要,则针对特定批准条件的NDA(包括505(B)(2)NDA)或上市产品的变更,如先前批准的产品的新配方,《哈奇-瓦克斯曼法》还规定了三年的市场排他性。现有药物的剂量或强度。 这三年排他期防止FDA批准ANDA和505(B)(2)NDA,适用于包括需要新临床数据的创新的药物,但不禁止FDA批准包含原始有效成分的ANDA。 五年和三年排他期不会推迟完整NDA的提交或批准;但是,提交完整的保密协议的申请者必须进行或获得证明安全性和有效性所必需的所有非临床研究和充分且控制良好的临床试验的参照权。
生物仿制药 排他性
2009年《生物制品价格竞争和创新法案》(简称"BPCIA")根据《公共卫生服务法案》(简称"PHSA")第351(k)节为生物仿制药产品创建了一个简化的审批途径。生物仿制药产品或"生物仿制药"是指与现有FDA许可的参比产品高度相似且无临床意义差异的生物 产品。生物相似性 必须通过分析研究、动物研究和至少一项临床研究来证明,除非豁免。如果生物仿制药产品为生物仿制药,且符合BPCIA的其他要求,包括 预期其产生与参比产品相同的临床结果,且多次给药的产品, 生物制剂和参比生物制剂在先前给药后可互换,而不会增加安全风险,或 相对于仅使用参比生物制剂,疗效降低的风险。可以用可互换产品替代 参比产品,而无需处方者参与。
Under the BPCIA, no section 351(k) application for a biosimilar may be submitted for four (4) years from the date of licensure of the reference product. Additionally, a reference biologic is granted twelve (12) years of exclusivity from the time of first licensure of the reference product, During this twelve (12)-year exclusivity period, another company may still market a competing version of the reference product if the FDA approves a full BLA for the competing product submitted under section 351(a) of the PHSA containing the competing sponsor’s own pre-clinical data and data from adequate and well-controlled clinical trials to demonstrate the safety, purity, and potency of the other company’s product. The first biologic product submitted under the abbreviated approval pathway that is determined to be interchangeable with the reference product may obtain exclusivity against a finding of interchangeability for other biologics for the same condition of use for the lesser of (i) one (1) year after first commercial marketing of the first interchangeable biosimilar; (ii) eighteen (18) months after the first interchangeable biosimilar is approved if there is no patent challenge; (iii) eighteen (18) months after resolution of a lawsuit over the patents of the reference biologic in favor of the first interchangeable biosimilar applicant; or (iv) forty-two (42) months after the first interchangeable biosimilar’s application has been approved if a patent lawsuit is ongoing within the forty-two (42)-month period.
| 99 |
加快开发和审查计划
快速 路径指定
Fast track designation may be granted for a product that is intended to treat a serious or life-threatening disease or condition for which preclinical or clinical data demonstrate the potential to address unmet medical needs for the condition. The sponsor of an investigational drug product may request that the FDA designate the drug candidate for a specific indication as a fast track drug concurrent with, or after, the submission of the IND for the drug candidate. The FDA must determine if the drug candidate qualifies for fast track designation within 60 days of receipt of the sponsor’s request. For fast track products, sponsors may have greater interactions with the FDA and the FDA may initiate review of sections of a fast track product’s NDA before the application is complete. This rolling review is available if the FDA determines, after preliminary evaluation of clinical data submitted by the sponsor, that a fast track product may be effective. The sponsor must also provide, and the FDA must approve, a schedule for the submission of the remaining information and the sponsor must pay applicable user fees. At the time of NDA filing, the FDA will determine whether to grant priority review designation. Additionally, fast track designation may be withdrawn if the FDA believes that the designation is no longer supported by data emerging in the clinical trial process.
突破性的 治疗指定
The FDA may also accelerate the approval of a designated Breakthrough Therapy, which is a drug that is intended, alone or in combination with one or more other drugs, to treat a serious or life-threatening disease or condition and preliminary clinical evidence indicates that the drug may demonstrate substantial improvement over existing therapies on one or more clinically significant endpoints, such as substantial treatment effects observed early in clinical development. The sponsor of a Breakthrough Therapy may request the FDA to designate the drug as a Breakthrough Therapy at the time of, or any time after, the submission of a IND for the drug. If the FDA designates a drug as a Breakthrough Therapy, it must take actions appropriate to expedite the development and review of the application, which may include (i) holding meetings with the sponsor and the review team throughout the development of the drug; (ii) providing timely advice to, and interactive communication with, the sponsor regarding the development of the drug to ensure that the development program to gather the nonclinical and clinical data necessary for approval is as efficient as practicable; (iii) involving senior managers and experienced review staff, as appropriate, in a collaborative, cross-disciplinary review; (iv) assigning a cross-disciplinary project lead for the FDA review team to facilitate an efficient review of the development program and to serve as a scientific liaison between the review team and the sponsor; and (v) taking steps to ensure that the design of the clinical trials is as efficient as practicable, when scientifically appropriate, such as by minimizing the number of patients exposed to a potentially less efficacious treatment.
加速了 审批
Accelerated approval may be granted for a product that is intended to treat a serious or life-threatening condition and that generally provides a meaningful therapeutic advantage to patients over existing treatments. A product eligible for accelerated approval may be approved on the basis of either a surrogate endpoint that is reasonably likely to predict clinical benefit, or on a clinical endpoint that can be measured earlier than irreversible morbidity or mortality, that is reasonably likely to predict an effect on irreversible morbidity or mortality or other clinical benefit, taking into account the severity, rarity or prevalence of the condition and the availability or lack of alternative treatments. The accelerated approval pathway is most often used in settings in which the course of a disease is long, and an extended period of time is required to measure the intended clinical benefit of a product, even if the effect on the surrogate or intermediate clinical endpoint occurs rapidly. The accelerated approval pathway is contingent on a sponsor’s agreement to conduct additional post-approval confirmatory studies to verify and describe the product’s clinical benefit. These confirmatory trials must be completed with due diligence and, in some cases, the FDA may require that the trial be designed, initiated, and/or fully enrolled prior to approval. Failure to conduct required post-approval studies, or to confirm a clinical benefit during post-marketing studies, would allow the FDA to withdraw the product from the market on an expedited basis. All promotional materials for product candidates approved under accelerated regulations are subject to prior review by the FDA.
| 100 |
孤儿药物
根据 孤儿药法案,FDA可以授予孤儿药指定给旨在治疗罕见疾病或病症的药物,这通常是 在美国影响不到20万人或超过200人的疾病或病症,美国000人 但没有合理预期开发和制造此类疾病产品的成本,或 在美国销售的产品将恢复。
在提交NDA之前,必须申请孤儿药指定。在FDA授予孤儿药指定后,FDA公开披露该药物的身份和 其潜在的孤儿用途。孤儿药指定不会在监管审查和批准过程中带来任何好处或缩短 持续时间。
第一个获得FDA批准的特定活性部分用于治疗罕见疾病的NDA申请人 有权在美国针对该适应症获得7年独家上市期。在七年的排他性 期内,FDA不得批准任何其他针对同一疾病的相同药物上市申请,除非在有限的情况下, 例如通过更高的有效性、更高的安全性、 或为患者护理提供重大贡献,或在药物供应问题的情况下,表现出优于具有孤儿药排他性的产品的临床优越性。孤儿药的排他性并不妨碍 FDA批准不同的药物治疗相同的疾病或病症,或相同的药物治疗不同的疾病或病症。孤儿药指定的其他好处 包括某些研究的税收抵免和豁免NDA用户费。
儿科信息
根据 《儿科研究公平法案》或PREA,NDA或NDA补充剂必须包含用于评估 药物在所有相关儿科亚群中声明适应症的安全性和有效性的数据,并支持该药物安全有效的每个儿科亚群的剂量和给药。FDA可以批准全部或部分豁免,或推迟提交数据。 除非法规另有要求,否则PREA不适用于已授予孤儿指定的任何适应症药物, 某些例外情况除外。
如果满足某些条件,《儿童最佳药品法案》(BPCA)为NDA持有者提供六个月的药物独占权(专利或非专利)延期。排他性的条件包括FDA确定 与儿科人群使用新药相关的信息可能会为该人群带来健康益处、FDA 提出儿科研究书面请求,以及申请人同意在法定时间范围内进行并报告所要求的研究 。BPCA下的申请被视为优先申请,享有指定赋予的所有好处。
上市后 FDA法规
在 新产品获得批准后,制药公司和获批产品将受到FDA和其他 联邦和州监管机构的持续监管,其中包括监测和记录保存活动,向适用 监管机构报告产品的不良反应,向监管机构提供最新的安全性和有效性 信息,产品抽样和分销要求,以及遵守促销和广告要求,其中包括 直接面向消费者的广告标准,限制在药物批准标签中未描述的用途或患者人群中推广药物 (称为"标签外使用"),对行业赞助的科学和教育活动的限制,以及对涉及互联网的促销活动的要求。虽然医生可以处方合法可用的药物 用于标签外用途,但制造商不得销售或推广此类标签外用途。产品或标签的修改或增强 或生产地点的变更通常需要FDA和其他监管机构的批准,这些批准可能会收到,也可能不会收到 ,或者可能会导致漫长的审查过程。
| 101 |
FDA、州和外国监管机构拥有广泛的执法权力。不遵守适用的监管要求 可能导致FDA、州或外国监管机构采取执法行动,其中可能包括以下内容:
| ● | 无标题 信件或警告信; | |
| ● | 罚款、 交出、归还或民事处罚; | |
| ● | 禁令 (例如,全部或部分暂停生产)或同意令; | |
| ● | 产品 召回、行政拘留或扣押; | |
| ● | 客户 通知或维修、更换或退款; | |
| ● | 操作 限制或部分暂停或完全关闭生产; | |
| ● | 延迟或拒绝批准未来产品批准或外国监管机构对新产品、新预期用途或 对现有产品的修改的请求; | |
| ● | 撤回 或暂停FDA产品营销批准或外国监管机构批准,导致产品销售被禁止; | |
| ● | 临床 暂停临床试验; | |
| ● | FDA 拒绝向外国政府颁发出口产品在其他国家销售的证书;以及 | |
| ● | 刑事 起诉。 |
任何 这些制裁措施都可能导致高于预期的成本或低于预期的销售额,并对 我们的声誉、业务、财务状况和经营业绩产生重大不利影响。政府机构的此类行动也可能要求我们 花费大量资源来应对这些行动。任何机构或司法执法行动都可能对我们的业务产生重大不利影响 。
处方药 广告受联邦、州和外国法规的约束。在美国,FDA监管处方药促销, 包括直接面向消费者的广告。处方药促销材料必须在其 首次使用时一并提交给FDA。处方药产品和药物样品的任何分销必须符合美国处方药营销法(“PDMA”),这是FDCA的一部分。产品一旦获得批准,其制造将受到FDA全面和持续的 法规的约束。FDA法规要求产品在特定批准的工厂中生产,并符合 cGMP,NDA或BLA持有者必须列出其产品并向FDA注册其生产机构。这些法规 还对制造和质量保证活动提出了某些组织、程序和文件要求。 药品制造商和其他参与生产和分销获批药品的实体需接受FDA和某些州机构的定期突击检查 ,以确保其符合cGMP和其他法律。
使用合同制造商、实验室或包装商的NDA 或BLA持有人负责选择和监控合格的 公司。这些公司随时接受FDA的检查,发现违规行为可能导致执行行动 ,从而中断任何此类设施的运营或分销这些设施制造、加工或测试的产品的能力。 新发现或开发的安全性或有效性数据可能需要更改产品的批准标签,包括添加 新警告和禁忌症,还可能需要实施其他风险管理措施。
| 102 |
医疗保健 和报销条例
If VAR 200, IC 100 and any other product candidate that we seek to develop, are approved by the FDA, government coverage and reimbursement policies will both directly and indirectly affect our ability to successfully commercialize the product, and such coverage and reimbursement policies will be affected by future healthcare reform measures. Government health administration authorities, private health insurers and other organizations generally decide which drugs they will pay for and establish reimbursement levels for healthcare. In particular, in the United States, private health insurers and other third-party payors often provide reimbursement for products based on the level at which the government (through the Medicare or Medicaid programs) provides reimbursement for such treatments. Patients who are prescribed treatments for their conditions and providers performing the prescribed services generally rely on third-party payors to reimburse all or part of the associated healthcare costs. Many patients are unlikely to use our products unless coverage is provided and reimbursement is adequate to cover a significant portion of the cost of our products. Sales of our products will therefore depend substantially, both domestically and abroad, to the extent they are reimbursed by government health administration authorities, such as Medicare and Medicaid, private health coverage insurers and other third-party payors. The market for our products will depend significantly on access to third-party payors’ formularies, or lists of products or treatments for which third-party payors provide coverage and reimbursement. Also, third-party payors are developing increasingly sophisticated methods of controlling healthcare costs. Coverage and reimbursements for therapeutic products can differ significantly from payor to payor. A third-party payors’ decision to provide coverage for a medical product or service does not imply that an adequate reimbursement rate will be approved. One third-party payor’s decision to cover a particular medical product or service does not assure that other payors will also provide coverage for the medical product or services, or to provide coverage at an adequate reimbursement rate. As a result, the coverage determination process will require us to provide scientific and clinical support for the use of or products to each payor separately, with no assurance that adequate coverage and reimbursement will be obtained.
在 美国和其他潜在重要市场,VAR 200、IC 100和我们寻求开发的任何其他候选产品, 政府当局和其他第三方支付方正在开发越来越复杂的控制医疗成本的方法。 例如,第三方支付方正试图限制或规范医疗产品的价格,特别是新的和创新的 产品和疗法的价格,这导致了平均销售价格的下降。此外, 美国越来越重视管理式医疗保健,这将给产品定价、报销和使用带来额外压力。这些压力可能来自管理式医疗团体的规则和 实践、司法决定以及与医疗保险、医疗补助和医疗保健改革有关的政府法律法规、药品报销政策和一般定价。
美国和一些外国司法管辖区已经颁布或正在考虑多项立法和监管提案 ,旨在改变医疗保健体系,从而影响我们以盈利方式销售产品的能力。在美国和其他地方的决策者和 支付者中,有很大的兴趣促进医疗保健系统的变革,其目标是控制医疗保健成本、提高医疗质量和/或扩大医疗保健的可获得性。在美国,制药行业一直是这些努力的一个特别重点,并受到重大立法举措的重大影响,包括2010年3月颁布的《患者保护》 和《平价医疗法案》(ACA)。今后,可能会有其他与 美国医疗保健系统改革有关的提案,其中一些提案可能会进一步限制我们对产品的收费价格,或 产品的报销金额。如果向 总务管理局联邦供应计划的授权用户提供药品,则适用其他法律和要求。所有这些活动还可能受到 联邦和州消费者保护和不正当竞争法的约束。
此外, 如果药品由Medicare、Medicaid或其他联邦或州医疗保健计划报销,我们和我们的业务活动, 包括但不限于我们的销售、营销和科学/教育补助计划,必须遵守经 修订的《虚假索赔法案》、经修订的联邦反回扣法令》、其他医疗保健欺诈和滥用法律以及类似的州法律。此外,如果 门诊处方药产品由Medicare或Medicaid报销,定价和回扣计划必须符合(如适用) 1990年综合预算协调法案(经修订)和2003年Medicare处方药改进和现代化法案的Medicaid回扣要求。
其他 监管事项和合规要求
Manufacturing, sales, promotion and other activities following product approval are also subject to regulation by numerous regulatory authorities in addition to the FDA, including, in the United States, the Centers for Medicare & Medicaid Services (“CMS”), other divisions of the Department of Health and Human Services, the Drug Enforcement Administration, the Consumer Product Safety Commission, the Federal Trade Commission, the Occupational Safety & Health Administration, the Environmental Protection Agency, and state and local governments. Sales, marketing and scientific/educational programs must also comply with federal and state fraud and abuse laws. Pricing and rebate programs must comply with the Medicaid rebate requirements of the U.S. Omnibus Budget Reconciliation Act of 1990. If products are made available to authorized users of the Federal Supply Schedule of the General Services Administration, additional laws and requirements apply. The handling of any controlled substances must comply with the U.S. Controlled Substances Act and Controlled Substances Import and Export Act. Products must meet applicable child-resistant packaging requirements under the U.S. Poison Prevention Packaging Act. Manufacturing, sales, promotion and other activities are also potentially subject to federal and state consumer protection and unfair completion laws.
| 103 |
药品分销受到其他要求和法规的约束,包括广泛的记录保存、许可、存储和安全要求,旨在防止未经授权销售药品。
ACA中的 联邦医师支付阳光法案及其实施条例要求某些药物、 设备、生物和医疗用品制造商,如果根据医疗保险、医疗补助或儿童健康保险 计划支付费用,(除某些例外情况外)报告与支付或分配给医生和教学医院的某些付款或其他价值转移有关的信息,或应医生和教学医院的要求或代表医生和教学医院指定的实体或个人,并每年报告医生及其直系亲属持有的某些所有权和投资权益。
此外,我们可能受到联邦政府和我们开展业务所在州的数据隐私和安全法规的约束。 经《健康信息技术促进经济和临床健康法》(“HITECH”)及其实施条例修订的《1996年健康保险可携带性和责任法案》(“HIPAA”)对个人可识别健康信息的隐私、安全和传输提出了某些要求。除其他事项外,HITECH使 HIPAA的隐私和安全标准直接适用于“业务伙伴”--代表承保实体接收或获取受保护健康信息以提供服务的独立承包商或代理。HITECH还创建了四个新的民事罚款等级,修订了HIPAA,使民事和刑事处罚 直接适用于商业伙伴和可能的其他人,并赋予州总检察长新的权力,可以向联邦法院提起民事诉讼,要求损害赔偿或禁令,以执行联邦HIPAA法律,并寻求与提起联邦民事诉讼相关的律师费和费用。此外,州法律在某些情况下管理健康信息的隐私和安全, 其中许多法律在很大程度上彼此不同,可能不会产生相同的效果,从而使合规工作复杂化。例如,加利福尼亚州最近颁布了《加州消费者隐私法》(California Consumer Privacy Act,简称CCPA),并于2020年1月1日生效。 CCPA除其他事项外,还为承保公司制定了新的数据隐私义务,并为加州居民提供了新的隐私权,包括选择不披露其信息的权利。CCPA还创建了针对某些数据泄露的法定损害赔偿的私人诉权 ,从而潜在地增加了与数据泄露相关的风险。
腐败 法律
美国《反海外腐败法》和类似的外国反腐败法一般禁止公司及其中间人 为获得 或保留业务或获取不公平优势而进行不正当付款或提供任何有价值的东西以不正当地影响外国政府官员。近年来,反腐败法的全球执行量大幅增加 。我们预期的非美国业务和我们预期的扩展到美国以外的其他国家,包括发展中国家,可能会增加此类违规行为的风险。违反这些法律可能导致严重的 刑事或民事制裁,可能扰乱我们的业务,并可能对我们的声誉、业务和运营结果 或财务状况造成不利影响。
国际药物管制
我们在美国以外的任何司法管辖区销售VAR 200、IC 100和我们寻求开发的任何其他候选产品之前, 我们必须在该司法管辖区获得必要的上市许可。许多此类司法管辖区需要大量的安全性和有效性数据 ,类似于FDA在授予上市许可前要求的数据。我们可能无法成功获得我们在美国境外寻求的营销 授权。如果我们在一个司法管辖区(包括美国)成功获得上市许可,则该授权并不确保我们将在任何其他司法管辖区获得上市许可。 销售药品所需的授权因管辖区而异。如果我们在美国以外的任何司法管辖区获得 上市批准,我们将遵守该司法管辖区的现行法规, 与我们在美国将遵守的现行法规一致。
| 104 |
国际 数据隐私和安全法
Certain non-U.S. laws, such as the GDPR govern the privacy and security of health information in certain circumstances, some of which are more stringent than HIPAA and many of which differ from each other in significant ways and may not have the same effect, thus complicating compliance efforts. Failure to comply with these laws, where applicable, can result in the imposition of significant civil and/or criminal penalties and private litigation. For example, in Europe, the GDPR went into effect in May 2018 and introduces strict requirements for processing the personal data of individuals within the EEA. The GDPR also increases the scrutiny of transfers of personal data from clinical trial sites located in the EEA to the United States and other jurisdictions that the European Commission does not recognize as having “adequate” data protection laws. Further, recent legal developments in Europe have created complexity and compliance uncertainty regarding certain transfers of information from the EEA to the United States. For example, on June 16, 2020, the Court of Justice of the European Union, or the CJEU, declared the EU-U.S. Privacy Shield framework, or the Privacy Shield, to be invalid. As a result, Privacy Shield is no longer a valid mechanism for transferring personal data from the EEA to the United States. Moreover, it is uncertain whether the standard contractual clauses will also be invalidated by the European courts or legislature, which seems possible given the rationale behind the CJEU’s concerns about U.S. law and practice on government surveillance. Companies that must comply with the GDPR face increased compliance obligations and risk, including more robust regulatory enforcement of data protection requirements and potential fines for noncompliance of up to €20 million or 4% of the annual global revenues of the noncompliant company, whichever is greater. Additionally, following the United Kingdom’s withdrawal from the European Union and the EEA, companies have to comply with the GDPR and the GDPR as incorporated into United Kingdom national law, the latter regime having the ability to separately fine up to the greater of £17.5 million or 4% of global turnover. The relationship between the United Kingdom and the European Union in relation to certain aspects of data protection law remains unclear, for example around how data can lawfully be transferred between each jurisdiction, which exposes us to further compliance risk. In Canada, PIPEDA and similar provincial laws impose obligations on companies with respect to processing personal information, including health-related information, and provides individuals certain rights with respect to such information, including the right to access and challenge the accuracy of their personal information held by an organization. Failure to comply with PIPEDA could result in significant fines and penalties.
属性
于2019年1月18日,本公司就位于北商业园道2200 North Commerce Parkway,Suite 208,Weston 33326,签订约3,502平方尺写字楼 订立租赁协议(“租赁”)。租期为60个月,自2019年1月起至2024年1月止。我们相信,我们现有的设施足以满足我们目前的需求,但可能需要额外的办公空间 ,以满足我们预期的员工扩展。
员工
截至2022年12月31日,我们拥有七(7)名全职员工 。我们的所有员工都从事行政、财务、研发、临床、监管和业务发展职能。我们相信我们与员工的关系很好。此外,我们利用并将继续利用顾问、临床研究组织和第三方来执行我们的临床前研究、临床研究、制造和监管职能。
法律诉讼
我们 目前没有参与任何重大法律诉讼,也没有意识到会受到任何重大法律诉讼的影响。然而,我们可能不时成为我们日常业务过程中产生的各种法律诉讼的一方,这可能对我们的业务、 财务状况或经营业绩造成重大不利影响。无论结果如何,诉讼都可能因辩护和和解费用 、管理资源的转移和其他因素而影响我们的业务。
企业信息
我们 是以“Larkspur Health Acquisition Corp.”的名称注册成立的。2021年3月17日,根据特拉华州法律,进行涉及一个或多个其他企业的合并、资本股票交换、资产收购、股票购买、重组或类似的企业合并。2022年12月12日,我们更名为 “ZyVersa治疗公司”。与企业合并有关。
我们的主要执行办公室位于北商业公园路2200North Commerce Parkway,Suit208,Weston,佛罗里达州33326。我们的电话号码是(754) 231-1688,我们的网址是https://www.zyversa.com.
| 105 |
管理层对财务状况和结果的讨论和分析
运营
除非 上下文另有规定,否则本节中所有提及的“我们”、“我们”或“我们”指的是业务合并前佛罗里达州ZyVersa治疗公司与特拉华州ZyVersa治疗公司及其合并子公司在业务合并生效前的合并业务。
下面的讨论和分析提供了管理层认为与评估和了解我们的 综合运营结果和财务状况相关的信息。您应将此讨论和分析与本招股说明书中其他部分包含的合并财务报表和附注一起阅读。 由于四舍五入,某些金额可能不足额。本讨论和分析包含前瞻性陈述,涉及许多风险和不确定因素,包括但不限于“风险因素”和“关于前瞻性陈述的告诫陈述”中描述的风险和不确定性。我们没有义务更新这些前瞻性陈述中的任何一项。实际的 结果可能与任何前瞻性陈述中包含的结果大不相同。
业务 概述
我们是一家临床阶段的专业生物制药公司,利用先进的专利技术为肾脏 或炎症性疾病患者开发一流的药物,这些患者的医疗需求尚未得到满足。
我们的主要肾脏药物 ,我们称之为胆固醇外流调节剂TMVAR200(2-羟丙基-β-环糊精或“2HPβCD”)具有治疗多种肾脏疾病的潜力。我们的主要抗炎药候选药物,我们将其称为Inflammasome ASC抑制剂IC 100,是一种人源化的单抗IgG4抗体炎症体ASC抑制剂,靶向ASC,具有治疗多种炎症性疾病的潜力。
业务合并
于2022年12月12日(“截止日期”),吾等根据该业务合并协议(“业务合并协议”)的条款完成先前公布的业务合并,由ZyVersa治疗公司、佛罗里达州的ZyVersa治疗公司(“Old ZyVersa”)、其中指定的Old ZyVersa股东代表(“证券持有人代表”)、特拉华州的Larkspur Health Acquisition Corp.(“Larkspur”)及Larkspur的全资附属公司Larkspur Merge Sub,Inc.(“合并子公司”)完成先前公布的业务合并。根据业务合并协议的条款(以及在业务合并协议的所有其他条件得到满足或放弃时),于业务合并及拟进行的交易(“业务合并”)的截止日期,(I)Larkspur更名为“ZyVersa Treateutics, Inc.”,特拉华州的一家公司(“该公司”)及(Ii)与Old ZyVersa合并并并入Old ZyVersa(“合并”)的合并子公司, 与Old ZyVersa合并为合并中的幸存公司,并在实施该合并后,Old ZyVersa成为本公司的全资附属公司(统称为“继承人”)。
在业务合并完成之前,Larkspur于2021年3月17日在特拉华州注册成立,ZyVersa Treateutics,Inc.(前身) 于2014年3月11日作为Variant PharmPharmticals,Inc.在佛罗里达州注册成立。Merge Sub于2022年7月13日在特拉华州注册。提及“公司”或ZyVersa时,指的是截至2023年9月30日的三个月和九个月的继任者,指的是截至2022年9月30日的三个月和九个月的前任。
| 106 |
财务 运营概述
我们 到目前为止没有产生任何收入,并出现了严重的运营亏损。我们在2023年1月1日至2023年9月30日(后继期)期间的净亏损为8,500万美元,从2022年1月1日至2022年9月30日(前继期)的净亏损为940万美元。截至2023年9月30日,我们的累计赤字约为8990万美元,现金为160万美元。我们预计在可预见的未来将继续产生巨额费用和运营亏损 。我们预计我们与持续活动相关的费用将增加,因为我们:
| ● | VAR 200和IC 100的开发进展; | |
| ● | 准备 并提交监管提交; | |
| ● | 生产我们用于临床试验的候选产品; | |
| ● | 聘请额外的研发、财务、一般和行政人员; | |
| ● | 保护 保护我们的知识产权;以及 | |
| ● | 满足 成为上市公司的要求。 |
我们 需要额外的资金来支持我们的持续运营。我们正在寻求通过公共或私募股权或债务融资或其他来源为我们的运营提供资金,其中可能包括政府拨款和与第三方的合作。我们可能无法以可接受的条款获得足够的额外融资 ,或者根本无法获得。我们未能在需要时筹集资金,将对我们的财务状况、执行业务战略的能力和持续经营的能力产生负面影响 。我们将需要筹集大量资金以继续我们的研发目标并创造收入以实现盈利,但我们可能永远不会这样做 。
经营成果的组成部分
收入
自 成立以来,我们没有产生任何收入,预计在不久的将来也不会从产品销售中产生任何收入。如果我们针对候选产品的开发工作取得成功并获得监管部门的批准,或者如果我们与第三方签订了 协作或许可协议,我们未来可能会从产品销售 或协作或许可协议付款的组合中获得收入。
运营费用
研究和开发费用
研究和开发费用包括发现和开发我们的候选产品所产生的成本,主要包括:
| ● | 根据与合同研究组织(“CRO”)和研究地点签订的第三方协议而发生的费用,进行或将进行我们的临床试验和部分临床前活动的费用; | |
| ● | 原材料成本,以及我们用于临床试验和其他开发测试的材料的制造成本; | |
| ● | 费用,包括从事研究和开发活动的雇员的工资、股票薪酬和福利; | |
| ● | 设备成本、折旧和其他分摊费用;以及 | |
| ● | 为合同监管服务支付的费用 以及支付给包括美国食品和药物管理局在内的监管机构的费用 以审查和批准我们的候选产品。 |
| 107 |
我们 将研发费用按发生时支付。外部开发活动的成本根据 使用供应商提供给我们的信息对完成特定任务的进度进行的评估确认。这些活动的付款 基于个别协议的条款,可能与发生的成本模式不同,并在我们的财务报表中 反映为预付费用或应计费用。
研究 和开发活动是我们商业模式的核心。我们预计,在可预见的将来,我们的研发费用将继续增加 ,因为我们将继续为候选产品进行临床开发。随着产品进入临床开发的后期阶段 ,它们的开发成本通常高于临床开发早期阶段的产品,这主要是由于 后期临床试验的规模和持续时间的增加。从历史上看,我们的研发成本主要与VAR 200和IC 100的开发有关。随着我们推进VAR 200和IC 100,以及确定任何其他潜在候选产品, 我们将继续将我们的直接外部研发成本分配给产品。我们希望从我们的当前现金和现金等价物以及任何未来股权或债务融资或其他资本来源(包括与其他公司的潜在合作或其他战略交易)中为我们的研发费用提供资金。
我们候选产品的成功开发具有很大的不确定性。目前,我们无法合理估计或了解完成剩余开发所需的工作的性质、 时间和成本,或者何时(如果有的话),我们的候选产品可能会开始实质性的 现金净流入。这种不确定性是由于与 临床试验的持续时间和成本相关的许多风险和不确定性,这些风险和不确定性在项目的整个生命周期中因许多因素而显著不同,包括:
| ● | 纳入临床试验的临床地点数量; | |
| ● | 招收合适的患者所需的时间长度; | |
| ● | 参与临床试验的患者群体大小; | |
| ● | 患者接受的剂量数; | |
| ● | 患者随访的持续时间; | |
| ● | 候选产品的开发状况;以及 | |
| ● | 候选产品的有效性和安全性。 |
我们的 支出还受到其他不确定因素的影响,包括监管批准的条款和时间,以及提交、起诉、辩护和执行任何专利主张或其他知识产权的费用。我们可能永远无法成功获得监管部门 对我们的候选产品的批准。我们可能会从临床试验中获得意想不到的结果。我们可以选择停止、延迟或 修改候选产品的临床试验。与 候选产品开发相关的这些变量的结果发生变化,可能意味着与该候选产品开发相关的成本和时间发生重大变化。 例如,如果FDA或其他监管机构要求我们进行超出我们当前 预期的临床试验,或者如果我们在任何临床试验中出现了严重的入组延迟,我们可能需要花费大量 额外的财政资源和时间来完成临床开发。产品商业化将需要数年时间 ,开发成本可能高达数百万美元。
一般费用 和管理费用
一般 和管理费用主要包括行政、 和财务职能部门员工的工资、基于股票的薪酬和相关成本。一般和管理费用还包括法律、会计、审计、税务 和咨询服务、保险、人力资源、信息技术、办公室和差旅费用的专业费用。
我们 预计,随着我们增加一般和行政人员数量,我们的一般和行政费用将在未来增加 ,以支持我们的持续研发和候选产品的潜在商业化。我们还预计将产生 与上市公司相关的费用增加,包括会计、审计、法律、监管和税务合规 服务、董事和高级管理人员保险以及投资者和公共关系成本。
其他 (收入)支出
利息 支出包括与无担保可转换本票相关的债务利息和债务折价的增加,该票据的年利率为6%。
衍生负债的公允价值变动 代表我们的衍生负债定期按市价计价。本公司记录于发行时按公允价值计量的衍生负债,涉及若干应付可转换票据的赎回特征及认沽期权 。
| 108 |
运营结果
截至2023年9月30日(后继期)的三个月与截至2022年9月30日(前续期)的三个月的比较
下表汇总了我们在截至2023年9月30日的三个月的后续业务和截至2022年9月30日的三个月的业务业绩。
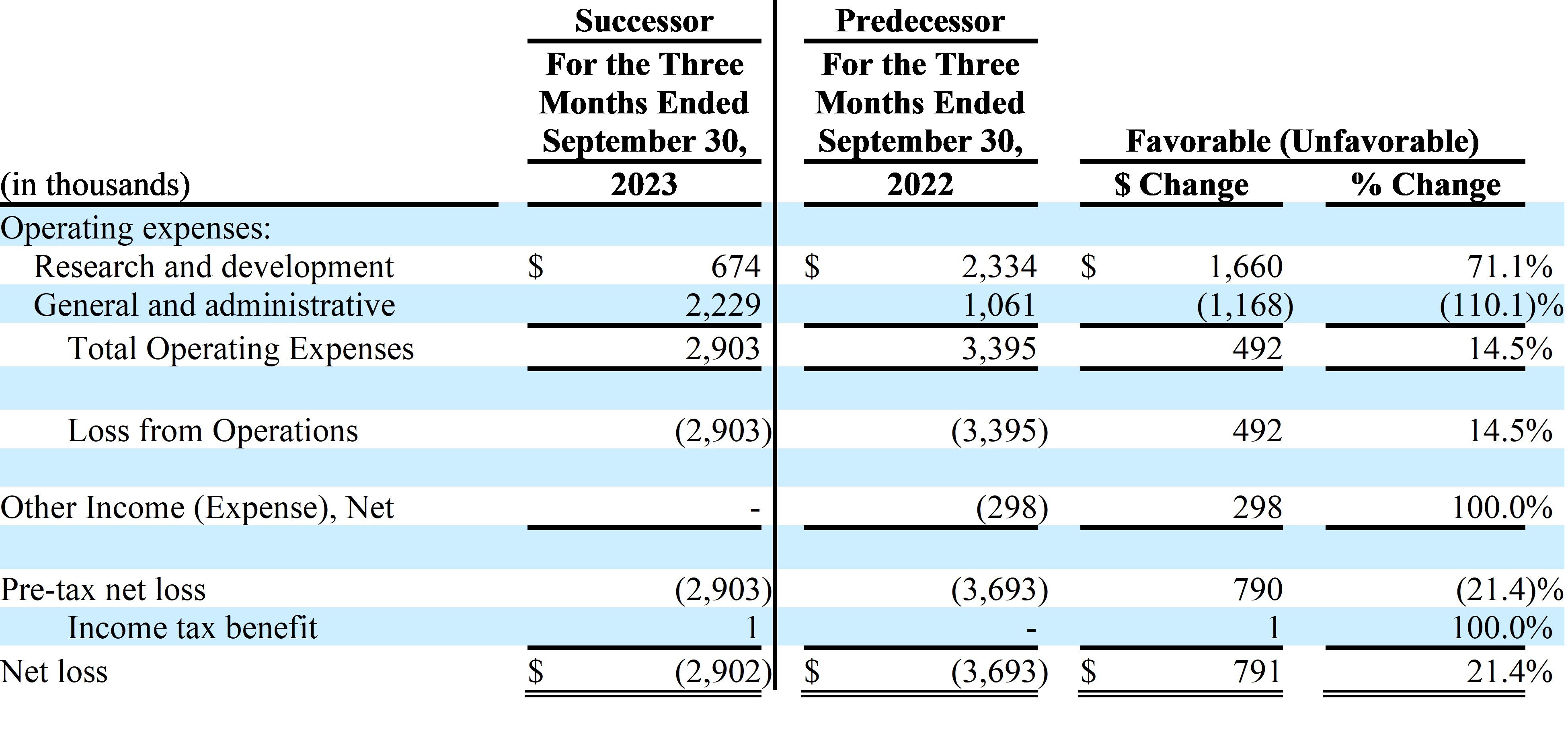
研究和开发费用
截至2023年9月30日的三个月,研究和开发费用为70万美元,比截至2022年9月30日的三个月减少170万美元,降幅为71.1%。这主要是由于截至2022年9月30日的三个月,IC 100材料的制造成本减少了170万美元。
一般费用 和管理费用
截至2023年9月30日的三个月,一般和行政费用为220万美元,比截至2022年9月30日的三个月增加了120万美元或110.1%。这一增长主要归因于与上市公司相关的专业费用增加了40万美元 ,董事和高管保险增加了30万美元,奖金 应计项目增加了20万美元,以及投资者和公关营销成本增加了10万美元。
其他收入(费用)
截至2023年9月30日的三个月,净其他收入(支出)总额为零,比截至2022年9月30日的三个月减少了30万美元,降幅为100.0%。这一变动主要是由于利息减少以及由于可转换债务转换为股权而导致的衍生负债支出公允价值变动总额约为30万美元所致。
截至2023年9月30日(后继期)的9个月与截至2022年9月30日(前继期)的9个月的比较
下表汇总了截至2023年9月30日的9个月的后续业务和截至2022年9月30日的9个月的业务结果。
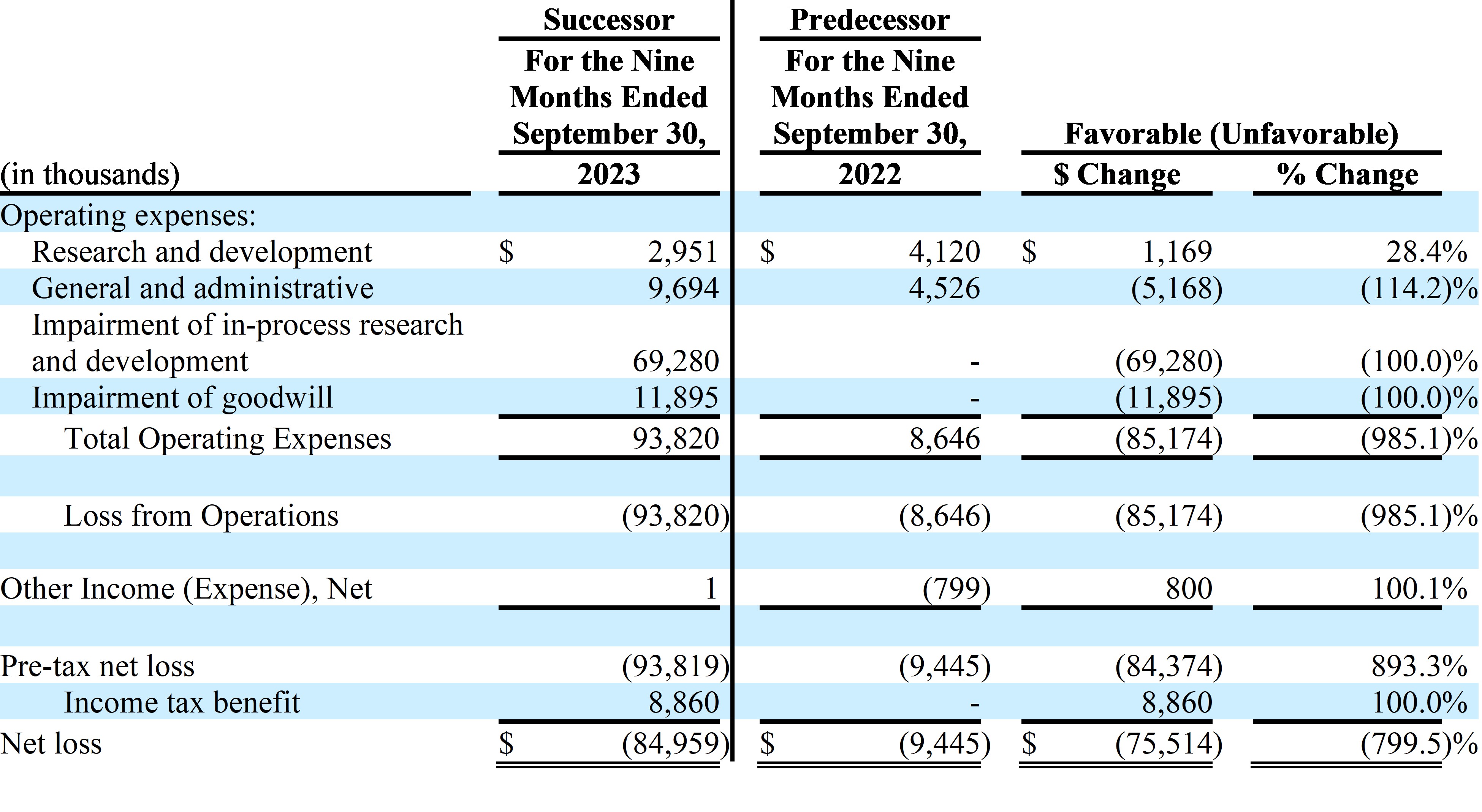
研究和开发费用
截至2023年9月30日的9个月,研发费用为300万美元,比截至2022年9月30日的9个月减少了120万美元,降幅为28.4%。这一减少主要是由于IC 100的制造材料成本减少了约200万美元。药品制造、配方和临床前操作成本增加了约80万美元,部分抵消了这一增长。
一般和行政费用
截至2023年9月30日的9个月,一般和行政费用为970万美元,比截至2022年9月30日的9个月增加了520万美元或114.2%。这一增长主要是由于与上市公司相关的专业费用增加了250万美元,投资者和公关营销成本增加了110万美元,董事和高管保险增加了100万美元,以及2023年因与PIPE股份相关的效力失效而支付的款项增加了40万美元。
正在进行的研发和商誉减值
正在进行中的研发减值和商誉减值分别为6930万美元和1190万美元,而截至2022年9月30日的9个月为零。减值是由于我们的股票价格下跌以及由此导致的公司在2023年6月30日的市值 。
其他(收入)支出
截至2023年9月30日的九个月,净其他收入(支出)为1,000美元,与截至2022年9月30日的九个月相比,支出减少了80万美元,降幅为100.1%。这一变化是由于利息支出减少了约40万美元,以及衍生债务公允价值变化导致的亏损减少了40万美元,两者都是由于可转换债务转换为股权造成的。
| 109 |
现金流
下表汇总了截至2023年9月30日的9个月的后继者和截至2022年9月30日的9个月的前继者的运营和融资活动的现金流:

经营活动的现金流
截至2023年9月30日和2022年9月30日的9个月,经营活动中使用的现金净额分别为590万美元和110万美元。 截至2023年9月30日和2022年9月30日的9个月,经营活动中使用的现金净额主要归因于分别约8,500万美元和940万美元的净亏损,分别被7500万美元和360万美元的非现金支出净额和约400万美元和480万美元的净亏损所抵消。经营资产和负债水平所产生的现金。
净额 融资活动提供的现金
截至2023年9月30日和2022年9月30日的9个月,融资活动提供的现金净额分别为160万美元和140万美元。 截至2023年9月30日的9个月,融资活动提供的现金主要包括通过公开发行普通股获得的1,310万美元现金收益和通过认股权证激励要约获得的100万美元行使收益。这被与普通股发行相关的180万美元注册和发行成本以及赎回A系列优先股所支付的1070万美元现金所抵消。在截至2022年9月30日的9个月中,融资活动提供的现金是通过非公开配售发行优先股获得的140万美元。
流动性 与资本资源
下表汇总了我们在2023年9月30日和2022年12月31日的流动资产、流动负债和营运资本缺口总额:

自2014年成立至2023年9月30日,我们没有产生任何收入,并且出现了严重的运营亏损和运营现金流为负的情况。根据我们目前的运营计划,我们已经限制了我们的研发支出,我们预计截至2023年9月30日的160万美元现金仅足以支付我们的运营费用和资本支出 按月计算的需求。然而,在获得FDA批准之前,很难预测我们在候选产品上的支出。此外,不断变化的情况可能会导致我们花费现金的速度远远快于我们目前的预期,而且由于我们无法控制的情况,我们 可能需要花费比当前预期更多的现金。
正在进行 关注
自2014年成立至2023年9月30日,我们没有产生任何收入,并且出现了严重的运营亏损和运营现金流为负的情况。根据我们目前的运营计划,我们已经限制了我们的研发支出,我们预计截至2023年9月30日的160万美元现金仅足以支付我们的运营费用和资本支出 按月计算的需求。然而,在获得FDA批准之前,很难预测我们在候选产品上的支出。此外,不断变化的情况可能会导致我们花费现金的速度远远快于我们目前的预期,而且由于我们无法控制的情况,我们 可能需要花费比当前预期更多的现金。
合同义务
以下 汇总了我们截至2023年9月30日的合同义务,这些义务将影响我们未来的流动性。根据我们目前的运营计划,我们计划从目前的现金余额和未来的融资中履行以下确定的义务。
现金 截至2023年9月30日,我们的流动负债所需现金包括约1,170万美元的应付帐款、应计费用、 和我们的经营租赁负债。
未来资本需求
我们 打算在短期内筹集更多资金,以履行我们目前的债务,并为我们的日常运营和当前的 债务提供资金。
我们 预计在后续发行中通过发行股权或与股权挂钩的证券来筹集额外资本。如果我们无法通过以对我们有利的条款发行股权或股权挂钩证券来筹集额外资本,我们可能没有足够的流动性来执行我们的业务 战略。我们有各种可为我们的普通股行使的未清偿认股权证,其中许多必须行使,以换取该等认股权证持有人向我们支付的现金。如果我们普通股的市场价格低于持有者认股权证的行权价格,持股人不太可能行使认股权证。因此,根据我们普通股的当前市场价格和该等认股权证的行使价,我们预计近期内不会因行使我们的大部分认股权证而获得重大收益。
我们的 政策是将任何超出我们当前需求的现金投资于旨在保持本金余额和提供流动性的投资,同时产生适度的投资回报。因此,我们的现金等价物将主要投资于货币市场基金,在当前的利率环境下,这些基金目前只提供最低回报。
我们 预计至少在未来几年内,随着我们继续开发我们的候选产品并寻求市场批准,并在获得批准后最终将我们的产品 商业化,我们将继续招致大量的额外运营亏损。如果我们的候选产品获得市场批准,我们将产生大量的销售、营销和外包制造费用 。此外,我们预计会产生额外费用来增加运营、财务和信息系统以及人员,包括支持我们计划的产品商业化努力的人员。我们还预计在遵守适用于我们作为上市公司的公司治理、内部控制和类似要求方面会产生巨额成本。
| 110 |
经营成果
截至2022年12月31日的年度与2021年12月31日的年度比较
下表汇总了我们在2022年12月13日至2022年12月31日期间的后续业务、在2022年1月1日至2022年12月12日期间以及截至2021年12月31日的前一年的运营结果:
| 继任者 | 前身 | |||||||||||
| 对于 期间 | 对于 期间 | 本年度的 | ||||||||||
| 12月 13至 | 1月1日至 | 告一段落 | ||||||||||
| 12月31日, | 12月 12, | 12月31日, | ||||||||||
| (单位:千) | 2022 | 2022 | 2021 | |||||||||
| 运营费用 : | ||||||||||||
| 研发 | $ | 400 | $ | 5,408 | $ | 2,124 | ||||||
| 常规 和管理 | 420 | 7,605 | 5,580 | |||||||||
| 总计 运营费用 | 820 | 13,013 | 7,704 | |||||||||
| 总计 经营亏损 | (820 | ) | (13,013 | ) | (7,704 | ) | ||||||
| 其他 收入(),净 | - | 1,035 | 380 | |||||||||
| 净 除所得税前亏损 | (820 | ) | (14,048 | ) | (8,084 | ) | ||||||
| 收入 税收优惠 | 745 | - | - | |||||||||
| 净亏损 | $ | (75 | ) | $ | (14,048 | ) | $ | (8,084 | ) | |||
| 111 |
研发费用
下表总结了 我们在2022年12月13日至2022年12月31日期间为继任者以及在2022年1月1日至2022年12月12日期间为前任者 以及截至2021年12月31日的年度的研发费用:
| 继任者 | 前身 | |||||||||||
| 对于 期间 | 对于 期间 | 本年度的 | ||||||||||
| 12月 13至 | 1月1日至 | 告一段落 | ||||||||||
| 12月31日, | 12月 12, | 12月31日, | ||||||||||
| (单位:千) | 2022 | 2022 | 2021 | |||||||||
| 研发 | ||||||||||||
| 人事费用 | $ | 31 | $ | 1,045 | $ | 1,306 | ||||||
| 临床 手术 | ||||||||||||
| VAR200 | - | (100 | ) | 259 | ||||||||
| 临床前操作 | ||||||||||||
| IC100 | - | 60 | 161 | |||||||||
| 药品 生产和配方 | ||||||||||||
| VAR200 | 1 | 27 | 25 | |||||||||
| IC100 | 322 | 3,934 | 144 | |||||||||
| 其他 成本 | ||||||||||||
| VAR200 | 36 | 314 | 215 | |||||||||
| IC100 | 10 | 128 | 14 | |||||||||
| 研发总额 | $ | 400 | $ | 5,408 | $ | 2,124 | ||||||
从2022年12月13日至2022年12月31日的后续期间的研发费用为40万美元,从2022年1月1日至2022年12月12日的前一段时间的研发费用为540万美元。截至2022年12月31日的合并年度的研发费用为580万美元,比截至2021年12月31日的前一年的210万美元增加370万美元或173.4%。 研发费用的增加是由于批量制造分析服务和制造材料供应的支出总体增加。
从2022年12月13日至2022年12月31日的后续期间的人事费用为31 000美元,从2022年1月1日至2022年12月12日的前一期间的人事费用为100万美元。截至2022年12月31日的合并年度的人事支出为110万美元,较截至2021年12月31日的前一年的130万美元减少20万美元或17.6%。人事费用减少的主要原因是,前一年授予立即归属的咨询人的期权的股票薪酬减少。
| 112 |
从2022年12月13日至2022年12月31日的后续期间的临床手术费用为0美元,从2022年1月1日至2022年12月12日的前一期间的临床手术费用为(10万美元)。截至2022年12月31日的合并年度的临床手术为(10万美元) ,比截至2021年12月31日的前一年的30万美元减少了40万美元或138.6%。临床业务减少的主要原因是一家供应商对因新冠肺炎疫情而未完成的工作获得了信用。
从2022年12月13日至2022年12月31日的后续期间的临床前 操作为0美元,从2022年1月1日至2022年12月12日的前一期间的临床前 操作为60,000美元。截至2022年12月31日的合并年度的临床前手术为6万美元,比截至2021年12月31日的前一年的16.1万美元减少了10.6万美元或62.7%。 减少是由于截至2022年12月31日的年度内药品支出微乎其微所致。
从2022年12月13日至2022年12月31日的后续期间的药物制造和配方费用为40万美元,从2022年1月1日至2022年12月12日的前一期间的费用为400万美元。截至2022年12月31日的合并年度的药品制造和配方为430万美元,比截至2021年12月31日的前一年的20万美元增加了410万美元或2436.1%。这一增长是由于为预期的批量制造购买了260万美元的材料,并为批量制造和分析服务购买了150万美元。
从2022年12月13日到2022年12月31日的后续期间的其他研发成本为46,000美元,从2022年1月1日到2022年12月31日的前一期间的其他研发成本为442,000美元。截至2022年12月31日的合并年度的其他研发成本为48.8万美元,比截至2021年12月31日的前一年的22.9万美元增加了25.9万美元或113.1%。增长是由咨询服务推动的。
一般费用和管理费用
下表汇总了2022年12月13日至2022年12月31日期间继任者以及2022年1月1日至2022年12月12日期间以及截至2021年12月31日的前一年的一般和行政费用:
| 继任者 | 前身 | |||||||||||
| 在该期间内 | 在该期间内 | 这一年的 | ||||||||||
| 12月13日至 | 1月1日至 | 告一段落 | ||||||||||
| 十二月三十一日, | 12月12日, | 十二月三十一日, | ||||||||||
| (单位:千) | 2022 | 2022 | 2021 | |||||||||
| 一般和行政部门: | ||||||||||||
| 人员费用 | $ | 138 | $ | 4,150 | $ | 4,474 | ||||||
| 交易成本 | 63 | 2,088 | - | |||||||||
| 律师费和律师费 | 100 | 887 | 639 | |||||||||
| 房租费用 | 8 | 149 | 148 | |||||||||
| 其他 | 111 | 331 | 319 | |||||||||
| 一般和行政合计 | $ | 420 | $ | 7,605 | $ | 5,580 | ||||||
从2022年12月13日到2022年12月31日的后续期间的一般和行政费用为40万美元,而从2022年1月1日到2022年12月12日的前一期间的一般和行政费用为760万美元。截至2022年12月31日的合并年度的一般和行政费用为800万美元,比截至2021年12月31日的前一年的560万美元增加了240万美元或43.8%。
从2022年12月13日至2022年12月31日的后续期间的人事费用为 10万美元,从2022年1月1日至2022年12月12日的前一期间的人事费用为420万美元。截至2022年12月31日的合并年度的人事支出为430万美元,比截至2021年12月31日的前一年的450万美元减少了20万美元或4.1%。人事费用减少的主要原因是,由于2022年授予的期权减少,股票薪酬减少。
从2022年12月13日至2022年12月31日的后续期间的交易成本为100万美元,而从2022年1月1日至2022年12月12日的前一期间的交易成本为210万美元。截至2022年12月31日的合并年度的交易成本为220万美元,而截至2021年12月31日的前一年的交易成本为零。交易成本的增加与业务合并的准备工作直接相关。
从2022年12月13日到2022年12月31日的后续期间的法律和专业费用 为10万美元,从2022年1月1日到2022年12月12日的前一段时间的法律和专业费用为90万美元。截至2022年12月31日的合并年度的法律和专业费用为100万美元,较截至2021年12月31日的前一年的60万美元增加40万美元或54.4%。 法律和专业费用的增加是由于与交易没有直接关系的业务合并费用。
| 113 |
从2022年12月13日至2022年12月31日的后续期间的租金费用为8 000美元 ,从2022年1月1日至2022年12月12日的前一期间的租金费用为149 000美元。截至2022年12月31日的合并年度的租金支出为15.7万美元,比截至2021年12月31日的前一年的14.8万美元增加了9000美元或6.1%。这一增长是由公共区域收费的增长 推动的。
从2022年12月13日至2022年12月31日的后续期间的其他一般和行政费用为10万美元,从2022年1月1日至2022年12月12日的前一期间的其他一般和行政费用为30万美元。截至2022年12月31日的合并年度的其他一般和行政费用为40万美元,比截至2021年12月31日的前一年的30万美元增加了10万美元或38.5%。其他费用的增加主要是因为董事和官员保险增加了5万美元 ,投资者和公关费用增加了大约5万美元。
其他 (收入)费用
下表汇总了2022年12月13日至2022年12月31日期间继任者的其他(收入)支出,以及2022年1月1日至2022年12月12日期间以及截至2021年12月31日的年度的前继者的其他(收入)支出:
| 继任者 | 前身 | |||||||||||
| 在该期间内 | 在该期间内 | 这一年的 | ||||||||||
| 12月13日至 | 1月1日至 | 告一段落 | ||||||||||
| 十二月三十一日, | 12月12日, | 十二月三十一日, | ||||||||||
| (单位:千) | 2022 | 2022 | 2021 | |||||||||
| 其他费用 | ||||||||||||
| 利息支出 | $ | - | $ | 428 | $ | 821 | ||||||
| 衍生负债的公允价值变动 | - | 607 | (228 | ) | ||||||||
| 获得PPP贷款的宽免权 | - | - | (213 | ) | ||||||||
| 其他费用合计(净额) | $ | - | $ | 1,035 | $ | 380 | ||||||
从2022年12月13日至2022年12月31日的后续期间的总其他费用净额为0美元,而从2022年1月1日至2022年12月12日的前一期间净额为100万美元。截至2022年12月31日的合并年度的其他支出净额为100万美元,较截至2021年12月31日的前一年的40万美元增加60万美元或172.4%。这一变动是 由于可转换债务转换导致利息支出减少约40万美元所致,但被衍生债务公允价值变化增加的亏损40万美元和2021年购买力平价贷款豁免收益约(20万美元)所抵消。
现金流
下表汇总了2022年12月13日至2022年12月31日期间、2022年1月1日至2022年12月12日期间以及截至2021年12月31日的前一年的运营和融资活动的现金流:
| 继任者 | 前身 | |||||||||||
| 对于 期间 | 对于 期间 | 本年度的 | ||||||||||
| 12月 13至 | 1月1日至 | 告一段落 | ||||||||||
| 12月31日, | 12月 12, | 12月31日, | ||||||||||
| (单位:千) | 2022 | 2022 | 2021 | |||||||||
| 净额 提供的现金(用于) | ||||||||||||
| 操作 活动 | $ | (3,394 | ) | $ | (1,495 | ) | $ | (5,076 | ) | |||
| 为 活动提供资金 | - | 1,865 | 5,230 | |||||||||
经营活动的现金流
2022年12月13日至2022年12月31日的后续期间经营活动中使用的现金净额为340万美元,2022年1月1日至2022年12月12日期间的前一期间为150万美元。 截至2022年12月31日的合并年度的经营活动中使用的现金净额为490万美元,较截至2021年12月31日的前一年的510万美元减少20万美元或 3.7%。在截至2022年12月31日的合并年度和截至2021年12月31日的年度,用于经营活动的现金净额主要是由于分别净亏损约1,410万美元和810万美元,分别被360万美元和400万美元的非现金净支出抵消,以及分别由运营资产和负债水平产生的现金约560万美元和(用于) 的现金约100万美元。
| 114 |
净额 融资活动提供的现金
从2022年12月13日到2022年12月31日,融资活动提供的净现金为0美元,从2022年1月1日到2022年12月12日,融资活动提供的现金净额为190万美元。 截至2022年12月31日的合并年度,融资活动提供的现金净额为190万美元,比截至2021年12月31日的前一年的520万美元减少330万美元 或64.3%。在截至2022年12月31日的年度内,融资活动提供的现金为发行优先股的收益。在截至2021年12月31日的年度内,我们从发行可转换债券中获得520万美元。
流动性 与资本资源
下表汇总了我们在2022年12月31日和2021年12月31日的流动资产、负债和营运资本缺口总额。 :
| 继任者 | 前身 | |||||||
| 12月31日, | 12月31日, | |||||||
| (单位:千) | 2022 | 2021 | ||||||
| 当前资产 | $ | 6,363 | $ | 812 | ||||
| 流动负债 | $ | 8,188 | $ | 13,626 | ||||
| 营运资金不足 | $ | (1,825 | ) | $ | (12,814 | ) | ||
自2014年成立至2022年12月31日,我们没有产生任何收入,并且发生了严重的运营亏损和运营现金流为负。根据我们目前的运营计划,我们预计截至2022年12月31日我们的现金为590万美元,仅够支付我们按月计算的运营费用和资本支出要求。 然而,在获得FDA批准之前,很难预测我们在候选产品上的支出。此外,不断变化的环境 可能会导致我们花费现金的速度远远快于我们目前的预期,而且由于我们无法控制的情况,我们可能需要花费比当前预期更多的现金 。
正在进行 关注
自 成立以来,我们一直从事组织活动,包括筹集资金和研发活动。我们 尚未产生收入,尚未实现盈利运营,也从未从运营中产生正现金流。 不能保证盈利运营即使实现,也能持续下去。我们面临着与任何临床前阶段的制药公司相关的风险,这些公司在研发方面投入了大量资金。 不能保证我们的研发项目会成功,不能保证开发的产品会获得必要的监管批准,也不能保证任何批准的产品在商业上是可行的。此外,我们在技术快速变化的环境中运营,并在很大程度上依赖于员工和顾问的服务。此外,我们未来的运营取决于公司筹集额外资本的努力是否成功。这些不确定性使人对我们是否有能力在财务报表发布日期后继续作为一家持续经营的企业持续12个月提出了极大的怀疑。所附财务报表 是以持续经营为基础编制的。财务报表不包括任何调整,以反映因公司可能无法继续经营而可能对资产的可回收性和分类或负债的金额和分类造成的未来可能影响 公司计划在正常业务过程中继续经营、变现资产和清算负债。截至2022年12月31日的财年,我们共亏损1,410万美元,截至2021年12月31日的财年净亏损810万美元,截至2022年12月31日,我们的累计赤字为490万美元。我们预计会遭受更多损失,直到我们可以从目前正在开发的候选产品中获得可观的收入为止。我们的主要资金来源 一直是发行债务和股权证券。我们认为,目前的现金仅足以按月为运营和资本需求提供资金。我们将需要额外的资金来为我们的运营提供资金,完成 的开发,并将我们的候选产品进行商业开发。不能保证在需要时或按可接受的条款提供此类融资。
| 115 |
合同义务
以下 汇总了我们截至2022年12月31日的合同义务,这些义务将影响我们未来的流动性。根据我们目前的运营计划,我们计划从目前的现金余额和未来的融资中履行以下确定的义务。
截至2022年12月31日,我们当前负债的现金需求包括约820万美元的应付帐款和应计费用。 截至2022年12月31日,长期负债没有现金需求。
企业合并后的资本需求
我们打算在未来筹集更多资金,为我们的运营和VAR200和IC100的持续开发提供资金。
我们预计在后续发行中通过发行股权或与股权挂钩的证券来筹集额外资本。如果我们无法通过以对我们有利的条款发行股权或股权挂钩证券来筹集额外资本,我们可能没有足够的流动性来执行我们的业务战略。我们 有各种可为我们的普通股行使的未清偿认股权证,其中许多必须行使,以换取该等认股权证持有人向我们支付的现金。如果我们普通股的市场价格低于持有人认股权证的行权价格,则持有人不太可能行使其认股权证。因此,根据我们普通股的当前市场价格和该等认股权证的行使价格,我们预计短期内不会从行使我们的大部分认股权证中获得重大收益 。
我们的政策是将任何超出我们当前需求的现金投资于旨在保持本金余额和提供流动性的投资,同时产生适度的投资回报。因此,我们的现金等价物将主要投资于货币市场基金,鉴于目前的利率环境,这些基金目前只提供最低回报。
我们 预计至少在未来几年内,随着我们继续开发我们的候选产品并寻求市场批准,并在获得批准后最终将我们的产品 商业化,我们将继续招致大量的额外运营亏损。如果我们的候选产品获得市场批准,我们将产生大量的销售、营销和外包制造费用 。此外,我们预计会产生额外费用来增加运营、财务和信息系统以及人员,包括支持我们计划的产品商业化努力的人员。我们还预计在遵守适用于我们作为上市公司的公司治理、内部控制和类似要求方面会产生巨额成本。
我们 未来运营现金和资本需求的使用将取决于许多前瞻性因素,包括:
| ● | 我们候选产品的临床试验的启动、进度、时间、成本和结果; | |
| ● | 我们为每个候选产品制定的临床开发计划; | |
| ● | 我们开发或可能获得许可的候选产品的数量和特征; | |
| ● | 我们可能选择执行的任何协作协议的条款; | |
| ● | 满足FDA或其他类似外国监管机构制定的监管要求的结果、时间和成本; | |
| ● | 提交、起诉、辩护和执行我们的专利主张和其他知识产权的费用; | |
| ● | 为知识产权纠纷辩护的费用,包括第三方对我们提起的专利侵权诉讼; | |
| ● | 实施商业规模制造活动的成本和时间;以及 | |
| ● | 在我们选择自己将产品商业化的地区,为我们可能获得监管批准的任何候选产品建立或外包销售、营销和分销能力的成本 。 |
| 116 |
To continue to grow our business over the longer term, we plan to commit substantial resources to research and development, clinical trials of our product candidates, and other operations and potential product acquisitions and in-licensing. We have evaluated and expect to continue to evaluate a wide array of strategic transactions as part of our plan to acquire or in-license and develop additional products and product candidates to augment our internal development pipeline. Strategic transaction opportunities that we may pursue could materially affect our liquidity and capital resources and may require us to incur additional indebtedness, seek equity capital or both. In addition, we may pursue development, acquisition or in-licensing of approved or development products in new or existing therapeutic areas or continue the expansion of our existing operations. Accordingly, we expect to continue to opportunistically seek access to additional capital to license or acquire additional products, product candidates or companies to expand our operations, or for general corporate purposes. Strategic transactions may require us to raise additional capital through one or more public or private debt or equity financings or could be structured as a collaboration or partnering arrangement. We have no arrangements, agreements, or understandings in place at the present time to enter into any acquisition, in-licensing or similar strategic business transaction. In addition, we continue to evaluate commercial collaborations and strategic relationships with established pharmaceutical companies, which would provide us with more immediate access to marketing, sales, market access and distribution infrastructure.
如果我们通过发行股权证券筹集额外资金,我们的股东将受到稀释。债务融资如果可行, 将导致固定支付义务增加,并可能涉及一些协议,其中包括限制或限制我们采取特定行动的能力的契约,例如招致额外债务、进行资本支出或宣布股息。我们筹集的任何债务融资或额外的 股权可能包含对我们或我们的现有股东不利的条款,如清算和其他优惠。 如果我们通过与第三方的合作和许可安排筹集额外资金,可能需要放弃对我们的技术、未来收入流或候选产品的宝贵 权利,或者以可能对我们不利的条款授予许可证 。
职位 会计选举法案
ZyVersa是一家“新兴成长型公司”,根据2012年的JumpStart Our Business Startups Act或JOBS Act的定义。JOBS法案允许具有新兴成长型公司地位的公司 利用延长的过渡期遵守新的或修订的会计准则, 推迟采用这些会计准则,直到它们适用于私营公司。ZyVersa希望利用这一延长的过渡期,使其能够遵守新的或修订的会计准则,这些会计准则对上市公司和私营公司具有不同的生效日期,直到公司(1)不再是新兴成长型公司或(2)明确且 不可撤销地选择退出《就业法案》规定的延长过渡期。因此,截至上市公司生效日期,我们的财务报表可能无法与符合新的或修订的会计准则的公司进行比较。
此外,公司打算依靠《就业法》规定的其他豁免和降低的报告要求。
表外安排
本公司与任何对财务状况、财务状况、收入或开支、经营业绩、流动资金、资本支出或资本资源具有或合理地可能对当前或未来有重大影响的其他实体之间并无任何表外安排 对股东而言至关重要。
关键会计政策和估算
财务报表和相关披露的编制必须符合美国公认会计准则。这些会计原则要求我们作出估计和判断,这些估计和判断可能会影响截至财务报表日期报告的资产和负债额以及列报期间报告的收入和费用。我们相信,我们所依赖的估计和判断是基于我们在作出这些估计和判断时获得的信息而做出的。如果这些估计与实际结果之间存在重大差异,我们的财务结果将受到影响。下面介绍反映我们更重要的估计和判断的会计政策,以及我们认为有助于全面了解和评估我们报告的财务业绩的最关键的会计政策。
以下内容并不是我们所有会计政策或估算的综合清单。我们的会计政策在本招股说明书末尾的财务报表中的附注3-重要会计政策摘要中有更全面的描述。
预算的使用
根据美国公认会计原则编制财务报表要求管理层作出估计、判断和假设,这些估计、判断和假设会影响财务报表中报告的金额和财务报表相关附注中披露的金额。本公司的估计和判断基于历史经验和其认为在当时情况下合理的各种其他假设。本公司资产负债表中报告的资产和负债额以及列报的每个期间的支出金额受估计和假设的影响,这些估计和假设用于但不限于股权证券、负债、基于股份的薪酬和收购的无形资产的公允价值计算,以及为递延税 资产建立估值扣除。公司的某些估计可能会受到外部条件的影响,包括公司独有的情况和一般经济状况。实际结果有可能与这些估计值不同,这是合理的。
| 117 |
业务合并
在对企业合并应用收购 会计方法时,分配给所收购可识别资产和负债的金额基于收购日期的估计 公允价值,其余部分记录为善意。无形资产最初采用适合无形资产类型的公认估值方法按公允价值进行估值。在业务合并中收购的在制品研发(IPR & D) 在获得监管机构批准之前被资本化为无限寿命的无形资产,此时 将其作为无限寿命的资产核算,并在其估计使用寿命或终止期间摊销,此时 无形资产将被注销。
长期资产和商誉
公司按照ASC 360-10-35的规定对长期资产进行会计处理。不动产、厂房和设备、减值 或长期资产的处置.本会计准则要求,当事件 或情况变化显示账面值可能无法收回时,应对长期资产进行减值审查。将持有及使用资产的可收回性 乃通过比较资产的账面值与该资产预期产生的未来未贴现现金流量净额来计量。 如果资产的账面值超过其估计未来现金流量,则按资产账面值超过资产公允价值的金额确认减值费用。
公司根据ASC 350会计准则对商誉和无形资产进行会计处理。无形资产-商誉和其他。商誉 代表实体的购买价格超出所收购资产和承担的负债的估计公允价值。 ASC 350要求商誉和其他具有无限寿命的无形资产每年进行减值测试,或在 事件或情况表明资产的公允价值已降至低于其账面价值的情况下进行临时减值测试。
在确定是否需要进行量化评估时,本公司将对相关事件或情况进行评估,以确定报告单位的公允价值是否更有可能低于其账面价值。如果在进行定性评估后,某实体得出结论认为报告单位的公允价值极有可能低于其账面价值,则该实体将执行ASC 350中所述的量化减值测试。然而,如果在应用定性评估后,该实体得出结论认为公允价值不太可能少于账面价值,则不需要进行量化减值测试。该公司基于其历史数据和经验、行业预测、微观和宏观经济状况预测以及预期做出这些假设。
可转换本票
本公司评估其 可转换工具,以确定该等合约或该等合约的嵌入部分是否符合衍生金融工具的资格,并须根据财务会计准则委员会(“FASB”)会计准则编纂(“ASC”)的第815题“衍生工具及对冲”(“ASC 815”)单独入账。衍生金融工具的会计处理要求本公司按协议开始之日的公允价值和随后的每个资产负债表日期的公允价值记录任何有分歧的嵌入特征。公允价值的任何变动均作为营业外、非现金收入或支出计入每个期间的收益 。本公司于每个资产负债表日重新评估其衍生工具的分类。如果分类因期间内发生的事件而更改,则合同自导致重新分类的 事件发生之日起重新分类。分叉的嵌入功能按其初始公允价值记录,这为托管工具创造了额外的 债务折扣。
在2021年1月1日采用会计准则更新(ASU)2020-06年度之前,如果嵌入的转换选项不需要区分,则公司随后通过比较截至承诺日的公司标的股票的公允价值和工具的有效转换价格(内在价值)来评估是否存在有益的转换功能。托管票据按摊余成本计量,账面价值按实际利息法计提合约到期日本金金额,并计入相应的利息支出。在2021年1月1日采用ASU 2020-06之后,公司不再需要 评估是否存在有益的转换功能。
金融工具的公允价值
本公司根据ASC 820“公允价值计量和披露”(“ASC 820”)计量金融资产和负债的公允价值, 定义公允价值,建立公允价值计量框架,并扩大关于公允价值计量的披露。
ASC 820将公允价值 定义为在计量日市场参与者之间有序交易中为资产或负债在本金或最有利的 市场上转移负债而收取的交换价格(退出价格)。ASC 820还建立了公允价值等级,要求实体在计量公允价值时最大限度地使用可观察到的投入,最大限度地减少使用不可观察到的投入 。ASC 820描述了可用于计量公允价值的三个级别的投入:
第1级--相同资产或负债在活跃市场的报价 ;
第2级--对活跃市场或可观察到的投入中类似资产和负债的报价;以及
级别3-无法观察到的输入(例如,基于假设的现金流建模输入)。
由于这些工具的短期性质,公司的金融工具,如现金、应付账款和投资者存款的账面价值接近公允价值。
有关评估第3级投入所用的估值技术和假设的其他详情,请参阅附注8-衍生负债 。
| 118 |
所得税
对于财务报表或纳税申报表中已计入或未计入的项目的预期未来税务后果,本公司确认递延的 纳税资产和负债。递延税项资产及负债乃根据资产及负债的课税基准与其各自按现行税率计算的财务报告金额(“暂时性差异”)之间的差额(“暂时性差异”)而厘定。递延税项资产减值至管理层认为资产更有可能无法变现的范围。税率变动对递延税项资产和负债的影响 在包括颁布日期在内的期间的经营报表中确认。
本公司利用确认门槛和计量程序确认财务报表,并对纳税申报表中已采取或预期采取的纳税状况进行计量 。
研究和开发费用
研发成本 按已发生费用计入,包括与我们的候选产品开发相关的所有直接和间接成本。这些费用 包括支付给第三方的研发和制造服务、人员成本和制造设备的折旧 。在报告期结束时,我们将向第三方服务提供商支付的款项与在完成研究或开发目标方面的估计进度进行比较。随着获得更多信息,此类估计可能会发生变化。 根据向服务提供商付款的时间和我们估计所提供的服务取得的进展,我们可能会记录与这些成本相关的预付或应计费用净额。
基于股票的薪酬
本公司根据授予权益工具的公允价值计量获得服务的成本 。奖励的公允价值 在授予日计量。然后在需要提供服务以换取奖励的期间(通常是授权期)确认公允价值金额。
股票期权和认股权证的公允价值
该公司使用Black-Scholes期权定价模型计算了授予的股票期权和认股权证的公允价值。期权没收在发生时计入 。后续普通股将采用市场法,使用普通股在纳斯达克全球市场的交易价格进行估值。于2022年期间,前身普通股的公允价值是根据业务合并协议在每个估值日期与收购方进行的公平讨论的状况,以及该协议最终于2022年7月20日签订,前身估值为8,500万美元,采用市场法确定的。2021年,管理层在第三方估值专家的协助下,采用收益法确定了前身普通股的公允价值。期权使用的预期 术语是授予的期权预计未偿还的预计时间段。 认股权证使用的预期期限为合同期限。本公司利用“简化”方法对“普通”期权授予的预期期限进行估算。本公司在2022年12月13日之前没有普通股的公开交易历史,以支持其 历史波动率计算。因此,本公司使用的预期波动率数字是基于对六家可比实体在相当于被估值工具的预期寿命的一段时间内的历史波动率进行回顾的 。无风险利率是根据美国国债零息债券的隐含收益率确定的,剩余期限与被估值工具的预期期限一致。
最近采用的 会计声明
2019年12月,FASB 发布了ASU 2019-12《所得税(740主题):简化所得税会计处理》,旨在简化与所得税会计处理相关的各个方面。ASU 2019-12删除了主题740中一般原则的某些例外情况,并澄清和修改了现有指南,以改进一致性应用。ASU 2019-12财年在2021年12月15日之后从 开始的财年有效。该标准于2022年1月1日采用,并未对公司的财务报表产生实质性影响。
2021年5月,FASB发布了ASU 2021-04、每股收益(主题260)、债务修改和清偿(主题470-50)、补偿-股票补偿(主题718)以及实体自身股权的衍生品和对冲合同(主题815-40):发行人 对独立股权分类书面看涨期权的某些修改或交换进行了会计处理。这项新标准提供了 澄清,并减少了发行人对修改或交换独立股权分类 书面看涨期权(如权证)的会计处理的多样性,这些期权在修改或交换后仍保持股权分类。本标准在2021年12月15日之后的 财年有效,包括该财年内的过渡期。公司应将新标准 应用于新标准生效日期之后发生的修改或交换。本准则于2022年1月1日采用,并未对公司财务报表产生实质性影响。
2020年8月,财务会计准则委员会发布了ASU 2020-06,债务转换和其他期权(分主题470-20)和衍生工具和套期保值-实体自有股权合同(分主题815-40):实体自己股权中可转换工具和合同的会计处理 ,以明确某些具有负债和股权特征的金融工具的会计处理。本次更新中的修订 通过删除现金转换模式和受益转换特征模式,减少了可转换债务工具和可转换优先股的会计模式数量 。限制会计模型将导致从主机合同中单独识别的嵌入式转换功能减少 个。继续受分离模式约束的可转换工具是:(1)具有与宿主合同不明确和密切相关的嵌入转换特征的可转换工具,符合衍生工具的定义,不符合衍生工具会计范围例外的可转换债务工具,以及(2) 发行的溢价可观的可转换债务工具,其溢价记录为实收资本。此外,这一ASU改进了对可转换工具和每股收益指引的披露要求。ASU还修订了衍生产品 范围例外指南,以减少由远程或有事件驱动的基于形式而不是实质的会计结论。此更新中的修订 适用于2023年12月15日之后的财政年度以及该财政年度内的过渡期 。将允许提前采用,但不能早于2020年12月15日之后的财年。本公司提前采用了ASU 2020-06,自2021年1月1日起生效,无需评估是否需要在发行新的可转换票据时确认有益的转换功能。
2016年2月,美国财务会计准则委员会发布了2016-02年度会计准则更新(“ASU”)“租赁(主题842)”。ASU 2016-02要求承租人确认经营性租赁产生的资产和负债。承租人应在财务状况表 中确认支付租赁款项的负债(租赁负债)和代表其在租赁期内的标的资产使用权的使用权资产。对于租期为12个月或以下的租赁,承租人可按标的资产类别选择不确认租赁资产和租赁负债的会计政策。在过渡期间,承租人和出租人需要 在采用修正的回溯法提出的最早期间开始时确认和计量租约。这项修订 将在2021年12月15日之后的财年对非上市公司和新兴成长型公司生效,并在2022年12月15日之后的财年内的过渡期 内生效。FASB于2018年7月发布了ASU第2018-10号《对主题 842租赁的编纂改进》和ASU第2018-11号《租赁(主题842)有针对性的改进》,并于2018年12月发布了ASU第2018-20号《租赁 (主题842)--出租人范围狭窄的改进》。ASU 2018-10和ASU 2018-20提供了影响ASU 2016-02发布的指南的狭义方面的某些修订。ASU 2018-11允许所有采用ASU 2016-02的实体 选择另一种(且可选的)过渡采用方法,根据该方法,实体最初在采用日期适用新的租赁标准,并确认采用期间留存收益期初余额的累计效果调整。 本公司于2022年12月31日采用ASU 2016-02,自1月1日起生效。2022年和采用该ASU导致本公司经营租赁的使用权资产和租赁负债入账约182,732美元和199,642美元,并取消确认递延租金约16,910美元。
关于市场风险的定量和定性披露
不适用 。
| 119 |
管理
执行官员和董事
下表列出了截至2023年12月5日有关我们的高管和董事的某些信息:
| 名字 | 年龄 | 职位 | ||
| Stephen C.格洛弗 | 64 | 主管 执行官、总裁兼主席 | ||
| Karen a.羊绒 | 71 | 首席商务官 | ||
| 彼得 沃尔夫 | 56 | 主管 财务干事和秘书 | ||
| 巴勃罗·A·古兹曼医学博士 | 74 | 首席医疗官、医务处高级副总裁 | ||
| Robert G. finizio | 52 | 董事 | ||
| 最小值 Chul Park博士 | 42 | 董事 | ||
| 詹姆斯·萨皮尔斯坦 | 62 | 董事 | ||
| 格雷戈里·弗赖塔格 | 61 | 董事 |
执行官员
斯蒂芬·C·格洛弗。格洛弗先生是我们的联合创始人之一,自2022年12月以来一直担任我们的首席执行官总裁和董事长 。格洛弗先生于2014年3月至2022年12月担任Old ZyVersa首席执行官兼总裁, 于2014年3月至2021年9月担任董事会成员,并于2021年9月至2022年12月担任董事长。格洛弗先生以前是Coherus Biosciences的联合创始人,在那里他专注于商业战略、合作伙伴关系、产品开发努力和公司资本。在加入Coherus之前,他是Insmed治疗蛋白公司的总裁(2007年至2010年),以及Insmed Inc.的首席商务官(2007年至2010年)。在Insmed,格洛弗先生负责创建生物相似业务部门,并将业务剥离给默克公司。作为首席商务官,他领导了Insmed的战略审查流程,导致了Insmed和Transave的合并。在加入Insmed之前,格洛弗先生曾在Andrx实验室(2004年至2005年)和Andrx治疗公司(2005年至2006年)担任高级副总裁兼总经理一职,这两个部门都是Andrx Corporation 。在Andrx,格洛弗先生负责Andrx实验室(开发和营销代谢性疾病和男性健康产品)和Andrx Treeutics(专注于开发新的受控释放产品和合同制造)的战略和运营。早些时候,他曾在霍夫曼·拉罗什(1984年至1995年)、安进(1995年至1998年)和IMS Health(1998年至2001年)担任过多个销售、营销和运营职务。格洛弗先生获得了伊利诺伊州州立大学的市场营销学士学位。格洛弗先生在财富100强、初创企业和创业环境中拥有多方面的经验,他还在PDS Biotech、库尔特基金会(迈阿密大学)和Asclepius Lifesciences的董事会任职。基于格洛弗先生在治疗学行业的丰富经验、对ZyVersa的深厚知识以及他作为其他生命科学公司董事会成员的持续经验,格洛弗先生被选为我们的董事会成员。GLOVER先生根据企业合并协议由ZyVersa 任命为我们的董事会成员。
Karen A.山羊绒。卡什米尔女士自2022年12月以来一直担任我们的首席商务官。羊绒女士于2019年1月至2022年12月在Old ZyVersa担任同样的职务,并于2014年8月至2019年1月担任代理副总裁总裁,负责开发和市场营销。卡什米尔女士在生物制药和医疗器械公司的业务规划和执行方面拥有超过25年的经验,这些公司的规模从初创公司到财富100强公司。她曾在Mako Surgical Corporation(一家新兴的机器人整形外科公司)负责市场营销 沟通职能,在那里她负责为每个定价超过100万美元的机械臂系统及其用于部分膝关节和全髋关节置换的相关植入物 树立知名度并推动销售。卡什米尔女士还曾担任Auxilium PharmPharmticals新产品营销高级副总裁总裁,Auxilium PharmPharmticals是一家专注于男性健康和孤儿适应症的新兴制药公司。职责包括创建新产品营销业务部门、战略机会评估、管道优先顺序、临床开发的商业监督,以及策划新的产品商业化战略。卡什米尔女士领导了Auxilium的战略合作伙伴关系审查程序,导致将具有多个指标的关键资产xiaflex的欧洲权利授予辉瑞公司。在加入Auxilium之前,卡什米尔女士在安德烈斯实验室担任董事高级市场部 ,负责一个新成立的业务部,专注于男士健康流水线产品的商业化 。早些时候,她在Noven、Serono和Abbott担任战略营销职位。
| 120 |
彼得·沃尔夫。沃尔夫先生自2022年12月以来一直担任我们的首席财务官兼秘书。沃尔夫先生于2019年至2022年12月担任Old ZyVersa财务与行政部 高级副总裁,在此之前于2015年10月至2019年10月担任财务副总裁。Wolfe先生在金融服务、专业金融和制药/医疗保健行业担任过各种财务职务。最近,Wolfe先生在各种医疗保健实体中培养了 个初创企业组织,经常与复杂的商业模式打交道,以开发一个财务框架,使其中许多此类第一类企业获得成功。沃尔夫先生在其职业生涯的最后24年里一直在医疗保健行业 ,其中四分之一的时间是在Kos PharmPharmticals度过的,Kos PharmPharmticals是一家上市的、完全整合的专业制药公司。沃尔夫先生拥有迈阿密大学的工商管理学士学位和匹兹堡大学的MBA学位。
巴勃罗·A·古兹曼,医学博士古兹曼博士自2023年1月以来一直担任我们的首席医疗官和医务事务高级副总裁 。在此之前,他是我们的顾问,从2015年1月开始。自2017年以来,古兹曼博士一直在治疗解决方案国际公司的科学咨询委员会任职,这是一家专注于免疫调节的公司。他于1971年在泽西城圣彼得大学获得生物学学士学位,1975年在波多黎各大学医学院获得医学学位,1980年在巴尔的摩约翰·霍普金斯医院获得介入心脏病学奖学金。他拥有内科(1978)和心血管疾病(1981)方面的董事会认证。他于1980年加入约翰霍普金斯大学的工作人员,他的职责包括照顾病人,教学,以及狗实验室的临床和基础科学研究。他在同行评议的期刊上发表了30多篇文章和许多摘要,其中一些在包括美国心脏协会和美国心脏病学会在内的国家会议上发表。在霍普金斯大学期间,他成为美国心脏协会临床心脏病学委员会的会员、北美起搏和电生理学学会的会员、美国心脏病学会的会员,并担任过巴尔的摩市医院(现为弗朗西斯·斯科特关键医院)心脏插管实验室的董事助理、永久起搏器实验室的联合董事和心脏导管实验室的联合董事。古兹曼博士在南佛罗里达州从事医学/介入心脏病学执业35年 ,1987年,古兹曼博士设计并成为博卡拉顿社区医院(现为博卡拉顿地区医院)心脏插管实验室的董事研究员,并成为心脏血管造影和干预学会的会员。然后,他成为北岭医学中心心导管实验室的董事助理。他是大劳德代尔卡杜塞学会的昔日总裁,曾任北岭医学中心心血管和肺部疾病科主任。古兹曼博士是劳德代尔堡心脏病协会的管理合伙人,曾是布罗沃德县医学会的成员,并是圣十字健康公司董事会的成员,自2015年以来一直是三一健康公司的成员。他是Campbell神经科学公司和国际治疗解决方案公司的科学顾问委员会成员。
非雇员董事
罗伯特·G·菲尼齐奥。菲尼齐奥先生自2022年12月以来一直担任我们的董事会成员。Finizio先生于2018年9月至2022年12月在Old ZyVersa担任同样的职务。菲尼齐奥先生目前是药品开发公司PleoPharma的执行董事,该公司专注于寻找FDA批准的安全有效的治疗药物使用障碍的方法 。Finizio先生是TreateuticsMD Inc.的联合创始人,这是一家创新的女性健康制药公司,并在2008年至2021年11月期间担任该公司的首席执行官和董事。Finizio先生拥有20多年的医疗保健经验,在内窥镜专家公司(ESI)开始了他的职业生涯,该公司是腹腔镜设备外包和术中技术支持方面的领先者。在ESI任职期间,Finizio先生晋升到区域管理职位,最终离开 加入制药自动化领域的领先者OmNicell Technologies。在宏盟时,菲尼齐奥担任董事的销售员,最终于2001年离开公司,与人共同创立了CareFusion。CareFusion是医院患者用药、血液和护理点标本验证安全系统的先驱。Finizio先生于2008年联合创立了TreateuticsMD,结合了他在女性医疗保健、制药技术、临床软件和患者安全方面的背景。菲尼齐奥先生是两个非营利性组织--生物佛罗里达和博卡拉顿警察基金会--的董事会成员。Finizio先生毕业于迈阿密大学,获得了医学预科和心理学专业的文学学士学位,在从事医疗保健工作之前,他曾在日本大阪教授英语。Finizio先生因其在医疗保健行业早期公司发展方面的丰富经验而被选为我们董事会的成员。Finizio先生 根据业务合并协议被ZyVersa任命为我们的董事会成员。
分钟 Chul朴智星博士。Park博士自2022年12月以来一直担任我们的董事会成员。从2021年5月到2022年12月,朴槿惠在Old ZyVersa担任同样的职务。Park博士是英杰大学药学院的助理教授。Park博士曾担任韩国首尔生物制药公司CureBioTreateutics的首席执行官和董事首席执行官,从2020年10月至2022年4月,该公司开发治疗癌症、脱发和伤口护理的多肽药物。Park博士还在2017年8月至2022年3月期间担任库里比奥首席技术官总裁和董事 执行副总裁。Park博士于2019年3月至2022年2月在韩国大学药剂系担任ADJUST教授。Park博士在制药行业拥有10年的工作经验,曾在药物靶标发现、分析开发和候选药物优化领域工作。他在基础和应用分子和细胞生物学方面拥有专业知识。在他之前在Curebio治疗公司担任的职务期间,Park博士领导了融资和业务开发交易,包括与三家制药公司 的共同开发协议,以及一项许可协议。此外,他还开发了化妆品多肽,并共同开发了抗体、基于循环肿瘤细胞的诊断方法和癌症干细胞分析系统。此外,Park博士是TME治疗公司的联合创始人,目前是其科学顾问委员会的成员。
| 121 |
在2017年之前,Park博士一直担任韩国首尔新生物技术公司的首席执行官和董事,在那里他帮助扩大了合同实验和生物材料业务, 他领导了将新经济学与Curebio和BumYoung Bio,Ltd.合并为CureBio.的努力。Park博士开发了化妆品多肽,以及一种皮肤病多肽药物候选药物,他获得了许可。Park博士的职业生涯始于首尔国立大学医学生物融合研究中心的高级研究助理 ,在那里他开发并领导了一种外显体分离设备的外部许可交易,他 负责了两项抗肿瘤致癌多肽的外部许可交易。Park博士在首尔国立大学药剂系获得了药物生物科学博士学位。Park博士因其对制药行业和药物开发技术的深入了解而被选为我们的董事会成员。Park博士根据企业合并协议由ZyVersa 任命为我们的董事会成员。
詹姆斯·萨皮尔斯坦。詹姆斯·萨皮尔斯坦自2023年1月以来一直担任我们的董事会成员。萨皮尔斯坦先生目前是第一波生物制药(纳斯达克:FWBI)的董事长、首席执行官兼总裁。萨皮尔斯坦先生的职业生涯始于较小的生物技术公司,他后来加入吉利德科学公司,领导全球营销团队推出ViRead(替诺福韦)。 2002年,他接受了Serono实验室代谢和内分泌学执行副总裁总裁的职位。后来,在2006年,他成为当时一家私营公司Tobira Treeutics的创始首席执行官。Tobira治疗公司于2016年被Allergan 收购。2012年,Sapirstein先生成为Aliqua,Inc.的首席执行官。此后,他在2014年3月至2018年10月期间担任Contravir PharmPharmticals的首席执行官。这些都是上市公司。萨皮尔斯坦先生在他担任首席执行官的各种活动中,通过风险投资和公共资本市场筹集了超过3亿美元的资金。 他入围了2015年和2016年安永年度企业家奖的决赛。除了担任First Wave Bio Pharma的董事会成员外,Sapirstein先生目前还在以诺基亚生物科学公司(Enochian Biosciences)(纳斯达克股票代码:ENOB)和蓝色生物疫苗公司(Blue Water Vaccines)(纳斯达克股票代码:BWV)担任董事职务。2017年2月至2019年2月,他担任新泽西州生物制药行业协会BioNJ董事会主席。此外,他还是BIO(生物技术创新组织)的董事会成员,BIO是推动医疗保健领域公共政策和网络的领先生物技术贸易组织,他是新兴公司 部门管理委员会的成员。Sapirstein先生之所以被选为董事会成员,是因为他在生物技术和制药行业担任高管以及在这些行业的多家上市公司担任董事的丰富经验。
格雷戈里 弗雷塔格。格雷戈里·弗雷塔格自2023年1月以来一直担任我们的董事会成员。Freitag先生目前是PDS生物技术公司(纳斯达克代码:PDSB)的董事会成员,该公司是一家临床阶段免疫治疗公司,基于其专有的Veramune和Infectimune T细胞激活平台,开发不断增长的靶向癌症和传染病免疫治疗流水线。他还是致力于周围神经修复的领先再生医药公司Axogen,Inc.(纳斯达克代码:AXGN)的董事会成员。Freitag先生于2020年6月至2021年3月担任Axogen的特别法律顾问,于2011年9月至2020年6月担任总法律顾问,于2011年9月至2014年5月和 2015年8月至2016年3月担任首席财务官,并于2014年5月至2018年10月担任高级副总裁业务发展部部长。Freitag先生是LecTec Corporation的首席执行官、首席财务官和董事会成员,LecTec Corporation是一家知识产权许可和控股公司,于2011年9月与Axogen Inc.合并,从2010年6月到2011年9月。从2009年5月到现在,Freitag先生一直是FreiMc,LLC的负责人,这是一家他创建的医疗保健和生命科学咨询和咨询公司 ,提供战略指导和业务发展咨询服务。在创建FreiMc,LLC之前,Freitag先生是辉瑞健康解决方案公司业务开发部的董事主管,从2006年1月到2009年5月,他是辉瑞公司的前子公司。 从2005年7月到2006年1月,Freitag先生在Guidant Corporation的业务开发部工作。在加入Guidant公司之前,Freitag先生从2000年3月至2005年初担任生物技术工具初创公司HTS BioSystems的首席执行官。从1995年12月到2000年3月,Freitag先生担任公共医疗诊断公司Quantech的首席运营官、首席财务官和总法律顾问。在此之前,Freitag先生在明尼苏达州明尼阿波利斯从事公司法工作。Freitag先生拥有芝加哥大学的法学博士学位和明尼苏达州Macalester学院的经济学、商业和法律与社会专业的学士学位。Freitag先生之所以被选为董事会成员和公司审计委员会主席,是因为他作为一名高级管理人员具有成熟的领导力和经验,他 对上市公司的特殊知识,包括与之相关的报告、合规和金融市场,他的财务 管理和法律专业知识,他曾担任过的上市公司首席财务官,以及在生命科学领域 的30多年经验。
| 122 |
董事会委员会
我们董事会的常务委员会由审计委员会、薪酬委员会和提名和公司治理委员会组成。我们的董事会可能会不时成立其他委员会。本公司首席执行官和其他高管定期向非执行董事汇报工作以及审计、薪酬和提名及公司治理委员会,以确保对我们的活动进行有效和高效的监督,并协助进行适当的风险管理和持续的管理控制评估。我们相信,我们董事会的领导结构为公司的活动提供了适当的风险监督。
审计委员会
审计委员会由担任主席的格雷戈里·弗雷塔格、罗伯特·G·菲尼齐奥和詹姆斯·萨皮尔斯坦组成。我们的董事会已确定,根据董事上市规则 和交易所法案规则10A-3的独立性要求,审计委员会的每一名成员都有资格成为独立的纳斯达克。至少有一名审计委员会成员有资格成为S-K条例第407(D)(5)项所界定的“审计委员会财务专家”。审计委员会的目的是 准备美国证券交易委员会要求的审计委员会报告,该报告应包括在公司根据美国证券交易委员会规则和条例要求提交的任何委托书或招股说明书中,并协助我们的董事会监督和监督(1)财务报表的质量和完整性;(2)遵守法律和监管要求;(3)公司独立的注册会计师事务所的资格和独立性;(4)公司内部审计职能的履行情况(如果有);(五)本公司独立注册会计师事务所的经营情况。我们的董事会已经通过了审计委员会的书面章程,该章程可以在我们的公司网站(www.zyversa.com).
薪酬委员会
薪酬委员会由罗伯特·G·菲尼齐奥(Robert G.Finizio)担任主席,朴敏哲(Min Chul Park)博士和詹姆斯·萨皮尔斯坦(James Sapirstein)组成。我们的董事会已经通过了薪酬委员会的书面章程,该章程可以在我们的公司网站(www.zyversa.com)。 薪酬委员会的目的是协助我们的董事会履行以下职责:(1) 制定公司的薪酬计划及其高管和董事的薪酬;(2)监督公司的激励性和基于股权的薪酬计划;以及(3)准备薪酬委员会报告,该报告必须包括在公司根据美国证券交易委员会的规则和规定必须提交的任何委托书或招股说明书中。
提名和公司治理委员会
提名和公司治理委员会由格雷戈里·弗雷塔格、敏哲·帕克博士和詹姆斯·萨皮尔斯坦组成,担任主席。我们的董事会已经为提名和公司治理委员会通过了一份书面章程,可以在我们的 公司网站(www.zyversa.com)。提名和公司治理委员会的目的是帮助我们的董事会 直接履行以下职责:(1)根据董事会批准的标准确定、审查董事会推荐的提名人选进入董事会,(2)遴选或推荐董事会挑选下一届年度股东大会的董事提名人选,(3)监督董事会和管理层的年度评估,以及(4)向董事会推荐董事会各委员会的董事提名人选。
| 123 |
商业行为准则
公司通过了适用于我们所有董事、高级管理人员和员工的新商业行为准则,包括首席执行官、首席财务官和首席会计官,该准则可在公司网站上查阅。 公司的商业行为准则是S-K条例第406(B)项中定义的“道德准则”。请注意 公司的互联网网站地址仅作为非活动文本参考提供。本公司将在其公司网站上对其道德守则条款的修订或豁免进行任何法律 规定的披露。
薪酬 委员会联锁和内部人士参与
在2022财年期间或在任何其他时间,我们的薪酬委员会没有 成员是我们的高管或员工。 我们的高管都没有担任过董事或任何实体的薪酬委员会(或具有同等 职能的其他委员会)的成员,其中一名高管曾担任过我们董事会的董事或薪酬 委员会的成员。
董事会独立性
纳斯达克规则一般要求独立董事必须在上市公司董事会中占多数。根据各推荐董事要求及提供的有关其背景、工作及从属关系(包括家庭关系)的资料, 我们已确定,罗伯特·G·菲尼齐奥、朴敏哲博士、詹姆斯·萨皮尔斯坦和格雷戈里·弗雷塔格代表美国证券交易委员会五(5)名董事中的四(4)名,该词是根据美国证券交易委员会适用的规则和法规以及 纳斯达克的上市要求和规则定义的。
责任和赔偿的限制 事项
《第二次修订和重新签署的公司注册证书》(以下简称《宪章》)包含的条款限制了本公司董事因违反其受托责任而承担的金钱损害赔偿责任,但根据DGCL不能免除的责任除外。 特拉华州法律规定,公司董事对违反其受托责任的个人责任不承担个人责任,但对下列任何一项的责任除外:
| ● | 违反其对公司或其股东的忠诚义务; |
| ● | 非善意的行为或不作为,或者涉及故意的不当行为或者明知是违法的; |
| ● | 非法支付股息或非法股票回购或 DGCL第174条规定的赎回;或 |
| ● | 董事从中获取不当个人信息的任何交易 效益 |
此 责任限制不适用于根据联邦证券法产生的责任,且不影响 等公平救济措施的可用性,例如禁令救济或撤销。
《章程》和《第二次修订和重述的章程》(以下简称《章程》)还规定,我们应在法律允许的最大范围内赔偿董事和执行人员,并可赔偿我们的其他高级管理人员和雇员以及其他代理人。我们认为, 《章程》规定的赔偿至少包括违约方的过失和重大过失。本章程 还允许我们代表任何高级管理人员、董事、雇员或其他代理人为他或 的行为引起的任何责任投保,无论本章程是否允许赔偿。
除了我们的章程文件中规定的赔偿 外,我们 还与董事和执行官签订了单独的赔偿协议。这些协议,除其他事项外,规定我们的董事和执行官 赔偿此人在因此人作为董事或执行官的服务而引起的任何诉讼或程序中或应我们的要求而发生的费用、判决、罚款和和解金额。我们认为,这些条款和协议对于吸引 和留住合格的人员担任董事和执行官是必要的。
| 124 |
高管薪酬
摘要 截至2022年12月31日的年度薪酬表
以下薪酬摘要表列出了有关我们的指定高管 (“NEO”)在2022年和2021年因在2022年和2021年期间以各种身份向我们及其子公司提供的服务而支付、授予或赚取的薪酬的信息。
| 名称和主要职位 | 年 | 薪金(元) | 期权奖励(1)($) | 总补偿(美元) | ||||||||||||
| 史蒂芬·C·格洛弗 | 2022 | 450,500 | 1,027,948 | 1,478,448 | ||||||||||||
| 联合创始人、首席执行官、总裁兼董事长 | 2021 | 450,500 | 1,803,896 | 2,254,396 | ||||||||||||
| 尼古拉斯·A小拉贝拉(2) | 2022 | 325,000 | 385,394 | 710,394 | ||||||||||||
| 首席科学官兼高级副总裁 的研发 | 2021 | 325,000 | 425,902 | 750,903 | ||||||||||||
| 卡伦·A·卡什米尔 | 2022 | 300,000 | 282,622 | 582,622 | ||||||||||||
| 首席商务官 | 2021 | 300,000 | 312,328 | 612,328 | ||||||||||||
| 彼得·沃尔夫 | 2022 | 275,000 | 282,622 | 557,622 | ||||||||||||
| 首席财务官兼秘书 | 2021 | 275,000 | 312,328 | 587,328 | ||||||||||||
| 巴勃罗·古兹曼,医学博士(3) | 2022 | - | - | - | ||||||||||||
| 首席医疗官与医务处高级副总裁 | 2021 | - | - | - | ||||||||||||
| (1) | 报告的 金额代表根据FASB ASC主题718计算的截至2022年12月31日和2021年12月31日的年度内,根据我们的2014年股权激励计划授予董事的股票期权的授予日期公允价值合计。有关计算授予日期公允价值时使用的假设,请参阅我们的 财务报表附注11。 |
| (2) | 小尼古拉斯·拉贝拉,M.S.,我们的前首席科学官和研发高级副总裁总裁于2023年8月18日退休。 |
| (3) | 古兹曼博士于2023年1月26日开始担任我们的首席医疗官和医务事务高级副总裁 。 |
高管 薪酬安排
执行 雇佣协议
斯蒂芬·C·格洛弗
于2019年1月1日,吾等与Stephen C.Glover订立雇佣协议(“GLOVER雇佣协议”)。 根据GLOVER雇佣协议的条款,他担任首席执行官一职,每年领取45万美元的基本工资,该基本工资金额可能会由董事会或薪酬委员会定期调整。此外,格洛弗先生有资格获得年度奖金,目标金额相当于格洛弗先生基本工资的50%(50%)。 每笔年度奖金的实际金额将基于我们公司目标的实现程度和格洛弗先生的个人目标,在每种情况下,都是由我们和格洛弗先生为与年度奖金相关的日历年度确定的 。公司目标的实现程度和格洛弗先生一年的个人业绩目标应由我们根据合理的酌情权作出决定。此外,根据格洛弗雇佣协议的条款,格洛弗先生有资格根据我们现有的股权激励计划或我们未来可能采用的任何其他股权激励计划不时获得股权奖励,奖励的条款和条件(如果有)将由我们的董事会或 薪酬委员会酌情决定。格洛弗先生还有资格参加我们采用的任何高管福利计划或计划。
根据 《Glover雇佣协议》,我们可以在提前60天书面通知Glover先生的情况下,在没有理由的情况下随时终止Glover先生的雇佣关系(该期限见Glover雇佣协议 中的定义)。Glover先生可在90天书面通知我们后(根据Glover先生雇佣协议中的定义)终止其雇佣关系,收到通知后,我们有 30天的时间来纠正Glover先生认为符合良好理由的条件,但须遵守Glover雇佣协议 中规定的某些条件。
如果 Glover先生的雇佣被无故终止,或有正当理由而非控制变更后期间(定义见Glover雇佣协议 ),Glover先生将有权获得(i)应计债务(定义见格洛弗雇佣协议),㈡相当于格洛弗先生15个月基薪的遣散费(在格洛弗先生被解雇后60天内的下一个正常 发薪日一次性支付),以及(iii)如果选择,公司将向Glover先生偿还15个月的COBRA健康福利。
尽管如此,如果格洛弗先生在控制权变更后12个月内被无故终止雇佣或有正当理由辞职(如格洛弗雇佣协议所定义),格洛弗先生将获得(I)应计债务,(Ii)相当于格洛弗先生基本工资36个月的遣散费 (从格洛弗先生被解雇后60天内的下一个正常发薪日开始分两个月支付),(Iii)应付给格洛弗先生的任何递延赔偿金,(Iv)如果当选,本公司将偿还格洛弗先生为期24个月的某些眼镜蛇健康福利,(V)相当于格洛弗先生在终止发生的日历年的目标年度红利金额的付款,(Vi)代替因行使授予格洛弗先生的未偿还期权而发行的普通股,格洛弗先生将获得相当于(A)纳斯达克上报告的普通股收盘价 的超额乘积的现金。按终止日期或最接近终止日期之最低出价及最高出价之平均值(br}终止日期或最近终止日期)计算,除以格洛弗先生所持每项购股权之每股行使价(不论当时是否可全数行使)加上任何适用现金增值权金额,乘以(B)每项该等购股权所涵盖之普通股股份数目,及(Vii)相当于格洛弗先生因该等终止而招致之任何及所有法律费用金额之付款。
| 125 |
根据 《Glover雇佣协议》,我们可以在书面通知Glover先生后随时无故终止Glover先生的雇佣关系。 Glover先生可在没有充分理由的情况下随时自愿终止其雇佣关系,但须提前九十(90)天书面通知 公司;但是,我们保留在书面通知格洛弗先生后接受格洛弗先生的辞职通知的权利 ,并加速该通知并使格洛弗先生的辞职立即生效,或在格洛弗先生 计划的最后一天工作之前,我们认为合适的其他日期。如果Glover先生的雇佣被无故终止或无正当理由,他 有权获得(i)其在雇佣最后一天已赚取但未支付的基本工资,(ii)其累积但未使用的假期, (iii)根据雇佣协议在雇佣最后一天或之前产生的可报销的费用,及(iv)Glover先生根据我们的任何股权补偿计划有权获得的任何金额 或利益。
根据 《Glover雇佣协议》,我们可以在书面通知Glover先生后随时无故终止Glover先生的雇佣关系。 Glover先生可在没有充分理由的情况下随时主动终止其雇佣关系,但须提前两周书面通知我们。
于2022年7月20日,吾等与Stephen C.Glover订立新的行政人员聘用协议(“新Glover协议”) ,该协议于业务合并完成后生效,据此吾等同意在业务合并完成后继续保留GLOVER先生为我们的行政总裁,但须受新GLOVER协议的条款及条件所规限。新的格洛弗协议已经取代了格洛弗就业协议。根据新格洛弗协议,格洛弗先生的雇用条件包括,除其他事项外,他同意并签署专有信息和限制性 契约协议。
根据新格洛弗协议的条款,格洛弗先生将继续担任首席执行官一职,并根据我们的标准薪资惯例领取每年550,000美元的基本工资。格洛弗先生的基本工资和未来的薪酬增长 将由董事会定期审查和批准。此外,格洛弗先生有资格获得基于绩效的年度现金奖金,目标金额相当于格洛弗先生基本工资的55%(55%),董事会将根据格洛弗先生实现某些业绩目标的情况进行审查和调整。格洛弗先生是否获得年度奖金还取决于格洛弗先生在支付奖金时是否继续受雇于我们,否则年度奖金将被没收。此外,根据新格洛弗协议的条款,格洛弗先生可能有资格获得我们普通股的某些股权奖励,但须受授予奖励的我们的股权计划的归属和其他条款和条件以及我们将提供并与格洛弗先生签订的协议的限制。格洛弗先生还有资格在与处境相似的员工相同的 基础上参加我们的福利计划,该计划在他受雇期间不时生效。
根据新格洛弗协议 ,我们可在书面通知格洛弗先生后,随时终止对格洛弗先生的雇用(该术语在新格洛弗协议中定义)。如果我们之前没有通知格洛弗先生我们打算终止他的雇佣关系, 格洛弗先生可以在60天内向我们发出书面通知,在符合新格洛弗协议中规定的条件的情况下,基于正当理由(该术语在新格洛弗协议中定义),我们有30天的时间解决格洛弗先生认为有充分理由的条件。如果格洛弗先生因正当理由辞职,且该解雇 构成离职(如新格洛弗协议中所定义),则在格洛弗先生履行其在新格洛弗协议下的义务的前提下,格洛弗先生有资格获得离职福利(该条款在新格洛弗协议中定义为 ),其条款和条件与我们在无故终止其雇佣关系时有权获得的条款和条件相同。
如果我们在任何时间无故终止聘用格洛弗先生,或如果格洛弗先生因正当理由辞职,且这种终止构成了离职,则格洛弗先生有权获得应计债务(该条款在新格洛弗协议中定义),并且,在格洛弗先生履行其在新格洛弗协议下的义务的情况下,格洛弗先生还应有权获得以下福利:(I)相当于格洛弗先生当时24个月基本工资的金额, 在发布生效日期(该术语在 新格洛弗协议中定义)之后的定期工资单日期以等额分期付款的方式支付;(2)在格洛弗先生被解雇后60天内一次性一次性支付的数额,相当于在格洛弗先生被解雇前一年所赚取的任何未付奖金。(3)数额等于以下两项中较大的一项:(A)在格洛弗先生被终止之前的业绩年度支付的奖金,和(B)格洛弗先生在发生此种终止的业绩年度本应获得的奖金,两者按格洛弗先生受雇期间至其被解雇之日按比例计算,在格洛弗先生被解雇后60天内一次性支付;(IV) 截至格洛弗先生离职之日尚未授予格洛弗先生的任何股权奖励将成为100%既得 ,任何未行使的股票期权将继续可行使,直至(A)格洛弗先生离职后18个月、 或(B)适用奖励协议规定的此类既得期权的原始到期日;以及(Iv)如果当选,我们将根据新的《格洛弗协议》的条款和条件以及适用的法律法规,向格洛弗先生报销长达18个月的某些COBRA健康福利。
尽管有上述规定, 如果吾等(或任何尚存或收购公司)在控制权变更生效日期(定义见《格洛弗雇佣协议》)生效日期前90天内及生效日期后24个月内,无故终止格洛弗先生的雇佣,或格洛弗先生有正当理由辞职,则格洛弗先生将有权获得应计债务,并在格洛弗先生履行其在新格洛弗协议下的义务的情况下 ;格洛弗先生有资格领取福利,条件与我们无故终止雇用他的条件相同;然而,如果格洛弗先生在其被终止的年度获得相当于格洛弗先生基本工资55%(55%)的奖金;而且,如果控制权的变更 是公司所有权的变更、公司实际控制权的变更或公司资产的相当大部分的所有权变更,则此类终止的应付(或剩余应付)遣散费的累计金额应在控制权变更后30天或之后30天内一次性支付。
根据新格洛弗协议,我们可以书面通知格洛弗先生,随时终止对格洛弗先生的雇用。如果格洛弗先生的雇佣关系在任何时候因任何原因被终止,格洛弗先生将不会获得遣散费或任何其他遣散费或福利,但根据我们的标准工资政策,我们将向格洛弗先生支付应计债务。格洛弗先生可在不少于30天前书面通知我们辞去他在我们公司的工作。如果格洛弗先生因任何原因(正当理由辞职除外)辞去我们的工作,格洛弗先生将不会获得遣散费福利或任何其他遣散费或福利,但我们将支付并提供应计债务。
格洛弗先生有权获得某些遣散费福利的条件之一是,他有义务签署并交付有效的豁免 (该术语在新格洛弗协议中定义),其格式为我们可以接受的60这是终止后的第二天或新闻稿中规定的较早日期。
| 126 |
彼得·沃尔夫
于2022年7月20日,吾等与Peter Wolfe订立高管聘用协议(“Wolfe聘用协议”),该协议于完成业务合并后生效,据此吾等同意在业务合并完成后,根据Wolfe聘用协议的条款及条件,继续留任Wolfe先生担任我们的首席财务官。根据Wolfe雇用协议,Wolfe先生的雇用条件包括,除其他事项外,他同意并签署专有信息和限制性契约协议。
根据沃尔夫雇佣协议的条款,沃尔夫先生将担任首席财务官一职,根据我们的标准工资惯例,他每年的基本工资为395,000美元。沃尔夫先生的基本工资和未来的薪酬增长将由董事会定期审查和批准。此外,沃尔夫先生有资格获得基于绩效的年度现金奖金,目标金额相当于沃尔夫先生基本工资的40%(40%),董事会将根据沃尔夫先生实现某些业绩目标的情况进行审查和调整。沃尔夫先生是否获得年度奖金也取决于沃尔夫先生在支付奖金时是否继续受雇于我们,否则年度奖金 将被没收。此外,根据沃尔夫雇佣协议的条款,Wolfe先生可能有资格获得我们普通股的某些股权授予 奖励,受授予奖励的我们的股权计划的归属和其他条款和条件以及我们将提供并与Wolfe先生签订的协议的限制。沃尔夫先生还有资格在与 处境相似的员工相同的基础上参加我们的福利计划,该计划在他任职期间不时生效。
根据Wolfe雇佣协议,吾等可在书面通知Wolfe先生后,随时无故终止Wolfe先生的雇佣(该术语在Wolfe雇佣协议中定义) 。如果我们之前没有通知Wolfe先生我们打算终止他的雇佣关系,则Wolfe先生可以在30天内 书面通知我们,根据Wolfe雇佣协议中规定的条件,基于充分的理由(该术语在Wolfe雇佣协议中定义)辞去他在我们的雇佣关系。如果Wolfe先生因正当理由辞职,且该解雇构成离职(如Wolfe雇佣协议中所定义),则在Wolfe先生履行其在Wolfe雇佣协议下的义务的情况下,Wolfe先生有资格按与我们无故终止其雇佣关系 的相同条款和条件领取Serverance福利(该条款在Wolfe雇佣协议中定义)。
如果我们在任何时间无故终止对Wolfe先生的雇用,或者Wolfe先生出于正当理由辞职,且这种终止构成了与服务的分离,则Wolfe先生有权获得应计债务(该条款在Wolfe雇佣协议中定义),并且,在Wolfe先生履行其在Wolfe雇佣协议下的义务的情况下,Wolfe先生还应有权获得以下福利:(I)相当于Wolfe先生当时12个月的基本工资的金额。在发布生效日期(如《沃尔夫雇佣协议》中定义的那样)之后,在我们定期安排的薪资发放日以等额分期付款的方式支付;(Ii)在Wolfe先生被解雇后60天内一次性一次性支付的金额,相当于Wolfe先生被解雇时前一年所赚取的任何未付奖金;及(Iv)如果当选,我们 将向Wolfe先生偿还长达12个月的某些COBRA健康福利,在每种情况下都要遵守Wolfe雇佣协议和适用法律法规的条款和条件。
尽管有上述规定, 如果我们(或任何尚存或收购的公司)无故终止对Wolfe先生的雇用,或Wolfe先生在控制权变更(定义见Wolfe雇佣协议)生效日期前90天内及生效日期后24个月内因正当理由辞职,则Wolfe先生将有权获得应计债务,且受Wolfe先生履行Wolfe雇佣协议项下义务的限制。沃尔夫先生有资格获得福利,条件与他有权因我们无故终止其雇佣关系和下列各项的条件相同,但如果控制权变更 是公司所有权的变更、公司实际控制权的变更或公司资产大部分所有权的变更,应在控制权变更后30天内或在控制权变更后30天内一次性支付终止合同的遣散费的累计金额 :(I)沃尔夫先生将在其终止合同发生的 年度获得相当于沃尔夫先生基本工资的40%(40%)的奖金,并在沃尔夫终止合同后60天内一次性支付;及(Ii)倘若吾等向Wolfe先生发出的任何股权奖励于控制权变更结束时仍未完成 由尚存实体在该控制权变更中承担或继续(根据其条款),则该等股权奖励的未归属部分将于Wolfe先生终止时100%归属。
根据沃尔夫雇佣协议,我们可以书面通知沃尔夫先生,随时终止对沃尔夫先生的雇用。如果沃尔夫先生的雇佣关系在任何时候因任何原因被终止,沃尔夫先生将不会获得遣散费或任何其他遣散费补偿或福利,但根据我们的标准工资政策,我们将向沃尔夫先生支付应计债务。沃尔夫先生可在不少于30天前书面通知我们辞去他在我们公司的工作。如果沃尔夫先生因任何原因(有充分理由辞职除外)辞去我们的工作,沃尔夫先生将不会获得离职金或任何其他遣散费或福利,但我们将支付和提供应计债务。
沃尔夫先生有权获得某些离职福利的条件之一是,他有义务签署并交付一份有效的免责声明(如沃尔夫雇佣协议中定义的那样),其格式为我们可以接受的60这是终止后的第二天或新闻稿中规定的较早日期。
| 127 |
凯伦 山羊绒
于2022年7月20日,吾等与凯伦羊绒订立高管聘用协议(“羊绒聘用协议”) ,该协议于业务合并完成后生效,据此吾等同意于业务合并完成后,根据 羊绒聘用协议的条款及条件,继续留任卡什米尔女士为我们的首席商务官。根据《羊绒就业协议》,除其他事项外,卡什米尔女士的就业条件包括她的协议和签署专有信息和限制性契约协议。
根据《羊绒雇佣协议》的条款,凯什米尔女士将担任首席商务官一职,并根据我们的标准薪资惯例获得32万美元的基本年薪。卡什米尔女士的基本工资和未来的薪酬增长 将由董事会定期审查和批准。此外,卡什米尔女士有资格获得基于绩效的年度现金奖金,目标金额相当于卡什米尔女士基本工资的30%(30%),董事会将根据卡什米尔女士实现某些业绩目标的情况进行审查和调整。卡什米尔女士是否收到年终奖也取决于卡什米尔女士在发放年终奖时是否继续受雇于我们,否则 年终奖被没收。此外,根据羊绒雇佣协议的条款,根据授予奖励的本公司股权计划的归属及其他条款和条件,凯什米尔女士可能有资格 获得我们普通股的某些股权奖励 ,以及我们将提供并与羊绒女士签订的协议。卡什米尔女士也有资格 在与处境相似的员工相同的基础上参加我们的福利计划,该计划在她受雇期间不时生效。
根据《羊绒就业协议》,我们可在书面通知卡什米尔女士后,随时无故终止对卡什米尔女士的聘用(该术语在《羊绒就业协议》中有定义)。如果我们之前没有通知卡什米尔女士我们打算终止她的雇佣关系 ,卡什米尔女士可以有充分的理由(该术语在羊绒雇佣协议中定义)在30天内书面通知我们,我们有30天的时间来解决卡什米尔女士认为 是正当理由的条件,但要遵守羊绒雇佣协议中规定的某些条件。如果卡什米尔女士出于好的 理由辞职,并且只要该解雇构成离职(如《羊绒雇佣协议》中所定义),则在卡什米尔女士履行其在《羊绒雇佣协议》项下的义务的情况下,卡什米尔 女士将有资格按与我们有权无故终止其雇佣关系的条款和条件 领取离职福利。
如果我们在任何时间无故终止雇用克什米尔女士,或如果克什米尔女士出于正当理由辞职,且这种终止构成离职,则克什米尔女士有权获得应计债务(该术语在《羊绒雇佣协议》中有定义),并且,在克什米尔女士履行《羊绒雇佣协议》规定的义务的前提下,克什米尔女士还有权获得以下福利:(I)相当于克什米尔女士当时12个月基本工资的金额,在发放生效日期(该术语在《羊绒就业协议》中定义)之后,在我们定期安排的工资发放日以等额分期付款的方式支付;(Ii)在羊绒女士离职后60天内一次性一次性支付相当于上一年(br}羊绒女士被解雇时)赚取的任何未付奖金的金额;及(Iv)如果当选,我们将根据羊绒雇佣协议的条款和条件以及适用的法律和法规,向羊绒女士偿还长达12个月的某些眼镜蛇健康福利。
尽管有上述规定, 如果我们(或任何尚存或收购的公司)在控制权变更生效日期(定义见《羊绒雇佣协议》)生效前90天内和生效后24个月内,无故终止凯什米尔女士的雇佣关系,或凯什米尔女士有正当理由辞职,则凯什米尔女士将有权获得应计债务,并受凯什米尔女士遵守《羊绒雇佣协议》规定的义务的制约。卡什米尔女士有资格在与我们无故终止雇佣关系及下列各项相同的 条件下领取离职金,但如果控制权变更是公司所有权的变更、公司实际控制权的变更或公司大部分资产所有权的变更,终止合同应支付的遣散费(或剩余款项)的累计金额应在控制权变更后30天内一次性支付:(I)凯什米尔女士在终止合同的当年将获得相当于凯什米尔基本工资的30%(30%)的奖金,在凯什米尔女士被解雇后60天内一次性支付;及(Ii)倘若吾等向羊绒女士发出的任何股权奖励 于控制权变更结束时仍未清偿,而控制权变更中尚存的实体(根据其条款)接管或继续(根据其条款),则该等股权奖励的未归属部分将于羊绒女士终止时成为 归属。
根据《羊绒雇佣协议》,我们可以书面通知凯什米尔女士,随时终止对凯什米尔女士的雇佣。如果卡什米尔女士的雇佣关系在任何时间因任何原因被终止,卡什米尔女士将不会获得离职金或任何其他遣散费 补偿或福利,但根据我们的标准工资政策,我们将向卡什米尔女士支付应计债务。 卡什米尔女士可以在不少于30天的提前书面通知我们辞职后的任何时间辞去她在我们公司的工作。如果卡什米尔女士因任何原因(正当理由辞职除外)辞去我们的工作,卡什米尔女士将不会获得离职金或任何其他遣散费补偿或福利,但我们将支付并提供 应计债务。
克什米尔女士有权获得某些遣散费福利的条件之一是,她有义务签署并交付一份有效的免责声明(如《羊绒雇佣协议》中所定义的),其形式为我们可以接受的60这是终止后的第二天或新闻稿中规定的较早日期。
| 128 |
尼古拉斯·拉贝拉,Jr.
2018年12月28日,我们与小Nicholas A.LaBella,Jr.签订了雇佣协议。根据LaBella雇佣协议的条款,他担任首席科学官和研发部门的高级副总裁 ,每年基本工资为325,000美元,该基本工资金额会受到董事会或薪酬委员会的定期调整 。
此外,根据拉贝拉雇佣协议,拉贝拉先生有资格获得年度奖金,目标金额相当于拉贝拉先生基本工资的35%。每笔年度奖金的实际金额将基于我们和格洛弗先生就年度奖金所涉及的日历年度所确立的公司目标的实现程度。 此外,根据其雇佣协议的条款,拉贝拉先生有资格根据我们现有的股权激励计划或我们未来可能采取的任何其他股权激励计划不时获得股权奖励 ,而此类奖励的条款和条件(如果有)将由我们的董事会或薪酬委员会酌情决定。
如果 在生效日期之后的任何时间,而不是在控制权变更期间(如LaBella雇佣协议所定义),我们无故终止LaBella先生的雇佣(如LaBella雇佣协议所定义),则受LaBella先生在终止雇佣后六十(60)天内执行且未撤销对公司的全面索赔的约束,Labella先生将有权获得:(I)继续领取其基本工资的六个月,包括按比例计算的年度奖金,减去适用的联邦和州扣缴税款,按照公司正常的工资发放方式支付工资; (2)相当于(A)COBRA规定的每月医疗和牙科保险保费与(B)6的乘积的款项,将于 60支付这是(I)于有关雇佣关系终止后第二日;(Iii)归属受LaBella先生于紧接有关雇佣关系终止后六个月内将会归属的任何购股权及股权奖励的股份数目;及(Iv)于雇佣关系终止后三个月行使既有股份,但须受其受雇期间授出的购股权所规限。
如果, 在控制权变更开始的12个月期间(如拉贝拉雇佣协议所定义),我们无故终止了拉贝拉先生的雇佣(如拉贝拉雇佣协议所界定的),或他有正当理由辞职(如拉贝拉雇佣协议所界定),则受其执行且不撤销在该雇佣终止后60天内以本公司可接受的形式对本公司提出的索赔、以及上述遣散费和福利的限制。LaBella先生终止时持有的受任何股票期权和股权奖励约束的100%未归属股份将加速并完全归属,他将有权在终止雇佣后的六个月内行使既有股份,但须遵守LaBella先生受雇期间授予的期权。
2022年7月20日,我们与小Nicholas A.LaBella,Jr.签订了一份新的高管聘用协议。(“新拉贝拉协议”) 于完成业务合并后生效,据此,吾等同意在业务合并完成后,根据新拉贝拉协议的条款及条件,继续留任拉贝拉先生为我们的首席科学官及研发总监高级副总裁。新拉贝拉协议取代了拉贝拉雇佣协议。 根据新拉贝拉协议,拉贝拉先生的雇用条件包括,他同意并签署专有信息和限制性契约协议。
根据新拉贝拉协议的条款,拉贝拉先生将继续担任首席科学官和研发部门高级副总裁总裁,并根据我们的标准工资惯例,每年获得40万美元的基本工资。 拉贝拉先生的基本工资和未来的薪酬增长将由董事会定期审查和批准。 此外,拉贝拉先生还有资格获得年度绩效现金奖金,目标金额相当于拉贝拉先生基本工资的35%。须由董事会根据拉贝拉先生实现某些业绩目标的情况进行审查和调整。LaBella先生是否获得年度奖金还取决于LaBella先生在支付奖金时是否继续受雇于我们,否则年度奖金将被没收。此外,根据新的拉贝拉协议的条款,拉贝拉先生可能有资格获得我们普通股的某些股权奖励,但须受归属和我们授予奖励的股权计划的其他条款和条件以及我们将提供并与拉贝拉先生签订的协议的限制。LaBella先生也有资格在与类似职位的员工相同的基础上参加我们的福利计划,在他任职期间 生效。
根据新拉贝拉协议,吾等可在书面通知拉贝拉先生后,随时无故终止聘用拉贝拉先生(该词在新拉贝拉协议中定义)。如果我们之前没有通知LaBella先生我们打算终止他的雇佣关系,LaBella先生可以有充分的理由(该术语在新LaBella 协议中定义)在30天内书面通知我们,我们有30天的时间来解决LaBella先生认为是好的理由的条件,但受新LaBella协议中规定的某些条件的限制。如果LaBella先生因正当理由辞职, 并且该终止构成离职(该术语在新LaBella协议中定义),则 在LaBella先生履行其在新LaBella协议下的义务的情况下,LaBella先生有资格获得 离职福利(该条款在新LaBella协议中定义),条款和条件与他有权因我们无故终止其雇佣关系而享有的条款和条件相同。
如果我们在任何时间无故终止拉贝拉先生的雇用,或者拉贝拉先生出于正当理由辞职,但这种终止构成离职,则拉贝拉先生有权获得应计债务(如新拉贝拉协议中所定义的),并且,在拉贝拉先生履行其在新拉贝拉协议下的义务的情况下,拉贝拉先生还应有权获得以下福利:(I)相当于拉贝拉先生当时12个月基本工资的金额,在发布生效日期(该术语在新拉贝拉协议中定义)之后,在我们定期安排的工资单日期以等额分期付款方式支付;(Ii)在LaBella先生被解雇后60天内一次性一次性支付相当于LaBella先生被解雇前一年所赚取的任何未付奖金的金额; 及(Iv)如果当选,我们将向LaBella先生偿还长达12个月的某些眼镜蛇健康福利,每一种情况下都要遵守新LaBella协议的条款和条件以及适用的法律和法规。
| 129 |
尽管有上述规定,如果我们(或任何尚存或收购的公司)无故终止拉贝拉先生的雇佣,或拉贝拉先生在控制权变更生效日期(定义见拉贝拉雇佣协议)前90天内及生效日期后24个月内因正当理由辞职,则拉贝拉先生将有权获得应计债务,并在拉贝拉先生遵守他在新拉贝拉协议下的义务的情况下,拉贝拉先生有资格在与我们无故终止其雇佣关系和下列各项相同的条件下获得离职福利,但条件是,如果控制权变更是公司所有权的变更、公司实际控制权的变更或公司大部分资产所有权的变更,应在控制权变更后30天内或在控制权变更后30天内一次性支付终止合同的遣散费的累计金额 :(I)拉贝拉先生将在其终止合同的当年获得相当于拉贝拉先生基本工资的35%(35%)的奖金,在拉贝拉先生终止合同后60天内一次性支付;及(Ii)倘若吾等向LaBella先生发出的任何股权奖励于控制权变更结束时仍未完成,而控制权变更中尚存的实体(根据其条款) 接管或继续 ,则该等股权奖励的未归属部分将于LaBella先生终止时100%归属。
根据新拉贝拉协议,吾等可在书面通知拉贝拉先生后,随时以任何理由终止聘用拉贝拉先生。 如拉贝拉先生因任何原因而被终止聘用,拉贝拉先生将不会获得遣散费福利或任何 其他遣散费或福利,但根据我们的标准薪酬政策,我们将向拉贝拉先生支付应计的 债务。LaBella先生可以在不少于30天的提前书面通知我们的情况下,随时辞去他在我们公司的工作。如果LaBella先生因任何原因(好的原因辞职除外)辞去我们的工作,LaBella先生将不会获得离职金或任何其他遣散费或福利,但我们将支付并 提供应计债务。
拉贝拉先生有权获得某些遣散费福利的条件之一是,他有义务签署并 以我们可以接受的形式提交有效的解除(如新拉贝拉协议中定义的那样)这是终止后的第 天或新闻稿中规定的较早日期。
小尼古拉斯·A·拉贝拉于2023年8月18日退休。
巴勃罗·A·古兹曼,医学博士
2023年1月26日,我们与巴勃罗·古兹曼博士签订了一项高管聘用协议(“古兹曼聘用协议”),该协议在完成业务合并后生效,据此,吾等同意终止与古兹曼博士之间的任何未完成的咨询协议,并保留古兹曼博士为我们的首席医疗官和医疗事务部的高级副总裁,但须遵守古兹曼聘用协议的条款和条件。根据《古兹曼就业协议》,除其他事项外,古兹曼博士的就业条件包括他同意并签署专有信息和限制性公约协议。
根据古兹曼雇佣协议的条款,古兹曼博士将担任首席医疗官和医疗事务部的高级副总裁,并根据我们的标准工资惯例获得每年350,000美元的基本工资。古兹曼博士的基本工资和未来的薪酬增长将由董事会定期审查和批准。此外,古兹曼博士有资格获得基于绩效的年度现金奖金,目标金额相当于古兹曼博士基本工资的30%(30%),董事会将根据古兹曼博士实现某些业绩目标的情况进行审查和调整。古兹曼博士是否获得年度奖金还取决于古兹曼博士在支付奖金时是否继续受雇于我们,否则年度奖金将被没收。此外,根据古兹曼雇佣协议的条款,古兹曼博士可能有资格获得我们普通股的某些股权奖励,条件是授予奖励的我们的股权计划的归属和其他条款和条件,以及我们将提供并与古兹曼博士签订的协议。古兹曼博士也有资格在与处境相似的员工相同的基础上参加我们的福利计划,该计划在他受雇期间不时生效。
| 130 |
根据古兹曼雇佣协议,我们可在书面通知古兹曼博士后,随时无故终止对古兹曼博士的雇用(该术语在古兹曼雇佣协议中有定义)。如果我们之前没有通知古兹曼博士我们打算终止他的雇佣关系,古兹曼博士可以在30天内向我们发出书面通知后,以正当理由(该术语在古兹曼雇佣协议中定义)辞去他在我们的工作,并在30天内治愈古兹曼博士认为是正当理由的条件,但要遵守古兹曼雇佣协议中规定的某些条件。如果古兹曼博士因良好的 理由辞职,并且该解雇构成离职(如古兹曼雇佣协议中的定义),则在古兹曼博士履行其在古兹曼雇佣协议下的义务的情况下,古兹曼博士有资格 按他有权在我们无故终止其雇佣关系的相同条款和条件下获得离职福利(该条款在古兹曼雇佣协议中定义)。
如果我们在任何时间无故终止对古兹曼博士的雇用,或古兹曼博士出于正当理由辞职,且该终止构成离职,则古兹曼博士有权获得应计债务(如古兹曼雇佣协议中所定义),并且,在古兹曼博士履行其在古兹曼雇佣协议下的义务的情况下,古兹曼博士还应有权获得以下福利:(I)相当于古兹曼博士当前12个月基本工资的金额,在发放生效日期(古兹曼雇佣协议中对该术语的定义)之后,在我们定期安排的工资单日期以等额分期付款方式支付;(Ii)在古兹曼博士离职后60天内一次性一次性支付相当于古兹曼博士离职前一年所赚取的任何未付奖金的金额; 和(Iv)如果当选,我们将向古兹曼博士偿还长达12个月的某些眼镜蛇医疗福利,在每种情况下都要遵守古兹曼雇佣协议的条款和条件以及适用的法律和法规。
尽管有上述规定,如果我们(或任何尚存或收购的公司)无故终止对古兹曼博士的雇用,或古兹曼博士在控制权变更生效日期(如《古兹曼雇佣协议》所定义)生效日期前90天内和生效日期后24个月内有充分理由辞职,则古兹曼博士将有权获得应计债务,并在古兹曼博士履行其在《古兹曼雇佣协议》下的义务的前提下,古兹曼博士有资格获得离职福利,条件与他有权在我们无故解雇他的情况下领取福利的条件相同,但条件是,如果控制权变更是公司所有权的变更、公司实际控制权的变更或公司大部分资产所有权的变更,终止合同的应付(或剩余应付)遣散费的累计金额 应在控制权变更后30天内一次性支付:(I)古兹曼博士终止合同的当年将获得相当于古兹曼博士基本工资30%(30%)的奖金,并在古兹曼博士终止合同后60天内一次性支付;及(Ii)倘若吾等向古兹曼博士发出的任何股权奖励于控制权变更结束时仍未清偿,而该控制权变更中的幸存实体(根据其条款)接管或继续(根据其条款),则该等股权奖励的未归属部分将于古兹曼博士终止时100%归属。
根据《古兹曼雇佣协议》,在书面通知古兹曼博士后,我们可以随时终止对古兹曼博士的雇用。 如果古兹曼博士的雇佣因任何原因而在任何时间被终止,古兹曼博士将不会获得离职金或任何其他遣散费补偿或福利,但根据我们的标准工资政策,我们将向古兹曼博士支付应计的 义务。古兹曼博士可在不少于30天前向我们发出辞职书面通知,随时辞去在我们的工作。如果古兹曼博士因任何原因(正当理由辞职除外)辞去我们的工作,古兹曼博士将不会获得离职福利或任何其他遣散费补偿或福利,但我们将支付并提供应计债务。
古兹曼博士有权获得某些遣散费福利的条件之一是,他有义务以我们可以接受的形式签署并交付有效的解除合同(如古兹曼雇佣协议中定义的那样)。Th 在此之前的一天,或在此之前的一天,或在此之前。
2023年1月26日,我们董事会的薪酬委员会批准授予古兹曼博士可行使的2,858股我们普通股的期权,行权价为73.85美元。
年度现金奖金
根据他们的雇佣协议或聘书(视情况而定),每个NEO都有资格获得基于公司和个人实现董事会酌情确定的业绩目标的现金奖励奖金。2021年,近地天体未参加 年度现金奖励奖金计划,但可能有资格参加2022年1月1日生效的年度现金奖励奖金计划。在2022财年,我们的每个近地天体都有资格获得一个目标奖金金额,该金额反映了其年度基本工资的一个百分比。董事会还有权根据具体情况向我们的近地天体发放额外的酌情奖金 。在截至2022年12月31日的财政年度内,授予近地天体的任何可自由支配的奖金均列于上文标题为“-《高管聘用协议》
员工 福利计划
除了每个指定高管的雇佣协议(如上所述)中规定的任何个人福利外,根据适用法律,提名的 高管通常有资格在与公司其他员工相同的基础上参与我们的高管和员工健康及其他员工福利计划。
我们的 员工福利计划包括我们的医疗、牙科、视力、团体人寿和意外死亡和肢解保险计划,在每个 案例中,其基础与我们所有其他员工相同。
| 131 |
奖励 安排
2014股权激励计划
我们 有权根据2018年10月9日、2019年2月2日和2021年2月2日修订的2014年股权激励计划(“2014计划”)颁发奖励。根据2014年计划,自2021年12月31日起,授权发行285,714股我们的普通股 。2014计划下可供发行的普通股数量应在2014计划期限内自2019年开始的每个日历年1月份的第一个交易日自动增加,增加的金额相当于前一日历年12月份最后一个交易日已发行普通股总数的5% (5%),但在任何情况下,此类年度增加不得超过2,857股普通股。2014年计划规定向我们及其附属公司的员工、董事和顾问发放激励性股票期权、非法定股票期权、普通股购买权、股票增值权、限制性股票 和限制性股票单位。2014计划要求股票期权的行权价格 不低于授予之日我们普通股的公允价值。截至2021年12月31日,根据2014年计划,可供未来发行的股票为30,519股。
2014年计划修正案
2022年12月12日,为完成业务合并,本公司批准了对2014年计划的修订 (《2014计划修订》)。2014年计划修正案规定,完成业务合并后,2014年计划下保留和可供发行的普通股股份不得进一步增加 ,2014年计划下不再授予新的奖励。2014年计划修正案的上述摘要由2014年计划修正案全文限定 作为本招股说明书的附件,并以引用的方式并入本文
2022年综合股权激励计划
以下是对《2022年综合股权激励计划》(以下简称《2022年计划》)主要条款的说明,是对《2022年计划》全文的总结。
管理。 总体而言,2022计划将由董事会薪酬委员会管理。薪酬委员会将确定哪些人可以购买普通股、股票增值权(或SARS)、限制性股票单位、受限或非限制性普通股、绩效股票、绩效单位、激励奖金、 其他股票奖励和其他现金奖励。薪酬委员会还可制定规则和条例 ,以管理2022年计划以及修订或修改未决赔偿金。薪酬委员会可根据适用法律和《2022年计划》, 授权首席执行官和其他高管向员工(他们本人除外)授予期权和其他奖励。在2022年计划生效日期即2032年(或到期日)后10年或之后,不得根据2022年计划作出任何期权、股票购买权或奖励,但2022年计划此后将继续 ,而之前授予的期权、SARS或其他奖励仍未完成。
| 132 |
资格。 根据2022年计划,有资格获得期权、SARS或其他奖励的人士是薪酬委员会认为能够为我们的成功做出贡献的本公司及其子公司的员工、高级管理人员、董事、顾问、顾问和其他个人服务提供商,或薪酬委员会认为是公司或任何子公司的未来员工、高管、 高管、董事、顾问、顾问或其他个人服务提供商的任何人士。截至2022年10月31日,公司及其子公司共有七名员工,其中包括四名高管和两名非雇员董事。由于2022计划下的 奖励是薪酬委员会的自由裁量权,我们无法确定上述每个类别中有多少人将获得奖励。
受2022年计划约束的股票 。根据2022年计划的调整条款和下文所述的自动增持规定,根据2022年计划可能发行的普通股的最大总数为41,517股。
根据2022年计划可供发行的普通股数量将于1月1日自动增加ST每年的 ,从2023年1月1日开始,此后每年1月1日至到期日,金额相当于我们在12月31日发行的普通股总数的4%ST除非董事会在此之前采取行动,规定该年度的股份储备不会增加,或该年度的股份储备增加的普通股数量将少于其他情况下增加的普通股数量。
根据《2022年计划》,可根据《2022年计划》授予最多71,429股根据《2022年计划》授权发行的普通股,这些股票期权或ISO旨在满足修订后的《1986年国内收入法》第422节的要求 。根据前款规定可供发行的普通股增发股份不得受国际标准化组织的约束。
如果 根据2022年计划授予的任何期权或SAR在尚未全部行使或任何奖励被没收的情况下终止,或普通股股票 被扣缴以支付期权或其他奖励的预扣税款,或用于支付期权的行使价或奖励的购买价 ,则被没收的被扣留或支付的普通股数量将可用于2022计划下的未来授予。以现金结算的奖励将不计入根据2022年计划可供发行的 股票数量。
在任何日历年度,非雇员董事不得获得会计价值超过250,000美元的奖励(包括非雇员董事在该年度获得的任何现金奖励,但不是根据2022年计划);但如果是新的非雇员董事,则在非雇员董事任期的最初一年,这一金额将增加到500,000美元。
根据2022年计划授权发行的股份数量和前述股份限制受股票拆分、股票分红、类似交易或影响我们普通股的任何其他变化的惯常调整 。
期权条款 和条件。根据2022年计划授予的期权可能是不符合守则第422节要求的ISO或“非法定股票期权” 。薪酬委员会将确定根据2022年计划授予的期权的行权价格。股票期权的行权价格不得低于授予之日我们普通股的每股公允市值(如果是授予10%股东的ISO,则不得低于公允市值的110%)。
如果普通股在授予日在证券交易所上市或在纳斯达克股票市场自动报价系统中报价,则公允市场价值通常为授予日(或授予日 日未发生交易)前最后一个交易日的收盘价。如果没有这样的价格,公平市场价值将由赔偿委员会基于合理应用合理的估值方法 真诚地确定。
| 133 |
自授予之日起, 期权不得超过十年(如果ISO授予10%的股东,则为五年)。根据2022年计划授予的期权将在薪酬委员会在授予时规定的一个或多个时间内行使。任何员工在任何日历年首次可行使的ISO金额不得超过100,000美元。
薪酬委员会可酌情允许期权持有人在期权以其他方式行使之前行使该期权, 在这种情况下,我们发行给接受者的普通股股票将继续遵守 行使前适用于该期权的归属要求。
通常,期权价格可以现金支付,也可以通过保兑支票、银行汇票或汇票支付。赔偿委员会可允许其他付款方式 ,包括(A)通过交付公平市值等于购买价格的普通股股票, (B)通过具有赔偿委员会允许的条款的有全额追索权的计息本票,或(C)这些方法的组合,如授标协议中规定的或赔偿委员会以其他方式决定的。薪酬委员会 被授权建立无现金行权计划,并允许履行行权价格(或预扣税款义务) ,方法是从行权时可发行的股票中减去一些公平市值等于行权价格的股票。
除遗嘱或继承和分配法外,不得转让任何选择权,在接受者有生之年,选择权只能由接受者行使。但是,补偿委员会可允许期权、特别行政区或其他奖励的持有人将期权、权利或其他奖励转让给直系亲属、用于遗产规划的家庭信托或将礼物转让给慈善机构。薪酬委员会将决定股票期权持有人在终止与我们的服务后可在多大程度上行使该期权。
股票 增值权利。补偿委员会可能会根据2022年计划批准SARS。赔偿委员会将决定适用于SARS的其他条款。香港特别行政区的每股行使价格将不低于授予日我们普通股的公平市值的100% ,由补偿委员会决定。根据《2022年规划》授予的任何特区的最长期限为自授予之日起十年。一般而言,每个特区均会在运动时给予参加者一笔相等於以下金额的款项:
| ● | 行使日一股我们普通股的公允市值超过行权价的 乘以 | |
| ● | 香港特别行政区涵盖的普通股股数。 |
支付 可以是我们普通股的股票,也可以是现金,或者部分是普通股,部分是现金,所有这些都由薪酬委员会决定。
受限股票和受限股票单位。薪酬委员会可根据2022年计划授予限制性普通股和/或限制性股票 个单位。限制性股票奖励包括转让给参与者的股票,但受限制 ,如果不满足指定条件,这些限制可能会导致没收。限制性股票单位授予在薪酬委员会指定的特定条件达到或之后的未来日期接受我们普通股、现金或股票和现金组合的权利 。适用于每次授予限制性股票或限制性股票 单位的限制和条件可能包括基于业绩的条件。与限制性股票有关的股息或分配可在向股东支付股息时或在限制性股票归属时支付给股份持有人,由补偿委员会确定。如果任何股息或分配是在限制性股票归属之前以股票支付的,则它们将受到相同的限制。 受限股票单位可在向股东支付现金股息时支付股息等值金额,或在单位归属时支付 股息等值金额。除非薪酬委员会另有决定,否则限制性股票的持有者将有权投票表决股票。
| 134 |
绩效 股票和绩效单位。薪酬委员会可根据2022年计划授予绩效股和/或绩效单位。绩效股票和绩效单位是以股票或美元计价的奖励,在特定的 绩效期间根据达到薪酬委员会制定的绩效标准而赚取。薪酬 委员会将确定适用于每个绩效股票和绩效单位奖励的限制和条件。
奖励 奖金。薪酬委员会可根据2022年计划不定期发放激励性奖金。奖励 奖金的条款将在奖励协议中规定。每份奖励协议将有薪酬委员会确定的条款和条件,包括绩效目标和根据这些目标的实现情况支付的金额。奖励奖金以现金和/或普通股形式 支付。
其他 基于股票和现金的奖励。薪酬委员会可根据《2022年计划》授予其他类型的股权或现金奖励,包括授予或出售没有归属要求的普通股股票,以及在满足薪酬委员会可能施加的条件的情况下获得一笔或多笔现金付款的权利。
某些公司交易的影响 。补偿委员会可在授予裁决时规定控制权变更(如《2022年计划》所界定)对任何裁决的影响,包括(1)加快或延长行使、归属于任何裁决或从任何裁决中实现收益的期限,(2)取消或修改裁决的业绩或其他条件,或(3)按补偿委员会所确定的等值现金价值现金结算裁决。赔偿委员会可酌情采取下列一项或多项行动,视控制权的变动而定:(A)使任何或所有未清偿期权和SARS立即全部或部分可行使;(B)使任何其他赔偿全部或部分不可没收;(C)取消任何期权或特别行政区以换取替代期权;(D)取消对限制性股票、限制性股票单位、履约股份或绩效单位的奖励,以换取任何继承人的股本的类似奖励;。(E)赎回任何限制性股票以换取现金和/或其他替代对价;。(F)取消或终止任何现金和/或其他替代对价的奖励,以换取相当于参与者在控制权变更发生之日行使此类奖励或实现权利时应获得的金额(如果有)的现金和/或财产,但如果关于任何期权或特别行政区的控制权对价的改变 不超过其行使价格,则可以取消该期权或特别行政区,而无需支付任何对价; 或(G)对赔偿委员会认为必要或 适当的其他未支付赔偿金进行修改、调整或修改。
修改, 终止。董事会可随时修订2022年计划,以满足守则或其他适用法律或法规的要求或任何其他法律目的,但未经股东同意,董事会不得(A)增加2022年计划下的普通股数量,(B)改变有资格获得期权、SARS和/或其他奖励的个人群体,或(C)延长2022年计划的期限。
其他 信息
没有提供美国证券交易委员会委托书规则中描述的 “新计划福利”表,因为2022计划下的期权和 其他奖励的授予是可自由支配的,我们现在无法确定未来将向任何特定个人或群体授予 期权或奖励的具体数量或类型。
美国 联邦所得税后果
以下是2022年计划下OPTION和其他赠款的美国联邦所得税后果摘要。建议根据2022年计划授予的其他权利和奖励的受购人和接受者在行使期权或 特别行政区或处置因行使期权或特别行政区或在授予和支付任何奖励后收到的任何股票之前咨询其个人税务顾问。 此外,以下摘要基于对现行法律、现行法律、司法裁决、行政裁决、法规和拟议法规的分析,所有这些都可能发生变化,不涉及州、地方、外国或其他 税法。
| 135 |
选项的处理
《准则》区别对待激励性股票期权和非法定股票期权。然而,对于这两类期权,在授予2022年计划下的期权时,不会向期权受让人确认任何收入,本公司届时也不会有权享受减税 。
一般而言,在行使非法定股票期权(包括拟作为激励性股票期权但在行使时并未继续符合此资格的期权)时,期权受让人将就行使日股票的公平市值超过期权价格确认普通所得税。本公司将有权获得减税,减税金额等于受购人在包括受购人的纳税年度结束在内的会计年度中确认的普通收入。我们将被要求 满足适用的预扣要求,才有权享受税收减免。一般来说,如果期权接受者在行使非法定股票期权时,以部分或全部支付期权价格的方式投标我们普通股的股份,投标将不会确认任何收益或损失 。然而,如果投标的股份是在行使激励性股票期权时获得的 ,而投标是在授予之日起两年内或激励性股票期权行使之日后一年内进行的,则投标 将是对行使激励性股票期权时获得的股份的丧失资格的处置。
对于 激励性股票期权,期权持有人在行使时不存在应税收入。然而,在决定“替代最低税额”是否适用于行权年度时,将考虑股票在行权日期的公平市价 超过行权价格的情况。如果行权时收购的股份持有至授予之日起至少两年,行权之日起一年以上,则出售该等股份所产生的任何损益,如作为资本资产持有,则为长期资本收益或亏损(以股票售价与行权价格之间的差额衡量)。根据当前的联邦所得税法,长期资本利得的税率将低于普通收入的最高税率。如果不符合两年和一年持有期的要求(“取消资格处置”),期权受让人将在处置年度确认普通收入,其数额等于(I)股票在行使日的公允市值减去行使价或(Ii)处置变现金额减去行使价中的较小者。 收益的剩余部分将被视为长期资本收益,具体取决于该股票是否已持有一年以上。如果期权接受者 作出取消资格的处置,本公司将有权获得相当于期权接受者确认的普通收入的减税。
在一般情况下,如果期权接受者在行使激励性股票期权时,以部分或全部支付期权价格的方式投标普通股股份,投标时不会确认任何收益或损失。然而,如果投标股份是在行使另一项激励性股票期权时获得的,而投标是在授予日起两年内或另一项期权行使日期 后一年内进行的,则投标将是对行使另一项期权所获得的股份的丧失资格的处置。
如上文 所述,行使激励性股票期权可使期权接受者缴纳替代性最低税额。对任何特定期权持有人适用替代性最低税额取决于行使年度内与期权持有人有关的特定事实和情况。然而,作为一般规则,普通股在期权行使之日的公允市值超过期权行权价格的金额将构成一项“调整”项目,以确定可对其征收替代税的替代最低应纳税所得额。因此,此项目将进入计算替代最低税的计税基础,因此可能导致替代最低税在任何给定年度都适用 。
股票增值权的处理
一般情况下,特区的接受者不会在授予特区时确认任何收入,届时我公司也将无权扣除。 在行使特区时,持有人将确认普通收入,我公司一般将有权获得相应的扣除, 相当于当时我们普通股的公允市值超过行使价的部分。
| 136 |
股票奖励的处理
通常情况下, 如果没有根据《守则》第83(B)条当前要征税的选择(或第83(B)条),则在授予限制性股票奖励或绩效股票奖励时,不会对接受者或本公司产生联邦收入 税收后果。在限制期届满及适用于受限制股份的任何其他限制获得满足后,收受人将确认普通收入,本公司一般将有权获得相当于当时普通股公平市价的相应扣除 。如果在授予限制性股票奖励之日起30天内作出第83(B)条的选择,接受者将在收到限制性股票时确认一笔普通收入,本公司 一般将有权获得相应的扣除,相当于当时股票的公平市值(在不考虑适用限制的情况下确定) 减去接受者为股票支付的任何金额。如果作出第83(B)条的选择,则在股份限制失效时(以及在出售该等股份之前),接受者不会确认额外的 收入,但如果股份随后被没收,接受者不得扣除在收到股份时根据第83(B)条确认的收入 。
非限制性股票奖(包括业绩单位奖)的 获奖者将确认普通收入,我们公司通常将有权获得相应的扣除,相当于奖项颁发时作为奖励对象的普通股的公平市值 。
限制性股票单位的接受者一般会在单位归属和结算时确认普通收入。收益的金额将等于我们当时发行的普通股的公允市值,我们公司将有权 获得相应的扣除。限制性股票单位的接受者将不被允许就该裁决作出第83(B)条的选择 。
激励性奖金和其他股票或现金奖励的处理
通常情况下,奖励奖金或其他基于股票或现金的奖励的获得者在奖励授予时不会确认任何收入,同时本公司届时也无权获得扣减。在支付此类奖励时,获奖者将确认普通 收入,我们公司通常将有权获得相应的扣减,相当于支付的现金金额和/或我们当时发行的普通股的公平市场价值。
公司扣除额的潜在限制
《守则》第(Br)162(M)节一般不允许公共控股公司在一个课税年度向其首席执行官和某些其他“受保雇员”支付超过100万美元的补偿的减税。我们的董事会和薪酬委员会 打算考虑第162(M)条对根据2022年计划发放的赠款的潜在影响,但保留批准超过第162(M)条扣减限额的高管期权和其他奖励的赠款 的权利。
预缴税款
根据《2022年计划》,我们有权在适当的时候要求购买普通股的每一位受购人和获得普通股奖励的每一位受让人缴纳法律规定须预扣的任何联邦、州或地方税。
| 137 |
未偿还的 2022财年年底的股权奖励
下表汇总了截至2022年12月31日,我们每位被任命的高管所持有的普通股标的已发行股票期权的股票数量:
| 选项 奖项(1) | ||||||||||||||||
| 名字 | 授予日期 | 证券 可行使的基础未行使期权(#) | 证券 基础未行使期权不可行使(#) | 期权 行权价(美元) | 选项 到期日期 | |||||||||||
| 史蒂芬·C·格洛弗 | ||||||||||||||||
| 联合创始人兼首席执行官, | 4/11/2014 | 3,971 | (2) | - | 176.05 | 04/11/2024 | ||||||||||
| 和主席 | 10/28/2016 | 4,822 | (6) | - | 176.05 | 10/28/2026 | ||||||||||
| 4/2/2019 | 7,567 | (9) | - | 405.30 | 04/02/2029 | |||||||||||
| 2/8/2021 | 1,201 | (10) | 2,403 | (10) | 572.60 | 02/08/2031 | ||||||||||
| 2/3/2022 | - | 2,270 | (12) | 572.60 | 02/03/2032 | |||||||||||
| 小尼古拉斯·A·拉贝拉 | ||||||||||||||||
| 首席科学官兼 | 4/11/2014 | 568 | (2) | - | 176.05 | 04/11/2024 | ||||||||||
| 总裁副主任 | 6/9/2015 | 1,135 | (4) | - | 176.05 | 06/09/2025 | ||||||||||
| 研究与开发 | 10/30/2017 | 1,702 | (7) | - | 176.05 | 10/30/2027 | ||||||||||
| 4/2/2019 | 1,135 | (9) | - | 405.30 | 04/02/2029 | |||||||||||
| 2/8/2021 | 284 | (10) | 567 | (10) | 572.60 | 02/08/2031 | ||||||||||
| 1/28/2022 | - | 851 | (11) | 572.60 | 01/28/2032 | |||||||||||
| 卡伦·A·卡什米尔 | ||||||||||||||||
| 首席商务官 | 9/10/2014 | 284 | (3) | - | 176.05 | 09/10/2024 | ||||||||||
| 10/30/2017 | 568 | (7) | - | 176.05 | 10/30/2027 | |||||||||||
| 4/2/2019 | 851 | (9) | - | 405.30 | 04/02/2029 | |||||||||||
| 2/8/2021 | 208 | (10) | 416 | (10) | 572.60 | 02/08/2031 | ||||||||||
| 1/28/2022 | - | 624 | (11) | 572.60 | 01/28/2032 | |||||||||||
| 彼得·沃尔夫 | ||||||||||||||||
| 首席财务官 | 10/21/2015 | 284 | (5) | - | 175.05 | 10/20/2025 | ||||||||||
| 和局长 | 10/30/2017 | 284 | (8) | - | 176.05 | 10/30/2027 | ||||||||||
| 04/02/2019 | 1,135 | (9) | - | 405.30 | 04/02/2029 | |||||||||||
| 02/08/2021 | 208 | (10) | 416 | (10) | 572.60 | 02/08/2031 | ||||||||||
| 01/28/2022 | - | 624 | (11) | 572.60 | 01/28/2032 | |||||||||||
| (1) | 本表所述的所有 未偿还股票期权奖励(“ZyVersa期权”) 均根据ZyVersa 2014股票计划(“2014计划”)授予,可对ZyVersa普通股股票行使 。某些选项会在发生 特定事件时加速。为使业务合并生效,期权相关股份数量和行使价已进行调整 。 |
| (2) | 2014年4月11日,我们授予了为期10年的股票期权,购买了总计4,539股普通股,这些普通股在三年内按年等额分期付款, 行权价为每股176.05美元,它代表我们的普通股在授予日的市场价格。 |
| (3) | 2014年9月10日,我们授予了为期10年的股票期权,购买了总计284股普通股,这些普通股在三年内按年等额分期付款, 行权价为每股176.05美元,代表授予日我们普通股的市场价格。 |
| (4) | 2015年6月9日,我们授予了购买1,135股普通股的10年期股票期权,这些股票在三年内按年等额分期付款,行权价 为每股176.05美元。它代表我们普通股在授予日期 的市场价格。 |
| (5) | 2015年10月21日,我们授予了购买284股普通股的10年期股票期权,普通股在三年内按年等额分期付款,行权价 为每股176.05美元。它代表我们普通股在授予日期 的市场价格。 |
| (6) | 2016年10月26日,我们授予了购买4,822股普通股的10年期股票期权,这些股票立即归属,行权价为每股176.05美元, 代表授予日我们普通股的市场价格。 |
| (7) | 2017年10月30日,我们授予了10年期股票期权,购买了总计2270股普通股,其中三分之一立即归属,其余归属于两年内等额的年度分期付款,行使价为每股 176.05美元,代表我们普通股在授予日的市场价格。 |
| (8) | 2017年10月30日,我们授予了为期10年的股票期权,购买了总计284股普通股,其中25%立即归属,剩余部分在三年内按年等额分期付款,行权价为每股176.05美元。其中 代表我们普通股在授予日的市场价格。 |
| (9) | 2019年4月2日,我们授予了10年期股票期权,购买了总计10,688股普通股,这些普通股在三年内按年等额分期付款, 行权价为每股405.30美元,它代表我们的普通股在授予日的市场价格。 |
| (10) | 2021年2月8日,我们授予了为期10年的股票期权,购买了总计5,703股普通股,这些普通股在三年内按年等额分期付款, 行权价为每股572.60美元,代表授予日我们普通股的市场价格。 |
| (11) | 2022年1月28日,公司授予了为期十年的股票期权,购买了总计2,099股普通股,这些普通股在三年内按年等额分期付款,行权价为每股572.60美元。它代表我们普通股在授予日的市场价格。 |
| (12) | 2022年2月3日,公司授予为期十年的股票期权,购买总计2,270股普通股,这些普通股在三年内按年等额分期付款 ,行权价为每股572.60美元,它代表我们普通股在授予日的市场价格。 |
| 138 |
董事 薪酬
下表列出了有关在2022年内担任本公司董事会非雇员成员的每位员工所赚取或支付的薪酬信息。2022年,除下文另有描述外,我们没有向董事会任何其他非雇员成员支付任何费用、进行任何股权奖励或 支付任何其他薪酬。我们向董事会成员报销因出席董事会会议而产生的合理差旅费用。
赚取的费用或 以现金支付 ($) | 库存 奖项(1) ($) | 选择权 奖项(1) ($) | 总计 ($) | |||||||||||||
| David·S·布里奥内斯(2) | - | - | - | - | ||||||||||||
| Raj Mehra博士,J.D.(2) | - | - | - | - | ||||||||||||
| 格雷戈里·斯卡利奇(2) | - | - | - | - | ||||||||||||
| 克里斯托弗·特威蒂博士(2) | - | - | - | - | ||||||||||||
| Daniel·奥康纳(3) | - | - | - | - | ||||||||||||
| 罗伯特·菲尼齐奥(4) | 37,000 | - | 128,465 | 165,465 | ||||||||||||
| 民哲公园(4) | 30,000 | - | 128,465 | 158,465 | ||||||||||||
| (1) | 报告的金额代表根据FASB ASC主题718计算的截至2022年12月31日的年度,根据我们的2014年股权激励计划授予董事的股票期权的授予日期公允价值合计。有关计算授出日期公允价值时使用的假设,请参阅我们的财务报表附注11。 |
| (2) | 业务合并完成后,个人 于2022年12月12日辞去公司董事会职务。 |
| (3) | Daniel 奥康纳自成立以来一直是拉克斯珀的董事公司,并在业务合并完成后仍是公司的董事公司。 |
| (4) | 业务合并完成后,个人 于2022年12月12日被任命为公司董事会成员 。 |
授予本公司非雇员董事的购股权于三年内授予,其中33 1/3%的购股权于授出日期一周年时归属及可行使,33 1/3%归属及于购股权授出日期两年周年日及33 1/3%归属时行使,并于购股权授出日期三年周年日行使,惟非雇员董事 须于适用归属日期前继续留在本公司董事会。
董事会设置非雇员董事薪酬, 旨在提供必要的具有竞争力的薪酬,以吸引和留住高质量的非雇员董事,并鼓励 持有我们的普通股,以进一步使他们的利益与我们股东的利益保持一致。2022年,公司每位非员工董事 有资格获得30,000美元的年费。财务委员会的一名成员因担任这一职务而额外获得7,000美元。根据2014年计划,公司还向非雇员董事授予股票期权。
Finizio先生每年将获得40,000美元的现金预聘费(按本年度比例计算),以及作为薪酬委员会主席和审计委员会成员的额外现金预聘费15,000美元和8,000美元。根据本公司先前披露的2022年综合股权激励计划(“2022年计划”),Finizio先生还将获得初始和年度期权授予。
朴博士每年将获得40,000美元的现金预约费(按比例计算为本年度),并因其作为薪酬委员会成员的服务而额外获得7,500美元的现金预付金。
O‘Connor先生每年将获得40,000美元的现金预约费(按本年度的比例计算),以及作为审计委员会成员的额外保留现金8,000美元。根据2022年计划,奥康纳先生还将获得初始和年度期权授予。
萨皮尔斯坦先生将获得每年40,000美元的现金预聘费(按本年度比例计算),以及作为薪酬委员会和提名与公司治理委员会成员的额外现金预付金7,500美元和4,000美元。 萨皮尔斯坦先生还将根据2022年计划获得初始和年度期权授予。
弗雷塔格先生将获得每年40,000美元的现金预聘费(按本年度比例计算),以及作为审计委员会主席和公司治理委员会成员服务的18,500美元的额外现金预聘费。根据2022年计划,Freitag先生还将获得初始和年度期权奖励。
鲁帕拉博士每年将获得40,000美元的现金预聘费(按本年度比例计算),并因担任董事会提名和公司治理委员会主席而额外获得8,000美元的现金预付金。Rupalla博士还将根据2022年计划获得初始 和年度期权赠款。
| 139 |
证券的实益所有权
下表 列出了截至2023年12月5日公司普通股的实益所有权:
| ● | 每个 已知为公司5%以上已发行普通股实益拥有人的人; | |
| ● | 公司的每一位高管和董事;以及 | |
| ● | 所有 公司现任高管和董事作为一个团体。 |
受益所有权是根据美国证券交易委员会的规则确定的,该规则一般规定,如果一个人对该证券拥有单独或共享的投票权或投资权,则该人对该证券拥有实益所有权。根据这些规则,受益所有权包括个人或实体有权在2023年12月5日起60天内通过行使认股权证或股票期权或授予受限股票单位等方式获得的证券。受2023年12月5日起60天内可行使或可行使的认股权证或期权约束的股票,或受2023年12月4日起60天内归属的受限股票单位约束的股票,在计算该人的持有量百分比时,被视为已发行股票,并由持有该等认股权证、期权或受限制股票单位的人实益持有,但在计算任何其他人士的持有量百分比时,则不视为已发行股份 。
本公司普通股的某些受益股东拥有购买本公司普通股股份的认股权证,而该认股权证含有阻止持有人行使其认股权证的阻止剂,条件是持有人将因行使该等权利而实益拥有超过4.99%或9.99%(视情况而定)的本公司普通股。在准备下表时,我们在适用的情况下考虑了这些阻滞剂。根据向本公司提供的信息,除脚注所注明的情况外,在符合社区财产法的情况下,下表所列个人和实体对其实益拥有的所有股份拥有唯一投票权和投资权。 除非另有说明,下表所列各实益所有人的营业地址为c/o ZyVersa Treateutics,Inc., 2200 N.Commerce Parkway,Suite208,Weston,佛罗里达州33326。
我们普通股的实益所有权 基于2023年12月5日发行和发行的1,243,297股普通股。
| 实益拥有的股份数目 | 实益拥有的股份百分比 | |||||||||||
| 实益拥有人姓名或名称及地址 | 在提供产品之前 | 在提供服务之前* | 在提供后* | |||||||||
| 董事及行政人员 | ||||||||||||
| 史蒂芬·C·格洛弗(1) | 40,779 | 3.22 | % | 2.45 | % | |||||||
| 朴敏哲博士(2) | 1,040 | * | * | |||||||||
| 罗伯特·G·菲尼齐奥(3) | 1,418 | * | * | |||||||||
| 彼得·沃尔夫(4) | 4,326 | * | * | |||||||||
| 卡伦·卡什米尔(5) | 2,535 | * | * | |||||||||
| 巴勃罗·A·古兹曼医学博士(6) | 4,041 | * | * | |||||||||
| 詹姆斯·萨皮尔斯坦 | - | - | - | |||||||||
| 格雷戈里·弗赖塔格 | - | - | - | |||||||||
| 所有董事和高级管理人员为一组(8人) | 54,139 | 4.24 | % | 3.23 | % | |||||||
| 其他5%实益拥有人 | ||||||||||||
| Ion Ventures LLC(7) | 87,625 | 6.76 | % | 5.17 | % | |||||||
| Wleye Opportunities大师基金(8) | 179,515 | 9.99 | % | 9.99 | % | |||||||
| L1 Capital Global Opportunities Master Fund(9) | 81,424 | 6.42 | % | 4.88 | % | |||||||
| * | 表示 受益所有权低于1%。 |
| 140 |
| (1) | 包括史蒂芬·C·格洛弗及其关联公司持有的18,190股普通股,其中包括(1)斯蒂芬·C·格洛弗登记持有的13,076股普通股;(2)MedicaRx Inc.登记持有的1,253股普通股;(3)Asclepius生命科学基金有限责任公司登记持有的2,442股普通股;以及(4)Asclepius Master Fund,Ltd.登记持有的1,419股普通股。该金额还包括可在2023年12月5日或之后60天内分别针对20,275股和2,314股普通股行使的期权和认股权证。格洛弗先生 是MedicaRx Inc.的董事管理董事、Asclepius Master Fund,Ltd.的管理董事以及Asclepius生命科学基金LP的管理成员。 |
| (2) | 表示可在2023年12月5日或之后60天内对1,040股普通股行使的期权。 |
| (3) | 表示在2023年12月5日或之后60天内可对1,418股普通股行使的期权。 |
| (4) | 代表:(I)1,275股普通股;及(Ii)可于2023年12月5日或之后60天内分别行使2,535股及516股普通股的期权及认股权证 。 |
| (5) | 表示在2023年12月5日或之后60天内可对2,535股普通股行使的期权。 |
| (6) | 代表:(I)744股普通股;及(Ii)可于2023年12月5日或之后60天内分别就3,039股及258股普通股行使的期权及认股权证 。 |
| (7) | 包括(I)35,598股普通股和(Ii)购买52,027股普通股的认股权证,如2023年5月3日提交的附表13G所披露。根据该等 备案文件,已披露的由报告人持有的认股权证可予行使,但须受该等认股权证所载的9.99%实益拥有权的限制限制,但鉴于自该等申报以来本公司已发行股份的增加,所持有的所有认股权证 均于此披露。这些证券由Ionic Ventures LLC持有。布伦丹·奥尼尔和基思·库尔斯顿都是Ionic Ventures LLC的经理,对Ionic Ventures LLC实益拥有的股票拥有共同的投票权和投资者控制权。 Ionic Ventures,LLC的业务地址是3053Fillmore St,Suit256,San Francisco,CA 94123。 |
| (8) | 代表(I)25,864股普通股及(Ii)购买153,651股普通股的认股权证,但不包括购买244,698股普通股的认股权证,该等认股权证因该等认股权证所载9.99%的实益拥有权限制而目前不可行使。这些证券由Walleye Opportunities Master Fund创纪录地持有 。Walleye Opportunities Master Fund Ltd成员的首席投资官William England对Walleye Opportunities Master Fund Ltd持有的证券拥有唯一投票权和处置权。Walleye Opportunities Master Fund的业务地址为:开曼群岛乔治城埃尔金大道190号,开曼群岛KY-9008。 |
| (9) | 代表总计81,424股实益拥有的普通股,包括:(I)60,207股普通股,以各种私募方式向保荐人和某些其他投资者发行,与Larkspur的成立、Larkspur IPO的完成有关,并包括与Larkspur IPO完成相关的权证;(Ii)11,359股普通股,可在行使2023年4月股票发行时发行的认股权证 时发行;及(Iii)于管道股份转换后60天内可发行的普通股9,858股,每股管道股份的金额等于管道股份的收购价除以转换价格 $70.00(底价)。这些证券由L1 Capital Global Opportunities Master Fund登记持有。David先生及Joel Arber为L1 Capital Global Opportunities Master Fund Ltd董事。因此,L1 Capital Global Opportunities Master基金有限公司、Feldman先生及Arber先生可被视为实益拥有上述证券(该词的定义见1934年证券交易法第13d-3条)。在费尔德曼先生和阿尔伯先生被视为实益拥有该等 股份的范围内,费尔德曼先生和阿尔伯先生不为所有其他目的而实益拥有这些证券。L1 Capital Global Opportunities Master Fund的业务地址为开曼群岛大开曼群岛KY1-10085信箱10085炮庭1号施登路161A。 |
| 141 |
分销计划
AG.P./Alliance 我们在此称为配售代理的全球合作伙伴已同意根据2023年12月6日的配售代理协议的条款和条件,担任本次发行的配售代理。配售代理不购买或出售本招股说明书提供的任何证券,也不需要安排购买或出售任何特定数量或金额的证券,但其已同意 尽其合理努力安排出售本招股说明书提供的所有证券。我们将与买方就本次发售直接签订证券购买协议,不得根据本招股说明书 出售全部发售的证券。
本次 发售将不迟于本次发售开始后两个工作日完成,该等证券的交割将在收到本公司收到的投资者资金后进行。
我们 将根据机构投资者的选择,直接与机构投资者签订证券购买协议,机构投资者将在此次发行中购买我们的证券。未签订证券购买协议的投资者应仅依据本招股说明书 购买本次发行的我们的证券。
我们 将在收到投资者资金后向投资者交付正在发行的证券,以购买根据本招股说明书 提供的证券。我们预计将在2023年12月11日左右交付根据本招股说明书发行的证券。 本次发行没有任何最低证券数量或收益金额作为结束发行的条件。
我们 已同意赔偿配售代理和指定其他人的特定责任,包括《证券法》下的责任,并分担配售代理可能被要求就此支付的款项。
费用 和费用
本次 发售是以“合理的最大努力”为基础进行的,配售代理没有义务从我们手中购买任何证券,也没有义务安排购买或出售任何特定数量或金额的证券。我们已同意 支付下表所列的配售代理费(假设购买了我们提供的所有证券)。
根据 分享和陪伴共同 认股权证 | 按预先资助的金额 令状和随附普通令状 | 总计 | ||||||||||
| 公开发行价 | $ | 1.2500 | $ | 1.2499 | $ | 4,999,640 | ||||||
| 安置代理费 | $ | 0.0750 | $ | 0.750 | $ | 299,978 | ||||||
| 给我们的收益(未计费用)(1) | $ | 1.1750 | $ | 1.1749 | $ | 4,699,662 | ||||||
| (1) | 不包括行使普通权证的收益(如果有的话)。 |
我们 已同意向配售代理支付相当于本次发行所筹总收益6.0%的现金费用。由于本次发售没有最低发售金额要求作为完成发售的条件,因此实际现金配售费用(如果有)目前无法确定,可能会大大低于上文规定的最高金额。
我们 估计本次发行应支付的总费用约为345,000美元,其中包括:(I)支付给配售代理的非实报实销的 费用津贴20,000美元;(Ii)与我们支付的配售代理的法律费用有关的实报实销费用 80,000美元(均未预付);以及(Iii)其他估计的 费用约245,000美元,其中包括我们的法律、会计和印刷成本以及与我们的证券注册和上市相关的各种费用。
| 142 |
配售代理可被视为证券法第2(A)(Ii)条所指的承销商,其收取的任何佣金和在作为委托人转售其出售的证券时实现的任何利润,可能被视为根据证券法承销 折扣或佣金。作为承销商,配售代理将被要求遵守证券法和交易法的要求,包括但不限于证券法下的规则415(A)(4)和交易法下的规则10b-5和规则M。这些规则和条例可能会限制作为委托人的配售代理购买和出售证券的时间。根据这些规则和规定,安置代理:
| ● | 不得从事与我们的证券相关的任何稳定活动;以及 | |
| ● | 不得 竞购或购买我们的任何证券,或试图诱使任何人购买我们的任何证券,除非交易法允许 ,直到它完成参与分销。 |
锁定协议
我们的 董事和高级管理人员已签订锁定协议。根据这些协议,除 指定的例外情况外,这些个人同意,在本招股说明书日期后90天结束的期间内,除非事先获得配售代理的书面同意,否则不得出售或转让任何普通股或可转换为、可交换或可行使普通股的证券。具体地说,这些人在一定程度上同意不:
| ● | 要约、质押、出售、合同出售或以其他方式处置我们的证券或任何可转换为或可行使或可交换的普通股股票 ; | |
| ● | 将 输入到任何交换或其他转移到其他安排中。全部或部分拥有我们证券的任何经济后果,无论任何此类交易是以现金或其他方式交割我们的证券; | |
| ● | 对我们的任何证券的登记提出任何要求或行使任何权利;以及 | |
| ● | 公开 披露打算对我们的任何证券进行任何要约、出售、质押或处置,或进行任何交易、互换、对冲或其他 安排。 |
尽管有这些限制,我们的证券可以在有限的情况下转让,包括但不限于赠送。遗嘱或无遗嘱继承。
我们 已与配售代理达成协议,根据本招股说明书,自发售结束之日起45天内为禁售期。这意味着,在适用的禁售期内,除某些有限的例外情况外,未经配售代理事先书面同意,吾等不得:(I)发行、订立任何协议以发行或宣布发行或拟发行任何普通股或普通股等价物,或(Ii)提交任何登记声明或其修订或补充 ,但与本次发售有关的初步招股说明书或招股说明书或S-8表格中与任何员工福利计划有关的登记声明除外。
发行价的确定
我们发售的证券的公开发行价由吾等与投资者协商,并根据发售前我们普通股的交易情况与配售代理进行磋商,以及其他事项。在确定我们正在发行的证券的公开发行价时考虑的其他因素包括我们的历史和前景、我们经营的行业、我们过去和现在的经营业绩、我们业务的发展阶段、我们对未来的业务计划以及这些计划的实施程度、我们高管以前的经验、发行时证券市场的总体状况以及其他被认为相关的因素。
| 143 |
上市
我们的普通股在纳斯达克全球市场的纳斯达克股票市场有限责任公司上市,代码是“纳斯达克”。普通权证还没有建立公开交易市场,我们预计不会发展这样的市场。我们不打算申请在任何证券交易所或其他国家认可的交易系统上上市普通权证。如果没有活跃的交易市场,普通权证的流动性将受到限制。
可自由支配的 帐户
配售代理不打算确认向其拥有自由裁量权的任何账户出售在此发售的证券。
其他 活动和关系
配售代理及其某些附属公司是从事各种活动的全方位服务金融机构,这些活动可能包括证券交易、商业和投资银行、财务咨询、投资管理、投资研究、本金投资、对冲、融资和经纪活动。配售代理及其某些附属公司已经并可能在未来为我们及其附属公司提供各种商业和投资银行及金融咨询服务, 他们已收到或将收到常规费用和开支。
AG.P. 于2021年5月购买了12,767股Old Larkspur B类普通股,该等股份因完成业务合并而转换为我们的普通股 。AGP此前还担任Old Larkspur IPO的承销商和管道的配售代理。关于此次IPO,Old Larkspur向A.G.P.支付了500,000美元的承销费,并同意 聘请A.G.P.担任业务合并的顾问,以协助其与股东举行会议,讨论潜在的业务合并和目标业务的属性,将其介绍给有兴趣购买其与业务合并相关的证券的潜在投资者,帮助其获得股东对业务合并的批准 ,并协助其发布新闻稿和提交与业务合并相关的公开文件。Old Larkspur同意在业务合并完成后向AGP支付相当于首次公开募股总收益的4.5%的现金咨询费(“咨询费”)。关于管道,我们同意支付管道总收益的6.0%的AGP配售代理费(“管道代理费”)。关于完成业务合并,我们与AGP达成协议,通过发行面值为每股0.0001美元的B系列可转换优先股(“B系列股票”),履行我们欠AGP的咨询费和管道代理费方面的义务。在企业合并结束时,A.G.P.获得了4,026股B系列股票,总购买价为4,026,000美元,其中包括(1)3,495,000美元的咨询费,(2)506,000美元的管道代理费,以及(3)相当于25,000美元的非可交代费用。 有关更多信息,请参阅“某些关系和关联人交易。
AG.P.持有的3,495股B系列股票受一项锁定协议的约束,根据该协议,根据FINRA规则 51101,除其中另有规定外,该等B系列股票和转换后可发行的普通股股票 不会被出售、转让、转让、质押或质押,也不会成为任何对冲、卖空、衍生品、看跌或看涨交易的标的,从而导致任何人在紧接我们的尽力而为的要约结束后的900日内有效经济处置该等股票。AGP亦订立登记权协议 ,据此,吾等根据证券法以S-1表格形式向美国证券交易委员会提交一份登记声明,涵盖于B系列股份转换后可发行的所有普通股的回售。不存在对此类股票的需求权。 此外,AGP在招股说明书发布之日起七年内拥有一定的“搭便式”注册权。 该招股说明书涵盖了我们的最大努力产品。我们将承担与提交任何此类注册声明相关的费用。
此外,配售代理及其若干关联公司在其各项业务活动的正常过程中,可进行或 持有多种投资,并积极交易债务和股权证券(或相关衍生证券)和金融工具 (包括银行贷款)用于其自身账户和其客户的·账户,该等投资和证券活动 可能涉及本公司及其关联公司发行的证券和/或工具。如果配售代理或其关联公司与我们建立借贷关系 ,他们将根据其惯常的风险管理政策对冲其对我们的信用风险敞口。 配售代理及其关联公司可以通过进行交易来对冲此类风险敞口,交易包括购买信用违约互换或在我们的证券或我们关联公司的证券中建立空头头寸,可能包括据此发行的普通股。任何此类空头头寸都可能对特此发售的普通股未来的交易价格产生不利影响。配售代理及其某些附属公司亦可传达独立的投资建议、市场颜色或交易理念及/或 就该等证券或工具发表或表达独立研究意见,并可随时持有或向 客户推荐他们持有该等证券及工具的多头及/或空头头寸。
此电子格式的招股说明书可以在配售代理维护的网站上获得,并且配售代理可以电子方式分发 本招股说明书。
上述 并不是配售代理协议或证券购买协议的条款和条件的完整声明,其副本附在本招股说明书所属的注册说明书上。请参阅“在哪里可以找到更多信息.”
| 144 |
某些 关系和关联方交易
除了与董事和高级管理人员的薪酬安排外,“高管薪酬 “和”管理“以及本招股说明书其他地方描述的注册权,以下 是自2020年12月12日以来每笔交易以及当前拟议交易的描述,其中:
| ● | 我们 曾经或即将成为参与者; | |
| ● | 涉及金额超过或将超过120,000美元;和 | |
| ● | 任何 我们的董事、执行人员或5%以上股本的受益持有人,或任何直系亲属, 或与其中任何一个人(租户或员工除外)共享家庭的人,已经或将拥有直接或间接的 物质利益。 |
业务合并后 关联方交易
私人配售
2023年6月5日,我们向保荐人的某些成员发行了总计86,978股普通股,以换取延长该等成员拥有的本公司所有证券的锁定期。
婚约 信(S)
于2023年1月19日,我们与AG.P/Alliance Global Partners(“AG.P.”)签订聘书,同意向AG.P.支付现金费用,相当于预期发售中出售证券的每位购买者支付的总购买价的6.0%,并向AG.P.偿还与此类发售相关的某些费用,总额最高可达100,000美元。AGP还曾担任我们IPO的承销商 和管道的配售代理,如下文所述:前业务合并关联方交易: 拉克斯普.”
咨询 协议
2015年1月22日,我们与我们的首席医疗官巴勃罗·古兹曼博士和医疗事务高级副总裁总裁签订了经修订的咨询协议,以我们代理首席医疗官的身份为我们提供服务。根据咨询安排,自2020年12月12日以来,我们(I)向古兹曼博士支付了总额相当于207,984美元的现金;以及(Ii)向古兹曼博士授予了以每股396.55美元至572.60美元的行使价购买834股我们普通股的期权。与古兹曼博士的咨询安排于2023年1月26日终止,自他受雇于本公司起生效。
管道 交易和相关协议
管道 订阅协议
关于业务合并,吾等与PIPE投资者(包括本公司的若干联属公司)订立经修订的PIPE认购协议,据此,吾等以私募方式向PIPE投资者出售合共8,636股A系列可转换优先股 ,每股面值0.0001美元(“PIPE股份”),总购买价为8,635,000美元,可转换为普通股 ,转换价格最初等于每股350.00美元(须向下调整至不低于 我们普通股股票的底价每股70美元,这是根据本登记声明生效日期后90天 和该证券登记生效日期后150天计算的),可在 根据A系列指定证书的条款转换管道股票时发行,但需进行某些调整; 及(Ii)普通股认购权证(各为“PIPE认股权证”),可购买最多相当于PIPE股份转换后已发行及可发行的普通股 至100%的普通股,行使价最初为每股402.50美元,但须作出若干 调整。PIPE认股权证的行权价将受若干调整影响,包括(I)股票 派息及分拆、(Ii)后续供股、(Iii)按比例分配、(Iv)基本交易、(V)若干自愿 调整及(Vi)根据PIPE认股权证的条款以当时有效价格发行其他证券所产生的调整。A系列指定证书包括发行人按当时已发行管道股票发行价的120%赎回此类股票的权利。此外,PIPE订阅协议还包含惯例陈述和担保,以及某些转让限制。完成出售PIPE股份及PIPE认股权证的条件包括(其中包括)惯常完成交易的条件及完成业务合并协议所拟进行的交易。 根据PIPE认购协议发行的证券基本上与完成业务合并的完成同时完成。
管道 保修协议
关于PIPE认购协议,吾等与其他PIPE投资者订立认股权证协议,据此,吾等发行普通股认购权证(每份为“PIPE认股权证”),以购买最多数目相当于PIPE股份转换后可发行普通股的最多数目的普通股 至100%的普通股,行使价初步等于每股402.50美元,并可作出若干调整。PIPE认股权证的行权价将受若干调整影响,包括(I)股票股息及分拆、(Ii)后续供股、(Iii)按比例分配、(Iv)基本交易、(V)若干自愿调整及(Vi)按行使价或低于行使价发行其他证券所产生的调整 ,在每种情况下,根据PIP权证的条款。
| 145 |
管道 注册权协议
关于业务合并的完成,吾等与PIPE投资者订立了登记权协议 (“PIPE登记权协议”),据此,吾等同意于业务合并完成日期后5个工作日内向美国证券交易委员会编制及提交本登记声明,该登记声明以1933年证券法 下经修订的表格S-1为准,涵盖因PIPE股份的转换或行使而可发行的所有普通股股份的回售 以及根据PIPE认购协议及PIP权证发行的PIP权证。我们还需尽最大努力使此类初始注册声明(以及根据PIPE注册权利协议需要提交的其他注册声明)在提交后在切实可行的范围内尽快由美国证券交易委员会宣布生效,但在任何情况下不得迟于提交后20个历日 (如果美国证券交易委员会进行“全面审查”,则不得迟于45个历日)。此外,根据管道登记权协议的条款 ,在符合某些要求和习惯条件的情况下,包括可能行使的某些 请求权,管道投资者还应拥有某些“搭便式”登记权利,但须受某些要求和习惯条件的约束。我们将承担与提交任何此类注册声明相关的费用 。
股东 支持协议
关于业务合并协议,Larkspur、Old ZyVersa和主要ZyVersa股东签订了股东支持协议(“股东支持协议”),其中规定主要ZyVersa股东(其所有权权益共同代表已发行的ZyVersa普通股和ZyVersa A系列优先股(按转换后的基准投票)足以代表Old ZyVersa批准业务合并),支持批准和采纳业务合并协议和拟进行的交易,并签署和交付了书面同意,股东支持协议将于(A)企业合并结束、(B) 企业合并协议根据其条款终止、(C)Larkspur及Old ZyVersa采纳对企业合并协议的任何重大修订,及(D)Larkspur、Old ZyVersa及ZyVersa股东终止股东支持协议的书面协议(“终止时间”)中以最早者为准终止。ZyVersa的主要股东还同意, 在到期之前,遵守某些转让限制(不包括转换)。
锁定 协议
关于股东支持协议,我们与Key ZyVersa股东签订了锁定协议,我们将其称为“锁定协议”。根据禁售期协议,向ZyVersa发行的与业务合并有关的已发行及未偿还证券总额的约75%须受以下所述的限制,自交易结束 起至适用禁售期终止为止。
我们 和ZyVersa主要股东已同意,在未经本公司董事会审计委员会事先书面同意的情况下,除某些例外情况外,不会在适用的禁售期内:
| ● | 直接或间接出售、要约出售、签订合同或同意出售、质押、质押、授予购买或以其他方式转让、处置或同意转让或处置的任何期权、权利或权证, 或设立或增加看跌期权等值头寸,或平仓或减少交易所法案及据此颁布的美国证券交易委员会规则和条例所指的看涨期权等值头寸,在紧接收购合并生效时间后由其持有的任何合并实体的普通股,或因业务合并而向其发行或可向其发行的任何股份(包括作为管道投资的一部分收购或为交换而发行的公司普通股),或 转换或行使作为管道投资的一部分发行的任何证券),在紧接收购合并生效时间后,可在行使购买其持有的公司普通股股份的期权时发行的任何公司普通股,或在紧接合并生效时间后可转换为或可行使或可交换的任何证券 公司持有的普通股(“禁售股”); | |
| ● | 订立全部或部分转让任何禁售股的任何经济后果的任何掉期或其他安排,不论任何此类交易 将以现金或其他方式交付此类证券结算;或 | |
| ● | 公开 宣布任何意向达成上述条款规定的任何交易。 |
| 146 |
根据禁售协议,吾等及ZyVersa主要股东于截止日期起至(X)截止日期(X)及(Y)本公司完成清算、合并、股本交换、重组或导致本公司所有 股东有权将其股份兑换为现金、证券或其他财产的日期(以较早者为准)的期间内,同意上述转让限制。
修订了 并重新签署了注册权协议
关于业务合并,由Larkspur 与持有Larkspur证券的某些个人和实体之间于2021年12月10日签订的特定注册权协议(“IPO注册权协议”)已修订并重述,本公司、保荐人、在交易结束前持有Larkspur证券的某些个人和实体(连同保荐人、“Larkspur持有人”)以及在交易结束前持有Old ZyVersa证券的某些个人和实体(“ZyVersa持有人”,以及Larkspur持有人,注册权持有人“)签订了日期为2022年12月12日的修订和重新签署的注册权协议。根据经修订及重订的登记权利协议,本公司同意,(I)登记权利持有人将获准于业务合并完成后六个月 要求取得某些登记权利,(Ii)本公司将尽其商业上合理的努力,向美国证券交易委员会提交一份登记转售由 持有或可向登记权利持有人发行的若干证券的登记声明(“转售登记声明”)。及(Iii)本公司将尽其商业上合理的努力,在转售登记声明提交后,在合理可行的情况下尽快宣布该声明生效。在某些情况下,注册权持有人可以要求最多两次包销发行,这些持有人 将有权获得习惯上的搭便式注册权。经修订及重订的注册权协议并无就本公司未能履行经修订及重订的权利协议项下的任何责任而支付任何现金罚款作出规定 。
B系列采购协议
关于业务合并,我们同意以私募方式向向我们提供服务的某些买家发行总计5,062股B系列可转换优先股(“B系列购买协议”),每股面值0.0001美元(“B系列股票”),总购买价为5,062,000美元。可转换为我们普通股的股票,转换价格最初等于每股350.00美元(受 向下调整至不低于每股245.00美元的底价,这是基于我们普通股的股票的公开交易价格 在本注册声明生效日期后150日计算),可根据B系列指定证书的条款转换为B系列股票时发行, 需进行某些调整。B系列指定证书包括发行人以当时已发行B系列股票发行价的120% 赎回此类股票的权利。此外,B系列购买协议还包含惯例陈述和担保,以及某些转让限制。完成出售B系列股份的条件包括(其中包括)惯常的成交条件及完成业务合并协议所拟进行的交易。证券的发行 基本上与业务合并的结束同时完成。
系列 B注册权协议
关于B系列购买协议,吾等及其他买方订立了登记权协议(“B系列登记权协议”),据此,吾等根据1933年证券法(经修订)以S-1表格格式(或 其他适用登记声明)格式向美国证券交易委员会提交本初步登记声明,当中涵盖根据B系列购买协议发行的B系列股份转换或行使时可发行的所有普通股的全部股份的转售。我们 还被要求尽最大努力促使该初始注册声明(以及根据注册权协议需要提交的额外注册声明 )在提交后在切实可行的范围内尽快由美国证券交易委员会宣布生效。此外, 根据B系列注册权协议的条款,在符合某些要求和习惯条件的情况下,包括关于可能行使的某些要求权利,购买者还应具有某些“搭载”登记权利 ,受某些要求和习惯条件的限制。我们将承担与提交 任何此类注册声明相关的费用。
| 147 |
过桥融资
从2022年3月至2022年12月,Old ZyVersa进行了A系列可转换优先股的股票和认股权证(“过桥认股权证”)的私募发行,以购买Old ZyVersa的普通股(“过桥融资”)。 A系列可转换优先股的股票在紧接业务合并完成之前自动转换为Old ZyVersa普通股。该等旧ZyVersa普通股于完成业务合并后(按兑换比率)交换为36,363股本公司普通股(其中9,635股与过桥融资有关,其余股份来自将2021年本票融资转换为过桥融资的转换)。此外,在业务合并完成后,已发行的过桥认股权证被假定并(根据合并交换比率)转换为认股权证,以购买我们普通股的股份。替代认股权证可行使36,363股普通股(其中9,365股认股权证来自桥融资,其余认股权证来自2021年承诺票 票据融资转换为桥融资),初始行使价相当于每股241.50美元(经 调整以实施业务合并),须作出若干调整。本公司的某些关联公司作为投资者参与了Bridge融资。
相关的 方交易政策
我们的 董事会已采纳书面关联人交易政策,其中规定了 关联人交易审查、批准或批准的以下政策和程序。
"关联人交易"是指公司或其任何子公司 过去、现在或将来参与的交易、安排或关系,涉及的金额超过120,000美元,并且任何关联人在其中已经、已经或将要拥有 直接或间接重大利益。
“关系人”是指:
| ● | 任何 是或在适用期间内任何时候曾是公司的 公司的高级管理人员或董事之一; |
| ● | 公司所知的拥有超过5% (5%)有表决权股票的实益所有人; |
| ● | 任何 上述任何人的直系亲属,指任何子女,继子, 父母、继父母、配偶、兄弟姐妹、婆婆、岳父、儿媳、姐夫 董事、高级管理人员或超过百分之五(5%)的实益拥有人的嫂子 其有表决权的股份,以及任何人(租客或雇员除外)与家庭共享 该董事、高级管理人员或受益所有人的投票权超过百分之五(5%) 存货;及 |
| ● | 任何商号、公司或其他实体,其中任何上述人士为合伙人或负责人或处于类似职位,或拥有10%(10%)或更大的实益 所有权权益。 |
公司制定了政策和程序,旨在尽量减少因与 关联公司的任何交易而产生的潜在利益冲突,并提供适当的程序,以披露 不时可能存在的任何实际或潜在利益冲突。具体而言,根据其章程,审计委员会有责任审查关联方交易。
本节中描述的所有 交易都是在采用本政策之前进行的。上述披露的某些内容 是我们关联方协议的某些条款的摘要,其全部内容均参考此类协议的所有条款 进行限定。由于这些描述仅是适用协议的摘要,因此它们不一定包含您可能会发现有用的所有信息。某些协议(或协议形式)的副本已作为本招股说明书的一部分作为登记说明书的附件提交,并可在美国证券交易委员会网站上以电子方式获得,网址为:Www.sec.gov.
执行 高管和董事薪酬安排
参见 “高管薪酬"有关与公司执行人员和董事 的薪酬安排的信息,其中包括(除其他外)雇佣、终止雇佣和控制权变更安排、股票奖励 和某些其他福利。
董事 和军官赔偿
本公司第二次修订及重订的公司注册证书(“章程”)及第二次修订及重订的附例(“附例”) 为本公司的董事及高级职员提供最大限度的保障。我们已经与我们的每一位董事和高管签订了赔偿协议。有关更多信息,请参阅中包含的赔偿讨论 “管理。”
| 148 |
开业前 旧ZyVersa合并关联方交易
2021年本票融资
在2021年2月至3月期间,Old ZyVersa发行了本金总额为523万美元的可转换本票(“2021年票据”)。Old ZyVersa超过5%的股东Inon有限公司购买了本金总额为250万美元的2021年债券,Old ZyVersa首席执行官斯蒂芬·格洛弗购买了本金总额为30万美元的2021年债券。 2021年债券的利息年利率为6%,按日复利,2021年12月31日到期。如果ZyVersa在2021年2月15日之后开始债务融资(“合格债务融资”),2021年票据将自动转换为 与合格债务融资中发行的相同形式、相同条款和条件的本票,本金 金额等于2021年票据项下的当时未偿还本金和应计未付利息(“票据义务”)。 当公司在2021年2月15日之后完成最低50万美元的股权融资(“合格股权融资”)时, 2021年票据将自动转换为以该等合资格股权融资的任何投资者所收到的相同价格及相同条款及条件于一项合资格股权融资(“后续一轮证券”)出售的股权证券。 于该等转换后将发行的后续一轮证券的数目,应等于(I)除以(I)该等有限制股权融资结束时未偿还的票据责任的金额除以该等后续一轮证券在该合资格股权融资中出售的最低每份证券价格(“换股价格”)所得的商数。如果在合格股权融资之前的任何时间,控制权发生变更,则相当于该控制权变更结束时未偿还票据债务的金额应在控制权变更结束时自动转换,价格为每股3.25美元。2022年7月8日,由于A系列优先股融资(导致合格股权融资,累计毛收入超过500,000美元),2021年票据由5,230,000美元本金和428,888美元应计利息组成, 自动转换为1,802,193股A系列优先股,实际转换价格为A系列优先股每股3.14美元。此外,购买2,035,571股普通股的A系列认股权证是在A系列优先股自动转换时向前2021年票据持有人发行的。A系列优先股在业务合并结束时发生。 这些证券最终转换为桥梁融资中发行的证券,并按相同的条款转换。
库存 与INCON,Ltd.的采购协议。
在2018年11月15日的融资交易中,Old ZyVersa向INCON,Ltd.发行了4,347,826股Old ZyVersa普通股 ,总代价为1,000万美元(“2018 INCON投资”)。关于2018年的INCON投资,INCON任命了一名代表加入Old ZyVersa的董事会,INCON可能会要求Old ZyVersa的首席执行官Stephen Glover加入并担任INCON董事会的成员。
注册 权利协议
于2016年11月,就非公开配售Old ZyVersa的普通股(“2016 Old ZyVersa融资”), Old ZyVersa与参与2016年融资的每名投资者订立注册权协议(“2016注册权协议”)。根据二零一六年登记权协议,参与二零一六年融资的每名投资者均获授予搭载登记权,据此,倘若Old ZyVersa建议根据证券法登记任何供Old ZyVersa出售的股本股份,而登记形式将容许登记投资者的普通股股份,则参与二零一六年融资的每名投资者将有权将其持有的Old ZyVersa普通股股份纳入该登记声明内。2016注册 权利协议在业务合并结束时自动终止。
在2016年Old ZyVersa的发行中,Old ZyVersa首席执行官斯蒂芬·格洛弗和与格洛弗先生有关的实体购买了总计55万美元的普通股,与Old ZyVersa 5%股东肖恩·泰特科姆有关的实体购买了价值20万美元的普通股。
2014年旧ZyVersa股东协议
2014年4月11日,Old ZyVersa与三名5%股东Shawn Titcomb、Nico Pronk和Nathan Cali以及Old ZyVersa首席执行官Stephen Glover签订了股东协议(“2014年ZyVersa旧股东协议”)、据此,每个 股东同意以确保(i)董事人数 的方式对其各自的所有投票证券进行投票Old ZyVersa始终担任三名董事,并且(ii)Shawn Titcomb、Nico Pronk和Stephen Glover当选并继续担任Old ZyVersa董事。
| 149 |
《2014旧ZyVersa股东协议》还包含对股东方所拥有证券的某些转让限制 ,但某些惯例例外情况除外。根据2014年Old ZyVersa股东协议,如果任何其他股东方收到第三方出售其证券的真诚要约,则股东各方均有优先购买权。 2016年10月28日,诺贝尔国际投资公司,Old ZyVersa普通股超过5%的股东和与Pronk先生有关联的实体 签署了一项联合协议,并根据与其他各方相同的条款被定为2014 Old ZyVersa股东协议的订约方。2014年旧ZyVersa股东协议在业务合并结束时自动终止 。
开业前 Larkspur合并关联方交易
于2021年4月4日,Larkspur与Brio Financial Group(“Brio Financial”) 订立协议(“Brio协议”),据此Brio Financial向Larkspur提供若干财务及会计服务,包括但不限于协助Larkspur制定及记录每月及季度会计结算流程、编制财务报表、维护Larkspur会计系统及其内部债务及权益分类账、编制季度及年度报告的MD&A部分,以及评估其财务报告的内部控制。根据Brio协议,Larkspur同意向Brio Financial支付固定价格15,000美元的初始服务和固定的每月1,750美元的经常性服务,从2021年6月开始。Larkspur 还同意报销Brio Financial的旅费和其他自付费用。《Brio协议》的有效期自2021年4月4日起生效,有效期至2022年12月31日。Larkspur或Brio Financial可在书面通知另一方后10天内,以任何理由随时终止Brio协议。David·S·布里奥内斯,Larkspur的首席财务官、财务主管、秘书兼董事,是Brio Financial的管理成员,拥有Brio Financial的100%股权。布里奥协议的价值约为48,250美元,David·S·布里奥内斯在布里奥协议中的权益的大约价值为48,250美元。
在完成业务合并方面,Larkspur与A.G.P. 签订了B系列购买协议,包括向A.G.P.发行4,026股B系列股票,考虑到A.G.P.代表我们开展的活动, 包括确定潜在目标业务和对合适的业务合并进行尽职调查,购买总价约为4,026,000美元,其中包括:(I)与管道有关的配售代理费6.0%,金额约为506,000美元,(Ii)与本公司首次公开招股有关的递延承销折扣4.5%,金额相当于3,495,000美元;及(Iii)不可申报的 开支,金额相当于25,000美元。
在Larkspur首次公开募股结束之前,Larkspur Health LLC的投资者同意向Larkspur提供总计75万美元的贷款,用于此次发行的部分费用。这些贷款是无息、无抵押的,应于2021年12月31日之前或Larkspur首次公开募股结束时(以较早的日期为准)到期 用于支付相关发售费用(承销佣金除外)的估计1,176,000美元发售所得款项。
在Larkspur最初的业务合并之后,其管理团队中继续留在合并后公司的成员可能会从合并后的公司获得咨询费、管理费或其他费用,并在投标要约或委托书征集材料(视情况而定)中向股东充分披露任何和所有金额。此类薪酬的金额 不太可能在分发此类投标要约材料时或在为考虑我们最初的业务合并而召开的股东大会 上得知,因为将由合并后业务的董事 来确定高管和董事的薪酬。
Larkspur 与我们的高级管理人员和董事签订了惯例协议,在其修订和重新修订的公司注册证书中规定的赔偿之外,提供合同赔偿。Larkspur的章程还将允许他们代表任何高管、董事或员工为其行为引起的任何责任投保,而无论特拉华州法律 是否允许此类赔偿。Larkspur将购买董事和高级管理人员责任保险,为其高级管理人员和董事在某些情况下支付辩护、和解或支付判决的费用提供保险,并为其赔偿其高级管理人员和董事的义务提供保险。
| 150 |
于2021年5月7日,保荐人根据一份书面协议向Larkspur 购买合共9,151个私募单位,购买价为每份认股权证350.00美元,与首次公开发售结束及承销商行使超额配售选择权同时进行。每个定向增发单位由一股A类普通股和四分之三的可赎回定向增发认股权证组成。每份私募认股权证使持有人有权以每股402.50美元的价格购买一股A类普通股,价格可能会有所调整。普通股和私募认股权证的标的股份(包括行使认股权证时可发行的普通股股份),除某些有限的 例外情况外,持有人不得转让、转让或出售,直至初始业务合并完成后30天。
于2021年5月7日,Larkspur向保荐人的投资者发行无担保本票(“本票”),并于2021年10月7日修订及重列,据此Larkspur可借入本金总额高达750,000美元。 本票为无息票据,于(I)2021年12月31日及(Ii)Larkspur完成首次公开发售时(以较早者为准)支付。
对于在完成初始业务合并之前或与初始业务合并相关的服务,不会向保荐人、高级管理人员和董事或他们各自的关联公司支付任何形式的补偿,包括发起人和咨询费。然而, 这些个人将获得与Larkspur代表活动相关的任何自付费用的报销 ,例如确定潜在的目标业务和对合适的业务组合进行尽职调查。Larkspur的审计委员会按季度审查Larkspur向赞助商、高级管理人员、董事或其附属公司支付的所有款项,并确定哪些费用和费用金额将得到报销。此类人员因代表Larkspur开展活动而发生的自付费用没有上限或上限。
此外,为了支付与计划的初始业务合并相关的交易成本,保荐人或保荐人的附属公司或Larkspur的某些高级管理人员和董事可以(但没有义务)按需要借给Larkspur资金 (“营运资金贷款”)。这种周转资金贷款将由期票证明。票据可在业务合并完成时偿还,不计利息。这些单位将与私人配售单位相同。如果企业合并没有结束,公司可以使用信托账户以外的收益的一部分来偿还营运资金贷款,但信托账户中的收益不会用于偿还营运资金贷款。截至2022年9月30日,营运资金贷款项下没有未偿还金额。Larkspur预计不会从赞助商、其附属公司或其管理团队以外的其他方寻求贷款,因为它不相信第三方会愿意借出此类资金,并免除 寻求使用信托账户中资金的任何和所有权利。
赔偿协议
公司已与每位董事和指定的高管签订了赔偿协议。这些协议要求公司在特拉华州法律允许的范围内,最大限度地赔偿这些个人因其服务于公司而可能产生的责任,并预支因对他们提起诉讼而产生的费用,因为他们可能会受到赔偿。该公司还打算与其未来的董事和高管签订赔偿协议。对于 ,有关赔偿协议的更详细描述,请参阅《高管薪酬.”
关联方交易的政策和程序
我们的董事会已经通过了一项政策,我们的高管、董事、被选举为董事的被提名人、任何类别普通股的实益拥有人 、任何上述人士的直系亲属以及上述任何人受雇于其中、是合伙人或主事人或处于类似职位或拥有5%或更大实益所有权权益的任何公司、公司或其他实体(统称为“关联方”),未经本公司董事会通过审核委员会行事或在某些情况下经审核委员会主席事先同意,不得 与本公司进行交易。任何要求本公司与关联方进行交易的请求,如涉及金额超过100,000美元,且该关联方将拥有直接或间接利益,则必须首先提交审计委员会,或在某些情况下提交审计委员会主席进行审查、审议和批准。在批准或拒绝任何此类建议时,审计委员会或审计委员会主席应考虑交易的重大事实,包括但不限于,交易条款是否不低于在相同或相似情况下非关联第三方通常可获得的条款、对我们的好处程度、可比产品或服务的其他来源 ,以及关联方在交易中的利益程度。
董事 独立
我们的董事会对其组成、委员会的组成以及每个董事的独立性进行了审查。根据每个董事要求并提供的有关其背景、就业和从属关系的信息,包括家庭关系,我们的董事会决定,代表董事七(7)名董事中的六(6)名的罗伯特·G·菲尼齐奥、朴敏哲、Daniel·J·奥康纳、詹姆斯·萨皮尔斯坦、格雷戈里·弗雷塔格和卡特琳·鲁帕拉博士不存在会干扰独立判断履行董事职责的关系。该等 名董事均为“独立”董事,该词由美国证券交易委员会的适用规则及规则及纳斯达克的上市 要求及规则界定。
| 151 |
股本说明
以下是对ZyVersa治疗公司(“我们”、“我们”、“我们”或“公司”)的证券的说明,这些证券载于我们第二次修订和重新签署的公司注册证书(“宪章”)和我们第二次修订和重新修订的章程(“章程”)的某些条款、A系列指定证书、B系列指定证书和适用的认股权证。每一份之前已向美国证券交易委员会(“美国证券交易委员会”)提交,并通过引用并入作为本招股说明书组成部分的本登记声明的证物。本摘要并不声称是完整的 ,全文包括宪章全文、章程、A系列指定证书、B系列指定证书、适用的授权书格式以及《特拉华州公司法》(以下简称《DGCL》)的适用条款。 我们鼓励您仔细阅读我们的《宪章》、章程、A系列指定证书、B系列指定证书、适用的授权书格式和DGCL的适用部分。
授权的 资本化
公司授权股本总额包括:
| ● | 250,000,000股普通股,每股面值0.0001美元(“普通股”),以及 | |
| ● | 1,000,000股优先股,每股面值0.0001美元(“优先股”)。 |
截至2023年12月5日,我们的已发行和已发行股本包括1,243,297股普通股、50股A系列优先股和5,062股B系列优先股。我们的普通股在纳斯达克全球市场上市,代码为 “ZVSA”。
普通股 股票
投票权 权利
每名普通股持有人有权就股东一般有权投票的所有事项,就其登记在案的每股普通股股份投一票。
分红 权利
在 可能适用于任何已发行优先股的优先权的前提下,普通股股份持有人将有权 从合法可用的资金中获得 按比例收取具有股息权的普通股的股息(如有)。
清算时的权利
如果 公司事务发生任何自愿或非自愿清算、解散或清盘,普通股持有人将有权按比例分享公司债务和其他债务偿还后剩余的所有资产, 平价通行证以及优先股或任何类别或系列的优先股优先于普通股 的优先股的优先分配权,当时尚未发行,如果有的话。
其他 权利
普通股的 持有者将不享有优先认购权或转换权或其他认购权。不会有适用于普通股的赎回或偿债拨备 。普通股持有人的权利、优先权和特权将受制于公司未来可能发行的任何优先股的持有人的权利、优先权和特权。
| 152 |
优先股 股票
我们 有50股A系列优先股和5,062股B系列优先股已发行和流通。 宪章规定,优先股可以不时以一个或多个系列发行。董事会被授权确定适用于每一系列优先股股票的投票权、指定、权力和优惠、相对、参与、选择或其他特殊权利及其任何资格、限制和限制。董事会可以在没有股东批准的情况下发行具有投票权和其他权利的优先股,这些权利可能会对普通股持有人的投票权和其他权利产生不利影响,并可能产生反收购效果。董事会在未经股东批准的情况下发行优先股的能力可能会延迟、推迟或阻止 公司控制权的变更或现有管理层的撤换。
系列 A可转换优先股
关于业务合并,吾等与PIPE投资者(包括本公司的某些关联公司)订立经修订的PIPE认购协议,据此,吾等以私募方式向PIPE投资者出售合共8,636股A系列可转换优先股,每股面值0.0001美元,总收购价为8,635,000美元。可转换为普通股,转换价格最初等于每股350.00美元(根据我们普通股的股票公开交易价格,根据与此类证券的登记相关的注册声明生效日期后90天和150天计算,向下调整至不低于每股70美元的底价),可在根据A系列指定证书的条款转换管道股票时发行,但需进行某些调整;和(Ii)PIPE认股权证购买最多 数量的普通股,初始数量相当于PIPE根据A系列指定证书和认股权证的条款转换后已发行和可发行的普通股 ,行使价最初等于 至每股402.50美元,可进行某些调整。PIPE认股权证的行使价将受若干调整影响 ,包括因(I)股票股息及拆分、(Ii)后续供股、(Iii)按比例分配、(Iv)基本交易、(V)若干自愿调整及(Vi)按行使价或低于行使价发行其他证券而产生的调整 ,在每种情况下,根据PIPE认股权证的条款生效。A系列指定证书包括发行人有权以当时已发行管道股票发行价的120%赎回此类股票。此外,PIPE订阅协议 包含惯例陈述和保证,以及某些转让限制。完成出售管道股份及管道认股权证的条件包括(其中包括)惯常的完成条件及完成业务合并协议预期的交易 。根据PIPE认购协议发行证券的工作基本上与业务合并的完成同时完成。截至2023年12月5日,(I)只有50股管道股票已发行,(Ii)已发行的管道权证为139,403股,均可按每股70.00美元行使。
B系列可转换优先股
紧接业务合并完成前,吾等根据认购 协议(统称为“B系列认购协议”),向本公司若干服务供应商发行合共5,062股本公司B系列可转换优先股(“B系列股份”),收购价为每股1,000美元 ,以代替向该等服务供应商支付的若干费用的现金支付,总额为5,062,000美元。每一股B系列股票可转换为若干普通股 ,等于购买价格除以转换价格。根据B系列指定证书的条款,转换价格等于每股245.00美元 ,可能会进行某些调整。指定的B系列证书包括发行人有权按当时发行的B系列股票发行价的120%赎回此类股票。 此外,B系列购买协议还包含惯例陈述和担保,以及某些转让限制。完成出售B系列股份的条件包括(其中包括)惯常的成交条件及完成业务合并协议拟进行的交易。证券的发行基本上在业务合并结束的同时完成 。
| 153 |
未偿还的认股权证
公共 认股权证
每份完整认股权证使登记持有人有权在自Larkspur首次公开招股结束起一年后至业务合并完成 后30天开始的任何时间,按每股402.50美元的价格购买一股普通股,但下一段讨论的调整除外。根据认股权证协议,认股权证持有人只能就整数股普通股行使其认股权证。
这 意味着权证持有人在给定时间内只能行使整个权证。拆分单位后,不会发行零碎认股权证,只会买卖整份认股权证。该等认股权证将于业务合并完成后五年、美国东部时间下午5:00或赎回或清盘时更早到期。
我们 将没有义务根据认股权证的行使交付任何普通股,也没有义务就此类认股权证的行使进行结算 ,除非根据证券法就认股权证相关的普通股股份的登记声明生效,且招股说明书是最新的,前提是我们履行了下文所述的登记义务 ,或者有有效的登记豁免。认股权证将不会被行使,我们将不会有义务在认股权证行使时发行普通股,除非认股权证行使时可发行的普通股股份已根据认股权证登记持有人居住国家的证券法登记、符合资格或被视为豁免。如果前两句中的条件不符合认股权证的条件,则该认股权证的持有人将无权行使该认股权证,而该认股权证可能没有价值且到期时一文不值。 在任何情况下,我们均不会被要求以现金净额结算任何认股权证。如果登记声明对已行使的认股权证无效,则包含该认股权证的单位的购买者将仅为该单位的普通股股份支付该单位的全部购买价。
我们 已同意,我们将尽我们商业上合理的努力,尽快向美国证券交易委员会提交一份登记声明 ,以便根据证券法登记在行使认股权证时可发行的普通股,我们将 尽我们商业上合理的努力,使其在我们最初的 业务合并结束后60个工作日内生效,并保持该登记声明和与该等普通股有关的当前招股说明书的有效性,直到认股权证协议中规定的认股权证到期或赎回为止;如果我们的普通股股票 在行使未在国家证券交易所上市的公共认股权证时符合证券法第18(B)(1)条规定的“担保证券”的定义,我们可以根据证券法第3(A)(9)条的规定,要求行使其认股权证的公共认股权证持有人在“无现金基础上”行使,如果我们这样选择,我们将不会被要求为根据证券法登记在行使认股权证时可发行的普通股股份的 提交或维护登记声明,但我们将 尽我们商业上合理的努力根据适用的蓝天法律登记或符合出售资格 不能获得豁免 。如果认股权证行使时可发行普通股的登记声明在60年前未生效这是在初始业务合并结束后第二天,权证持有人可根据证券法第3(A)(9)条或其他豁免以“无现金基础”方式行使认股权证,但我们将尽我们商业上合理的努力,根据适用的蓝天法律登记股票或使其符合豁免条件,直至 有有效的注册声明及未能维持有效的注册声明的任何期间为止。在这种情况下,每位持股人将交出普通股的认股权证,以支付行使价,认股权证的数目等于(A)认股权证的普通股股数乘以(X)认股权证相关的普通股股数乘以(X)认股权证的行使价格所得的“公平市价”(定义见下文)乘以(Y)公平市价和(B)每份认股权证的0.361。本款所称“公允市价”,是指权证代理人收到行权通知之日前十个交易日内普通股股票成交量加权平均价。
赎回权证
一旦 认股权证变为可行使,我们可以赎回尚未行使的认股权证(除本文中关于私募认股权证的说明外):
| ● | 全部而不是部分; |
| ● | 以每份认股权证0.35美元的价格; |
| ● | 向每名权证持有人发出至少30天的提前赎回书面通知;以及 |
| ● | 如果, 且仅当普通股的收盘价等于或超过每股630.00美元(经行使时可发行的股份数量调整后调整)或权证的行权价,如标题“-未偿还的 可赎回权证-公开认股权证-反稀释调整“) 在我们向认股权证持有人发出赎回通知之日前三十(30)个交易日内任何二十(20)个交易日内的任何二十(20)个交易日。 |
| 154 |
我们 将不会赎回上述认股权证,除非证券法下有关在行使认股权证时可发行的普通股 股份的注册声明生效,以及有关该等普通股 股份的最新招股说明书在整个30天的赎回期内可供查阅。如果认股权证可由我们赎回,我们可以 行使赎回权,即使我们无法根据所有适用的州证券法登记标的证券或使其符合出售资格 。
如果 我们如上所述要求赎回权证,我们的管理层将有权要求所有希望行使 权证的持有者在“无现金的基础上”这样做。在决定是否要求所有持有人在“无现金 基础上”行使其认股权证时,除其他因素外,我们的管理层将考虑我们的现金状况、尚未发行的认股权证的数量,以及在行使我们的认股权证后发行最多数量的普通股对我们股东的稀释影响。在这种情况下,每位持股人将通过交出普通股 股票的认股权证来支付行使价,该数量等于(A)认股权证相关普通股数量乘以(X)普通股股份数量乘以(Y)认股权证行使价格除以(Y)公平市场价值所得的普通股“公平市价”的差额,两者中的较小者。
我们 已经建立了上述最后一个赎回标准,以防止赎回赎回,除非在赎回时存在对认股权证行使价的显著溢价。如果满足上述条件并发出认股权证赎回通知,每个认股权证持有人将有权在预定的赎回日期之前行使其认股权证。任何此类行使将不会在“无现金”的基础上进行,并将要求行使权证持有人为行使的每份认股权证支付行使 价格。然而,普通股的价格可能会低于630.00美元的赎回触发价格 (根据行使时可发行的股份数量或权证的行使价格的调整进行调整,如标题“-未偿还可赎回权证-公有权证-反稀释调整“) 以及赎回通知发出后的402.50美元(整股)认股权证行权价。
行权时不会发行任何普通股的零碎股份。如果在行使时,持有人将有权获得一股股份的零头 权益,我们将向下舍入到将向 持有人发行的普通股数量的最接近整数。如果在赎回时,根据认股权证协议,认股权证可行使普通股股份以外的证券(例如,如果我们不是我们最初业务合并中尚存的公司),则可就该等证券行使认股权证。当认股权证可供普通股股份以外的证券行使时,本公司(或尚存公司)将根据证券法作出商业上合理的努力,登记可于行使认股权证时发行的证券。
赎回程序
如果认股权证持有人选择受制于一项要求,即该持有人将无权行使该认股权证,则该认股权证持有人可以书面通知吾等,但条件是在行使该等权利后,该人(连同该人的 联属公司),据认股权证代理人实际所知,将实益拥有超过9.8%(或持有人 指定的其他金额)的已发行及已发行普通股股份。
认股权证 收益
在本公司进行要约收购或以其他方式赎回、终止或注销所假设的Larkspur认股权证的情况下,(X)Larkspur创始股东及(Y)本公司管理层的若干成员将有权因行使与该等赎回有关的任何 该等假设的Larkspur认股权证而获得本公司实际收到的任何现金收益的百分之五(5%)。
反稀释调整
如果普通股的流通股数量因普通股的资本化或应付股息而增加,或普通股的分拆或其他类似事件增加,则在该 资本化或股份分红、分拆或类似事件的生效日期,每份认股权证可发行的普通股数量将按普通股流通股的此类增加比例增加。向所有或几乎所有普通股持有者配股 有权以低于“历史公允市价”(定义见下文)的价格购买普通股,将 视为相当于以下乘积的普通股股息:(I)在配股中实际出售的普通股数量(或在配股中出售的可转换为普通股或可行使普通股的任何其他股权证券下可发行的)和(Ii)1减去(X)在此类配股中支付的普通股每股价格和(Y)历史公允市值的商数。为此目的,(I)如果配股是可转换为普通股或可为普通股行使的证券,在确定普通股的应付价格时,将考虑为该等权利收到的任何对价,以及在行使或转换时应支付的任何额外金额,以及(Ii)“历史公允市价”是指普通股在适用交易所或适用市场正常交易的第一个交易日之前的10个交易日内报告的普通股成交量加权平均价格,但无权获得该权利。
| 155 |
此外,如果我们在认股权证未到期及未到期期间的任何时间,以现金、证券或其他资产向所有或几乎所有普通股持有人支付普通股(或认股权证可转换为的其他证券)的股息或现金分配,但(A)如上所述,(B)任何现金股息或现金分配 ,如果以每股为基础与在宣布该等股息或分配之日止的365天期间就普通股股份支付的所有其他现金股利和现金分配合并,则不超过17.50美元(经调整后适当反映任何其他调整,不包括导致 行使价或在行使每份认股权证时可发行的普通股股数调整的现金股利或现金分配),但仅涉及等于或低于每股17.50美元的现金股息或现金分配总额。(C)满足普通股持有人与拟议的初始业务合并相关的赎回权,(D)满足普通股持有人的赎回权利 股东投票修改我们的章程(A)修改我们的章程的实质或时间 我们有义务向普通股持有人提供赎回其股票的权利,以与我们最初的业务合并相关 如果我们没有在首次公开募股结束后12个月内完成我们的初始业务合并(除非该日期按照现有的组织文件延长)或{br)(B)与本公司普通股持有人的权利有关的任何其他条文,或(E)因未能完成初步业务合并而赎回本公司的公众股份,则认股权证行权价将于该事件生效日期后立即减去现金金额及/或就该事件支付的任何证券或普通股每股资产的公平市价。
如果普通股的流通股数量因普通股合并、合并、股份反向拆分或重新分类或其他类似事件而减少,则在该合并、合并、股份反向拆分或类似事件的生效日期,每份认股权证可发行的普通股数量将根据普通股流通股的此类减少按比例减少。
如上文所述,每当 行使认股权证时可购买的普通股股份数目被调整时,认股权证的行使价将会作出调整,方法是将紧接该项调整前的认股权证行使价格乘以一个分数(X),其中 分子将为紧接该项调整前 行使认股权证时可购买的普通股股份数目,及(Y)其分母将为紧接该项调整后可购买的普通股股份数目。
普通股流通股的任何重新分类或重组(上文所述的或仅影响该等普通股面值的 除外),或我们与 或其他公司的任何合并或合并(合并或合并除外,其中我们是持续公司,且不会导致我们的普通股流通股进行任何重新分类或重组),或将吾等的全部或实质上与吾等解散有关的资产或其他财产出售或转让给另一公司或实体的情况下,认股权证持有人此后将有权在 的基础上,根据认股权证中指定的条款和条件,立即购买和接收普通股,以取代在行使其所代表的权利时到目前为止可购买和应收的普通股 股票或其他证券或财产(包括现金)的种类和金额合并或合并,或在任何该等出售或转让后解散时,权证持有人如在紧接该等事件发生前已行使其认股权证,该等认股权证持有人将会收到该等认股权证。然而,如果该等持有人有权就该等合并或合并后应收证券、现金或其他资产的种类或金额行使选择权,则每份认股权证可行使的证券、现金或其他资产的种类及金额,将被视为该等持有人在该等合并或合并中所收取的种类及每股金额的加权平均值,且如已向该等持有人(投标除外)提出投标、交换或赎回要约,并已接受该等要约。公司就本章程规定的公司股东所持有的赎回权作出的交换或赎回要约,或由于公司赎回普通股股份的结果(如果拟议的初始业务 合并提交给公司股东以供批准),在这种情况下,投标或交换要约完成后,其发起人连同该发起人所属的任何团体的成员(在规则13d-5(B)(1)的范围内),并连同该庄家的任何联营公司或联营公司(根据《交易法》规则12b-2的含义),以及任何此类联营公司或联营公司是其中一部分的任何此类集团的任何成员,实益拥有 (根据《交易法》规则13d-3的含义)超过50%的已发行和已发行普通股, 认股权证持有人将有权获得最高金额的现金,如果该认股权证持有人在该等收购要约或交换要约届满前已行使认股权证,并接受该要约,而该持有人所持有的所有普通股股份已根据该收购要约或交换要约购买,则该持有人 实际有权作为股东享有的证券或其他财产,须经调整(在该收购要约或交换要约完成时及之后) ,与认股权证协议所规定的调整尽可能相等。如果普通股持有者在此类交易中的应收对价不足70%应以普通股的形式在 在全国证券交易所上市交易或在已建立的场外交易市场报价的继承实体支付,或将在此类事件发生后立即如此上市交易或报价,且如果权证的注册持有人在此类交易公开披露后30天内正确行使认股权证,权证行权价格将根据权证协议中的布莱克-斯科尔斯价值(在权证协议中的定义),按照权证协议中的规定进行下调。此等行权价格下调的目的,是在权证行权期内发生 权证持有人未能获得权证全部潜在价值的特别交易时,为权证持有人提供额外价值。
| 156 |
认股权证是根据作为认股权证代理的大陆股票转让信托公司与我们之间的认股权证协议以注册形式发行的。认股权证协议规定,认股权证的条款可在未经任何持有人同意的情况下进行修改,以(I)纠正任何含糊之处或纠正任何错误,包括使认股权证协议的规定符合本招股说明书所载认股权证条款及认股权证协议的说明。(Ii)根据认股权证协议修订与普通股派发现金股息有关的条文 ,或就认股权证协议各方认为必要或适宜,并认为不会对认股权证登记持有人的权利造成不利影响的事项或问题,加入 或更改任何有关认股权证协议项下的事宜或问题的条文, 但须经当时已发行的至少50%的公开认股权证持有人批准,方可作出任何对登记持有人利益造成不利影响的改动。认股权证协议副本是作为首次公开招股登记声明的证物而提交的,其中载有适用于认股权证的条款和条件的完整说明。
权证持有人在行使认股权证并获得普通股股份之前,不享有普通股持有人的权利或特权及任何投票权。于认股权证行使后发行普通股后,每名股东将有权就股东就所有事项所持有的每一股登记股份投一票。
拆分单位后,不会发行任何零碎认股权证,只会买卖整份认股权证。如于认股权证行使时,持有人将有权获得一股股份的零碎权益,吾等将于行使认股权证时将普通股股份数目向下舍入至最接近的整数。
我方 已同意,根据适用法律,因 认股权证协议而引起或以任何方式与之有关的任何诉讼、诉讼或索赔将在纽约州法院或美国纽约南部 地区法院提起并执行,我方无可争议地服从该司法管辖权,该司法管辖权将是任何此类诉讼的专属法院, 诉讼或索赔。本规定适用于《证券法》下的索赔,但不适用于《交易法》下的索赔或 美利坚合众国联邦地区法院是唯一和专属法院的任何索赔。
私募认股权证
除以下所述的 外,私募认股权证的条款及条款与作为Larkspur首次公开招股的 部分单位出售的认股权证相同。私募认股权证(包括在行使私募认股权证时可发行的普通股)在我们的初始业务合并完成后30天内不得转让、转让或出售(除我们的高级职员和董事以及与私募认股权证初始购买者有关联的其他个人或实体的有限例外情况外),只要它们由保荐人或其获准受让人持有,吾等将不能赎回。保荐人或其获准受让人有权在无现金的基础上行使私募认股权证。如果私募认股权证由保荐人或其获准受让人以外的持有人持有,则私募认股权证将可由我们在所有赎回情况下赎回,并可由持有人按与Larkspur首次公开募股所出售单位所包括的认股权证相同的基准行使。对私募认股权证条款的任何修订或认股权证协议中有关私募认股权证的任何条款,都需要持有当时尚未发行的私募认股权证数量的至少50%的 持有人投票表决。
如果 私募认股权证持有人选择在无现金基础上行使认股权证,他们将支付行使价,支付行使价,支付行使价 他/她或其认股权证的认股权证数量等于(X)认股权证相关普通股数量的乘积乘以“保荐人公平市价”(定义见下文) 除以认股权证的行使价除以(Y)保荐人公平市价所得的商数。就此等目的而言,“保荐人公平市价” 指认股权证行使通知送交认股权证代理人的日期前,截至 第三个交易日止的10个交易日内普通股的平均收市价。Larkspur同意这些认股权证可在无现金基础上行使,只要它们由保荐人及其许可受让人持有,是因为在Larkspur首次公开募股时, 并不知道它们是否会在业务合并后与我们建立联系。如果他们仍然与我们保持联系,他们在公开市场上出售我们的证券的能力将受到极大限制。我们制定了政策,限制 内部人士出售我们的证券,但在特定时间段除外。即使在允许内部人士出售我们证券的这段时间内,如果内部人士掌握重要的非公开信息,他或她也不能交易我们的证券。因此,与公众股东可以行使认股权证并在公开市场上自由出售行使认股权证后获得的普通股以收回行使权证的成本不同,内部人士可能会受到很大限制,不能出售此类证券。 因此,我们认为允许持有人以无现金基础行使认股权证是适当的。
为了弥补营运资金不足或支付与Larkspur计划的初始业务合并相关的交易成本,发起人或发起人的关联公司或Larkspur的某些高级管理人员和董事可以(但没有义务)根据需要借给我们资金。最多1,500,000美元的此类贷款可根据贷款人的选择,按每份认股权证35美元的价格转换为公司的认股权证。这类认股权证将与私募认股权证相同。
| 157 |
管道 授权书
为配合PIPE认购协议,吾等根据A系列指定证书及PIP权证的条款,发行普通股认购权证(每份为“PIPE认股权证”),以购买最多相当于PIPE股份转换后可发行普通股股份的最多数目的普通股 ,行使价最初相当于每股402.50美元,可作出若干调整。在我们的尽力而为发售后,PIPE认股权证的行使价重置为70.00美元,行使PIPE认股权证后可发行的普通股金额增加至141,868股。管道 认股权证的行使期为五年。PIPE认股权证的行权价将受若干调整影响,包括(I)股票股息及分拆、(Ii)后续供股、(Iii)按比例分配、(Iv)基本交易、(V)若干自愿调整及(Vi)按行使价或低于行使价发行其他证券所产生的调整 ,在每种情况下,根据PIP权证的条款。
管道认股权证不包括任何兑换功能。管道认股权证可在无现金基础上行使:(I)在没有关于管道认股权证相关普通股的有效登记声明的情况下,以及(Ii)在管道认股权证的行权期届满时。PIP权证持有人在行使认股权证并收取普通股股份之前,并不享有普通股持有人的权利或特权及任何投票权。普通股发行后 认股权证行使后,每位股东将有权就将由 股东表决的所有事项持有的每股股份享有一票投票权。截至2023年12月5日,未偿还的管道权证有139,403份,所有这些权证都可以每股70.00美元的价格行使。
尽最大努力是必要的
根据我们于2023年1月27日向美国证券交易委员会提交的经修订的S-1表格登记声明(文件第333-269442号)(“尽力而为发售”),我们按行使价每股35美元(或每股合并公开发行价及随附认股权证的100%),发行认股权证以购买314,751股普通股(“尽力而为认股权证”)。其中39,373份尽力而为权证重新定价 ,作为2023年7月发行的一部分,行权价从行权价35.00美元下调至5.78美元。以下 是尽力而为认股权证的某些条款和条款的摘要,并不完整,受认股权证条款的约束,并受认股权证条款的约束,其形式作为招股说明书的一部分作为注册说明书的证物提交。我们鼓励您仔细审阅认股权证表格的条款和规定,以获得对认股权证条款和条件的完整描述。
存续期与行权价格
每份 认股权证的行使价相当于每股35.00美元(或每股合并公开发行价和附带的 认股权证的100%)。认股权证将可立即行使,并可在发行之日起计五年内行使。行权时可发行的普通股的行权价格和数量在发生股票分红、股票拆分、重组或影响我们的普通股和行权价格的类似事件时,将进行适当调整。认股权证将分别与普通股或预筹资权证分开 发行,并可在此后立即单独转让。认股权证将 仅以认证形式签发。
可运动性
根据每位持有人的选择,认股权证将可全部或部分行使,方法是向吾等递交正式签署的行权通知 ,并就行权时所购买的普通股股数支付全数款项(以下讨论的无现金行权除外)。持有人(及其联属公司)不得行使该等持有人认股权证的任何部分至 持有人在行使后立即拥有超过4.99%的已发行普通股,但如持有人于 向吾等发出至少61天的事先通知,持有人可在行使该等认股权证后增加已发行普通股的持有量,最多可于行使后增加至本公司已发行普通股数目的9.99%,该百分比所有权乃根据认股权证条款厘定。终止日,权证 将通过无现金行使方式自动行使。
无现金锻炼
如果, 在持有人行使认股权证时,登记发行或转售认股权证相关普通股的登记声明 当时并不有效或不适用于发行该等股份,则 持有人可选择在行使认股权证时收取(全部或部分)根据认股权证所载公式厘定的普通股股份净额,而不是支付原本预期在行使认股权证时向吾等支付的现金款项。
| 158 |
基本面交易
在 认股权证所述的任何基本交易(一般包括与另一实体的任何合并或合并)、出售我们的全部或几乎所有资产、要约收购或交换要约、或我们普通股的重新分类的情况下,在任何 随后行使认股权证时,持有人将有权就紧接该等基本交易发生前行使该等权利而可发行的普通股的每股股份,收取继任者或收购公司或本公司普通股的股份数目,作为替代对价。如果是尚存的公司,以及持有者在紧接该事件之前可行使认股权证的普通股数量的交易中或因该交易而应收的任何额外 代价。尽管有上述规定,如发生基本交易,认股权证持有人有权要求吾等或后续实体于基本交易完成后30天内或同时赎回认股权证未行使部分的Black-Scholes 价值(定义见每份认股权证)的权证,以换取现金。
然而, 如果发生不在我们控制范围内的基本交易,包括未经我们董事会批准的基本交易,权证持有人将有权从我们或我们的后续实体获得与基本交易相关的相同类型或形式(且按相同比例)的对价,无论该对价是以现金形式向我们普通股持有人提供和支付的。股票或现金和股票的任何组合,或者我们普通股的持有者是否可以选择获得与基本交易相关的其他形式的对价。
可转让性
在符合适用法律的情况下,权证持有人在将权证连同适当的转让文书交回本行时,可自行选择转让权证。
零碎股份
认股权证行使时,不会发行普通股的零碎股份。相反,根据我们的选择,将发行的普通股数量将向上舍入到下一个完整的股份,或者我们将就该最后的 部分支付现金调整,金额等于该部分乘以行使价。
交易市场
目前认股权证尚无成熟的交易市场,我们预计不会出现活跃的交易市场。我们不打算申请 在任何证券交易所或其他交易市场上市权证。如果没有交易市场,权证的流动性将极其有限。
作为股东的权利
除非 认股权证另有规定或凭藉持有人对本公司普通股股份的所有权,否则该认股权证持有人 不享有本公司普通股持有人的权利或特权,包括任何投票权,直至该持有人行使该等 持有人认股权证。认股权证将规定,认股权证持有人有权参与我们普通股的分派或股息。
豁免及修订
经我方和持有人书面同意,可修改或修改本授权书,或放弃本授权书的规定。
| 159 |
2023年7月的认股权证
以下是2023年7月认股权证的某些条款和条款的摘要,并不完整,受2023年7月认股权证的条款制约,并受其限制。截至2023年12月5日,有2023年7月的认股权证可购买最多160,182股普通股,行使价为每股普通股5.78股。
持续期 和行权价
2023年7月发行的每份认股权证的行使价相当于每股5.78美元。2023年7月的S认股权证可立即行使 ,有效期至发行之日起计五年。在股票分红、股票拆分、重组或类似事件影响我们的普通股和行权价格的情况下,行权时可发行的普通股的行权价格和股份数量将进行适当调整。
可运动性
2023年7月的认股权证可由每名持有人选择全部或部分行使,方法是向吾等递交正式签立的行使权通知 ,并就行使权证时所购买的普通股股数支付全数款项(以下讨论的无现金行使除外)。持有人(及其关联公司)不得行使该持有人2023年7月认股权证的任何部分 ,条件是持有人在行使后立即拥有超过4.99%的已发行普通股,但在持有人向吾等发出至少61天的事先通知后,持有人可在 行使持有人的2023年7月认股权证后,将已发行普通股的持有量增加至紧随行使后已发行普通股数量的9.99%,因为该百分比所有权是根据认股权证的条款确定的。在终止日期 ,认股权证将通过无现金行使自动行使。
无现金锻炼
如果在持有人根据证券法行使其2023年7月认股权证时,登记发行或转售认股权证相关普通股的登记声明当时并未生效或不适用于发行该等股份,则 持有人可选择根据2023年7月认股权证所载公式收取(全部或部分)行使认股权证时所决定的普通股股份净额,以代替预期于行使认股权证时向吾等支付的现金付款。
| 160 |
基本交易
如果发生如2023年7月认股权证所述的任何基本交易,一般包括与另一实体的任何合并、出售我们的全部或几乎所有资产、要约收购或交换要约、或我们普通股的重新分类,则在随后的任何认股权证行使时,持有者将有权就紧接该基本交易发生前行使认股权证后可发行的普通股的每股股份收取替代对价, 继任者或收购公司或本公司的普通股股份数目,如果是尚存的公司, 以及持有者在紧接该事件发生前可行使认股权证的普通股数量的交易中或因该交易而应收的任何额外代价。尽管如上所述,如果发生基本交易,2023年7月权证的持有人有权要求我们或后续实体在基本交易完成后30天内,同时赎回或赎回权证未行使部分的布莱克-斯科尔斯价值(定义见每份权证),以换取现金 。
然而, 如果发生不在我们控制范围内的基本交易,包括未经我们董事会批准的基本交易,2023年7月认股权证的持有人将有权从我们或我们的后续实体获得自该基本交易完成之日起的相同类型或形式(以及相同比例)的对价,其价值为向我们普通股持有人提供并支付与该基本交易相关的权证的未行使部分的黑斯科尔斯 价值,无论该对价是现金形式,股票或现金和股票的任何组合,或者我们普通股的持有者是否可以选择获得与基本交易相关的其他形式的对价 。
可转让性
在符合适用法律的情况下,2023年7月认股权证在持有人将2023年7月认股权证连同适当的转让文书交回吾等后,可由持有人自行选择转让。
零碎的 股
于2023年7月认股权证行使时,不会发行普通股的零碎股份。相反,根据我们的选择,将发行的普通股数量将向上舍入到下一整股,或者我们将就该最终部分支付现金调整,金额等于该部分乘以行使价。
交易 市场
2023年7月的权证没有成熟的交易市场,我们预计不会出现活跃的交易市场。我们不打算 申请将认股权证在任何证券交易所或其他交易市场上市。如果没有交易市场,权证的流动性将极其有限。
权利 作为股东
除认股权证另有规定或持有人对本公司普通股股份的所有权另有规定外,持有本公司2023年7月认股权证的持有人在该持有人 行使该持有人的2023年7月认股权证之前,并不享有本公司普通股持有人的权利或特权,包括任何投票权。2023年7月的认股权证将规定,认股权证持有人有权 参与我们普通股的分派或派息。
豁免和修正案
经我方和持有人书面同意,可修改或修订认股权证,或放弃2023年7月认股权证的条款。
| 161 |
奖励令
于2023年9月,根据有限时间诱因要约,以4.75美元的减价行使本公司普通股股份的203,464份现有认股权证。因此,公司发行了203,464股普通股,加上203,464股新的诱导权证,行使价为4.75美元,获得约966,000美元的总收益。 新的诱导权证于发行六个月周年日起可行使,并可在此后五年内行使 。
期限和行权价格 价格
每个 诱导权证的行权价格将等于其适用的减价行权价格。诱导权证将于发行之日起六个月内行使,并可自该日起行使五年。在发生股票分红、股票拆分、重组或类似事件影响我们的普通股和行权价格时,行权价格和行权时可发行的普通股数量将进行适当调整。
可运动性
激励认股权证将可由每名持有人选择全部或部分行使,方法是向吾等递交正式签立的行权通知,并就行权时购买的普通股股数支付全数款项(以下讨论的无现金行权的情况除外)。持有人(及其联营公司)不得行使该持有人的 诱导权证的任何部分,条件是持有人在行使权证后立即拥有超过9.99%的已发行普通股,但在持有人向吾等发出至少61天的事先通知后,持有人可增加该百分比的拥有权。
无现金锻炼
如在持有人行使诱导权证时,登记根据1933年证券法(经修订)(“证券法”)发行诱导权证股份 的登记声明当时并不有效或不适用于发行 该等股份,则持有人可选择在行使诱导权证时收取(全部或部分)根据诱导权证所载公式厘定的普通股股份净额,以代替在行使诱导权证时预期向吾等支付的现金付款。
基本面交易
如果发生任何基础交易,如诱导权证中所述,一般包括与另一实体的任何合并、出售我们的全部或几乎所有资产、要约收购或交换要约、或我们普通股的重新分类, 则在随后行使诱导权证时,持有人将有权以 在紧接该基础交易发生之前行使该权证后可发行的普通股作为替代对价,收取继任者或收购公司或本公司普通股的股数。如果是尚存的 公司,以及持有在紧接该事件之前可行使激励认股权证的普通股数量的 普通股的持有人在该交易中或因该交易而应收的任何额外代价。尽管有上述规定,如发生基本交易,诱导权证持有人有权要求吾等或后继实体 在基本交易完成后30天内或同时赎回诱导权证中未行使部分的布莱克-斯科尔斯价值(定义见各诱导权证)的现金诱导权证。
然而, 如果发生不在我们控制范围内的基本交易,包括一项未经我们董事会批准的基本交易,诱导权证持有人将有权从我们或我们的后续实体获得与基本交易相关的相同类型或形式(且按相同比例)的对价,无论该对价是以现金的形式提供并支付给我们普通股持有人的。股票或现金和股票的任何组合,或者我们普通股的持有者是否可以选择获得与基本交易有关的其他形式的对价 。
可转让性
在符合适用法律的情况下,在将诱因认股权证连同适当的转让文书交回吾等时,持有人可选择转让诱因认股权证。
零碎股份
于激励认股权证行使时,不会发行普通股的零碎股份。相反,根据我们的选择,将发行的普通股数量将向上舍入到下一个完整的股份,或者我们将就该最终部分支付现金调整 ,金额等于该部分乘以行使价。
交易市场
目前还没有成熟的诱导权证交易市场,我们预计不会出现活跃的交易市场。我们不打算申请在任何证券交易所或其他交易市场上市 诱导权证。如果没有交易市场,诱导权证的流动性将极其有限。
| 162 |
作为股东的权利
除非 诱导权证另有规定或凭借持有人对本公司普通股股份的所有权,该等 诱导权证持有人并不享有本公司普通股持有人的权利或特权,包括任何投票权,直至该持有人行使该持有人的诱导权证。诱导权证将规定,诱导权证的持有人有权参与我们普通股的分派或派息。
豁免及修订
经我方和持有人书面同意,可修改或修改诱因认股权证,或放弃诱因认股权证的规定。
替换 认股权证
从2022年3月至2022年12月,佛罗里达州的ZyVersa治疗公司(“Old ZyVersa”)进行了一次私募 发售其A系列可转换优先股和认股权证(“桥梁认股权证”),以购买 Old ZyVersa的普通股(“桥梁融资”)。本公司的某些关联公司作为投资者参与了桥梁融资 。A系列可转换优先股的股票在紧接业务合并完成之前自动转换为旧ZyVersa普通股。该等旧ZyVersa普通股于完成业务组合后(按交换比率)交换为36,363股本公司普通股(其中9,365股与过桥融资有关,其余 为2021年本票融资转换为过桥融资的转换所得)。此外,在完成业务合并后,已发行的过桥认股权证被假定并(根据合并交换比率)转换为认股权证,以购买我们普通股的股份。2022年12月12日,在业务合并完成的同时,本公司发行了置换认股权证(“置换认股权证”),以换取桥式认股权证,如下所述。
可对36,363股普通股行使 认股权证(其中9,365股认股权证来自桥融资,其余认股权证来自2021年本票融资转换为桥融资) ,初始行使价相当于每股241.50美元(经调整以使业务合并生效),须受 某些调整。替代认股权证的行使期为五年。替换认股权证的行使价将受到某些调整的影响,包括因派发股息、重新分类和拆分而产生的调整。更换认股权证 不包括任何兑换功能。替代认股权证可在无现金基础上行使。置换认股权证持有人 在行使认股权证并获得普通股股份之前,不享有普通股持有人的权利或特权及任何投票权。于行使替代认股权证而发行普通股后,每名持有人将有权就所有将由股东表决的事项,以每一股已登记在案的普通股股份投一票。
可转换债券轮权证
2018年11月30日,Old ZyVersa发行了可转换债券轮权证(“可转换债券轮权证”),如下所述。未发行的可转换债券轮认股权证由本公司在完成业务合并后承担。
可转换债券轮认股权证可行使3,771股普通股,初始行权价等于每股405.30美元,但须作出某些调整。可转换债券轮的行使期限为五年。 可转换债券轮的行使价格将受到某些调整,包括因股票股息、重新分类和拆分而产生的调整。可转换债券轮认股权证不包括任何赎回功能。可转换债券 轮权证可在无现金基础上行使。可转换债权证持有人在行使认股权证并收取普通股股份前,并不享有普通股持有人的权利或特权及任何投票权。在可转换债券轮认股权证行使后发行普通股后,每位持有人将有权就其股东就所有事项所登记持有的每股普通股股份投一票 。
经纪人 认股权证
2018年11月30日,Old ZyVersa发行了经纪认股权证(以下简称经纪认股权证)。尚未发行的经纪 权证于业务合并完成后由本公司承担。经纪权证于2023年11月1日到期。
| 163 |
战略性 认股权证
2019年4月16日,Old ZyVersa发布了战略认股权证(“战略认股权证”),详情如下。未偿还的 战略认股权证由本公司于业务合并完成后承担。
战略认股权证总数为8,669份,其中3,268份目前可行使普通股股份,初步行使价格为每股275.10美元,须作出若干调整。剩余的5,401个将在取得里程碑式成就时定价。战略认股权证的行使期为五年。战略认股权证的行使价将受若干调整影响,包括因派发股息、重新分类及拆分而产生的调整。战略认股权证 不包括任何赎回功能。战略认股权证可在无现金基础上行使。战略认股权证持有人在行使认股权证并收取普通股股份前,并不享有普通股持有人的权利或特权及任何投票权。于战略认股权证行使后发行普通股后,每名股东将有权就其股东就所有事项所登记持有的每股普通股股份投一票。
《宪章》和《附例》的反收购
《宪章》和《章程》包含可能延迟、推迟或阻止另一方获得对本公司控制权的条款。 公司希望下面概述的这些规定将阻止强制收购行为或不充分的收购出价。这些规定还旨在鼓励寻求获得该公司控制权的人首先与董事会,公司认为这可能会导致任何此类收购的条款得到改善,有利于公司的 股东。然而,它们也赋予董事会阻止一些股东可能赞成的合并的权力。
董事会 组成和填补空缺
章程规定,只有在有理由的情况下,并且只有在拥有至少多数 当时有权在董事选举中投票的所有有表决权股票的持有人投票的情况下,才可罢免董事。 董事会因死亡、辞职、取消资格、退休、免职或其他原因而产生的任何空缺,以及 因董事人数增加而产生的任何新设董事职位,应完全由现任董事的过半数赞成票填补,即使不足法定人数,或由唯一剩余董事(由一个或多个已发行优先股系列单独投票选出的任何董事除外),且不得由股东填补。根据上一句任命的任何 董事应任职至 该董事应被任命的类别的任期届满或其提前死亡、辞职、退休、取消资格或免职。
股东特别会议
《宪章》规定:(A)股东大会主席可召集股东特别会议。董事会、(B)董事会或(C)本公司首席执行官或总裁 ,但该特别会议可由董事会或召集会议的其他人士延期、重新安排或取消。该章程将年度或特别股东大会上可能进行的事务限制在适当提交会议的事项上。
经书面同意采取的行动
章程规定,要求或允许股东采取的任何行动必须在股东年度或特别会议上 ,不得以书面同意代替会议采取。
提前 通知要求
章程规定了与提名候选人参选 或提交股东会议的新业务有关的股东提案的事先通知程序。这些程序规定,股东提案通知 必须在拟采取行动的会议之前以书面形式及时向公司的公司秘书发出。一般而言,为及时,通知必须在上一年的年度大会第一周年日前90天 或120天前,或(如较晚)10天前,在公司主要行政办公室收到这是 首次公开披露(定义见第2.4节)该特别会议日期的次日。 章程规定了所有股东通知的形式和内容的要求。这些要求可能阻止股东 在年度或特别会议上向股东提出事项。
| 164 |
章程和章程修正案
董事会明确授权采用、修改或废除章程。公司的股东也有 通过、修改或废除章程的权力;条件是,除了适用法律或本章程要求的公司任何类别或系列股票的持有人的任何投票权外,(包括一个或多个优先股系列 的任何指定证书)或公司章程,采纳,公司股东对章程的修订或废除 应要求拥有至少 当时有权在董事选举中普遍投票的所有有表决权的公司当时流通股的投票权的持有人投赞成票, 作为一个类别共同投票 。
特拉华州 反收购法规
DGCL和我们的章程的条款 可能会使通过要约收购、委托书竞争或其他方式收购本公司变得更加困难, 或罢免现任高级管理人员和董事。这些条款概述如下,旨在阻止强制收购行为和不充分的收购要约,并鼓励寻求获得公司控制权的人首先与 董事会谈判。我们认为,这些条款的好处大于阻止某些收购或收购提议的坏处,因为谈判这些提议可能会改善条款,并增强我们董事会实现股东价值最大化的能力 。然而,这些条款可能会延迟、阻止或阻止股东可能认为符合其最佳利益的对我们的合并或收购,包括那些可能导致溢价高于普通股现行市场价格的尝试。
此外,我们的宪章还规定了可能具有反收购效力的某些其他条款:
| ● | 没有关于董事选举的 累计投票; | |
| ● | 董事会有权选举一名董事,以填补因 董事会扩大或在某些情况下董事辞职、去世或罢免而产生的空缺; | |
| ● | 董事 只有在有理由的情况下才能从董事会中免职; | |
| ● | 董事会将分为三类董事,因此,一个人可以通过在两个或两个以上的年度 会议上成功地进行代理竞争来获得对我们董事会的控制权; | |
| ● | 禁止股东在书面同意下采取行动,迫使股东在股东年度会议或特别会议上采取行动; | |
| ● | 禁止股东召开特别会议,并要求只有我们的董事会成员才能召开股东会议,这可能会推迟我们的股东强制考虑提案或采取行动的能力,包括罢免董事 ;和 | |
| ● | 我们的 授权但未发行的普通股和优先股可用于未来的发行,无需股东批准,并且可以 可用于各种公司目的,包括未来用于筹集额外资本、收购和员工福利计划的产品。本公司董事会有权在无需股东进一步批准的情况下指定一个或多个优先股系列以及该系列优先股的相关投票权、优先股和特权。已授权但未发行的 和未保留的普通股和优先股的存在可能会使获得控制权的尝试变得更加困难或受阻我们 通过代理竞争,要约收购、合并或其他方式。 |
| 165 |
论坛 选择条款
我们的 宪章包括论坛选择条款。我们的《宪章》规定,除有限的例外情况外,特拉华州衡平法院和特拉华州内的联邦法院将是下列任何人的专属论坛:
| ● | 衍生 代表公司提起的诉讼或诉讼; |
| ● | 主张董事、本公司高管或股东违反本公司或本公司股东的受托责任或其他不当行为的诉讼; |
| ● | 针对本公司或本公司的任何高级职员、股东、雇员或代理人根据本公司章程或附例的任何规定或本公司授权特拉华州衡平法院行使管辖权的诉讼; | |
| ● | 解释、适用、强制执行或确定本公司章程或章程的有效性的行动 ;或 | |
| ● | 针对公司或受内部事务原则管辖的公司任何现任或前任董事、高管、 或股东主张索赔的其他 行动。 |
此 选择的法院条款不适用于为执行《交易法》或联邦法院拥有专属管辖权的任何其他索赔而提起的义务或责任的诉讼。此外,根据我们的章程,除非公司书面同意选择替代法院,否则美国联邦地区法院将在 法律允许的最大范围内成为解决根据证券法提出的任何诉因的独家法院。公司 打算将本条款适用于根据《证券法》提出诉因的任何投诉,尽管《证券法》第 22节规定,联邦法院和州法院可同时管辖为执行《证券法》或其下颁布的规则和条例所规定的任何义务或责任而提起的所有诉讼。
高级职员和董事的责任和赔偿限制
《宪章》包含将公司现任和前任董事对金钱损害的责任限制在特拉华州法律允许的最大限度内的条款。特拉华州法律规定,公司董事不对任何违反董事受托责任的行为承担个人赔偿责任,但以下责任除外:
| ● | 任何 违反了他对我们或我们的股东忠诚的义务; | |
| ● | 非善意的行为或者不作为,或者涉及故意的不当行为或者明知是违法的 ; | |
| ● | 非法支付股息或非法回购或赎回股票;以及 | |
| ● | 董事牟取不正当个人利益的交易。 |
对于违反美国联邦证券法的行为,这些规定可能被裁定为不可执行。
转接 代理
普通股转让代理和登记机构以及公开认股权证和私募认股权证的认股权证代理为大陆股票转让信托公司。我们已同意赔偿大陆证券转让信托公司作为转让代理人和认股权证代理人、其代理人及其股东、董事、高级职员和员工的所有责任,包括因其以该身份进行的活动或遗漏的行为而可能产生的判决、费用和合理的律师费,但因受赔人或实体的任何严重疏忽、故意不当行为或失信行为而产生的责任除外。
| 166 |
我们提供的证券说明
我们将发行400,000股普通股,A系列普通权证购买最多4,000,000股普通股 系列普通股认股权证,以每股1.25美元的公开发行价购买最多4,000,000股普通股,以及附带的A系列普通权证和B系列普通权证。我们还向那些在本次发售中购买我们普通股股份将 导致买方及其关联方和某些关联方在本次发售完成后实益拥有超过4.99%(或经买方选择,9.99%)我们的普通股流通股的购买者提供预资权证,以购买最多3,600,000股普通股,而不是将导致该超额所有权的普通股股份 。普通股和预先出资的认股权证的每股股票将与A系列普通股认股权证和B系列普通股认股权证一起出售。 普通股认股权证的行使价为每股1.25美元,发行时可行使。A系列普通权证将于发行五周年时终止,而B系列普通权证将于发行十八个月后终止 。我们还登记在行使预先出资的认股权证和在此提供的普通权证时可不时发行的普通股股份。
普通股 股票
本公司普通股的主要条款和规定在“股本说明”的标题下说明。
本次发行中提供预融资的 认股权证
持续期 和行权价
在此发售的每一份预付资金认股权证的初始行权价将相当于每股普通股0.0001美元。预付资金权证将可立即行使,并可随时行使,直至预付资金认股权证全部行使为止。行权价格和行权时可发行的股票数量在发生股票分红、股票拆分、重组或影响我们普通股和行权价格的类似事件时,将进行适当的比例调整。
可运动性
预筹资认股权证将根据每个持有人的选择,全部或部分通过向我们交付正式签立的行使权证通知和(I)两个交易日和(Ii)构成普通股标准结算期的交易日(以较早者为准)在此后交付行使权证通知之日有效的方式行使。全额支付在行使时购买的普通股股数(以下讨论的无现金行使除外)。 持有人不得行使预筹资权证的任何部分,条件是持有者及其关联公司和任何其他 人以及任何此类人士将拥有超过4.99%(或经购买者选择,9.99%)的 行使后立即发行的普通股股数(“受益所有权限制”); 只要实益所有权限额为4.99%的持有人在接到通知后61天内通知我们,只要实益所有权限额在任何情况下都不超过行权后已发行普通股数量的9.99%,该持有人就可以提高实益所有权限额。
| 167 |
无现金锻炼
持有者可以通过无现金行使的方式行使其预付的认股权证(全部或部分),而不是进行预期的现金支付 以支付行权总价,在此期间,持有人只能通过无现金行权的方式行使其预付资助权证(全部或部分),持有者有权在行使时获得根据预付资权证中规定的公式确定的普通股净股数。其规定的股票数量一般等于(A)(1)行权通知前一个交易日的成交量加权平均价格,如果行权通知是在非交易日或在行权通知的交易日“常规交易时间”开盘前的一天签立和交付,或(Y)行权通知的交易日,如果行权通知是在该交易日的“正常交易时间”结束之后签立和交付的,或(2)行权通知当日的买入价,如果行权通知是在交易日的“正常交易时间”内执行并在此后两小时内交付的,则减去(B)行权价格乘以(C)可行使预融资认股权证的普通股数量,再除以 该乘积除以根据本句(A)款确定的数量。
零碎的 股
在行使预先出资的认股权证时,不会发行普通股的零碎股份。相反,我们将在我们的选择中, ,代替发行该零碎股份,(I)支付金额等于该零碎股份乘以行权价格的现金,或(Ii)四舍五入到在行使预融资认股权证后可发行的下一个完整股份。
可转让性
在符合适用法律的情况下,预付资助权证可在持有人将预备资金权证交还给我们时根据持有人的选择进行转让 连同适当的转让文书和足以支付此类转让时应缴纳的任何转让税款的资金。
交易 市场
在任何证券交易所或国家认可的交易系统上,都没有预融资权证的交易市场。我们 不打算在任何证券交易所或国家认可的交易系统上上市预融资权证。行使预融资权证后可发行的普通股目前在纳斯达克挂牌上市,代码为“ZVSA”。
作为股东的权利
除 预资金权证另有规定或凭藉该持有人对普通股股份的所有权外,预资资权证持有人在行使其预资资权证之前,并不享有本公司普通股持有人的权利或特权,包括任何投票权。
基本交易
如果发生如预筹资权证所述的基本交易,一般包括我们普通股的任何重组、资本重组或重新分类,出售、转让或以其他方式处置我们的全部或几乎所有财产 或资产,我们与另一人的合并或合并,收购公司普通股股权的50%以上的投票权,预资资权证的持有人将有权在行使预资资权证时获得 种类和金额的证券,如果持有人在紧接这类基本交易之前行使预筹资权证,他们将获得的现金或其他财产。
| 168 |
本次发行中提供普通 认股权证
稀释 和行使价
在此发售的每份普通权证的初始行使价为每股1.25美元。普通权证将立即可行使。A系列普通权证将于发行五周年时终止,而B系列普通权证将于发行十八个月后终止 。如果发生股息、股份拆分、重组或类似事件影响我们的普通股和行权价格,行使时可发行的普通股的行使价和股份数量将受到适当的比例调整 。
可运动性
普通权证将根据每个持有人的选择,通过向我们交付正式签署的行使通知和(I)两个交易日和(Ii)构成普通股的标准结算期的交易日(以较早者为准)在此后交付行使通知之日有效的方式,全部或部分行使普通股。全额支付在行使时购买的普通股股数(以下讨论的无现金行使除外)。 持有者不得行使普通股认股权证的任何部分,条件是持有者及其附属公司和任何其他作为一个集团的人以及任何此类人将拥有超过4.99%(或在购买者选择时,9.99%)的普通股在行使权证后立即发行的股数(“受益所有权限制”); 只要实益所有权限额为4.99%的持有人在通知吾等并在该通知送达吾等后六十一(61)天内生效 ,只要实益所有权限额在任何情况下均不超过行权后已发行普通股数量的9.99% ,该持有人即可提高实益所有权限额。
无现金锻炼
如果, 在持有人行使普通权证时,根据证券法登记普通股股票发行的登记声明 不再有效或不适用于该等股票的发行,则 持有人只能行使其普通权证(全部或部分),而不是在行使时向我们支付现金,以支付总的行权价,在这种情况下,通过无现金行使,持有人有权在行使时获得根据普通权证中提出的公式确定的普通股净数量,该公式通常规定普通股的数量等于(A)(1)行使通知前一个交易日的 成交量加权平均价格,如果行权通知是在非交易日或在交易日的“正常交易时间”开盘前或(Y)行权通知的交易日 之前签立和交付的,如果行权通知是在该交易日的“正常交易时间”收盘之后签立和交付的,或者(2)行权通知当天的买入价,如果行权通知是在交易日的“正常交易时间”内执行并在此后两小时内交付的,则减去(B)行权价格,乘以(C)可行使普通股认股权证的普通股股数,乘以该乘积除以本句第(A)款规定的数字。
零碎的 股
在普通权证行使时,不会发行普通股的零碎股份。相反,我们将在我们的选择中,并 代替发行该零碎股份,(I)支付金额等于该零碎股份乘以行权价格的现金,或(Ii)向上舍入至在行使普通权证时可发行的下一个完整股份。
可转让性
在符合适用法律的情况下,普通权证在将普通权证交还给吾等后,持有人可选择将其连同适当的转让文书和足以支付转让时应付的任何转让税款的资金一起转让。
交易 市场
任何证券交易所或国家认可的交易系统上的普通权证都没有交易市场。我们不打算在任何证券交易所或国家认可的交易系统上上市普通权证。行使普通权证后可发行普通股 目前在纳斯达克挂牌上市,代码为“ZVSA”。
| 169 |
作为股东的权利
除 普通权证另有规定或凭借该持有人对普通股股份的所有权外,普通权证持有人 在 行使其普通股认股权证前,并不享有本公司普通股持有人的权利或特权,包括任何投票权。
基本交易
如果发生普通权证中所述的基本交易,一般包括普通股的任何重组、资本重组或重新分类,出售、转让或以其他方式处置我们所有或几乎所有的财产或资产, 我们与他人合并或合并,收购公司普通股超过50%的投票权,普通权证持有人将有权在行使普通权证时获得 证券的种类和金额,如果持有人在紧接此类基本交易之前行使普通权证,他们将获得现金或其他财产。此外,在发生基本交易的情况下,我们或任何后续实体将根据普通权证持有人的选择权,在基本交易完成 的同时或在基本交易完成后三十(30)天内(或,如果晚于其公布日期)从持有人手中购买普通权证,向持有人支付相当于基于Black-Scholes期权定价模型的基本交易完成日期 该普通权证剩余未行使部分的价值的对价。根据共同认股权证中规定的公式 确定。支付给持有人的对价将与与基本交易相关的向普通股持有人提出和支付的对价的类型或形式相同;如果没有提出或支付此类对价,普通股持有人将被视为在该基本交易中收到了后续实体的普通股 ,就本普通权证的规定而言。
| 170 |
法律事务
在此提供的证券的有效性将由纽约Thompson Hine LLP为我们传递。配售代理 由加利福尼亚州科斯塔梅萨的马纳特,菲尔普斯和菲利普斯律师事务所代表,与此次发行有关。
| 171 |
专家
ZyVersa Treateutics,Inc.于2022年12月31日(前身)和2021年12月31日(前身)、2022年12月13日至2022年12月31日(前身)、2022年1月1日至2022年12月12日(前身)和截至2021年12月31日的合并财务报表已由独立注册会计师事务所安永会计师事务所审计。如其报告所载(该报告载有一段解释,描述财务报表附注 2所述令人对本公司持续经营能力产生重大怀疑的情况),并根据该等公司作为会计及审计专家的授权而列入。
| 172 |
此处 您可以找到详细信息
我们 向美国证券交易委员会提交年度、季度和当前报告、委托书和其他信息。我们还根据证券法就本招股说明书提供的证券提交了S-1表格的登记声明 ,包括证物。本招股说明书 是注册说明书的一部分,但并不包含注册说明书或证物中包含的所有信息。 我们的美国证券交易委员会备案文件可在互联网上由美国证券交易委员会维护的网站http://www.sec.gov.上向公众提供这些文件 也可在我们的网站上的“财务和文件”标题下向公众提供或通过http://www.zyversa.com. The访问,但我们网站上包含的信息或通过我们网站以其他方式访问的信息不是、也不应被视为本招股说明书的一部分。
| 173 |
财务报表索引
| 独立注册会计师事务所报告(PCAOB ID:42) | F-2 | |
| 截至2022年12月31日(继任者)和2021年12月31日(前身)的资产负债表 | F-3 | |
| 2022年12月13日至2022年12月31日(继任)、2022年1月1日至2022年12月12日(前身)和2021年12月31日终了年度(前身)的业务说明 | F-4 | |
| 2022年12月13日至2022年12月31日继承期股东权益变动表 | F-5 | |
| 2021年12月31日至2022年12月12日前一期间股东亏损额变动报表 | F-6 | |
| 2022年12月13日至2022年12月31日(继任)、2022年1月1日至2022年12月12日(前身)和2021年12月31日终了年度(前身)的现金流量表 | F-7 | |
| 合并财务报表附注 | F-8 |
| 截至2023年9月30日(未经审计)和2022年12月31日(后续)的简明综合资产负债表 | F-33 | |
| 截至2023年9月30日(后继)和2022年9月30日(前身)的三个月和九个月未经审计的合并业务简表 | F-34 | |
| 截至2023年9月30日(继任)和2022年9月30日(前身)的三个月和九个月未经审计的简明股东权益变动表(亏损表) | F-35 | |
| 截至2023年9月30日(后继)和2022年9月30日(前身)的9个月未经审计的简明现金流量表 | F-36 | |
| 未经审计的简明合并财务报表附注 | F-37 |
| F-1 |
独立注册会计师事务所报告{br
致ZyVersa治疗公司的股东和董事会。
对财务报表的意见
我们 审计了ZyVersa治疗公司(本公司)截至2022年12月31日(后继者) 和2021年(前身)的合并资产负债表、2022年12月13日至2022年12月31日(后继者)期间的相关综合经营报表、股东权益和现金流量的变化、2022年1月1日至2022年12月12日(前身)和截至2021年12月31日的年度的相关综合经营报表、股东短缺和现金流量变化以及相关附注 (统称为“合并财务报表”)。我们认为,综合财务报表在所有重要方面都公平地反映了公司于2022年12月31日、2022年12月31日和2021年12月31日的财务状况,以及2022年12月13日至2022年12月31日(后继者)、2022年1月1日至2022年12月12日(前身)以及截至2021年12月31日的年度的经营成果和现金流,符合美国公认会计原则。
公司作为持续经营企业的能力
随附综合财务报表的编制假设本公司将持续经营。如财务报表附注2中所述 ,该公司遭受了经常性的经营损失,存在营运资金不足,且 已表示对该公司持续经营的能力存在重大疑问。管理层对事件和条件的评估以及管理层关于这些事项的计划也在附注2中描述。合并财务报表 不包括可能因此不确定性结果而导致的任何调整。
征求意见的依据
这些 财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券 法律以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们 按照PCAOB的标准进行审计。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是舞弊。公司 不需要对其财务报告的内部控制进行审计,也没有聘请我们进行审计。作为我们审计的一部分,我们需要了解财务报告的内部控制,但不是为了对公司财务报告内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的 审计包括执行程序,以评估财务报表重大错报的风险,无论是由于错误 还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试的基础上审查与财务报表中的金额和披露有关的证据。我们的审计还包括评估管理层使用的会计原则和作出的重大估计,以及评估财务报表的整体列报。我们相信,我们的审计 为我们的观点提供了合理的基础。
/s/ 安永律师事务所
我们 自2019年以来一直担任本公司的审计师。
佛罗里达州奥兰多
2023年3月31日,除合并财务报表附注14中讨论的反向股票拆分的影响外,日期为2023年12月4日
| F-2 |
ZYVERSA THERAPEUTICS,INC.
合并资产负债表
| 继任者 | 前身 | |||||||
| 十二月三十一日, | 十二月三十一日, | |||||||
| 2022 | 2021 | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金 | $ | 5,902,199 | $ | 328,581 | ||||
| 预付费用和其他流动资产 | 225,347 | 106,929 | ||||||
| 供应商保证金 | 235,000 | 376,272 | ||||||
| 流动资产总额 | 6,362,546 | 811,782 | ||||||
| 设备,网络 | 17,333 | 27,733 | ||||||
| 正在进行的研究和开发 | 100,086,329 | - | ||||||
| 商誉 | 11,895,033 | - | ||||||
| 保证金 | 46,659 | 46,659 | ||||||
| 经营性租赁使用权资产 | 98,371 | - | ||||||
| 供应商保证金 | - | 240,000 | ||||||
| 总资产 | $ | 118,506,271 | $ | 1,126,174 | ||||
| 负债、临时权益和股东权益(亏损) | ||||||||
| 流动负债: | ||||||||
| 应付帐款 | $ | 6,025,645 | $ | 2,000,100 | ||||
| 应计费用和其他流动负债 | 2,053,559 | 1,914,101 | ||||||
| 经营租赁负债 | 108,756 | - | ||||||
| 衍生负债 | - | 560,600 | ||||||
| 应付可转换票据(截至2022年12月31日和2021年12月31日,分别扣除0美元和39,942美元的债务折价) | - | 5,976,508 | ||||||
| 可转换应付票据关联方 | - | 3,175,000 | ||||||
| 流动负债总额 | 8,187,960 | 13,626,309 | ||||||
| 递延税项负债 | 10,323,983 | - | ||||||
| 总负债 | 18,511,943 | 13,626,309 | ||||||
| 承付款和或有事项(附注10) | - | - | ||||||
| 继任者 可赎回普通股,可能赎回截至2022年12月31日已发行的1,880股 | 331,331 | - | ||||||
| 前身可赎回普通股,可能需要赎回,截至2021年12月31日已发行的331,331股 | - | 331,331 | ||||||
| 股东权益(不足): | ||||||||
| 优先股,面值0.0001美元,授权股份1,000,000股: | ||||||||
| 截至2022年12月31日,A系列继任者优先股,指定股份8,635股,已发行和已发行股票8,635股 | 1 | - | ||||||
| 继任者B系列优先股,指定5,062股,截至2022年12月31日已发行和已发行5,062股 | 1 | |||||||
| 继承人 普通股,面值0.0001美元,授权股份1.1亿股;截至2022年12月31日已发行和已发行股票257,604股 | 26 | - | ||||||
| 前身普通股,面值0.00001美元,授权股份75,000,000股;截至2021年12月31日已发行和已发行24,167,257股 | - | 242 | ||||||
| 追加实收资本 | 104,584,147 | 40,065,109 | ||||||
| 累计赤字 | (4,921,178 | ) | (52,896,817 | ) | ||||
| 股东权益总额(亏损) | 99,662,997 | (12,831,466 | ) | |||||
| 负债总额、临时权益和股东权益(亏损) | $ | 118,506,271 | $ | 1,126,174 | ||||
附注是这些合并财务报表的组成部分。
| F-3 |
ZYVERSA THERAPEUTICS,INC.
综合 运营说明书
| 继任者 | 前身 | |||||||||||
| 对于 期间 | 对于 期间 | 本年度的 | ||||||||||
| 12月 13至 | 1月1日至 | 告一段落 | ||||||||||
| 12月31日, | 12月 12, | 12月31日, | ||||||||||
| 2022 | 2022 | 2021 | ||||||||||
| 运营费用 : | ||||||||||||
| 研发 | $ | 399,894 | $ | 5,407,859 | $ | 2,124,277 | ||||||
| 常规 和管理 | 420,174 | 7,605,205 | 5,580,099 | |||||||||
| 运营费用总额 | 820,068 | 13,013,064 | 7,704,376 | |||||||||
| 运营亏损 | (820,068 | ) | (13,013,064 | ) | (7,704,376 | ) | ||||||
| 其他 (收入): | ||||||||||||
| 利息 费用 | - | 427,542 | 821,366 | |||||||||
| 衍生负债公允价值变动 | - | 607,001 | (228,100 | ) | ||||||||
| 收益 关于免除PPP贷款 | - | - | (213,481 | ) | ||||||||
| 税前 净亏损 | (820,068 | ) | (14,047,607 | ) | (8,084,161 | ) | ||||||
| 收入 税收优惠 | 745,050 | - | - | |||||||||
| 净亏损 | (75,018 | ) | (14,047,607 | ) | (8,084,161 | ) | ||||||
| 被视为 优先股股东股息 | - | (10,015,837 | ) | - | ||||||||
| 净 归因于普通股股东的损失 | $ | (75,018 | ) | $ | (24,063,444 | ) | $ | (8,084,161 | ) | |||
| 每股净亏损 | ||||||||||||
| - 基本及摊薄 | $ | (0.29 | ) | $ | (0.99 | ) | $ | (0.33 | ) | |||
| 加权 已发行普通股平均数量 | ||||||||||||
| - 基本及摊薄 | 257,604 | 24,194,270 | 24,167,257 | |||||||||
附注是这些合并财务报表的组成部分。
| F-4 |
ZYVERSA THERAPEUTICS,INC.
合并 股东权益变动表
| 2022年12月13日至2022年12月31日期间 | ||||||||||||||||||||||||||||||||||||
| A系列 | B系列 | 其他内容 | 总计 | |||||||||||||||||||||||||||||||||
| 优先股 | 优先股 | 普通股 | 已缴费 | 累计 | 股东的 | |||||||||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 股票 | 金额 | 资本 | 赤字 | 权益 | ||||||||||||||||||||||||||||
| 继任者 | ||||||||||||||||||||||||||||||||||||
| 余额-2022年12月13日 | 0 | 8,635 | $ | 1 | 5,062 | $ | 1 | 257,604 | $ | 26 | $ | 104,527,814 | $ | (4,846,160 | ) | $ | 99,681,682 | |||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | - | 56,333 | - | 56,333 | ||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | (75,018 | ) | (75,018 | ) | ||||||||||||||||||||||||
| 余额-2022年12月31日 | - | 8,635 | $ | 1 | 5,062 | $ | 1 | 257,604 | $ | 26 | $ | 104,584,147 | $ | (4,921,178 | ) | $ | 99,662,997 | |||||||||||||||||||
附注是这些合并财务报表的组成部分。
| F-5 |
ZYVERSA THERAPEUTICS,INC.
合并 股东不足变动表
| 2020年12月31日至2022年12月12日期间 | ||||||||||||||||||||||||||||
| 其他内容 | 总计 | |||||||||||||||||||||||||||
| 优先股 | 普通股 | 已缴费 | 累计 | 股东的 | ||||||||||||||||||||||||
| 前身 | 股票 | 金额 | 股票 | 金额 | 资本 | 赤字 | 缺憾 | |||||||||||||||||||||
| 余额-2020年12月31日 | - | - | $ | - | - | 24,167,257 | $ | 242 | $ | 35,923,373 | $ | (44,812,656 | ) | $ | (8,889,041 | ) | ||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | 4,141,736 | - | 4,141,736 | |||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | (8,084,161 | ) | (8,084,161 | ) | |||||||||||||||||
| 余额-2021年12月31日 | - | - | - | - | 24,167,257 | 242 | 40,065,109 | (52,896,817 | ) | (12,831,466 | ) | |||||||||||||||||
| 以私募方式发行优先股[1] | - | 625,639 | 6 | - | - | - | 1,865,378 | - | 1,865,384 | |||||||||||||||||||
| 将应付可转换票据转换为优先股[2] | - | 1,802,193 | 18 | - | - | - | 5,658,870 | - | 5,658,888 | |||||||||||||||||||
| 将优先股转换为普通股 | - | (2,427,832 | ) | (24 | ) | - | 6,406,210 | 64 | (40 | ) | - | - | ||||||||||||||||
| 将应付可转换票据转换为普通股[3] | - | - | - | - | 2,940,537 | 29 | 5,838,180 | - | 5,838,209 | |||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | 3,524,801 | - | 3,524,801 | |||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | (14,047,607 | ) | (14,047,607 | ) | |||||||||||||||||
| - | ||||||||||||||||||||||||||||
| 余额-2022年12月12日 | 1 | - | $ | 0 | 1 | 33,514,004 | $ | 335 | $ | 56,952,298 | $ | (66,944,424 | ) | $ | (9,991,791 | ) | ||||||||||||
附注是这些财务报表的组成部分。
| [1] | 包括1,964,524美元的总收益减去99,140美元的发行成本 |
| [2] | 包括本金 5,230,000美元和应计利息428,888美元 |
| [3] | 包括本金 3,961,000美元、应计利息709,608美元和衍生负债1,167,601美元 |
| F-6 |
ZYVERSA THERAPEUTICS,INC.
合并 现金流量表
| 继任者 | 前身 | |||||||||||
| 在该期间内 | 在该期间内 | 这一年的 | ||||||||||
| 12月13日至 | 1月1日至 | 告一段落 | ||||||||||
| 十二月三十一日, | 12月12日, | 十二月三十一日, | ||||||||||
| 2022 | 2022 | 2021 | ||||||||||
| 经营活动的现金流: | ||||||||||||
| 净亏损 | $ | (75,018 | ) | $ | (14,047,607 | ) | $ | (8,084,161 | ) | |||
| 对净亏损与经营活动中使用的现金净额进行的调整: | ||||||||||||
| 股票补偿选项 | 56,333 | 3,524,801 | 4,141,736 | |||||||||
| 债务贴现摊销 | - | 39,492 | 317,833 | |||||||||
| 获得PPP贷款的宽免权 | - | - | (213,481 | ) | ||||||||
| 衍生负债的公允价值变动 | - | 607,001 | (228,100 | ) | ||||||||
| 固定资产折旧 | 532 | 9,868 | 10,400 | |||||||||
| 非现金租金费用 | 4,443 | 79,918 | - | |||||||||
| 递延税项负债 | (745,050 | ) | - | - | ||||||||
| 经营性资产和负债变动情况: | ||||||||||||
| 预付费用和其他流动资产 | 36,606 | 73,675 | (318,761 | ) | ||||||||
| 保证金 | - | - | 11,665 | |||||||||
| 供应商保证金 | 125,645 | 255,627 | 10,000 | |||||||||
| 应付帐款 | (2,076,863 | ) | 6,617,064 | (311,862 | ) | |||||||
| 经营租赁负债 | (4,786 | ) | (86,100 | ) | - | |||||||
| 应计费用和其他流动负债 | (715,730 | ) | 1,431,620 | (411,358 | ) | |||||||
| 经营活动中使用的现金净额 | (3,393,888 | ) | (1,494,641 | ) | (5,076,089 | ) | ||||||
| 融资活动的现金流: | ||||||||||||
| 私募发行优先股所得 | - | 1,964,524 | - | |||||||||
| 与优先股发行相关的发行成本 | - | (99,140 | ) | - | ||||||||
| 发行可转换应付票据所得款项 | - | - | 5,230,000 | |||||||||
| 融资活动提供的现金净额 | - | 1,865,384 | 5,230,000 | |||||||||
| 现金和限制性现金净(减)增 | (3,393,888 | ) | 370,743 | 153,911 | ||||||||
| 现金--期初 | 9,296,087 | 328,581 | 174,670 | |||||||||
| 现金--期末 | $ | 5,902,199 | $ | 699,324 | $ | 328,581 | ||||||
| 现金流量信息的补充披露: | ||||||||||||
| 非现金投资和融资活动: | ||||||||||||
| 获得PPP贷款的宽免权 | $ | - | $ | - | $ | 231,481 | ||||||
| 将可转换票据和应计利息转换为优先股 | $ | - | $ | 5,658,888 | $ | - | ||||||
| 将可转换票据和应计利息转换为普通股 | $ | - | $ | 5,838,209 | $ | - | ||||||
| 采用ASC 842后ROU资产和租赁负债的确认 | $ | - | $ | 182,732 | $ | - | ||||||
| 延期发售费用的应付帐款 | $ | 240,691 | $ | 667,224 | $ | 25,000 | ||||||
附注是这些简明财务报表的组成部分。
| F-7 |
ZYVERSA THERAPEUTICS,INC.
财务报表附注
注 1-企业组织、运营性质及风险和不确定性
业务 组织、运营性质和陈述依据
组织 和运营
Larkspur(“Larkspur”)是一家空白支票特殊用途收购公司,于2021年3月17日在特拉华州注册成立。2022年12月12日,Larkspur完成了与ZyVersa Treateutics,Inc.(前身)的业务合并(详情见注4-业务合并),ZyVersa Treateutics,Inc.(前身)于2014年3月11日作为Variant PharmPharmticals,Inc.在佛罗里达州注册成立。在业务合并完成之日,Larkspur(“新母公司”)更名为ZyVersa Treateutics,Inc.,前身在与新母公司的子公司合并后更名为ZyVersa Treateutics Operating,Inc.(“运营中的 公司”)这导致它在特拉华州注册成立,并成为新母公司的全资子公司(统称为“继承人”)。 凡提及“公司”或“ZyVersa”时,指的是从2022年12月13日至2022年12月31日的继承人,以及指从2021年1月1日至2022年12月12日的前身。
ZyVersa 是一家临床阶段的生物制药公司,利用专有技术为慢性肾脏疾病或炎症性疾病患者开发药物,这些患者具有高度未得到满足的医疗需求。我们的使命是开发优化健康结果和提高患者生活质量的药物。
风险 和不确定性
2020年初,引起冠状病毒病的一种新的冠状病毒株--SARS-CoV-2(新冠肺炎)在全球暴发。一开始,该公司的业务在许多方面都受到了重大的负面影响。这些影响包括 VAR 200 2a期试验推迟启动,因为潜在的患者参与者不愿冒险进入设施进行试验 。此外,私人融资市场不稳定,使公司失去了为业务融资所需的流动资金。因此,管理层实施了大量降低成本的措施,以持续到经济状况改善。新冠肺炎S未来对公司运营和财务状况的全面影响仍不确定。持续的新冠肺炎疫情可能会对该公司的运营业绩、财务状况和流动性产生重大不利影响,包括该公司推进其临床开发计划的时间和能力。财务报表不包括 这种不确定性可能导致的任何调整。
2023年3月10日,硅谷银行(SVB)被加州金融保护和创新部关闭,联邦存款保险公司(FDIC)被任命为接管人。同样,2023年3月12日,Signature银行和Silvergate Capital Corp.分别被卷入破产管理程序。财政部、美联储和联邦存款保险公司的一份声明称,SVB的所有储户在关闭仅一个工作日后就可以取用他们的所有资金,包括未投保存款账户中的资金。对于每个帐户所有权类别,每个投保银行的每个储户的标准存款保险金额最高为250,000美元。虽然我们在上述银行没有任何存款,但我们与其他金融机构的现金余额经常超过FDIC保险限额。如果存款机构未能退还存款,可能会影响我们获得现金或现金等价物,并可能对我们的经营流动性和财务业绩产生不利影响。
注 2-持续经营和管理层的计划
自成立以来,公司每年都出现亏损,截至2022年12月31日,公司净营运资金不足。根据财务报表发布之日的手头现金,本公司预计,自财务报表发布之日起12个月内,公司目前的可用现金将不足以支持其运营。因此,公司 将被要求通过股权或债务融资筹集额外资金,并且不能保证它将成功获得额外资本 。这些条件令人对公司是否有能力在这些财务报表发布之日起至少一年内继续经营下去产生很大的怀疑。
公司尚未实现盈利,预计将继续从运营中产生现金流出。预计其研究和开发以及一般和管理费用将继续增加,因此,公司最终将需要 产生可观的产品收入以实现盈利。
| F-8 |
公司的现金流需求包括运营其业务的计划成本,包括为研发提供资金所需的金额、 营运资金和资本支出。公司未来的资本需求和可用资金的充足性 将取决于许多因素,包括公司成功将其产品和服务商业化的能力、竞争性的技术 和市场发展,以及与其他公司合作或收购其他公司或技术以 增强或补充我们的产品和服务产品的需要。我们打算在未来筹集额外资金,为运营提供资金。如果 公司无法获得额外的资本,则可能会要求其缩减研发计划,并采取额外的 措施来降低成本,以节省现金。
随附的财务报表是根据美国公认的会计原则 ("美国公认会计原则")编制的,该原则考虑了公司作为持续经营企业的持续经营以及在正常业务过程中实现资产 和清偿负债。财务报表不包括任何必要的调整,如果公司无法继续作为一个持续经营。
注 3 -重要会计政策摘要
列报依据和合并原则
随附的合并财务报表源自本公司及其合并子公司的会计记录。 由于业务合并,出于会计目的,Larkspur Health Acquisition Corp.是收购方,ZyVersa Therapeutics, Inc.是收购方。是被收购者和会计的前身。因此,财务报表列报包括 前任公司在2022年12月13日之前的财务报表和继承公司在2022年12月13日及之后的财务报表,包括 ZyVersa Therapeutics Operating,Inc.的合并。所有重大公司间结余均已在合并 财务报表中抵销。综合财务报表是根据美国公认会计准则(“美国公认会计准则”)和美国证券交易委员会(“SEC”)的会计规则和条例编制的。
使用预估的
根据美国公认会计原则编制财务报表要求管理层 作出估计、判断和假设,这些估计、判断和假设会影响财务报表中报告的金额和财务报表相关附注中披露的金额。本公司的估计和判断基于历史经验和其认为在当时情况下合理的各种其他 假设。本公司资产负债表中列报的资产负债额和列报各期间的支出金额受估计和假设的影响,这些估计和假设用于但不限于股权证券、衍生负债、基于股份的薪酬和收购的无形资产的公允价值计算,以及递延税项资产的估值扣除。公司的某些估计 可能会受到外部条件的影响,包括公司独有的情况和一般经济状况。实际结果有可能与这些估计值不同,这是合理的。
现金 和现金等价物
公司在财务报表中将所有原始到期日在三个月或以下的高流动性投资视为现金等价物。截至2022年12月31日和2021年12月31日,公司没有现金等价物。
公司有现金存款,有时可能超过联邦存款保险公司("FDIC")的保险限额。 本公司未在此类账户中出现亏损,并定期评估其金融机构的信誉。 请参见注释1—风险和不确定性。
| F-9 |
业务合并
在应用业务合并会计的收购方法时,分配给收购的可识别资产和负债的金额是基于收购日期的估计公允价值, 其余部分记录为商誉。无形资产最初按公允价值估值,采用适用于该类型无形资产的公认估值方法 。在企业合并中取得的正在进行的研究与开发(IPR&D)在获得监管部门批准之前,将作为无限期无形资产进行资本化 ,在获得监管部门批准之前,将其计入定期无形资产,并在其预计使用寿命内摊销,或停止使用,此时将注销该无形资产。
长期资产和商誉
本公司 根据ASC 360-10-35的规定对长期资产进行会计处理。财产、厂房和设备、减值或处置长期资产。本会计准则要求,只要发生事件或情况变化表明账面金额可能无法收回,就应对长期资产进行减值审查。将持有和使用的资产的可回收性是通过将资产的账面价值与资产预期产生的未来未贴现净现金流量进行比较来衡量的。 如果资产的账面价值超过其估计的未来现金流量,则按资产账面价值超过资产公允价值的金额确认减值费用。本公司拟于每年10月1日起进行年度减值测试。
本公司 根据ASC 350会计准则对商誉和无形资产进行会计处理。无形资产-商誉和其他。商誉是指一个实体的购买价格超出所收购资产和承担的负债的估计公允价值的部分。ASC 350要求 具有无限寿命的商誉和其他无形资产每年进行减值测试,或在事件或情况表明资产的公允价值已降至低于其账面价值的情况下临时进行减值测试。
在确定是否需要进行量化评估时,本公司将对相关事件或情况进行评估,以确定报告单位的公允价值低于其账面价值的可能性是否更大。如果在进行定性评估后, 某实体得出结论认为报告单位的公允价值很可能少于其账面价值,则该实体 将执行ASC 350中所述的量化减值测试。然而,如果在应用定性评估后,实体 得出结论认为公允价值不太可能小于账面价值,则不需要 进行量化减值测试。该公司基于其历史数据和经验、行业预测、微观和宏观总体经济状况预测以及预期做出这些假设。
设备, 净
设备 按成本扣除累计折旧后的净额列报,从启用之日起采用直线 法,按足以在预计使用年限(即5年)内将应折旧资产的成本计入运营的比率进行记录。截至2022年和2021年12月31日,设备包括2019年9月1日投入使用的价值52,000美元的医疗设备,减去截至2022年和2021年12月31日分别为34,667美元和24,267美元的累计折旧。在2022年12月13日至2022年12月31日期间,继任者 确认折旧费用为532美元。 在截至2022年12月12日和2021年12月31日期间,前任 确认折旧费用为$每个期间9 869美元,列入业务报表中的一般费用和行政费用。
融资 成本
债务 发行成本主要包括与债务融资有关的直接、递增专业费用, 作为应付票据面值的直接扣除进行报告,并使用实际利率法在相关应付票据的合同期限内摊销 。
可转换本票 本票
本公司评估其可转换工具,以确定该等合约或该等合约的嵌入部分是否符合根据财务会计准则委员会(“FASB”)会计准则编纂 (“ASC”)第815题“衍生工具及对冲”(“ASC 815”)单独入账的衍生金融工具的资格。对衍生金融工具的会计处理要求本公司按协议开始之日的公允价值和随后的每个资产负债表日期的公允价值记录任何分支的嵌入特征 。公允价值的任何变动在每一期间的收益中作为非营业、非现金收入或费用入账。本公司于每个资产负债表日重新评估其衍生工具的分类。如果分类因期间内的 事件而发生更改,则合同自导致重新分类的事件发生之日起重新分类。分叉的 嵌入功能按其初始公允价值记录,这为托管工具创造了额外的债务折扣。
在2021年1月1日采用会计准则更新(ASU)2020-06年1月1日之前,如果嵌入的转换选项不需要 分支,公司然后通过比较 公司截至承诺日期的标的股票的公允价值和工具的有效转换价格(内在价值)来评估是否存在有益的转换功能。 主机工具按摊余成本计量,账面价值计入规定的合同到期日本金 使用有效利息法,并相应计入利息费用。在2021年1月1日采用ASU 2020-06之后,公司不再需要评估是否存在有益的转换功能。
金融工具的公允价值
公司根据ASC 820 "公允价值计量和披露" (以下简称"ASC 820")计量金融资产和负债的公允价值,该标准定义了公允价值,建立了公允价值计量框架,并扩大了公允价值计量的披露 。
| F-10 |
ASC 820将公允价值定义为在计量日期 市场参与者之间有序交易的资产或负债的本金或最有利市场中为转移负债而收取的或支付的交换价格(退出价格)。ASC 820还建立了公允价值等级,这要求一个实体在计量公允价值时最大限度地使用可观察到的投入,并最大限度地减少使用不可观察到的投入。ASC 820描述了可用于计量公允价值的三个级别的投入:
1级—相同资产或负债在活跃市场的报价;
2级—活跃市场或可观察输入数据中类似资产和负债的报价;以及
第3级—不可观察的输入(例如,基于假设的现金流建模输入)。
由于该等金融工具的短期性质,该等金融工具的账面价值,例如现金、应付帐款及投资者存款,接近公允价值。
有关评估第3级投入时使用的估值技术和假设的更多详情,请参阅 附注8-衍生负债。
所得税 税
对于财务报表或纳税申报表中已计入或未计入的项目的预期未来税务后果,公司确认递延税项资产和负债。递延税项资产及负债乃根据资产及负债的课税基准与其各自的财务报告金额(“暂时性差异”)之间的差额(“暂时性差异”)而厘定,该等差额按预期暂时性差额可望拨回的年度的现行税率 计算。递延税项资产在管理层得出结论认为资产不会变现的可能性比 更大的范围内减值。税率变动对递延税项资产和负债的影响在包括颁布日期在内的期间的经营报表中确认。
公司使用确认阈值和计量流程,用于财务报表确认和计量已采取或预期将在纳税申报表中采取的税务状况 。
租契
有关采用ASC 842的更多详细信息,请参见 附注3—重要会计政策摘要—最近采用的会计声明。
研究和开发
研究 和开发费用在发生时计入运营。
基于股票的薪酬
公司根据奖励的公允价值计量为换取权益工具奖励而获得的服务成本。 奖励的公允价值于授予日期计量。然后,公允价值金额在需要提供服务以换取奖励的期间(通常为归属期)内确认。
股票期权和认股权证的公允价值
公司使用Black-Scholes期权定价模型计算了授予的股票期权和认股权证的公允价值。期权没收 在发生时计入。后续普通股将采用市场法,使用普通股在纳斯达克全球市场的交易价格 进行估值。在2022年期间,前身普通股的公允价值是根据在每个估值日期与收购方进行的业务合并协议公平讨论的状况 采用市场法确定的,该协议最终于2022年7月20日签订,前置估值为8,500万美元。2021年,管理层在第三方估值专家的协助下,采用 收益法确定了前身普通股的公允价值。期权使用的预期术语是授予的期权预计未偿还的预计时间段。 认股权证使用的预期术语是合同期限。本公司利用“简化”方法对“普通”期权授予的预期期限进行估算。本公司在2022年12月13日之前没有普通股的公开交易历史,以支持其历史波动率计算。因此,本公司采用预期波动率 数字,该数字是基于对六家可比实体在相当于被估值工具预期寿命的一段时间内的历史波动率的回顾得出的。无风险利率是根据美国国债零息债券的隐含收益率确定的,其剩余期限与被估值工具的预期期限一致。
| F-11 |
每股普通股净亏损
基本 每股普通股净亏损的计算方法为净亏损除以期间已发行的既有普通股的加权平均数。每股普通股摊薄净收入的计算方法是净收入除以每个期间已发行的普通股和稀释性普通股的加权平均数。
下表列出了未行使的潜在摊薄证券,这些证券已被排除在计算每股摊薄净亏损 之外,因为这样做会产生反摊薄效应:
附表 反稀释证券不计入稀释后每股净亏损。
| 继任者 | 前身 | |||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 前身授权令 [1] | - | 8,560,561 | 2,154,351 | |||||||||
| 继任权证[1][5] | 246,534 | - | - | |||||||||
| 前置任务选项 | - | 10,039,348 | 8,755,179 | |||||||||
| 继任者选项 | 56,950 | - | - | |||||||||
| 前身A系列可转换优先股 | - | 6,406,210 | - | |||||||||
| 后续A系列可转换优先股 | 24,671 | (3) | - | - | ||||||||
| 后续B系列可转换优先股 | 14,465 | (4) | - | - | ||||||||
| 应付前身可转换票据 [2] | - | - | 3,400,187 | |||||||||
| 潜在稀释股份总数 | 342,620 | 25,006,119 | 14,309,717 | |||||||||
| [1] | 作为InflamaCORE,LLC许可协议的一部分,购买600,000股前身普通股或3,404股后继普通股的认股权证将在满足某些里程碑后发行 ,因此不包括在目前报告的金额中。 |
| [2] | 公司的可转换应付票据内含转换选项,可在某些符合条件的交易完成后自动发行普通股 。转换价格是与符合条件的交易相关联的隐含普通股价格的函数。为了披露上表中的潜在稀释证券,我们使用了符合条件的交易发生且隐含普通股价格等于截至2021年12月31日每股3.25美元的普通股公允价值的情况下可发行的普通股数量。 |
| [3] | 如果后续A系列可转换优先股转换价格重置为其下限价格,则 不包括额外的98,686股票。 |
| [4] | 如果后续B系列可转换优先股转换价格重置为其下限价格,则 不包括额外的6,199股票。 |
| [5] | 如果后续的A系列认股权证行权价重置为底价,则 不包括额外的98,686股。 |
细分市场报告
本公司作为一个可报告的运营部门和运营部门来经营和管理其业务。所有资产和业务都在美国。公司首席执行官是首席运营决策者,他在汇总的基础上审查财务信息,以分配资源和评估财务业绩。
最近 采用了会计公告
2019年12月,FASB发布了ASU 2019—12“所得税(主题740):简化所得税会计”,旨在简化与所得税会计相关的各个方面。ASU 2019—12删除了主题740中一般 原则的某些例外,并澄清和修订了现有指南,以改善一致性应用。ASU 2019—12在2021年12月15日之后开始的 财政年度内有效。该准则于2022年1月1日采纳,对 公司的财务报表没有重大影响。
2021年5月,FASB发布ASU 2021—04,每股收益(专题260)、债务修改和消除(子主题470—50), 补偿—股票补偿(主题718),以及实体自有权益中的衍生品和套期保值合同(副主题 815—40):发行人对独立股权分类书面看涨期权的某些修改或交换的会计处理。此 新准则澄清并减少发行人对修改或交换后仍为权益分类的独立 股权分类书面认购期权(如认股权证)的修改或交换会计处理的多样性。本准则 于2021年12月15日之后开始的财政年度生效,包括该财政年度内的中期期间。公司应 对新准则生效日期后发生的修改或交换预期应用新准则。该准则 于2022年1月1日采纳,对公司的财务报表并无重大影响。
| F-12 |
2020年8月,财务会计准则委员会发布了ASU 2020-06,债务转换和其他期权(分主题470-20)和衍生工具和套期保值-实体自有股权合同(分主题815-40):实体自己股权中可转换工具和合同的会计处理 ,以明确某些具有负债和股权特征的金融工具的会计处理。此次更新中的修订删除了现金转换模型和受益转换功能模型,从而减少了可转换债务工具和可转换优先股的会计模型数量。限制会计模型将导致从主机合同中单独识别的嵌入式转换 功能更少。继续受分离模式约束的可转换工具包括:(1)具有与宿主合同不明确和密切相关、符合衍生工具定义 且不符合衍生工具会计例外范围的嵌入转换特征的可转换债务工具;及(2)已发行且溢价可观的可转换债务工具 ,其溢价记录为实收资本。此外,该ASU还改进了对可转换工具和每股收益指引的披露要求。ASU还修订了衍生工具范围例外指南,以减少由远程或有事件驱动的基于形式而不是实质的会计结论。此更新中的修订适用于我们从2023年12月15日之后的 开始的财政年度以及这些财政年度内的过渡期。将允许提前采用,但不得早于2020年12月15日之后的 财年。公司提前采用了ASU 2020-06,自2021年1月1日起生效,无需在发行新的可转换票据时评估是否需要确认有益的转换功能。
2016年2月,美国财务会计准则委员会发布了2016-02年度会计准则更新(“ASU”)“租赁(主题842)”。ASU 2016-02要求承租人确认经营性租赁产生的资产和负债。承租人应在财务状况表中确认支付租赁款项的负债(租赁负债)和代表其在租赁期内使用标的资产的权利的使用权资产。对于租期为12个月或以下的租赁,承租人被允许按标的资产类别作出会计政策选择,不确认租赁资产和租赁负债。在过渡阶段, 承租人和出租人必须确认和计量采用改进的回溯法提出的最早期间开始时的租约。这项修订将在2021年12月15日之后的财年 以及2022年12月15日之后的财年内的过渡期内对非上市公司和新兴成长型公司生效。FASB于2018年7月发布了ASU 第2018-10号《对主题842租赁的编纂改进》和ASU第2018-11号《租赁(主题842)针对性改进》,并于2018年12月发布了ASU第2018-20号《租赁(主题842)--出租人范围狭窄的改进》。ASU 2018-10和ASU 2018-20提供了某些修正案,这些修正案会影响ASU 2016-02发布的指南的狭义方面。ASU 2018-11允许采用ASU 2016-02的所有实体选择另一种(和可选的)采用过渡方法,根据该方法,实体最初在采用日期应用新租赁标准,并确认采用期间留存收益期初余额的累计影响调整 。本公司于2022年12月31日采用ASU 2016-02,自2022年1月1日起生效,采用此ASU后,本公司经营租赁的使用权资产和租赁负债入账,金额约为182,732美元和199,642美元,取消确认递延租金约为16,910美元。
重新分类
某些 上一年度余额已重新分类,以符合本年度的列报方式。这些重新分类对 之前报告的经营业绩或每股亏损没有影响。
注: 4-业务合并
业务 组合、善意和在制品研发
2022年7月20日,运营公司与Larkspur,Larkspur Merger Sub Inc.签署了一份业务合并协议(以下简称“业务合并协议”)。(“合并子公司”是Larkspur的全资子公司)和Stephen Glover(作为运营公司股东代表的身份)。Larkspur是一家空白支票特殊目的收购公司(“SPAC”) ,于2021年12月23日完成首次公开募股后成为一家上市公司,其成立的目的是 与一家私人公司业务进行合并,该业务可以通过获得可以筹集的资本而受益,因为 其股票在纳斯达克公开交易。
| F-13 |
2022年12月12日,在2022年12月8日召开特别股东会议后,业务合并完成,Larkspur的股东审议并批准了一项通过业务合并协议的提案等事项。有关业务合并的更多 信息载于(i)表格S-4上注册声明中包含的委托声明/招股说明书 (文件编号333-266838),经修订和补充,最初于2022年8月12日提交给SEC,并于2022年11月14日由SEC宣布生效。和(ii)2022年7月22日向SEC提交的8-K表格当前报告。
业务合并包括以下交易:
| ● | 运营公司合并到合并子公司,因此运营公司成为存续实体,并在 特拉华 | |
| ● | 运营公司普通股股东以33,845,335股前身普通股(包括33,514,004股永久股权和331,331股临时股权)换取前身普通股191,992股,换股比例为176.28。 该前身普通股被注销,新母公司仅拥有运营公司一股。因此,营运公司成为新母公司的全资附属公司。 | |
| ● | 10,039,348个未偿还的前置期权换成了56,950个未偿还的后继期权。向前置期权持有人发行的后续期权数量 是在实施176.28的交换比例后确定的。 相应期权的行权价也根据交换比例进行了调整。 | |
| ● | 8,560,561份未偿还的先行权证换成了48,561份未偿还的后继权证。向先行权证持有人发行的后继权证数量 是在176.28的交换比例生效后确定的。 每份相应权证的行使价也根据交换比例进行调整。 |
公司将业务合并作为经营公司的远期收购入账,因为已确定经营 公司于业务合并日期为可变权益实体。新母公司是主要受益人,因为其所有权 提供了指导运营公司活动的权力,并有义务承担运营公司的损失和/或收益 。
业务合并采用收购会计方法入账,初始收购价格分配基于我们对收购对价的公允价值和经营公司于收购日收购的有形和无形资产及承担的负债的公允价值的初步评估。由于收购日期接近日历年末,采购价格分配未完成,将在允许的12个月测算期内进行细化。
收购对价的收购日期公允价值的初步估计是采用市场法估计的,对于继任者普通股的公允价值,采用1级投入(可观察投入),对于继继权证和期权的公允价值,采用3级投入(不可观察投入) 。根据业务合并协议,收购方有责任取代营运公司的现有认股权证及期权。因此,有必要在购买对价(合并前服务的公允价值)和合并后服务补偿之间分配替代认股权证和期权的公允价值。可归因于合并后服务的替代权证和期权的公允价值分别为584,260美元和1,731,237美元。
| F-14 |
购买对价的收购日期公允价值的初步估计如下:
购买对价公允价值附表
| 继承人普通股 | $ | 67,197,300 | ||
| 继承权证 | 12,190,015 | |||
| 继任者选项 | 11,864,556 | |||
| 购买代价的公允价值总额 | $ | 91,251,871 |
收购资产的初步收购日期公允价值由管理层估计,但最终将得到改进,特别是对于正在进行的研究和开发,将包括使用收益法进行的估计。收购价格超出所收购可确认净资产的估计公允价值的部分计入商誉。
收购的可识别净资产估计公允价值附表 记为商誉
| 流动资产,包括现金699 324美元 | $ | 1,093,223 | ||
| 正在进行的研究和开发 | 100,086,329 | |||
| 商誉 | 11,895,033 | |||
| 其他非流动资产 | 64,523 | |||
| 收购的总资产 | 113,139,108 | |||
| 流动负债 | 10,818,204 | |||
| 递延税项负债 | 11,069,033 | |||
| 承担的负债总额 | 21,887,237 | |||
| 取得的净资产 | $ | 91,251,871 |
为账面目的而记录的正在进行的研究和开发被视为无限期的无形资产,直到研究和开发工作完成或放弃为止。由于收购是以股票出售的形式进行的,因此正在进行的研发和商誉预计不会有任何税基,也不会因为税收目的而扣除。
在截至2022年12月12日的前身期间,前身产生了约210万美元的交易成本,其中 计入营业报表的一般和行政费用。
考虑到 Larkspur作为SPAC的活动的非经常性性质,合并Larkspur和运营公司业务合并前结果 的备考财务数据将没有意义,因此未呈列。
继任者在成功完成业务合并的同时,以8,635,000美元的净收益出售了A系列优先股 。有关更多信息,请参见附注11-股东永久和临时股权-后续A系列优先股融资 。
| F-15 |
附注 5-应收票据
于二零二零年十二月十三日,本公司与L订立本票协议(“L本票协议”),据此,本公司同意接受L本金额为351,579美元的应收票据(“L本票”)。L票据的利息年利率为1.17厘,每年派息一次,到期日期为(A)本公司在发生违约事件后要求支付L票据项下所有未偿还款项的日期及(B)2025年12月15日,两者中以较早者为准。L公司被要求立即预付L和L公司票据的所有应计和未付利息,并支付以下款项:(A)ZyVersa根据许可协议的条款向L公司支付的第二笔500,000美元里程碑式付款的100% (见附注10-承诺和或有事项),(B)L&F根据认沽期权的条款向ZyVersa出售普通股所得的100%(见附注11-股东永久和临时股权),(C)L律师事务所向ZyVersa以外的任何一方出售ZyVersa普通股超过每股1.00美元的总收益 ,以及(D)因协议定义的某些清算事件而收到的收益 。自2021年12月13日起至2025年12月13日止,只要L票据本金 未偿还,本公司将每年向L支付相当于6,000美元的管理费。于二零二二年十二月三十一日,由于本公司尚未收到L及F支付的应付款项,亦未就附注10-承担及或有事项中所述的许可协议向L&F支付任何所需款项,因此,该笔款项被记录为抵销负债,以抵销应支付予L及F的与许可协议有关的里程碑式付款 ,有关款项已计入应计开支及其他流动负债内。在将应收L&F票据计入抵销责任时,本公司考虑了商业实质、双方的意图以及ZyVersa与L研究之间的整体合同协议,该协议赋予双方法定权利将本公司欠L研究的里程碑式的债务与本公司应收的L&F票据进行抵销。本公司确定该等金额可于资产负债表内抵销,原因如下:i)本公司所欠及欠本公司的金额可予厘定,ii)本公司有法定的 权利以欠L研究公司的L票据金额抵销欠本公司的里程碑负债,iii)本公司 拟将L应收票据抵销里程碑负债,以及iv)抵销权利可依法强制执行。有关L&F票据的其他详细信息,请参阅 附注13-后续活动。
附注 6--应计费用和其他流动负债
截至2022年12月31日和2021年12月31日,应计费用和其他流动负债包括:
应计费用和其他流动负债明细表
| 在过去几年里 | ||||||||
| 十二月三十一日, | ||||||||
| 2022 | 2021 | |||||||
| L & F里程碑付款责任 | $ | 1,500,000 | $ | 1,500,000 | ||||
| L&F注 | (351,579 | ) | (351,579 | ) | ||||
| L & F,净额 | 1,148,421 | 1,148,421 | ||||||
| 应计薪金 | 584,226 | - | ||||||
| 其他应计费用 | 214,229 | - | ||||||
| 应付联邦所得税 | 106,683 | - | ||||||
| 应计利息 | - | 748,767 | ||||||
| 递延租金 | - | 16,913 | ||||||
| 应计费用和其他流动负债总额 | $ | 2,053,559 | $ | 1,914,101 | ||||
附注 7-可转换应付票据
无担保 可转换本票
于2019年10月至2020年7月期间,本公司向投资者及经纪商发行了24个月期无抵押可转换本票(“票据”),本金总额为3,961,000美元。其中,25,000美元的票据已发行给关联方(公司管理团队的成员 )。债券的利息相当于年息6厘,到期日期为(I)初始成交后二十四个月 个月;(Ii)失责事件发生之时、当日或之后;或(Iii)本公司控制权任何变更发生时(br}较早者)。在公司结束合格发行的情况下,定义为;(I)首次公开募股,总收益至少2000万美元,或成为普通股在合格交易所上市的实体,(Ii)与上市公司反向合并,(Iii)公司股权证券的法规A发行,总收益至少2000万美元,或(Iv)公司股权证券的发行,总收益不低于2000万美元,债券项下到期的本金及应计利息应按投资者在该等合资格发售中收到的相同 条款及条件自动转换。自动转换价格应等于(A) 每股3.25美元或(B)每股价格的80%,(I)如果是首次公开发行(IPO)或REG A发行, 合格发行证券的最低每股价格,(Ii)如果是反向合并,则是应付给公司股东的普通股每股毛价,或(Iii)如果是私募,转换股份的每股价格(“赎回功能转换价格”)。本公司分析了票据的嵌入特征,并确定票据包含(I)按固定价格每股3.25美元的合资格发售时的自动转换,(br}不包含有益的转换功能,(Ii)违约时的赎回功能,不需要分拆,(Iii)按赎回功能转换价格的合资格发行时的赎回 功能,总公允价值为373,000美元,该功能是从债务宿主分出的,并记录了贷方到衍生负债和借方到债务的折扣,及(Iv)于控制权变更时触发认沽期权,公平值为64,342美元,由债务承担者分拆,并记入衍生负债的贷方及借方与债务的折让。债务折价按实际利率法于票据期限内摊销,衍生负债于每个报告日期按市价计价。有关更多详情,请参阅附注8-衍生负债。
| F-16 |
于2021年2月至3月期间,公司发行了新的无抵押可转换本票(“2021年票据”),本金总额为5,230,000美元,其中3,150,000美元已发行给公司关联方(包括公司管理层成员、一名创始人和一名重要股东)。2021年发行的债券年利率为6%,按日复利,到期日期为2021年12月31日。如果本公司在2021年2月15日之后开始债务融资(“有条件债务融资”),则2021年票据应自动转换为本票,其形式和条款与在有条件债务融资中发行的票据相同,本金金额等于2021年票据项下的当时未偿还本金和应计未付利息(“票据义务”)。在本公司于2021年2月15日后完成最少500,000美元的股权融资(“合资格股权融资”)后,2021年债券将自动转换为以合资格股权融资(“下一轮证券”)出售的股权证券,其价格和条款与任何投资者在该等合资格股权融资中收到的相同。在该等转换时将发行的后续轮证券的数目 应等于以下所得的商数:(I)等同于该等合格股权融资完成时的未偿还票据债务的金额除以随后的每轮证券在合格股权融资中出售的最低价格 (“转换价格”)。如果在合格股权融资之前的任何时间发生控制权变更,相当于该控制权变更结束时未偿还票据债务的金额应在控制权变更结束时同时自动转换,价格为每股3.25美元。本公司分析了2021年债券的嵌入特点,并确定2021年债券包含(I)在符合资格的债务融资时自动转换而不需要分拆,(Ii)在符合资格的股权融资时自动转换 每股3.25美元的固定价格而不需要分拆,(Iii)在控制权变更时以每股3.25美元的固定价格自动转换而不需要分拆,及(Iv)违约时的赎回 功能不需要分拆。
于2022年1月,本公司及其可换股票据持有人同意将票据及2021年票据的到期日延长至2022年12月31日。这些扩展被限定为修改,因为这些术语并没有本质上的不同。因此,扩展说明 被视为原始说明和2021年说明的延续。
公司须支付相当于总收益8%的现金费用,金额为配售代理首先确定的范围 并将债券融资的任何投资者带给公司。关于票据融资,前身产生了总计228,236美元的配售代理和法律费用,这些费用被记录为债务折扣,并将按实际利息法在票据期限内摊销 。
在2022年12月13日至2022年12月31日期间,继承人记录了与票据相关的债务折价摊销0美元。 请参阅下面的自动转换。
在截至2022年12月12日和2021年12月31日的期间内,前身分别在与票据有关的营业报表中将债务贴现摊销记为利息支出 709,608美元和317,833美元。
| F-17 |
自动 转换
2022年7月8日,由于额外的前身A系列优先股融资(这导致了合格股权融资 ,累计毛收入超过500,000美元),2021年票据由5,230,000美元本金和428,888美元应计利息组成,自动转换为前身A系列优先股1,802,193股,有效转换价格为每股前身A系列优先股3.14美元。更多细节见附注11--股东永久和临时股权--前身A系列优先股融资。由于按照原始条款转换的2021年债券和2021年债券不包括股份结算赎回功能,因此自动转换通过转换会计进行核算,其中2021年债券的本金和应计利息的账面价值被取消确认,这些总额 分配为普通股(面值)和额外的实收资本。
2022年12月12日,本公司完成了符合与上市公司反向合并的法律定义的业务合并(见附注4-业务合并)(尽管出于会计目的,这是一项正向合并)。因此,该业务组合符合合格发售的定义,因此,3,961,000美元的票据本金、709,608美元的相关应计利息和1,167,601美元的衍生负债自动 转换为2,940,537股前身普通股,再 换取16,681股后继普通股 。自动换股乃根据票据原始条款所包括的股份结算赎回功能而进行,换股价格为1.58835美元(按业务合并交换比率5.037厘定的前身普通股每股公允价值1.98542美元的八成)。根据股份结算赎回功能自动转换可转换票据 计入清偿,但这项自动转换并未导致 确认清偿亏损,因为赎回功能(衍生负债)于业务合并日期(详见附注8-衍生负债)在终止确认票据本金、应计利息及衍生负债的账面价值 前按市场计价(见附注8-衍生负债),而该等总额分配为普通股(面值)及额外实收资本。
附注 8--衍生负债
截至2021年1月1日,本公司拥有3级衍生负债,按发行时的公允价值计量,与债券的赎回功能和认沽期权有关。有关更多细节,请参阅附注7-可转换应付票据。赎回功能是使用贴现现金流和Black-Scholes估值技术相结合进行估值的。
于2022年12月12日,于业务合并完成时(见附注4-业务合并),票据自动将 转换为2,940,537股前身普通股,转换价格为1.58835美元(业务合并时应支付给本公司股东的普通股每股1.98542美元公允价值的80%),公允价值对价为5,838,209美元。 通过将赎回功能调整为其在业务合并日期的公允价值,自动 转换的损益表影响是确认衍生负债的公允价值变动186,401美元,没有清偿收益或损失。
下表列出了按公允价值计量的第3级衍生负债的公允价值变化摘要 :
第三级衍生品负债公允价值变动表
| 截至2021年1月1日的期初余额 | $ | 788,700 | ||
| 衍生负债的公允价值变动 | (228,100 | ) | ||
| 截至2021年12月31日的期末余额 | $ | 560,600 | ||
| 衍生负债的公允价值变动 | 607,001 | |||
| 票据转换后重新分类为权益 | (1,167,601 | ) | ||
| 2022年12月12日期末余额 | $ | - |
| F-18 |
截至2022年12月31日,没有衍生负债。对于衍生品负债估值,截至2021年12月31日,贴现现金流中使用的重要 不可观察输入为25%的贴现率、发生合格发行的可能性为 85%和发生控制权变更的可能性为0%。对于截至2021年12月31日的估值,Black-Scholes假设 如下:
衍生品负债表公允价值假设
| 2021年12月31日 | ||||
| 发行日普通股公允价值 | $ | 3.25 | ||
| 无风险利率 | 0.06% - 0.19 | % | ||
| 预期期限(年) | 0.00 - 0.50 | |||
| 预期波动率 | 75 | % | ||
| 预期股息 | 0.00 | % | ||
附注 9--所得税
公司须缴纳美国联邦和州所得税。
所得税准备金包括以下(福利)准备金:
所得税拨备附表
| 继任者 | 前身 | |||||||||||
| 在该期间内 | 在该期间内 | |||||||||||
| 12月13日至 | 一月一日 至 | 这一年的 已结束 | ||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 递延税项优惠: | ||||||||||||
| 联邦制 | $ | (151,625 | ) | $ | (2,191,344 | ) | $ | (1,480,472 | ) | |||
| 状态 | (34,844 | ) | (482,283 | ) | (763,612 | ) | ||||||
| 递延税项优惠 | (186,469 | ) | (2,673,627 | ) | (2,244,084 | ) | ||||||
| 更改估值免税额 | (558,581 | ) | 2,673,627 | 2,244,084 | ||||||||
| 所得税拨备 | $ | (745,050 | ) | $ | - | $ | - | |||||
所得税规定与联邦法定税率不同,具体如下:
所得税准备金表与联邦法定税率不同
| 继任者 | 前身 | |||||||||||
| 在该期间内 | 在该期间内 | |||||||||||
12月 13 穿过 | 一月 1 穿过 | 本年度的 告一段落 | ||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 联邦法定利率 | 21.0 | % | 21.0 | % | 21.0 | % | ||||||
| 扣除联邦福利后的州税率 | 3.6 | % | 3.6 | % | 3.7 | % | ||||||
| 永久性物品 | (1.9 | %) | (5.4 | %) | (0.9 | %) | ||||||
| 不可扣除的基差 | 0.0 | % | 0.0 | % | 0.1 | % | ||||||
| 国家利率变化的影响 | 0.0 | % | (0.1 | %) | 3.9 | % | ||||||
| 上期调整数和其他 | 0.0 | % | (0.1 | %) | 0.0 | % | ||||||
| 更改估值免税额 | 68.1 | % | (19.0 | %) | (27.8 | %) | ||||||
| 有效所得税率 | 90.8 | % | (0.0 | %) | 0.0 | % | ||||||
| F-19 |
递延 纳税资产和负债包括:
递延税项资产负债表
| 继任者 | 前身 | |||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 净营业亏损结转 | $ | 6,671,907 | $ | 6,639,882 | $ | 4,930,055 | ||||||
| 基于股票的薪酬费用 | 2,936,945 | 4,084,595 | 3,220,799 | |||||||||
| 资本化的研发成本 | 2,421,390 | 2,362,939 | 2,199,126 | |||||||||
| 资本化启动成本 | 1,121,802 | 565,530 | 620,016 | |||||||||
| 资本化许可证费用 | 687,926 | 689,820 | 735,485 | |||||||||
| 衍生负债 | - | - | 6,388 | |||||||||
| 资本化专利 | 288,123 | 273,682 | 235,065 | |||||||||
| 认股权证 | 133,203 | 238,768 | 239,307 | |||||||||
| 应计工资总额 | 71,830 | - | - | |||||||||
| 结转捐款 | 2,833 | 2,833 | 2,840 | |||||||||
| 租赁负债 | 26,794 | - | - | |||||||||
| 递延租金 | - | - | 4,176 | |||||||||
| 递延税项资产 | 14,362,753 | 14,858,049 | 12,193,257 | |||||||||
| 估值免税额 | - | (14,853,648 | ) | (12,180,021 | ) | |||||||
| 递延税项资产 | 14,362,753 | 4,401 | 13,236 | |||||||||
| 递延债务贴现 | - | - | (6,388 | ) | ||||||||
| 使用权资产 | (24,236 | ) | - | - | ||||||||
| 正在进行的研究和开发 | (24,658,231 | ) | - | - | ||||||||
| 固定资产 | (4,270 | ) | (4,401 | ) | (6,848 | ) | ||||||
| 递延税项负债 | (24,686,737 | ) | (4,401 | ) | (13,236 | ) | ||||||
| 递延税项资产,净额 | $ | (10,323,984 | ) | $ | - | $ | - | |||||
在2022年12月31日,继任者结转的联邦净营业亏损约为27,515,427美元,州净营业亏损约为20,567,703美元;在2022年12月12日和2021年12月31日,继任者的联邦净营业亏损结转约为27,385,445美元和20,446,200美元,州净营业亏损结转约为20,458,902美元和14,644,000美元,可用于 抵消未来联邦和州应纳税收入。这样的NOL结转不会过期。然而,由于所有权变更,它们用于抵销未来应纳税所得额 可能会受到《国税法》第382条和类似州法规的限制。
公司已评估了递延税项资产变现的可能性,并考虑了所有可用的正面和负面证据,包括递延税项负债的预定冲销、预计未来应纳税所得额和税务筹划策略。当“很有可能”全部或部分递延税项资产不会变现时,便会计提估值拨备。 在截至2022年12月12日及2021年12月31日进行审核后,管理层认为前述递延税项资产的未来变现存在不确定性,因此已于该等日期设立全额估值拨备。因此,前任在2022年1月1日至2022年12月12日期间和2021年12月31日终了年度与税务准备金有关的估值免税额分别增加2 673 627美元和2 244 084美元。
由于2022年12月12日的业务合并和新的递延税项负债的出现(A)作为收购会计的一部分,前身 公布了其14,853,648美元的估值准备。在后续期间,新母公司发放了558,581美元的估值免税额,作为一项所得税优惠,与业务合并分开。
| F-20 |
管理层已评估并得出结论,截至2022年12月31日和2021年12月31日,公司财务 报表中没有需要确认的重大不确定税务状况。本公司预计其未确认的税务优惠在报告日期起计的12个月内不会有任何重大变化。
截至2022年12月31日及2021年12月31日止年度内,并无开始或正在进行税务审核,且该等年度内并无产生任何与税务有关的利息或罚款 。本公司自截至2019年12月31日止年度开始的报税表仍有待审核。
附注 10--承付款和或有事项
诉讼、索赔和评估
在 正常业务过程中,本公司可能会涉及在正常业务过程中产生的法律诉讼、索赔和评估 。当损失被评估为可能发生且 损失金额可以合理估计时,公司记录因此类索赔而产生的或有负债(如有)。
许可证 协议
L & F Research LLC
2015年12月15日,本公司与L律师事务所订立许可协议,根据协议所载条款及条件,L授予ZyVersa若干技术的独家许可 。许可协议的期限应从生效日期开始 ,除非按照协议条款提前终止,否则将一直持续到被许可人的所有使用费支付义务的最后一个到期为止。
许可协议包括预付现金200,000美元(2015年支付并确认为研发费用),里程碑现金付款总额2,150万美元(公司将在有可能实现里程碑时确认与里程碑现金付款相关的支出;2020年确认的1,500,000美元支出(其中500,000美元最初应于 到期,并于2021年支付)与美国食品和药物管理局(FDA)接受研究新药申请以及开始2a期临床试验有关;2,500,000美元的下一个里程碑是在与FDA的第二阶段会议积极结束时赚取的(br}),当产品进入市场时,版税从产品销售的5%-10%不等(如果销售发生,公司将确认版税费用 ;至今仍未确认)及前置认股权证,可购买合共878,947股前置认股权证,行使价为每股1.00美元,授予日公允价值为766,384美元,自实现指定里程碑之日起五年内可予行使(前置认股权证购买351,579股前置普通股的权证于2015年发行时可予行使,因此,本公司于2015年内确认其授出日期公允价值306,411美元为研发开支,并与额外实收资本相对应;当有可能达到相关的履约条件时,本公司将 确认与剩余认股权证相关的费用; 根据FDA的定义,在FDA接受化合物或产品的研究新药申请后,可于2020年1月行使购买175,789股前任普通股的前任认股权证,当时公司确认的费用等于授权日公允价值153,324美元;截至2022年12月31日,尚未行使购买351,578股前任普通股的前任认股权证 ,因为尚未实现里程碑)。对于上述尚未支出或支付的对价,本公司将在相关项目有可能实现且价值可评估时确认相关支出。
2020年1月9日,对许可协议进行了修订,其中规定了以下修订:(I)部分延长了与成功完成第一阶段临床试验相关的1,000,000美元里程碑现金付款的支付时间(在2a阶段临床试验开始时支付500,000美元(“1/2里程碑”)和在 1/2阶段里程碑开始一周年(“一周年里程碑”)时支付500,000美元);及(Ii)在L律师事务所于1/2期里程碑完成后行使其认股权证的条件下,351,579美元的行权价将从应付L 1/2期里程碑的现金中扣减。有关L基金行使认股权证时订立的本票协议及附注11-股东权益-认沽期权有关本公司与L就L票据协议订立的认沽期权协议的进一步详情,请参阅附注4-应收票据。
| F-21 |
2022年3月7日,本公司与L公司签署了一份放弃协议,放弃L公司在2022年8月31日之前因未支付150万美元里程碑式付款而终止许可协议或任何其他补救措施的权利。许可协议的所有其他条款仍然有效。
2022年8月26日,本公司与L律师事务所签署了一份放弃协议,放弃L律师事务所在2023年1月3日之前因未支付150万美元里程碑付款而终止许可协议或任何其他补救措施的权利。许可协议的所有其他条款仍然有效。
2022年12月23日,本公司与L律师事务所签署了一份放弃协议,放弃L律师事务所在2023年3月31日之前因未支付150万美元里程碑付款而终止许可协议或任何其他补救措施的权利。许可协议的所有其他条款仍然有效。
有关L&F许可协议的更多详细信息,请参阅 附注13-后续活动。
InflamaCORE
于2019年4月18日,本公司与InflamaCORE,LLC(“InflamaCORE”)订立许可协议,据此,InflamaCORE同意向其前身授予InflamaCORE计划技术的独家许可。许可协议的期限应从生效日期开始 ,除非按照协议条款提前终止,否则将一直持续到被许可人的所有使用费支付义务的最后一个到期为止。在本许可协议的同时,InflamaCORE与迈阿密大学签订了一项协议,将InflamaCORE科学家开发的所有知识产权和技术整合到InflamaCORE旗下,这些科学家都是迈阿密大学的员工。本协议的有效期自生效之日起生效,直至(A)专利权范围内所有已颁发的专利和提交的专利申请均已失效或被放弃且无使用费到期之日,或(B)二十(20)年,除非根据协议条款提前终止,否则一直有效。签署这两项协议的谅解是,ZyVersa将根据许可协议进一步开发知识产权和技术。
作为许可证的对价,前任同意向InflamaCORE支付346,321美元的预付款,以支付向迈阿密大学偿还专利的费用。InflamaCORE还有权获得六笔里程碑式的付款,总计22,500,000美元(第一笔200,000美元的里程碑式付款是由提交治疗许可产品的第一个适应症的研究新药申请引发的)。ZyVersa需要向InflamaCORE支付5%至10%的销售特许权使用费,该特许权使用费将在协议中定义的(A)最后一个到期的专利或(B)法规排他性到期的最新 到期时到期。ZyVersa 需要向迈阿密大学支付3%至6%的销售版税。最后,InflamaCORE将获得总计1,000,000股前置普通股的五年前置权证,其中,前置认股权证购买400,000股前置普通股,发行日期公允价值为815,822美元,记为研发费用, 在协议执行时以每股2.30美元的行使价发行,其余前置认股权证购买 60万股前置普通股,将在满足某些里程碑后,以相当于发行时前置普通股公允价值的每股价格发行。除非本公司完成首次公开招股(“IPO”),否则将发行所有认股权证 ,其定义为前身普通股或其他股本证券的首次公开招股。如果公司在紧接到期日之前的三年内完成首次公开募股,到期日将自动延长至公司首次公开募股生效日期的三周年。该公司认定该业务合并不符合首次公开募股的定义。根据协议,迈阿密大学还收到了200,000股前身 普通股,授予日期公允价值为460,000美元,记为研发费用。 截至2022年12月31日,继任者没有支付或欠任何特许权使用费,与现金支付和发行继承者认股权证相关的业绩里程碑没有实现,公司没有产生任何付款,也没有发行与许可协议相关的剩余继承者权证 。
| F-22 |
运营 租约
于2019年1月18日,前任签订了一份位于佛罗里达州韦斯顿的约3,500平方英尺办公空间的租赁协议 ,租期为五年。根据租赁协议,第一年的年度基本租金(不包括前任应承担的税项和运营成本)约为89,000美元,此后每年上涨约3%,总基本租金约为497,000美元。
继任者确认2022年12月13日至2022年12月31日期间的租金支出为7,795美元,继任者确认截至2022年12月12日和2021年12月31日期间的租金支出分别为148,881美元和148,125美元。
有关 公司采用新租赁会计准则以及确认使用权资产和经营租赁 负债的相关信息,请参见 附注3—主要会计政策概要—最近采用的会计声明。
本公司的使用权资产和负债摘要如下:
使用权资产及负债一览表
| 财务 指定、前身和继承人 [固定列表] | 继任者 | 前身 | ||||||
| 2022年12月31日 | 十二月 2022年12月12日 | |||||||
| 为计量租赁负债所包括的金额支付的现金: | ||||||||
| 运营 经营业务所用之现金流量 | $ | 4,786 | $ | 86,100 | ||||
| 使用权 为换取租赁义务而获得的资产 | ||||||||
| 运营 租约 | $ | - | $ | - | ||||
| 加权 平均剩余租期 | ||||||||
| 运营 租约 | 1.08 年 | 1.08 年 | ||||||
| 加权 平均折价率 | ||||||||
| 运营 租约 | 6.5 | % | 6.5 | % | ||||
根据这些经营租赁协议,未来 最低付款额如下:
租赁项下未来最低付款计划
| 金额 | ||||
| 未来最低还款额 | $ | 112,916 | ||
| 减去:代表推定利息的金额 | (4,160 | ) | ||
| 总计 | $ | 108,756 | ||
注 11 -股东永久和临时股权
授权资本
前身获授权发行75,000,000股前身普通股,每股面值0.00001美元,以及5,000,000股前身优先股,每股面值0.00001美元。前任普通股的持有者有权 每股一票。
继承人被授权发行110,000,000股继承人普通股,每股面值0.0001美元,以及1,000,000股继承人优先股,每股面值0.0001美元。继承人普通股的持有者有权每股 股投一票。
| F-23 |
股权激励计划
前身 2014年股权激励计划
前身获授权根据其2014年股权激励计划(“2014计划”)颁发奖励,该计划于2018年10月9日、2019年2月2日和2021年2月2日修订。根据2014年计划,自2021年12月31日起,授权发行本公司10,000,000股前身普通股 。2014年计划下可供发行的普通股数量应在2014计划期限内自2019年开始的每个日历年1月份的第一个交易日自动增加,增加的金额相当于上一日历年12月份最后一个交易日已发行普通股总数的5%(5%),但在任何情况下,此类年度增加不得超过10万股普通股 。2014年计划规定向本公司及其关联公司的员工、董事和顾问发行激励性股票期权、非法定股票期权、普通股购买权、股票增值权、限制性股票和限制性股票单位。2014年计划要求股票期权的行权价格不低于授予日公司普通股的公允价值。截至2022年12月31日,根据2014年计划,可供未来发行的前身股票有45,652股。
2022年12月12日,鉴于业务合并的完善,前身批准了2014年计划修正案(“2014年计划修正案”)。除其他事项外,《2014年计划修正案》规定,在业务合并完成后, 根据2014年计划保留和可供发行的普通股股份不得进一步增加, 根据2014年计划不得作出新的奖励。
继任者 2022年综合股权激励计划
继任者有权根据《2022年综合股权激励计划》(《2022年计划》)颁发奖励。根据2022年计划,自2022年12月12日起,授权发行继任者的31,138股继任者普通股 。2022年计划下可供发行的普通股数量应在2022年计划期限内的每个日历年1月份的第一个交易日(从2023年日历年开始)自动增加,增加的金额相当于上一个日历年12月份最后一个交易日已发行普通股总数的4%(4%)。2022年计划规定向本公司及其关联公司的员工、董事和顾问发行激励性股票期权、非法定股票期权、普通股购买权、股票增值权、限制性股票和限制性股票单位 。2022年计划要求股票期权的行权价格不低于授予之日公司普通股的公允价值。截至2022年12月31日,根据2022年计划,可供未来发行的后继股为31,138股 。
可赎回普通股
于2020年12月13日(“生效日期”),关于L票据协议(详见附注5-应收票据 ),前身与L订立协议,向L提供认沽期权,使本公司可按每股1.00美元的价格购买最多331,331股前身普通股(“认沽期权”)。 认沽期权将于(A)L票据悉数偿还之日届满;或(B)生效日期五(5)周年。双方同意,如L公司行使权力,本公司将根据L公司票据协议减少L公司当时欠本公司的应收款项,以代替向L公司支付认沽股份。认沽期权 以331美元的总代价售予L基金,并记入额外实收资本内。
2022年12月12日,本公司结束了业务合并(见附注4-业务合并),据此,受认沽期权约束的331,331股前身普通股交换为1,880股后继普通股,价格为 每股176.28美元。看跌期权具有使普通股标的股票可赎回的实际效果。因此,在继任者和前任资产负债表上,它们都被归类为临时股本。
| F-24 |
有关L债券和看跌期权的更多详细信息,请参阅 附注13-后续事件。
前身 A系列优先股
前身 系列A优先股融资s
2022年3月31日,前身以每股3.14美元的价格向投资者出售了133,541股A系列优先股,净收益为392,301美元,其中10万美元来自关联方。
先前A系列优先股可根据持有人的选择随时以一对一的方式转换为先前普通股股票 ,但须进行标准反稀释调整。此外,如果本公司 以低于有效转换价的价格进行任何非豁免发行,则应按加权 平均值降低先前A系列优先股转换价。在(i)公开交易结束或(ii)先前A系列优先股多数当时流通股持有人的书面同意或协议指定日期的同时,每股先前A系列优先股的每股股份应自动转换为先前普通股 。公开 交易指(a)承销公开发行的坚定承诺;或(b)与纳斯达克股票市场上市的特殊 收购公司("SPAC")的交易完成,在该交易中,公司将成为SPAC的全资子公司 。
先前A系列优先股股东应与先前普通股股东在转换后的基础上共同投票, 股息仅在支付给先前普通股股东时,才会在转换后的基础上支付。在任何清算、 解散或清盘的情况下,或在被视为清算事件的情况下,在支付给先前普通股 之前,先前A系列优先股股东将有权从先前可供分配的资产中获得原购买价的两倍,加上先前A系列优先股每股已宣布且未支付的股息 ,或先前A系列优先股持有人在转换后将收到的金额(如金额更大)。任何收益的余额 应按比例分配给先前普通股股东。视为清算事件包括(a)前公司或其子公司为组成方的合并 或合并导致控制权变更("合并 事件");或(b)前公司全部或绝大部分资产的出售、租赁、转让、独家许可或其他处置("处置事件")。
前身A系列优先股不可强制赎回,因此不应归类为负债。 前身确定被视为清算事件在前身控制范围内,因此前身A系列优先股应归类为永久股权。具体地说,根据州法律,合并事件和处置事件需要得到董事会的批准,而前任优先股东无法控制董事会的投票 。前人确定,嵌入的转换期权与优先股宿主明确而密切相关,因此,嵌入的转换期权不需要被分成两部分。但是,如果在随后的证券发行中重新设定转换价格,则前任将需要评估价格重新设定的会计处理。由于前身在2021年1月1日采用了ASU 2020-06,因此没有必要评估嵌入式转换选项以实现有益的转换 功能。
2022年7月8日,前身以每股3.14美元的价格向投资者出售了94,393股前身A系列优先股,产生了296,400美元的毛收入。21,200美元的配售代理费被记录为额外实收资本的减少。
2022年9月16日,前身以每股3.14美元的价格向投资者额外出售了222,929股前身A系列优先股,产生了700,000美元的毛收入。配售代理费16,000美元被记录为额外实收资本的减少。
2022年12月6日,前身以每股3.14美元的价格向投资者出售了174,776股前身A系列优先股,产生了548,805美元的毛收入。2,000美元的配售代理费被记录为额外实收资本的减少。
| F-25 |
修改前身系列A优先股名称
2022年5月10日,前身获得了必要的批准,以(A)修改前身公司注册证书中的前身A系列优先股名称,将前身A系列优先股的有效转换价格 从每股前身普通股3.14美元降至每股前身普通股2.78美元;以及(B)并增加了100%的认股权证覆盖面, 这样,转换时发行的每一股前身普通股,持有人也将获得前身认股权证,以购买 一股前身普通股。这些前置认股权证可按每股3.20美元的初始行权价行使(如果被视为发行价低于当前行权价格,则可在公开交易完成时减持),并在五年后到期(“前置A系列认股权证”),或在不符合公开交易定义的较早控制权变更时 。前身确定(A)前身A系列权证 在发行时有资格被归类为股权,而不需要随后的重新计量,以及(B)前身A系列权证的或有发行性质不会改变前身的结论,即嵌入的转换选项与优先股宿主明确而密切地 相关,因此,嵌入的转换选项不需要被分开。前身公司还认定,降低前身A系列优先股转换价格,再加上转换时增加100%的权证覆盖率, 代表前身A系列优先股条款需要应用清偿会计的重大变化。因此,在计算每股亏损时,有必要将经修订前身A系列优先股及新前身A系列认股权证的331,200美元增量公允价值(与A系列优先股的账面价值相比)记录为视为股息以计算每股亏损 。
对先前系列A优先股名称的第二次修订
2022年8月31日,前身向佛罗里达州国务院提交了对前身公司注册证书中前身A系列优先股名称的第二次修订,将前身A系列优先股的转换价格从每股前身普通股和前身A系列认股权证降至每股1.19美元。此外,前身还将转换时可发行的前身A系列权证的行权价从每股3.20美元下调至每股1.37美元。
前身确定下调前身A系列优先股转换价格,再加上与可于转换时发行的前身A系列认股权证(统称为“第二修订证券”)相关的修订条款 , 代表需要应用清偿会计的重大变化。因此,为计算每股亏损,有必要将经修订前身A系列优先股及经修订前身A系列认股权证的9,684,637美元增量公允价值(与A系列优先股的账面价值及前身A系列认股权证第二次修订前的公允价值比较)记录为视为股息,以计算每股亏损。
扑灭前身A系列优先股
本公司认为,降低A系列优先股转换价格,加上或有发行A系列认股权证或更改A系列优先股(统称为“经修订证券”),是一项需要应用清偿会计的重大变化。因此,为计算每股亏损,有必要将经修订证券的331,200美元增量价值(与原来A系列优先股的价值相比)记录为视为股息 。
| F-26 |
自动 先前A系列优先股转换
于2022年12月12日,与业务合并有关,所有已发行的2,427,832股前身A系列优先股 自动转换为6,406,210股前置普通股和5年期前置A认股权证,以购买6,406,210股前置普通股, 然后 换成36,340股后继普通股和5年期 认股权证,以每股241.50美元的行使价 购买36,340股后继普通股。按照优先股的原始条款转换的权益类优先股将导致优先股账面价值的终止确认,并将该金额分配给普通股(面值)和额外的实收资本,而不确认损益。
继任者 优先股
继任者 A系列优先股融资
在业务合并方面,继承人出售了8,635股A系列优先股和五年权证,可按行使价每股402.50美元(“管道认股权证”),购买24,671股后续普通股(“管道认股权证”), 以每股1,000美元的价格向某些买家出售净收益8,635,000美元(“管道”融资)。
根据持有人的选择,后续系列A优先股可在任何时间转换为一定数量的后续普通股,等于面值除以当时生效的转换价格(最初为350.00美元)。此外,在后续A系列优先股发行后的五年内,转换价格将自动调整为(A) $70.00美元和(B)低于转换价格的任何后续证券发行的最低价格中的较大者。
在后续A系列优先股(每个均为“生效日期”)注册生效后, 转换价格也将分别重置为90天和150天,以(A)70.00美元和(B)自每个生效日期(包括)开始并包括在内的连续十个每日成交量加权平均价格中最低价格的85%为较大值。截至申请日,后续系列 A优先股尚未注册,也未进行换股价格重置。
| F-27 |
继任A系列优先股股东没有投票权,只有在向继任普通股股东支付股息时,股息才会按折算后的基础支付。如果继承人发生清算、解散或清盘,每一位A系列优先股继承人有权从合法可供分配的公司资产、其所持股份的声明价值以及任何应计和未支付的股息中获得 支付。任何收益的余额应按折算后的基础分配给后续的A系列优先股股东Pari 通行证有继任者的普通股股东。
继任者A系列优先股在持有人选择时不可赎回 ,因此被归类为永久股权。然而,在持有人有权选择 进行转换的情况下,公司有权随时以面值的120%赎回后续的A系列优先股。后继者 确定嵌入的转换选项与优先股主机明显且密切相关,因此,嵌入的 转换选项不需要被分成两部分。然而,如果转换价格因随后的证券发行而重置,则本公司将需要评估价格重置的会计处理。由于继任者于2021年1月1日采用ASU 2020-06,因此无需评估嵌入式转换选项以实现有益的转换功能。
后继者 首选系列B发行
在业务合并方面,继承人以每股1,000美元的价格向向本公司提供服务的某些供应商发行了5,062股B系列优先股,以换取5,062,000美元的公司债务。
根据 持有者的选择,后续B系列优先股可在任何时间转换为若干后续普通股,等于面值除以当时的转换价格(最初为350.00美元)。 此外,在后续B系列优先股发行后的五年内,转换价格将自动调整为(A)245.00美元; 和(B)任何后续证券发行的最低价,价格低于转换价格。
在后续B系列优先股注册生效后的150日内,转换价格也将重置为(A)245.00美元、 和(B)连续五个每日成交量加权平均价格中的最低者,自开始日期(包括开始日期)起计。截至申请日,后续系列 B优先股尚未注册,也未进行转换价格重置。
继任者B系列优先股股东没有投票权,只有在向继任者普通股股东支付股息时,股息才会按折算后的基础支付。如果继承人发生任何清算、解散或清盘,则每个继承人B系列优先股股东有权从公司合法可供分配的资产、其所持股份的规定价值以及任何应计和未支付的股息中获得支付。 任何收益的余额应按折算后的基础分配给继承人B系列优先股股东。平价通行证 与继任者普通股股东。
继任者B系列优先股不可赎回 ,因此被归类为永久股权。继任者确定嵌入的转换选项与优先股宿主明确而密切地相关,因此,嵌入的转换选项不需要被分成两部分。但是,如果在随后的证券发行中重置了转换价格 ,则继任者将需要评估重置价格的会计处理。由于继任者于2021年1月1日采用了ASU 2020-06,因此没有必要评估嵌入式转换 选项以获得有利的转换功能。
| F-28 |
基于股票的薪酬
在2022年12月13日至2022年12月31日期间,继任者记录的股票薪酬支出为56,333美元(其中,7,808美元包括在研发中,48,525美元包括在一般和行政费用中),与向员工和顾问发放的期权 相关。在截至2022年12月12日的期间,前任记录的基于股票的薪酬支出为3,524,802美元(其中673,160美元包括在研发中,2,851,642美元包括在一般和行政费用中),与向员工和顾问发放的期权有关。截至2022年12月31日,有2,957,047美元的未确认股票薪酬 费用,公司预计将在1.6年的加权平均期间内确认。
在截至2021年12月31日的年度,公司记录了4,245,463美元的股票薪酬支出(其中944,525美元包括在研发中,3,300,938美元包括在一般和行政费用中),与向员工和顾问发放的期权有关。
股票 期权
2022年12月12日,本公司结束了业务合并(见附注4-业务合并),据此,10,039,348个未偿还前置期权 交换了56,999个未偿还后继期权 。向前置期权持有人发行的后继期权数量 是通过可发行前置普通股的股数除以176.28的兑换比率来确定的。 每个前置期权的行权价格也乘以兑换比率。
在将布莱克-斯科尔斯期权定价模型应用于已授予的前身股票期权时,该公司使用了以下假设:
已授予的股票期权日程表
| 继任者 | 前身 | |||||||||
| 在该期间内 | 在该期间内 | 这一年的 | ||||||||
| 12月13日至 | 1月1日至 | 告一段落 | ||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||
| 授予日期普通股的公允价值 | 不适用 | $2.27 - $3.00 | $ | 3.25 | ||||||
| 无风险利率 | 不适用 | 1.68% - 3.01 | % | 0.66% - 1.26 | % | |||||
| 预期期限(年) | 不适用 | 3.53 - 6.00 | 5.00 - 6.00 | |||||||
| 预期波动率 | 不适用 | 111% - 119 | % | 118% - 125 | % | |||||
| 预期股息 | 不适用 | 0.00 | % | 0.00 | % | |||||
截至2022年12月12日止期间,前身公司普通股的公允价值是根据 在每个估值日与收购方进行的公平讨论的业务合并协议的状态,使用市场法确定的,该协议最终于2022年7月20日签订,公司估值为8500万美元。截至2022年12月12日期间 授予的期权的合同期限为七至十年,必要的服务期限为零至三年。
在截至2021年12月31日的年度内,管理层在第三方估值专家的协助下使用收益法确定了前身普通股的公允价值。截至2021年12月31日止年度授予的期权的合同期限为十年,必要的服务期为零至三年。
| F-29 |
继承人2022年12月13日至2022年12月31日期间以及继承人截至2022年12月12日期间的期权活动 如下:
股票期权活动时间表
| 继任者 | 数量 选项 | 加权 平均值 锻炼 价格 | 加权 平均值 剩余 生命 以年为单位 | 集料 固有的 价值 | ||||||||||||
| 杰出,2022年12月13日 | 56,999 | $ | 366.29 | |||||||||||||
| 授与 | - | - | ||||||||||||||
| 已锻炼 | - | - | ||||||||||||||
| 被没收 | - | - | ||||||||||||||
| 未清偿,2022年12月31日 | 56,999 | $ | 366.29 | 5.8 | $ | - | ||||||||||
| 可行使,2022年12月31日 | 47,030 | $ | 337.43 | 5.3 | $ | - | ||||||||||
| 前身 | 数量 选项 | 加权 平均值 锻炼 价格 | 加权 平均值 剩余 生命 以年为单位 | 集料 固有的 价值 | ||||||||||||
| 未偿还,2022年1月1日 | 8,755,179 | $ | 2.00 | |||||||||||||
| 授与 | 1,284,169 | 3.17 | ||||||||||||||
| 已锻炼 | - | - | ||||||||||||||
| 被没收 | - | - | ||||||||||||||
| 杰出,2022年12月12日 | 10,039,348 | $ | 2.15 | 5.9 | $ | 3,271,992 | ||||||||||
| 可撤销,2022年12月12日 | 8,258,023 | $ | 1.91 | 5.3 | $ | 3,271,992 | ||||||||||
下表列出了截至2022年12月31日与股票期权相关的信息:
与股票期权相关的信息一览表
| 继任者 | ||||||||||||||
| 未完成的期权 | 可行使的期权 | |||||||||||||
| 杰出的 | 加权平均 | 可操练 | ||||||||||||
| 锻炼 | 数量 | 余生 | 数量 | |||||||||||
| 价格 | 选项 | 以年为单位 | 选项 | |||||||||||
| $ | 176.05 | 18,952 | 3.1 | 18,952 | ||||||||||
| $ | 396.55 | 351 | 9.5 | 351 | ||||||||||
| $ | 405.30 | 20,819 | 6.3 | 20,819 | ||||||||||
| $ | 572.60 | 16,877 | 8.3 | 6,908 | ||||||||||
| 56,999 | 5.3 | 47,030 | ||||||||||||
| F-30 |
股票 认股权证
继承人2022年12月13日至2022年12月31日期间以及继承人截至2022年12月12日期间的授权活动 如下:
权证活动摘要
| 加权 | ||||||||||||||||
| 加权 | 平均值 | |||||||||||||||
| 平均值 | 剩余 | 集料 | ||||||||||||||
| 数量 | 锻炼 | 生命 | 固有的 | |||||||||||||
| 继任者 | 认股权证 | 价格 | 以年为单位 | 价值 | ||||||||||||
| 杰出,2022年12月13日 | 246,594 | $ | 376.11 | |||||||||||||
| 已发布 | - | - | ||||||||||||||
| 未清偿,2022年12月31日 | 246,594 | $ | 376.11 | 4.8 | $ | - | ||||||||||
| 可行使,2022年12月31日 | 244,598 | $ | 376.11 | 4.8 | $ | - | ||||||||||
| 加权 | ||||||||||||||||
| 加权 | 平均值 | |||||||||||||||
| 平均值 | 剩余 | 集料 | ||||||||||||||
| 数量 | 锻炼 | 生命 | 固有的 | |||||||||||||
| 前身 | 认股权证 | 价格 | 以年为单位 | 价值 | ||||||||||||
| 未偿还,2022年1月1日 | 2,154,352 | $ | 1.98 | |||||||||||||
| 已发布 | 6,406,210 | 1.37 | ||||||||||||||
| 已锻炼 | - | - | ||||||||||||||
| 杰出,2022年12月12日 | 8,560,562 | $ | 1.52 | 1.8 | $ | 59,681 | ||||||||||
| 可撤销,2022年12月12日 | 8,560,562 | $ | 1.55 | 3.9 | $ | 34,203 | ||||||||||
下表显示了截至2022年12月31日继任者的认股权证相关信息:
认股权证相关资料附表
| 继任者 | ||||||||||||||
| 未清偿认股权证 | 可行使的认股权证 | |||||||||||||
| 锻炼 | 杰出的 | 加权平均 | 可行使的数目 | |||||||||||
| 价格 | 数量 | 余生 | 认股权证 | |||||||||||
| $ | 176.05 | 2,994 | 2.0 | 998 | ||||||||||
| $ | 241.50 | 36,363 | 4.9 | 36,363 | ||||||||||
| $ | 402.50 | 197,985 | 4.9 | 197,985 | ||||||||||
| $ | 405.30 | 9,252 | 1.0 | 9,252 | ||||||||||
| 246,594 | 4.8 | 244,598 | ||||||||||||
截至2022年12月31日的后续认股权证包括以下内容:
| (a) | 可行使的 认股权证购买173,302股后续 普通股,这些普通股最初是由Larkspur向Larkspur的企业前合并首次公开募股和私募的参与者发行的(“Larkspur 认股权证”)。根据它们的条款,Larkspur认股权证(I)的行使价为每股后续普通股402.50美元;(Ii)由于业务合并的结束,其到期日延长至2027年12月12日;及(Iii)在本公司向认股权证持有人发出赎回通知前30个交易日结束的任何20个交易日内,继任普通股的收市价等于或超过每股630.00美元的情况下,本公司可按每份Larkspur认股权证0.35美元的价格,在至少30天的书面赎回通知下赎回。 |
| F-31 |
| (b) | 可行使的 认股权证购买24,671股后续普通股,由Larkspur的PIPE融资参与者 发行,该融资与业务合并同时结束,并以此为条件(见 附注11-股东永久和临时股权-后续A系列优先股融资)。根据其条款,管道认股权证(I)的行使价为每股后续普通股402.50美元; 和(Ii)的到期日为2027年12月12日。 | |
| (c) | 认股权证 购买48,561股后继普通股(“替代认股权证”) 于本公司于2022年12月12日本公司结束业务合并(见附注4-业务合并)时, 取代已发行的前置认股权证,购买8,560,561股前置普通股。根据后续权证可发行的股票数量是通过将根据每个前置权证发行的股份除以交易所 比率176.28来确定的。 后续权证的行权价格是通过将每个前置权证的行权价格乘以176.28的交换比率来确定的。 | |
| 替换认股权证包括:(A)购买36,340股后续普通股的可行使权证,行使价为每股241.50美元,到期日为2027年12月12日,取代A系列优先股持有人的前身在其前身A系列优先股 自动转换为前身普通股和前身A系列权证后发行的权证(见注11- 股东永久和临时股权-前身A系列优先股的自动转换);(B) 购买2,992股后续普通股,行使价为每股176.05美元,取代前身向战略合作伙伴发行的权证 (见附注10-承诺和或有-许可协议 -L&F Research LLC),其中购买997股的权证可行使至2025年1月6日左右到期,其余部分在实现某些里程碑时授予,并在实现该等里程碑后五年内到期;和(C)购买9,229股后续普通股的可行使权证,行使价为每股405.30美元,截止日期为2024年4月17日,取代前身 在签订许可协议时向某些可转换票据购买者、某些经纪商和战略合作伙伴发行的认股权证 (见附注10-承诺和或有-许可协议-InflamaCORE)。 |
附注 12-关联方交易
在2022年12月13日至2022年12月31日期间,继任者没有任何关联方交易。
在截至2022年12月12日和2021年12月31日的期间内,前任分别向作为公司部分所有者的投资银行家支付了0美元和50,000美元的经纪费。
在截至2022年12月12日和2021年12月12日的期间内,公司分别从公司管理团队成员、创始人和主要股东那里获得了0美元和3,150,000美元,用于购买2021年债券。有关2021年票据的进一步讨论,请参阅附注7--可转换应付票据 。
附注 13-后续事件
自财务报表发布之日起,公司已对后续事件进行了评估。根据评估,本公司并无发现任何已确认或未确认的后续事项需要在财务报表中作出调整或披露,但下述情况除外。
许可证 协议
于2023年2月28日,本公司与L律师事务所签署修订及重述协议,放弃L因未能支付1,500,000美元里程碑付款而终止许可协议或任何其他补救措施的权利,直至(A)2023年3月31日为止(B)就该等里程碑付款中的1,000,000美元(“豁免A”)及(B)2024年1月31日就500,000美元的里程碑付款(“放弃(Br)B”)。豁免A视乎(I)本公司宽免本金总额351,579美元,以及(Ii)本公司于2023年3月31日或之前向L律师事务所支付648,421美元现金。豁免B视情况而定 本公司于2024年1月31日或之前向L律师事务所支付500,000美元现金,及(Y)自本公司收到发行新股本所得款项净额至少30,000,000美元之日起计十个营业日。许可协议的所有其他 条款仍然有效。
2023年3月29日,本公司向L基金支付了648,421美元现金,从而满足了豁免A的条件,同时也具有取消应收票据和看跌期权的效果。
股票 期权授予
于2023年1月27日,本公司根据纳斯达克上市规则第5635(C)(4)条,向新任命的首席医疗官及医务部高级副总裁授予为期十年的购股权,以购买2,857股继任 普通股,作为进入本公司工作的诱因。这些股票期权在三年内每年授予一次,行权价为每股73.85美元。
2023年3月10日,公司根据2022年计划向公司员工授予了购买372股后续普通股的为期10年的股票期权。这些股票期权在三年内每年授予一次,行权价为每股79.10美元。在372股中,有143股是向公司一名高管的儿子发行的。
有效性失效
于2023年2月20日左右,本公司未能让美国证券交易委员会在PIPE证券购买协议(“PIPE证券购买协议”)规定的 期限内申报涵盖PIPE应登记证券的登记声明 生效(“生效失败”)。SPA使PIPE投资者有权在有效性失败之日收到相当于每位投资者购买价格1.5%的注册延迟付款,并在有效性失败持续后每隔30 天获得一次延迟付款。未能及时支付注册延迟付款将导致 按每月2.0%的利率计息。截至提交日期,公司预计必须支付两个月的注册延迟付款(总计约260,000美元),然后才能解决有效性故障。
附注 14-反向股票-普通股授权股份的拆分和增加
2023年12月4日,公司按35股1股的比例对普通股进行了反向拆分(“反向拆分”)。在反向拆分生效后,每35股已发行普通股重新分类并合并为一股普通股。此外,因行使本公司的股权奖励、可转换证券及认股权证而可发行的普通股股份按比例减少,而相应的行使价格则按比例增加。由于反向拆分,没有发行零碎股份。因此,此等财务报表及其附注所呈列所有期间的所有股份及每股 金额已追溯调整至后续期间(如适用),以反映各项未偿还股权奖励、可换股证券及认股权证的行使价的反向拆分及调整,犹如交易于呈列的最早期间开始时发生一样。
自2023年11月30日起,公司修改了公司注册证书,将公司股本的法定股数从111,000,000股增加到251,000,000股,普通股的法定股数从110,000,000股增加到250,000,000股。
| F-32 |
ZYVERSA THERAPEUTICS,INC.
精简的 合并资产负债表
| 继任者 | ||||||||
| 9月30日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| (未经审计) | ||||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金 | $ | 1,578,721 | $ | 5,902,199 | ||||
| 预付费用和其他流动资产 | 426,519 | 225,347 | ||||||
| 供应商保证金 | - | 235,000 | ||||||
| 流动资产总额 | 2,005,240 | 6,362,546 | ||||||
| 设备,网络 | 9,533 | 17,333 | ||||||
| 正在进行的研究和开发 | 30,806,158 | 100,086,329 | ||||||
| 商誉 | - | 11,895,033 | ||||||
| 保证金 | - | 46,659 | ||||||
| 经营性租赁使用权资产 | 31,078 | 98,371 | ||||||
| 总资产 | $ | 32,852,009 | $ | 118,506,271 | ||||
| 负债、临时权益和股东权益 | ||||||||
| 流动负债: | ||||||||
| 应付帐款 | $ | 8,897,534 | $ | 6,025,645 | ||||
| 应计费用和其他流动负债 | 2,775,485 | 2,053,559 | ||||||
| 经营租赁负债 | 34,349 | 108,756 | ||||||
| 流动负债总额 | 11,707,368 | 8,187,960 | ||||||
| 递延税项负债 | 1,440,982 | 10,323,983 | ||||||
| 总负债 | 13,148,350 | 18,511,943 | ||||||
| 承付款和或有事项(附注8) | - | - | ||||||
| 继任者 可赎回普通股,可能赎回,0 和1,880股已发行股票 分别截至2023年9月30日和2022年12月31日 | - | 331,331 | ||||||
| 股东权益: | ||||||||
| 后续优先股,面值0.0001美元,授权1,000,000股: A系列优先股,指定股8,635股,截至2023年9月30日和12月已发行和流通股50股和8,635股 分别为2022年31日 | - | 1 | ||||||
| B系列优先股,指定5,062股,发行5,062股和 截至2023年9月30日和2022年12月31日未偿还 | 1 | 1 | ||||||
| 后续普通股,0.0001美元 面值,110,000,000股 授权; 1,243,359和257,604 分别于2023年9月30日和2022年12月31日发行的股票和1,243,297 和257,604股已发行股票 分别截至2023年9月30日和2022年12月31日 | 123 | 26 | ||||||
| 追加实收资本 | 109,591,327 | 104,584,147 | ||||||
| 累计赤字 | (89,880,624 | ) | (4,921,178 | ) | ||||
| 国库券,按成本计算,62 9月且0股 分别于2023年30日和2022年12月31日 | (7,168 | ) | - | |||||
| 股东权益总额 | 19,703,659 | 99,662,997 | ||||||
| 负债、临时权益和股东权益合计 | $ | 32,852,009 | $ | 118,506,271 | ||||
附注是这些简明综合财务报表的组成部分。
| F-33 |
ZYVERSA THERAPEUTICS,INC.
精简的 合并业务报表
(未经审计)
| 继任者 | 前身 | 继任者 | 前身 | |||||||||||||
| 截至2023年9月30日的三个月内 | 截至以下三个月 2022年9月30日 | 在截至的9个月中 2023年9月30日 | 在截至的9个月中 2022年9月30日 | |||||||||||||
| 运营费用: | ||||||||||||||||
| 研发 | $ | 673,943 | $ | 2,334,120 | $ | 2,950,462 | $ | 4,120,477 | ||||||||
| 一般和行政 | 2,228,735 | 1,061,046 | 9,694,097 | 4,526,428 | ||||||||||||
| 正在进行的研究和开发的损害 | - | - | 69,280,171 | - | ||||||||||||
| 商誉减值 | - | - | 11,895,033 | - | ||||||||||||
| 总运营费用 | 2,902,678 | 3,395,166 | 93,819,763 | 8,646,905 | ||||||||||||
| 运营亏损 | (2,902,678 | ) | (3,395,166 | ) | (93,819,763 | ) | (8,646,905 | ) | ||||||||
| 其他(收入)支出: | ||||||||||||||||
| 利息(收入)支出 | 210 | 69,352 | (555 | ) | 377,820 | |||||||||||
| 衍生负债的公允价值变动 | - | 228,100 | - | 420,600 | ||||||||||||
| 税前净亏损 | (2,902,888 | ) | (3,692,618 | ) | (93,819,208 | ) | (9,445,325 | ) | ||||||||
| 所得税优惠 | 485 | - | 8,859,762 | - | ||||||||||||
| 净亏损 | (2,902,403 | ) | (3,692,618 | ) | (84,959,446 | ) | (9,445,325 | ) | ||||||||
| 优先股股东视为股息 | (32,373 | ) | (9,684,637 | ) | (7,948,209 | ) | (10,015,837 | ) | ||||||||
| 普通股股东应占净亏损 | $ | (2,934,776 | ) | $ | (13,377,255 | ) | $ | (92,907,655 | ) | $ | (19,461,162 | ) | ||||
| 每股净亏损 | ||||||||||||||||
| -基本版和稀释版 | $ | (3.32 | ) | $ | (0.55 | ) | $ | (167.59 | ) | $ | (0.81 | ) | ||||
| 已发行普通股加权平均数 | ||||||||||||||||
| -基本版和稀释版 | 885,101 | 24,167,257 | 554,372 | 24,167,257 | ||||||||||||
附注是这些简明综合财务报表的组成部分。
| F-34 |
ZYVERSA THERAPEUTICS,INC.
集中 股东权益变动综合报表(不足)
| 截至2023年9月30日的三个月和九个月 | ||||||||||||||||||||||||||||||||||||||||||||
| A系列 | B系列 | 其他内容 | 总计 | |||||||||||||||||||||||||||||||||||||||||
| 优先股 | 优先股 | 普通股 | 库存股 | 已缴费 | 累计 | 股东的 | ||||||||||||||||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 股票 | 金额 | 股票 | 金额 | 资本 | 赤字 | 权益 | ||||||||||||||||||||||||||||||||||
| 继任者 | ||||||||||||||||||||||||||||||||||||||||||||
| 余额-2023年1月1日 | 8,635 | $ | 1 | 5,062 | $ | 1 | 257,604 | $ | 26 | - | $ | - | $ | 104,584,147 | $ | (4,921,178 | ) | $ | 99,662,997 | |||||||||||||||||||||||||
| 重新分类以前可赎回的普通股 | - | - | - | - | 1,880 | - | - | - | 331,331 | - | 331,331 | |||||||||||||||||||||||||||||||||
| 根据供应商协议发行普通股 | - | - | - | - | 3,714 | - | - | - | 395,200 | - | 395,200 | |||||||||||||||||||||||||||||||||
| 与发行优先股相关的注册成本 | - | - | - | - | - | - | - | - | (34,674 | ) | - | (34,674 | ) | |||||||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | - | - | 287,461 | - | 287,461 | |||||||||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | - | (3,543,950 | ) | (3,543,950 | ) | |||||||||||||||||||||||||||||||
| 余额-2023年3月31日 | 8,635 | 1 | 5,062 | 1 | 263,198 | 26 | - | - | 105,563,465 | (8,465,128 | ) | 97,098,365 | ||||||||||||||||||||||||||||||||
| 登记发行普通股[1] | - | - | - | - | 314,729 | 31 | - | - | 9,830,988 | - | 9,831,019 | |||||||||||||||||||||||||||||||||
| 赎回A系列优先股 | (8,400 | ) | (1 | ) | - | - | - | - | - | - | (10,080,000 | ) | - | (10,080,001 | ) | |||||||||||||||||||||||||||||
| 将A系列优先股转换为普通股 | (35 | ) | - | - | - | 500 | - | - | - | - | - | - | ||||||||||||||||||||||||||||||||
| 作为延长禁售期代价而发行的股份 | - | - | - | - | 86,976 | 9 | - | - | 1,156,769 | - | 1,156,778 | |||||||||||||||||||||||||||||||||
| 根据供应商协议发行普通股 | - | - | - | - | 10,857 | 1 | - | - | 209,999 | - | 210,000 | |||||||||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | - | - | 365,742 | - | 365,742 | |||||||||||||||||||||||||||||||||
| 按成本价购入库存股 | - | - | - | - | - | - | (62 | ) | (7,168 | ) | - | - | (7,168 | ) | ||||||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | - | (78,513,093 | ) | (78,513,093 | ) | |||||||||||||||||||||||||||||||
| 余额-2023年6月30日 | 200 | - | 5,062 | 1 | 676,260 | 67 | (62 | ) | (7,168 | ) | 107,046,963 | (86,978,221 | ) | 20,061,642 | ||||||||||||||||||||||||||||||
| 登记发行普通股[2] | - | - | - | - | 93,030 | 9 | - | - | 1,575,929 | - | 1,575,938 | |||||||||||||||||||||||||||||||||
| 授权证修改 | - | - | - | - | - | - | - | - | 181,891 | - | 181,891 | |||||||||||||||||||||||||||||||||
| 赎回A系列优先股 | (150 | ) | - | - | - | - | - | - | - | (215,048 | ) | - | (215,048 | ) | ||||||||||||||||||||||||||||||
| 行使预先出资的认股权证 | - | - | - | - | 270,606 | 27 | - | - | 920 | - | 947 | |||||||||||||||||||||||||||||||||
| 认股权证诱导要约—行使收益 [3] | - | - | - | - | 203,463 | 20 | - | - | 757,627 | - | 757,647 | |||||||||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | - | - | 243,045 | - | 243,045 | |||||||||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | - | (2,902,403 | ) | (2,902,403 | ) | |||||||||||||||||||||||||||||||
| 余额-2023年9月30日 | 50 | $ | - | 5,062 | $ | 1 | 1,243,359 | $ | 123 | (62 | ) | $ | (7,168 | ) | $ | 109,591,327 | $ | (89,880,624 | ) | $ | 19,703,659 | |||||||||||||||||||||||
| 截至2022年9月30日的三个月和九个月 | ||||||||||||||||||||||||||||
| A系列 | 其他内容 | 总计 | ||||||||||||||||||||||||||
| 优先股 | 普通股 | 已缴费 | 累计 | 股东的 | ||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 资本 | 赤字 | 缺憾 | ||||||||||||||||||||||
| 前身 | ||||||||||||||||||||||||||||
| 余额-2022年1月1日 | - | $ | - | 24,167,257 | $ | 242 | $ | 40,065,109 | $ | (52,896,817 | ) | $ | (12,831,466 | ) | ||||||||||||||
| 以私募方式发行优先股[4] | 133,541 | 1 | - | - | 393,300 | - | 393,301 | |||||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | 1,941,746 | - | 1,941,746 | |||||||||||||||||||||
| 净亏损 | - | - | - | - | - | (3,748,495 | ) | (3,748,495 | ) | |||||||||||||||||||
| 余额-2022年3月31日 | 133,541 | 1 | 24,167,257 | 242 | 42,400,155 | (56,645,312 | ) | (14,244,914 | ) | |||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | 695,940 | - | 695,940 | |||||||||||||||||||||
| 净亏损 | - | - | - | - | - | (2,004,212 | ) | (2,004,212 | ) | |||||||||||||||||||
| 余额-2022年6月30日 | 133,541 | 1 | 24,167,257 | 242 | 43,096,095 | (58,649,524 | ) | (15,553,186 | ) | |||||||||||||||||||
| 以私募方式发行优先股[5] | 317,322 | 4 | - | - | 959,196 | - | 959,200 | |||||||||||||||||||||
| 将应付可转换票据和应计利息转换为优先 股票 | 1,802,193 | 18 | - | - | 5,658,870 | - | 5,658,888 | |||||||||||||||||||||
| 基于股票的薪酬: | - | - | - | - | 494,022 | - | 494,022 | |||||||||||||||||||||
| 净亏损 | - | - | - | - | - | (3,692,618 | ) | (3,692,618 | ) | |||||||||||||||||||
| 余额-2022年9月30日 | 2,253,056 | $ | 23 | 24,167,257 | $ | 242 | $ | 50,208,183 | $ | (62,342,142 | ) | $ | (12,133,694 | ) | ||||||||||||||
| [1] | 包括收益总额11,015,500美元减去发行成本1,184,482美元 |
| [2] | 包括总收益2,099,053美元,减去发行成本523,115美元 |
| [3] | 包括收益总额966,349美元,减去发行成本208,702美元 |
| [4] | 包括收益总额419,320美元,减去发行成本26,019美元 |
| [5] | 包括收益总额996,400美元,减去发行成本37,200美元 |
附注是这些简明综合财务报表的组成部分。
| F-35 |
ZYVERSA THERAPEUTICS,INC.
简明 合并现金流量表
| 继任者 | 前身 | |||||||
| 为九人而战 | 为九人而战 | |||||||
| 截至的月份 | 截至的月份 | |||||||
| 9月30日, | 9月30日, | |||||||
| 2023 | 2022 | |||||||
| 经营活动的现金流: | ||||||||
| 净亏损 | $ | (84,959,446 | ) | $ | (9,445,325 | ) | ||
| 对净亏损与经营活动中使用的现金净额进行的调整: | ||||||||
| 正在进行的研究和开发的损害 | 69,280,171 | - | ||||||
| 商誉减值 | 11,895,033 | - | ||||||
| 基于股票的薪酬 | 896,248 | 3,131,708 | ||||||
| 根据供应商协议发行普通股 | 605,200 | - | ||||||
| 作为延长禁售期代价而发行的股份 | 1,156,778 | - | ||||||
| 债务贴现摊销 | - | 39,492 | ||||||
| 衍生负债的公允价值变动 | - | 420,600 | ||||||
| 固定资产折旧 | 7,800 | 7,800 | ||||||
| 非现金租金费用 | 67,293 | - | ||||||
| 递延税项优惠 | (8,883,001 | ) | - | |||||
| 经营性资产和负债变动情况: | ||||||||
| 预付费用和其他流动资产 | (201,172 | ) | (57,366 | ) | ||||
| 保证金 | 46,659 | (1 | ) | |||||
| 供应商保证金 | 235,000 | 160,000 | ||||||
| 应付帐款 | 2,871,889 | 3,448,439 | ||||||
| 经营租赁负债 | (74,407 | ) | - | |||||
| 应计费用和其他流动负债 | 1,122,488 | 1,216,322 | ||||||
| 经营活动中使用的现金净额 | (5,933,467 | ) | (1,078,331 | ) | ||||
| 融资活动的现金流: | ||||||||
| 公开发行普通股所得款项 | 13,114,555 | - | ||||||
| 与普通股发行有关的登记和发行费用 | (1,763,584 | ) | - | |||||
| 赎回A系列优先股 | (10,695,610 | ) | - | |||||
| 私募发行优先股所得 | - | 1,415,720 | ||||||
| 购买库存股 | (7,168 | ) | - | |||||
| 行使预先出资的认股权证 | 947 | - | ||||||
| 认股权证诱导要约—行使收益 | 966,349 | - | ||||||
| 与优先股发行相关的注册和发行费用 | (5,500 | ) | (63,219 | ) | ||||
| 融资活动提供的现金净额 | 1,609,989 | 1,352,501 | ||||||
| 现金净(减)增 | (4,323,478 | ) | 274,170 | |||||
| 现金--期初 | 5,902,199 | 328,581 | ||||||
| 现金--期末 | $ | 1,578,721 | $ | 602,751 | ||||
| 现金流量信息的补充披露: | ||||||||
| 将可转换应付票据和应计利息转换为优先股 | $ | - | $ | 5,658,888 | ||||
| 重新分类以前可赎回的普通股 | $ | 331,331 | $ | - | ||||
| 采用ASC 842后ROU资产和租赁负债的确认 | $ | - | $ | 182,732 | ||||
| 延期发售费用的应付帐款 | $ | 44,892 | $ | 1,506,211 | ||||
| 权证修改-增量价值 | $ | 181,891 | $ | - | ||||
| 认股权证诱因要约-增值 | $ | 134,591 | $ | - | ||||
附注是这些简明综合财务报表的组成部分。
| F-36 |
ZYVERSA治疗公司 Inc.
简明合并财务报表附注
附注 1--业务组织、业务性质和列报依据
组织 和运营
Larkspur(“Larkspur”)是一家空白支票特殊用途收购公司,于2021年3月17日在特拉华州注册成立。2022年12月12日,Larkspur完成了与ZyVersa Treateutics,Inc.(前身)的业务合并(定义如下),该业务合并于2014年3月11日作为Variant PharmPharmticals,Inc.在佛罗里达州注册成立。根据业务合并协议(“业务合并协议”)的条款(以及在满足或放弃业务合并协议的所有其他条件的情况下),在完成业务合并和由此预期的交易(“业务合并”)的日期(“截止日期”),Larkspur(“新母公司”) 更名为ZyVersa Treateutics,Inc.,前身在与新母公司的一家子公司合并后更名为ZyVersa Treating,Inc.(“运营公司”),运营公司是尚存的实体,这导致它在特拉华州注册成立,并成为新母公司的全资子公司(统称为“继承人”)。 提及“公司”或“ZyVersa”是指截至2023年9月30日的三个月和九个月的继任者。以及截至2022年9月30日的三个月和九个月的前任。
ZyVersa 是一家临床阶段生物制药公司,利用专有技术为慢性肾脏或炎症性疾病患者开发一流的药物,这些患者具有高度未得到满足的医疗需求。该公司的使命是开发优化健康结果和提高患者生活质量的药物。
列报依据和合并原则
随附的未经审核简明综合财务报表乃根据美国中期财务资料公认会计准则(“美国公认会计原则”)编制。因此,它们不包括 美利坚合众国公认的年度财务报表所要求的所有信息和披露。管理层认为,该等报表包括为公平列报本公司截至2023年9月30日及截至2023年9月30日及截至2022年9月30日及截至2022年9月30日的9个月的未经审核简明综合财务报表所需的所有调整(只包括正常经常性项目) 。截至2023年9月30日的九个月的经营业绩并不一定代表全年的经营业绩。建议将这些未经审计的简明合并财务报表与公司于2023年3月31日提交给美国证券交易委员会(“美国证券交易委员会”)的截至2022年12月31日的10-K表格年度报告中包含的综合财务报表及其附注一并阅读。
随附的未经审核简明综合财务报表 来源于本公司及其合并子公司的会计记录。作为业务合并的结果,出于会计目的,Larkspur是收购方,前身是ZyVersa治疗公司,Inc.是被收购方和会计前身。因此,财务报表列报包括前身在2022年12月13日之前的财务报表和后继者在2022年12月13日及之后期间的财务报表,包括运营公司的合并。所有重大的公司间结余已在未经审计的简明综合财务报表中冲销。未经审计的简明综合财务报表是根据美国公认会计准则和美国证券交易委员会的会计规则和规定编制的。
2023年12月4日,公司 以1股普通股与35股已发行普通股的比例进行反向股票拆分。因此,此等财务报表及其附注所呈列的所有后续期间的所有股份及每股金额已追溯调整 ,以反映各项未偿还股权奖励、可换股证券及认股权证的行使价的反向拆分及调整,犹如交易已于呈列的最早期间开始时发生。
注 2-持续经营和管理层的计划
随附的简明综合财务报表以持续经营为基础编制,考虑正常业务过程中的资产变现和负债清偿。简明综合财务报表并不包括与资产金额的可收回及分类或负债分类有关的任何调整,而如本公司无法继续经营下去,则该等调整可能需要 。
截至2023年9月30日,公司的现金约为160万美元,营运资金赤字约为970万美元。 在截至2023年9月30日的9个月中,公司净亏损约8500万美元,运营中使用的现金约为590万美元。截至2023年9月30日,该公司的累计赤字约为8990万美元。
| F-37 |
公司尚未实现盈利,预计将继续从运营中产生现金外流。该公司将需要大量现金来完成其专有技术的开发,目前正在管理成本以维持现金。 预计其研发以及一般和管理费用将继续增加,因此,公司最终将需要产生大量产品收入来实现盈利。
因此,公司将被要求通过股权或债务融资筹集额外资金。管理层相信本公司可获得资本资源,并继续评估额外的融资机会;然而,不能保证本公司将 成功获得额外资本,或本公司将能够以商业上可接受的条款获得资金。 也不能保证本公司可能筹集的资金数额将使本公司消除营运资金 赤字、完成其发展计划或实现盈利运营。上述情况令人对公司是否有能力在这些财务报表发布之日起至少一年内继续经营下去产生极大的怀疑。
注 3 -重要会计政策摘要
自公司在截至2022年12月31日的2022年年报10-K表格中发布2022年12月31日财务报表以来,公司的重大会计政策没有发生重大变化。
使用预估的
根据美国公认会计原则编制财务报表要求管理层作出估计、判断和假设,以影响财务报表中报告的金额和财务报表相关附注中披露的金额。本公司的估计和判断基于历史经验和其认为在 情况下合理的各种其他假设。本公司资产负债表中列报的资产和负债额以及列报各期间的支出金额受估计和假设的影响,这些估计和假设用于但不限于股权证券、衍生负债、基于股份的薪酬和收购的无形资产的公允价值计算,以及确定递延税项资产的估值 准备。公司的某些估计可能会受到外部条件的影响,包括公司独有的情况和一般经济状况。实际结果有可能与这些估计值不同,这是合理的。
每股普通股净亏损
基本 每股普通股净亏损的计算方法为净亏损除以期间已发行的既有普通股的加权平均数。每股普通股摊薄净收入的计算方法是净收入除以每个期间已发行的普通股和稀释性普通股的加权平均数。
下表列出了未行使的潜在摊薄证券,这些证券已被排除在计算每股摊薄净亏损 之外,因为这样做会产生反摊薄效应:
反摊薄证券附表 不计入每股摊薄净亏损
| 继任者 | 前身 | |||||||
| 9月30日, | 9月30日, | |||||||
| 2023 | 2022 | |||||||
| 前身授权令 [1] | - | 8,699,397 | ||||||
| 继任权证[1] | 1,039,295 | - | ||||||
| 前置任务选项 | - | 10,039,348 | ||||||
| 继任者选项 | 101,695 | - | ||||||
| 继任者系列A可转换优先股 | 714 | - | ||||||
| 继任者B系列可转换优先股 | 20,664 | - | ||||||
| 前身A系列可转换优先股 | - | 5,945,045 | ||||||
| 前身可转换应付票据[2] | - | 2,977,528 | ||||||
| 潜在稀释股份总数 | 1,162,368 | 27,661,318 | ||||||
| [1] | 作为InflamaCORE,LLC许可协议的一部分,购买600,000股前置普通股或3,404股后继普通股的认股权证将在满足某些里程碑后发行 ,因此不包括在当前报告的金额中。 有关详细信息,请参阅注8-承诺和或有-许可协议。 |
| [2] | 公司的可转换应付票据内含转换选项,可在某些符合条件的交易完成后自动发行普通股 。转换价格是与符合条件的交易相关联的隐含普通股价格的函数。为了披露上表中的潜在稀释证券,我们使用了符合条件的交易发生且隐含普通股价格等于截至2022年9月30日的普通股公允价值每股67.90美元的情况下可发行的普通股数量。 |
| F-38 |
分部 报告
公司将其业务作为一个可报告和经营分部进行经营和管理。所有资产和运营均在美国。公司的 首席执行官(即首席运营决策者)以汇总的方式审查财务信息,以 分配资源和评估财务业绩。
注 4-业务合并、商誉和正在进行的研究与开发
2022年12月12日,Larkspur完成了与ZyVersa Treateutics,Inc.的业务合并(见注1-业务组织, 运营性质和陈述基础)。本公司将业务合并作为经营公司的远期收购入账,因为已确定经营公司于业务合并日期为可变权益实体。新母公司被确定为主要受益人,因为它的所有权赋予了指导运营公司活动的权力和承担运营公司的损失和/或接受运营公司利益的义务。
考虑到 Larkspur作为SPAC的活动的非经常性性质,合并Larkspur和运营公司业务合并前结果 的备考财务数据将没有意义,因此未呈列。
采购 价格分配
业务合并采用收购会计方法入账,初始收购价格分配基于 公司对收购对价的公允价值的初步评估,以及经营公司于收购日收购的有形和无形资产及承担的负债的公允价值。截至2022年12月31日,由于收购日期临近日历年末,采购价格分配 尚未完成。
截至2023年6月30日,收购对价的收购日期公允价值的初步估计和收购价格分配的初步估计已得到确认,不需要测算期调整,并被视为最终估计。收购日期 购买对价要素的公允价值是采用市场法估计的,对于继任者普通股的公允价值,采用1级投入(可观察投入) ,对于归属于继任权证和期权的公允价值,采用3级投入(不可观察投入)。根据业务合并协议,收购方有责任取代营运公司现有的 认股权证及期权。因此,有必要在购买对价(合并前服务的公允价值)和合并后服务的补偿之间分配 替代权证和期权的公允价值。可归因于合并后服务的替代认股权证和期权的公允价值分别为584 260美元和1 731 237美元。
收购代价于收购日期公允价值的最终估计如下:
购买对价公允价值附表
| 继承人普通股 | $ | 67,197,300 | ||
| 继承权证 | 12,190,015 | |||
| 继任者选项 | 11,864,556 | |||
| 购买代价的公允价值总额 | $ | 91,251,871 |
| F-39 |
收购资产和假设负债的最终收购日期公允价值(见下表)由管理层在专门负责正在进行的研究和开发(“IPR&D”)的第三方估值专家的协助下确定。 IPR&D资产的估计公允价值是使用“收益法”确定的,这是一种估值技术 ,根据市场参与者对资产在其剩余使用寿命内使用第三级投入将产生的现金流的预期,提供对资产公允价值的估计。估值中使用的一些更重要的假设包括:每项资产每年的估计净现金流、衡量未来现金流固有风险所需的适当贴现率、每项资产的生命周期、潜在的监管和商业成功风险、净销售额的特许权使用费,以及其他 因素。存在与这些因素相关的固有不确定性以及管理层在应用这些因素以得出估计公允价值时的判断。收购价格超出收购的可识别净资产估计公允价值的部分记为商誉,管理层认为这是由于集合的劳动力和其他不符合单独确认资格的无形资产所致。
收购的可识别净资产估计公允价值附表 记为商誉
| 流动资产,包括现金699 324美元 | $ | 1,093,223 | ||
| 正在进行的研究和开发 | 100,086,329 | |||
| 商誉 | 11,895,033 | |||
| 其他非流动资产 | 64,523 | |||
| 收购的总资产 | 113,139,108 | |||
| 流动负债 | 10,818,204 | |||
| 递延税项负债 | 11,069,033 | |||
| 承担的负债总额 | 21,887,237 | |||
| 取得的净资产 | $ | 91,251,871 |
在完成或放弃研究和开发工作之前,为账面目的记录的知识产权和开发 被视为一种无限期无形资产。由于该收购是以股票销售为结构,因此知识产权和开发和商誉没有任何税基 ,因此不能就税务目的进行扣减。
减损
虽然管理层没有发现与其知识产权研发资产相关的任何不利发展,但管理层确实确定,由于公司市值大幅持续下降,公司单一报告单位的公允价值更有可能低于其账面价值。因此,有必要从2023年6月30日起进行中期减值测试。
本公司的公允价值乃采用收益法厘定。收益法是以未来现金流量的现值为基础的,这些现金流量是根据财务预测得出的,需要作出重大假设和判断,包括每项资产每年的估计净现金流量、衡量未来现金流量固有风险所需的适当贴现率、每项资产的生命周期、潜在的监管和商业成功风险、净销售额的特许权使用费以及其他因素。由此产生的估计公允价值与本公司的市值进行了核对。
对账包括2023年6月30日估计的隐含控制权溢价,该溢价比公司市值高出约100%。
| F-40 |
本公司的商誉和知识产权研发公允价值合计(由本公司的贴现现金流量计算所示) 与本公司的综合公允价值(如本公司的市值所示)进行比较,以评估本公司计算的合理性。本公司确定投资者将为控制头寸支付的合理控制溢价包括以下几个因素:
| ● | 市场 控制溢价。识别可比同行收购交易的近期公开市场信息。可比同行收购交易的选择受到判断和不确定性的影响。 | |
| ● | 影响 低公众持股量和有限的市值交易活动:公司普通股的很大一部分 由集中的投资者拥有。公司普通股的公众持股量,按百分比计算 由公众投资者自由交易的普通股除以公司的流通股总数,显著低于 比公司上市的同行根据公司对第三方市场数据的评估,我们认为 由于公众持股量较低,交易量有限,存在影响公司股价的内在折扣,因此 影响公司的市值。 |
根据该公司的分析,2023年6月30日,该公司对其1,190万美元的声誉进行了全额减损,并记录了 对其其他无限寿命无形资产(即IPR & D)的6,930万美元的减损费用。
公司确定,截至2023年9月30日,不存在任何新事件或情况表明IPR & D的公允价值已降至低于其公允价值的情况,并打算自2023年10月1日起进行年度减损测试。
注 5 -应计费用和其他流动负债
截至2023年9月30日和2022年12月31日,应计 费用和其他流动负债包括以下内容:
应计费用和其他流动负债明细表
| 9月30日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| L & F里程碑付款责任 | $ | 500,000 | $ | 1,500,000 | ||||
| L & F票据 [1] | - | (351,579 | ) | |||||
| L & F,净额 | 500,000 | 1,148,421 | ||||||
| 应计薪金 | 894,416 | 584,226 | ||||||
| 其他应计费用 | 31,969 | 214,229 | ||||||
| 应付联邦所得税 | 129,922 | 106,683 | ||||||
| 奖金应计 | 1,212,359 | - | ||||||
| 注册延误责任 [2] | 6,819 | - | ||||||
| 应计费用和其他流动负债总额 | $ | 2,775,485 | $ | 2,053,559 | ||||
| [1] | 请参阅 注8 -“承诺和意外情况”了解L & F注释豁免的详细信息。 |
| [2] | 请参阅 注9 -“股东永久和临时权益”,了解登记延迟责任的详细信息。 |
注 6 -衍生品负债
截至2022年1月1日,本公司拥有按发行时公允价值计量的3级衍生债务,与某些可转换票据的赎回 特征和认沽期权有关。赎回功能使用贴现现金流和布莱克-斯科尔斯估值技术相结合的方式进行估值。截至2023年9月30日或2022年12月31日,没有衍生品负债。
在截至2022年9月30日的三个月和九个月内,前身分别记录了衍生工具负债的公允价值变动亏损228,100美元和420,000美元。
| F-41 |
附注 7--所得税
截至2023年、2023年及2022年9月30日止九个月的税项拨备乃根据适用于各应课税司法管辖区的估计实际税率计算。本公司的税率将根据需要接受管理层的季度审查和修订。截至2023年9月30日及2022年9月30日止九个月,本公司的实际税率分别为9.44%及0%。 季度税率上升主要是由于其估值津贴的变动所致。截至2022年9月30日,由于历史和预计亏损,公司 记录了全额估值备抵。截至2022年12月31日,本公司记录了一项重大的递延税项负债,该负债是于2022年12月12日与业务合并相关设立的,这是实现其递延税项净资产的未来应纳税所得额的来源。于截至2023年9月30日止九个月内,本公司录得与递延税项负债相关的资产减值,以减少递延税项负债。因此,截至2023年9月30日的9个月的有效税率为9.44%,主要是由于对递延纳税净负债的调整。
附注 8--承付款和或有事项
诉讼、索赔和评估
在正常业务过程中,公司可能会参与法律诉讼、索赔和评估。当评估为可能发生损失且损失金额可合理估计时,公司记录因此类索赔而产生的或有负债(如果有的话)。
许可证 协议
L & F Research LLC
公司与L研究有限责任公司(“L研究”)订立经修订 许可协议(下称“L许可协议”),自2015年12月15日起生效。根据该协议,L于2023年2月28日授予吾等一项于VAR 200的专利及知识产权及专有技术许可,以治疗、抑制或预防人类的肾脏疾病及其症状,包括局灶性节段性肾小球硬化。本公司与L律师事务所签订了《修订及重述协议》,放弃L律师事务所因未能支付第一笔里程碑付款而终止L许可证协议或任何其他补救措施的权利,直至:(A)2023年3月31日就该等里程碑付款中的1,000,000美元(“放弃A”)及(B)2024年1月31日就500,000美元的里程碑付款(“放弃B”)。 放弃A取决于(I)本公司对某一可转换票据项下未偿还的本金总额351,579美元的宽免。及(Ii)本公司于2023年3月31日或之前向L基金支付648,421美元现金。豁免B视情况而定 本公司于2024年1月31日或之前向L律师事务所支付500,000美元现金,及(Y)自本公司收到发行新股本所得款项净额至少30,000,000美元之日起计十个营业日。L&F许可证的所有 其他条款仍然有效。
于2023年3月29日,本公司免除了某票据的本金总额351,579美元,并向L基金支付了648,421美元现金,从而满足了豁免A的条件 L的认沽期权在满足豁免A的条件后到期,从而将1,880股普通股和331,331美元的临时股权重新分类为永久股权。
运营 租约
于2019年1月18日,前任签订了一份位于佛罗里达州韦斯顿的约3,500平方英尺办公空间的租赁协议 ,租期为五年。根据租赁协议,第一年的年度基本租金(不包括前任应承担的税项和运营成本)约为89,000美元,此后每年上涨约3%,总基本租金约为497,000美元。
继任者分别就截至2023年9月30日止三个月及九个月的经营租赁确认了38,885美元及116,083美元的使用权资产摊销,而前身则分别就截至2022年9月30日止三个月及九个月的经营租赁确认租金支出42,225美元及118,519美元。
| F-42 |
本公司的使用权资产和负债摘要如下:
使用权资产及负债一览表
| 财务名称、前身和继任者[固定列表] | 继任者 | 前身 | ||||||
| 为九人而战 | 为九人而战 | |||||||
| 截至的月份 | 截至的月份 | |||||||
| 9月30日, | 9月30日, | |||||||
| 2023 | 2022 | |||||||
| 为计量租赁负债所包括的金额支付的现金: | ||||||||
| 经营活动中使用的经营现金流量 | $ | 74,405 | $ | 67,567 | ||||
| 以租赁义务换取的使用权资产 | ||||||||
| 经营租约 | $ | - | $ | - | ||||
| 加权平均剩余租期 | ||||||||
| 经营租约 | 0.34年 | 1.34年 | ||||||
| 加权平均贴现率 | ||||||||
| 经营租约 | 6.5 | % | 6.5 | % | ||||
根据这些经营租赁协议,未来 最低付款额如下:
租赁项下未来最低付款计划
| 金额 | ||||
| 2023年10月1日至2023年12月31日 | $ | 34,822 | ||
| 减去:代表推定利息的金额 | (472 | ) | ||
| 总计 | $ | 34,349 | ||
附注 9--股东的永久和临时股权
普通股 股票
2023年6月5日,本公司以私募方式向某些投资者(包括本公司保荐人的某些成员)发行了86,976股普通股,价值120万美元,以换取该等投资者持有的总计56,507股普通股作为该等投资者所持本公司所有证券的锁定期延长至2023年7月31日。已发行普通股的公允价值1,156,778美元在截至2023年9月30日的9个月的营业报表中记录在一般和行政费用中。
在截至2023年9月30日的9个月内,本公司与两家供应商签订了投资者营销协议,其中本公司 发行了总计14,571股普通股和现金以换取营销服务 。普通股的公允价值605,200美元被确定为预付费用,公司正在根据合同条款确认这笔费用。
| F-43 |
股权 产品
于2023年4月28日,本公司完成发售314,729股普通股及认股权证,以1,100万美元的总收益 购买314,729股普通股(“登记发售”)。 每股普通股连同一份五年期认股权证一并出售,认股权证可于发行时按每股35.00美元的行使价购买一股普通股。 本公司决定认股权证应按股权分类,主要是因为该认股权证与本公司本身的股票挂钩,并符合股权分类的要求。因此,由于普通股和权证都是按股权分类的, 没有必要将收益或发行成本分配给各自的证券。总发行成本为1,184,482美元,包括配售费用440,620美元,法律费用455,332美元,与此次发行相关的会计和专业服务成本259,774美元,以及其他成本28,756美元。
于2023年7月26日,本公司完成公开发售93,030股普通股、预资金权证(“预资金权证”),以购买270,606股普通股及普通权证(“2023年7月认股权证”),以每股5.78美元的合并公开发行价购买363,636股普通股,总收益210万美元(“2023年7月发售”)。 预资金权证可即时行使,可随时行使,直至所有预资资权证全部行使为止。 ,行权价为每股0.0035美元。2023年7月的认股权证可立即行使,行使期为五年 ,行使价为每股5.78美元。本公司决定这两份认股权证应按股权分类,主要是因为它们与本公司本身的股票挂钩,并且符合股权分类的要求 。因此,由于普通股和两种权证都是按股权分类的,因此没有必要将收益或发行成本分配给各自的证券。总发行成本为523,115美元,包括125,943美元的配售费用、236,091美元的法律费用、87,037美元的会计和专业服务成本 、26,744美元的其他成本以及与原始认股权证相比的47,300美元的增额认股权证公允价值(见下文认股权证)。
赎回A系列优先股
在2023年4月28日左右,注册发行的现金收益1,050万美元用于赎回8,400股A系列优先股。优先股清偿损失的会计处理方式与对优先股支付股息的处理方式类似。清偿损失按(A)转让给A系列优先股持有人的1,050万美元现金的公允价值(这也解决了公司支付溢价和有效性失败付款的义务)与(B)A系列优先股的380万美元账面净额之间的差额计算。因此,赎回导致在计算公司每股普通股亏损时确认670万美元的视为股息 。由于公司有累计亏损,与股息相关的借方和贷方都是额外的实收资本,因此不存在资产负债表效应。
于2023年8月3日,本公司与一名投资者订立赎回协议并发放股份,导致本公司于2023年8月4日赎回A系列剩余200股可转换优先股及认股权证中的150股,按行使价每股70.00美元购买2,464股普通股,现金支付230,000美元。 本公司于截至2023年9月30日的三个月内确认了84,315美元的股息,这是与赎回相关的会计清偿所致。
触发下一轮拨备
作为登记发行的结果,(A)A系列认股权证的行权价以每股402.50美元的行权价购买24,671股普通股, 在原始管道融资中向参与者发行的行权证的行权价重置为每股70美元的底价,同时可以行使141,861股普通股(这导致 确认了140万美元的视为股息);(B)A系列优先股其余235股的原始转换价格重置为每股普通股350.00美元的下限 转换价格为每股普通股70.00美元(这导致 确认了37,000美元的股息);以及(C)与企业合并有关而发行的5,062股B系列优先股的原始转换价格重置为每股普通股245.00美元的底价(这导致 确认了100,000美元的视为股息)。
| F-44 |
转换A系列优先股
在触发下一轮条款后,A系列优先股35股的持有者以每股70.00美元的新转换价格将 转换为500股普通股。
临时股权
关于2023年3月29日临时股本转为永久股本的讨论,见 附注8--“承付款和或有事项”。
基于股票的薪酬
在截至2023年9月30日的三个月中,继任者记录了243,045美元的基于股票的薪酬支出(其中,(38,224美元)包括在研发中,281,269美元包括在一般和行政费用中),与向员工和顾问发放的期权有关。在截至2022年9月30日的三个月里,前身记录的基于股票的薪酬支出为494,022美元(其中67,608美元包括在研发中,426,414美元包括在一般和行政费用中),与向员工和顾问发放的期权有关。
在截至2023年9月30日的9个月中,继任者记录的股票薪酬支出为896,249美元(其中117,320美元包括在研发中,778,929美元包括在一般和行政费用中),与向员工和顾问发放的期权有关。在截至2022年9月30日的9个月中,前身记录的基于股票的薪酬支出为3,131,708美元(其中619,363美元包括在研发中,2,512,345美元包括在一般和行政费用中),与向员工和顾问发放的期权有关。截至2023年9月30日,有1,324,176美元未确认的基于股票的薪酬 费用,公司预计将在1.7年的加权平均期间确认这笔费用。
股票 期权
2023年1月27日,本公司根据纳斯达克上市规则 2022年综合股权激励计划(“2022计划”)第5635(C)(4)条,向新任命的首席医疗官 和医务部高级副总裁授予为期十年的 购股权,购买2,858股后续普通股,授予日合计价值184,426美元,作为进入本公司工作的激励。股票期权在三年内每年授予,行权价为每股73.85美元。
2023年3月10日,公司根据2022年计划,授予公司员工购买372股后续普通股的为期10年的股票期权 。这些股票期权的授予日总价值为23,770美元,在三年内每年授予,行权价为每股79.10美元。在372股中,有143股是向公司一名高管的儿子发行的。
2023年5月24日,公司根据2022年计划向公司员工和董事授予了为期十年的股票期权,购买了41,523股后续普通股。股票期权的授予日总价值为555,004美元,其中499,660美元在三年内每年授予,55,344美元立即授予,行使价 为每股15.40美元。
在截至2023年9月30日和2022年9月30日的三个月和九个月期间授予的股票期权的授予日期公允价值是使用布莱克·斯科尔斯方法确定的,并使用了以下假设:
已授予的股票期权日程表
| 继任者 | 前身 | 继任者 | 前身 | |||||||||||||
| 对于三个人来说 | 对于三个人来说 | 为九人而战 | 为九人而战 | |||||||||||||
| 截至的月份 | 截至的月份 | 截至的月份 | 截至的月份 | |||||||||||||
| 9月30日, | 9月30日, | 9月30日, | 9月30日, | |||||||||||||
| 2023 | 2022 | 2023 | 2022 | |||||||||||||
| 授予日期普通股的公允价值 | 不适用 | 不适用 | $ | 15.26 - $78.05 | $ | 2.27 - $3.00 | ||||||||||
| 无风险利率 | 不适用 | 不适用 | 3.53% - 4.27 | % | 1.68% - 3.01 | % | ||||||||||
| 预期期限(年) | 不适用 | 不适用 | 6.00 | 3.53 - 6.00 | ||||||||||||
| 预期波动率 | 不适用 | 不适用 | 120% - 123 | % | 111% - 119 | % | ||||||||||
| 预期股息 | 不适用 | 不适用 | 0.00 | % | 0.00 | % | ||||||||||
| F-45 |
截至2023年9月30日止九个月的期权活动摘要如下:
股票期权活动时间表
| 加权 | |||||||||||||||
| 加权 | 平均值 | ||||||||||||||
| 平均值 | 剩余 | 集料 | |||||||||||||
| 数量 | 锻炼 | 生命 | 固有的 | ||||||||||||
| 选项 | 价格 | 以年为单位 | 价值 | ||||||||||||
| 未偿还,2023年1月1日 | 56,999 | $ | 366.29 | ||||||||||||
| 授与 | 44,753 | 19.52 | |||||||||||||
| 已锻炼 | - | - | |||||||||||||
| 被没收 | - | - | |||||||||||||
| 未完成,2023年9月30日 | 101,752 | $ | 220.65 | 6.6 | $ | - | |||||||||
| 可行使,2023年9月30日 | 56,284 | $ | 333.65 | 5.2 | $ | - | |||||||||
下表列出了截至2023年9月30日与股票期权相关的信息:
与股票期权相关的信息一览表
| 未完成的期权 | 可行使的期权 | |||||||||||||
| 加权 | ||||||||||||||
| 杰出的 | 平均值 | 可操练 | ||||||||||||
| 锻炼 | 数量 | 余生 | 数量 | |||||||||||
| 价格 | 选项 | 以年为单位 | 选项 | |||||||||||
| $ | 15.25 | 41,523 | 10 | 4,286 | ||||||||||
| $ | 73.85 | 2,858 | - | - | ||||||||||
| $ | 79.10 | 372 | - | - | ||||||||||
| $ | 176.05 | 18,952 | 2.3 | 18,952 | ||||||||||
| $ | 396.55 | 351 | 8.8 | 351 | ||||||||||
| $ | 405.30 | 20,819 | 5.5 | 20,819 | ||||||||||
| $ | 572.60 | 16,877 | 7.7 | 11,876 | ||||||||||
| 101,752 | 5.2 | 56,284 | ||||||||||||
| F-46 |
股票 认股权证
2023年7月26日,关于2023年7月的发行(见上文股权发行),本公司将向三名投资者购买39,373股普通股的若干 认股权证的行使价从每股35.00美元修订为5.78美元,到期日从2028年4月28日修订为2028年7月28日。与原始认股权证相比,经修改的权证的公允价值增加47,300美元,确认为2023年7月发行的额外发行成本。
2023年8月2日、8月8日和9月8日,2023年8月2日、8月8日和9月8日,一名发行股票的投资者行使了预融资权证,以每股0.0035美元的行使价购买了270,607股普通股,总收益为947美元。
在2023年9月13日至2023年9月18日期间,本公司启动了一项有限时间计划,在权证持有人的选择下, 将允许他们以每股4.75美元的降价行使2023年7月的权证,他们还将获得 新的5.5年权证,以每股4.75美元的行权价购买同等数量的 普通股。新认股权证在前六个月内不可行使 。根据该计划,2023年9月14日,以966,400美元的总收益减去208,702美元的总发行成本,行使了总计203,464股普通股的认股权证。 发行成本包括配售代理费57,980美元, 法律费用16,131美元, 和权证修改成本134,591美元。 由于修改是短期激励,因此只对根据该计划实际执行的权证进行修改会计处理。本公司确认经修订的权证及增发的权证较原来的权证于修改日期增加134,591美元,作为行使认股权证的发行成本。
在截至2023年9月30日和2022年9月30日的三个月和九个月期间发行的认股权证的发行日期公允价值是使用布莱克·斯科尔斯方法确定的,并使用了以下假设:
已授出认股权证公允价值附表{br
| 继任者 | 前身 | 继任者 | 前身 | |||||||||||||
| 对于三个人来说 | 对于三个人来说 | 为九人而战 | 为九人而战 | |||||||||||||
| 截至的月份 | 截至的月份 | 截至 | 截至 | |||||||||||||
| 2023年9月30日 | 2022年9月30日 | 2023年9月30日 | 2022年9月30日 | |||||||||||||
| 授予日期普通股的公允价值 | $ | 4.90 - $5.95 | 不适用 | $4.90 - $35.00 | 不适用 | |||||||||||
| 无风险利率 | 4.09% - 4.42 | % | 不适用 | 3.51% - 4.42 | % | 不适用 | ||||||||||
| 预期期限(年) | 4.9-5.5年 | 不适用 | 5年 | 不适用 | ||||||||||||
| 预期波动率 | 121 % - 123 | % | 不适用 | 121% - 123 | % | 不适用 | ||||||||||
| 预期股息 | 不适用 | 不适用 | 不适用 | 不适用 |
| F-47 |
截至2023年9月30日止九个月的认购证活动摘要如下:
权证活动摘要
| 加权 | ||||||||||||||||
| 加权 | 平均值 | |||||||||||||||
| 平均值 | 剩余 | 集料 | ||||||||||||||
| 数量 | 锻炼 | 生命 | 固有的 | |||||||||||||
| 认股权证 | 价格 | 以年为单位 | 价值 | |||||||||||||
| 未偿还,2023年1月1日 | 246,594 | $ | 376.11 | |||||||||||||
| 已发布 | 1,152,467 | 13.58 | ||||||||||||||
| 已锻炼 | (474,071 | ) | 5.33 | |||||||||||||
| 被没收 | (2,796 | ) | 109.69 | |||||||||||||
| 重新定价—旧 [1] | (24,672 | ) | 402.50 | |||||||||||||
| 重新定价—新 [1] | 141,868 | 70.00 | ||||||||||||||
| 重新定价—旧 [2] | (39,372 | ) | 35.00 | |||||||||||||
| 重新定价—新 [2] | 39,372 | 5.78 | ||||||||||||||
| 重新定价—旧 [3] | (203,464 | ) | 5.78 | |||||||||||||
| 重新定价—新 [3] | 203,464 | 4.75 | ||||||||||||||
| 未完成,2023年9月30日 | 1,039,384 | $ | 100.25 | 4.6 | $ | - | ||||||||||
| 可行使,2023年9月30日 | 832,690 | $ | 123.37 | 4.4 | $ | - | ||||||||||
| [1] | 逮捕令 代表将购买24,671股普通股的PIPE令的行使价重置至底价 每股70.00美元。 |
| [2] | 权证 代表将2023年4月28日发行的认股权证购买39,371股普通股的行使价重新设定为每股5.79美元的价格。 |
| [3] | 权证 代表将2023年7月26日发行的某些认股权证购买203,463股普通股的行使价重新设定为每股4.75美元。 |
| F-48 |
下表显示了截至2023年9月30日的认股权证相关信息:
认股权证相关资料附表
| 未清偿认股权证 | 可行使的认股权证 | |||||||||||||
| 杰出的 | 加权平均 | 可操练 | ||||||||||||
| 锻炼 | 数量 | 余生 | 数量 | |||||||||||
| 价格 | 认股权证 | 以年为单位 | 认股权证 | |||||||||||
| $ | 4.75 | 203,464 | 不适用 | - | ||||||||||
| $ | 5.78 | 199,555 | 4.8 | 199,555 | ||||||||||
| $ | 35.00 | 275,378 | 4.6 | 275,378 | ||||||||||
| $ | 70.00 | 139,403 | 4.2 | 139,403 | ||||||||||
| $ | 176.05 | 2,994 | 1.3 | 998 | ||||||||||
| $ | 241.50 | 36,363 | 4.2 | 36,363 | ||||||||||
| $ | 402.50 | 173,306 | 4.2 | 173,306 | ||||||||||
| $ | 405.30 | 8,921 | 0.2 | 8,921 | ||||||||||
| 1,039,384 | 4.4 | 833,924 | ||||||||||||
有效性 失败
在业务合并方面,根据日期为2022年7月20日的认购协议(统称为“管道认购协议”),本公司根据日期为2022年7月20日的认购协议,发行了8,635股A系列可换股优先股 (“管道股份”)及普通股认股权证(每股为“管道认购权证”),按每股35,000美元的收购价及认股权证购买24,671股普通股,总认购价为8,635,000美元(“管道投资”)。于2023年2月20日左右,本公司未能让美国证券交易委员会在PIPE证券购买协议(“PIPE证券购买协议”)规定的时间内宣布涵盖 私募股权投资(“PIPE”)应注册证券的注册声明生效(“生效失败”)。SPA使PIPE投资者有权在有效性失败之日收到相当于每个投资者购买价格1.5% 的注册延迟付款(“注册延迟付款”),并在有效性 失败持续后每隔30天获得一次注册延迟付款。未能及时支付注册延迟付款将导致每月按 2.0% 的利率计息。2023年4月28日,登记发行所得资金用于赎回几乎所有的PIPE股票。(请参阅上文 赎回A系列优先股。)截至本文件的提交日期,公司预计在2023年9月30日之后、在修复生效失败之前,必须额外支付总计约6819美元的注册延迟付款
注 10-后续事件
2023年9月8日,公司董事会批准了经股东于2023年10月31日批准的2022年综合股权激励计划(“A&R计划”)。重述的计划将公司预留供发行的普通股数量增加114,286股,达到155,803股。
2023年12月4日,本公司按35股1股的比例对其普通股进行了 股反向拆分(“反向拆分”)。在反向拆分生效后,每35股已发行普通股重新分类并合并为一股普通股。此外,因行使本公司的股权奖励、可转换证券及认股权证而可发行的普通股股份按比例减少,而相应的行使价格按比例增加。没有因反向拆分而发行任何零碎股份。因此,此等财务报表及其附注所呈列的所有后继期的所有股份及每股金额已追溯调整(如适用),以反映各项未偿还股权奖励、可转换证券及认股权证的反向拆分及 行使价调整,犹如交易已于呈列的最早期间开始时发生。
自2023年11月30日起,公司修订了公司注册证书,将公司股本的法定股数从111,000,000股增加到251,000,000股,普通股的法定股数从110,000,000股增加到250,000,000股。
| F-49 |
400,000股普通股
购买最多3600,000股普通股的预融资认股权证
A系列普通股认股权证最多购买400万股普通股
B系列普通股认股权证将购买最多400万股普通股
800万股普通股作为普通权证的基础
3,600,000股普通股 预筹资金认股权证

招股说明书
Sole 安置代理
AGP。
2023年12月6日