
纳斯达克公司介绍:ZNTL 2023 年 11 月附录 99.2

2 前瞻性声明和免责声明Zentalis Pharmicals, Inc.(“我们”、“我们的”、“Zentalis” 或 “公司”)警告说,本演示文稿(包括本演示附带的口头评论)包含1995年《美国私人证券诉讼改革法》所指的前瞻性陈述。本演示文稿中所有与历史事实无关的陈述均应被视为前瞻性陈述,包括但不限于关于azenosertib(Zn-C3)成为同类首创和同类最佳的可能性;azenosertib的特许经营潜力;azenosertib对各种肿瘤类型的潜在适用性,包括与分子靶向药物联合使用的陈述;提交我们的第一种新药的可能时机 azenosertib 的申请;azenosertib 有可能产生实际影响针对患者;我们的执行定位;我们预计的现金流;我们对候选产品的开发方法;计划对候选产品进行临床试验,包括我们在铂敏感性卵巢癌中使用azenosertib的战略;我们生成注册数据的潜力;azenosertib在解决各种肿瘤类型的大量未满足需求方面的潜力;注册研究的可能性;潜在的注册途径;潜力以及azenosertib是否适合治疗高浓度肿瘤基因组不稳定;azenosertib有机会在同源修复能力强的铂敏感性卵巢癌中进行一线维护;azenosertib有机会在铂耐药性卵巢癌中获得单一疗法的批准;我们的azenosertib开发战略,包括在铂敏感性卵巢癌中;azenosertib有可能在一线维持环境中为最多的卵巢癌患者提供长期益处;CCNE1 扩增和 Cyclin E1 IHC 作为潜在患者富集的潜力策略;通过合并azenosertib和Zn-d5来解决复发或难治性急性髓系白血病未得到满足的需求的机会;建立azenosertib特许经营权,包括azenosertib的特许经营机会在扩展到妇科恶性肿瘤以外时增加一倍以上;特定适应症和/或患者群体的潜在未满足需求;生成具有价值创造潜力的数据集的可能性;组合的可能性,包括我们的候选产品及其潜在优势;我们的潜在成功定位azenosertib特许经营权;候选产品设计的潜在好处;我们的候选产品的目标特征和潜在益处及其作用机制,包括作为单一疗法和/或组合疗法;候选产品的市场机会和市场潜力,包括每年的潜在患者数量;我们预期里程碑的时间和内容,包括临床试验启动的时间和临床数据的披露,以及包含以下内容的声明这样的话如 “预测”、“建立”、“估计”、“预期”、“可能”、“里程碑”、“机会”、“计划”、“定位”、“潜力”、“战略”、“意愿” 以及具有未来或前瞻性质的类似陈述。这些陈述既不是承诺也不是保证,但涉及已知和未知的风险、不确定性和其他重要因素,这些因素可能导致我们的实际业绩、业绩或成就与前瞻性陈述所表达或暗示的任何未来业绩、业绩或成就存在重大差异,包括但不限于以下内容:我们有限的运营历史,这可能使评估我们当前的业务和预测未来的成功和生存能力变得困难;我们已经而且预计将继续承受重大损失损失;我们需要额外的资金,但可能不可用;我们开发任何诊断工具的计划,包括相关成本;临床前测试和早期试验的结果可能无法预测后期临床试验的成功;未能确定其他候选产品以及开发或商业化可销售的产品;临床试验期间的潜在不可预见事件可能导致延误或其他不利后果;与监管批准程序或持续监管义务相关的风险;未能获得美国或国际上市许可;我们的候选产品可能会造成严重的不利副作用;无法维持我们的合作或这些合作的失败;我们对第三方的依赖;激烈竞争的影响;系统故障或安全漏洞的可能性;与知识产权相关的风险;我们吸引、留住和激励合格人员的能力以及与管理层过渡相关的风险;以及上市公司运营带来的巨大成本。其他风险和不确定性包括我们在最近提交的10-K和10-Q表定期报告中在 “风险因素” 标题下确定的风险和不确定性,以及随后向美国证券交易委员会提交的文件可能会导致实际结果与本演示文稿中前瞻性陈述所示的结果存在重大差异。任何此类前瞻性陈述均代表管理层截至本演讲之日的估计。新的风险和不确定性可能会不时出现,因此不可能预测所有的风险和不确定性。尽管我们可能会选择在未来的某个时候更新这些前瞻性陈述,但除非适用法律要求,否则我们没有义务更新或修改任何前瞻性陈述。尽管我们认为此类前瞻性陈述中反映的预期是合理的,但我们无法保证此类预期会被证明是正确的。因此,提醒读者不要过分依赖这些前瞻性陈述。对于任何此类前瞻性陈述的准确性,不作任何陈述或保证(明示或暗示)。本演示文稿还包含独立方和我们就市场规模以及有关我们行业的其他数据所做的估算和其他统计数据。这些数据涉及许多假设和局限性,提醒您不要过分重视此类数据和估计值。此外,对我们未来表现的预测、假设和估计以及我们经营的市场的未来表现必然受到高度的不确定性和风险的影响。我们和我们的关联公司、顾问或代表均未就该数据的准确性或完整性作出任何陈述,也未承诺在本演示之日之后更新此类数据。ZENTALIS® 及其相关徽标是 Zentalis 和/或其关联公司的商标。本演示文稿中出现的所有其他商标、商品名称和服务标志均为其各自所有者的财产。本演示文稿中提供的所有网站地址仅供参考,无意作为有效链接或将任何网站信息纳入本文档。Zentalis的候选产品是研究药物,尚未获得美国食品药品监督管理局或任何其他监管机构的批准。

3 具有广泛特许经营潜力的同类首创WEE1抑制剂:PROC,耐铂性卵巢癌;USC,子宫浆液性癌;ORR,客观反应率;NDA,新药申请;MPF,将azenosertib与其他药物进行比较的中位数无进展存活声明,而不是正面比较推进Azenosertib • 临床阶段资产生成潜在注册数据 • 间歇性给药允许最大化有效的曝光量 • 与其他药物区别开来,领先于开发中的针对这一目标的药物靶向 WEE1 的高特异性药物 • 单一疗法疗效;在经过大量预处理的卵巢和 USC 中有 6.5 个月 MPF • 与其他商业上成功的抗癌药物相比,具有优异的安全性和耐受性 • 与多种化疗药物联合使用对患者的实际影响 • 至少 2 种妇科恶性肿瘤 (PROC/USC) • 与分子靶向药物联合使用可扩展到多种肿瘤类型 • 更多 10 项正在进行和计划中的试验 • 可能在 2026 年推出首个保密协议 Blockbuster机会 • 深厚的肿瘤学专业知识 • 行业领先的科学和临床顾问 • 与辉瑞和葛兰素史克的合作伙伴关系 • 2026年的现金流有望付诸实施
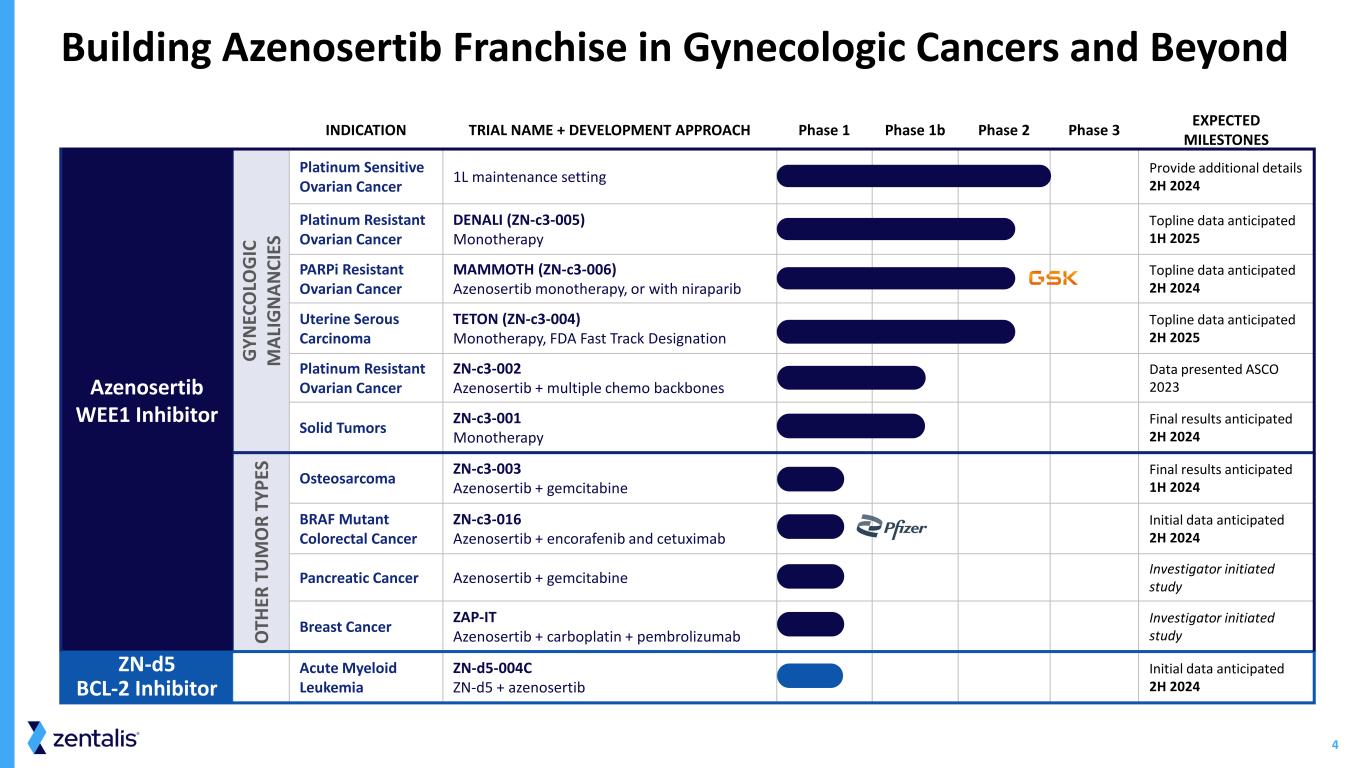
4 在妇科癌症及其他适应症领域建立Azenosertib特许经营权试验名称 + 开发方法 1 期 1b 期第 2 阶段 3 期预期里程碑 Azenosertib WEE1 抑制剂 GY N EC O LO G IC M AL IG N AN CI ES 铂敏感性卵巢癌 1L 维持设置提供更多详情 2024 年下半年铂耐药卵巢癌 DENALI (ZN-C3-005) 单一疗法顶线数据预计 2025 年上半年耐药性卵巢癌 MAMMOTH (Zn-c3-006) Azenosertib 单一疗法,或使用尼拉帕尼Topline数据预计 2024 年下半年子宫浆液性癌TETON(ZN-C3-004)单一疗法、FDA Fast Track 指定标题数据预计在 2025 年下半年铂耐药卵巢癌 zn-c3-002 Azenosertib + 多种化疗骨干数据 ASCO 2023 实体瘤 zn-C3-001 单一疗法预计最终结果 O TH ER T U M O R TY PE S 骨肉瘤 zn-c3-003 gemenosertib + 预计2024年上半年最终结果 BRAF 突变体结直肠癌 zn-c3-016 Azenosertib + encorafenib 和 cetuximab 初步数据预计于 2024 年下半年胰腺癌 Azenosertib + gemcitabine 研究者启动的研究乳房癌症 ZAP-IT Azenosertib + carboplatin + pembrolizumab 研究者发起的研究 zn-d5 BCL-2 抑制剂急性髓系白血病 zn-d5-004C zn-d5 + azenosertib 初始数据预计于 2024 年下半年
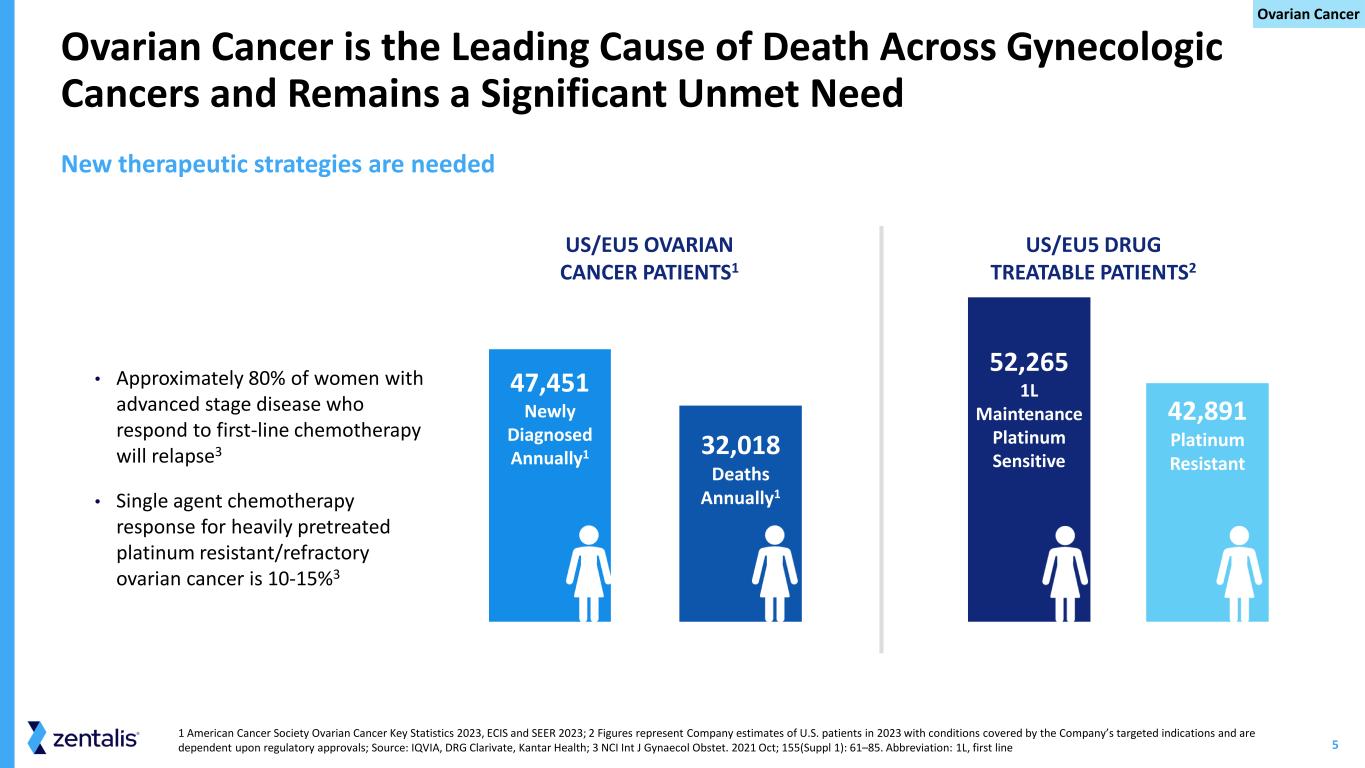
需要5种新的治疗策略卵巢癌是妇科癌的主要死亡原因,仍然是未得到满足的重要需求 47,451人每年新诊断1 32,018人死亡1 1 1 美国癌症协会2023年卵巢癌关键统计数据,ECIS和SEER 2023年;2数字代表公司对2023年患有公司靶向适应症所涵盖疾病的美国患者的估计,取决于监管部门的批准;来源:IQVIA,DRVIA G Clarivate,Kantar Health;3 NCI Int J Gynaecol Obsett。2021 年 10 月;155(补编 1):61—85。缩写:1L,第一线 • 对一线化疗有反应的晚期疾病女性中,大约 80% 会复发3 • 对预先大量铂耐药/难治性卵巢癌的单一药物化疗反应为 10-15% 3 美国/欧盟5 卵巢癌 PATIENTS1 美国/欧盟5 药物可治疗 PATIENTS2 52,265 1L 维持铂敏感 42,891 铂金耐药卵巢癌
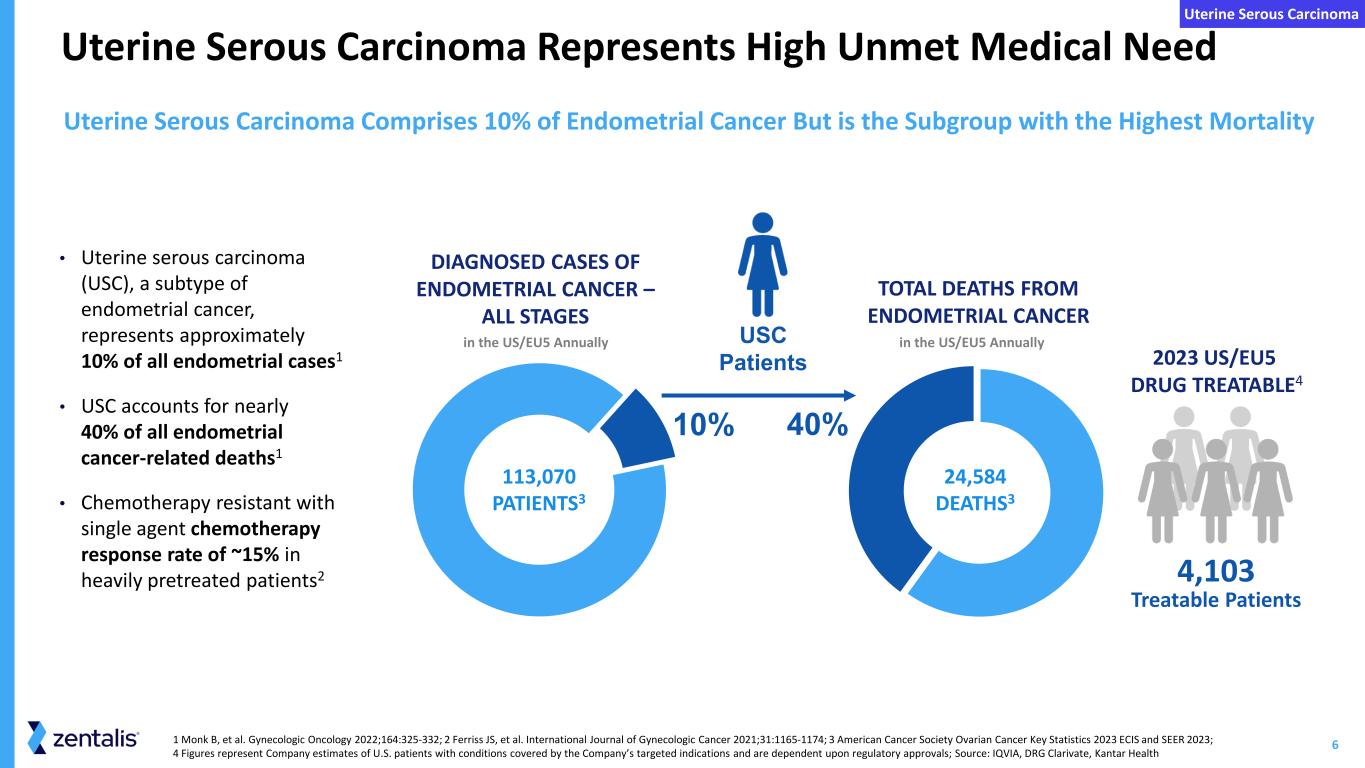
6 子宫浆液性癌占子宫内膜癌的10%,但却是死亡率最高的亚组 1 monk B 等人。妇科肿瘤学 2022;164:325-332;2 Ferriss JS 等。《2021年国际妇科癌症杂志》;31:1165-1174;3 美国癌症协会卵巢癌关键统计数据 2023 年 ECIS 和 SEER 2023;4 个数字代表公司对患有公司靶向适应症并取决于监管部门批准的美国患者的估计;来源:IQVIA、DRG Clarivate、Kantar Health 子宫浆液癌代表大量未得到满足的医疗需求 113,070 名 PATIENTS3 USC 患者 • 子宫浆液性癌(USC)是子宫内膜癌的一种亚型,约占所有子宫内膜病例的10%1 • USC占所有子宫内膜癌相关死亡人数的近 40% 1 • 在大量预先治疗的患者中,单药化疗反应率约为 15% 2 2023 美国/欧盟5 药物 TREATABLE4 美国/欧盟5 可治疗患者每年 10% 40% 24,584 DEATHS3 美国/欧盟5 每年有 4,103 例子宫内膜癌确诊病例 — 所有阶段子宫内膜癌死亡总数子宫内膜癌

7 2023 2024 2025 2026 多种肿瘤类型(包括卵巢和子宫浆液癌)铂耐药卵巢癌铂敏感性卵巢癌子宫浆液癌缩写:1H,上半年;2H,下半年临床项目将 Zentalis 定位为具有创造价值潜力的多个数据集 DENALI(ZN-C3-005):Azenosertib 单一疗法 MAMMOTH (ZN-C3-006):PARN-C3-006 耐药性 Azenosertib 单一疗法 Zn-C3-001:剂量增加/扩大 Azenosertib 单一疗法一线维护 Azenosertib TETON(Zn-C3-004):Azenosertib 单一疗法TOPLINE 数据 2025 年第 1H TOPLINE 数据 2024 年第 2H TOPLINE 数据 2025 年下半年最终结果 2024 年下半年

8 azenosertib WEE1 cdk2/cyclin E 细胞死亡 S G2 M G1 1 Gelli Luserna di Rorà A 等。J Hematol Oncol 2020;13:126;2 Elbak CR 等人。Cell Rep 2022 Azenosertib 的作用机制导致 DNA 损伤积累导致癌细胞死亡 CDK1/ Cyclin A • Azenosertib 脱磷酸化 CDK1 和 CDK2,从而消除 G1-S 和 G2-M 细胞周期检查点,加速细胞周期1 • 加速细胞循环无法充分修复 DNA 1,2 • DNA 损伤增加和积累1,2 • 癌细胞经历有丝分裂灾难1,2 azenosertib WEE1 CDK2/Cyclin E 细胞死亡 S G2 M G1 作为单一药物在卵巢和子宫等基因组不稳定性高的肿瘤中具有临床活性浆液性癌

DRG Clarivate 的 9 项 “药物可治疗” 估计。对于 “其他细胞周期素E1+肿瘤”,使用了SEER和ECIS报告的发病率。HRD Post ParPi 肿瘤类型:前列腺、胰腺和乳房;其他周期蛋白 E1+ 肿瘤类型包括膀胱癌、胃癌、食道癌、肺癌和乳腺癌缩写:PROC,耐铂性卵巢癌;2L,二线 USC,子宫浆液性癌;PSOC,铂敏感性卵巢癌;HRD,同源重组修复缺乏;parPi,Poly-ADP rip bose 聚合酶抑制剂;brafM CRC、BRAF V600E 突变结直肠癌;复发/难治性急性髓系白血病、复发或难治性急性髓系白血病 Azenosertib 可治疗患者人数随着特许经营权的扩大而增加一倍以上两个非妇科恶性肿瘤 Po te nt ia l U S + EU 5 Pa time time nt s per Y ea r(20 23 E st im at es)妇科恶性肿瘤 43,000 47,900 67,900 87,200 114,200 114,100 单一疗法 PROC 2L USC PSOC 维护 HRD post parPi 166,000 组合 braFM CRC R/R AML 其他周期蛋白 E1+ 肿瘤 (wwpi)/化疗) 102,200

Azenosertib单一疗法最新结果单一疗法在妇科恶性肿瘤中的抗肿瘤活性具有良好的安全性和耐受性
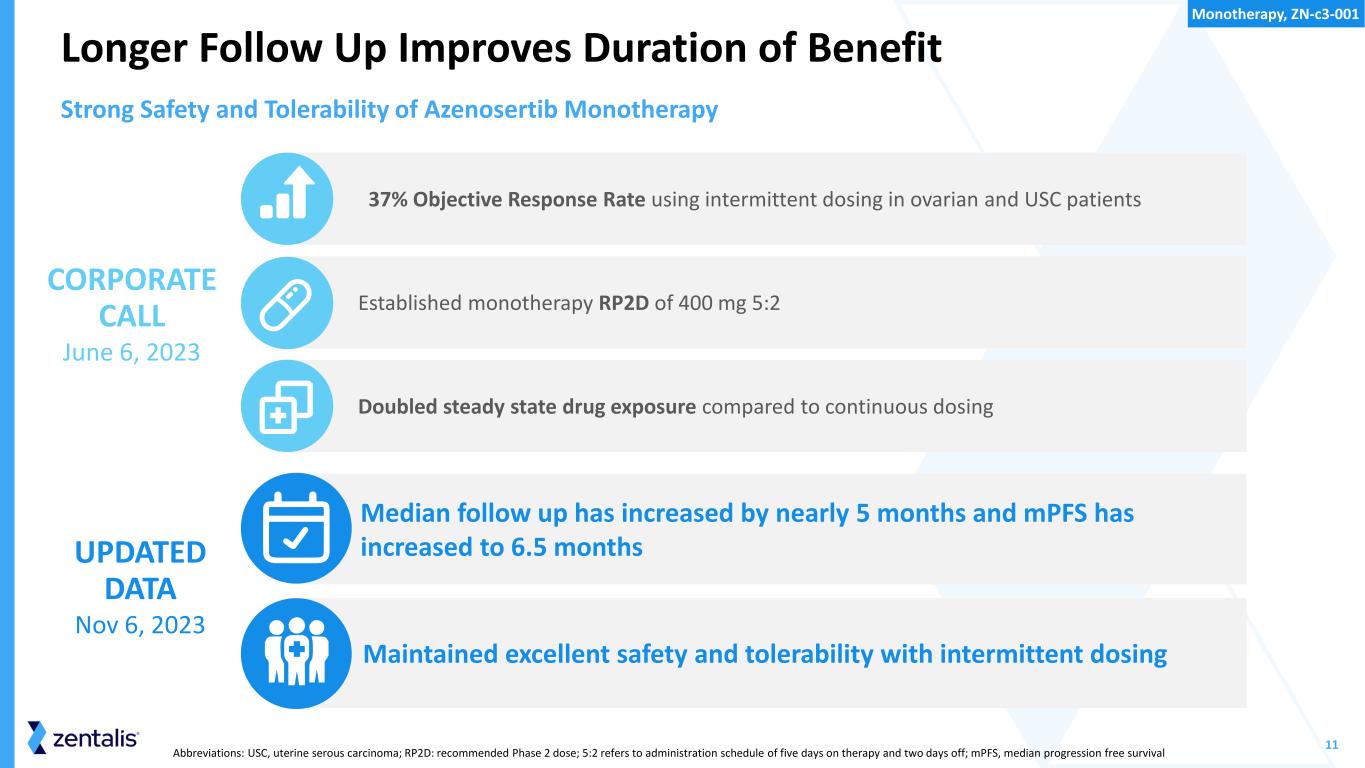
11 已确立的单一疗法 RP2D 为 400 mg 5:2 中位随访时间延长了近 5 个月,MPF 增加到 6.5 个月 37% 卵巢和南加州大学患者间歇给药的客观缓解率通过间歇给药保持了极好的安全性和耐受性 2023 年 6 月 6 日 Azenosertib 单一疗法缩写:USC,子宫浆液性癌;RP2D:推荐的 2 期剂量; 5:2 是指治疗五天和休假两天的给药时间表;MPF,无进展存活率中位数较长的随访时间可延长受益期与持续给药相比,稳态药物暴露量增加一倍更新数据 2023 年 11 月 6 日单一疗法,Zn-C3-001
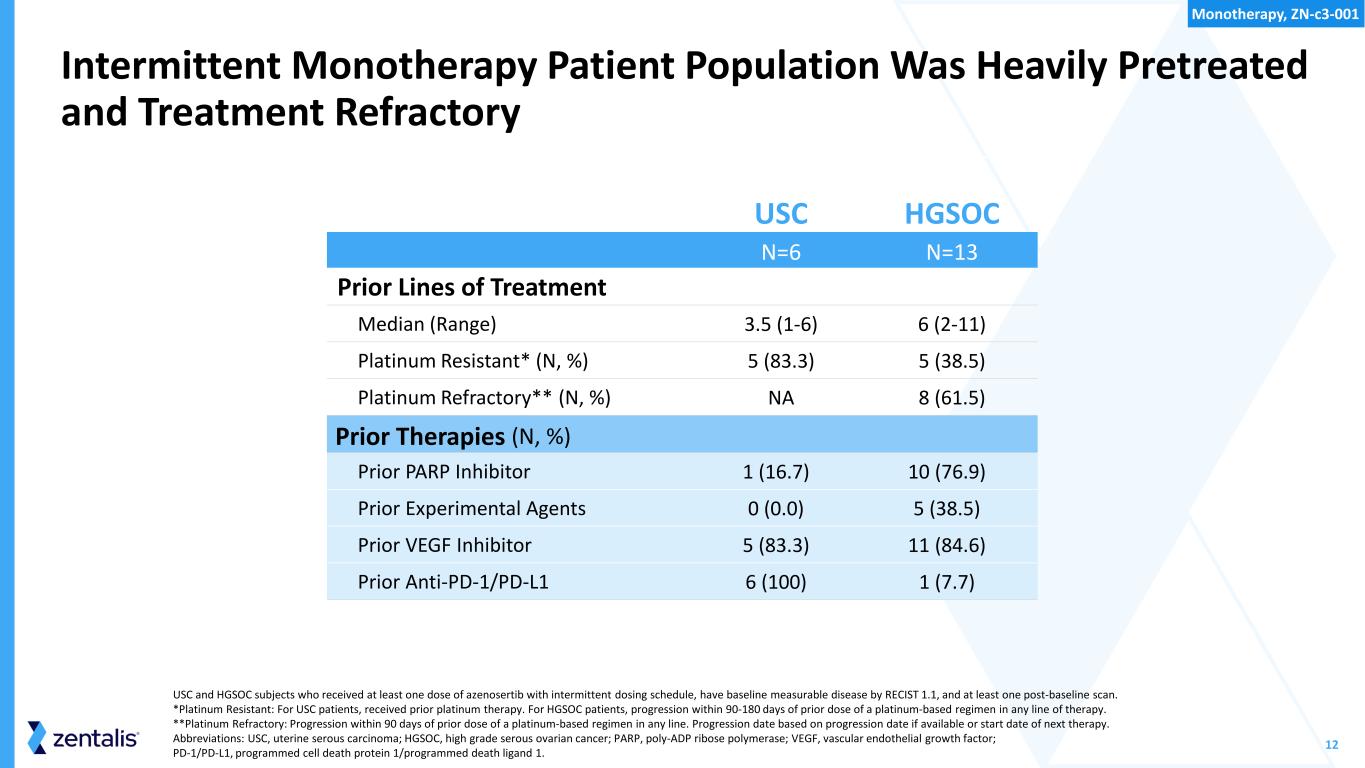
12 名间歇性单一疗法患者群体接受了大量预治疗,接受了至少一剂阿泽诺舍替布的难治性USC和HGSOC受试者,他们接受了间歇性给药计划,在RECIST 1.1之前患有基线可测量的疾病,并且至少进行过一次基线后扫描。*铂耐药性:对于南加州大学患者,先前接受过铂金治疗。对于HGSOC患者,在任何疗法中,在先前服用铂类药物后的90-180天内都有进展。**铂金耐火药物:在任何产品上次服用铂基疗法后 90 天内进展。进展日期基于进展日期(如果有)或下一次治疗的开始日期。缩写:USC,子宫浆液性癌;HGSOC,高级别浆液性卵巢癌;PARP,聚-ADP 核糖聚合酶;VEGF,血管内皮生长因子;PD-1/PD-L1,程序性细胞死亡蛋白 1/程序性死亡配体 1。USC HGSOC N=6 N=13 先前的治疗路线中位数(范围)3.5(1-6)6(2-11)耐铂*(N,%)5(83.3)5(38.5)铂耐药**(N,%)NA 8(61.5)先前的治疗(N,%)先前的PARP抑制剂 1(16.7)10(76.9)先前的实验药物 0(0.0)5 (38.5) 先前的血管内皮生长因子抑制剂 5 (83.3) 11 (84.6) 先前的抗PD-1/PD-L1 6 (100) 1 (7.7) 单一疗法,Zn-C3-001
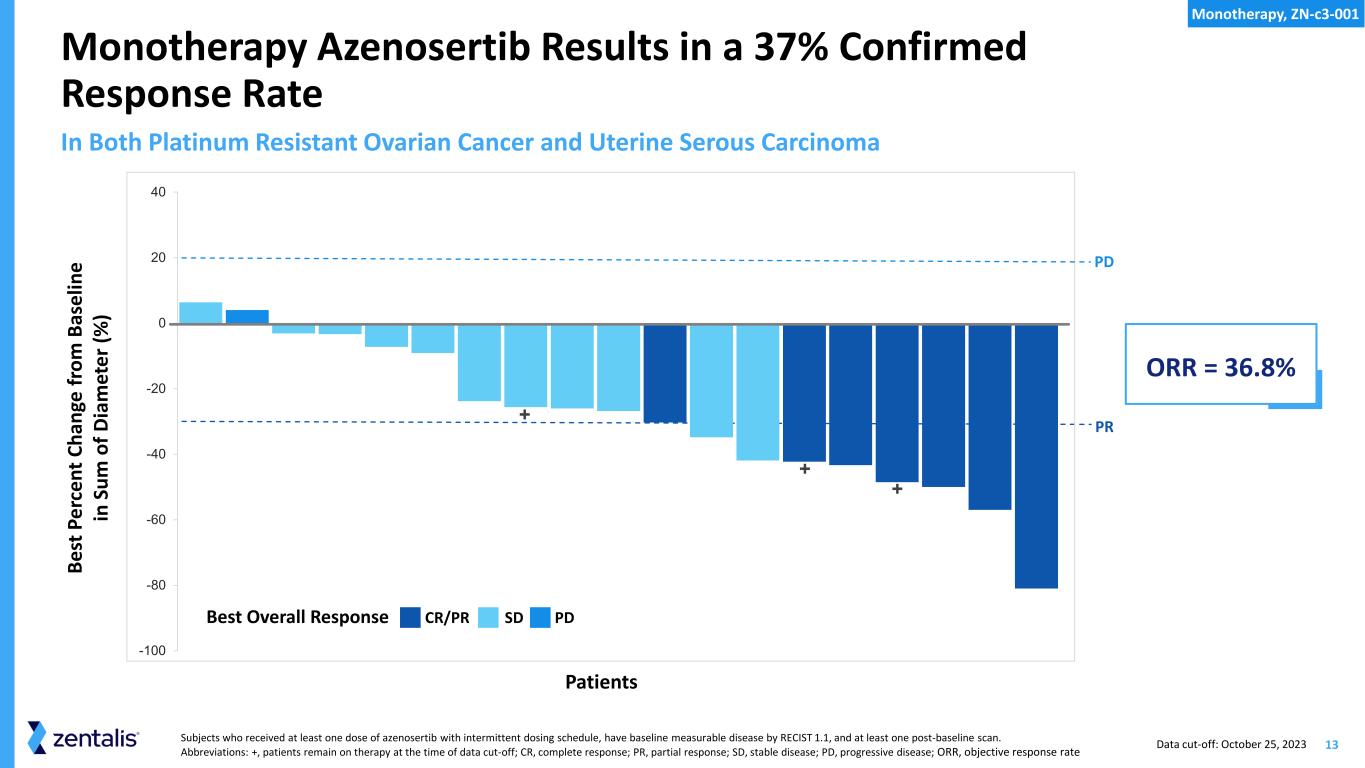
13接受至少一剂azenosertib和间歇给药计划的受试者,根据RECIST 1.1进行基线测量,并且至少进行过一次基线后扫描。缩略语:+,患者在数据截止时仍在接受治疗;CR,完全缓解;PR,部分反应;SD,稳定疾病;PD,进行性疾病;ORR,客观缓解率 Azenosertib 导致耐铂卵巢癌和子宫浆液癌的确认反应率均为 37% -100 -80 -60 -20 0 40 Be st P er ce nt C ha ng e fr om B as el in e in S um o f D ia m et er (%) 患者最佳总体反应 CR/PR SD PD ORR = 36.8% PR PD + + + 数据截止日期:2023 年 10 月 25 日单一疗法,Zn-C3-001
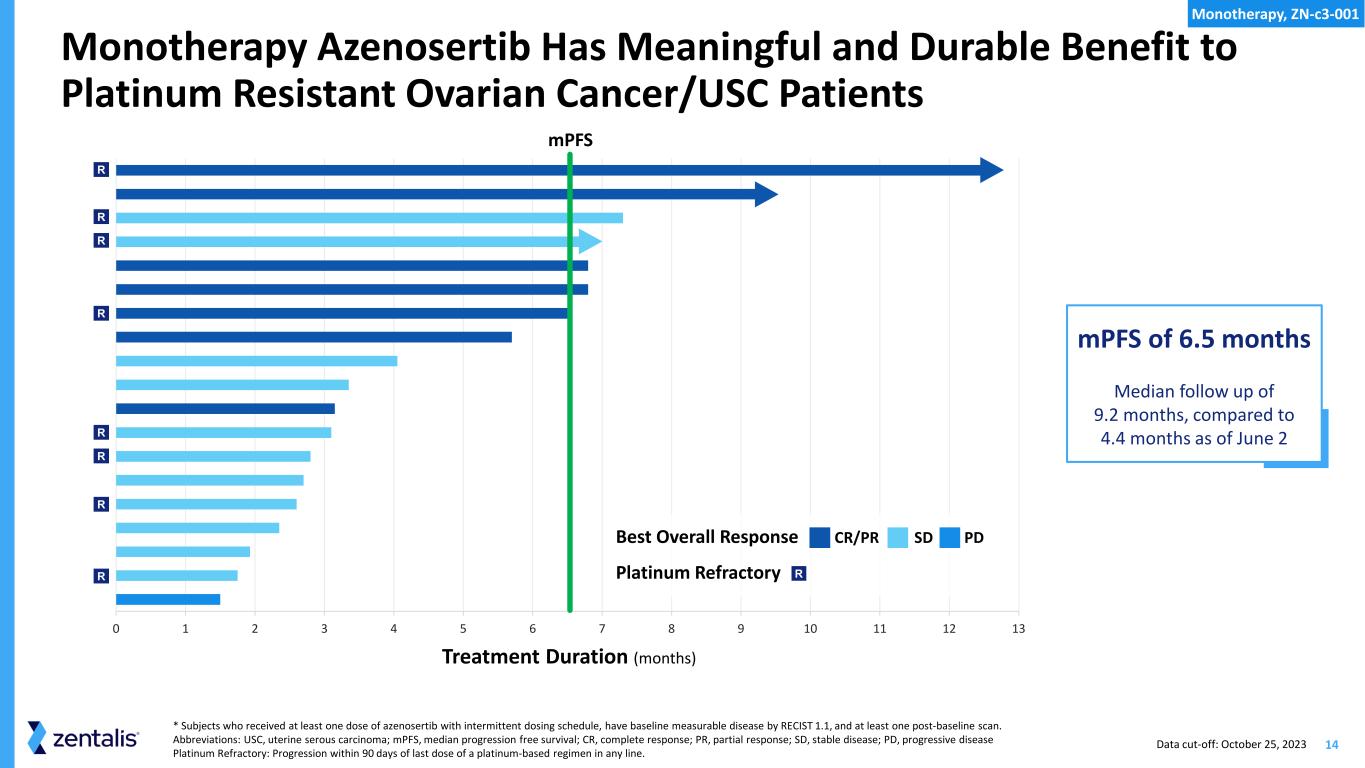
14 单一疗法 Azenosertib 对铂耐药卵巢癌/USC 患者具有有意义且持久的益处* 接受至少一剂阿泽诺舍替布间歇给药的受试者,在 RECIST 1.1 之前有基线可测量的疾病,并且至少接受过一次基线后扫描。缩写:USC,子宫浆液性癌;MPF,无进展存活率中位数;CR,完全缓解;PR,部分缓解;SD,稳定的疾病;PD,进行性疾病铂金难治性:在任何系列的最后一剂铂基疗法后 90 天内进展。0 1 2 3 4 5 6 7 8 9 10 11 12 13 治疗持续时间(月)中位随访时间为 9.2 个月,而截至为 4.4 个月 6 月 2 日 6.5 个月的 MPF 最佳整体反应 CR/PR SD PD 铂金耐火材料数据截止日期:2023 年 10 月 25 日 R RR R R R R R R R R R R R R R MPFS 单一疗法,zn-c3-001
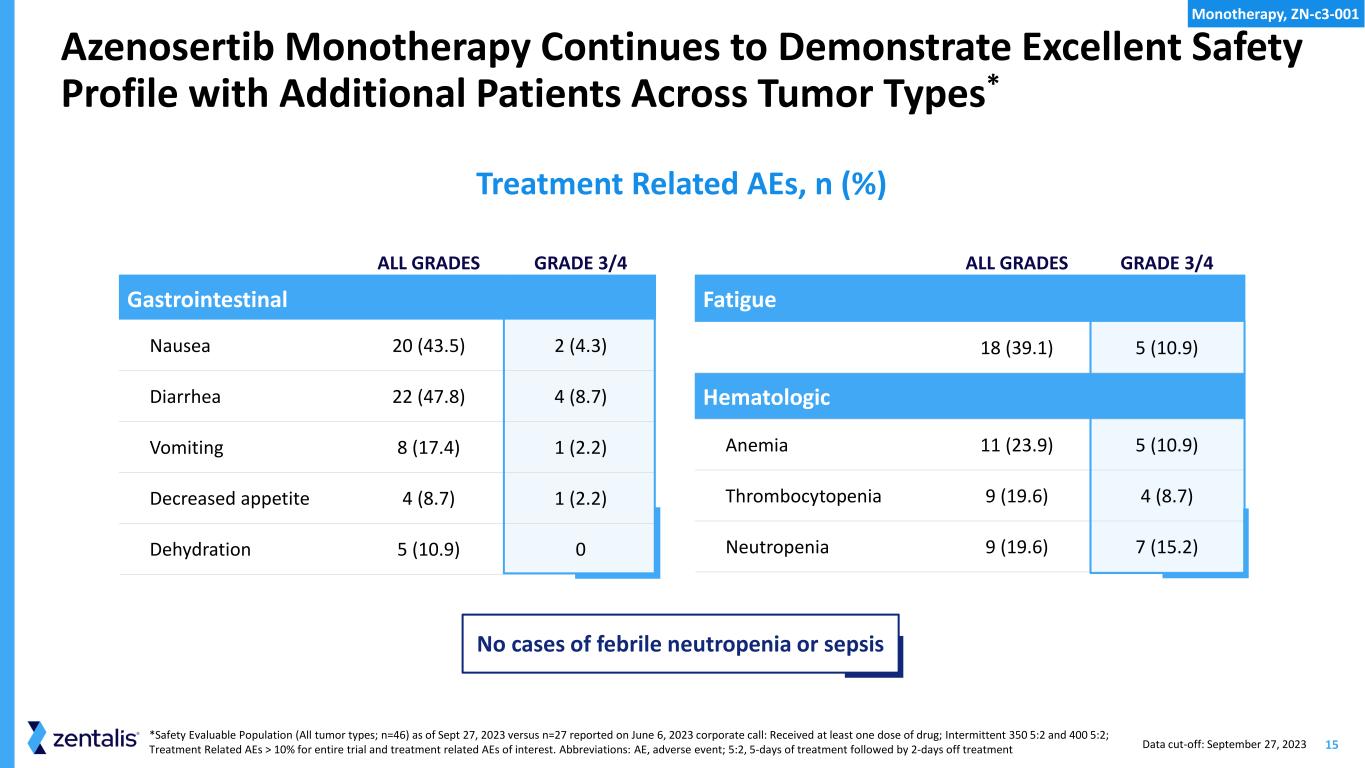
15 所有年级 3/4 级疲劳 18 (39.1) 5 (10.9) 血液学贫血 11 (23.9) 5 (10.9) 血小板减少症 9 (19.6) 4 (8.7) 中性粒细胞减少症 9 (19.6) 7 (15.2) 所有年级 3/4 级胃肠道恶心 20 (43.5) 2 (4.3) 腹泻 22 (47.8) 4 (8.7) 呕吐 8 (17.4)) 1 (2.2) 食欲下降 4 (8.7) 1 (2.2) 脱水 5 (10.9) 0 Azenosertib 单一疗法继续表现出良好的安全性以及其他肿瘤类型的患者* *截至2023年9月27日的安全性可评估人群(所有肿瘤类型;n=46)对比 2023 年 6 月 6 日公司电话会议上公布的 n=27: 接受了至少一剂药物;间歇性 350 5:2 和 400 5:2;与治疗相关的整个试验和治疗相关不良反应的治疗相关不良反应大于 10%。缩写:AE,不良事件;5:2,治疗 5 天,然后休学 2 天数据截止日期:2023 年 9 月 27 日治疗相关 AE,n (%) 无发热性中性粒细胞减少或败血症病例单一疗法,Zn-c3-001
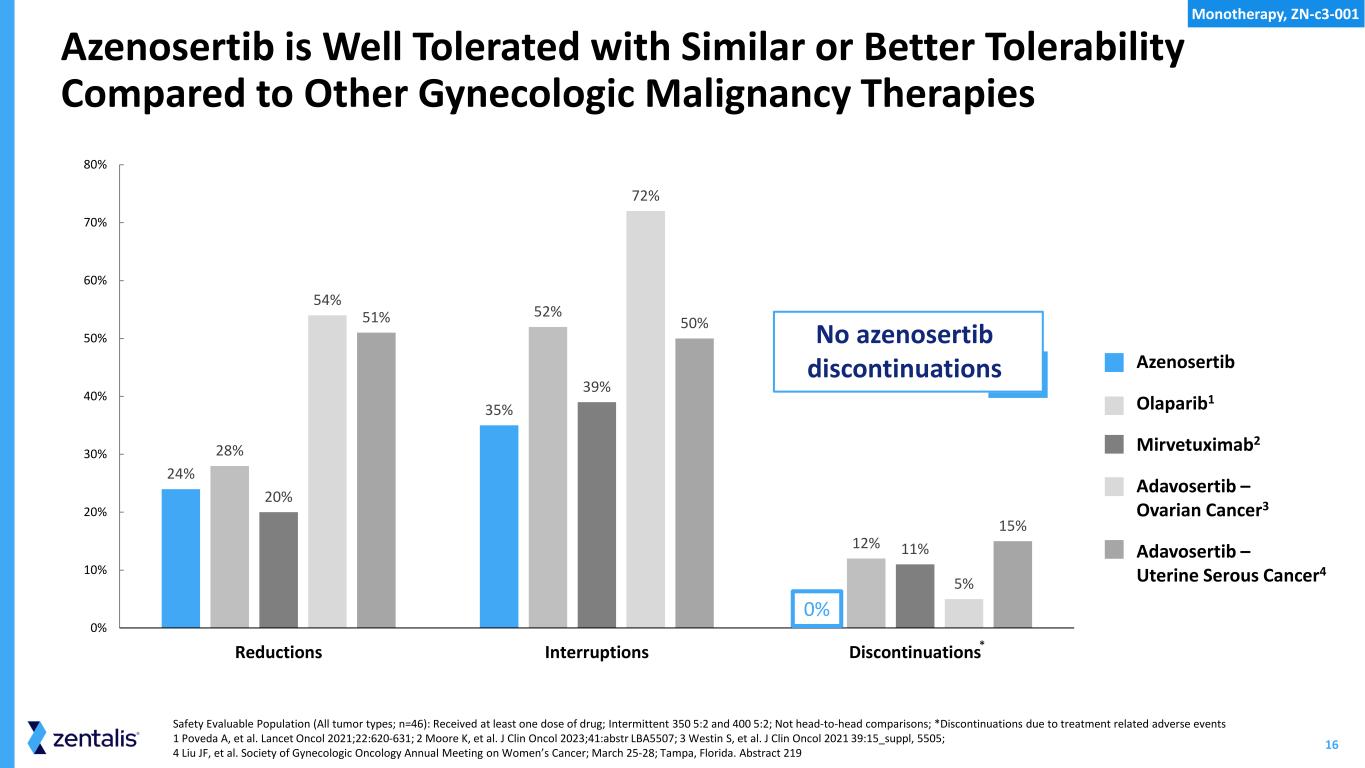
16 24% 35% 0% 0% 28% 52% 12% 39% 54% 72% 51% 50% 10% 20% 40% 50% 60% 70% 80% 中断停药与其他妇科恶性肿瘤疗法相比,Azenosertib耐受性良好,耐受性相似或更好(所有肿瘤类型;n=46):至少接受一剂药物;间歇性 350 5:2 和 400 5:2;不是正面比较;*因治疗相关不良事件而停药 1 Poveda A 等人Lancet Oncol 2021;22:620-631;2 Moore K 等人。J Clin Oncol 2023;41:abstr LBA5507;3 Westin S 等J Clin Oncol 2021 39:15 _suppl,5505;4 Liu JF 等人妇科肿瘤学会女性癌症年会;3月25日至28日;佛罗里达州坦帕。摘要 219 不停药 Azenosertib Olaparib1 Mirvetuximab2 Adavosertib — 卵巢癌3 Adavosertib — 子宫浆液癌4 0 * 单一疗法,zn-c3-001

17 项数据支持正在进行的Azenosertib单一疗法可能对卵巢癌和子宫浆液癌单一疗法进行注册研究结论:优异的耐受性和安全性 37% 证实 ORR 改善 6.5 个月的 MPF 支持区别于其他临床 WEE1 抑制剂的最终数据随访时间更长的缩写:ORR,客观反应率;MPF,自由进展存活率中位数;与其他药物的比较不是正面交锋。与其他可用药物一致或优于单一疗法,Zn-C3-001

Azenosertib在卵巢癌和子宫浆液性癌中的潜在注册途径的多项正在进行的2期试验

19 种耐铂性卵巢癌:高未得到满足的需求为单一疗法的批准提供了机会 1 数字代表公司对患有公司靶向适应症所涵盖疾病的美国和欧盟五国患者的估计;来源:IQVIA,DRG Clarivate;2 Matulonis U. JCO 2023 41:13:2436-2445;缩写:BRCam,BRCA 突变体;HRD,同源重组修复缺乏;HRP,同源重组修复缺乏精通重组修复;PFI、无铂间隔耐铂单药化疗或 Mirvetuximab(约 35% pts)2 42,981 名可治疗患者1 美国/欧盟 5 未获满足需要未经治疗的 III/IV 期卵巢癌卡铂 + 紫杉醇一线维护 PARP 抑制剂或 Bevacizumab + Olaparib 贝伐珠单抗 brcam/HRD HRP pfi6m PFI
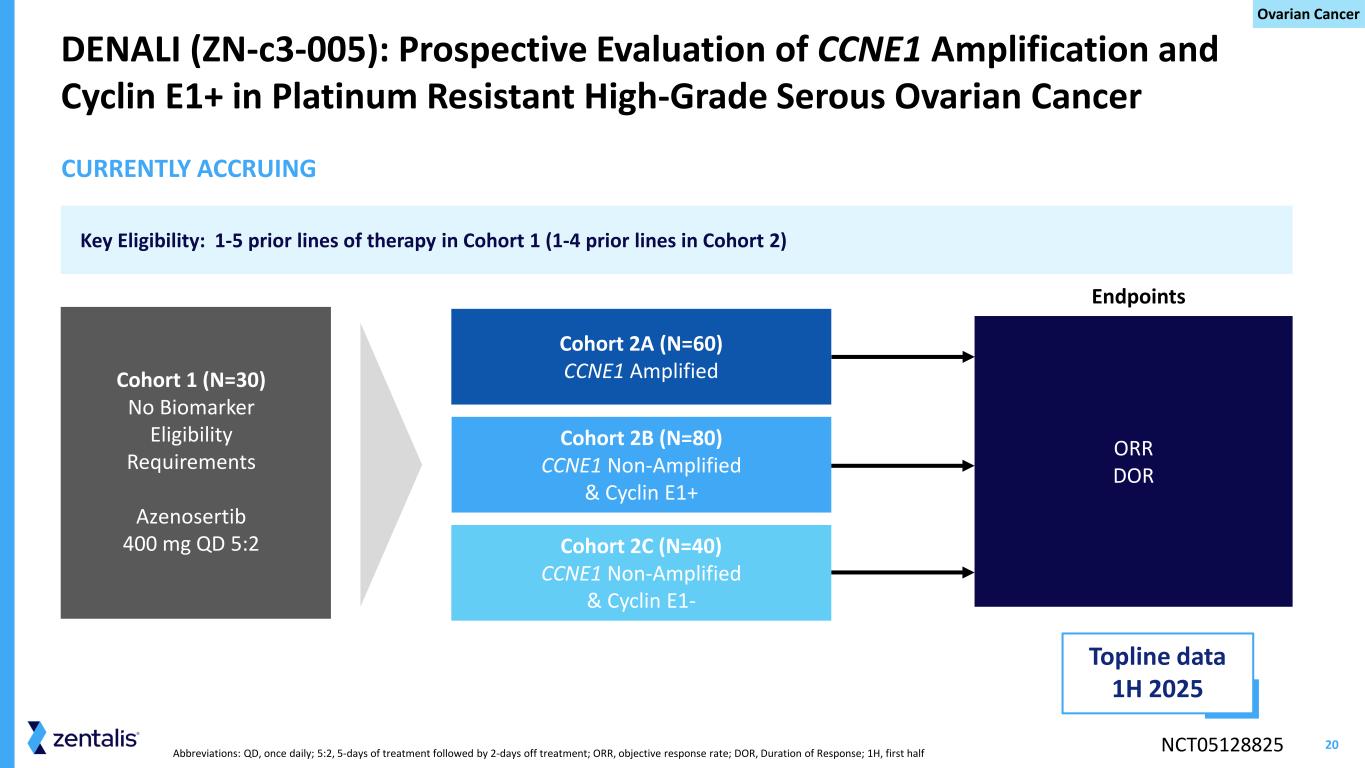
20 个缩写:QD,每天一次;5:2,治疗 5 天,然后休息 2 天;ORR,客观缓解率;DOR,缓解持续时间;1H,上半场 DENALI(zn-C3-005):耐铂高级浆液性卵巢癌终点队列 2B(N=80)CCNE1 非扩增和细胞周期蛋白 E1+ 的前瞻性评估 2C (N=40) CCNE1 非扩增和细胞周期蛋白 E1-队列 2A (N=60) CCNE1 放大 NCT05128825 队列 1 (N=30) 无生物标记物资格要求 Azenosertib 400 mg QD 5:2 关键资格:1-5 个先前线路 CCNE1队列 1 中的治疗量(队列 2 中有 1-4 个先前线路)目前正在累积的 ORR DOR Topline 数据 2025 年上半年卵巢癌
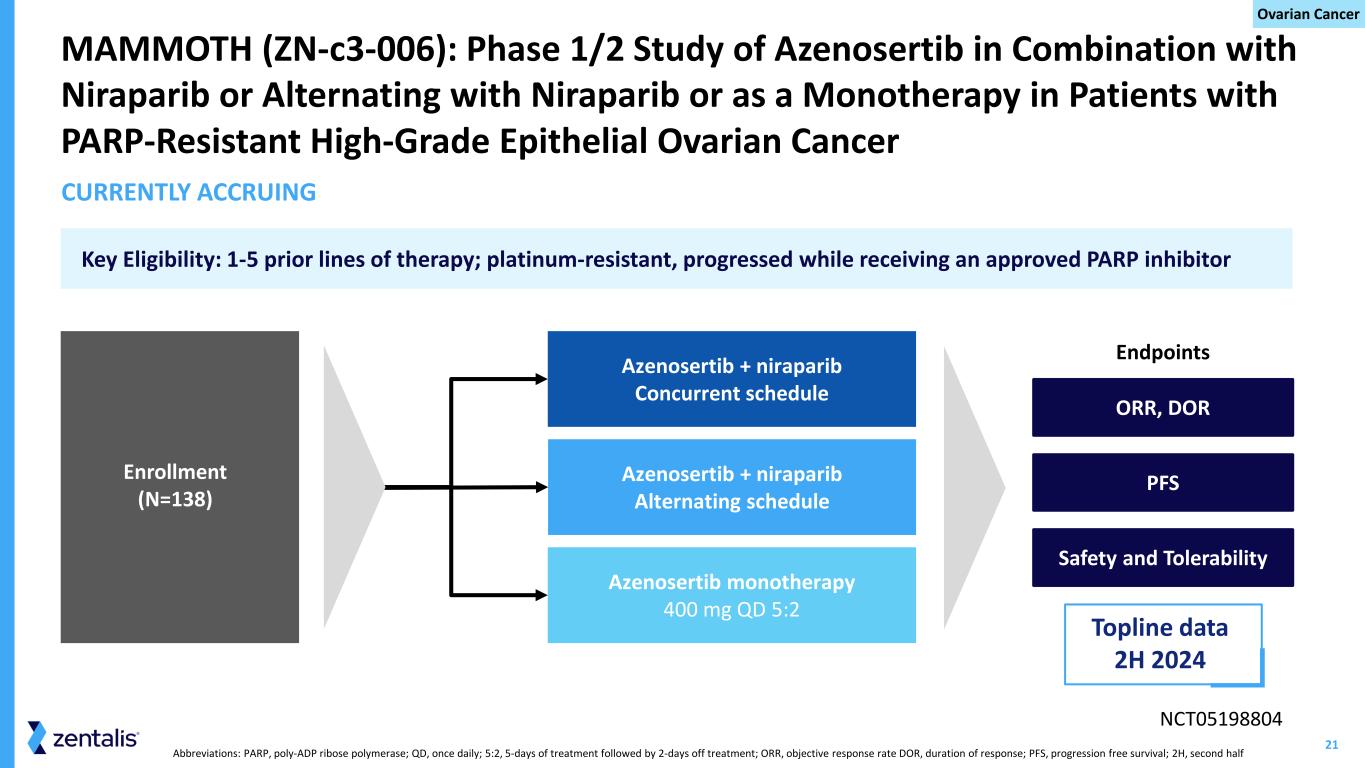
21 缩写:PARP,Poly-ADP 核糖聚合酶;QD,每日一次;5:2,治疗 5 天,休假 2 天;ORR,客观缓解率 DOR,缓解持续时间;PFS,无进展存活率;2H,下半场 MAMMOTH(Zn-C3-006):Azenosertib联合尼拉帕尼或与尼拉帕尼交替使用的1/2期研究或者作为抗PARP患者的单一疗法高级上皮性卵巢癌终点 Azenosertib + niraparib 交替疗程 Azenosertib 单一疗法 400 mg QD 5:2 Azenosertib + niraparib 并行疗程NCT05198804 入组(N=138)关键资格:先前有 1-5 个疗法;铂耐药性,在接受批准的 PARP 抑制剂 PFS 安全性和耐受性 ORR、DOR 目前正在累积的顶线数据 2024 年下半年卵巢癌

221 数字代表公司对患有公司靶向适应症覆盖且取决于监管部门批准的美国患者的估计;来源:IQVIA、DRG Clarivate、Kantar Health;缩写:2L+,二线维持补充;USC,子宫浆液性癌;1L,2L+ IV 期子宫浆液性癌或复发性USC 2L+ 单药化疗所需的新治疗方案 103 名可治疗患者1 美国/欧盟 5 未满足的需求 1L 卡铂 + 紫杉醇 + Pembrolizumab/Dostarlimab 子宫浆液性癌

23 目前正在累积——美国食品药品管理局快速通道名称缩写:2L,两行;QD,每天一次;5:2,治疗5天,休息2天;ORR,客观缓解率;DOR,缓解持续时间;2H,下半年;美国食品药品管理局于2021年11月授予先前接受过至少一种铂类化疗方案的晚期或转移性USC患者的azenosertib快速通道称号用于治疗晚期或转移性疾病。TETON(Zn-C3-004):对患有 ≥2L 晚期子宫浆液性癌的女性进行Azenosertib单一疗法 NCT04814108 关键资格:≥1 种以铂为基础的化疗方案;先前的抗 PD(L)1 终点患者(N=130)Azenosertib 400 mg QD 5:2 DOR 安全性和耐受性 ORR 顶线数据 2025 年下半年子宫浆液性癌

Azenosertib 治疗铂敏感性卵巢癌修订后的策略 1L 维持有机会为更多患者提供长期益处
25 Pfi6m PFI

26 Azenosertib在1L维持环境中影响卵巢癌患者人数的可能性最大 1 数字代表公司对患有公司靶向适应症所涵盖疾病的美国和欧盟五国患者的估计;来源:IQVIA、DRG Clarivate Kantar和DRG;2 Ray-Coquard I.,N Engl J Med 2019;2019年12月 381:2416-2428;缩写:1L,一线治疗;2L,二线治疗;HRP,精通同源重组修复;parPi、poly-ADP 核糖聚合酶抑制剂 2x 许多患者接受 1L 维持治疗与2L治疗1相比,HRP2也是如此,没有资格获得PARPi 1L维持治疗的患者为HRP/未知肿瘤患者提供新的1L维持性口服疗法的40%提供了机会 parPi口服非化疗药物的标签和处方实践不断变化的全球监管途径Azenosertib在维持治疗中具有独特优势卵巢癌

27 2024年下半年Azenosertib作为1L维持疗法用于铂敏感卵巢癌患者的其他试验细节,医学博士亚历山德拉·利里教授,法国癌症研究所肿瘤学副主任古斯塔夫·鲁西和ENGOT研究员 “Zentalis对WE1抑制的前线维持研究可能会改变预后不佳的卵巢癌患者的实践” Premal Thaker教授,医学博士、硕士圣路易斯华盛顿大学医学院妇产科杰出主席 GOG 研究员 “进步azenosertib 进入一线 HRP 维持环境有可能覆盖最多的卵巢癌患者” 卵巢癌

Azenosertib联合化疗临床数据显示,在铂耐药性卵巢癌中具有很强的疗效和良好的安全性
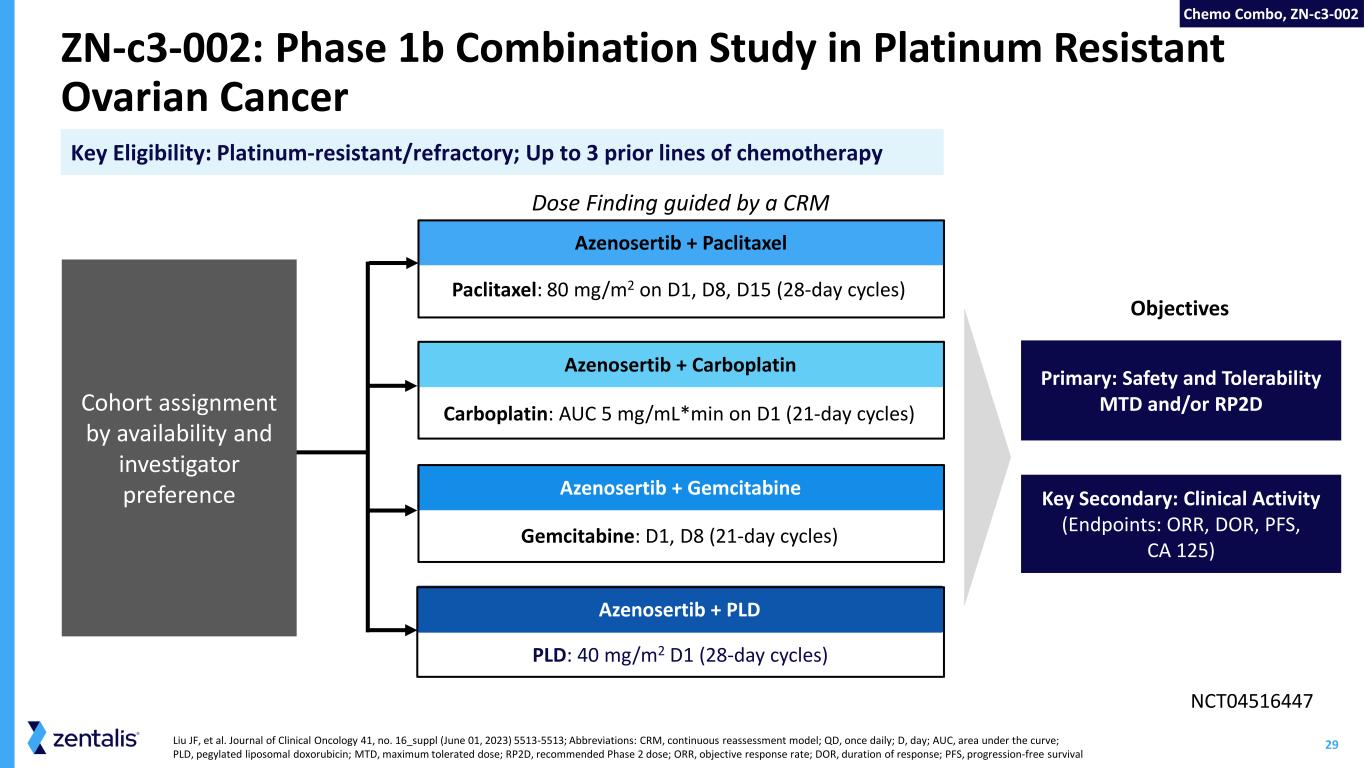
29 Azenosertib + Paclitaxel Azenosertib + Gemcitabine Azenosertib + PLD Azenosertib + Carboplatin Liu JF 等《临床肿瘤学杂志》41,第 16_suppl(2023 年 6 月 1 日)5513-5513;缩写:CRM,持续重新评估模型;QD,每日一次;D,日;AUC,曲线下区域;PLD,聚乙二醇化脂质体多柔比星;MTD,最大耐受剂量;RP2D,推荐的 2 期剂量;ORR,客观缓解率;DOR,持续时间反应;PFS,无进展存活率 zn-C3-002:按可用性和研究者偏好划分的耐铂性卵巢癌队列的1b期联合研究紫杉醇:在D1、D8、D15上为80 mg/m2(28天周期)目标吉西他滨:D1、D8(21 天周期)卡铂:AUC 5 mg/ml*min 在 D1(21 天周期)PLD:40 mg/m2 D1(28 天周期)CRM 指导的剂量查找关键资格:铂耐药/难治性;最多 3 种先前的化疗线路:安全性和耐受性 MTD 和/或 RP2D 关键次要:临床活动(终点:ORR、DOR),PFS,CA 125) NCT04516447 化疗组合,Zn-C3-002
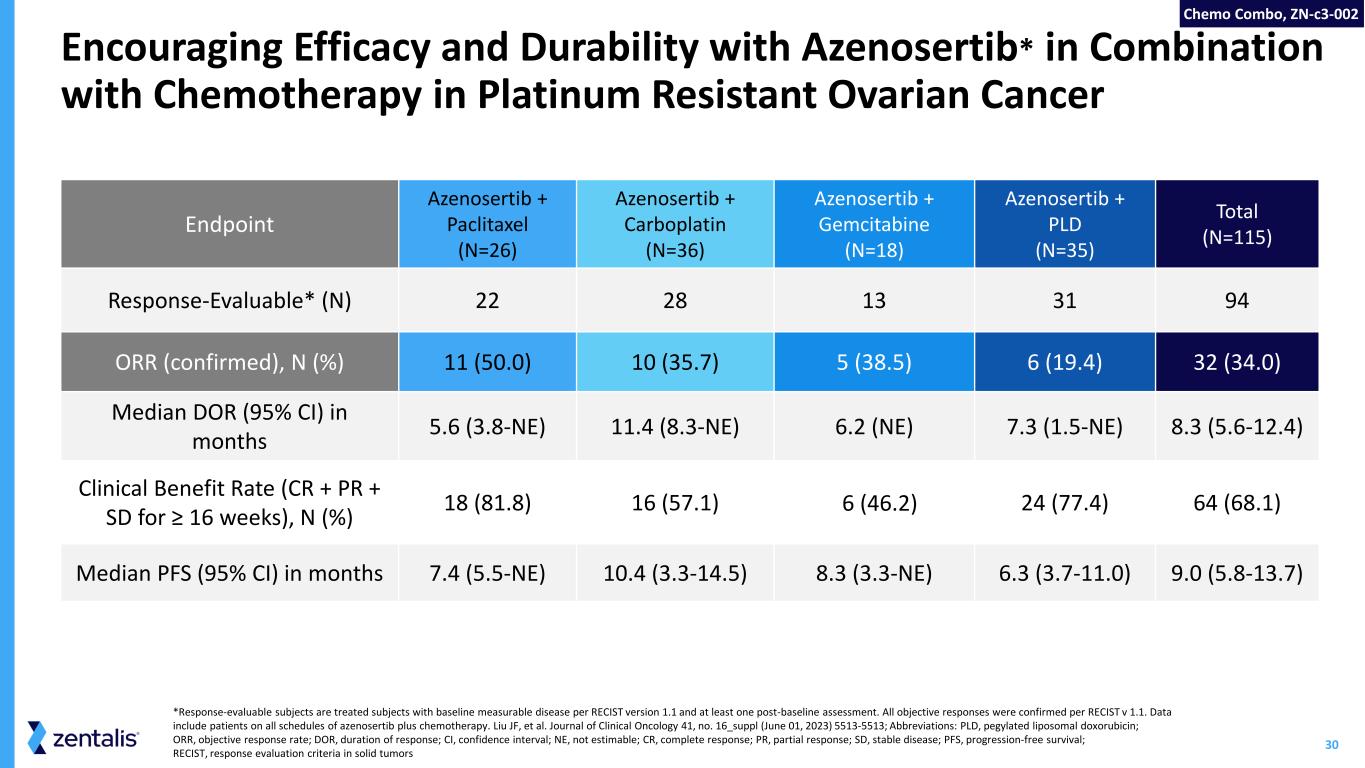
30 *根据RECIST 1.1版本和至少一次基线后评估,反应可评估的受试者是患有基线可测量疾病的受试者。根据RECIST v 1.1,所有客观答复均得到确认。数据包括所有服用azenosertib加化疗计划的患者。Liu JF 等《临床肿瘤学杂志》第 41 期,第 16_suppl(2023 年 6 月 1 日)5513-5513;缩写:PLD,聚乙二醇化脂质体多柔比星;ORR,客观缓解率;DOR,可信区间;NE,不可估计;CR,完全反应;SD,稳定疾病;PFS,无进展生存;RECIST,反应评估实体瘤标准鼓励Azenosertib*与化疗联合用于耐铂卵巢癌终点 Azenosertib + Paclitaxel (N=26) Azenosertib + Carboplatin (N=26) Azenosertib + Carboplatin 的疗效和耐久性(N=36) Azenosertib + 吉西他滨 (N=18) Azenosertib + PLD (N=35) 总计 (N=115) 反应可评估* (N) 22 28 13 31 94 ORR(已确认),N(%)11 (50.0) 10 (35.7) 5 (38.5) 6 (19.4) 32 (34.0) 月内中位数 DOR(95% 置信区间)5.6 (3.8-NE) 11.4 (8.3-NE) 6.2 (NE) 7.3 (1.5-NE) 8.3 (5.6-12.4) 临床获益率(≥ 16 周的 CR + PR + SD),N(%)18 (81.8) 16 (57.1) 6 (46.2) 24 (77.4) 64 (68.1) 个月内中位数 PFS(95% CI)10.4(3.3-14.5)) 8.3 (3.3-NE) 6.3 (3.7-11.0) 9.0 (5.8-13.7) 化疗组合,Zn-C3-002
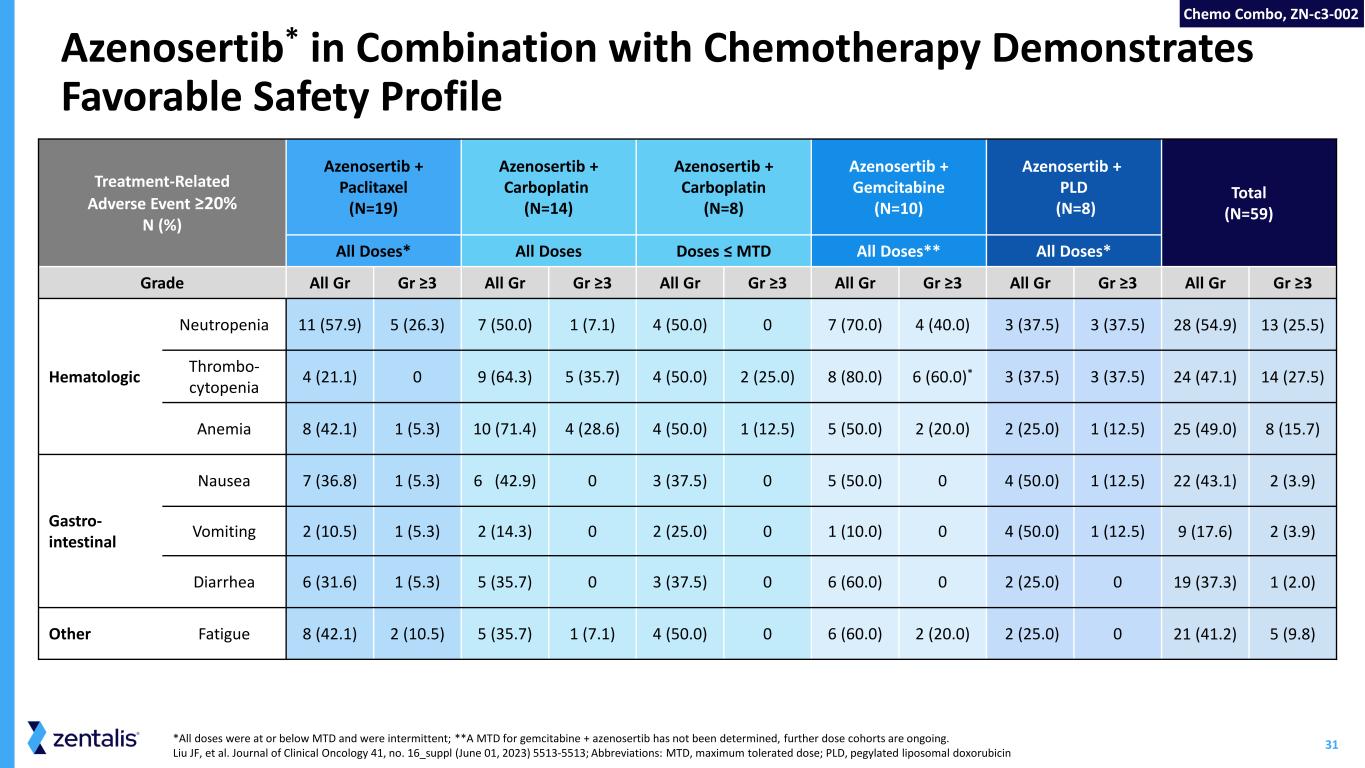
31*所有剂量均等于或低于MTD,并且是间歇性的;**吉西他滨+ azenosertib的MTD尚未确定,进一步的剂量队列正在进行中。Liu JF 等《临床肿瘤学杂志》41,第 16_suppl(2023 年 6 月 1 日)5513-5513;缩写:MTD,最大耐受剂量;PLD、聚乙二醇化脂质体多柔比星Azenosertib*与化疗联合显示出良好的安全性治疗相关不良事件 ≥ 20% N (%) Azenosertib + Paclitaxel (N=19) Azenosertib + Carboplatin (N=14) Azenosertib + Gemcitabine (N=10) Azenosertib + PLD (N=8) 总剂量 (N=59) 所有剂量* 所有剂量 ≤ MTD 所有剂量** 所有剂量* 等级 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 Gr ≥3 全部 GrGr ≥3 All Gr ≥3 血液学中性粒细胞减少症 11 (57.9) 5 (26.3) 7 (50.0) 1 (7.1) 4 (50.0) 0 7 (70.0) 4 (40.0) 4 (40.0) 3 (37.5) 3 (37.5) 28 (54.9) 13 (25.5) 13 (25.5) 4 (21.1) 0 9 (64.3) 5 (35.7) 4 (35.7) 4 (37.5) 28 (54.9) 13 (25.5) 50.0) 2 (25.0) 8 (80.0) 6 (60.0) * 3 (37.5) 3 (37.5) 24 (47.1) 14 (27.5) 贫血 8 (42.1) 1 (5.3) 10 (71.4) 4 (28.6) 4 (50.0) 1 (50.0) 5 (50.0) 2 (25.0) 1 (12.5) 25 (49.0) 8 (15.7) 胃肠恶心 7 (36.8) 1 (5.3) 6 (42.9) 0 3 (37.5) 0 5 (50.0) 0 4 (50.0) 1 (12.5) 22 (43.1) 2 (3.9) 呕吐 2 (10.5) 1 (5.3) 2 (14.3) 0 1 (10.0) 0 4 (50.0) 1 (50.0) 1 (50.0) 1 (50.0) 1 (12).5) 9 (17.6) 2 (3.9) 腹泻 6 (31.6) 1 (5.3) 5 (35.7) 0 3 (37.5) 0 6 (60.0) 0 2 (25.0) 0 19 (37.3) 1 (2.0) 其他疲劳 8 (42.1) 2 (10.5) 5 (35.7) 1 (7.1) 4 (50.0) 0 6 (60.0) 2 (20.0) 2 (20.0) 2 (20.0) 2 (25.0) 2 (42.0) 2 (42.0) 2 (10.5) 5 (35.7) 1 (7.1) 4 (50.0) 0 6 (60.0) 2 (20.0) 2 (20.0) 2 (20.0) 2 (0) 0 21 (41.2) 5 (9.8) Chemo Combo,Zn-C3-002

32Liu JF 等《临床肿瘤学杂志》第 41 期,第 16_suppl(2023 年 6 月 1 日)5513-5513;缩写:SOC,护理标准;PLD,聚乙二醇化脂质体多柔比星在单药化疗中添加阿泽诺舍替布可提高卵巢癌的反应率和反应的耐久性与单独的化疗相比,紫杉醇和卡铂组合的总体耐受性优于 SOC 化疗双联紫杉醇-卡铂或 PLD-Carbplatin 卡铂组合卡铂具有优异的耐久性,10.4 个月无进展存活率,目标为 36%缓解率 50% 紫杉醇联合疗法 7.4 个月无进展存活率 50% 化疗组合、Zn-C3-002 Cyclin E1+ 状态与较高的客观反应率和更长的反应可评估患者群体无进展存活率相关

使用 Azenosertib 靶向基因组不稳定性高的肿瘤

34 cdk2/cyclin E S G1 1 Fagundes R 等Front Cell Dev Biol. 2021;2 Stewart 医学博士,肿瘤学家。2022;3 Zhang,J 等Genes 2016;缩写:BRAF、V-Raf 小鼠肉瘤病毒癌基因同系物 B;KRAS、Kirsten 大鼠肉瘤病毒癌基因同系物导致基因组不稳定的多种机制增强对 Azenosertib 的敏感度高基因组不稳定性1 可由以下原因引起:细胞周期蛋白 E1+ 激活 • 细胞周期蛋白 E1/CDK2 的激活会增加细胞增殖,从而产生更高的复制压力并促成具有致癌驱动突变的基因组不稳定性肿瘤2 • 驱动突变,例如 BRAF 或 KRAS,会加速 G1/S 细胞周期转变,诱导 DNA 复制压力,导致 DNA 损伤和基因组不稳定同源重组缺陷肿瘤3 • 基因组不稳定性源于无法修复双链 DNA 断裂细胞周期蛋白 E1+ 激活致癌驱动突变(BRAF、KRAS)同源重组缺陷肿瘤复制压力增加有丝分裂灾难细胞死亡添加氮舍替进一步增加复制压力和 DNA 损伤

35 1 Etemadmoghadam D,等人。Proc Natl Acad Sci U S A. 2013;2 Zhao H 等人。J Cancer。2018;3 Ma,等。Cancer Res 2023 83(7_Supplement):2153;4 Kok、YP 等人。Oncogeneseris 9, 88 2020 具有 CCNE1 扩增或细胞周期蛋白 E1 阳性的肿瘤对 Azenosertib 高度敏感 • CCNE1 基因扩增是许多实体瘤的常见致癌驱动因素,包括高级别浆液性卵巢癌1 • CCNE1 基因扩增和蛋白质表达都与化疗耐药性和患者疗效不佳有关2 • 细胞周期蛋白 E1 过度表达,也可能在缺少的情况下发生 CCNE1 基因扩增,增加 CDK2 活性并加速 G1/S 过渡3,4 • 细胞周期蛋白 E1 过度表达导致复制压力使细胞更加依赖于 WEE1 G2/M 细胞周期检查点3、4 Azenosertib 治疗的细胞周期蛋白 E1High 癌细胞周期蛋白 E1 高癌细胞周期蛋白 E1
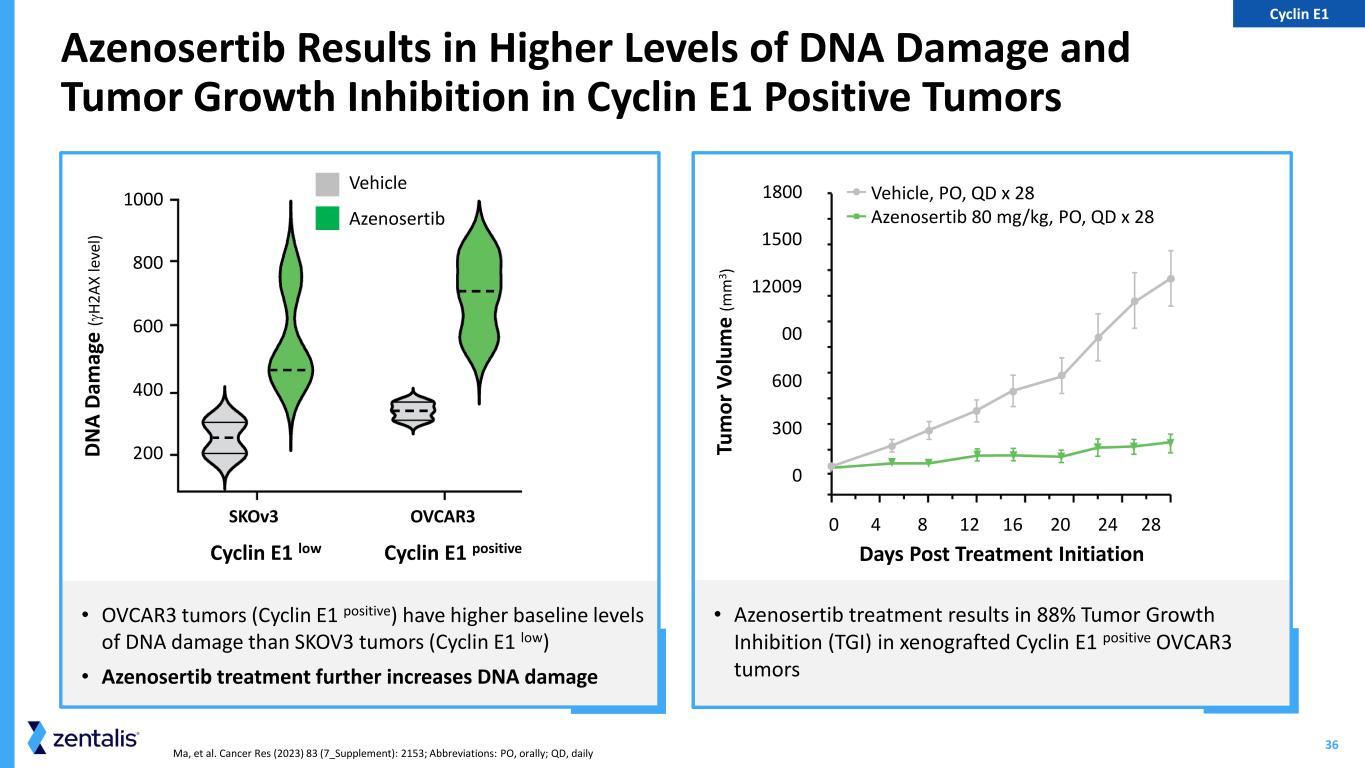
36 1800 1500 12009 00 600 300 0 0 4 8 12 16 20 24 28 • Azenosertib 治疗可使异种移植的细胞周期蛋白 E1 阳性 OVCAR3 肿瘤生长抑制 (TGI) 为 88% Ma 等人Cancer Res (2023) 83(7_Supplement):2153;缩写:PO,口服;QD,每日 Azenosertib 导致细胞周期蛋白 E1 阳性肿瘤的 DNA 损伤和肿瘤生长抑制水平更高 • OVCAR3 肿瘤(细胞周期蛋白 E1 阳性)的基准损伤水平高于 SKOV3 肿瘤(Cyclin E1 低)• Azenosertib 治疗进一步增加 DNA 损伤 Cyclin E1 低周期 IN E1 阳性 skoV3 OVCAR3 DN A Da m ag e (γH2 AX le ve l) Vehicle Azenosertib 1000 800 600 400 400 200 天治疗开始后 200 天 Tu m 或 V ol um e (m m 3) 车辆、PO、QD x 28 Azenosertib 80 mg/kg、PO、QD x 28 Cyclin E1
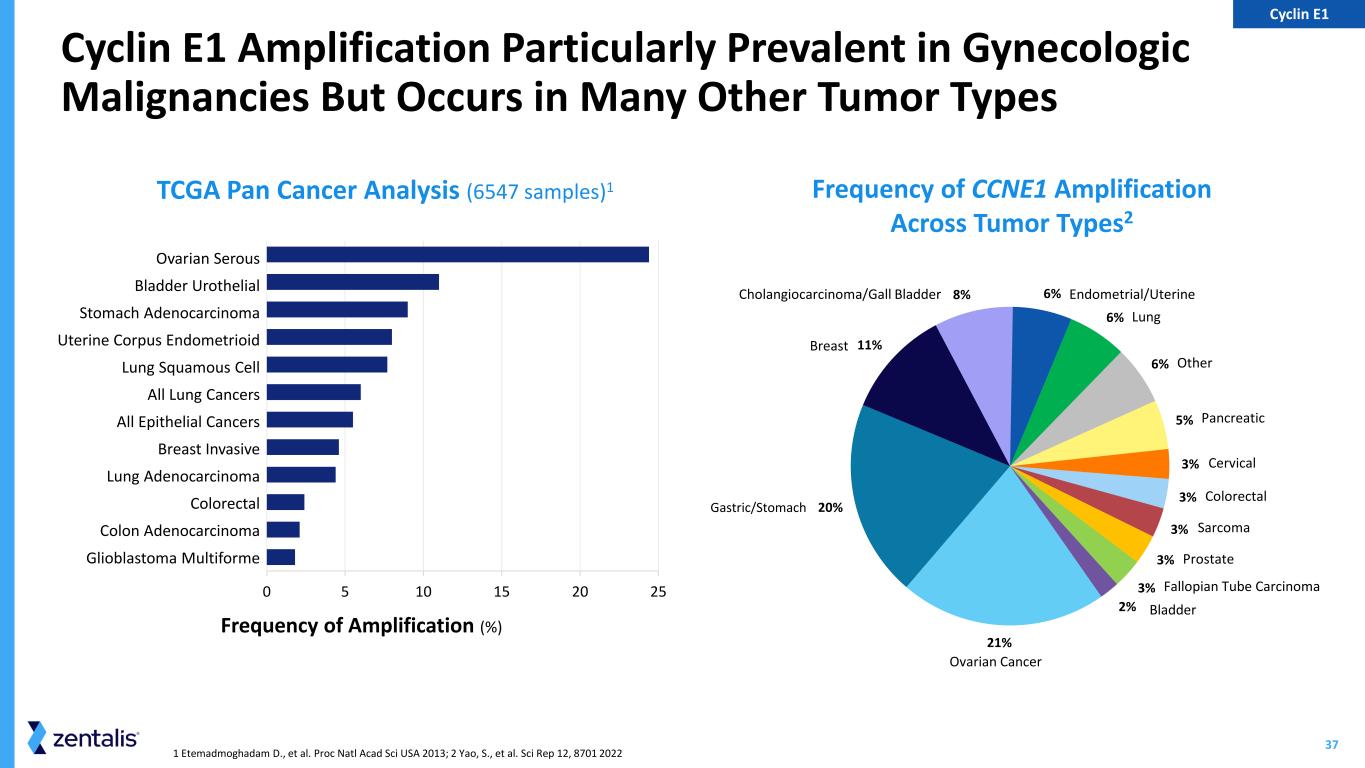
37 1 Etemadmoghadam D.,等人。Proc Natl Acad Sci USA 2013;2 Yao、S. 等Sci Rep 12, 8701 2022 Cyclin E1 扩增在妇科恶性肿瘤中特别普遍,但也出现在许多其他肿瘤类型中 TCGA 泛癌分析(6547 个样本)1 跨肿瘤类型的 CCNE1 扩增频率2 0 5 10 15 20 25 扩增频率(%)卵巢浆液性膀胱尿路上皮胃腺癌子宫内膜样肺鳞状细胞所有肺癌全部上皮癌乳腺浸润性肺腺癌结直肠结肠腺癌多形胶质母细胞瘤 21% 20% 11% 8% 6% 6% 6% 6% 5% 3% 3% 3% 3% 3% 3% 3% 2% 2% 卵巢癌胃/胃乳房胆管癌/胆囊子宫内膜/子宫肺其他胰腺宫颈结直肠肉瘤前列腺输卵管癌膀胱周期蛋白 E1
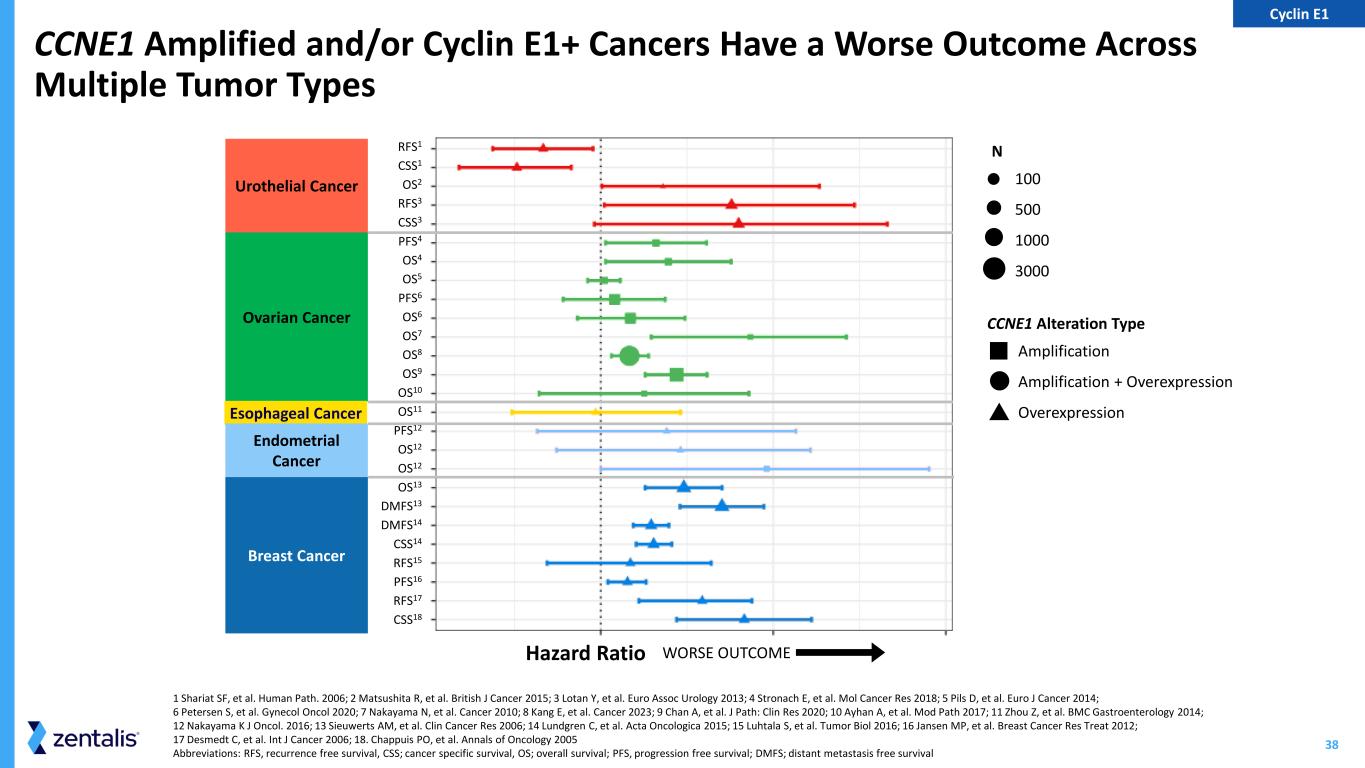
38 1 Shariat SF,等。Human Path. 2006;2 Matsushita R,等。2015 年英国癌症杂志;3 Lotan Y 等人。2013 年欧洲泌尿外科协会;4 Stronach E 等。Mol Cancer Res 2018;5 Pils D 等人2014 年 Euro J Cancer;6 Petersen S 等人。Genchol Oncol 2020;7 Nakayama N,等。Cancer 2010;8 Kang E 等人Cancer 2023;9 Chan A 等人。J Path:2020 年临床研究报告;10 Ayhan A 等。Mod Path 2017;11 Zhou Z 等BMC 胃肠病学 2014;12 Nakayama K J Oncol. 2016;13 Sieuwerts AM 等人Clin Cancer Res 2006;14 Lundgren C 等人。Acta Oncologica 2015;15 Luhtala S 等人。Tumor Biol 2016;16 Jansen MP 等2012 年乳腺癌研究治疗;17 Desmedt C 等人。2006 年国际癌症杂志;18.Chappuis PO 等人2005 年肿瘤学年鉴缩写:RFS,无复发存活率,CSS;癌症特异性存活率,操作系统;总存活率;PFS,无进展存活率;DMFS;远距离无转移存活 CCNE1 扩增和/或细胞周期蛋白 E1+ 癌症在多种肿瘤类型中的预后较差 N 100 500 1000 3000 危险比率更差 CCNE1 改变类型扩增扩增 + 过表达过度表达 RFS1 CS2 RFS1 CS3 SS3 PFS4 OS4 OS5 PFS6 OS6 OS7 OS8 OS9 OS10 OS11 PFS12 OS12 OS12 OS13 DMFS13 DMFS14 CSS14 RFS15 PFS16 RFS17 CSS18 尿路上皮癌卵巢癌乳腺癌食道癌子宫内膜癌 Cyclin E1
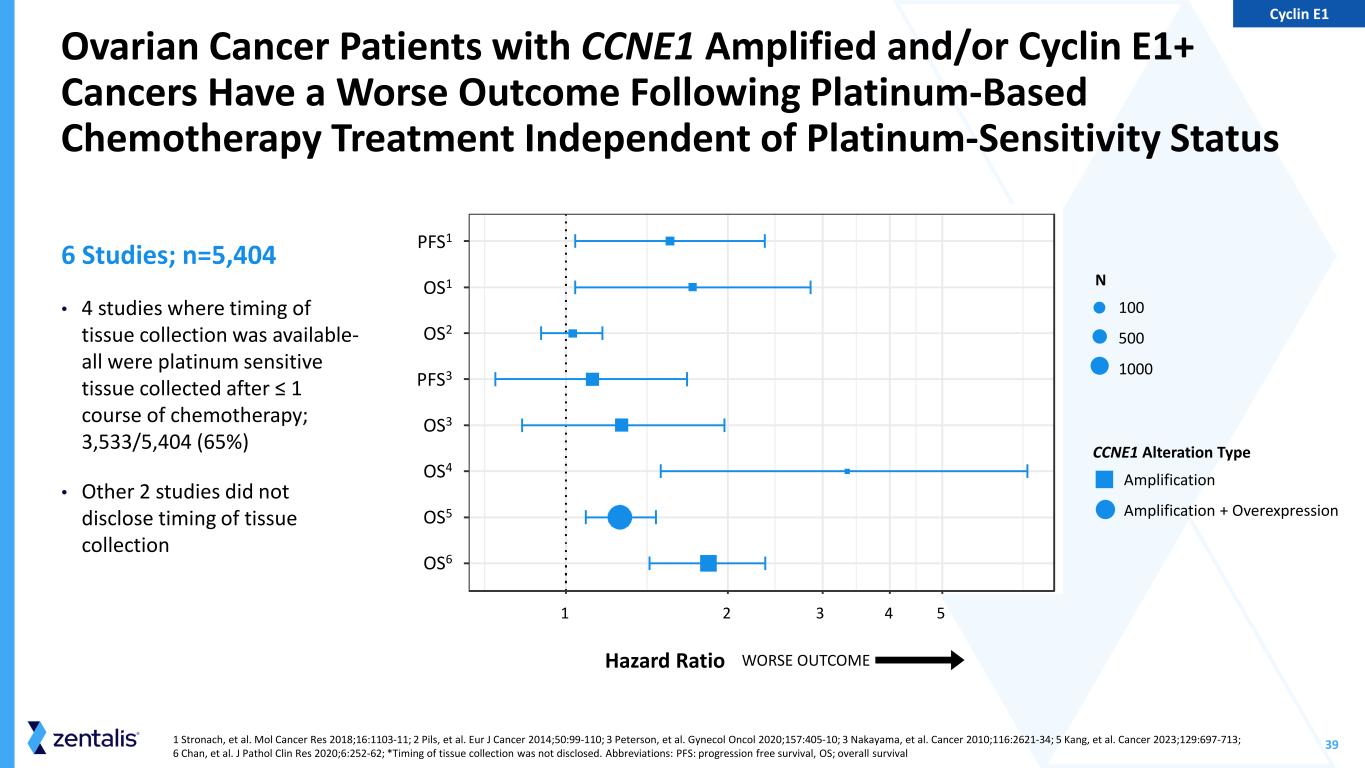
391 斯特罗纳赫等人Mol Cancer Res 2018;16:1103-11;2 Pils 等。Eur J Cancer 2014;50:99-110;3 Peterson 等人。Genchol Oncol 2020;157:405-10;3 Nakayama 等。Cancer 2010;116:2621-34;5 Kang 等。巨蟹座 2023;129:697-713;6 Chan 等。J Pathol Clin Res 2020;6:252-62;*组织采集的时间尚未披露。缩写:PFS:无进展存活率,OS;总存活率 CCNE1 放大和/或周期蛋白 E1+ 癌症患者在接受铂类化疗后预后较差 6 项研究;n=5,404 • 4 项有组织采集时机的研究——均为在 ≤ 1 个疗程化疗后采集的铂敏感组织;3,533/5,404 (65%) • 其他 2 项研究有没有透露组织采集的时机 1 2 4 53 PFS1 OS1 OS2 PFS3 OS3 OS4 OS5 OS6 危险比率结果更差 CCNE1改变类型扩增放大 + 过度表达 N 100 500 1000 Cyclin E1
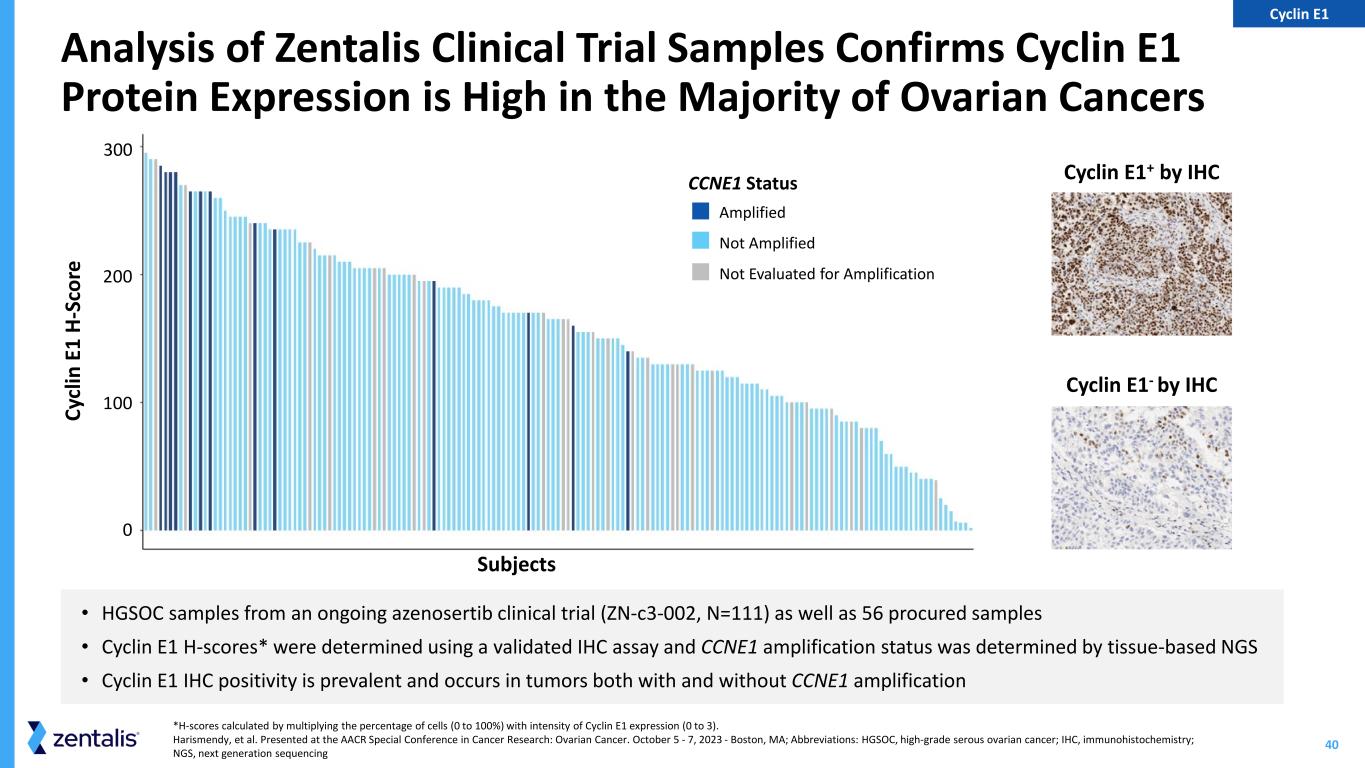
40 *H 分数是通过将细胞百分比(0 到 100%)乘以 Cyclin E1 表达强度(0 到 3)计算得出的。哈里斯门迪等在AACR癌症研究特别会议上发表:卵巢癌。2023年10月5日至7日——马萨诸塞州波士顿;缩写:HGSOC,高级别浆液性卵巢癌;IHC,免疫组织化学;NGS,Zentalis临床试验样本的下一代测序分析证实大多数卵巢癌的细胞周期蛋白E1蛋白表达量很高 • 正在进行的azenosertib临床试验(ZN-C3-002,N=111)的HGSOC样本以及56份采集样本 • Cyclin E1 H-scores* 是使用经过验证的 IHC 分析测定的,CCNE1 扩增状态由组织基于 NGS 确定 • Cyclin E1 IHC 阳性普遍存在并发生在IHC 受试者 IHC Cyclin E1+ 有和没有 CCNE1 扩增的肿瘤 IHC 受试者 Cy cl 在 E 1 H-Sc 或 e 300 200 100 0 CCNE1 状态扩增未扩增未进行扩增评估周期蛋白 E1
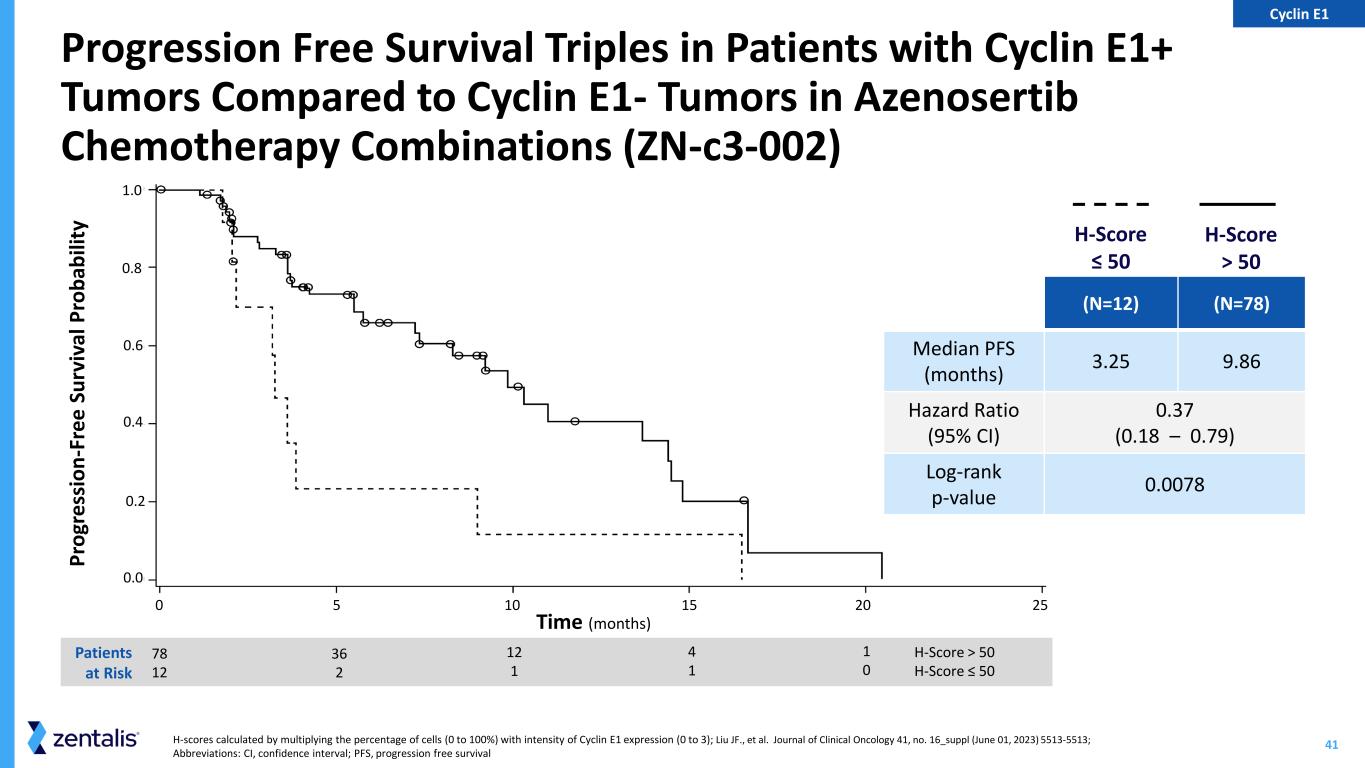
41H 分数是通过将细胞百分比(0 到 100%)乘以 Cyclin E1 表达强度(0 到 3)计算得出的;Liu JF. 等人《临床肿瘤学杂志》41,第 16_suppl(2023 年 6 月 1 日)5513-5513;缩写:CI,置信区间;PFS,细胞周期蛋白 E1+ 肿瘤患者无进展存活率与 Azenosertib 化疗组合 (Zn-C3-002) 中的细胞周期素 E1-肿瘤相比,无进展存活率为三倍(Zn-C3-002)0 0.0 0.2 0.4 0.6 0.8 5 10 15 20 Pr og re ss io-Fr ee s ur vi va l P ro ba ba ba bi lit 按时间(月)列出风险患者 78 12 12 1 1 1 1 0 H 分数 > 50 H 评分 ≤ 50(N = 12)(N = 78)PFS 中位数(月)3.25 9.86 危险率(95% 置信区间)0.37(0.18 — 0.79)对数等级 p-值 0.0078 H 分数 ≤ 50 H 分数 > 50 Cyclin E1
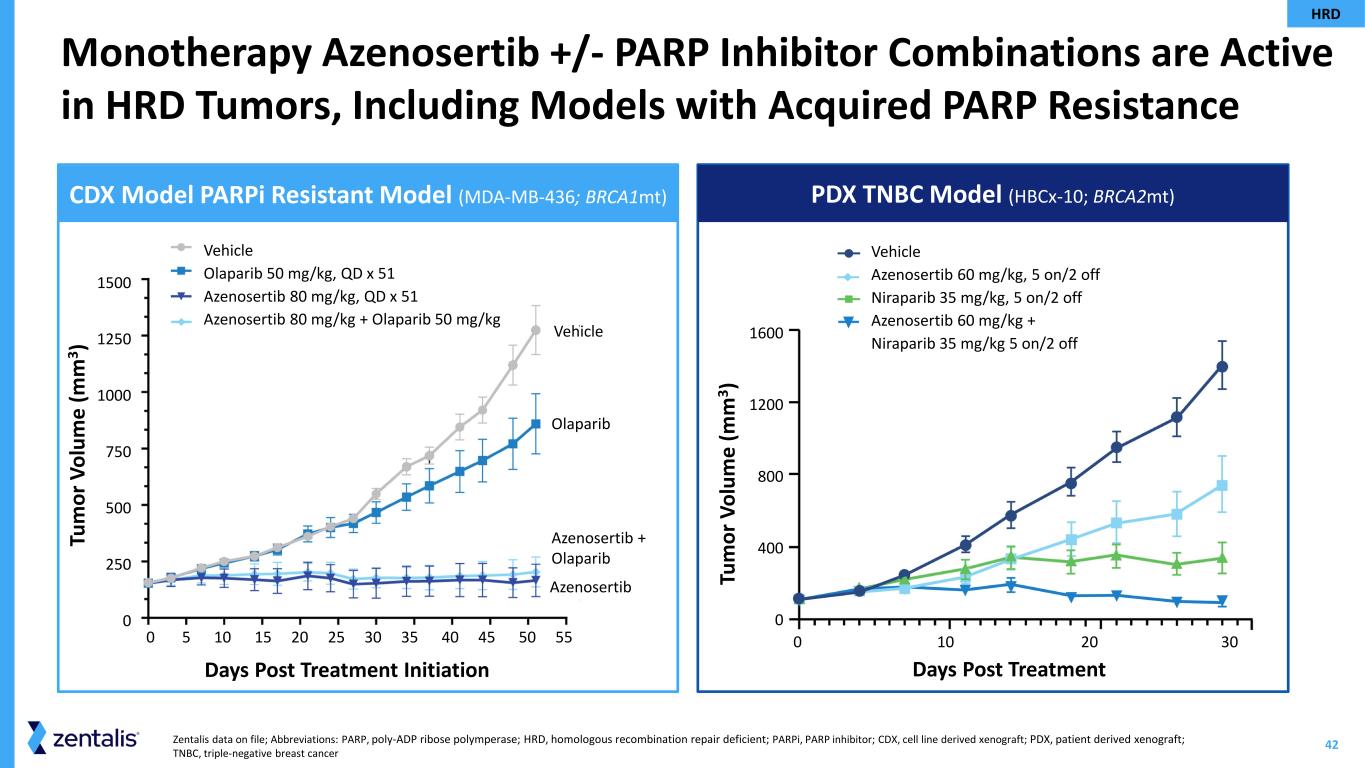
42 1600 1200 800 400 0 0 0 10 20 30 Zentalis 存档数据;缩写:PARP、Poly-ADP 核糖聚合酶;HRD,同源重组修复缺乏;parPi,PARP 抑制剂;CDX,细胞系衍生异种移植;TNBC,三阴性乳腺癌单一疗法 Azenosertib +/-抑制剂组合在 HRD 肿瘤中具有活性,包括具有获得性 PARP 耐药性的模型 TNBC ModelPDX TNBC 模型 (Hbcx-10;brca2MT) CDX 模型 parPi 耐药模型 (MDA-MB-436;brca1MT) HRD Tu m 或 V ol um e (m m 3) 天后开始治疗1500 1250 1000 750 500 0 0 5 10 15 20 25 30 35 40 45 50 55 车辆 Olaparib 50 mg/kg,QD x 51 Azenosertib 80 mg/kg,QD x 51 Azenosertib 80 mg/kg + Olaparib 50 mg/kg 车辆奥拉帕里布 Azenosertib Azenosertib + Olaparib Tu m 或 V ol um e (m m 3) Days 治疗后车辆 Azenosertib 60 mg/kg,5 on/2 关闭 Niraparib 35 mg/kg,5 on/2 关闭 Azenosertib 60 mg/kg + Niraparib 35 mg/kg 5 on/2 关闭
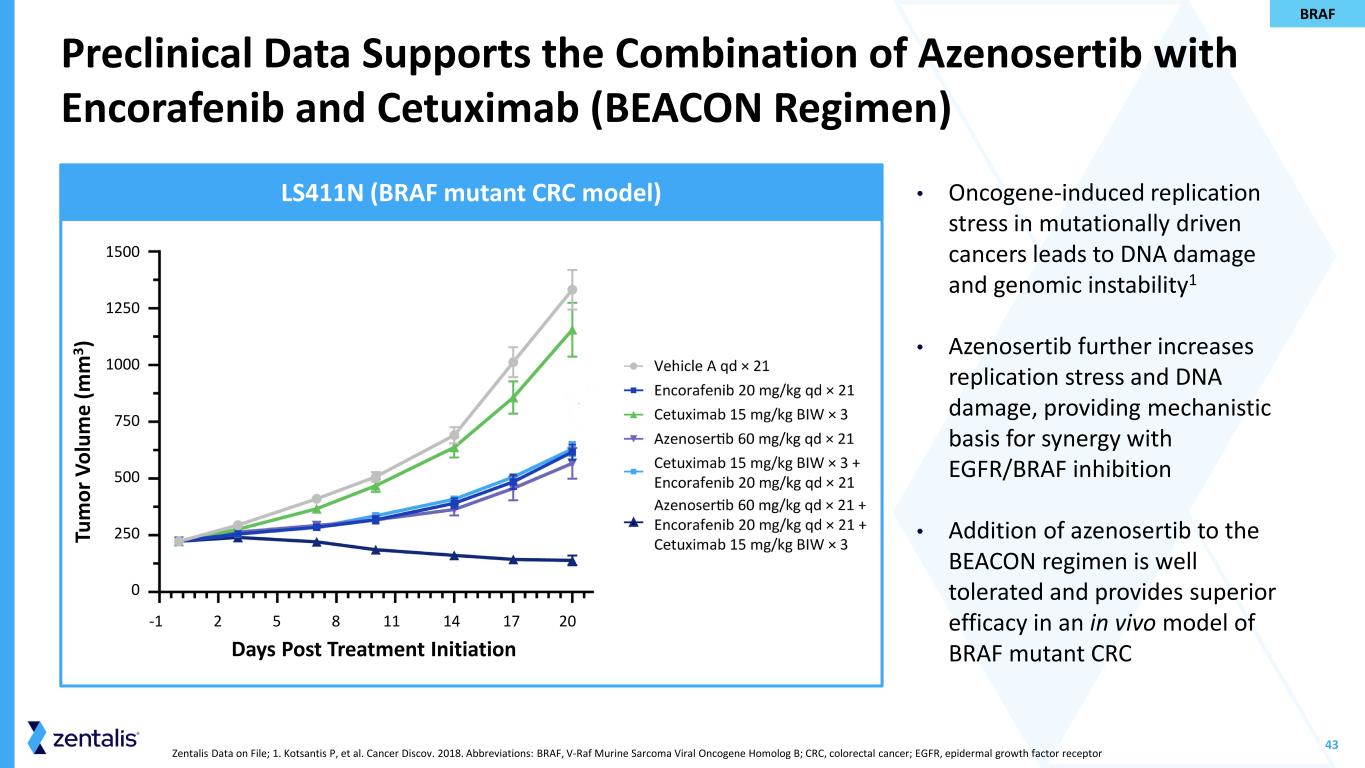
43 • 在突变驱动的癌症中,癌基因诱导的复制压力会导致 DNA 损伤和基因组不稳定1 • Azenosertib 进一步增加复制压力和 DNA 损伤,为与 EGFR/BRAF 抑制的协同作用提供机制基础 • 在 BEACON 方案中添加氮舍替布具有良好的耐受性,在 BRAF 突变体 CRC 的体内模型中提供卓越的疗效支持结合 Azenosertib 含有 Encorafenib 和 Cetuximab(BEACON 方案)LS411N(BRAF 突变体 CRC 模型)Zentalis 存档数据;1.Kotsantis P 等人Cancer Discov. 2018。缩写:BRAF、V-Raf 小鼠肉瘤病毒癌基因同系物 B;CRC,结直肠癌;表皮生长因子受体 Tu m 或 V ol um e (m m 3) 治疗开始后的天数 1500 1250 1000 750 250 0 -1 2 5 8 11 14 17 20 BRAF
44 缩写:BRAF、V-Raf 小鼠肉瘤病毒癌基因同系物 B;mCRC,转移性结直肠癌;EGFR,表皮生长因子受体;MTD,最大耐受剂量;RP2D,推荐的 2 期剂量;ORR,客观缓解率;DCR,疾病控制率;PFS,自由生存期;TTP,进展时间;2H,下半年;2L,二线 zn-c3-016:与辉瑞合作在 BRAF mCRC 中进行的 1/2 期试验关键资格:BRAF V600E 突变 mCRC;先前 1 或 2 种转移性疾病方案后的疾病进展;先前的治疗可能包括 BRAF 和/或 EGFR 导向治疗(例如,在 BEACON 方案后可能已取得进展)Encorafenib 联合西妥昔单抗(BEACON)是 BRAF V600E mCRC 2L 治疗的护理标准 1 阶段:安全性、耐受性、MTD、RP2D 第 2 阶段:剂量扩展阶段 1:剂量查找主要目标第 2 阶段:ORR、DOR、DCR、PFS、TTP azenosertib + encorafenib + cetuximab 的剂量水平不断上升 n=最多 80 名患者的初始数据 2024 年下半年 BRAF NCT05743036
45 3 2 1 缩写:IHC,免疫组织化学;PARP,Poly-ADP 核糖聚合酶;BRAF,V-Raf 小鼠肉瘤病毒癌基因同系物 B;EGFR,表皮生长因子受体;HRD,同源重组修复缺乏强有力的理由支持Azenosertib在基因组不稳定性高的癌症中的持续临床开发 Cyclin E1 状态为预测性临床前模型中azenosertib的灵敏度 • DENALI(ZN-C3-005)正在前瞻性地评估 CCNE1 扩增和 Cyclin E1 IHC 作为潜在的患者富集策略多种 HRD 模型中的单一疗法活性 • MAMMOTH(ZN-C3-006)正在评估单一疗法以及与尼拉帕尼联合治疗对抗PARP、铂耐药卵巢癌的 Azenosertib 可增强结直肠癌临床前模型中抑制 BRAF + 表皮生长因子的疗效 • ZN-C3-016 正在评估阿泽诺舍替布与恩科拉非尼和西妥昔单抗联合使用的疗效 BRAFV600E 转移性结直肠癌

BCL-2 抑制剂 (Zn-d5) 与 Azenosertib 联合使用为治疗已知预后不佳、需求未得到满足的急性髓系白血病患者提供了机会

47 1.美国癌症协会。2023年癌症事实与数据、SEER和ECIS。2 个数字代表公司根据患有公司目标适应症所涵盖疾病的美国患者得出的最佳估计。资料来源 DRG Clarivate、Kantar Health 3 Shimony、S 等Am J Hematol. 2023;98 (3):502-526;4 Maiti A 等人《癌症杂志》28 (1) 2022年缩写:CR,完全反应;R/R,复发/难治性;OS,总存活率;AML,急性髓系白血病复发/难治性急性髓系白血病仍然是一种毁灭性疾病,是尚未满足的主要医疗需求 • 成人中最常见的急性白血病;大约 60 岁的患者的 5 年存活率约 10% 3 • 57% 患者要么在 CR 后复发,要么是原发性难治性患者,要么在 12 个月内死亡3 • 复发/难治患者的预后特别惨淡,中位操作系统为 3-6 个月3 • BCL-2 抑制剂(例如 venetoclax) 是 AML4 的基础治疗方法 33,000 例确诊死亡 17,000 例死亡 ~15,000 例复发或难治性 (R/R) 2023 年美国/欧盟 5 估计新发病例和患者死亡1 2023 美国/欧盟 5 药物治疗2 AML

48 HL-60(体外)HL-60(体外)1.Izadi H 等人AACR 2022 Cancer Res (2022) 82 (12_supplement): 2591;存档的数据/报告,Zentalis 制药 Zn-d5 和 Azenosertib 的组合可增强细胞凋亡、DNA 损伤和协同抗肿瘤活性--+-+ 6小时裂解-Caspase-3 Zn-d5 100 nM azenosertib 250 nM azenosertib 250 nM Casenosertib-+-+ 6 小时裂解-Caspase-3 Zn-d5 100 nM azenosertib 250 nM azenosertib 3 Actin γH2AX 细胞凋亡 DNA 损伤协同效应在两种药物的低效剂量下可见协同效应 Tu m 或 V ol um e (m m 3) 载体 qdx 21 Zn-d5 50 mg/kg qdx 21 azenosertib 80 mg/kg qdx 21 zn-d5 50 mg/kg qdx 21治疗的最后一天 AML

49 改编自 Heuser、Y. 等人艾尔。《肿瘤学年鉴》31 (6) 697-712 2020;缩写:AML,急性髓系白血病;SCT,干细胞移植尽管急性髓细胞白血病最近取得了进展和不断演变的治疗模式,但许多患者在复发后仍然缺乏治疗选择 Chemo/SCT 不符合资格:没有可操作的突变第二次复发:突变导向治疗后 AML 发生率 (2021) US + EU5 = ~33,000 212 复发/难治性 ~10,500 次符合治疗条件维持新诊断:前线约 4,500 次治疗符合条件未得到满足的急性髓细胞白血病

50 zn-d5-004c:在R/R AML中注册Zn-d5和Azenosertib的1/2期研究缩写:R/R,复发/难治性;AML,急性髓系白血病;RP2D,推荐的2期剂量;PK,药代动力学;ORR,客观反应率;CRi:完全反应,不完全计数恢复;MLFS:形态学无白血病状态;PR,部分缓解;cRH:完全缓解,部分血液学恢复;DoR;缓解持续时间;2H,下半部分关键资格:R/R AML;必须先前接受过至少 1 条急性髓细胞白血病 NCT05682170 疗法Zn-d5 + Azenosertib 剂量递增 Azenosertib 单一疗法剂量递增 Zn-d5 + Azenosertib 和组合 RP2D(s)安全性、耐受性、PK、RP2D(s)Azenosertib 单一疗法和 Zn-d5 + Azenosertib 剂量递增组合 A 部分剂量扩展 B 部分终点 ORR(CR + cRi + MLFS + PR);cRH;DoR;初始数据 2024 年下半年反洗钱

发挥 Azenosertib 的特许经营潜力

52 2023 年里程碑实现了 Zn-d5 BCL-2 抑制剂发现 2023 年第一季度启动与辉瑞合作的 BRAF 突变结直肠癌 BEACON 方案联合临床试验的注册 2023 年上半年在科学会议上为 Cyclin E1 富集策略提供临床前依据宣布单一疗法 RP2D,并提供剂量优化活动、计划时间表和潜在注册路径的最新信息 2023 年上半年 1b 期卵巢化疗联合试验的结果,包括有关Cyclin E1扩增的临床转化数据/过度表达 2023 年下半年更新实体瘤单一疗法剂量优化的中期疗效临床数据 2023 年下半年更新单一疗法项目时间表和潜在注册路径 2023 年下半年提供中期临床数据并申报 RP2D 2023 年下半年针对复发/难治性急性髓系白血病的 azenosertib + Zn-d5 临床试验的初步数据 2023 高级研究正在进行中关于未公开靶标的蛋白质降解计划 Azenosertib WEE1 抑制剂修订至 2024 年下半年
53缩写:1H,上半部分;2H 下半部分;BRAF,V-Raf 小鼠肉瘤病毒癌基因同系物 B;mCRC,转移性结直肠癌;parPi,多聚ADP核糖聚合酶抑制剂;R/R,复发性或难治性急性髓系白血病;PROC,耐铂性卵巢癌;USC,子宫血清 oma;PSOC,铂敏感性卵巢癌;1L,一线即将推出的临床里程碑单一疗法组合 2H 2H 1b 期实体瘤 azenosertib 单一疗法试验 (zn-c3-001) 的最终结果 2期 azenosertib 单一疗法试验的最终结果PROC(DENALI,ZN-C3-005)来自南加州大学(TETON,ZN-C3-004)2期 azenosertib 单一疗法试验 20252024 年下半年 1 期骨肉瘤 azenosertib + 吉西他滨试验的最终结果(Zn-C3-003)BRN 1 期 azenosertib + BEACON 疗法试验的最终结果 1 期 azenosertib + BEACON 疗法试验的最终结果辉瑞的 AF 突变体 mCRC (Zn-C3-016) 1H 在 1L 维持设置下启动 PSOC 临床试验 topline 数据来自 2 期 azenosertib、在 PARPI PROC 后与葛兰素史克合作的 niraparib 试验(MAMMOTH,Zn-C3-006)的初始数据来自复发性急性髓细胞白血病 1 期 azenosertib + Zn-d5 试验 (ZN-d5-006) 4c)
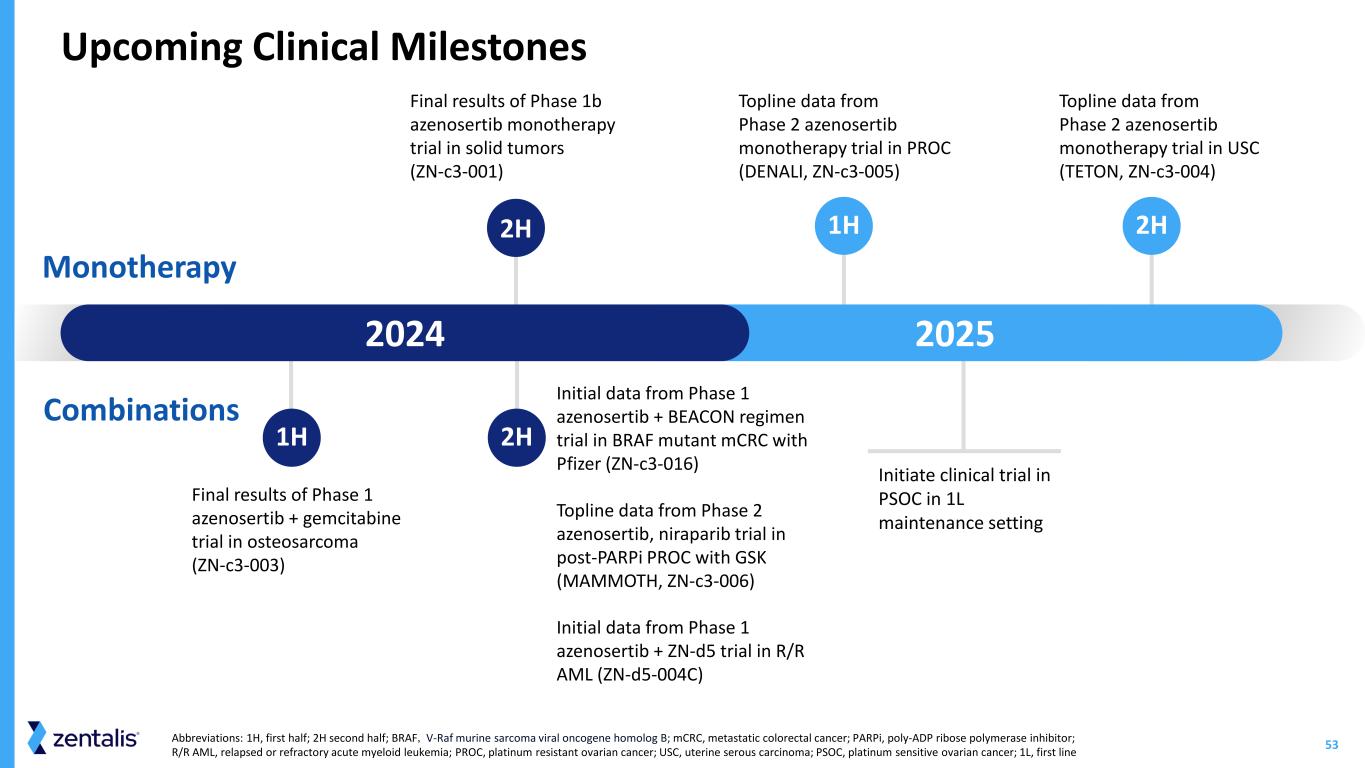
54缩写:MPF:无进展存活率中位数;ORR,客观缓解率;MPF,无进展存活率中位数;USC,子宫浆液性癌;1L,一线保密协议,新药申请;将azenosertib与其他药物进行比较的声明,而不是正面对比的陈述 Zentalis有望在Azenosertib系列中取得成功 • 单一疗法的疗效;37% 的ORR和6.5个月的MPFs在经过大量预处理的情况下有望取得成功卵巢和 USC • 疗效和安全性明确区分了azenosertib与其他 WEE1 抑制剂 • 比其他正在开发的 WEE1 抑制剂早了好几年可能是同类首屈一指和最佳的WEE1抑制剂 • 计划中的试验,因为卵巢癌维持1L有可能使最多的患者受益 • 与靶向药物联合应用临床策略支持重磅机遇多个短期价值转折点 • 未来18-24个月3项2期试验的读数以及其他数据更新 • 2026年可能的首个保密协议 • 由强劲的现金余额和2022年的资金支持 6

zentalis.com 金伯利·布莱克威尔,医学博士首席执行官 kblackwell@zentalis.com (212) 433-3787 梅利莎·埃珀利首席财务官 mepperly@zentalis.com (215) 290-7271 公司办公室 1359 百老汇套房 801 纽约州纽约 10018 科学中心 10275 科学中心大道套房 200 加利福尼亚州圣地亚哥 92121