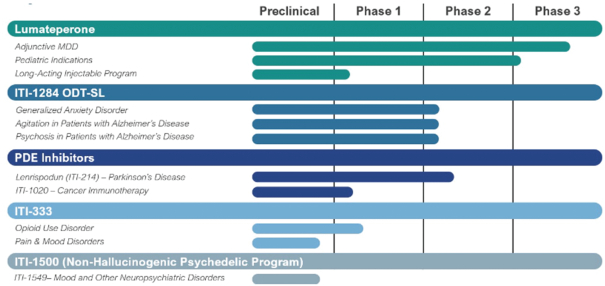
可能进行额外的注册试验,以支持补充新药申请(snDa),以批准卢马佩龙作为抗抑郁药的辅助疗法,用于治疗
MDD(如果需要)。我们预计将在2024年第二季度末公布第502号研究的主要结果,根据这些结果,我们预计将在2024年下半年向美国食品药品管理局提交sndA,批准lumateperone作为抗抑郁药的辅助疗法,用于
治疗MDD。
2020年第一季度,作为lumateperone双相抑郁症临床项目的一部分,我们
启动了第三项单一疗法的3期研究,即403号研究,评估了卢马匹龙作为单一疗法治疗与躁郁症I或双相情感障碍相关的重度抑郁发作中的单一疗法。继我们的辅助研究
(这是我们的双相抑郁症临床项目402号研究的一部分)取得积极结果之后,我们对403号研究进行了修订,以评估I型或双相情感障碍患者中具有混合特征的重度抑郁发作以及MDD
患者的混合特征。2023 年 3 月,我们宣布了 403 项研究的积极结果,即每天给予一次的 42 mg lumateperone 达到了该研究的主要终点,这表明在混合特征的 MDD 和混合特征的双相抑郁综合患者群体中,第 6 周的 MADRS
总分与安慰剂相比有统计学意义且具有临床意义的降低(与安慰剂相比降低 5.7 分;p
我们还有一项正在进行的研究,即304号研究,该研究评估了卢马佩隆预防精神分裂症患者复发的作用。该研究
分五个阶段进行,包括筛查阶段;为期6周的开放标签磨合阶段,所有患者每天将接受42毫克的卢马佩龙;为期12周的开放标签稳定阶段,在此期间,所有患者每天将接受42毫克的卢马佩龙;双盲治疗阶段,持续26周,在此期间,患者每天接受42毫克的
lumateperone 或安慰剂(比例为 1:1);以及为期2周的安全随访阶段。这项研究是根据我们在批准后向美国食品药品管理局做出的上市承诺
进行的,该承诺涉及批准CAPLYTA用于治疗精神分裂症,就像抗精神病药物一样。
在lumateperone
产品组合中,我们已经或正在对患有与自闭症谱系障碍相关的精神分裂症、双相情感障碍和易怒的儿科患者进行研究。此外,我们正在开发一种长效注射剂(
或 LAI),为精神疾病患者提供更多治疗选择。我们已经使用LAI配方进行了1期单一递增剂量研究。该研究评估了
lumateperone LAI 在精神分裂症症状稳定且总体上安全且耐受性良好的患者中的药代动力学、安全性和耐受性。我们正在评估其他几种治疗持续时间为一个月或更长时间的lumateperone LAI配方。我们已经完成了所有非临床研究,以支持启动另外四种LAI制剂的1期研究。我们预计将在2024年上半年开始这项研究的临床研究。鉴于迄今为止口服卢马佩龙具有令人鼓舞的疗效和良好的安全性,我们认为,特别是LAI选项可能成为某些患者的重要配方选择。
我们正在开发 ITI-1284-ODT-SL用于
治疗广泛性焦虑症、治疗痴呆患者的躁动和痴呆相关精神病的治疗。
ITI-1284-ODT-SL是 lumateperone 的一种氘化形式,这是一种新的分子实体,配方为口服崩解片,用于
舌下给药。 ITI-1284-ODT-SL采用口服固体剂型配制,放置在舌下
时几乎会立即溶解,便于老年人使用,可能特别有益于
2