| 精准肿瘤学 通过合成 杀伤力 2024 年 4 月 |
| 2 © 2024 Aprea Therapeutics, Inc. 版权所有 前瞻性陈述 本演示文稿中包含的某些信息包括经修订的1933年《证券法》第27A条、 和经修订的1934年《证券交易法》第21E条所指的 “前瞻性陈述”,与我们的临床试验、监管文件和战略计划有关。在某些情况下, 使用诸如 “预测”、“相信”、“潜在”、“继续”、“预期”、“估计”、“预期”、“计划”、“打算”、“可能”、“可能”、“可能”、“可能”、“将”、“应该” 或 等术语来传达未来事件或结果的不确定性,以识别这些前瞻性陈述。前瞻性陈述基于 我们管理团队当前的信念和期望,这些信念和期望涉及风险、环境的潜在变化、假设和不确定性。任何或全部 前瞻性陈述都可能是错误的,或者受到我们管理团队可能做出的不准确假设或已知或未知风险和 不确定性的影响。这些前瞻性陈述受风险和不确定性的影响,包括但不限于与我们的临床 试验或其他研究的成功和时机相关的风险,以及我们在向美国证券交易委员会提交的文件中列出的其他风险,包括我们的10-K表年度报告和10-Q表的 季度报告。关于我们的候选产品的前瞻性陈述还会受到额外的风险和不确定性的影响,包括没有 限制,这些风险和不确定性涉及:我们依赖额外的融资来为我们的运营提供资金并完成我们的产品 候选产品的开发和商业化,以及筹集此类额外资本可能限制我们的运营或要求我们放弃对技术或候选产品权利的风险;我们从阿特收购的资产的 历史和临床前状况有限林制药公司;我们的业务计划或成功实施 此类业务计划的可能性;启动候选产品计划临床试验的时机;此类试验的未来成功;我们的 研发计划和合作的成功实施以及对此类计划和合作结果和结果的解释,以及此类结果 是否足以支持我们的候选产品的未来成功;我们的预期成功、时机和成本我们目前的临床试验候选产品; 启动时间、无效分析、数据呈现、报告、公布和接收中期结果(包括但不限于任何临床前结果或 数据);关于我们对候选产品作用机制的理解以及对其临床 开发计划和任何合作研究的临床前和早期临床结果的解释的任何陈述;以及其他因素,包括我们无法控制的立法、监管、政治和经济发展。 出于所有这些原因,实际业绩和发展可能与我们的前瞻性陈述中表达或暗示的业绩和发展存在重大差异。 提醒您不要过分依赖这些前瞻性陈述,这些陈述仅在本演示之日作出。除非法律或法规要求,否则我们没有义务更新此类前瞻性陈述以反映后续事件或情况。 |
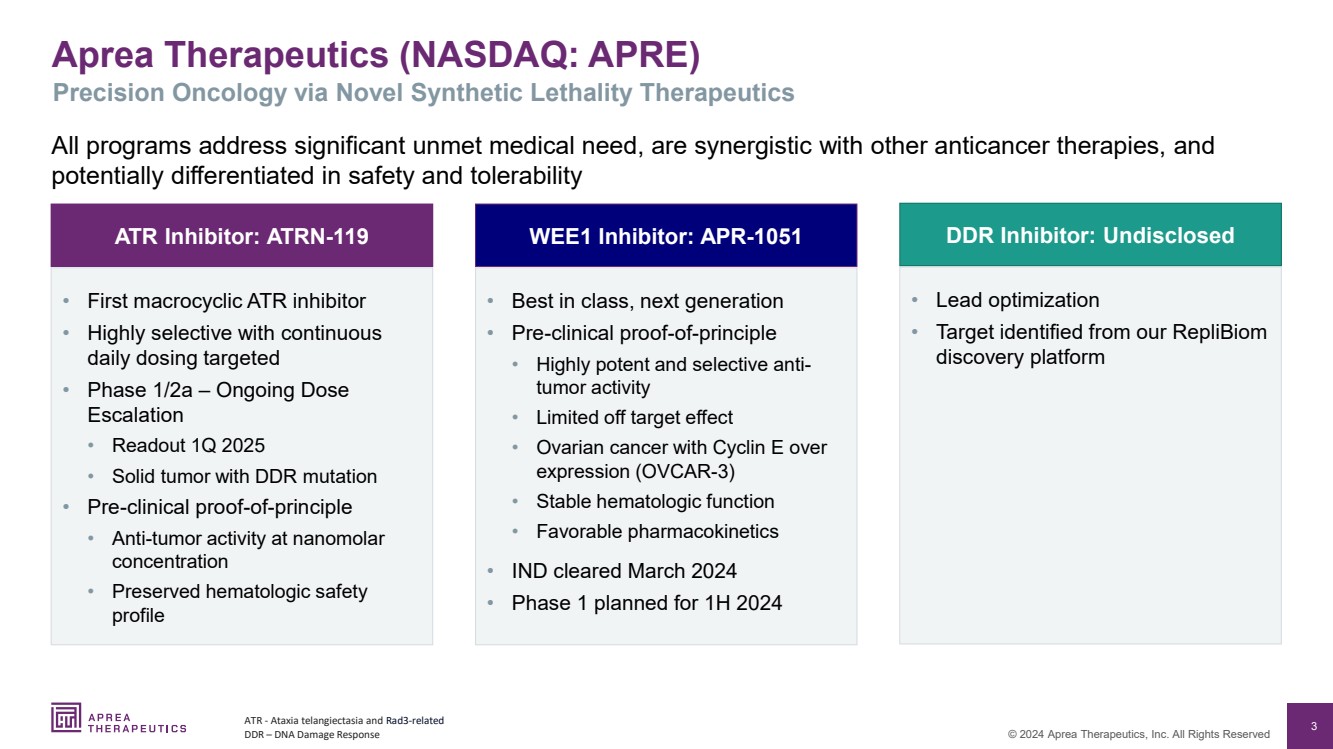
| 3 © 2024 Aprea Therapeutics, Inc. 版权所有 Aprea Therapeutics(纳斯达克股票代码:APRE) 所有项目均针对尚未满足的重大医疗需求,与其他抗癌疗法具有协同作用, 在安全性和耐受性方面可能存在差异 ATR-共济失调毛细血管扩张症和与RAD3相关的 DDR — 通过新型肿瘤合成进行DNA损伤反应 精度 Lethality Therapeutics • 第一种大环类 ATR 抑制剂 • 高度选择性,每日连续给药定向 • 1/2a 阶段 — 持续剂量 递增 • 2025 年第一季度读数 •具有 DDR 突变的实体瘤 • 临床前原理验证 • 纳米摩尔 浓度下的抗肿瘤活性 • 保持血液学安全性 • 同类最佳,下一代 • 临床前原理验证 • 高效的选择性抗肿瘤活性 • 细胞周期蛋白 E 超过 的卵巢癌 br} 表达 (OVCAR-3) • 稳定的血液学功能 • 良好的药代动力学 • IND 2024 年 3 月获批 • 第 1 阶段计划于 2024 年上半年实施 • 先导药物优化 • 目标由我们确定Replibiom 发现平台 ATR 抑制剂:ATRN-119 WEE1 抑制剂:APR-1051 DDR 抑制剂:未公开 |
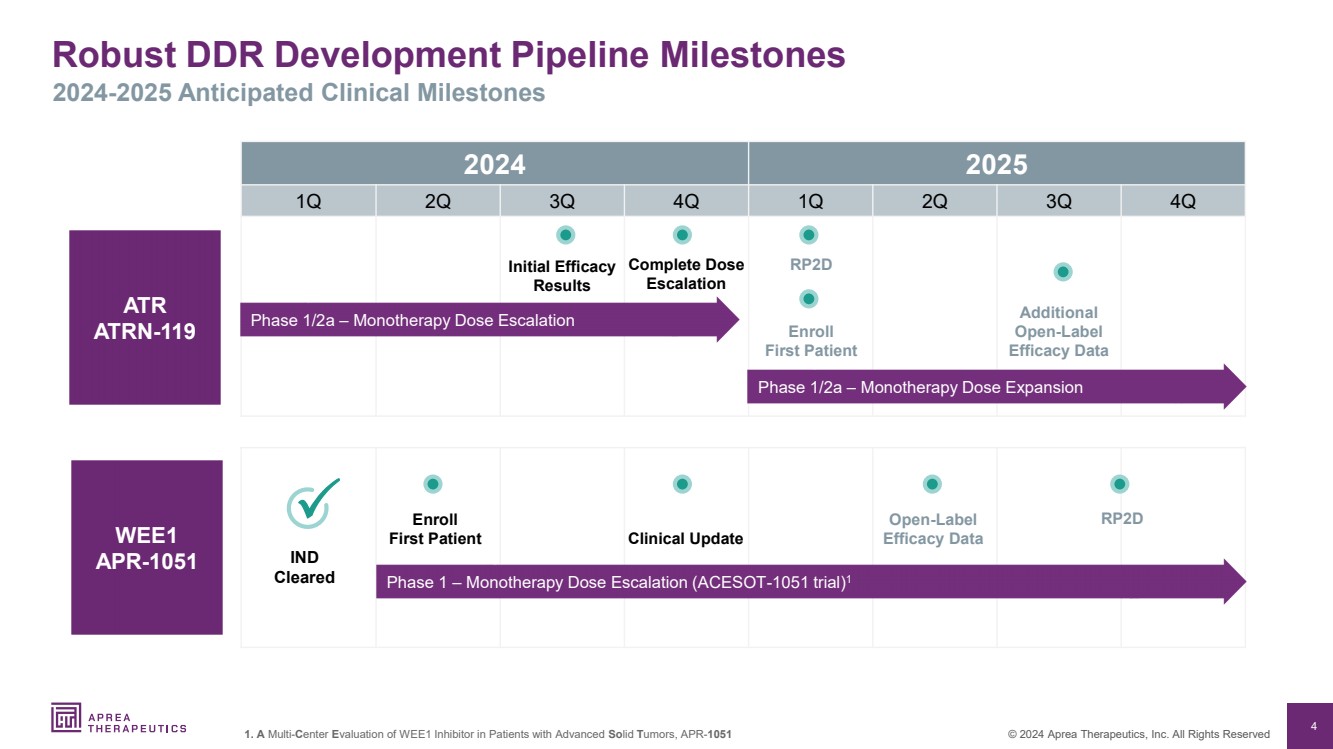
| 4 © 2024 Aprea Therapeutics, Inc. 版权所有 稳健的 DDR 开发管道里程碑 2024-2025 年预期临床里程碑 1.对晚期实体瘤患者中 WEE1 抑制剂的多中心评估,APR-1051 2024 2025 年第一季度第二季度第三季度第四季度 ATR ATRN-119 完整剂量 升级 RP2D 注册 首位患者 其他 开放标签 疗效数据 WEE1 APR-1051 第 1 阶段 — 单一疗法剂量递增(ACESOT-1051 试验)1 注册 首位患者 开放标签 RP2D 疗效数据 IND 已批准 临床更新 第 1/2a 期 — 单一疗法剂量扩大 阶段 1/2a — 单一疗法剂量递增 初始疗效 结果 |
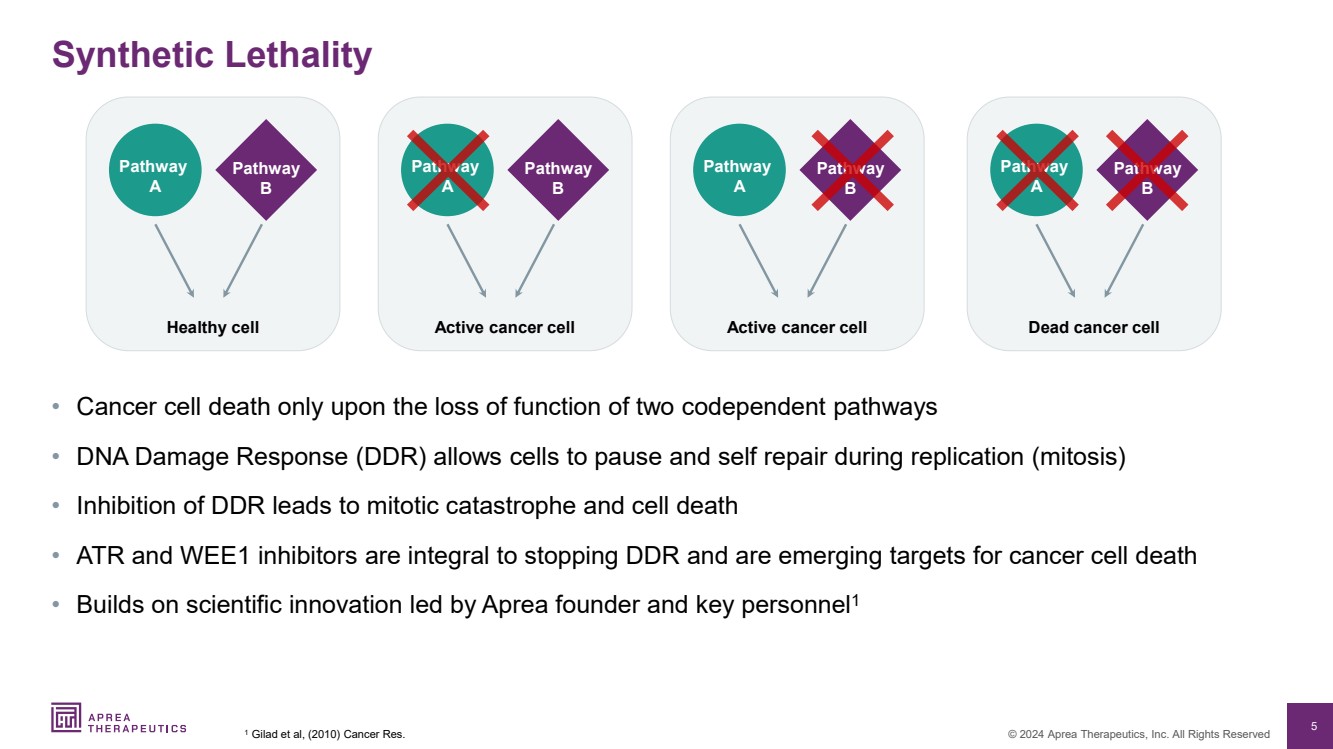
| 5 © 2024 Aprea Therapeutics, Inc. 版权所有 合成杀伤力 • 癌细胞只有在两种相互依赖的途径功能丧失时才会死亡 • DNA 损伤反应 (DDR) 允许细胞在复制过程中暂停和自我修复(有丝分裂) • 抑制 DDR 会导致有丝分裂灾难和细胞死亡 • ATR 和 WEE1 抑制剂是不可或缺的阻止复员重返社会并成为癌细胞死亡的新目标 • 建立在由Aprea创始人兼关键人员领导的科学创新基础上1 1 Gilad等人,(2010)《癌症研究》。 健康细胞 途径 A 途径 B 活性癌细胞 途径 A 途径 B 死癌细胞 途径 A 途径 路径 活性癌细胞 路径 路径 B 路径 |
| 6 © 2024 Aprea Therapeutics, Inc. 版权所有 具有强大药物研发和商业专业知识的领导地位 合成杀伤力的先驱 董事会 理查德·彼得斯医学博士 董事会主席 奥伦·吉拉德博士 总裁兼首席执行官 Jean-Pierre Bizzari,医学博士 Jean-Pierre Bizzari,医学博士 br} 导演 Marc Duey 导演 Michael Grissinger 导演 Gabriela Gruia,医学博士 导演 Rifat Pamukcu,医学博士 Bernd R. Seisinger,医学博士 br} 董事 奥伦·吉拉德博士 总裁兼首席执行官 John Hamill 高级副总裁兼首席财务官 Nadeem Mirza,医学博士, MPH 高级医学顾问 Ze'ev Weiss,注册会计师, 理学学士 首席商业顾问 迈克·卡尔顿博士 转化医学 顾问 Brian Wiley 企业 高级副总裁 企业 战略高级副总裁 |
| 7 © 2024 Aprea Therapeutics, Inc. 版权所有 ATR 抑制剂: ATRN-119 临床 概念验证 |
| 8 © 2024 Aprea Therapeutics, Inc. 版权所有 ATRN-119:第一种也是唯一的大环类 ATR 抑制剂1 大环类:一种进化的 PIK 相关激酶抑制方法(例如雷帕霉素和 mTOR)2-4 1 基于公司知识 2 Brown,EJ 等人,(1994)Nature 3 Brown,EJ 等人,(1995)Nature 4 Brown、EJ 和 SL Schreiber,(1996)Cell 独特的循环骨架结构与 竞争对手的第一代非环结构 宏循环的优势限制了 可以形成的构象数量,这可以: • 提高效力 br} • 提高选择性 然后 这些效果可以促进: • 通过 减少偏离靶向 来提高耐受性 • 允许更有效的 剂量 |
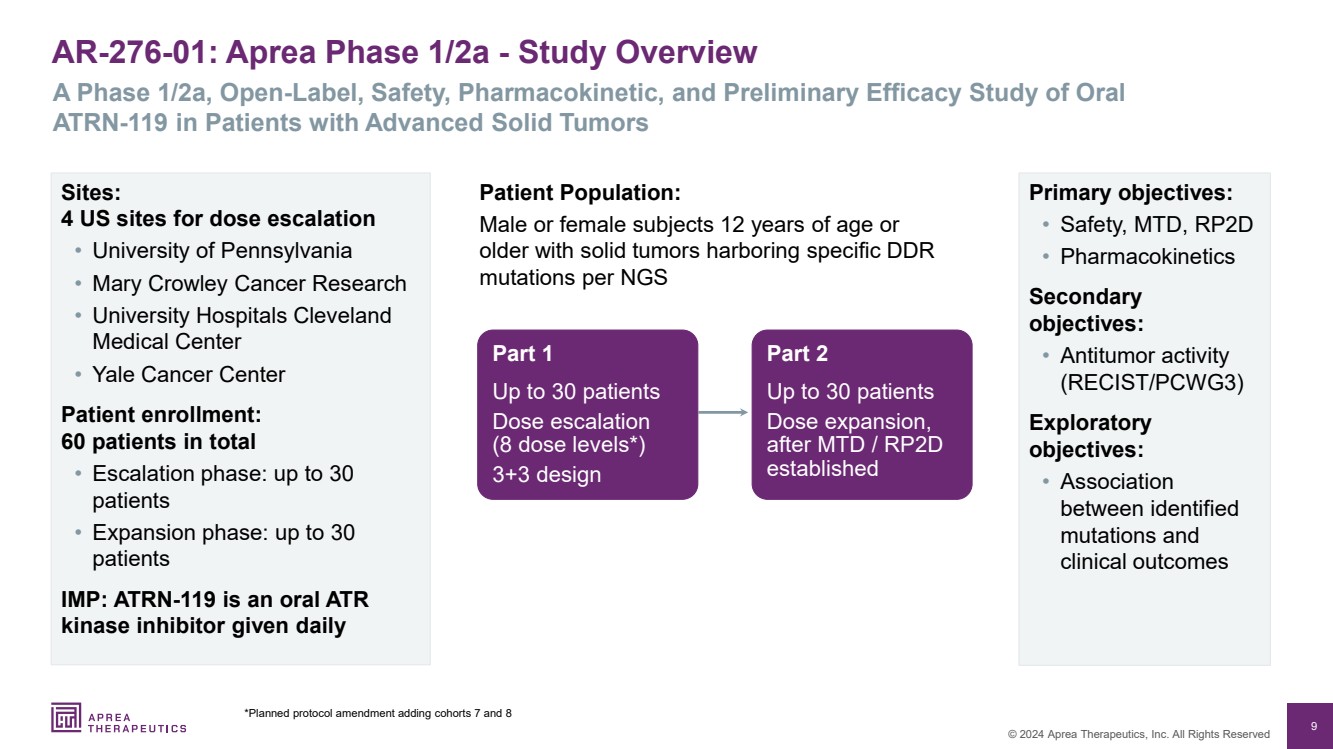
| 9 © 2024 Aprea Therapeutics, Inc. 版权所有 AR-276-01:Aprea 1/2a 期-研究概述 A 1/2a 期、开放标签、安全性、药代动力学和初步疗效研究 第 1 部分最多 30 名患者 剂量递增 (8 剂量水平*) 3+3 设计 主要目标: • 安全性、MTD、RP2D • 药代动力学 次要 目标: • 抗肿瘤活性 (RECIST/PCWG3) 探索性 目标: • 已识别的 突变与 临床之间的关联 ATRN-119结果 患者群体: 年满 12 岁或 的男性或女性受试者,其实体瘤在 NGS 第 2 部分中具有特定 DDR 突变的实体瘤 第 2 部分最多 30 名患者 剂量扩大, 在 MTD/RP2D 建立 之后 地点: 4 个美国剂量增加站点 • 宾夕法尼亚大学 • Mary Crowlele y 癌症研究 • 克利夫兰大学医院 医学中心 • 耶鲁癌症中心 患者入组: 共有 60 名患者 • 升级阶段:最多 30 名患者 • 扩张阶段:最多 30 名患者 IMP:ATRN-119 是每日给予口服 ATR 激酶抑制剂 *计划修订方案,增加队列 7 和 8 |
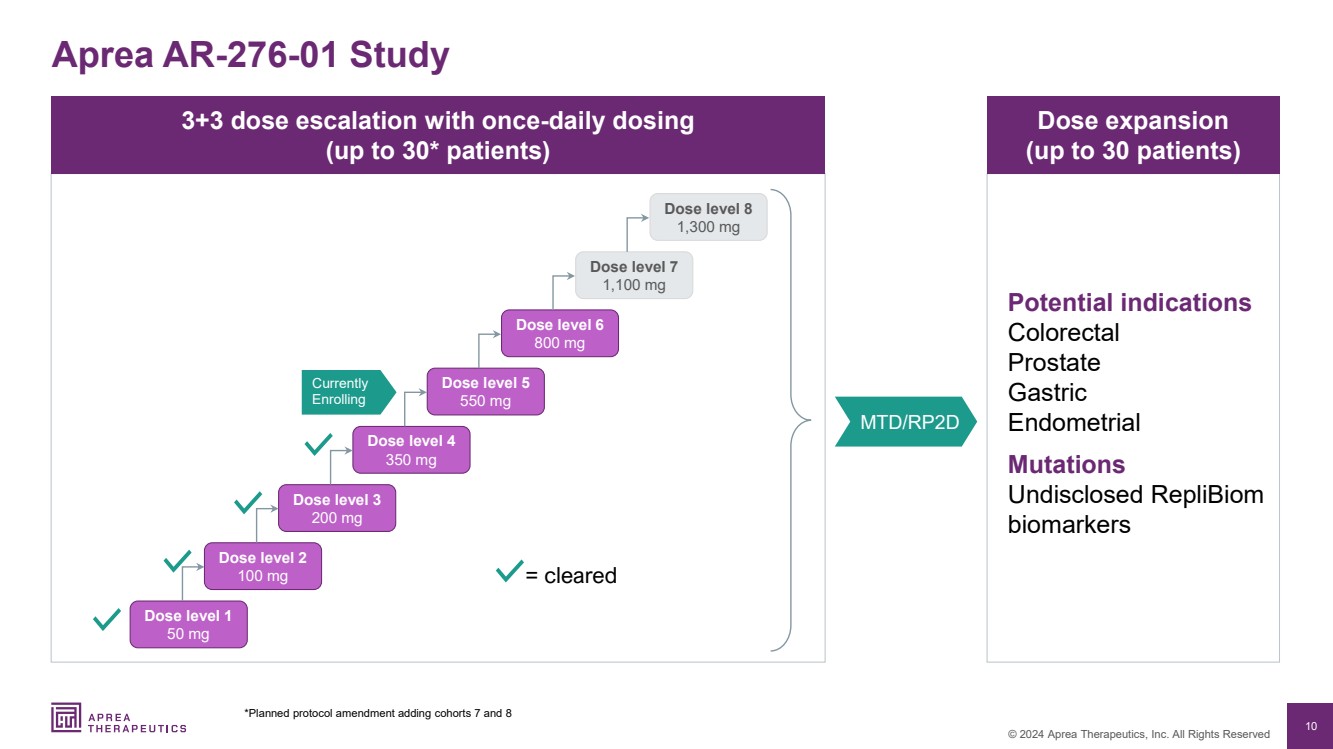
| 10 © 2024 Aprea Therapeutics, Inc. 版权所有 3+3 剂量递增,每日一次 (最多 30 名患者) 剂量扩大 (最多 30 名患者) 潜在适应症 结直肠 前列腺 胃部 子宫内膜 突变 未公开的 ReplibiOM 生物标志物 Aprea AR-276-01 研究 MTD/RP2D *计划中的协议修正案增加队列 7 和 8 = 已批准 剂量等级 1 50 mg 剂量等级 2 100 mg 剂量等级 3 200 mg 剂量等级 4 350 mg 剂量水平 5 550 mg 剂量等级 6 800 mg 目前 剂量等级 剂量水平 剂量等级 3 200 mg 剂量等级 4 350 mg 剂量水平 5 550 mg 剂量等级 6 800 mg7 级 1,100 mg 剂量等级 8 1,300 mg |
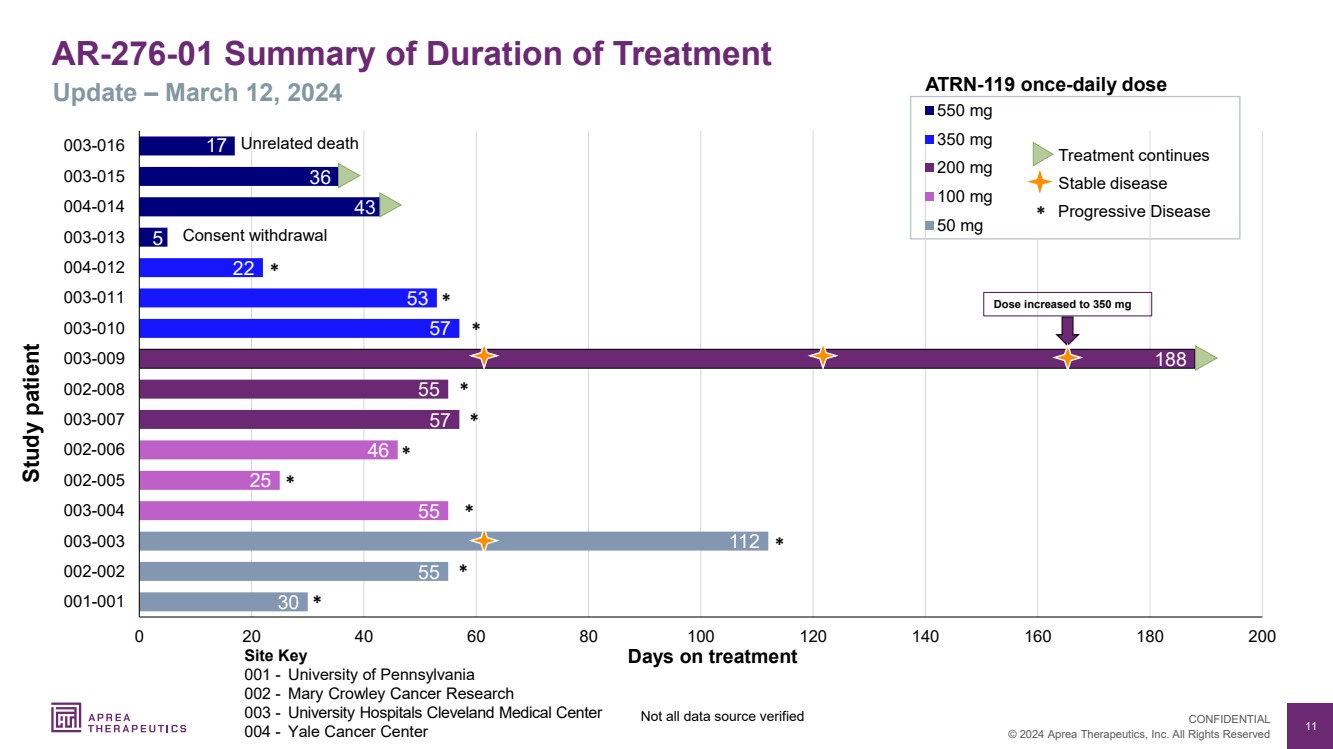
| 11 © 2024 Aprea Therapeutics, Inc. 版权所有 机密信息 001-宾夕法尼亚大学 002-玛丽·克劳利癌症研究 003-大学医院克利夫兰医学中心 004-耶鲁癌症中心 30 55 55 25 46 57 58 57 57 22 0 20 40 60 80 100 120 160 001-001 002 003-003 003-004 002-005 002-006 002-007 002-008 003-009 003-009 003-010 003-011 004-013 004-014 003-014 003-016 550 mg 350 mg 200 mg 100 mg 50 mg 无关死亡 AR-276-01 治疗持续时间摘要 更新 —2024 年 3 月 12 日研究患者 接受治疗的天数 * * * * * * * * * * * * 43 17 5 36 不是所有数据来源已验证 剂量增加到 350 mg ATRN-119 |
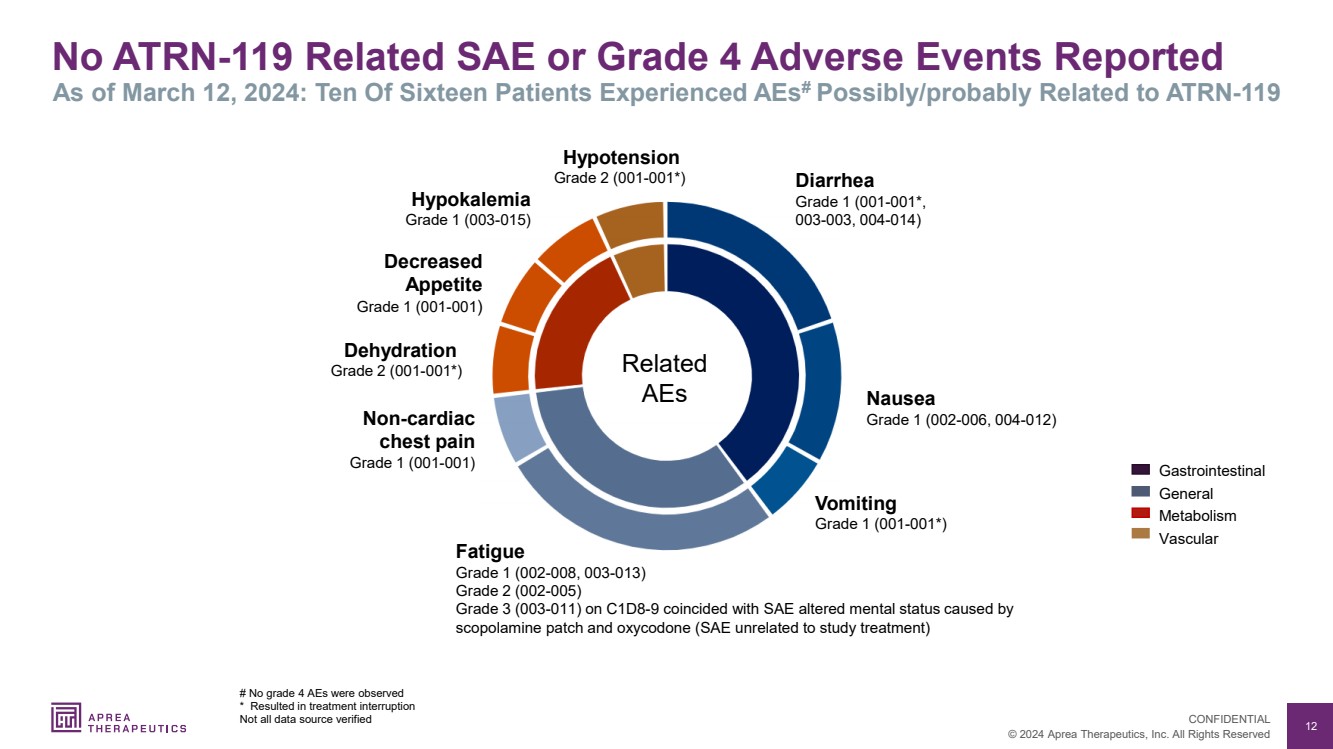
| 12 © 2024 Aprea Therapeutics, Inc. 版权所有 机密信息 截至 2024 年 3 月 12 日,未报告与 ATRN-119 相关的 SAE 或 4 级不良事件 :十六名患者中有 10 名可能/可能与 ATRN-119 有关 # 未观察到 4 级不良反应 导致治疗中断 并非所有数据源都经过验证 腹泻 1 级 (001-001*, 003-003、004-014) 呕吐 1 级 (001-001*) 非心脏 胸痛 1 级 (001-001) 脱水 2 级 (001-001*) 下降 {食欲 br} 1 级 (001-001) 低血压 2 级 (001-001*) 恶心 1 级(002-006,004-012) 疲劳 1 级(002-008,003-013) 2 级(002-005) 服用 C1D8-9 的 3 级(003-011)与 司波拉明补丁引起的 SAE 精神状态改变相吻合和羟考酮(SAE 与研究治疗无关) 胃肠道 一般 代谢 血管 相关 AEs 低钾血症 1 级(003-015) |
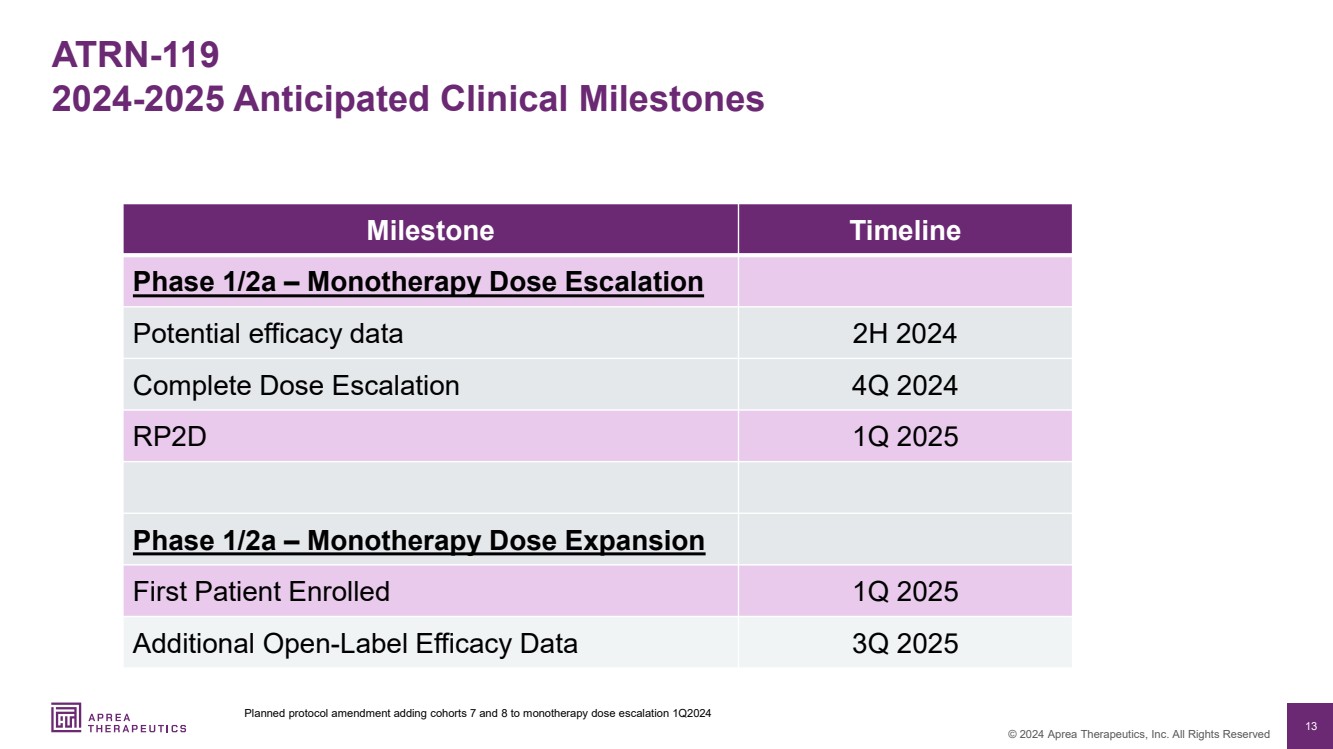
| 13 © 2024 Aprea Therapeutics, Inc. 版权所有 ATRN-119 2024-2025 预期临床里程碑 计划中的协议修正案增加了单一疗法剂量递增第 7 组和 8 组 1Q2024 里程碑时间表 第 1/2a 阶段 — 单一疗法剂量递增 2024 年下半年完全剂量递增 2024 年第 1 季度 RP2D 2025 年第一季度第 1/2a 期 — 单一疗法剂量扩展 2025 年第 1 季度新增开放标签的首位患者 2024 年下半年完全剂量递增 2024 年第 1 季度 RP2D 第 1/2a 阶段 — 单一疗法剂量扩展 2025 2025 年第三季度功效数据 |
| 14 © 2024 Aprea Therapeutics, Inc. 版权所有 ATR 抑制剂: ATRN-119 临床前 原理证明 |
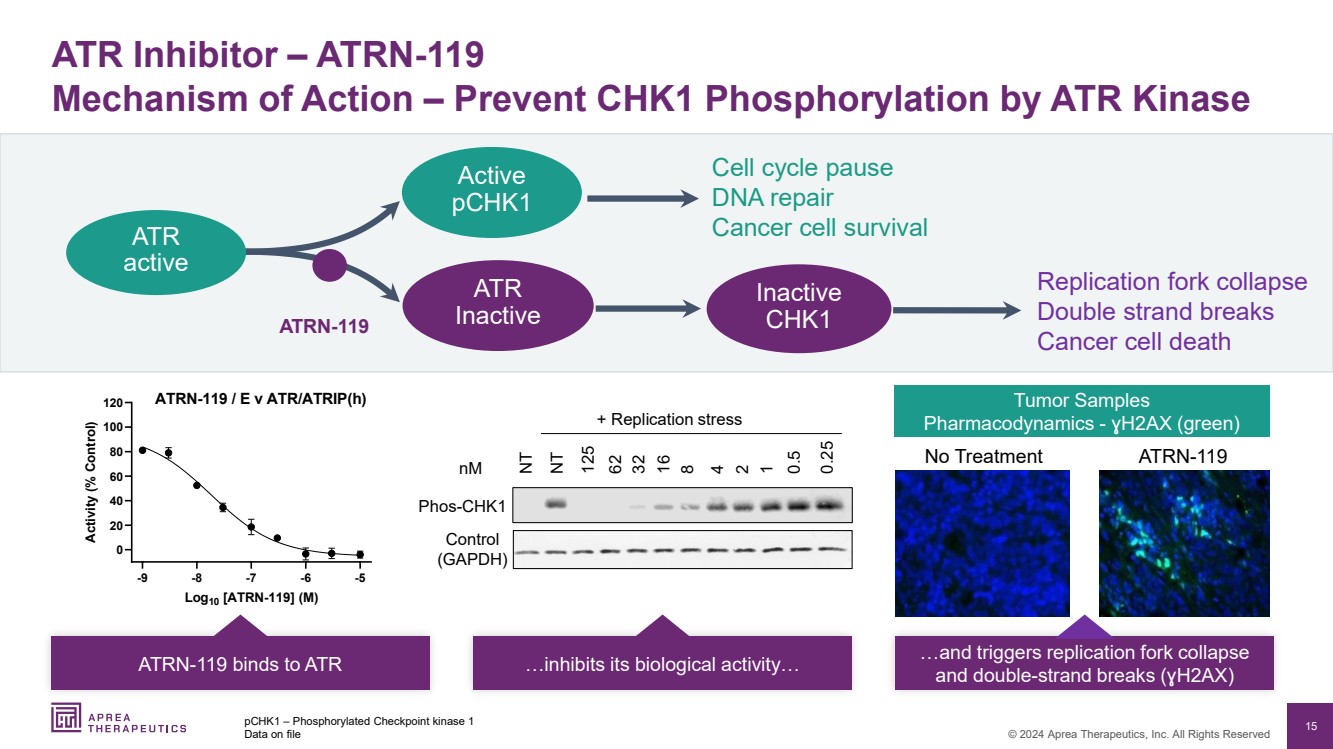
| 15 © 2024 Aprea Therapeutics, Inc. 版权所有 ATR 抑制剂 — ATRN-119 作用机制 — 防止 ATR 激酶 pchK1 磷酸化 — 磷酸化检查点激酶 1 存档数据 无治疗 ATRN-119 肿瘤样本 药效学-H2AX(绿色) -9 -8 -7 -6 -5 20 40 60 120 100 ATRN-119/E v ATR/ATRIP (h) Log10 [ATRN-119](M) 活性 (% Control) ATRN-119 与 ATR 结合... 抑制其生物活性... 并触发复制叉崩溃 和双链断裂 (H2AX) -9 -8 -7 -6 -5 0 20 40 60 80 100 120 ATRN-119/E v ATR/ATRIP (h) Log10 [ATRN-119](M) A c t i v i t y ( % o n t t o o o o ) NT NT 125 62 32 16 8 4 2 1 phos-chkks1 控制 (GAPDH) nM 0.5 0.25 + 复制压力 复制叉崩溃 双链断裂 癌细胞死亡 ATR 非活性 ATRN-119 活性 pChk1 非活性 ATR 活性 细胞周期暂停 DNA 修复 癌细胞存活率 |
| 16 © 2024 Aprea Therapeutics, Inc. 版权所有 ATRN-119 临床前概况 体外纳米摩尔效力 在体内观察到强大的肿瘤控制力,包括在具有挑战性的遗传背景下 N=每组 4 只雌性小鼠,ATRN-119-100 mg/kg/天 P.O,ATRN-157-20 mg/kg/天 SQ。 ATRN-157 是一种活性代谢物,在接受 ATRN-119 P.O. 的狗身上被发现对犬和人类肝细胞以及 肝微粒体的体外代谢研究表明,这两个物种都形成 ATRN-157。ATRN-157 的效力和选择性与 ATRN-119 相当。 使用 ATRN-119 和 ATRN-157 进行临床前研究。 肿瘤生长抑制 HCT-116(KRASG13D,p53 空值) 体重 HCT-116(KRASG13D,p53 空值) |
| 17 © 2024 Aprea Therapeutics, Inc. 版权所有 ATRN-119 + Olaparib: brca2 缺陷卵巢 (HGSOC) 肿瘤回归 N=6-8 只小鼠,ATRN-119-90 mg/kg P.O BID,奥拉帕尼-50 mg/kg P.O,P.O 50 mg/kg P.O,Atrn-119+Olaparib,剂量和时间表相同。 使用 ATRN-119 进行临床前研究。 存档数据 ATRN-119 + Olaparib 可抑制 卵巢肿瘤随时间推移的生长 ATRN-119 + Olaparib 显示 随着时间的推移体重减轻可忽略不计 人卵巢 PDX 肿瘤生长抑制 人类卵巢 PDX |
| 18 © 2024 Aprea Therapeutics, Inc. 版权所有 ATR 抑制剂: ATRN-119 A 潜在的 差异化 aTrI |
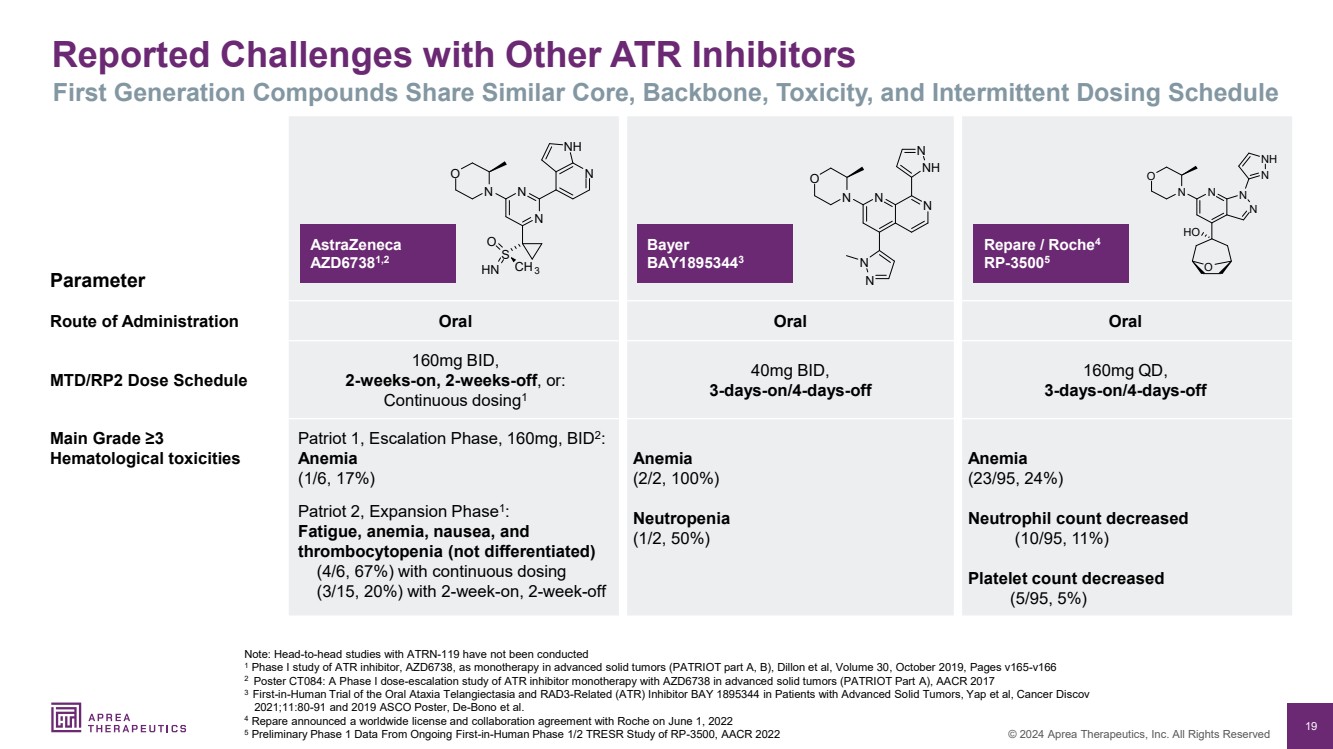
| 19 © 2024 Aprea Therapeutics, Inc. 版权所有 报告的其他 ATR 抑制剂面临的挑战 第一代化合物具有相似的核心、主干、毒性和间歇性给药时间表 尚未进行 将 ATR 抑制剂 AZD6738 作为晚期实体瘤单一疗法(PATRIOT A、B 部分),Dillon 等人,第 30 卷,2019 年 10 月,第 v165-v166 页 2 海报 CT084:晚期实体瘤中使用 AZD6738 进行 ATR 抑制剂单一疗法的 I 期剂量递增研究(PATRIOT A 部分),ATRN-119AACR 2017 3 针对晚期实体瘤患者的口服共济失调毛细血管扩张症和 RAD3 相关 (ATR) 抑制剂 BAY 1895344 的首次人体试验,Yap 等人,Cancer Discov 2021;11:80-91 和 2019 年 ASCO 海报,De-Bono 等人 4 Repare 于 2022 年 6 月 1 日宣布了与罗氏的全球许可和合作协议 5 正在进行的 RP-3500 的首次人体 1/2 期 TRESR 研究的初步第一阶段数据,AACR 2022 参数 口服口服 MTD/RP2 剂量表 160mg BID, 2 周后,2 周休息,或: 连续给药1 40mg BID, br} 3 天/4 天休息 160mg QD, 3 天/4 天休息 主等级 ≥3 血液学毒性 爱国者 1,升级阶段,160mg,BID2: 贫血 (1/6,17%) 爱国者 2,扩展阶段 1: 疲劳,贫血、恶心和 血小板减少症(未分化) (4/6,67%),持续给药 (3/15,20%),连续给药 2 周 贫血 (2/2,100%) 中性粒细胞减少症 (1/2,50%) (23/95,24%) br} 中性粒细胞计数减少 (10/95,11%) 血小板数量减少 (5/95,5%) 阿斯利康 AZD67381,2 拜耳 BAY18953443 Repare/Roche4 RP-35005 N N N N N O N O N N O N O N N O N O N O N O {br N N N O O O HN CH3 N NH N N N N O N N N N N N N N N N N N N N { |
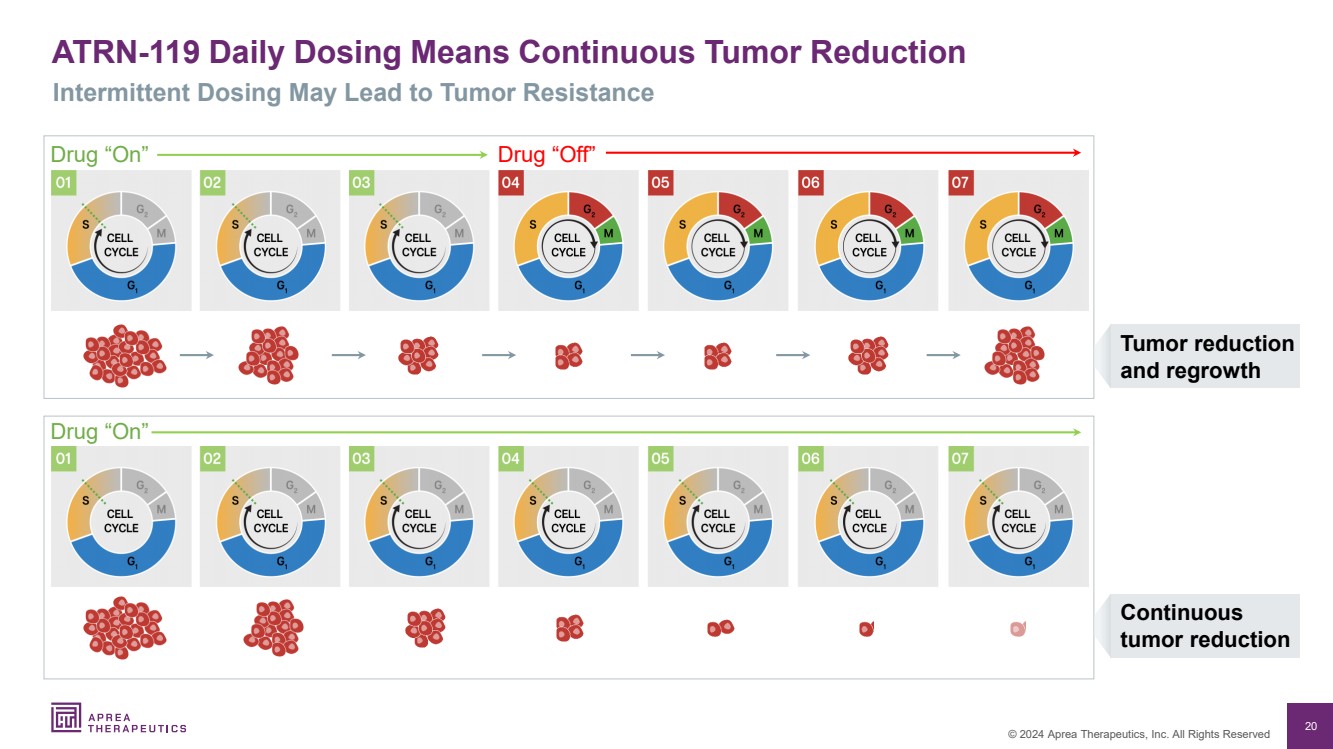
| 20 © 2024 Aprea Therapeutics, Inc. 版权所有 肿瘤减少 和再生 持续 药物 “开启” 药物 “关闭” 药物 “开启” ATRN-119 每日给药意味着持续减少肿瘤 间歇性给药可能导致肿瘤耐药性 |
| 21 © 2024 Aprea Therapeutics, Inc. 版权所有 根据其他正在开发的 atRI Artios ATR 抑制剂:ART0380 第 1 阶段剂量升级的初步结果1 1art0380-ESMO-poster-2023 可衡量 患者的疗效 • 持续 — ORR 29% (2/7)。两名应答者中有一人接受了两次RP2D的治疗。 • 间歇性 — ORR 8% (2/26)。两名应答者中有一人接受了两次RP2D的治疗。 剂量递增 阶段 • 49 名患者 • 连续给药:QD;范围 200-400 mg,(n=10) • 间歇给药:3D on/4D 关闭;范围 100-1,200 mg,(n=39) • 连续 = 200 mg • 间歇给药 = 600mg 贫血 安全性 • 36% 等级 3 级,剂量被认为是可耐受的 |
| 22 © 2024 Aprea Therapeutics, Inc. 版权所有 ATRN-119:潜在的最佳口服 ATR 抑制剂 ,具有结构差异化的核心、骨干和毒性特征 注意:ATRN-119 尚未经过临床试验 1 ATRN-119,1/2a 期临床研究协议 2 针对雄性小猎犬的内部临床前正对头耐受性研究。 参数 给药途径口服 临床研究选择 (MTD/RP2D),剂量表连续每日给药(第 1 阶段的 RP2D 待定)1 临床前研究、毒理学研究中的血液学毒性: • 在为期 28 天的狗 GLP 毒素研究中,血液学变化幅度很小且在 正常范围内 • 在一项正面比较耐受性研究中,ATRN-119 显示出的 毒性明显低于目前正在临床开发的另一种口服 atRI 2 ATRN-119 可能降低毒性使其成为 单一药物的首选 ATR 抑制剂,也是与标准护理疗法联合使用的候选药物。 ATRN-119 (1) |
| 23 © 2024 Aprea Therapeutics, Inc. 版权所有 WEE1 抑制剂: APR-1051 ACESOT-1051: 首次对包含 癌症相关基因 变异的晚期 实体瘤患者进行 WEE1 抑制剂 APR-1051 的人体1期研究 |
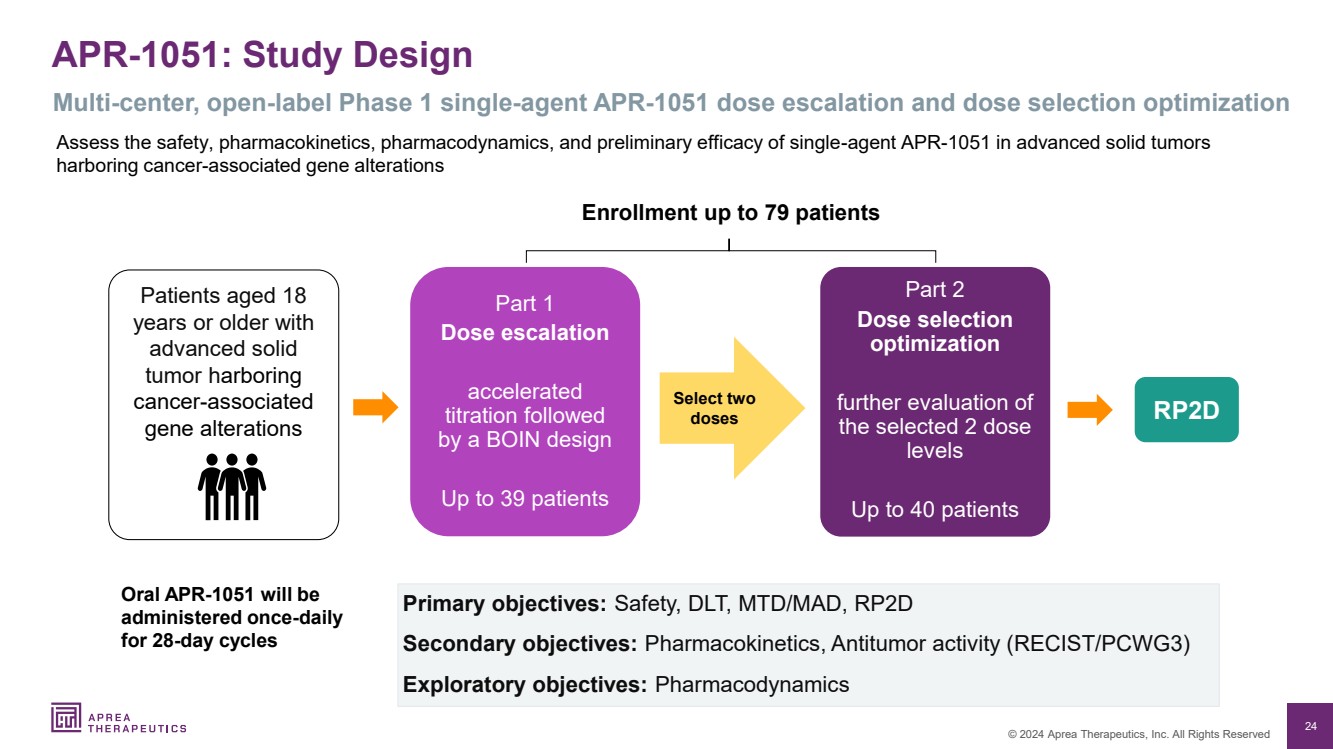
| 24 © 2024 Aprea Therapeutics, Inc. 版权所有 APR-1051:研究设计 多中心、开放标签 1 期单剂 APR-1051 剂量递增和剂量选择优化 评估单剂 APR-1051 在晚期实体瘤中的安全性、药代动力学、药效学和初步疗效 最多入组 79 名患者 年龄为 18 岁的患者患有 晚期实体 肿瘤且包含 癌症相关的 基因变异的老年人 口服 APR-1051 将每天一次 给药一次 br} 对于 28 天周期 RP2D 第 2 部分剂量选择 进一步评估 所选的 2 剂量 水平 最多 40 名患者 第 1 部分剂量递增 加快 滴定后进行 BOIN 设计 最多 39 名患者 主要目标:安全、DLT、MTD/MAD、RPD 2D 次要目标:药代动力学、抗肿瘤活性 (RECIST/PCWG3) 探索性目标:药效学 选择两个 剂量 |
| 25 © 2024 Aprea Therapeutics, Inc. 版权所有 APR-1051:研究设计 单剂 APR-1051 剂量递增研究架构 BOIN 设计 每剂量水平 3-12 名患者 加速滴定 每剂量水平 1-6 名患者 最多 39 名晚期实体瘤患者 伴有癌症相关基因改变 选择两个 剂量 br} 剂量 1 级剂量 2 级剂量 3 级剂量 4 级剂量 5 级剂量 等级 6 剂量 级别 6 剂量 级别 7 剂量 级别 8 |
| 26 © 2024 Aprea Therapeutics, Inc. 版权所有 APR-1051:研究设计 单剂 APR-1051 剂量选择优化研究架构和关键资格标准 1:1 随机化 RP2D 精选 剂量 1 精选 剂量 2 最多 40 名患者 伴有癌症相关的 基因改变 标准 ▪ 年龄 18 岁或以上,ECOG PS 0 或 1(或 KPS ≥ 70) ▪ 诊断为局部晚期且不适合治疗性 治疗或 4 期疾病的晚期/转移性实体瘤包括: ▪ 无论肿瘤类型如何 CCNE1 或 CCNE2 的扩增/过度表达,或 ▪ 无论肿瘤类型如何 FBXW7 或 PPP2R1A 都有有害突变,或 ▪ 结直肠癌 KRAS-GLY12 和 TP53 共同突变,或 ▪ 子宫浆液性癌,无论生物标志物状态如何 ▪ 可测疾病(mcRPC 患者标准 PCWG3) ▪ 已从先前的治疗相关毒性/AES 恢复 1 级或基线 ▪ 骨髓和器官功能充足 |
| 27 © 2024 Aprea Therapeutics, Inc. 版权所有 WEE1 抑制剂: APR-1051 临床前 原理证明 |
| 28 © 2024 Aprea Therapeutics, Inc. 版权所有 WEE1 抑制剂 — APR-1051 作用机制 — 防止 WEE1 激酶 pcDK1-磷酸化细胞周期蛋白依赖激酶 1 存档数据 -10 -9 -8 -7 -6 0 20 40 60 80 100 120 ATRN-1051 Log10 [ATRN1051](M) 活性(% 位移) -5 -4 -2 -1 0 1 2 2 3 4 5 0 1 2 3 4 5 6 累积细胞倍增 NT 125nm 250nm 250nm 500nm APR-1051 与 WE1 结合... 抑制其生物活性... 并引发有丝分裂灾难 和癌细胞死亡 有丝分裂灾难 癌细胞死亡 WEE1 无活性 APR-1051 活性 pcDK1 无活性 CDK1 有丝分裂周期暂停 DNA 修复 WEE1 癌细胞存活 活性 phos-CDK1 控制 (Tubulin) APR-1051 |
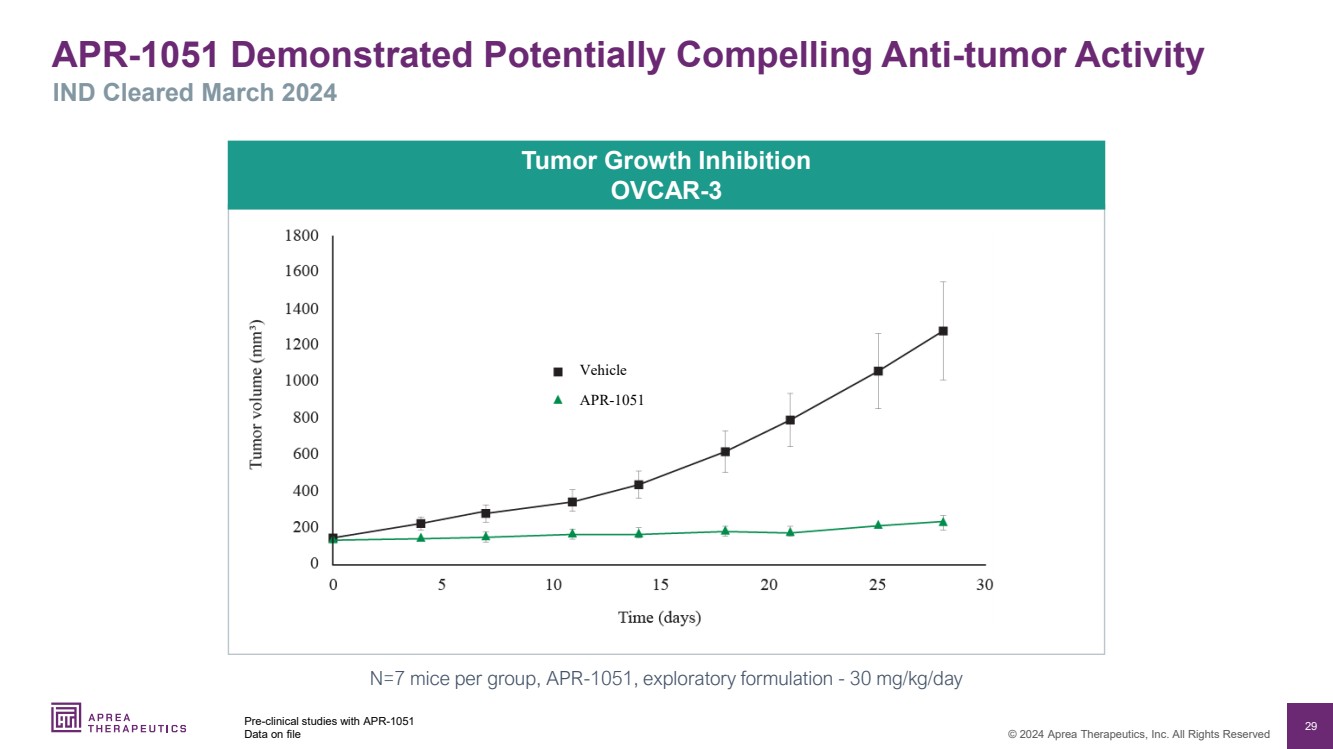
| 29 © 2024 Aprea Therapeutics, Inc. 版权所有 使用 APR-1051 存档数据的临床前研究 肿瘤生长抑制 OVCAR-3 N=7 只小鼠,APR-1051,探索性配方-30 mg/kg/天 APR-1051 显示出潜在的令人信服的抗肿瘤活性 APR-1051 |
| 30 © 2024 Aprea Therapeutics, Inc. 版权所有 WEE1 抑制剂: APR-1051 A 潜在的差异化 WEE1i |
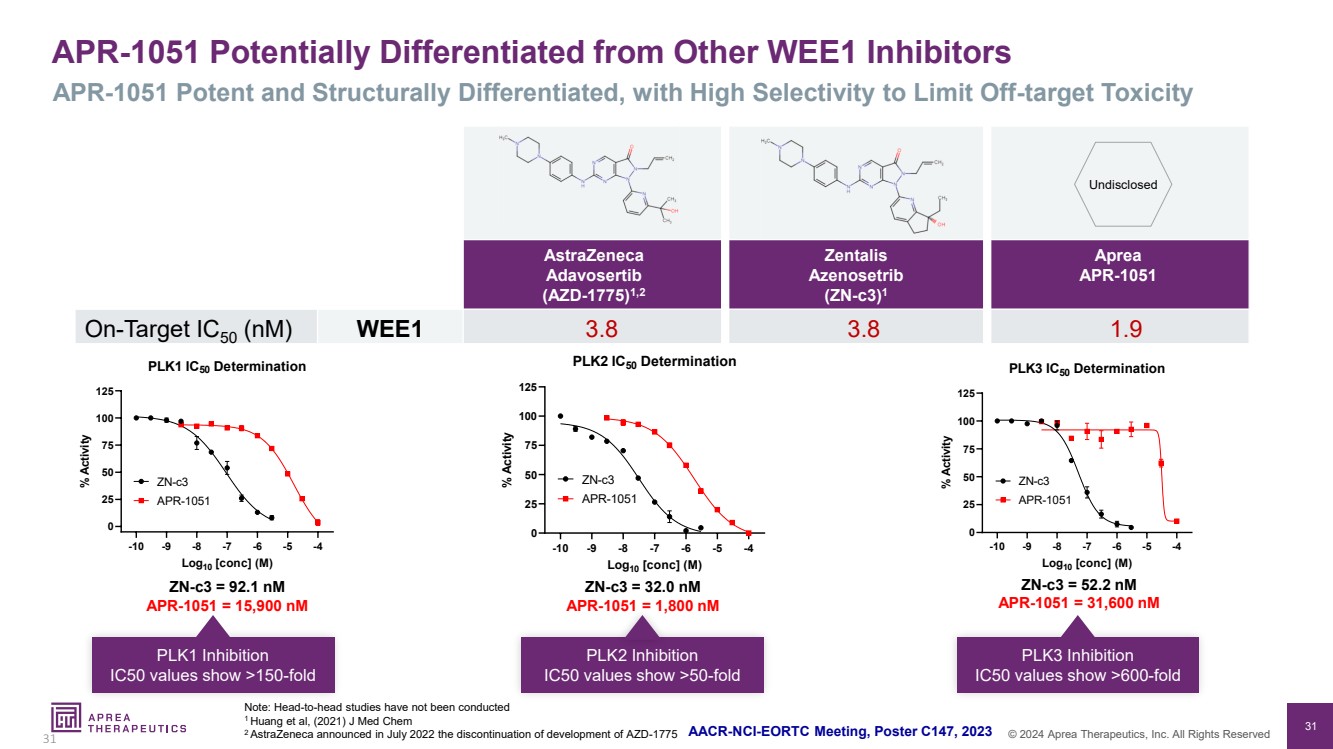
| 31 © 2024 Aprea Therapeutics, Inc. 版权所有 阿斯利康 Adavosertib (AZD-1775) 1,2 Zentalis Azenosetrib (zn-C3) 1 Aprea APR-1051 靶向 IC50 (nM) WEE1 3.8 3.8 1.9 APR-1051 可能与其他 WEE1 抑制剂区别 APR-1051 强效且具有结构差异性,具有高选择性以限制脱靶毒性 注意:尚未进行正面交锋研究 1 Huang 等人,(2021)J Med Chem 2AstraZeneca 于 2022 年 7 月宣布停止开发 AZD-1775 31 AACR-NCI-EORTC 会议,海报 C2023 年 147 日未公开 Zn-C3 = 92.1 nM APR-1051 = 15,900 nM Zn-C3 = 32.0 nM APR-1051 = 1,800 nM Zn-C3 = 52.2 nM APR-1051 = 31,600 nM PLK1 抑制 PLK1 抑制 IC50 值显示>150倍 PLK2 抑制 } IC50 值显示 >50 倍 PLK3 抑制 IC50 值显示 >600 倍 -10 -9 -8 -7 -6 -5 -4 0 25 50 75 100 125 PLK1 IC50 测定 Log10 [conc](M) % 活性 Zn-C3 APR-1051 -10 -9 -8 -7 -6 -5 -4 0 25 50 75 100 125 125 PLK2 IC50 测定 Log10 [conc](M) % 活性 Zn-C3 APR-1051 -10 -9 -8 -7 -6 -5 -4 0 25 50 75 100 125 125 PLK3 IC50 测定 Log10 [conc](M) % 活性 Zn-C3 APR-1051 |
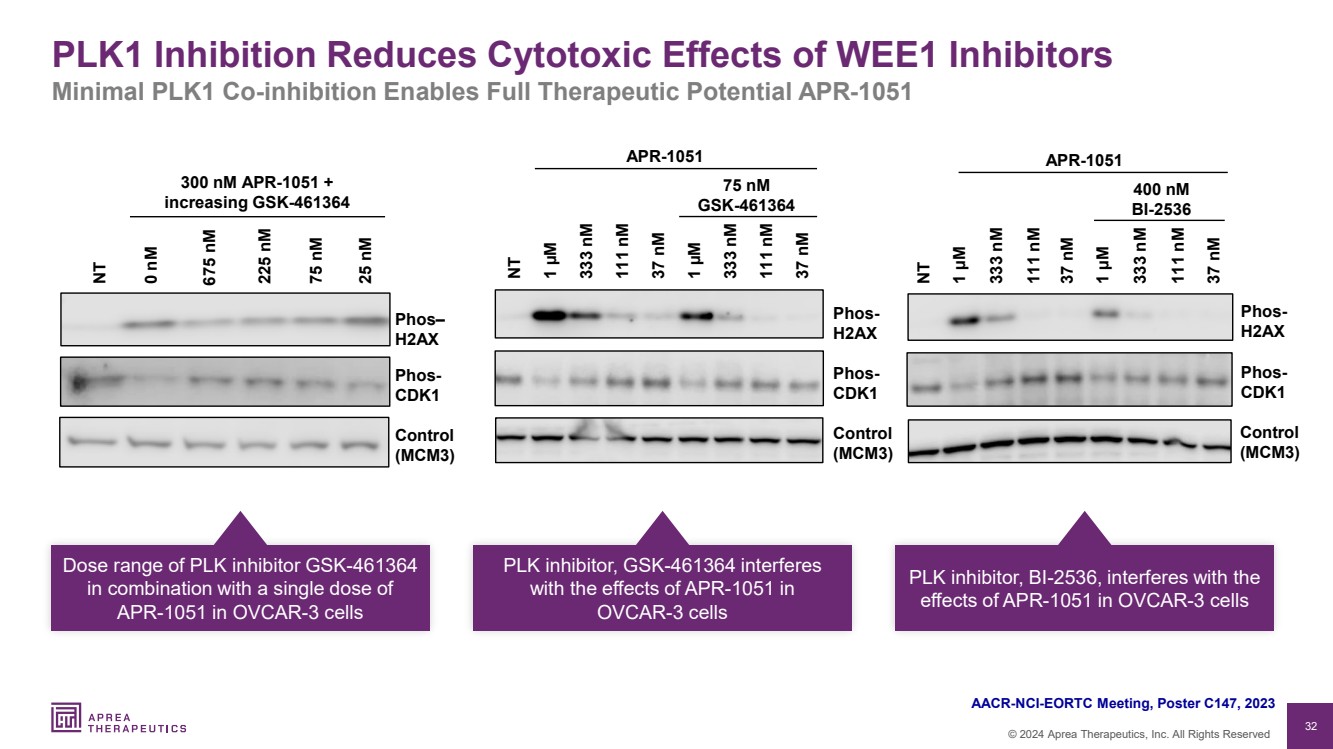
| 32 © 2024 Aprea Therapeutics, Inc. 版权所有 PLK1 抑制剂可降低 WE1 抑制剂的细胞毒性作用 最小 PLK1 共抑制可发挥全部治疗潜力 APR-1051 AACR-NCI-EORTC 会议,海报 C147,2023 年 0 nM NT 675 nM 25 nM 75 nM 75 nM 75 nM 75 nM PHO s— H2AX 控制 (MCM3) phos-CDK1 300 nM APR-1051 + 增加 GSK-461364 37 nM 111 nM 333 nM APR-1051 1 µM 37 nM 111 nM 1 µM phos-H2AX 控制 (MCM3) NT 75 nM GSK-461364 phos-CDK1 控制 (MCM3) 37 nM 37 nM 111 nM 111 nM {br 333 nM 1 µM 37 nM 111 nM 333 nM NT 1 µM 400 nM BI-2536 APR-1051 phos-H2AX phos-CDK1 PLK 抑制剂 GSK-461364 与单剂量 APR-1051 联合用于 OVCAR-3 细胞中的剂量范围 PLK 抑制剂,GSK-461364 干扰 具有 APR-1051 在 OVCAR-3 细胞中的作用 PLK 抑制剂,BI-2536 会干扰 OVCAR-3 细胞中 APR-1051 的 效应 |
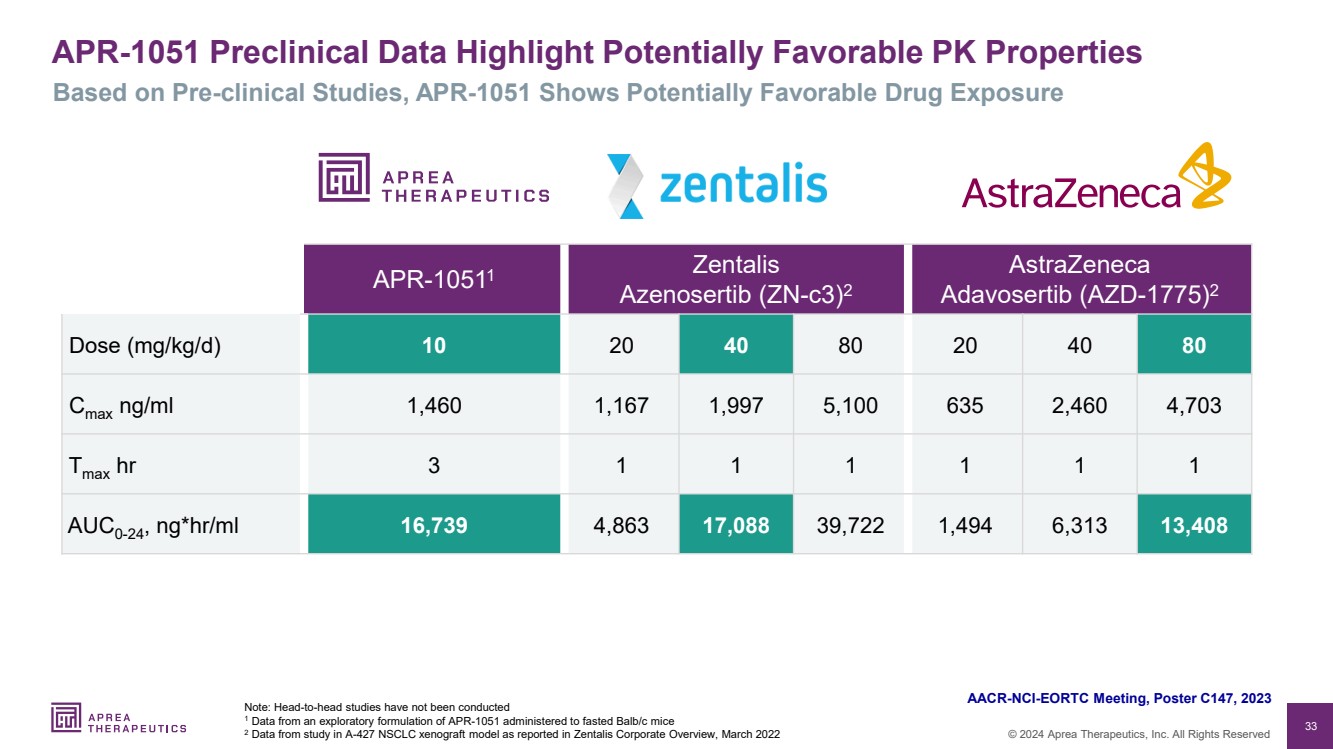
| 33 © 2024 Aprea Therapeutics, Inc. 版权所有 APR-1051 临床前数据亮点潜在有利的药效特性 注意:尚未进行正面交头研究 1 来自给禁食 BALB/C 小鼠的 APR-1051 探索性配方的数据 2 数据来自Zentalis公司概述中报告的 A-427 NSCLC 异种移植模型的研究数据基于临床前研究 APR-1051 显示可能存在的有利的药物暴露 AACR-NCI-EORTC 会议,海报 C147,2023 年 APR-10511 Zentalis Azenosertib (zn-C3) 2 阿斯利康 Adavosertib (AZD-1775) 2 剂量 (mg/kg/d) 10 20 40 80 20 40 80 Cmax ng/ml 1,460 1,167 1,997 5,100 635 2,460 4,703 Tmax hr 3 1 1 1 1 1 AUC0-24,ng*hr/ml 16,739 4,863 17,088 39,722 1,494 6,313 13,408 |
| 34 © 2024 Aprea Therapeutics, Inc. 版权所有 APR-1051 对 hERG 通道的抑制可以忽略不计 AACR-NCI-EORTC 会议,海报 C147,2023 年体外激酶试验 IC50 平均 WE1 激酶 IC50 HerG 抑制 IC50 平均值 hERG IC50 与 hERG IC50 之间的折叠差异 lanthaScreen (Thermo) Hotspot (反应生物学) HEK293 细胞 (美迪西隆) CHO 细胞 hERG 对 WEE1 激酶抑制 2.2 nM 41.4 nM 21.8 nM 8,840 nM 660 nM 4,750 nM 218 倍 (范围 16 至 3,3,000 nM)946 倍) QT一些竞争对手的WEE1抑制剂报告了延期 AE |
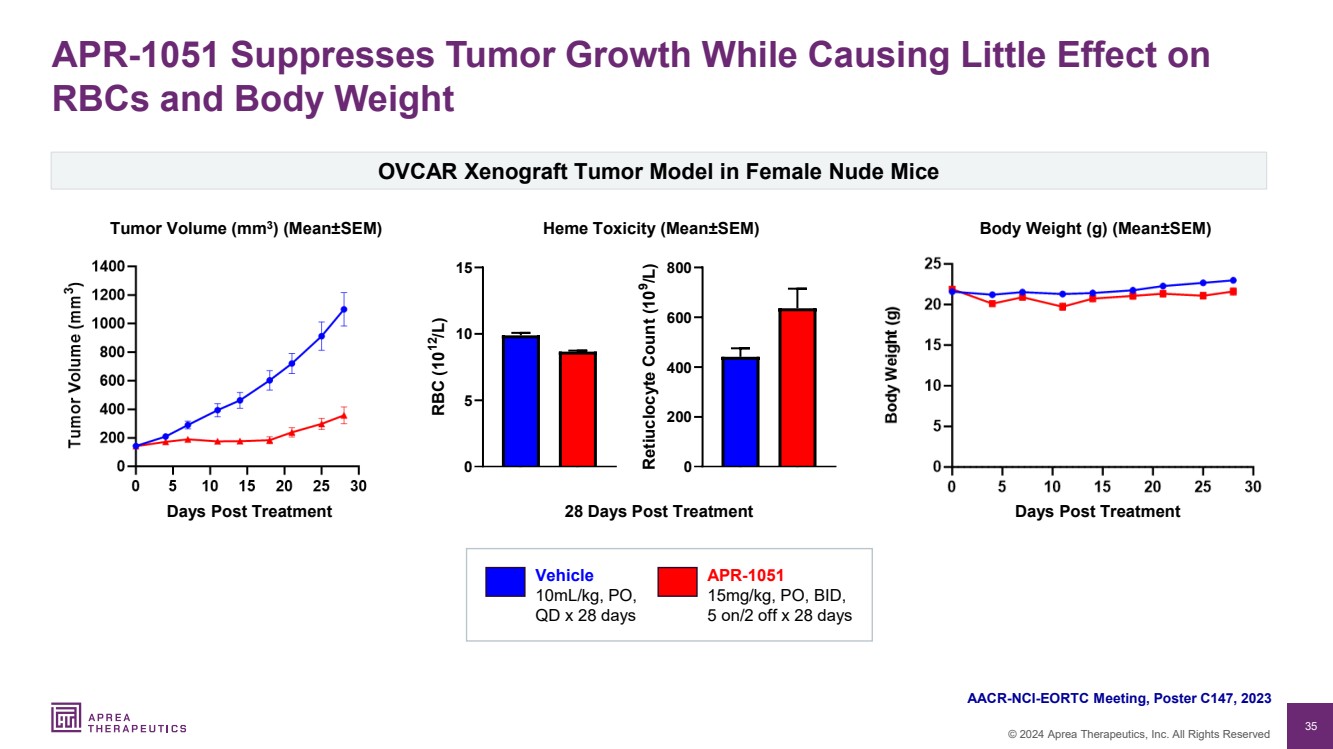
| 35 © 2024 Aprea Therapeutics, Inc. 版权所有 APR-1051 抑制肿瘤生长但对 红细胞和体重几乎没有影响 车辆 ATRN-1051,15mg/kg PO,BID, 0 5 10 15 RBC (10 12 /L) 车辆 ATRN-1051,15mg/kg PO,BID,5 on/2 of 0 200 400 600 Retip cuclocyte count (10 9 /L) AACR-NCI-EORTC 会议,海报 C147,2023 年肿瘤体积 (mm3)(平均值±SEM)体重(g)(平均值±SEM) APR-1051 15mg/kg,PO,BID, 5 次/2 次折扣 x 28 天 车辆 10mL/kg,PO, QD x 28 天 br} OVCAR 女性裸体异种移植肿瘤模型小鼠 血红素毒性 (平均值±SEM) 治疗后天数 28 天治疗后治疗后天数 |
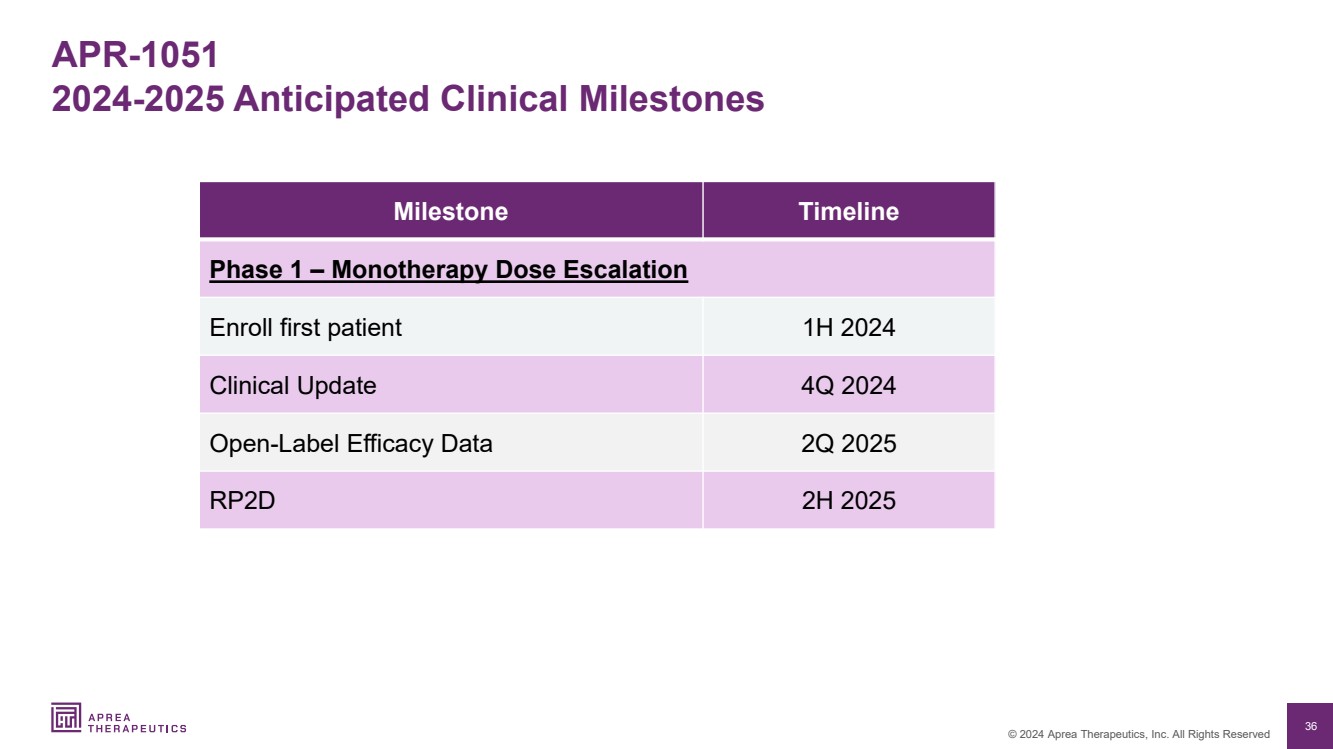
| 36 © 2024 Aprea Therapeutics, Inc. 版权所有 APR-1051 2024-2025 预期临床里程碑 里程碑时间表 第 1 阶段 — 单一疗法剂量增加 2024 年上半年注册首位患者 2024 年第 4 季度临床更新 2025 年第二季度 RP2D 2025 年下半年注册首位患者 2024 年第四季度开放标签疗效数据 2025 年第二季度 RP2D 下半年 |
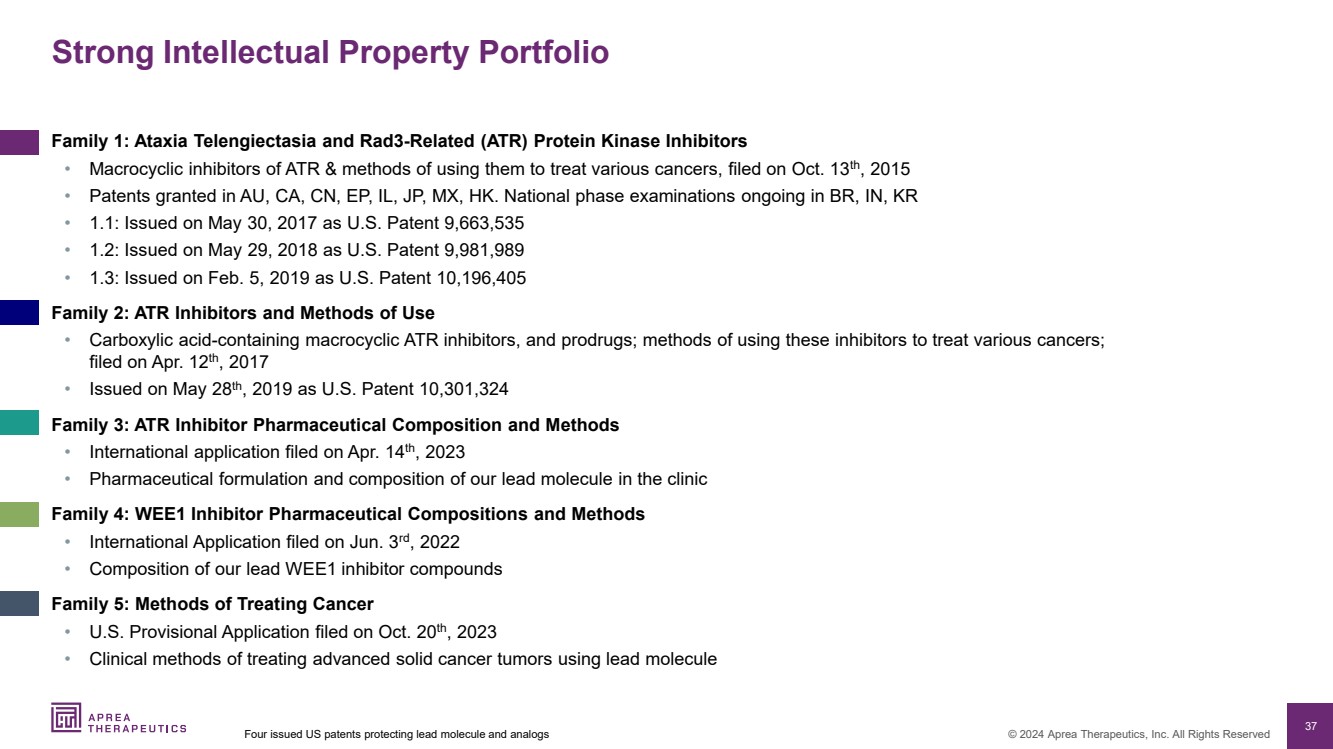
| 37 © 2024 Aprea Therapeutics, Inc. 版权所有 强大的知识产权组合 系列 1:共济失调和 Rad3 相关 (ATR) 蛋白激酶抑制剂 • ATR 大环抑制剂及其用于治疗各种癌症的方法,于 2015 年 10 月 13 日申请 • 在澳大利亚、加利福尼亚州、中国、埃普、伊利诺伊州、日本、墨西哥、香港获得专利。巴西、印第安纳州、韩国 • 1.1:于 2017 年 5 月 30 日作为美国专利 9,663,535 发布 • 1.2:于 2018 年 5 月 29 日作为美国专利 9,981,989 发布 • 1.3:于 2019 年 2 月 5 日作为美国专利 10,196,405 系列 2:ATR 抑制剂和使用方法 • 含羧酸的大环 ATR 抑制剂和前体药物;使用这些抑制剂治疗各种癌症的方法; 于 2017 年 4 月 12 日提交 • 于 2019 年 5 月 28 日作为美国专利 10,301,324 Family 3:ATR 抑制剂药物成分和方法 • 国际2023 年 4 月 14 日提交的申请 • 我们在临床中主分子的药物配方和成分 系列 4:WEE1 抑制剂药物组合物和方法 • 国际申请于 2022 年 6 月 3 日提交 • 我们的主要 WE1 抑制剂化合物的组成 系列 5:治疗癌症的方法 • 2023 年 10 月 20 日提交的美国临时申请 • 使用先导分子治疗晚期实体癌肿瘤的临床方法 四项保护先导分子和类似物的美国专利 |
| 38 © 2024 Aprea Therapeutics, Inc. All Rights Reserved Aprea Therapeutics (NASDAQ: APRE) Financial Summary & Capitalization Cash & Equivalents of $21.6M as of December 31, 2023 Closed approximately $16.0M (before deducing placement agent fees and offering costs of approximately $1.4 million) from our private placement of our common stock in March 2024 with the potential to receive up to an additional $18.0 million upon cash exercise of accompanying warrants at the election of the investors. Securities Common Equivalents as of April 8, 2024 Preferred Stock (as converted) 28,112 Common Stock 5,430,215 Warrants: Pre-Funded Tranche A Tranche B Total 507,076 1,097,394 1,097,394 2,701,864 Options 682,101 Restricted Stock Units 28,130 Fully Diluted Equivalents 8,870,422 |
| 39 © 2024 Aprea Therapeutics, Inc. All Rights Reserved Financed into 3Q 2025 • Reach short term inflection points and catalysts • Evaluate optimal strategic partnerships Near term catalysts • Phase 1/2a ATRN-119 potential efficacy 2H 2024; complete dose escalation 4Q 2024 • Initiate Phase 1 for APR-1051 1H 2024 Diversified portfolio with best in class, de-risked clinical and preclinical programs • Highly potent and selective ATR and WEE1 inhibitors • Opportunities in ovarian, colorectal, prostate, and breast cancers • Single agent and combination therapies Technology developed by pioneers in synthetic lethality • Management with strong drug development and commercial expertise Investment Highlights |