
附录 99.1

1 © 2024,Iovance Biotherapeutics, Inc. © 2024,Iovance Biotherapeutics, Inc. 公司概述 2024 年 1 月 25 日 1

2 © 2024,Iovance Biotherapeutics, Inc. 前瞻性陈述本新闻稿中讨论的某些事项是1995年《私人证券诉讼改革法》(“PSLRA”)所指的 “公司”、“我们” 或 “我们的”)的 “前瞻性声明”。除历史事实陈述外,本新闻稿中所有此类书面或口头陈述均为前瞻性陈述,意在PSLRA提供的前瞻性声明的安全港中进行报道。在不限制前述内容的情况下,在某些情况下,我们可能会使用诸如 “预测”、“相信”、“潜在”、“继续”、“估计”、“预测”、“计划”、“打算”、“预测”、“指导”、“展望”、“可能”、“可能”、“将”、“应该” 等术语或其他表达未来事件不确定性的词语 o utc 来了,旨在确定前瞻性陈述。前瞻性陈述基于管理层的经验以及对历史趋势、当前状况、预期未来发展和其他被认为合适的因素的假设和评估。本新闻稿中的前瞻性声明是自本新闻稿发布之日起发表的,我们没有义务更新或修改任何此类声明,无论是由于新信息、未来事件还是其他原因。前瞻性陈述不能保证未来的表现,并且受风险、不确定性和其他因素的影响,其中许多因素是我们无法控制的,这些因素可能导致实际结果、活动水平、业绩、成就和发展与这些粗鲁陈述所表达或暗示的实质性差异。我们向美国证券交易委员会提交的文件中标题为 “风险因素” 的章节描述了可能导致实际业绩、发展和业务决策与前瞻性陈述存在重大差异的重要因素,包括我们最新的10-K表年度报告和10-Q表季度报告,包括但不限于我们业务中固有的以下重大已知和未知风险和不确定性:COV ID的影响-19 大流行;风险与发生的时间和我们的能力有关成功开发、提交、获得或维持美国食品药品监督管理局(“FDA”)、欧洲药品监督管理局(“EMA”)或其他监管机构对我们的候选产品的批准或其他行动,以及我们成功将获得 FDA、EMA 或其他监管机构批准的任何候选产品商业化的能力;无论临床试验是我们的关键研究和队列以及与 FDA 的会晤的结果,E MA 或其他监管机构可能通过以下方式支持注册研究和后续批准:FDA、EMA或其他监管机构,包括已批准的单臂IOV-LUN-202试验可能不支持注册的风险;正在进行的临床试验或队列的初步和中期临床结果,可能包括疗效和安全性结果,可能无法反映在我们正在进行的临床试验或这些试验中的亚组的最终分析中,也可能反映在其他先前的试验或队列中;非病风险可能需要根据我们的试验和基于美国食品药品管理局和其他监管机构的试验中的队列进行调整意见;不断变化的宫颈癌患者护理格局可能影响我们在该适应症中的临床试验的风险;根据FDA、EMA或其他监管机构的反馈,我们可能需要进行更多临床试验或修改正在进行或未来的临床试验的风险;我们对临床试验结果的解释或与FDA、EMA或r监管机构的沟通可能与对此类结果的解释有所不同或此类监管机构的通信(包括先前与美国食品和药物管理局的BLA会晤和/或我们先前与美国食品药品管理局就我们的非小细胞肺癌临床试验举行的会议);FDA、EMA或其他监管机构可能不批准或可能推迟批准我们提交的转移性黑色素瘤Lifileucel的BLA申请的风险;市场对我们的候选产品的接受以及支付方可能在美国和其他国际上对其进行补偿(如果获得批准)市场;我们使用第三方制造商或我们自己的设施生产疗法的能力或能力可能会有不利影响我们潜在的商业发布;我们赞助的试验可能无法反映在我们赞助的试验中;成功整合最近收购的Proleukin的风险;我们产品的成功开发或商业化可能无法从产品销售中产生足够收入的风险,我们可能在短期内或根本无法盈利;意外支出可能减少我们估计的风险现金余额和预测以及增加我们的估计资本需求;以及其他不在我们控制范围内的因素,包括总体经济状况和监管发展。

3 © 2024,Iovance Biotherapeutics, Inc. 在为癌症患者创新、开发和交付 TIL 疗法方面处于全球领先地位平台人员和资产合作伙伴与合作者缩写:bla=生物制剂许可证申请;BTD=突破性疗法称号;LCM=与美国食品药品监督管理局的后期周期会议;RMAT =再生医学高级疗法称号 22 天专有制造工艺 90% + 制造成功率 7 00+ 名患者截至23年9月30日,接受Iovance的现金头寸约为4.28亿美元60多美元国际专利 500 多名员工德克萨斯大学医学博士安德森癌症中心 3 © 2024,Iovance Biotherapeutics, Inc. 3 1 1 指定临床活跃临床试验 7 种肿瘤类型 5 BLA 审查:最终标签讨论正在进行快速通道 BTD RMAT 1
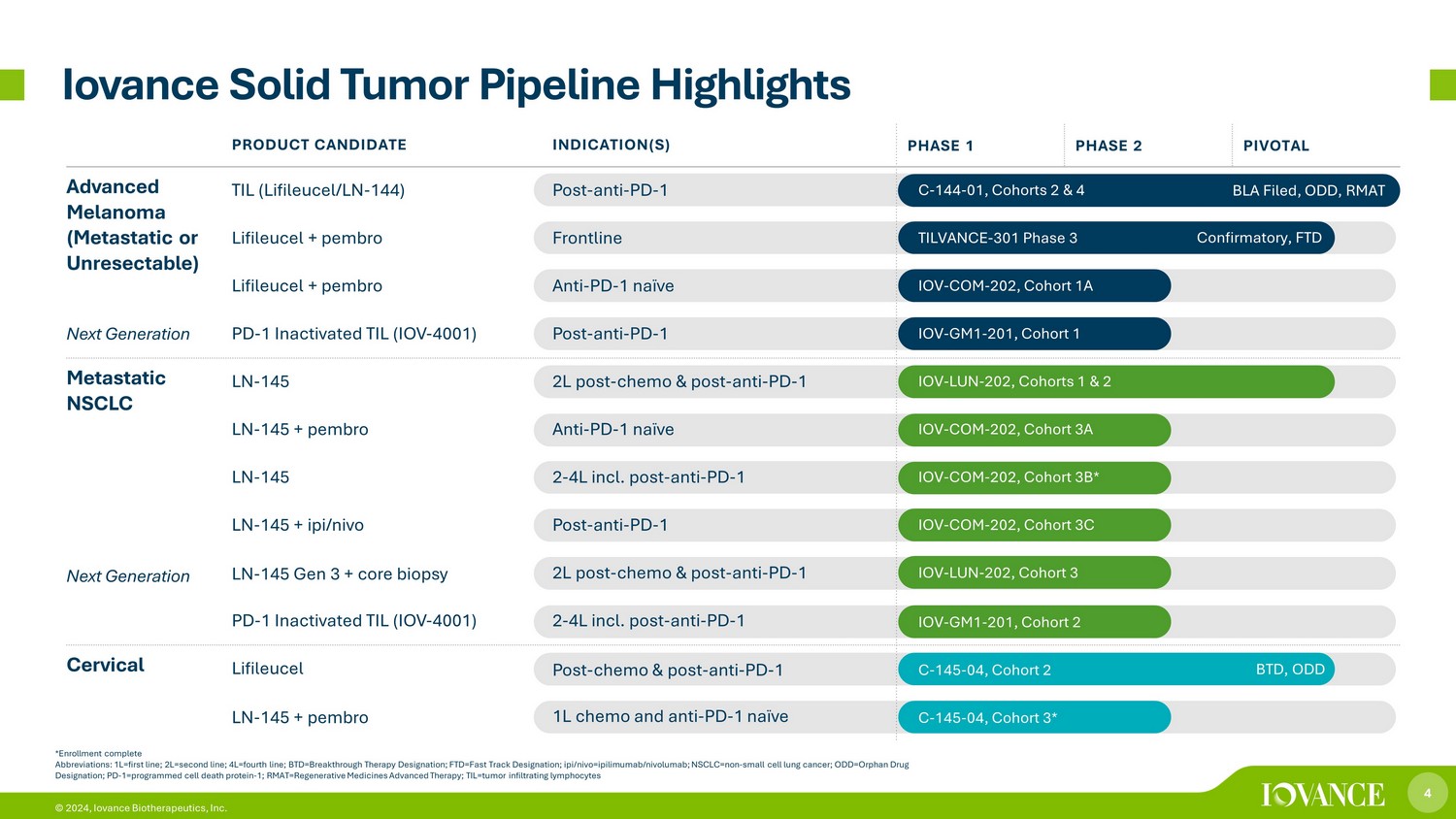
4 © 2024,Iovance Biotherapeutics, Inc. *注册完整缩写:1L=第一行;2L=第二行;4L=第四行;btd=突破性疗法称号;ftd=快速通道指定n;ipi/nivo=ipilimumab/nivolumab;nsclc=non——小细胞肺癌;ODD=孤儿药物名称;PD-1=孤儿药名称;PD-1=孤儿药名称程序性细胞死亡蛋白-1;RMAT=再生药物高级疗法;til=肿瘤浸润淋巴试验 Iovance 实体瘤管线要点确认,FTD BLA 已提交,ODD,RMAT BTD,ODD 候选产品适应症(S)第 1 阶段 2 关键进展黑色素瘤(转移性或不可切除性)下一代 TIL(LifiLeucel/Ln-144)术后-抗 PD-1 C-144-01,队列 2 和 4 Lifileucel + pembro Frontline TILVANCE-301 阶段 3 Lifileucel + pembro Anti-PD-1 naive IOV-COM-202,队列 1A PD-1 灭活 TIL (IOV)-4001) 后——抗——PD——1 IOV——GM1-201,队列 1 转移性非小细胞肺癌下一代 LN——145 2L 后——化疗和术后——抗PD——1 IOV——LUN——202,队列 1 和 2 LN——145 + pembro Anti-PD-1 naive IOV——COM-202,队列 3A LN-145 2-4L,队列 3A LN-145 2-4L post — 反 PD — 1 IOV — COM — 202,队列 3B* LN-145 + ipi/nivo Post-抗 PD-1 IOV-COM-202,队列 3C LN-145 第 3 代 + 核心活检 2L 后-化疗和后-抗 PD-1 IOV-LUN-202,队列 3 PD-1 灭活 TIL (IOV-4001) 2-4L 包括后抗-PD-1 IOV-GM 1-201,队列 2 子宫颈 Lifileucel 术后——化疗和术后——抗 PD-1 C-145-04,队列 2 LN-145 + pembro 1L 化疗和抗 PD-1 naive C-145-04,队列 3*

5 © 2024,Iovance Biotherapeutics, Inc. 1.美国国家癌症研究所监测、流行病学和最终结果(SEER)计划。2023 年估计。https://seer.cancer.gov acc acc 2023 年 5 月 2.世界卫生组织国际癌症研究机构(IARC)。GLOBOCAN 2020 美国死亡人数 1 全球死亡人数 2 黑色素瘤 8K 57K 宫颈 4K 342K 肺部和支气管 127K 180 万 91% 的癌症病例为实体瘤 1 180 万美国实体瘤新发病例 1 扩展到其他适应症进入早期疗法实体瘤和我们的关键项目具有显著的市场潜力
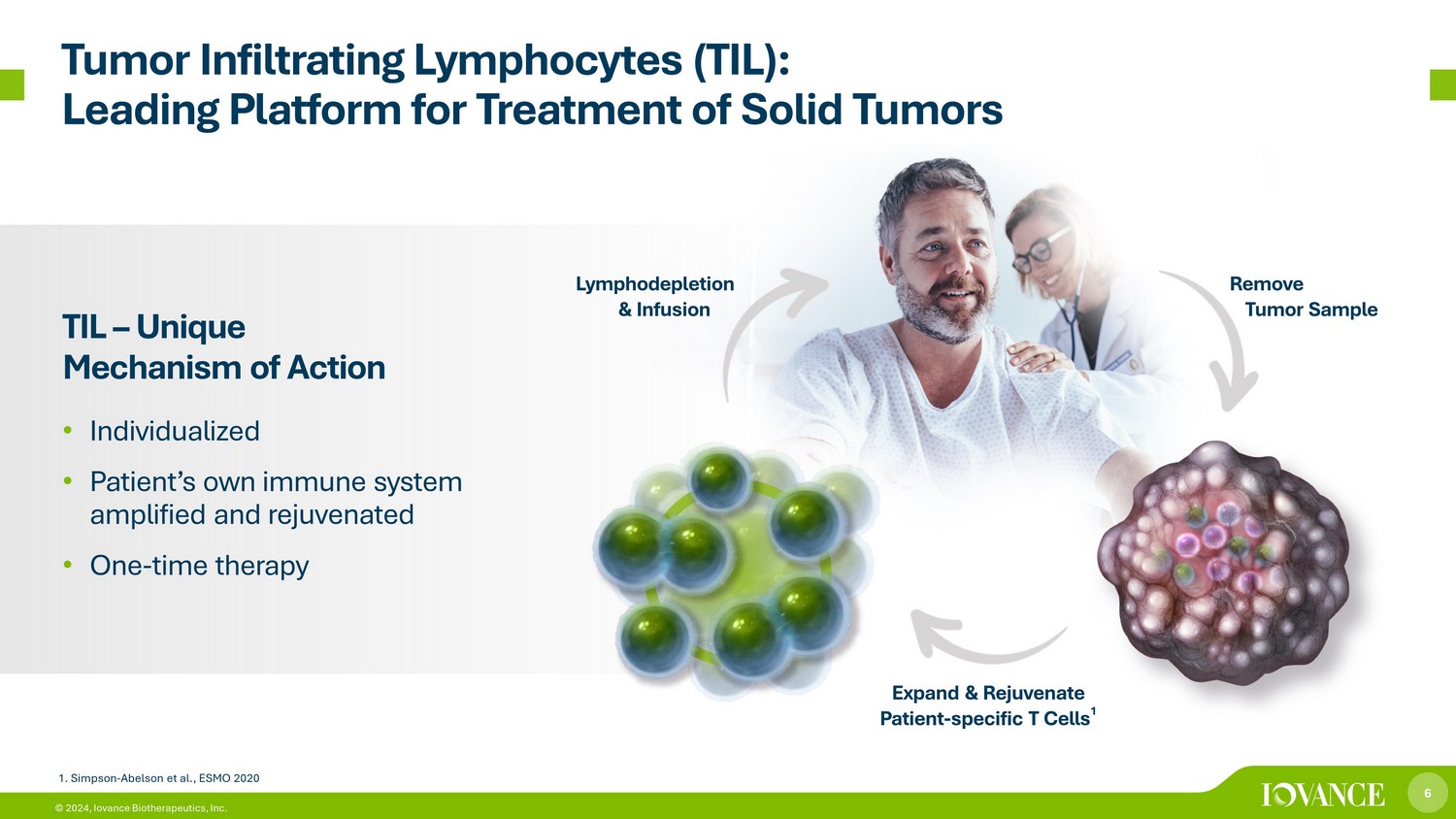
6 © 2024,Iovance Biotherapeutics, Inc. 肿瘤浸润淋巴细胞 (TIL):实体瘤治疗的领先平台 TIL — 独特的作用机制 • 个性化 • 患者自身免疫系统增强和恢复活力 • 一次性疗法移除肿瘤样本扩大和恢复活力-特异性 T 细胞 1 淋巴消耗和输液 1.辛普森-阿伯森等人,ESMO 2020
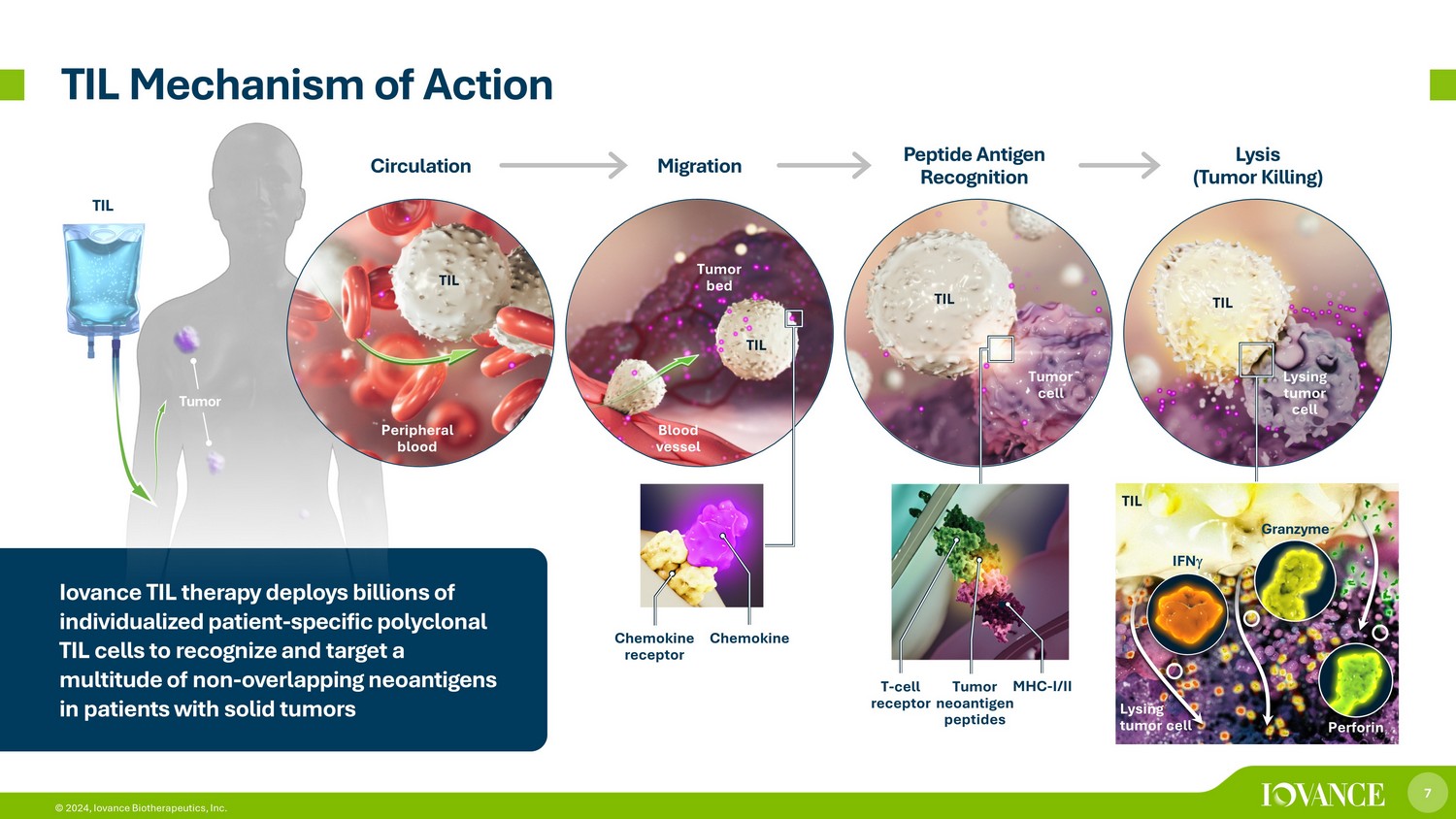
7 © 2024,Iovance Biotherapeutics, Inc. 肿瘤 TIL 作用机制 TIL 外周血管肿瘤细胞 TIL 肿瘤床 TIL 溶解肿瘤细胞 T-细胞受体肿瘤新抗原肽 MHC-I/II 趋化因子受体循环迁移肽抗原识别裂解(肿瘤杀死)趋化因子 TIL IFN Granzyme Perforin TIL TIL 疗法部署数十亿个个体化患者-特异性克隆 TIL 细胞可识别和靶向实体瘤患者中多种非重叠的新抗原溶解肿瘤细胞
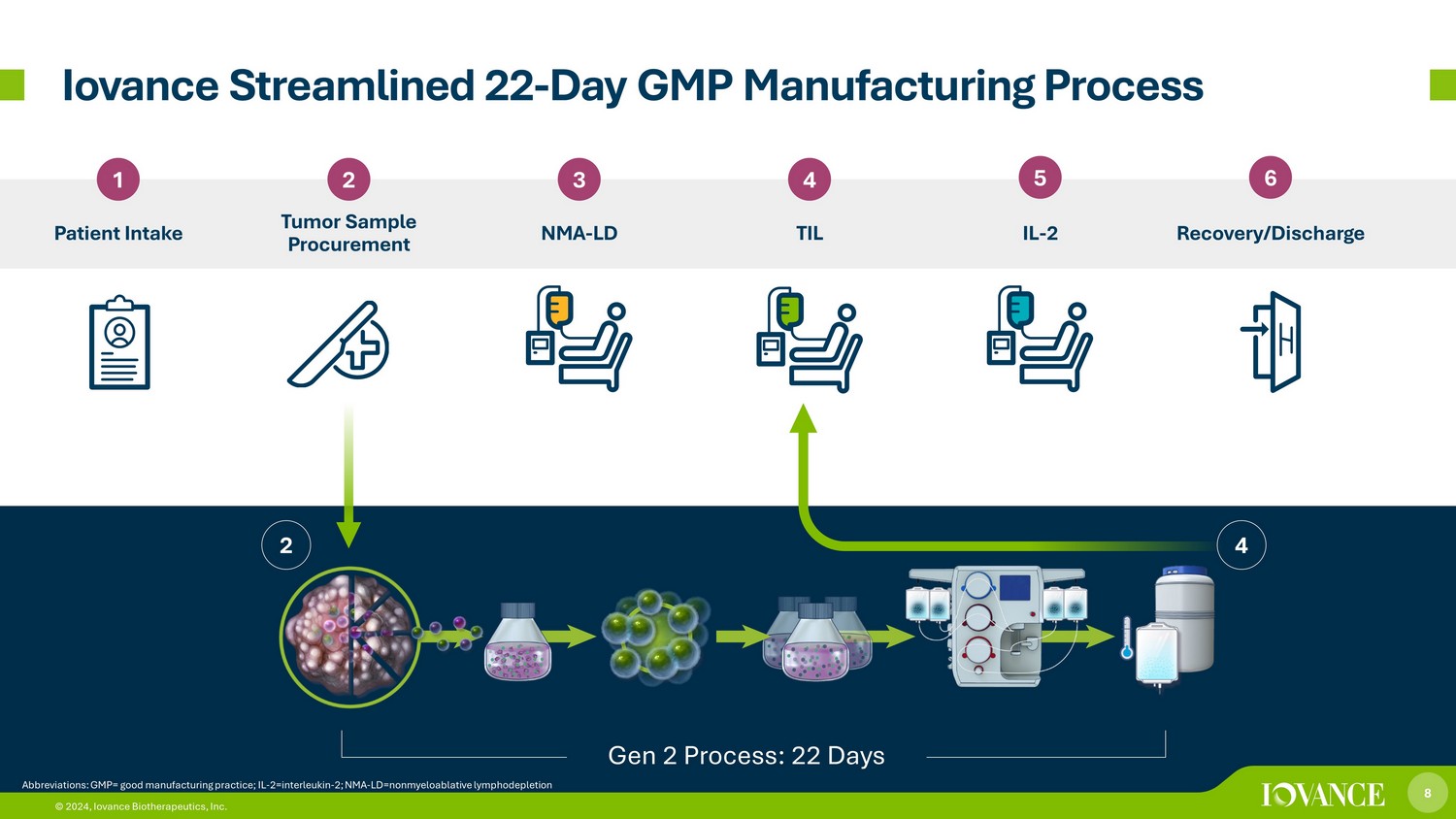
8 © 2024,Iovance Biotherapeutics, Inc. 简化了 22 天 GMP 制造流程 1 2 患者摄入肿瘤样本采购 3 4 NMA-LD TIL 5 6 IL-2 恢复/出院 4 2 第 2 代流程:22 天 8 © 2024,Iovance Biotherapeutics, Inc.缩写:GMP= 良好生产规范;IL-2=白介素-2;NMA-LD=mynonnonMynonmonLoalablative 淋巴消耗

9 © 2024,Iovance Biotherapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics Cell Therapeutics, Inc.:i CTC 在费城海军造船厂建造 136,000 英尺,投资 8,500 万美元 LEED 金牌认证临床供应于 2021 年第 3 季度成功完成 FDA 许可前检查预计

10 © 2024,Iovance Biotherapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics, Inc.(i CTC):为数千名癌症患者建设年度能力建设第 1 期 iCTC 今天 100 名患者/年 100 名患者在商用 4 个独立弹性套件中为临床 2 期 iCTC 扩展 1 个 5,000 多名患者/年 24 商用核心套件 4 个独立弹性套件用于临床 4 期 i CTC+ 额外站点 10,000 多名患者/年 i CTC 邻近和新建站点2 Automation 10 © 2024,Iovance Biotherapeutics, Inc. 1.在现有外壳中扩展 2.可选择在相邻地块上建房
11 © 2024,Iovance Biotherapeutics, Inc. 11 晚期黑色素瘤的 Iovance TIL 疗法

12 © 2024,Iovance Biotherapeutics, Inc. 美国转移性黑色素瘤治疗的医疗需求未得到满足的 ICI(抗 PD-1)疗法和 BRAF/MEK 抑制剂 BRAF/MEK 抑制剂 BRAF/MEK 抑制剂 ORR 4-10% 5 MoS ~7-8 个月 6 抗 PD-1 免疫疗法 21%-33% ORR 4 可用护理:9.9K 6.3K 4.8K 1L 2L 3L-4L 黑色素瘤药物——2021 年接受治疗的人群 3 不可切除/转移(美国)1L 2L+ 缩写:1L=一线疗法,2L=二线疗法,3L=三线疗法,4L=四线疗法;ici=免疫检查 poi nt 抑制剂;ORR = 客观反应率;mos = 总存活率中位数;PD-1=编程细胞死亡蛋白-1 15k 美国每年的晚期黑色素瘤新发病例 1 8k 美国每年死亡人数 2 1根据二级和初级市场研究估算的不可切除或转移性黑色素瘤的美国发病率(2021 年)2.美国国家癌症研究所监测、流行病学和最终结果(SEER)计划。2023 年估计。https://seer.cancer.gov 已于 2023 年 5 月访问 3.Clarivate DRG 疾病概况 (2021) 4.Keytruda USPI 5.Keytruda USPI(4%)和韦伯等人,《Lancet Oncol 2015》(ICC 10%)6。Kirchburger 等人,2016 年 Eur J Cancer 和 Goldinger 等人,J Clin Oncol 2018
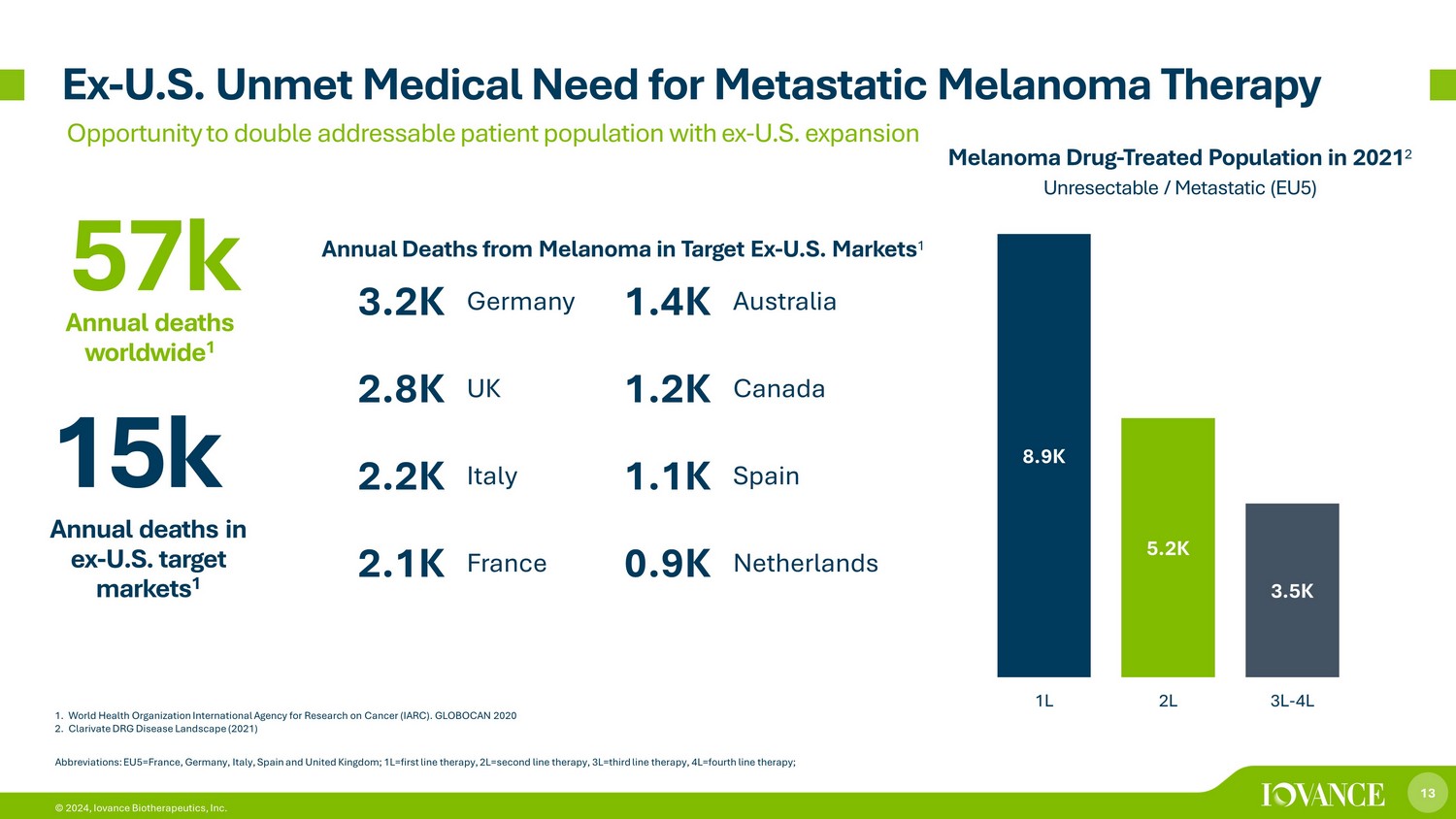
13 © 2024,Iovance Biotherapeutics, Inc. 1.世界卫生组织国际癌症研究机构(IARC)。GLOBOCAN 2020 2.Clarivate DRG 疾病概况(2021 年)例如-美国未满足的转移性黑色素瘤治疗医疗需求通过扩张将可解决的患者人数增加一倍的机会 8.9K 5.2K 3.5K 1L 2L 3L-4L 黑色素瘤药物——2021 年接受治疗的人群 2 不可切除/转移(EU5)缩写:EU5=法国、德国、意大利、西班牙和英国;1L=第一行疗法,2L=二线疗法,3L=第三线电子疗法,4L=四线疗法;前美国目标市场1.5万人年死亡人数 1 3.2K 德国 1.4K 澳大利亚 2.8K 英国 1.2K 加拿大 2.2K 意大利 1.1K 西班牙 2.1K 英国 1.2K 加拿大 2.1K 意大利 1.1K 西班牙 2.1K法国 0.9K 荷兰 57k 全球年死亡 1 Target Ex-美国市场每年死于黑色素瘤 1
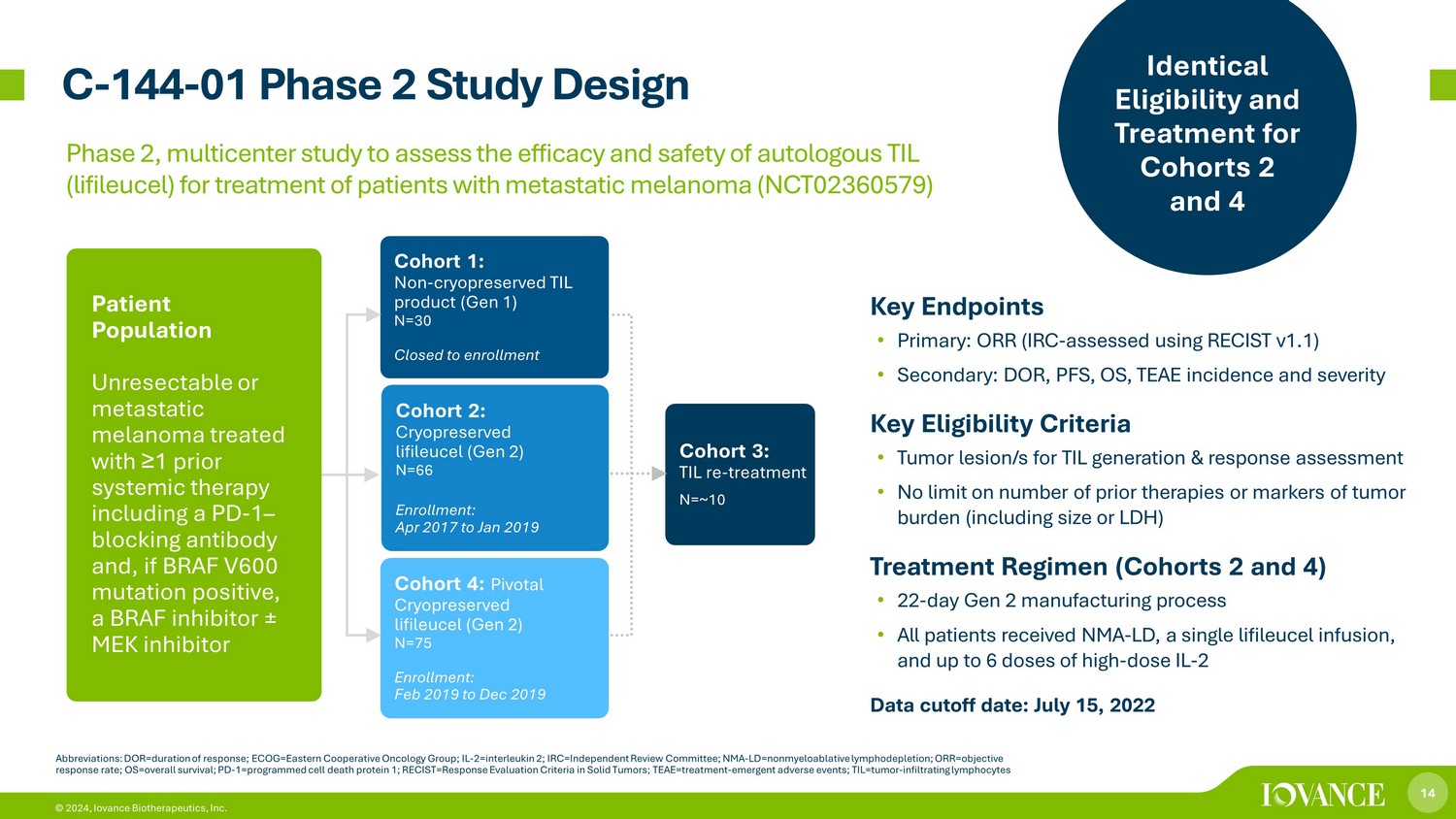
14 © 2024,Iovance Biotherapeutics, Inc. C-144-01 第二阶段研究设计缩写:dor=反应时间;ECOG=东方合作肿瘤学小组;IL-2=白介素2;IRC=独立审查委员会;NMA-LD= 非骨髓性淋巴消耗;ORR = 客观反应率;OS = 总存活率;PD-1=编程细胞死亡蛋白 1;recist=实体瘤的反应评估标准;T eae=治疗——紧急不良事件;til=肿瘤——浸润淋巴细胞队列 1:非冷冻保存的 TIL 产品(第 1 代)N=30 已关闭入组队列 2:Cryopreservered lifileucel(第 2 代)N=66 入组:2017 年 4 月至 2019 年 1 月队列 3:TIL 再治疗 N=~10 患者群体接受了 ≥ 1 种全身治疗,包括 PD-1 — 阻断抗体,如果 BRAF V600 突变呈阳性,则使用 BRAF 抑制剂 ± MEK 抑制剂队列 4:关键冷冻保存 lifileucel (Gen) 2) N=75 入组:2019 年 2 月至 2019 年 12 月关键终点 • 主要:ORR(IRC-使用 RECIST v1.1 进行评估)• 次要:DOR、PFS、OS、TEAE 发病率和严重程度关键资格标准 • TIL 的肿瘤病变/s生成和反应评估 • 对先前疗法的数量或肿瘤负担标志物(包括大小或 LDH)治疗方案(第 2 组和第 4 组)不设限制 • 第 2 代制造流程 22 天 • 所有患者都接受了 NMA-LD、单次利弗利赛尔输液和最多 6 剂高剂量 IL-2 数据截止日期:2022年7月15日第 2 期和第 4 组的相同资格和治疗,评估自体 TIL(lifileucel)治疗转移性黑色素瘤患者的疗效和安全性的多中心研究(NCT02360579)
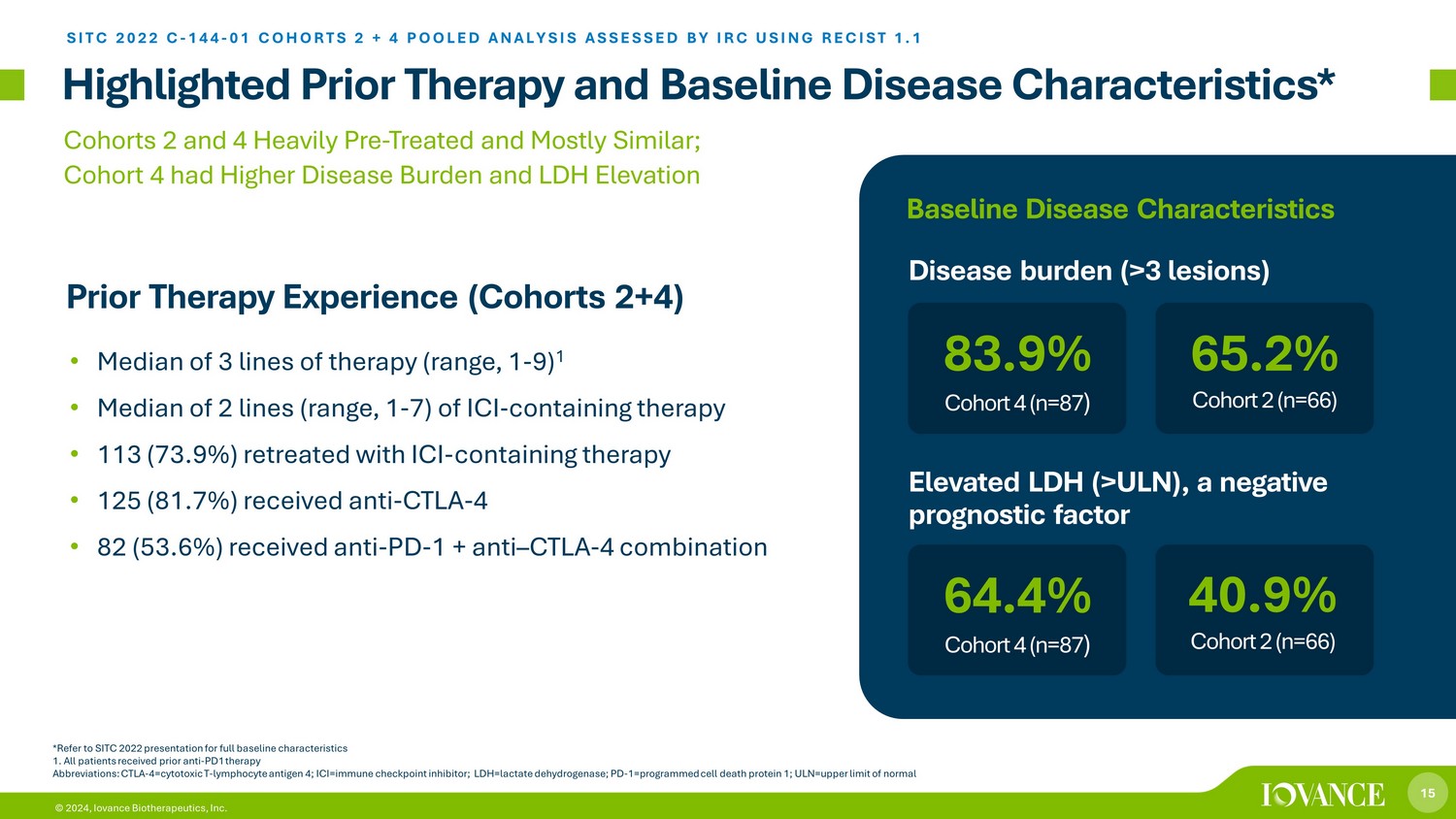
15 © 2024,Iovance Biotherapeutics, Inc. 重点介绍了先前的治疗和基线疾病特征* *有关完整的基线特征,请参阅SITC 2022的演讲 1。所有患者先前接受过抗 PD1 治疗缩写:CTLA-4 = 细胞毒性 T-淋巴细胞抗原 4;ICI = 免疫检查点抑制剂;LDH = 乳酸脱氢酶;PD-1=progra mmed 细胞死亡蛋白 1;ULN = 正常值上限 • 3 条疗法的中位数(范围,1-7)ICI-含有 ICI 的疗法 • 113(73.9%)使用 ICI 含疗法撤退 • 125(81.7%)接受了抗 CTLA-4 • 82(53.6%)接受了抗 PD-1 + 抗 — CTLA-4 组合 2 和 4 严重预处理且基本相似;队列 4有较高的疾病负担和 LDH 升高的先前治疗经历(队列 2+4)SITC 2022 C-144-01 队列 2 + 4 汇总分析 IRC 使用 RECIST 进行评估 1.1 64.4% 队列 4 (n=87) 疾病负担 (>3 个病变) 40.9% 队列 2 (n=66) 83.9% 队列 4 (n=87) 65.2% 队列 2 (n=66) 65.2% 队列 2 (n=66)) LDH 升高 (>ULN),一种不利的预后因素基线疾病特征
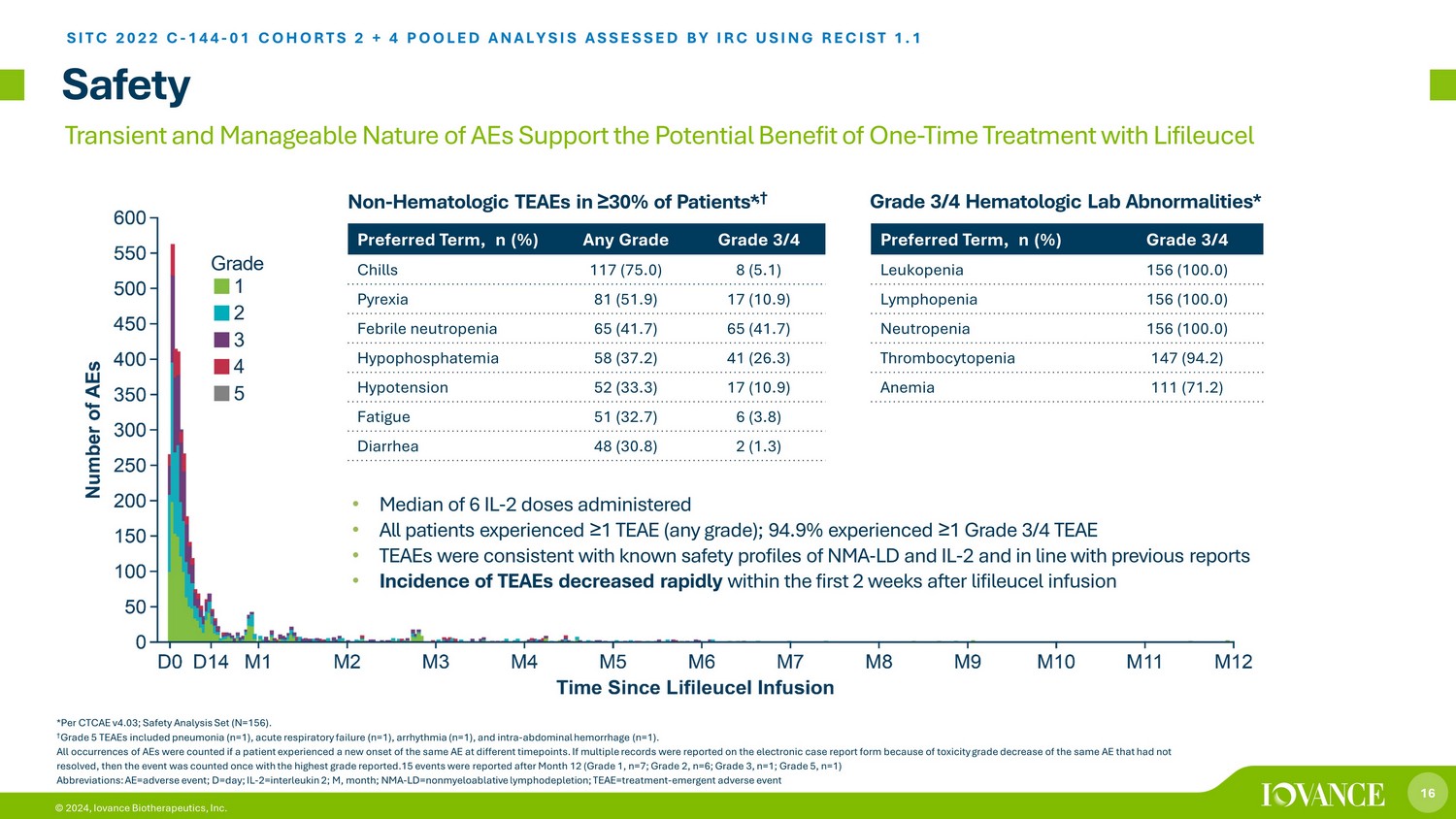
16 © 2024,Iovance Biotherapeutics, Inc. 在 ≥ 30% 的患者中使用安全性非血液学 TEAE *,† *根据CTCAE v4.03;安全性分析集(N = 156)。† 5 级 TEAE 包括肺炎(n=1)、急性呼吸衰竭(n=1)、心律失常(n=1)和腹内出血(n=1)。如果患者在不同的时间点出现同一 AE 的新发作,则计算所有出现 AE 的次数。如果由于同一 AE 的毒性等级下降而在电子病例报告表上报告了多个记录病例,则对该事件进行一次统计,报告了最高等级。第 12 个月之后报告了 15 个事件(1 级,n = 7;2 级,n=6;3 级,n=1;等级 5,n=1)缩写:AE=不良事件;d=日;IL-2=interleukleuks 2 内;M,月;NMA-LD = 非骨髓性淋巴消耗;TEAE = 治疗-em 紧急不良事件 • 6 IL 的中位数-给药 2 剂 • 所有患者经历 ≥ 1 次 TEAE(任何等级);94.9% 的患者经历 ≥ 1 次3/4 级 TEAE • TEAE 与 NMA-LD 和 IL-2 的已知安全特征一致,与先前的报告一致 • TEAE 的发病率在利弗利赛尔输液后的前 2 周内迅速下降首选期限,n (%) 任何 3/4 级寒战 117 (75.0) 8 (5.1) Pyrexia 81 (51.9) 17 (10.9) 发热性中性粒细胞减少症 65 (41.7) 65 (41.7) 低磷血症 58 (37.2) 41 (26.3) 低血压 52 (33.3) 17 (10.9) 疲劳 51 (32.7) 6 (3.8) 腹泻 48 (30.8) 2 (1.3) 首选术语,n (%) 3/4 级白细胞减少症 156 (100.0) 淋巴细胞减少 156 (100.0) 中性粒细胞减少 156 (100).0) 血小板减少症 147 (94.2) 贫血 111 (71.2) 3/4 级血液学实验室异常* *UDGH SITC 2022 C-144-01 COHORTS 2 + 4 汇总分析由 IRC 使用 RECIST 1.1 进行评估 AE 的短暂性和可控性质支持使用 Lifileucel 一次性治疗的潜在益处
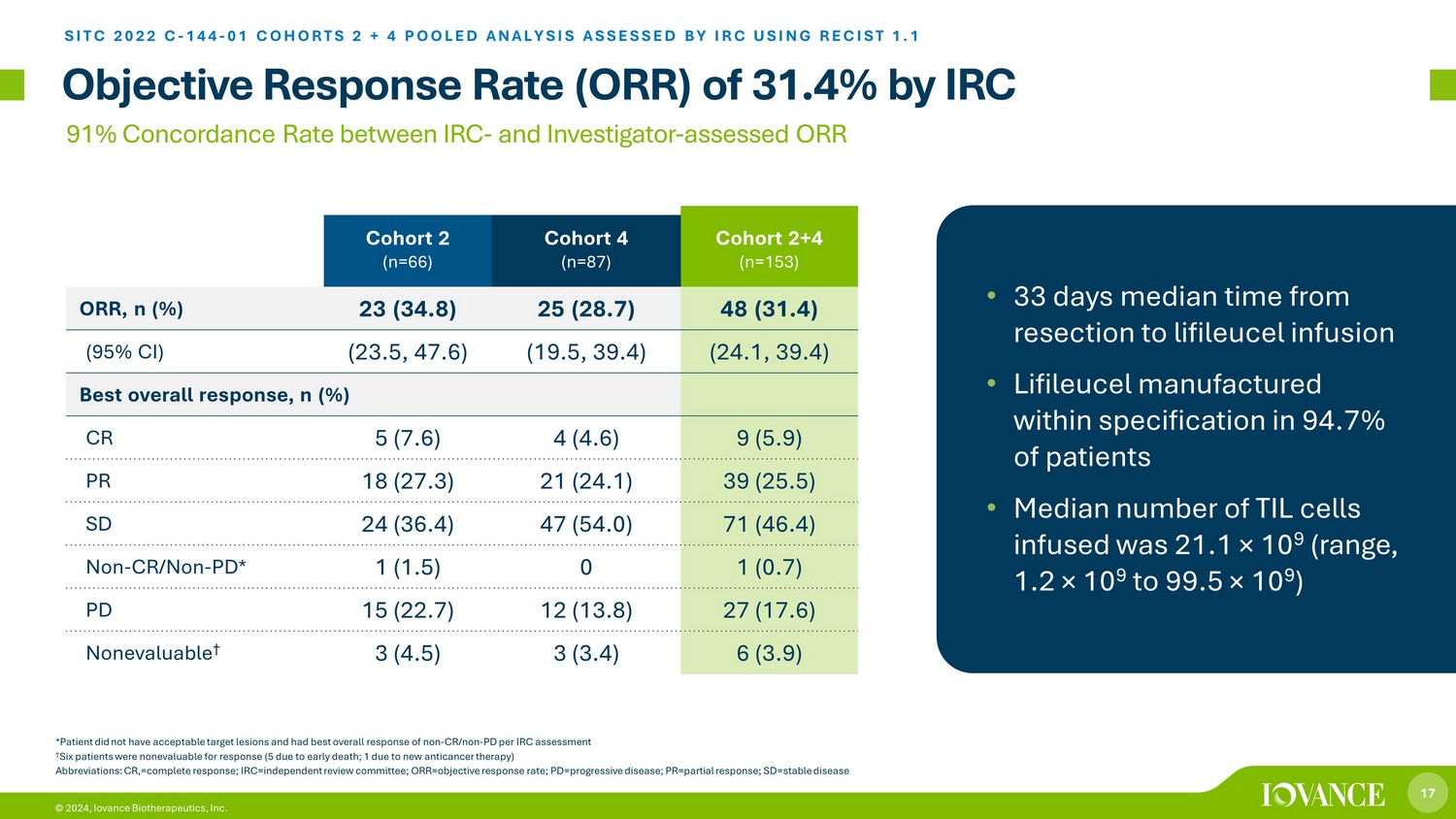
17 © 2024,Iovance Biotherapeutics, Inc.的客观反应率(ORR)为 31.4% SITC 2022 C-144-01 COHORTS 2 + 4 汇总分析 IRC 使用 RECIST 进行评估 1.1 评估的 ORR *患者目标病变不可接受,非 CR/NON-PD 的总体反应最佳 6 名患者 † 无法对反应进行评估(5 是由于过早死亡;1 是由于新的抗癌疗法)缩写:CR,=完全回应;IRC=独立审查委员会;ORR = 客观回应率;PD=进行性疾病;PR= 部分反应;sd=稳定疾病队列 2 (n=66) 队列 4 (n=87) 队列 2+4 (n=153) ORR,n (%) 23 (34.8) 25 (28.7) 48 (31.4) (95% 置信区间) (23.5, 47.6) (19.5, 39.4) (24.1, 39.4) 最佳总体反应,n (%) CR 5 (7.6) 4 (4.6) 9 (5.9) PR 18 (27.3) 21 (24.1) 39 (25.5) SD 24 (36.4) 47 (54.0) 71 (46.4) 非 CR/非 PD* 1 (1.5) 0 1 (0.7) PD 15 (22.7) 12 (13.8) 27 (17.6) 不可评估 3 (4.5) 3 (3.4) 6 (3.9)) • 从切除到 lifileucel 输液的平均时间 33 天 • 94.7% 的患者按规格生产 Lifileucel • 中位数注入的 TIL 细胞数量为 21.1 × 10 9(范围,1.2 × 10 9 到 99.5 × 10 9)
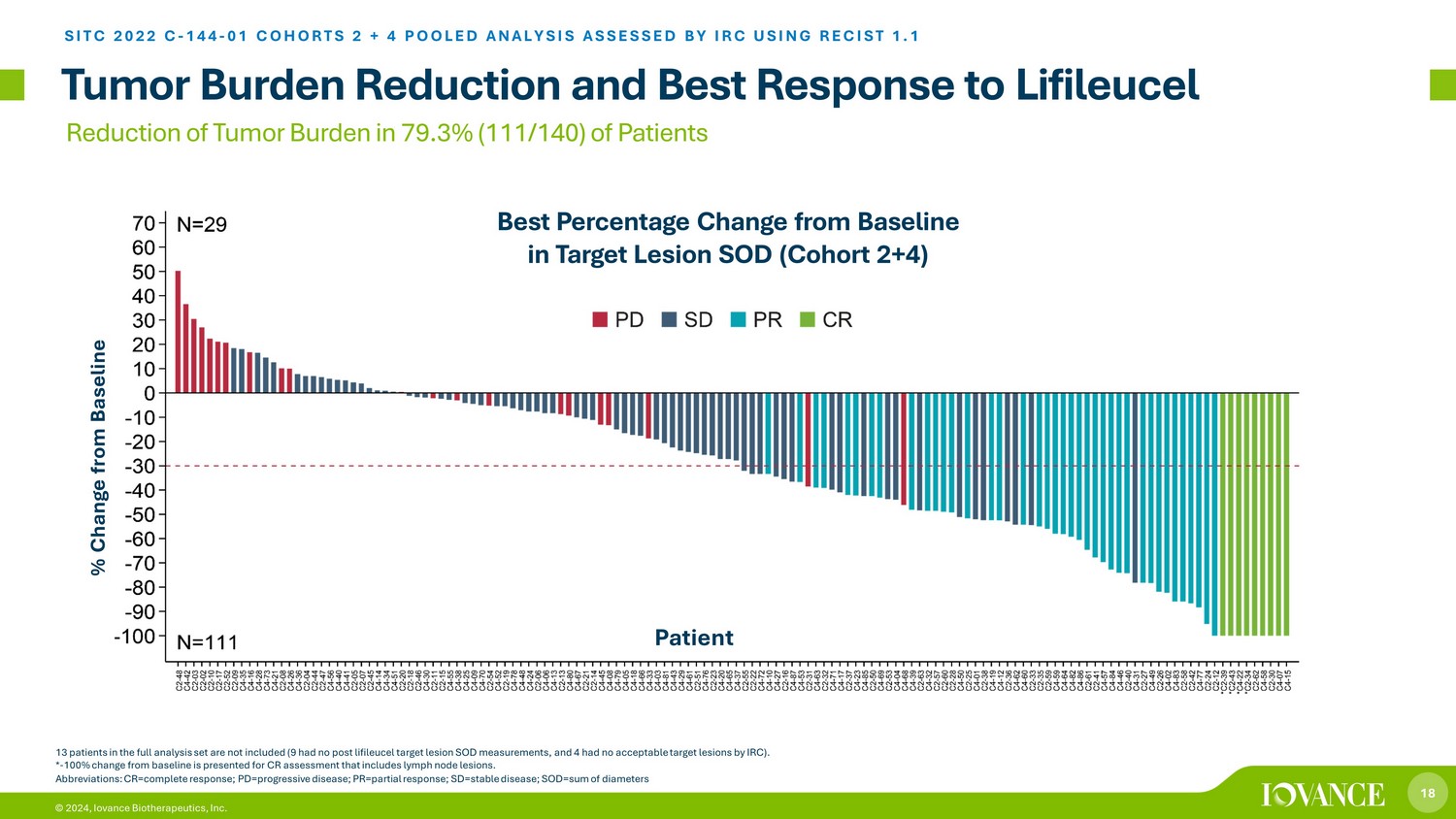
18 © 2024,Iovance Biotherapeutics, Inc. 肿瘤负担减轻和对Lifileucel的最佳反应 SITC 2022 C-144-01 COHORTS 2 + 4 汇总分析 IRC 使用 RECIST 1.1 评估了完整分析集合中的 13 名患者(9 名患者没有接受过利弗莱采后靶区病变测量,4 名患者没有 IRC 的 acc ep 表目标病变)。*-与 100% 相比变化为包括淋巴结病变在内的 CR 评估提供了基线。目标病变 SOD(队列 2+4)与基线相比的最佳百分比变化 79.3%(111/140)患者肿瘤负担缩写:CR=完全反应;pd=进展性疾病;pr=部分反应;sd=稳定疾病;SOD=直径总和与基线患者相比变化百分比
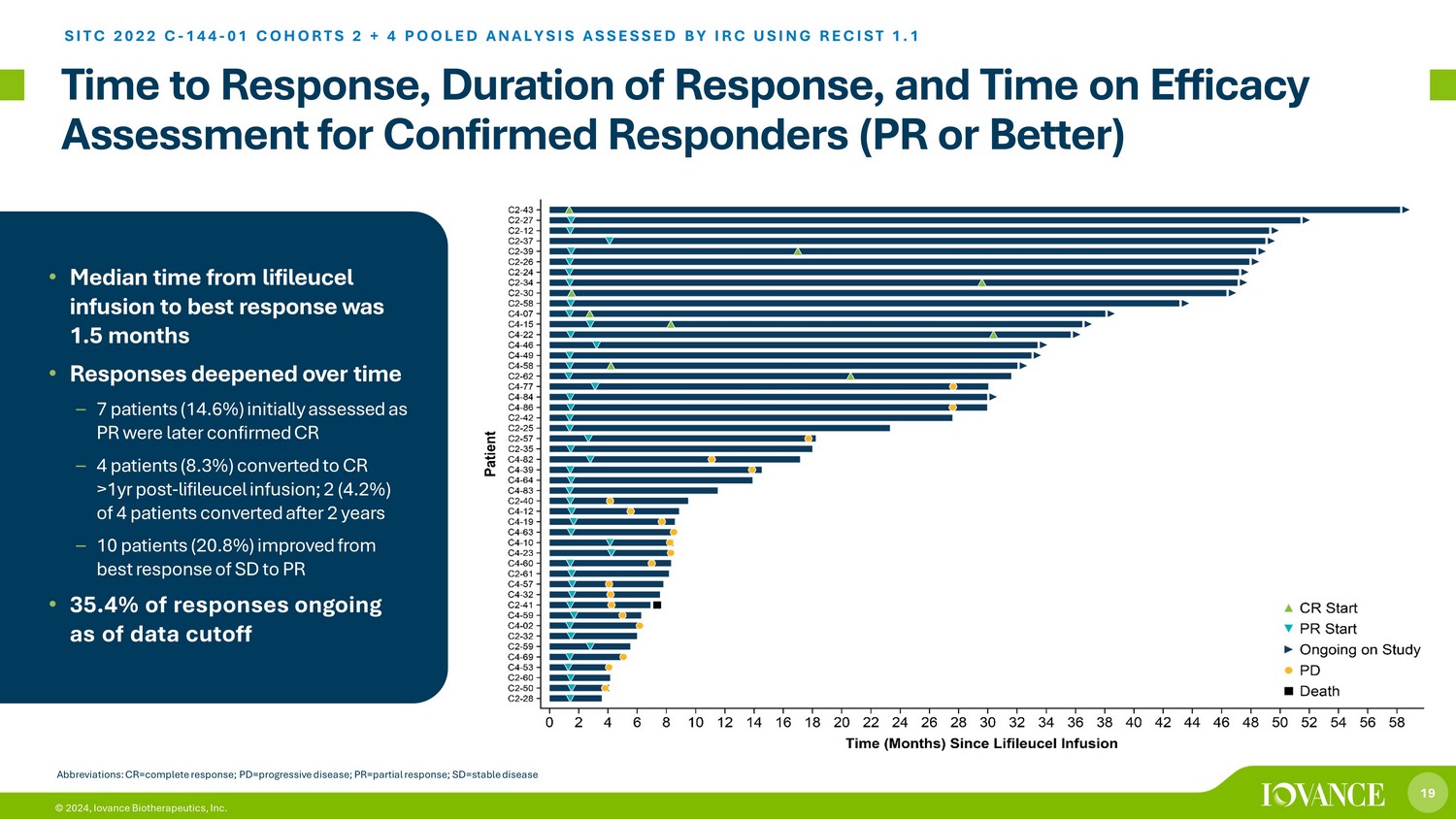
19 © 2024,Iovance Biotherapeutics, Inc. 对确诊的应答者(PR 或更好)的反应时间、反应时间和疗效评估时间 SITC 2022 C-144-01 COHORTS 2 + 4 汇总分析由 IRC 使用 RECIST 1.1 进行评估 • 从利弗赛尔输液到最佳反应的平均时间为1.5个月 • 反应随着时间的推移而加深——7名患者(14.6%)最初被评估为公关者(14.6%)CR — 4 名患者(8.3%)在 lifileucel 输液 1 年后转化为 CR;4 名患者中 2 名(4.2%)在 2 年后转换 — 10 名患者(20.8%)较最佳水平有所改善SD 对 PR 的反应 • 35.4% 的答复截至数据截止日期仍在进行缩写:CR=完全响应;pd=进行性疾病;pr=部分反应;sd=稳定疾病
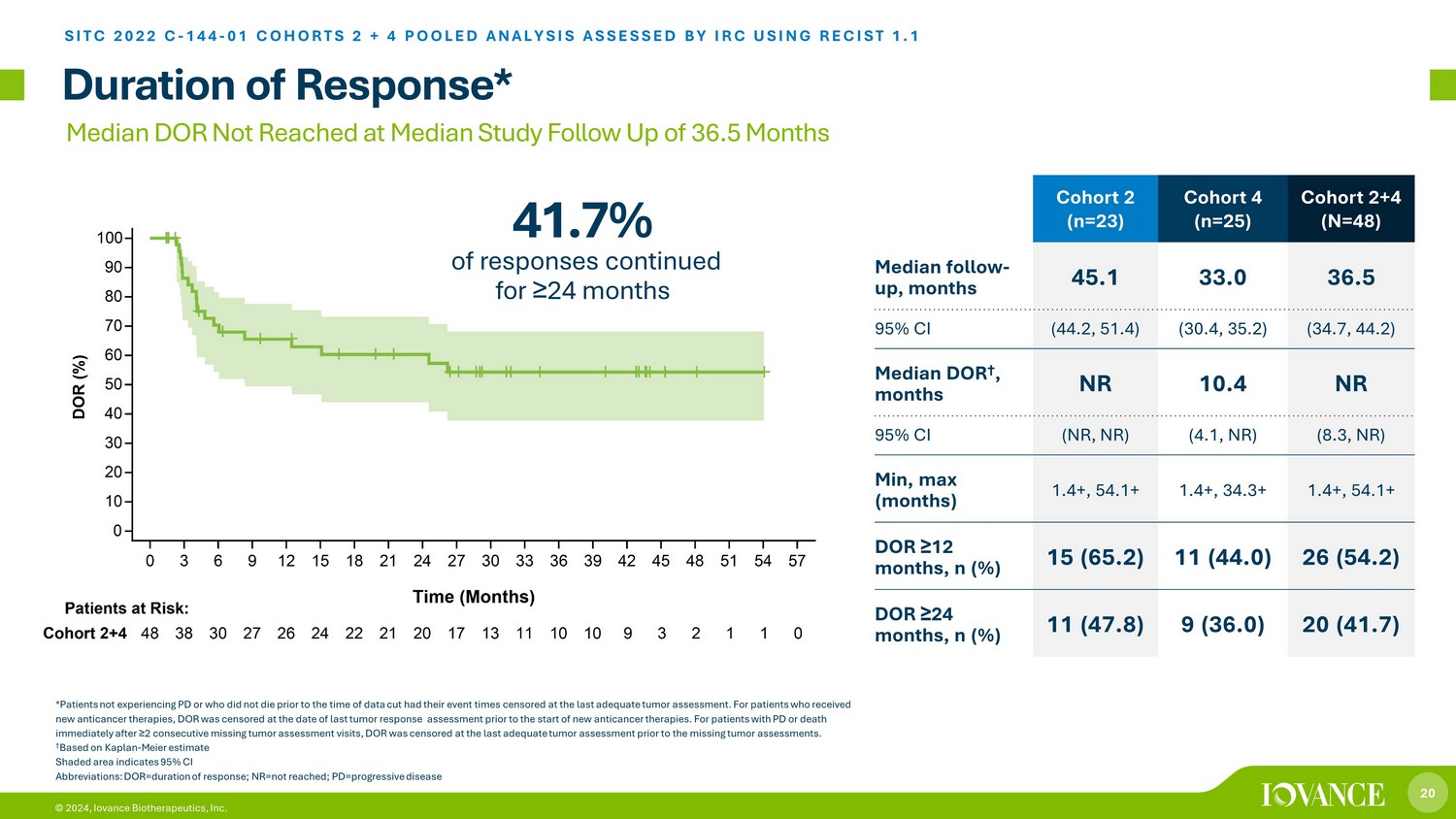
20 © 2024,Iovance Biotherapeutics, Inc. 队列 2 (n=23) 队列 4 (n=25) 队列 2+4 (N=48) 随访中位数,45.1 33.0 36.5 95% 置信区间 (44.2、51.4) (30.4、35.2) (34.7、44.2) 中位数 DOR †,月份 NR 10.4 NR 95% 置信区间(NR,NR)(30.4、35.2) 中位数 4.1、NR) (8.3, NR) 最小、最大(月)1.4+、54.1+ 1.4+、34.3+ 1.4+、54.1+ ≥ 12 个月,n (%) 15 (65.2) 11 (44.0) 26 (54.2) ≥ 24 个月,n (%) 11 (47.8) 9 (36.0) 20 (41.7) 响应时间* SITC 2022 C-144-01 COHORTS 2 + 4 汇总分析,由 IRC 使用 RECIST 1.1 进行评估 *未患有 PD 或之前未死亡的患者直到截取数据时,他们的活动时间都经过审查,直到最后一次进行肿瘤评估。对于接受新抗癌疗法的患者,在新的抗癌疗法开始之前的最后一次肿瘤反应评估之日对DOR进行了审查。对于 PD 患者或在连续 ≥ 2 次缺失肿瘤评估就诊后立即死亡的患者,在缺失肿瘤评估前的最后一次充分肿瘤评估中对 DOR 进行了审查。† 根据卡普兰——迈尔估计,阴影区域表示 95% 置信区间缩写:dor=反应持续时间;nr=未达到;pd=进行性疾病中位数 DOR 在研究随访中位数 36.5 个月时未达到 41.7% 的反应持续了 ≥ 24 个月
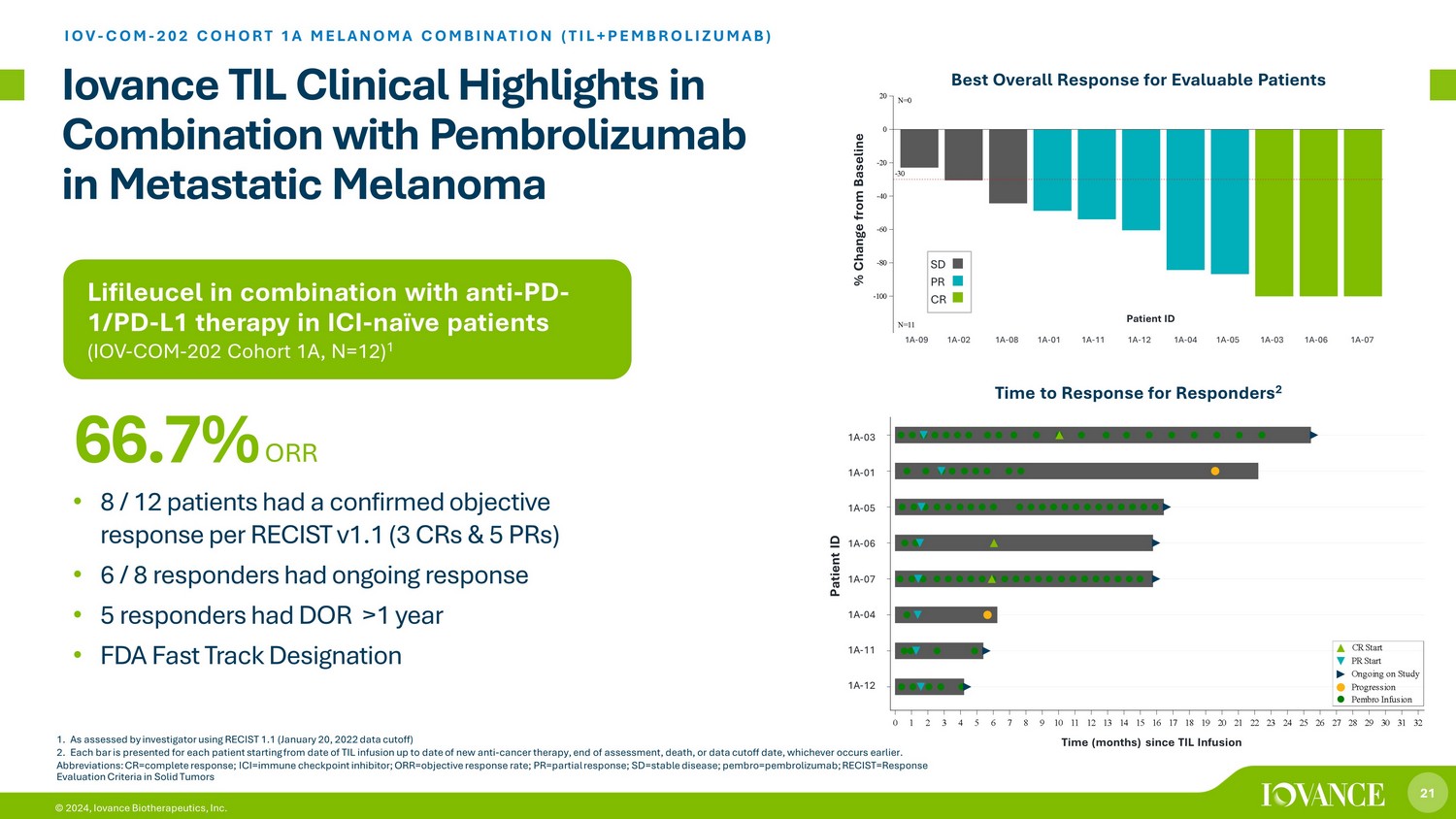
21 © 2024,Iovance Biotherapeutics, Inc. Lifileucel 与 ICI 天真患者的抗 PD-1/PD-L1 疗法(IOV-COM-202 队列 1A,N=12)1 Iovance TIL 与派姆罗利珠单抗联合治疗转移性黑色素瘤的临床亮点 IOV-COM-202 队列 1A 黑色素瘤组合(TIL+PEMBROLIZUMAB)ZUMAB) • 根据 RECIST v1.1(3 个 CR 和 5 个 PR),8/12 名患者的客观反应已得到确认 • 6/8 名受访者的反应持续不断 • 5 名受访者的 DOR 大于 1 年 • FDA 快速通道认证 66.7% ORR 1。根据调查人员使用RECIST 1.1(2022年1月20日数据截止日期)评估的结果2。从TIL输液之日起至新的抗癌疗法的最新日期、评估结束、死亡或数据截止日期(以较早者为准),为每位患者提供每个条形图。缩写:cr=完全反应;ICI=免疫检查点抑制剂;ORR = 客观反应率;pr=部分反应;sd=st abl e 疾病;pembro=pembrolizumab;recist=实体瘤反应评估标准 TIL 输液以来的时间(月)1A-12 1A-04 1A-06 1A-05 1A-01 1A-03 S u b j e c t s 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 自 TIL 输液以来的时间(月)Pembro 输液进展正在进行中 PR 开始 CR 开始时间(月)自 TIL 输液 1A-03 1A-01 1A-05 1A-05 1A-06 1A-06 1A-06 1A-071A-04 1A-11 1A-11 1A-04 1A-03 1A-06 1A-04 1A-09 1A-08 1A-08 1A-01 1A-01 1A-01 1A-12 1A-04 1A-05 1A-05 1A-03 1A-06 1A-07 1A-07 -100 -80 -40 -20% C h a n g e f r o m b a s e l i n e n=0 N=11 队列 1A 与基线 SD PR CR 1A-09 1A-02 1A-08 1A-01 1A-11 1A-12 1A-04 1A-04 1A-05 1A-03 1A-03 1A-06 1A-07 患者 ID 可评估患者的最佳总体反应
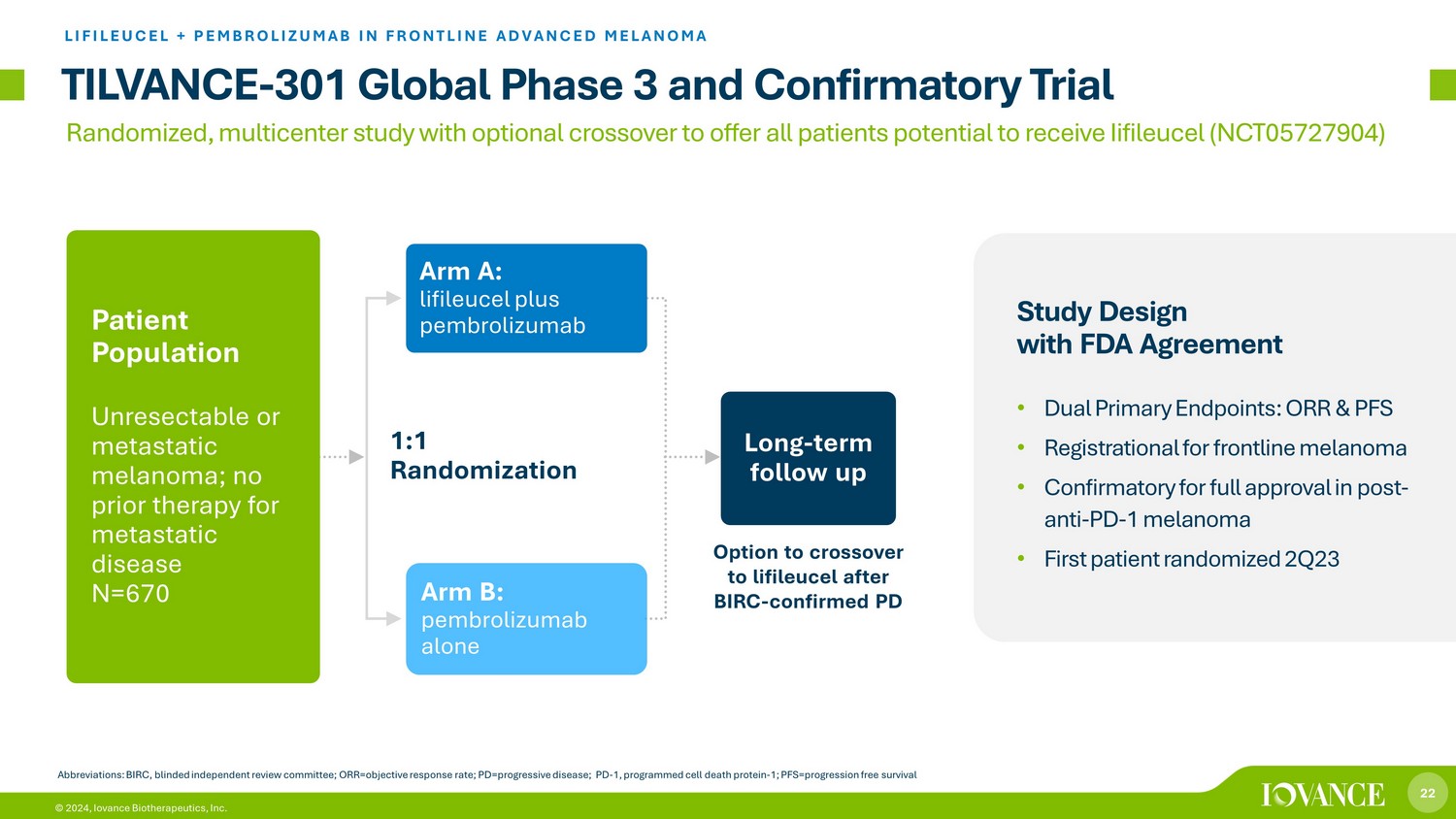
22 © 2024,Iovance Biotherapeutics, Inc. 1:1 随机分配 TILVANCE-301 全球三期和一线晚期黑色素瘤中的确认性试验 LIFILEUCEL + PEMBROLIZUMAB 缩写:BIRC,盲人独立审查委员会;ORR = 客观反应率;pd=进行性疾病;PD-1,程序 d 细胞死亡蛋白-1;pfs=无进展生存组 A:lieufileufile cel plus pembrolizumab 长期随访患者群体不可切除或转移性黑色素瘤;之前没有治疗过转移性疾病 N=670 Arm B:单独使用 pembrolizumab 与 FDA 合作的研究设计协议 • 双重主要终点:ORR 和 PFS • 一线黑色素瘤注册 • 证实抗PD-1 黑色素瘤获得全面批准后 • 首位患者在 BIRC 之后随机分配 2Q23 交叉选择 lifileucel-PD 已确诊的随机多中心研究,可选择交叉治疗,为所有患者提供可能接受 Iifileucel (NCT05727904) 的治疗

23 © 2024,Iovance Biotherapeutics, Inc. Proleukin® 交易的战略利益 • Proleukin®(aldesleukin,人体重组 IL-2)的全球版权及相关收入 • 为lifileucel方案提供安全的IL-2供应链 • 降低临床试验成本和未来的COGS • TIL商业化预计将获得可观的额外收入 1.677亿英镑的预付投资由现有现金关键数字融资 4170 万在首次获得 lifileucel 批准后,收购于 2023 年 5 月 18 日完成
24 © 2024,Iovance Biotherapeutics, Inc. 24 非小细胞肺癌的 Iovance TIL 疗法
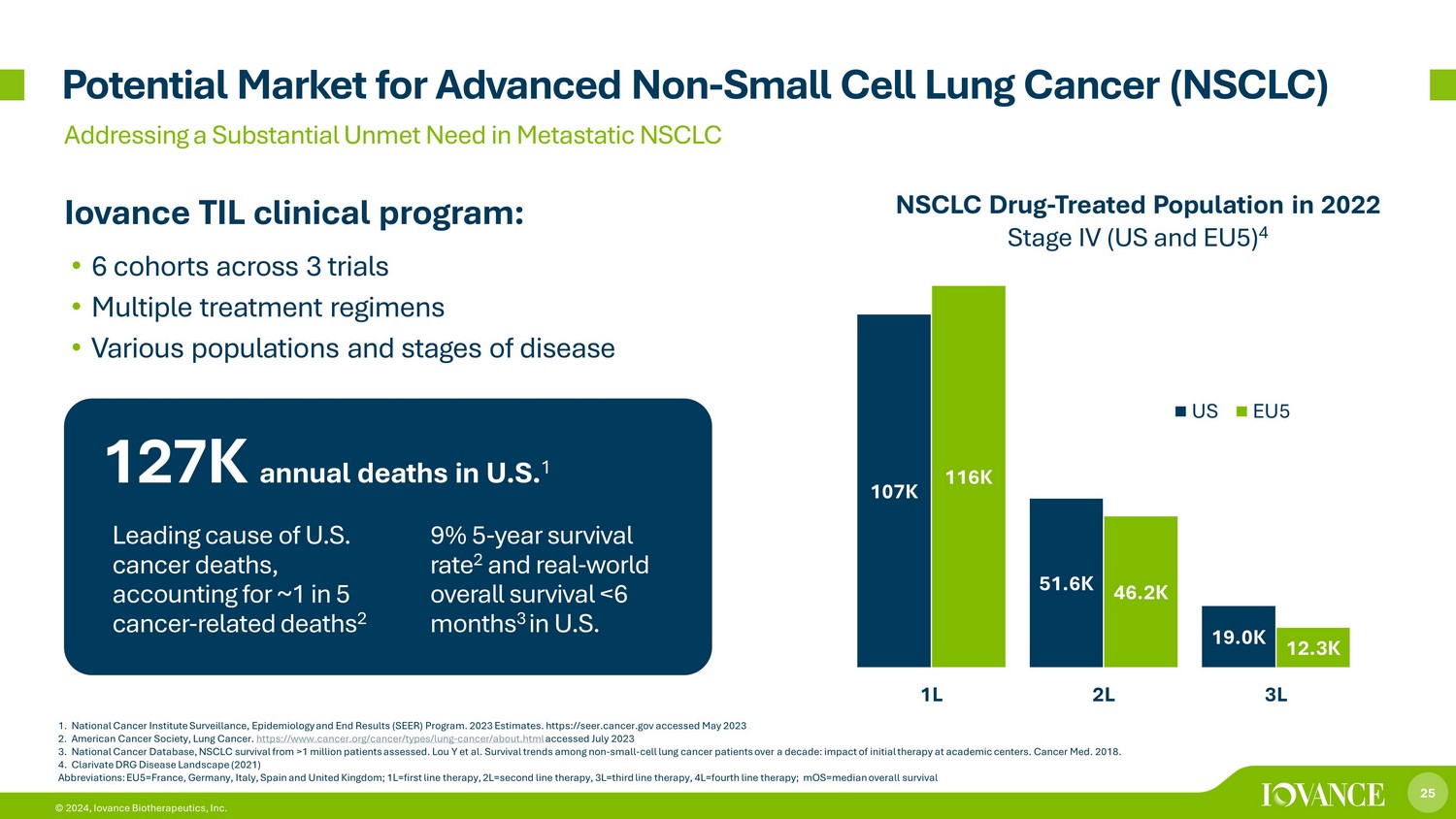
25 © 2024,Iovance Biotherapeutics, Inc. 1.美国国家癌症研究所监测、流行病学和最终结果(SEER)计划。2023 年估计。https://seer.cancer.gov acc acc 2023 年 5 月 2.美国癌症协会,肺癌。https://www.cancer.org/cancer/types/lung-cancer/about.html 已于 2023 年 7 月访问 3.国家癌症数据库,评估了超过100万名患者的非小细胞肺癌存活率。Lou Y 等人十年来非小细胞肺癌患者的存活趋势:学术中心初始治疗的影响。癌症医学。2018. 4.Clarivate DRG 疾病概况(2021)缩写:EU5=法国、德国、意大利、西班牙和英国;1L=一线疗法,2L=二线疗法,3L=三线e疗法,4L=四线疗法;mos=晚期非小细胞肺癌(NSCLC)总体存活率中位数潜在市场解决转移性非小细胞肺癌Iovance TIL临床项目中未得到满足的大量需求:• 3项试验的6个队列•多种治疗方案•不同的人群和疾病阶段美国的年死亡人数美国每年死亡人数为12.7万人 1 10.7万 5.16K 19.0K 11.6K 11.6K 46.2K 12.3K 1L 2L 3L 美国 EU5 非小细胞肺癌药物——2022年接受治疗的人群第四阶段(美国和欧盟 5)4 美国癌症死亡的主要原因,约占五分之一的癌症相关死亡 2 9% 5 年存活率 2 和真实世界总存活率

26 © 2024,Iovance Biotherapeutics, Inc. IOV-LUN-202 试验设计对抗 PD 1 NSCLC 后患者 LN-145 † 的二期多中心研究 (NCT04614103) * 终点 • 主要:IRC 的 ORR • 次要:安全性* 美国食品药品管理局于 2023 年 12 月 22 日对IOV-LUN-202试验进行了临床搁置。新患者的注册已暂停。之前接受过治疗的患者将继续接受监测和跟踪。已经接受肿瘤切除术的患者将继续接受 LN-145 TIL 治疗方案,并采取额外的预防措施和风险缓解措施。† 第 2 代 TIL 产品 † 第 3 代队列患者无法接受手术采集,TIL 由核心活检生成。缩写:Anti-PD-1,抗程序性细胞死亡抑制剂;IRC,独立审查委员会;NSCLC,非小细胞肺癌;ORR,客观反应率; TPS,肿瘤比例分数 Iovance TIL Therapy LN-145 在 NSCLC IOV-LUN-202 中旨在招收晚期患者非小细胞肺癌的医疗需求大量未得到满足,但在抗 PD-1 治疗后先前的治疗线路有限。患者群体不可切除或转移性非小细胞肺癌,在先前的抗 PD-1 治疗和化疗期间或之后有进展,约有 40 个部位并且在美国、加拿大、欧洲正在扩大。队列 1: 的非小细胞肺癌患者
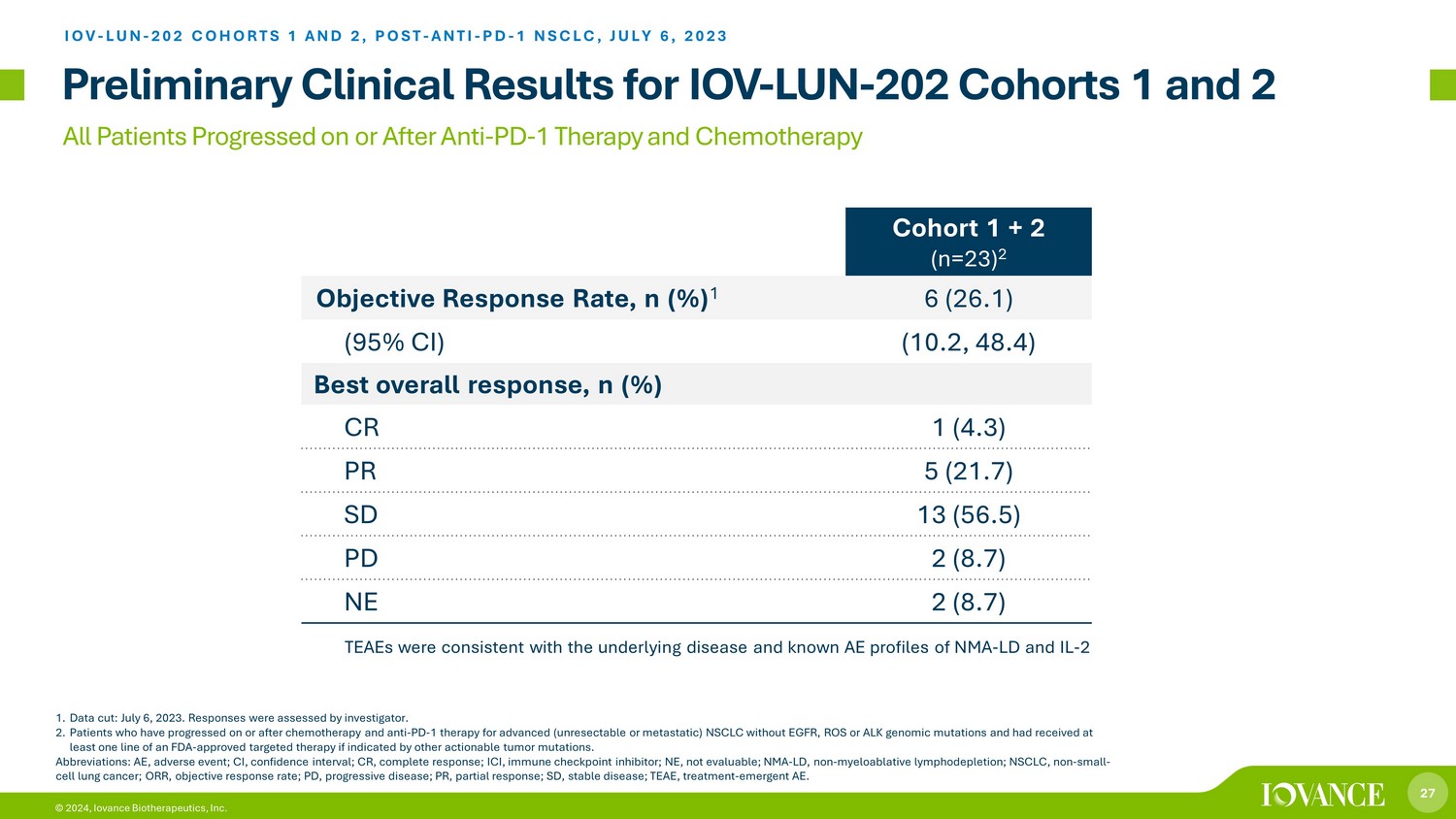
27 © 2024,Iovance Biotherapeutics, Inc. 所有患者在抗PD-1治疗和化疗后均取得进展 IOV-LUN-202 队列 1 和 2 的初步临床结果 1。数据削减:2023年7月6日。调查人员对答复进行了评估。2.在没有表皮生长因子、活性氧或ALK基因组突变的晚期(不可切除或转移的)非小细胞肺癌的化疗和抗PD-1治疗后出现进展的患者,如果有其他可操作的肿瘤突变指示,则接受过至少一个FDA批准的靶向疗法的患者。缩写:AE,不良事件;CI,置信区间;CR,完全反应;ICI,免疫检查点抑制剂;NE,不可用;NMA-LD,非骨髓性淋巴消耗;NSCLC,非小细胞肺癌;ORR,客观反应率;PD,进行性疾病;PR,部分反应;SD,稳定疾病;TEAE,治疗时间非急性脑炎。Iovance TIL Therapy LN-145 在 NSCLC 队列 1 + 2 (n=23) 2 中客观反应率,n (%) 1 6 (26.1) (95% CI) (10.2, 48.4) 最佳总体反应,n (%) CR 1 (4.3) PR 5 (21.7) SD 13 (56.5) PD 2 (8.7) NE 2 (8.7) IOV-LUN-202 COHORTS 1 而且 2,POST-ANTI-PD-1 NSCLC,2023 年 7 月 6 日 TEAE 与 NMA-LD 和 IL 的潜在疾病和已知 AE 概况一致-2
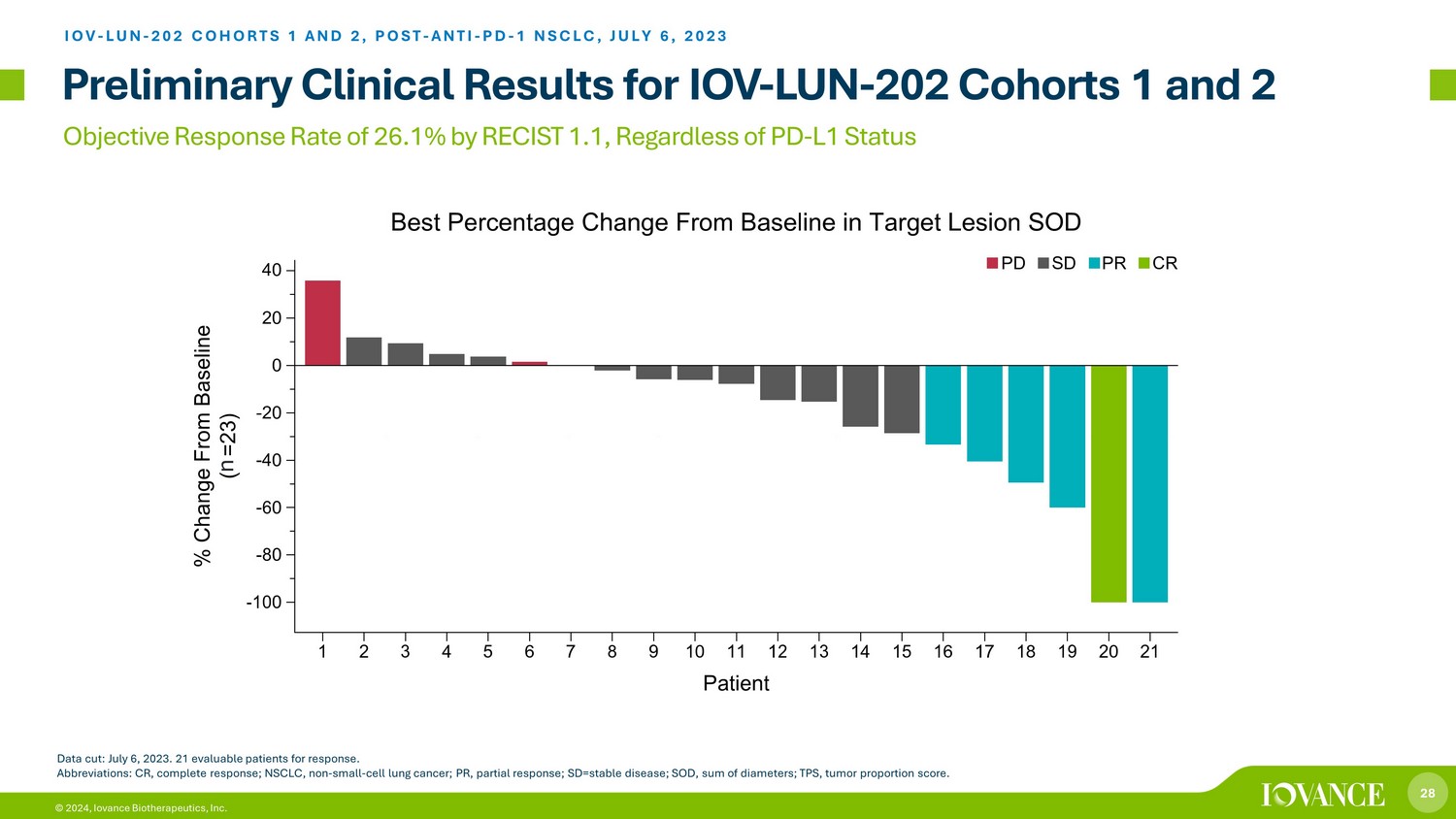
28 © 2024,根据RECIST 1.1,Iovance Biotherapeutics, Inc.的目标回复率为26.1%,无论PD-L1状态如何,IOV-LUN-202队列1和2 IOV-LUN-202队列1和2,POST-ANTI-PD-1 NSCLC的初步临床结果,2023年7月6日截止日期:2023年7月6日。21名可评估患者的反应。缩写:CR,完全反应;NSCLC,非小细胞肺癌;PR,部分反应;SD = 稳定疾病;SOD,二米总和;TPS,肿瘤比例分数。n
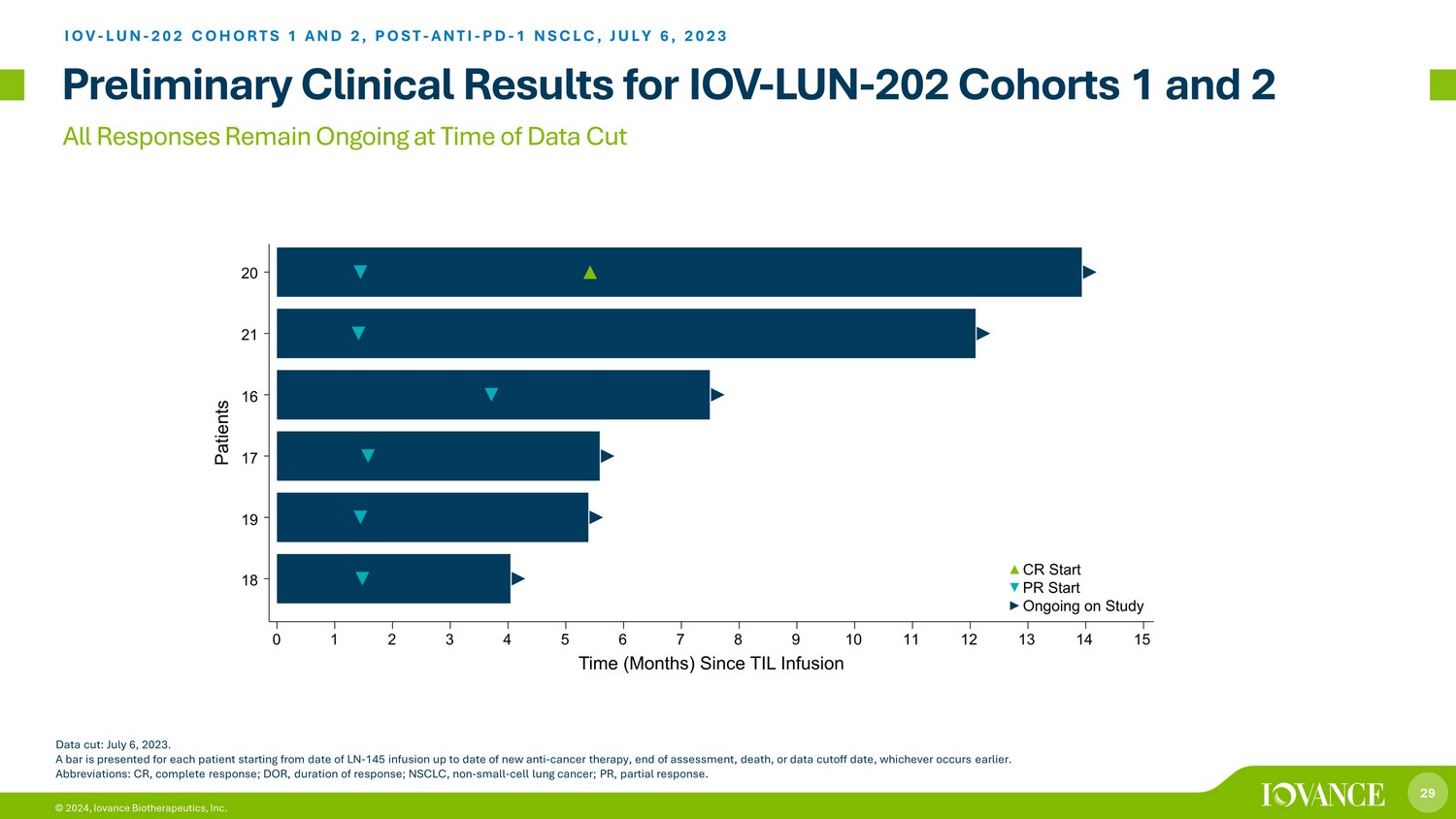
29 © 2024,Iovance Biotherapeutics, Inc. 截止数据时:2023年7月6日,所有回复仍在进行中。从注射LN-145之日起,到新的抗癌疗法的最新日期、评估结束、死亡或数据截止日期,以较早者为准,为每位患者提供一个条形图。缩写:CR,完全反应;DOR,反应持续时间;NSCLC,非小细胞肺癌;PR,部分反应。IOV-LUN-202 队列 1 和 2,POST-ANTI-PD-1 NSCLC,2023 年 7 月 6 日 IOV-LUN-202 队列 1 和 2 的初步临床结果

30 © 2024,Iovance Biotherapeutics, Inc. ICI 中的 TIL 概念验证——无论病情如何,均为天真非小细胞肺癌——L1 状态队列 3A 摘要 IOV-COM-202 队列 3A 非小细胞肺癌组合(TIL+PEMBROLIZUMAB),WCLC 口头报告(2023 年 6 月 26 日数据截图)队列 3A 结果支持将 TIL 疗法添加到前线 Pembrolizumab Zumab + 化疗组合方案随访 18.2 个月时的临床活性 1 • ICI 初生亚组和 TPS 评分的活性 • 表皮生长因子 WT 病非小细胞肺癌患者的 58.3% (7/12) ORR 和 3 种持续反应 • 安全性与Iovance TIL 联合研究 • 支持针对一线表皮生长因子 WT 病患者的注册试验设计筛查 Pembrolizumab 给药(单剂量)NMA-LD Cy/Flu Lifileucel/LN-145 输液 IL-2 ≤6 剂量 Pembrolizumab Q3W 或 Q6W 疗效随访入组/手术切除评估期:第 0 天至 EOA GMP 制造 EOA 新疗法的进展 EOS EOT 长期随访 1.舍恩菲尔德等WCLC 2023 缩写:cy/flu、阿糖胞苷/氟达拉滨;EGFR,表皮生长因子受体;ICI,免疫检查点抑制剂;IL-2,白介素-2;NMA-LD,非骨髓消融性淋巴消耗;TPS,肿瘤比例评分;WT,野生型

31 © 2024,Iovance Biotherapeutics, Inc. ICI Naieve 亚组的 TIL 活性和 TPS 分数,包括 EGFR WT 病最佳反应患者的 58.3% ORR 和靶损变动百分比 SOD IOV-COM-202 队列 3A 非小细胞肺癌组合(TIL+PEMBROLIZUMAB),WCLC口头报告(2023年6月26日数据截图)1。KEYTRUDA USPI;OPDIVO USPI 缩写:CR,完全反应;DCR,疾病控制率;EGFR,表皮生长因子受体;ICI,免疫检查点抑制剂;NSCLC,非小细胞肺癌;ORR,客观反应率;PD,进行性疾病;PR,稳定疾病;SOD,直径总和;PS,肿瘤比例 sc ore;WT,野生型最佳总体反应队列 3A 表皮生长因子 WT 患者(N=12)n/n%(95% 置信区间)ORR 7 58.3(27.7,84.8)DCR 9 75.0(42.8,94.5)CR 1 8.3 PR 6 50.0 SD 2 16.7 PD 2 16.7 NE 1 8.3 • 队列 3A 75.0(42.8,94.5)CR 1 8.3 PR 6 50.0 SD 2 16.7 PD 2 16.7 NE 1 8.3 • 队列 3A先前治疗的ORR:• 治疗——天真:80%(4/5)• 化疗后:42.9%(3/7)• 抗 PD-1 单一疗法基准 1:• 治疗-天真:27%(TPS ≥ 1%);39-45%(TPS ≥ 50%)• 化疗后:18-20% 60 40 20-20-40-60-80 3A-03 3A-16 3A-16 A-08 3A-15 3A-09 3A-04 3A-02 3A-10 3A-17 3A-11 3A-13 -100 -80 -60 -20 0 20 40 60 100% C h h h a n g e f r o m b a s e l i n e l i n e n e a s e l i n e n=2 N=9 CRPRSDPD 最佳整体反应患者编号 03 16 08 15 09 04 02 10 11 13-100-80-60-40-20 0 20 40 60 80 100% 与基线相比变化 N=9 N=2 总体最佳回应 PD SD PR CR
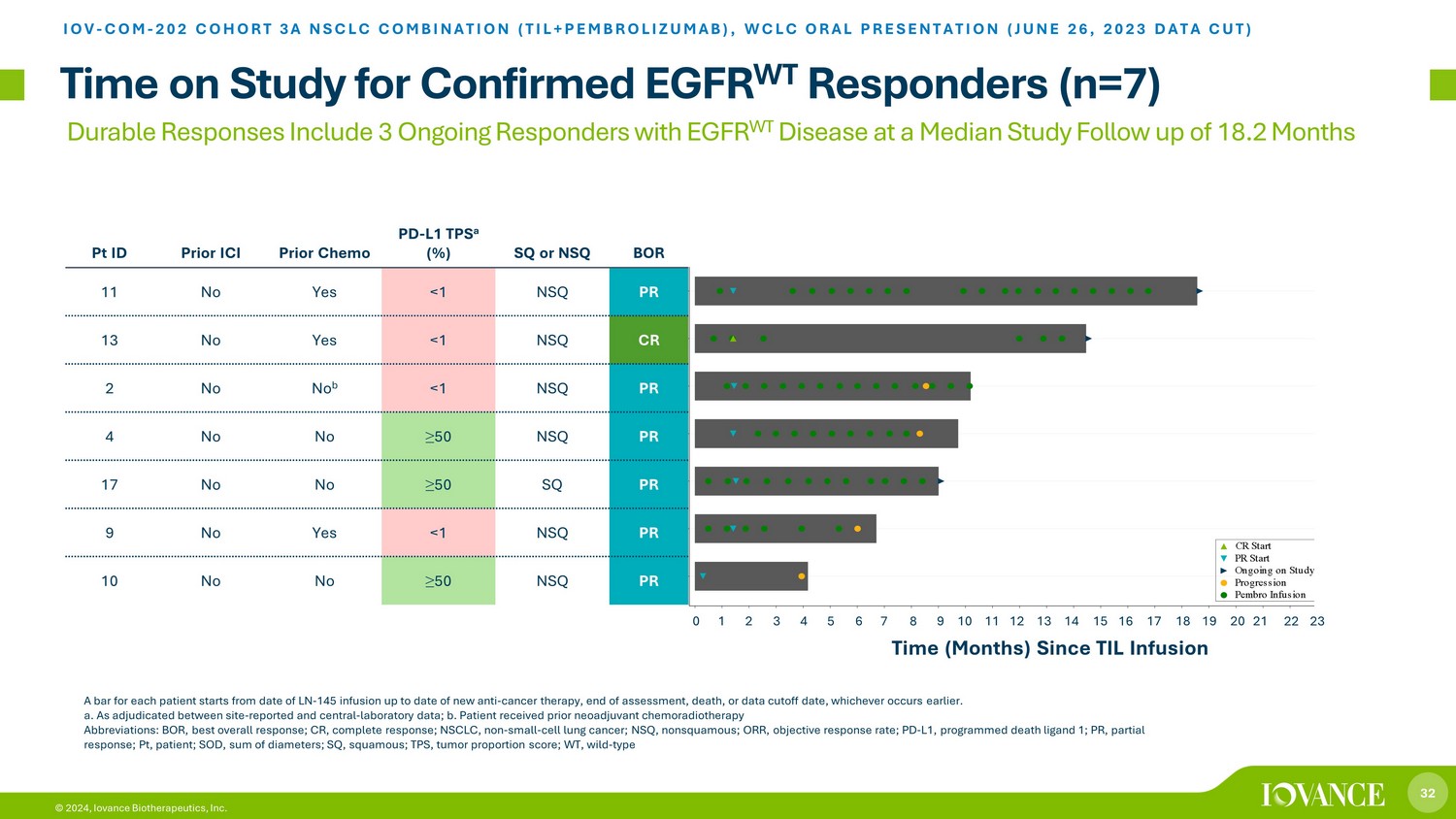
32 © 2024,Iovance Biotherapeutics, Inc. 对已确诊的表皮生长因子 WT 反应者的研究时间(n=7)IOV-COM-202 队列 3A 非小细胞肺癌组合(TIL+PEMBROLIZUMAB),WCLC 口头报告(2023 年 6 月 26 日数据截图)持久反应者包括 3 名表皮生长因子 WT 病的持续应答者,研究随访时间中位数为 18.2 个月,每位患者均有禁忌从注射LN-145之日起至新的抗癌疗法、评估结束、死亡或数据截止日期,以较早者为准。a. 根据现场报告和中心实验室数据之间的裁定;b.患者先前接受过新辅助放化疗缩写:BOR,最佳总体反应;CR,完全反应;NSCLC,非小细胞肺癌;NSQ,非鳞状肺癌;ORR,客体活性反应率;PD-L1,程序性死亡配体 1;PR,部分反应;PT,患者;SOD,直径总和;SQ,鳞状;TPS,肿瘤比例分数;WT,野生——3A-10 型 3A-09 3A-17 3A-04 3A-02 3A-02 3A-11 S u b j e c t s 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 个时间(月)Pembro 输液进展正在进行中 PR 开始 CR开始 Pt ID Prior ICI Prior Chemo PD-L1 TPS a (%) SQ 或 NSQ BOR 11 不是
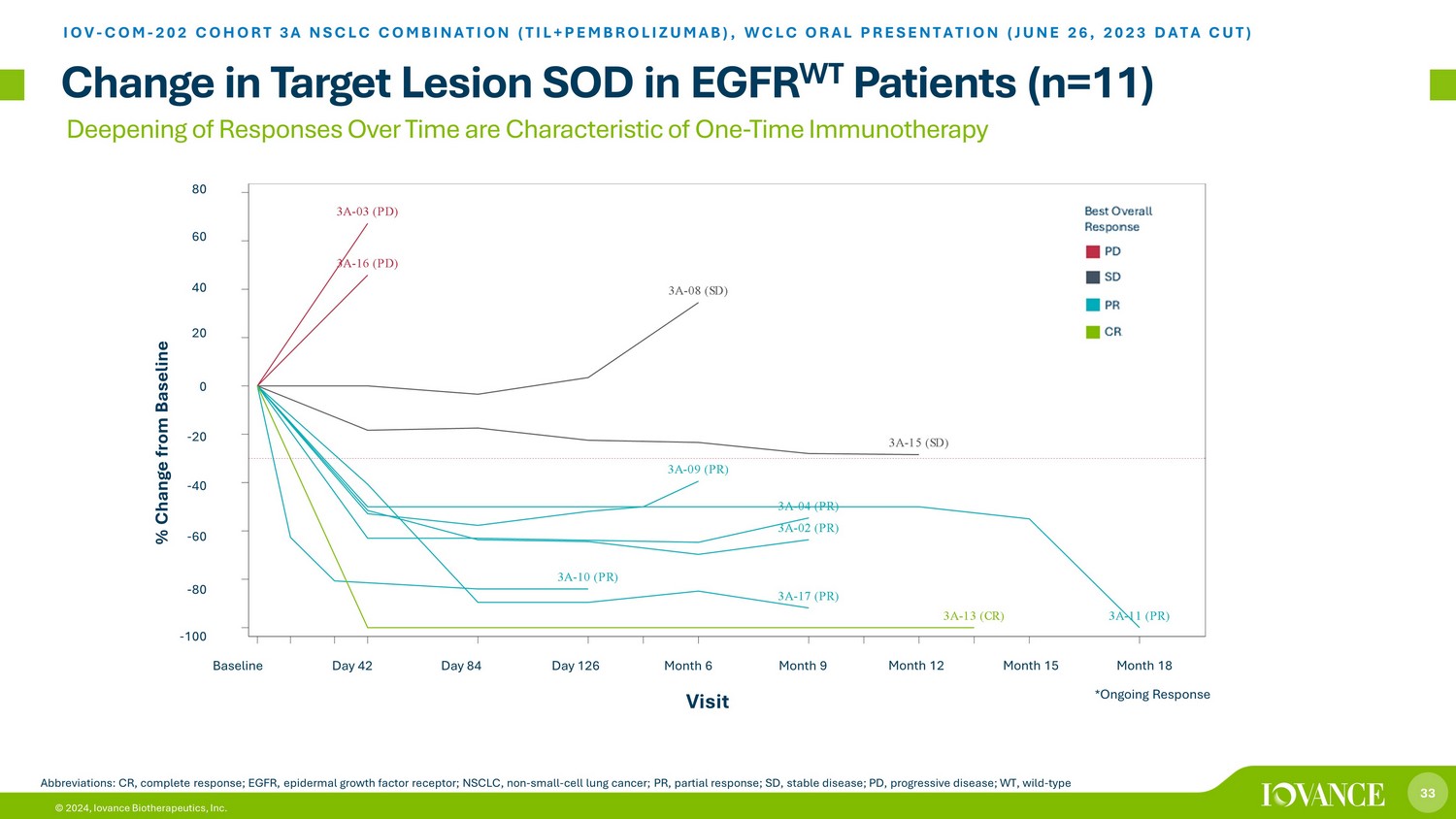
33 © 2024,Iovance Biotherapeutics, Inc. 随着时间的推移反应加深是 EGFR WT 患者靶病变 SOD 的一次性免疫疗法变化的特征(n=11)IOV-COM-202 队列 3A 非小细胞肺癌组合(TIL+PEMBROLIZUMAB),WCLC 口头陈述(2023 年 6 月 26 日数据剪切)缩写:CR,完整反应;表皮生长因子、表皮生长因子生长因子受体;NSCLC,非小细胞肺癌;PR,部分分辨率;SD,稳定疾病;PD,进行性疾病;WT,野生型最佳总体反应 PD SD PR CR 访问量 60 40-100-80-60-40-20 0 20 20 4060 80 与基准日相比的基准百分比变化 42 天 84 天 126 个月 6 个月 9 个月 12 个月 18 点 3 (PD) 第 8 点 (SD) 第 15 (SD) 第 9 点 (PR) 第 10 点 (PR) 第 17 点 (PR*) 第 13 点 (CR*) 第 11 点 (PR*) 第 4 点 (PR) *持续回复第 16 点 (PD) 第 2 点 (PR) 3A-03 (PD)) 3A-15 (SD) 3A-08 (SD) 3A-04 (PR) 3A-11 (PR) 3A-17 (PR) 3A-02 (PR) 3A-09 (PR) 3A-09 (PR) 3A-13 (CR) 基准日 42 天 84 天 126 个月六个月九个月 15 个月 18 访问 -100 -80 -60 -20 20 40 60 80 P e r c e n t C h a n g e CRPRSDPD 最佳回应
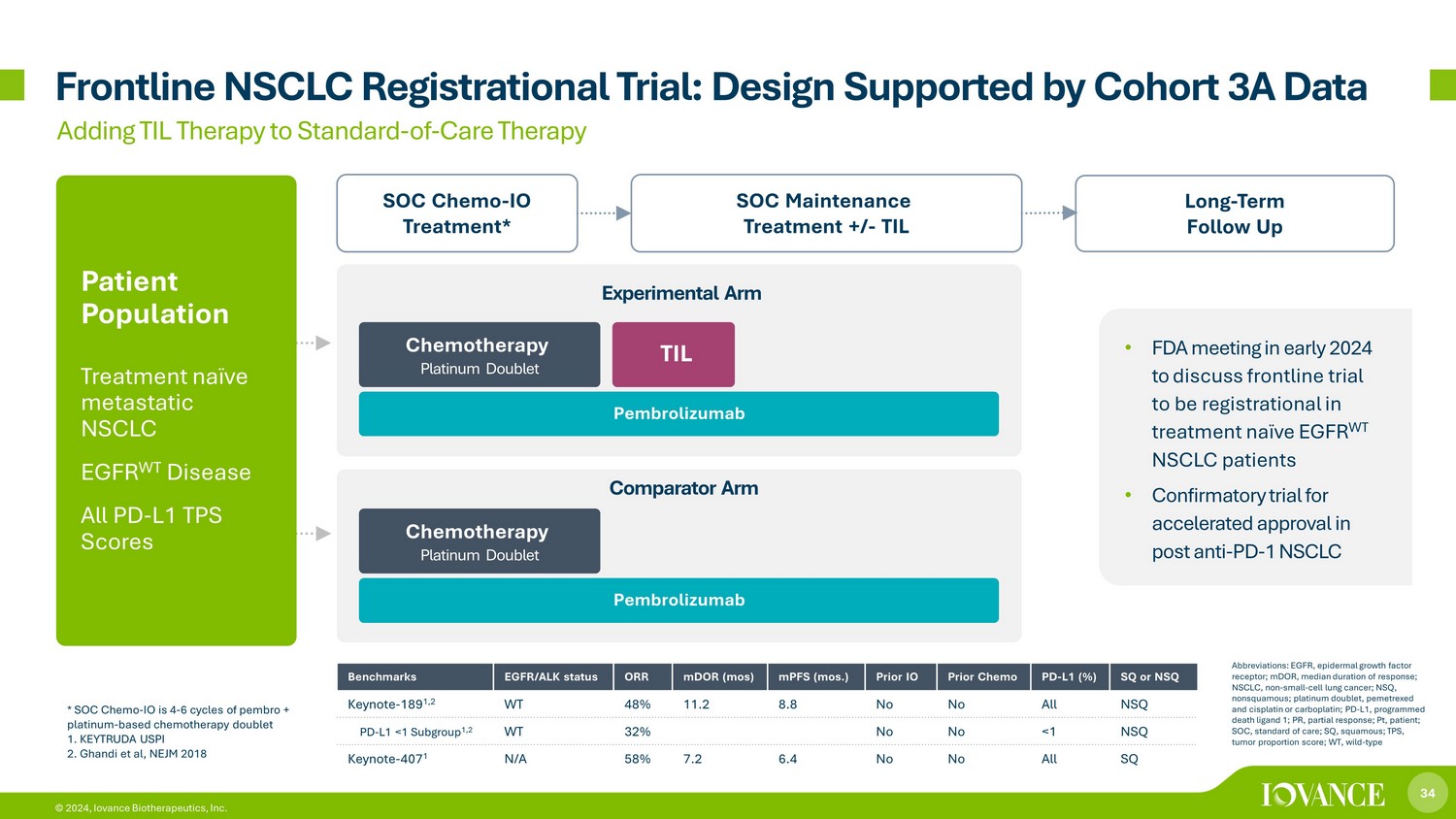
34 © 2024,Iovance Biotherapeutics, Inc. Frontline NSCLC 注册试验:由队列 3A 数据支持的设计长期随访 SOC 维持治疗 +/-TIL SOC Chemo-IO 治疗* 将 TIL 疗法添加到标准护理疗法中 TIL 患者群体治疗天真转移性非小细胞肺癌 EGFR WT 疾病所有 PD-L1 TPS 评分化疗铂金二联* SOC Chemo-IO 4-6 个周期的 pembro + 铂基化疗 doublet 1。KEYTRUDA USPI 2.Ghandi 等人,NEJM 2018 年基准 EGFR/ALK 状态 ORR mDoR(最多)MPF(mos.)Prior IO Prior Chemo PD-L1 (%) SQ 或 NSQ Keynote-189 1,2 WT 48% 11.2 8.8 否否所有 NSQ PD-L1
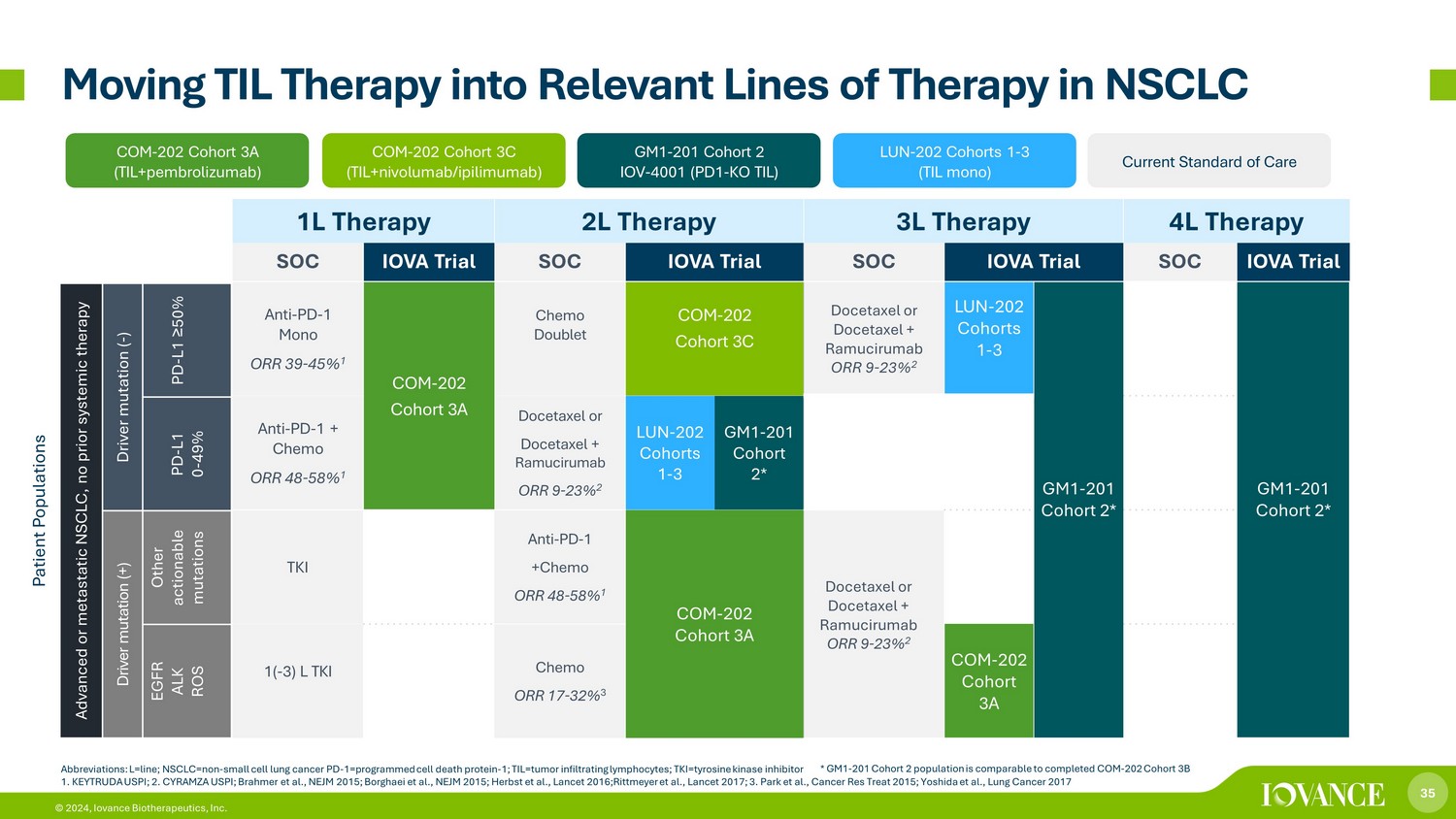
35 © 2024,Iovance Biotherapeutics, Inc. 1L 疗法 2L 疗法 3L 疗法 4L 疗法 SOC IOVA 试验 SOC IOVA 试验 SOC IOVA 试验 SOC IOVA 试验 ANTI-PD-1 单 ORR 39-45% 1 COM-202 队列 3A Chemo Doublet COM-202 队列 3C 多西他赛或多西他赛 + 拉穆西鲁单抗 ORR 9-23% 2 LUN 202 Horts 1-3 GM1-201 队列 2* GM1-201 队列 2* 抗 PD-1 + 化疗 ORR 48-58% 1 多西他赛或多西他赛 + Ramucirumab ORR 9-23% 2 LUN-202 队列 1-3 GM1-201 队列 2* TKI 抗-PD-1 +Chemo ORR 48-58% 1 COM-202 队列 2* TKI 抗-PD-1 +Chemo ORR 48-58% 1 COM-202 队列 3A 多西他赛或多西他赛+Ramucirumab ORR 9-23% 2 1 (-3) L TKI Chemo ORR 17-32% 3 COM-202 队列 3A * GM1-201 队列 2 人群与已完成的 COM-202 队列 3B 将 TIL 疗法转入 NSCLC 的相关治疗线路相当 COM-202 队列 3A (til+pembrolizumab) LUN-202 队列 1-3 (TIL mono) COM-202 队列 3C (TIL+ nivolumab /i pilimumab) GM1-201 队列 2 IOV-4001 (PD1-KO TIL) 当前护理标准患者群体晚期或转移性非小细胞肺癌,先前未进行全身治疗驱动突变 (-) PD-L1 ≥ 50% PD-L1 0-49% 驱动突变 (+) 其他可操作的突变 EGFR ALK ROS 缩写:L=Line;nsclc=non——小细胞肺癌 PD-1=编程细胞死亡蛋白——1;til=肿瘤浸润淋巴细胞;TKI=酪氨酸激酶抑制剂 1。KEYTRUDA USPI;2.CYRAMZA U S PI;Brahmer 等人,NEJM 2015;Borghaei 等人,NEJM 2015;Herbst 等人,《柳叶刀》2016;Rittmeyer 等人,《柳叶刀》2017;3.Park 等人,《2015 年癌症研究治疗》;Yoshida 等人,2017 年肺癌

36 © 2024,Iovance Biotherapeutics, Inc. 36 上市准备工作

37 © 2024,Iovance Biotherapeutics, Inc. i CTC 专为大批量 TIL 制造和灵活性而设计 • 核心套件:TIL 商业制造 • 灵活的套件:临床供应、管道扩张和先进制造 • 集成的质量控制、供应链和信息技术系统 • 100 多名员工,在发布前及以后将增加员工 • iovance Biotherapeutics, Inc.
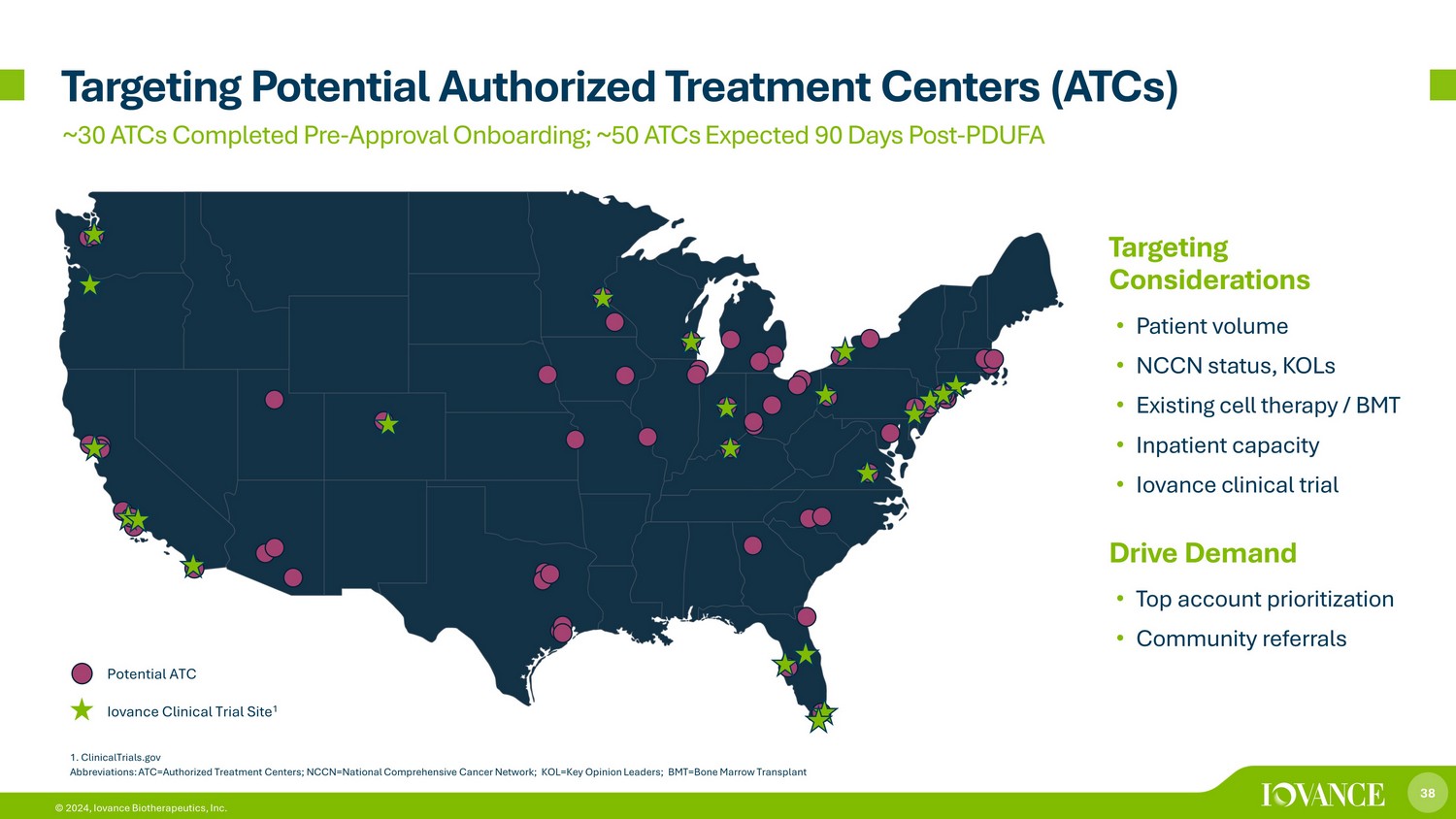
38 © 2024,Iovance Biotherapeutics, Inc. 瞄准潜在的授权治疗中心 (ATC) 潜在的 ATC Iovance 临床试验地点 1 1.ClinicalTrials.gov 缩写:ATC=授权治疗中心;nccn=全国综合癌症网络;KOL=关键意见领袖;bmt=骨髓移植靶向注意事项 • 患者数量 • NCCN状态,KOL • 现有细胞疗法/ BMT • 住院容量 • Iovance 临床试验推动需求 • 首要客户优先级 • 社区转诊约 30 个 ATC 预批准入职;预计在 90 天后 90 天内完成 50 个 ATC-PDUFA
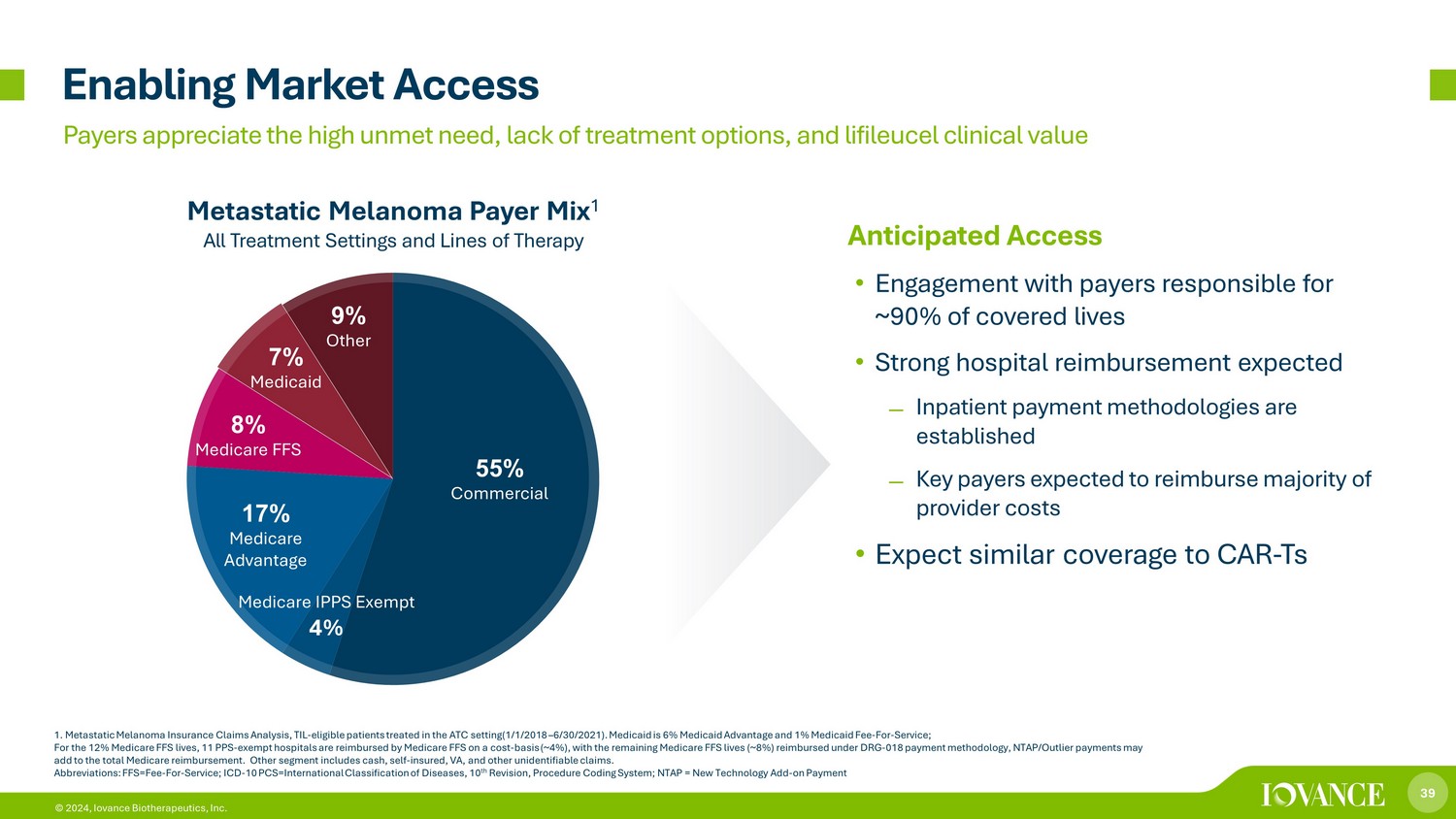
39 © 2024,Iovance Biotherapeutics, Inc. 55% 商业医疗保险 IPPS 豁免 4% 17% Medicare Advantage 8% Medicare FFS 7% Medicaid 9% 其他赋能市场准入转移性黑色素瘤支付者混合物 1.转移性黑色素瘤保险索赔分析,TIL-在 ATC 环境中接受治疗的符合条件的患者(2018 年 1 月 1 日 — 2021 年 6 月 30 日)。Medicai d为6%的医疗补助优势和1%的医疗补助费——服务费;对于12%的Medicare FFS生活,11家PPS——免税医院由Medicare FFS按成本(约4%)报销,剩余的Medicare FFS寿命(约8%)根据DRG-018付款方式报销,NTAP/异常值补助金可能会增加医疗保险报销总额。其他部分包括现金、自保、弗吉尼亚州和其他无法识别的索赔。缩略语:FFS=Fee——用于——服务;ICD-10 PCS=国际疾病分类,第十修订版,程序编码系统;NTAP = 新技术附加付款人意识到大量未得到满足的需求、缺乏治疗选择和生命的临床价值预期准入 • 与负责约90%的承保生命的付款人互动 • 预计将有强劲的医院报销——住院补偿方法已制定——预计主要付款人将占大部分供应商成本 • 预计承保范围与 CAR 相似-Ts
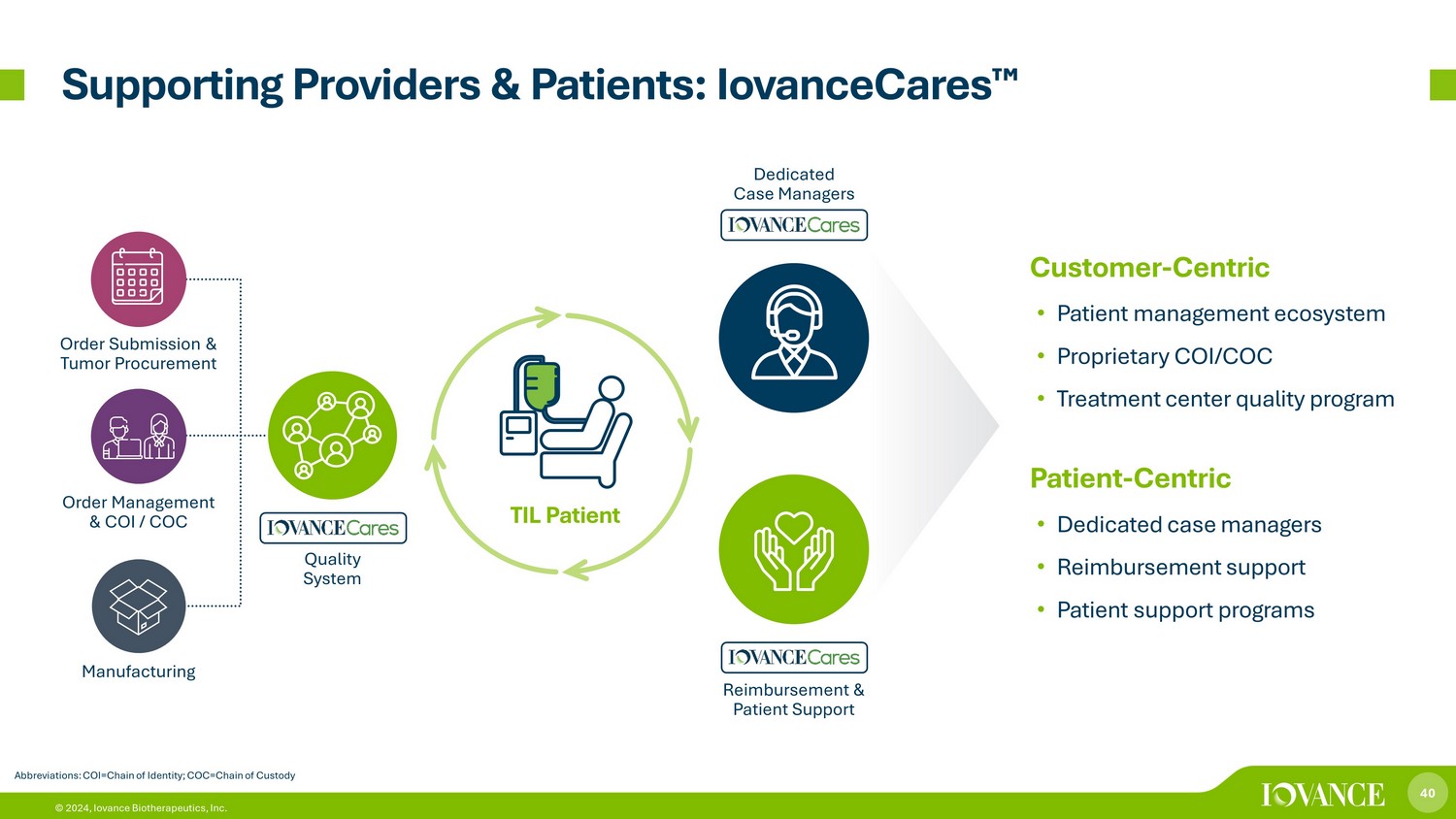
40 © 2024,Iovance Biotherapeutics, Inc. 支持提供商和患者:iovanceCares 缩写:COI=身份链;COC=监管链以客户为中心 • 患者管理生态系统 • 专有COI/COC • 治疗中心质量计划以患者为中心 • 专属病例经理 • 报销支持 • 患者支持计划质量体系专业个案经理报销和患者支持订单提交和肿瘤采购订单管理和COI/COC制造 TIL 病人
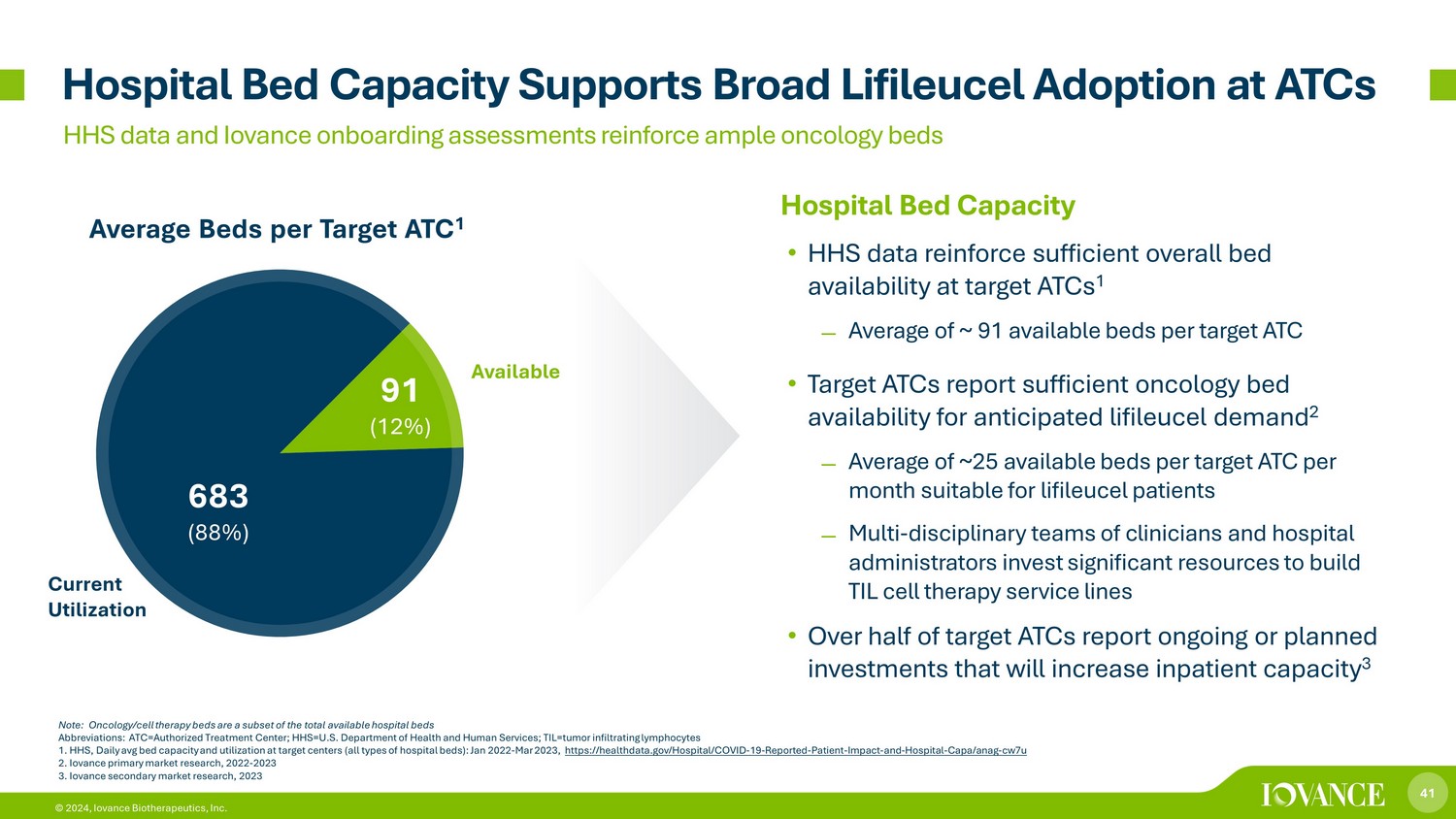
41 © 2024,Iovance Biotherapeutics, Inc. 的医院床位容量 • HHS 数据证实了目标 ATC 的总体床位供应量充足 1-每个目标 ATC 的可用床位平均约为 91 张 • 目标 ATC 报告肿瘤床位充足,可满足预期的生命细胞需求 2-每个目标 ATC 每月平均有大约 25 张可用床位,适合lifileucel患者,由临床医生和医院管理人员组成的多学科团队投入大量资源建立 TIL 细胞疗法服务热线 • 超过一半的目标 ATC 报告说正在进行或计划中投资将增加住院容量 3 张目标平均床位 ATC 1 病床容量支持 ATC 广泛采用 Lifileucel HHS 数据和 Iovance 入职评估强化了充足的肿瘤病床注意:肿瘤学/细胞疗法床位是可用病床总数的子集缩写:ATC=授权治疗中心;HHS=美国卫生与公共服务部;til=肿瘤浸润淋巴细胞 1。HHS,目标中心(所有类型的医院病床)的每日平均床位容量和利用率:2022年1月至2023年3月,https://healthdata.gov/Hospital/COVID-19-已报告-患者-影响-和-医院-CAPA/Anag-cw7u 2。Iovance 主要市场研究,2022-2023 3 3 3.Iovance 二级市场研究,2023 683 (88%) 91 (12%) 可用电流

42 © 2024,Iovance Biotherapeutics, Inc. 42 其他 TIL 疗法临床项目亮点

43 © 2024,Iovance Biotherapeutics, Inc. 1/2 阶段开放——标签先入——人体研究:IOV-GM1-201 个终点 • 第 1 阶段:安全性 • 第 2 阶段:研究者评估的 RECIST v1.1 的客观反应率 (ORR) • 次要终点包括完全反应率 (CR)、反应持续时间 (DOR)、疾病控制率 (DCR)、自由进展存活率 (PFS)、总体存活率 (OS)、安全性和耐受性、可行性研究更新 • 22 年第 3 季度:第一批接受治疗的患者队列 1:不可切除或转移的黑色素瘤后-抗 PD-1/L1,后-BRAF/MEKBRAF 突变患者的抑制剂队列 2:III 期或 IV 期 NSCLC 后-抗 PD-1/L1 或靶向治疗后,以及化疗或抗 PD-1/L1 患者群体患有不可切除或转移性黑色素瘤或晚期 NSCLC 的成年人 N=53 转基因,PD-1 灭活 TIL 治疗 IOV-4001 用于先前治疗的转移性黑色素瘤和 NSCLC (NCT05361174) 下一代 TIL 疗法 IOV-4001 nsclc=非小细胞肺癌

44 © 2024,Iovance Biotherapeutics, Inc. 宫颈癌的潜在市场 1.2020年全球癌症统计:GLOBOCAN对全球185个国家36种癌症的发病率和死亡率估计,CA Ca ncer J Clin。,2021年5月;2.美国国家癌症研究所监测、流行病学和最终结果(SEER)计划。2023 年估计。https://seer.cancer.gov 已于 2023 年 5 月访问;3.Tewari 等人,NEJM 2014;4.科伦坡等人,NEJM 2021;5.Keytruda 美国 PI;6.Coleman 等人,《Lancet Oncol 2021》;7.McLachlan 等人,Clin Oncol 2017;8.Miller 等人,Gencheol Oncol 2008 年新增病例 WW 每年美国有 1 60.4 万例 14k 诊断 2 342k 4k 全球每年 1 人死亡 2 可用护理 ORR 前线中位数:联合化疗 + 贝伐珠单抗 3 48% 未报告 Pembrolizumab + chemo + bevacizumab(PD-L1+ 患者)4 68.1% 18 个月 18 个月未报告 Pembrolizumab + 化疗 + 贝伐珠单抗(PD-L1+ 患者)4 68.1% 18 个月线路:Pembrolizumab 后——化疗(PD-L1+ 患者)5 14.3% 未达到 Tisotumab vedotin——tftv 发布——化疗 6 24% 8.3 个月二线/三线化疗 7,8 3.4% — 15% 4.4 个月 8 解决明确的未满足问题化疗和抗PD后宫颈癌的需求-1
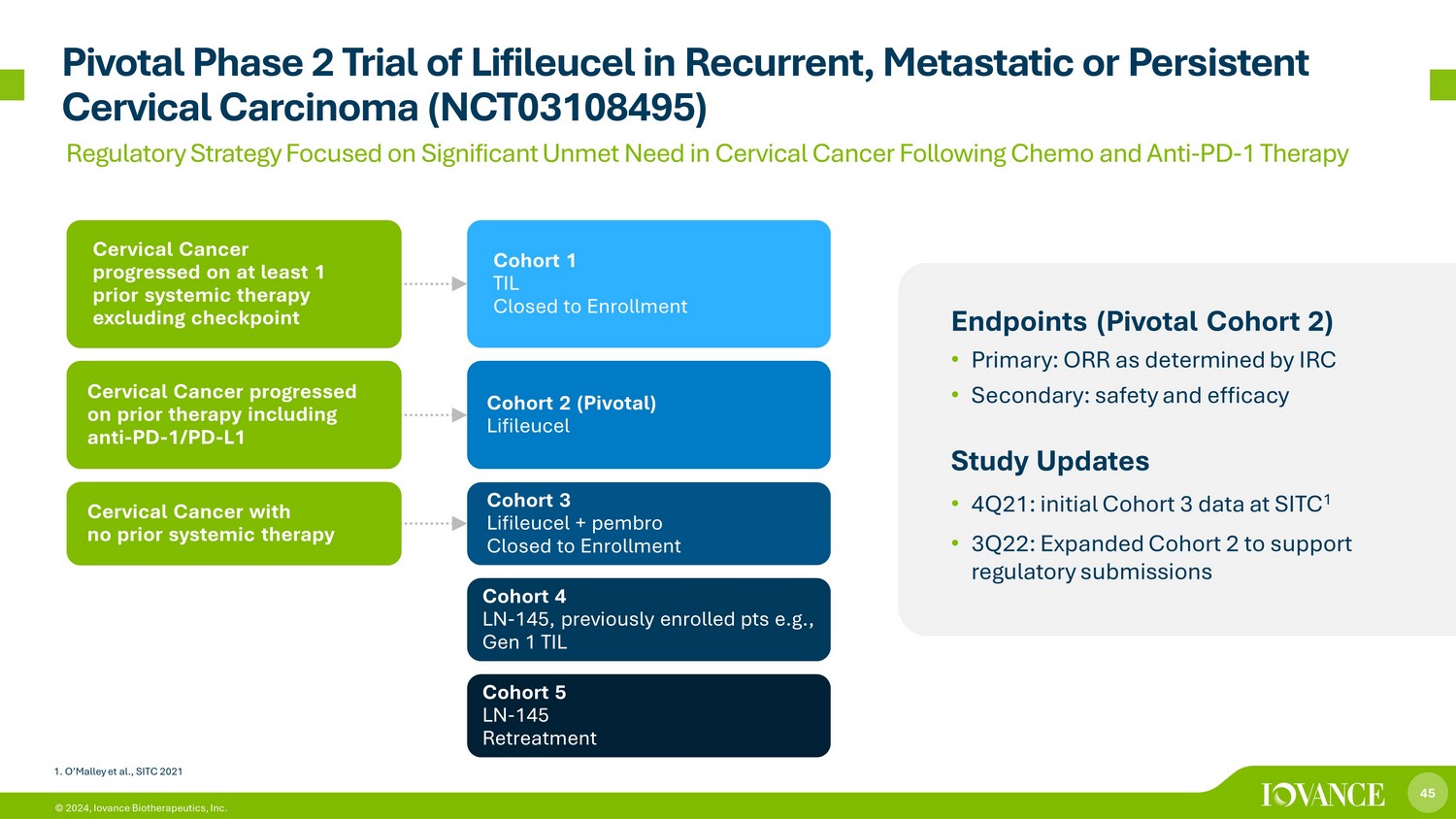
45 © 2024,Iovance Biotherapeutics, Inc. Lifileucel在复发、转移性或持续性宫颈癌(NCT03108495)终点中的关键性2期试验(关键队列2)• 主要:IRC确定的ORR • 次要:安全性和有效性研究更新 • 2021年第四季度:SITC 1的初始队列3数据•2022年第三季度:扩大队列2以支持监管机构提交队列1 TIL已停止入组 2 (Pivotal) Lifileucel 队列 3 Lifileucel + pembro 已关闭入组队列 4 LN-145,之前注册的 pts,例如,第 1 代 TIL 队列 5 LN-145 再治疗宫颈癌在先前的至少1次全身治疗中进展不包括检查点子宫颈癌在先前的治疗中进展,包括抗PD-1/PD-L1宫颈癌,之前没有进行全身治疗 1.O'Malley等人,《SITC 2021年监管战略》侧重于化疗和抗PD-1疗法后宫颈癌未得到满足的重大需求

46 © 2024,Iovance Biotherapeutics, Inc. 46 下一代研究项目
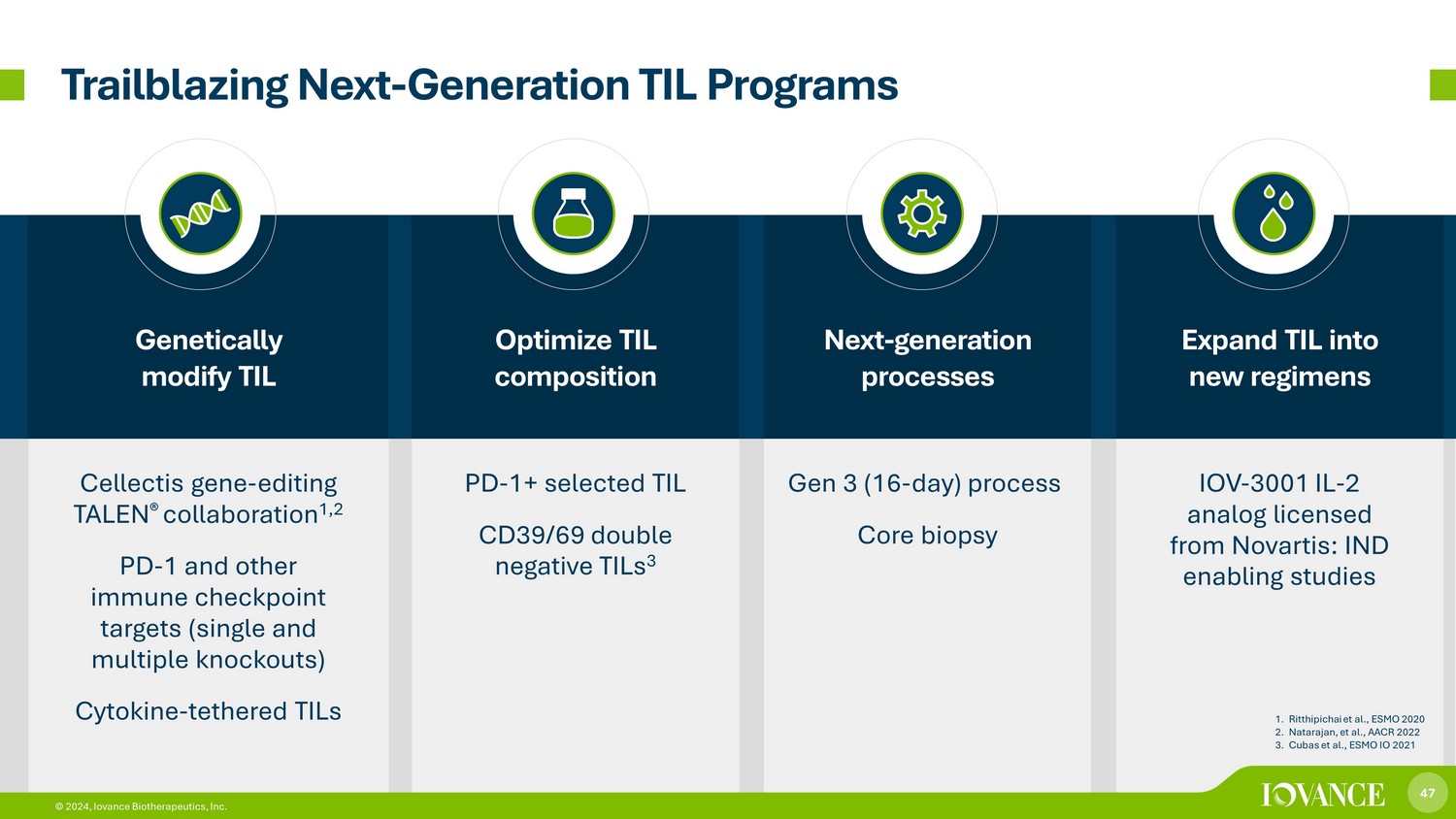
47 © 2024,Iovance Biotherapeutics, Inc. 进行基因修改 TIL 优化 TIL 成分下一代流程将 TIL 扩展到新方案 Cellectis 基因-编辑 TALEN® 合作 1,2 PD-1 和其他免疫检查点靶标(单一和多重敲除)细胞因子-联机 TilS PD-1+ 精选 TIL CD39/69 双阴性 TIL 3 代(16 天)流程核心活检 IOV-3001 IL-2 模拟器获得诺华许可:IND 支持研究 “开拓下一代 TIL 计划” 1。Ritthipichai 等人,ESMO 2020 2.Natarajan 等人,AACR 2022 3.Cubas 等人,ESMO IO 2021 47 © 2024,Iovance Biotherapeutics, Inc.

48 © 2024,Iovance Biotherapeutics, Inc. 48 公司摘要和里程碑

49 © 2024,Iovance Biotherapeutics, Inc. 2023 年 9 月 30 日(以百万计)现金、现金等价物、投资、限制性现金427.8 美元 1 已发行普通股 255.8 股已发行优先股 2.9 2 已发行的股票期权和限制性股票单位 23.1 1.包括截至2023年9月30日的6,640万美元的限制性现金。2.优先股按转换后的基础上列示好吧——为追求TIL商业化而资本化的现金流到2025年已经足够了**包括2024年来自lifileucel和Proleukin® 的预期收入
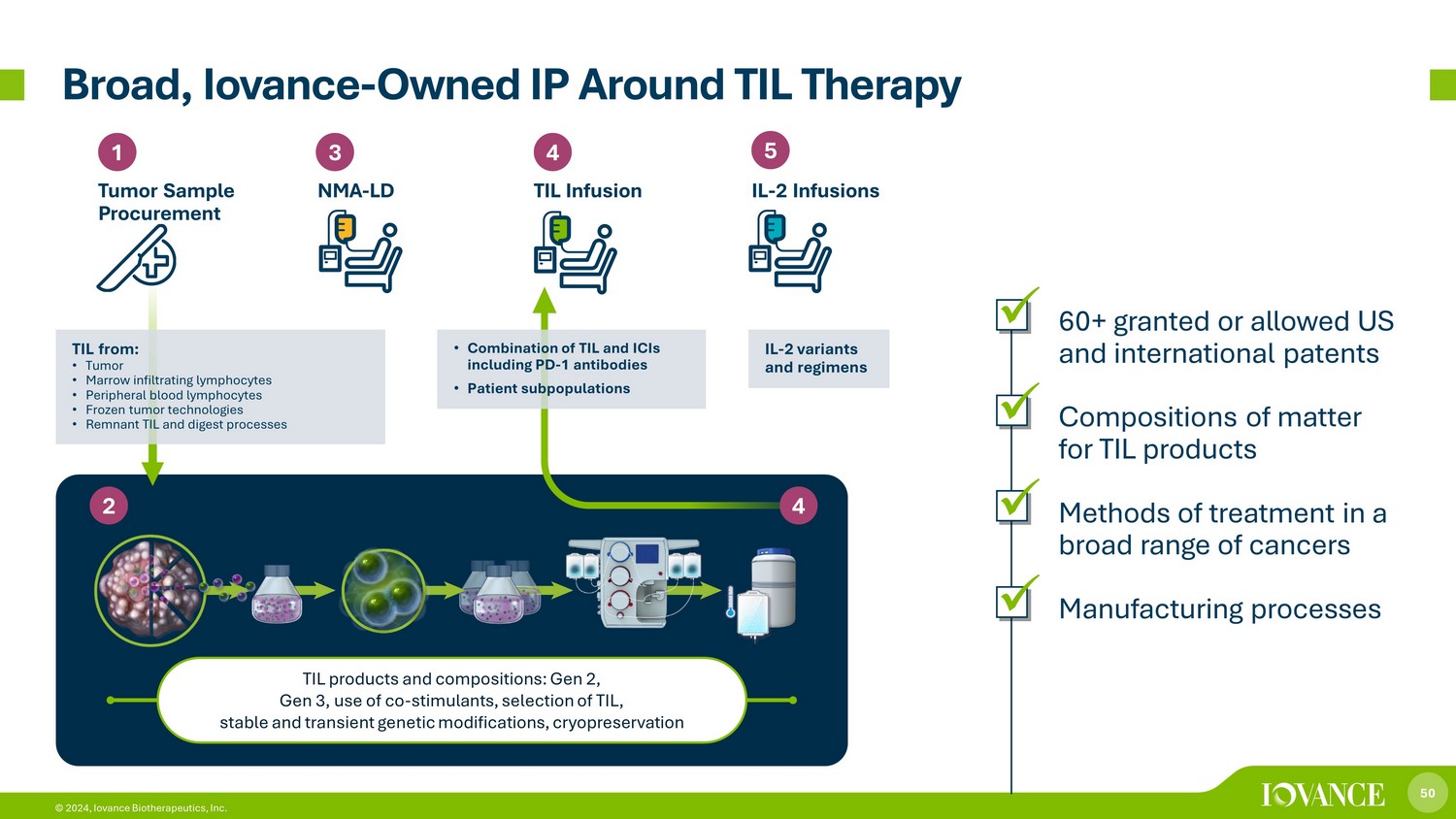
50 © 2024,Iovance Biotherapeutics, Inc. Broad,Iovance——在TIL Therapy TIL产品和成分方面拥有的知识产权:第二代、第三代、共兴奋剂的使用、TIL、稳定和短暂的基因修饰、低温保存 1 肿瘤样本采购 3 4 NMA-LD TIL 输液 5 IL-2 输液 4 2 TIL 来自:• 肿瘤 • 骨髓浸润淋巴细胞 • 外周血液淋巴细胞 • 冷冻肿瘤技术 • 残留 TIL 和消化过程 • TIL 和 ICI 的组合,包括 PD-1 抗体 • 患者亚群 IL-2 变体和方案 x60 多项已获授权或允许的美国和国际专利 x TIL 产品的物质成分 x 各种癌症的治疗方法 x 制造工艺

51 © 2024,Iovance Biotherapeutics, Inc. 公司要点开创治疗癌症的变革性方法在未得到满足的癌症需求中拥有巨大市场机遇首个细胞疗法获准用于实体瘤高效且可扩展的专有制造设施基础设施在商业上取得成功 • 最初的重点是ICI后期实体瘤 • 扩展到联合疗法、早期疗法和基因改造 • 黑色素瘤、非小细胞肺癌和宫颈癌的关键后期试验 • 先进-转基因 TIL 的人体试验,PD-1 已失活 • BLA 通过优先审查和 RMAT 申请了用于晚期黑色素瘤的 lifileucel • TILVANCE-301 使用 FTD 进行的 3 期一线晚期黑色素瘤确认试验 • 非小细胞肺癌和宫颈癌 (BTD) 的明确注册策略 • 内部制造的 Iovance 细胞疗法中心 (i CTC) • 合同制造商增加产能 • 为期 22 天的快速第 2 代制造,成功率超过 90% • >使用 Iovance 专有工艺治疗 700 名患者 • 完全整合的公司 • 经验丰富的跨职能细胞疗法团队 • 合作美国领先的癌症中心将开发TIL服务——线路能力 • iovanceCares的专有平台 • Proleukin® 整合 51 © 2024,Iovance Biotherapeutics, Inc. 缩写:BLA,生物制剂许可申请;BTD,突破性疗法名称;FTD,快速通道名称;ICI,i mmu ne 检查点抑制剂;NSCLC,非小细胞肺癌;PD-1,程序性细胞死亡蛋白质-1;RMAT,再生药物高级疗法;TIL,肿瘤信息渗透淋巴细胞。

52 © 2024,Iovance Biotherapeutics, Inc. 监管 □ BLA:在 2023 年第一季度完成了抗PD-1 晚期黑色素瘤的 lifileucel 的滚动提交;后期周期会议已完成,BLA 有望实现 PDUFA 日期 □ 前线美国监管机构文件:启动美国前市场申报准备工作管道 □ 黑色素瘤:招收患者参加一线晚期黑色素瘤确诊试验 □ NSCLC:报告数据并继续入组 IOV-LUN-202、IOV-COM-202、IOV-GM1-202、IOV-GM1-201 试验 □ 子宫颈:招收更多患者进行注册第 2 组 □ 研究:将新产品推向临床,包括其他转基因 TIL 疗法制造 □ 执行 GMP 商业准备活动以支持 BLA 批准,包括通过 PLI 检查 □ 在发布时供应lifileucel:提高 iCTC 和 CDMO 产能,为上市做准备 □ 完成交易并成功整合 Proleukin® 业务 2023 年里程碑

53 © 2024,Iovance Biotherapeutics, Inc. 监管 □ 获得 FDA 批准用于晚期黑色素瘤的 lifileucel(PDUFA 日期:2024 年 2 月 24 日)□ 于 2024 年上半年提交 EMA 监管机构申报 □ 在 2024 年下半年提交更多前美国申报 □ 与 FDA 会面,讨论 NSCLC 注册路径/前线研究管道 □ 报告临床和临床前数据 □ 恢复IOV-LUN的注册-202 □ 启动子宫内膜癌的二期试验 □ 继续招募患者参与晚期黑色素瘤、非小细胞肺癌和妇科癌的临床试验 □将新产品推向临床,包括更多转基因 TIL 疗法的制造 □ 满足患者对商业上市和临床试验的需求 □ 进一步扩大产能以满足美国和美国以外的需求商用 □ 进行商业发布(24 年第 1 季度)□ 在 PDUFA 之日起 90 天内上线 50 台 ATC 预计里程碑 2024 年里程碑

54 © 2024,Iovance Biotherapeutics, Inc. © 2024,Iovance Biotherapeutics, Inc. 谢谢