目录表
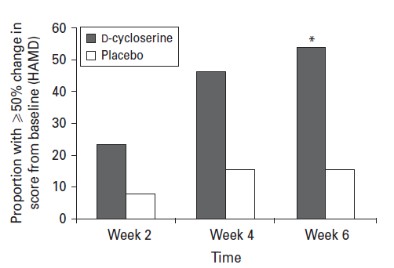
抗精神病药物)。这种协同效应现在已经在实验室啮齿动物行为实验和多个第二阶段临床试验中得到证明,并导致在美国和多个外国司法管辖区授予物质组合物专利。贾维特随后观察到,当抑郁症患者接受NMDA拮抗剂DC与抗抑郁药联合治疗时,他们表现出更强的抗抑郁效果,但没有表现出之前报道的幻觉和其他NMDA效应。他进一步观察到,DCs似乎减少了所有已知的5-羟色胺靶向抗抑郁药常见的一些抗抑郁药副作用(静坐不能)。
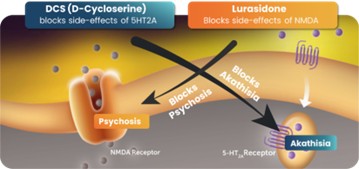
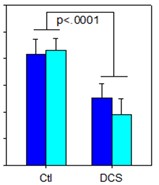
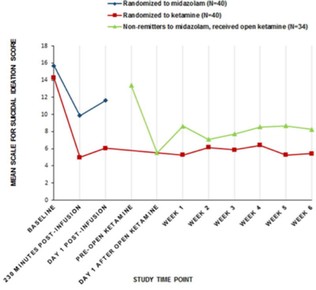
图1抑制NMDA受体的药物阻断由5-羟色胺靶向药物和5-羟色胺靶向药物引起的静坐不能,进而阻断NMDA抑制剂的迷幻作用的物质的协同组成。美国专利10583138的基础。消息来源:NeuroRx,Inc.
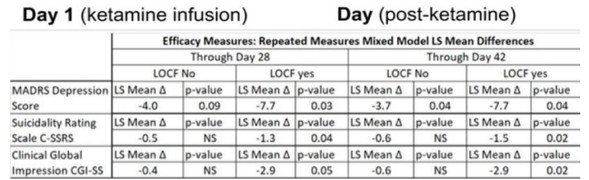
这些专利发现支持NRX-101,这是第一个获得快速通道指定和突破性治疗指定的研究用口服抗抑郁药,以及FDA针对ASIB患者严重双相抑郁的特别协议。NRX致力于该产品和其他产品的研究、开发和未来的商业化,用于治疗在双相抑郁和严重抑郁障碍(“MDD”)以及创伤后应激障碍(PTSD)和潜在的慢性疼痛中患有自杀意念的患者。抑制大脑NMDA受体而不受氯胺酮限制的药物引起了人们的极大兴趣,自从发现氯胺酮在减少抑郁和自杀意念方面具有强大的效果以来,人们一直在探索用于治疗上述疾病的药物。我们认为,NRX-101和我们将不同分子结合在一起的知识产权可能会产生使用NMDA抑制药物用于此目的的竞争优势,因为其他化合物可能会受到不利因素的限制,如神经毒性(长期使用)、幻觉、潜在的习惯性(即成瘾特性)、血压升高和/或缺乏口服生物利用度。
这种协同效应是下文所述专利组合背后的一项关键发现。科学发现表明,NMDA药物的一些副作用可以被5-HT2A药物阻断,反过来,NMDA成分可以阻止静坐不能,这是5-HT2A阻断药物的已知副作用,众所周知,它容易导致自杀。这种双重目标的方法是我们全球专利组合的主要基础,目前包括38项未决申请,以及多个司法管辖区的48项已授权专利,涵盖物质的组成和使用方法(见“NRX专利组合”)。此组合中的相关专利和专利申请由NeuroRx拥有,由GlyTech,LLC(“GlyTech”)独家授权给NeuroRx,GlyTech是一家特拉华州的有限责任公司,由Daniel·贾维特博士全资拥有(“GlyTech许可证”),或由Sarah Herzog Memory Hospital Ezrat Nashim(“SHMH”)独家授权给NeuroRx,后者是根据以色列法律组织的非营利性组织(“SHMH许可证”)。
NeuroRx拥有一项美国合成物质专利,涵盖NRX-101。GlyTech许可下的专利涵盖物质的组成(包括NRX-101和流水线治疗候选药物)和使用方法(包括使用NRX-101治疗有自杀意念的躁郁症和治疗创伤后应激障碍的方法),已在美国、欧洲(包括欧洲专利公约18个成员国的验证)、日本、澳大利亚和中国获得授权。
12