
O c u p h i r e i r e i n v e s t o r p r e s e n t a t i o n m a r c h 2 0 2 4 附录 99.1

本演示文稿包含1995年
《私人证券诉讼改革法》所指的前瞻性陈述。此类声明包括但不限于以下方面的声明:与美国食品药品管理局举行第二阶段会议以协调后期注册终点和研究参数、RYZUMVI 的推出
、PS 和 LDP 的持续发展、我们与 Viatris 的合作、我们的现金状况强度以及 APX3330 作为非增殖性糖尿病视网膜病变患者口服疗法的潜力。这些
前瞻性陈述与我们、我们的业务前景和经营业绩有关,受许多因素和事件构成的某些风险和不确定性的影响,这些因素和事件可能导致我们的实际业务、前景和
运营业绩与此类前瞻性陈述的预期存在重大差异。可能导致或促成此类差异的因素包括但不限于我们 10-K 表年度报告中
中 “风险因素” 标题下描述的因素。提醒读者不要过分依赖这些前瞻性陈述,这些陈述仅代表截至本演讲之日。在某些情况下,你可以通过以下词语来识别前瞻性陈述:“预期”、“相信”、“继续”、“可能”、“估计”、“预期”、“打算”、“可能”、“持续”、“计划”、“潜在”、“预测”、“项目”、“应该”、“将” 或否定这些术语或其他类似的
术语,但是并非所有前瞻性陈述都包含这些词语。我们没有义务修改任何前瞻性陈述以反映随后可能发生的事件或情况。这些前瞻性
陈述基于Ocuphire当前的预期,涉及可能永远无法实现或可能被证明不正确的假设。由于各种风险和不确定性,实际结果和事件发生时间可能与此类
前瞻性陈述中的预期存在重大差异,包括但不限于:监管机构申报以及临床前和临床试验的成功和时机,包括入组和数据读取;
监管要求或发展;与临床试验设计和监管路径相关的变化或意外事件;临床试验患者入组的延迟或困难;实质性竞争
和快速的技术变革;我们销售和营销基础设施的发展;未来的收入损失和盈利能力;我们相对较短的运营历史;资本资源要求的变化;与Ocuphire无法获得足够的额外资本以继续推进其候选产品及其临床前计划相关的风险;国内和全球立法、监管、政治和经济发展;员工不当行为;
市场机会和接受度的变化;对第三者的依赖双方;未来、潜在的产品责任和证券诉讼;系统故障、计划外事件或网络事件;与我们与LPC的股票信贷额度安排相关的大量可能发行的股票;我们与Viatris的合作或其他许可安排可能不利于Ocuphire的产品
候选产品的商业化或市场接受的风险;我们普通股市场价格的未来波动;成功以及 Ocuphire 任何产品的商业化时机候选人;以及获得和维护Ocuphire的知识产权。
前面对可能导致实际事件与预期不同的重要因素的回顾不应被解释为详尽无遗。我们敦促读者仔细审查和考虑我们在本演示文稿
和向美国证券交易委员会提交的报告中所做的各种披露,这些报告向利益相关方提供了可能影响我们业务的风险和因素的建议。本演示文稿中包含的所有前瞻性陈述仅代表其发表之日。
Ocuphire 没有义务更新此类陈述以反映声明发表之日后发生的事件或存在的情况。2 披露和前瞻性陈述

有望改变糖尿病视网膜病变的治疗方法3 NPDR市场
根据2023年89亿美元的总DR市场规模以及2023年NPDR收入份额70.38%计算得出。AMD,年龄相关性黄斑变性;DR,糖尿病视网膜病变;DRSS,糖尿病视网膜病变严重程度量表;FDA,食品药品
管理局;GA,地理萎缩;NPDR,非增殖性糖尿病视网膜病变;PDR,增殖性糖尿病视网膜病变;SPA,特别协议评估。Vabysmo® 是基因泰克公司的商标;Syfovre® 是阿佩利斯制药公司的注册商标
;Meibo 是 Bausch + Lomb Incorporated 或其附属公司的商标;Oxervate® 是 Dompe Farmaceutici S.p.A. 的注册商标;RYZUMVI 是 Ocuphire Pharmaceutici, Inc. 的商标;Xiive dra® 是 Bausch + Lomb Incorporated 或其附属公司的注册
商标;Eysuvis® 和 Inveltys 是爱尔康公司的注册商标 1。Flaxel CJ 等人。糖尿病视网膜病变首选练习模式®。眼科学. 2020; 127:66-145. 2.
糖尿病视网膜病变的患病率。疾病控制与预防中心。已于 2023 年 12 月 21 日访问。https://www.cdc.gov/visionhealth/vehss/estimates/dr-prevalence.html 3.存档的DR数据是工作年龄成年人失明的主要原因,
影响着美国的1000万名患者1,2 大多数患者患有早期疾病(非增殖性糖尿病视网膜病变),这种疾病通常未经治疗,市场规模为60亿美元3 糖尿病视网膜病变市场庞大且服务不足。当前
疗法是侵入性的,通常仅限于晚期 DR,并且不涉及多种疾病途径 APX3330 可能是一种很有前途的口服选择,可通过抑制 Ref-1 来减缓 DR 进展,同时抑制血管新生,
氧化压力和炎症口服 APX3330 通过多种途径靶向早期的 DR 与安慰剂相比,经过 DR 恶化的受试者较少,表现出在 FDA 确认的 ≥ 3 步
DRSS 双目尺度下恶化的有效性与安慰剂相比,接受过增殖性糖尿病视网膜病变(晚期 DR)的受试者较少 APX3330 在减缓 DR 进展方面的疗效 2 期会议结束后 FDA
已提交主要终点 SPA 的校准,以确保研究设计和统计数据保持一致分析计划为即将到来的关键性2/3期研究做好准备超过60年的综合眼科经验高级管理层参与众多眼科产品的研发、开发和批准工作,包括Vabysmo®、Syfovre®、Miebo、Oxervate®、Ryzumvi、Xiidra®、Eysuvis® 和Inveltys® 等众多眼科产品的研发、开发和批准,Ryzumvi预计将与Viatris合作将启动2024年上半年以逆转
药理诱发的散大,并正在进行两项正在进行的、资助的针对弱光条件下视力下降和老花眼的3期研究提供潜在的双重视力数字版税和里程碑式付款久经考验的开发
团队创收合作伙伴关系
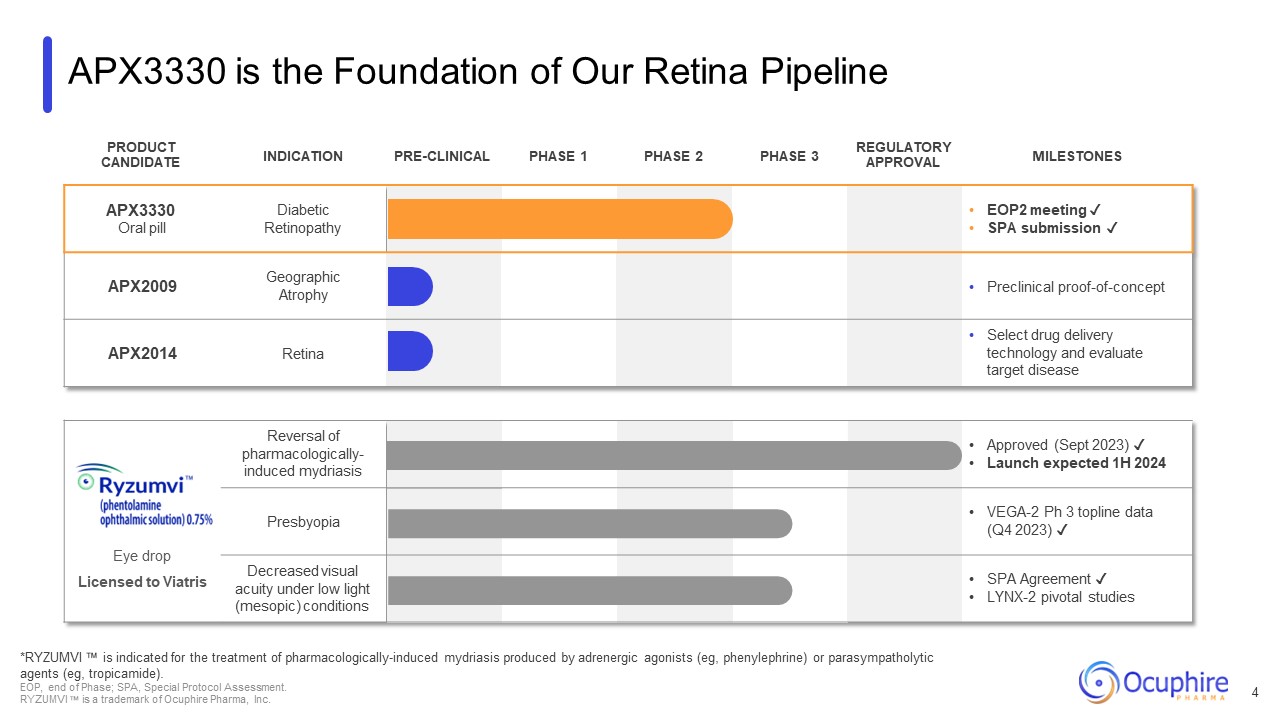
APX3330 是我们视网膜管道产品的基础
候选适应症临床前 1 期第 2 阶段 3 期监管批准里程碑 APX3330 口服药糖尿病视网膜病变 EOP2 会议 ✓ SPA 提交 ✓ APX2009 地理萎缩临床前
概念验证 APX2014 视网膜精选药物递送技术和评估目标疾病滴眼液获准逆转药理学诱发的散瞳获批(2023 年 9 月)✓ 预计上半年上市
2024 Presbyopia VEGA-2 Ph 3 顶线数据(2023 年第四季度)✓ 低水平下视力下降轻(中视)状况 SPA Agreement ✓ LYNX-2 关键研究 *RYZUMVI 适用于治疗肾上腺素能激动剂(例如去氧肾上腺素)或副交感神经分解剂(例如托匹卡胺)产生的药理诱发的散大
。EOP,阶段结束;SPA,特殊协议评估。RYZUMVI 是 Ocuphire Pharma, Inc. 的商标 4
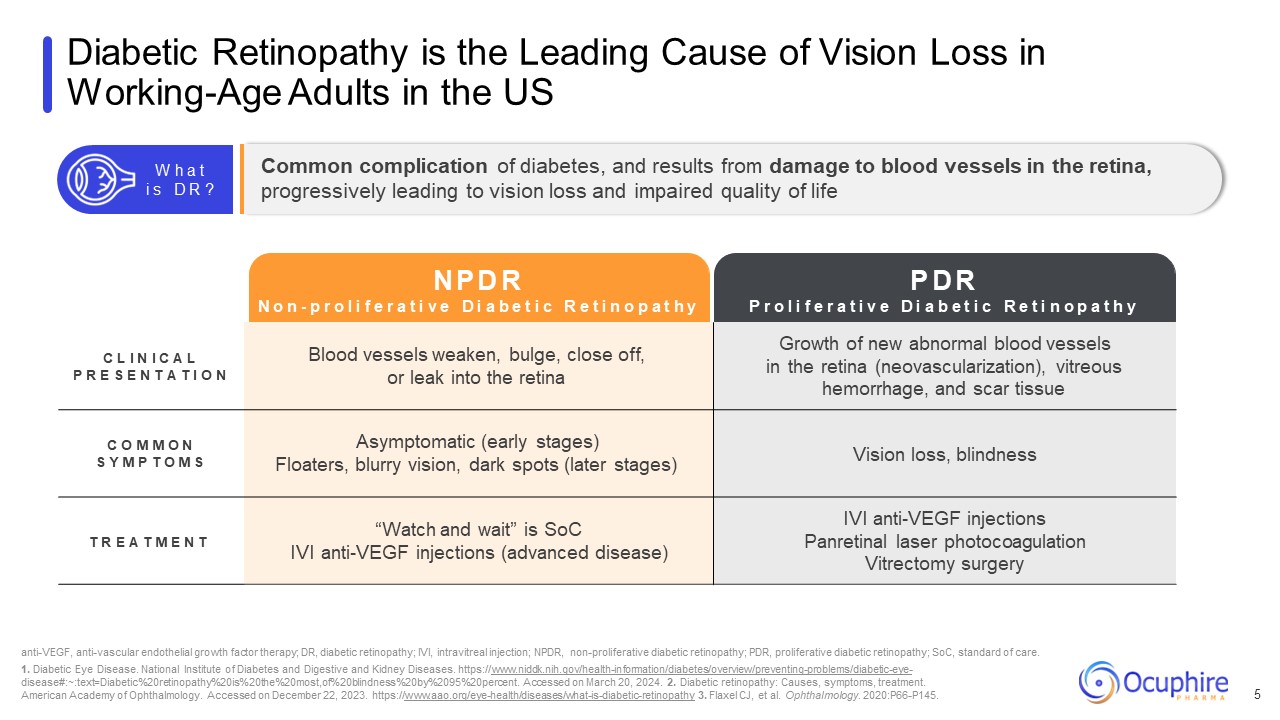
糖尿病视网膜病变是美国工作年龄成年人视力丧失的主要原因
5 C L L P R E S E N T A T I O N 血管变弱、膨胀、闭塞或渗入视网膜视网膜中新的异常血管的生长(新生血管)、玻璃体出血和疤痕组织 C O M O
N S Y M P T O M S 无症状(早期阶段)漂浮者、视力模糊、黑斑(晚期)视力丧失、失明 T R E A T M E N T “观察并等待” 是 SoC IVI 抗 VEGF 注射(晚期疾病)IVI 抗 VEGF 注射
Panretinal激光光凝玻璃体切除术抗血管内皮生长因子、抗血管内皮生长因子疗法;DR,糖尿病视网膜病变;IVI,玻璃体内注射;NPDR,非增殖性糖尿病视网膜病变;PDR,增殖性糖尿病
视网膜病变;SoC,护理标准。1.糖尿病眼病。美国国立糖尿病和消化与肾脏疾病研究所。https://www.niddk.nih.gov/health-information/diabetes/overview/preventing-problems/diabetic-eye-
disease#: ~: text=diabetic%20retinopaty%20is%20s%20most,%20blindness%20by% 20% 2095% 20%。已于 2024 年 3 月 20 日访问。2.糖尿病视网膜病变:原因,症状,治疗。美国眼科学会。已于 2023 年 12 月 22 日访问。
https://www.aao.org/eye-health/diseases/what-is-diabetic-retinopathy 3.Flaxel CJ 等人眼科。2020: P66-P145。糖尿病的常见并发症,由视网膜血管损伤引起,逐渐导致视力
丧失和生活质量受损 W h a t i s D R?N P D R N o n o n o n-p r o l i f e r a t i v e d i a b e t i c r e t i c r e t i n o p p a t h y p r o l i f e r o l i f e v e p e e p d D D D i a b e i c r e t i a b e t i a b e t i c r e t i p o l i f e e v e p e d d d i a b e t i c r e n o p a t h y p o l i v e e v e p e d d d i a b e t i c r e

DR 进展可能对功能性视力产生重大影响注:
视力丧失的严重程度因患者 DR(糖尿病视网膜病变)、NPDR(非增殖性糖尿病视网膜病变)、PDR(增殖性糖尿病视网膜病变)的患者而异。1. [未列出作者]。ETDRS 报告编号为 12。眼科。
1991; 98:823-833. 2.糖尿病眼病。国立糖尿病和消化与肾脏疾病研究所。https://www.niddk.nih.gov/health-information/diabetes/overview/preventing-
问题/糖尿病眼病 #: ~: text=diabetic%20Retinopaty%20is%20is%20the%20most,%20blindness%20by% 2095% 20%。于 2024 年 3 月 5 日访问。N P D R P D R M i n i i n i m a l v i s u a l d i s r u p p t i o n S i g n i f i c a n t v i s i o
n l o s s ~ 50% 的重度 NPDR 患者将在 1 年内发展为 PDR 1 及早治疗糖尿病视网膜病变可以将失明风险降低 95% 2 6
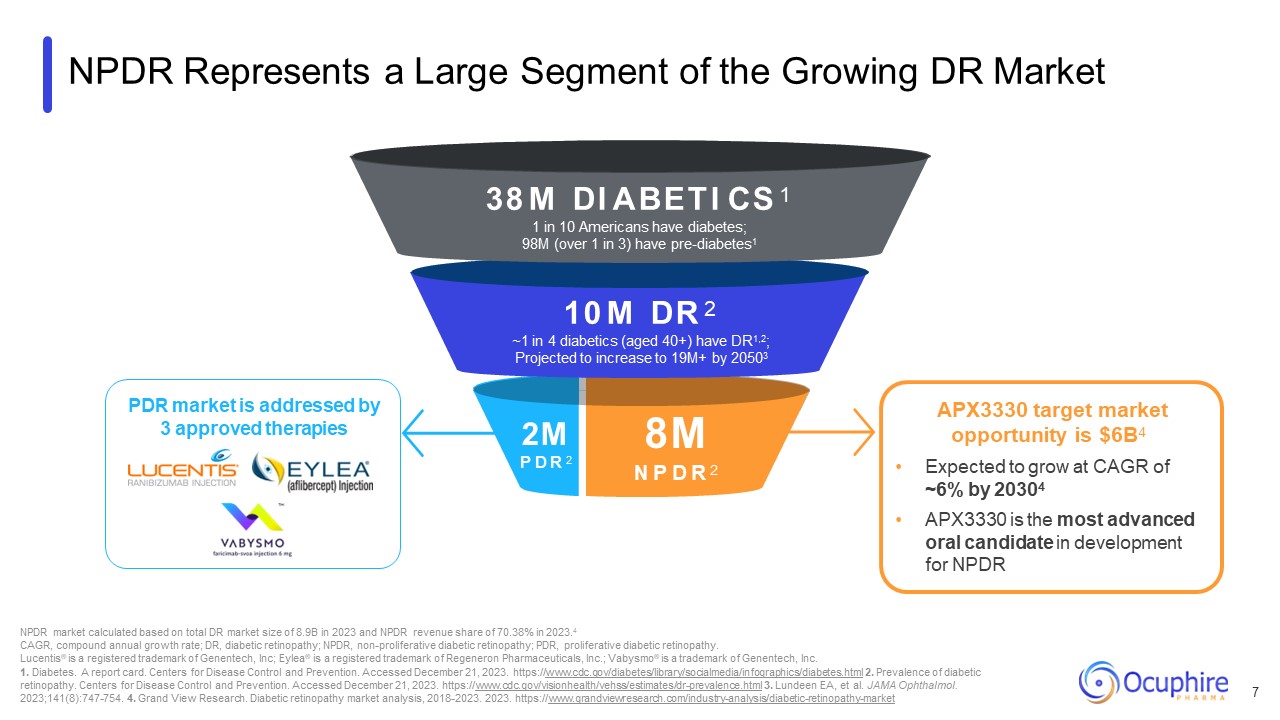
NPDR 代表了不断增长的 DR 市场的很大一部分 2M P D R 2 38 M DI
ABETI CS 十分之一的美国人患有糖尿病;9800万(超过三分之一)患有糖尿病前期1 1000万DR 2~4名糖尿病患者(40岁以上)有DR1,2;预计到20503年,将增加到1900万+ 800万NP D R 2 NPDR市场根据总DR市场计算
2023年规模为89亿美元,2023年NPDR收入份额为70.38%,复合年增长率;DR,糖尿病视网膜病变;NPDR,非增殖性糖尿病视网膜病变;PDR,增殖性糖尿病视网膜病变。Lucentis® 是 Genentech, Inc. 的注册
商标;Eylea® 是 Regeneron Pharmicals, Inc. 的注册商标;Vabysmo® 是基因泰克公司的商标 1.糖尿病。成绩单。疾病控制与预防中心。已于 2023 年 12 月 21 日访问。
https://www.cdc.gov/diabetes/library/socialmedia/infographics/diabetes.html 2.糖尿病视网膜病变的患病率。疾病控制与预防中心。已于 2023 年 12 月 21 日访问。
https://www.cdc.gov/visionhealth/vehss/estimates/dr-prevalence.html 3.Lundeen EA 等JAMA Othalmol. 2023; 141 (8): 747-754. 4.大观研究。2018-2023年糖尿病视网膜病变市场分析。2023年。
https://www.grandviewresearch.com/industry-analysis/diabetic-retinopathy-market APX3330 的目标市场机会为60亿美元4美元预计到20304年将以约6%的复合年增长率增长 APX3330 是
正在开发的最先进的口服候选药物 NPDR 7 PDR 市场由三种批准的疗法所解决
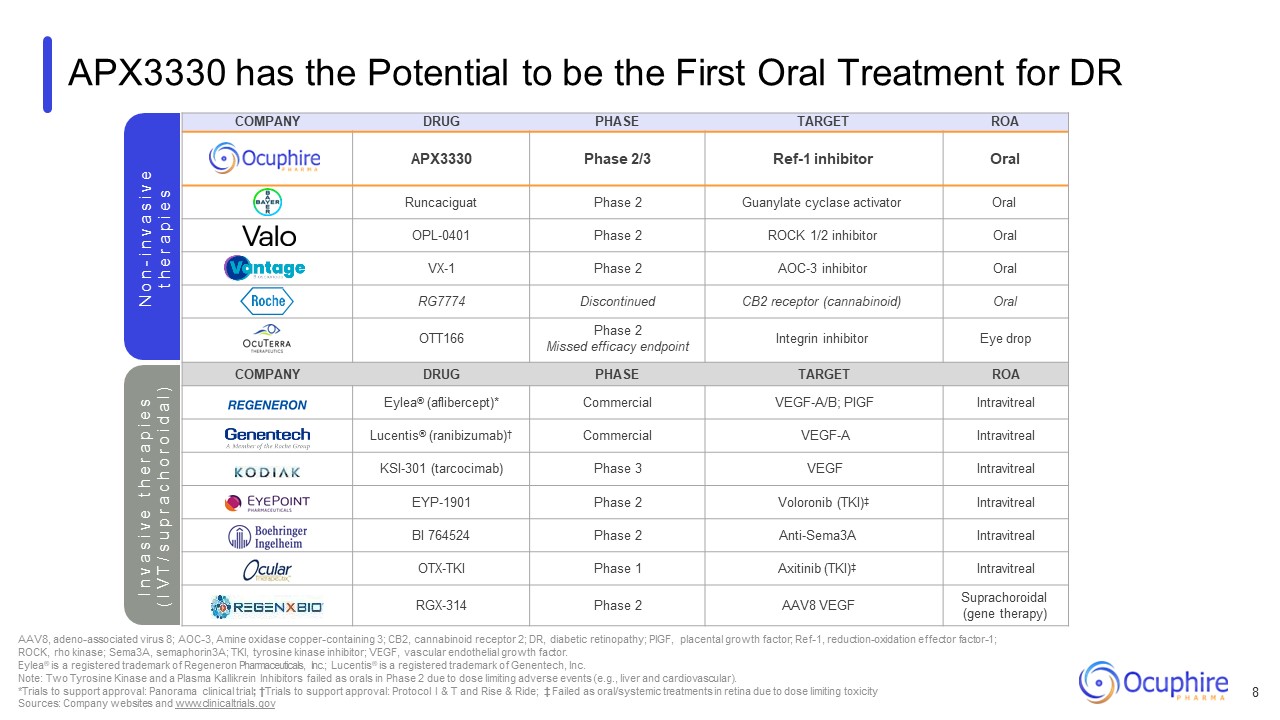
公司药物阶段目标 ROA APX3330 2/3 期 Ref-1 抑制剂口服 Runcaciguat 2 期鸟苷酸环化酶激活剂口服 OPL-0401 2 期 ROCK 1/2 抑制剂口服 VX-1 第 2 期 AOC-3 抑制剂口服 RG7774 停产的 CB2 受体(大麻素)口服 OTT166 2 期错过
疗效终点整合素抑制剂滴眼剂公司药物阶段目标 ROA Eylea®(aflibercept)* 商用 VEGF/A/cept B; PIGF 玻璃体注射 Lucentis®(雷尼珠单抗)† 商用 VEGF-A 玻璃体内 KSI-301(tarcocimab)期
3 VEGF 玻璃体内注射 EYP-1901 第 2 期 Voloronib (TKI) ‡ 玻璃体内 BI764524 2 期 Anti-Sema3A 玻璃体注射 OTX-TKI 1 期 Axitinib (TKI) ‡ 玻璃体注射 RGX-314 第 2 期 AAV8 VEGF Suprachoroidal(基因疗法)APX3330 有可能成为 DR N o n-i n v a s i v e t e t h e r a p i e s AAV8、腺相关病毒 8 的首种口服疗法;AOC-3,胺氧化酶含铜 3;CB2,大麻素受体 2;DR,糖尿病视网膜病变;PIGF,胎盘
生长因子;Ref-1,还原氧化效应因子-1;ROCK,rho 激酶;Sema3A,SemaForin3A;TKI,酪氨酸激酶抑制剂;VEGF,血管内皮生长因子。Eylea® 是 Regeneron Pharmicals,
Inc. 的注册商标;Lucentis® 是基因泰克公司的注册商标。注意:由于剂量限制的不良事件(例如肝脏和心血管),两种酪氨酸激酶和一种血浆激酶抑制剂在第二阶段口服失败。*支持
批准的试验:全景临床试验;†支持批准的试验:方案 I & T 和 Rise & Ride;‡ 由于剂量限制毒性,作为视网膜口服/全身治疗失败来源:公司网站和 www.clinicaltrials.gov I n v a
s i v e t h e r a p i e s (I V T/s u p r a c h o r o i d l) 8

APX3330 目前正在开发的最先进的糖尿病
视网膜病变口服项目
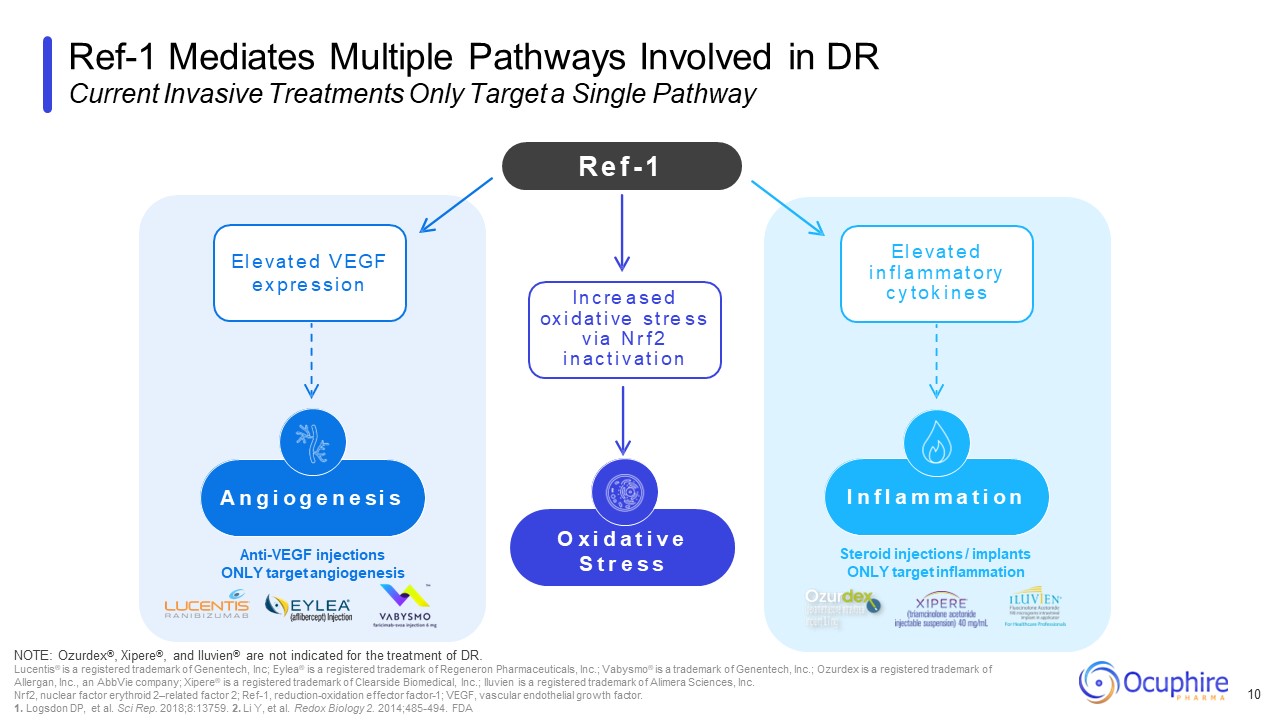
类固醇注射/植入物仅针对炎症抗血管内皮生长因子注射
仅靶向血管生成 Ref-1 介导 DR 当前侵入性治疗涉及的多种途径仅靶向单一途径 10 注意:Ozurdex®、Xipere® 和 Iluvien® 不适用于治疗博士 Lucentis® 是 Genentech, Inc. 的
注册商标;Eylea® 是 Regenere 的注册商标 Ozurdex 是艾伯维旗下公司 Allergan, Inc. 的注册商标;Vabysmo® 是 Genentech, Inc. 的注册商标;Xipere® 是
的注册商标Clearside Biomedical, Inc. 的商标;Iluvien 是 Alimera Sciences, Inc. 的注册商标。nrf2,核因子 erythroid 2 相关因子 2;Ref-1,还原氧化效应因子 1;VEGF,血管内皮
生长因子。1.Logsdon DP 等人Sci Rep.2018;8:13759. 2.Li Y 等氧化还原生物学 2. 2014;485-494。FDA R e f-1 O x i d a t i v e s t r e s s i n c re a s r e s i n c re a s a s r f 2 i i n a c t i v a t i v a t i v a t i o n E
l e v e v e d v e g e g e g e g e g e e g e g f e e g e g f e e g e g f e x p re s s s i s s i a n n g i o n a c t i v a t e d v e g e d v e g e g e e g f e e g e e g f e x p s 我 n f l a m m a t i o n e l e l e v a t e d i n f l a m m a t o ry c y t o ry c y t o k i n e s
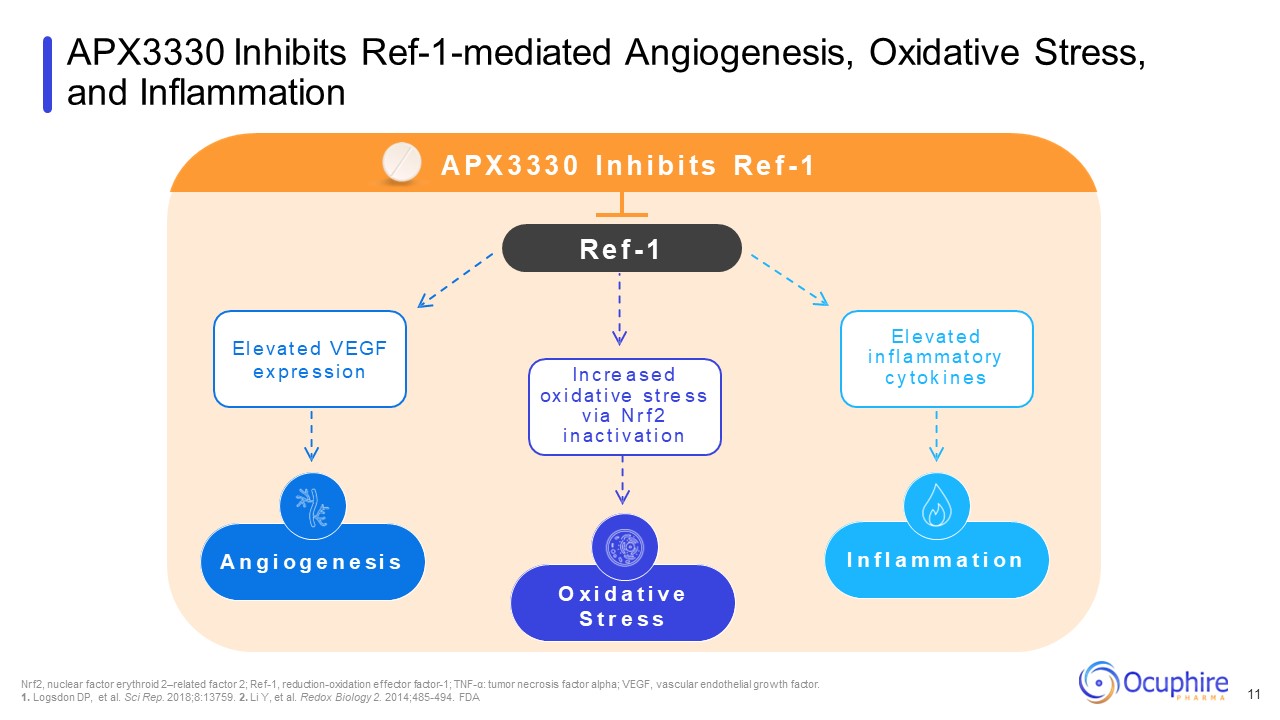
APX3330 抑制 REF-1 介导的血管新生、氧化应激和
炎症 Nrf2、核因子红体 2 相关因子 2;Ref-1,还原氧化效应因子 1;肿瘤坏死因子 α:肿瘤坏死因子 α;血管内皮生长因子。1.Logsdon DP 等Sci Rep.2018;8:13759. 2.Li
Y,等。氧化还原生物学 2. 2014;485-494。FDA O x i d a t i v e s t r e s s a n g i o g g i o g e s i s s i s i s i s i s i s i s i a p x 3 3 3 0 I n h h i b i t s r e f -1 I n c re a s r e f -1 I n c re a s r e f -1 i n c re a s a s a s a s a s a s a s a s a s a s e d e x i ve a s a s a s r e f -1 I n c re a s a s a s a s e d d ox i ve s a s r f 2 i
n a c t i v a t i o n e l e v a t e d v e d v e d v e g f e x p re s s s i o n E l e l e v a t i o n e l e v a t i f l a m m m a t o ry c y t o k i n e s s s i o n e e s a t e d i f l a m m m a t o ry c y t o k i n e e s s s i o n e l e v a t t
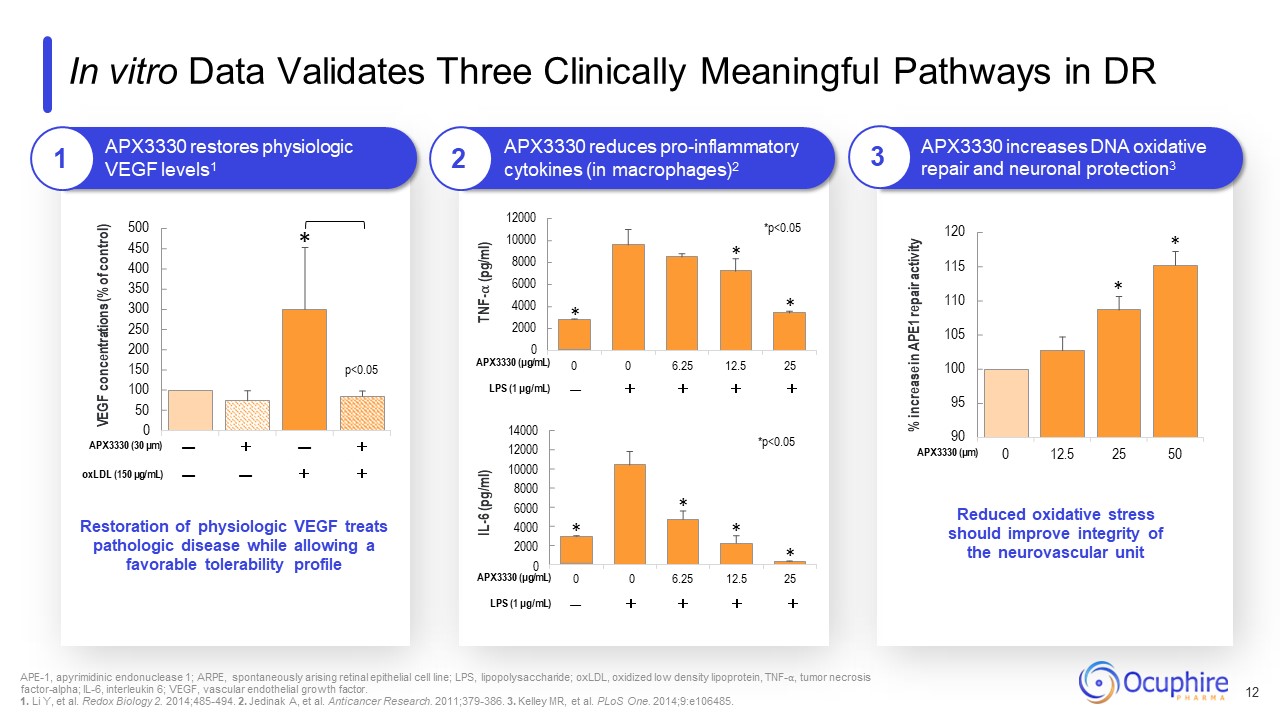
95 100 105 110 115 120 0 12.5 25 50 500 450 400 350 300 250 200 150 100 50 0 VEGF
浓度(控制百分比)* p

ZETA-1 临床试验 2 期随机、安慰剂对照、双面罩
研究已完成 APX3330
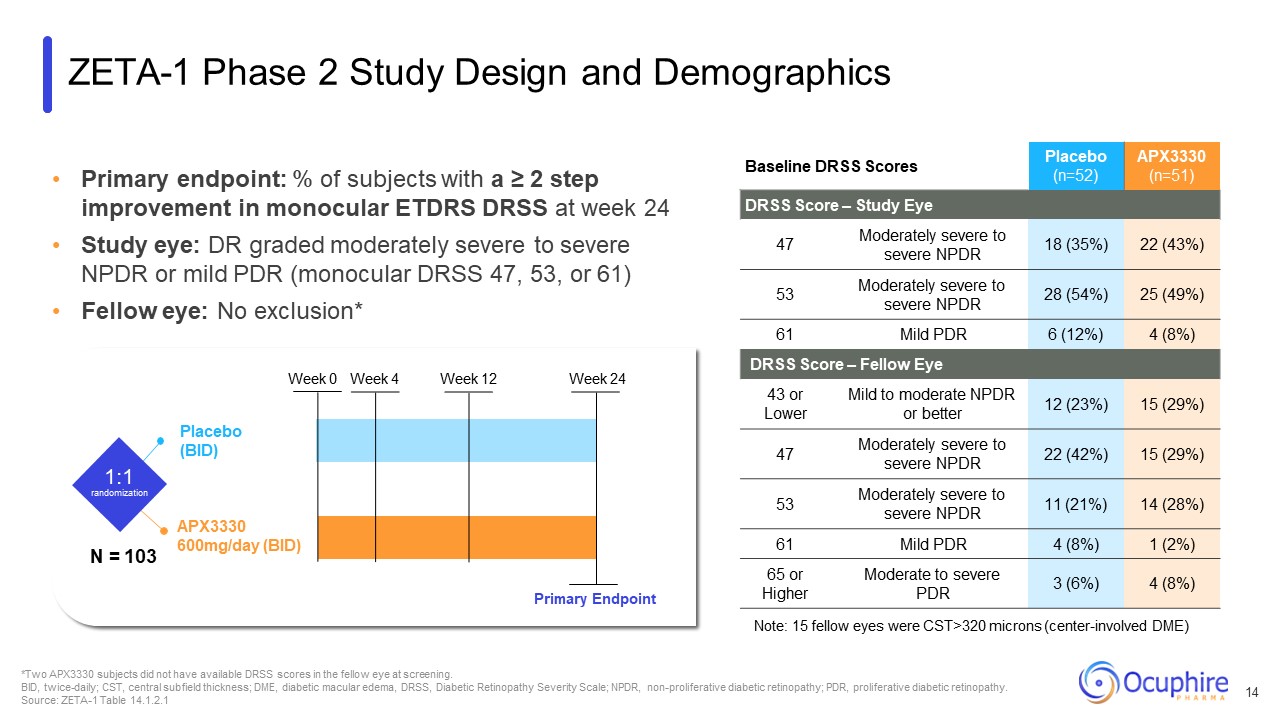
主要终点:第24周单眼 ETDRS
DRSS 改善≥ 2 步的受试者百分比研究眼睛:DR 评分为中度至重度 NPDR 或轻度 PDR(单眼 DRSS 47、53 或 61)同眼:无排除* 基线 DRSS 评分安慰剂(n=52)APX3330(n=51)DRSS 评分 — 研究眼睛 47 中度
重度到重度 NPDR 18 (35%) 22 (43%) 53 中度重度至重度 NPDR 28 (54%) 25 (49%) 61 轻度 PDR 6 (12%) 4 (8%) DRSS 分数 — 同伴眼 43 或以下轻度至中度 NPDR 或更低 12 (23%) 15 (29%) 47 中度
重度到重度 NPDR 22 (42%)15 (29%) 53 中度至重度 NPDR 11 (21%) 14 (28%) 61 轻度 PDR 4 (8%) 1 (2%) 65 或更高中度至重度 PDR 3 (6%) 4 (8%) 注意:15 只同眼 CST>320 微米
(中心受试者 DME)*两名 APX3330 受试者在筛查时对方眼睛没有可用的 DRSS 分数。BID,每日两次;CST,中心亚场厚度;DME,糖尿病黄斑水肿,DRSS,糖尿病视网膜病变严重程度量表;NPDR,
非增殖性糖尿病视网膜病变;PDR,增殖性糖尿病视网膜病变。来源:ZETA-1 表 14.1.2.1 APX3330 600mg/天(BID)安慰剂(BID)1:1 随机分配 0 周 4 周 12 周 24 周主要终点 ZETA-1 第 2 阶段研究设计和人口统计 N = 103 14
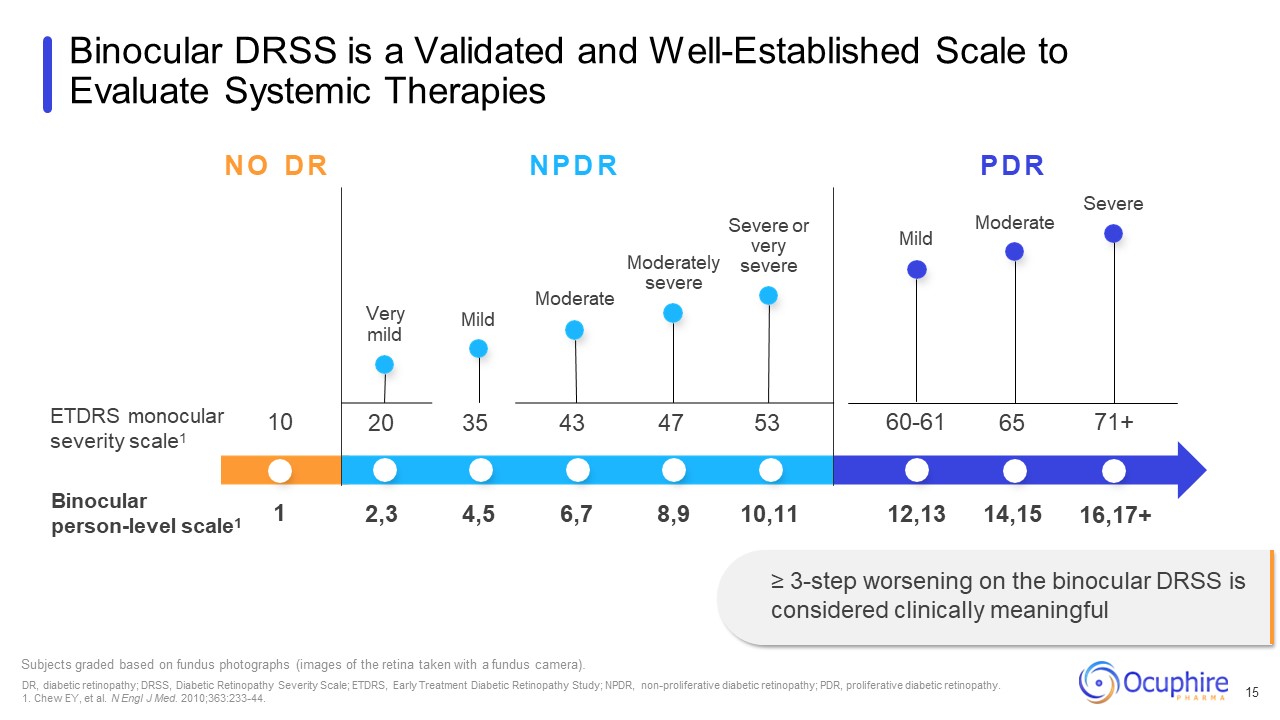
ETDRS 单眼严重程度量表1 双目人体水平量表1 中等
重度或非常严重的轻度受试者根据眼底照片(使用眼底摄像机拍摄的视网膜图像)进行分级。DR,糖尿病视网膜病变;DRSS,糖尿病视网膜病变严重程度量表;ETDRS,糖尿病早期治疗视网膜病变研究;NPDR,非增殖性糖尿病视网膜病变;PDR,增殖性糖尿病视网膜病变。1.Chew EY 等N Engl J Med. 2010;363:233-44。Binocular DRSS 是一款经过验证且成熟的评估全身
疗法的量表 15 中度 N O D R N P D R P D R 重度极轻度 10 20 35 47 53 60-61 61 65 71+ 1 2,3 4,5 6,7 8,9 10,11 14,15 16,17+ ≥ 3 步双眼 DRSS 恶化被认为具有临床意义
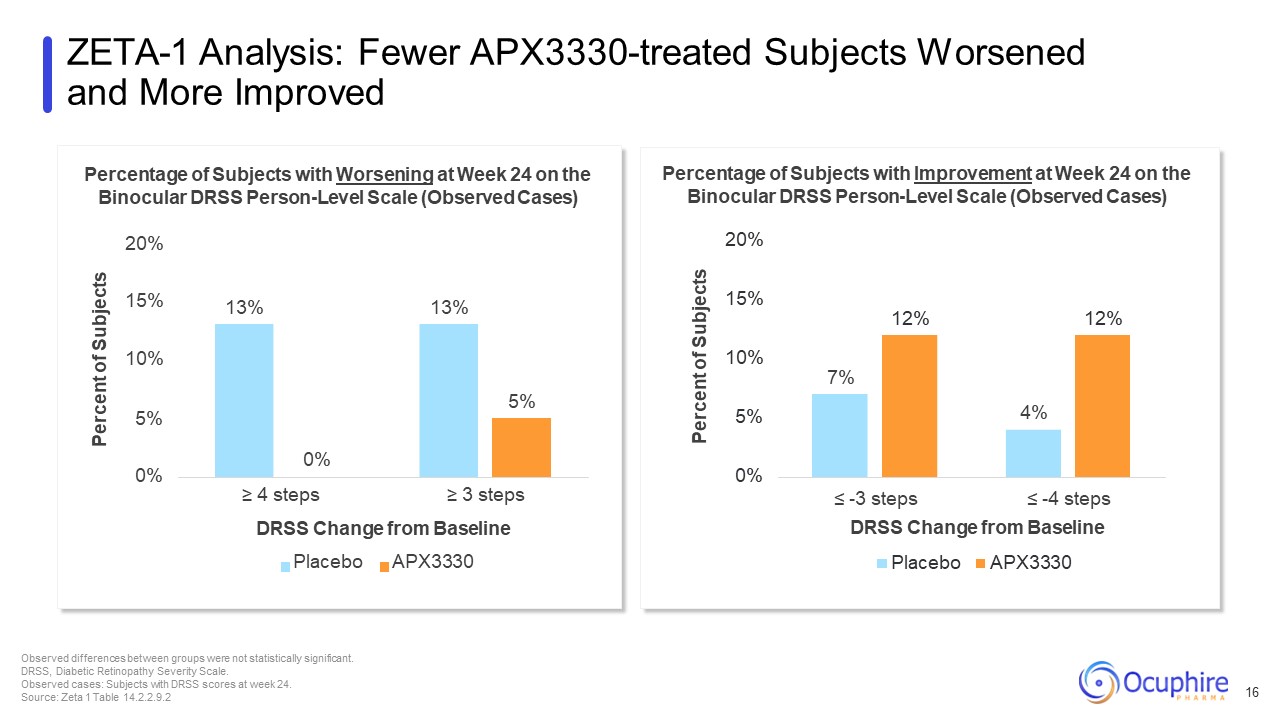
7% 4% 12% 12% 0% 5% 10% 15% 受试者百分比 ≤ -4 步 DRSS 与基线安慰剂的变化 APX3330 双眼 DRSS 人员水平量表上第 24 周改善的受试者的百分比(观察到的病例)20% 13% 5% 0% 10% 5% 15% 受试者百分比 0% ≥ 4 步 ≥ 3 步
DRSS 与基线安慰剂的变化 APX3330 双眼 DRSS 在第 24 周出现恶化的受试者的百分比 SS 人员水平量表(观察到的病例)20% ZETA-1 分析:接受过 APX3330 治疗的受试者更少恶化且更好观察到的组间差异更大
的差异是不具有统计学意义。DRSS,糖尿病视网膜病变严重程度量表。观察到的病例:第 24 周有 DRSS 分数的受试者。来源:Zeta 1 表 14.2.2.9.2 16
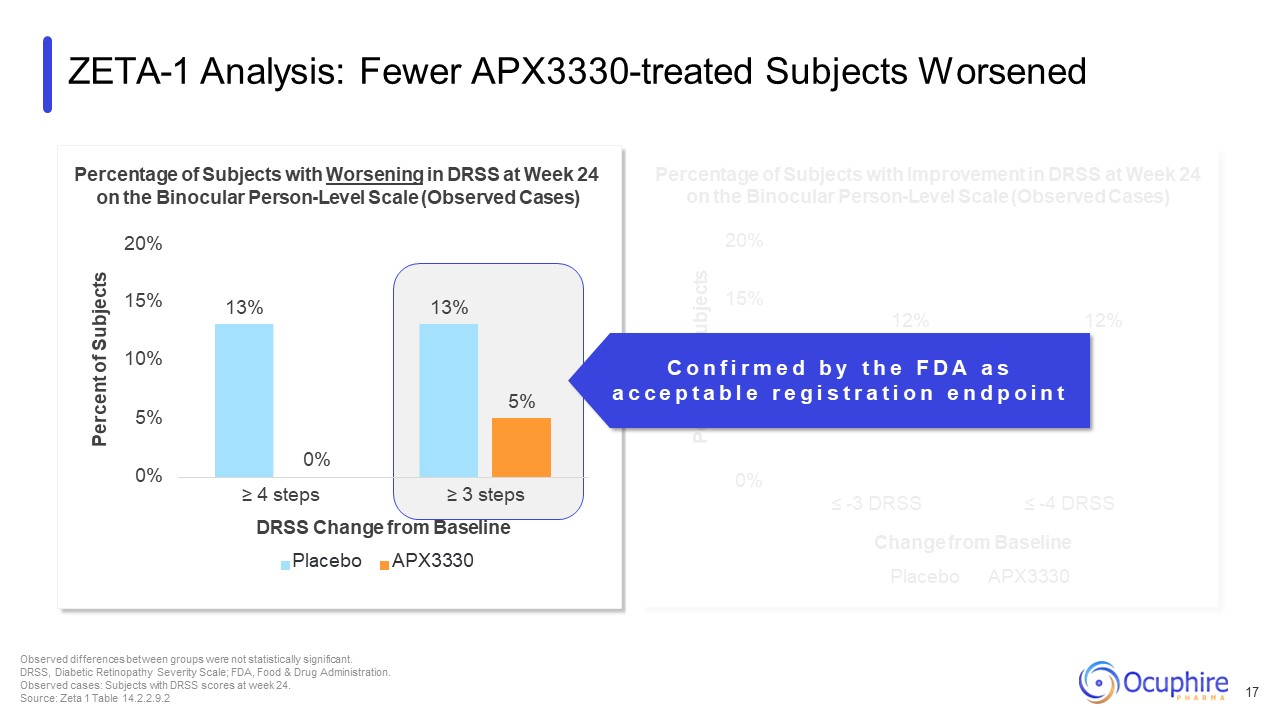
20% 15% 12% 12% 10% 7% 4% 0% ≤ -3 DRSS ≤ -4 DRSS
受试者百分比双目人物水平量表上第24周DRSS改善的受试者的百分比(观察到的病例)与基线安慰剂 APX3330 ZETA-1 的变化分析:较少接受APX3330治疗的受试者恶化 17 组之间观察到的
差异不具有统计学意义。DRSS,糖尿病视网膜病变严重程度量表;FDA,食品药品监督管理局。观察到的病例:第 24 周有 DRSS 分数的受试者。来源:Zeta 1 表
14.2.2.9.2 13% 13% 5% 0% 5% 10% 15% 15% 双目人群水平量表上第 24 周 DRSS 恶化的受试者百分比(观察病例)20% 受试者百分比 0% ≥ 4 步 ≥ 3 步 DRSS 与基线安慰剂的变化
APX3330 C o n f i r m e d b y t h e F D A s a c c e p t a b l e r e g i s t r a t i o n e n e n d p o i s t r a t i n t
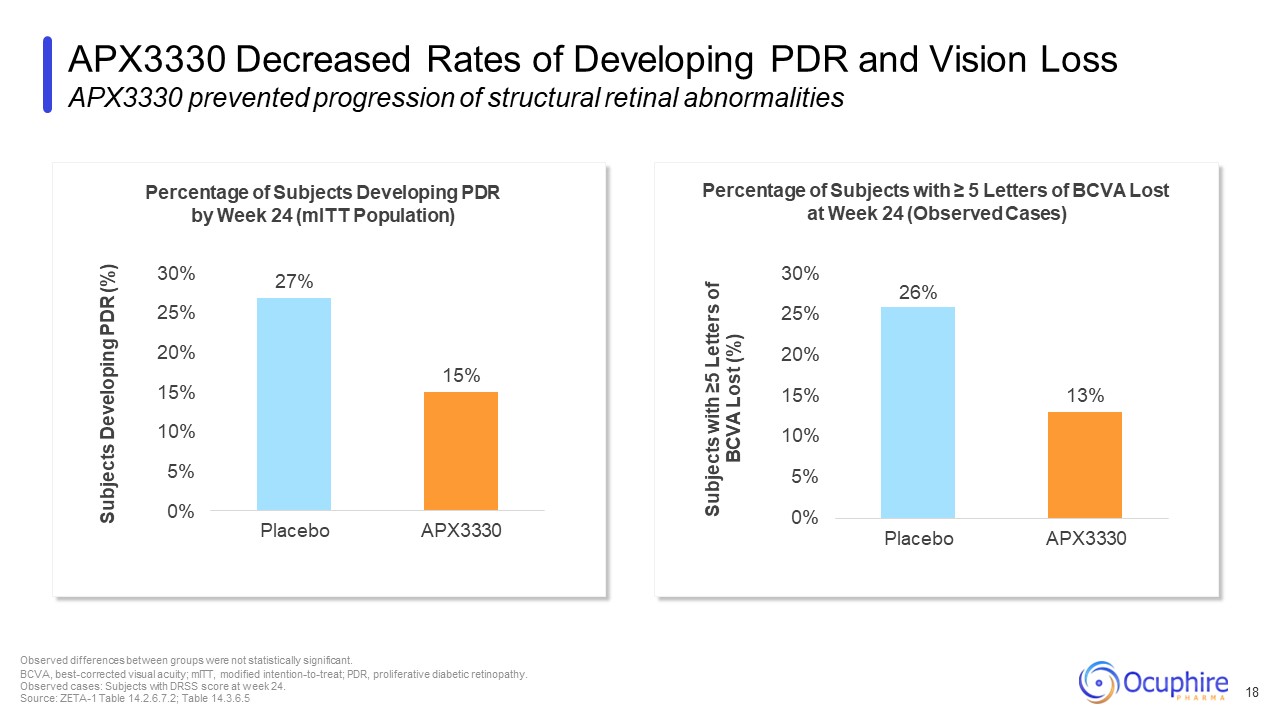
第 24 周出现 PDR 的受试者百分比(MitT 人群)第 24 周遗失 ≥ 5 个字母 BCVA 的受试者百分比
(观察到的病例)26% APX3330 降低 PDR 和视力丧失率 APX3330 防止了结构性视网膜异常的进展观察到的组间差异不具有统计学意义
没有统计学意义。BCVA,最佳矫正视力;MitT,改良的意向治疗;PDR,增殖性糖尿病视网膜病变。观察到的病例:第 24 周有 DRSS 评分的受试者。来源:ZETA-1 表 14.2.6.7.2;表
14.3.6.5 18 27% 15% 15% 15% 10% 0% 30% 安慰剂 APX3330 受试者正在发展 PDR (%) 13% 10% 5% 0% 25% 20% 15% 30% 安慰剂 APX3330 有 ≥ 5 个字母 BCVA 的受试者 (%)

APX3330 表现出良好的安全性和耐受性,与
先前研究的总抗体安慰剂 (n=52) APX3330 (n=51) 120 91 总治疗相关 AE 14 14 名治疗相关 AE 10 (20%) 10 (19%) 的受试者因治疗相关 AEs 1 (2%) 1 (2%) AE 在超过 5% 的
受试者中因治疗相关不良反应而退出 1 (2%) 1 (2%) AE 所有与 AEs 治疗相关 AEs 安慰剂 (n=52) APX3330 (nnn) 51) 安慰剂 (n=52) APX3330 (N=51) Ocular aEs DME 5 (10%) 2 (4%) (1%) 0 DR 6 (12%) 1 (2%) 1 (2%) 0 (2%) 0 玻璃体脱离 3 (6%) 0 0 白内障 1 (2%) 3 (6%) 0 非眼部 AES 瘙痒(瘙痒)(1) (1) (1) (1%) 02%) 6 (12%) 1 (2%) 3 (6%) 皮疹 1 (2%) 3 (6%) 1 (2%) 2 (4%) COVID-19 5 (10%) 1 (2%) 0 0 0 SARS CoV-2 检测阳性 3 (6%) 0 0 APX3330 安全概况 APX3330 和安慰剂之间类似
临床二甲状腺炎恶化的发生率较低 APX3330 瘙痒炎在没有 APX3330 剂量减少的情况下缓解或停药服用 DR 的受试者继续服用常规药物来控制合并症
AE,不良事件;DME,糖尿病黄斑水肿,DR,糖尿病视网膜病变。资料来源:ZETA-1 临床试验。表:14.3.1.1、14.3.1.7、14.3.1.10、16.2.7. 19

ZETA-2 临床试验 NPDR 中 APX3330 的 2/3 期随机、
安慰剂对照、双面罩研究正在计划中

优化 ZETA-2 以取得成功 D u r a t i o n 24 周(6 个月)48 周
(12 个月)E l i g i b i l i t y y Study 眼睛(1 只眼睛)双眼(2 只眼睛)S a m p l e s i z e n=103 P r i m a r y e n d p o i n t ≥ 2 步 DRSS 改善 ≥ 3 步 DRSS 在双目人物水平
量表上恶化 B a s e l i n e d R S s s c o r e 47、53、61 在研究眼中;同伴眼睛一只眼睛没有排斥 47 或 53;研究眼睛中的同伴 43、47、53 K e y e x l u s i o n n DME PDR 或两只眼中的 DME P h a s e 2 Z E TA-1 P h a s e
2/3 Z E TA-2 DME,糖尿病性黄斑水肿;DRSS,糖尿病视网膜病变严重程度量表;PDR,增殖性糖尿病视网膜病变。21
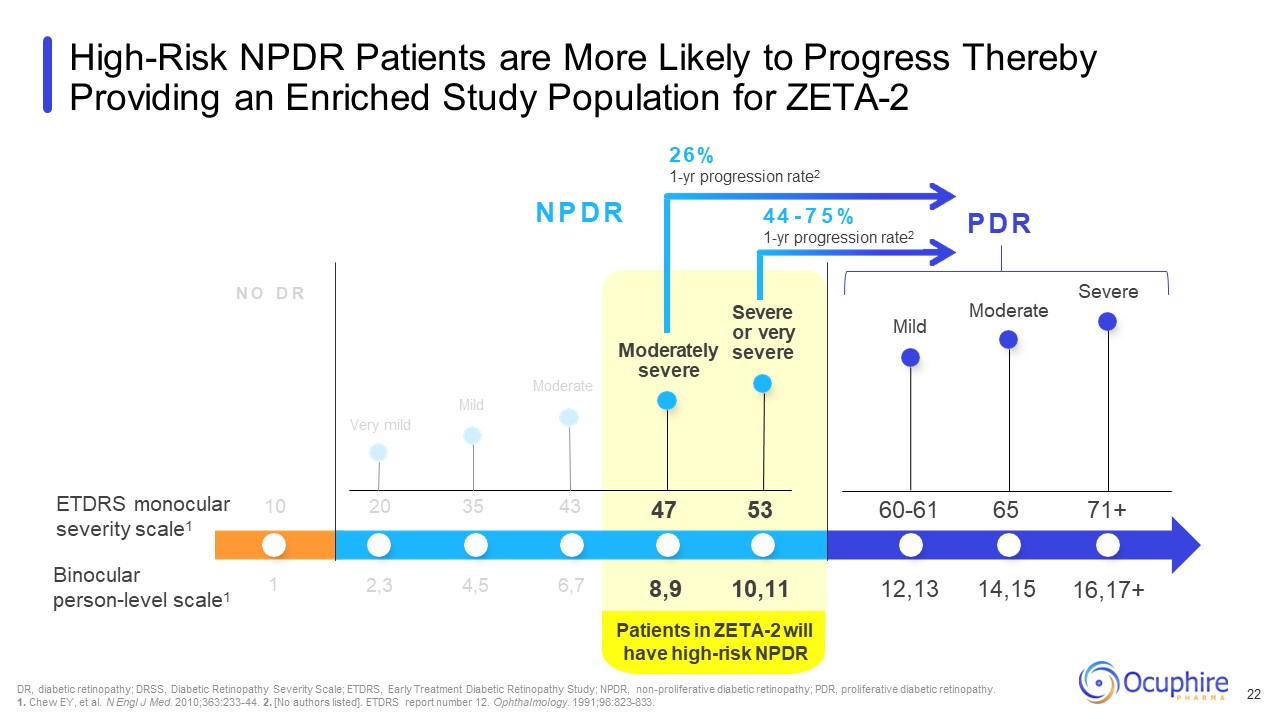
ZETA-2 患者将有高风险 NPDR N O D R N P D R P D R ETDRS
单眼严重程度表1 双眼人体水平量表1 极轻度中度轻度重度或非常严重轻度 DR,糖尿病视网膜病变;DRSS,糖尿病视网膜病变严重程度量表;ETDRS,早期治疗糖尿病
视网膜病变研究;NPDR,非增殖性糖尿病视网膜病变;PDR,增殖性糖尿病视网膜病变。1.Chew EY 等N Engl J Med. 2010; 363:233-44. 2. [未列出作者]。ETDRS 报告编号为 12。眼科。
1991; 98:823-833。高危的 NPDR 患者更有可能取得进展,从而为 ZETA-2 10 20 35 43 中度重度 2,3 4,5 6,7 47 53 60-61 65 71+ 8,9 10,11 12,13 14,15 16,17+ 1 26%
1 年进展率2 44-7 5% 1 年进展率2 22
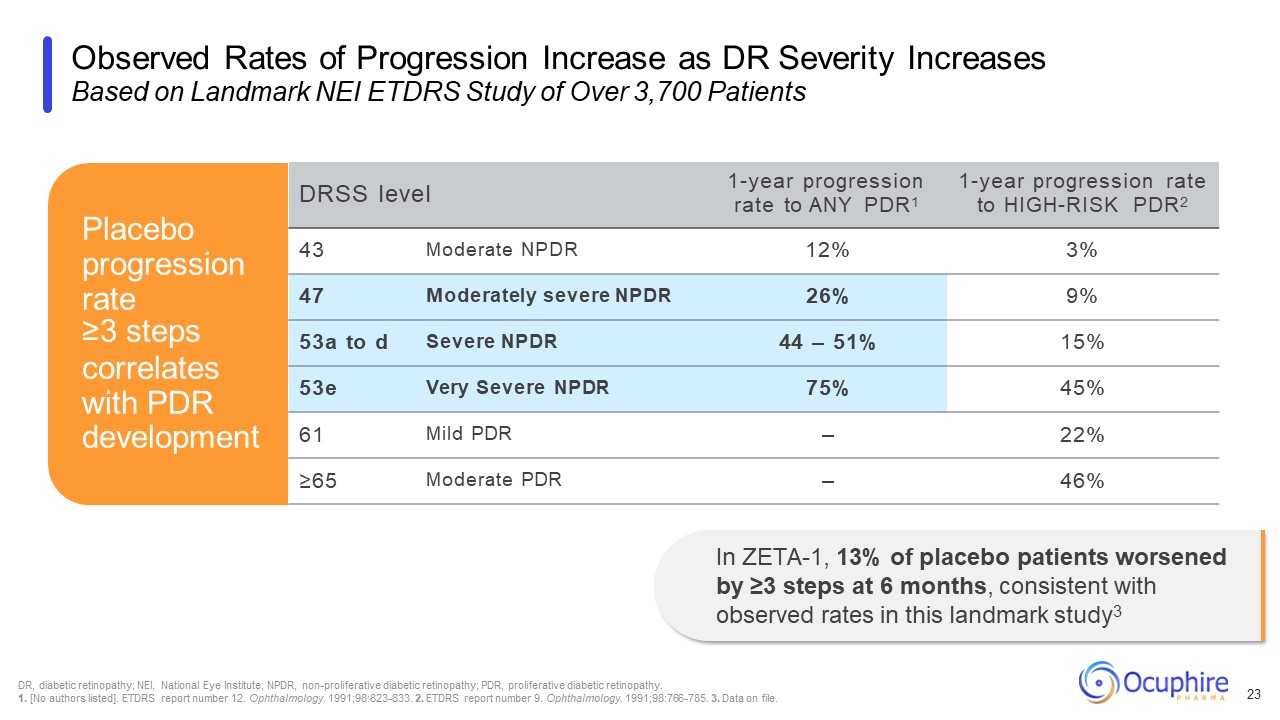
根据
Landmark NEI ETDRS 对 3,700 多名患者的研究,观察到的进展率随着 DRS 严重程度的增加而增加 23 DRSS 1 年进展率任何 PDR1 1 年进展率为高风险 PDR2 43 中度 12% 3% 47 中度重度 NPDR 26% 9% 9% 53a 至 d 重度 NPDR 44 —
51% 15% 53e 非常严重 NPDR 75% 45% 61 轻度 PDR — 222%% ≥65 中度 PDR — 46% 安慰剂进展率 ≥3 步与 PDR 发展相关在 ZETA-1 中,13% 的安慰剂患者在 6 个月时恶化 ≥3 步,
与该里程碑观察到的进展率一致study3 DR,糖尿病视网膜病变;NEI,国家眼科研究所;NPDR,非增殖性糖尿病视网膜病变;PDR,增殖性糖尿病视网膜病变。1. [未列出作者]。ETDRS 报告编号为 12。
眼科。1991 年;98:823-833。2.ETDRS 报告编号 9。眼科。1991;98:766-785。3.存档的数据。
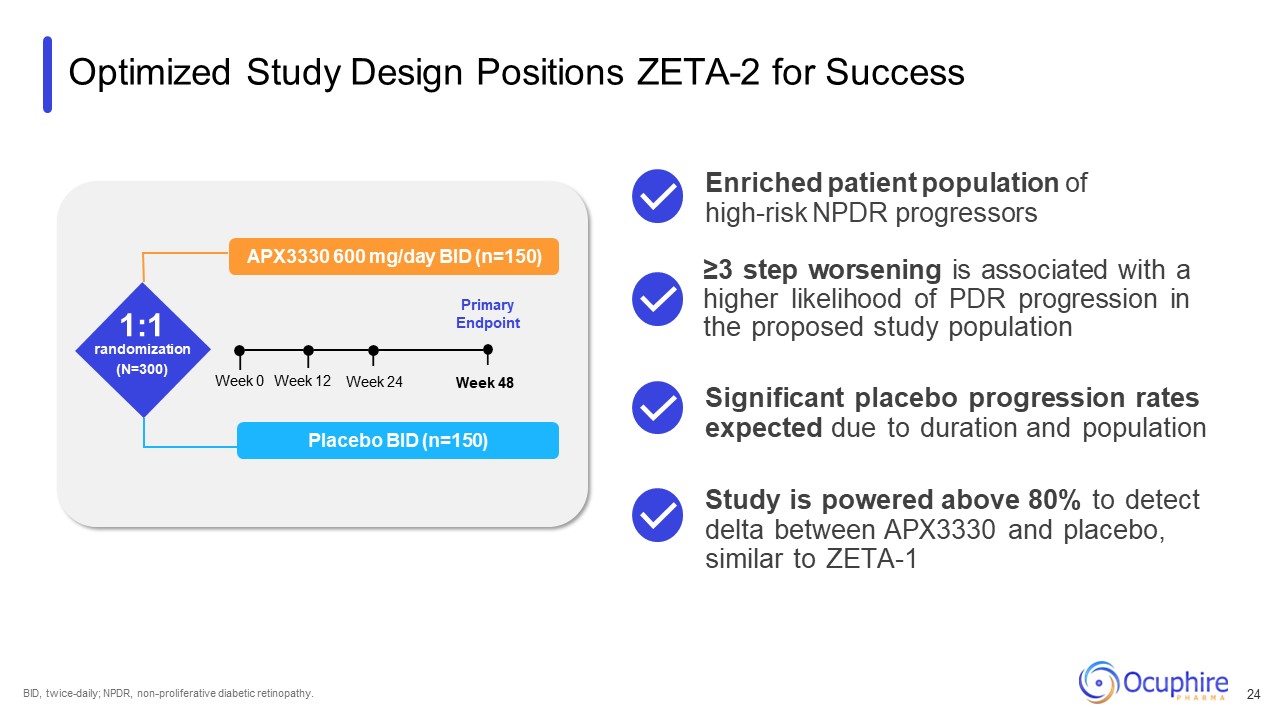
优化的研究设计定位 ZETA-2 取得成功 APX3330 600 mg/天 BID
(n=150) 1:1 随机分配 (N=300) 主要终点安慰剂 BID (n=150) 周 0 周 24 周 48 周 BID,每日两次;NPDR,非增殖性糖尿病视网膜病变。≥3 步恶化与拟议研究人群中 PDR
进展的可能性增加显著安慰剂进展有关根据持续时间和人群高风险 NPDR 进展患者群体的预期发病率研究发现 APX3330 和安慰剂之间的差异,可在 80% 以上,类似于 ZETA-1 24

波士顿眼科顾问医学博士杰夫·海尔:“如果在第 3 阶段重复 ZETA-1 结果,我几乎会让所有糖尿病患者口服 APX3330,只在需要时进行局部治疗。”“Ref-1 生物学针对糖尿病眼病的三大支柱:血管新生、炎症和氧化应激。在寻求为患者提供非侵入性的早期选择方面,这个
很有希望。”克利夫兰诊所医学博士彼得·凯泽 “我喜欢与团队合作制定创新的方案设计,以招收最有可能患有
进行性疾病的患者,同时保持研究的实用性,以帮助入组。”医学博士 Arshad Khanani Sierra Eye Associates 全球认可的视网膜专家支持 APX3330 开发 25

与 Viatris Ryzumvi(酚妥洛明眼用溶液)的合作
0.75% RYZUMVI 是 Ocuphire Pharma, Inc. 的商标。

Ryzumvi 与 Viatris 的全球合作伙伴关系 Ryzumvi 获准逆转药理学诱发的散大
,预计将于 2024 年上半年启动许可协议为另外 2 项适应症提供资金,Viatris 负责商业化两项正在进行的老花眼和 dim
轻度干扰三阶段研究根据许可协议获得了 3500 万美元的预付现金支付 1.2 亿美元的潜在监管和商业里程碑付款首个 1000 万美元里程碑获得 Ryzumvi 批准
分级特许权使用费的潜力合作伙伴用于全球商业化资金充足的开发;Viatris 负责商业化允许 Ocuphire 专注于 APX3330 和管道加强现金状况 RYZUMVI 是 Ocuphire Pharma 的商标,
Inc. 27

所有 3 种适应症都有相当大的潜在美国患者群体 *RYZUMVI
适用于治疗肾上腺素能激动剂(例如去氧肾上腺素)或副交感神经分解剂(例如托匹卡胺)产生的药理诱发的散大。RYZUMVI 是 Ocuphire Pharma, Inc. 的商标 1.Ryzumvi。处方
信息。Ocuphire Pharma, Inc.;2023. 2.Wilson FA 等J Othalmol. 2015; 2015:435606. 3.Berdahl J 等人临床眼科杂志,2020;14:3439-3450。4.林德斯特罗姆 RL.千禧一代将成为激光视力矫正的下一个目标。Ocular
手术新闻。2019 年 4 月 1 日。已于 2023 年 12 月 12 日访问。https://www.healio.com/news/ophthalmology/20190329/millennials-will-成为激光视觉校正的下一个目标 5.Mamalis N.J 白内障折光手术。2014;40:343-344。每年进行 100 万次眼睛
扩张2 Tr e a t m e n t o f p h a r m a o l o g i c o l o g i c a l l o g i c a l l l y-i n d u d d d r i a s s i s * 1 Tr e a t m e n t o f p r e s b y o p r e s b y o p r e s b y o p r e a l l o g i c a l l l l y y y d d r i a s s i s s i s * 1 Tr e a t m e n t o f f p r e s b y o p r e s a l l o g i c i a Tr e a t m e n t o f d e c r e a s e d v i s u a l a l a l a a l a a l a l l l o w l i g h t t c o n d i t o n d i t i o n d i t i o n d i t i o n s 133M presbyopes3 600-700K 激光视力矫正手术4 35% 的 LASIK 患者报告昏暗的光线障碍5

经验丰富的团队拥有丰富的专业知识超过 60 年久经考验的
临床、商业和交易经验参与众多眼科产品的研究、开发和批准:眼科专家 29 Ash Jayagopal,博士,工商管理硕士首席科学与开发官 Vabysmo® 是 Genentech, Inc. 的商标;Syfovre® 是 Apellis Pharmicals, Inc. 的注册商标;RYZUMVI 是 Ocuphire Pharma, Inc. 的商标;Eysuvis® 和 Inveltys 是爱尔康公司的注册商标;Meibo 是
Bausch + Lomb 的商标公司或其关联公司;Oxervate® 是 Dompé Farmaceutici S.p.A. 的注册商标;Xiidra® 是 Bausch + Lomb Incorporated 或其附属公司的注册商标;George Magrath,医学博士,工商管理硕士,工商管理硕士首席运营官
官尼拉夫·贾维里,工商管理硕士首席财务官约瑟夫·沙赫勒

博士,糖尿病视网膜病变;FDA,食品药品监督管理局。Ocuphire
有望改变糖尿病视网膜病变的治疗方法对广泛、服务不足的DR市场有广泛了解通过口服治疗靶向多种DR途径解决未满足的需求在已完成的2期研究中显示出减缓DR
进展的疗效已完成的2期研究为具有美国食品药品管理局确认终点的关键2/3期研究做好准备拥有数十年眼科专业知识的经过验证的开发团队创收伙伴关系可增强现金状况 30