
1 Avalo治疗公司(AVTX)Avalo收购抗IL-1β单抗并宣布2024年3月进行高达1.85亿美元的私人配售展览99.2

2本陈述可包括根据1995年《私人证券诉讼改革法》所作的前瞻性陈述。前瞻性陈述是指非历史事实的陈述。此类前瞻性陈述会受到重大风险和不确定性的影响,这些风险和不确定性可能会因各种因素而发生变化(其中许多因素不在Avalo的控制范围之内),这可能会导致实际结果与前瞻性陈述不同。此类陈述可包括但不限于,与Avalo的计划、目标、预测、期望和意图有关的陈述,以及由以下词语标识的其他陈述:“项目”、“可能”、“可能”、“将”、“应该”、“继续”、“寻求”、“目标”、“预测”、“相信”、“预期”、“预期”、“估计”、“打算”、“计划,“潜在的”或类似的表述(包括用在否定中),或通过对未来事项的讨论,例如:满足与私募有关的惯常成交条件;这些风险包括但不限于私募所得资金的预期用途;AVTX-009与我们业务的整合;药物开发成本、试验结果的公布时间以及其他风险,包括对研究人员的依赖和患者在临床试验中的招募;对关键人员的依赖;监管风险;总体经济和市场风险及不确定性,包括那些导致乌克兰和中东战争的风险;以及Avalo在提交给美国证券交易委员会的文件中详细描述的其他风险,这些文件可在www.sec.gov上查阅。实际结果可能与前瞻性陈述中陈述的结果不同。除适用法律另有要求外,Avalo明确表示不承担任何义务或承诺公开发布本文中包含的任何前瞻性陈述的任何更新或修订,以反映Avalo对此的预期的任何变化,或任何陈述所基于的事件、条件或情况的任何变化。前瞻性陈述
3支经验丰富的团队,在晚期免疫学开发方面有良好的业绩记录纳斯达克上市:AVTX私人公司主要由第二阶段就绪的抗IL-1β单抗和相关资产组成降低了MOA的风险目标适应症AlmataBio公司在治疗炎症的生物制药方面的领先企业,重点是AVTX-009(抗IL-1β单抗)紫癜性汗腺炎2026年上市结果:AVTX在收购AVTX-009的同时,Avalo宣布进行高达1.85亿美元的管道融资,提供进入2027年的现金跑道Avalo治疗公司和AlmataBio公司:一项适合推动长期增长的强大战略

4个化合物适应症PreClin P1 P2 P3预期里程碑AVTX-009抗IL-1β单抗化脓性汗腺炎(HS)P2 TOPLINE结果2026年自身免疫适应症待定下一代IL-1β(延长半衰期)--待定Quisvalimab AVTX-002,抗光单抗--战略审查AVTX-008BTLA激动剂融合蛋白--战略审查Avalo治疗流水线

5·在HS中实现最佳疾病特征的可能性-高效和有利的半衰期可能允许在其他自身免疫性疾病中改善疗效和方便的给药潜力·支持IL-1β在HS中的关键临床证据-在一项大型、控制良好的第二阶段试验(NCT05139602)中,lutikizumab在HS中验证了IL-1β靶向。尽管患者更严重,但疗效与其他HS疗法相当1-临床证据表明,抗IL-1α疗法在HS2中无效。3-MAS825(IL-1β/IL-18双特异性)在第二阶段随机对照研究(NCT03827798)中显示阳性结果(NCT03827798)4-单特异性IL-1β抑制作用可能优于针对未经验证的靶点(IL-18)或已知对疗效无贡献的双特异性药物(IL-1α)-我们认为AVTX-009在HS中成功的可能性很高·HS有望成为数十亿美元的市场·HS Topline结果预计将在2026年实现现金跑道进入2027年执行摘要和发展时间表1.金宝AB,等人的研究。介绍地点:美国皮肤病学会;2024年3月8日至12日;加利福尼亚州圣地亚哥。更新日期:2023年11月13日。访问时间为2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308 NCT04019041 3.临床试验.gov标识:NCT04019041.更新日期:2023年7月27日。访问时间为2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308://4.Kimball AB,et al.发表于:美国皮肤病学会;2024年3月8日至12日;加利福尼亚州圣地亚哥

在制药和生物技术领域拥有60年的成功领导、产品开发和商业化经验,医学博士首席执行官、董事会主席Garry A.Neil、项目管理、企业基础设施、临床运营Colleen Matkowski高级副总裁、全球监管事务、质量保证Dino C.Miano、博士高级副总裁、CMC、技术运营首席财务官Chris Sullivan经验丰富的管理团队
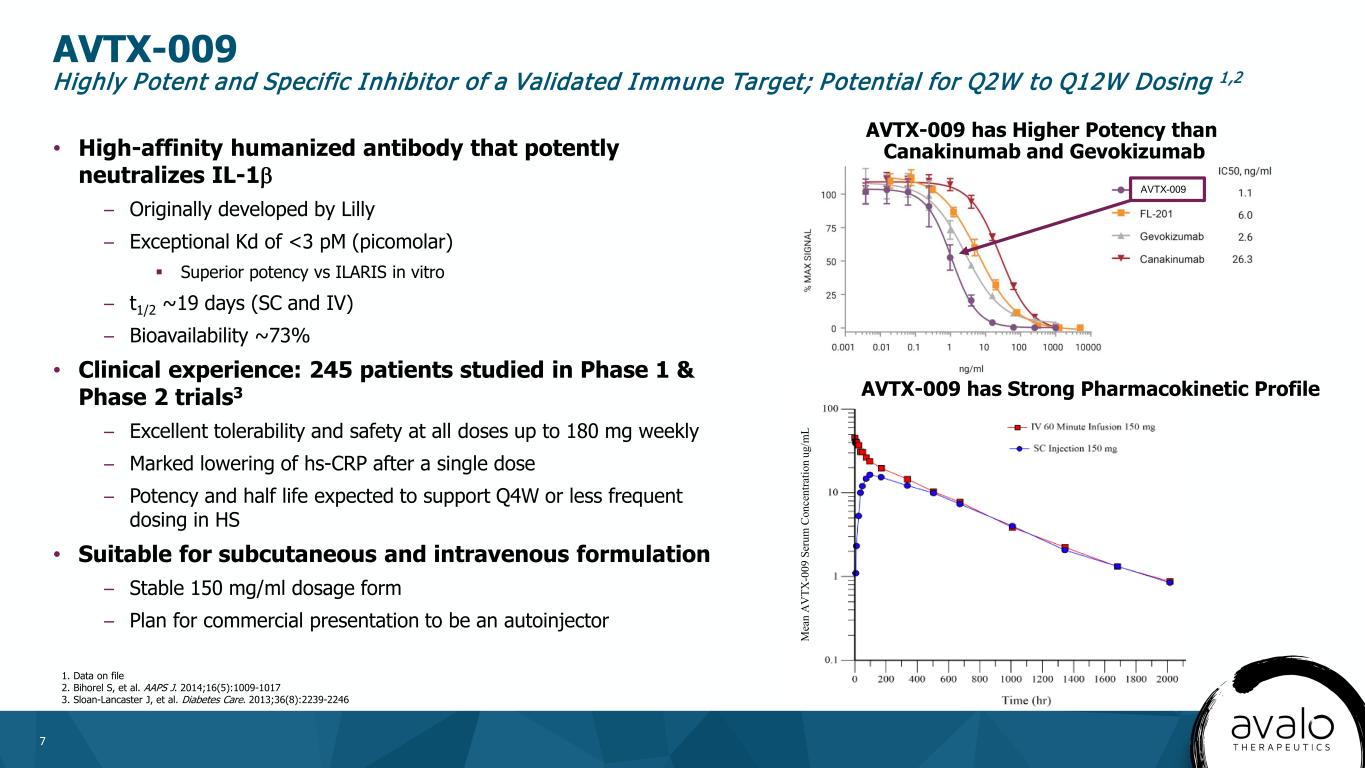
7·高亲和力人源化抗体,可有效中和IL-1β-最初由礼来公司开发-例外KD
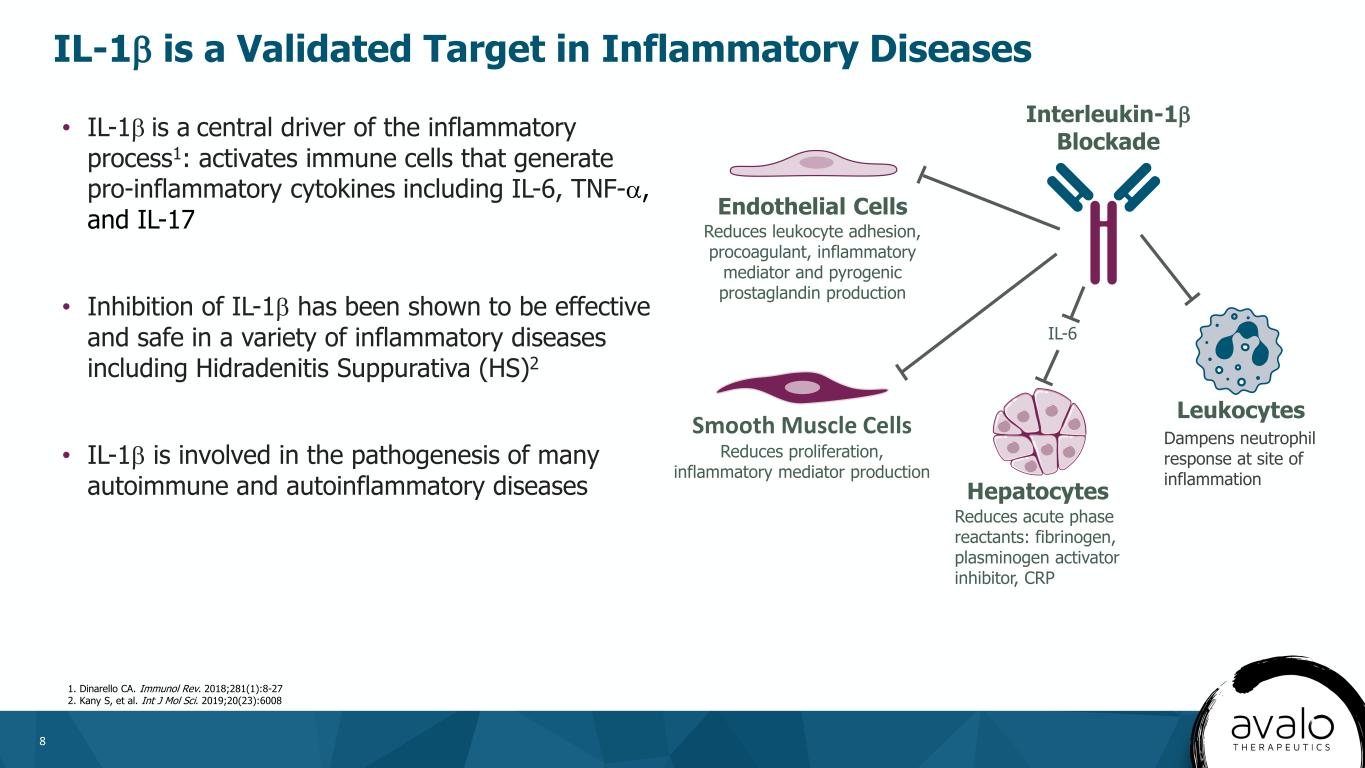
8·IL-1β是炎症过程的中心驱动力1:激活产生包括IL-6、肿瘤坏死因子-α和IL-17在内的致炎细胞因子的免疫细胞·抑制IL-1β已被证明在包括化脓性汗腺炎(HS)在内的多种炎症性疾病中有效和安全2·IL-1β参与许多自身免疫性和自身炎症性疾病的发病机制白介素1β阻断内皮细胞减少白细胞黏附、促凝剂、炎症介质和热原前列腺素产生平滑肌细胞减少增殖,炎症介质产生肝细胞减少急性期反应物:纤维蛋白原、纤溶酶原激活物抑制物、C反应蛋白、白细胞IL-1。《免疫杂志》2018年版;281(1):8-27。2.加尼·S等。INT J MOL Sci。2019;20(23):6008 IL-1β是炎症性疾病抑制炎症部位中性粒细胞反应的有效靶点

9化脓性汗腺炎(HS)
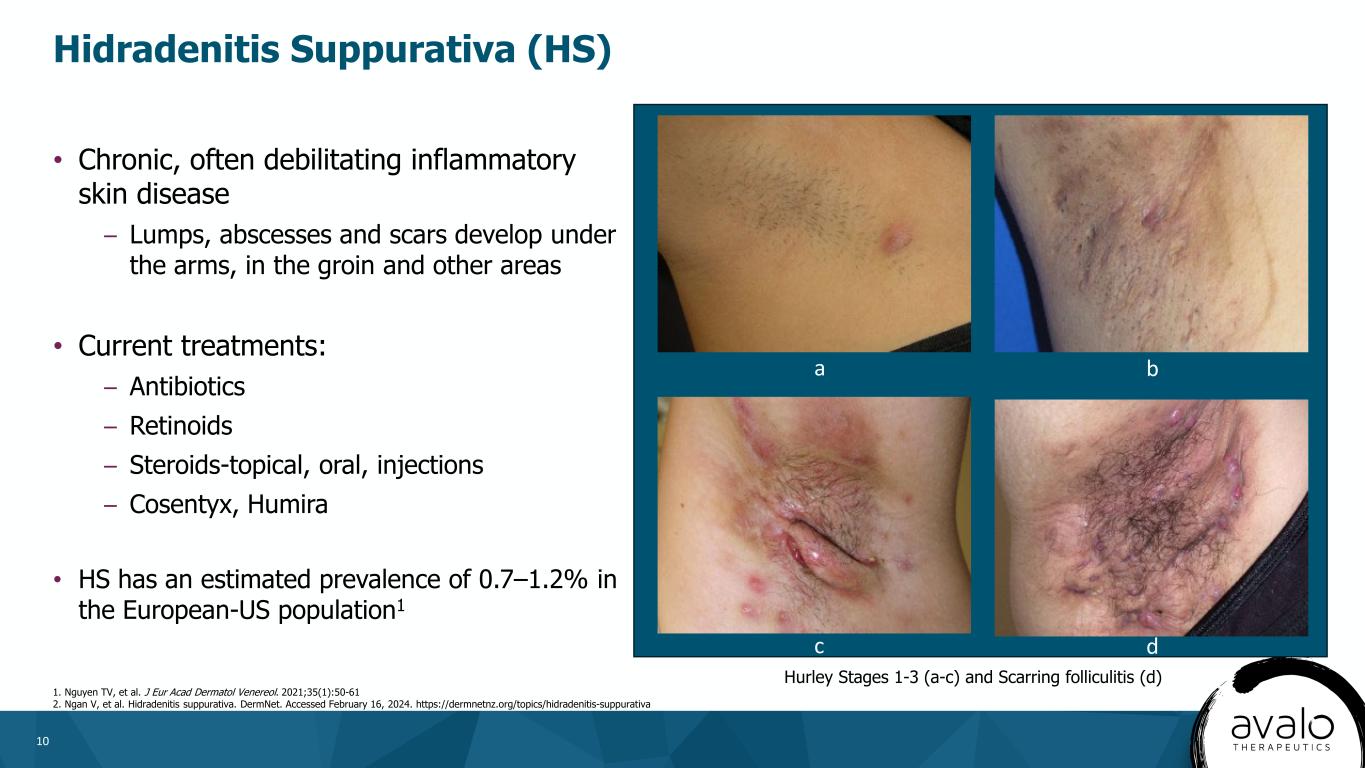
10·慢性、通常使人衰弱的炎症性皮肤病--腋下、腹股沟和其他部位形成肿块、脓肿和疤痕·目前的治疗方法:-抗生素-维甲酸-类固醇-外用、口服、注射-Cosentyx,Humira·HS在欧美人群中的患病率估计为0.7-1.2%。1化脓性汗腺炎(HS)1.Nguyen TV等人。J EUR阿卡德皮肤醇和维那醇。2021;35(1):50-61 2.颜维等.化脓性汗管炎。DermNet。访问时间为2024年2月16日。Https://dermnetnz.org/topics/hidradenitis-suppurativa-Hurley分期1-3(a-c)和瘢痕性毛囊炎(D)c d a b

11·HS的炎性下跌是由各种外界刺激-吸烟、生物失调或机械应激-触发的·IL-1β是导致毛囊皮脂单位破坏的炎性下跌的关键驱动因素-皮损中IL-1β水平升高4-抗IL-1药物的临床疗效观察IL-1β与HS1的病理生理学密切相关1.Calabrese L,等。生物分子。2024年;14(2):175 2.沃森ARJV等人。J·维斯特·皮马托。2020;140(7):1463-1466.e2 3.Kelly G等人BrJ皮马托尔。2015;173(6):1431-1439 4.Marzano AV,et al.皮肤科。2022;238(5):860-869 DAMPS,损伤相关的分子模式分子;DC,树突状细胞;IL,白介素性;IL-R,白介素受体;PAMPs,病原体相关的分子模式分子。

12最近HS试验的生物制品的基线患者特征Lutik izumab试验招募了比竞争对手试验更严重的患者1.Kimball AB等人。N Engl J Med.2016;375:422-34;2.Kimball AB等人。柳叶刀。2023年3月17日至21日在洛杉矶新奥尔良的美国皮肤病学会和2023年10月11日至14日在德国柏林的欧洲皮肤病和性病学学会的演讲4.研发演示-结果米拉试验2023年6月26日https://ir.moonlaketx.com/static-files/86c71a51-5836-4f1c-9a2c-45e440a50d75 5.在美国皮肤病学会(AAD 2024年)上的演讲,2024年3月8日至12日,加利福尼亚州圣地亚哥,患者特征adalimumab Pioneer I/II1 secukinumab阳光/SUNEISE2 bimekizumab BIRA4 lutikizumab NCT051396025年龄(年),平均34.9-37.8 35.5-37.3 36.7/36.6 37.6 37.0-39.5性别,女性,%59.5-69.3 54-57 63.0/50.7 53.8-67.6种族,白人,%75.8-87.7 74-81 77.8/81.5 85.0 64.9-88.9 BMI,公斤/平方米,平均31.3-34.5 31.4-32.8 33.8/32.3 33.7 33.0-34.1吸烟,目前为52.9-67.3 50-58 43.0/48.1 46.6 24.3-46.2年,平均8.8-9.9 6.6-8.2 9.0/7.0 8.5 10.0-13.2个病灶,平均计数-DT10.7-14.4 3.0-4.6 12.6-13.9 3.2-3.6 16/16.5 3.8/3.4 14.0 3.5 11.4-17.0 5.7-8.7 Hurley分期,%-I-II-III 052.3-54.6 45.4-47.7 2-6 51-60 28-46 050.3/61.1 49.7/38.9 063.7 36.3 25.6-35.1 64.9-74.4以前的生物使用,%0 20-26 25.0/13.2 17.5 100肿瘤坏死因子失败进入标准
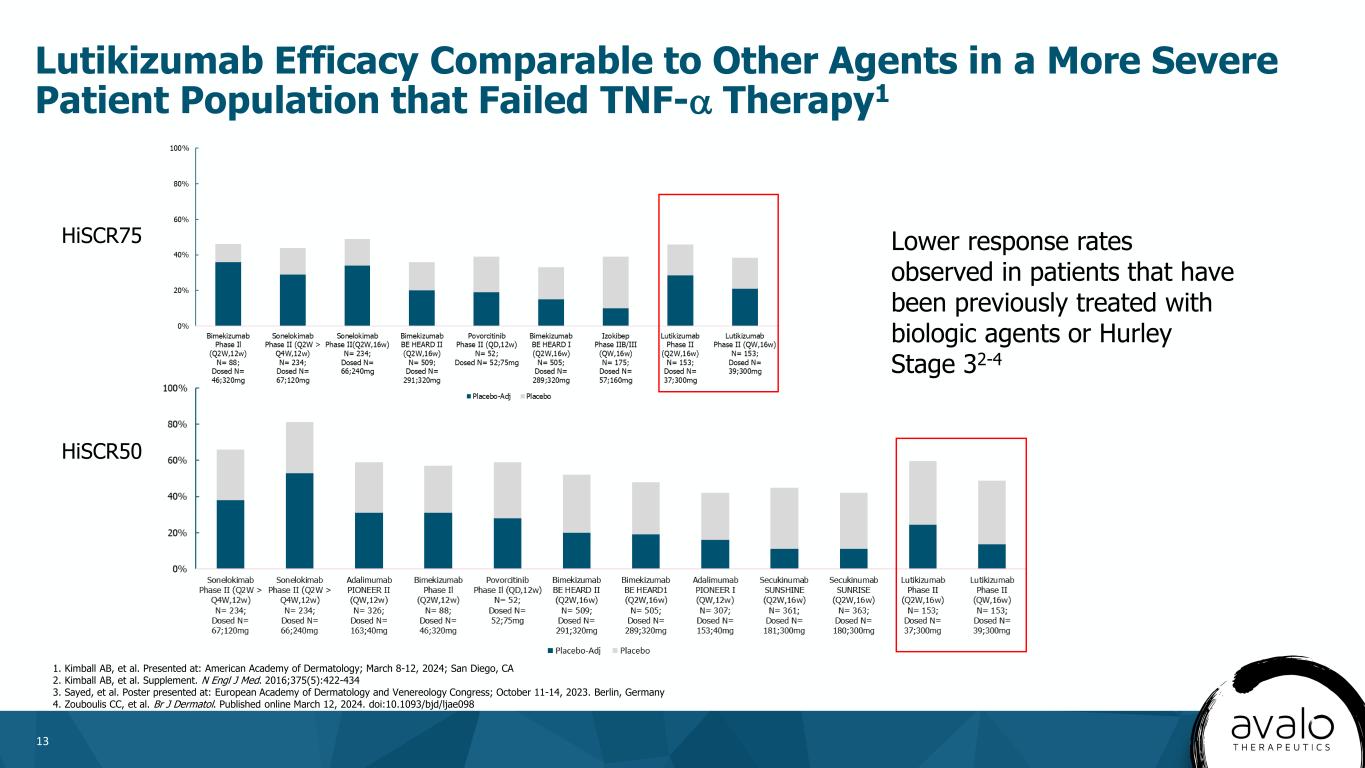
13 Lutikizumab在肿瘤坏死因子-α治疗失败的更严重的患者群体中的疗效与其他药物相当1 HiSCR75在以前接受过生物药物或Hurley分期32-4 1的患者中观察到的应答率较低。发表于:美国皮肤病学会;2024年3月8日至12日;加利福尼亚州圣地亚哥。副刊。N Engl J Med.2016;375(5):422-434海报出现在:欧洲皮肤病和性病学学会大会上;2023年10月11日至14日。德国柏林4.Zouboulis CC等人BrJ皮马托尔。2024年3月12日在线发布。DOI:10.1093/bjd/ljae098 HiSCR50
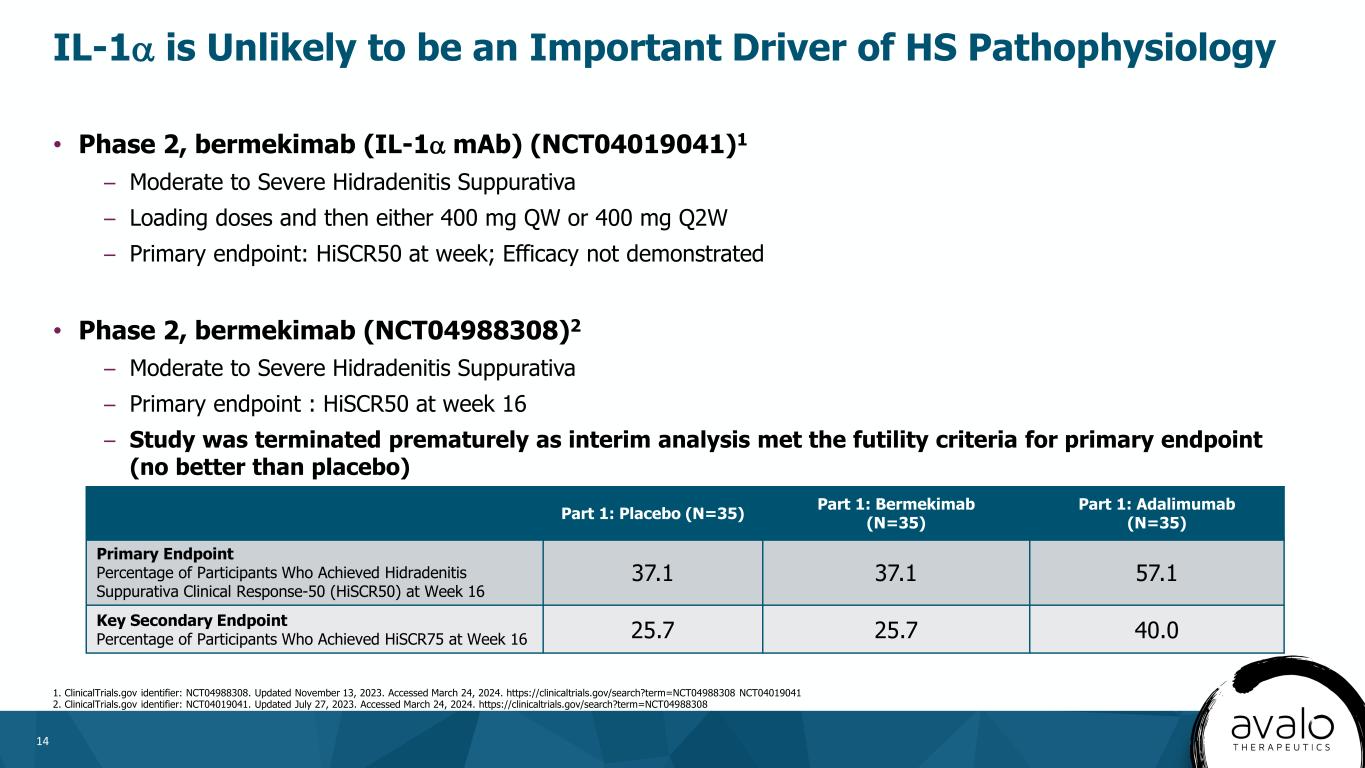
14·第二阶段,Bermekimab(IL-1α单抗)(NCT04019041)1-中至重度化脓性汗腺炎负荷剂量,然后400mgQW或400mgQ2W-主要终点:每周HSCR50;未证明疗效·2期,bermekimab(NCT04988308)2-中重度化脓性汗腺炎-主要终点:HSCR50在第16周-研究过早终止,因为中期分析满足主要终点的无效标准(不比安慰剂好)IL-1α不太可能是HS病理生理学HSCR1的重要驱动因素1。更新日期:2023年11月13日。访问时间为2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308 NCT04019041 2.临床试验.gov标识:NCT04019041.更新日期:2023年7月27日。访问时间为2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308://第1部分:安慰剂(N=35)第1部分:Bermekimab(N=35)第1部分:Adalimumab(N=35)在第16周达到化脓性汗腺炎临床反应-50(HiSCR50)的参与者的主要终点百分比在第16周达到HiSCR75的参与者百分比37.1 37.1 57.1在第16周达到HiSCR75的参与者百分比25.7 25.7 40.0
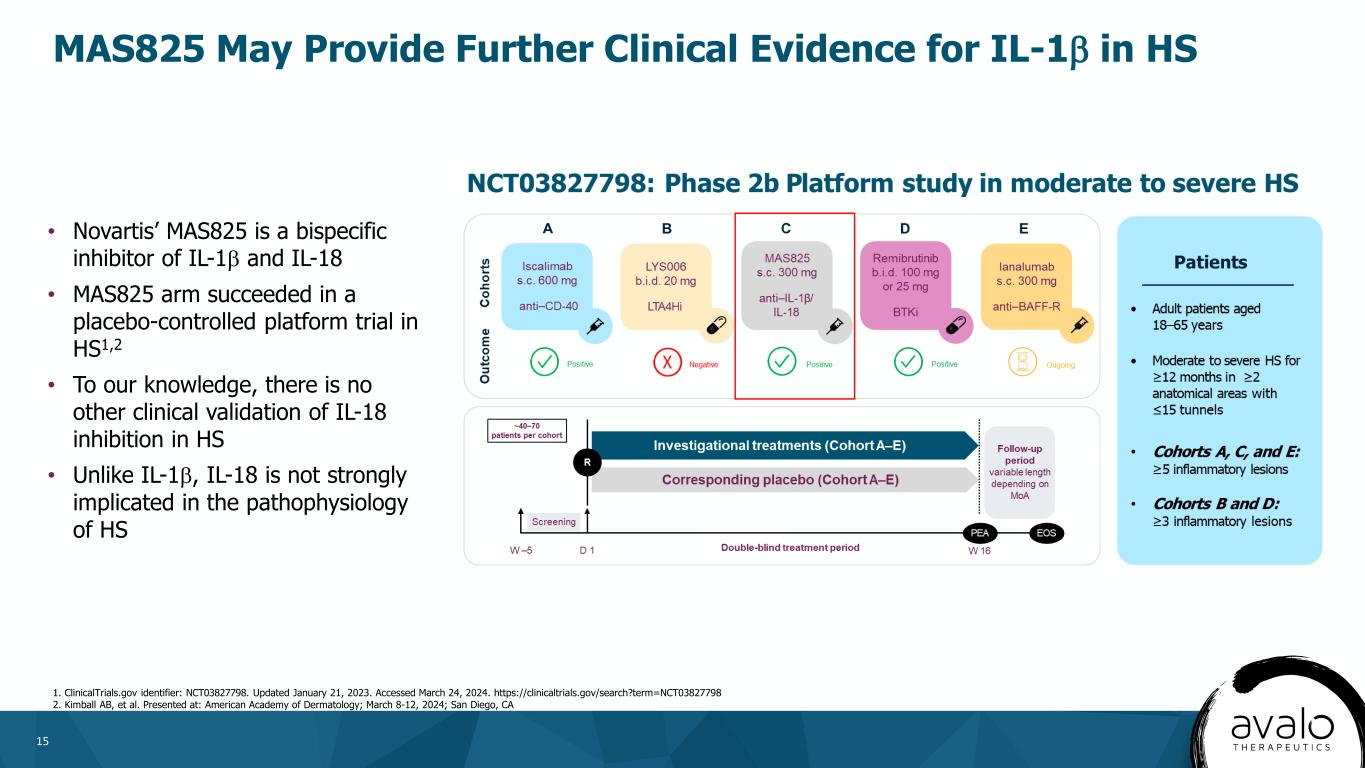
15MAS825可能为IL-1β在HS 1中的临床应用提供进一步的证据。更新日期:2023年1月21日。访问时间为2024年3月24日。Https://clinicaltrials.gov/search?term=NCT03827798 2.金博尔AB等人。诺华公司的MAS825是一种IL-1β和IL-18的双特异性抑制剂·MAS825 ARM成功地在HS1中进行了安慰剂对照平台试验2·据我们所知,在HS中没有其他临床验证对IL-18的抑制作用·与IL-1β不同,IL-18与HS的病理生理学关系不大

16·估计28%的HS病例为Hurley 2期,另外4%为Hurley 34期·有大量患者明显需要改进治疗方案1.Biotech Value Advisors LLC的独立市场分析2.Nguyen TV等人。J EUR阿卡德皮肤醇和维那醇。2021;35(1):50-61 3.Garg A等人JAMA皮肤醇。2017年;153(8):760-764 4.截止日期2/15/24·据估计,美国有0.7-1.2%的人患有HS,尽管一些估计高达2-4%2潜在的潜在市场·HS似乎被低估和报告,健康记录中报告的病例估计占美国人口的0.1%3·我们认为,要获得最佳结果,量身定制的治疗将需要获得多种疗法,以满足HS的多个目标大型未满足的需求全球HS市场具有数十亿美元的销售潜力几个已获批准的产品的赞助商预计年销售额为1.5-3B1 HS影响美国约240-400万人~105,000赫尔利阶段2/3~330,000人已被诊断为HS

17个关键次级/探索性终点AVTX-009治疗化脓性汗腺炎参与者的有效性和安全性关键次级终点:·HiSCR50、HiSCR90和HiSCR100·安全性和耐受性·PK探索性终点:·生物标记物--CRP、IL-6,潜在的其他生物标记物·临床诊断化脓性汗腺炎(HS)至少在基线前一年,由研究人员确定。·基线时总脓肿和炎性结节(AN)计数>5·HS病变必须至少存在于两个不同的解剖区域。·必须针对HS关键纳入标准的抗肿瘤坏死因子治疗失败随机化n=~165分(1:1:1)16w主要终点(HiSCR75)AVTX-009 300毫克SC Q4W安慰剂主要研究终点主要终点:在16周内获得汗腺炎化脓性临床反应的参与者百分比HiSCR75建议化脓性汗腺炎(HS)第二阶段研究安全随访3个月开放标签延长响应者AVTX-009 150 mg SC Q2W Lo in g D OS 600 mg 300 mg PBO试验有80%的能力显示每个单独手臂的HiSCR75反应(基于Lukizumab阶段2 HiSCR75)

18个潜在的附加适应症

19·IL-1β在炎症性疾病中发挥核心作用-IL-1β是炎症性小体激活产生的关键细胞因子-调节的炎症性小体激活异常参与了克罗恩病(CD)的发病机制·IL-1驱动的间质-中性粒细胞相互作用定义了对当前治疗无效的患者子集2,3·观察到IBD患者和HS4,5患者的重叠IL-1β在IBD中的作用://doi.org/10.3389/fimmu.2018.02566 1.毛L,等。前置免疫系统。2018年;9:2566 2.弗里德里希·M等人。奈特·梅德。2021年;27(11):1970-1981。3.卡德尔·MZ,卡泽·A·纳特·梅德。2021年;27(11):1870-1871年4.陈卫东,迟浩田。JAMA皮肤醇。2019;155(9):1022-1027 5.张明等。世界J临床病例。2021;9(15):3506-3516

20·炎症性肠病治疗的目标是缓解--目前的治疗方法只有一小部分炎症性肠病患者获得缓解·AbbVie计划评估lutikizumab,双变构域白细胞介素1α/1β拮抗剂作为UC的单一疗法,并与克罗恩的SKYRIZI联合治疗--…我们相信lutikizumab具有联合使用的潜力,以提供转化水平的IBD疗效。我们计划评估Lutikizumab和Skyrizi…的组合方法我们对炎症性肠病的第二阶段研究预计将于今年晚些时候开始。“--罗帕尔·塔卡尔,全球治疗公司首席医疗官高级副总裁--来自AbbVie 4Q23收益电话会议记录·将抗IL-1β作为单一疗法和最近启动的IL-1炎症性肠病试验相结合,有机会提高IBD患者的疗效

21执行摘要

22·在HS中实现最佳疾病特征的可能性-高效和有利的半衰期可能允许在其他自身免疫性疾病中改善疗效和方便的给药潜力·支持IL-1β在HS中的关键临床证据-在一项大型、控制良好的第二阶段试验(NCT05139602)中,lutikizumab在HS中验证了IL-1β靶向。尽管患者更严重,但疗效与其他HS疗法相当1-临床证据表明,抗IL-1α疗法在HS2中无效。3-MAS825(IL-1β/IL-18双特异性)在第二阶段随机对照研究(NCT03827798)中显示阳性结果(NCT03827798)4-单特异性IL-1β抑制作用可能优于针对未经验证的靶点(IL-18)或已知对疗效无贡献的双特异性药物(IL-1α)-我们认为AVTX-009在HS中成功的可能性很高·HS有望成为数十亿美元的市场·HS Topline结果预计将在2026年实现现金跑道进入2027年执行摘要和发展时间表1.金宝AB,等人的研究。介绍地点:美国皮肤病学会;2024年3月8日至12日;加利福尼亚州圣地亚哥。更新日期:2023年11月13日。访问时间为2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308 NCT04019041 3.临床试验.gov标识:NCT04019041.更新日期:2023年7月27日。访问时间为2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308://4.Kimball AB,et al.发表于:美国皮肤病学会;2024年3月8日至12日;加利福尼亚州圣地亚哥

23附录

24·2024年3月,Avalo进行了一项私募融资:·总收益高达1.85亿美元,交易结束时初始资金为1.156亿美元·预计交易结束时净收益约为1.05亿美元,预计将为2027年提供现金通道·预计将于2024年3月28日完成·在折算基础上,计入收购AlmataBio,Inc.和融资(不包括行使1200万份认股权证)后,Avalo已发行普通股的总数量约为2340万股·以下数据是截至12月31日的数据:2023年,不包括上述交易:·现金及现金等价物-740万美元·普通股流通股-80万股·完全稀释股份-80万纳斯达克:AVTX金融及投资者信息1包括1.156亿美元的预付资金,以及在充分行使已发行认股权证时将收到的6940万美元。认股权证可按每股普通股约5.8美元的价格行使,并可行使普通股或同等金额(转换为普通股)的无投票权可转换优先股,如果达到适用于每个持有人的某些实益所有权限制,则可行使认股权证,直至发行起五年前或在AVTX-009治疗化脓性汗腺炎的第二阶段试验中首次用药的公开宣布后30天为止。2净收益包括私募融资和收购AlmataBio,Inc.的估计交易成本。估计交易成本不包括在私募融资结束时应向前AlmataBio股东支付的750万美元里程碑付款。

25纳斯达克:AVTX www.avalotx.com