
SerpinPC 用于重度血友病患者 (pWH):一项多中心、由多部分组成的首次人体研究 T Baglin*、A Koch、I Mocanu+、L Makhaldiani$、J Huntington* *Centessa Pharmicals plc,英国柴郡奥尔特林厄姆阿什利路 1 号,WA14 2DT,Simbec-Orion 临床药理学,Merlical Pharmicals plc Thyr Tydfil,CF48 4DR,英国,+Arensia Exploratory Medicine,Testemitanu Str. 30,摩尔多瓦共和国基希讷乌,$Arensia 探索医学,格鲁吉亚第比利斯 Tevdeli Str. 0112 号 13a Tevdeli Str. 0112

特雷弗·巴格林员工的披露 Centessa Pharmicals 股东 Centessa Pharmicals Grant /Research Support 没有相关的利益冲突可供申报顾问没有相关的利益冲突可供申报议长局没有相关的利益冲突可供申报其他没有相关的利益冲突可供申报演示包括讨论以下药品或医疗器械的标签外用途:

免责声明本演示文稿由Centessa Pharmicals plc(“公司”)编写,仅供参考,不用于任何其他目的。本演示文稿不包含对投资者或潜在投资者具有重要意义或可能具有重要意义的所有信息,不应被视为就证券或其他金融工具的持有、购买或出售向投资者或潜在投资者提出的建议或推荐,并且不考虑任何投资者的特定目标、财务状况或需求。本演示文稿的传播可能受法律限制;本演示文稿的发布或使用不符合当地法律或法规的任何司法管辖区的任何人不得分发或供其使用。本演示文稿不直接或间接地针对任何公民或居民或位于任何地方、州、国家或其他司法管辖区的个人或实体进行分发、转让、出版、可用性或使用会违反法律或法规或需要在该司法管辖区内进行任何注册或许可的个人或实体或供其使用。本演示文稿可能包含根据1995年《私人证券诉讼改革法》的安全港条款做出的前瞻性陈述。本演示文稿中非历史事实陈述的陈述均为前瞻性陈述,包括但不限于与公司向患者提供有影响力的药物的能力;我们的主要高管推动公司项目组合执行的能力;研究和临床开发计划;开发我们的候选产品或任何其他未来候选产品的范围、进展、结果和成本;我们目前对开发和治疗等方面的期望我们的候选产品的潜力和收益,包括SerpinPC;与SerpinPC以及其他公司计划(如果有)有关的新研究或临床试验或临床和临床前数据的开始、继续和结束;公司继续满足快速通道指定标准的能力;其有资格获得加速批准、优先审查或滚动审查的能力;其识别、筛选、招聘、注册和保留足够数量或任何数量的能力其现有或预期的新研究或临床研究中的受试者包括Present-2、present-3和present-5在内的试验;战略;监管事项,包括获得批准以启动或继续临床试验或上市任何产品的时机和成功可能性;注册受试者参与临床试验;候选产品的市场规模和机会;以及我们预期的现金流。但是,诸如 “可能”、“可能”、“将”、“可以”、“应该”、“打算”、“计划”、“目标”、“预期”、“相信”、“估计”、“预测”、“潜在”、“继续”、“持续”、“目标”、“寻求” 等词语以及这些词语或类似表述的变体旨在识别前瞻性陈述并非所有前瞻性陈述都一定包含这些识别词。这些前瞻性陈述基于公司管理层的信念以及公司做出的假设和目前可获得的信息。此类陈述反映了公司当前对未来事件的看法,并存在已知和未知的风险,包括但不限于与我们保护和维护知识产权地位的能力相关的风险;业务、监管、经济和竞争风险、不确定性、突发事件和对公司的假设;开发产品和技术的固有风险;我们正在进行和计划中的临床试验的未来结果;我们获得充足融资的能力,包括通过我们的融资机制与Oberland合作,为我们计划的临床试验和其他费用提供资金;行业趋势;该行业的法律和监管框架,包括获得和维持进行或继续临床测试的许可;与我们以资产为中心的公司模式相关的未来支出风险;我们的任何一种或多种候选产品无法成功开发和商业化的风险;临床前研究或临床研究的结果无法预测未来结果的风险与未来研究的关系;以及与 COVID-19 疫情相关的风险,包括 Delta、Omicron 和任何其他变种的影响,俄罗斯-乌克兰冲突等地缘政治风险以及我们向美国证券交易委员会提交的文件中包含的其他风险因素。鉴于这些风险和不确定性,前瞻性陈述中提及的事件或情况可能不会发生。实际结果可能与预期结果有所不同,并且差异可能是重大的。不应将这些前瞻性陈述视为预测或承诺,也不应将其视为暗示任何迹象、保证或保证,表明此类前瞻性陈述所依据的假设是正确或详尽的,或者就假设而言,在本演示文稿中已得到充分陈述。提醒您不要过分依赖这些前瞻性陈述,这些陈述仅代表截至本演示文稿发表之日。所有预测、估值和统计分析仅供参考。除非法律要求,否则我们明确表示没有义务或承诺公开发布此处包含的任何前瞻性陈述的任何更新或修订,以反映我们期望的任何变化或任何此类声明所依据的事件、条件或情况的任何变化。它们可能基于主观评估和假设,并可能使用产生不同结果的替代方法中的一种,如果它们基于历史信息,则不应将其作为对未来表现的准确预测。本演示文稿讨论了正在进行临床研究且尚未获得美国食品药品监督管理局或任何其他监管机构批准上市的候选产品。对于这些候选产品的研究用途的安全性或有效性,不作任何明示或暗示的陈述或保证。此处包含的商标是其所有者的财产,仅用于参考目的。此类使用不应被解释为对此类产品的认可。本演示文稿中包含的某些信息涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及公司自己的内部估计和研究。尽管我们认为截至本演示文稿之日这些第三方来源是可靠的,但我们尚未独立核实,对于从第三方来源获得的任何信息的充分性、公平性、准确性或完整性,我们也没有做出任何明示或暗示的陈述或保证。最后,尽管我们认为自己的内部研究是可靠的,但此类研究尚未得到任何独立来源的证实。
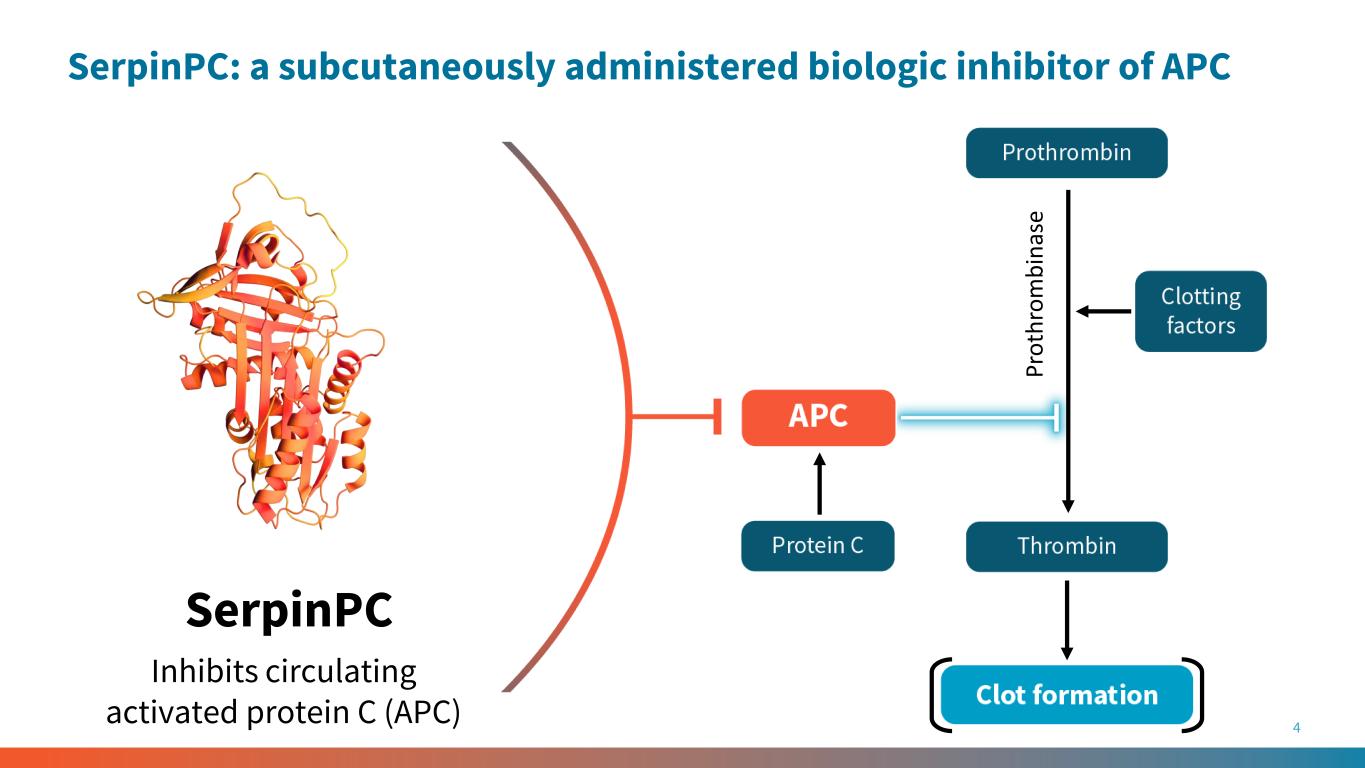
4 serpinPC 抑制循环活化蛋白 C (APC) P ro th ro m b in as e serpinPC:一种皮下给药的 APC 生物抑制剂

AP-0101 研究设计:适应性首次人体研究,旨在研究 SerpinPC 5 第 1b 部分 SAD pWh(n=12)高达 0.03 mpk 0.1 至 1.2 mpk 第 1a 部分 SAD HV(n=15)1.2 mpk Q2W 第 2 部分 MAD pWH(n=23)第 3 部分平坦剂量(n=22)第 4 部分 1.2 mpk Q2W(n=21)第 1 周至 24 周 25 至 72 周 73 至 96 周 48 周 24 周 0.3/0.6/1.2 mpk 60 mg 平剂 2.4 mpk 1.2 mpk Q2W 60 mg Q4W0.3/0.6/1.2 mpk Q4W 第 5 部分 1.2 mpk Q2W (n=20) 第 97 周至 148 周 2.4 mpk 有效月剂量计时周期 149 至 200 周 120 mg 平淡部分6 平剂量 (n=16) 60 mg Q2W 148 周(2.8 岁)
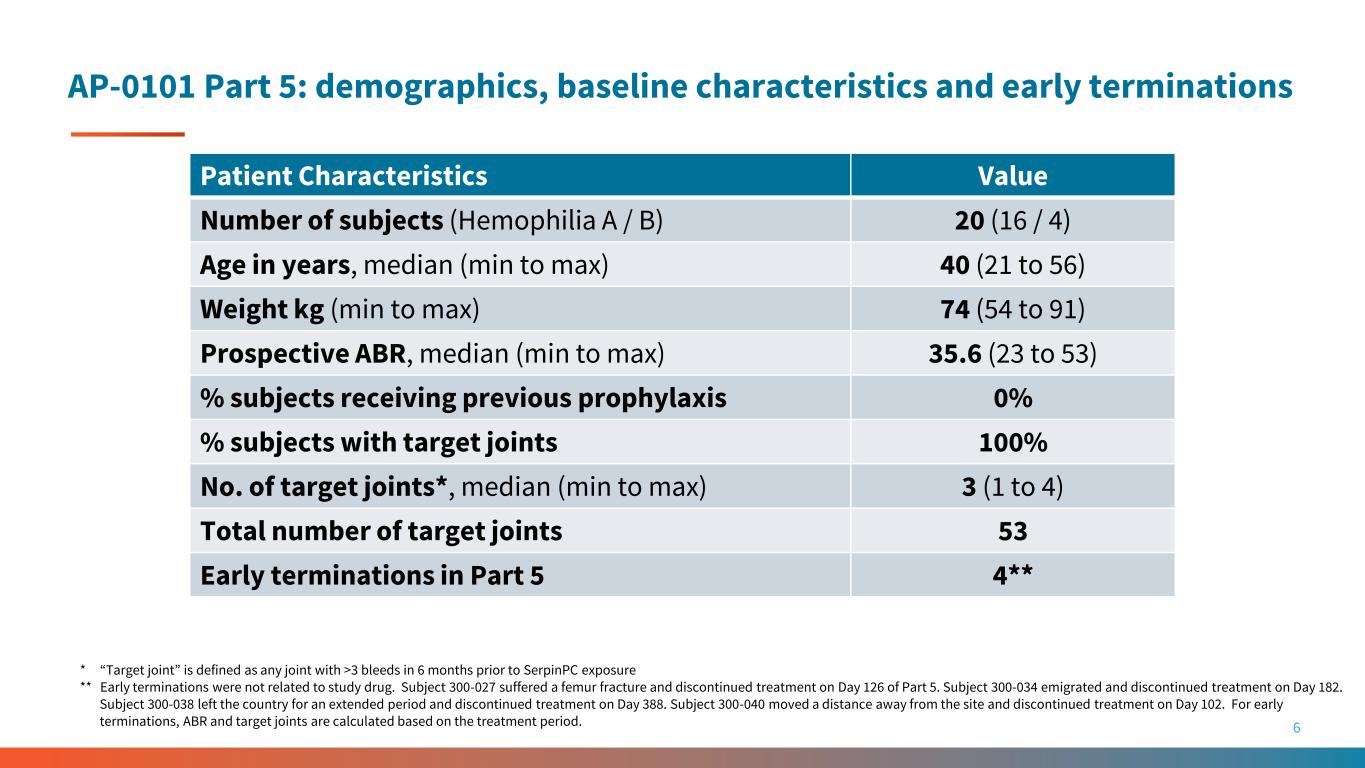
AP-0101 第 5 部分:人口统计、基线特征和早期终止妊娠 6 患者特征值受试者数量(血友病 A/B)20(16/4)年龄,中位数(最小至最大)40(21 至 56)体重 kg(最小至最大)74(54 至 91)前瞻性 ABR,中位数(最小至最大)35.6(23 至 53)% 先前接受预防的受试者 0% 有目标关节的受试者 100% 目标关节*,中位数(最小到最大)3(1 到 4)目标关节总数 53 第 5 部分中的早期终止 4** * “目标关节” 是指在 6 个月内出血超过 3 次的任何关节在 SerpinPC 暴露之前 ** 早期终止治疗与研究药物无关。受试者 300-027 股骨骨折并于第 5 部分第 126 天停止治疗。受试者 300-034 于第 182 天移居国外并停止治疗。受试者300-038长时间离开该国,并于第38天停止治疗。受试者300-040离开了该部位一段距离,并在第102天停止了治疗。对于早期终止治疗,ABR 和目标关节是根据治疗周期计算的。

AP-0101 第 5 部分:未观察到与治疗相关的不良事件 7 治疗紧急不良事件 (TEAE) 受试者数量 (%) n=20 所有 TEAE(共 41 个事件)16 (80%) 与 SerpinPC 相关 0 导致停药 1 (5%) 导致死亡 0 特别关注的不良事件 0 严重不良事件 2 (10%) * 血栓栓塞事件 0 注射部位反应 0 抗药抗体 1# 中和抗药抗体 0# *出现了两个 SAE,被认为与研究药物无关:(1)股骨外伤性骨折(导致停药)(2)创伤性附睾炎# 初步调查结果

AP-0101 第 5 部分:年化出血率 (ABR) 和目标关节降低 8 目标关节基线 (n=20) 第 5 部分 (n=20) 变化 (%) 每位患者的目标关节(中位数)3 0 -100% 队列中的目标关节总数 53 3 -94% 年化出血率 (ABR) 基线 (n=20) 第 5 部分 (n=20) 变化* (%) 所有出血(中位数)四分位数范围 35.6 29.8 至 40.4 1.0 1.0 至 4.5 -96% -89% 至 -98% 自发性关节出血(中位数)四分位间距 30.3 24.0 至 35.2 1.0 0.0 至 3.0 -95% -90% 至 -100% *通过比较基准值计算得出的个体变化中位数来自同一主题的每个受试者具有第 5 部分的值。
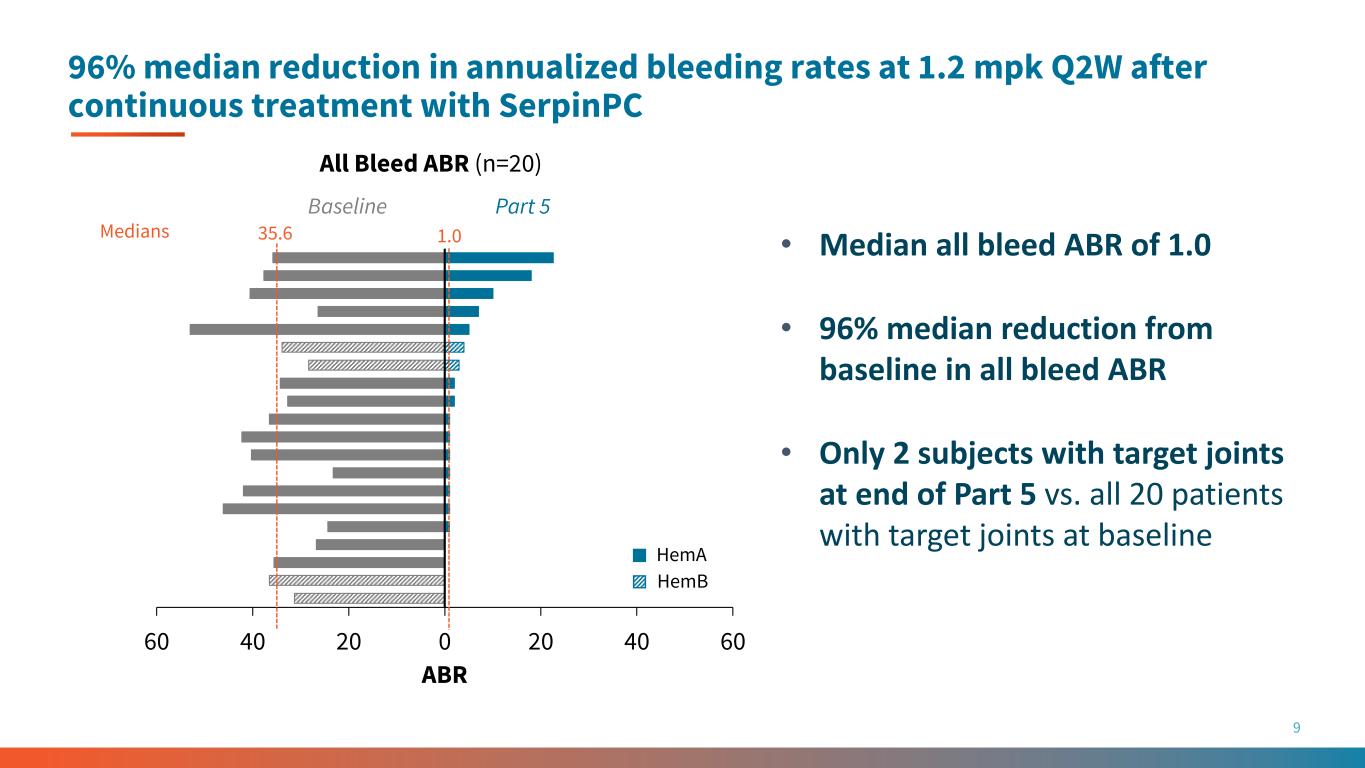
持续使用 SerpinPC 9 All Bleed ABR 治疗后,年化出血率中位数降低 96%,第二季度为 1.2 mpk • 所有出血 ABR 的中位数 1.0 • 所有出血 ABR 的中位数比基线降低 96% • 仅有 2 名受试者在第 5 部分末有目标关节,而基线时目标关节的所有 20 名患者 60 40 20 40 60 第 5 部分 hemA HemB 1.03 5.6 ABR

0 100 200 300 400 500 600 700 0 0 6 12 18 24 30 36 42 48 54 60 66 72 84 90 96 102 114 126 132 144 150 在治疗 148 周内未观察到原因不明的 D 二聚体值持续升高 10 平均值 d-二聚体1(ng/ml)第 3 部分(60 mg 平均 Q4W)n=23 第 4 部分和第 5 部分(1.2 mpk Q2W)n=21,20

在第 5 部分参数均值中测得的药代动力学参数(标准偏差)Tmax (n=20) 74 小时 (28) t1/2 (n=17) 99 小时 (10) Cmax (n=20) 3184 ng/ml (1122) AUC0-T (n=19) 564 小时*mg/ml (148) auc0-inf (n=17) 673 小时*mg/ml (21)
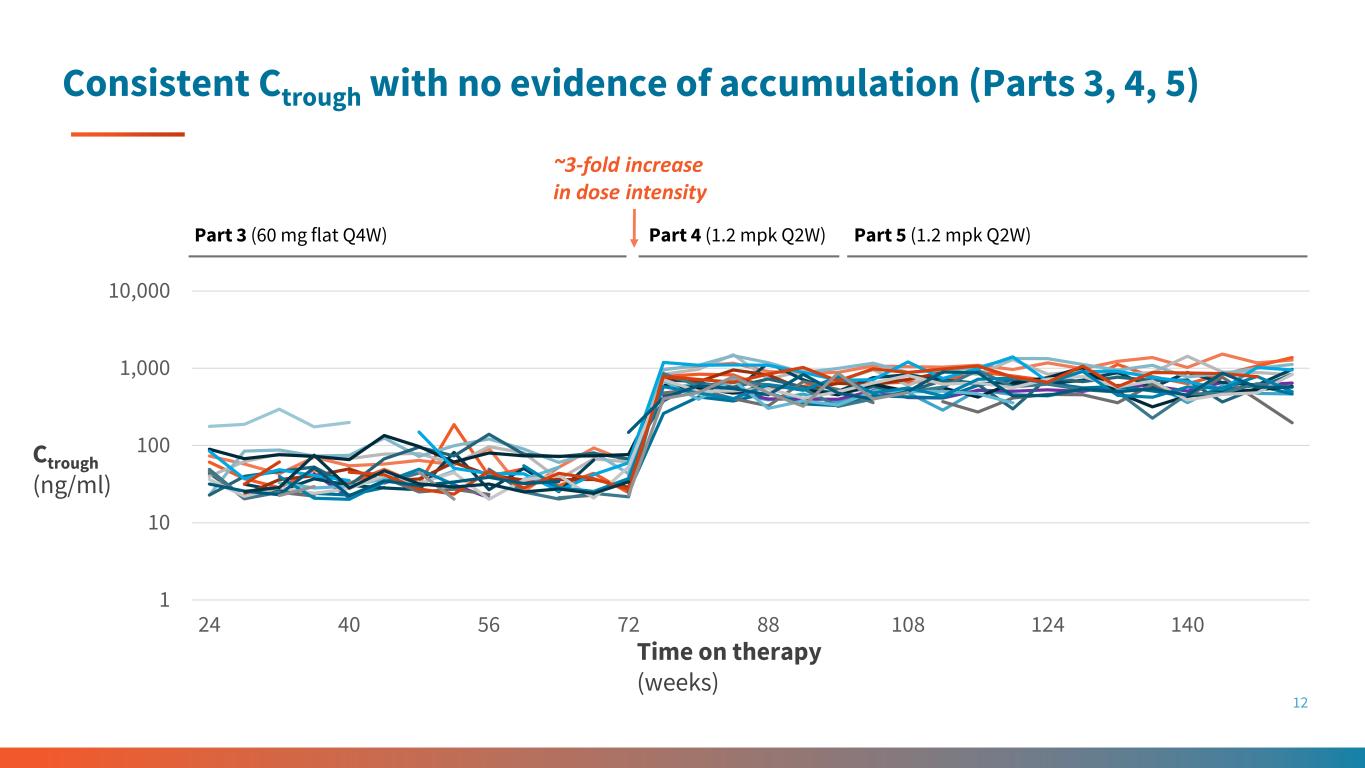
1 10 100 1,000 10,000 10,000 24 40 56 72 88 108 108 124 140 持续的阻力,没有积累的证据(第 3、4、5 部分)12 第 3 部分(60 mg 平量 Q4W)第 4 部分(1.2 mpk Q2W)剂量强度增加约 3 倍第 5 部分(1.2 mpk Q2W)Ctrough(ng/ml)治疗时间(周)

• 在第 5 部分中,在 20 名受试者中观察到 1 次短暂的 ADA 反应 — 受试者在检测极限(1:100 稀释)时出现单例 ADA。在中和抗药抗体测试中,同一样本呈阴性——受试者在第 5 部分中 ABR 为 0.99 — 受试者的平均 Ctrough 为 619 ng/ml(第 5 部分中最小为 422 至最大 911 ng/ml),而第 5 部分中所有受试者的平均值为 681 ng/ml • 在任何受试者中未观察到与 a1 抗胰蛋白酶交叉反应*的抗药抗体非机密 13 *serpinPC 源自 a1 抗胰蛋白酶,其氨基酸序列相同 99%

摘要 14 • 在重复剂量暴露2.8年后,SerpinPC被证明具有安全和良好的耐受性 — 在第2至第5部分中没有观察到与SerpinPC相关的不良反应,只有1例已解决,已有皮肤病的受试者出现中度注射部位反应 — 未观察到原因不明的持续升高D-二聚体升高 — 观察到PK参数稳定且一致 • 使用SerpinPC持续治疗2.8年 ABR 降低并针对关节出血 — 第 5 部分中所有出血 ABR 的中位数为 1.0 — 所有出血 ABR 的降低 96%基线 — 研究人群中目标关节减少94%