
美国 美国
证券交易委员会
华盛顿特区,20549
表格
(标记 一)
| 根据1934年《证券交易法》第13或15(D)节提交的年度报告 |
对于
截止的财政年度
或
| 根据1934年《证券交易法》第13或15(D)条提交的过渡报告 |
对于 ,过渡期从_
佣金
文件编号:
(注册人的确切名称与其章程中规定的名称相同)
| 状态 或其他司法管辖权 | (I.R.S.雇主 | |
| 合并 或组织 | 标识 编号) |
(主要执行机构地址 )(邮编)
注册人的电话号码,包括区号
根据该法第12(B)条登记的证券:
| 每个班级的标题 | 交易 个符号 | 注册的每个交易所的名称 | ||
|
|
根据该法第12(G)条登记的证券:无
如果注册人是证券法规则405中定义的知名经验丰富的发行人,请用复选标记表示
。是的☐
如果注册人不需要根据该法第13条或第15(D)条提交报告,请用勾号表示
。是的☐
用复选标记表示注册人(1)是否在过去12个月内(或注册人被要求提交此类报告的较短期限内)提交了1934年《证券交易法》第13或15(D)节要求提交的所有报告,以及(2)
在过去90天内是否符合此类提交要求。
用复选标记表示注册人是否在过去12个月内(或在注册人被要求提交此类文件的较短时间内)以电子方式提交了根据S-T规则(本章232.405节)第405条要求提交的每个交互数据文件。
用复选标记表示注册人是大型加速申报公司、加速申报公司、非加速申报公司、较小的申报公司或新兴成长型公司。请参阅《交易法》第12b-2条规则中“大型加速申报公司”、“加速申报公司”、“较小申报公司”和“新兴成长型公司”的定义。
| 大型 加速文件服务器 | ☐ | 加速的 文件管理器 | ☐ | ||
| ☒ | 较小的报告公司 | ||||
| 新兴的 成长型公司 |
如果
是一家新兴成长型公司,请用复选标记表示注册人是否已选择不使用延长的过渡期来遵守根据《交易法》第13(A)节提供的任何新的或修订的财务会计准则。
用复选标记表示注册人是否提交了一份报告,并证明其管理层根据《萨班斯-奥克斯利法案》(《美国法典》第15编第7262(B)节)第404(B)条对其财务报告内部控制的有效性进行了评估
编制或发布其审计报告的注册会计师事务所。
如果证券是根据该法第12(B)条登记的,请用复选标记表示备案文件中包括的注册人的财务报表是否反映了对以前发布的财务报表的错误更正。
用复选标记表示这些错误更正中是否有任何重述需要根据§240.10D-1(B)对注册人的任何高管在相关恢复期间收到的基于激励的薪酬进行恢复分析。
用复选标记表示注册人是否是空壳公司(如该法第12b-2条所界定)。是,☐不是
根据纳斯达克公布的2023年6月30日收盘价计算,注册人的非关联公司持有的注册人普通股的总市值,每股面值0.00001美元,按2023年6月30日纳斯达克公布的收盘价计算,约为$
注册人的普通股在2024年3月20日的流通股数量为
航天飞机 制药控股公司
目录表
| 第 页第 | |||
| 第一部分 | |||
| 第 项1. | 业务 | 4 | |
| 第 1a项。 | 风险因素 | 24 | |
| 项目 1B。 | 未解决的员工意见 | 52 | |
| 项目 1C。 | 网络安全 | 52 | |
| 第 项2. | 属性 | 53 | |
| 第 项3. | 法律诉讼 | 53 | |
| 第 项。 | 煤矿安全信息披露 | 53 | |
| 第II部 | |||
| 第 项5. | 注册人普通股市场、相关股东事项与发行人购买股权证券 | 54 | |
| 第 项6. | [已保留] | 55 | |
| 第 项7. | 管理层对财务状况和经营成果的探讨与分析 | 55 | |
| 第 7A项。 | 关于市场风险的定量和定性披露 | 60 | |
| 第 项8. | 财务报表和补充数据 | 61 | |
| 第 项9. | 会计与财务信息披露的变更与分歧 | 62 | |
| 第 9A项。 | 控制和程序 | 62 | |
| 第 9B项。 | 其他信息 | 62 | |
| 第 9C项。 | 关于妨碍检查的外国司法管辖区的披露 | 62 | |
| 第三部分 | |||
| 第 项10. | 董事、高管与公司治理 | 63 | |
| 第 项11. | 高管薪酬 | 72 | |
| 第 项12. | 某些实益拥有人的担保所有权以及管理层和相关股东的事项 | 75 | |
| 第 项13. | 某些关系和相关交易,以及董事的独立性 | 76 | |
| 第 项14. | 首席会计师费用及服务 | 77 | |
| 第四部分 | |||
| 第 项15. | 展示和财务报表明细表 | 78 | |
| 第 项16. | 表格10-K摘要 | 80 | |
| 签名 | 81 | ||
| 2 |
前瞻性陈述
This Annual Report on Form 10-K (including the section regarding Management’s Discussion and Analysis and Results of Operations, the “Annual Report”) contains forward-looking statements within the meaning of Section 27A of the Securities Act of 1933, as amended, or the Securities Act, and Section 21E of the Securities Exchange Act of 1934, as amended, or the Exchange Act. These statements are based on our management’s beliefs and assumptions and on information currently available to our management. Although we believe that the expectations reflected in these forward-looking statements are reasonable, these statements relate to future events or our future financial performance, and involve known and unknown risks, uncertainties and other factors that may cause our actual results, levels of activity, performance or achievements to be materially different from any future results, levels of activity, performance or achievements expressed or implied by these forward-looking statements. All statements other than statements of historical facts contained in this Form 10-K are forward-looking statements. In some cases, you can identify forward-looking statements by terminology such as “may,” “could,” “will,” “would,” “should,” “expect,” “plan,” “anticipate,” “believe,” “estimate,” “intend,” “predict,” “seek,” “contemplate,” “project,” “continue,” “potential,” “ongoing” or the negative of these terms or other comparable terminology. These forward-looking statements include, but are not limited to, statements about:
| ● | 我们研发计划、临床前研究、任何临床试验和IND的启动、时间、进度和结果,以及其他法规提交; | |
| ● | 我们对第三方合作伙伴开发、获得监管机构批准并将候选产品商业化的预期依赖; | |
| ● | 根据我们签订的任何研究合作和许可协议,我们的 任何里程碑付款或版税的接收和时间安排; | |
| ● | 我们识别和开发候选产品的能力; | |
| ● | 我们的 或合作者获得并维护监管部门对我们的任何候选产品的批准的能力; | |
| ● | 任何经批准的候选产品的市场接受率和程度; | |
| ● | 任何经批准的候选产品的商业化; | |
| ● | 我们 能够建立和维护额外的协作,并为需要协作的候选产品保留商业权利; | |
| ● | 为我们的业务、技术和候选产品实施我们的业务模式和战略计划; | |
| ● | 我们对费用、持续亏损、未来收入和资本需求的估计; | |
| ● | 我们 为我们的运营获得额外资金的能力; | |
| ● | 我们 为我们的技术和候选产品获得和维护知识产权保护的能力,以及我们在不侵犯他人知识产权的情况下运营我们的业务的能力。 | |
| ● | 我们依赖第三方进行临床前研究或任何未来的临床试验; | |
| ● | 我们依赖第三方供应和制造合作伙伴为我们的研究和开发、临床前和临床试验药物供应提供材料和组件,并进行制造。 | |
| ● | 我们有能力吸引和留住合格的关键管理和技术人员; | |
| ● | 我们使用我们从首次公开募股、IPO或任何后续私募中获得的净收益; | |
| ● | 我们对根据《就业法案》成为新兴成长型公司的时间的预期; | |
| ● | 我们的财务业绩;以及 | |
| ● | 与我们的竞争对手或我们的行业相关的发展。 |
您 不应过分依赖前瞻性陈述,因为它们涉及已知和未知的风险、不确定性和其他 因素,在某些情况下,这些因素超出了我们的控制范围,并可能对结果产生重大影响。可能导致实际结果 与当前预期有重大差异的因素包括(除其他外)我们向美国证券交易委员会(SEC)提交的报告中列出的因素。由于这些风险因素,实际事件或结果可能与 前瞻性陈述中暗示或预测的事件或结果有很大差异。任何前瞻性陈述均不能保证未来业绩。您应阅读 本年度报告、我们在本年度报告中引用的文件以及我们作为其证据向 SEC提交的文件,并了解我们的实际未来结果和情况可能与我们的预期有重大差异。
除非 上下文另有要求,本年度报告中的术语“公司”、“Shuttle Pharma”、“我们”、“我们”和“我们的”指Shuttle Pharmaceuticals Holdings,Inc.。
| 3 |
第 部分I
第 项1.业务
我们 是一家临床阶段制药公司,利用我们的专有技术开发旨在治愈癌症的新型疗法。 我们的目标是通过手术、放疗、化疗和免疫疗法扩大癌症治疗的益处。放射治疗 ("RT")是治疗癌症的最有效方式之一。我们正在开发一系列产品,旨在解决当前癌症治疗的局限性,并扩展到RT的新应用。我们相信,我们的候选产品 将使我们能够提供比当前 标准治疗更安全、更可靠、更大规模的癌症治疗。
我们的 候选产品包括罗哌多尿苷、延长生物利用度罗哌多尿苷(IPdR/TPI)和HDAC抑制剂平台(SP—1—161、 SP—2—225和SP—1—303)。2023年12月,我们向美国食品和药物管理局(“FDA”)提交了新药研究申请,以支持罗哌多尿苷的下一阶段开发。2024年1月,我们收到了 FDA的"安全进行"信函,内容涉及我们在新诊断的带有未甲基化MGMT启动子的IDH—野生型胶质母细胞瘤患者放疗期间作为放射增敏剂的II期研究的IND申请。收到该函 后,我们可以开始罗哌多尿苷(IPdR)的II期研究。我们已申请并获得FDA批准,将罗哌多尿苷和RT用于治疗脑癌(胶质母细胞瘤)。我们相信我们的管理团队在放射治疗 、癌症联合治疗和免疫肿瘤学方面的专业知识将有助于推动这些潜在治疗方法的开发,如果获得批准,将其商业化 用于侵袭性癌症患者。
放射 肿瘤学在过去几年中经历了变革性的技术创新,以更好地定义肿瘤,允许改善 放射输送的形状,并支持以更短的疗程递增剂量。此外,在肿瘤体积内实现更高的剂量分布 已经达到实际的平台,因为癌症经常与更敏感的正常 组织整合或包围,并且进一步的剂量递增会增加组织坏死的风险。为了在最大耐受辐射剂量下增加癌症治愈率, 需要对细胞进行药理学和生物学修饰,以使癌症敏感,保护正常组织,并刺激免疫 系统对辐射受损的癌细胞产生的抗原作出反应。显示出致敏特性的药物,或使癌细胞对辐射更敏感的能力 ,为这个问题提供了解决方案。目前,这类药物是标签外使用的化疗药物,而且许多药物具有固有的毒性,因为它们设计用于直接的癌症治疗,而不是用于致敏。
我们 正在开发我们的产品,目标是解决癌症治疗中尚未满足的需求,推出一种商业化的辐射响应修饰剂解决方案,该解决方案可提高癌细胞对电离放射治疗的敏感性。我们产品的目标是提高接受放射治疗的患者的治疗指数,并减少实体肿瘤患者的放射相关毒性。我们的 产品涉及与RT治疗癌症相关的三个领域:
| 1. | 使生长中的癌细胞敏化,使其更容易受到放射治疗的影响。 | |
| 2. | 激活DNA损伤反应通路以杀死癌细胞并保护邻近的正常细胞。 | |
| 3. | 激活免疫系统以杀死RT后剩余的任何细胞。 |
我们的 平台技术允许创建用于辐射增敏、免疫调节和健康组织保护的产品库存。
| 4 |
我们的 管道
我们 目前正在开发小分子辐射增敏剂和免疫反应调节药物的生产线。我们最先进的候选产品 是Ropidoxuridine,一种口服卤代嘧啶,在临床前研究中具有较强的癌症辐射增敏特性 。此外,我们还有一系列免费候选产品,我们正在开发这些产品,以解决大量实体瘤 癌症适应症。我们的管道如下图所示:

临床阶段(罗匹多尿苷)和临床前阶段(HDAC抑制剂)流水线的时间表 。
我们的主要候选产品包括:
| ● | 罗哌多尿苷 (IPdR)is our lead candidate radiation sensitizer for use in combination with RT to treat brain tumors (glioblastoma) and sarcomas. Phase I clinical trial results supported by Shuttle Pharma and the NCI (CTEP) were reported in the medical journal, Clinical Cancer Research, in July 2019, by our SBIR subcontractor. Eighteen patients completed dose escalations to 1,800 mg/day for 30 days, establishing the maximum tolerated dose (MTD) of 1,200 mg/day in combination with RT. Four partial responses, nine stable disease and one progressive disease in target lesions were reported. Four patients did not have measurable disease and, as a result, were not evaluable. These Phase I trial results demonstrate oral bioavailability and an MTD of 1,200 mg per day for 28 days for use in combination with radiation for Phase II clinical trials that we propose to perform in brain tumors and in sarcomas. The brain tumor, glioblastoma multiforme (GB) is eligible for orphan disease designations. Shuttle Pharma has advanced drug manufacture and formulation and prepared a clinical protocol of a “Phase 2 Single-Arm Study of IPdR as a Radiation Sensitizing Agent During Radiotherapy in Patients with Newly Diagnosed IDH-Wildtype MGMT Unmethylated Glioblastoma Multiforme.” In December 2023, we submitted an IND application with the FDA to support the next phase of development of Ropidoxuridine. In January 2024, we received the ‘Safe to Proceed’ letter from the FDA for our IND application for the Phase II study of Ropidoxuridine (IPdR) as a radiation sensitizing agent during radiotherapy in patients with newly diagnosed IDH-wildtype glioblastoma with unmethylated MGMT promoter. Receipt of the letter allows us to commence the Phase II study of Ropidoxuridine (IPdR). |
| 5 |
| ● | 罗哌多尿苷 和替吡嘧啶(IPdR/TPI)是一种新的复方制剂,口服给药后生物利用度延长 在动物模型系统中。IPdR/TPI制剂将进行临床前开发,用作直肠放射增敏剂 第二阶段脑肿瘤临床试验已经启动。 | |
| ● | SP—1—161 是Shuttle Pharma的临床前候选先导HDAC抑制剂,辐射增敏候选产品。此盘HDAC 抑制剂启动共济失调—毛细血管扩张(ATM)反应途径突变。通过合理的药物设计,我们发现了双重功能 分子、HDAC抑制剂和ATM激活剂能够使癌细胞对辐射敏感并保护正常细胞。药物 候选物可用作直接化疗剂或用作治疗癌症的放射增敏剂。 | |
| ● | SP—2—225 是Shuttle Pharma的临床前IIb类选择性HDAC抑制剂,可选择性地影响组蛋白脱乙酰酶HDAC 6。 SP—2—225对免疫系统有调节作用。RT与癌症治疗免疫应答的相互作用 目前有很大的兴趣,为原发部位和转移性癌症治疗的潜在机制提供了深入的见解。为此 因此,Shuttle Pharma选择SP—2—225作为临床前开发的候选先导HDAC抑制剂。我们已经签约 与乔治敦大学的研究人员一起进行动物放射治疗后免疫激活的临床前研究 肿瘤模型已经提交了关于推进药品生产和IND扶持研究的提案申请,目前正在审查 以使药物开发到2024年的I期临床试验。随着检查点抑制剂的引入,CAR—T疗法 以及癌症中的个性化药物,RT后的免疫应答的调节具有重要的临床和商业意义。 | |
| ● | SP—1—303 是Shuttle Pharma的临床前选择性I类HDAC抑制剂,优先影响组蛋白脱乙酰酶 HDAC1和HDAC3属于I类HDAC酶家族的成员。SP—1—303数据显示ER阳性乳腺中的直接细胞毒性 癌细胞此外,SP—1—303增加PD—L1表达。报告已完成临床前体外研究的手稿为 在准备中我们计划寻求合作,在2024年完成SP—1—303临床前开发。 |
我们的 方法
我们 相信我们已经在辐射增敏剂的发现和开发方面确立了领先地位。经过大约七年的研究,我们确定了两种临床阶段候选产品,并使用我们专有的 平台技术发现了新的临床前分子,以提高接受放射治疗实体肿瘤的患者的治疗指数。我们的发展战略有四个关键支柱:(1)通过证明接受放射治疗的患者的无病存活率提高了RT的效率,(2)减少良好的肿瘤反应所需的辐射量,从而限制 与辐射相关的对健康细胞的潜在毒性,(3)减少移除癌症和提高生活质量所需的手术范围, 和(4)利用我们的下一代技术来创造调节免疫反应的药物,以协助免疫检查点和CAR-T 疗法和其他针对癌症的个性化药物。
我们 建议进行第一阶段和第二阶段临床试验,以推进我们的临床候选产品。此外,候选HDAC抑制剂 分子将在动物模型中进行测试,并将进行启用IND的研究,为I期临床试验做准备。
| 6 |
到目前为止,我们已经从美国国家卫生研究院获得了三份SBIR合同,以:
| ● | 开发IPdR作为治疗胃肠癌的放射增敏剂,与放射治疗相结合。这笔资金为罗比多尿苷和RT的I期临床试验提供了部分支持。 | |
| ● | 开发 来自非洲裔美国男性的前列腺癌细胞培养物,与供体匹配的正常前列腺细胞,建立了50对加速 研究减少非洲裔美国男性前列腺癌的健康差异。该项目由"Moonshot"资助 并且Shuttle Pharma有资格提交额外的SBIR(第IIb期)资金申请,以建立基础设施 为了研究目的扩大和分配细胞。非洲裔美国患者的细胞分发给研究人员 他们正在进行健康差异研究。 | |
| ● | 开发 用于确定用SBRT治疗后前列腺癌患者的结局的预测性生物标志物。该SBIR资助的项目 已于2022年3月15日完成,Shuttle Pharma有资格通过SBIR(第IIb期)机制申请额外资金 IIb期SBIR赠款机制旨在降低临床验证的风险,以开发预测性生物标志物以实现商业化。 Shuttle Pharma已从乔治敦大学获得前列腺癌预测生物标志物检测知识产权的授权 并将寻求公共市场的额外投资,以通过其Shuttle Diagnostics实体推进临床开发。 |
SBIR资助的所有三个项目均已完成。该公司有资格申请SBIR第二阶段资金,以“弥合”资金缺口 如果Shuttle Pharma选择推进“Moonshot”健康差距或预测生物标志物项目。 NIH SBIR计划旨在鼓励小型企业从事具有商业化潜力的联邦研究/研发(“R/R&D”) 。
我们的 战略
我们的目标是保持和巩固我们在辐射敏化方面的领导地位。我们计划开发罗匹多尿苷和HDAC6抑制剂(SP-2-225),如果FDA批准,我们的候选产品将用于治疗癌症。虽然这一过程可能需要数年时间才能完成,但我们相信,实现这一目标可能会产生新的辐射增敏剂和免疫疗法产品。我们战略的关键元素 包括:
| ● | 大写 Ropidoxuridine作为口服小分子辐射增敏剂。迄今为止,有一种药物(西妥昔单抗,单克隆 抗体)被FDA专门批准作为辐射敏化剂。如果我们成功开发罗哌多尿苷并获得 FDA批准后,小分子敏化剂将用于放射敏化适应症的临床应用。 | |
| ● | 扩大我们在辐射敏感剂领域的领导地位。除了我们传统的辐射敏感剂外,我们还计划推进我们的近期流水线,以包括用于质子治疗的辐射敏感剂。质子治疗作为放射治疗的一种形式,由于其独特的束流整形特性,正在全球范围内发展壮大。因此,这项新技术为Shuttle Pharma 努力开发一种创新的、耐受性良好的质子治疗敏化药物提供了一个重大机遇。 | |
| ● | 执行 严格的业务发展战略,以加强我们的候选产品组合。我们已经构建了当前产品 通过内部发现、开发、与领先学术机构的伙伴关系以及通过内部许可进行管道。我们会 继续评估与领先学术机构和其他生物技术的新的许可机会和合作协议 围绕那些寻求解决高未满足需求领域且我们认为临床可能性很高的项目的公司 成功,包括超出我们目标特许经营领域和当前技术足迹的项目。 |
| ● | 投资 在我们的HDAC平台技术中,并最大限度地提高其在癌症治疗中的效用。我们最初正在应用该平台来开发 用于癌症放射增敏、正常组织放射防护和放射后免疫刺激的药物。基于 我们目前所获得的数据,这些药物是免疫调节的。我们打算投资开发平台的其他属性 技术,也。 | |
| ● | 将 加入协作,充分发挥我们平台的潜力。我们HDAC技术平台的广度支持其他治疗应用,包括辐射增敏和免疫治疗。我们打算以我们的 平台为中心寻求合作,以最大限度地应用于癌症治疗。 |
| 7 |
放射治疗
放射 肿瘤学家使用放射疗法(RT)治疗无法通过手术完全切除但尚未扩散到人体内较远部位的癌症。半个多世纪以来,RT一直是治疗癌症恶性肿瘤的主要手段。放射治疗和化疗相结合的治疗包括使用细胞毒药物、靶向生物制剂和靶向外照射,以增加对肿瘤细胞的破坏,治愈或延缓癌症进展。作为辐射增敏剂正在研究的药物和生物制剂的数量很少,这突显了对新方法和制剂的需求尚未得到满足,这些方法和制剂能够为患者提供更有效、更高质量和更好的耐受性。
目前,头颈部、食道癌、肺癌、胃癌、乳腺癌、脑癌、胰腺癌、直肠癌和子宫颈癌都采用了“化疗”疗法。与周围正常组织相比,理想的放射增敏剂应该以适当的浓度到达肿瘤,并在肿瘤中选择性地发挥作用。它将具有可预测的放射治疗时机的药代动力学,并且可以在每种放射治疗方法中给药。理想的辐射增敏剂应具有最小的毒性或可管理地增强辐射毒性。
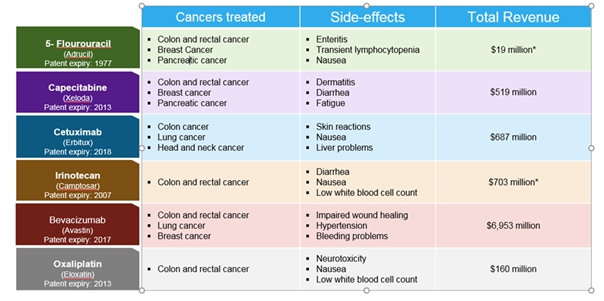
美国辐射增敏剂市场正在经历动态增长,原因是新辐射技术的发展、新试剂的推出、各种癌症确诊患者数量的增加以及治疗模式的改变。已经推出了新的药物,包括贝伐单抗(阿瓦斯丁®,罗氏),帕尼图单抗(Vectibix®,安进),替莫唑胺(Temodar®,默克) 和西妥昔单抗(艾比妥®,礼来/艾美力),有可能作为辐射增敏剂(尽管除西妥昔单抗外,所有药物都在标签外使用);所有这些药物都被NCCN®(国家综合癌症网络)推荐在临床实践指南中与已有的疗法联合使用,如FOLFOX(亚叶酸,5-Fu,奥沙利铂),CapeOX(卡培,奥沙利铂)和FOLFIRI(亚叶酸钙,5-Fu,伊立替康)。
癌症患者数量的增长受到人口老龄化和诊断工具改进的推动。根据 国家癌症研究所(NCI)的数据,超过一半(~50—60%)的癌症患者在治疗过程中接受了某种类型的放疗 。美国治疗放射学和肿瘤学会(ASTRO)的资料说明书显示,每年约125万癌症患者中约有67%接受一次或多次的放射治疗。此外,在2016年《临床肿瘤学杂志》发表的一项研究中,估计未来10年内,需要放射治疗的癌症患者数量将增加22%。(参见“2010年至2020年美国放射肿瘤学的未来:供应与需求保持同步吗?”本杰明·D Smith,Bruce G. Haffty,Lynn D. Grace L. Wilson,Grace L. Smith,Akshar N. Patel和Thomas A. Buchholz Journal of Clinical Oncology 2010 28:35,5160—5165)。
美国临床肿瘤学会(ASCO)估计,美国80%以上的癌症发生在50岁及以上的人群中,60%以上的癌症发生在65岁及以上的人群中。(看见,2018年临床癌症进展报告,美国临床肿瘤学会,2018年)。例如,根据美国癌症协会(ACS),超过90%的结直肠癌患者是50岁及以上的个体,所有病例的大约40%发生在75岁及以上的患者中。结肠癌联盟估计,90%的结直肠癌新发病例和95%的死亡病例发生在50岁或以上的人群中。此外,美国人口普查(U.S. Census)估计,65—84岁的年龄组在未来五年内将增长23%,这表明美国癌症患者的总数可能会增加 。
| 8 |
下表详细列出了2024年美国估计的癌症数量:
估计美国新增癌症病例
| 男性 | 女性 | |||||||||||||||||
| 前列腺 | 299,010 | 27 | % | 乳腺 | 310,720 | 31 | % | |||||||||||
| 肺和支气管壁 | 116,310 | 12 | % | 肺和支气管壁 | 118,270 | 13 | % | |||||||||||
| 冒号 和直肠 | 81,540 | 8 | % | 冒号 和直肠 | 71,270 | 8 | % | |||||||||||
| 尿 膀胱 | 118,330 | 6 | % | 子宫体体 | 67,880 | 7 | % | |||||||||||
| 皮肤黑色素瘤 | 59,170 | 6 | % | 皮肤黑色素瘤 | 41,470 | 5 | % | |||||||||||
| 肾 和肾盆 | 52,380 | 5 | % | 甲状腺 | 31,520 | 3 | % | |||||||||||
| 非霍奇金淋巴瘤 | 44,590 | 4 | % | 非霍奇金淋巴瘤 | 36,030 | 4 | % | |||||||||||
| 口腔和咽部 | 41,510 | 4 | % | 肾 和肾盆 | 29,230 | 3 | % | |||||||||||
| 白血病 | 36,450 | 4 | % | 胰腺 | 31,910 | 3 | % | |||||||||||
| 胰腺 | 34,530 | 3 | % | 白血病 | 26,320 | 3 | % | |||||||||||
| 全部 网站 | 983,160 | 全部 网站 | 934,870 | |||||||||||||||
ACS 事实与数据,2024年
美国估计的对放射治疗有反应的癌症患者的发病率、死亡率和五年生存率是显著的(ACS Facts & Figures,2024)。根据新诊断患者的数量,显示了对辐射有反应的最多的癌症。在美国,某些癌症的发病率 以每年约1—2%的速度增长。由于人口老龄化和诊断技术的改进,新诊断患者的数量相当可观, 并在增长。
上面列出的 癌症说明了辐射增敏剂的机会。值得注意的是胰腺癌、脑癌、肺癌和食管癌的五年存活率很低,这些癌症都是航天飞机制药公司生产的辐射增敏化合物的候选产品。存活率低的癌症 值得关注,因为它们显示出对新疗法的高度未满足的需求,并且Shuttle Pharma 有机会获得大量吸收其管道化合物。
存在挑战并可能限制辐射增敏剂市场增长的因素 包括许多 具有辐射增敏特性的新型制剂的安全性和耐受性;导致对临床实践问题进行更高水平审查的监管环境 ;新型制剂的高成本;以及通过 CMS(医疗保险和医疗补助服务中心)和私人支付方在放射肿瘤学中不断变化(且限制性更强)的报销环境。这些因素可能会对 美国市场的增长潜力产生负面影响。
许多在标签外用作辐射敏感剂的药物 目前需要仔细检查其潜在的副作用 ,这些副作用可能会影响患者使用这些药物的安全性和耐受性。目前所有的药物都有很大的潜在副作用,可能会影响患者的治疗和生活质量。辐射增敏剂可引起患者的急性和慢性副作用。副作用因人而异,取决于年龄、性别、癌症类型、每天给药剂量、给药总剂量以及患者的一般医疗状况。目前使用的辐射增敏剂的一些常见副作用包括: 白细胞减少、皮肤损伤、脱发、疲劳、膀胱问题、恶心、纤维化、记忆力丧失、不孕不育,以及罹患第二次癌症的风险增加 这可能是由于治疗中使用的细胞毒性药物导致患者免疫系统减弱而引起的,或者 当较新的生物制剂导致特定细胞因子或蛋白质产生过量而导致继发性癌症的时候。
在过去的五年里,FDA对肿瘤治疗的新药物的批准采取了越来越保守的方法。关于新药物的无进展存活率、总体存活率以及安全性和耐受性的临床试验结果受到了更严格的审查。与前五年相比,黑盒警告和REMS(风险评估和迁移策略)等限制在过去五年应用于更多 新产品。这些限制要求医生在评估较新代理和较新诊断工具的使用时更加谨慎,以便为较新批准的代理选择最合适的患者。
许多新药物是分子靶向治疗,在其开发和生产过程中是生物的。较新 代理的成本可能很高。例如,根据美国的一位关键意见领袖(Carl Schmidt,顾问,Shuttle Pharmaceuticals Holdings,Inc.,2018年商业计划)。 最近,诺华公司推出了一种CAR—T基因疗法,年成本为47.5万美元。此外,由于许多私人支付者仔细审查 新药物的成本和适当使用,他们要求医生通过事先授权请求、使用 阶梯疗法和指南来提供理由,这些指南延迟了治疗、增加了行政成本并限制了医生和 医院的治疗选择。
| 9 |
公共 CMS等放射肿瘤治疗的付款人已经制定了报销减免,这可能会影响治疗的总成本 ,并可能限制对新代理的接受。随着CMS宣布减少放射肿瘤学的报销, 寻找副作用更少、成本效益更高的更有效的辐射增敏剂的压力越来越大。
不断上升的医疗支出增加了政府和商业支付者控制药品成本的压力。虽然肿瘤学领域可以说不像其他治疗领域那样由支付者严格管理,但昂贵的癌症治疗药物的使用管理已成为美国支付者日益 优先考虑的问题,特别是随着生物制剂的出现。付款人(和欧盟的市场准入机构)通常会限制 高成本药物、生存福利有限或没有生存利益的药物,以及被认为具有高风险的药物,以便在标签外广泛使用。
除了 保险公司在成本控制方面的努力(通常要求患者先获得成本较低的药物以确定有效性 ,然后才允许报销更昂贵(或成本效益较低)的药物)外,支付方还希望实施 临床路径,以保持或改善健康结果,同时降低成本。临床路径旨在解决 事先授权和降低费用计划的局限性,为支付者提供更持久的成本控制。这些途径可以 通过鼓励使用仿制药、简化治疗选择以及在维持 结果的同时减少副作用,从而节省成本。
经工程设计的辐射敏感剂
所选癌症类型的辐射敏感剂市场是由改善局部和区域肿瘤控制的需要决定的。已经开发了治疗方案,以满足患者对肿瘤控制和生活质量的需求。由于Ropidoxuridine和选择性HDAC抑制剂的最初应用是辐射敏感型癌症治疗标准的补充,市场上未得到满足的需求在于以下方面的潜力:
| ● | 与目前使用的“标签外”增敏药物相比,放射治疗疗效的改善 取决于总体存活率、无进展存活率和应答率。 | |
| ● | 减少所需的辐射剂量以影响患者的积极临床反应。 | |
| ● | 切除残留癌所需的手术范围内的减少量。 | |
| ● | 生活质量结果的改善。 |
各种消息来源估计,美国有超过80万名癌症患者正在接受放射治疗。根据美国癌症协会的数据,大约50%的人接受治疗是为了治疗,其余的人是为了姑息治疗。辐射增敏剂的市场机会在于接受治疗的40万名患者。未来五年,接受RT治疗的患者数量预计将增长22%以上。根据每名患者12,000美元的辐射致敏品牌药物 Treatment(此时未贴标签)的粗略估计,市场规模将超过40亿美元。这将占美国每年癌症护理费用的4%。
在过去二十年中,肿瘤学领域的发展导致上市的具有辐射增敏特性的产品的临床试验数量有所增加。以下是最近批准的具有辐射增敏特性的产品的几个例子:拓扑替康(Hycamtin®)被批准用于卵巢癌和小细胞肺癌,当与顺铂联合使用时,也被批准用于宫颈癌。伊立替康(Camptosar®)用于治疗转移性结直肠癌,曲妥珠单抗(Herceposn®) 用于乳腺癌,吉非替尼(易瑞沙®)用于局部晚期非小细胞肺癌。然而,关于辐射增敏的声明 在科学文献中只是轶事。
| 10 |
此外,临床试验正在进行中,以开发新的分子(例如聚腺苷二磷酸核糖聚合酶(PARP)抑制剂(如Lynparza(Olaparib)、组蛋白脱乙酰酶(HDAC)抑制剂(如佐林扎®(伏立诺)和热休克蛋白90(HSP90)抑制剂 ),以增加具有辐射敏感性的化合物对其他癌症的治疗用途。几种具有辐射增敏特性的药物目前正处于第三阶段临床试验,例如尼莫拉唑(用于头颈部癌症)、莫特沙芬 Gd(用于脑转移)和顺铂(用于宫颈癌);尽管没有一种药物可能向FDA申请放射增敏声明 ,因为其临床试验中的放射增敏元素不是主要终点。虽然预计未来将推出更多具有辐射增敏特性的药物,从而进一步推动辐射增敏剂市场,但到目前为止, 没有迹象表明任何正在开发的药物有望被专门批准作为辐射增敏剂。
实体肿瘤“标签外”放射增敏剂的竞争环境预计将成为主要的通用环境。阿瓦斯丁、Erbitux、Camptosar和希罗达在未来三年已经或将失去专利保护。正在研究或批准的较新产品,如安进公司生产的Vectibix®(Panitumumab),将被宣传为具有辐射增敏特性,以及治疗特定癌症的适应症 。与目前的护理标准相比,这些新疗法的高昂成本加上有限的疗效将受到公共和私人支付者的限制。其他新的代理商正在开发中,但将面临类似的挑战。
我们 预计,在新产品进入癌症市场之前,新产品的有效性、质量和耐受性将受到限制,直到它们被添加到已建立的临床路径和指南中为止。如果FDA确定它们的有效性、质量和耐受性在临床上得到证明,预计国家癌症综合网络(NCCN)--治疗指南的肿瘤学药物评估的领先权威机构--将在推出后大约6到12个月内发布建议 和增加护理标准。NCCN的推荐将对新产品进入市场的增长潜力产生积极影响。此外,支付人,无论是公共的还是私人的,都将把新产品添加到他们的 批准的药品清单中,并向报销提供者提供激励,鼓励他们将该产品用作标准护理的新辅助和辅助治疗 。
与许多癌症治疗方法一样,副作用通常会对生活质量产生明显影响,并影响市场增长潜力。 患者在选择合适的治疗方法和治疗癌症的成本的决策过程中越来越有发言权。 随着支付者越来越多地将更多的治疗成本的经济负担直接放在患者身上,患者向他们的医生和支付者表达他们的意见,这对选择哪些产品有直接影响。目前的许多疗法都有明显的副作用:
私营保险公司预计将拥有更严格的处方和医疗福利,预计患者将承担更多的药品成本负担。此外,预计私人付款人将更多地应用第三方开发的治疗指南,例如来自NCCN(国家综合癌症网络)的指南,通过事先授权和实施分步治疗或增加自付费用的方法,限制特定情况下获得产品的机会。由于目前用作辐射增敏剂的许多药物价格昂贵,且未被批准用作辐射增敏剂(因此,此类治疗 是“标签外”),而临床试验中的许多产品预计将处于当前或更高的价格水平, 可能被特别批准为唯一批准的辐射增敏剂的新产品将增加 报销的考虑。
CMS 越来越多地通过Medicare Advantage和ACO将许多患者转移到私人保险。Medicare Advantage计划是通过私人保险公司向Medicare患者提供的按人头计算的HMO和PPO计划。ACO正在开发中,以提高其患者的护理质量。大多数新的ACO最初定位于医疗保险患者,有400多人获得CMS批准。来自健康战略中心(2017)、《美国医学会杂志》(Journal Of American Medical Association)2018年和布鲁金斯学会(Brookings Institute)2015年的多项研究估计,用于医疗保险和非医疗保险患者群体的近1000个ACO将获得CMS的批准或由各种医疗保健实体 开发,以便在2017年开始在ACA下运营。我们预计,无论未来ACA可能发生什么变化,ACO的增长都将持续。2017年初,追踪ACO的杂志《健康事务》估计,超过2200万患者参加了联邦医疗保险和私人ACO。为了解决CMS指定的护理质量措施并获得额外的激励,预计将越来越多地使用临床路径或治疗指南来管理患者护理。在这种环境下,如果新产品是一流的,并被包括在NCCN等组织的国家指南中和/或获得区域CMS合同小组的批准,那么在这种环境下对新产品的采用可能会产生深远的影响。
| 11 |
罗比索尿定
卤代胸腺嘧啶核苷(TDR)类似物,溴脱氧尿苷(BUDR)和碘脱氧尿苷(IUdR),是一类自20世纪60年代初以来被公认为有效的放射增敏剂的嘧啶类似物。(看见金塞拉TJ.人类肿瘤放射增敏的研究进展癌症科学杂志Am1996年7-8月:2(4);184-193)。它们的细胞摄取和代谢依赖于TDR挽救途径,在该途径中,它们最初被限速酶胸苷激酶(TK)磷酸化为单磷酸衍生物。(参见 谢瓦赫DS,劳伦斯TS。抗代谢放射增敏剂。J·克莱恩·奥科尔2007年9月10日;25(26):4043-4050)。在顺序磷酸化为三磷酸后,它们被DNA聚合酶用于DNA复制,与脱氧胸苷三磷酸(DTTP)竞争。DNA的掺入是卤代胸腺嘧啶核苷类似物对人体肿瘤放射增敏的前提条件,其放射增敏程度与DNA中胸腺嘧啶脱氧核苷的置换百分率直接相关。(看见[2]Lawrence TS,Davis MA,Maybaum J,Stetson PL,Ensminger WD. 卤代嘧啶的掺入和放射增敏与药物暴露时间的关系国际放射肿瘤学、生物学、物理学杂志。1990年6月;第18(6);1393-1398)。放射增敏的分子机制很可能是TDR类似物取代的DNA对电离辐射(IR)产生高活性尿嘧啶自由基的敏感性增加的结果,这也可能是对未被取代的互补链DNA造成损伤的结果。IR损伤的修复也可以通过在IR前暴露于这些类似物而减少。
使用Ropidoxuridine作为辐射增敏剂的理由是基于先前对活性代谢物IUdR的临床研究;在NIH实验室中确认 是一种有效的辐射增敏剂。罗比多尿苷是宫内发育迟缓的口服前药。在体内,罗比多尿苷在肝脏中代谢成IUdR。IUdR被整合到活跃生长的细胞的DNA中,当细胞暴露在电离辐射下时,会产生DNA链断裂,导致更多的细胞死亡和辐射增敏。(看见首页--期刊主要分类--期刊细介绍--期刊题录与文摘--期刊详细文摘内容DNA错配修复对细胞周期动力学和碘脱氧尿苷-DNA掺入影响的概率模型。《癌症研究》2007年11月15日;67(22):10993-11000)。
大多数临床疗效数据来自美国国立卫生研究院支持的研究,这些研究使用的是洛比多尿苷的活性代谢物IUdR。然而,IUdR需要持续输注超过六周的治疗,这给患者带来了严重的依从性问题。罗比多尿苷可作为胶囊口服给药,从而更容易给药,潜在地改善依从性 并减少并发症。
在过去的20年里,这些卤代TDR类似物作为实验性辐射增敏剂在选定的癌症患者群体中重新引起了人们的兴趣。这些类似物在啮齿动物和人类体内都能迅速代谢,主要是随着脱氧核糖的裂解和随后的肝脏和肝外代谢的脱卤化,当与See Fowler JF,Kinsella TJ的血浆半衰期一起团注时。S相敏剂对肿瘤的极限放射增敏作用。Br J癌症。1996年;74(补充)(27):294-296)。在放射治疗(RT)之前和期间使用长时间连续或重复间断静脉注射BUDR或IUdR的I期和II期试验主要集中在高级别脑肿瘤的患者身上。 这些临床上耐受辐射的肿瘤可以具有快速的增殖率(潜在的肿瘤倍增时间为5-15天),并且 周围是非增殖的正常脑组织,几乎没有TDR类似物的DNA掺入。因此,高级别脑肿瘤是这种放射增敏方法的理想靶点。在I期/II期临床试验中,间变性星形细胞瘤患者和多形性胶质母细胞瘤患者持续静脉输注(1000 mg/m)相比,存活时间延长。2/天/14天),共39名患者(F.Sullivan等人InJ Radiat Onol Biol Phys.1994年; 30(3):583-90。根据其他I/II期临床试验的结果,建议将这些卤化TDR类似物用于其他类型的低反应(辐射抵抗)癌症,包括局部晚期宫颈癌、头颈癌、无法切除的结直肠癌肝转移和局部晚期肉瘤,从而在临床放射增敏方面取得疗效。
靶标:胶质母细胞瘤、肉瘤和直肠癌
在Ropidoxuridine和RT治疗晚期GI癌症的I期临床试验完成后,我们提议对脑肿瘤(胶质母细胞瘤)、软组织肉瘤和直肠癌进行II期疗效临床试验。多形性胶质母细胞瘤是一种致命的脑部恶性肿瘤,目前尚无治愈方法。放射治疗可以延缓疾病进展,是手术切除或活组织检查后的标准护理。放射治疗与泰莫达相结合,泰莫达是一种在治疗脑肿瘤方面显示出活性(约四个月存活益处)的药物。初步数据显示,联合使用放射治疗和IUdR可使疾病进展延迟长达6个月。 我们建议在第二阶段临床试验中联合使用放射治疗测试IPdR。同样,在IUdR和RT联合治疗肉瘤后,也观察到了疾病进展的延迟。根据我们临床试验的I期数据,我们知道IUdR的治疗水平是通过口服前药IPdR来达到的。
| 12 |
临床数据
分包商在2018年11月举行的第30届EORTC-NCI-AACR研讨会上和2019年医学杂志《临床癌症研究》上报告了由Shuttle Pharma的SBIR合同和布朗大学肿瘤学 小组(BrUOG)的分包合同支持的临床试验的I期结果。18名患者完成了剂量升级至1800毫克/天,持续30天,建立了结合RT的最大耐受剂量(MTD)为1,200毫克/天。治疗后IUdR血药浓度达到治疗水平。4例患者部分缓解,9例病情稳定,1例靶病变进展。这些数据支持将IPdR和RT推进到FDA的临床试验中,以确定疗效。
开发 计划
推动Ropidoxuridine产品向前发展的关键是制定临床计划,该计划具有积极的时间表,并在放射肿瘤学社区内提供支持,以便与适当的患者一起参与临床试验,以确保每种产品的全面NDA档案 。最初,该计划的重点是第一阶段和第二阶段的临床试验。在第二阶段研究完成后,我们 将决定是将第二阶段研究扩展到随机第二阶段,还是进行随机第三阶段临床试验。这样的确定将基于初始临床试验的结果和与FDA的第二阶段会议结束。Shuble PharmPharmticals 申请并获得FDA的孤儿药物Ropidoxuridine作为治疗胶质母细胞瘤的临床放射增敏剂和软组织肉瘤的术前治疗。因此,罗哌酸尿苷与RT联合治疗胶质母细胞瘤的“孤儿”申请已经获得批准。然而,肉瘤的申请没有得到批准,需要解决FDA的某些意见和重新提交。IPdR/TPI制定的临床计划将侧重于可切除的II期和III期直肠癌患者。
到目前为止,我们已实施的罗比多尿苷开发临床计划包括:
| ● | GMP 用于临床试验的24公斤罗比多尿苷的制造和配方已经完成。 | |
| ● | 罗比多尿苷和RT治疗胶质母细胞瘤的II期临床试验的IND已被批准进行这项研究。 | |
| ● | 与合同研究组织(CRO)合作,Theradex Oncology已被聘用协助进行II期临床试验。 | |
| ● | 完成 胶质母细胞瘤II期临床试验,以确定治疗的适当剂量、有效性和耐受性。 |
从NIH/NCI SBIR资助的I期临床试验中获得的 数据支持了筹集资金以进行罗哌尿苷II期 临床试验的努力。我们的目标是开展并完成II期临床试验,以便我们可以向FDA提交数据 ,以确定疗效。我们相信,这将支持我们筹集额外所需资金以完成II期,为III期临床试验提供资金,并寻求FDA批准具有"孤儿"名称的NDA。
IPdR/TPI制剂的 临床计划将侧重于可切除的II期和III期直肠癌患者以及接受质子疗法治疗的复发性胶质母细胞瘤 。然而,我们不能保证成功完成任何这些审判。如果我们无法达到II期或III期临床试验中的任何上述里程碑,将导致我们无法继续进行目前的 工作,并可能导致我们无法筹集额外资金。
| 13 |
我们的HDAC小分子输送平台
一般信息
自Shuttle Pharma成立以来,我们的发现研发工作一直专注于我们的小分子技术交付 平台,该平台使用针对癌细胞的HDAC抑制剂,同时保护健康组织。
HDAC是一类通过组蛋白和非组蛋白的化学修饰来调节基因表达的酶。HDAC活性增加导致染色质(由DNA和其他蛋白质组成的蛋白质复合体)更加浓缩,基因表达减少,关键基因产物丢失,包括肿瘤抑制基因功能。抑制HDAC活性导致染色质更加开放,关键基因产物的表达增加。这种染色质修饰是表观遗传细胞调控系统的基础,也是一个深入研究的领域。
到目前为止,我们的研究和开发工作主要集中在发现新的双功能分子,作为癌症的辐射敏感剂、正常组织的保护剂和对受辐射的癌细胞表达的抗原的免疫反应的激活剂,在癌症治疗中具有潜在的用途。到目前为止,我们已经生产了三个候选分子:
| ● | SP-1-161, 这是一种候选先导化合物,可激活ATM基因产物(在共济失调-毛细血管扩张症中突变)。共济失调-毛细血管扩张症是一种以神经系统、免疫学和放射生物学临床特征为特征的人类遗传病。 | |
| ● | SP-2-225, 显示第二类(HDAC6)选择性抑制的化合物的候选先导。HDAC6是巨噬细胞将抗原呈递给T淋巴细胞所必需的分子。 | |
| ● | SP-1-303是一种候选的I类HDAC抑制剂,对ER阳性肿瘤有优先疗效。 |
SP—1—161 - 双功能代理
SP-1-161是羟甲酸类化合物的HDAC抑制剂和吲哚类化合物的ATM激活剂。HDAC修饰组蛋白和非组蛋白,它们是染色质结构、基因表达调控和细胞生长的关键成分。HDAC抑制剂 抑制细胞增殖、血管生成和免疫。已鉴定出18种人类HDAC,根据序列和功能同源性将其细分为四类。在癌细胞中,HDAC活性沉默了对细胞生长调节和染色体不稳定至关重要的肿瘤抑制基因。HDAC活性的异常还与肿瘤细胞的生长、侵袭、转移和对治疗的耐药性有关。因此,HDACs的抑制剂作为抗癌药物应运而生。伏立诺和罗米地辛已被FDA批准用于治疗复发或难治性T细胞淋巴瘤。此外,帕诺比坦还获得了FDA的批准,用于与硼替佐米和地塞米松联合治疗复发性多发性骨髓瘤。
在临床前研究中,SP-1-161抑制了PAN-HDAC的活性,并激活了ATM基因产物。在正常细胞中,ATM是激活细胞应激反应以使细胞从辐射暴露中恢复的关键蛋白,但在癌细胞中不是。ATM激活被称为“基因组守护者”的P53蛋白,并作为肿瘤抑制因子,对正常细胞功能和激活癌细胞中的程序性细胞死亡至关重要。
在 临床前研究中,SP—1—161在暴露于电离辐射后保护正常乳腺上皮细胞(184A1),同时增加 乳腺癌细胞(MCF7)的敏感性。SP—1—161在单个分子中提供了这种双重功能,并且该分子通过治疗癌症同时保护正常细胞而与其他HDAC抑制剂区分开来 。(看见Grindrod S,Brown M,Jung M. "双功能小分子作为癌症研究治疗剂的开发",海报展示#A178,美国癌症研究协会2017年10月)。
| 14 |
SP-2-225
SP—2—225是一种选择性HDAC抑制剂,影响组蛋白脱乙酰酶(HDAC 6),是IIb类HDAC家族的成员。II类HDAC在癌症运动、侵袭、神经疾病和免疫检查点中发挥重要作用。HDAC 6抑制在血液学癌症治疗中的作用得到了最广泛的研究 。HDAC 6在HDAC酶中是独特的,因为它具有两个活性催化结构域 和独特的生理功能。除了修饰组蛋白外,HDAC 6靶向特定底物,包括α—微管蛋白 和HSP 90,并参与蛋白质运输和降解、细胞形状和迁移。选择性HDAC 6抑制剂是一类新兴的药物,因为HDAC 6参与了神经退行性疾病、癌症和免疫学相关的通路。具体而言, 其影响免疫系统调节和增强癌症免疫反应的潜力引起了极大的兴趣。随着 检查点抑制剂、CAR—T疗法和癌症个体化药物的引入,对这种疗法的免疫应答的调节 具有重大的临床和商业利益。(See Noonepalle SKR,Grindrod S,Aghdam N,Li X,Gracia—Hernandez M,Zevalos—Delgado C,Jung M,Villagra A,Dritschilo A.选择性HDAC6抑制增强放射治疗诱导的免疫应答。Mol Cancer Ther 2023年12月1日;22(12):1376—1389. doi:10.1158/1535—7163。
选择性抑制HCAC6可减少与非选择性HDAC抑制剂相关的剂量限制副作用。选择性HDAC6抑制剂可与其他细胞毒药物联合使用。航天飞机发现的选择性HDAC抑制剂已经产生了几个选择性HDAC6候选分子,包括SP-2-225。HDAC6抑制剂在多发性骨髓瘤等疾病的治疗中的作用正在研究中。
SP—1—303 - 目标适应症:乳腺癌
组蛋白 脱乙酰酶抑制剂使癌症对辐射的影响敏感,保护正常组织免受辐射损伤并激活免疫 系统。SP—1—303是一种选择性I类HDAC抑制剂,可抑制HDAC 1、3和6,并在ER阳性乳腺癌细胞中具有直接细胞毒性 。此外,SP—1—303以时间依赖性方式增加PD—L1表达水平,支持SP—1—303与免疫检查点阻断剂联合使用以增强治疗益处。我们目前正在对这些 分子进行临床前疗效研究。
开发 计划
候选分子的HDAC抑制剂平台将需要进行临床前评估,完成启用IND的研究,并将在第一阶段临床试验中测试候选药物的药代动力学和MTD。我们有三个潜在的候选治疗实体肿瘤,包括乳腺癌、肺癌和多发性骨髓瘤。
第一阶段和第二阶段临床试验的结果将决定进一步的药物开发,Shuttle将寻求与其他制药公司建立合作伙伴关系,以完成我们候选产品的临床前和临床开发、药物制造和营销 。如果我们在任何阶段都未能成功完成临床试验,或者如果我们获得了 阴性结果,我们很可能无法筹集与我们的HDAC研究相关的额外资金,或者将不得不改变 我们关于候选分子的HDAC抑制剂平台的研究方向。
我们的 制造战略
我们 没有由我们拥有或运营的生产设施。我们在马里兰州盖瑟斯堡的研究 实验室进行了实验室规模的合成和测试。API、药物制剂和人用制剂的GMP合成将根据与第三方生产商的合同 进行。
| 15 |
战略性 协议
我们 与学术机构就获取知识产权、核心设施和合同关系等资源制定了重要的战略协议。此外,我们还与Propagenix就知识产权入版许可达成了协议。 我们目前和正在进行的合作包括:
| ● | 乔治敦大学 |
| ○ | 分包商 SBIR支持的非裔美国人前列腺癌患者健康差异项目(已完成)。条件重编程 细胞(CRC)技术是乔治敦大学发明的,乔治敦大学拥有知识产权。Propagenix 拥有乔治敦大学的CRC技术知识产权许可证。知识产权 乔治城大学研究所的非裔美国人患者的细胞属于穿梭制药公司。 根据我们与亚马逊的分许可协议。 | |
| ○ | SBIR支持的代谢预测生物标记物项目的分包商 (已完成)。代谢生物标记物知识产权属于乔治敦大学,Shuttle Pharma拥有授权知识产权的独家选择权。 | |
| 独占 与乔治敦大学签订的许可协议,乔治敦大学同意对知识产权进行许可 被称为"放射治疗不良反应的预测生物标志物"(美国专利申请号17/476,184,提交 2021年9月15日)(“专利权”),由公司首席执行官Anatoly Dritschilo博士开发 执行官,公司首席科学家Scott Grindrod博士,员工Amrita Cheema博士和Yaoxiang Li博士 乔治敦大学的专利权将在全球范围内供公司使用。 | ||
| 穿梭机 制药公司与乔治敦大学签订了一项研究协议(“研究协议”),以测试小分子 Shuttle Pharma在细胞和动物异种移植物中发现和开发的辐射增敏剂和免疫激活候选物 模型 | ||
| ○ | 在 在研究协议的同时,Shuttle Pharma还签署了一份材料转移协议(“MTA”), 2023年3月21日,乔治敦大学。根据MTA,Shuttle Pharma同意转让候选人的研究数量 乔治敦大学的药物分子,乔治敦大学将仅使用这些材料进行额外研究 以及哪些材料应始终归Shuttle Pharma所有。 |
| ● | 布朗大学 |
| ○ | SBIR的分包商 支持IPdR和RT的I期临床试验(完成)。 |
| ● | 弗吉尼亚大学 |
| ○ | 研究 合作开发用于质子辐射敏化应用的重氧分子。 |
| ● | 乔治·华盛顿大学 |
| ○ | 用于在免疫模型系统中测试HDAC抑制剂效果的材料转让协议 | |
| ○ | 保护我们的HDAC抑制剂知识产权的材料转让协议是与乔治华盛顿大学签订的,转让 用于研究目的的药物,并共享出版物的作者身份。不存在与此类活动有关的资金转移。 |
| ● | Propagenix, Inc. |
| ○ | 许可证 “有条件重新编程单元”(CRC)技术协议。由Shuttle Pharma科学家在乔治城大学建立的细胞属于我们,根据Propagenix,Inc.的子许可。已向 Propagenix支付了25,000美元的预付许可费。未来没有其他里程碑或与Propagenix协议相关的特许权使用费欠款。 |
| 16 |
竞争 “标签外”使用
具有辐射敏感性的药物 。
我们的 候选产品
我们正在推进临床阶段的候选产品罗比多尿苷,我们相信当与RT联合使用时,它将靶向癌细胞,同时保护健康组织 。
罗哌多尿苷
罗哌多尿苷是一种口服卤代嘧啶,具有很强的癌症辐射增敏特性,是我们的主要"临床阶段" 候选产品。卤代嘧啶通过快速生长的癌细胞而被整合到DNA中,并对RT的作用变得更加敏感。我们已经从NIH获得了SBIR合同,为与布朗大学(Brown University)在Lifespan/Rhode Island医院合作的I期临床试验提供资金,以确定晚期胃肠道癌患者的最大耐受剂量。 与试验有关,NCI批准了I期临床方案,并为罗德岛医院提供药物和临床数据管理支持。I期临床试验已经完成,结果支持将罗哌多尿苷推进到脑肿瘤、肉瘤和其他肿瘤的II期临床试验。
下表提供了已报道的碘脱氧尿苷和放射治疗治疗脑癌(多形性胶质母细胞瘤)和高级别肉瘤的临床试验数据。我们的罗比多尿苷和RT治疗的主要策略是提供口服药物输送,以实现癌症的辐射增敏,并验证对胶质母细胞瘤和肉瘤的疗效,这些都是潜在的“孤儿”适应症。
| 17 |
脑癌治疗
与既往的单纯RT对照治疗的疗效比较
高级别原发脑瘤(RTOG*、NCI**试验)
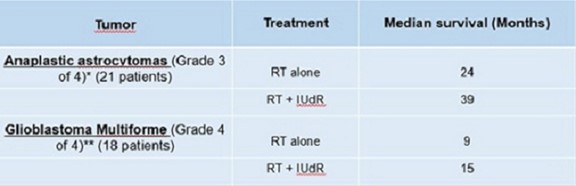
| ** | IUdR持续静脉滴注(1000 mg/m2/d/14天),共39例患者(F.Sullivan等人)。InJ Radiat Onol Biol Phys.1994年;30(3):583-90) |
| * | IUdR持续静脉滴注(2000 mg/m2/4天/6周),共21例(R.Urtasun等人)。InJ Radiat Onol 生物物理。1996年;36(5):1163-7。) |
肉瘤 治疗
与既往的单纯RT对照治疗的疗效比较
个高级别肉瘤(密歇根大学试验)
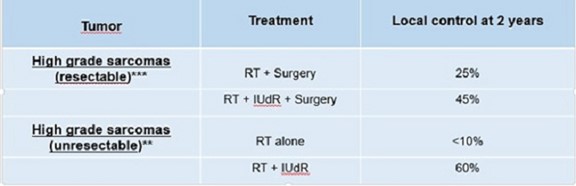
| *** | 16例患者接受持续输液(1000-1600 mg/m2/d)加RT(J.M.Robertson等人)治疗。Int J Radiat Onol Biol Phys. 1995;31(1):87-92)。 |
除了我们的主要候选产品,我们正在开发和计划开发其他癌症辐射敏感剂和辐射保护剂,目标是在放疗期间保护正常组织,以及利用我们的HDAC小分子 技术平台的其他产品。
SBIR 合同
SBIR计划
小企业创新研究计划由国会根据1982年《小企业创新发展法案》制定,旨在鼓励国内小企业从事具有商业化潜力的联邦研究/研发(R/R&D)。通过基于奖项的竞争性计划,SBIR使小型企业能够发掘其技术潜力,并提供从其商业化中获利的激励。SBIR的一些计划目标包括激励技术创新、满足联邦研发需求以及鼓励参与创新和创业。
| 18 |
SBIR计划分为三个阶段。第一阶段是确定拟议研发工作的技术优势和商业潜力。第二阶段将继续第一阶段开始的研发工作,资金基于第一阶段取得的成果。第三阶段允许小型企业实现第一阶段和第二阶段研发活动产生的商业化目标。此外,成功完成第一阶段和第二阶段的公司也有资格申请第二阶段资金。
除了SBIR合同,以资助我们的Ropidoxuridine联合RT治疗晚期胃肠癌的I期临床研究,我们还获得了美国国立卫生研究院授予的SBIR合同,以解决前列腺癌健康差距和前列腺癌放射生物标记物的开发。
截至本年度报告日期,公司收到的所有SBIR合同均已完成。公司于2022年3月28日提交了SBIR合同#75N81018C00031的最终报告 。下面提供了三个第二阶段SBIR合同的条款摘要 。
SBIR合同摘要
| ● | SBIR 合同编号261201400013C:I期(191,971美元)和II期(1,428,117美元),用于放射增敏的IPdR临床开发,日期 2014年9月19日至2017年8月3日。分包给布朗大学/LifeSpan Rhode Island Hospital。无相关知识 财产 | |
| ● | SBIR 合同#HHSN261201600038C;I期(224,687美元)和#261201800016C:前列腺癌健康差异研究的细胞模型 - Moonshot Project(第二阶段),奖励金额为1,484,350美元,日期为2016年9月19日至2021年9月16日。分包给乔治敦 大学知识产权由细胞培养物组成,是Shuttle Pharmaceuticals,Inc.的财产。通过许可协议。 | |
| ● | SBIR 合同#HHSN 261201600027C(299,502美元)和#75N81018C00031:前列腺癌患者放射敏感性的预测生物标志物 延迟效应,奖励金额为1,903,015美元,日期为2019年9月16日至2022年3月15日。分包给乔治敦大学。知识分子 该财产由分包商乔治敦大学拥有,有权选择许可给航天飞机制药公司。 |
前列腺癌研究:解决健康差距问题
前列腺癌的健康差异研究表明,与白人美国男性相比,非洲裔美国男性患前列腺癌的风险更高,以及癌症特定死亡率的风险更高。差异的原因被归因于社会经济差异、环境暴露和生物因素。大多数差异研究都是基于人群的,部分原因是缺乏相关的体外和体内模型来支持生物学研究。
Shuttle Pharma已获得题为"前列腺癌健康差异研究细胞模型"的I期和II期SBIR合同 ,以开发非洲裔美国人前列腺癌细胞系,使用供体匹配的非裔美国人男性正常前列腺上皮细胞系 。
前列腺细胞的商业化将需要通过SBIR资助机制提供额外支持。已完成 第一阶段和第二阶段SBIR奖励的公司有资格申请第IIb阶段SBIR资助。这些奖项旨在通过为产品开发到商业化提供最多400万美元的配套资金来降低项目的风险。我们打算申请这样的政府资金,以 推进实验室设施,并扩大细胞培养的可用性。我们没有通过我们的IPO筹集资金的健康差距项目。如果我们在SBIR IIb的资助中未能取得成功,我们将暂停并可能不得不终止该项目。
前列腺癌生物标志物研究进展
接受前列腺癌治疗的患者可能会经历与治疗相关的后遗症,这些后遗症会对生活质量产生不利影响,并可能危及生命。 Shuttle Pharma已获得一份名为“前列腺癌患者辐射后遗症敏感性的预测生物标记物”的第一阶段SBIR合同,以确定预测前列腺癌患者放射后遗症的生物标记物小组的技术和商业可行性。
通过 与乔治敦大学的合作,分析了接受SBRT治疗的前列腺癌患者的泌尿和直肠症状 ,并通过质谱分析其血液中的预测性生物标志物。代谢产物组的发现和验证可作为放射治疗后患者结局的预测生物标志物,并通过II期SBIR工作支持 诊断产品的未来开发和商业化。
| 19 |
代谢物预测生物标志物检测板的开发和商业化需要通过SBIR供资机制获得额外支持。 我们将有资格在下一轮招标中申请IIb期SBIR资助。IIb期将通过 提供高达400万美元的配套资金,用于执行产品开发到商业化的临床验证试验,从而帮助降低项目的风险。 我们打算申请此类政府资助以推进该项目。我们还打算通过公开市场筹集资金,通过Shuttle Diagnostics实体进行 预测性生物标志物开发。我们不打算将通过IPO筹集的资金用于医疗差异项目。如果我们未能成功获得SBIR IIb资助,我们将终止该项目。
协作 安排
虽然 我们打算达成选择性的合作安排,以在未来进一步开发我们的候选药物,但由于我们仍在完成临床试验, 目前我们尚未与第三方达成任何合作安排,以开发我们的候选药物,因此无法保证我们将能够在商业上合理的条款或其他条款下这样做。
知识产权
我们 在研发方面投入了大量资金。截至2023年12月31日和2022年12月31日止的财政年度,我们的研究和开发费用(未计合同偿还)分别为3,517,093美元和1,360,167美元。在截至2023年12月31日和2022年12月31日的财政年度的合同偿还 后,净研发费用分别为3,517,093美元和1,148,712美元。
我们 正在为我们的知识产权寻求多方面的保护,包括许可证、保密和保密协议、版权、专利、商标和普通法权利,如商业秘密。我们与员工、顾问、合作者、分包商和其他第三方签订保密和专有权利协议,通常控制对我们的文档和专有信息的访问。
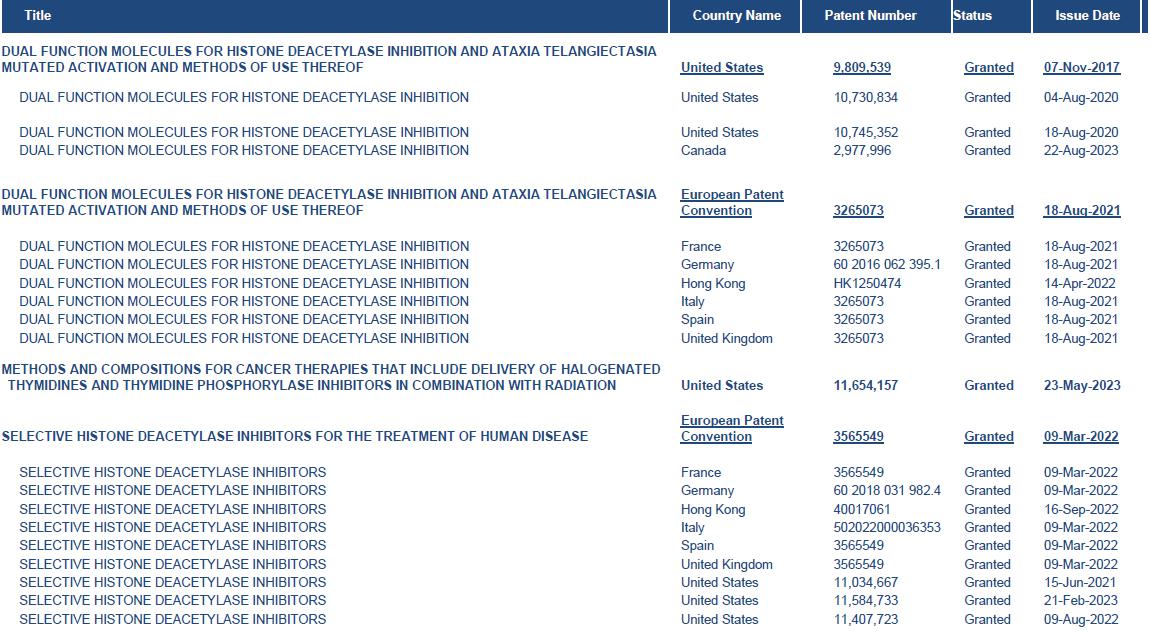
截至本年度报告之日,我们已向美国专利商标局提交了五项专利申请,涉及我们的HDAC 小分子递送平台和我们的主要候选产品罗哌多尿苷的各个方面。以下是迄今为止Shuttle提交的专利申请的状态:
| 20 |
Shuttle Pharma知识产权组合摘要
Morgan, Lewis & Bockius LLP准备了与Ropidoxuridine(IPdR)和HDAC抑制剂相关的专利申请,并且在2018年第四季度 ,发现Ropidoxuridine用作放射增敏剂并与替吡嘧啶以及HDAC抑制剂一起使用 SP—1—161和SP—2—225没有操作自由(FTO)问题。
我们的 保护我们的专有技术,包括任何创新和改进的战略是获得全球专利覆盖 ,重点放在代表重要的全球制药市场的司法管辖区。一般来说,专利的有效期为自最早的优先权日期起计的二十年 ,假设所有维护费都已支付,专利的任何部分都没有被最终放弃 ,专利也没有被宣布无效。在某些司法管辖区和某些情况下,专利期限可以延长或缩短。 我们正在获得至少新分子、物质组成、药物配方、使用方法 使用方法(包括疾病治疗、制造方法和来自我们的研发工作的发明分子的其他新用途)的全球专利保护。我们不断评估,与寻求专利保护相比,对有关新发明的“专有技术”进行保密在战略上是否更有利。对于提交的每一项专利申请,我们 根据特定技术的现有专利版图,战略性地定制我们的权利要求。
There can be no assurance that an issued patent will remain valid and enforceable in a court of law through the entire patent term. Should the validity of a patent be challenged, the legal process associated with defending the patent can be costly and time consuming. Issued patents can be subject to oppositions, interferences and other third-party challenges that can result in the revocation of the patent limit patent claims such that patent coverage lacks sufficient breadth to protect subject matter that is commercially relevant. Competitors may be able to circumvent our patents. Development and commercialization of pharmaceutical products can be subject to substantial delays and it is possible that at the time of commercialization any patent covering the product has expired or will be in force for only a short period of time following commercialization. We cannot predict with any certainty if any third-party U.S. or foreign patent rights or other proprietary rights will be deemed infringed by the use of our technology. Nor can we predict with certainty which, if any, of these rights will or may be asserted against us by third parties. Should we need to defend ourselves and our partners against any such claims, substantial costs may be incurred. Furthermore, parties making such claims may be able to obtain injunctive or other equitable relief, which could effectively block our ability to develop or commercialize some or all of our products in the U.S. and abroad and could result in the award of substantial damages. In the event of a claim of infringement, we or our partners may be required to obtain one or more licenses from a third party. There can be no assurance that we can obtain a license on a reasonable basis should we deem it necessary to obtain rights to an alternative technology that meets our needs. The failure to obtain a license may have a material adverse effect on our business, results of operations and financial condition.
| 21 |
我们也依赖商业秘密保护我们的机密和专有信息。不能保证我们能够持续有效地保护我们的商业秘密。其他公司可以独立开发基本上等同的机密和专有信息,或以其他方式获取我们的商业秘密。
我们的政策是要求我们的员工和顾问、外部科学合作者、受赞助的研究人员和其他顾问在开始雇佣或咨询关系时执行保密协议。 这些协议规定,这些个人在与公司的 关系期间开发或获知的所有机密信息都应保密,除非在特定情况下,否则不得向第三方披露。 协议规定,员工构思的所有发明都将是我们公司的财产。但是,不能保证在未经授权使用或泄露此类信息的情况下,这些协议将为我们的商业秘密提供有意义的保护或足够的补救措施。
我们的成功将在一定程度上取决于我们是否有能力获得和维护专利保护、保护商业机密、防止第三方侵犯我们的专有权,以及在不侵犯他人专有权利的情况下运营,无论是在美国还是在全球其他 地区。
制造和供应
我们 目前不拥有或运营用于生产任何 候选产品的临床前、临床或商业批量的生产设施。我们目前使用我们的多家供应商提供原材料和配方,以满足我们候选产品的临床前和任何临床要求。我们没有与这些各方中的任何一方达成长期协议,我们相信存在替代的供应来源。
我们 打算就我们的候选产品的制造进行合作,由我们的合作者负责 此类制造。制造业必须遵守广泛的法规,这些法规规定了各种程序和文件要求,其中包括记录保存、制造过程和控制、人员、质量控制和质量保证等。我们使用的任何 协作者或第三方合同制造商都需要遵守cGMP。CGMP是将用于人体的药物生产的监管标准。
销售 和市场营销
我们目前的重点是开发我们现有的产品组合,完成临床试验,并在适当的情况下注册我们的候选产品 。我们目前没有营销、销售和分销能力。如果我们的任何候选产品获得营销和商业化批准,我们打算直接或通过协作、战略联盟和与第三方的分销协议来营销产品。我们实现候选产品财务价值的最终战略的实施取决于我们候选产品的临床试验结果、资金的可用性以及与第三方协商可接受的商业条款的能力。
员工
截至本年度报告之日,我们有八名全职员工,其中包括五名高管,还有三名从事研究和开发工作。我们认为我们与员工的关系很好。
最近的融资-我们的IPO和2022年后融资
2022年9月2日,我们完成了1,225,888个单位的首次公开募股(每个单位为“单位”,统称为“单位”),每个单位由一股公司普通股和一股认股权证组成,以每股8.125美元的公开发行价 购买一股普通股。我们的IPO由Boustead Securities,LLC(“Boustead”)承销,扣除承销折扣和佣金后,总收益为9960,430美元。2022年9月29日,Boustead行使了超额配售选择权,额外购买了183,883个单位,在扣除承销商 佣金和折扣之前,毛收入为1,494,041美元。因此,在扣除承销折扣、佣金和相关IPO费用之前,我们的IPO总共筹集了11,454,474美元。
| 22 |
于2023年1月11日,吾等与Alto Opportunity Master Fund,SPC- 开曼实体(“投资者”)订立证券购买协议(“SPA”),据此,本公司向投资者出售4,300,000美元可换股票据(“可换股票据”)及认股权证(“认股权证”),以购买本公司1,018,079股普通股,以换取总收益4,000,000美元(“投资额”)。可换股票据按月摊销,本公司可按月以现金或在某些股本条件下以普通股登记股份或两者的组合方式支付该等每月摊销款项。对于股权偿还,可转换票据可按每股价格转换为普通股 ,每股价格等于(I)2.35美元(Ii)付款日期前15个交易日三个最低每日VWAP的90%或(Iii)付款日期前一个交易日VWAP的90%中的较低者。可换股票据的偿还期为26个月 ,年利率为5%。该认股权证自交易完成之日起可行使四年,并可按每股2.35美元价格行使 。如果投资者全面行使认股权证,则行使认股权证将为本公司带来约240万美元的额外毛收入。
2023年5月10日,我们签订了对SPA的修订协议(“修订协议”)。根据修订协议,本公司及投资者修订交易文件如下:(I)修订及重述认股权证第2条,以删除一项可能需要调整根据认股权证可行使的认股权证股份数目的条文, (Ii)规定本公司将获得大股东批准,增发最多1,000万美元的可转换票据(“后续票据”)及相当于后续票据未偿还本金价值42.5%的认股权证(“后续票据”),该等后续票据及后续认股权证将按与现有可换股票据及认股权证(均经修订协议修订)大致相同的条款 出售予投资者,且于转换及/或行使时将导致 潜在发行超过本公司已发行及已发行股份的19.9%,(Iii)在获得大股东批准后,本公司将于订立修订 协议后30个历日内提交附表14C,说明可能发行与可能向投资者出售后续票据及后续认股权证有关的普通股,及(Iv)规定投资者将向本公司发放1,500,000美元现金抵押品,其中1,000,000美元将于签署修订协议后立即发放予本公司,500,000美元将于本公司提交修订协议时发放500,000美元。于订立修订协议前,本公司已取得大股东同意可能向投资者出售后续票据及后续认股权证 。
2023年6月4日,我们签订了日期为2023年5月11日的修订协议第1号修正案(“第1号修正案”),目的是修改SPA的条款。根据修订协议第1号修订,本公司与投资者同意:(I) 可换股票据第15(Q)条将不再适用,该条款要求本公司在受控账户协议中持有现金抵押品 (定义见可换股票据),(Ii)投资者将规定向本公司发放合共2,924,000美元的剩余现金抵押品(从而向本公司发放全部现金抵押品),及(Iii) ,如投资者行使其购买后续票据及后续认股权证的选择权,该等后续票据将 省略第15(Q)节,且本公司将不会被要求维持任何受控账户或以其他方式遵守任何受控账户协议。
| 23 |
第 1a项。风险因素
投资我们的证券涉及高度风险。在决定投资我们的证券之前,您应仔细考虑以下所述的所有风险,以及本10-K年度报告中包含的其他信息,包括我们在其他地方的财务报表和相关附注。如果发生以下任何事件,我们的业务、财务状况和经营业绩可能会受到重大不利影响。在这种情况下,我们证券的交易价格可能会下跌,您可能会损失全部或部分投资。
风险因素摘要
本年度报告表格10—K第25页开始的“风险因素”标题下描述的风险可能导致我们 无法充分发挥我们的优势和/或可能导致我们无法成功执行全部或部分战略。我们面临的一些 更重要的挑战包括:
| ● | 我们能否在短期内继续作为一家持续经营企业取决于我们能否成功筹集额外的股权或债务融资,为我们的运营提供资金。 | |
| ● | 我们的成功主要取决于我们候选产品的成功开发、监管批准和商业化。 所有这些都处于开发的早期阶段。 | |
| ● | 我们 目前没有产品销售收入来源。 | |
| ● | 我们面临着来自已经或可能为我们的目标疾病适应症开发候选产品的实体的竞争,包括 基于与我们类似的模式和技术开发新疗法和技术平台的公司。如果这些公司 比我们更快地开发技术或候选产品,或者他们的技术(包括交付技术)更有效,我们开发和商业化候选产品的能力可能会受到不利影响。 | |
| ● | 如果我们未能遵守美国和外国的监管要求,监管机构可以限制或撤回我们可能获得的任何营销或商业化批准,并使我们受到其他可能对我们的业务造成实质性损害的处罚。 | |
| ● | 如果我们不遵守保护环境、健康和人类安全的法律,我们的业务可能会受到不利影响 。 | |
| ● | 如果 我们无法为我们的技术或候选产品获得并实施专利保护,我们候选产品的开发和商业化可能会受到不利影响。 | |
| ● | 我们 或我们的许可人,或任何未来的合作伙伴或战略合作伙伴可能会受到第三方索赔或诉讼,指控 侵犯专利或其他专有权利或试图使专利或其他专有权利无效,我们可能需要 诉诸诉讼来保护或强制执行我们的专利或其他专有权利,所有这些都可能代价高昂、耗时、 推迟或阻止我们候选产品的开发和商业化,或者使我们的专利和其他专有权利面临风险 。 | |
| ● | 如果我们无法保护我们的商业秘密的机密性,我们的业务和竞争地位将受到损害。 | |
| ● | 我们 可能无法获得美国或外国监管机构的批准,因此无法将我们的候选产品商业化。 | |
| ● | 我们开发的任何药物都可能受到不利的定价法规、第三方报销做法或医疗改革 举措的约束,从而损害我们的业务。 | |
| ● | 我们从联邦政府获得服务、报销或资金的能力可能会受到联邦支出可能减少的影响 。 | |
| ● | 如果我们的任何候选产品获得市场批准,而我们或其他人后来发现该候选产品造成的不良副作用,我们营销和从候选产品获得收入的能力可能会受到影响。 | |
| ● | 我们的 股价目前交易低于1.00美元,虽然纳斯达克已授权我们在2024年8月26日之前恢复合规,但 并不能保证我们在不实行反向股票分割的情况下重新获得合规。 | |
| ● | 我们的股价可能会波动,购买我们普通股的人可能会遭受重大损失。 | |
| ● | 未来发行可转换为普通股的股票或债务证券将稀释我们的股本。 | |
| ● | 如果证券或行业分析师不发表关于我们业务的研究或报告,或者如果他们对我们的股票发表不利或误导性的意见,我们的股价和交易量可能会下降。 |
| 24 |
风险因素
投资我们的普通股涉及很高的风险。在您决定购买我们的普通股之前,您应该仔细考虑以下风险因素和本年度报告中的所有其他 信息。如果与我们的业务相关的任何风险实际发生 ,我们的业务、财务状况、经营业绩和前景都将受到不利影响。我们普通股的市场价格可能会因与我们的业务有关或与对我们普通股的投资有关的任何这些风险和不确定性而下跌。 您可能会损失部分或全部投资。
与我们的业务、财务状况和资本要求有关的风险
我们的 综合财务报表是在持续经营的基础上编制的,考虑到在正常业务过程中变现资产以及清偿 负债和承诺; 我们能否继续作为一个持续经营的企业取决于我们成功进行临床试验、将候选药物商业化、产生收入以及筹集额外的 股权或债务融资以资助我们的运营的能力。
我们的 综合财务报表乃按持续经营基准编制,考虑在正常业务过程中变现资产及清偿 负债和承担。该公司自成立以来已发生亏损,截至2023年12月31日止年度净亏损约为660万美元,无收入,截至2023年12月31日,营运资金约为460万美元。此外,于2023年12月31日尚未偿还的应付可换股票据包括契约及若干现金 付款要求。这些条件以及本公司遵守这些条件的能力,对本公司能否在综合财务报表发布之日起一年内持续经营产生了重大疑问。
2022年9月,本公司完成了首次公开发行普通股,产生的所得款项净额约为1000万美元。此外,于2023年1月,本公司与一家机构投资者签订了一份证券购买协议, 据此,本公司出售了本金额为430万美元的可换股票据,以及一份为期四年的认股权证,以购买 1,018,079股普通股,可按每股2.35美元行使,为公司提供约360万美元的净收益 。迄今为止,该逮捕令尚未行使。然而,公司现有的现金资源、有价证券和从公司首次公开发行和可换股票据发行中获得的现金预计不会 提供足够的资金支持公司未来12个月的运营和临床试验。
此次 融资支持了生产药品和FDA批准IND用于罗哌多尿苷和胶质母细胞瘤放射治疗II期临床试验的运营。FDA建议并同意扩大临床试验 ,完成试验需要额外的资本支出。管理层打算以450万美元的价格启动一项权利发行 ,并已提交SBIR申请,要求为我们的临床前项目提供非稀释性NIH资金。公司能否 继续作为一个持续经营企业取决于我们成功进行临床试验、将候选药物 商业化、创造收入以及筹集额外股权或债务融资以资助我们的运营的能力。
| 25 |
我们的成功主要取决于我们候选产品的成功开发、监管批准和商业化,所有这些都处于开发的早期阶段。
我们 目前有一个临床阶段候选产品处于开发的早期阶段。罗哌多尿苷已在Lifespan/Rhode Island医院接受SBIR资助的I期临床试验。我们也有HDAC抑制剂小分子平台。三种先导药物候选 分子处于临床前开发阶段。我们的候选产品都没有获得在美国或任何其他国家销售的市场批准,我们不能保证我们将有适销对路的产品。迄今为止,我们已经投入了大量 所有的精力和财政资源,用于当前候选产品 和HDAC小分子输送平台的研发和商业规划。我们的近期前景,包括我们为公司融资和创收的能力, 以及我们未来的增长,将在很大程度上取决于我们候选产品的开发、营销批准和商业化。 候选产品的临床和商业成功取决于许多因素,包括:
| ● | 建筑 我们的IPdR I期临床试验以及II期和III期临床试验的有利结果,这可能 比我们目前预期的速度更慢或成本更高; | |
| ● | 我们是否有能力证明我们的候选产品的安全性和有效性,这是仅在FDA 授权范围内的持续确定; | |
| ● | 即使我们的临床试验已经完成,也不能保证FDA会同意我们已经令人满意地证明了安全性或有效性,或者FDA不会对我们的临床试验设计提出新的问题; | |
| ● | FDA是否要求我们进行额外的临床试验以支持我们的候选产品的批准; | |
| ● | FDA接受我们建议的监管批准参数,包括我们建议的适应症、终点和终点 与我们的候选产品相关的测量工具; | |
| ● | 不良副作用的发生率、持续时间和严重程度; | |
| ● | 及时收到FDA的必要上市批准; | |
| ● | 我们是否能够确保合作,以完成我们的候选产品的开发和商业化(如果获得批准); |
| ● | 我们和我们的潜在合作伙伴的营销、销售和分销战略以及已获批准的候选产品的运营 的有效性; | |
| ● | 我们成功地对医生和患者进行了关于我们候选产品的益处、管理和使用的教育; | |
| ● | 我们的第三方制造商和潜在合作者 有能力生产我们的候选产品的临床试验和商业供应,以保持与监管机构的良好关系,并开发、验证和维护符合当前良好制造规范(“cGMP”)规定的商业可行的制造 流程; | |
| ● | 如果我们的候选产品获准上市,我们有能力将其商业化; | |
| ● | 我们执行知识产权的能力; | |
| ● | 我们 能够避免第三方专利干扰或专利侵权索赔; | |
| ● | 患者和医学界接受我们的候选产品是安全有效的;以及 | |
| ● | 获得批准后,我们的候选产品的质量状况仍可接受。 |
以上列出的许多风险因素 超出了我们的控制范围。因此,我们无法向您保证,我们将能够通过销售我们的候选产品创造 收入。本年度报告中讨论的任何一个因素或其他因素都可能 影响我们将候选产品商业化的能力,这可能影响我们赚取足够收入以从发展阶段的公司过渡 并继续开展业务的能力。如果我们没有获得 候选产品的市场批准和商业化,或者在这方面被严重拖延,我们的业务将受到重大损害。我们的经营历史有限, 自成立以来已经发生了重大损失,我们预计在 可预见的将来我们将继续发生损失,可能永远无法实现或保持盈利能力。
我们 是一家临床阶段的制药公司,准备开始我们的主要候选药物的II期临床试验,经营历史有限,您可以根据此历史评估我们的业务和前景。 特种药品开发是一项高度投机的事业,涉及相当大的风险。我们 目前没有任何正在进行高级临床试验或批准销售的候选产品,并且我们将继续产生与我们运营相关的大量研究和开发以及一般和管理费用。此外,我们的经验有限, 尚未证明有能力成功克服新的和 快速发展的领域,特别是特种制药行业的公司经常遇到的许多风险和不确定性。自2012年12月成立以来,我们没有产生任何收入,每年都出现亏损 。截至2023年12月31日,我们的累计赤字为1550万美元。我们预计在可预见的将来继续 造成重大损失。即使我们在未来实现了盈利,我们也可能无法在随后的时期维持 盈利。
| 26 |
我们 目前没有产品销售收入来源。
我们 尚未完成临床试验,因此我们的产品尚未商业销售,并且尚未从我们候选产品的商业销售中产生任何 收入。我们创造产品收入的能力取决于我们开发和商业化产品的能力,包括我们当前的任何候选产品或我们可能开发、 许可或将来获得的其他候选产品。我们预期于可见将来不会从销售产品中产生收益。 我们从当前或未来候选产品中产生未来产品收入的能力还取决于多个其他 因素,包括我们能够:
| ● | 直接或通过协作关系完成当前和未来候选产品的研究和临床开发; | |
| ● | 与第三方建立和维护供应和制造关系,并确保充足和合法合规地生产原料药和药品以维持供应; | |
| ● | 在我们打算直接或通过合作关系销售我们的候选产品的司法管辖区,获得 相关监管机构的监管批准; | |
| ● | 推出我们通过协作合作伙伴获得营销批准的未来候选产品,并将其商业化; | |
| ● | 从包括政府支付方在内的第三方支付方获得保险和足够的产品报销; | |
| ● | 使我们的产品获得市场认可(如果有的话); | |
| ● | 建立、维护和保护我们的知识产权;以及 | |
| ● | 吸引、聘用和留住合格的人员。 |
此外,由于与临床产品开发相关的众多风险和不确定性,包括我们的候选产品 可能无法通过开发或达到适用临床试验的终点,我们无法预测未来任何潜在产品销售收入的时间或金额 。如果我们决定或被FDA或类似的外国监管机构要求在我们目前预期的研究或试验之外进行研究或试验,我们的费用也可能超出预期。 即使我们完成了上述开发和监管流程,我们预计也会产生与推出和商业化这些产品相关的巨额成本。
市场可能不接受我们基于新型治疗模式的候选产品,并且我们未来可能不会从候选产品的销售或许可中获得任何收入。
即使 如果产品候选获得批准,由于产品是否能够以具有竞争力的成本销售并以其他方式被市场接受等因素,我们可能无法从产品的销售中产生或维持收入。我们正在开发的候选产品 基于新的递送平台治疗方法(目前还没有FDA批准用于辐射致敏适应症的药物 )。对新疗法的接受有重大影响的市场参与者,如医生和第三方付款人,可能不接受我们的交付平台,我们也可能无法说服医学界和第三方付款人接受和使用我们开发的任何候选产品,或为其提供优惠的报销。市场是否接受我们的候选产品 将取决于其他因素:
| ● | 我们收到任何营销和商业化批准的时间; |
| 27 |
| ● | 任何批准的条款和获得批准的国家/地区; | |
| ● | 我们候选产品的安全性和有效性,这完全是FDA授权范围内的决定; | |
| ● | 与我们的候选产品相关的任何不良副作用的流行率和严重程度; | |
| ● | FDA或其他监管机构批准的任何标签中包含的警告 ; | |
| ● | 方便 和易于管理我们的候选产品; | |
| ● | 我们医生教育项目的成功 ; | |
| ● | 是否有足够的政府和第三方付款人报销; | |
| ● | 我们产品的定价,特别是与替代疗法相比;以及 | |
| ● | 替代有效产品的可用性 我们的候选产品用于治疗的迹象。 |
我们 将需要大量额外资金以获得我们候选产品的市场批准并将我们的候选产品商业化 ;如果在需要时未能以可接受的条款获得这笔必要的资金,或者根本不能获得资金,可能会迫使我们推迟、限制、减少 或终止我们的产品开发、其他运营或商业化努力。
自我们成立以来,我们几乎所有的资源都致力于我们的HDAC小分子递送平台和我们的首批候选产品Ropidoxuridine的临床前和临床开发。到目前为止,我们的资本需求通过现有股东的贡献以及我们证券和SBIR合同的私募和IPO来满足。我们相信,在可预见的未来,我们将继续投入大量资源,用于完成我们的候选产品的临床开发和监管准备,准备我们的候选产品的商业发布(如果获得批准),以及开发我们可能选择进一步开发的任何其他当前或未来的候选产品。这些支出将包括与研发、进行临床前研究和临床试验、获得上市批准相关的成本,如果我们无法进行计划中的合作,则包括制造和供应以及营销和销售任何获准销售的产品。此外,还可能产生其他意外成本 。由于任何药物开发过程的结果都高度不确定,我们无法合理估计完成我们当前候选产品(如果获得批准)或未来候选产品(如果有)的开发和商业化所需的实际金额。
我们 相信,我们在IPO中获得的收益和随后的400万美元后续可转换票据发行,我们 获得了360万美元的净收益,加上我们现有的资本资源,如果没有额外的资本注入,将不足以支持我们的运营 到2025年3月。我们预计我们将需要通过 公共或私募股权或债务融资或其他来源寻求额外资金,例如通过配股、战略合作或赠款 和合同。此类融资可能导致对股东的摊薄,强制实施债务契约和偿还义务,或 其他可能对我们的业务产生不利影响的限制。此外,由于有利的市场条件或战略考虑,我们可能会寻求额外的资本,即使我们认为我们有足够的资金来执行当前或未来的运营 计划。
| 28 |
我们未来的资本需求取决于许多因素,包括:
| ● | 研究和开发我们当前候选产品、未来候选产品以及进行临床前和临床试验的范围、进度、结果和成本; | |
| ● | 如果我们当前的候选产品和未来的候选产品被批准销售,则商业化活动的成本,包括 确保合作企业完成开发、确保营销批准并最终营销、销售和分销我们的候选产品,如果获得批准,或者如果我们必须直接进行这些活动,则建立公司基础设施 ; |
| ● | 我们有能力建立和维护战略合作、许可或其他安排以及此类协议的财务条款; | |
| ● | 我们可能开发或获得的任何其他候选产品的数量和特性; | |
| ● | 任何与我们的产品有关的产品责任或其他诉讼,或对我们发起的任何诉讼; | |
| ● | 吸引和留住技术人才所需的费用; |
| ● | 与上市公司相关的成本; | |
| ● | 专利权利要求的准备、提交、起诉、维护、辩护和执行所涉及的费用,包括诉讼费用和诉讼结果;以及 | |
| ● | 任何未来批准的产品(如果有)的时间、收据和销售金额或版税。 |
额外的 资金可能无法在我们需要时以我们可以接受的条款获得,或者根本无法获得。如果我们无法及时获得足够的资金 ,我们可能需要:
| ● | 延迟、 限制、减少或终止我们当前候选产品或未来候选产品的临床前研究、临床试验或其他开发活动(如果有); | |
| ● | 推迟、限制、减少或终止我们的研究和开发活动;或 | |
| ● | 延迟、 限制、减少或终止我们的销售和营销能力的建立或其他可能是商业化所必需的活动 我们当前或未来的候选产品。 |
筹集 额外资本可能会稀释我们的现有股东,限制我们的运营,或者要求我们放弃对我们的 技术或候选产品的权利。
我们 可以通过公共和私募股权发行、债务融资、战略合作以及 联盟和许可安排相结合的方式寻求额外资本。如果我们通过出售股权或可转换债务证券来筹集额外资本,您的所有权权益将被稀释,条款可能包括清算或其他对您作为股东的权利产生不利影响的优惠 。债务的产生将导致固定支付义务的增加,并可能涉及某些限制性的 契约,例如,对我们产生额外债务的能力的限制,对我们获取或许可知识产权的能力的限制,以及可能对我们开展业务的能力产生不利影响的其他运营限制。如果我们通过与第三方的战略协作和联盟以及许可安排来筹集额外的 资金,我们可能不得不放弃对我们的技术或候选产品有价值的 权利,或者以对我们不利的条款授予许可证。
| 29 |
不利和/或不稳定的全球市场和经济状况,包括乌克兰和俄罗斯之间持续的冲突和持续的新冠肺炎疫情造成的状况,可能会对我们的业务、财务状况和运营结果产生严重的不利影响。
The global economy, including credit and financial markets, has experienced extreme volatility and disruptions as a result of the ongoing conflict between the Ukraine and Russia and challenges arising from the ongoing COVID-19 pandemic, including severely diminished liquidity and credit availability, declines in consumer confidence, declines in economic growth, increases in unemployment rates, increases in inflation rates and uncertainty about economic stability. Our results of operations could be adversely affected by the general conditions of the global economy and the global financial markets. In addition, any such volatility and disruptions may have adverse consequences on us or the third parties upon whom we rely. For example, in 2008, the global financial crisis caused extreme volatility and disruptions in the capital and credit markets and the current COVID-19 pandemic has caused significant volatility and uncertainty in U.S. and international markets. Inflation rates, particularly in the United States, have increased recently to levels not seen in years. Increased inflation may result in increased operating costs (including our labor costs), reduced liquidity, and limitations on our ability to access credit or otherwise raise debt and equity capital. In addition, the United States Federal Reserve has raised, and may again raise, interest rates in response to concerns about inflation. Increases in interest rates, especially if coupled with reduced government spending and volatility in financial markets, may have the effect of further increasing economic uncertainty and heightening these risks, which may impact our ability to raise additional capital in the future. The March 2023 failure of Silicon Valley Bank, the pressure such failure has placed on other mid-sized banks, and its potential near- and long-term effects on the biotechnology industry and its participants such as our vendors, suppliers and investors, may also adversely affect our operations and stock price. In addition, U.S. and global markets are experiencing volatility and disruption following the escalation of geopolitical tensions and the start of the military conflict between Russia and Ukraine. On February 24, 2022, a full-scale military invasion of Ukraine by Russian troops began. Although the length and impact of the ongoing military conflict is highly unpredictable, the conflict in Ukraine has led to market disruptions, including significant volatility in commodity prices, credit and capital markets, as well as supply chain disruptions. Various of Russia’s actions have led to sanctions and other penalties being levied by the United States, Australia, the European Union, and other countries, as well as other public and private actors and companies, against Russia and certain other geographic areas, including agreement to remove certain Russian financial institutions from the Society for Worldwide Interbank Financial Telecommunication payment system and restrictions on imports of Russian oil, liquified natural gas and coal. Additional potential sanctions and penalties have also been proposed and/or threatened. Russian military actions and the resulting sanctions could disrupt or otherwise adversely impact our operations and the operations of third parties upon which we rely, as well as the global economy and financial markets, and lead to instability and lack of liquidity in capital markets, potentially making it more difficult for us to obtain additional funds. Related sanctions, export controls or other actions that may be initiated by nations including the United States, the European Union or Russia (e.g., potential cyberattacks, disruption of energy flows, etc.), which could adversely affect our business and/or our supply chain, our CROs, CMOs and other third parties with which we conduct business. A severe or prolonged economic downturn, inflationary environment, rising interest rates, or political unrest could result in a variety of risks to our business, including, weakened demand for our product candidates and our ability to raise additional capital when needed on acceptable terms, if at all. A weak or declining economy could also strain our suppliers, possibly resulting in supply disruption, or cause our customers to delay making payments for our services. The extent and duration of the military action, sanctions, and resulting market disruptions are impossible to predict, but could be substantial. Any such disruptions may also magnify the impact of other risks described in this Annual Report on Form 10-K and the documents incorporated by reference herein.
我们的 候选产品处于开发的早期阶段,可能会在开发中失败或出现延迟,从而对其商业可行性产生重大不利影响。
我们 市场上没有产品,我们所有的候选产品都处于开发的早期阶段。我们能否实现并保持 盈利能力取决于获得监管部门的批准,包括IRB批准,并将我们的候选产品进行商业化 单独或与第三方合作。在获得监管机构对我们候选产品的商业分销的批准之前,我们或我们的一个合作者必须进行广泛的临床前测试和临床试验,以证明我们候选产品在人体上的安全性和有效性,最终决定完全取决于FDA的授权。临床前测试和临床试验 昂贵,难以设计和实施,可能需要数年时间才能完成,而且结果不确定。 临床研究的开始或结束通常会因为法规要求的变化、制造方面的挑战、所需的临床试验 管理措施、患者登记慢于预期、护理标准的变化、可获得性或使用比较药物或所需的先前治疗、临床结果或财务限制而延迟或停止。例如,患者登记的延迟或困难或留住试验参与者的困难可能会导致成本增加、开发时间延长或临床试验终止。新产品候选产品的临床试验需要登记足够数量的患者,包括患有该产品候选产品拟治疗的疾病且符合其他资格标准的患者 。患者入院率受多种因素影响,包括患者群体的大小、临床试验的资格标准、患者的年龄和病情、疾病的阶段和严重程度、方案的性质、患者距离临床 地点的距离以及相关疾病的有效治疗是否可用。
| 30 |
候选产品在临床前和临床开发的任何阶段都可能意外失败。候选产品的历史不合格率较高,原因是科学可行性、缺乏质量和有效性、不断变化的医疗保健标准和其他变量。 候选产品的临床前测试或早期临床试验的结果可能无法预测将在候选产品的后期临床试验中获得的结果。我们、FDA或其他适用的监管机构可出于各种原因(包括认为参与此类试验的受试者暴露于不可接受的健康风险或不良副作用),随时暂停候选产品的临床试验。如果我们遇到任何问题或其他不可预见的事件,延误或阻碍了监管机构对候选产品的批准或我们将其商业化的能力,我们可能没有财力继续开发候选产品,或 与候选产品进行合作,包括:
| ● | 对于与我们相似的候选产品,我们的临床试验或其他人的临床试验结果为阴性或不确定,导致 决定或要求进行额外的临床前试验或临床试验或放弃计划; | |
| ● | 我们临床试验的参与者或使用与我们的候选产品类似的药物的个人经历了严重的 和意想不到的药物相关副作用; | |
| ● | 延迟 提交研究新药申请(“IND”)或延迟或未能从监管机构获得开始临床试验所需的批准 ,或在临床试验开始后暂停或终止临床试验; | |
| ● | 由FDA或类似的外国当局就我们临床试验的范围或设计施加的条件; | |
| ● | 延迟将研究对象纳入临床试验 ; | |
| ● | 研究对象辍学率高; | |
| ● | 高于预期的临床试验成本; | |
| ● | 我们的候选产品在临床试验期间的有效性较差; | |
| ● | 不利于FDA或其他监管机构对临床试验场地进行检查和审查; | |
| ● | 我们的第三方承包商或调查人员未能及时或根本不遵守监管要求或履行合同义务 ; | |
| ● | 延迟 以及法规要求、政策和指导方针的变化,包括对临床试验或特别针对我们的技术施加额外的监管监督;或 | |
| ● | FDA和类似的外国监管机构对数据的不同解释。 |
如果我们进行临床前研究或任何未来临床试验所依赖的第三方未按合同要求执行, 无法满足法规或法律要求或错过预期的截止日期,我们的开发计划可能会被推迟,从而对我们的业务、财务状况、运营结果和前景产生重大不利影响。
我们 依赖第三方合作者进行我们的Ropidoxuridine疗效临床试验,并计划依靠第三方临床研究人员、CRO、临床数据管理组织和顾问来设计、实施、监督和监控我们候选产品的临床前研究 ,并将对任何临床试验进行同样的操作。由于我们计划在很大程度上依赖第三方,并且没有能力独立进行临床前研究或临床试验,因此与我们自己进行临床前研究和临床试验相比,我们对临床前研究和临床试验的时间、质量和其他 方面的控制较少。这些调查人员、CRO和顾问 不是我们的员工,我们对他们用于我们项目的时间和资源的控制有限。这些第三方 可能与其他实体有合同关系,其中一些可能是我们的竞争对手,这可能会从我们的计划中耗费时间和资源 。与我们签约的第三方在进行我们的临床前研究或临床试验时可能不勤奋、谨慎或及时,导致临床前研究或临床试验延迟或不成功。
如果 我们无法以商业上合理的条款与可接受的第三方签订合同,或者如果这些第三方没有履行其合同职责,不满足进行临床前研究或临床试验的法律和法规要求,或者 在预期的最后期限内完成,我们的临床开发计划可能会被推迟,并以其他方式受到不利影响。在任何情况下,我们都有责任确保我们的每一项临床前研究和临床试验都是按照总体调查计划和试验方案进行的。FDA要求临床试验必须按照良好的临床实践进行,包括进行、记录和报告临床前研究和临床试验的结果,以确保数据和报告的结果可信和准确,并保护临床试验参与者的权利、完整性和机密性。我们对不受我们控制的第三方的依赖并不能免除我们的这些责任和要求。任何此类事件都可能对我们的业务、财务状况、运营结果和/或前景产生重大的不利影响。
| 31 |
由于我们依赖第三方制造和供应合作伙伴,我们的研发、临床前和临床开发材料的供应可能会变得有限或中断,或者数量或质量可能不令人满意。
我们 依靠第三方供应和制造合作伙伴为我们的研发、临床前和临床试验药物供应提供材料和组件,并进行制造。我们不拥有此类组件和材料的制造设施或供应来源。 不能保证我们的研发、临床前和临床开发药物及其他材料的供应不会受到限制、中断、限制在某些地理区域或质量令人满意,或继续以可接受的价格供应。特别是,如果特定候选产品的合格替代品数量有限,则我们可能使用的任何药品配方制造商的任何替代品都可能需要大量的工作和专业知识。
候选产品的制造流程将接受FDA和外国监管机构的审查。供应商和制造商 必须满足适用的制造要求,并接受监管机构要求的严格的设施和工艺验证测试 ,以符合监管标准,如当前的良好制造规范(或CGMP)。如果我们的任何供应商或制造商未能遵守此类要求或履行其在质量、时间或其他方面对我们的义务, 或者如果我们的组件或其他材料的供应因其他原因变得有限或中断,我们可能会被迫自己制造 材料,而我们目前没有能力或资源,或者与另一方 达成协议,而我们可能无法以合理的条款(如果有的话)这样做。在某些情况下,制造我们的候选产品所需的技术技能或技术可能是原始制造商独有的或专有的,我们可能会遇到困难,或者可能存在合同 限制,禁止我们将此类技能或技术转让给其他第三方,并且可能不存在可行的替代方案。 这些因素会增加我们对该制造商的依赖,或者要求我们获得该制造商的许可证,以便让 其他第三方生产我们的候选产品。如果我们因任何原因被要求更换制造商,我们将被要求 验证新制造商的设施和程序是否符合质量标准以及所有适用的法规和指南 。与新制造商验证相关的延迟可能会对我们及时或在预算内开发候选产品的能力产生负面影响。
如果我们获得监管部门对任何候选产品的批准,我们 预计将继续依赖第三方制造商。就我们与第三方现有或未来的制造安排而言,我们将依赖这些第三方按照合同和法规要求(包括与质量控制和保证相关的要求)及时履行其义务。 如果我们无法获得或维持候选产品的第三方制造,或者无法以商业合理的条款这样做,我们可能无法完全开发我们的候选产品并将其商业化。如果我们或第三方未能执行我们的 制造要求,可能会在多种方面对我们的业务产生不利影响,包括:
| ● | 无法启动或继续开发中的候选产品的临床试验; | |
| ● | 延迟提交监管申请或收到监管部门对候选产品的批准; | |
| ● | 合作者合作损失 ; | |
| ● | 让我们的候选产品接受监管机构的额外检查; | |
| ● | 要求 停止分销或召回我们的候选产品批次;以及 | |
| ● | 在候选产品获得市场和商业化批准的情况下,无法满足我们产品的商业需求。 |
我们 可能无法成功进行战略性交易,这可能会对我们开发和商业化候选产品的能力产生不利影响,影响我们的现金状况,增加我们的支出,并对我们的管理层造成重大干扰。
我们可能会时不时地考虑战略交易,例如协作、公司收购、资产购买以及候选产品或技术的外许可或外许可。特别是,我们将进行评估,如果在战略上具有吸引力,我们将寻求与其他合作伙伴进行更多合作,包括与主要生物技术或制药公司合作,以完成我们候选产品的开发和营销 ,如果获得批准。合作伙伴的竞争非常激烈,谈判过程既耗时又复杂。任何建议的协作条款对我们来说都可能不是最优的,并且我们可能无法维持任何新的或现有的 协作,例如,如果候选产品的开发或审批被推迟、已批准候选产品的销售达不到预期,或者协作者终止协作。任何此类协作或其他战略交易可能要求我们 产生非经常性费用或其他费用,增加我们的短期和长期支出,并带来重大的整合或实施挑战或中断我们的管理或业务。这些交易将带来许多运营和财务风险,包括: 暴露于未知负债;业务中断;为了管理协作或开发收购的产品、候选产品或技术而转移管理层的时间和注意力;为支付交易对价或成本而产生大量债务或股权证券的稀释发行;高于预期的协作、收购或整合成本;资产或商誉或减值费用的减记;摊销费用增加;促进协作或合并任何收购业务的运营和人员的困难和成本增加;与主要供应商的关系受损;由于管理层和所有权的变更以及无法留住任何被收购企业的关键员工,制造商或任何被收购企业的 客户。因此,虽然不能保证我们将进行或成功完成上述性质的任何交易 ,但我们确实完成的任何交易可能会受到前述或其他风险的影响,并对我们的业务、运营结果、财务状况和前景产生重大不利影响 。相反,如果未能达成对我们有利的任何协作或 其他战略交易,可能会推迟我们候选产品的开发和潜在商业化 ,并对任何进入市场的候选产品的竞争力产生负面影响。
| 32 |
我们面临来自已经或可能为我们的目标疾病适应症开发候选产品的实体的竞争,包括基于与我们类似的模式和技术开发新疗法和技术平台的公司 。如果这些公司开发技术或候选产品的速度比我们更快,或者他们的技术(包括交付技术)更有效,我们开发和商业化候选产品的能力 可能会受到不利影响。
药品的开发和商业化竞争激烈。我们与各种跨国制药公司和专业生物技术公司以及正在开发新技术的大学和其他研究机构竞争。 我们的竞争对手已经开发、正在开发或将开发与我们的候选产品竞争的候选产品和工艺。 具有竞争力的治疗方法包括已被医学界批准和接受的治疗方法以及进入市场的任何新治疗方法 。我们认为,有相当数量的产品目前正在开发中,并可能在未来投入商业 ,用于治疗我们可能尝试开发产品候选的条件。
我们的许多竞争对手拥有比我们多得多的财务、技术、制造、营销、销售和供应资源或经验 。如果我们获得任何候选产品的批准,我们将面临基于许多不同因素的竞争,包括我们产品的质量和有效性、我们产品的管理容易程度和患者接受相对较新的给药途径的程度、这些产品获得监管批准的时间和范围、 制造、营销和销售能力的可用性和成本、价格、报销范围和专利地位。竞争产品可以提供 更好的治疗替代方案,包括比我们可能开发的任何产品更有效、更安全、更便宜或更有效地营销和销售。在我们收回开发和商业化候选产品的费用之前,竞争性产品可能会使我们开发的任何产品过时或不具竞争力。此类竞争对手还可能招聘我们的员工,这可能会对我们的专业水平和执行业务计划的能力产生负面影响。
任何无法吸引和留住合格关键管理和技术人员的情况都会削弱我们实施业务计划的能力。
Our success largely depends on the continued service of certain key management and other specialized personnel, including Anatoly Dritschilo, M.D., our Chief Executive Officer, Mira Jung, Ph.D., our Chief Scientific Officer, Michael Vander Hoek, our Chief Financial Officer and Vice President Operations and Regulatory, and Peter Dritschilo, our President and Chief Operating Officer. The loss of one or more members of our management team or other key employees or advisors could delay our research and development programs and materially harm our business, financial condition, results of operations and prospects. The relationships that our key managers have cultivated within our industry make us particularly dependent upon their continued employment with us. We are dependent on the continued service of our technical personnel because of the highly technical nature of our product candidates and technologies and the specialized nature of the regulatory approval process. Because our management team and key employees are not obligated to provide us with continued service, they could terminate their employment with us at any time without penalty. We do not maintain key person life insurance policies on any of our management team members or key employees. Our future success will depend in large part on our continued ability to attract and retain other highly qualified scientific, technical and management personnel, as well as personnel with expertise in clinical testing, manufacturing, governmental regulation and commercialization. We face competition for personnel from other companies, universities, public and private research institutions, government entities and other organizations.
如果我们的候选产品进入第二阶段和第三阶段临床试验,我们在管理增长和扩大业务方面可能会遇到困难。
随着 我们的候选产品进入并通过临床前研究和任何临床试验取得进展,我们将需要扩大我们的开发、 监管和生产能力,或与其他组织签订合同,以提供这些能力。今后,我们 预计必须管理与协作者或合作伙伴、供应商和其他组织的其他关系。我们管理 运营和未来增长的能力将要求我们继续改进我们的运营、财务和管理控制、报告 系统和程序。我们可能无法以高效 或及时的方式对管理信息和控制系统实施改进,并可能发现现有系统和控制中的缺陷。
如果 我们的任何候选产品被批准用于营销和商业化,而我们无法自行开发销售、营销和分销能力,或无法与第三方达成协议以可接受的条款履行这些功能,则我们将无法 将任何此类未来产品商业化。
我们 目前没有销售、营销或分销能力或经验。如果我们的任何候选产品获得批准,我们计划 与第三方合作销售、营销和分销我们的产品。否则,我们将不得不发展 内部销售、市场营销和分销能力,将任何批准的产品商业化,这将是昂贵和耗时的 ,或者更有可能的是与第三方合作来执行这些服务。如果我们依赖具有销售、营销和分销能力的第三方来营销我们的产品或决定与合作伙伴共同推广产品,我们将需要与第三方建立 并维护营销和分销安排,并且不能保证我们能够以可接受的条款达成此类安排(如果有的话)。在达成第三方营销或分销安排时,我们获得的任何收入将取决于第三方的努力,不能保证这些第三方将建立足够的销售和分销能力或成功地获得市场对任何经批准的产品的接受。如果我们决定直接营销我们的产品,我们将需要投入大量的财务和管理资源来培养一支具有 技术专长和支持分销、管理和合规能力的营销和销售队伍。如果我们无法自行或通过第三方将未来批准的任何 产品商业化,我们的业务、财务状况、运营结果和前景可能会受到重大不利影响。
| 33 |
如果 我们未能遵守美国和外国的监管要求,监管机构可能会限制或撤回我们可能获得的任何营销或商业化审批 并使我们受到其他可能对我们的业务造成实质性损害的处罚。
即使 如果我们获得了候选产品的营销和商业化批准,也不能保证我们不会受到未来的 或持续的监管审查,包括与产品上市后报告的患者不良体验和临床结果有关的审查,无论是在美国还是在我们寻求监管批准的任何外国司法管辖区。 FDA拥有重要的上市后权限,包括根据新的安全信息要求更改标签的权力,以及 要求进行上市后研究或临床试验以评估与使用产品相关的安全风险或要求将该产品从市场上召回的权力。FDA还有权要求批准后的风险评估和缓解策略(“REMS”) 计划,该计划可能会对批准的药物的分销或使用施加进一步的要求或限制。我们用于制造未来产品的制造商和制造设施(如果有)也将接受FDA和其他监管机构的定期审查和检查,包括是否继续符合CGMP要求。如果我们的第三方制造商、制造流程或设施发现任何新的或以前未知的问题,可能会导致对产品、制造商或设施的限制,包括将产品从市场上召回。如果我们依赖第三方制造商,我们将无法控制 此类制造商遵守适用的规章制度。任何产品推广和广告也将受到监管要求和持续监管审查的约束。如果我们或我们的合作者、制造商或服务提供商未能遵守 在我们寻求销售产品的美国或外国司法管辖区适用的持续法规要求,我们或他们可能会受到罚款、警告信、临床试验暂停、FDA拒绝批准未决申请或已批准申请的补充、暂停或撤回监管批准、产品召回和扣押、拒绝允许产品进口或出口、经营限制、禁令、民事处罚和刑事起诉等。
我们的业务存在重大的产品责任风险,我们获得足够保险的能力可能会对我们的业务、财务状况、运营结果或前景产生重大影响。
我们的 业务使我们面临治疗性 治疗的开发、测试、制造和营销过程中固有的重大产品责任风险。产品责任索赔可能会推迟或阻止我们开发计划的完成。如果我们成功营销产品, 此类声明可能导致FDA对我们的产品、我们的制造工艺和设施或我们的营销计划的质量和有效性进行调查,并可能召回我们的产品或采取更严重的执法行动,对可用于这些产品的批准适应症进行限制 或暂停或撤回批准。无论是非曲直或最终结果如何,责任索赔可能 还会导致对我们产品的需求减少、对我们声誉的损害、相关诉讼的辩护成本、转移管理层的时间和我们的资源、对试验参与者或患者的巨额金钱奖励以及我们股票价格的下跌。我们目前 有产品责任保险,我们认为该保险适用于我们的开发阶段,可能需要在营销我们的任何候选产品之前获得更高的级别。我们拥有或可能获得的任何保险可能无法为潜在的 责任提供足够的保险。此外,临床试验和产品责任保险正变得越来越昂贵。因此,我们可能无法 以合理的成本获得足够的保险,以保护我们免受产品责任索赔造成的损失,这些损失可能会对我们的业务产生 实质性的不利影响。
| 34 |
我们的 员工、主要调查人员、CRO和顾问可能从事不当行为或其他不当活动,包括不遵守监管标准和要求。
我们 面临员工、主要调查人员、CRO和顾问可能从事欺诈、其他不当行为或非法活动的风险 。这些当事人的不当行为可能包括故意不遵守FDA的规定、向FDA提供准确的信息、遵守我们可能制定的制造标准、遵守联邦和州医疗欺诈和滥用法律法规、 准确报告财务信息或数据或向我们披露未经授权的活动。特别是,医疗保健行业的销售、营销和业务安排受到广泛的法律法规、回扣、自我交易和其他滥用行为的约束。 这些法律法规可能会限制或禁止各种定价、折扣、营销和促销、销售佣金、 客户激励计划和其他业务安排。虽然我们努力保持对员工、承包商和顾问的严格工作流程和监督 ,但任何不当行为都可能使我们因在临床试验过程中不当使用所获得的信息而承担责任 ,这可能会导致监管制裁并严重损害我们的声誉。此外,并非总是能够识别和阻止此类不当行为,我们为检测和防止此类活动而采取的预防措施在控制未知或未管理的风险或损失方面或在保护我们免受政府调查或因不遵守此类法律或法规而引起的其他行动或诉讼方面可能无法有效 。如果对我们提起任何此类诉讼,而我们未能成功为自己辩护或维护自己的权利,这些行动可能会对我们的业务产生重大影响,包括 施加巨额罚款或其他制裁。
我们的内部计算机系统,或我们的CRO或其他承包商或顾问的系统,可能会出现故障或遭遇安全漏洞,这可能会 导致我们的产品开发计划发生实质性中断。
尽管实施了网络安全措施,但我们的内部计算机系统以及我们的CRO和其他承包商和顾问的计算机系统容易受到计算机病毒、未经授权的访问、自然灾害、恐怖主义、战争和电信以及电气故障的破坏 。这样的事件可能会导致我们的运营中断。例如,丢失临床前数据或未来任何涉及我们的候选产品的临床试验的数据可能会导致我们的开发和监管申报工作的延迟,并显著增加我们的成本。如果任何中断或安全漏洞导致我们的数据丢失或损坏,或者不适当地 泄露机密或专有信息,我们可能会承担责任,我们候选产品的开发可能会 延迟。
我们的 专有信息或我们客户、供应商和业务合作伙伴的专有信息可能会丢失,或者我们可能会遭遇安全漏洞。
在我们的正常业务过程中,我们收集和存储敏感数据,包括知识产权、临床试验数据、我们的专有 业务信息、我们的客户、供应商和业务合作伙伴的业务信息,以及我们客户、临床试验对象和员工的个人身份信息、我们的数据中心和我们的网络。安全处理、维护和传输此信息对我们的运营至关重要。尽管我们采取了安全措施,但我们的信息技术和基础设施可能容易受到黑客的攻击,或者由于员工错误、渎职或其他中断而被攻破。尽管据我们所知,我们迄今尚未经历任何此类重大安全漏洞,但任何此类漏洞都可能危及我们的网络,或我们CRO或其他第三方服务提供商的网络,存储在那里的信息可能会被访问、公开披露、丢失或被盗。任何此类访问、披露或其他信息丢失都可能导致法律索赔或诉讼,根据保护个人信息隐私的法律承担责任, 监管处罚,扰乱我们的运营,损害我们的声誉,并导致人们对我们的产品和我们进行临床试验的能力失去信心,这可能会对我们的业务和声誉产生不利影响,并导致我们药品获得监管批准的时间推迟 。尽管我们维持业务中断保险范围,但我们的保险可能不涵盖未来任何系统违规造成的所有损失 。
我们的信息技术系统故障 可能会严重扰乱我们的业务运营。
我们的业务越来越依赖于信息技术的使用,这意味着某些关键领域,如研发、生产和销售,在很大程度上依赖于我们或第三方提供商的信息系统。我们执行业务计划并遵守有关数据控制和数据完整性的法规要求的能力,在一定程度上取决于我们的信息技术系统或第三方服务提供商提供的IT系统和IT系统的持续且不间断的性能。这些系统容易受到各种来源的损坏,包括电信或网络故障、恶意人为行为和自然灾害。此外,尽管采取了网络安全和备份措施,我们的一些服务器仍可能 容易受到物理或电子入侵、计算机病毒和类似的破坏性问题的攻击。尽管我们和我们的第三方服务提供商已经采取了预防措施,以防止可能影响我们的IT系统的意外问题,但在升级我们的任何IT系统期间,持续或重复出现的系统故障或问题会中断我们生成和维护数据的能力,尤其是操作我们的专有技术平台的能力,这可能会对我们的业务运营能力产生不利影响。
| 35 |
如果我们不遵守保护环境、健康和人类安全的法律,我们的业务可能会受到不利影响 。
我们的研究、开发和制造涉及使用危险材料和各种化学品。我们在马里兰州盖瑟斯堡的设施中保留了大量的易燃和有毒化学品,这些化学品是我们的研究、开发和制造活动所需的 。对于这些危险材料的使用、制造、储存、搬运和处置,我们受联邦、州和地方法律法规的约束。我们相信,我们在盖瑟斯堡工厂存储、处理和处置这些材料的程序 符合盖瑟斯堡、马里兰州和美国劳工部职业安全与健康管理局的相关指导方针。尽管我们相信我们处理和处置这些材料的安全程序符合适用法规规定的 标准,但无法消除这些材料造成意外污染或伤害的风险。 如果发生事故,我们可能要对由此造成的损害负责,损失可能是巨大的。我们还受到许多环境、健康和工作场所安全法律法规的约束,包括管理实验室程序、接触血液传播病原体以及处理动物和生物危险材料的法律法规。虽然我们维持工人补偿保险以支付我们的费用和开支,但我们可能会因使用这些材料而对员工造成伤害,但该保险可能无法为潜在的责任提供足够的保险。我们不为可能因我们储存或处置生物或危险材料而对我们提出的环境责任或有毒侵权索赔投保。未来可能会采用影响我们运营的其他联邦、州和 地方法律法规。如果我们违反任何这些法律或法规,我们可能会招致巨额成本遵守,并 巨额罚款或处罚。
我们的信息技术系统可能面临严重中断,这可能会对我们的业务产生不利影响。
我们的信息技术和其他内部基础设施系统,包括公司防火墙、服务器、租用线路和互联网连接 ,都面临系统性故障的风险,这可能会扰乱我们的运营。如果我们的信息技术和其他内部基础设施系统的可用性出现重大中断,可能会导致我们与合作伙伴的合作中断 ,并延误我们的研发工作。
会计规则和法规或其解释的更改 可能会导致不利的会计费用或要求我们更改薪酬政策 。
制药公司的会计方法和政策,包括收入确认、研发和相关费用的政策,以及股票薪酬的会计处理,将受到包括美国证券交易委员会在内的相关会计机构的审查、解释和指导。会计方法或政策的变更或其解释可能需要我们重新分类、重述或以其他方式更改或修订我们的财务报表,包括本年度报告中包含的财务报表。
与我们知识产权相关的风险
如果 我们无法为我们的技术或候选产品获得并实施专利保护,我们候选产品的开发和商业化可能会受到不利影响。
我们的成功在一定程度上取决于我们获得和维护专利和其他形式的知识产权的能力,包括为我们的候选产品获得和维护他人知识产权的许可 、用于制造我们的候选产品的方法和治疗使用我们候选产品的患者的方法 ,以及我们保护我们的商业秘密、防止 第三方侵犯我们的专有权和在不侵犯他人专有权利的情况下运营的能力。截至本年度报告发布之日,我们已向美国专利商标局(USPTO)提交了6项专利申请,涉及我们的HDAC抑制剂小分子给药平台和我们的主要候选产品罗比奥尿苷的各个方面。但是,我们可能无法及时或根本无法就我们的候选产品或交付技术的某些方面申请专利。 到目前为止,已授予4项美国专利和18项欧洲专利。不保证我们的任何未决专利申请 将导致颁发或授予专利,不保证我们的任何颁发、授予或许可的专利稍后不会被发现无效或 不可执行,也不保证任何颁发、授予或许可的专利将包括足够广泛的权利要求,足以涵盖我们的候选产品或交付技术,或针对我们的竞争对手提供有意义的保护。此外,专业制药公司的专利地位可能非常不确定,因为它涉及复杂的法律和事实问题。我们将能够保护我们的专有 权利,使其不被第三方未经授权使用,前提是我们当前和未来的专有技术和候选产品 受有效和可强制执行的专利保护,或作为商业秘密有效保留。如果第三方披露或挪用我们的专有权,可能会对我们的市场地位产生重大不利影响。
| 36 |
美国专利商标局和各种外国政府专利机构要求在专利过程中遵守一些程序、文件、费用支付和其他 要求。在某些情况下,不遵守规定可能会导致专利或专利申请的放弃或失效,从而导致相关司法管辖区的专利权部分或全部丧失。在这种情况下,竞争对手 可能会比其他情况下更早进入市场。美国专利商标局和外国专利局在授予专利时采用的标准并不总是统一或可预测的。例如,对于药品专利中允许的专利标的或权利要求的范围,没有统一的全球政策。因此,我们不知道未来对我们的专有产品和技术的保护程度。虽然我们将努力适当地使用专利等知识产权来保护我们的候选产品,但获得专利的过程既耗时又昂贵,有时甚至不可预测。
我们 可能出于商业原因决定不再追求或放弃在美国或其他地方的某些知识产权,包括 由于发明人或此类知识产权、现有技术或保护范围的不合作,或其他原因。
一旦授予专利,在准予或授予之后的一段时间内,专利可以继续在法院或专利局或类似的诉讼程序中接受反对、干扰、复审、授予后复审、当事各方之间的复审、无效或派生诉讼,在此期间,第三方可以对此类初始授予提出异议。在这种可能持续很长时间的诉讼过程中,专利权人可能被迫限制由此受到攻击的允许或批准的权利要求的范围,或者可能完全失去允许或批准的权利要求。此外,不能保证:
| ● | 其他 将不能或可能不能制造、使用或销售与我们的候选产品相同或相似但不在我们拥有或许可的专利权利要求范围内的化合物; | |
| ● | 我们 或我们的许可人、合作者或任何未来的合作者最先做出我们拥有或许可的每项已颁发专利和未决专利申请所涵盖的发明。 | |
| ● | 我们 或我们的许可人、合作者或任何未来的合作者最先提交涉及我们发明的某些方面的专利申请 ; | |
| ● | 其他 不会在不侵犯我们知识产权的情况下独立开发类似或替代技术或复制我们的任何技术 ; | |
| ● | 第三方不得挑战我们的专利,如果受到挑战,法院可能不会认为我们的专利有效、可强制执行和受到侵犯; |
| ● | 我们拥有或许可的任何 颁发的专利将为我们提供任何竞争优势,或不会受到第三方的挑战; | |
| ● | 我们 可以开发其他可申请专利的专有技术; | |
| ● | 他人的专利不会对我们的业务产生不利影响;以及 | |
| ● | 我们的 竞争对手不在我们没有可强制执行专利权的国家/地区开展研发活动,然后 利用从此类活动中学到的信息来开发在我们的主要商业市场销售的有竞争力的产品。 |
| 37 |
我们 打算从第三方所有者或被许可人那里许可专利权。如果这些所有者或被许可人没有正确或成功地获得、 维护或强制执行此类许可所依据的专利,或者如果他们保留或许可他人任何竞争权利,我们的竞争地位和业务前景可能会受到不利影响。我们可能无法在全球范围内保护我们的知识产权。
在美国和世界范围内获得涵盖我们技术的有效且可强制执行的已颁发或已授权专利可能成本极高。在我们未获得专利保护的司法管辖区 ,竞争对手可以使用我们的技术开发他们自己的产品,并进一步将其他侵权产品出口到我们拥有专利保护的地区,但在与美国相比更难实施专利的地区 。竞争对手的产品可能会在我们没有颁发或授予专利的司法管辖区与我们未来的产品竞争 ,或者我们发布或授予的专利声明或其他知识产权不足以阻止竞争对手在这些司法管辖区的活动 。某些国家的法律制度,特别是某些发展中国家的法律制度,使专利难以强制执行,而这些国家可能不承认其他类型的知识产权保护,特别是与生物制药相关的知识产权保护。 这可能使我们难以防止在某些司法管辖区侵犯专利或营销竞争产品,侵犯我们的专有 权利。在外国司法管辖区强制执行我们的专利权的诉讼可能会导致巨大的成本,并将我们的努力和注意力转移到我们业务的其他方面。
我们 通常首先向USPTO提交临时专利申请(优先权申请)。美国公用事业申请和根据专利合作条约(PCT)提出的国际申请通常在优先权申请后12个月内提交。根据PCT的备案,可以在欧盟、日本、澳大利亚和加拿大等国家和地区提交国家和地区专利申请。 到目前为止,我们还没有在可能提供此类保护的所有国家和地区司法管辖区申请专利保护。此外,我们可能会决定在授予之前放弃国家和地区的专利申请。最后,每一项国家或区域专利的授予程序是一个独立的程序,这可能导致在某些法域中,申请可能被有关登记当局拒绝,而由其他法域批准。根据国家/地区的不同,可能会对同一候选产品或技术授予不同范围的专利保护,这一点也很常见。某些司法管辖区的法律对知识产权的保护程度不如美国法律,许多公司在此类司法管辖区保护和捍卫知识产权方面遇到了很大困难。如果我们或我们的许可人在保护知识产权方面遇到困难,或因其他原因无法有效保护对我们在这些司法管辖区的业务至关重要的知识产权,这些权利的价值可能会降低 ,我们可能会面临来自这些司法管辖区其他人的额外竞争。许多国家都有强制许可的法律,根据这些法律,专利权人可能会被强制向第三方授予许可。此外,许多国家限制专利对政府机构或政府承包商的可执行性。在这些国家,专利权人的补救措施可能有限,这可能会大大降低这种专利的价值。如果我们或我们的任何许可人被迫向第三方授予与我们的业务相关的任何专利的许可,我们在相关司法管辖区的竞争地位可能会受到损害,我们的业务和运营结果可能会受到不利影响。
我们 或我们的许可人,或任何未来的合作伙伴或战略合作伙伴可能会受到第三方索赔或诉讼,指控 侵犯专利或其他专有权利或试图使专利或其他专有权利无效,我们可能需要 诉诸诉讼来保护或强制执行我们的专利或其他专有权利,所有这些都可能代价高昂、耗时、延迟 或阻止我们候选产品的开发和商业化,或者将我们的专利和其他专有权利置于风险之中。
我们 或我们的许可人,或任何未来的合作伙伴或战略合作伙伴可能会因侵犯或挪用专利或其他专有权而受到第三方索赔。根据我们的许可或合作协议,我们通常有义务赔偿我们的许可人或合作者因我们侵犯知识产权而造成的损害,并使其不受损害。如果我们或我们的许可方,或任何未来的合作伙伴或战略合作伙伴被发现侵犯了第三方专利或其他知识产权,如果我们被发现故意侵权,我们可能被要求 支付损害赔偿金,可能包括三倍的损害赔偿金。此外,我们或我们的 许可方、协作者或任何未来的战略合作伙伴可能会选择向第三方寻求或被要求向第三方寻求许可,而 可能无法以可接受的条款获得许可。即使可以按可接受的条款获得许可,这些权利也可能是非排他性的, 这可能会使我们的竞争对手获得许可给我们的相同技术或知识产权。如果我们未能获得 所需的许可证,我们或我们的合作者或任何未来的合作者可能无法基于我们的技术有效地销售候选产品,这可能会限制我们创造收入或实现盈利的能力,并可能阻止我们产生足以维持我们运营的收入 。此外,我们可能会发现有必要提出索赔或提起诉讼,以保护或强制执行我们的专利或其他知识产权。我们为与专利或其他专有权有关的任何诉讼或其他诉讼辩护或提起诉讼的成本可能是巨大的,即使解决方案对我们有利,诉讼也会分散我们管理层的 注意力。我们的一些竞争对手可能比我们更有效地承担复杂专利诉讼的费用,因为他们拥有更多的资源。专利诉讼或其他诉讼的发起和继续带来的不确定性可能会推迟我们的研发工作,并限制我们继续运营的能力。
| 38 |
如果我们对第三方提起法律诉讼,以强制执行涵盖我们的产品或技术之一的专利,被告 可以反诉我们的专利无效或不可强制执行。在美国的专利诉讼中,被告声称无效或不可执行的反诉很常见。质疑有效性的理由可能是据称未能满足几项法定要求中的任何一项,例如,缺乏新颖性、明显或无法实施。不可执行性断言的理由可能是,与专利诉讼有关的人在起诉期间向美国专利商标局隐瞒了相关信息,或做出了误导性声明。 专利诉讼期间法律断言无效和不可执行性的结果是不可预测的。关于有效性问题,例如,我们不能确定没有无效的现有技术,而我们和专利审查员 在起诉期间并不知道这一点。如果被告胜诉,我们将至少部分甚至全部失去对我们的一个或多个产品或我们平台技术的某些方面的专利保护。 这种专利保护的丧失可能会对我们的业务产生实质性的不利影响。如果竞争对手围绕我们受保护的技术进行设计而不合法侵犯我们的专利或 其他知识产权,则专利和其他知识产权也无法保护我们的技术。
第三方的知识产权可能会对我们将候选产品商业化的能力产生不利影响,我们可能需要 提起诉讼或从第三方获得许可,以便开发或营销我们的候选产品。此类诉讼或许可证可能非常昂贵,或者无法以合理的商业条款获得。
如果向第三方或其他第三方知识产权颁发的专利涵盖我们的产品 或其元素,或与我们的发展计划相关的制造或使用,我们的竞争地位可能会受到影响。在这种情况下,我们可能无法开发 或将产品或候选产品商业化,除非我们成功提起诉讼以使相关的第三方知识产权无效或无效,或者与知识产权持有人签订许可协议(如果按商业上的合理条款可用)。
第三方知识产权权利人也可以积极向我们提出侵权索赔。我们不能保证我们 能够成功解决或以其他方式解决此类侵权索赔。如果我们不能按照我们可以接受的条款成功解决未来的索赔,我们可能被要求进行或继续进行代价高昂、不可预测和耗时的诉讼,并可能被阻止 或在营销我们的产品方面遇到重大延误。如果我们在任何此类纠纷中失败,除了被迫支付损害赔偿金外, 我们可能被暂时或永久禁止将任何被认定为侵权的候选产品商业化。如果可能,我们 还可能被迫重新设计候选产品,以便我们不再侵犯第三方知识产权 。这些事件中的任何一项,即使我们最终获胜,也可能需要我们转移大量的财务和管理资源 ,否则我们将能够投入到我们的业务中。
如果 我们未能履行任何许可、协作或其他协议下的义务,我们可能被要求支付损害赔偿金,并可能 失去开发和保护我们的候选产品和交付技术所必需的知识产权,或者 我们可能会失去授予再许可的某些权利。
我们当前的许可证,以及我们未来签订的任何许可证,都可能对我们施加各种开发、商业化、资金、里程碑、版税、勤勉、再许可、保险、专利起诉和强制执行以及其他义务。如果我们违反 任何这些义务,或以未经授权的方式使用许可给我们的知识产权,我们可能被要求支付损害赔偿金 ,许可方可能有权终止许可,这可能导致我们无法开发、制造和销售许可技术涵盖的产品,或使竞争对手能够获得许可技术。此外,我们的许可人可能拥有或控制未经许可给我们的知识产权,因此,我们可能会受到索赔,无论其是非曲直,我们侵犯或以其他方式侵犯许可人的权利。此外,虽然我们目前无法确定我们需要为未来产品的销售支付的版税义务的金额(如果有),但金额可能很大。 我们未来的版税义务的金额将取决于我们在目标为 开发和商业化的产品中使用的技术和知识产权。因此,即使我们能够开发产品并将其商业化,我们也可能无法实现 或保持盈利。
| 39 |
如果我们无法保护我们的商业秘密的机密性,我们的业务和竞争地位将受到损害。
除了为我们的候选产品和交付技术的某些方面寻求专利保护外,我们还考虑商业机密,包括机密和非专利的技术诀窍,这对保持我们的竞争地位很重要。我们保护商业秘密以及机密和非专利专有技术,部分是通过与有权访问此类知识的各方签订保密和保密协议,例如我们的员工、公司合作者、外部科学合作者、CRO、合同制造商、 顾问、顾问和其他第三方。我们还与我们的员工和顾问 签订保密和发明或专利转让协议,规定他们有义务保密并将他们的发明转让给我们。尽管做出了这些努力,但 任何一方都可能违反协议并泄露我们的专有信息,包括我们的商业秘密,我们可能无法 针对此类违规行为获得足够的补救措施。执行一方非法披露或挪用交易秘密的主张是困难、昂贵和耗时的,结果不可预测。此外,美国的一些法院和某些外国司法管辖区不太愿意或不愿意保护商业秘密。如果我们的任何商业秘密是由竞争对手合法获取或独立开发的,我们将无权阻止他们使用该技术或信息与我们竞争。如果我们的任何商业秘密被泄露给竞争对手或由竞争对手自主开发,我们的竞争地位将受到损害。
我们 可能会受到指控,即我们或我们的员工或顾问错误地使用或披露了我们的员工 或顾问的前雇主或其客户的所谓商业机密。这些索赔的辩护成本可能很高,如果我们不成功辩护,我们 可能会被要求支付金钱损害赔偿,并可能会失去宝贵的知识产权或人员。
我们的许多员工 以前受雇于大学、生物技术或制药公司,包括我们的竞争对手或潜在竞争对手。尽管目前没有针对我们的索赔待决,但我们可能会受到这些员工或我们因疏忽或以其他方式使用或泄露其前雇主的商业秘密或其他专有信息的索赔。可能需要 诉讼来对抗这些索赔。如果我们未能为此类索赔辩护,除了支付金钱损害赔偿外,我们还可能失去 宝贵的知识产权或人员。失去关键研究人员或他们的工作产品可能会阻碍我们将候选产品商业化的能力,或阻止我们将其商业化,这可能会严重损害我们的业务。即使我们成功地对这些索赔进行了辩护,诉讼也可能导致巨额成本,并分散管理层的注意力。
如果我们的商标和商号得不到充分保护,我们可能无法在我们感兴趣的市场建立知名度 ,我们的业务可能会受到不利影响。
我们的商标或商品名称可能会受到质疑、侵犯、规避或宣布为通用商标,或被确定为侵犯了其他商标。 我们可能无法保护我们对这些商标和商品名称的权利,或者可能被迫停止使用这些名称,我们需要这些名称 才能在我们感兴趣的市场中获得潜在合作伙伴或客户的名称认可。如果我们不能根据我们的商标和商品名称建立名称识别,我们可能无法有效竞争,我们的业务可能会受到不利影响。
| 40 |
与政府监管和产品审批相关的风险
我们 可能无法获得美国或外国监管机构的批准,因此无法将我们的候选产品商业化。
我们的 候选产品受广泛的政府法规的约束,其中包括药物的研究、测试、开发、 制造、安全性、有效性、批准、记录保存、报告、标签、储存、包装、广告和促销、定价、 营销和分销。在美国和许多外国司法管辖区,需要完成严格的临床前测试和临床试验以及广泛的监管审批程序,才能上市。满足这些和其他 法规要求的成本高昂、耗时、不确定,而且会出现意外延误。我们可能开发的候选产品 都可能无法获得我们或合作者开始销售所需的监管批准。
我们在进行和管理获得监管批准所需的临床试验方面的经验非常有限,包括FDA的批准 。获得FDA和其他批准所需的时间是不可预测的,但通常需要在临床试验开始 后数年,这取决于候选产品的类型、复杂性和新颖性。FDA及其国外同行在监管我们时使用的标准并不总是可预测的或统一的,而且可以改变。我们对临床前和临床活动数据执行的任何分析都需要得到监管机构的确认和解释,这可能会推迟、限制或阻止监管部门的批准。由于新的政府法规,例如,未来的立法或行政行动,或在产品开发、临床试验和FDA监管审查期间FDA政策的变化,我们还可能遇到意想不到的延迟或成本增加。无法预测是否会颁布立法更改,或FDA或外国法规、指南或解释是否会更改,或此类更改可能产生的影响(如果有的话)。
在获得所需审批方面的任何延误或失败都可能对我们从我们正在寻求批准的特定候选产品 中获得收入的能力产生重大不利影响。此外,任何销售产品的监管批准都可能受到我们销售该产品的批准用途的限制,或标签或其他限制。此外,FDA 有权要求风险评估和缓解策略(REMS)计划作为NDA或生物制品许可证申请(BLA)的一部分或在获得批准后 ,该计划可能会对批准的药物或生物的分发或使用施加进一步的要求或限制,例如限制仅向经过专门培训的特定医生或医疗中心开处方 ,将治疗限制为满足某些安全使用标准的患者,并要求接受治疗的患者登记注册。这些限制和限制可能会限制产品的市场规模 并影响第三方付款人的报销。
| 41 |
如果我们或我们的合作者、制造商或服务提供商未能遵守医疗保健法律法规,我们或他们可能会 受到执法行动,这可能会影响我们开发、营销和销售我们产品的能力,并可能损害我们的声誉。
我们 和我们的合作者受联邦、州和外国医疗法律法规的约束,涉及欺诈和滥用以及患者的 权利。这些法律法规包括:
| ● | 美国联邦医疗保健计划反回扣法,除其他事项外,禁止个人直接或间接索要、收受或提供报酬,以引诱个人推荐医疗保健项目或服务,或购买或订购项目或服务,这些项目或服务的付款可根据联邦医疗保险或医疗补助计划进行; | |
| ● | 美国联邦虚假申报法,其中禁止个人或实体故意提交或导致提交虚假或欺诈性的政府资助计划(如Medicare或Medicaid)的付款索赔,以及 可能因向客户或第三方做出的声明和陈述而适用于我们的索赔; | |
| ● | 美国联邦《健康保险携带和责任法案》(HIPAA)和《经济和临床健康信息技术法案》(HITECH),禁止执行欺诈医疗保健计划的计划,对个人可识别健康信息的隐私、安全和传输施加要求,并要求在某些违反个人可识别健康信息安全的情况下通知受影响的个人和监管机构; | |
| ● | 国家医生支付透明度计划下的联邦开放式支付条例已根据患者保护和平价医疗法案发布,经医疗保健和教育负担能力协调法案修订,并将要求联邦医疗保险、医疗补助和儿童健康保险计划涵盖的药品和生物药物的制造商报告向医生和教学医院支付的所有咨询费、旅费报销、研究补助金和价值超过10美元的其他付款或礼物; 以及 | |
| ● | 州 可与上述每个联邦法律相媲美的法律,例如,适用于商业保险公司和其他非联邦付款人的反回扣和虚假索赔法律、强制性企业监管合规计划的要求,以及与患者数据隐私和安全相关的法律。 |
如果我们的业务被发现违反了任何此类要求,我们可能会受到惩罚,包括民事或刑事处罚、 金钱损害赔偿、我们业务的缩减或重组、失去获得FDA批准的资格、或排除 参与政府合同、医疗保健报销或其他政府计划,包括Medicare和Medicaid, 任何这些都可能对我们的财务结果造成不利影响。尽管有效的合规计划可以降低因违反这些法律而受到调查和起诉的风险,但这些风险无法完全消除。因涉嫌或涉嫌违规而对我们采取的任何行动都可能导致我们产生巨额法律费用,并可能转移我们管理层对业务运营的注意力,即使我们的辩护成功。此外,在资金、时间和资源方面,实现并持续遵守适用的法律法规对我们来说可能是昂贵的。
如果我们或我们的合作者、制造商或服务提供商未能遵守适用的联邦、州或外国法律或法规, 我们可能会受到执法行动的影响,这可能会影响我们成功开发、营销和销售我们的产品的能力, 可能会损害我们的声誉,并导致市场对我们产品的接受度降低。这些执法行动包括:
| ● | 监管检查结果为不良的; | |
| ● | 警告信 封; |
| ● | 自愿或强制召回产品,或向医疗保健专业人员发出公开通知或医疗产品安全警报; | |
| ● | 限制或禁止销售我们的产品; |
| 42 |
| ● | 限制或禁止进口或出口我方产品; | |
| ● | 暂停审查或拒绝批准待决申请或已批准申请的补充申请; | |
| ● | 排除 参加政府资助的医疗保健计划; | |
| ● | 排除 授予我们产品的政府合同的资格; | |
| ● | 暂停或撤销产品审批; | |
| ● | 产品 缉获量; | |
| ● | 禁令; 和 | |
| ● | 民事和刑事处罚和罚款。 |
我们开发的任何药物都可能受到不利的定价法规、第三方报销做法或医疗改革举措的约束, 从而损害我们的业务。
管理新药上市审批、定价和报销的法规因国家而异。有些国家/地区 需要批准药品的销售价格才能将其上市。在许多国家/地区,定价审查期从营销或产品许可批准后开始。在一些国外市场,处方药定价即使在获得初步批准后,仍然受到政府的持续控制。尽管我们打算监测这些法规,但我们的项目目前处于开发的早期阶段,我们将在几年内无法评估价格法规的影响。因此, 我们可能会在特定国家/地区获得产品的监管批准,但随后会受到价格法规的约束,这些法规会推迟该产品的商业发布 ,并对我们在该国家/地区销售该产品所能产生的收入产生负面影响。
我们将任何产品商业化的能力还将在一定程度上取决于政府卫生行政部门、私人健康保险公司和其他组织对这些产品和相关治疗的报销程度。即使我们成功地将一个或多个产品推向市场,这些产品也可能不被认为具有成本效益,任何产品的报销金额可能不足以让我们在竞争的基础上销售我们的产品。由于我们的计划处于开发的早期阶段,我们目前无法确定其成本效益或可能的报销水平或方法。越来越多地,向患者或医疗保健提供者(如政府和私人保险计划)报销的第三方付款人要求 制药公司在标价的基础上向他们提供预定的折扣,并寻求降低药品的收费价格或报销金额。如果根据我们的开发和其他成本,我们能够为我们开发的任何产品收取的价格或为此类产品提供的报销 不够充分,我们的投资回报可能会受到不利影响。
我们目前的候选产品将需要在门诊医生的监督下进行管理。根据当前适用的美国法律,在以下情况下,某些通常不是自行给药的药物(包括注射药物)可能符合联邦医疗保险B部分计划的承保范围:
| ● | 它们 是医生服务的意外事件; | |
| ● | 对于根据公认的医疗实践标准给予其治疗的疾病或伤害的诊断或治疗而言,它们是合理和必要的;以及 | |
| ● | 它们 已获得FDA批准,符合法规的其他要求。 |
| 43 |
在获得新批准的药物的承保范围方面可能会有重大延误,并且承保范围可能比该药物获得FDA批准的目的 更为有限。此外,有资格获得保险并不意味着任何药物在所有情况下都会得到报销,或者报销的费率可以覆盖我们的成本,包括研究、开发、制造、销售和分销。新药的临时付款(如果适用)也可能不足以支付我们的成本,并且可能不会成为永久付款。报销可能基于已报销的低成本药品的允许付款 ,可能被合并到其他服务的现有付款中,并可能反映预算 限制或Medicare数据中的缺陷。药品净价可以通过政府医疗保健计划或私人付款人要求的强制性折扣或回扣,以及未来任何限制药品进口的法律放宽来降低,这些法律目前限制从那些国家/地区以低于美国的价格销售药品。第三方付款人在设定自己的报销费率时通常依赖联邦医疗保险覆盖政策和付款限制 。对于我们开发并获得监管批准的新药,我们无法迅速从政府资助的 和私人付款人那里获得保险和足够的报销率,这可能会对我们的经营业绩、我们筹集产品商业化所需资金的能力以及我们的财务状况产生实质性的不利影响。
我们 相信,政府和第三方付款人控制或降低医疗保健成本的努力,以及扩大医疗保健可获得性的立法和监管建议,将继续影响制药和生物制药公司的业务和财务状况。近年来,有人提议对美国和其他主要医疗保健市场的医疗保健系统进行多项立法和监管改革,这些努力在最近几年得到了大幅扩大。这些进展包括: 2006年1月颁布并生效的处方药福利立法,某些州颁布的医疗改革立法,以及经《医疗保健和教育负担能力协调法》(ACA)修订的《患者保护和平价医疗法案》(ACA),这是一项旨在扩大获得医疗保险的机会、减少或限制医疗支出增长的全面法律 ,并加强针对欺诈和滥用行为的补救措施。ACA还包含一些条款,这些条款将通过对业务实践施加额外成本和改变来影响制药行业和其他医疗保健相关行业的公司。影响制药公司的条款包括:
| ● | 已增加销售到Medicaid计划中的药品的强制回扣,并已将回扣要求扩展到在基于风险的Medicaid管理的医疗保健计划中使用的药品 ; | |
| ● | 《公共卫生服务法》下的340B药品定价计划已经扩展,要求销售给某些关键准入医院、癌症医院和其他承保实体的药品必须有折扣; | |
| ● | 制药公司被要求向属于联邦医疗保险D部分覆盖缺口的患者提供品牌药品折扣,通常被称为“甜甜圈洞”;以及 | |
| ● | 制药公司需要向联邦政府支付年度非税可抵扣费用,该费用基于各公司对某些联邦医疗保健计划(如Medicare、Medicaid、退伍军人事务部和国防部)前一年品牌产品总销售额的市场份额 。由于我们预计我们的品牌药品销售额只占联邦健康计划药品市场的一小部分,因此我们预计这项年度评估不会对我们的财务状况产生实质性影响。 |
此外, 我们无法预测未来可能采取什么医疗改革举措。联邦和州立法和监管 可能会进一步发展,我们预计美国正在进行的举措将增加药品定价的压力。此类改革可能会对我们可能开发并可能获得监管批准的候选产品的预期收入产生不利影响 ,并可能影响我们的整体财务状况和开发候选产品的能力。
我们从联邦政府获得服务、报销或资金的能力可能会受到联邦支出可能减少的影响。
美国联邦政府机构目前面临潜在的大幅开支削减。根据2011年的《预算控制法案》,国会未能通过2013年至2021年至少1.2万亿美元的赤字削减措施,引发了对 大多数联邦计划的自动削减。这些削减将包括从2013年开始,每个财年向提供商支付的联邦医疗保险总额最高可减少2%。根据2013年1月1日颁布的《2012年美国纳税人救济法》,这些自动减税措施的实施被推迟到2013年3月1日。其中一些自动削减已经实施。这些自动削减对我们业务的全面影响 尚不确定。如果联邦支出减少,预计的预算缺口也可能影响相关机构,如FDA或NIH继续在当前水平上运作的能力。分配给联邦拨款和合同的金额 可能会减少或取消。这些削减还可能影响相关机构及时审查和批准药物研究以及开发、制造和营销活动的能力,这可能会推迟我们开发、营销和销售我们可能 开发的任何产品的能力。
| 44 |
如果我们的任何候选产品获得市场批准,而我们或其他人后来发现该候选产品造成的不良副作用,我们营销和从候选产品获得收入的能力可能会受到影响。
如果我们的任何候选产品获得监管部门的批准,而我们或其他人发现由我们的产品之一引起的不良副作用,可能会发生以下任何不良事件,这可能会导致我们的重大收入损失, 对我们的运营和业务结果产生实质性和不利的影响:
| ● | 监管部门可以撤回对该产品的批准或没收该产品; | |
| ● | 我们 可能被要求召回该产品或改变给患者服用该产品的方式; | |
| ● | 可对特定产品的销售或该产品或其任何组件的制造工艺施加额外的 限制。 | |
| ● | 我们 可能受到罚款、禁令或施加民事或刑事处罚; |
| ● | 监管当局可能要求添加标签说明,例如“黑匣子”警告或禁忌症; | |
| ● | 我们 可能需要创建一份药物指南,概述此类副作用的风险,以便分发给患者; | |
| ● | 我们 可能会被起诉,并对给患者造成的伤害承担责任; | |
| ● | 产品的竞争力可能会降低;以及 | |
| ● | 我们的声誉。 |
与我们的普通股相关的风险
如果 我们未能遵守纳斯达克股票市场的持续上市要求,可能导致我们的普通股被摘牌, 这可能对我们证券的市场价格和流动性产生不利影响,并可能产生其他不利影响。
2023年8月31日,我们收到纳斯达克股票市场有限责任公司(以下简称"纳斯达克")纳斯达克上市资格工作人员的信函 ,其中指出,在连续30个工作日期间, 2023年7月20日至2023年8月30日 该公司的普通股未能按照纳斯达克上市规则5550(a)(2)("最低买入价要求")在纳斯达克资本市场继续上市的要求维持每股1.00美元的最低收盘价。根据纳斯达克上市规则第5810(c)(3)(A)条,该公司的初始期限为180个日历日, 或 至2024年2月27日(the“合规期”),以重新符合最低投标价要求。为了 恢复合规性,公司普通股的收盘价必须至少连续10个交易日达到或超过每股1美元,除非纳斯达克延长了该期限。由于公司尚未恢复遵守最低投标价 要求, 2024年2月27日,公司要求并获得了额外180天 的时间以恢复合规性(“额外合规期”)。为符合资格,该公司必须满足持续 公众持股市值的上市要求和纳斯达克资本市场的所有其他初始上市标准, 最低出价要求除外,并且我们需要提供书面通知,说明我们打算在第二个合规期内纠正出价 不足之处,如有必要,进行反向股票分割。纳斯达克工作人员确定,该公司有资格在额外的180个日历日期间,或直到2024年8月26日,恢复合规(上市规则1 5810(c)(3)(A))。
| 45 |
公司认为,它可以通过市场力量有机地重新获得合规性,或者(如有必要)在额外合规期结束前实施反向库存 拆分。但是,如果公司在额外合规期内无法重新遵守最低出价 要求,纳斯达克将通知公司,我们的普通股将被 退市。届时,本公司可就纳斯达克的退市决定向纳斯达克听证会小组提出上诉。虽然纳斯达克 向公司发出的不符合规定的通知对我们普通股的上市没有立即影响,我们的普通股将继续 在纳斯达克资本市场上市,代码为"SHPH",但不能保证我们将重新遵守 最低出价要求或继续遵守任何其他纳斯达克继续上市要求。我们将继续 监控我们普通股的收盘价,并可能(如适用)考虑可用选项,以重新符合 最低出价价要求。
可换股票据的财务契约可能导致违约,并可能对我们的流动性造成重大不利影响。
尽管 我们有能力通过现金或发行普通股股份清偿可换股票据债务,但如果我们不符合某些股权条件,包括但不限于股权条件计量期内 每个交易日的成交量或价格下跌、授权股票下跌或出现 票据中定义的违约,我们可能需要以现金偿还可换股票据及其利息。可能引发违约的事件包括未能向票据持有人支付任何金额、破产、资不抵债或违反 现金燃烧契约。
虽然本公司的管理层正在努力改善我们的内部 控制和程序,但目前管理层已确定,我们的 内部控制被认为是不充分的,这可能导致我们的财务报告不可靠,并导致 错误信息被传播给公众。
我们的管理层负责建立和维护对财务报告的充分内部控制。根据修订后的1934年《证券交易法》(以下简称《交易法》)规则13a-15(F) 的定义,财务报告内部控制是指由主要高管和主要财务官设计或在其监督下,由董事、管理层和其他人员组成的董事会 为财务报告的可靠性和根据公认的会计原则为外部目的编制财务报表提供合理保证的程序,包括以下政策和程序:
| ● | 与维护合理、详细、准确和公平地反映我们资产的交易和处置的记录有关; |
| ● | 提供必要的交易记录,以便按照公认的会计原则编制财务报表,并且公司的收入和支出仅根据公司管理层和/或董事的授权进行;以及 | |
| ● | 为防止或及时发现可能对财务报表产生重大影响的公司资产的未经授权收购、使用或处置提供合理保证。 |
我们 需要包括一份关于我们对财务报告的内部控制有效性的管理层报告。我们预计,执行为符合管理认证要求所需的系统和流程评估、测试和 补救措施,会产生额外的费用和转移管理层的时间。
目前,我们 没有足够数量的员工来划分职责,可能无法负担增加员工或聘请 外部顾问或专业人员来解决我们缺乏员工的问题。在我们的测试过程中,我们可能会发现我们可能无法及时补救的其他缺陷 。如果我们不能提供可靠的财务报告或防止欺诈,我们的业务和运营 结果可能受到损害,投资者可能对我们报告的财务信息失去信心,如果市场发展,我们的普通股的交易价格可能会大幅下跌。
| 46 |
《就业法案》减少了我们需要披露的信息。
根据《就业法案》,我们需要披露的信息已通过多种方式减少。
作为一家在公司上一财年毛收入低于10亿美元的公司,根据《就业法案》(EGC)的定义,该公司是一家新兴的 成长型公司。我们将保留这一地位,直到下列中最早的一天:(A)财政年度的最后一天,我们的年度总收入为1,000,000,000美元(根据《就业法案》中规定的通胀指数)或更多;(B)根据修订后的1933年《证券法》(《证券法》)的有效登记声明,普通股首次出售之日起五周年之后的财政年度的最后一天; (C)我们在过去三年内发行了超过1,000,000,000美元的不可转换债券的日期;或(D) 我们被视为“大型加速申请者”的日期,如交易法第12b-2规则或其任何继承者所定义。作为一名雇员补偿委员会,本公司可免除以下责任:
| ● | 公司被排除在萨班斯-奥克斯利法案(“萨班斯-奥克斯利法案”)第404(B)条之外,否则本应要求公司的审计师对公司财务报告的内部控制进行证明和报告。就业法案 还修订了《萨班斯-奥克斯利法案》第103(A)(3)条,规定:(I)公司轮换审计或变更审计师报告以包括审计师讨论和分析(如果PCAOB采用审计师轮换要求的情况下)的任何新规则将不适用于对EGC的审计;以及(Ii)除非美国证券交易委员会另有决定,否则PCAOB未来通过的任何其他规则将不适用于公司的审计。 |
| ● | 就业法案修订了证券法第7(A)节,规定本公司无需在首次公开募股注册表和任何其他注册表中提交超过两年的经审核财务报表,也无需根据S-K法规第301项提供与该首次公开募股相关的最早审核期间之前的任何期间的选定财务数据。此外,在非上市公司(即并非萨班斯-奥克斯利法案第2(A)节所界定的“发行人”的公司)被要求遵守该新的或修订的会计准则之前,本公司无需遵守任何新的或修订的财务会计准则。交易所 法案已做出相应更改,涉及定期报告要求,如果公司被要求遵守这些要求,该要求将适用。 |
| ● | 只要我们是EGC,我们就可以遵守S-K法规第402项,该条款要求在高管薪酬方面进行广泛的定量和定性披露 ,披露“较小的报告公司”所需的更有限的信息。 | |
| ● | 《就业法案》还将豁免我们遵守根据《多德-弗兰克法案》强加给美国上市公司的下列与薪酬相关的额外披露条款:(I)《交易所法案》第14A(A)节所要求的关于高管薪酬的咨询投票;(Ii)《交易所法案》第14A(B)节关于股东就“黄金降落伞”薪酬进行咨询投票的要求;(Iii)《交易所法案》第14(I)节关于披露高管薪酬与我们财务业绩之间关系的要求;及(Iv)《多德-弗兰克法案》第953(B)(1)节关于披露首席执行官薪酬与员工薪酬中值之间关系的要求。 |
| 47 |
我们的股价可能会波动,购买我们普通股的人可能会遭受重大损失。
自 于2022年8月29日在纳斯达克股票市场有限责任公司或纳斯达克开始交易以来,我们的股价一直非常波动, 交易最高达126.26美元,最低达0.42美元。由于这种波动性,投资者可能无法以 或高于购买我们普通股时的价格出售其普通股。我们普通股的市价可能受许多因素的影响,包括 本年度报告标题为"风险因素"的本节中描述的其他风险以及以下各项:
| ● | 竞争产品或技术的成功; | |
| ● | 我们的候选产品或我们的竞争对手、我们现有的合作者或任何未来的合作者的临床前和临床研究结果 ; | |
| ● | 美国和其他国家/地区的监管或法律发展,特别是适用于我们产品的法律或法规的变化; | |
| ● | 我们、我们的商业化合作伙伴或我们的竞争对手对新产品的介绍和公告,以及这些介绍或公告的时间。 | |
| ● | 监管机构对我们的产品、临床研究、制造工艺或销售和营销条款采取的行动; | |
| ● | 我们的财务业绩或被认为与我们相似的公司的财务业绩的实际或预期变化; | |
| ● | 我们在获得或许可其他技术、产品或候选产品方面取得的成功; | |
| ● | 与我们的合作有关的发展,包括但不限于我们的制造供应来源和商业化合作伙伴的发展 ; | |
| ● | 我们或我们的竞争对手宣布重大收购、战略伙伴关系、合资企业或资本承诺; | |
| ● | 发展 或与专利或其他专有权利有关的纠纷,包括专利、诉讼事项和我们为产品获得专利保护的能力 ; | |
| ● | 我们 筹集额外资本的能力或能力以及筹集资金的条款; | |
| ● | 关键人员的招聘或离职; | |
| ● | 医疗保健支付制度结构的变化 | |
| ● | 制药和生物技术部门的市场状况; |
| 48 |
| ● | 关于我们的普通股、其他可比公司或我们行业的实际 或预期的收益估计变化或股票市场分析师建议的变化; | |
| ● | 我们或我们的竞争对手未能达到我们或我们的竞争对手可能给予市场的分析师的预测或指引; | |
| ● | 投资者认为与我们相当的公司估值波动 ; | |
| ● | 宣布 并预计将做出更多融资努力; | |
| ● | 新闻界或投资界的猜测 ; | |
| ● | 我们普通股的交易量; | |
| ● | 销售 我们或我们的股东持有我们的普通股; | |
| ● | 我们普通股的集中所有权; | |
| ● | 会计原则变更 ; | |
| ● | 恐怖行为、战争行为或大范围内乱时期; | |
| ● | 自然灾害和其他灾害;以及 | |
| ● | 一般的经济、行业和市场状况。 |
此外,一般的股票市场,尤其是医药股市场都经历了极端的波动,这种波动往往与发行人的经营业绩无关。这些广泛的市场和行业因素可能会严重损害我们普通股的市场价格,无论我们的经营业绩如何。
未来发行可转换为普通股的股票或债务证券将稀释我们的股本。
我们 可以根据市场情况、战略考虑和运营要求,在未来选择筹集额外资本。 如果通过发行股票或其他可转换为普通股的证券来筹集额外资本,我们的股东将被稀释。未来我们普通股或其他股权证券的发行,或可能发生此类 出售的看法,可能会对我们普通股的交易价格产生不利影响,并削弱我们通过未来发行股票或股权证券筹集资金的能力。无法预测未来普通股销售或可用于未来销售的普通股对我们普通股交易价格的影响(如果有的话)。
如果我们未能维持适用的上市要求,纳斯达克可能会将我们的普通股摘牌,在这种情况下,我们的普通股的流动性和 市场价格可能会下降。
我们 无法向您保证,我们未来将能够达到纳斯达克的持续上市标准。如果我们未能遵守适用的上市标准,纳斯达克将我们的普通股摘牌,我们和我们的股东可能面临重大不利后果, 包括:
| ● | 我们普通股股票的市场报价有限; | |
| ● | 我们普通股的流动资金减少; | |
| ● | 确定我们的普通股是“细价股”,这将要求交易我们普通股的经纪商遵守更严格的规则,并可能导致我们普通股的股票在二级交易市场的交易活动减少。 | |
| ● | 有关我们的新闻和分析师对我们的报道数量有限;以及 | |
| ● | 我们未来发行更多股权证券或获得更多股权或债务融资的能力下降。 |
1996年的《国家证券市场改善法》是一项联邦法规,它阻止或抢先各州管理某些证券的销售,这些证券被称为“覆盖证券”。由于我们的普通股在纳斯达克上市, 此类证券将被视为担保证券。虽然各州将被抢先监管我们的证券的销售, 联邦法规确实允许各州在怀疑存在欺诈行为的情况下对公司进行调查,如果发现存在欺诈行为 ,那么各州可以在特定情况下监管或禁止受保证券的销售。此外,如果我们不再在纳斯达克上市 ,我们的证券将不属于承保证券,并且我们将遵守我们提供 证券的每个州的法规。
| 49 |
由于 我们的管理层对如何使用我们从首次公开募股和后续发行中获得的净收益有广泛的自由裁量权,因此,您可能不同意 我们如何使用这些净收益,因此所得收益可能无法成功投资。
我们 打算将IPO和后续发行所得的净收益用于资助候选产品的临床前和临床试验, 罗哌多尿苷和罗哌多尿苷与替吡嘧啶的新制剂,用于质子辐射增敏的含O—18分子,持续 HDAC技术平台开发,营运资金和一般企业用途,包括作为上市公司运营的成本, 以及潜在的收购或许可内活动。因此,我们的管理层对IPO所得款项和我们随后私募的所得款项的使用有广泛的自由裁量权。因此,您将依赖我们管理层 关于这些净收益的使用的判断,并且作为您投资决策的一部分,您将没有机会评估 这些收益是否得到适当使用。所得款项的投资方式可能不会为我们的公司带来有利的 或任何回报。
如果 证券或行业分析师不发布有关我们业务的研究或报告,或者如果他们对我们的股票发表不利或误导性的意见 ,我们的股价和交易量可能会下降。
我们普通股的交易市场将受到行业或证券分析师发布的有关我们或我们业务的研究和报告的影响。我们目前没有,也可能永远不会获得证券和行业分析师的研究报道。如果没有或很少 证券或行业分析师开始对我们进行报道,我们股票的交易价格将受到负面影响。如果我们 获得证券或行业分析师的报道,如果报道我们的任何分析师对我们、我们的业务模式、我们的知识产权或我们的股票表现发表了不利或误导性的意见,或者如果我们的目标研究和经营结果未能达到分析师的预期,我们的股价可能会下跌。如果其中一位或多位分析师停止对我们的报道或未能定期发布有关我们的报告,我们可能会在金融市场失去可见性,进而可能导致我们的股价或交易量 下降。
我们的 董事会有权在未经股东批准的情况下发行优先股,其条款可能不利于 我们的普通股持有人,这种发行可能会对股东的投票权产生不利影响,并延续他们对我们的 控制权。
我们的公司注册证书已修改至今,允许我们发行优先股,而不需要我们的股东投票或采取进一步行动。我们的董事会有权确定和确定任何优先股的相对权利和偏好 。因此,我们的董事会可以授权发行一系列优先股,这将授予持有人在清算时对我们资产的优先权利,在股息分配给普通股持有人 之前获得股息支付的权利,以及在赎回我们普通股 股票之前赎回股份的权利和溢价。这些权利和优惠可能会对我们普通股的持有者产生负面影响。
| 50 |
我们的高管和董事是我们的主要股东,他们控制我们业务的能力可能会限制或消除小股东影响公司事务的能力。
我们的 执行官和董事是我们的主要股东,拥有我们大约39.6%的已发行和流通普通股。 因此,他们可能能够有效地控制董事的选举,以及所有其他需要股东批准的事项。 在发行股份、 与其他公司的业务交易或出售给其他公司、选择其他董事和其他商业决策方面,我们主要股东的利益可能与其他股东的利益不同。少数股东 无法推翻我们主要股东的决定。这种控制水平也可能对 我们股票的市场价值产生不利影响,因为我们的主要股东可能会制定或实施导致 损失的交易、政策或计划,并且可能不会采取任何措施提高我们在金融界的知名度,和/或可能会出售足够数量的股票 以显著降低我们的每股价格。
我们的《公司注册证书》和《公司章程》均已修订,规定由公司承担高级管理人员和董事的费用,并限制他们的责任,因为公司资源可能会为高级管理人员和/或董事的利益而花费,这可能会给我们带来重大成本并损害我们股东的利益。
我们的公司注册证书和章程都经过了修改,规定了对我们的高级管理人员和董事的赔偿。我们 被告知,美国证券交易委员会认为,根据联邦证券法产生的责任的赔偿违反了证券法中所表达的公共政策,因此,无法强制执行。
我们至今已修订的公司注册证书规定,争议必须在特拉华州衡平法院解决, 根据证券法或交易法提起的案件除外。
我们的公司注册证书已修订至今,规定特拉华州的衡平法院将是解决某些列举的诉讼争议的独家 场所,不包括根据证券法或交易法提起的任何诉讼, 或除非公司书面同意另一司法管辖区。如果我们的股东或其他利益相关者需要就证券法或交易法以外的诉讼对公司提起诉讼,这一排他性论坛选择条款可能会给他们带来不便 。
我们 预计在可预见的未来不会派发现金股息。
我们 从未为普通股支付现金股息。我们不希望在可预见的未来 的任何时候支付普通股的现金股息。我们普通股未来的股息支付直接取决于我们未来的收益、资本需求、财务需求和董事会将考虑的其他因素。由于我们不打算对我们的普通股 支付现金股息,您的投资回报(如果有的话)将完全取决于我们的普通股市场价值的增加(如果有的话)。
我们修订和重述的公司注册证书、修订的章程以及特拉华州法律中的条款 可能会阻止、推迟或阻止我们公司控制权的变更或我们管理层的变更,从而压低我们普通股的市场价格 。
我们的《公司注册证书》和《公司章程》(均已修订)以及《章程》中包含的条款可能会阻止、推迟或阻止本公司控制权的变更或本公司股东认为有利的管理层变更,从而压低本公司普通股的市场价格。除其他外,这些规定包括:
| ● | 允许董事会确定董事会人数; | |
| ● | 规定只有在获得662/3%的股东同意的情况下,才能“出于原因”罢免董事; |
| 51 |
| ● | 需要 超级多数投票来修改我们的公司注册证书和附则中的一些条款; | |
| ● | 授权 发行“空白支票”优先股,我们的董事会可以用来实施股权计划(也称为“毒丸”)。 | |
| ● | 取消我们的股东召开股东特别会议的能力; | |
| ● | 禁止 股东书面同意的行动,要求所有股东行动在股东会议上进行; | |
| ● | 提供董事会明确授权制定、更改或废除我们的附例;以及 | |
| ● | 为提名我们的董事会成员或提出可由股东在年度股东大会上采取行动的事项确定 提前通知要求。 |
此外,特拉华州公司法第203条可能会阻止、推迟或阻止对我们公司的控制权变更。第 203节对我们与持有我们15%或以上普通股的人之间的合并、业务合并和其他交易施加了某些限制。
项目 1B。未解决的员工意见
没有。
项目 1C。网络安全
风险 管理和战略
我们 已经制定了评估、识别和管理网络安全威胁的重大风险的政策和流程,并将 这些流程集成到我们的整体风险管理系统和流程中。我们会定期评估网络安全威胁的重大风险, 包括在我们的信息系统上发生的任何潜在未经授权的事件或通过我们的信息系统进行的事件,这些事件可能会对 我们的信息系统或其中的任何信息的机密性、完整性或可用性造成不利影响。
我们 至少每年进行一次风险评估,以识别网络安全威胁。这些风险评估包括确定合理 可预见的潜在内部和外部风险、发生的可能性和可能由此类风险 导致的任何潜在损害,以及我们为管理此类风险而制定的现有政策、程序、系统、控制措施和其他保障措施的充分性 。我们的风险管理流程还包括与使用我们的主要第三方 供应商和服务提供商相关的网络安全风险。
这些风险评估后,我们设计、实施和维护合理的保障措施,以最大限度地减少已识别的风险;合理地 解决现有保障措施中任何已识别的漏洞;必要时更新现有保障措施;并监控 保障措施的有效性。我们相信,我们已分配了与网络安全风险管理流程相关的充足资源,并 指定首席财务官负责管理网络安全风险评估和缓解流程 。
作为 整体风险管理计划的一部分,我们为高风险领域的员工提供必要的网络安全培训,并在提交本文件后向所有员工分发了标准操作程序。有关网络安全 威胁的任何风险(包括先前任何网络安全事件)是否已经或可能 对我们公司(包括我们的业务战略、运营结果或财务状况)产生重大影响的其他信息,请参阅本年度报告表格10—K中的项目 1A "风险因素",包括标题为 “我们的内部计算机系统,或我们的CRO或其他承包商或顾问的计算机系统可能出现故障或遭受安全漏洞,这可能导致我们的产品开发计划受到重大破坏”,“我们的专有信息,或我们客户、供应商和业务合作伙伴的专有信息可能丢失,或我们可能遭受安全漏洞”,以及“我们的信息 技术系统故障可能会严重扰乱我们的业务运营。
| 52 |
治理
我们董事会的主要职能之一是对我们的风险管理流程进行知情监督,包括 网络安全威胁引发的风险。我们的董事会负责监控和评估战略风险敞口,我们的高管负责我们面临的重大风险的日常管理。我们的董事会直接对其网络安全风险监督职能进行整体管理,我们最近成立了 董事会网络安全委员会(以下简称网络安全委员会),以进一步加强我们的网络安全监督。网络安全委员会成员 由董事会任命,并由董事会酌情决定。网络安全委员会由两名董事会成员组成,他们都是独立的 。
我们的首席财务官主要负责评估和管理日常网络安全威胁带来的重大风险。
第 项2.属性
设施
我们的公司总部目前位于马里兰州20879盖瑟斯堡专业大道401号Suite260,我们租用了约2,109平方英尺的办公和实验室空间(合计为“实验室空间”),其中包括共享使用办公空间和接待服务。我们的研究和开发活动是在实验室空间进行的。我们于2023年6月1日签订了新实验室空间的租约,初始租期为5.25年,并可选择延长三年,月租金为每月7,206美元,可按每年3%的速度增加。所有这些空间都是从非关联的第三方那里租赁的。
我们 相信上述设施足以满足我们当前的需求,并且有足够的实验室空间来容纳更多的科学家 随着我们的成长。
第 项3.法律诉讼
目前,没有针对我们的法律诉讼待决或威胁。我们目前不参与任何悬而未决或受到威胁的法律诉讼或索赔,我们认为这些诉讼或索赔将对我们的业务、财务状况或经营业绩产生重大不利影响, 尽管我们在正常业务过程中可能会不时卷入法律诉讼。
第 项4.矿山安全信息披露
不适用 。
| 53 |
第 第二部分
第 项5.注册人普通股市场、相关股东事项和发行人购买股权证券
市场信息
我们的普通股于2022年8月29日在纳斯达克资本市场开始交易,交易代码为SHPH。在此之前,我们的普通股没有在任何交易所交易或在任何场外市场报价。
持有者
截至2024年3月20日,我们有55名普通股登记持有人,以及16,794,893股已发行和已发行普通股。
分红
我们 自成立以来一直没有就我们的普通股支付任何股息,我们目前预计,在可预见的未来,所有收益 (如果有)将保留用于我们的业务发展,我们的普通股不会宣布或支付任何股息。我们普通股未来的任何股息将由我们的董事会酌情决定,并将取决于我们的 收益(如果有)、经营业绩、财务状况和资本要求、一般业务状况和其他相关事实。
优先派息
我们的董事会已指定并授权发行最多10,000股A系列可转换优先股,每股票面价值 $0.00001(“A系列可转换优先股”),其中已发行1,212.5股,全部 在2022年9月2日首次公开募股结束时转换为336,810股普通股和336,810股认股权证,用于购买普通股。A系列可转换优先股的声明价值为每股1,000美元,有权按每年8.5%的利率收取股息,该股息为累积股息,可于转换或赎回之日以普通股或现金支付,由本公司厘定。
截至2022年12月31日止年度,本公司就A系列可转换优先股累计派息8.5%计得71,009美元及截至2021年12月31日止年度累计派息103,062美元,合共分别为402,068美元及331,059美元,全部于首次公开招股完成后以100,517股普通股的形式支付。
最近销售的未注册证券
在过去三年中,我们根据《证券法》规定的注册豁免进行了以下交易:
2021年12月28日,我们签署了两份总额为500,000美元的贷款协议(在我们首次公开募股时应偿还),同时,我们发行了认股权证,以购买总共500,000股我们普通股,行使价为每股1美元。根据《证券法》第506条(b)款规定的注册豁免,此类 权证已出售给两名认可投资者。 Boustead Securities LLC担任配售代理人,但放弃了与此类发行相关的现金补偿,迄今为止,该公司 未收到与该交易相关的认股权证补偿。
2022年2月8日和2022年3月11日,公司分别向某些认可投资者出售了365,000美元和224,985美元的6%可转换 票据(“票据”),利息为6%,自发行之日起三年内偿还,并自动 转换为普通股,或,如果在发行中出售单位,单位,在 完成IPO时,单位转换价为每单位4.00美元。根据《证券法》第506条(b)款规定的注册豁免,此类票据被出售给认可的投资者。Boustead Securities LLC担任配售代理人,并收到以下补偿:(i)36,500美元现金和认股权证,以购买可换股票据转换后可发行股份总数的10%,可按2月发行的可换股票据转换价行使,以及(ii)22美元,750股现金,以及购买可换股票据转换时可发行股份总数的10%的认股权证,可按三月份发售的可换股票据的转换价行使。
| 54 |
自 2022年3月30日起,本公司向约23名现有股东发行合共1,678股普通股(839股按反向拆分后基准计算) ,以偿还因2018年股票交易所中可换股 票据不准确转换而产生的若干利息。发行人全额偿还了因不准确 转换而产生的所有欠款或其他应计利息。此类发行是根据《证券法》第506(b)条进行的。
2022年8月1日,我们签署了三份总额为125,000美元的贷款协议(在完成IPO后偿还),同时,我们发行了认股权证,以购买总计50,000股普通股,行使价为每股2.50美元。根据《证券法》第506(b)条的规定,此类权证 已出售给三名认可投资者。Boustead Securities LLC担任配售代理人,并收到了购买5,000股普通股的认股权证,行使价为每股2.50美元, 相当于票据发行价值的10%,以及12,500美元的现金补偿。
上述披露不包括根据Shuttle Pharmaceuticals Holdings,Inc.授予的678,180股股份。2018年股权激励计划,该计划已向若干雇员、董事和顾问发行,并根据该等个人与公司之间的授予协议定期归属。
发行人 购买股票证券
没有。
使用收益的
没有。
第 项6.[已保留]
第 项7.管理层对财务状况和经营成果的讨论和分析
The following Management’s Discussion and Analysis should be read in conjunction with our financial statements and the related notes thereto included elsewhere in this Annual Report. The Management’s Discussion and Analysis contains forward-looking statements that involve risks and uncertainties, such as statements of our plans, objectives, expectations, and intentions. Any statements that are not statements of historical fact are forward-looking statements. When used, the words “believe,” “plan,” “intend,” “anticipate,” “target,” “estimate,” “expect,” and the like, and/or future-tense or conditional constructions (“will,” “may,” “could,” “should,” etc.), or similar expressions, identify certain of these forward-looking statements. These forward-looking statements are subject to risks and uncertainties that could cause actual results or events to differ materially from those expressed or implied by the forward-looking statements in this Annual Report. Our actual results and the timing of events could differ materially from those anticipated in these forward-looking statements as a result of several factors including, but not limited to, those noted under “Risk Factors” in this Annual Report.
除美国联邦证券法要求外,我们 不承担更新前瞻性陈述以反映本年度报告日期之后发生的事件或情况的任何义务。
概述
由乔治城大学医学院教职员工创建的Shuttle PharmPharmticals Holdings,Inc.是一家发现和发展阶段的制药公司 利用我们的专利技术开发旨在治愈癌症的新型疗法。最初 成立于2012年,最初是Shuttle PharmPharmticals,LLC,我们的目标是通过利用对癌症治疗的洞察力 手术、放射治疗、化疗和免疫治疗来扩大癌症治疗的好处。虽然有几种治疗方法正在开发,目的是治愈癌症,但最有效和最有效的方法之一是放射治疗(RT)。我们正在开发一系列产品,旨在解决目前癌症治疗标准的局限性。我们相信,我们的候选产品将使我们能够提供比当前护理标准更安全、更可靠、规模更大的癌症治疗。
Operations to date have focused on continuing our research and development efforts to advance Ropidoxuridine clinical testing and improved drug formulation, to advance HDAC6 inhibitor (SP-2-225) preclinical development and explore new SBIR contract work on predictive biomarkers of radiation response, as well as prostate cell lines for health disparities research. We received Small Business Innovation Research (“SBIR”) contract funding from the National Institutes of Health (“NIH”) for the aforementioned projects. The clinical development of Ropidoxuridine has shown drug bioavailability and a maximum tolerated dose has been established for use in Phase II clinical trials. TCG GreenChem, Inc. (“TCG GreenChem”), with whom we have contracted for process research, development and cGMP compliant manufacture of IPdR, has successfully completed the manufacturing campaign for the active pharmaceutical ingredient (API) of Ropidoxuridine for use in the Company’s upcoming Phase II clinical trial in brain cancer patients undergoing radiation therapy. Shuttle also worked with University of Iowa Pharmaceuticals to develop the formulation, produce the capsules, and which have been shipped to Contract Research Organization (CRO) Theradex Oncology for distribution to clinical trial sites. Both activities have now been completed. In addition, Shuttle received approval from the FDA to begin the clinical trial. The FDA made recommendations to expand the clinical trial and the company agreed with the recommendation. With this change incorporated into the revised protocol, the Company believes it remains on track to commence its Phase II clinical study in the second quarter of 2024. The radiation biomarker project and the health disparities project have been completed and the company is following up with plans for clinical validation and potential commercialization. Changes in operational, administrative, legal and professional expenses related to our operations are set forth in more detail in the discussion below.
| 55 |
运营结果
截至2023年12月31日和2022年12月31日止年度的比较
下表总结了我们的运营结果:
| 截止的年数 | ||||||||||||||||
| 十二月三十一日, | ||||||||||||||||
| 2023 | 2022 | 变化 | % | |||||||||||||
| 收入 | $ | - | $ | - | $ | - | - | |||||||||
| 运营费用: | ||||||||||||||||
| 研究与开发,合同费用报销净额 | 3,517,093 | 1,148,712 | 2,368,381 | 206 | % | |||||||||||
| 一般和行政 | 1,046,854 | 538,796 | 508,058 | 94 | % | |||||||||||
| 法律和专业 | 1,328,435 | 866,770 | 461,665 | 53 | % | |||||||||||
| 业务费用和业务损失共计 | 5,892,382 | 2,554,278 | 3,338,104 | 131 | % | |||||||||||
| 其他收入(支出): | ||||||||||||||||
| 利息支出关联方 | (6,825 | ) | (52,010 | ) | 45,185 | (87 | %) | |||||||||
| 利息支出 | (2,484,193 | ) | (917,879 | ) | (1,566,314 | ) | 171 | % | ||||||||
| 利息收入 | 79,117 | - | 79,117 | 100 | % | |||||||||||
| 融资费 | (104,245 | ) | - | (104,245 | ) | (100 | %) | |||||||||
| 衍生负债的公允价值变动 | 2,216,488 | 94,025 | 2,122,463 | 2,257 | % | |||||||||||
| 出售有价证券收益 | 4,970 | - | 4,970 | 100 | % | |||||||||||
| 有价证券公允价值变动 | 71,568 | - | 71,568 | 100 | % | |||||||||||
| 可转债结算亏损 | (477,221 | ) | - | (477,221 | ) | (100 | %) | |||||||||
| 结清应付账款收益 | - | 328,687 | (328,687 | ) | (100 | %) | ||||||||||
| Paycheck保护计划应付票据的宽恕收益 | - | 73,007 | (73,007 | ) | (100 | %) | ||||||||||
| 其他费用合计 | (700,341 | ) | (474,170 | ) | (226,171 | ) | 48 | % | ||||||||
| 净亏损 | $ | (6,592,723 | ) | $ | (3,028,448 | ) | $ | (3,564,275 | ) | 118 | % | |||||
研究 和开发,扣除合同费用报销。截至2023年12月31日止年度,研发(“研发”)总开支为350万美元,而截至2022年12月31日止年度则为110万美元,其中包括研发费用报销分别为0美元及211,455美元。增加240万美元,或206%,主要与公司增加研发支出有关,因为收到了公司在2022财年第三季度首次公开募股的资金,以及截至2023年3月31日止期间发行的可换股票据。
截至2023年12月31日止年度,研发 薪酬相关支出为150万美元,而截至 2022年12月31日止年度则为80万美元。截至2023年12月31日止年度,薪酬相关费用(不包括报销)占研发费用的 %,较截至2022年12月31日止年度所产生研发总额的59%有所下降。分包工作(不包括报销)占截至2023年12月31日止年度总研发费用的52%,占截至2022年12月31日止年度总研发费用的35%。
| 56 |
一般 和管理费用。截至2023年12月31日止年度的一般及行政费用由截至2022年12月31日止年度的50万美元增加50万美元或 94%至截至2023年12月31日止年度的100万美元。一般 和行政费用的增加主要是由于保险费用增加了10万美元,赔偿金增加了20万美元,广告费用增加了10万美元。
法律 和专业费用.截至2023年12月31日止年度,法律及专业费用增加了50万美元或 53%。法律和专业费用的增加主要是由于我们与公共备案要求、 合同和融资相关工作相关的费用增加。
其他 收入(费用)截至2023年12月31日止年度的其他支出为70万美元,主要包括 可换股票据利息支出250万美元、清偿可换股债务损失50万美元,并被 衍生负债公允价值变动收益220万美元所抵销。截至2022年12月31日止年度的其他开支为50万美元, 主要包括可换股票据利息开支90万美元,由认股权证负债变动收益94万美元及应付账款结算收益30万美元所抵销。
流动性 与资本资源
我们的 综合财务报表乃按持续经营基准编制,考虑在正常业务过程中变现资产及清偿 负债和承担。该公司自成立以来已发生亏损,截至2023年12月31日止年度净亏损为660万美元,无收入,截至2023年12月31日,营运资金约为460万美元。此外,于2023年12月31日尚未偿还的应付可换股票据包括契诺及若干现金付款要求。 这些条件以及公司遵守这些条件的能力,对公司在发布这些财务报表之日后一年内继续经营的能力产生了重大疑问 。
2022年9月,本公司完成了首次公开发行普通股,产生的所得款项净额为1000万美元。此外, 于2023年1月,本公司与一家机构投资者签订了一份证券购买协议,通过该协议,本公司出售了 本金额为430万美元的可换股票据,以及购买1,018,079股普通股的四年期认股权证, 可按每股2.35美元行使,为本公司提供了360万美元的净收益。迄今为止,该逮捕令尚未行使。 然而,公司现有现金资源、有价证券以及从股权发行和可转换 票据中收到的现金预计不会为公司未来12个月的运营和临床试验提供足够的资金。
此次 融资支持了生产药品和FDA批准IND用于罗哌多尿苷和胶质母细胞瘤放射治疗II期临床试验的运营。FDA建议并同意扩大临床试验 ,这需要额外的资金来完成试验。管理层打算发起450万美元的配股,并已提交 SBIR申请,要求NIH为临床前项目提供非稀释性资金。本公司能否继续作为一个持续经营企业, 取决于我们能否成功进行临床试验,将候选药物商业化以产生收入, 以及筹集额外股权或债务融资。
随附财务报表不包括任何调整,以反映未来对资产可收回性和分类 或负债金额和分类的影响,如果公司无法持续经营。
| 57 |
资产负债表数据:
| 十二月三十一日, | 十二月三十一日, | |||||||||||||||
| 2023 | 2022 | 变化 | % | |||||||||||||
| 流动资产 | $ | 5,593,005 | $ | 8,578,351 | $ | (2,985,346 | ) | (35 | %) | |||||||
| 流动负债 | 1,042,237 | 975,676 | 66,561 | 7 | % | |||||||||||
| 营运资本 | $ | 4,550,768 | $ | 7,602,675 | $ | (3,051,907 | ) | (40 | %) | |||||||
截至2023年12月31日 ,流动资产总额为560万美元,流动负债总额为100万美元,流动资本 为460万美元。截至2022年12月31日,流动资产总额为860万美元,流动负债总额为100万美元,营运资金为760万美元。截至2023年12月31日,本公司的流动资产主要是 发行应付可换股票据收到的360万美元现金净额,被 关联方票据偿还的80万美元所抵消(本金685,473美元,应计利息98,135美元),以及以现金偿还的可换股票据 (本金334,444美元,应计利息59,846美元)。此外,我们于截至2023年12月31日止年度继续推进研发计划,导致现金支出增加。流动负债的增加主要是由于 430万美元可换股票据的流动部分,即应付可换股票据70万美元和应计利息,应付账款增加 20万美元,但被应付关联方票据和应计利息减少80万美元所抵消。
现金流
| 截至十二月三十一日止的年度, | ||||||||||||||||
| 2023 | 2022 | 变化 | % | |||||||||||||
| 用于经营活动的现金 | $ | (5,581,147 | ) | $ | (2,710,454 | ) | $ | (2,870,693 | ) | 106 | % | |||||
| 用于投资活动的现金 | $ | (2,829,723 | ) | $ | - | $ | (2,829,723 | ) | (100 | %) | ||||||
| 融资活动提供的现金 | $ | 2,570,083 | $ | 10,622,908 | $ | (8,052,825 | ) | (76 | %) | |||||||
| 手头现金 | $ | 2,576,416 | $ | 8,417,203 | $ | (5,840,787 | ) | (69 | %) | |||||||
经营活动的现金流
迄今为止,我们尚未从经营活动中产生正现金流。截至2023年12月31日止年度,经营活动中使用的净现金流量 为560万美元,主要包括净亏损660万美元,增加了衍生工具 负债变动收益220万美元,被债务贴现摊销210万美元所抵消,清偿可转换债务损失50万美元,以普通股结算的应计利息为30万美元,以股票为基础的薪酬为20万美元,并进一步减少 经营资产和负债净变动20万美元。截至2022年12月31日止年度,经营活动使用的现金流量净额为270万美元,主要包括净亏损300万美元,加上衍生负债变动收益9400万美元,应付账款结算收益300万美元,经营资产及负债变动净额50万美元,债务贴现摊销90万美元,股票补偿40万美元。
| 58 |
投资活动的现金流
截至2023年12月31日止年度,我们投资了2,998,572美元的有价证券交易,并收到了187,895美元的处置有价证券收益,并购买了19,046美元的设备。截至二零二二年十二月三十一日止年度,我们并无投资活动。
融资活动的现金流
截至2023年12月31日止年度,我们从出售及发行应付可换股票据及认股权证中收到所得款项净额3,590,000美元,并偿还了334,444美元的可换股票据及685,473美元的应付关联方票据。截至2022年12月31日止年度, 我们从发行普通股股份和行使认股权证中获得10,022,193美元,从发行 可换股票据和认股权证中获得600,715美元。
最近 融资
2023年1月11日,我们与投资者签订了交易协议,据此,公司向投资者出售了一份价值430万美元的可换股票据(“可换股票据”)和认股权证(“认股权证”),以购买本公司1,018,079股普通股,以换取收益总额400万美元投资额 。可转换票据按月摊销,本公司可以现金或 在某些股权条件下,以普通股注册股份或两者的组合进行每月摊销付款。就股本偿还而言,可转换票据 可按每股价格转换为普通股股份,每股价格等于(i)2.35美元(ii)支付日前15个交易日的三个最低每日VWAP 的90%或(iii)支付日前交易日的VWAP的90%。可换股票据 须于26个月内偿还,并按年利率5%计息。认股权证自 收盘之日起四年内可行使,可行使价为每股2.35美元。如果投资者完全行使认股权证,这种行使将导致 公司的额外总收益约为240万美元。
On May 10, 2023, we entered into the Amendment Agreement to the SPA. Under the Amendment Agreement, the Company and the Investor amended the transaction documents as follows: (i) amended and restated Section 2 of the Warrant so as to remove a provision that would have potentially required an adjustment to the number of warrant shares exercisable under the Warrant, (ii) stipulated that the Company would obtain majority shareholder approval to issue up to an additional $10 million Subsequent Notes and Subsequent Warrants equal to 42.5% of the outstanding principal value of the Subsequent Notes, which Subsequent Note and Subsequent Warrant would be sold to the Investor on substantially the same terms as the existing Convertible Note and Warrant (each as amended by the Amendment Agreement) and upon conversion and/or exercise would cause the potential issuance of in excess of 19.9% of the Company’s issued and outstanding stock, (iii) that, upon obtaining majority stockholder approval, the Company would file a Schedule 14C related to such potential issuance of the shares of common stock related to the potential sale of the Subsequent Notes and Subsequent Warrants to the Investor within 30 calendar days of entry into the Amendment Agreement, and (iv) stipulated that the Investor would release $1,500,000 in cash collateral to the Company, with $1,000,000 to be released to the Company immediately upon singing of the Amendment Agreement and $500,000 to be released upon the Company’s filing of the Schedule 14C. The Company obtained majority stockholder consent to the potential sale of the Subsequent Notes and Subsequent Warrants to the Investor in advance of entry into the Amendment Agreement.
2023年6月4日,我们于2023年5月11日签署了对修订协议的修订,以修订 SPA的条款。根据修订协议之修订,本公司与投资者协议如下:(i)可换股票据第15(q)条,要求公司在受控账户协议中持有现金抵押品(定义见可换股票据), 将不再适用,(ii)投资者将规定向公司发放总额为 2,924,000美元的剩余现金抵押品(从而向本公司释放现金抵押品的全部金额),及(iii)如果投资者行使其选择权 购买后续票据及后续认股权证,该等后续说明将省略第15(q)条,且公司 不需要维持任何受控账户或受任何受控账户协议的约束。
| 59 |
表外安排 表内安排
我们 没有任何对我们的财务状况、财务状况的变化、收入或支出、运营结果、流动性、资本支出或资本资源产生当前或未来影响的资产负债表外安排对投资者具有重大影响 。
关键的会计政策和重要的判断和估计
对我们财务状况和经营结果的讨论和分析以我们的财务报表为基础,财务报表是根据美国公认会计原则(“GAAP”)编制的。在编制这些财务报表时,我们需要做出估计和假设,以影响财务报表日期的已报告资产和负债额、或有资产和负债的披露,以及报告期间发生的已报告费用。我们的估计是基于我们的历史经验和我们认为在这种情况下合理的各种其他因素,这些因素的结果构成了对从其他来源难以明显看到的资产和负债的账面价值做出判断的基础。在不同的假设或条件下,实际结果可能与这些估计值不同。虽然我们的重要会计政策 在本注册说明书其他地方的财务报表附注中有更详细的描述,但我们 认为以下会计政策对于了解我们的历史和未来业绩至关重要,因为这些政策 涉及涉及管理层判断和估计的更重要的领域。
我们的 最关键的会计政策和估算涉及以下内容:
| ● | 研究和开发费用 | |
| ● | 公平 衍生金融工具的价值 | |
| ● | 首字母 股票权证的计量 |
研究和开发
研究和开发费用在发生时计入费用,在我们于2022年9月首次公开募股之前,历史上已 由支持我们科学研究的NIH SBIR合同的合同应收款项抵销。这在合并 财务报表中列作研发,扣除合同费用报销。
金融工具的公允价值
我们 评估我们所有的金融工具,以确定这些工具是否为衍生工具或包含符合嵌入式 衍生工具资格的特征。就作为负债入账的衍生金融工具而言,衍生工具最初按其公允价值入账 ,然后在每个报告日期重新估值,公允价值的变动在综合经营报表 中报告。衍生工具的分类(包括该等工具是否应记录为负债)在每个报告期末 进行评估。
对于 我们分类为负债的衍生金融工具,本公司使用蒙特卡洛估值模型在开始时和随后估值日期对 衍生工具进行估值。该模型要求使用基于重大不可观察输入(包括总体集的平均波动率和分配的概率)加权 的模拟。每个 模拟基于场景中的输入范围,每个模拟的输出平均值计算为平均值。 蒙特卡洛模拟使用隐含VWAP进行估值。通过设置各部分的总和 (例如,衍生工具和无衍生工具的债务)等于现金收益,并在每个期间更新。
使用蒙特卡洛估值模型需要关键输入,其中一些输入基于管理层和/或外部 顾问的估计和判断。该等主要输入数据的任何变动均可能导致公平值计量大幅增加或减少。
初始 股权权证计量
我们 评估我们所有的金融工具,以确定这些工具是否为衍生工具或包含符合嵌入式 衍生工具资格的特征。就作为权益入账的衍生金融工具而言,衍生工具最初按 其公允价值入账,并计入额外已缴资本。衍生工具的分类,包括该等工具 是否应记录为权益,于各报告期末进行评估。
对于 我们分类为权益的衍生金融工具,本公司使用布莱克·斯科尔斯估值模型计算发行日的公允价值 ,不进行重估。
使用布莱克·斯科尔斯估值模型需要输入高度主观的假设,包括预期价格波动, 是基于对一组可比实体普通股历史波动的分析。 这些输入数据的任何变更都可能导致公允价值计量大幅增加或减少。
第 7A项。关于市场风险的定量和定性披露
由于 是“较小的申报公司”,此项不是必填项。
| 60 |
第 项8.财务报表和补充数据
财务报表索引
| 页面 | |
| 独立注册会计师事务所的
报告—FORVIS,
LLP(PCAOB ID |
F-1 |
| 独立注册会计师事务所报告 —BF Borgers CPA PC(PCAOB ID 5041) | F-2 |
| 截至2023年12月31日和2022年12月31日的合并资产负债表 | F-3 |
| 截至2023年及2022年12月31日止年度的综合经营及全面收益(亏损)报表 | F-4 |
| 截至2023年12月31日和2022年12月31日止年度股东权益变动表 | F-5 |
| 截至2023年12月31日和2022年12月31日的合并现金流量表 | F-6 |
| 合并财务报表附注 | F-7 |
| 61 |
独立注册会计师事务所报告
致 股东、董事会和审计委员会
航天飞机 制药控股公司
关于合并财务报表的意见
我们 审计了随附的Shuttle Pharmaceuticals Holdings,Inc.的合并资产负债表。及子公司(“本公司”) 截至2023年12月31日止年度的相关合并经营报表、股东权益变动和现金流量,以及相关附注(统称为“财务报表”)。我们认为,财务报表在所有重大方面公允列报了截至2023年12月31日的公司财务状况,以及截至2023年12月31日止年度的经营成果和现金流量,符合美国公认的会计原则(“美国公认会计准则”)。
正在进行 关注
随附财务报表的编制假设本公司将持续经营。如财务报表附注1所述,本公司自成立以来一直遭受经常性亏损和经营负现金流量。这些 条件,以及附注1中所述的其他事项,对公司持续经营的能力产生了重大疑问。管理层有关该等事项的计划亦载于附注1。财务报表不包括 可能由这种不确定性的结果导致的任何调整。
征求意见的依据
这些 财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的 财务报表发表意见。
我们 是一家在上市公司会计监督委员会(美国)(“PCAOB”)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会(SEC)和PCAOB的适用规则 和条例, 必须独立于本公司。
我们 根据PCAOB的标准进行了审计。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是舞弊。公司 不需要对其财务报告的内部控制进行审计,也没有聘请我们进行审计。作为我们审计的一部分,我们需要了解财务报告的内部控制,但不是为了对公司财务报告内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的 审计工作包括执行程序以评估财务报表重大错报风险(无论是由于错误还是 欺诈),以及执行程序应对这些风险。此类程序包括在测试基础上审查有关 财务报表中金额和披露的证据。我们的审计还包括评价管理层使用的会计原则和作出的重大 估计,以及评价财务报表的整体列报方式。我们相信,我们的审计为我们的意见提供了合理的基础。
/s/
我们 自2023年以来一直担任本公司的审计师。
2024年3月21日
| F-1 |
独立注册会计师事务所报告
致Shuttle PharmPharmticals Holdings,Inc.股东和董事会。
对财务报表的意见
我们 已审计所附Shuttle PharmPharmticals Holdings,Inc.(“本公司”)截至2022年12月31日的综合资产负债表、截至该日止年度的相关营运报表、股东权益(亏损)及现金流量 及相关附注(统称为“财务报表”)。我们认为,财务报表 在所有重要方面都公平地反映了本公司截至2022年12月31日的财务状况,以及截至该日止年度的经营业绩和现金流量,符合美国公认的会计原则。
征求意见的依据
这些 财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会(SEC)和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们 根据PCAOB的标准进行了审计。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是舞弊。
我们的 审计包括执行程序,以评估财务报表重大错报的风险,无论是由于错误还是 欺诈,并执行应对这些风险的程序。这些程序包括在测试的基础上审查与财务报表中的金额和披露有关的证据。我们的审计还包括评估管理层使用的会计原则和作出的重大估计,以及评估财务报表的整体列报。我们相信,我们的审计为我们的意见提供了合理的基础。
/s/ BF BorgersCPA PC
BF 博格斯CPA PC
自2021年起担任 审计员至2023年3月21日
莱克伍德公司
2023年3月15日
| F-2 |
航天飞机 制药控股公司
合并资产负债表
| 十二月三十一日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| 资产 | ||||||||
| 流动资产 | ||||||||
| 现金和现金等价物 | $ | $ | ||||||
| 预付费用 | ||||||||
| 有价证券 | ||||||||
| 应计利息收入 | ||||||||
| 流动资产总额 | ||||||||
| 财产和设备,扣除累计折旧#美元 | ||||||||
| 其他资产 | ||||||||
| 经营性租赁使用权资产 | ||||||||
| 总资产 | $ | $ | ||||||
| 负债与股东权益 | ||||||||
| 流动负债 | ||||||||
| 应付账款和应计费用 | $ | $ | ||||||
| 应收账款及应计费用关联方 | ||||||||
| 应计应付利息 | ||||||||
| 应计应付利息—关联方 | ||||||||
| 应付关联方票据 | ||||||||
| 可转换应付票据,净额 | ||||||||
| 经营租赁负债 | ||||||||
| 流动负债总额 | ||||||||
| 可转换票据净额非流动应付票据 | ||||||||
| 衍生负债 | ||||||||
| 非流动经营租赁负债 | ||||||||
| 总负债 | ||||||||
| 股东权益 | ||||||||
| A系列可转换优先股,$面值 | ||||||||
| 普通股,$票面价值;授权股份;和分别发行和发行的股份 | ||||||||
| 额外实收资本 | ||||||||
| 累计赤字 | ( | ) | ( | ) | ||||
| 股东权益总额 | ||||||||
| 总负债和股东权益 | $ | $ | ||||||
附注是这些合并财务报表的组成部分。
| F-3 |
航天飞机 制药控股公司
合并的操作报表
| 截止的年数 | ||||||||
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 收入 | $ | $ | ||||||
| 运营费用 | ||||||||
| 研究与开发,合同费用报销净额 | ||||||||
| 一般和行政 | ||||||||
| 法律和专业 | ||||||||
| 总运营费用 | ||||||||
| 运营亏损 | ( | ) | ( | ) | ||||
| 其他收入(费用) | ||||||||
| 利息支出关联方 | ( | ) | ( | ) | ||||
| 利息支出 | ( | ) | ( | ) | ||||
| 利息收入 | ||||||||
| 融资费 | ( | ) | ||||||
| 衍生负债的公允价值变动 | ||||||||
| 出售有价证券收益 | ||||||||
| 有价证券公允价值变动 | ||||||||
| 可转债结算亏损 | ( | ) | ||||||
| 结清应付账款收益 | ||||||||
| Paycheck保护计划应付票据的宽恕收益 | ||||||||
| 其他费用合计 | ( | ) | ( | ) | ||||
| 净亏损 | ( | ) | ( | ) | ||||
| A系列优先股的股息 | ( | ) | ||||||
| 普通股股东应占净亏损 | $ | ( | ) | $ | ( | ) | ||
| 已发行普通股的加权平均数--基本和稀释 | ||||||||
| 普通股每股净亏损--基本亏损和摊薄亏损 | $ | ) | $ | ) | ||||
附注是这些合并财务报表的组成部分。
| F-4 |
航天飞机 制药控股公司
合并 股东权益变动表
| A系列优先股 | 普通股 | 其他已缴费 | 即将发行的普通股 | 累计 | 股东权益合计 | |||||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 资本 | 已发布 | 赤字 | (赤字) | |||||||||||||||||||||||||
| 余额-2021年12月31日 | $ | $ | $ | $ | $ | ( | ) | $ | ( | ) | ||||||||||||||||||||||
| 普通股以现金形式发行 | - | |||||||||||||||||||||||||||||||
| 行使认股权证换取现金 | - | |||||||||||||||||||||||||||||||
| 为融资成本发行的认股权证 | - | - | ||||||||||||||||||||||||||||||
| 为转换可转换债务和应计利息而发行的普通股 | - | ( | ) | |||||||||||||||||||||||||||||
| 为行使认股权证及结算应付票据而发行的普通股 | - | |||||||||||||||||||||||||||||||
| 为限制性股票单位发行的普通股 | - | |||||||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | ||||||||||||||||||||||||||||||
| A系列优先股股息 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 为A系列优先股的股息和转换而发行的普通股 | ( | ) | ||||||||||||||||||||||||||||||
| 净亏损 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 余额-2022年12月31日 | $ | $ | $ | $ | $ | ( | ) | $ | ||||||||||||||||||||||||
| 为融资成本而发行的权证,扣除发行费 | - | - | ||||||||||||||||||||||||||||||
| 为转换应计利息和本金而发行的普通股 | - | |||||||||||||||||||||||||||||||
| 为限制性股票单位发行的普通股 | - | ( | ) | |||||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | ||||||||||||||||||||||||||||||
| 净亏损 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 余额-2023年12月31日 | $ | $ | $ | $ | $ | ( | ) | $ | ||||||||||||||||||||||||
附注是这些合并财务报表的组成部分。
| F-5 |
航天飞机 制药控股公司
合并的现金流量表
| 截止的年数 | ||||||||
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 经营活动的现金流: | ||||||||
| 净亏损 | $ | ( | ) | $ | ( | ) | ||
| 对净亏损与经营活动中使用的现金净额进行的调整: | ||||||||
| 折旧 | ||||||||
| 衍生负债的公允价值变动 | ( | ) | ( | ) | ||||
| 摊销债务贴现和财务费用 | ||||||||
| 有价证券收益 | ( | ) | ||||||
| 有价证券公允价值变动 | ( | ) | ||||||
| 用普通股结算的应计利息 | ||||||||
| 可转债结算亏损 | ||||||||
| 结清应付账款收益 | ( | ) | ||||||
| Paycheck保护计划应付票据的宽恕收益 | ( | ) | ||||||
| 转换应付票据的利息宽免收益 | ||||||||
| 基于股票的薪酬 | ||||||||
| 经营性资产和负债变动情况: | ||||||||
| 应计利息收入 | ( | ) | ||||||
| 预付费用 | ( | ) | ||||||
| 应付账款和应计费用 | ( | ) | ||||||
| 与应付账款和应计费用有关的各方 | ( | ) | ||||||
| 应计应付利息 | ( | ) | ||||||
| 应计应付利息—关联方 | ( | ) | ||||||
| 其他资产 | ||||||||
| 经营租赁资产和负债变动 | ( | ) | ||||||
| 用于经营活动的现金净额 | ( | ) | ( | ) | ||||
| 投资活动产生的现金流: | ||||||||
| 有价证券投资 | ( | ) | ||||||
| 出售有价证券的收益 | ||||||||
| 购买设备 | ( | ) | ||||||
| 用于投资活动的现金净额 | ( | ) | ||||||
| 融资活动的现金流: | ||||||||
| 发行普通股及行使认股权证所得款项 | ||||||||
| 应付票据收益--关联方 | ||||||||
| 应付票据的偿还-关联方 | ( | ) | ( | ) | ||||
| 应付可换股票据及认股权证所得款项 | ||||||||
| 支付与应付可转换票据相关的融资成本 | ( | ) | ||||||
| 支付应付可转换票据 | ( | ) | ||||||
| 融资活动提供的现金净额 | ||||||||
| 现金和现金等价物净变化 | ( | ) | ||||||
| 期初现金及现金等价物 | ||||||||
| 期末现金和现金等价物 | $ | $ | ||||||
| 支付的现金: | ||||||||
| 利息 | $ | $ | ||||||
| 所得税 | $ | $ | ||||||
| 补充性非现金融资活动: | ||||||||
| 为转换应计利息而发行的普通股 | $ | $ | ||||||
| 为清偿债务而发行的普通股 | $ | $ | ||||||
| 为行使认股权证及结算应付票据而发行的普通股 | $ | $ | ||||||
| 为应付股息而发行的普通股 | $ | $ | ||||||
| 为融资费而发行的权证,扣除发行费 | $ | $ | ||||||
| 使用权资产和负债的初步确认 | $ | $ | ||||||
附注是这些合并财务报表的组成部分。
| F-6 |
航天飞机 制药控股公司
合并财务报表附注
2023年和2022年12月31日
注 1-组织和流动性
组织 和业务线
公司于2012年12月18日在马里兰州成立,名为Shuttle Pharmaceuticals,LLC。2016年8月12日,公司向马里兰州提交了
转换条款,将其从有限责任公司转换为C公司,当时公司将其名称
更改为Shuttle Pharmaceuticals,Inc.。(“穿梭机”)。本公司发行了一份有关转换的文件。 普通股
股票以换取
The Company’s primary purpose is to develop and commercialize unique drugs for the sensitization of cancers and protection of normal tissues, with the goal of improving outcomes for cancer patients receiving radiation therapy. Shuttle has deployed its proprietary technology to develop novel cancer immunotherapies, producing a pipeline of selective HDAC inhibitors for cancer and immunotherapy applications. The Company’s HDAC platform is designed to target candidate molecules with potential roles in therapeutics beyond cancer, including autoimmune, inflammatory, metabolic, neurological and infectious diseases. The Company’s Ropidoxuridine product, which is used with radiation therapy to sensitize cancer cells, was funded by a Small Business Innovation Research (“SBIR”) contract provided by the National Cancer Institute (“NCI”), a unit of the National Institutes of Health (“NIH”). Ropidoxuridine has been further developed though the Company’s collaborations with scientists at the University of Virginia for use in combination with proton therapy to improve patient survival. Historically, and prior to the Company’s initial public offering, the Company has obtained funding to develop products through NIH grants, including a product to predict late effects of radiation with metabolite biomarkers and develop prostate cancer cell lines in health disparities research.
本公司产品的生产和营销及其正在进行的研发活动将 受到美国众多政府机构的广泛监管。在美国上市之前,公司开发的任何产品或产品组合都必须经过严格的临床前(动物)和临床(人体)测试,以及食品和药物管理局(FDA)根据《食品、药物和化妆品法》实施的广泛的监管批准程序。 不能保证公司在临床试验中不会遇到会导致公司或FDA推迟或暂停临床试验的问题。
该公司的成功将在一定程度上取决于其在美国和其他国家/地区获得专利和产品许可权、保护商业秘密以及 在不侵犯他人专有权的情况下运营的能力。不能保证颁发给本公司或由本公司许可的专利不会受到挑战、无效或规避,也不能保证根据该专利授予的权利将在现在或将来为本公司提供专有保护或竞争优势。
流动性 和持续经营
我们的
综合财务报表乃按持续经营基准编制,考虑在正常业务过程中变现资产及清偿
负债和承担。公司自成立以来已经发生亏损,净亏损
约为美元
2022年9月,该公司完成了普通股的首次公开发行,净收益约为$
此次融资支持了导致药物产品生产和FDA批准IND用于Ropidoxuridine和胶质母细胞瘤放射治疗的第二阶段临床试验的运营。FDA建议,该公司同意扩大临床试验,需要额外的资金来完成试验。管理层打算以#美元的价格进行配股
| F-7 |
随附的综合财务报表不包括任何调整,以反映未来对资产可回收性和资产分类的影响,或如本公司无法继续经营下去,则负债的金额和分类。
注: 2-重要会计政策摘要
演示基础
这些 合并财务报表和相关披露是根据美国证券交易委员会(“美国证券交易委员会”)的规则和规定编制的。综合财务报表及披露乃根据美国公认会计原则(“GAAP”)采用权责发生制会计基础编制。
合并依据
合并财务报表是与公司全资子公司Shuttle PharmPharmticals,Inc.和Shuttle Diagnostics,Inc.在合并的基础上编制的。所有公司间交易和余额均已注销。
重新分类
为了与本年度的列报保持一致,对上一年的某些数额进行了重新分类。这些改叙 对报告的业务结果没有影响。
纠正上期财务报表中的一项重大错误
于2023年第四季度,本公司根据美国会计准则委员会730的规定,认定上一年度合并财务报表存在因某些研发费用的无形分类错误而导致的错报。作为一个结果,
c某些上一年度数额已作更正,以与本年度列报方式一致。本公司根据SEC员工会计公告第99号"重要性"(ASC主题250,会计变更和错误更正)评估了上一期间合并财务报表列报方式中此变更的重要性。根据这一评估,
公司得出结论, 合并的操作报表
根据数量和质量因素的总体考虑,
对先前呈列的任何财务报表并不重要。这些更正对已整合
资产负债表, 合并现金流量表或合并股东权益变动表 权益,
这些财务报表,或任何先前呈列的中期或年度财务报表。此外,这些修正并未导致季度或年初至今的营业亏损、基本或摊薄每股收益或营运资本发生变化。2023年的季度
更正包括美元
截至2022年12月31日止年度,反映前期对公司综合经营报表影响的更正摘要如下:
| 2022年12月31日 | 更正 | 更正 2022年12月31日 | ||||||||||
| 一般和行政费用 | $ | $ | $ | |||||||||
| 研发费用 | ( | ) | ||||||||||
| 净亏损 | $ | $ | $ | |||||||||
使用预估的
按照公认会计原则编制合并财务报表要求管理层作出估计和假设,这些估计和假设影响 合并财务报表日期的资产和负债的报告金额和或有资产和负债的披露 以及报告期内的收入和支出的报告金额。公司定期评估估计和 假设。本公司根据当前事实、历史经验和 在当时情况下认为合理的各种其他因素进行估计和假设,其结果构成了对资产和负债账面值 以及无法从其他来源显而易见的成本和费用的应计作出判断的基础。公司经历的实际结果 可能与公司的估计存在重大不利差异。如果估计值与实际结果之间存在重大差异 ,未来的经营结果将受到影响。 随附的综合财务报表中载有衍生工具估值和基于权益的 认股权证的初步计量的重要估计。
| F-8 |
现金 和现金等价物
现金 及现金等价物包括银行账户和货币市场基金中的现金,自成立之日起不到三个月的到期日,这些现金 可随时转换为已知数额的现金,并且管理层认为这些现金的价值损失风险很小 。于二零二三年及二零二二年十二月三十一日,现金及现金等价物包括以下各项:
| 十二月三十一日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| 现金 | $ | $ | ||||||
| 货币市场基金 | ||||||||
| $ | $ | |||||||
定期,
公司可能会在金融机构持有超过联邦保险限额的现金余额,
有价证券
我们的 债务证券投资按公允价值列账。未分类为持有至到期日的债务证券投资 按公平值列账,并分类为买卖或可供出售。债务证券买卖 的已实现及未实现损益计入收入。
截至
2023年12月31日,本公司持有的被分类为交易性有价证券的有价证券包括
未偿还余额$
金融工具的公允价值
公司遵循关于按经常性基准计量的金融工具公允价值计量的会计准则,以及 最初按其估计公允价值记录的某些资产和负债。公允价值定义为截至计量日期的退出价格 或在市场参与者之间的有序交易 中出售资产所收取的金额或转让负债所支付的金额。本公司采用以下三个层级架构,最大限度地使用可观察输入数据,最大限度地使用 使用不可观察输入数据,以评估其金融工具:
| ● | 级别 1:可观察的输入数据,例如相同工具在活跃市场的未经调整的报价。 | |
| ● | 级别 2:市场上可直接或间接观察到的类似工具的报价。 | |
| ● | 级别 3:由很少或根本没有市场活动支持的重大不可观察输入,并且是价值 使用定价模型、贴现现金流方法或类似技术确定,以及 厘定公平值需要作出重大判断或估计。 |
按公允价值计量的金融工具根据对公允价值计量具有重要意义的最低投入水平进行整体分类。本公司对某一特定投入对整个公允价值计量的重要性的评估 要求本公司作出判断并考虑该资产或负债的具体因素。使用不同的假设和/或估计方法可能会对估计公允价值产生重大影响。因此,披露的公允价值估计或最初记录的 金额可能不能反映本公司或工具持有人在当前市场上可变现的金额 。
由于该等工具的短期到期日,本公司的金融工具包括现金及现金等价物、预付开支、应付帐款及应计负债等的账面金额与公允价值相若。
以下载列了本公司于2023年12月31日须按经常性基准按公允价值重新计量的金融工具及其 公允价值层级(2022年12月31日无):
| 2023年12月31日 | 1级 | 2级 | 3级 | 账面价值 | ||||||||||||
| 资产 | ||||||||||||||||
| 有价证券: | ||||||||||||||||
| 美国国债 | $ | $ | $ | $ | ||||||||||||
| 总资产 | $ | $ | $ | $ | ||||||||||||
| 负债 | ||||||||||||||||
| 衍生负债-认股权证 | $ | $ | $ | $ | ||||||||||||
| 衍生工具负债加速功能 | ||||||||||||||||
| 总负债 | $ | $ | $ | $ | ||||||||||||
| F-9 |
租契
我们从一开始就确定一项安排是否为租赁。经营租赁包括在 综合资产负债表上的经营租赁使用权资产(“ROU”)、经营租赁负债(流动)和经营租赁负债(非流动)。融资租赁包括在我们综合资产负债表中的财产和设备、其他流动负债和其他长期负债 。在截至2023年12月31日及2022年12月31日的年度内,本公司并无利用任何需要确认融资租赁的融资。
ROU 资产代表我们在租赁期内使用标的资产的权利,租赁负债代表我们支付租赁产生的租赁 款项的义务。经营租赁ROU资产及负债于开始日期根据租赁期内租赁付款的现值 确认。由于我们的租赁不提供隐含利率,我们使用基于抵押借款的估计利率的递增借款利率 ,超过开始日期租赁付款的类似期限。运营租赁ROU资产还包括支付的任何租赁费用,不包括租赁奖励。我们的租赁条款可能包括在合理确定我们将行使该选项时延长或终止租赁的选项。租赁付款的租赁费用在租赁期限内以直线方式确认。
租赁开始时租期不超过12个月的租约不会记录在我们的合并 平衡床单并在我们的运营报表中以直线 的方式在租赁期内支出。我们与租赁和非租赁组件签订了租赁协议, 通常单独核算。
公司通过估计在类似期限内以抵押方式借款所需支付的利率、等于租赁付款和类似经济环境的金额 (“增量借款利率”或“IBR”)来确定经营租赁的最低未来租赁付款的现值。本公司通过确定参考利率并考虑到融资选择和某些租赁特定情况进行调整来确定适当的IBR。对于参考利率,本公司使用股本积累的风险调整利率作为隐含利率。
财产 和设备
财产和设备按成本减去累计折旧列报。维护和维修支出在发生时计入费用; 增加、续订和改进计入资本化。当财产和设备报废或以其他方式处置时,相关成本和累计折旧将从各自的账户中扣除,任何收益或损失都将计入运营。 财产和设备的折旧是使用直线法计算的,估计寿命如下:
| 家俱 | ||||
| 计算机和设备 | ||||
| 研究设备 |
衍生工具 金融工具
公司不使用衍生工具来对冲现金流风险、市场风险或外汇风险。我们对我们的所有金融工具进行评估,以确定此类工具是衍生工具还是包含符合嵌入衍生工具资格的功能。对于作为负债入账的衍生金融工具,衍生工具最初按其公允价值入账 ,然后于每个报告日期重新估值,并在综合经营报表中报告公允价值变动。对于我们的衍生金融工具,本公司使用蒙特卡罗估值模型对衍生工具在开始时及之后的估值日期进行估值。衍生工具的分类,包括该等工具是否应记录为负债或权益,于每个报告期结束时进行评估。衍生工具负债在综合资产负债表中按是否需要在资产负债表日起十二(12)个月内进行净现金结算或转换而分类为流动或非流动负债。
可兑换的 备注
公司将转换期权从其宿主工具中分离出来,并在满足特定条件的情况下将其作为独立的衍生金融工具入账 。该等准则包括以下情况:(A)嵌入衍生工具的经济特征及风险与宿主合约的经济特征及风险并不清楚及密切相关,(B)同时包含嵌入衍生工具及宿主合约的混合工具 并未根据其他适用的公认会计原则按公允价值重新计量,而公允价值的变动在发生时于收益中报告;及(C)条款与嵌入衍生工具相同的独立工具 将被视为衍生工具。
| F-10 |
认股权证
公司根据对权证具体条款的评估和FASB ASC 480中适用的权威指导,将权证作为权益分类或负债分类工具进行会计处理,区分负债与权益(“ASC 480”) 和ASC 815,衍生工具和对冲(“ASC 815”)。评估考虑认股权证是否为ASC 480所指的独立金融工具,是否符合ASC 480所指的负债定义,以及权证是否符合ASC 815中有关股权分类的所有要求,包括权证是否与本公司本身的普通股挂钩,以及 权证持有人是否可能在本公司无法控制的情况下要求“现金净额结算”,以及股权分类的其他条件。这项评估需要使用专业判断,在权证发行时以及在权证尚未结清的每个季度结束日进行。
对于符合所有股权分类标准的已发行或修改的权证,权证必须在发行时记录为额外实收资本的组成部分 。对于不符合所有股权分类标准的已发行或修改的权证, 权证必须在发行之日及其之后的每个资产负债表日按其初始公允价值记录。 权证估计公允价值的变化在合并 运营报表。权证的公允价值使用Black-Scholes定价模型或蒙特卡洛模拟进行估算。
长期资产减值
只要发生的事件或商业环境的变化表明资产的账面金额可能无法完全收回,公司就会审查其长期资产的减值。资产的可回收能力是通过将资产的账面价值与资产预期产生的预计未贴现现金流进行比较来衡量的。如果资产的账面金额超过其估计的未来现金流量,将在资产账面金额超过资产公允价值的金额中确认减值费用 。在本报告所述期间,长期资产没有减值。
股票奖励的薪酬 包括限制性股票单位(“RSU”),按授予日的公允价值计量, 在相关服务或绩效期间确认为费用。股票奖励的公允价值以授予日我们普通股的报价为基础。与RSU相关的薪酬支出减去员工在归属之前被没收的单位的公允价值。RSU的补偿成本使用直线 方法在必要的服务期限内确认。
研究和开发费用
研发费用在发生时计入费用。研发费用包括但不限于产品开发、临床和监管费用、工资和其他人员费用,其中包括一定比例的首席执行官、首席运营官、首席财务官和董事薪酬。在截至2023年12月31日和2022年12月31日的年度中,这些个人的部分人事相关费用和基于股票的薪酬费用总计 美元百万美元和美元由于积极参与研究和开发活动、材料、用品、相关分包费用和咨询成本,分别有100万美元计入研发费用。
关于
报销的会计处理,GAAP为营利性
公司收到的政府补助金的会计提供了有限的指导。根据ASC主题832, 政府援助2022年1月1日采纳,我们在综合财务报表附注中披露了收到的某些类型的政府援助,其中包括:a)交易的性质
包括所提供援助的性质,b)用于对交易进行核算的会计政策以及c)其他
相关条款(如有需要)。根据补助金或合同的类型,我们理解有不止一种可接受的会计处理方法——减少成本、摊销递延信贷、收入或其他收入。
公司已得出结论,收到的研发费用报销更类似于降低成本,并将报销
用于支付已发生的研究费用。截至二零二三年及二零二二年十二月三十一日止年度,我们录得美元
所得税 税
公司根据ASC主题740对所得税进行核算, 所得税。ASC 740要求公司使用资产和负债法核算所得税,递延税项资产确认为可扣除的暂时性差异,递延税项负债确认为应税暂时性差异。暂时性差异是指报告的资产和负债金额及其税基之间的差异。当管理层认为本公司预计不会在不久的将来产生应纳税所得额并利用其递延税项资产时,递延税项资产减值准备。 因此,部分或全部递延税项资产更有可能无法变现。递延税项资产及负债于颁布之日按税法及税率变动的影响作出调整。
根据 ASC 740,只有当税务检查中"更有可能"维持税务状况 ,且假定进行税务检查时,税务状况才被确认为福利。确认的金额是 在检查时实现的可能性大于50%的最大税收优惠金额。对于不符合"更有可能"测试的税务头寸, 不记录任何税务优惠。本公司于任何呈报期间并无重大不确定税务状况。
| F-11 |
普通股的 每股净损失要求在所有 资本结构复杂的实体的经营报表正文中列报每股基本收益,并要求对每股基本收益的分子和分母进行核对 计算。在随附的综合财务报表中,每股基本亏损乃按净亏损除以年内已发行普通股加权平均股数计算。每股摊薄收益的计算方法是将净收入除以 期内普通股和潜在摊薄已发行普通股的加权平均数, 反映通过或然股份安排、股票期权和 认股权证发行的普通股可能产生的潜在摊薄,除非结果会产生反摊薄效应。
受归属限制股票单位和其他股票支付奖励的 摊薄影响使用"库存 股票法"计算,该法假设行使这些工具的"所得"用于以该期间的平均市价购买普通 股。可转换证券的摊薄效应采用"如果转换 法"计算。根据如果转换法,假设证券在期初转换,所得 普通股股份计入所呈列整个期间的摊薄计算的分母。
| 十二月三十一日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| 可换股票据(附注5) | ||||||||
| 认股权证(注6) | ||||||||
| 受限制股票单位(附注6) | ||||||||
最近 会计声明
2023年12月,FASB发布了ASU 2023—09,“所得税(主题740):所得税披露的改进”,其中要求提供有关报告实体有效税率调节的分类信息以及有关支付所得税的信息。该指导方针在2025年2月1日之后开始的公司财年生效,允许提前采用。 公司 预计采纳本准则不会 对其财务报表产生任何重大影响。
截至2023年12月31日止年度,并无其他对本公司具有重大意义 或潜在重大意义的近期会计公告、会计公告变更或近期采纳的会计指引。
注: 3-租契
公司在年内签订了两份租赁协议,允许使用实验室设施。
2023年2月16日,公司签订了新的办公室和实验室空间租赁协议,基本租金为美元
以下 汇总了公司经营租赁的使用权资产和租赁信息:
| 截止的年数 | ||||||||
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 经营租赁成本 | $ | $ | ||||||
| 可变租赁成本 | ||||||||
| 转租收入 | ( | ) | ( | ) | ||||
| 总租赁成本 | $ | $ | ||||||
| 其他信息 | ||||||||
| 来自经营租赁的经营现金流 | $ | $ | ||||||
| 以新的经营租赁负债换取的使用权资产 | $ | $ | ||||||
| 加权平均剩余租赁年限-经营租赁(年) | ||||||||
| 加权平均贴现率-经营租赁 | % | % | ||||||
| F-12 |
截至2023年12月31日,根据经营租赁负债,未来 不可取消的最低租赁付款如下:
| 截至十二月三十一日止的年度, | ||||
| 2024 | $ | |||
| 2025 | ||||
| 2026 | ||||
| 2027 | ||||
| 2028 | ||||
| 未来最低租赁付款总额 | ||||
| 减去:推定利息 | ( | ) | ||
| 付款现值 | $ | |||
注: 4-应付票据-关联方
2020年12月1日,公司合并了欠公司一名高管及其配偶的所有未偿还贷款,产生了以下两笔贷款:(I)一名公司高管的配偶于2020年12月1日提供的一笔贷款,本金
余额为#美元
2021年6月21日,公司从公司一名高级管理人员的配偶那里获得了一笔金额为#美元的贷款。
截至2023年6月30日,本金支付金额为$
注: 5-可转换票据
Alto 机会大师基金,SPC
于2023年1月11日,本公司与开曼群岛实体(“投资者”)Alto Opportunity Master Fund(SPC-Separated Master Portfolio B)订立证券购买协议(“SPA”),据此本公司向投资者出售$
| F-13 |
在加入SPA的同时,本公司签订了一系列相关协议,包括担保协议(“担保
协议”)、知识产权担保协议(“知识产权担保协议”)和附属担保(
“附属担保”)。担保协议和担保允许投资者对公司的所有资产和知识产权拥有担保
权益和留置权,直至Alto可转换票据
付清为止。此外,SPA要求公司签订弹性存款账户控制协议(“弹性存款账户控制协议”),在公司拖欠偿还Alto可转换票据的情况下,允许投资者仅就Alto可转换票据下剩余的任何资金承担对公司银行账户的控制权。因此,在加入SPA的同时,本公司设立了一个单独的银行账户,将投资额存入该账户,根据该账户,本公司、投资者和持有投资额的银行First Republic Bank签订了正在启动的
Boustead证券有限责任公司(“Boustead”)作为Alto可转换票据和认股权证发售的配售代理,获得了
$
公司分配了与Boustead配售代理费相关的融资成本,金额为美元
公司为票据的债务部分分配了原始折扣$
截至2023年12月31日止年度,本公司录得利息支出为美元
截至2023年12月31日,可换股票据的未偿还本金为美元
注: 6-股东权益
普通股 股票
截至2023年12月31日止年度,本公司发行:
| ● |
普通股以结算美元 | |
| ● | 为授予受限制股票单位而发行的普通股股份。 |
| F-14 |
在截至2022年12月31日的年度内,公司发布了:
| ● |
普通股股份兑换美元
应计利息, 应付美元票据结算时的普通股股份 | |
| ● | ||
| ● |
公司首次公开募股完成后, | |
| ● | 公司为行使认股权证而首次公开发行完成后的普通股股份
$ | |
| ● |
行使认股权证以结算应付美元票据时的普通股股份, | |
| ● |
优先股转换后的普通股股份, 结算应支付的股息$ |
认股权证
关于2023年1月发行的Alto可转换票据,Boustead获得了认股权证
关于2023年和2022年12月31日终了年度发行的所有认股权证的活动摘要如下:
| 数量 | 加权平均 | 加权平均 | ||||||||||
| 认股权证 | 行权价格 | 寿命(年) | ||||||||||
| 未清偿,2021年12月31日 | $ | - | ||||||||||
| 授与(1) | ||||||||||||
| 已锻炼(2) | ( | ) | - | |||||||||
| 未清偿,2022年12月31日 | $ | |||||||||||
| 已授予--Boustead | ||||||||||||
| 批准—Ayrton | ||||||||||||
| 未清偿,2023年12月31日 | $ | |||||||||||
| (1) | ||
| (2) |
截至2023年12月31日,权证的 内在价值为美元.所有尚未行使之认股权证可于二零二三年十二月三十一日行使。
股权 激励计划
我们的 2018年股权激励计划(以下简称“2018年计划”)为员工、执行官、 董事以及主要顾问和顾问提供股权激励。股权激励授予可以以行使价 不低于根据2018年股权激励计划确定的相关股份公允市值的股票期权、限制性股票 奖励、其他股票奖励或上述各项的任何组合的形式进行。2018年股权激励计划由公司的 薪酬委员会管理。我们已预留 根据2018年股权激励计划发行的普通股股份。截至2023年12月31日, 股份已根据2018年股权激励计划授出,其中, 股份已归属。
受限的 个库存单位
我们 可以根据我们的2018年计划授予限制性股票单位(RSU)。RSU是记账分录,其金额等于我们普通股的一股公平市场价值。根据我们2018年计划的规定,管理人确定RSU的 条款和条件,包括归属标准以及付款形式和时间。尽管有上述规定,管理人仍可自行决定加速任何限制失效或取消的时间。授予的RSU通常从任命之日起以三分之一的增量每年授予 。
截至2023年和2022年12月31日止年度,根据与董事、高级管理人员和顾问的协议, 和值为$的RSU
| Year ended December 31, | ||||||||
| 2023 | 2022 | |||||||
| 确认为一般和行政费用 | $ | 115,000 | $ | 170,663 | ||||
| 在研发费用中确认 | 66,960 | 233,293 | ||||||
| 总计 | $ | 181,960 | $ | 403,956 | ||||
截至2023年和2022年12月31日,及$ 与未归属的受限制单位相关的未确认股票补偿费用,预计将在加权平均期间内确认, 年 , 分别是几年。
| F-15 |
| 股份数量 | 加权平均授予日期每股公允价值 | |||||||
| 未清偿,2021年12月31日 | $ | |||||||
| 授与 | ||||||||
| 未清偿,2022年12月31日 | $ | |||||||
| 授与 | ||||||||
| 既得 | ( | ) | ||||||
| 未清偿,2023年12月31日 | $ | |||||||
注: 7-衍生负债
衍生负债会计中使用的公允价值假设
ASC 815要求我们在每个报告期末评估衍生工具负债的公允市场价值,并将公允市场价值的任何变化 确认为其他收入或支出。
2023年1月,就Alto可换股票据而言,本公司发行认股权证,
公司确定我们的衍生负债来自票据持有人的加速选择权, 与主机不明确且密切相关,因此应作为一个分支衍生负债入账。
我们
将该等衍生负债分类为第三级公允价值计量,并使用蒙特卡洛定价模型计算截至2023年1月11日及各报告期的公允价值。模拟的关键输入概述如下。蒙特卡洛模拟
对每个估值日期使用隐含VWAP。隐含的VWAP通过设置各部分的总和(例如,衍生工具
和不含衍生工具的债务)等于现金收益。然后,对模拟进行迭代和操作,以求解隐含股价
,该价格约为$每股(或近似
截至2023年12月31日止年度,蒙特卡洛模拟的 关键输入范围如下:
| 净现金结算及下跌轮关键估值输入—认股权证 * | ||||
| 年化波动率 | ||||
| 无风险利率 | ||||
| 引用VWAP * | $ | |||
| 行权价格 | $ | |||
| 概率评估 | ||||
| 非流动性折价 | - | |||
| 期间(年) | ||||
| * |
| F-16 |
| 加速选择关键估值输入 * | ||||
| 年化波动率 | ||||
| 无风险利率 | ||||
| 引用VWAP * | $ | |||
| 非流动性折价 | - | |||
| 期间(年) |
| * |
下表汇总了衍生工具负债的变动情况:
| 使用重大不可观察投入计量公允价值(第3级) | ||||||||
| 认股权证 | 加速功能 | |||||||
| 余额-2021年12月31日 | $ | $ | ||||||
| 公允价值变动收益 | ( | ) | ||||||
| 余额-2022年12月31日 | ||||||||
| 添加新衍生物 | ||||||||
| 公允价值变动收益 | ( | ) | ( | ) | ||||
| 余额-2023年12月31日 | $ | $ | ||||||
注: 8-关联方交易
2022年9月14日,我们与TCG GreenChem,Inc.签订了生产协议。(“TCG GreenChem”),TCG Lifesciences Pvt Ltd.的美国子公司
,一家位于印度的全球合同研究和制造服务公司。Chis Senanayake博士是我们的独立董事之一,是TCG GreenChem的首席执行官兼CSO,也是TCG Lifesciences Pvt Ltd.的CSO。TCG GreenChem已签约进行工艺研究、开发和符合cGMP要求的IPdR生产。本公司向TCG GreenChem支付$
| F-17 |
注: 9-所得税
本公司于截至2023年及2022年12月31日止年度并无所得税开支或收益,因为本公司已就该等期间的净经营亏损结转计提全额估值拨备 。
我们 仅当税务机关根据头寸的技术优势进行审查后,税务状况很有可能维持, 方会确认来自不确定税务状况的税务利益。从该等头寸确认的税务利益是根据最终结算时实现的可能性大于50%的最大利益进行估计 。2023年和2022年纳税年度没有不确定的 税务状况需要报告。
《2017年减税和就业法案》(“TCJA”)修订了IRC第174条,要求将在2021年12月31日之后开始的纳税年度内发生的所有研发成本资本化。如果研发活动在美国进行,这些成本需要在
五年内摊销,或超过15年,如果活动是在美国境外进行的。为
税务申报目的,公司将美元资本化
按美国法定税率对所得税优惠的对账,
| 十二月三十一日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| 法定税率的联邦税收优惠 | $ | ( | ) | $ | ( | ) | ||
| 扣除联邦税收影响的州所得税优惠 | ( | ) | ( | ) | ||||
| 汇率变化 | ( | ) | ||||||
| 研发税收抵免 | ( | ) | ( | ) | ||||
| 返回拨备调整 | ||||||||
| 永久性差异 | ( | ) | ||||||
| 更改估值免税额 | ||||||||
| 股票补偿费用不足 | ||||||||
| 其他调整 | ||||||||
| 所得税费用 | $ | $ | ||||||
递延税项资产的主要组成部分包括:
| 十二月三十一日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| 递延税项资产: | ||||||||
| 净营业亏损结转 | $ | $ | ||||||
| 固定资产 | ||||||||
| 无形资产(包括第174条资本化) | ||||||||
| 研发税收抵免 | ||||||||
| 基于权益的薪酬 | ||||||||
| 利息和其他应计费用 | ||||||||
| 租赁资产/(负债) | ||||||||
| 总计 | $ | $ | ||||||
| 十二月三十一日, | 十二月三十一日, | |||||||
| 递延税项负债: | 2023 | 2022 | ||||||
| 证券公平市价变动 | $ | ( | ) | $ | ||||
| 预付费用 | ( | ) | ||||||
| 固定资产 | ( | ) | ||||||
| 总计 | $ | ( | ) | $ | ||||
| 递延税项资产总额 | $ | $ | ||||||
| 减去:估值免税额 | ( | ) | ( | ) | ||||
| 递延税项净资产 | $ | $ | ||||||
| F-18 |
美国联邦所得税率与公司实际税率的对账如下:
| 十二月三十一日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| 法定税率的联邦所得税优惠 | % | % | ||||||
| 扣除联邦税收影响的州所得税优惠 | % | % | ||||||
| 税率的变化 | % | % | ||||||
| 研发税收抵免 | % | % | ||||||
| 返回拨备调整 | ( | %) | ( | %) | ||||
| 永久性差异 | ( | %) | % | |||||
| 更改估值免税额 | ( | %) | ( | %) | ||||
| 股票补偿费用不足 | ( | %) | ||||||
| 其他调整 | ( | %) | ( | %) | ||||
| 所得税总支出 | % | % | ||||||
截至2023年12月31日,公司拥有约$
在2018年之前创建的NOL可以
向后结转两年
截至2023年12月31日,该公司拥有
注: 10-后续事件
管理层 评估了资产负债表日后至发布综合财务报表之日的所有其他事项 ,并确定需要披露以下项目。
纳斯达克 出价要求延长至2024年8月26日
2023年8月31日,在该公司的普通股交易低于美元后,每股
FDA 批准继续进行罗哌多尿苷(IPdR)的II期研究
2024年1月8日,穿梭制药控股公司,特拉华州一家公司(以下简称“公司”)发布了一份新闻稿,宣布 公司已收到美国食品药品管理局(FDA)的"安全继续"信函,该信函涉及公司的 研究新药(IND)申请,其在新诊断的带有未甲基化MGMT启动子的IDH—野生型胶质母细胞瘤患者中作为放射增敏剂的 期研究。收到信函后,Shuttle便可开始 II期研究,因此,公司目前正在完成研究中心的入组工作,预计在未来几个月内完成"首名患者,首剂" 。
权利 产品
自2024年2月7日起,公司及其全资子公司Shuttle Diagnostics,Inc.,与内华达州的一家有限责任公司SRO,LLC签订了证券购买协议(以下简称“购买协议”),根据该协议,SRO LLC同意
承诺从该公司购买$
购买协议允许SRO LLC在60天内筹集初始美元
限制性股票授予首席财务官
2024年3月8日,首席财务官被授予
受限制股票单位("RSU"),价值为美元
| F-19 |
项目 9.会计和财务披露方面的变更和分歧
2023年3月21日,公司审计委员会选择FORVIS,LLP(“新会计师”)作为公司的 独立注册会计师事务所,负责审核其截至2023年12月31日止年度的10—Q表格季度报告和10—K表格年度报告。因此,审计委员会决定BF Borgers CPA PC(“前会计师”) 将不再担任公司的独立注册会计师事务所,自2023年3月21日起生效。
2023年3月22日,公司向SEC提交了一份表格8—K(“表格8—K”)的当前报告,披露了其 认证会计师的变更。
如 在表格8—K中披露的,前会计师对我们截至2021年和2022年12月31日止年度的财务报表的审计报告不包含任何不利意见或不声明意见,也不存在关于不确定性、审计范围或会计原则的保留或修改,除了对公司截至12月31日止年度的财务报表的审计报告,二零二一年包含 对本公司持续经营能力的不确定性(“持续经营意见”)。前审计师的 持续经营意见在公司于2022年9月完成约1,140万美元的首次公开募股 和随后于2023年1月完成400万美元的私人配售后得到解决。
截至2022年12月31日和2021年12月31日止年度,截至8—K表日期,公司没有任何“分歧”。(定义见第S—K条第304(a)(1)(iv)项和相关指示)与前会计师就会计原则 或惯例、财务报表披露或审计范围或程序的任何事项,这些分歧如果解决得不到令前会计师满意 的解决,本应导致他们在有关这些期间的财务报表的报告中提及这些分歧。
截至2022年或2021年12月31日止年度, 无须报告事件,截至表8—K日期,未发生法规S—K第304(a)(1)(v)项所定义的须报告事件。
正如 在表格8—K中还披露的,在聘用新会计师之前,公司未就 与新会计师协商:(i)将会计原则应用于特定交易(无论是预期的还是提议的),或可能对公司财务报表发表的审计意见类型 ;或(ii)任何涉及"分歧"或"须报告事件"的事项(这些术语分别在第S—K条第304(a)(1)(iv)项和(a)(1)(v)项中定义)。
2023年3月21日,公司向前会计师提供了表8—K中所载的披露,披露了解雇 前会计师的情况,并书面要求前会计师向公司提供一封致SEC的信函,说明 他们是否同意此类披露。前会计师的答复作为表8—K的附件16.1提交。
第 9A项。控制和程序
对披露控制和程序进行评估
披露 控制措施和程序(定义见《交易法》第15d—15(e)条)旨在确保 根据《交易法》提交的报告(如本报告)中要求披露的信息在美国证券交易委员会规则和表格中指定的时间段内得到记录、处理、汇总和报告。披露控制和程序的设计目标是 确保此类信息得到累积并传达给我们的管理层,包括我们的首席执行官和首席财务官(视情况而定),以便及时就所需披露作出决定。
截至 2023年12月31日,我们的管理层对我们的披露控制 和程序的设计和运作的有效性进行了评估。该等评估在首席执行官的监督下进行,总裁 兼首席运营官、首席财务官和第三方金融服务提供商均参与其中。基于此评估,管理层 得出结论,截至2023年12月31日,我们的披露控制和程序一直无效,并将继续无效。基于上述情况, 我们的管理层得出结论,我们对以下财务报告领域的内部控制是重大弱点:
| ● | 我们的书面会计政策和管理层对重大不寻常交易(包括与债务和股权交易相关的复杂会计)的会计处理和影响的考虑的文件是有限的,并导致对财务报告的监督无效, | |
| ● | 由于香港的面积和发展阶段,将所有相互冲突的职责分开,未必总是可行的,在经济上也未必可行。在这一年中,我们缺乏足够的审查程序和职责分工 ,导致审计人员以外的其他人没有进行适当的审查,包括人工日记帐分录,并且 流程文件缺乏用于审查和监控财务报表结算流程和财务报告的控制。 | |
| ● | 由于公司自成立之日 以来的发展,当时我们一直专注于NIH SBIR研究合同,并提供相关成本分配津贴,直到我们完成 IPO并继续我们的开发过程,管理层一直缺乏一个正式的流程来识别和正确分类运营费用 为研发(以下简称“研发”)。 | |
| ● | 我们确定了与整体信息技术一般 控制(“ITGC”)相关的调查结果,包括支持公司内部 控制流程和控制的系统的访问和职责分离问题。 |
截至2023年12月31日止三个月,公司对财务报告的内部控制 未发生对公司对财务报告的内部控制产生重大影响或合理可能对公司对财务报告的内部控制产生重大影响的变化。管理层 将继续持续监控和评估我们对财务报告的内部控制和程序的有效性 ,并承诺采取进一步行动并在必要时实施额外改进。
第 9B项。其他信息
没有。
第 9C项。关于妨碍检查的外国司法管辖区的披露
不适用 。
| 62 |
第 第三部分
项目 10.董事、高管和公司治理
管理
我们的董事和高管以及他们各自的年龄和职称如下:
| 名字 | 年龄 | 担任职位 和职位 | ||
| Anatoly Dritschilo医学博士 | 79 | 董事会主席兼首席执行官 | ||
| 迈克尔·范德·胡克 | 64 | 首席财务官、运营和监管副总裁 | ||
| 彼得·德里奇洛 | 54 | 总裁 和首席运营官 | ||
| Mira Jung博士 | 74 | 首席科学官 | ||
| 泰文·里奇,医学博士 | 76 | 首席临床官 | ||
| 米尔顿·布朗,医学博士,博士 | 58 | 董事 | ||
| 史蒂文·理查兹 | 55 | 独立 董事(1)(2)(3) | ||
| 约书亚·谢弗 | 53 | 独立 董事(2)(3) | ||
| 克里斯·H·塞纳亚克博士。 | 66 | 独立 董事(1) | ||
| 贝特·雅各布斯博士 | 73 | 独立 董事(1)(3) |
| (1) | 审计委员会成员 |
| (2) | 薪酬委员会成员 |
| (3) | 成员 提名及企业管治委员会 |
以下是对我们董事和高管的背景和业务经验的描述。
Anatoly Dritschilo,医学博士Dr. Dritschilo是公司的联合创始人,自公司于2012年12月成立以来一直担任首席执行官兼董事会主席。Dritschilo是一名经过培训的放射肿瘤学家,并在医疗保健领域担任过 多个领导职务。在华盛顿特区的乔治敦大学医学院,1980年至2022年,他主要担任系主任;2005年至2022年,担任MedStar乔治敦大学医院放射肿瘤科主任;1994年至1997年,担任乔治敦大学医院医学主任;2005年至2007年,担任NCI资助的隆巴迪综合癌症中心临时主任。他还曾在MedStar乔治敦大学医院、国家首都康复医院和MedStar健康研究所的董事会任职。此前,他是Ontario,Inc.的创始董事。以及Neopharm,Inc.董事会成员。他的250多篇科学出版物和12项已颁发的专利使他当选为美国国家发明家学院院士。Dritschilo博士拥有宾夕法尼亚大学化学工程理学学士学位、新泽西医学院医学学位和哈佛联合放射治疗中心的住院医师培训。 他的资历支持他担任我们的首席执行官和董事会主席。
Michael P.Vander Hoek担任公司首席财务官,他于2019年8月被任命为首席财务官,副董事长总裁自2019年以来一直担任运营和监管职位。从2019年11月到2021年4月,Vander Hoek先生在乔治敦隆巴迪综合癌症中心(“LCCC”)担任董事财务和业务发展部 ,在那里他领导了一个新的五年期 2.19亿美元的机构承诺,根据国家癌症研究所批准的新的癌症财团安排用于癌症中心研究,并招聘 科学家与高级领导人一起实现改善癌症研究和治疗的战略目标。从2007年到2019年11月,Vander Hoek先生在乔治敦大学担任董事行政助理 ,负责肿瘤学、放射医学、病理学和生物统计学、生物信息学和生物数学系的400多名教职员工的直接行政 业务,包括管理Medstar Health、John Theurer癌症中心和乔治敦大学对LCCC的2.169亿美元机构承诺。并为乔治敦大学和Medstar Health实施企业范围的临床试验管理系统。2004年至2007年,范德·胡克在乔治敦大学的LCCC担任首席财务长。在乔治敦大学期间,Vander Hoek先生在LCCC和JTCC之间谈判了一系列12项研究整合协议,这些协议导致 在2019年获得NCI认可的联盟的批准。从2001年到2004年,Vander Hoek先生在MedStar Georgetown大学医院担任规划和行政副主席,负责管理约440名内科和神经科的工作人员、医生、住院医生和研究员的行政和财务业务。从1996年到2001年,Vander Hoek先生在乔治城大学医学中心医学部担任财务和信息系统高级副署长 ,设计和管理教师薪酬系统,同时管理部门的财务和信息系统。 他在上市公司的财务管理经验包括:1990年至1993年董事重症监护报销 和1993至1996年美国实验室公司(LabCorp)区域总监。他在这两家公司的职责包括与合并、收购和初创企业运营相关的广泛财务管理。Vander Hoek先生拥有乔治华盛顿大学的卫生服务管理硕士学位和霍普学院的生物学和心理学文学士学位。
| 63 |
自2012年12月航天飞机公司成立以来,Peter Dritschilo一直担任我们的总裁和首席运营官。他还担任我们的首席财务官,直至2019年。Dritschilo先生在医疗服务和癌症治疗方面拥有超过25年的企业管理经验。2001至2005年间,他曾在Medstar-Rad America、2005至2006年间在乔治敦大学、2006至2011年间在威廉王子医院和Fauquier医院癌症中心担任行政职务,并于2011至2018年间在英诺瓦健康系统的Schar癌症研究所担任行政职务。2014年,由于一家个人企业的失败,德里奇洛申请了破产法第七章的破产保护。Dritschilo先生毕业于乔治城大学,并获得乔治华盛顿大学工商管理硕士学位。
Mira Jung博士是我们公司的联合创始人,自2012年12月以来一直担任我们的生物学首席科学官,从2012年12月我们成立到2019年,她一直是我们的董事会成员。自2004年以来,Jung博士一直担任乔治敦大学医学院的放射医学和微生物学教授。她在分子辐射生物学研究方面拥有30多年的经验,是辐射抵抗机制和HDAC抑制剂在改变辐射反应中的作用方面的专家。Jung博士的研究得到了美国国立卫生研究院和美国国防部的资助,发表了100多篇论文,获得了美国专利商标局授予的9项专利,其中包括第一批HDAC抑制剂类药物可以改善癌细胞的辐射抗性并保护正常组织免受辐射损害的报告。Jung博士拥有堪萨斯大学劳伦斯分校微生物学和分子病毒学硕士学位和博士学位。
Tyvin A.Rich,M.D.担任我们公司的首席医疗官,负责新型辐射增敏剂的临床开发。自2010年以来,Rich博士一直在弗吉尼亚州汉普顿的汉普顿大学质子治疗研究所担任放射肿瘤学家,并在弗吉尼亚大学健康科学中心放射肿瘤学系担任荣誉退休教授。从1995年到2010年,Rich博士是弗吉尼亚大学健康科学中心治疗放射学和肿瘤学系的教授和主任。在此之前,从1984年到1995年,里奇博士是德克萨斯大学安德森癌症中心放射科的放射治疗和董事临床教授。他曾担任RTOG临床试验的方案主席,这些试验 促进了化疗和放射治疗直肠癌和胰腺癌的使用。他是输注5-氟尿嘧啶在胃肠癌化疗放射治疗中的应用方面的专家,撰写了200多篇科学文章、评论和书籍章节。Rich博士在罗格斯大学获得本科学位,在弗吉尼亚大学获得医学学位,并在乔治城大学医学中心完成内科住院医师培训,并在哈佛医学院马萨诸塞州综合医院完成放射治疗。
米尔顿·布朗,医学博士,博士,FNAI。Brown博士是我们公司的联合创始人,之前曾担任我们的化学首席科学官 ,自公司于2012年12月成立以来一直担任我们的董事会成员。自2022年8月以来,Brown 博士还担任东弗吉尼亚医学院研究部副院长、内科教授以及Prudence和Louis Ryan授予的翻译研究 主席。在此之前,他于2020年至2022年担任乔治梅森大学药物发现中心的董事 ,并于2016年至2020年担任伊诺瓦药物发现和开发中心的董事。布朗博士2004年是Rivanna制药公司的创始人之一,2020年是Trocar Pharma公司的联合创始人、董事长兼首席执行官,这两家公司都是总部位于弗吉尼亚州的生物制药公司,致力于发现和开发用于治疗神经、肿瘤和传染病的新型小分子疗法。2012年至2016年,布朗博士还担任乔治城大学医学院药物发现中心的董事研究员,2010年至2015年,担任美国国立卫生研究院/美国国立卫生研究院资助的化学多样性中心的首席研究员。布朗博士为Shuttle制药公司带来了25年的药物发现经验,发表了100多篇论文,获得了67项专利,其中包括发现新型HDAC抑制剂。布朗博士因在科学理论和/或应用研究方面的重大贡献而获得2015年全国黑人化学家和化学工程师组织颁发的珀西·朱利安奖。他曾在包括NIH实验治疗研究部门、NIH药物发现和分子药理研究部门在内的政府委员会任职,并曾担任美国卫生部长的科学顾问。布朗博士拥有阿拉巴马大学的合成化学博士学位和弗吉尼亚大学的医学博士学位。他是美国国家发明家学会(FNAI)的当选院士。他在药物发现方面的丰富经验和专业知识使他 成为唯一有资格作为我们董事会成员领导公司药物发现计划的人。
| 64 |
史蒂文·理查兹。Richards先生于2019年获委任为董事会成员。他是Endurance Media的首席执行官兼创始人,该公司是一家总部位于加利福尼亚州圣莫尼卡的媒体金融公司,于2014年与eOne Entertainment建立战略联盟,并授权制作和资助商业驱动的故事片。从2006年到2014年,Richards先生担任Silver Pictures的联席总裁兼首席运营官,监督所有业务活动,并管理一个由20多人组成的团队,负责 电影开发、制作和财务信息。2000年至2006年,他担任Silver Pictures首席财务官, 1995年至2000年,担任Silver Pictures财务副总裁。理查兹先生拥有加州大学洛杉矶分校金融MBA学位、坦普尔大学会计学BBA学位,并持有注册会计师执照。我们相信,他作为首席财务官的经验和他的会计知识 将有助于为我们的董事会提供指导和监督,因为我们的公司发展。
Joshua Schafer. Mr. Schafer was appointed to be a member of our Board of Directors in 2019. From January 2023 until present, Mr. Schafer has been serving as the Chief Commercial Officer, and EVP Business Development at Zevra Therapeutics, a rare disease company. From November 2022 until January 2023, Mr. Schafer was interim CEO and Chair of the board of directors at PHARNEXT, an entity he has served on the board of directors since July 2020. From December 2020 until November 2022, Mr. Schafer served as Senior Vice President and General Manager, Autoimmune and Rare Disease Business for Mallinckrodt Pharmaceuticals Incorporated. In addition, he served as Chief Strategy and Business Development Officer from September 2019 until December 2020, and from 2015 to September 2019 he was SCP of Business Development and General Manager of International Operations at Mallinckrodt Pharmaceuticals. From 2009 until 2015, he served as Vice President and Oncology Therapeutic Area Head at Astellas Pharmaceuticals Incorporated, where he was responsible for building the company’s global oncology franchise. From 2000 until 2009, Mr. Schafer served in positions of increasing seniority at Takeda Pharmaceuticals North America, including Manager and Senior Manager, New Product and New Business Development; Senior Product Manager, Gastrointestinal Marketing; and Director, Oncology and Renal Marketing and Commercial Development. He began working in the healthcare and pharmaceutical industry in 1998 and has served in various positions including management consulting at Accenture (formerly Anderson Consulting), G.D. Searle & Co. (later acquired by Pfizer) and Cognia Corporation. He received his Bachelor of Arts in Biology and German at the University of Notre Dame, his MS in Biotechnology from Northwestern University and his MBA from Northwestern University. We believe Mr. Schafer’s extensive experience in pharmaceutical strategy, marketing and business development will assist our Board of Directors’ oversight role as we build and develop our Company.
Chris H. Senanayake, Ph.D. Dr. Senanayake was appointed to be a member of the Company’s Board of Directors in 2021. In 2019, Dr. Senanayake founded TCG GreenChem, Inc., a U.S. subsidiary of TCG Lifesciences Pvt. Ltd., a leading global Contract Research and Manufacturing Services (CRAMS) company in the area of drug discovery, development and commercialization, where he serves as chief executive officer. Dr. Senanayake has more than 30 years of pharmaceutical industry experience, making him an invaluable asset to Shuttle Pharma’s mission as the Company advances its pharmaceutical candidates in clinical trials. He has held positions of Senior Scientist at Dow Chemical, and Research Fellow at Merck & Co, Inc. (from 1990 to 1996), Director and Executive Director of Process Research at Sepracor, Inc. (1996 to 2002), Director of Chemical Development and Vice President of Chemical Development for Boehringer Ingelheim Pharmaceuticals, Inc. In 2018, he was appointed as the CEO of Asta GreenChem, Inc in Richmond VA and Astatech (Chengdu) Biopharmaceuticals Corp. in China. He has a record of leading and delivering high complexity APIs for manufacturing. Dr. Senanayake participated in development activities of many drugs, including multi-billion-dollar blockbuster drugs, such as Crixivan, Lunesta, Jardiance, Formotorol, Desvenlafaxine and other drug candidates. He is co-author of 425 scientific publications and is co-inventor of more than 150 patents. Dr. Senanayake received his Ph.D. in synthetic organic chemistry at Wayne State University, where he developed the total synthesis of complex natural products and completed the first total synthesis of grosshemin in the guaianolide family. In his postdoctoral fellowship, he conducted total synthesis of polyol systems such as amphotericin B, compactin and C-nucleosides. We believe Dr. Senanayake’s detailed and in-depth experience as an executive and developer of pharmaceuticals will enable him to provide value to us by introducing potential joint venture partners, as well as enhancing our oversight through his in-depth understanding of and experience in the pharmaceuticals industry.
| 65 |
贝特·雅各布斯博士于2022年10月被任命为公司董事会成员。雅各布斯博士是一位经验丰富的研究员、管理人员和女商人,目前担任乔治城大学卫生系统管理系教授和奥尼尔国家和全球卫生法律研究所的杰出学者。雅各布斯博士拥有德克萨斯大学的博士学位,以她在系统设计方面的跨学科和跨部门的开创性工作而闻名。 作为切诺基民族的投票成员,她毕生参与公平项目,并在国会作证。除了在几个初创公司董事会任职外,雅各布斯博士还创建了由NIH国家普通医学研究所资助的全国少数民族护士协会联盟。在乔治敦大学担任现职之前,她曾担任乔治敦大学护理与健康研究学院院长、美国本田制造公司总裁副主任、UAB Civitan国际研究中心应用研究副主任以及加州州立大学研究生学习和研究代理院长。她一直是牛津大学的研究员和客座教授,也是全球几所著名大学的学术客座学者和讲师。 她在研究、管理和在董事会任职方面的丰富经验,加上她独特的背景和观点,使 她非常适合担任我们的董事会成员。
科学咨询委员会
西奥多·L·菲利普斯医学博士自2018年以来一直担任我们的科学咨询委员会主席。2014年至2018年,他在航天飞机制药公司担任首席医疗官和临床董事官。菲利普斯博士杰出的职业生涯包括: 曾任加州大学旧金山分校放射肿瘤学系主任(1978年至1998年)和董事副主任(1996年至1999年)。他在低氧放射增敏剂的放射肿瘤学临床试验方面经验丰富。菲利普斯博士曾担任罗比多尿苷I期临床试验SBIR合同的首席研究员。 他曾在1983年至1990年担任北加州肿瘤学小组董事副研究员,于1984年至1985年担任美国放射治疗肿瘤学家学会总裁,并当选为美国国家科学院医学研究所成员。菲利普斯博士拥有宾夕法尼亚州卡莱尔迪金森学院的理学士学位和宾夕法尼亚大学的医学博士学位。他为领导团队提供建议,帮助设计和实施放射治疗和辐射反应调整药物的临床试验。
自2013年以来,医学博士拉尔夫·R·魏克塞尔鲍姆一直担任Shuttle PharmPharmticals的科学顾问,负责该发现的翻译研究和辐射响应改进剂的开发。魏塞尔鲍姆博士是Daniel·路德维希教授,芝加哥大学放射和细胞肿瘤学系主任,自1985年以来一直担任该职位。他也是美国国家科学院医学研究所的当选成员。他的职业生涯致力于结合放射治疗和化疗的癌症转化研究。Weichselbaum博士和他的同事们构思了“基因放射治疗”,并开发了用于临床肿瘤放射增敏的病毒结构。这些产品被商业化,名称为TNFerade(GenVec,Inc.)并在前列腺癌的I期临床试验和胰腺癌的III期临床试验中进行了测试。
自2017年以来,马丁·布朗博士一直担任Shuttle制药公司的科学顾问,负责低氧辐射敏感剂开发的翻译研究。布朗博士于1968年在牛津大学获得癌症生物学博士学位,1984年至2004年在斯坦福大学放射和癌症生物学系担任董事 。他是癌症缺氧的放射生物学方面的专家,发表了300多篇同行评议的文章。他因其工作而获奖,包括美国治疗放射学和肿瘤学学会金奖(1999)、辐射研究学会费拉纪念奖(Br)(2000)、辐射研究协会Weiss奖章(2001)和国际辐射研究协会Henry S.Kaplan杰出科学家奖(2007)。他开发了乙硝唑,一种低氧辐射敏感剂,以及替拉帕明,一种低氧细胞毒性药物,从试验台到临床试验。
自2017年以来,亚历杭德罗·维拉格拉博士一直担任Shuttle制药公司的科学顾问,拥有细胞信号通路、表观遗传学和免疫学方面的专业知识。Villagra博士于2004年在智利康塞普西翁大学获得分子生物学博士学位,并于2009年在佛罗里达州坦帕市的H.Lee Moffitt癌症中心和研究所完成了分子免疫学的研究生培训 在马里兰州爱德华多·索托马约尔的实验室。他于2009年至2015年加入莫菲特癌症中心和研究所,担任研究科学家,并晋升为肿瘤学助理教授。2015年,他成为乔治华盛顿大学(GWU)医学和健康科学学院生物化学和分子医学系的助理教授 ,成为乔治华盛顿大学癌症中心的成员。他的研究重点是组蛋白脱乙酰酶(HDACs)在肿瘤免疫学中的分子和细胞作用,以及作为癌症免疫治疗的佐剂。
| 66 |
约瑟夫·阿姆斯特朗,三岁,博士,2021年加入Shuttle制药公司担任科学顾问,1988年获得科罗拉多大学博士学位,在弗吉尼亚大学夏洛茨维尔分校完成博士后工作,目前担任TCG Green,Inc.首席运营官兼全球业务发展主管。他提供化学、药物开发和工艺研究方面的行业经验,之前曾在拉赫韦的默克公司任职,在新泽西州和英国,在药物研发领域的两家制药 公司。他的主要工作领域一直是设计和实施适合大规模生产的候选药物的高效合成。阿姆斯特朗博士领导的开发团队设计、开发和实施了治疗II型糖尿病的新疗法Januvia TM的制造工艺。他的团队在2004年荣获索维亚斯奖(瑞士巴塞尔),2005年荣获IChemE Aztra-Zeneca绿色化学与工程奖(英国伦敦)。阿姆斯特朗博士发表了40多篇论文,并拥有10项专利。
家庭关系
Anatoly Dritschilo博士和Peter Dritschilo博士是父子。我们的董事和高管之间没有其他家庭关系。
参与某些法律程序
在过去的十年中,除了我们的总裁于2014年根据美国破产法第7章申请个人破产外,董事公司没有任何高管、高管、发起人或控制人参与 :
| (1) | 根据联邦破产法或任何州破产法,由或针对接管人、财务代理人或类似官员提起的 请愿书,是由法院为该人的业务或财产、或在提交申请时或之前两年内他是普通合伙人的任何合伙企业、或在提交申请前两年或之前两年内他是其高管的任何公司或商业协会的业务或财产而指定的; | |
| (2) | 这样 某人在刑事诉讼中被定罪,或者是未决刑事诉讼的指定对象(不包括交通违法行为 其他轻微罪行); | |
| (3) | 这样 该人是任何主管法院的任何命令、判决或法令的主体,但随后未被撤销、暂停或撤销 永久或暂时禁止或以其他方式限制下列活动: |
| i. | 代理 作为期货佣金商、介绍经纪人、商品交易顾问、商品池运营商、场内经纪人、杠杆 交易商、受商品期货交易委员会监管的任何其他人员,或任何 或作为投资顾问、承销商、经纪商或证券交易商,或作为关联人员、董事或雇员 任何投资公司、银行、储蓄和贷款协会或保险公司,或从事或继续任何行为或做法 与这类活动有关; | |
| 二、 | 参与 在任何类型的商业实践中;或 | |
| 三、 | 参与 在与购买或出售任何证券或商品有关的任何活动中,或与任何违反联邦法律有关的任何活动 州证券法或联邦商品法; |
| 67 |
| (4) | 这样 该人是任何联邦或州的任何命令、判决或法令的主体,但随后未被撤销、暂停或撤销 禁止、暂停或以其他方式限制该人员从事所述任何活动的权利超过60天的权力 或与从事任何该等活动的人有联系; | |
| (5) | 这样 在民事诉讼中,具有管辖权的法院或委员会认定某人违反了任何联邦或州 证券法,且该民事诉讼或证监会的裁决随后未被推翻、中止, 或空置; | |
| (6) | 这样 某个人在民事诉讼中被具有管辖权的法院或商品期货交易委员会认定违反了 任何联邦商品法,且此类民事诉讼或商品期货交易委员会的裁决没有 随后被撤销、暂停或空置; | |
| (7) | 这样 该人是任何联邦或州司法或行政命令、判决、法令或裁决的主体或当事人,而不是 随后撤销、暂停或撤销,涉及据称违反: |
| i. | 任何 联邦或州证券或商品法律或法规;或 | |
| 二、 | 任何 有关金融机构或保险公司的法律或法规,包括但不限于临时或永久 强制令、没收令或归还令、民事罚款或临时或永久停止令,或驱逐 或禁止令;或 | |
| 三、 | 任何 禁止邮件或电报欺诈或与任何商业实体有关的欺诈的法律或法规;或 |
| (8) | 这样 该人是任何自我监管的制裁或命令的主体或当事人,但随后未被撤销、暂停或撤销 组织(定义见《交易法》第3(a)(26)节(15 U.S.C. 78 c(a)(26),任何注册实体(定义见第 节 《商品交易法》第1(a)(29)条(7 U.S.C. 1(a)(29),或任何等同的交易所、协会、实体或组织, 对其成员或与成员有联系的人具有纪律处分权。 |
董事会
我们的董事会负责按照其对股东的受托责任监督公司的业务。 这一重大责任需要具有各种素质、属性和专业经验的高技能人员。 对董事会成员的任职有适用于董事的一般要求,还有其他技能和经验 应在整个董事会中代表,但不一定由每个董事代表。我们的公司治理和提名委员会将在董事会整体组成以及公司当前和未来需求的更广泛背景下,单独和更广泛地考虑董事候选人的资格,详情如下。
任期
我们所有的董事都被选举出来,任期一年,直到我们的股东下一次年度会议,直到任命继任者并获得资格,或者直到他们被免职、辞职或去世。高级管理人员可以按照董事会的意愿行事。
董事 独立
为了获得在纳斯达克继续上市的资格,我们的董事会必须由纳斯达克上市标准和交易所法案第10A-3(B)(1)条所界定的多数“独立”董事组成。目前,在我们董事会任职的六名董事中,有四名符合“独立”的资格。我们的独立董事包括理查兹先生和谢弗先生、塞纳亚克博士和雅各布斯博士。
| 68 |
董事会 委员会
一般信息
我们的董事会已经成立了三个委员会,由审计委员会、薪酬委员会和提名和公司治理委员会组成。根据纳斯达克上市准则 和规则10A-3(B)(1)的定义,每个委员会的成员均符合“独立”的定义。此外,审计委员会至少有一名成员根据各自在财务和会计领域的专业经验,在纳斯达克上市准则和美国证券交易委员会适用的规则和法规中定义了“审计委员会财务专家”的资格。
审计委员会
由Steve Richards、MBA、CPA(主席)、Bette Jacobs和Chris H.Senanayake组成的审计委员会协助我们的董事会监督公司的会计和财务报告流程,并审计公司的财务报表,包括(A)公司财务报表的质量和完整性,(B)公司遵守法律和法规要求,(C)独立审计师的资格和独立性,以及(D)公司内部审计职能和独立审计师的表现。以及董事会指示可能提交其审议的其他事项。此外,审计委员会在其认为必要或适当的范围内,在其几项其他职责中,将:
| ● | 负责为公司编制或发布审计报告或执行其他审计、审查或认证服务而聘用的任何独立审计师的任命、薪酬、保留、终止和监督工作 ; | |
| ● | 在向美国证券交易委员会提交年度报告(Form 10-K)和季度报告(Form 10-Q)之前,与管理层和独立审计师讨论经审计的年度财务报表和未经审计的季度财务报表 ; | |
| ● | 与公司管理层定期审查(I)有关会计原则和财务报表列报的问题,包括公司在选择或应用会计原则方面的任何重大变化;以及(Ii)任何监管和会计举措以及资产负债表外结构对公司财务报表的影响; | |
| ● | 监督公司遵守联邦、州、地方和外国法律法规的政策以及公司关于公司行为的政策 ; | |
| ● | 在董事会、审计委员会和我们的独立审计师之间保持公开、持续和直接的沟通;以及 | |
| ● | 监督 我们对法律和法规要求的遵守情况,并将有权启动对利益冲突的任何特别调查,以及对联邦、州和当地法律法规(包括《反海外腐败法》)的遵守情况 。 |
薪酬委员会
由Steve Richards(主席)和Joshua Schafer组成的薪酬委员会帮助我们的董事会履行其与公司高管薪酬有关的职责,并管理公司的所有激励性薪酬计划和基于股权的计划,包括董事、高管、员工和顾问可以收购公司证券的计划。此外,薪酬委员会在其认为必要或适当的范围内,在其几项其他职责中,将:
| ● | 定期审查我们公司关于高管薪酬的理念,以(I)确保吸引和留住公司高管;(Ii)确保公司高管实现公司业务目标的动力;以及(Iii)使关键管理层的利益与公司股东的长期利益保持一致; |
| 69 |
| ● | 审查并批准与Shuttle首席执行官薪酬和其他高管相关的公司目标和目标; | |
| ● | 就非雇员董事的薪酬向董事会提出建议,并根据薪酬委员会认为适当的因素,定期审查非雇员 董事相对于其他可比公司的薪酬;以及 | |
| ● | 定期审查 管理层关于为公司的养老金、退休、长期残疾和其他管理层福利计划提供资金的报告 。 |
提名 和公司治理委员会
由Joshua Schafer(主席)、Steve Richards和Bette Jacobs组成的提名和公司治理委员会向董事会和董事会委员会推荐有资格担任董事的个人,就董事会的组成、程序和委员会向董事会提供建议,以制定并向董事会推荐一套适用于公司的公司治理原则,并监督董事会和Shuttle管理层的评估。此外,提名和公司治理委员会在评估董事会成员候选人时,将考虑背景的多样性,包括种族、民族、国际背景、性别和年龄的多样性。
此外,提名和公司治理委员会在其认为必要或适当的范围内,其其他几项职责 将:
| ● | 根据我们的章程并与董事董事会关于 遴选新董事的证据一致,向董事会推荐 并经多数独立董事批准,由股东选举或 董事会任命(视情况而定); | |
| ● | 审查每位董事会成员任期届满或地位发生重大变化时继续担任董事的适宜性; | |
| ● | 每年审查董事会的组成,并定期审查董事会的规模; | |
| ● | 就董事会会议的频率和结构或董事会程序的任何其他方面提出建议; | |
| ● | 就常设委员会的主席和组成提出建议,并监督其职能; | |
| ● | 每年审查委员会的分配和主席职位; | |
| ● | 建议在必要或适宜的情况下不时设立特别委员会;以及 | |
| ● | 制定并定期审查公司治理程序,并考虑任何其他公司治理问题。 |
道德准则
我们 已采纳适用于我们所有执行官、董事和员工的道德准则。道德准则编纂了 管理我们业务各个方面的业务和道德原则。本文件将免费提供印刷版, 给任何股东,如果他们在马里兰州盖瑟斯堡的执行办公室向我们的秘书索取书面副本。我们的 道德准则的副本可在我们的网站上找到, www.shuttlepharma.com.
| 70 |
内幕交易政策和程序
The Company has adopted an insider trading policy, as amended and restated on March 10, 2023 (the “Insider Trading Policy”), overseen by the Company’s corporate secretary, that applies to all (i) directors, (ii) executive officers and (iii) employees who are exposed to insider information (together, the “Covered Persons”). The Insider Trading Policy prohibits the use of material non-public information obtained by Covered Persons through their involvement with the Company when making decisions to purchase, sell, give away or otherwise trade in the Company’s securities or to provide such information to others outside the organization. Under the Insider Trading Policy, material non-public information includes, among other things, significant changes in the Company’s prospects, significant write-downs, liquidity problems, changes in management, extraordinary borrowings, changes in debt, planned public offerings or any other information that may be deemed material to the Company or the Company’s prospects. Further, we have established black-out periods to which all Covered Persons are subject, including quarterly black-out periods, which commence three weeks before the end of each quarter and continue until the quarterly results are disclosed by filing the Company’s Quarterly Report on Form 10-Q or Annual Report on Form 10-K. The Company may impose black-out periods from time to time as other types of material non-public information occur when material non-public events or disclosures are pending. If the Company imposes a special black-out period, the Company will notify Covered Persons accordingly. Covered Persons are permitted to trade in the Company’s securities only when there is no black-out period in effect and such trade has been pre-cleared by the Company’s corporate secretary, or when a qualified 10b5-1 plan has been established in accordance with federal securities laws.
退还政策
虽然 公司目前没有与公司 整体财务业绩相关的任何重大激励补偿协议或奖励,但公司董事会已采取了追回政策,以遵守联邦证券 法律。因此,我们采取了一项追回政策,即如果我们在某些情况下重列财务报表,我们可能会寻求收回或没收我们支付的激励补偿, 包括现金、股权或股权补偿。 返还政策适用于我们的第16条官员、有资格获得奖励补偿且其行为 导致需要重述的任何员工,以及任何其他导致需要 此类重述的前第16条官员或其他员工。
董事会 在风险监督中的作用
董事会成员 定期与管理层和公司的独立审计师开会,对公司的内部控制程序进行风险监督 。本公司认为,董事会在风险中的角色 监督不会对本公司的领导结构产生重大影响。本公司相信,其创始人、领导团队和董事会成员在种族、性别和民族血统方面体现了多样性和包容性。董事会 目前有两名不同的董事,正在审查一名女性董事候选人。因此,该公司预计在上市第一年结束时完全符合纳斯达克新采用的多样性要求 。
第 第16(A)节受益所有权报告合规性
《交易法》第 第16(a)节要求我们的执行官和董事,以及拥有我们普通股10%以上的人,向SEC提交 有关我们证券所有权和交易的报告,并向我们提供这些报告的副本。 仅根据我们对提供给我们的此类表格副本的审查以及我们的高级管理人员和董事关于 遵守《交易法》第16(a)条适用报告要求的书面陈述,我们认为,在截至2023年12月31日的年度内,我们的行政人员、董事和10%股东的所有申报要求均得到满足, 以下除外:
犯罪 第16(a)条报告:
| 名字 | 迟到的报告 | 涵盖的交易 * | 股份数量 | |||||
| 米尔顿·布朗,医学博士,博士 | 表格4 | 普通股 | 2,921 | |||||
| 表格4 | 普通股 | 995 | ||||||
| 贝特·雅各布斯博士 | 表格4 | 普通股 | 4,157 | |||||
| Anatoly Dritschilo,医学博士 | 表格4 | 普通股 | 2,100,000 | |||||
| 史蒂文·理查兹 | 表格4 | 普通股 | 995 | |||||
| 71 |
第 项11.高管薪酬
汇总表 薪酬表
下表汇总了2023年和2022年授予、赚取或支付给我们的首席执行官和首席财务官以及 我们的某些其他执行官的所有薪酬。
汇总表 薪酬表
| 姓名 和主要职务 | 年 | 工资 (美元) | 奖金
($) | 股票
奖励 ($) | 选项
奖励 ($) | 非股权 激励计划薪酬(美元) | 不合格
递延薪酬收入 ($) | 所有
其他薪酬 ($) | 合计
($) | |||||||||||||||||||||||||||
| 阿纳托利 Dritschilo医学博士,CEO | 2023 | 287,175 | 112,000 | - | - | - | - | - | 399,175 | |||||||||||||||||||||||||||
| 2022 | 97,253 | - | 171,668 | - | - | - | - | 268,921 | ||||||||||||||||||||||||||||
| Michael Vander Hoek,首席财务官,副总裁 | 2023 | 230,530 | 72,000 | - | - | - | - | 302,530 | ||||||||||||||||||||||||||||
| 2022 | 82,792 | - | 46,000 | - | - | - | - | 128,792 | ||||||||||||||||||||||||||||
| 彼得 Dritschilo,总裁兼首席运营官 | 2023 | 242,012 | 72,000 | - | - | - | - | 314,012 | ||||||||||||||||||||||||||||
| 2022 | 100,308 | - | 78,333 | - | - | - | - | 178,641 | ||||||||||||||||||||||||||||
| Tyvin Rich,首席医疗官 | 2023 | 220,226 | 43,000 | - | - | - | - | - | 263,226 | |||||||||||||||||||||||||||
| 2022 | 67,077 | - | 29,000 | - | - | - | - | 96,077 | ||||||||||||||||||||||||||||
雇佣协议
我们的每一位高管都与我们签订了雇佣协议。每位员工将获得每年 现金补偿,从首次公开募股完成时开始按月分期付款,以及受限股票单位,但须 达到某些关键业绩指标。我们的某些高管有权在实现某些里程碑 时获得各种目标奖金。雇佣协议的条款如下:
| 72 |
与马里兰州Anatoly Dritschilo签订雇佣协议
2019年6月28日,我们与我们的首席执行官兼董事会主席Anatoly Dritschilo医学博士签订了雇佣协议。根据Dritschilo博士的雇佣协议,Dritschilo博士将获得每年27.4万美元的基本薪酬。 Dritschilo博士还获得了根据公司2018年股权激励计划发行的45,495股限制性股票单位(RSU)(按反向拆分后发行的22,747股)的初始限制性股票单位授予。其中RSU在三年内在协议每一年周年时以基本上相等的三分之一分期付款。根据他的雇佣协议,如果Dritschilo博士按照协议的定义以“充分的理由”终止雇用,Dritschilo博士将有权获得当时适用的基本工资,为期12个月,条件是他继续遵守其雇佣协议的某些要求。Dritschilo博士 在公司于2022年9月完成首次公开募股之前接受了减薪。
与Michael Vander Hoek签订雇佣协议
2019年9月1日,我们与首席财务官兼负责运营和监管的副总裁 Michael Vander Hoek签订了修订后的雇佣协议。根据Vander Hoek先生的雇佣协议,他将获得227,000美元的基本补偿,并有权在实现某些里程碑时获得72,000美元的目标奖金。Vander Hoek先生还收到了根据公司2018年股权激励计划可发行的6,096 RSU(反向拆分后)的初始限制性股票单位,RSU 在协议的每一年周年时以基本相等的分期付款方式在三年内授予。根据Vander Hoek先生的雇佣协议,如果他按照协议的定义以“充分的理由”终止雇佣关系,他将有权获得当时适用的为期12个月的基本工资,但前提是他必须继续遵守雇佣协议的某些要求。在公司于2022年9月完成首次公开募股之前,Vander Hoek先生接受了减薪。
雇佣 与Peter Dritschilo的协议
2019年5月30日,我们与总裁兼首席运营官Peter Dritschilo签订了雇佣协议。根据Dritschilo先生的 雇佣协议,Dritschilo先生将获得236,000美元的基本薪酬,并有权在实现 某些里程碑后获得72,000美元的目标奖金。Dritschilo先生还收到了根据公司2018年股权激励计划发行的20,760个受限制股票单位(10,380个按反向拆分后基准计算)的初始限制性股票单位授予,这些受限制股票单位在协议每一年周年时以大致相等的分期方式分配 。根据Dritschilo先生的雇佣协议,如果Dritschilo先生因协议中定义的“良好理由”终止其雇佣关系,则他将有权获得12个月的适用基本工资, 条件是他继续遵守雇佣协议的某些要求。Dritschilo先生在公司于2022年9月完成首次公开募股之前接受了减薪。
雇佣 与Tyvin Rich,M.D.的协议
2019年5月31日,我们与我们的首席临床医生Tyvin Rich医学博士签订了雇佣协议。根据Rich博士的雇佣协议,Rich博士每年获得218,000美元的基本薪酬,并有权在实现 某些里程碑的情况下获得43,000美元的目标奖金。Rich博士还收到了根据公司2018年股权激励计划可发行的3,843股限制性股票单位(按反向拆分后)的初始授予 ,RSU在协议的每一年 周年时分三年基本上等额地分批授予。根据Rich博士的雇佣协议,如果Rich博士按照协议中的定义,以“良好的 理由”终止雇佣,他有权获得12个月的当时适用的基本工资,但他必须继续遵守其雇佣协议的某些条款。在公司于2022年9月完成首次公开募股之前,里奇博士接受了减薪。
就业 与Mira Jung博士签订的协议。
2023年5月1日,我们与Mira Jung博士签订了雇佣协议,我们的首席科学官,取代2019年5月30日的雇佣协议。根据Jung博士目前的协议,Jung博士每年获得46,000美元(20%)的基本工资,并有权 获得15,620美元的目标奖金。她还获得了价值20,200美元的限制性股票单位的额外赠款,自授予限制性股票单位的第一周年日起,每年以 三分之一的增量授予。根据Jung博士先前的协议,Jung博士获得了46,800美元的基本报酬,并有权在实现某些里程碑时获得14,200美元的目标奖金。 Jung博士还获得了根据公司 2018年股权激励计划发行的892个受限制股票单位(按反向后拆分基准)的初始限制性股票单位授予,这些受限制股票单位在协议每满一年的周年纪念日以大致相等的方式在三年内归属。根据Jung博士的雇佣协议,如果Jung博士因协议中定义的"良好理由"终止其雇佣,Jung博士随后有权获得其当时适用的12个月基本工资,但须继续遵守 其雇佣协议的某些要求。郑博士在公司于2022年9月完成首次公开募股之前接受了减薪。
| 73 |
未偿还的 财政年末的股权奖励
截至2023年12月31日,根据2018年股权激励计划(“该计划”),合共259,326个受限制单位已授予我们的行政人员及董事 ,99,273个受限制单位于2022年12月31日尚未行使,160,744个受限制单位已归属,其中197,855个仍有待归属。公司已在表格S—8(SEC文件号333—268758)上提交了登记声明,以登记 根据该计划授予的股份。
下表载列了截至2023年12月31日,我们每名执行官的未行使股权激励奖励相关普通股股份数量的信息:
| 期权大奖 | 股票大奖 | |||||||||||||||||||||||||||
| 名字 | 授予日期 | 未行使的证券数量 可取消的选项(#) | 未行使的证券数量 不可行使的期权(#) | 期权行权价(美元) | 期权到期日期 | 尚未归属的股份或单位数量 (#)) | 尚未归属的股份或单位的市值 (美元) | |||||||||||||||||||||
| 贝特·雅各布斯 | 10/28/2022 | - | - | - | - | 11,863 | (1 | ) | $ | 5,457 | ||||||||||||||||||
| 米尔顿·布朗 | 02/15/2023 | 16,667 | (1 | ) | $ | 7,667 | ||||||||||||||||||||||
| (1) | 这些 限制性股票单位在授予日的周年纪念日分两次授予。 |
2018年股权激励计划
我们的 2018股权激励计划为我们的员工、高管或董事以及关键的 顾问和顾问提供股权激励。股权激励可以是股票期权的形式,其行使价格不低于根据2018年股权激励计划、限制性股票奖励、其他基于股票的 奖励或上述任何组合确定的标的股票的公平市场价值。2018年股权激励计划由公司薪酬委员会 管理,如果没有薪酬委员会,则由公司董事会管理。我们已预留3,000,000股我们的普通股,以根据该计划发行,其中截至本年度报告日期,已根据该计划授予678,180股。
董事 薪酬
根据董事与本公司订立的“董事”协议(“董事”)的条款,每位非雇员董事 于首次公开招股完成后90天起按年收取25,000美元现金酬金,按季分期付款 ,并于各自当选之日收取100,000美元限制性股票单位(“RSU”) 。RSU在两年内以三分之一的增量进行归属,三分之一在签署时立即归属 ,三分之一在选举一周年和两周年时归属。此外,非员工董事还将获得与出席会议相关的自付费用的报销。
| 74 |
项目 12.某些实益所有人和管理层的担保所有权及相关股东事项
主要股东
下表列出了截至本年度报告发布之日每个董事和高管、我们所知的实益拥有我们普通股5%或以上的每个人以及董事和高管作为一个整体对我们普通股的实益所有权。 除非另有说明,否则表中所列人员的地址为c/o Shuttle PharmPharmticals Holdings,Inc.,401 Professional Drive,Suite260,Gaithersburg,MD 20879。
受益 所有权根据美国证券交易委员会规则确定,通常包括对证券的投票权或投资权。除非 另有说明,下表所列股东对所列股份拥有唯一投票权和投资权。
所有 股票所有权数字包括可通过可转换或可交换为我们普通股的证券发行的普通股,无论是否可在本年度报告生效日期起60天内转换或交换。该等股份被视为已发行及由该人士实益拥有,只是为了计算其拥有的百分比,而不是为了计算任何其他人士的拥有百分比。
截至2024年3月20日,已发行和已发行普通股共16,794,893股。
| 姓名和地址 | 第 个 的股份 通用 股票 有益的 拥有 (#) | 百分比 的股份 通用 股票 有益的 拥有 (%) | ||||||
| 董事及获提名的行政人员: | ||||||||
| Anatoly Dritschilo,医学博士(1) | 4,309,607 | 25.8 | % | |||||
| 米尔顿·布朗,医学博士,博士(2) | 1,094,610 | 6.6 | % | |||||
| Mira Jung,博士。 | 1,071,388 | 6.4 | % | |||||
| 迈克尔·范德·胡克 | 103,852 | - | ||||||
| 彼得·德里奇洛 | 6,560 | - | ||||||
| 蒂文·A·里奇,医学博士 | 2,429 | - | ||||||
| 史蒂夫·理查兹 | 1,707 | - | ||||||
| 乔舒亚·谢弗 | 1,707 | - | ||||||
| 克里斯·H·塞纳亚克 | 2,791 | - | ||||||
| 贝特·雅各布斯(3) | 15,201 | - | ||||||
| 全体董事和高级管理人员(10人) | 6,609,852 | 39.6 | % | |||||
| 其他5%实益拥有人: | ||||||||
| 没有。 | ||||||||
| - | 表示持有者持有的已发行普通股不到1%。 |
| ± | 上述 人对所示股份拥有完全投票权和投资权。根据美国证券交易委员会的规则,如果一个人(或一组人)直接或间接拥有或 分享对该证券的投票权或指示投票权,或者有权处置或指示处置该证券,则该人(或一组人)被视为该证券的“实益所有人”。因此,多于一人可被视为同一担保的实益所有人。 |
| (1) | 包含 (i)Anatoly Dritschilo博士持有的1,085,200股普通股,(ii)1,104,407股普通股和认股权证 购买20,000股普通股,每股由Joy Dritschilo(其配偶)持有,以及(iii)2,100,000股由 持有的股份 PAL信托,为Dritschilo夫妇的成年子女的利益而成立的信托,由第三方担任 外部受托人及其两名子女担任共同受托人。Dritschilo博士放弃所有证券的实益所有权 由Dritschilo夫人和PAL信托公司持有 |
| (2) | 包括(i)1,094,610股普通股,包括25,000股普通股,分三期归属,16,667股尚未归属。 |
| (3) | 不包括11,862个仍受归属限制的受限制股票单位。 |
更改控制的
公司不知悉任何可能在日后导致公司控制权变更的安排。
| 75 |
根据股权补偿计划授权发行的证券
2018年股权激励计划
我们的 2018年股权激励计划(以下简称"计划")规定,将向员工、执行官 或董事以及主要顾问和顾问授予股权激励。股权激励的形式可以是行使价不 不低于根据本计划确定的相关股份的公平市场价值的股票期权、限制性股票奖励、其他股票奖励 奖励或上述各项的任何组合。本计划由公司的薪酬委员会管理, 如果没有薪酬委员会,则由公司的董事会管理。我们保留了3,000,000股普通股 以供根据本计划发行,截至本年报日期,其中678,180股已根据本计划授出,其中197,855股仍有待归属。
下表提供了截至2023年12月31日有关我们股权薪酬计划和安排的信息。
| 计划类别 | 在行使未偿还期权、认股权证和权利时发行的证券数量 | 加权—未行使期权的平均行使价, 认股权证和权利 | 剩余可供将来使用的证券数量 根据股权补偿计划发行 | |||||||||
| 证券持有人批准的股权补偿计划 | 197,855 | $ | 1.47 | 2,321,820 | ||||||||
| 未经证券持有人批准的股权补偿计划 | – | – | – | |||||||||
| 总计 | 197,855 | * | $ | 2,321,820 | ||||||||
* 未偿还的 股权激励授予全部由限制性股票单位组成,这些单位随时间自动归属为相等数量的普通股股票 ,持有人无需额外费用。
您可以在我们的合并财务报表附注7中找到有关我们的股权薪酬计划的更多信息。
第 项13.某些关系和关联交易,以及董事独立性
相关的 方交易
除非 以下所述,在过去两个会计年度内,我们没有参与或将参与任何交易或一系列类似的交易,其中:
| ● | 涉及的金额超过或将超过12万美元;以及 |
| ● | 本公司任何 董事、高管或超过5%股本的持有人,或上述任何 的任何直系亲属曾经或将会拥有直接或间接的重大利益。 |
2020年12月1日,本公司将2018年从我们的首席执行官妻子Joy Dritschilo获得的两笔贷款(贷款自成立之日起按7.5%计息)合并为Dritschilo夫人和 本公司之间的一笔贷款(“二零一八年综合贷款”),以使二零一八年综合贷款的本金余额为424,005. 65美元(连同应计利息),按年利率7. 5%计息,到期日为二零二一年十二月三十一日。根据日期为2022年1月24日的2018年合并贷款协议的修订,2018年合并贷款随后被 延长至2022年6月30日。2022年7月29日,公司和Dritschilo女士签署了2018年合并贷款的修订案,根据该修订案,还款期限延长至2023年6月30日。于2023年1月15日,在完成向Ayrton Capital的可换股票据及认股权证发售后,2018年合并贷款已悉数清偿。
| 76 |
于2020年12月1日,本公司与本公司行政总裁合并2018年5月及2019年9月的贷款(“2019年综合贷款”),连同应计利息,2019年综合贷款的本金余额为138,448.20美元,按7.5%的年利率计息,到期日为2021年12月31日。根据日期为2022年1月24日的2019年综合贷款协议修正案,2019年综合贷款延期至2022年6月30日。2022年7月29日,本公司与我们的首席执行官对2019年综合贷款进行了修订,根据该修订,还款期限延长至2023年6月30日。
于2021年6月21日,本公司与Dritschilo夫人订立了一项金额为120,000美元(本金)的贷款协议,按年利率7.5%计息,于2022年6月21日到期一次性偿还(“2021年6月贷款协议”)。 于2022年7月29日,本公司与Dritschilo女士订立修订2021年6月贷款协议,据此还款 延期至2023年6月30日。
2022年8月1日,我们私募了125,000美元的单位,其中包括购买普通股的10%票据和认股权证,这些单位总共出售给了三名认可投资者,Dritschilo女士购买了50,000美元的票据,并获得了认股权证,以每股2.5美元的价格购买了20,000股普通股。票据和认股权证是根据证券法D条例第506(B)条的豁免登记而出售的。
2022年9月14日,我们与TCG GreenChem,Inc.签订了生产协议。(“TCG GreenChem”),TCG Lifesciences Pvt Ltd.的美国子公司 ,一家位于印度的全球合同研究和制造服务公司。Chis Senanayake博士,我们的独立董事之一,是TCG GreenChem的首席执行官兼CSO和TCG Lifesciences Pvt Ltd.的CSO。TCG GreenChem与TCG GreenChem签订了工艺 研究、开发和符合cGMP要求的IPdR生产合同,截至2022年12月31日止年度,公司向TCG GreenChem支付了450,000美元,共计1,096美元,截至2023年12月31日止年度,370人完成合同。
审查、批准和批准关联方交易
所有 关联方交易均需经过我们的董事会或其相应委员会的审查、批准或批准 。
第 项14.总会计师费用和服务
下表为FORVIS LLP提供的截至2023年12月31日的财政年度公司年度财务报表和BF Borgers CPA PC提供的截至2022年12月31日的财政年度公司年度财务报表的专业审计服务费用。
| 截至12月31日的财年, | ||||||||
| 2023 | 2022 | |||||||
| 审计费1 | $ | 429,555 | $ | 56,500 | ||||
| 其他审计费用2 | $ | 27,500 | ||||||
| 税费3 | $ | 11,700 | $ | 4,588 | ||||
| 总费用 | $ | 441,255 | $ | 88,588 | ||||
| 1. | 审计费用 包括首席会计师为审计公司年度财务报表和审核公司首次公开募股(Form 10-K)和Form 10-Q 中包含的财务报表而提供的专业服务费用,以及会计师通常提供的与法定和监管申报或业务有关的服务费用。审计费用 包括与可转换票据和认股权证相关的范围外成本。 |
| 2. | 其他审计费用包括来自之前审计公司的过渡成本。 |
| 3. | 税 手续费。包括由我们的首席会计师提供的税务合规、税务咨询和税务规划方面的专业服务。 |
审计 委员会的审批前政策
审计委员会的任务是预先批准由独立审计师向本公司提供的任何非审计服务。
| 77 |
第四部分
第 项15.展示和财务报表明细表
| 附件 编号: | 描述 | |
| 3.1 | 修订和重订的公司注册证书(通过参考2022年6月3日提交的S-1表格登记声明(文件编号333-265429)附件3.1并入)。 | |
| 3.2 | 2022年3月30日生效的修订和重新注册证书(通过参考2022年6月3日提交的S-1表格登记声明(文件编号333-265429)附件3.2并入)。 | |
| 3.3 | 修订和重新发布的A系列可转换优先股指定证书,于2022年4月6日生效(通过参考2022年6月3日提交的S-1表格登记声明(文件编号333-265429)附件3.4并入)。 | |
| 3.4 | 2022年6月22日生效的修订和重新注册证书(通过参考2022年6月23日提交的S-1/A表格登记声明(文件编号333-265429)附件3.5并入)。 | |
| 3.5 | 第二次修订和重新修订附例(通过参考2022年11月1日提交的表格8-K的当前报告的附件3.1并入)。 | |
| 4.1 | 可转换票据的格式,日期为2022年2月(通过参考2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件4.1并入)。 | |
| 4.2 | 10%本票格式,日期为2022年8月(通过参考2022年8月18日提交的S-1/A表格登记声明(文件编号333-265429)附件4.2并入)。 | |
| 4.3 | 认股权证表格,日期为2022年8月(参考于2022年8月18日提交的S-1/A表格登记声明(文件编号333-265429)附件4.3)。 | |
| 4.4 | 公开发售认股权证表格(参考于2022年8月18日提交的S-1/A表格注册说明书附件4.4(文件编号333-265429)合并)。 | |
| 4.5 | 可发行给Boustead Securities LLC的承销权证表格(通过参考2022年8月18日提交的注册声明S-1/A表格(文件编号333-265429)附件4.5并入)。 | |
| 10.1 | A系列可转换优先股认购协议表格(于2022年6月3日提交的S-1表格注册说明书(文件编号333-265429)附件10.1)。 | |
| 10.2 | 2018年股权激励计划(参考2022年6月3日提交的S-1表格登记说明书(文件编号333-265429)附件10.2并入)。 | |
| 10.3 | 2014年7月30日,Shuttle PharmPharmticals Holdings,Inc.与Tyvin Rich之间的雇佣协议(通过参考2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.4而并入)。 | |
| 10.4 | 航天飞机制药有限责任公司与国立卫生研究院国家癌症研究所签订的编号HHSN261201400013C,日期为2014年9月19日的合同(通过引用2022年6月3日提交的S-1表格登记声明(文件编号333-265429)的附件10.5并入)。 | |
| 10.5 | 航天飞机有限责任公司与国家卫生研究院国家癌症研究所(放射增敏剂选项第二阶段)于2015年8月3日签订的SBIR合同#HHSN261201400013C招标/修改合同修正案(通过引用2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.6并入)。 | |
| 10.6 | 航天飞机制药有限责任公司与国立卫生研究院国家癌症研究所签订的编号HHSN261201600027C,日期为2016年9月19日的合同(通过引用附件10.7并入2022年6月3日提交的S-1表格注册说明书(文件编号333-265429)中)。 | |
| 10.7 | 2016年9月19日,Shuttle PharmPharmticals,LLC之间的SBIR合同编号HHSN261600038C。和国家卫生研究所和国家癌症研究所(通过参考2022年6月3日提交的S-1表格登记声明(文件编号333-265429)附件10.8注册成立)。 | |
| 10.8 | 航天飞机制药公司与乔治·华盛顿大学于2017年4月25日签订的《材料转让协议》(参考2022年6月3日提交的《S-1表格登记声明》(第333-265429号文件)附件10.9)。 | |
| 10.9 | 2019年5月30日,Shuttle PharmPharmticals Holdings,Inc.与Peter Dritschilo之间的雇佣协议(通过参考2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.10而并入)。 | |
| 10.10 | 2019年5月30日,Shuttle PharmPharmticals Holdings,Inc.与Mira Jung之间的雇佣协议(通过参考2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.11而并入)。 | |
| 10.11 | 2019年6月28日,Shuttle PharmPharmticals Holdings,Inc.和Anatoly Dritschilo之间的雇佣协议(通过参考2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.12而并入)。 |
| 78 |
| 10.12 | 2019年9月1日修订和重新签署的Shuttle PharmPharmticals Holdings,Inc.和Michael Vander Hoek之间的雇佣协议(通过参考2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.13而并入)。 | |
| 10.13 | 与董事的书面协议格式(参考2022年6月3日提交的S-1注册声明(文件编号333-265429)附件10.14)。 | |
| 10.14 | 航天飞机制药有限责任公司与LIFESPAN/罗德岛医院于2014年10月28日签订的分包协议(通过参考2022年6月3日提交的S-1表格注册声明(文件编号333-265429)附件10.15而并入)。 | |
| 10.15 | 2019年2月15日,Shuttle PharmPharmticals Inc.和ProPagenix,Inc.之间的再许可协议(通过引用2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.16而并入)。 | |
| 10.16 | SBIR合同编号HHSN261201800016C/75N91018C00016航天飞机制药有限责任公司与美国国立卫生研究院国家癌症研究所签订的协议(通过引用附件10.17并入2022年6月3日提交的S-1表格注册说明书(文件编号333-265429)中)。 | |
| 10.17 | 本票,日期为2019年8月24日,由Shuttle PharmPharmticals Holdings,Inc.和Anatoly Dritschilo(通过参考2022年6月3日提交的S-1表格登记声明(第333-265429号文件)附件10.18合并而成)。 | |
| 10.18 | SBIR第二阶段合同编号75N9101C00031,日期为2019年9月6日,由Shuttle PharmPharmticals,Inc.和国家卫生研究所国家癌症研究所签订(通过引用附件10.19并入2022年6月3日提交的S-1表格注册声明(文件编号333-265429)中)。 | |
| 10.19 | 董事 2020年12月2日克里斯·H·森纳亚克和航天飞机制药控股有限公司之间的邀请函(合并于2022年6月3日提交的S-1表格注册声明(文件编号333-265429)附件10.20)。 | |
| 10.20 | 由航天飞机医药控股公司和joy药业公司发行的日期为2020年12月1日的本票(通过参考2022年6月3日提交的S-1表格登记声明(文件编号333-265429)附件10.21合并而成)。 | |
| 10.21 | 本票,日期为2020年12月1日,由Shuttle PharmPharmticals Holdings,Inc.和Anatoly Dritschilo(通过参考2022年6月3日提交的S-1表格登记声明(文件编号333-265429)的附件10.22合并而成)。 | |
| 10.22 | 2019年5月30日,Shuttle PharmPharmticals,Inc.与弗吉尼亚大学许可和风险投资集团签订的保密、评估和期权协议(通过引用2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.23并入)。 | |
| 10.23 | 航天飞机制药公司与弗吉尼亚大学许可和风险投资集团于2019年11月30日签署的《保密、评估和期权协议第一修正案》(通过引用2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.24合并)。 | |
| 10.24 | 票据及认股权证认购协议表格,日期为2021年12月28日(参考于2022年6月3日提交的S-1表格登记声明(文件编号333-265429)附件10.25)。 | |
| 10.25 | 票据表格,日期为2021年12月28日(参考于2022年6月3日提交的S-1表格登记声明(文件编号333-265429)附件10.26)。 | |
| 10.26 | 普通股认购权证表格,日期为2021年12月28日(引用附件10.27并入2022年6月3日提交的S-1表格登记声明(文件编号333-265429))。 | |
| 10.27 | 2022年1月1日,Shuttle PharmPharmticals Holdings,Inc.与Steven Bayern签订的咨询协议(通过参考2022年6月3日提交的S-1表格注册声明(文件编号333-265429)的附件10.28而并入)。 | |
| 10.28 | 对2022年1月25日航天飞机制药控股公司和joy·德里奇洛之间的本票的修正案(通过参考2022年6月3日提交的S-1表格登记说明书(第333-265429号文件)附件10.29而并入)。 | |
| 10.29 | 对Shuttle PharmPharmticals Holdings,Inc.和Anatoly Dritschilo之间日期为2022年1月25日的本票的修正案(通过参考2022年6月3日提交的表格S-1(文件编号333-265429)登记声明的附件10.30而并入)。 | |
| 10.30 | 可换股票据认购协议及投资者权利协议表格(于2022年6月3日提交的S-1表格(档案编号333-265429)附件10.31)。 | |
| 10.31 | 2022年7月29日由Shuttle PharmPharmticals Holdings,Inc.和joy Dritschilo签署的本票第1号修正案(通过引用2022年8月18日提交的S-1/A表格登记声明(文件编号333-265429)的附件10.32并入本票)。 | |
| 10.32 | 2022年7月29日由Shuttle PharmPharmticals Holding,Inc.和joy Dritschilo签署的本票第2号修正案(通过引用2022年8月18日提交的S-1/A表格登记声明(第333-265429号文件)附件10.33并入本票)。 |
| 79 |
| 10.33 | 2022年7月29日Shuttle PharmPharmticals Holdings,Inc.和Anatoly Dritschilo之间的本票第2号修正案(通过引用2022年8月18日提交的登记声明S-1/A表格(文件编号333-265429)的附件10.34并入)。 | |
| 10.34 | 2022年9月14日,Shuttle PharmPharmticals,Inc.和TCG Greichem,Inc.之间的制造协议(通过参考2022年9月19日提交的当前8-K表格中的附件10.1并入)。 | |
| 10.35 | 2023年1月11日Shuttle PharmPharmticals Holdings,Inc.与其中指定的投资者之间的证券购买协议表格(通过引用2023年1月12日提交的当前8-K表格中的附件10.1并入)。 | |
| 10.36 | 说明表格,日期为2023年1月11日(通过引用附件10.2并入2023年1月12日提交的当前8-K表格报告中)。 | |
| 10.37 | 授权书表格,日期为2023年1月11日(通过引用附件10.3并入2023年1月12日提交的当前8-K表格报告中)。 | |
| 10.38 | 2023年1月11日,Shuttle PharmPharmticals Holdings,Inc.和Alto Opportunity Master Fund,SPC分离的投资组合B之间的担保协议表格(通过引用2023年1月12日提交的当前8-K表格的附件10.4并入)。 | |
| 10.39 | 知识产权担保协议表,日期为2023年1月11日(通过引用附件10.5并入2023年1月12日提交的当前8-K表报告中)。 | |
| 10.40 | 附属担保表格(通过引用附件10.6并入2023年1月12日提交的当前报告的表格8-K)。 | |
| 10.41 | 登记权协议表格,日期为2023年1月11日(通过引用附件10.7并入2023年1月12日提交的当前8-K表格报告中)。 | |
| 10.42 | 董事邀请函格式(通过参考2023年2月22日提交的当前报告的8-K表格的附件10.1并入)。 | |
| 10.43 | 2023年3月7日,Shuttle制药公司和爱荷华大学制药公司之间的服务协议提案(通过引用附件10.1并入2023年3月9日提交的当前8-K表格报告中)。 | |
| 10.44 | 修订和重新制定的内幕交易政策,2023年3月10日生效(通过参考2023年3月15日提交的Form 10-K年度报告的附件10.44并入)。 | |
| 10.45 | 高管薪酬追回政策表格,2023年3月10日生效(通过引用2023年3月15日提交的Form 10-K年度报告的附件10.45并入)。 | |
| 10.46 | Shuttle PharmPharmticals Holdings,Inc.和Alto Opportunity Master Fund之间作为抵押品代理的信件协议,日期为2023年3月11日,SPC分离的投资组合B(通过引用2023年3月15日提交的Form 10-K年度报告的附件10.46并入)。 | |
| 10.47 | 2023年3月16日,Shuttle制药公司和乔治城大学之间的研究协议(通过引用附件10.1并入2023年3月22日提交的当前8-K表格报告中)。 | |
| 10.48 | 2023年3月21日,Shuttle制药公司和乔治城大学之间的材料转让协议(通过引用附件10.2并入2023年3月22日提交的当前8-K表格报告中)。 | |
| 10.49 | 修订协议,由Shuttle PharmPharmticals Holdings,Inc.,Shuttle PharmPharmticals,Inc.和Alto Opportunity Master Fund,SPC分离的主投资组合B签订,日期为2023年5月10日(通过引用2023年5月11日提交的当前8-K表格的附件10.1并入)。 | |
| 10.50 | 对修订协议的第1号修正案,日期为2023年6月4日,由Shuttle PharmPharmticals Holdings,Inc.和Alto Opportunity Master Fund,SPC分离的主投资组合B组成(通过引用2023年6月5日提交的当前8-K表格的附件10.1并入)。 | |
| 10.51 | 2023年10月1日,Shuttle PharmPharmticals Holdings,Inc.和Joseph Armstrong之间的咨询协议(通过引用附件10.1并入2023年10月5日提交的当前报告Form 8-K)。 | |
| 10.52 | 许可协议,日期为2023年10月24日,由Shuttle PharmPharmticals Holdings,Inc.和乔治城大学签订(通过参考2023年10月30日提交的当前8-K表格中的附件10.1并入)。 | |
| 10.53 | 资产购买协议,由Shuttle PharmPharmticals Holdings,Inc.、Alan Kozikowski和Werner Tueckmantel签署,日期为2024年1月30日(本文通过参考2024年2月5日提交的当前8-K表格的附件10.1并入)。 | |
| 10.54 | 2024年2月7日,Shuttle PharmPharmticals Holdings,Inc.、Shuttle Diagnostics,Inc.和SRO LLC之间的证券购买协议(通过参考2024年2月13日提交的当前8-K报表的附件10.1并入本文)。 | |
| 10.55 | 配售代理和咨询服务协议,日期为2024年2月7日,由Shuttle PharmPharmticals Holdings,Inc.和Boustead Securities,LLC签订(通过参考2024年2月13日提交的当前8-K报表的附件10.2并入本文)。 | |
| 10.56 | 发行存款账户代理协议,日期为2024年2月7日,由Shuttle PharmPharmticals Holdings,Inc.,Boustead Securities,LLC和Sutter Securities Inc.签订(通过引用附件10.3并入2024年2月13日提交的本报告10-K表中)。 | |
| 14.1 | 商业行为和道德准则(通过参考2022年6月3日提交的S-1表格注册声明(文件编号333-265429)附件10.3而并入)。 | |
| 21 | 附属公司名单。* | |
| 23.1 | FORVIS LLP的同意 * | |
| 23.2 | BF Borgers CPA PC同意* | |
| 31.1 | 根据2002年《萨班斯-奥克斯利法案》第302条对首席执行官的认证* | |
| 31.2 | 根据2002年《萨班斯—奥克斯利法案》第302条认证首席财务官 * | |
| 32.1 | 根据18 U.S.C.的首席执行官认证。第1350条,根据2002年《萨班斯—奥克斯利法案》第906条通过** | |
| 32.2 | 根据18 U.S.C.的首席财务官认证。第1350条,根据2002年《萨班斯—奥克斯利法案》第906条通过** | |
| 101.INS | 内联 XBRL实例文档-实例文档不显示在交互数据文件中,因为XBRL标记嵌入在内联XBRL文档内。 | |
| 101.SCH | 内联 XBRL分类架构文档 | |
| 101.CAL | 内联 XBRL分类计算链接库文档 | |
| 101.DEF | 内联 XBRL分类定义Linkbase文档 | |
| 101.LAB | 内联 XBRL分类标签Linkbase文档 | |
| 101.PRE | 内联 XBRL分类演示文稿Linkbase文档 | |
| 104 | 封面 页面交互数据文件(嵌入内联XBRL文档中) |
”与此同时。
** 随函提供。
第 项16.表格10-K总结
没有。
| 80 |
签名
根据1934年《证券交易法》第13或15(D)节的要求,公司已正式安排本年度报告由经正式授权的签署人代表公司签署。
| 航天飞机 制药控股公司 | ||
| 发信人: | /S/ Anatoly Dritschilo,M.D. | |
| Anatoly Dritschilo医学博士 | ||
| 董事长 , | ||
| 首席执行官和总裁 | ||
| 日期: 2024年3月21日 | 首席执行官 | |
根据1934年《证券交易法》的要求,本年度报告已由以下人员代表注册人以指定的身份和日期在下面签署。
| 签名 | 标题 | 日期 | ||
| /S/ 阿纳托利·德里奇洛 | 董事长 , | |||
| Anatoly Dritschilo | 首席执行官 | 3月21日, 2024 | ||
| (首席执行官 ) | ||||
| /S/ 迈克尔·范德·胡克 | 首席财务官 | |||
| 迈克尔·范德·胡克 | (首席财务会计官) | 3月21日, 2024 | ||
| /S/ 克里斯·H·塞纳亚克 | 董事 | |||
| 克里斯·H·塞纳亚克 | 3月21日, 2024 | |||
| /S/ 史蒂文·理查兹 | 董事 | |||
| 史蒂文·理查兹 | 3月21日, 2024 | |||
| /S/ 约书亚·谢弗 | 董事 | |||
| 约书亚·谢弗 | 3月21日, 2024 | |||
| /S/ 米尔顿·布朗 | 董事 | |||
| 米尔顿·布朗 | 3月21日, 2024 | |||
| /S/ 贝特·雅各布斯 | 董事 | |||
| 贝特·雅各布斯 | 3月21日, 2024 |
| 81 |