
每个班级的标题 |
交易代码 |
注册的每个交易所的名称 |
美国存托股份 每个代表1股 |
NVS |
纽约证券交易所 |
普通股,面值0.50瑞士法郎/股 * |
NOVN |
纽约证券交易所* |
大型加速文件服务器x |
加速文件管理器o |
非加速文件管理器o |
新兴成长型公司o |
美国公认会计原则o |
国际会计准则理事会发布的国际财务报告准则x |
其他o |
目录
某些术语的引入和使用
前瞻性陈述
第一部分
项目1.董事、高级管理人员和顾问的身份
项目2.报价统计数据和预期时间表
项目3.关键信息
3.A部分财务数据
|
Year ended December 31,
|
|||||||||||
|
(百万美元,不包括每股信息)
|
2019
|
2018
|
2017
|
2016
|
2015
|
||||||
|
损益表数据1
|
|
|
|
|
|
||||||
|
持续运营对第三方的净销售额
|
47 445
|
44 751
|
42 338
|
41 975
|
42 641
|
||||||
|
持续经营的营业收入
|
9 086
|
8 403
|
8 702
|
8 248
|
8 522
|
||||||
|
来自相联公司的收入
|
659
|
6 438
|
1 108
|
703
|
266
|
||||||
|
利息支出
|
– 850
|
– 932
|
– 750
|
– 675
|
– 637
|
||||||
|
其他财务收支
|
45
|
186
|
42
|
– 385
|
– 433
|
||||||
|
持续经营的税前收入
|
8 940
|
14 095
|
9 102
|
7 891
|
7 718
|
||||||
|
税费
|
– 1 793
|
– 1 295
|
– 1 603
|
– 1 095
|
– 1 066
|
||||||
|
持续经营净收益
|
7 147
|
12 800
|
7 499
|
6 796
|
6 652
|
||||||
|
来自已终止经营业务之净(亏损)╱收入(扣除分派收益前)。诺华股东
|
– 101
|
– 186
|
204
|
– 98
|
376
|
||||||
|
Alcon Inc.诺华公司股东
|
4 691
|
|
|
|
|
||||||
|
与投资组合转换交易有关的净收入
|
|
|
|
|
10 766
|
||||||
|
非持续经营业务的净收益
|
4 590
|
– 186
|
|
204
|
|
– 98
|
|
11 142
|
|||
|
集团年终利润
|
11 737
|
12 614
|
7 703
|
6 698
|
17 794
|
||||||
|
归因于:
|
|
|
|
|
|
||||||
|
诺华制药的股东
|
11 732
|
12 611
|
7 703
|
6 712
|
17 783
|
||||||
|
非控制性权益
|
5
|
3
|
0
|
– 14
|
11
|
||||||
|
|
|
|
|
|
|||||||
|
基本每股收益(美元)
|
|
|
|
|
|
||||||
|
持续运营
|
3.12
|
5.52
|
3.20
|
2.86
|
2.77
|
||||||
|
停产经营
|
2.00
|
– 0.08
|
0.08
|
– 0.04
|
4.63
|
||||||
|
总计
|
5.12
|
5.44
|
3.28
|
2.82
|
7.40
|
||||||
|
|
|
|
|
|
|||||||
|
稀释后每股收益(美元)
|
|
|
|
|
|
||||||
|
持续运营
|
3.08
|
5.46
|
3.17
|
2.84
|
2.72
|
||||||
|
停产经营
|
1.98
|
– 0.08
|
0.08
|
– 0.04
|
4.57
|
||||||
|
总计
|
5.06
|
5.38
|
3.25
|
2.80
|
7.29
|
||||||
|
现金股利2
|
6 645
|
6 966
|
6 495
|
6 475
|
6 643
|
||||||
|
每股现金股息(瑞士法郎)3
|
2.95
|
2.85
|
2.80
|
2.75
|
2.70
|
||||||
|
持续运营的人员成本4, 5
|
13 843
|
13 515
|
12 009
|
11 950
|
11 336
|
||||||
|
年终持续业务的全职等值助理5
|
103 914
|
104 780
|
102 467
|
99 747
|
99 624
|
||||||
|
|
|||||||||||
|
1 持续经营包括创新药品和Sandoz部门的业务以及企业活动。已终止的业务包括于2019年剥离的Alcon业务;于2015年剥离的动物保健和疫苗业务;以及消费者保健业务,该业务也于2015年注入新实体葛兰素史克消费者保健控股有限公司(GSK消费者保健),诺华拥有36.5%的权益。该新创建的实体于2018年出售给GSK。为了反映这些交易,诺华根据国际财务报告准则的要求,将集团2019年至2015年的财务业绩报告为“持续经营”和“已终止经营”。
|
|||||||||||
|
2 现金股利是指适用年度的现金支付,通常与上一年的收益有关。
|
|||||||||||
|
3 每股现金股息指与本年度盈利有关的建议股息。二零一五年至二零一八年之股息已于各股东周年大会上获批准,而二零一九年之股息将于二零二零年二月二十八日提呈股东周年大会以供批准。
|
|||||||||||
|
4 人员成本包括工作人员的工资、薪金、津贴、佣金和奖金、加班费、奖励、假日工资、遣散费和社会福利费用。
|
|||||||||||
|
5 自己的员工。
|
|||||||||||
|
Year ended December 31,
|
|||||||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
2016
|
2015
|
||||||
|
资产负债表数据
|
|
|
|
|
|
||||||
|
现金、现金等价物、有价证券和衍生金融工具
|
11 446
|
15 964
|
9 485
|
7 777
|
5 447
|
||||||
|
盘存
|
5 982
|
6 956
|
6 867
|
6 255
|
6 226
|
||||||
|
其他流动资产
|
11 235
|
11 836
|
11 856
|
10 899
|
11 172
|
||||||
|
非流动资产
|
88 866
|
110 000
|
104 871
|
105 193
|
108 711
|
||||||
|
出售集团持有待售资产1
|
841
|
807
|
|
|
|
||||||
|
总资产
|
118 370
|
145 563
|
133 079
|
130 124
|
131 556
|
||||||
|
应付贸易帐款
|
5 424
|
5 556
|
5 169
|
4 873
|
5 668
|
||||||
|
其他流动负债
|
22 809
|
24 000
|
18 234
|
17 336
|
18 040
|
||||||
|
非流动负债
|
34 555
|
37 264
|
35 449
|
33 024
|
30 726
|
||||||
|
出售集团持有待售资产的负债1
|
31
|
51
|
|
|
|
||||||
|
总负债
|
62 819
|
66 871
|
58 852
|
55 233
|
54 434
|
||||||
|
Novartis AG股东应占已发行股本及储备
|
55 474
|
78 614
|
74 168
|
74 832
|
77 046
|
||||||
|
非控制性权益
|
77
|
78
|
59
|
59
|
76
|
||||||
|
总股本
|
55 551
|
78 692
|
74 227
|
74 891
|
77 122
|
||||||
|
负债和权益总额
|
118 370
|
145 563
|
133 079
|
130 124
|
131 556
|
||||||
|
净资产
|
55 551
|
78 692
|
74 227
|
74 891
|
77 122
|
||||||
|
已发行股本
|
856
|
875
|
869
|
896
|
890
|
||||||
|
总流通股(百万股)
|
2 265
|
2 311
|
2 317
|
2 374
|
2 374
|
||||||
|
1 持作出售之出售组别涉及山德士美国皮肤科业务及仿制美国口服固体产品组合出售给Aurobindo Pharma USA Inc.的资产及负债,如2018年9月6日宣布的(见第18项。财务报表—附注2。重大未决交易”)。
|
|||||||||||
|
|
|||||||||||
|
|
|||||||||||
|
年挣了 |
月和 支付年份 |
总股息
每股 (瑞士法郎) |
总股息
每股 (美元) |
||||
|
2015
|
2016年3月
|
2.70
|
2.70
|
||||
|
2016
|
2017年3月
|
2.75
|
2.72
|
||||
|
2017
|
2018年3月
|
2.80
|
2.94
|
||||
|
2018
|
2019年3月
|
2.85
|
2.84
|
||||
|
2019 1
|
2020年3月
|
2.95
|
3.04 2
|
||||
|
|
|||||||
|
1 于二零二零年二月二十八日召开之股东周年大会上建议派发股息,并于二零二零年三月五日派发。
|
|||||||
|
2 2019年12月31日换算成美元,汇率为1.032美元兑瑞士法郎。此换算仅为示例,不应解释为瑞士法郎金额所代表的、或已或可能按该汇率或任何其他汇率换算成美元。
|
|||||||
3.B资本化和债务
3.C提供和使用收益的理由
3.D风险因素
项目4. 公司信息
4.诺华的历史与发展
4.B业务概述
创新药物
|
项目/ 产品 |
普普通通 名字 |
机理 行动中的 |
潜在适应症 |
业务 特许经营 |
配方/ 路线: 行政管理 |
年项目
vt.进入,进入 当前 发展 相位 |
计划中的备案 日期/当前 相位 |
||||||||
|
ABL001
|
阿司米尼
|
Bcr-abl抑制剂
|
慢性粒细胞白血病,3研发线
|
肿瘤学
|
口头的
|
2016
|
2021/III
|
||||||||
|
ACZ885
|
Canakinumab
|
抗白细胞介素1β单抗
|
2发送非小细胞肺癌
|
肿瘤学
|
皮下注射
|
2017
|
2021/III
|
||||||||
|
|
|
1ST非小细胞肺癌
|
肿瘤学
|
皮下注射
|
2017
|
2021/III
|
|||||||||
|
|
|
辅助性非小细胞肺癌
|
肿瘤学
|
皮下注射
|
2017
|
2022/III
|
|||||||||
|
AVXS-1011
|
奥纳塞姆诺—基因abepar—vovec
|
运动神经元生存 (SMN)基因 替代疗法
|
脊髓性肌萎缩 (IV配方)
|
神经科学
|
静脉输注
|
2018
|
美国批准的欧盟注册
|
||||||||
|
|
|
脊髓性肌萎缩 (IT配方)2
|
神经科学
|
鞘内注射
|
2018
|
2020/I
|
|||||||||
|
AVXS—201
|
TBD
|
甲基化cpg结合 蛋白2基因 替代疗法
|
雷特综合征
|
神经科学
|
鞘内注射
|
2018
|
2023/I
|
||||||||
|
BYL7193
|
阿尔贝利西布
|
PI3K-α抑制物
|
PIK3CA突变体激素受体阳性 (HR+)/人表皮生长因子 受体2阴性(HER 2—) 绝经后晚期乳腺癌, 2发送线路(+Fulvestrant)
|
肿瘤学
|
口头的
|
2018
|
美国批准欧盟注册
|
||||||||
|
|
|
PIK3CA相关过度生长谱
|
肿瘤学
|
口头的
|
2019
|
2020/III
|
|||||||||
|
|
|
三阴性乳腺癌
|
肿瘤学
|
口头的
|
2019
|
2023/III
|
|||||||||
|
|
|
激素受体阴性(HR—)/人表皮生长因子受体2阳性(HER 2+)晚期乳腺癌
|
肿瘤学
|
口服
|
2019
|
2023/III
|
|||||||||
|
|
|
卵巢癌
|
肿瘤学
|
口头的
|
2019
|
2023/III
|
|||||||||
|
|
|
头颈部鳞状细胞癌
|
肿瘤学
|
口头的
|
2019
|
≥ 2024/III
|
|||||||||
|
CEE321
|
TBD
|
泛—jak抑制剂
|
特应性皮炎
|
免疫学, 肝病学和 皮肤科
|
局部
|
2019
|
≥ 2024/II
|
||||||||
|
CFZ533
|
伊卡利单抗
|
阻塞,非消耗, 抗CD40单克隆抗体 抗体
|
实体器官移植
|
免疫学, 肝病学和 皮肤科
|
静脉输注
|
2017
|
2023/II
|
||||||||
|
|
|
舍格伦综合征
|
免疫学, 肝病学和 皮肤科
|
静脉输注
|
2018
|
≥ 2024/II
|
|||||||||
|
科森提克斯
|
secukinumab
|
抗白细胞介素—17 单克隆抗体
|
非放射性轴性脊柱关节炎
|
免疫学, 肝病学和 皮肤科
|
皮下注射
|
2015
|
美国/欧盟注册
|
||||||||
|
|
|
银屑病关节炎与Humira的面对面研究®(阿达木单抗)
|
免疫学, 肝病学和 皮肤科
|
皮下注射
|
2015
|
2020/III
|
|||||||||
|
|
|
强直性脊柱炎与Sandoz生物相似的面对面研究赫里莫兹(阿达莫单抗)
|
免疫学, 肝病学和 皮肤科
|
皮下注射
|
2015
|
2022/III
|
|||||||||
|
|
|
化脓性汗腺炎
|
免疫学, 肝病学和 皮肤科
|
静脉输注
|
2017
|
2022/III
|
|||||||||
|
|
|
巨细胞动脉炎
|
免疫学, 肝病学和 皮肤科
|
静脉输注
|
2018
|
≥ 2024/II
|
|||||||||
|
|
|
扁平苔藓
|
免疫学, 肝病学和 皮肤科
|
静脉输注
|
2019
|
≥ 2024/II
|
|||||||||
|
CSJ117
|
待定
|
抗胸腺基质淋巴生成素单抗片段
|
重度哮喘
|
呼吸性
|
吸入
|
2018
|
2023/II
|
||||||||
|
ECF843
|
待定
|
边界润滑剂
|
干眼症
|
眼科
|
滴眼液
|
2017
|
2022/II
|
||||||||
|
Entresto
|
伐沙坦和萨舒比利(钠盐复合体)
|
血管紧张素受体/Neprilysin抑制剂
|
射血分数保留的慢性心力衰竭
|
心血管、肾脏和代谢
|
口头的
|
2012
|
2020/III
|
||||||||
|
|
|
急性心肌梗死后
|
心血管、肾脏和代谢
|
口服
|
2015
|
2021/III
|
|||||||||
|
|
|||||||||||||||
|
1 在美国被批准为佐尔根斯马治疗脊髓性肌萎缩症(IV配方)
|
|||||||||||||||
|
2 根据一项小型临床前动物研究的结果,FDA已经部分临床搁置了AVXS-101用于脊髓性肌萎缩症患者的鞘内试验。
|
|||||||||||||||
|
3 在美国被批准为皮克雷发送线路(+Fulvestrant)
|
|||||||||||||||
|
项目/ 产品 |
普普通通 名字 |
机理 行动中的 |
潜在适应症 |
业务 特许经营 |
配方/ 路线: 行政管理 |
年项目
vt.进入,进入 当前 发展 相位 |
计划中的备案 日期/当前 相位 |
||||||||
|
INC280
|
卡马替尼
|
C-MET抑制剂
|
非小细胞肺癌
|
肿瘤学
|
口头的
|
2014
|
美国注册
|
||||||||
|
|
|
实体瘤
|
肿瘤学
|
口头的
|
2019
|
≥2024/II
|
|||||||||
|
雅卡维
|
鲁索利替尼
|
JAK1/2抑制剂
|
acute graft—versus—host disease
|
肿瘤学
|
口头的
|
2016
|
2021/III
|
||||||||
|
|
|
慢性移植物抗宿主病
|
肿瘤学
|
口头的
|
2016
|
2021/III
|
|||||||||
|
KAE609
|
西帕加明
|
PfATP4抑制剂
|
疟疾
|
既定药物
|
口服
|
2012
|
≥ 2024/II
|
||||||||
|
|
|
严重疟疾
|
既定药物
|
口服
|
2019
|
≥ 2024/II
|
|||||||||
|
KAF156
|
加纳普拉赛德
|
咪唑哌嗪 衍生物
|
疟疾
|
既定药物
|
口服
|
2014
|
≥ 2024/II
|
||||||||
|
基斯卡利
|
核糖核素
|
CDK4/6抑制剂
|
HR +/HER 2—乳腺癌(辅助治疗)
|
肿瘤学
|
口头的
|
2018
|
2022/III
|
||||||||
|
KJX839
|
inclisiran
|
小干扰RNA(PCSK9)
|
高血脂
|
心血管、肾脏和代谢
|
皮下注射
|
2019
|
美国/欧盟 登记
|
||||||||
|
|
|
心血管的二级预防 水平升高患者发生的事件 的ldl—c
|
心血管、肾脏和代谢
|
皮下注射
|
2019
|
≥ 2024/III
|
|||||||||
|
金利亚
|
蒂桑—莱克卢塞尔
|
CD19靶向嵌合体 抗原受体t细胞 免疫治疗
|
复发性/难治性滤泡性淋巴瘤
|
肿瘤学
|
静脉输注
|
2017
|
2021/II
|
||||||||
|
|
|
复发性/难治性弥漫性大B细胞 淋巴瘤1ST旧病复发
|
肿瘤学
|
静脉输注
|
2018
|
2021/III
|
|||||||||
|
|
|
复发/难治性弥漫性大B细胞淋巴瘤(+pembrolizumab)
|
肿瘤学
|
静脉输注
|
2017
|
≥ 2024/II
|
|||||||||
|
LAM320
|
氯法齐明
|
分枝杆菌 dna结合
|
耐多药结核病
|
既定药物
|
口服
|
2016
|
2021/III
|
||||||||
|
LJC242
|
tropifexor, cenicriviroc (in固定剂量复方制剂)
|
FXR激动剂, CCR2/5抑制剂
|
非酒精性脂肪肝炎
|
免疫学、肝病学和皮肤科
|
口头的
|
2017
|
≥2024/II
|
||||||||
|
LJN452
|
托洛伊克索
|
FXR激动剂
|
非酒精性脂肪性肝炎
|
免疫学, 肝病学和 皮肤科
|
口服
|
2015
|
≥ 2024/II
|
||||||||
|
LMI070
|
布拉帕拉姆
|
SMN2RNA剪接调制器
|
脊髓性肌萎缩
|
神经科学
|
口服
|
2017
|
≥ 2024/II
|
||||||||
|
LNP023
|
TBD
|
B因子抑制物
|
IGA肾病
|
心血管、肾脏和代谢
|
口服
|
2018
|
2023/II
|
||||||||
|
|
|
C3肾小球病变
|
心血管、肾脏和代谢
|
口服
|
2018
|
2023/II
|
|||||||||
|
|
|
阵发性睡眠性血红蛋白尿
|
心血管、肾脏和代谢
|
口服
|
2019
|
2023/II
|
|||||||||
|
|
|
膜性肾病
|
心血管、肾脏和代谢
|
口服
|
2018
|
≥ 2024/II
|
|||||||||
|
LOU064
|
TBD
|
BTK抑制剂
|
慢性自发性荨麻疹
|
免疫学, 肝病学和 皮肤科
|
口服
|
2017
|
2023/II
|
||||||||
|
177Lu—PSMA—617
|
待定
|
靶向dna 破坏通过 β粒子 辐射
|
转移性去势抵抗性 前列腺癌
|
肿瘤学
|
静脉输注
|
2018
|
2020/III
|
||||||||
|
LXE408
|
TBD
|
动质体蛋白酶体抑制剂
|
内脏利什曼病
|
既定药物
|
口服
|
2019
|
≥ 2024/II
|
||||||||
|
MBG453
|
待定
|
tim—3拮抗剂
|
骨髓增生异常综合征
|
肿瘤学
|
静脉输液
|
2018
|
2021/II
|
||||||||
|
|
|
急性髓性白血病
|
肿瘤学
|
静脉输液
|
2019
|
≥2024/II
|
|||||||||
|
OMB157
|
ofatumumab
|
抗CD20单克隆抗体 抗体
|
复发型多发性硬化
|
神经科学
|
皮下注射
|
2015
|
美国/欧盟注册
|
||||||||
|
PDR001
|
斯帕他珠单抗
|
抗—pd—1单克隆 抗体
|
转移性BRAF V600+黑色素瘤(w/ 塔芬拉尔 + 麦金主义者)
|
肿瘤学
|
静脉输注
|
2017
|
2020/III
|
||||||||
|
|
|
转移性黑色素瘤(组合)
|
肿瘤学
|
静脉输液
|
2017
|
2023/II
|
|||||||||
|
QBW251
|
待定
|
CFTR型增强器
|
慢性阻塞性肺疾病
|
呼吸性
|
口头的
|
2017
|
≥2024/II
|
||||||||
|
QGE031
|
利吉珠单抗
|
高亲和力抗IgE 单克隆抗体
|
慢性自发性荨麻疹/ 慢性特发性荨麻疹
|
免疫学, 肝病学和 皮肤科
|
皮下注射
|
2017
|
2021/III
|
||||||||
|
QMF149
|
茚达特罗, 莫米松 糠酸 (in固定剂量 组合)
|
长效β2- 肾上腺素能激动剂和 吸入性皮质类固醇
|
哮喘
|
呼吸
|
吸入
|
2019
|
欧盟注册
|
||||||||
|
项目/ 产品 |
普普通通 名字 |
机理 行动中的 |
潜在适应症 |
业务 特许经营 |
配方/ 路线: 行政管理 |
年项目
vt.进入,进入 当前 发展 相位 |
计划中的备案 日期/当前 相位 |
||||||||
|
QVM149
|
吲哚卡特罗、呋喃莫米松、溴化吡咯铵(固定剂量组合)
|
长效β2-肾上腺素能激动剂、长效M受体拮抗剂和吸入性皮质类固醇
|
哮喘
|
呼吸性
|
吸入
|
2019
|
欧盟注册
|
||||||||
|
RTH2 584
|
溴珠单抗
|
抗VEGF单链 抗体片段
|
新生血管性(湿性)年龄相关性黄斑 变性
|
眼科
|
玻璃体内注射
|
2019
|
美国批准的欧盟注册
|
||||||||
|
|
|
糖尿病黄斑水肿
|
眼科
|
玻璃体内注射
|
2017
|
2021/III
|
|||||||||
|
|
|
视网膜静脉阻塞
|
眼科
|
玻璃体内注射
|
2018
|
2023/III
|
|||||||||
|
|
|
增殖性糖尿病视网膜病变
|
眼科
|
玻璃体内注射
|
2019
|
2023/III
|
|||||||||
|
SAF312
|
待定
|
TRPV1拮抗剂
|
慢性眼表疼痛
|
眼科
|
局部
|
2019
|
≥2024/II
|
||||||||
|
SEG1015
|
crizanlizumab
|
P—选择素抑制剂
|
镰状细胞病
|
肿瘤学
|
静脉输注
|
2019
|
美国批准的欧盟注册
|
||||||||
|
TQJ230
|
TBD
|
抗apo(a)反义 寡核苷酸
|
心血管的二级预防 水平升高患者发生的事件 脂蛋白(a)
|
心血管, 肾脏和 代谢
|
皮下注射
|
2018
|
≥ 2024/III
|
||||||||
|
中国人844
|
TBD
|
减少 二硫键
|
老花眼
|
心血管、肾脏和代谢
|
滴眼液
|
2017
|
≥ 2024/II
|
||||||||
|
VAY736
|
亚纳鲁单抗
|
抗BAFF(B细胞— 活化因子) 单克隆抗体
|
自身免疫性肝炎
|
免疫学, 肝病学和 皮肤科
|
皮下注射
|
2016
|
≥ 2024/II
|
||||||||
|
|
|
原发性干燥综合征
|
免疫学, 肝病学和 皮肤科
|
皮下注射
|
2015
|
≥ 2024/II
|
|||||||||
|
VPM087
|
TBD
|
白细胞介素—1 β 中和 单克隆抗体
|
结直肠癌,1ST肾细胞癌1例ST线
|
肿瘤学
|
静脉输注
|
2018
|
≥2024/I
|
||||||||
|
Xolair
|
omalizumab
|
抗ige单克隆 抗体
|
鼻息肉
|
呼吸
|
皮下注射
|
2017
|
美国/欧盟 登记
|
||||||||
|
|
|
食物过敏
|
呼吸性
|
皮下注射
|
2019
|
2021/III
|
|||||||||
|
ZPL389
|
阿德里福朗
|
组胺h4受体 拮抗剂
|
特应性皮炎
|
免疫学, 肝病学和 皮肤科
|
口服
|
2017
|
≥ 2024/II
|
||||||||
|
|
|||||||||||||||
|
4 在美国被批准为Beovu新生血管性(湿性)年龄相关性黄斑变性
|
|||||||||||||||
|
5 在美国被批准为阿达克维奥镰状细胞病
|
|||||||||||||||
|
项目/产品
|
潜在适应症
|
变化
|
事理
|
||||
|
ABL001
|
慢性髓系白血病,1例ST线
|
已删除
|
开发中止
|
||||
|
AVXS-101
|
脊髓性肌萎缩症1型(IV制剂)
|
现已披露为脊髓性肌萎缩症(IV配方)
|
|
||||
|
脊髓性肌萎缩症2/3型(IT配方)
|
现已披露为脊髓性肌萎缩症(IT配方)
|
|
|||||
|
BAF312
|
继发性进行性多发性硬化症
|
商业化为 梅曾特
|
|
||||
|
BYL719
|
激素受体阳性(HR+)/人表皮生长因子受体2阴性(HER2-)晚期乳腺癌(绝经后妇女),2发送线路(+Fulvestrant)
|
现已披露为PIK3CA突变激素受体阳性(HR+)/人表皮生长因子受体2阴性(HER2-)绝经后晚期乳腺癌,2发送线路(+Fulvestrant)
|
|
||||
|
PIK3CA相关过度生长谱
|
增列
|
进入验证性开发阶段
|
|||||
|
三阴性乳腺癌
|
增列
|
进入验证性开发阶段
|
|||||
|
激素受体阴性(HR-)/人表皮生长因子受体2阳性(HER2+)晚期乳腺癌
|
增列
|
进入验证性开发阶段
|
|||||
|
卵巢癌
|
增列
|
进入验证性开发阶段
|
|||||
|
头颈部鳞状细胞癌
|
增列
|
进入验证性开发阶段
|
|||||
|
CAD106
|
阿尔茨海默病
|
已删除
|
开发中止
|
||||
|
CEE321
|
特应性皮炎
|
增列
|
进入验证性开发阶段
|
||||
|
CNP520
|
阿尔茨海默病
|
已删除
|
开发中止
|
||||
|
科森提克斯
|
巨细胞动脉炎
|
增列
|
进入验证性开发阶段
|
||||
|
扁平苔藓
|
增列
|
进入验证性开发阶段
|
|||||
|
EMA401
|
外周神经性疼痛
|
已删除
|
开发中止
|
||||
|
HDM201
|
急性髓细胞性淋巴瘤
|
已删除
|
开发中止
|
||||
|
INC280
|
非小细胞肺癌(EGFR突变)
|
已删除
|
开发中止
|
||||
|
实体瘤
|
增列
|
进入验证性开发阶段
|
|||||
|
KAE609
|
严重疟疾
|
增列
|
进入验证性开发阶段
|
||||
|
KJX839
|
高血脂
|
添加
|
收购时, 药品公司
|
||||
|
心血管事件的二级预防 在LDL—C水平升高的患者中,
|
添加
|
收购时, 药品公司
|
|||||
|
金利亚
|
慢性淋巴细胞白血病
|
已删除
|
开发中止
|
||||
|
LCI699
|
库欣病
|
已删除
|
剥离给Recordati S.p.A.
|
||||
|
LNP023
|
C3肾小球病变
|
增列
|
进入验证性开发阶段
|
||||
|
阵发性睡眠性血红蛋白尿
|
增列
|
进入验证性开发阶段
|
|||||
|
卢森提斯
|
早产儿视网膜病变
|
商业化
|
|
||||
|
糖尿病视网膜病变
|
商业化
|
|
|||||
|
LXE408
|
内脏利什曼病
|
增列
|
进入验证性开发阶段
|
||||
|
MBG453
|
骨髓增生异常综合征
|
增列
|
进入验证性开发阶段
|
||||
|
急性髓性白血病
|
增列
|
进入验证性开发阶段
|
|||||
|
mor106
|
特应性皮炎
|
已删除
|
开发中止
|
||||
|
PDR001
|
恶性黑色素瘤(组合)
|
现在公开为转移性黑色素瘤(combination)
|
|
||||
|
普罗马克塔/ 起义
|
重度再生障碍性贫血,1例ST线
|
已删除
|
发展中断
|
||||
|
QAW039
|
哮喘
|
已删除
|
开发中止
|
||||
|
RTH2 58
|
新生血管性年龄相关黄斑变性
|
现公开为新生血管(湿)年龄相关 黄斑变性
|
|
||||
|
增殖性糖尿病视网膜病变
|
增列
|
进入验证性开发阶段
|
|||||
|
Rydapt
|
急性髓性白血病(FLT3野生型)
|
已删除
|
开发中止
|
||||
|
SAF312
|
慢性眼表疼痛
|
增列
|
进入验证性开发阶段
|
||||
|
TQJ230
|
脂蛋白(A)升高患者心血管事件的二级预防
|
添加
|
进入验证性开发阶段
|
||||
|
VAY785
|
非酒精性脂肪性肝炎
|
已删除
|
开发中止
|
||||
|
Xolair
|
食物过敏
|
增列
|
进入验证性开发阶段
|
||||
|
2019年第三方净销售额
|
|||||
|
数百万美元
|
%
|
||||
|
美国
|
13 789
|
37
|
|||
|
欧洲
|
12 818
|
34
|
|||
|
亚洲、非洲、澳大拉西亚
|
8 458
|
22
|
|||
|
加拿大和拉丁美洲
|
2 649
|
7
|
|||
|
总计
|
37 714
|
100
|
|||
|
其中在成熟市场 *
|
28 573
|
76
|
|||
|
其中新兴增长市场 *
|
9 141
|
24
|
|||
|
* 新兴增长市场包括除美国、加拿大、西欧、日本、澳大利亚和新西兰的成熟市场以外的所有市场。
|
|||||
桑多兹
|
产品
|
原研药
|
描述
|
|||
|
阿莫西林/克拉维酸
|
提示:®
|
抗生素
|
|||
|
唑来膦酸
|
阿拉斯塔
|
骨质疏松症治疗
|
|||
|
乙酰半胱氨酸
|
五花八门
|
粘液溶解剂
|
|||
|
芬太尼
|
五花八门
|
疼痛治疗
|
|||
|
活性成分
|
描述
|
||
|
口服和无菌青霉素类药物
|
抗感染药
|
||
|
口服和无菌头孢菌素
|
抗感染药
|
||
|
克拉维酸及其与克拉维酸的混合物
|
β-内酰胺类抑制剂
|
||
|
经典红霉素和半合成红霉素
|
抗感染药
|
||
|
|
|||
|
中间体
|
描述
|
||
|
各种头孢菌素中间体
|
抗感染药
|
||
|
红霉素碱基
|
抗感染药
|
||
|
发酵产生的各种粗制化合物
|
环孢霉素、子囊霉素、雷帕霉素、霉酚酸等。
|
||
|
产品
|
原研药
|
描述
|
|||
|
泛绳
|
吉诺托品®
|
重组人生长激素
|
|||
|
双斜晶石和Epoetin Alfa十六进制
|
eprex®/Erypo®
|
用于治疗贫血的重组蛋白
|
|||
|
Zarzio,Zarxio和非格司亭
|
Neupogen®
|
重组蛋白在肿瘤学中的应用
|
|||
|
格拉托帕
|
Copaxone®
|
多发性硬化症的治疗
|
|||
|
埃雷齐 1
|
Enbrel®
|
治疗多发性炎症性疾病
|
|||
|
里克斯托
|
美罗华®
|
血癌和免疫性疾病的治疗
|
|||
|
赫里莫兹
|
Humira®
|
治疗多发性炎症性疾病
|
|||
|
扎姆
|
Remicade®
|
胃肠病、风湿病和皮肤病的治疗
|
|||
|
济延索
|
纽拉斯塔®
|
减少化疗引起的中性粒细胞减少的持续时间和化疗引起的发热中性粒细胞减少的发生率(慢性粒细胞白血病和骨髓增生异常综合征除外)
|
|||
|
1 2016年在美国获得批准。在美国上市,等待与Amgen的诉讼最终解决,Amgen负责销售Enbrel®。2019年8月9日,美国新泽西州地区法院做出了不利于桑多斯的裁决;桑多兹对裁决不服,并提出上诉。上诉法院听证会定于2020年3月4日举行。
|
|||||
|
项目/
产品 1 |
普普通通
名字 |
作用机制 |
潜在适应症/适应症 |
治疗区域 |
路线:
行政管理 |
当前相 |
|||||||
|
GP2017
|
阿达木
|
肿瘤坏死因子-α抑制剂
|
关节炎(类风湿性关节炎,强直性关节炎 脊椎炎、银屑病关节炎)、斑块状银屑病 和其他(与发起人相同)
|
免疫学
|
皮下
|
欧盟:已批准美国:已批准2
|
|||||||
|
GP2411 3
|
denosumab
|
RANKL抑制剂
|
骨质疏松症,骨丢失,预防扩散到骨骼的癌症的骨并发症(适应症在美国和欧盟有所不同)
|
内分泌学, 神经病学
|
皮下
|
iii期
|
|||||||
|
EGI014A1 4
|
曲妥珠单抗
|
抗HER2单抗
|
乳腺和胃肿瘤
|
肿瘤学
|
静脉
|
第三阶段
|
|||||||
|
DST356A1 5
|
natalizumab
|
抗α4(α4)整合素单抗
|
缓解复发性多发性硬化症(RRMS)的单一疗法;美国活动性克罗恩病的二线治疗
|
神经病学, 免疫学(仅限美国)
|
静脉
|
iii期
|
|||||||
|
1 La-EP2006(Pegfilgratim)在欧盟获得批准并作为济延索2018年11月,并于2019年11月在美国获批并推出。
|
|||||||||||||
|
2 启动时为赫里莫兹2018年10月在欧盟。同样在2018年10月,我们宣布了一项全球解决方案,解决了与AbbVie有关阿达利单抗的所有知识产权诉讼。根据协议条款,AbbVie授予我们与Humira相关的AbbVie知识产权的非独家许可®,从艾伯维拥有知识产权的某些国家/地区的某些日期开始。我们没有资格发射赫里莫兹在美国,直到2023年下半年。
|
|||||||||||||
|
3 与Hexal AG合作开发。
|
|||||||||||||
|
4 与EirGenix,Inc.合作开发
|
|||||||||||||
|
5 与PolPharma Biologics合作开发。
|
|||||||||||||
|
2019年第三方净销售额
|
|||||
|
数百万美元
|
%
|
||||
|
欧洲
|
5 115
|
53
|
|||
|
美国
|
2 491
|
26
|
|||
|
亚洲、非洲、澳大拉西亚
|
1 341
|
14
|
|||
|
加拿大和拉丁美洲
|
784
|
7
|
|||
|
总计
|
9 731
|
100
|
|||
|
其中在成熟市场 *
|
7 111
|
73
|
|||
|
其中新兴增长市场 *
|
2 620
|
27
|
|||
|
* 新兴增长市场包括除美国、加拿大、西欧、日本、澳大利亚和新西兰的成熟市场以外的所有市场。
|
|||||
4.C组织结构
4.D不动产、厂场和设备
|
位置 |
场地面积(单位:
平方米) |
主要活动 |
|||
|
瑞士巴塞尔--圣约翰
|
589 000
|
全球集团总部;全球创新药物事业部总部;全球Sandoz事业部;研发;药物物质和药物中间体的生产
|
|||
|
昆德尔和沙夫特瑙,奥地利
|
480 000
|
生产生物技术产品、药品和成品、抗感染药, 活性原料药、产品开发
|
|||
|
新泽西州东汉诺威
|
391 000
|
创新药品事业部美国总部,研发
|
|||
|
巴莱本,德国
|
340 000
|
生产广泛的仿制药成品剂型
|
|||
|
马萨诸塞州坎布里奇
|
205 000
|
研发
|
|||
|
上海,中国
|
106 500
|
研发
|
|||
|
卢布尔雅那,斯洛文尼亚
|
83 000
|
生产各种成品固体和无菌制剂
|
|||
|
印度海得拉巴
|
80 500
|
综合行政和发展全球服务中心
|
|||
|
科罗拉多州朗蒙特
|
65 032
|
AveXis的生产、仓库和行政办公室
|
|||
|
斯坦因,瑞士
|
64 700
|
生产无菌小瓶、预充注射器和安瓿;吸入胶囊, 片剂和透皮制剂;活性药物成分,细胞和基因疗法
|
|||
|
德国霍尔兹基兴
|
64 200
|
全球山德士事业部总部,生产口服膜,透皮给药系统, 基质贴片,产品开发
|
|||
|
蒙格斯,斯洛文尼亚
|
62 400
|
药物和药物中间体的生产
|
|||
|
斯特里科夫,波兰
|
45 000
|
生产各种散装口服固体剂型和包装
|
|||
|
胡宁格,法国
|
35 000
|
临床和商业用药品的生产
|
|||
|
新加坡
|
35 000
|
创新药物固体和生物制品的生产
|
|||
|
巴贝拉,西班牙
|
33 000
|
片剂、胶囊剂和吸入剂产品的生产
|
|||
|
瑞士巴塞尔—Schweizerhalle
|
31 700
|
药物和药物中间体的生产
|
|||
|
2、鲁伊尔-马尔迈森,法国
|
29 500
|
创新药物管理办公室
|
|||
|
普尔斯,比利时
|
27 500
|
创新药物眼科产品的生产
|
|||
|
日本东京
|
20 000
|
创新药品和山德士行政办公室
|
|||
|
新泽西州莫里斯平原
|
15 600
|
创新药物生产部门细胞和基因疗法
|
|||
|
新泽西州普林斯顿
|
14 300
|
山德士分部美国总部
|
|||
|
利伯蒂维尔
|
9 800
|
AveXis的生产、仓库和行政办公室
|
|||
|
罗马尼亚塔尔古穆列什
|
9 070
|
创新药物和Sandoz固体的生产
|
|||
|
Les Ulis,法国
|
5 920
|
创新药物生产部门细胞和基因疗法
|
|||
|
米尔本
|
1 400
|
AAA放射性配体治疗的主要生产地点
|
|||
|
Colleretto Giacosa/Ivrea,意大利
|
1 200
|
AAA放射性配体治疗的主要生产地点
|
|||
项目4A. 未解决的工作人员意见
项目5.业务和财务回顾及展望
5.A经营业绩
|
(除非另有说明,否则为百万美元) |
截至的年度 2019年12月31日 |
截至的年度 2018年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % 2 |
|||||
|
持续运营对第三方的净销售额
|
47 445
|
44 751
|
6
|
9
|
|||||
|
对停产业务的销售
|
53
|
82
|
– 35
|
– 31
|
|||||
|
持续经营的净销售额
|
47 498
|
44 833
|
6
|
9
|
|||||
|
其他收入
|
1 179
|
1 266
|
– 7
|
– 7
|
|||||
|
销货成本
|
– 14 425
|
– 14 510
|
1
|
– 2
|
|||||
|
持续经营毛利
|
34 252
|
31 589
|
8
|
12
|
|||||
|
销售、一般和行政管理
|
– 14 369
|
– 13 717
|
– 5
|
– 8
|
|||||
|
研发
|
– 9 402
|
– 8 489
|
– 11
|
– 13
|
|||||
|
其他收入
|
2 031
|
1 629
|
25
|
27
|
|||||
|
其他费用
|
– 3 426
|
– 2 609
|
– 31
|
– 33
|
|||||
|
持续经营的营业收入
|
9 086
|
8 403
|
8
|
14
|
|||||
|
净销售额回报率(%)
|
19.2
|
18.8
|
|
|
|||||
|
来自相联公司的收入
|
659
|
6 438
|
NM
|
NM
|
|||||
|
利息支出
|
– 850
|
– 932
|
9
|
8
|
|||||
|
其他财务收支
|
45
|
186
|
– 76
|
– 69
|
|||||
|
持续经营的税前收入
|
8 940
|
14 095
|
– 37
|
– 33
|
|||||
|
税费
|
– 1 793
|
– 1 295
|
– 38
|
– 46
|
|||||
|
持续经营净收益
|
7 147
|
12 800
|
– 44
|
– 41
|
|||||
|
停止经营的净亏损扣除分配给诺华制药股东的收益前的净亏损
|
– 101
|
– 186
|
NM
|
NM
|
|||||
|
爱尔康公司向诺华制药股东分派的收益
|
4 691
|
|
|
|
|||||
|
非持续经营的净收益/(亏损)
|
4 590
|
– 186
|
NM
|
NM
|
|||||
|
净收入
|
11 737
|
12 614
|
– 7
|
– 3
|
|||||
|
归因于:
|
|
|
|
|
|||||
|
诺华制药的股东
|
11 732
|
12 611
|
– 7
|
– 3
|
|||||
|
非控制性权益
|
5
|
3
|
NM
|
NM
|
|||||
|
持续经营基本每股收益(美元)
|
3.12
|
5.52
|
– 43
|
– 40
|
|||||
|
非持续经营的基本每股收益(美元)
|
2.00
|
– 0.08
|
NM
|
NM
|
|||||
|
每股基本收益合计(美元)
|
5.12
|
5.44
|
– 6
|
– 2
|
|||||
|
来自持续经营的经营活动现金流量净额
|
13 547
|
13 049
|
4
|
|
|||||
|
持续运营的自由现金流 2
|
12 937
|
11 256
|
15
|
|
|||||
|
1 持续经营业务包括创新药品及Sandoz部门的业务,持续经营业务及已终止经营业务包括Alcon眼科护理设备业务及分拆前Alcon业务应占的若干企业业务、Alcon Inc.的分销收益。2019年向诺华公司股东支付的费用以及与分配有关的其他费用。见"项目18。财务报表—注1。重要会计原则",第18项财务报表—附注2。重大交易—二零一九年重大交易”及“第18项财务报表—附注30。停止运营”。
|
|||||||||
|
2 关于非IFRS计量和对账表的解释,请参见"项目5.A经营成果—Novartis定义的非IFRS计量。”
|
|||||||||
|
NM=没有意义
|
|||||||||
|
(百万美元) |
截至的年度 2019年12月31日 |
截至的年度 2018年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
创新药物
|
37 714
|
34 892
|
8
|
11
|
|||||
|
桑多兹
|
9 731
|
9 859
|
– 1
|
2
|
|||||
|
持续运营对第三方的净销售额
|
47 445
|
44 751
|
6
|
9
|
|||||
|
(百万美元) |
截至的年度 2019年12月31日 |
截至的年度 2018年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
诺华肿瘤业务部门合计
|
14 370
|
13 428
|
7
|
10
|
|||||
|
诺华制药业务部门合计
|
23 344
|
21 464
|
9
|
12
|
|||||
|
眼科
|
4 776
|
4 558
|
5
|
8
|
|||||
|
免疫学、肝病学和皮肤病学
|
4 222
|
3 392
|
24
|
27
|
|||||
|
神经科学
|
3 773
|
3 429
|
10
|
13
|
|||||
|
呼吸性
|
1 825
|
1 767
|
3
|
9
|
|||||
|
心血管、肾脏和代谢
|
1 750
|
1 050
|
67
|
70
|
|||||
|
已建立的药物
|
6 998
|
7 268
|
– 4
|
0
|
|||||
|
创新药物总量
|
37 714
|
34 892
|
8
|
11
|
|||||
|
|
|||||||||
|
|
|||||||||
|
|
|
我们
|
世界其他地区
|
总计
|
|||||||||||||||||
|
品牌 |
商业特许经营权 |
指示 |
百万美元 |
%
变化 美元/cc 2 |
百万美元 |
%
变化 美元 |
%
变化 抄送 2 |
百万美元 |
%
变化 美元 |
%
变化 抄送 2 |
|||||||||||
|
科森提克斯
|
免疫学, 肝病和皮肤病学
|
银屑病,强直性脊柱炎 脊柱炎和 银屑病关节炎
|
2 220
|
33
|
1 331
|
14
|
20
|
3 551
|
25
|
28
|
|||||||||||
|
吉伦亚
|
神经科学
|
复发性多发性硬化症
|
1 736
|
– 2
|
1 487
|
– 6
|
0
|
3 223
|
– 4
|
– 1
|
|||||||||||
|
卢森提斯
|
眼科
|
老年性黄斑变性
|
|
|
2 086
|
2
|
7
|
2 086
|
2
|
7
|
|||||||||||
|
塔西尼亚
|
肿瘤学
|
慢性髓系白血病
|
804
|
0
|
1 076
|
1
|
5
|
1 880
|
0
|
3
|
|||||||||||
|
Entresto
|
心血管,肾脏 和代谢
|
慢性心力衰竭
|
925
|
66
|
801
|
70
|
77
|
1 726
|
68
|
71
|
|||||||||||
|
善得定
|
肿瘤学
|
类癌和肢端肥大症
|
881
|
8
|
704
|
– 9
|
– 3
|
1 585
|
0
|
2
|
|||||||||||
|
Afinator/Votubia
|
肿瘤学
|
乳腺癌/TSC
|
1 003
|
8
|
536
|
– 15
|
– 10
|
1 539
|
– 1
|
1
|
|||||||||||
|
Promacta/Revolade
|
肿瘤学
|
免疫性血小板减少症 (ITP)严重再生障碍 贫血(SAA)
|
691
|
19
|
725
|
22
|
27
|
1 416
|
21
|
23
|
|||||||||||
|
塔芬拉尔 + 麦金主义者
|
肿瘤学
|
BRAF V600+转移性和佐剂性黑色素瘤;晚期非小细胞肺癌
|
481
|
5
|
857
|
23
|
30
|
1 338
|
16
|
20
|
|||||||||||
|
加尔沃斯集团化
|
已建立的药物
|
糖尿病
|
|
|
1 297
|
1
|
5
|
1 297
|
1
|
5
|
|||||||||||
|
Gleevec/Glivec
|
肿瘤学
|
慢性粒细胞 白血病和GIST
|
334
|
– 24
|
929
|
– 17
|
– 14
|
1 263
|
– 19
|
– 17
|
|||||||||||
|
Xolair 1
|
呼吸性
|
重度过敏性哮喘 (SAA)和慢性 自发性荨麻疹 (CSU)
|
|
|
1 173
|
13
|
19
|
1 173
|
13
|
19
|
|||||||||||
|
雅卡维
|
肿瘤学
|
骨髓纤维化(MF), 单纯性红细胞增多症
|
|
|
1 114
|
14
|
20
|
1 114
|
14
|
20
|
|||||||||||
|
Diovan集团化
|
已建立的药物
|
高血压
|
86
|
2
|
978
|
4
|
10
|
1 064
|
4
|
9
|
|||||||||||
|
Exforge集团化
|
已建立的药物
|
高血压
|
13
|
– 32
|
1 012
|
3
|
8
|
1 025
|
2
|
7
|
|||||||||||
|
Exjade/Jadeu
|
肿瘤学
|
慢性铁超负荷
|
450
|
– 14
|
525
|
– 9
|
– 6
|
975
|
– 11
|
– 9
|
|||||||||||
|
Votrient
|
肿瘤学
|
肾细胞癌
|
332
|
– 18
|
423
|
0
|
5
|
755
|
– 9
|
– 6
|
|||||||||||
|
伊拉里斯
|
免疫学, 肝病和皮肤病学
|
自身炎症(CAPS, 陷阱,HIDS/MKD,FMF,SJIA, AOSD和痛风)
|
304
|
16
|
367
|
26
|
33
|
671
|
21
|
25
|
|||||||||||
|
佐瑞斯/认证
|
已建立的药物
|
移植
|
169
|
17
|
316
|
– 1
|
4
|
485
|
5
|
8
|
|||||||||||
|
基斯卡利
|
肿瘤学
|
HR +/HER2—转移性乳腺癌
|
250
|
45
|
230
|
NM
|
NM
|
480
|
104
|
111
|
|||||||||||
|
前20名产品合计
|
|
|
10 679
|
11
|
17 967
|
5
|
11
|
28 646
|
7
|
11
|
|||||||||||
|
投资组合的其余部分
|
|
|
3 110
|
39
|
5 958
|
– 1
|
4
|
9 068
|
10
|
13
|
|||||||||||
|
部门销售总额
|
|
|
13 789
|
16
|
23 925
|
4
|
9
|
37 714
|
8
|
11
|
|||||||||||
|
1 净销售额反映Xolair所有适应症的销售额。
|
|||||||||||||||||||||
|
2 不变货币(Cc)是非《国际财务报告准则》的衡量标准。关于非国际财务报告准则计量的解释,见“--项目5.a经营成果--诺华公司定义的非国际财务报告准则计量”。
|
|||||||||||||||||||||
|
|
|||||||||||||||||||||
|
(百万美元) |
截至的年度 2019年12月31日 |
截至的年度 2018年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
零售业泛型1
|
7 590
|
7 880
|
– 4
|
0
|
|||||
|
生物制药
|
1 607
|
1 436
|
12
|
16
|
|||||
|
抗肿瘤药(合作伙伴标签/API)
|
534
|
543
|
– 2
|
2
|
|||||
|
Sandoz共计
|
9 731
|
9 859
|
– 1
|
2
|
|||||
|
|
|||||||||
|
1 其中7.84亿美元(2018年:8.26亿美元)代表以Sandoz名义销售的抗感染药物
|
|||||||||
|
(百万美元) |
截至的年度 2019年12月31日 |
的百分比 净销售额 |
截至的年度 2018年12月31日 |
的百分比 净销售额 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||||
|
创新药物
|
9 287
|
24.6
|
7 871
|
22.6
|
18
|
24
|
|||||||
|
桑多兹
|
551
|
5.7
|
1 332
|
13.5
|
– 59
|
– 53
|
|||||||
|
公司
|
– 752
|
|
– 800
|
|
6
|
4
|
|||||||
|
持续经营的营业收入
|
9 086
|
19.2
|
8 403
|
18.8
|
8
|
14
|
|||||||
|
|
|||||||||||||
|
(除非另有说明,否则为百万美元) |
截至的年度 2019年12月31日 |
截至的年度 2018年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
持续经营的核心毛利
|
37 392
|
34 886
|
7
|
10
|
|||||
|
销售、一般和行政管理
|
– 14 319
|
– 13 690
|
– 5
|
– 7
|
|||||
|
研发
|
– 8 386
|
– 8 154
|
– 3
|
– 5
|
|||||
|
其他收入
|
495
|
558
|
– 11
|
– 9
|
|||||
|
其他费用
|
– 1 070
|
– 1 043
|
– 3
|
– 5
|
|||||
|
持续运营的核心运营收入
|
14 112
|
12 557
|
12
|
17
|
|||||
|
占净销售额的百分比
|
29.7
|
28.1
|
|
|
|||||
|
1 关于非IFRS计量和对账表的解释,请参见"项目5.A经营成果—Novartis定义的非IFRS计量。”
|
|||||||||
|
(百万美元) |
截至的年度 2019年12月31日 |
的百分比 净销售额 |
截至的年度 2018年12月31日 |
的百分比 净销售额 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||||
|
创新药物
|
12 650
|
33.5
|
11 151
|
32.0
|
13
|
18
|
|||||||
|
桑多兹
|
2 094
|
21.5
|
2 002
|
20.3
|
5
|
10
|
|||||||
|
公司
|
– 632
|
|
– 596
|
|
– 6
|
– 9
|
|||||||
|
持续运营的核心运营收入
|
14 112
|
29.7
|
12 557
|
28.1
|
12
|
17
|
|||||||
|
|
|||||||||||||
|
(除非另有说明,否则为百万美元) |
截至的年度 2019年12月31日 |
截至的年度 2018年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
研究和探索性开发
|
– 2 855
|
– 2 770
|
– 3
|
– 4
|
|||||
|
验证性发展
|
– 5 297
|
– 4 905
|
– 8
|
– 10
|
|||||
|
创新药物司研发费用共计
|
– 8 152
|
– 7 675
|
– 6
|
– 8
|
|||||
|
创新药物净销售额占第三方的百分比
|
21.6
|
22.0
|
|
|
|||||
|
核心研究和探索性开发1
|
– 2 706
|
– 2 665
|
– 2
|
– 2
|
|||||
|
核心验证性发展1
|
– 4 879
|
– 4 675
|
– 4
|
– 6
|
|||||
|
核心创新药物司研发费用共计
|
– 7 585
|
– 7 340
|
– 3
|
– 5
|
|||||
|
创新药物净销售额占第三方的百分比
|
20.1
|
21.0
|
|
|
|||||
|
1 核心不包括减值、摊销及若干其他项目。关于非IFRS计量和对账表的解释,请参见"—项目5.A经营成果—诺华定义的非IFRS计量。”
|
|||||||||
|
(除非另有说明,否则为百万美元) |
截至的年度 2019年12月31日 |
截至的年度 2018年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
持续经营的营业收入
|
9 086
|
8 403
|
8
|
14
|
|||||
|
来自相联公司的收入
|
659
|
6 438
|
NM
|
NM
|
|||||
|
利息支出
|
– 850
|
– 932
|
9
|
8
|
|||||
|
其他财务收支
|
45
|
186
|
– 76
|
– 69
|
|||||
|
持续经营的税前收入
|
8 940
|
14 095
|
– 37
|
– 33
|
|||||
|
税费
|
– 1 793
|
– 1 295
|
– 38
|
– 46
|
|||||
|
持续经营净收益
|
7 147
|
12 800
|
– 44
|
– 41
|
|||||
|
停止经营的净亏损扣除分配给诺华制药股东的收益前的净亏损
|
– 101
|
– 186
|
NM
|
NM
|
|||||
|
爱尔康公司向诺华制药股东分派的收益
|
4 691
|
|
|
|
|||||
|
非持续经营业务的净收益
|
4 590
|
– 186
|
NM
|
NM
|
|||||
|
净收入
|
11 737
|
12 614
|
– 7
|
– 3
|
|||||
|
归因于:
|
|
|
|
|
|||||
|
诺华制药的股东
|
11 732
|
12 611
|
– 7
|
– 3
|
|||||
|
非控制性权益
|
5
|
3
|
NM
|
NM
|
|||||
|
持续经营基本每股收益(美元)
|
3.12
|
5.52
|
– 43
|
– 40
|
|||||
|
非持续经营的基本每股收益(美元)
|
2.00
|
– 0.08
|
NM
|
NM
|
|||||
|
每股基本收益合计(美元)
|
5.12
|
5.44
|
– 6
|
– 2
|
|||||
|
|
|||||||||
|
NM=没有意义
|
|||||||||
|
(除非另有说明,否则为百万美元) |
截至的年度 2019年12月31日 |
截至的年度 2018年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
持续运营的核心运营收入
|
14 112
|
12 557
|
12
|
17
|
|||||
|
联营公司的核心收入
|
1 086
|
1 113
|
– 2
|
– 2
|
|||||
|
核心利息支出
|
– 850
|
– 932
|
9
|
8
|
|||||
|
核心其他财务收入和支出
|
56
|
186
|
– 70
|
– 63
|
|||||
|
持续经营的核心税前收入
|
14 404
|
12 924
|
11
|
16
|
|||||
|
核心税种
|
– 2 300
|
– 2 004
|
– 15
|
– 19
|
|||||
|
持续运营的核心净收入
|
12 104
|
10 920
|
11
|
15
|
|||||
|
持续运营的核心基本每股收益(美元)
|
5.28
|
4.71
|
12
|
17
|
|||||
|
1 关于非IFRS计量和对账表的解释,请参见"项目5.A经营成果—Novartis定义的非IFRS计量。”
|
|||||||||
|
(除非另有说明,否则为百万美元) |
截至的年度 2018年12月31日 |
截至的年度 2017年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % 2 |
|||||
|
持续运营对第三方的净销售额
|
44 751
|
42 338
|
6
|
5
|
|||||
|
对停产业务的销售
|
82
|
43
|
91
|
76
|
|||||
|
持续经营的净销售额
|
44 833
|
42 381
|
6
|
5
|
|||||
|
其他收入
|
1 266
|
1 023
|
24
|
24
|
|||||
|
销货成本
|
– 14 510
|
– 13 633
|
– 6
|
– 5
|
|||||
|
持续经营毛利
|
31 589
|
29 771
|
6
|
6
|
|||||
|
销售、一般和行政管理
|
– 13 717
|
– 12 465
|
– 10
|
– 9
|
|||||
|
研发
|
– 8 489
|
– 8 389
|
– 1
|
0
|
|||||
|
其他收入
|
1 629
|
1 922
|
– 15
|
– 16
|
|||||
|
其他费用
|
– 2 609
|
– 2 137
|
– 22
|
– 21
|
|||||
|
持续经营的营业收入
|
8 403
|
8 702
|
– 3
|
– 3
|
|||||
|
净销售额回报率(%)
|
18.8
|
20.6
|
|
|
|||||
|
来自相联公司的收入
|
6 438
|
1 108
|
NM
|
NM
|
|||||
|
利息支出
|
– 932
|
– 750
|
– 24
|
– 27
|
|||||
|
其他财务收支
|
186
|
42
|
NM
|
NM
|
|||||
|
持续经营的税前收入
|
14 095
|
9 102
|
55
|
55
|
|||||
|
税费
|
– 1 295
|
– 1 603
|
19
|
19
|
|||||
|
持续经营净收益
|
12 800
|
7 499
|
71
|
71
|
|||||
|
净(亏损)/非持续经营收入
|
– 186
|
204
|
NM
|
NM
|
|||||
|
净收入
|
12 614
|
7 703
|
64
|
64
|
|||||
|
归因于:
|
|
|
|
|
|||||
|
诺华制药的股东
|
12 611
|
7 703
|
64
|
64
|
|||||
|
非控制性权益
|
3
|
0
|
NM
|
NM
|
|||||
|
持续经营基本每股收益(美元)
|
5.52
|
3.20
|
73
|
73
|
|||||
|
非持续经营的基本每股收益(美元)
|
– 0.08
|
0.08
|
NM
|
NM
|
|||||
|
每股基本收益合计(美元)
|
5.44
|
3.28
|
66
|
66
|
|||||
|
来自持续经营的经营活动现金流量净额
|
13 049
|
11 419
|
14
|
|
|||||
|
持续运营的自由现金流 2
|
11 256
|
9 791
|
15
|
|
|||||
|
1 持续经营业务包括创新药品及Sandoz部门的业务,而持续经营业务及已终止经营业务包括Alcon眼科护理设备业务及分拆前Alcon业务应占的若干企业业务,以及与分销有关的若干其他开支。见"项目18。财务报表—注1。重要会计原则",第18项财务报表—附注2。重大交易—二零一九年重大交易”及“第18项财务报表—附注30。停止运营”。
|
|||||||||
|
2 关于非IFRS计量和对账表的解释,请参见"项目5.A经营成果—Novartis定义的非IFRS计量。”
|
|||||||||
|
NM=没有意义
|
|||||||||
|
(百万美元) |
截至的年度 2018年12月31日 |
截至的年度 2017年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
创新药物
|
34 892
|
32 278
|
8
|
8
|
|||||
|
桑多兹
|
9 859
|
10 060
|
– 2
|
– 3
|
|||||
|
持续运营对第三方的净销售额
|
44 751
|
42 338
|
6
|
5
|
|||||
|
|
|||||||||
|
|
|||||||||
|
(百万美元) |
截至的年度 2018年12月31日 |
截至的年度 2017年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
诺华肿瘤业务部门合计
|
13 428
|
12 274
|
9
|
9
|
|||||
|
诺华制药业务部门合计
|
21 464
|
20 004
|
7
|
7
|
|||||
|
眼科
|
4 558
|
4 621
|
– 1
|
– 2
|
|||||
|
神经科学
|
3 429
|
3 287
|
4
|
4
|
|||||
|
免疫学、肝病学和皮肤病学
|
3 392
|
2 474
|
37
|
37
|
|||||
|
呼吸性
|
1 767
|
1 617
|
9
|
8
|
|||||
|
心血管、肾脏和代谢
|
1 050
|
524
|
100
|
100
|
|||||
|
已建立的药物
|
7 268
|
7 481
|
– 3
|
– 3
|
|||||
|
创新药物总量
|
34 892
|
32 278
|
8
|
8
|
|||||
|
|
|||||||||
|
|
|||||||||
|
|
|
我们
|
世界其他地区
|
总计
|
|||||||||||||||||
|
品牌 |
商业特许经营权 |
指示 |
百万美元 |
%
变化 美元/cc 2 |
百万美元 |
%
变化 美元 |
%
变化 抄送 2 |
百万美元 |
%
变化 美元 |
%
变化 抄送 2 |
|||||||||||
|
吉伦亚
|
神经科学
|
复发性多发性硬化症
|
1 765
|
3
|
1 576
|
7
|
5
|
3 341
|
5
|
4
|
|||||||||||
|
科森提克斯
|
免疫学、肝病学和皮肤科
|
银屑病,强直性脊柱炎 脊柱炎和 银屑病关节炎
|
1 674
|
31
|
1 163
|
46
|
44
|
2 837
|
37
|
36
|
|||||||||||
|
卢森提斯
|
眼科
|
老年性黄斑变性
|
|
|
2 046
|
8
|
7
|
2 046
|
8
|
7
|
|||||||||||
|
塔西尼亚
|
肿瘤学
|
慢性髓系白血病
|
806
|
0
|
1 068
|
4
|
3
|
1 874
|
2
|
1
|
|||||||||||
|
善得定
|
肿瘤学
|
类癌和肢端肥大症
|
817
|
– 2
|
770
|
– 1
|
– 1
|
1 587
|
– 2
|
– 2
|
|||||||||||
|
Gleevec/Glivec
|
肿瘤学
|
慢性粒细胞白血病与GIST
|
440
|
– 30
|
1 121
|
– 15
|
– 16
|
1 561
|
– 20
|
– 20
|
|||||||||||
|
Afinator/Votubia
|
肿瘤学
|
乳腺癌/TSC
|
929
|
13
|
627
|
– 11
|
– 12
|
1 556
|
2
|
2
|
|||||||||||
|
加尔沃斯集团化
|
已建立的药物
|
糖尿病
|
|
|
1 284
|
4
|
6
|
1 284
|
4
|
6
|
|||||||||||
|
Promacta/Revolade
|
肿瘤学
|
免疫性血小板减少症 (ITP)严重再生障碍 贫血(SAA)
|
581
|
30
|
593
|
41
|
40
|
1 174
|
35
|
35
|
|||||||||||
|
塔芬拉尔 + 麦金主义者
|
肿瘤学
|
BRAF V600+转移性和佐剂性黑色素瘤;晚期非小细胞肺癌
|
457
|
35
|
698
|
31
|
29
|
1 155
|
32
|
31
|
|||||||||||
|
Exjade/Jadeu
|
肿瘤学
|
慢性铁超负荷
|
521
|
1
|
578
|
6
|
5
|
1 099
|
4
|
3
|
|||||||||||
|
Xolair 1
|
呼吸性
|
重度过敏性哮喘 (SAA)和慢性 自发性荨麻疹 (CSU)
|
|
|
1 039
|
13
|
12
|
1 039
|
13
|
12
|
|||||||||||
|
Entresto
|
心血管,肾脏 和代谢
|
慢性心力衰竭
|
556
|
87
|
472
|
125
|
124
|
1 028
|
103
|
102
|
|||||||||||
|
Diovan集团化
|
已建立的药物
|
高血压
|
84
|
– 3
|
939
|
8
|
8
|
1 023
|
7
|
7
|
|||||||||||
|
Exforge集团化
|
已建立的药物
|
高血压
|
19
|
– 32
|
983
|
5
|
5
|
1 002
|
4
|
4
|
|||||||||||
|
雅卡维
|
肿瘤学
|
骨髓纤维化(MF), 单纯性红细胞增多症
|
|
|
977
|
26
|
24
|
977
|
26
|
24
|
|||||||||||
|
Votrient
|
肿瘤学
|
肾细胞癌
|
404
|
– 1
|
424
|
6
|
5
|
828
|
2
|
2
|
|||||||||||
|
伊拉里斯
|
免疫学、肝病学和皮肤科
|
自身炎症(CAPS、TRAPS、HIDS/MKD、FMF、SJIA、AOSD和痛风)
|
262
|
34
|
292
|
42
|
44
|
554
|
38
|
39
|
|||||||||||
|
曲伏前列素组
|
眼科
|
降低升高的 眼压
|
194
|
– 10
|
323
|
– 13
|
– 13
|
517
|
– 12
|
– 12
|
|||||||||||
|
佐瑞斯/认证
|
已建立的药物
|
移植
|
145
|
12
|
319
|
12
|
12
|
464
|
12
|
12
|
|||||||||||
|
前20名产品合计
|
|
|
9 654
|
11
|
17 292
|
10
|
9
|
26 946
|
10
|
10
|
|||||||||||
|
投资组合的其余部分
|
|
|
2 210
|
4
|
5 736
|
0
|
0
|
7 946
|
1
|
1
|
|||||||||||
|
部门销售总额
|
|
|
11 864
|
9
|
23 028
|
8
|
7
|
34 892
|
8
|
8
|
|||||||||||
|
1 净销售额反映Xolair所有适应症的销售额。
|
|||||||||||||||||||||
|
2 不变货币(Cc)是非《国际财务报告准则》的衡量标准。关于非国际财务报告准则计量的解释,见“--项目5.a经营成果--诺华公司定义的非国际财务报告准则计量”。
|
|||||||||||||||||||||
|
|
|||||||||||||||||||||
|
(百万美元) |
截至的年度 2018年12月31日 |
截至的年度 2017年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
零售业泛型1
|
7 880
|
8 409
|
– 6
|
– 7
|
|||||
|
生物制药
|
1 436
|
1 135
|
27
|
24
|
|||||
|
抗肿瘤药(合作伙伴标签/API)
|
543
|
516
|
5
|
3
|
|||||
|
Sandoz共计
|
9 859
|
10 060
|
– 2
|
– 3
|
|||||
|
|
|||||||||
|
1 其中8.26亿美元(2017年:8.8亿美元)是以山德士名义销售的抗感染药物
|
|||||||||
|
(百万美元) |
截至的年度 2018年12月31日 |
的百分比 净销售额 |
截至的年度 2017年12月31日 |
的百分比 净销售额 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||||
|
创新药物
|
7 871
|
22.6
|
7 595
|
23.5
|
4
|
4
|
|||||||
|
桑多兹
|
1 332
|
13.5
|
1 368
|
13.6
|
– 3
|
– 2
|
|||||||
|
公司
|
– 800
|
|
– 261
|
|
NM
|
NM
|
|||||||
|
持续经营的营业收入
|
8 403
|
18.8
|
8 702
|
20.6
|
– 3
|
– 3
|
|||||||
|
NM=没有意义
|
|||||||||||||
|
|
|||||||||||||
|
(除非另有说明,否则为百万美元) |
截至的年度 2018年12月31日 |
截至的年度 2017年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
持续经营的核心毛利
|
34 886
|
32 374
|
8
|
7
|
|||||
|
销售、一般和行政管理
|
– 13 690
|
– 12 468
|
– 10
|
– 9
|
|||||
|
研发
|
– 8 154
|
– 7 808
|
– 4
|
– 4
|
|||||
|
其他收入
|
558
|
748
|
– 25
|
– 26
|
|||||
|
其他费用
|
– 1 043
|
– 1 132
|
8
|
9
|
|||||
|
持续运营的核心运营收入
|
12 557
|
11 714
|
7
|
7
|
|||||
|
占净销售额的百分比
|
28.1
|
27.7
|
|
|
|||||
|
1 关于非IFRS计量和对账表的解释,请参见"项目5.A经营成果—Novartis定义的非IFRS计量。”
|
|||||||||
|
(百万美元) |
截至的年度 2018年12月31日 |
的百分比 净销售额 |
截至的年度 2017年12月31日 |
的百分比 净销售额 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||||
|
创新药物
|
11 151
|
32.0
|
10 019
|
31.0
|
11
|
11
|
|||||||
|
桑多兹
|
2 002
|
20.3
|
2 080
|
20.7
|
– 4
|
– 3
|
|||||||
|
公司
|
– 596
|
|
– 385
|
|
– 55
|
– 52
|
|||||||
|
持续运营的核心运营收入
|
12 557
|
28.1
|
11 714
|
27.7
|
7
|
7
|
|||||||
|
|
|||||||||||||
|
(除非另有说明,否则为百万美元) |
截至的年度 2018年12月31日 |
截至的年度 2017年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
研究和探索性开发
|
– 2 770
|
– 2 729
|
– 2
|
– 1
|
|||||
|
验证性发展
|
– 4 905
|
– 4 886
|
0
|
0
|
|||||
|
创新药物司研发费用共计
|
– 7 675
|
– 7 615
|
– 1
|
0
|
|||||
|
创新药物净销售额占第三方的百分比
|
22.0
|
23.6
|
|
|
|||||
|
核心研究和探索性开发1
|
– 2 665
|
– 2 603
|
– 2
|
– 2
|
|||||
|
核心验证性发展1
|
– 4 675
|
– 4 431
|
– 6
|
– 5
|
|||||
|
核心创新药物司研发费用共计
|
– 7 340
|
– 7 034
|
– 4
|
– 4
|
|||||
|
创新药物净销售额占第三方的百分比
|
21.0
|
21.8
|
|
|
|||||
|
|
|||||||||
|
1 核心不包括减值、摊销及若干其他项目。关于非IFRS计量和对账表的解释,请参见"—项目5.A经营成果—诺华定义的非IFRS计量。”
|
|||||||||
|
(除非另有说明,否则为百万美元) |
截至的年度 2018年12月31日 |
截至的年度 2017年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
持续经营的营业收入
|
8 403
|
8 702
|
– 3
|
– 3
|
|||||
|
来自相联公司的收入
|
6 438
|
1 108
|
NM
|
NM
|
|||||
|
利息支出
|
– 932
|
– 750
|
– 24
|
– 27
|
|||||
|
其他财务收支
|
186
|
42
|
NM
|
NM
|
|||||
|
税前收入
|
14 095
|
9 102
|
55
|
55
|
|||||
|
税费
|
– 1 295
|
– 1 603
|
19
|
19
|
|||||
|
持续经营净收益
|
12 800
|
7 499
|
71
|
71
|
|||||
|
净(亏损)/非持续经营收入
|
– 186
|
204
|
NM
|
NM
|
|||||
|
净收入
|
12 614
|
7 703
|
64
|
64
|
|||||
|
归因于:
|
|
|
|
|
|||||
|
诺华制药的股东
|
12 611
|
7 703
|
64
|
64
|
|||||
|
非控制性权益
|
3
|
0
|
NM
|
NM
|
|||||
|
持续经营基本每股收益(美元)
|
5.52
|
3.20
|
73
|
73
|
|||||
|
非持续经营的基本每股收益(美元)
|
– 0.08
|
0.08
|
NM
|
NM
|
|||||
|
每股基本收益合计(美元)
|
5.44
|
3.28
|
66
|
66
|
|||||
|
|
|||||||||
|
NM=没有意义
|
|||||||||
|
(除非另有说明,否则为百万美元) |
截至的年度 2018年12月31日 |
截至的年度 2017年12月31日 |
变化 以美元为单位 % |
更改中
常量 货币 % |
|||||
|
持续运营的核心运营收入
|
12 557
|
11 714
|
7
|
7
|
|||||
|
联营公司的核心收入
|
1 113
|
1 335
|
– 17
|
– 17
|
|||||
|
核心利息支出
|
– 932
|
– 750
|
– 24
|
– 27
|
|||||
|
核心其他财务收入和支出
|
186
|
42
|
NM
|
NM
|
|||||
|
持续经营的核心税前收入
|
12 924
|
12 341
|
5
|
5
|
|||||
|
核心税种
|
– 2 004
|
– 1 867
|
– 7
|
– 7
|
|||||
|
持续运营的核心净收入
|
10 920
|
10 474
|
4
|
4
|
|||||
|
持续运营的核心基本每股收益(美元)
|
4.71
|
4.46
|
6
|
5
|
|||||
|
|
|||||||||
|
1 关于非IFRS计量和对账表的解释,请参见"项目5.A经营成果—Novartis定义的非IFRS计量。”
|
|||||||||
|
NM=没有意义
|
|||||||||
|
(百万美元) |
2019 |
以%计
销售总额 |
2018 |
以%计
销售总额 |
2017 |
以%计
销售总额 |
|||||||
|
创新药物销售总额需扣除
|
52 956
|
100.0
|
47 785
|
100.0
|
43 127
|
100.0
|
|||||||
|
特定于美国的医疗保健计划和计划回扣
|
– 4 824
|
– 9.1
|
– 3 921
|
– 8.2
|
– 3 303
|
– 7.7
|
|||||||
|
非特定于美国的医疗计划和计划回扣
|
– 3 438
|
– 6.5
|
– 3 140
|
– 6.6
|
– 2 652
|
– 6.1
|
|||||||
|
非医疗保健计划和计划相关的回扣、退货和其他扣除
|
– 6 980
|
– 13.2
|
– 5 832
|
– 12.2
|
– 4 894
|
– 11.4
|
|||||||
|
创新药物总额对净销售额的调整
|
– 15 242
|
|
– 28.8
|
|
– 12 893
|
– 27.0
|
– 10 849
|
– 25.2
|
|||||
|
创新药物净销售额
|
37 714
|
71.2
|
34 892
|
73.0
|
32 278
|
74.8
|
|||||||
|
|
|
||||||||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
持续经营的营业收入
|
9 086
|
8 403
|
8 702
|
||||
|
财产、厂房和设备折旧
|
1 345
|
1 482
|
1 303
|
||||
|
使用权资产折旧 1
|
305
|
|
|
||||
|
无形资产摊销
|
2 836
|
2 587
|
2 624
|
||||
|
不动产、厂场和设备以及无形资产的减值
|
1 340
|
1 142
|
809
|
||||
|
来自持续运营的EBITDA 1
|
14 912
|
13 614
|
13 438
|
||||
|
非持续经营的营业收入
|
71
|
– 234
|
– 73
|
||||
|
财产、厂房和设备折旧
|
42
|
235
|
217
|
||||
|
使用权资产折旧
|
9
|
|
|
||||
|
无形资产摊销
|
174
|
1 052
|
1 066
|
||||
|
不动产、厂场和设备以及无形资产的减值
|
|
394
|
57
|
||||
|
非持续业务的EBITDA
|
296
|
1 447
|
1 267
|
||||
|
EBITDA合计 1
|
15 208
|
15 061
|
14 705
|
||||
|
|
|
|
|||||
|
1 于二零一九年,由于租赁费用分类为使用权资产折旧(3. 14亿美元,其中3. 05亿美元持续经营业务)及利息费用(6,600万美元),故于二零一九年,EBITDA因于二零一九年一月一日采纳国际财务报告准则第16号租赁而受到正面影响。于过往年度,租赁费用确认为营业收入内的功能性费用(2018年集团租赁费用为3. 83亿美元,其中3. 31亿美元来自持续经营业务,2017年3. 37亿美元来自持续经营业务,其中2. 92亿美元来自持续经营业务)。
|
|||||||
|
(百万美元
除非另有说明,否则) |
2019年12月31日 1 |
2018年12月31日 |
2017年12月31日 |
||||
|
市值
|
214 815
|
196 950
|
195 541
|
||||
|
非控制性权益
|
77
|
78
|
59
|
||||
|
非流动金融债务
|
20 353
|
22 470
|
23 224
|
||||
|
流动金融债务和衍生金融工具
|
7 031
|
9 678
|
5 308
|
||||
|
有价证券、商品、定期存款和衍生金融工具
|
– 334
|
– 2 693
|
– 625
|
||||
|
现金和现金等价物
|
– 11 112
|
– 13 271
|
– 8 860
|
||||
|
企业价值
|
230 830
|
213 212
|
214 647
|
||||
|
|
|||||||
|
1 2019年12月31日不包括爱尔康的业务,后者于2019年4月剥离为一家独立交易的公司。详情见“项目18.财务报表--附注2.重大交易”。
|
|||||||
|
创新药物
|
桑多兹
|
公司
|
集团化
|
||||||||||||||
|
(除非另有说明,否则为百万美元)
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
|||||||||
|
国际财务报告准则持续经营的营业收入
|
9 287
|
7 871
|
551
|
1 332
|
– 752
|
– 800
|
9 086
|
8 403
|
|||||||||
|
无形资产摊销
|
2 447
|
2 158
|
314
|
363
|
|
|
2 761
|
2 521
|
|||||||||
|
减值
|
|
|
|
|
|
|
|
|
|||||||||
|
无形资产
|
632
|
592
|
503
|
249
|
|
|
1 135
|
841
|
|||||||||
|
与整个集团生产基地合理化有关的财产、厂房和设备
|
83
|
170
|
69
|
63
|
|
|
152
|
233
|
|||||||||
|
其他财产、厂房和设备
|
10
|
65
|
33
|
|
|
|
43
|
65
|
|||||||||
|
总减值费用
|
725
|
827
|
605
|
312
|
|
|
1 330
|
1 139
|
|||||||||
|
收购或撤资业务及相关项目
|
|
|
|
|
|
|
|
|
|||||||||
|
- 收入
|
– 8
|
|
|
|
– 108
|
– 21
|
– 116
|
– 21
|
|||||||||
|
- 费用
|
87
|
126
|
|
|
115
|
29
|
202
|
155
|
|||||||||
|
企业及相关项目的收购或撤资总额,净额
|
79
|
126
|
|
|
7
|
8
|
86
|
134
|
|||||||||
|
其他项目
|
|
|
|
|
|
|
|
|
|||||||||
|
撤资收益
|
– 1 091
|
– 482
|
|
– 78
|
2
|
– 56
|
– 1 089
|
– 616
|
|||||||||
|
金融资产—公允价值调整
|
– 18
|
– 107
|
|
|
– 20
|
113
|
– 38
|
6
|
|||||||||
|
结构调整和有关项目
|
|
|
|
|
|
|
|
|
|||||||||
|
- 收入
|
– 58
|
– 25
|
– 7
|
– 12
|
– 6
|
– 2
|
– 71
|
– 39
|
|||||||||
|
- 费用
|
509
|
665
|
390
|
179
|
113
|
106
|
1 012
|
950
|
|||||||||
|
与法律有关的项目
|
|
|
|
|
|
|
|
|
|||||||||
|
- 收入
|
|
– 1
|
– 32
|
– 63
|
|
|
– 32
|
– 64
|
|||||||||
|
- 费用
|
999
|
36
|
156
|
90
|
|
|
1 155
|
126
|
|||||||||
|
额外收入
|
– 316
|
– 73
|
– 4
|
– 171
|
– 95
|
– 19
|
– 415
|
– 263
|
|||||||||
|
额外费用
|
87
|
156
|
121
|
50
|
119
|
54
|
327
|
260
|
|||||||||
|
其他项目合计
|
112
|
169
|
624
|
– 5
|
113
|
196
|
849
|
360
|
|||||||||
|
调整总额
|
3 363
|
3 280
|
1 543
|
670
|
120
|
204
|
5 026
|
4 154
|
|||||||||
|
持续运营的核心运营收入
|
12 650
|
11 151
|
2 094
|
2 002
|
– 632
|
– 596
|
14 112
|
12 557
|
|||||||||
|
占净销售额的百分比
|
33.5%
|
32.0%
|
21.5%
|
20.3%
|
|
|
29.7%
|
28.1%
|
|||||||||
|
来自相联公司的收入
|
1
|
1
|
2
|
5
|
656
|
6 432
|
659
|
6 438
|
|||||||||
|
对关联公司收入的核心调整,税后净额
|
|
|
|
|
427
|
– 5 325
|
427
|
– 5 325
|
|||||||||
|
利息支出
|
|
|
|
|
|
|
– 850
|
– 932
|
|||||||||
|
其他财务收支
|
|
|
|
|
|
|
45
|
186
|
|||||||||
|
对其他财务收入和支出的核心调整
|
|
|
|
|
|
|
11
|
|
|||||||||
|
按上述项目调整的税款(核心税款)
|
|
|
|
|
|
|
– 2 300
|
– 2 004
|
|||||||||
|
持续运营的核心净收入
|
|
|
|
|
|
|
12 104
|
10 920
|
|||||||||
|
非持续经营业务的核心净收入 1
|
|
|
|
|
|
|
278
|
1 018
|
|||||||||
|
核心净收入
|
|
|
|
|
|
|
12 382
|
11 938
|
|||||||||
|
诺华制药公司股东应占核心净收入
|
|
|
|
|
|
|
12 377
|
11 935
|
|||||||||
|
持续运营的核心基本每股收益(美元) 2
|
|
|
|
|
|
|
5.28
|
4.71
|
|||||||||
|
非持续运营的核心基本每股收益(美元) 2
|
|
|
|
|
|
|
0.12
|
0.44
|
|||||||||
|
核心基本每股收益(美元) 2
|
|
|
|
|
|
|
5.40
|
5.15
|
|||||||||
|
1 关于从《国际财务报告准则》到核心净收入的非连续性业务对账的详情,请参阅第109页。
|
|||||||||||||||||
|
2 每股收益(EPS)按诺华制药股东应占净收益金额计算。
|
|||||||||||||||||
|
创新药物
|
桑多兹
|
公司
|
集团化
|
||||||||||||||
|
(除非另有说明,否则为百万美元)
|
2018
|
2017
|
2018
|
2017
|
2018
|
2017
|
2018
|
2017
|
|||||||||
|
国际财务报告准则持续经营的营业收入
|
7 871
|
7 595
|
1 332
|
1 368
|
– 800
|
– 261
|
8 403
|
8 702
|
|||||||||
|
无形资产摊销
|
2 158
|
2 119
|
363
|
454
|
|
|
2 521
|
2 573
|
|||||||||
|
减值
|
|
|
|
|
|
|
|
|
|||||||||
|
无形资产
|
592
|
591
|
249
|
61
|
|
|
841
|
652
|
|||||||||
|
与整个集团生产基地合理化有关的财产、厂房和设备
|
170
|
7
|
63
|
60
|
|
|
233
|
67
|
|||||||||
|
其他财产、厂房和设备
|
65
|
77
|
|
13
|
|
|
65
|
90
|
|||||||||
|
金融资产 1
|
|
|
|
|
|
197
|
|
197
|
|||||||||
|
总减值费用
|
827
|
675
|
312
|
134
|
|
197
|
1 139
|
1 006
|
|||||||||
|
收购或撤资业务及相关项目
|
|
|
|
|
|
|
|
|
|||||||||
|
- 收入
|
|
– 2
|
|
|
– 21
|
– 115
|
– 21
|
– 117
|
|||||||||
|
- 费用
|
126
|
32
|
|
|
29
|
130
|
155
|
162
|
|||||||||
|
企业及相关项目的收购或撤资总额,净额
|
126
|
30
|
|
|
8
|
15
|
134
|
45
|
|||||||||
|
其他项目
|
|
|
|
|
|
|
|
|
|||||||||
|
撤资收益
|
– 482
|
– 368
|
– 78
|
|
– 56
|
|
– 616
|
– 368
|
|||||||||
|
金融资产—公允价值调整 1
|
– 107
|
|
|
|
113
|
|
6
|
|
|||||||||
|
结构调整和有关项目
|
|
|
|
|
|
|
|
|
|||||||||
|
- 收入
|
– 25
|
– 53
|
– 12
|
– 7
|
– 2
|
– 1
|
– 39
|
– 61
|
|||||||||
|
- 费用
|
665
|
268
|
179
|
134
|
106
|
– 9
|
950
|
393
|
|||||||||
|
与法律有关的项目
|
|
|
|
|
|
|
|
|
|||||||||
|
- 收入
|
– 1
|
– 21
|
– 63
|
|
|
|
– 64
|
– 21
|
|||||||||
|
- 费用
|
36
|
35
|
90
|
|
|
|
126
|
35
|
|||||||||
|
额外收入
|
– 73
|
– 534
|
– 171
|
– 3
|
– 19
|
– 372
|
– 263
|
– 909
|
|||||||||
|
额外费用
|
156
|
273
|
50
|
|
54
|
46
|
260
|
319
|
|||||||||
|
其他项目合计
|
169
|
– 400
|
– 5
|
124
|
196
|
– 336
|
360
|
– 612
|
|||||||||
|
调整总额
|
3 280
|
2 424
|
670
|
712
|
204
|
– 124
|
4 154
|
3 012
|
|||||||||
|
持续运营的核心运营收入
|
11 151
|
10 019
|
2 002
|
2 080
|
– 596
|
– 385
|
12 557
|
11 714
|
|||||||||
|
占净销售额的百分比
|
32.0%
|
31.0%
|
20.3%
|
20.7%
|
|
|
28.1%
|
27.7%
|
|||||||||
|
来自相联公司的收入
|
1
|
– 1
|
5
|
23
|
6 432
|
1 086
|
6 438
|
1 108
|
|||||||||
|
对来自联营公司的收入的核心调整,扣除税项
|
|
1
|
|
|
– 5 325
|
226
|
– 5 325
|
227
|
|||||||||
|
利息支出
|
|
|
|
|
|
|
– 932
|
– 750
|
|||||||||
|
其他财务收支
|
|
|
|
|
|
|
186
|
42
|
|||||||||
|
按上述项目调整的税款(核心税款)
|
|
|
|
|
|
|
– 2 004
|
– 1 867
|
|||||||||
|
持续运营的核心净收入
|
|
|
|
|
|
|
10 920
|
10 474
|
|||||||||
|
非持续经营业务的核心净收入 2
|
|
|
|
|
|
|
1 018
|
917
|
|||||||||
|
核心净收入
|
|
|
|
|
|
|
11 938
|
11 391
|
|||||||||
|
诺华制药公司股东应占核心净收入
|
|
|
|
|
|
|
11 935
|
11 391
|
|||||||||
|
持续运营的核心基本每股收益(美元) 3
|
|
|
|
|
|
|
4.71
|
4.46
|
|||||||||
|
非持续运营的核心基本每股收益(美元) 3
|
|
|
|
|
|
|
0.44
|
0.40
|
|||||||||
|
核心基本每股收益(美元) 3
|
|
|
|
|
|
|
5.15
|
4.86
|
|||||||||
|
1 就按公平值计入损益的金融工具而言,由于国际财务报告准则第9号的变动,于二零一八年一月一日,金融资产的未实现收益╱亏损于“金融资产—公平值调整”项下呈列。
|
|||||||||||||||||
|
2 有关已终止经营业务从国际财务报告准则至核心净收入对账的详情,请参阅第110页。
|
|||||||||||||||||
|
3 每股收益(EPS)按诺华制药股东应占净收益金额计算。
|
|||||||||||||||||
|
|
|||||||||||||||||
|
2019年(除非另有说明,否则为百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 3 |
其他 物品 4 |
核心成果 |
|||||||
|
持续经营毛利
|
34 252
|
2 711
|
85
|
48
|
296
|
37 392
|
|||||||
|
持续经营的营业收入
|
9 086
|
2 761
|
1 330
|
86
|
849
|
14 112
|
|||||||
|
持续经营的税前收入
|
8 940
|
3 188
|
1 330
|
86
|
860
|
14 404
|
|||||||
|
持续经营所得税款 5
|
– 1 793
|
|
|
|
|
– 2 300
|
|||||||
|
持续经营净收益
|
7 147
|
|
|
|
|
12 104
|
|||||||
|
非持续经营业务的净收益 6
|
4 590
|
|
|
|
|
278
|
|||||||
|
净收入
|
11 737
|
|
|
|
|
12 382
|
|||||||
|
来自持续经营业务的基本每股收益(美元) 7
|
3.12
|
|
|
|
|
5.28
|
|||||||
|
中断业务的基本每股收益(美元) 7
|
2.00
|
|
|
|
|
0.12
|
|||||||
|
基本每股收益(美元) 7
|
5.12
|
|
|
|
|
5.40
|
|||||||
|
|
|||||||||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
其他收入
|
1 179
|
|
|
|
– 66
|
1 113
|
|||||||
|
销货成本
|
– 14 425
|
2 711
|
85
|
48
|
362
|
– 11 219
|
|||||||
|
|
|||||||||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 14 369
|
|
|
10
|
40
|
– 14 319
|
|||||||
|
研发
|
– 9 402
|
50
|
1 078
|
10
|
– 122
|
– 8 386
|
|||||||
|
其他收入
|
2 031
|
|
– 2
|
– 116
|
– 1 418
|
495
|
|||||||
|
其他费用
|
– 3 426
|
|
169
|
134
|
2 053
|
– 1 070
|
|||||||
|
|
|||||||||||||
|
以下是达到税前核心收入的调整
|
|
|
|
|
|
|
|||||||
|
来自相联公司的收入
|
659
|
427
|
|
|
|
1 086
|
|||||||
|
其他财务收支
|
45
|
|
|
|
11
|
56
|
|||||||
|
|
|||||||||||||
|
1 无形资产摊销:销售成本包括已收购的市场产品和其他与生产相关的无形资产的摊销;研究和开发包括已收购的技术权利的摊销;来自联营公司的收入包括诺华在估计罗氏核心项目中的份额4.27亿美元
|
|||||||||||||
|
2 损伤:销售货品成本及研发成本包括与无形资产有关的减值支出;研发亦包括减值支出拨回;销售货品成本、其他收入及其他支出包括与物业、厂房及设备有关的减值支出净额
|
|||||||||||||
|
3 收购或剥离业务及相关项目,包括重组和整合费用:销售成本、销售成本、一般和行政管理成本、研发成本、其他收入和其他支出包括与收购相关的净支出;其他收入和其他支出还包括过渡服务费收入和与投资组合转型和Alcon分拆相关的支出
|
|||||||||||||
|
4 其他项目:其他收入包括来自外发许可协议的收入和与修订合作协议有关的收入;销售货物成本、其他收入和其他支出包括重组净额和与集团范围内生产基地合理化有关的其他支出;销售成本,研发成本,销售成本,一般成本和管理成本,其他收入及其他开支包括其他重组收入及支出及相关项目;销售货品成本及研发成本亦包括或然代价负债之公平值调整;销售成本还包括存货核销和其他准备金;销售、一般和管理包括应收款预期信用损失准备金和其他准备金;其他收入及其他开支包括公平值调整及金融资产及法定资产的剥离收益及亏损,相关项目以及环境准备金;其他收入还包括剥离产品和不动产、厂房和设备以及拨备释放的净收益;其他支出包括繁重合同的准备金和其他准备金;其他财务收入和支出包括通过Alcon分配产生的财务负债的重估影响,
|
|||||||||||||
|
5 国际财务报告准则与核心业绩之间的调整所产生的税项,就调整所包含的每一个别项目而言,均会考虑最终适用于该项目的税率(基于调整最终会产生税务影响的司法管辖区)。一般而言,这会导致无形资产的摊销及减值以及收购相关重组及整合项目产生全部税务影响。其他项目通常会受到税务影响,但某些司法管辖区的法律解决产生的项目并非总是如此。有关来自联营公司之收入之调整乃扣除任何相关税项影响入账。由于这些因素以及不同司法管辖区的有效税率不同,持续经营业务的55亿美元调整总额为5.07亿美元,以达到税前核心业绩。调整后的平均税率为9. 3%。
|
|||||||||||||
|
6 有关国际财务报告准则与核心净收入对账的详情,请参阅第109页。
|
|||||||||||||
|
7 每股收益(EPS)是根据诺华制药股东应占净收益计算的。
|
|||||||||||||
|
2018年(百万美元,除非另有说明) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 3 |
其他 物品 4 |
核心成果 |
|||||||
|
持续经营毛利
|
31 589
|
2 342
|
488
|
5
|
462
|
34 886
|
|||||||
|
持续经营的营业收入
|
8 403
|
2 521
|
1 139
|
134
|
360
|
12 557
|
|||||||
|
持续经营的税前收入
|
14 095
|
2 965
|
1 139
|
– 5 656
|
381
|
12 924
|
|||||||
|
持续经营所得税款 5
|
– 1 295
|
|
|
|
|
– 2 004
|
|||||||
|
持续经营净收益
|
12 800
|
|
|
|
|
10 920
|
|||||||
|
非持续经营业务的净收益 6
|
– 186
|
|
|
|
|
1 018
|
|||||||
|
净收入
|
12 614
|
|
|
|
|
11 938
|
|||||||
|
来自持续经营业务的基本每股收益(美元) 7
|
5.52
|
|
|
|
|
4.71
|
|||||||
|
中断业务的基本每股收益(美元) 7
|
– 0.08
|
|
|
|
|
0.44
|
|||||||
|
基本每股收益(美元) 7
|
5.44
|
|
|
|
|
5.15
|
|||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 14 510
|
2 342
|
488
|
5
|
462
|
– 11 213
|
|||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 13 717
|
|
|
28
|
– 1
|
– 13 690
|
|||||||
|
研发
|
– 8 489
|
179
|
167
|
23
|
– 34
|
– 8 154
|
|||||||
|
其他收入
|
1 629
|
|
|
– 21
|
– 1 050
|
558
|
|||||||
|
其他费用
|
– 2 609
|
|
484
|
99
|
983
|
– 1 043
|
|||||||
|
以下是达到税前核心收入的调整
|
|
|
|
|
|
|
|||||||
|
来自相联公司的收入
|
6 438
|
444
|
|
– 5 790
|
21
|
1 113
|
|||||||
|
1 无形资产的摊销:出售商品的成本包括对市场上产品和其他与生产相关的无形资产的已获得权利的摊销;研究和开发包括已获得权利的摊销,包括技术平台;来自关联公司的收入包括诺华在估计的罗氏核心项目中的份额4.44亿美元
|
|||||||||||||
|
2 减值:商品销售成本和研发费用包括与无形资产有关的减值费用;研发还包括财产、厂房和设备的减值冲销;其他费用包括与财产、厂房和设备有关的减值费用;售出商品成本和其他费用包括与出售集团商誉和当前销售的产品有关的减值费用
|
|||||||||||||
|
3 收购或撤资业务及相关项目,包括重组和整合费用:出售商品的成本、销售、一般和管理、研发和其他费用包括与收购相关的费用;其他收入和其他费用包括过渡服务费收入和支出,以及与投资组合转型相关的其他项目;来自关联公司的收入包括出售GSK Consumer Healthcare Holdings Ltd.36.5%的投资所产生的58亿美元的税前收益。
|
|||||||||||||
|
4 其他项目:销售商品成本、其他收入和其他支出包括与整个集团生产基地合理化有关的净重组和其他费用;销售商品成本、销售、一般和管理、研发、其他收入和其他支出包括其他重组收入和费用及相关项目;销售商品成本和其他支出包括与合同协议变更有关的费用;销售商品成本还包括库存注销和其他与产品召回有关的成本;销售、一般和管理包括拨备的冲销;研究和开发包括或有对价负债的公允价值调整和对繁重合同的收费;其他收入和其他费用包括金融资产的公允价值调整和撤资损益;其他收入还包括产品撤资收益、财产、厂房和设备的撤资收益、应计项目的释放和法律和解收益;其他费用包括与法律有关的项目和重组费用;来自关联公司的收入包括诺华在估计的葛兰素史克消费者保健控股有限公司核心项目中所占份额的2100万美元的调整。
|
|||||||||||||
|
5 国际财务报告准则与核心结果之间的调整的税收考虑到,对于调整中包括的每个单独项目,根据调整将最终产生税收影响的司法管辖区,最终适用于该项目的税率。一般来说,这会导致无形资产的摊销和减值,以及与收购相关的重组和整合项目产生全面的税务影响。通常对其他项目有税收影响,尽管在某些法域,因法律和解而产生的项目并不总是如此。与联营公司收入相关的调整在扣除任何相关税项影响后入账。由于这些因素和不同司法管辖区不同的实际税率,为实现税前核心结果而进行的12亿美元总调整的税额为7.09亿美元。不包括出售葛兰素史克Cosumer Healthcare Holdings Ltd.36.5%投资的收益,为实现税前核心业绩而进行的46亿美元调整的总税额为7700亿美元。不包括这笔交易的调整的平均税率为16.7%。
|
|||||||||||||
|
6 关于从“国际财务报告准则”到核心净收入的非连续性业务对账的详情,请参阅第110页。
|
|||||||||||||
|
7 每股收益(EPS)是根据诺华制药股东应占净收益计算的。
|
|||||||||||||
|
2017年(除非另有说明,否则为百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 3 |
其他 物品 4 |
核心成果 |
|||||||
|
毛利
|
29 771
|
2 386
|
92
|
|
125
|
32 374
|
|||||||
|
营业收入
|
8 702
|
2 573
|
1 006
|
45
|
– 612
|
11 714
|
|||||||
|
税前收入
|
9 102
|
2 949
|
1 007
|
45
|
– 762
|
12 341
|
|||||||
|
税费 5
|
– 1 603
|
|
|
|
|
– 1 867
|
|||||||
|
持续经营净收益
|
7 499
|
|
|
|
|
10 474
|
|||||||
|
非持续经营业务的净收益 6
|
204
|
|
|
|
|
917
|
|||||||
|
净收入
|
7 703
|
|
|
|
|
11 391
|
|||||||
|
来自持续经营业务的基本每股收益(美元) 7
|
3.20
|
|
|
|
|
4.46
|
|||||||
|
中断业务的基本每股收益(美元) 7
|
0.08
|
|
|
|
|
0.40
|
|||||||
|
基本每股收益(美元) 7
|
3.28
|
|
|
|
|
4.86
|
|||||||
|
|
|||||||||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 13 633
|
2 386
|
92
|
|
125
|
– 11 030
|
|||||||
|
|
|||||||||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 12 465
|
|
|
|
– 3
|
– 12 468
|
|||||||
|
研发
|
– 8 389
|
187
|
594
|
|
– 200
|
– 7 808
|
|||||||
|
其他收入
|
1 922
|
|
– 9
|
– 117
|
– 1 048
|
748
|
|||||||
|
其他费用
|
– 2 137
|
|
329
|
162
|
514
|
– 1 132
|
|||||||
|
|
|||||||||||||
|
以下是达到税前核心收入的调整
|
|
|
|
|
|
|
|||||||
|
来自相联公司的收入
|
1 108
|
376
|
1
|
|
– 150
|
1 335
|
|||||||
|
1 无形资产的摊销:出售商品的成本包括对市场产品和其他与生产相关的无形资产的已获得权利的经常性摊销;研究和开发包括对技术平台已获得权利的经常性摊销;来自关联公司的收入包括诺华在估计的罗氏核心项目中的份额3.76亿美元
|
|||||||||||||
|
2 减值:商品销售成本和研发费用包括与无形资产相关的减值费用;研发、其他收入和其他费用包括与财产、厂房和设备减值相关的冲销和费用;其他费用还包括与金融资产相关的减值费用
|
|||||||||||||
|
3 收购或撤资业务及相关项目,包括重组和整合费用:其他收入和其他费用包括过渡性服务费收入和费用,以及与投资组合转型有关的其他项目
|
|||||||||||||
|
4 其他项目:销售成本、其他收入和其他支出包括与整个集团生产基地合理化有关的净重组和其他费用;销售商品成本、研发、销售、一般和管理、其他收入和其他支出包括其他重组收入和费用及相关项目;销售、一般和管理包括拨备释放的收入;研究和开发包括对或有对价负债的公允价值调整;其他收入和其他支出包括与法律有关的项目;其他收入还包括瑞士养老金计划修正案的收益、产品和金融资产撤资收益、解决合同纠纷的收入和对或有对价销售里程碑应收款的公允价值调整;其他费用还包括合同终止费用准备金、繁重合同费用和瑞士养老金计划修正案;关联公司的收入包括诺华在估计的葛兰素史克消费者保健控股有限公司核心项目中所占份额的1.5亿美元的调整。
|
|||||||||||||
|
5 国际财务报告准则与核心结果之间的调整的税收考虑到,对于调整中包括的每个单独项目,根据调整将最终产生税收影响的司法管辖区,最终适用于该项目的税率。一般来说,这会导致无形资产的摊销和减值,以及与收购相关的重组和整合项目产生全面的税务影响。通常对其他项目有税收影响,尽管在某些法域,因法律和解而产生的项目并不总是如此。与联营公司收入相关的调整在扣除任何相关税项影响后入账。由于这些因素和不同司法管辖区不同的实际税率,为实现税前核心结果而进行的32亿美元总调整的税额为2.64亿美元。调整后的平均税率为8.2%。
|
|||||||||||||
|
6 关于从“国际财务报告准则”到核心净收入的非连续性业务对账的详情,请参阅第110页。
|
|||||||||||||
|
7 每股收益(EPS)是根据诺华制药股东应占净收益计算的。
|
|||||||||||||
|
2019 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 3 |
其他 物品 4 |
核心成果 |
|||||||
|
毛利
|
29 539
|
2 397
|
|
48
|
116
|
32 100
|
|||||||
|
营业收入
|
9 287
|
2 447
|
725
|
79
|
112
|
12 650
|
|||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
其他收入
|
1 092
|
|
|
|
– 66
|
1 026
|
|||||||
|
销货成本
|
– 10 050
|
2 397
|
|
48
|
182
|
– 7 423
|
|||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 11 617
|
|
|
10
|
25
|
– 11 582
|
|||||||
|
研发
|
– 8 152
|
50
|
632
|
10
|
– 125
|
– 7 585
|
|||||||
|
其他收入
|
1 586
|
|
– 1
|
– 8
|
– 1 230
|
347
|
|||||||
|
其他费用
|
– 2 069
|
|
94
|
19
|
1 326
|
– 630
|
|||||||
|
1 无形资产摊销:销售成本包括已取得的市场产品权利和其他与生产有关的无形资产的摊销;研究和开发包括已取得的技术权利的摊销
|
|||||||||||||
|
2 损伤:研究和开发包括与无形资产有关的减值费用和减值费用转回;其他收入和其他支出包括与不动产、厂房和设备有关的减值费用净额
|
|||||||||||||
|
3 收购或剥离业务及相关项目,包括重组和整合费用:销售成本、销售成本、一般和行政管理成本、研发成本、其他收入和其他支出包括与收购相关的净支出;其他收入和其他支出还包括过渡服务费收入和与投资组合转型和Alcon分拆相关的支出
|
|||||||||||||
|
4 其他项目:其他收入包括来自外发协议的净收入和与修订合作协议有关的收入;销售货品成本、其他收入和其他支出包括重组和与集团范围内生产基地合理化有关的其他支出;销售货品成本、研发、其他收入和其他支出包括其他重组收入和支出以及相关项目;销售、一般及行政包括其他拨备;其他收入及其他开支包括公平值调整及金融资产的出售收益及亏损;其他收入还包括剥离产品和财产、厂房和设备以及拨备释放的净收益;其他支出包括法律相关项目
|
|||||||||||||
|
2018 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 3 |
其他 物品 4 |
核心成果 |
|||||||
|
毛利
|
26 951
|
1 979
|
423
|
5
|
329
|
29 687
|
|||||||
|
营业收入
|
7 871
|
2 158
|
827
|
126
|
169
|
11 151
|
|||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 9 870
|
1 979
|
423
|
5
|
329
|
– 7 134
|
|||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 10 907
|
|
|
28
|
– 11
|
– 10 890
|
|||||||
|
研发
|
– 7 675
|
179
|
167
|
23
|
– 34
|
– 7 340
|
|||||||
|
其他收入
|
977
|
|
|
|
– 671
|
306
|
|||||||
|
其他费用
|
– 1 475
|
|
237
|
70
|
556
|
– 612
|
|||||||
|
1 无形资产摊销:出售货物的成本包括对市场产品和其他与生产有关的无形资产所获得的权利的摊销;研究和开发包括对所获得的权利的摊销,包括技术平台
|
|||||||||||||
|
2 减值:商品销售成本和研发费用包括与无形资产有关的减值费用;研发还包括财产、厂房和设备的减值冲销;其他费用包括与财产、厂房和设备有关的减值费用
|
|||||||||||||
|
3 收购或撤资业务及相关项目,包括重组和整合费用:出售货物的成本、销售、一般和行政、研发和其他费用包括与收购有关的费用;其他费用还包括与投资组合转型有关的项目
|
|||||||||||||
|
4 其他项目:销售成本和其他费用包括与整个集团生产基地合理化有关的重组和其他费用,以及与合同协议变更有关的费用;销售商品成本、研发、其他收入和其他支出包括其他重组收入和费用及相关项目;销售商品成本和研发还包括或有对价负债的公允价值调整;销售商品成本还包括存货注销;销售、一般和行政费用包括冲销拨备;研究和开发包括繁重合同的费用;其他收入和其他支出包括金融资产和法律相关项目的公允价值调整;其他收入还包括产品撤资收益和应计项目的释放。
|
|||||||||||||
|
2017 (百万美元) |
国际财务报告准则 结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 3 |
其他 物品 4 |
核心成果 |
|||||||
|
毛利
|
25 194
|
1 932
|
31
|
|
56
|
27 213
|
|||||||
|
营业收入
|
7 595
|
2 119
|
675
|
30
|
– 400
|
10 019
|
|||||||
|
|
|||||||||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 8 650
|
1 932
|
31
|
|
56
|
– 6 631
|
|||||||
|
|
|||||||||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 9 887
|
|
|
|
– 3
|
– 9 890
|
|||||||
|
研发
|
– 7 615
|
187
|
594
|
|
– 200
|
– 7 034
|
|||||||
|
其他收入
|
1 027
|
|
– 9
|
– 2
|
– 665
|
351
|
|||||||
|
其他费用
|
– 1 124
|
|
59
|
32
|
412
|
– 621
|
|||||||
|
1 无形资产摊销:销售商品成本包括对市场产品和其他与生产有关的无形资产的已获得权利的经常性摊销;研究和开发包括技术平台已获得权利的经常性摊销
|
|||||||||||||
|
2 减值:商品销售成本和研发费用包括与无形资产有关的减值费用;研发、其他收入和其他费用包括与财产、厂房和设备减值有关的冲销和费用
|
|||||||||||||
|
3 收购或撤资业务及相关项目,包括重组和整合费用:其他收入包括过渡服务费收入;其他费用包括与投资组合转型有关的项目和与收购有关的成本
|
|||||||||||||
|
4 其他项目:销售商品成本、其他收入和其他支出包括与整个集团生产基地合理化有关的净重组和其他费用;销售商品成本、研发、销售、一般和管理、其他收入和其他支出包括其他重组收入和费用及相关项目;销售、一般和管理包括拨备发布的收入;研究和开发包括对或有对价负债的公允价值调整;其他收入和其他支出包括与法律有关的项目;其他收入还包括瑞士养恤金计划修正案的收益、解决合同纠纷的收入以及产品和金融资产撤资收益;其他费用还包括合同终止费用准备金、瑞士养恤金计划修正案、繁重合同费用和其他费用。
|
|||||||||||||
|
|
|||||||||||||
|
2019 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 |
其他 物品 3 |
核心成果 |
|||||||
|
毛利
|
4 601
|
314
|
85
|
|
180
|
5 180
|
|||||||
|
营业收入
|
551
|
314
|
605
|
|
624
|
2 094
|
|||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 5 334
|
314
|
85
|
|
180
|
– 4 755
|
|||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 2 218
|
|
|
|
15
|
– 2 203
|
|||||||
|
研发
|
– 1 250
|
|
446
|
|
3
|
– 801
|
|||||||
|
其他收入
|
167
|
|
– 1
|
|
– 39
|
127
|
|||||||
|
其他费用
|
– 749
|
|
75
|
|
465
|
– 209
|
|||||||
|
1 无形资产摊销:销售成本包括已收购的市场产品权利和其他与生产有关的无形资产的摊销,
|
|||||||||||||
|
2 损伤:销售成本、研发成本包括与无形资产有关的减值支出;销售成本、其他收入和其他支出包括与物业、厂房及设备有关的减值支出净额
|
|||||||||||||
|
3 其他项目:销售货品成本及其他开支包括重组净额及与本集团范围内生产基地合理化有关的其他开支;销售货品成本、销售、一般及行政开支、其他收入及其他开支包括重组收入及开支及相关项目;销售货品成本亦包括存货核销及其他拨备;销售、一般和管理包括应收款预期信用损失准备金和其他准备金;其他收入和其他费用也包括法律相关项目;其他费用还包括环境准备金、繁重合同准备金和其他准备金,
|
|||||||||||||
|
2018 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 |
其他 物品 3 |
核心成果 |
|||||||
|
毛利
|
4 568
|
363
|
65
|
|
133
|
5 129
|
|||||||
|
营业收入
|
1 332
|
363
|
312
|
|
– 5
|
2 002
|
|||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 5 530
|
363
|
65
|
|
133
|
– 4 969
|
|||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 2 305
|
|
|
|
10
|
– 2 295
|
|||||||
|
其他收入
|
505
|
|
|
|
– 295
|
210
|
|||||||
|
其他费用
|
– 622
|
|
247
|
|
147
|
– 228
|
|||||||
|
1 无形资产摊销:销售成本包括已收购的市场产品权利和其他与生产有关的无形资产的摊销,
|
|||||||||||||
|
2 减值:销货成本包括与无形资产有关的减值费用,以及与待售处置集团有关的当前销售产品的减值费用;其他费用包括与财产、厂房和设备有关的减值费用,以及与待售处置集团有关的商誉减值费用
|
|||||||||||||
|
3 其他项目:销售货品成本、其他收入及其他开支包括重组净额及与本集团整体生产基地合理化有关的其他开支;销售货品成本亦包括存货核销及其他产品回收相关成本;销售货品成本、销售、一般及行政、其他收入及其他开支包括其他重组收入及开支及相关项目;其他收入还包括产品撤资收益、合法结算收益和或有对价负债的公允价值调整;其他支出包括法律相关项目和重组费用
|
|||||||||||||
|
2017 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 |
其他 物品 3 |
核心成果 |
|||||||
|
毛利
|
4 415
|
454
|
61
|
|
69
|
4 999
|
|||||||
|
营业收入
|
1 368
|
454
|
134
|
|
124
|
2 080
|
|||||||
|
|
|||||||||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 5 800
|
454
|
61
|
|
69
|
– 5 216
|
|||||||
|
|
|||||||||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
其他收入
|
204
|
|
|
|
– 10
|
194
|
|||||||
|
其他费用
|
– 351
|
|
73
|
|
65
|
– 213
|
|||||||
|
1 无形资产摊销:销售货物成本包括对市场上产品和其他与生产有关的无形资产的收购权利的经常性摊销,
|
|||||||||||||
|
2 损伤:销售成本包括与无形资产有关的减值费用;其他费用包括与不动产、厂房和设备有关的减值费用
|
|||||||||||||
|
3 其他项目:销售货品成本、其他收入及其他开支包括重组净额及与整个集团生产基地合理化有关的其他开支,以及其他重组收入及开支及相关项目;其他收入亦包括瑞士退休金计划修订案的收益
|
|||||||||||||
|
2019 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 |
减值 |
收购或
撤资 企业和 相关项目 1 |
其他 物品 2 |
核心成果 |
|||||||
|
毛利
|
112
|
|
|
|
|
112
|
|||||||
|
营业亏损
|
– 752
|
|
|
7
|
113
|
– 632
|
|||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
其他收入
|
278
|
|
|
– 108
|
– 149
|
21
|
|||||||
|
其他费用
|
– 608
|
|
|
115
|
262
|
– 231
|
|||||||
|
1 收购或剥离业务及相关项目,包括重组及整合费用:其他收入及其他支出包括过渡服务费收入及与投资组合转型及Alcon分拆相关的支出
|
|||||||||||||
|
2 其他项目:其他收入及其他开支包括金融资产的公允价值调整及剥离损益、重组收入及支出及相关项目,以及环境准备金
|
|||||||||||||
|
2018 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 |
减值 |
收购或
撤资 企业和 相关项目 1 |
其他 物品 2 |
核心成果 |
|||||||
|
毛利
|
70
|
|
|
|
|
70
|
|||||||
|
营业亏损
|
– 800
|
|
|
8
|
196
|
– 596
|
|||||||
|
以下是达到核心运营亏损的调整
|
|
|
|
|
|
|
|||||||
|
其他收入
|
147
|
|
|
– 21
|
– 84
|
42
|
|||||||
|
其他费用
|
– 512
|
|
|
29
|
280
|
– 203
|
|||||||
|
1 收购或撤资业务及相关项目,包括重组和整合费用:其他收入和其他费用包括过渡性服务费收入和费用,以及与投资组合转型有关的其他项目
|
|||||||||||||
|
2 其他项目:其他收入及其他支出包括金融资产的公允价值调整、剥离收益及亏损,以及重组收入及支出及相关项目;其他收入亦包括物业、厂房及设备的剥离收益
|
|||||||||||||
|
2017 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 |
减值 1 |
收购或
撤资 企业和 相关项目 2 |
其他 物品 3 |
核心成果 |
|||||||
|
毛利
|
162
|
|
|
|
|
162
|
|||||||
|
营业亏损
|
– 261
|
|
197
|
15
|
– 336
|
– 385
|
|||||||
|
|
|||||||||||||
|
以下是达到核心运营亏损的调整
|
|
|
|
|
|
|
|||||||
|
其他收入
|
691
|
|
|
– 115
|
– 373
|
203
|
|||||||
|
其他费用
|
– 662
|
|
197
|
130
|
37
|
– 298
|
|||||||
|
1 减值:其他费用包括与金融资产有关的减值费用
|
|||||||||||||
|
2 收购或撤资业务及相关项目,包括重组和整合费用:其他收入和其他费用包括过渡性服务费收入和费用,以及与投资组合转型有关的其他项目
|
|||||||||||||
|
3 其他项目:其他收入包括对或有对价销售里程碑应收账款、瑞士养老金计划修正案和其他项目的公允价值调整;其他收入和其他费用包括重组收入和费用及相关项目;其他费用还包括对瑞士养老金计划的修正案。
|
|||||||||||||
|
2019 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 |
收购或
撤资 企业和 相关项目 2 |
其他 物品 3 |
核心成果 |
|||||||
|
毛利
|
949
|
165
|
|
|
9
|
1 123
|
|||||||
|
已终止经营业务的营业收入
|
71
|
167
|
|
|
112
|
350
|
|||||||
|
已终止经营的税前收入
|
58
|
|
|
|
|
337
|
|||||||
|
税费 4
|
– 159
|
|
|
|
|
– 59
|
|||||||
|
爱尔康公司向诺华制药股东分配收益前的非持续经营净亏损/收益
|
– 101
|
|
|
|
|
278
|
|||||||
|
Alcon Inc.诺华公司股东
|
4 691
|
|
|
– 4 691
|
|
|
|||||||
|
非持续经营业务的净收益
|
4 590
|
|
|
|
|
278
|
|||||||
|
基本每股收益(美元) 5
|
2.00
|
|
|
|
|
0.12
|
|||||||
|
|
|||||||||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 860
|
165
|
|
|
9
|
– 686
|
|||||||
|
|
|||||||||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 638
|
|
|
|
14
|
– 624
|
|||||||
|
研发
|
– 142
|
2
|
|
|
4
|
– 136
|
|||||||
|
其他收入
|
15
|
|
|
|
– 3
|
12
|
|||||||
|
其他费用
|
– 113
|
|
|
|
88
|
– 25
|
|||||||
|
1 无形资产摊销:销售成本包括已取得的市场产品权利和其他与生产有关的无形资产的摊销;研究和开发包括已取得的技术权利的摊销
|
|||||||||||||
|
2 收购或剥离业务及相关项目是指与爱尔康公司(剥离)向诺华制药股东分配相关的免税、非现金收益调整
|
|||||||||||||
|
3 其他项目:销售成本、销售成本、一般及行政成本、研发成本及其他支出包括其他重组费用及相关项目;研发还包括期权权摊销及或然代价负债的公允价值调整;其他收入包括金融资产的公允价值调整;其他支出还包括法律相关项目
|
|||||||||||||
|
4 国际财务报告准则与核心结果之间的调整的税收考虑到,对于调整中包括的每个单独项目,根据调整将最终产生税收影响的司法管辖区,最终适用于该项目的税率。一般来说,这会导致无形资产的摊销和减值,以及与收购相关的重组和整合项目产生全面的税务影响。通常对其他项目有税收影响,尽管在某些法域,因法律和解而产生的项目并不总是如此。由于这些因素以及不同司法管辖区的不同实际税率,不包括Alcon Inc.向诺华制药股东分派(剥离)以实现核心税前业绩的2.79亿美元的非应税、非现金收益,总调整的税额为1亿美元。2019年的核心税率为17.5%,不包括收益对爱尔康公司向诺华制药股东分配的影响。
|
|||||||||||||
|
5 每股收益(EPS)按诺华制药股东应占净收益金额计算。
|
|||||||||||||
|
2018 (百万美元) |
国际财务报告准则结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 |
其他 物品 3 |
核心成果 |
|||||||
|
毛利
|
3 170
|
996
|
389
|
|
– 23
|
4 532
|
|||||||
|
已终止经营业务的经营亏损/收入
|
– 234
|
1 007
|
391
|
|
102
|
1 266
|
|||||||
|
已终止经营业务税前亏损/收入
|
– 260
|
|
|
|
|
1 240
|
|||||||
|
税费 4
|
74
|
|
|
|
|
– 222
|
|||||||
|
非持续经营的净亏损/净收益
|
– 186
|
|
|
|
|
1 018
|
|||||||
|
基本每股收益(美元) 5
|
– 0.08
|
|
|
|
|
0.44
|
|||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 3 983
|
996
|
389
|
|
– 23
|
– 2 621
|
|||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
销售、一般和行政管理
|
– 2 754
|
|
2
|
|
13
|
– 2 739
|
|||||||
|
研发
|
– 585
|
11
|
|
|
47
|
– 527
|
|||||||
|
其他收入
|
61
|
|
|
|
– 23
|
38
|
|||||||
|
其他费用
|
– 126
|
|
|
|
88
|
– 38
|
|||||||
|
1 无形资产摊销:销售成本包括已收购的市场产品权利和其他与生产有关的无形资产的摊销;研发包括已收购的技术平台权利的摊销
|
|||||||||||||
|
2 减值:商品销售成本和销售成本,一般和行政费用包括与无形资产有关的减值费用
|
|||||||||||||
|
3 其他项目:货品销售成本,销售成本,一般及行政成本,以及研发成本,包括与产品自愿退出市场有关的费用及费用转回;货品销售成本,一般及行政成本,研究开发成本,其他收入及其他开支亦包括其他重组收入及费用及相关项目;研究和开发还包括期权权的摊销和或有对价负债的公允价值调整;其他收入包括金融资产的公允价值调整;其他支出包括法律相关项目
|
|||||||||||||
|
4 国际财务报告准则与核心业绩之间的调整所产生的税项,就调整所包含的每一个别项目而言,均会考虑最终适用于该项目的税率(基于调整最终会产生税务影响的司法管辖区)。一般而言,这会导致无形资产的摊销及减值以及收购相关重组及整合项目产生全部税务影响。其他项目通常会受到税务影响,但某些司法管辖区的法律解决产生的项目并非总是如此。由于这些因素以及不同司法管辖区的有效税率不同,为达到税前核心业绩而进行的15亿美元的总调整所得税达2.96亿美元。2018年核心税率为17.9%。
|
|||||||||||||
|
5 每股收益(EPS)按诺华制药股东应占净收益金额计算。
|
|||||||||||||
|
2017 (百万美元) |
国际财务报告准则 结果 |
摊销 无形的 资产 1 |
减值 2 |
收购或
撤资 企业和 相关项目 |
其他 物品 3 |
核心成果 |
|||||||
|
毛利
|
3 189
|
1 015
|
|
|
|
4 204
|
|||||||
|
已终止经营业务的经营亏损/收入
|
– 73
|
1 025
|
86
|
|
98
|
1 136
|
|||||||
|
已终止经营业务税前亏损/收入
|
– 103
|
|
|
|
|
1 106
|
|||||||
|
税费 4
|
307
|
|
|
|
|
– 189
|
|||||||
|
非持续经营业务的净收益
|
204
|
|
|
|
|
917
|
|||||||
|
基本每股收益(美元) 5
|
0.08
|
|
|
|
|
0.40
|
|||||||
|
|
|||||||||||||
|
以下是为实现核心毛利而进行的调整
|
|
|
|
|
|
|
|||||||
|
销货成本
|
– 3 588
|
1 015
|
|
|
|
– 2 573
|
|||||||
|
|
|||||||||||||
|
以下是达到核心运营收入的调整
|
|
|
|
|
|
|
|||||||
|
研发
|
– 583
|
10
|
86
|
|
– 18
|
– 505
|
|||||||
|
其他收入
|
47
|
|
|
|
– 17
|
30
|
|||||||
|
其他费用
|
– 194
|
|
|
|
133
|
– 61
|
|||||||
|
1 无形资产摊销:销售商品成本包括对市场产品和其他与生产有关的无形资产的已获得权利的经常性摊销;研究和开发包括技术平台已获得权利的经常性摊销
|
|||||||||||||
|
2 减值:研究和开发包括与无形资产和金融资产有关的减值费用
|
|||||||||||||
|
3 其他项目:研发包括对或有对价负债的公允价值调整;其他收入和其他支出包括重组收入和费用以及相关项目;其他收入还包括瑞士养恤金计划修正案的收益和前期费用的部分转回;其他支出还包括法律相关项目
|
|||||||||||||
|
4 国际财务报告准则与核心业绩之间的调整所产生的税项,就调整所包含的每一个别项目而言,均会考虑最终适用于该项目的税率(基于调整最终会产生税务影响的司法管辖区)。一般而言,这会导致无形资产的摊销及减值以及收购相关重组及整合项目产生全部税务影响。其他项目通常会受到税务影响,但某些司法管辖区的法律解决产生的项目并非总是如此。由于这些因素以及不同司法管辖区的有效税率不同,为达到税前核心业绩而进行的12亿美元的总调整税额为4.96亿美元。2017年核心税率为17.1%。
|
|||||||||||||
|
5 每股收益(EPS)按诺华制药股东应占净收益金额计算。
|
|||||||||||||
|
|
|||||||||||||
5.b流动资金和资本资源
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
持续经营业务的经营活动现金流量净额
|
13 547
|
13 049
|
11 419
|
||||
|
已终止经营业务的经营活动现金流量净额
|
78
|
1 223
|
1 202
|
||||
|
用于持续业务投资活动的现金流量净额
|
– 1 067
|
– 4 590
|
– 2 344
|
||||
|
用于投资活动的非持续业务现金流量净额
|
– 1 159
|
– 1 001
|
– 775
|
||||
|
持续经营业务筹资活动所用现金流量净额
|
– 16 884
|
– 4 077
|
– 7 318
|
||||
|
来自/用于已终止经营业务融资活动的现金流量净额
|
3 257
|
– 167
|
– 415
|
||||
|
汇率变动对现金及现金等价物的影响
|
69
|
– 26
|
84
|
||||
|
现金和现金等价物净变化
|
– 2 159
|
4 411
|
1 853
|
||||
|
有价证券、商品、定期存款和衍生金融工具的变化
|
– 2 359
|
2 068
|
– 145
|
||||
|
流动及非流动金融债务及衍生金融工具变动
|
4 764
|
– 3 616
|
– 4 730
|
||||
|
净债务变动
|
246
|
2 863
|
– 3 022
|
||||
|
截至1月1日的净债务
|
– 16 184
|
– 19 047
|
– 16 025
|
||||
|
截至12月31日的净债务
|
– 15 938
|
– 16 184
|
– 19 047
|
||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
非流动金融债务
|
– 20 353
|
– 22 470
|
– 23 224
|
||||
|
流动金融债务和衍生金融工具
|
– 7 031
|
– 9 678
|
– 5 308
|
||||
|
金融债务总额
|
– 27 384
|
– 32 148
|
– 28 532
|
||||
|
流动性减少
|
|
|
|
||||
|
现金和现金等价物
|
11 112
|
13 271
|
8 860
|
||||
|
有价证券、商品、定期存款和衍生金融工具
|
334
|
2 693
|
625
|
||||
|
总流动资金
|
11 446
|
15 964
|
9 485
|
||||
|
截至12月31日的净债务
|
– 15 938
|
– 16 184
|
– 19 047
|
||||
|
2019
|
|||||||||||||
|
(百万美元) |
截止日期为 一个月 |
截止日期晚于
一个月 但不到 三个月 |
截止日期晚于
三个月 但不到 一年 |
截止日期晚于
一年 但不到 五年 |
截止日期为 五年 |
总计 |
|||||||
|
流动资产
|
|
|
|
|
|
|
|||||||
|
原到期日超过90天的有价证券、定期存款和短期投资
|
20
|
26
|
16
|
3
|
57
|
122
|
|||||||
|
商品
|
|
|
|
|
110
|
110
|
|||||||
|
衍生金融工具和应计利息
|
14
|
79
|
3
|
3
|
3
|
102
|
|||||||
|
现金和现金等价物
|
9 712
|
1 400
|
|
|
|
11 112
|
|||||||
|
流动金融资产总额
|
9 746
|
1 505
|
19
|
6
|
170
|
11 446
|
|||||||
|
|
|
|
|
|
|
||||||||
|
非流动负债
|
|
|
|
|
|
|
|||||||
|
金融债务
|
|
|
|
– 9 110
|
– 11 243
|
– 20 353
|
|||||||
|
金融债务--未贴现
|
|
|
|
– 9 150
|
– 11 355
|
– 20 505
|
|||||||
|
非流动金融债务共计
|
|
|
|
– 9 110
|
– 11 243
|
– 20 353
|
|||||||
|
|
|
|
|
|
|
||||||||
|
流动负债
|
|
|
|
|
|
|
|||||||
|
金融债务
|
– 4 243
|
– 1 373
|
– 1 230
|
|
|
– 6 846
|
|||||||
|
金融债务--未贴现
|
– 4 243
|
– 1 373
|
– 1 230
|
|
|
– 6 846
|
|||||||
|
衍生金融工具
|
– 130
|
– 29
|
– 26
|
|
|
– 185
|
|||||||
|
流动金融债务总额
|
– 4 373
|
– 1 402
|
– 1 256
|
|
|
– 7 031
|
|||||||
|
|
|
|
|
|
|
||||||||
|
净债务
|
5 373
|
103
|
– 1 237
|
– 9 104
|
– 11 073
|
– 15 938
|
|||||||
|
2018
|
|||||||||||||
|
(百万美元) |
截止日期为 一个月 |
截止日期晚于
一个月 但不到 三个月 |
截止日期晚于
三个月 但不到 一年 |
截止日期晚于
一年 但不到 五年 |
截止日期为 五年 |
总计 |
|||||||
|
流动资产
|
|
|
|
|
|
|
|||||||
|
原到期日超过90天的有价证券、定期存款和短期投资
|
39
|
56
|
2 091
|
198
|
63
|
2 447
|
|||||||
|
商品
|
|
|
|
|
104
|
104
|
|||||||
|
衍生金融工具和应计利息
|
40
|
75
|
27
|
|
|
142
|
|||||||
|
现金和现金等价物
|
3 571
|
9 700
|
|
|
|
13 271
|
|||||||
|
流动金融资产总额
|
3 650
|
9 831
|
2 118
|
198
|
167
|
15 964
|
|||||||
|
|
|
|
|
|
|
||||||||
|
非流动负债
|
|
|
|
|
|
|
|||||||
|
金融债务
|
|
|
|
– 8 980
|
– 13 490
|
– 22 470
|
|||||||
|
金融债务--未贴现
|
|
|
|
– 9 025
|
– 13 623
|
– 22 648
|
|||||||
|
非流动金融债务共计
|
|
|
|
– 8 980
|
– 13 490
|
– 22 470
|
|||||||
|
|
|
|
|
|
|
||||||||
|
流动负债
|
|
|
|
|
|
|
|||||||
|
金融债务
|
– 5 217
|
– 4 084
|
– 319
|
|
|
– 9 620
|
|||||||
|
金融债务--未贴现
|
– 5 217
|
– 4 084
|
– 319
|
|
|
– 9 620
|
|||||||
|
衍生金融工具
|
– 16
|
– 34
|
– 8
|
|
|
– 58
|
|||||||
|
流动金融债务总额
|
– 5 233
|
– 4 118
|
– 327
|
|
|
– 9 678
|
|||||||
|
|
|
|
|
|
|
||||||||
|
净债务
|
– 1 583
|
5 713
|
1 791
|
– 8 782
|
– 13 323
|
– 16 184
|
|||||||
|
流动性 % 2019 1 |
流动性 2018年百分比 1 |
流动性 2017年百分比 1 |
金融
债务(%) 2019 2 |
金融
债务(%) 2018 2 |
金融
债务(%) 2017 2 |
||||||||
|
美元
|
72
|
83
|
77
|
53
|
60
|
63
|
|||||||
|
CHF
|
14
|
7
|
5
|
12
|
10
|
11
|
|||||||
|
欧元
|
7
|
6
|
8
|
29
|
25
|
20
|
|||||||
|
日元
|
1
|
|
1
|
3
|
3
|
4
|
|||||||
|
其他
|
6
|
4
|
9
|
3
|
2
|
2
|
|||||||
|
100
|
100
|
100
|
100
|
100
|
100
|
||||||||
|
1 流动资金包括现金及现金等价物、有价证券、商品及定期存款。
|
|||||||||||||
|
2 金融债务包括非流动金融债务和流动金融债务。
|
|||||||||||||
|
2019
|
2018
|
2017
|
|||||||||||
|
货币 |
净销售额 % |
运营中
费用 % 1 |
净销售额 % |
运营中
费用 % 1 |
净销售额 % |
运营中
费用 % 1 |
|||||||
|
美元(U.S.)
|
37
|
36
|
35
|
31
|
36
|
37
|
|||||||
|
欧元(欧元)
|
28
|
26
|
29
|
27
|
28
|
24
|
|||||||
|
瑞士法郎(瑞士法郎)
|
2
|
16
|
2
|
20
|
2
|
17
|
|||||||
|
日元(JPY)
|
6
|
3
|
6
|
3
|
6
|
5
|
|||||||
|
人民币(CNY)
|
5
|
4
|
4
|
3
|
4
|
3
|
|||||||
|
加元(CAD)
|
3
|
2
|
3
|
2
|
3
|
1
|
|||||||
|
英镑(GBP)
|
2
|
2
|
2
|
2
|
2
|
2
|
|||||||
|
巴西雷亚尔(BRL)
|
2
|
1
|
2
|
1
|
2
|
1
|
|||||||
|
俄罗斯卢布(卢布)
|
2
|
1
|
2
|
1
|
2
|
1
|
|||||||
|
澳元(AUD)
|
1
|
1
|
1
|
1
|
2
|
1
|
|||||||
|
其他货币
|
12
|
8
|
14
|
9
|
13
|
8
|
|||||||
|
1 营业费用包括销售商品的成本;销售、一般和行政费用;研究和开发;其他收入和其他费用。
|
|||||||||||||
|
年平均数
|
年终
|
||||||||||||
|
单位美元
|
2019
|
2018
|
变动率%
|
2019
|
2018
|
变动率%
|
|||||||
|
澳元(AUD)
|
0.695
|
0.748
|
– 7
|
0.701
|
0.707
|
– 1
|
|||||||
|
巴西雷亚尔(BRL)
|
0.254
|
0.275
|
– 8
|
0.249
|
0.258
|
– 3
|
|||||||
|
加元(CAD)
|
0.754
|
0.772
|
– 2
|
0.767
|
0.735
|
4
|
|||||||
|
瑞士法郎(瑞士法郎)
|
1.006
|
1.023
|
– 2
|
1.032
|
1.014
|
2
|
|||||||
|
人民币(CNY)
|
0.145
|
0.151
|
– 4
|
0.144
|
0.145
|
– 1
|
|||||||
|
欧元(欧元)
|
1.120
|
1.181
|
– 5
|
1.121
|
1.144
|
– 2
|
|||||||
|
英镑(GBP)
|
1.277
|
1.336
|
– 4
|
1.313
|
1.274
|
3
|
|||||||
|
日元(JPY(100))
|
0.918
|
0.906
|
1
|
0.920
|
0.907
|
1
|
|||||||
|
俄罗斯卢布(RUB(100))
|
1.546
|
1.600
|
– 3
|
1.613
|
1.437
|
12
|
|||||||
|
年平均数
|
年终
|
||||||||||||
|
单位美元
|
2018
|
2017
|
变动率%
|
2018
|
2017
|
变动率%
|
|||||||
|
澳元(AUD)
|
0.748
|
0.766
|
– 2
|
0.707
|
0.779
|
– 9
|
|||||||
|
巴西雷亚尔(BRL)
|
0.275
|
0.313
|
– 12
|
0.258
|
0.302
|
– 15
|
|||||||
|
加元(CAD)
|
0.772
|
0.771
|
0
|
0.735
|
0.797
|
– 8
|
|||||||
|
瑞士法郎(瑞士法郎)
|
1.023
|
1.016
|
1
|
1.014
|
1.024
|
– 1
|
|||||||
|
人民币(CNY)
|
0.151
|
0.148
|
2
|
0.145
|
0.154
|
– 6
|
|||||||
|
欧元(欧元)
|
1.181
|
1.129
|
5
|
1.144
|
1.195
|
– 4
|
|||||||
|
英镑(GBP)
|
1.336
|
1.288
|
4
|
1.274
|
1.347
|
– 5
|
|||||||
|
日元(JPY(100))
|
0.906
|
0.892
|
2
|
0.907
|
0.888
|
2
|
|||||||
|
俄罗斯卢布(RUB(100))
|
1.600
|
1.715
|
– 7
|
1.437
|
1.734
|
– 17
|
|||||||
|
更改中 美元% 2019 |
更改中
常量 货币% 2019 |
百分比
点数货币 影响 2019 |
更改中 美元% 2018 |
更改中
常量 货币% 2018 |
百分比
点数货币 影响 2018 |
||||||||
|
合计组
|
|
|
|
|
|
|
|||||||
|
持续运营对第三方的净销售额
|
6
|
9
|
– 3
|
6
|
5
|
1
|
|||||||
|
持续经营的营业收入
|
8
|
14
|
– 6
|
– 3
|
– 3
|
0
|
|||||||
|
持续经营净收益
|
– 44
|
– 41
|
– 3
|
71
|
71
|
0
|
|||||||
|
持续经营基本每股收益(美元)
|
– 43
|
– 40
|
– 3
|
73
|
73
|
0
|
|||||||
|
持续运营的核心运营收入
|
12
|
17
|
– 5
|
7
|
7
|
0
|
|||||||
|
持续运营的核心净收入
|
11
|
15
|
– 4
|
4
|
4
|
0
|
|||||||
|
持续运营的核心基本每股收益(美元)
|
12
|
17
|
– 5
|
6
|
5
|
1
|
|||||||
|
|
|
|
|
|
|
||||||||
|
创新药物
|
|
|
|
|
|
|
|||||||
|
对第三方的净销售额
|
8
|
11
|
– 3
|
8
|
8
|
0
|
|||||||
|
营业收入
|
18
|
24
|
– 6
|
4
|
4
|
0
|
|||||||
|
核心营业收入
|
13
|
18
|
– 5
|
11
|
11
|
0
|
|||||||
|
|
|
|
|
|
|
||||||||
|
桑多兹
|
|
|
|
|
|
|
|||||||
|
对第三方的净销售额
|
– 1
|
2
|
– 3
|
– 2
|
– 3
|
1
|
|||||||
|
营业收入
|
– 59
|
– 53
|
– 6
|
– 3
|
– 2
|
– 1
|
|||||||
|
核心营业收入
|
5
|
10
|
– 5
|
– 4
|
– 3
|
– 1
|
|||||||
|
|
|
|
|
|
|
||||||||
|
公司
|
|
|
|
|
|
|
|||||||
|
营业亏损
|
6
|
4
|
2
|
NM
|
NM
|
NM
|
|||||||
|
铁心运行损耗
|
– 6
|
– 9
|
3
|
– 55
|
– 52
|
– 3
|
|||||||
|
|
|||||||||||||
|
NM=没有意义
|
|||||||||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
持续经营的营业收入
|
9 086
|
8 403
|
8 702
|
||||
|
对非现金项目的调整
|
|
|
|
||||
|
折旧、摊销和减值
|
5 788
|
5 217
|
4 963
|
||||
|
准备金和其他非流动负债的变化
|
1 871
|
895
|
86
|
||||
|
其他
|
– 476
|
– 229
|
– 465
|
||||
|
经非现金项目调整后的营业收入
|
16 269
|
14 286
|
13 286
|
||||
|
从联营公司及其他公司收取的股息
|
463
|
719
|
987
|
||||
|
利息及其他财务收入
|
242
|
459
|
97
|
||||
|
利息和其他财务付款
|
– 826
|
– 847
|
– 967
|
||||
|
已缴纳的税款
|
– 1 876
|
– 1 506
|
– 1 487
|
||||
|
从准备金和非流动负债中的其他净现金流动中支付
|
– 924
|
– 638
|
– 829
|
||||
|
存货和贸易应收款减去贸易应收款的变动
|
– 809
|
– 679
|
– 776
|
||||
|
其他流动资产净值和其他经营性现金流量项目变动
|
1 008
|
1 255
|
1 108
|
||||
|
来自持续经营的经营活动现金流量净额
|
13 547
|
13 049
|
11 419
|
||||
|
购置房产、厂房和设备
|
– 1 379
|
– 1 254
|
– 1 325
|
||||
|
出售财产、厂房和设备所得收益
|
857
|
102
|
91
|
||||
|
购买无形资产
|
– 878
|
– 1 394
|
– 969
|
||||
|
出售无形资产所得款项
|
973
|
823
|
640
|
||||
|
购买金融资产
|
– 302
|
– 205
|
– 354
|
||||
|
出售金融资产所得收益 1
|
176
|
165
|
328
|
||||
|
购买其他非流动资产
|
– 60
|
– 39
|
– 40
|
||||
|
出售其他非流动资产所得款项
|
3
|
9
|
1
|
||||
|
持续运营的自由现金流
|
12 937
|
11 256
|
9 791
|
||||
|
非持续经营产生的自由现金流 2
|
– 62
|
461
|
637
|
||||
|
自由现金流总额
|
12 875
|
11 717
|
10 428
|
||||
|
1 就自由现金流量而言,出售金融资产所得款项不包括出售Alcon Inc.部分的现金流入。某些合并基金会通过Alcon分拆获得的股份,金额为9.76亿美元。见"项目18。财务报表—附注2二零一九年重大交易。”
|
|||||||
|
2 2019年,终止经营业务自由现金流量为现金流出6200万美元(2018年:4.61亿美元现金流入,2017年:6.37亿美元现金流入)包括7800万美元来自已终止经营业务的经营活动净现金流入(2018年和2017年:12亿美元),12亿美元用于已终止经营的投资活动的净现金流量(2018年:10亿美元,2017年:7.75亿美元)经收购和剥离业务净现金流出3.62亿美元调整(2018年:2.39亿美元,2017年:2.10亿美元)及分拆Alcon业务应占现金流出6.57亿美元(2018年及2017年:无)。
|
|||||||
|
(百万美元)
|
2019年12月31日
|
2018年12月31日
|
变化
|
||||
|
资产
|
|
|
|
||||
|
财产、厂房和设备
|
12 069
|
15 696
|
– 3 627
|
||||
|
使用权资产
|
1 677
|
|
1 677
|
||||
|
商誉
|
26 524
|
35 294
|
– 8 770
|
||||
|
商誉以外的无形资产
|
28 787
|
38 719
|
– 9 932
|
||||
|
金融资产和其他非流动资产
|
19 809
|
20 291
|
– 482
|
||||
|
非流动资产总额
|
88 866
|
110 000
|
– 21 134
|
||||
|
盘存
|
5 982
|
6 956
|
– 974
|
||||
|
应收贸易账款
|
8 301
|
8 727
|
– 426
|
||||
|
其他流动资产及应收所得税
|
2 934
|
3 109
|
– 175
|
||||
|
现金、有价证券、商品、定期存款和衍生金融工具
|
11 446
|
15 964
|
– 4 518
|
||||
|
出售集团持有待售资产
|
841
|
807
|
34
|
||||
|
流动资产总额
|
29 504
|
35 563
|
– 6 059
|
||||
|
总资产
|
118 370
|
145 563
|
– 27 193
|
||||
|
权益和负债
|
|
|
|
||||
|
总股本
|
55 551
|
78 692
|
– 23 141
|
||||
|
金融债务
|
20 353
|
22 470
|
– 2 117
|
||||
|
租赁负债
|
1 703
|
|
1 703
|
||||
|
递延税项负债
|
5 867
|
7 475
|
– 1 608
|
||||
|
准备金和其他非流动负债
|
6 632
|
7 319
|
– 687
|
||||
|
非流动负债总额
|
34 555
|
37 264
|
– 2 709
|
||||
|
贸易应付款
|
5 424
|
5 556
|
– 132
|
||||
|
金融债务和衍生金融工具
|
7 031
|
9 678
|
– 2 647
|
||||
|
租赁负债
|
246
|
|
246
|
||||
|
准备金及其他流动负债和流动所得税责任
|
15 532
|
14 322
|
1 210
|
||||
|
出售集团持有待售资产的负债
|
31
|
51
|
– 20
|
||||
|
流动负债总额
|
28 264
|
29 607
|
– 1 343
|
||||
|
总负债
|
62 819
|
66 871
|
– 4 052
|
||||
|
权益和负债总额
|
118 370
|
145 563
|
– 27 193
|
||||
|
(百万美元)
|
2019
|
2018
|
|||
|
未逾期
|
7 763
|
7 916
|
|||
|
逾期不超过一个月
|
161
|
296
|
|||
|
逾期一个月以上三个月以下
|
123
|
194
|
|||
|
逾期三个月以上六个月以下
|
103
|
136
|
|||
|
逾期六个月以上一年以下
|
96
|
98
|
|||
|
逾期一年以上
|
150
|
213
|
|||
|
可疑贸易应收账款拨备
|
– 95
|
– 126
|
|||
|
应收贸易账款总额,净额
|
8 301
|
8 727
|
|||
|
已发行股份数(百万股)
|
诺华股份公司股东应占已发行股本和储备
|
||||||||||||
|
2019 |
2018 |
变化 |
2019
数百万美元 |
2018
数百万美元 |
变化
数百万美元 |
||||||||
|
年初余额
|
2 311.2
|
2 317.5
|
– 6.3
|
78 614
|
74 168
|
4 446
|
|||||||
|
会计政策变化的影响 1
|
|
|
|
3
|
60
|
– 57
|
|||||||
|
于1月1日重列权益
|
|
|
|
78 617
|
74 228
|
4 389
|
|||||||
|
被收购的股份将被注销
|
– 60.3
|
– 23.3
|
– 37.0
|
– 5 351
|
– 1 859
|
– 3 492
|
|||||||
|
其他股票购买
|
– 1.7
|
– 1.2
|
– 0.5
|
– 160
|
– 114
|
– 46
|
|||||||
|
行使期权和员工交易
|
5.5
|
7.8
|
– 2.3
|
210
|
434
|
– 224
|
|||||||
|
其他股份销售
|
|
3.0
|
– 3.0
|
|
263
|
– 263
|
|||||||
|
基于股权的薪酬
|
9.4
|
7.4
|
2.0
|
833
|
756
|
77
|
|||||||
|
由于Alcon分拆而交付给Alcon员工的股份
|
0.9
|
|
0.9
|
18
|
|
18
|
|||||||
|
库藏股交易税 2
|
|
|
|
– 189
|
|
– 189
|
|||||||
|
股份回购交易计划下库存股回购义务减少/(增加)
|
|
|
|
284
|
– 284
|
568
|
|||||||
|
交易成本,税后净额 3
|
|
|
|
– 253
|
– 79
|
– 174
|
|||||||
|
分红
|
|
|
|
– 6 645
|
– 6 966
|
321
|
|||||||
|
实物股息,以实现爱尔康公司的剥离。 4
|
|
|
|
– 23 434
|
|
– 23 434
|
|||||||
|
诺华股份公司股东应占年度净收入
|
|
|
|
11 732
|
12 611
|
– 879
|
|||||||
|
合并实体所有权变更的影响
|
|
|
|
– 3
|
– 13
|
10
|
|||||||
|
Novartis AG股东应占其他全面收益
|
|
|
|
– 207
|
– 401
|
194
|
|||||||
|
其他动作 5
|
|
|
|
22
|
38
|
– 16
|
|||||||
|
年终余额
|
2 265.0
|
2 311.2
|
– 46.2
|
55 474
|
78 614
|
– 23 140
|
|||||||
|
1 2019年,会计政策变更的影响包括与实施国际财务报告准则第16号租赁有关的300万美元(见“第18项。财务报表—注1。重大会计政策”)。2018年,会计政策变更的影响包括与实施IFRS 15有关的6000万美元,以及与实施IFRS 9有关的1.77亿美元。
|
|||||||||||||
|
2 2019年计入与库藏股递延税项负债重估有关的6900万美元影响。这一重估源于2019年5月颁布的瑞士联邦税制改革(见“项目18.财务报表--附注12.递延税项资产和负债”)。
|
|||||||||||||
|
3 交易成本,扣除税项3600万美元(2018年:2000万美元),直接归因于向诺华股东潜在分配(分拆)。财务报表—注1。重大会计政策”)。
|
|||||||||||||
|
4 Alcon Inc.的实物股息公允价值。在2019年2月28日举行的2019年年度股东大会上批准的诺华股份和ADR(美国存托凭证)持有人。分派于2019年4月8日生效,据此,诺华股份公司的每位股东和ADR持有人获得了一个Alcon Inc.。2019年4月8日营业结束时,每持有5股诺华股份/美国存托凭证(见“项目18。财务报表—注1。重大会计政策”)。
|
|||||||||||||
|
5 恶性通货膨胀经济体的影响(见"项目18。财务报表—注1。重大会计政策”)。
|
|||||||||||||
5.研究和开发、专利和许可证
5.D趋势信息
5.E资产负债表外安排
5.F合同义务的表格披露
|
按期间到期的付款
|
|||||||||||
|
(百万美元) |
总计 |
少于
1年 |
2-3年 |
4-5年 |
之后
5年 |
||||||
|
非流动金融债务,包括当期部分
|
22 355
|
2 002
|
4 650
|
4 460
|
11 243
|
||||||
|
非流动金融债务利息,包括当期部分
|
5 434
|
464
|
845
|
686
|
3 439
|
||||||
|
租赁负债,非流动部分和流动部分
|
1 949
|
246
|
365
|
257
|
1 081
|
||||||
|
租赁负债利息,非流动部分和流动部分
|
1 536
|
49
|
83
|
66
|
1 338
|
||||||
|
资金不足的养恤金和其他离职后福利计划
|
1 748
|
101
|
201
|
208
|
1 238
|
||||||
|
研发潜力里程碑承诺
|
4 404
|
809
|
761
|
891
|
1 943
|
||||||
|
或有对价负债
|
1 036
|
71
|
352
|
230
|
383
|
||||||
|
不动产、厂场和设备购置承付款
|
220
|
177
|
43
|
|
|
||||||
|
收购业务承诺 1
|
10 164
|
10 130
|
34
|
|
|
||||||
|
合同现金债务总额
|
48 846
|
14 049
|
7 334
|
6 798
|
20 665
|
||||||
|
1 有关收购业务承诺,请参阅“第18项。财务报表—附注2重大交易—重大待决交易"。
|
|||||||||||
项目6.董事、高级管理人员和雇员
6.董事和高级管理人员
6.B补偿
薪酬一览
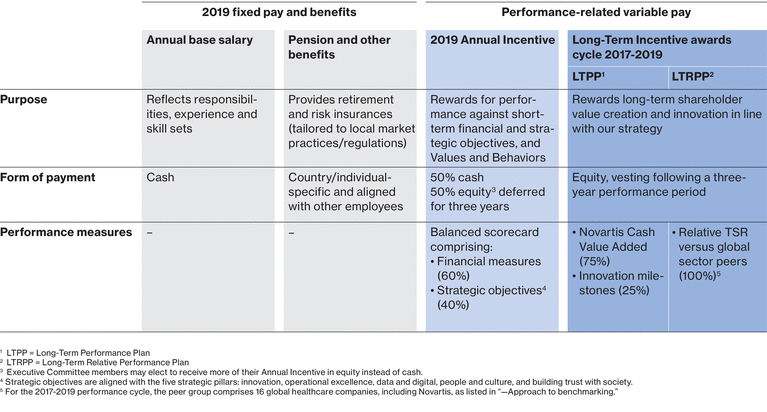
|
决定
|
决策权
|
||
|
董事会主席和其他成员的报酬
|
董事会
|
||
|
CEO薪酬
|
董事会
|
||
|
执行委员会其他成员的报酬
|
薪酬委员会
|
||
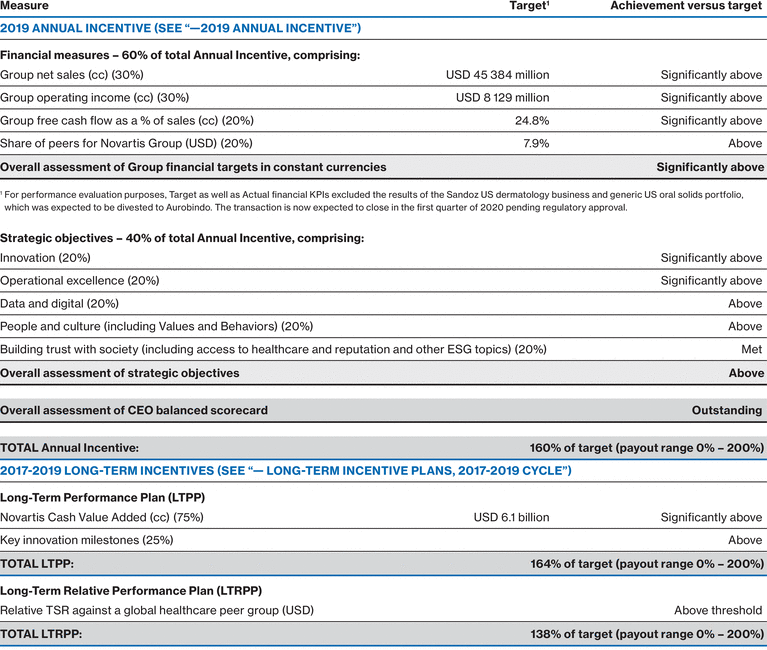
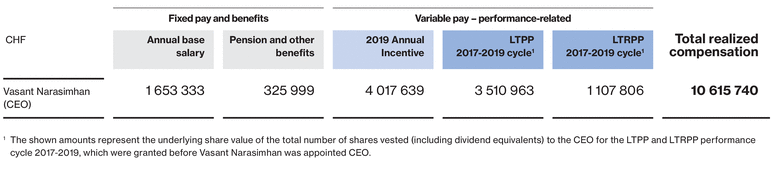
|
千瑞士法郎 |
2019-2020年度股东大会
年费 |
||
|
董事会主席
|
3 800
|
||
|
董事会成员
|
280
|
||
|
副主席
|
50
|
||
|
审计和合规委员会主席
|
130
|
||
|
薪酬委员会主席
|
90
|
||
|
以下委员会主席:
·治理、提名和企业责任委员会 ·研发委员会 ·风险委员会 |
70 |
||
|
审计和遵约委员会成员
|
70
|
||
|
下列委员会的成员:
·薪酬委员会 ·治理、提名和企业责任委员会 ·研发委员会 ·风险委员会 |
40 |
||
|
千瑞士法郎 |
2019
总薪酬 1 |
||
|
董事会主席
|
3 804
|
||
|
董事会其他12名成员
|
4 387
|
||
|
总计
|
8 191
|
||
|
1 包括诺华公司向政府社会保障体系支付的21 002瑞士法郎的强制性雇主缴款。这一数额是从雇主缴款总额413 '985瑞士法郎中扣除的,并为董事会成员提供了获得未来最高保险政府养恤金福利的权利。
|
|||
执行委员会薪酬理念和原则
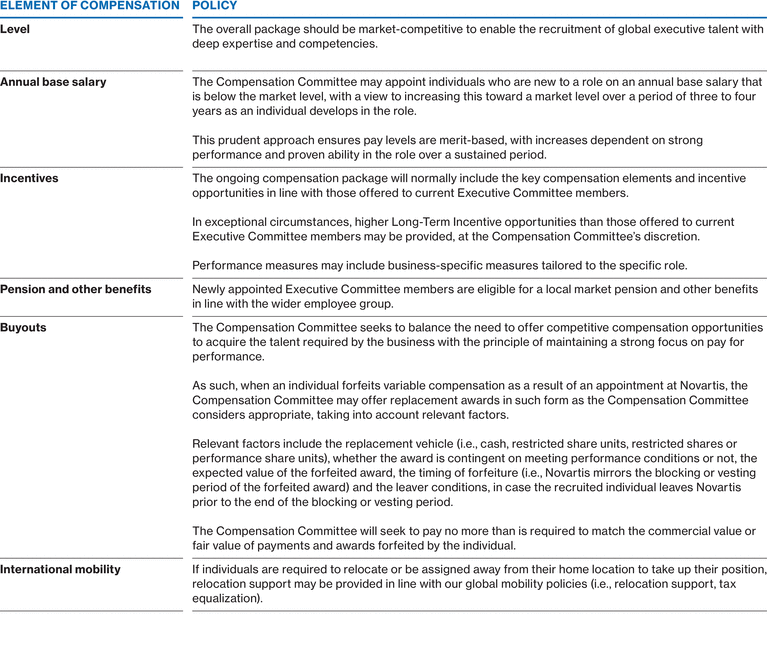
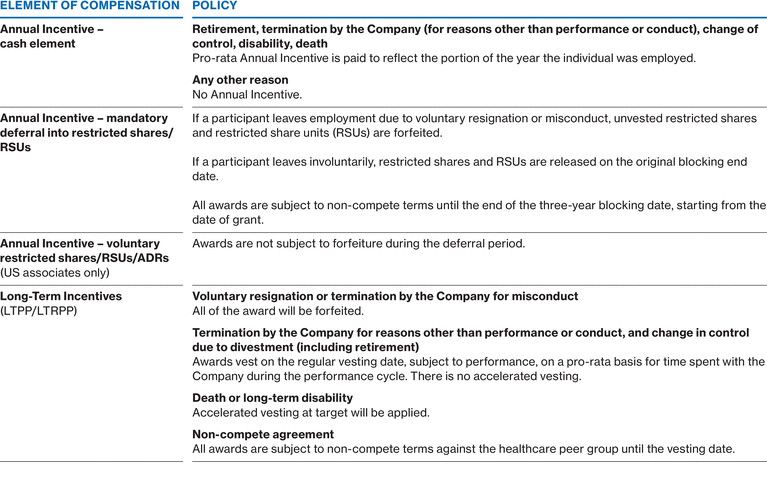

2019年执行委员会薪酬
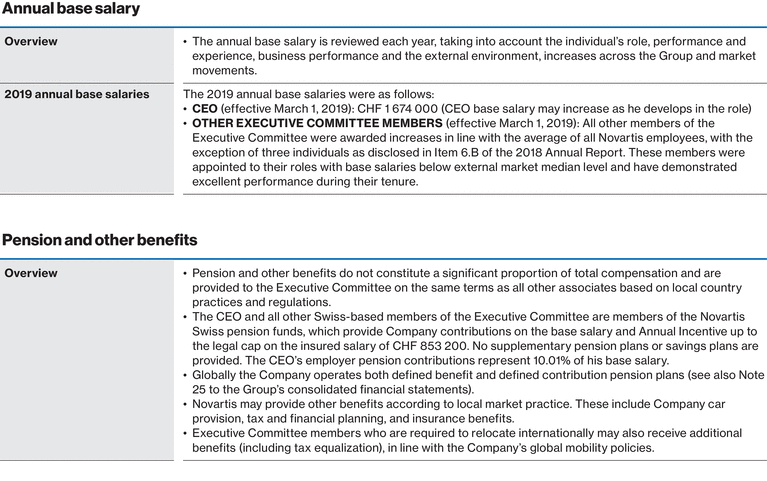
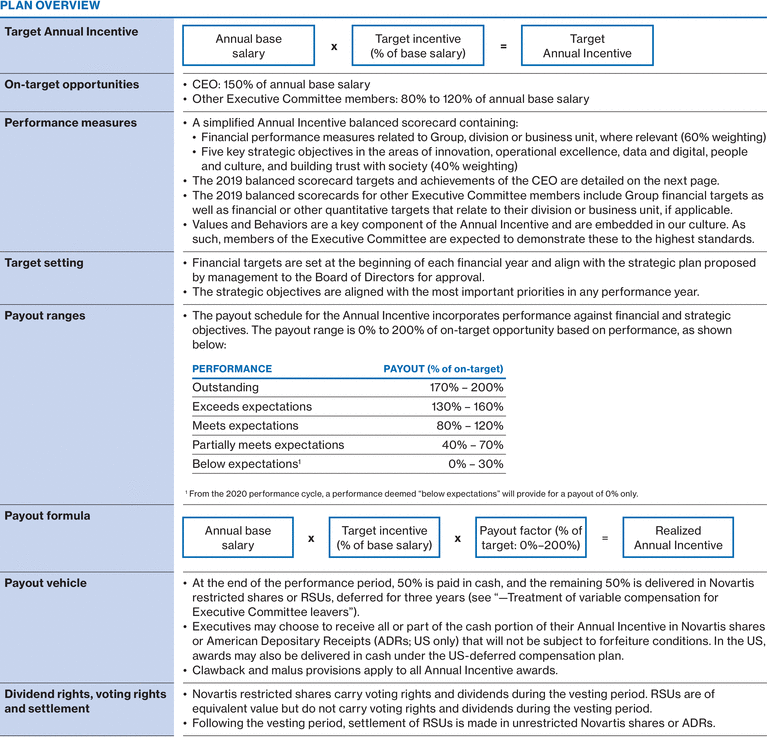
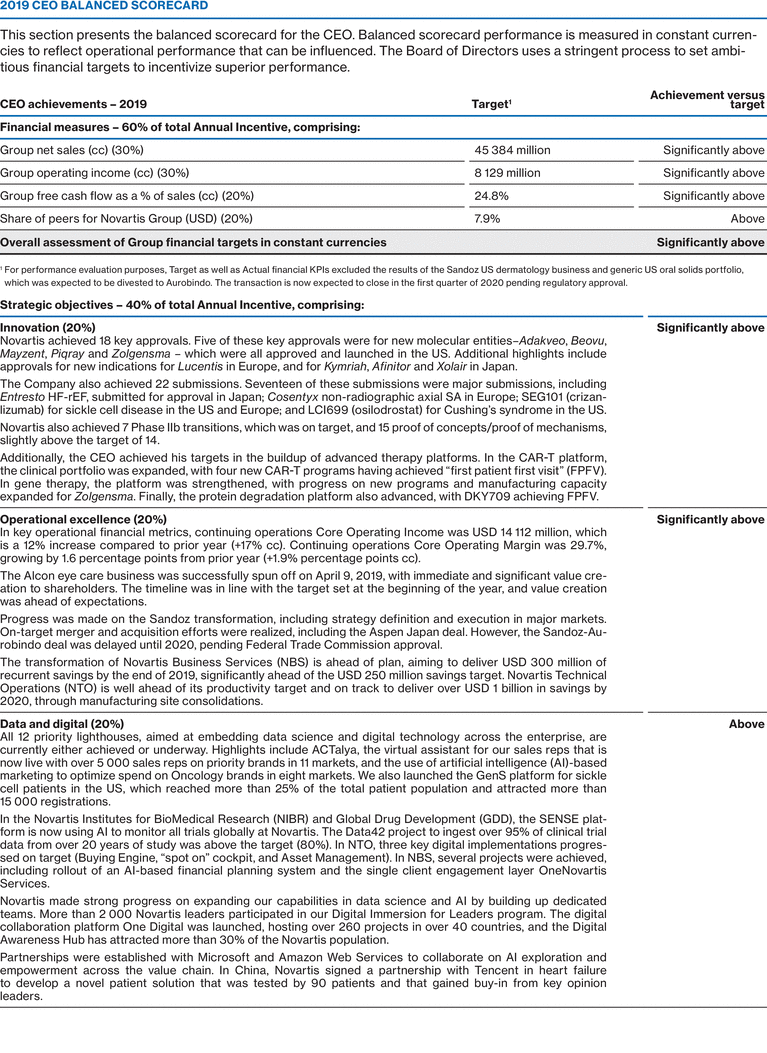

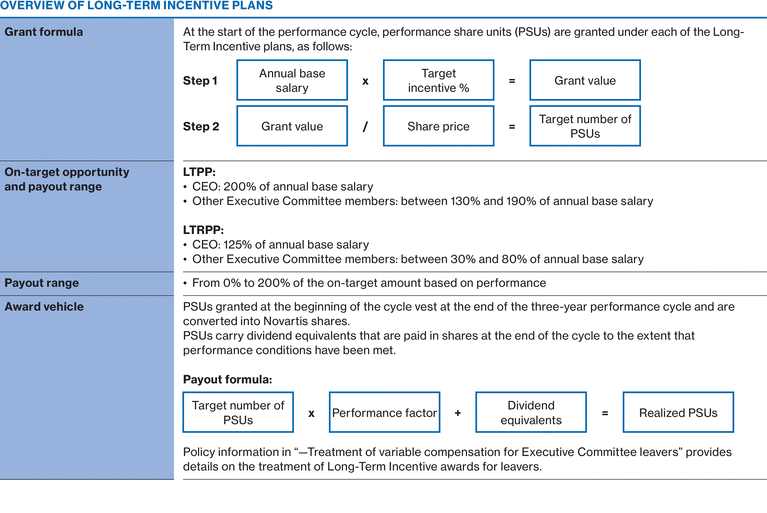

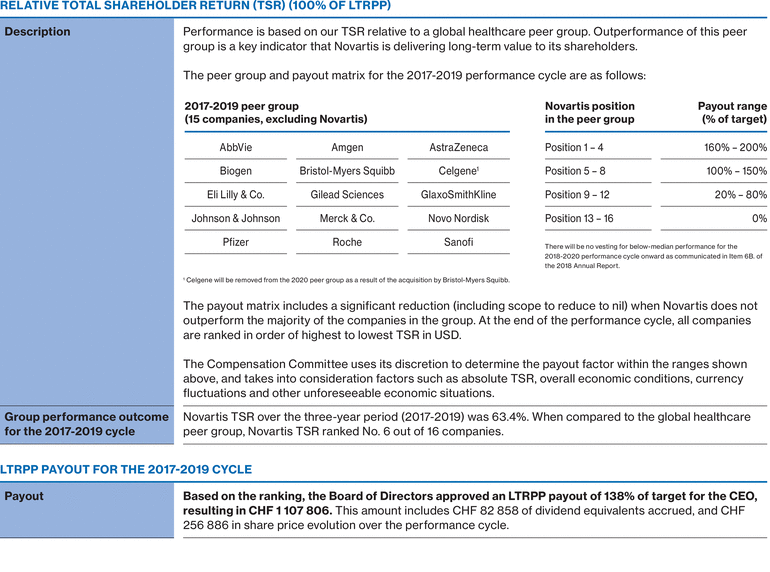
|
名字
|
任命之日
|
现金支付(瑞士法郎)
|
股权奖励
|
授予时的总价值
|
||
|
理查德·塞诺
|
2019年7月15日
|
157 087
|
1 034 803
|
1 191 890
|
||
|
首席执行官,Sandoz
|
|
|
相当于4,172个PSU和7,280个RSU,在2020—2022年期间归属
|
|
||
|
|
||||||
|
|
2019年度基薪
|
2019年养老金福利1
|
2019年度奖励
|
长期激励
|
2019年其他补偿
|
|
|||||||||||||
|
|
|
|
|
|
LTPP 2017—2019周期
|
LTRPP 2017—2019周期
|
|
|
|||||||||||
|
货币 |
现金(金额) |
金额 |
现金 |
权益2 |
价值(Value) (于归属日期)3 |
股权(价值 (于归属日期)3 |
金额2,4,5 |
已实现总收益
补偿 (包括分享 价格变动)6 |
|||||||||||
|
执行委员会成员
|
|||||||||||||||||||
|
Yu Sheng(CEO)
|
CHF
|
1 653 333
|
165 547
|
2 008 800
|
2 008 839
|
3 510 963
|
1 107 806
|
160 452
|
10 615 740
|
||||||||||
|
其他14名执行委员会成员(包括在2019财政年度辞职的两名成员)的实际薪酬总额 7, 8
|
CHF
|
9 370 547
|
2 131 905
|
5 809 455
|
7 013 842
|
17 932 704
|
6 383 700
|
7 233 594
|
55 875 748
|
||||||||||
|
总计
|
CHF
|
11 023 880
|
2 297 452
|
7 818 255
|
9 022 682
|
21 443 667
|
7 491 506
|
7 394 046
|
66 491 488
|
||||||||||
|
2018年的比较数字见“--CEO和其他执行委员会成员的2018年已实现薪酬”。
|
|||||||||||||||||||
|
1 包括诺华公司向政府社会保障体系支付的雇主强制性缴款:CEO 4'373瑞士法郎,执行委员会其他成员63'461瑞士法郎。该金额是2019年为所有执行委员会成员支付的雇主缴款总额3'923 '070瑞士法郎中的,并为执行委员会成员提供了获得未来最高保险政府养老金福利的权利。
|
|||||||||||||||||||
|
2 以股权形式交付的年度奖励部分按授予日期(2020年1月21日)每股诺华股份92. 89瑞士法郎和每股ADR 95. 19美元的收盘价四舍五入至最接近的股份。
|
|||||||||||||||||||
|
3 该金额指于2020年1月17日归属于首席执行官及其他执行委员会成员的232 '425个LTPP PSU及77'904个LTPP PSU的相关股份价值,包括三年周期的赚取股息等值(详见“—2017—2019年绩效周期LTPP和2017—2019年绩效周期LTPP”)应课税价值采用诺华董事会批准LTPP和LTRPP最终业绩因素当日的收盘股价确定(即,2020年1月21日)每股诺华股份92.89美元,每股ADR 95.19美元。Shannon Thyme Klinger、Stefan Lang、Susanne Schaffert及Marie—France Tschudin于2017—2019年业绩期间获晋升为执行委员会成员,因此,所披露的资料反映了彼等于2017—2019年LTPP及LTRPP的按比例支出。Bertrand Bodson、Klaus Moosmayer、John Tsai、Robert Weltevreden和Richard Saynor在2017年LTI颁奖后加入诺华,因此在2017—2019年的演出期间没有获得LTPP和LTRPP奖项。
|
|||||||||||||||||||
|
4 根据全球流动政策,包括任何其他津贴、实物福利、国际外派福利(例如,在退任日期后,该等权益包括住房、国际医疗保险、儿童学费、衡平税)以及LTPP及LTRP下的既得股份。
|
|||||||||||||||||||
|
5 包括5430个既得受限制股份单位2019年7月28日(502 003瑞士法郎),以代替他在离开前雇主时没收的长期利息及1323个既得受限制单位(123 092瑞士法郎)和14470个PSU(1 346 289瑞士法郎)于2019年3月24日归属给Paul Hudson,以代替他离开前雇主时没收的长期利息。PSU在2016—2018年绩效周期中采用与LTPP相同的绩效指标(NCVA和长期创新)。
|
|||||||||||||||||||
|
6 所有数额均在扣除执行委员会成员应缴的社会保障缴费和所得税之前。
|
|||||||||||||||||||
|
7 根据计划规则,包括Sandoz前首席执行官Richard Francis的薪酬,包括其2017—2019绩效周期的长期奖励。Paul Hudson之未归属股份于彼离开本公司时被没收。详情见"执行委员会成员离职"。
|
|||||||||||||||||||
|
8 以美元支付的执行委员会成员款项按1. 00美元= 0. 9938瑞士法郎的汇率换算,与本集团2019年合并财务报表所用的平均汇率相同。
|
|||||||||||||||||||
|
赠款时的PSU
|
|
归属时交付的股份
|
|||||||||||||||
|
PSU (目标数量) |
PSU (目标值 授出日期) (瑞士法郎) 2 |
支出系数 对于LTPP (目标的百分比) |
业绩股 在归属时交付 (数字) |
业绩股 在归属时交付 (归属日期的价值) (瑞士法郎) 3 |
分红 等值股份 在归属时交付 (数字) 4 |
分红
等值股份 在归属时交付 (归属日期的价值) (瑞士法郎) |
总股份数
在归属时交付 (价值在 归属日期) (瑞士法郎) |
||||||||||
|
执行委员会成员 1
|
|
|
|
|
|
|
|
|
|||||||||
|
Vasant Narasimhan
|
21 323
|
1 980 693
|
164%
|
34 970
|
3 248 363
|
2 827
|
262 600
|
3 510 963
|
|||||||||
|
其他14名执行委员会成员,包括在2019财政年度辞职的两名成员 5
|
109 616
|
10 247 244
|
164%
|
178 984
|
16 735 046
|
13 151
|
1 227 397
|
17 932 704
|
|||||||||
|
总计
|
130 939
|
12 227 938
|
|
213 954
|
19 983 409
|
15 978
|
1 489 997
|
21 443 667
|
|||||||||
|
1 Shannon Thyme Klinger、Stefan Lang、Susanne Schaffert和Marie—France Tschudin于2017—2019年业绩期间加入执行委员会。因此,所披露的资料反映了他们作为执行委员会成员期间的按比例LTPP 2017—2019支出。Bertrand Bodson、Klaus Moosmayer、John Tsai、Robert Weltevreden和Richard Saynor在2017年LTPP颁奖典礼后加入诺华,因此在2017—2019年的演出期间没有获得LTPP奖项。
|
|||||||||||||||||
|
2 所示金额代表2017—2019年业绩期间授予各执行委员会成员的PSU目标数量的基础股份价值,基于授予日期(2017年1月17日)的收盘价每股诺华股份71. 35瑞士法郎和每股ADR 71. 99美元。
|
|||||||||||||||||
|
3 所示金额代表2017—2019年业绩期间归属的目标数量PSU的相关股份价值,基于诺华董事会批准最终LTPP和LTRPP业绩支付因素当日的最后收盘股价(即,2020年1月21日)每股诺华股份92.89瑞士法郎,每股ADR 95.19美元。
|
|||||||||||||||||
|
4 股息等值股份乃根据执行委员会各成员于二零一七年至二零一九年表现期末实际交付之股份数目而收取之股息计算。在归属时,股息等价物计入股份或美国存托凭证。
|
|||||||||||||||||
|
5 根据计划规则,包括Sandoz前首席执行官Richard Francis在2017—2019年绩效周期的LTPP归属。诺华制药前首席执行官Paul Hudson的LTPP归属于2019年8月31日,他离开本公司时被没收。更多详情请参见"—LTPP绩效结果"。
|
|||||||||||||||||
|
赠款时的PSU
|
|
归属时交付的股份
|
|||||||||||||||
|
PSU (目标数量) |
PSU (目标值 授出日期) (瑞士法郎) 2 |
支出系数 对于LTRPP (目标的百分比) |
业绩股 在归属时交付 (数字) |
业绩股 在归属时交付 (归属日期的价值) (瑞士法郎) 3 |
分红 等值股份 在归属时交付 (数字) 4 |
分红
等值股份 在归属时交付 (归属日期的价值) (瑞士法郎) |
总股份数
在归属时交付 (价值在 归属日期) (瑞士法郎) |
||||||||||
|
执行委员会成员 1
|
|
|
|
|
|
|
|
|
|||||||||
|
Vasant Narasimhan
|
7 996
|
742 748
|
138%
|
11 034
|
1 024 948
|
892
|
82 858
|
1 107 806
|
|||||||||
|
其他14名执行委员会成员,包括在2019财政年度辞职的两名成员 5
|
45 858
|
4 290 344
|
138%
|
63 283
|
5 920 579
|
5 077
|
474 933
|
6 383 700
|
|||||||||
|
总计
|
53 854
|
5 033 093
|
|
74 317
|
6 945 527
|
5 969
|
557 791
|
7 491 506
|
|||||||||
|
1 Shannon Thyme Klinger、Stefan Lang、Susanne Schaffert和Marie—France Tschudin于2017—2019年业绩期间加入执行委员会。因此,所披露的资料反映彼等担任执行委员会成员期间的按比例于二零一七年至二零一九年长期发展与投资计划支出。Bertrand Bodson、Klaus Moosmayer、John Tsai、Robert Weltevreden和Richard Saynor在2017年LTRPP颁奖典礼后加入诺华,因此在2017—2019年的演出期间没有获得LTRPP奖项。
|
|||||||||||||||||
|
2 所示金额代表2017—2019年业绩期间授予各执行委员会成员的PSU目标数量的基础股份价值,基于授予日期(2017年1月17日)的收盘价每股诺华股份71. 35瑞士法郎和每股ADR 71. 99美元。
|
|||||||||||||||||
|
3 所示金额代表2017—2019年业绩期间归属的目标数量PSU的相关股份价值,基于诺华董事会批准最终LTPP和LTRPP业绩支付因素当日的最后收盘股价(即,2020年1月21日)每股诺华股份92.89瑞士法郎,每股ADR 95.19美元。
|
|||||||||||||||||
|
4 股息等值股份乃根据执行委员会各成员于二零一七年至二零一九年表现期末实际交付之股份数目而收取之股息计算。在归属时,股息等价物计入股份或美国存托凭证。
|
|||||||||||||||||
|
5 根据计划规则,包括Sandoz首席执行官2017—2019绩效周期的LTRPP归属。Paul Hudson于二零一九年八月三十一日离开本公司时,其归属的LTRPP已被没收。更多详情请参见"—LTRPP绩效结果"。
|
|||||||||||||||||
|
|
2018年年度基薪
|
2018年养老金福利1
|
2018年度奖励
|
长期激励
|
2018年其他补偿
|
||||||||||||||
|
|
|
|
|
|
LTPP 2016—2018周期
|
LTRPP 2016—2018周期
|
|
|
|||||||||||
|
货币 |
现金(金额) |
金额 |
现金 |
权益2 |
价值(Value) (于归属日期)3 |
股权(价值 (于归属日期) |
金额2,4 |
已实现总收益
补偿 (包括分享 价格变动)5 |
|||||||||||
|
执行委员会成员
|
|||||||||||||||||||
|
Vasant Narasimhan(2018年2月1日起担任CEO)
|
CHF
|
1 491 667
|
168 233
|
1 594 801
|
1 594 805
|
1 796 381
|
0
|
34 401
|
6 680 288
|
||||||||||
|
执行委员会其他16名成员的实际薪酬总额,包括2018财政年度辞职的4名成员 6, 7
|
CHF
|
9 297 021
|
1 874 671
|
5 727 765
|
5 532 316
|
24 079 974
|
0
|
13 131 653
|
59 643 400
|
||||||||||
|
总计
|
CHF
|
10 788 688
|
2 042 904 1
|
7 322 566
|
7 127 121
|
25 876 355
|
0
|
13 166 054
|
66 323 688
|
||||||||||
|
1 包括首席执行官的强制性雇主缴费4336瑞士法郎,以及诺华公司向政府社会保障系统支付的执行委员会其他成员的强制性雇主缴费78403瑞士法郎。这一数额来自2018年为执行委员会所有成员支付的2 847 422瑞士法郎的雇主缴费总额,并为执行委员会成员提供了获得未来最高保险政府养老金福利的权利。
|
|||||||||||||||||||
|
2 以股权形式交付的年度激励部分将根据授予日(2019年1月22日)的收盘价(每股诺华股票88.14瑞士法郎,每股美国存托凭证88.32美元)向上舍入到最近的股票。
|
|||||||||||||||||||
|
3 这些金额代表于2019年1月22日归属首席执行官和其他执行委员会成员的294 971个PSU在2016-2018年度业绩周期的基本股票价值,包括三年周期的赚取股息等价物。应税价值是根据诺华董事会批准最终LTPP和LTRPP业绩因数当日(即2019年1月22日)的收盘价确定的,每股诺华股票88.14瑞士法郎,每股美国存托凭证88.32美元。Vasant Narasimhan、Shannon Thyme Klinger、Stefan Lang和AndréWyss于2016-2018年期间加入执行委员会,因此,披露的信息反映了他们在担任执行委员会成员期间按比例支付的2016-2018年度LTPP股息。伊丽莎白·巴雷特、伯特兰·博德森、保罗·哈德森、克劳斯·穆斯迈尔、约翰·蔡崇信和罗伯特·韦尔特夫雷登在2016年LTPP奖颁发后加入,因此没有获得2016-2018年的LTPP奖。
|
|||||||||||||||||||
|
4 包括任何其他福利、实物福利、全球流动政策规定的国际派任福利(例如住房、国际医疗保险、子女学费、税收均衡),以及在退役日期后长期合作伙伴关系下的既得股份。
|
|||||||||||||||||||
|
5 所有数额均在扣除执行委员会成员应缴的社会保障缴费和所得税之前。
|
|||||||||||||||||||
|
6 包括即将离任的首席执行官、总法律顾问、爱尔康首席执行官和诺华瑞士业务和国家总裁的总裁的薪酬,包括根据计划规则授予他们在2016年至2018年业绩周期的长期激励。
|
|||||||||||||||||||
|
7 执行委员会成员以美元支付的金额按1.00美元=0.978瑞士法郎的汇率折算,这与集团2018年综合财务报表使用的平均汇率相同。
|
|||||||||||||||||||
|
|
固定薪酬和养恤金福利
|
可变薪酬
|
|
||||||||||||||
|
|
2019年实际支付或批准的补偿
|
2019—2021年长期激励性周期赠款达到目标
|
|
|
|||||||||||||
|
|
2019年度基薪
|
2019年养老金福利
|
2019年度奖励 (取得的业绩)
|
ltpp 2019—2021周期
|
2019年其他补偿
|
总 补偿 支付、承诺或授予2019年
|
|||||||||||
|
货币 |
现金 (金额) |
金额 1 |
现金 (金额) |
权益
(价值在 授予日期) 2 |
PSU
(目标值 授出日期) 3 |
金额 4 |
金额 5 |
||||||||||
|
执行委员会成员活跃于2019年12月31日
|
|||||||||||||||||
|
Vasant Narasimhan
|
CHF
|
1 653 333
|
165 547
|
2 008 800
|
2 008 839
|
5 440 530
|
160 452
|
11 437 501
|
|||||||||
|
史蒂文·伯特
|
CHF
|
789 750
|
161 454
|
633 360
|
633 417
|
1 662 585
|
124 979
|
4 005 545
|
|||||||||
|
贝特朗·博德森
|
CHF
|
607 500
|
170 178
|
341 040
|
341 092
|
974 476
|
137 826
|
2 572 111
|
|||||||||
|
詹姆斯·布拉德纳 6
|
美元
|
1 126 781
|
359 961
|
951 720
|
951 805
|
2 832 511
|
85 498
|
6 308 275
|
|||||||||
|
哈里·基尔希
|
CHF
|
1 053 000
|
164 467
|
1 045 044
|
1 045 105
|
2 744 591
|
27 658
|
6 079 865
|
|||||||||
|
香农百里香克林格
|
CHF
|
783 333
|
188 990
|
468 000
|
468 073
|
1 600 005
|
111 375
|
3 619 776
|
|||||||||
|
斯特芬·朗
|
CHF
|
745 000
|
167 815
|
408 000
|
612 145
|
1 200 026
|
9 810
|
3 142 796
|
|||||||||
|
克劳斯·莫斯迈尔
|
CHF
|
500 000
|
125 483
|
260 000
|
260 092
|
800 047
|
171 749
|
2 117 371
|
|||||||||
|
Richard Saynor(2019年7月15日) 7
|
CHF
|
356 021
|
87 118
|
179 315
|
179 371
|
–
|
1 950 908
|
2 752 732
|
|||||||||
|
苏珊娜·沙弗特 7
|
CHF
|
850 000
|
167 096
|
459 000
|
1 071 115
|
1 870 066
|
160 252
|
4 577 528
|
|||||||||
|
蔡俊华
|
CHF
|
858 333
|
181 048
|
602 000
|
602 020
|
2 064 063
|
377 544
|
4 685 007
|
|||||||||
|
Marie—France Tschudin(2019年6月7日起) 7
|
CHF
|
481 667
|
92 090
|
290 630
|
290 653
|
968 249
|
–
|
2 123 289
|
|||||||||
|
罗伯特·韦尔特夫雷登
|
CHF
|
607 500
|
157 423
|
158 340
|
475 132
|
974 476
|
4 860
|
2 377 731
|
|||||||||
|
小计
|
|
10 405 223
|
2 186 434
|
7 799 341
|
8 932 950
|
23 114 040
|
3 322 378
|
55 760 366
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
2019年卸任的执行委员会成员
|
|||||||||||||||||
|
Richard Francis(至2019年3月19日) 8, 9
|
CHF
|
179 315
|
36 025
|
18 914
|
37 435
|
720 460
|
3 808 445
|
4 800 594
|
|||||||||
|
Paul Hudson(至2019年6月7日) 9, 10
|
CHF
|
439 342
|
74 994
|
–
|
–
|
270 451
|
2 885 164
|
3 669 950
|
|||||||||
|
小计
|
|
618 657
|
111 018
|
18 914
|
37 435
|
990 910
|
6 693 609
|
8 470 543
|
|||||||||
|
总计
|
|
11 023 880
|
2 297 452
|
7 818 255
|
8 970 384
|
24 104 951
|
10 015 988
|
64 230 910
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
基于假设100%的支出目标。实际支出(目标的0—200%)将于二零二二年一月三年周期结束时公布。
|
|
|
|
||||
|
2018年的比较数据见下一页。
|
|||||||||||||||||
|
1 包括诺华公司向政府社会保障体系支付的雇主强制性缴款:CEO 4'373瑞士法郎,执行委员会其他成员63'461瑞士法郎。该金额是2019年为所有执行委员会成员支付的雇主缴款总额3'923 '070瑞士法郎中的,并为执行委员会成员提供了获得未来最高保险政府养老金福利的权利。
|
|||||||||||||||||
|
2 以股权形式交付的年度奖励部分按授予日期(2020年1月21日)每股诺华股份92. 89瑞士法郎和每股ADR 95. 19美元的收盘价四舍五入至最接近的股份。
|
|||||||||||||||||
|
3 这些金额代表2019-2021年业绩周期授予执行委员会成员的目标数量PSU的基本股票价值,基于授予日期(2019年1月22日)诺华股票每股88.14瑞士法郎和美国存托凭证每股88.32美元的收盘价,除Richard Saynor先生外,他在年度授予日期不是公司的一部分,因此没有获得LTPP奖励。
|
|||||||||||||||||
|
4 根据全球流动政策,包括任何其他津贴、实物福利和国际外派福利(例如,住房、国际健康保险、儿童学费、衡平征税)
|
|||||||||||||||||
|
5 所有数额均在扣除执行委员会成员应缴的社会保障缴费和所得税之前。
|
|||||||||||||||||
|
6 James Bradner的美元金额按1.00瑞士法郎=1.006美元的汇率转换,这是本集团2019年合并财务报表使用的平均汇率。
|
|||||||||||||||||
|
7 对于那些于2019年加入执行委员会的成员,“2019年实际支付或发放的报酬”和“按目标计算的2019-2021年长期奖励周期赠款”栏下的资料包括从他们加入执行委员会之日起至2019年12月31日止至业绩周期结束时按比例计算的报酬,如果是“按目标计算的2019-2021年长期奖励周期赠款”。
|
|||||||||||||||||
|
8 理查德·弗朗西斯于2019年3月19日辞去Sandoz首席执行官一职,并将根据合同通知期于2020年3月31日离开公司。在通知期结束之前,他将获得进一步的合同补偿,包括基本工资、年度奖励和养老金福利。根据计划规则,LTPP 2019-2021年周期赠款(21 217 PSU)全部包括在上表中,将根据业绩周期内诺华公司的雇佣月数按比例在正常归属日期按比例授予。这笔赠款的授予取决于在期末评估的业绩条件。
|
|||||||||||||||||
|
9 对于那些离开执行委员会的成员,“2019年实际支付或发放的报酬”和“按目标计算的2019-2021年周期赠款长期奖励”一栏反映了他们担任执行委员会成员期间按比例支付的报酬。“2019年其他报酬”一栏除其他外,包括他们从离开执行委员会之日起至2019年12月31日期间的按比例报酬,或在“按目标提供的2019-2021年长期奖励周期赠款”的情况下,直至业绩周期结束。详情见“-2019年执行委员会成员离职”。
|
|||||||||||||||||
|
10 保罗·哈德森于2019年6月7日辞去诺华制药首席执行官一职,并于2019年8月31日离开公司,这与他缩短的合同通知期一致(有关更多细节,请参阅《-2019年执行委员会成员离职》)。上表所列的2019-2021年年度奖励和长期合作伙伴计划周期补助金(31 553个PSU)在他离职后被全部没收。
|
|||||||||||||||||
|
|
|||||||||||||||||
|
|
|||||||||||||||||
|
|
|||||||||||||||||
|
|
固定薪酬和养恤金福利
|
可变薪酬
|
|
|
||||||||||||||||
|
|
2018年实际支付或发放的赔偿金
|
2018-2020年目标周期赠款长期激励
|
|
|
||||||||||||||||
|
|
2018年年度基本工资
|
2018年养老金福利
|
2018年度激励(绩效达标)
|
LTPP 2018-2020周期
|
LTRPP 2018-2020周期
|
2018年其他薪酬
|
2018年已支付、承诺或授予的补偿总额
|
|||||||||||||
|
货币 |
现金 (金额) |
金额 1 |
现金 (金额) |
权益
(价值在 授予日期) 2 |
PSU
(目标值 授出日期) 3 |
PSU
(目标值 授出日期) 3 |
金额 4 |
金额 5 |
||||||||||||
|
执行委员会成员活跃于2018年12月31日
|
||||||||||||||||||||
|
Vasant Narasimhan(2018年2月1日起担任CEO) 6
|
CHF
|
1 491 667
|
168 233
|
1 594 801
|
1 594 805
|
3 100 046
|
1 937 539
|
34 401
|
9 921 491
|
|||||||||||
|
史蒂文·伯特
|
CHF
|
780 000
|
152 914
|
585 000
|
585 073
|
1 170 051
|
468 053
|
77 550
|
3 818 642
|
|||||||||||
|
Elizabeth Barrett(2018年2月1日至2018年12月31日) 7
|
CHF
|
779 167
|
174 274
|
0
|
0
|
1 360 040
|
510 057
|
2 747 859
|
5 571 397
|
|||||||||||
|
Bertrand Bodson(2018年4月1日起) 8
|
CHF
|
450 000
|
97 666
|
216 986
|
217 001
|
440 614
|
110 174
|
146 478
|
1 678 918
|
|||||||||||
|
詹姆斯·布拉德纳 9
|
美元
|
1 094 462
|
257 018
|
924 000
|
924 004
|
1 870 085
|
880 086
|
63 313
|
6 012 967
|
|||||||||||
|
理查德·弗朗西斯
|
CHF
|
850 000
|
176 368
|
382 500
|
382 528
|
1 360 057
|
510 001
|
1 790 428
|
5 451 882
|
|||||||||||
|
保罗·哈德森
|
CHF
|
985 000
|
180 771
|
1 007 325
|
1 007 352
|
1 683 036
|
792 027
|
94 355
|
5 749 866
|
|||||||||||
|
哈里·基尔希
|
CHF
|
1 040 000
|
173 499
|
858 000
|
858 043
|
1 768 008
|
832 067
|
58 814
|
5 588 431
|
|||||||||||
|
Shannon Thyme Klinger(2018年4月1日起) 8
|
CHF
|
520 833
|
103 448
|
275 770
|
275 790
|
619 595
|
185 862
|
37 118
|
2 018 416
|
|||||||||||
|
Steffen Lang(2018年4月1日起) 8
|
CHF
|
540 000
|
99 535
|
260 384
|
260 454
|
596 631
|
179 064
|
8 595
|
1 944 663
|
|||||||||||
|
Klaus Moosmayer(2018年12月1日起)
|
CHF
|
41 667
|
9 704
|
16 986
|
17 011
|
0
|
0
|
808 821
|
894 189
|
|||||||||||
|
John Tsai(2018年5月1日起)
|
CHF
|
566 667
|
126 845
|
313 801
|
313 867
|
0
|
0
|
4 590 950
|
5 912 129
|
|||||||||||
|
Robert Weltevreden(2018年6月1日起)
|
CHF
|
350 000
|
70 950
|
77 392
|
232 337
|
671 702
|
155 003
|
3 715
|
1 561 099
|
|||||||||||
|
小计
|
|
9 464 855
|
1 785 446
|
6 492 171
|
6 647 490
|
14 597 819
|
6 540 145
|
10 460 974
|
55 988 900
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
2018年卸任的执行委员会成员 10
|
||||||||||||||||||||
|
Joseph Jimenez(CEO至2018年1月31日)
|
CHF
|
178 601
|
19 146
|
133 767
|
0
|
0
|
0
|
2 357 371
|
2 688 885
|
|||||||||||
|
F.迈克尔·鲍尔(至2018年6月30日) 9
|
美元
|
555 397
|
|
126 594
|
|
333 238
|
|
333 231
|
|
888 640
|
|
388 845
|
2 970 642
|
5 596 587
|
||||||
|
费利克斯河Ehrat(至2018年5月31日)
|
CHF
|
384 740
|
|
68 918
|
|
153 896
|
|
153 892
|
|
654 081
|
|
230 877
|
2 346 072
|
3 992 477
|
||||||
|
André Wéré(至2018年3月31日) 11
|
CHF
|
217 582
|
45 646
|
216 986
|
0
|
116 060
|
43 523
|
1 375 802
|
2 015 599
|
|||||||||||
|
小计
|
|
1 323 833
|
257 458
|
830 395
|
479 632
|
1 638 802
|
654 503
|
8 983 098
|
14 167 721
|
|||||||||||
|
总计
|
|
10 788 688
|
2 042 904
|
7 322 566
|
7 127 122
|
16 236 621
|
7 194 648
|
19 444 072
|
70 156 621
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
基于假设100%的支出目标。实际支出(目标的0—200%)将于二零二一年一月三年周期结束时公布。
|
|
|
|
|
|
||||
|
1 包括首席执行官的强制性雇主缴费4336瑞士法郎,以及诺华公司向政府社会保障系统支付的执行委员会其他成员的强制性雇主缴费78403瑞士法郎。这一数额来自2018年为执行委员会所有成员支付的2 847 422瑞士法郎的雇主缴费总额,并为执行委员会成员提供了获得未来最高保险政府养老金福利的权利。
|
||||||||||||||||||||
|
2 以股权形式交付的年度激励部分将根据授予日(2019年1月22日)的收盘价(每股诺华股票88.14瑞士法郎,每股美国存托凭证88.32美元)向上舍入到最近的股票。
|
||||||||||||||||||||
|
3 该金额代表2018—2020年业绩周期授予执行委员会成员的PSU目标数量的基础股份价值,基于授予日期(2018年1月18日)的收盘股价每股诺华股份82. 90瑞士法郎和每股ADR 86. 41美元(除Elizabeth Barrett和Robert Weltevreden外)。对于Barrett女士和Weltevreden先生,授予日期的收盘价分别为每股诺华股份于2018年2月1日83.52瑞士法郎和2018年6月1日74.70瑞士法郎。
|
||||||||||||||||||||
|
4 根据全球流动政策,包括任何其他津贴、实物福利和国际外派福利(例如,住房、国际健康保险、儿童学费、衡平征税)
|
||||||||||||||||||||
|
5 所有数额均在扣除执行委员会成员应缴的社会保障缴费和所得税之前。
|
||||||||||||||||||||
|
6 这些数据包括Vasant Narasimhan 2018年1月作为全球药物开发负责人的薪酬。
|
||||||||||||||||||||
|
7 Elizabeth Barrett于2018年营业年度结束时辞去诺华肿瘤学首席执行官的职务和执行委员会的职务。2018—2020年表现周期的LTPP及LTRP补助金(分别为16284及6107个PSU),以及2018年21267股表现股份的买断奖励(反映在其他补偿中),均载于上表,已于2018年12月31日离职时全数没收。
|
||||||||||||||||||||
|
8 对于于2018年加入执行委员会的成员,“2018年年度基本工资”、“2018年退休金福利”、“2018年年度奖励”、“LTPP”及“LTPP”栏下的资料包括他们自加入执行委员会之日起至2018年12月31日的按比例薪酬。
|
||||||||||||||||||||
|
9 美元为F。Michael Ball和James Bradner的汇率为1.00瑞士法郎= 0.978美元,与集团2018年合并财务报表中使用的平均汇率相同。
|
||||||||||||||||||||
|
10 对于于2018年离开执行委员会的成员,“2018年年度基本工资”、“2018年退休金福利”、“2018年年度奖励”、“LTPP”和“LTPP”栏下的信息反映了他们于2018年担任执行委员会成员期间的按比例薪酬。“其他2018年薪酬”一栏下的信息还包括,除其他外,他们从执行委员会卸任之日起至2018年12月31日的按比例薪酬。
|
||||||||||||||||||||
|
11 根据《2018—2020年长期发展计划》和《2018—2020年长期发展计划》,授予André Wendel的永久发展计划总数分别为16985个和6370个。上表所列长期保护计划及长期保护计划下的金额乃按比例披露至其通知期结束时(即,2018年9月30日),根据他的合同协议并受计划规则的约束。
|
||||||||||||||||||||
|
可变薪酬1
|
|||||||
|
2019年度奖励(取得的业绩)
|
LTPP 2019—2021周期
|
其他
|
|||||
|
权益
(数字) 2 |
PSU
(目标数量) 3 |
权益/PSU
(数字) |
|||||
|
执行委员会成员活跃于2019年12月31日
|
|||||||
|
Vasant Narasimhan
|
21 626
|
61 726
|
0
|
||||
|
史蒂文·伯特
|
6 819
|
18 863
|
0
|
||||
|
贝特朗·博德森
|
3 672
|
11 056
|
0
|
||||
|
詹姆斯·布拉德纳
|
9 999
|
32 071
|
0
|
||||
|
哈里·基尔希
|
11 251
|
31 139
|
0
|
||||
|
香农百里香克林格
|
5 039
|
18 153
|
0
|
||||
|
斯特芬·朗
|
6 590
|
13 615
|
0
|
||||
|
克劳斯·莫斯迈尔
|
2 800
|
9 077
|
0
|
||||
|
Richard Saynor(2019年7月15日) 4
|
1 931
|
0
|
11 452
|
||||
|
苏珊娜·沙弗特
|
11 531
|
21 217
|
0
|
||||
|
蔡俊华
|
6 481
|
23 418
|
0
|
||||
|
Marie—France Tschudin(2019年6月7日起) 4
|
3 129
|
11 085
|
0
|
||||
|
罗伯特·韦尔特夫雷登
|
5 115
|
11 056
|
0
|
||||
|
小计
|
95 983
|
262 476
|
11 452
|
||||
|
|
|
|
|||||
|
2019年卸任的执行委员会成员
|
|||||||
|
Richard Francis(至2019年3月19日) 5, 6
|
403
|
8 841
|
0
|
||||
|
Paul Hudson(至2019年6月7日) 5, 7
|
0
|
4 525
|
0
|
||||
|
小计
|
403
|
13 366
|
0
|
||||
|
总计
|
96 386
|
275 842
|
11 452
|
||||
|
2018年的比较数据见下一页。
|
|||||||
|
1 奖励价值载于表“首席执行官及其他执行委员会成员按授出价值计算的2019年薪酬”。”
|
|||||||
|
2 2019年业绩期间根据年度奖励授出的既得股份、受限制股份及╱或受限制股份单位
|
|||||||
|
3 2019—2021年绩效周期,根据长期保障计划授予的PSU目标数目(适用于2019—2021年)
|
|||||||
|
4 对于于2019年加入执行委员会的成员,“可变薪酬”一栏下的资料包括自彼等加入执行委员会之日起至2019年12月31日止,或如属“LTPP 2019—2021周期”,则至业绩周期结束时按比例持有的权益工具数目。
|
|||||||
|
5 对于离开执行委员会的成员,"可变薪酬"一栏反映了其担任执行委员会成员期间按比例持有的股权工具数量。“其他”一栏包括从他们离开执行委员会之日起至2019年12月31日或“LTPP 2019—2021周期”至绩效周期结束的按比例薪酬。详见《—2019执委会委员离任情况》。
|
|||||||
|
6 Richard Francis于2019年3月19日辞去Sandoz首席执行官一职,并将于2020年3月31日根据合同通知期离开公司。根据计划规则,LTPP 2019—2021年周期授出(21217个PSU)(全部列于上表)将于正常归属日期根据诺华在业绩周期内的雇用月数按比例归属。该补助金的归属须受期末评估的表现条件所规限。
|
|||||||
|
7 Paul Hudson于2019年6月7日辞去诺华制药首席执行官一职,并于2019年8月31日根据缩短的合同通知期离开公司(更多详情请参见“—2019执行委员会成员离职”)。上表所载2019年度奖励及LTPP 2019—2021周期补助金(31 553个总补助金)已于彼离职时全数没收。
|
|||||||
|
|
|||||||
|
|
|||||||
|
可变薪酬1
|
|||||||||
|
2018年度奖励(业绩)
|
LTPP 2018—2020周期
|
LTRPP 2018—2020周期
|
其他
|
||||||
|
权益
(数字) 2 |
PSU
(目标数量) 3 |
PSU
(目标数量) 3 |
权益/PSU
(数字) |
||||||
|
执行委员会成员活跃于2018年12月31日
|
|||||||||
|
Vasant Narasimhan(2018年2月1日起担任CEO)
|
18 094
|
37 395
|
23 372
|
0
|
|||||
|
史蒂文·伯特
|
6 638
|
14 114
|
5 646
|
0
|
|||||
|
Elizabeth Barrett(2018年2月1日至2018年12月31日) 4
|
0
|
16 284
|
6 107
|
21 267
|
|||||
|
Bertrand Bodson(2018年4月1日起)
|
2 462
|
5 315
|
1 329
|
0
|
|||||
|
詹姆斯·布拉德纳
|
10 462
|
21 642
|
10 185
|
0
|
|||||
|
理查德·弗朗西斯
|
4 340
|
16 406
|
6 152
|
0
|
|||||
|
保罗·哈德森
|
11 429
|
20 302
|
9 554
|
0
|
|||||
|
哈里·基尔希
|
9 735
|
21 327
|
10 037
|
0
|
|||||
|
Shannon Thyme Klinger(2018年4月1日起)
|
3 129
|
7 474
|
2 242
|
0
|
|||||
|
Steffen Lang(2018年4月1日起)
|
2 955
|
7 197
|
2 160
|
0
|
|||||
|
Klaus Moosmayer(2018年12月1日起)
|
193
|
0
|
0
|
8 857
|
|||||
|
John Tsai(2018年5月1日起)
|
3 561
|
0
|
0
|
27 381
|
|||||
|
Robert Weltevreden(2018年6月1日起)
|
2 636
|
8 992
|
2 075
|
0
|
|||||
|
小计
|
75 634
|
176 448
|
78 859
|
57 505
|
|||||
|
|
|
|
|
||||||
|
2018年卸任的执行委员会成员
|
|||||||||
|
Joseph Jimenez(CEO至2018年1月31日) 5
|
0
|
0
|
0
|
0
|
|||||
|
F.迈克尔·鲍尔(至2018年6月30日)
|
7 609
|
10 284
|
4 500
|
18 865
|
|||||
|
费利克斯河Ehrat(至2018年5月31日)
|
4 221
|
7 890
|
2 785
|
17 603
|
|||||
|
André Wéré(至2018年3月31日) 6
|
0
|
1 400
|
525
|
3 915
|
|||||
|
小计
|
11 830
|
19 574
|
7 810
|
40 383
|
|||||
|
总计
|
87 464
|
196 022
|
86 669
|
97 888
|
|||||
|
1 奖励价值载于“按补助价值计算的2018年首席执行官及执行委员会成员按补助价值计算的2018年薪酬计算的首席执行官及其他执行委员会成员按补助价值计算的2018年薪酬计算”。”
|
|||||||||
|
2 2018年业绩期间根据年度奖励授出的既得股份、受限制股份及╱或受限制股份单位
|
|||||||||
|
3 2018—2020年表现周期内,根据长期保障计划及长期保障计划批出的私营单位目标数目(如适用)
|
|||||||||
|
4 Elizabeth Barrett于2018年营业年度结束时辞去诺华肿瘤学首席执行官的职务和执行委员会的职务。2018—2020年表现周期的LTPP及LTRP补助金(分别为16284及6107个PSU),以及2018年21267股表现股份的买断奖励(反映在其他补偿中),均载于上表,已于2018年12月31日离职时全数没收。
|
|||||||||
|
5 Joseph Jimenez以100%现金获得2018年度奖励,但没有获得LTPP和LTRPP 2018—2020绩效周期的奖励。
|
|||||||||
|
6 André Wendel于2018年3月31日辞去执行委员会职务,并于2018年9月30日结束其通知期。彼按比例以现金100%获得二零一八年度奖励,而上表所载2018—2020年表现周期的长期发展计划及长期发展计划补助将于表现周期结束时根据其合约协议按比例归属,并受计划规则规限。
|
|||||||||
|
功能
|
所有权水平
|
||
|
首席执行官
|
5倍基本补偿
|
||
|
执行委员会其他成员
|
3倍基本补偿
|
||
|
既得股份 和ADR 1 |
未归属股份 和其他股权 2 |
股权级别
作为的倍数 年基本工资 3 |
未授权的目标PSU (e.g.,LTPP/LTRPP) 4 |
相配股份 根据《本地退休计划》 5 |
总计为 2019年12月31日 |
||||||||
|
Vasant Narasimhan
|
59 983
|
89 381
|
8x
|
115 896
|
4 657
|
269 917
|
|||||||
|
史蒂文·伯特
|
39 785
|
31 890
|
8x
|
64 538
|
0
|
136 213
|
|||||||
|
贝特朗·博德森
|
4 600
|
11 492
|
2x
|
15 037
|
0
|
31 129
|
|||||||
|
詹姆斯·布拉德纳
|
21 794
|
46 531
|
5x
|
104 379
|
0
|
172 704
|
|||||||
|
哈里·基尔希
|
108 193
|
40 968
|
12x
|
102 484
|
0
|
251 645
|
|||||||
|
香农百里香克林格
|
12 193
|
22 028
|
3x
|
35 117
|
1 488
|
70 826
|
|||||||
|
斯特芬·朗
|
56 063
|
20 248
|
9x
|
26 782
|
4 535
|
107 628
|
|||||||
|
克劳斯·莫斯迈尔
|
0
|
3 016
|
0x
|
12 034
|
0
|
15 050
|
|||||||
|
Richard Saynor(2019年7月15日)
|
0
|
9 211
|
1x
|
1 790
|
0
|
11 001
|
|||||||
|
苏珊娜·沙弗特
|
43 770
|
26 123
|
7x
|
36 224
|
1 735
|
107 852
|
|||||||
|
蔡俊华
|
11 859
|
29 570
|
4x
|
12 487
|
0
|
53 916
|
|||||||
|
Marie—France Tschudin(2019年6月7日起)
|
5 500
|
24 715
|
3x
|
45 078
|
0
|
75 293
|
|||||||
|
罗伯特·韦尔特夫雷登
|
150
|
7 751
|
1x
|
11 386
|
0
|
19 287
|
|||||||
|
总计 6
|
363 890
|
362 924
|
|
583 232
|
12 415
|
1 322 461
|
|||||||
|
1 包括与执行委员会成员"密切联系的人"持有的财产(见定义"—密切联系的人)。")
|
|||||||||||||
|
2 根据上述定义,包括未归属股份和美国存托凭证以及适用于确定股权金额的其他股权。还包括与Alcon分拆有关收到的未归属保留完整股份。
|
|||||||||||||
|
3 倍数乃根据全年基本薪金及二零一九年财政年度结算日之收市股价计算。于二零一九年十二月三十一日,二零一九年最后一个交易日的股价为91. 90瑞郎╱ 94. 69美元。
|
|||||||||||||
|
4 除非根据相关计划规则,奖励符合完全归属资格,否则优先认股单位的目标数目按比例披露至二零一九年十二月三十一日。
|
|||||||||||||
|
5 杠杆式股份储蓄计划(LSSP)项下的配对股份按比例披露至2019年12月31日,除非奖励根据计划规则符合完全归属资格。2014年,执行委员会成员停止参加LSP计划,尽管一些现任成员在成为执行委员会成员之前根据该计划获得了后来的赠款。未偿还的奖励将于授出日期起计五年内归属,惟须遵守LSSP计划规则。
|
|||||||||||||
|
6 Paul Hudson和Richard Francis于2019年退出执行委员会。在他们从执行委员会卸任时,哈德森先生拥有零归属股份、140121股未归属股份和其他股权,弗朗西斯先生拥有50615股已归属股份和86740股未归属股份和其他股权。
|
|||||||||||||
|
|
|||||||||||||
|
|
|||||||||||||
|
每年一次
基本工资 1 |
变量
补偿 2 |
||||
|
Vasant Narasimhan
|
14.7%
|
85.3%
|
|||
|
史蒂文·伯特
|
20.5%
|
79.5%
|
|||
|
贝特朗·博德森
|
25.3%
|
74.7%
|
|||
|
詹姆斯·布拉德纳
|
18.9%
|
81.1%
|
|||
|
哈里·基尔希
|
17.8%
|
82.2%
|
|||
|
香农百里香克林格
|
22.8%
|
77.2%
|
|||
|
斯特芬·朗
|
25.0%
|
75.0%
|
|||
|
克劳斯·莫斯迈尔
|
25.1%
|
74.9%
|
|||
|
理查德·塞诺
|
13.4%
|
86.6%
|
|||
|
苏珊娜·沙弗特
|
19.3%
|
80.7%
|
|||
|
蔡俊华
|
19.1%
|
80.9%
|
|||
|
玛丽-法国-舒丁
|
23.7%
|
76.3%
|
|||
|
罗伯特·韦尔特夫雷登
|
27.4%
|
72.6%
|
|||
|
总计 3
|
19.4%
|
80.6%
|
|||
|
1 不包括养恤金和其他福利
|
|||||
|
2 有关可变资产的披露原则,见表“2019年CEO及其他执行委员会成员按补助价值计算的薪酬”。
补偿。 |
|||||
|
3 不包括2019年辞去执行委员会职务的Richard Francis和辞职的Paul Hudson。
|
|||||
|
绩效衡量标准
|
跟踪
|
||
|
LTPP NCVA(75%)
|
在目标前面
|
||
|
LTPP创新(25%)
|
在目标前面
|
||
|
LTRPP相对TSC(100%)
|
领先于同龄群体中位数
|
||
2020年执行委员会薪酬制度
2020年执行委员会薪酬
2019年董事会薪酬
|
千瑞士法郎 |
2019-2020年度股东大会
年费 |
||
|
董事会主席
|
3 800
|
||
|
董事会成员
|
280
|
||
|
副主席
|
50
|
||
|
审计和合规委员会主席
|
130
|
||
|
薪酬委员会主席
|
90
|
||
|
以下委员会主席:
·治理、提名和 企业责任委员会 ·研发委员会 ·风险委员会 |
70 |
||
|
审计署的成员
和合规委员会 |
70 |
||
|
下列委员会的成员:
·薪酬委员会 ·治理、提名和 企业责任委员会 ·研发委员会 ·风险委员会 |
40 |
||
|
|
|||
|
董事会成员
|
审计和合规委员会
|
薪酬委员会
|
治理, 提名 和企业 责任 委员会
|
研究与发展委员会
|
风险委员会
|
股份(数量) 1
|
现金(瑞士法郎)(A)
|
股份(瑞士法郎)(B)
|
其他(瑞士法郎)(C) 2
|
总计(瑞士法郎)(A)+(B)+(C) 3
|
|||||||||||||
|
活跃于2019年12月31日的董事会成员
|
|||||||||||||||||||||||
|
约尔格·莱因哈特 4
|
椅子
|
|
|
|
椅子
|
|
21 498
|
1 900 000
|
1 900 000
|
4 373
|
3 804 373
|
||||||||||||
|
恩里科·瓦尼
|
副主席
|
•
|
椅子
|
•
|
|
|
4 494
|
220 833
|
309 166
|
3 512
|
533 511
|
||||||||||||
|
南希·安德鲁斯
|
•
|
|
|
|
•
|
•
|
2 035
|
180 000
|
180 000
|
–
|
360 000
|
||||||||||||
|
唐·比希纳
|
•
|
•
|
|
|
|
|
2 967
|
145 833
|
204 166
|
4 373
|
354 372
|
||||||||||||
|
帕特里斯·布拉 5
|
•
|
|
•
|
|
|
|
1 813
|
–
|
266 667
|
4 373
|
271 040
|
||||||||||||
|
Srikant Datar
|
•
|
•
|
•
|
|
|
椅子
|
2 602
|
230 000
|
230 000
|
–
|
460 000
|
||||||||||||
|
伊丽莎白·多尔蒂
|
•
|
椅子
|
|
|
|
•
|
2 544
|
225 000
|
225 000
|
–
|
450 000
|
||||||||||||
|
安·福吉
|
•
|
|
•
|
•
|
|
•
|
2 262
|
200 000
|
200 000
|
–
|
400 000
|
||||||||||||
|
Frans van Houten
|
•
|
|
|
|
•
|
|
2 716
|
26 667
|
293 334
|
–
|
320 001
|
||||||||||||
|
安德烈亚斯·冯·普兰塔
|
•
|
•
|
|
椅子
|
|
•
|
2 602
|
230 000
|
230 000
|
4 373
|
464 373
|
||||||||||||
|
Charles L.索耶斯
|
•
|
|
|
•
|
•
|
|
2 035
|
180 000
|
180 000
|
–
|
360 000
|
||||||||||||
|
William T.温特斯
|
•
|
|
•
|
• 5
|
|
|
3 620
|
–
|
353 333
|
–
|
353 333
|
||||||||||||
|
小计
|
|
|
|
|
|
|
51 188
|
3 538 333
|
4 571 666
|
21 002
|
8 131 001
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
于2019年股东周年大会上卸任的董事会成员
|
|||||||||||||||||||||||
|
迪米特里·阿扎尔 6
|
•
|
|
|
•
|
•
|
|
1 016
|
30 000
|
30 000
|
–
|
60 000
|
||||||||||||
|
小计
|
|
|
|
|
|
|
1 016
|
30 000
|
30 000
|
–
|
60 000
|
||||||||||||
|
总计
|
|
|
|
|
|
|
52 204
|
3 568 333
|
4 601 666
|
21 002
|
8 191 001
|
||||||||||||
|
2018年的比较数据见下一页。
|
|||||||||||||||||||||||
|
1 所示金额代表于二零一九年就各董事会成员服务期间交付予各董事会成员的股份总数。本栏所呈报之股份数目指:(i)于二零一九年二月就二零一八年股东周年大会至二零一九年股东周年大会之服务交付之第二期及最后一期股权分期付款,及(ii)于二零一九年八月就二零一九年股东周年大会至二零二零年股东周年大会之服务交付之两期股权分期付款中的第一期。自二零一九年股东周年大会至二零二零年股东周年大会之服务之第二期及最后一期股权分期付款将于二零二零年二月进行。
|
|||||||||||||||||||||||
|
2 包括诺华公司向政府社会保障体系支付的21 002瑞士法郎的强制性雇主缴款。这一数额是从雇主缴款总额413 '985瑞士法郎中扣除的,并为董事会成员提供了获得未来最高保险政府养恤金福利的权利。
|
|||||||||||||||||||||||
|
3 所有金额均未扣除董事会成员应付的社会保障缴款和所得税。
|
|||||||||||||||||||||||
|
4 Joerg Reinhardt没有额外的委员会费用,以担任研究与发展委员会主席。
|
|||||||||||||||||||||||
|
5 2019年2月28日起
|
|||||||||||||||||||||||
|
6 截止2019年2月28日
|
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
董事会成员
|
审计和合规委员会
|
薪酬委员会
|
治理, 提名 和企业 责任 委员会
|
研究与发展委员会
|
风险委员会
|
股份(数量) 1
|
现金(瑞士法郎)(A)
|
股份(瑞士法郎)(B)
|
其他(瑞士法郎)(C) 2
|
总计(瑞士法郎)(A)+(B)+(C) 3
|
|||||||||||||
|
2018年12月31日活跃的董事会成员
|
|||||||||||||||||||||||
|
约尔格·莱因哈特 4
|
椅子
|
|
|
|
椅子
|
|
23 889
|
|
1 900 000
|
|
1 900 000
|
4 336
|
3 804 336
|
||||||||||
|
恩里科·瓦尼
|
副主席
|
•
|
椅子
|
•
|
|
|
4 854
|
41 667
|
483 334
|
3 475
|
528 476
|
||||||||||||
|
南希·安德鲁斯
|
•
|
|
|
|
•
|
•
|
2 262
|
180 000
|
180 000
|
–
|
360 000
|
||||||||||||
|
迪米特里·阿扎尔
|
•
|
|
|
• 5
|
•
|
|
2 359
|
182 500
|
182 500
|
–
|
365 000
|
||||||||||||
|
唐·比希纳
|
•
|
• 5
|
|
|
|
• 6
|
4 270
|
–
|
346 667
|
4 336
|
351 003
|
||||||||||||
|
Srikant Datar
|
•
|
•
|
•
|
|
|
椅子
|
2 859
|
229 167
|
229 167
|
–
|
458 334
|
||||||||||||
|
伊丽莎白·多尔蒂
|
•
|
椅子
|
|
|
|
•
|
2 828
|
225 000
|
225 000
|
–
|
450 000
|
||||||||||||
|
安·福吉
|
•
|
|
•
|
•
|
|
•
|
2 481
|
199 167
|
199 167
|
–
|
398 334
|
||||||||||||
|
Frans van Houten
|
•
|
|
|
|
• 5
|
|
2 334
|
148 333
|
168 333
|
–
|
316 666
|
||||||||||||
|
安德烈亚斯·冯·普兰塔
|
•
|
•
|
|
椅子
|
|
•
|
2 859
|
229 167
|
229 167
|
4 336
|
462 670
|
||||||||||||
|
Charles L.索耶斯
|
•
|
|
|
•
|
•
|
|
2 262
|
180 000
|
180 000
|
–
|
360 000
|
||||||||||||
|
William T.温特斯
|
•
|
|
•
|
|
|
|
4 087
|
–
|
321 667
|
–
|
321 667
|
||||||||||||
|
小计
|
|
|
|
|
|
|
57 344
|
3 515 001
|
4 645 002
|
16 483
|
8 176 486
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
在2018年年度股东大会上辞职的董事会成员
|
|||||||||||||||||||||||
|
皮埃尔·兰道特(至2018年3月2日) 7
|
•
|
|
|
• 6
|
|
|
2 131
|
–
|
55 000
|
3 475
|
58 475
|
||||||||||||
|
小计
|
|
|
|
|
|
|
2 131
|
–
|
55 000
|
3 475
|
58 475
|
||||||||||||
|
总计
|
|
|
|
|
|
|
59 475
|
3 515 001
|
4 700 002
|
19 958
|
8 234 961
|
||||||||||||
|
1 所示金额为2018年向每名董事会成员交付的各自董事会成员服务期间的股份总数。本栏报告的股份数量代表:(I)2018年2月就2017年股东周年大会至2018年股东周年大会的服务交付的第二期也是最后一期股权分期付款,及(Ii)2018年8月就2018年股东周年大会至2019年股东周年大会的服务交付的两期股权分期付款中的第一期。从2018年年度股东大会到2019年年度股东大会的服务的第二次也是最后一次股权分期付款将于2019年2月进行。
|
|||||||||||||||||||||||
|
2 包括诺华公司向政府社会保障系统支付的所有董事会成员的强制性雇主缴费,金额为19958瑞士法郎。这一数额是雇主缴费总额383 864瑞士法郎中的一部分,为董事会成员提供了获得未来最高保险政府养老金福利的权利。
|
|||||||||||||||||||||||
|
3 所有金额均未扣除董事会成员应付的社会保障缴款和所得税。
|
|||||||||||||||||||||||
|
4 Joerg Reinhardt没有额外的委员会费用,以担任研究与发展委员会主席。
|
|||||||||||||||||||||||
|
5 2018年3月2日起
|
|||||||||||||||||||||||
|
6 至2018年3月2日
|
|||||||||||||||||||||||
|
7 根据皮埃尔·兰道特的说法,桑多斯家族基金会是这笔赔偿的经济受益者。
|
|||||||||||||||||||||||
|
股份数量
2019年12月31日 1,2 |
|||
|
约尔格·莱因哈特
|
563 697
|
||
|
恩里科·瓦尼
|
26 645
|
||
|
南希·安德鲁斯
|
7 265
|
||
|
唐·比希纳
|
10 950
|
||
|
帕特里斯·布拉
|
1 946
|
||
|
Srikant Datar
|
41 334
|
||
|
伊丽莎白·多尔蒂
|
6 765
|
||
|
安·福吉
|
14 114
|
||
|
Frans van Houten
|
4 764
|
||
|
安德烈亚斯·冯·普兰塔
|
161 035
|
||
|
Charles L.索耶斯
|
10 986
|
||
|
William T.温特斯
|
18 170
|
||
|
总计 3
|
867 671
|
||
|
1 包括与董事会成员有“密切联系”的人的持有量(见定义“--密切联系的人”)
|
|||
|
2 每股股票提供了一票的权利。
|
|||
|
3 迪米特里·阿扎尔于2019年2月28日辞去董事会职务。2019年2月28日,阿扎尔先生持有18750股。他的股票不包括在总数中。
|
|||
薪酬治理

|
决定
|
决策权
|
||
|
董事会主席和其他成员的报酬
|
董事会
|
||
|
CEO薪酬
|
董事会
|
||
|
执行委员会其他成员的报酬
|
薪酬委员会
|
||
6.董事会惯例
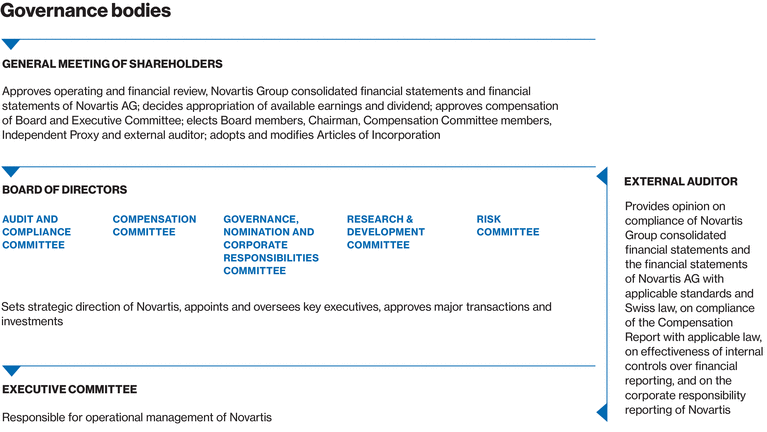
|
持股百分比
股本 2019年12月31日 |
|||
|
登记在自己账户上的股东:
|
|
||
|
埃马桑股份公司,巴塞尔
|
3.5
|
||
|
诺华员工参与基金会,巴塞尔
|
2.1
|
||
|
瑞银基金管理(瑞士)股份公司,巴塞尔
|
2.1
|
||
|
持股百分比
股本 2019年12月31日 |
|||
|
登记为被提名人的股东:
|
|
||
|
大通提名者有限公司,伦敦
|
10.4
|
||
|
纽约梅隆银行,纽约
|
3.8
|
||
|
通过纽约梅隆银行,Everett
|
2.0
|
||
|
通过纽约梅隆银行,纽约
|
1.2
|
||
|
通过纽约梅隆银行,SA/NV,布鲁塞尔
|
0.6
|
||
|
诺瑞信被提名人有限公司,伦敦
|
3.9
|
||
|
作为美国存托股份(美国存托股份)存托的股东:
|
|
||
|
摩根大通银行,N.A.,纽约
|
12.5
|
||
|
截至2019年12月31日 1 |
数量
注册 股东 |
注册的百分比 股本 |
|||
|
1–100
|
25 442
|
0.06
|
|||
|
101–1 000
|
97 161
|
1.59
|
|||
|
1 001–10 000
|
34 884
|
3.84
|
|||
|
10 001–100 000
|
3 080
|
3.16
|
|||
|
100 001–1 000 000
|
451
|
5.45
|
|||
|
1 000 001–5 000 000
|
64
|
4.96
|
|||
|
5000至001人或更多 2
|
29
|
50.66
|
|||
|
登记股东/股份总数
|
161 111
|
69.72
|
|||
|
未登记股份
|
|
30.28
|
|||
|
总计
|
|
100.00
|
|||
|
1 于二零一九年股东周年大会(股东周年大会)的记录日期,未登记股份占15%。
|
|||||
|
2 包括上文所列的重要注册股东
|
|||||
|
截至2019年12月31日
|
股东百分比
|
占%的股份
|
|||
|
个人股东
|
96.43
|
12.99
|
|||
|
法人单位 1
|
3.52
|
32.77
|
|||
|
被提名人、受托人和美国存托股份托管机构
|
0.05
|
54.24
|
|||
|
总计
|
100.00
|
100.00
|
|||
|
1 不包括诺华公司或其全资附属公司作为库存股持有的5.7%股本
|
|||||
|
截至2019年12月31日
|
股东百分比
|
占%的股份
|
|||
|
比利时
|
0.13
|
1.13
|
|||
|
法国
|
2.06
|
0.29
|
|||
|
德国
|
5.66
|
1.64
|
|||
|
日本
|
0.21
|
0.70
|
|||
|
卢森堡
|
0.05
|
0.42
|
|||
|
瑞士 2
|
87.68
|
42.38
|
|||
|
英国
|
0.56
|
26.15
|
|||
|
美国
|
0.32
|
25.41
|
|||
|
其他国家
|
3.33
|
1.88
|
|||
|
总计
|
100.00
|
100.00
|
|||
|
1 被提名者持有的记名股票显示在作为股东登记在股份登记册上的公司/关联公司的登记所在地。
|
|||||
|
2 不包括诺华公司或其全资附属公司作为库存股持有的5.7%股本
|
|||||
|
年度股东大会 |
股东决定 |
已注销的股份 |
平均回购
股价(瑞士法郎) 1 |
||||
|
2017
|
·资本减少510万瑞士法郎(从1 313 557 410瑞士法郎减至1 308 422 410瑞士法郎)
|
10 270 000
|
74.67
|
||||
|
2018
|
·资本减少3311万瑞士法郎(从1 308 422 410瑞士法郎减至1 275 312 410瑞士法郎)
|
66 220 000
|
78.34
|
||||
|
2019
|
·资本减少1,163万瑞士法郎(从1 275 312 410瑞士法郎减至1 263 687 410瑞士法郎)
·授权董事会回购最多100亿瑞士法郎的股份 根据第八次股票回购计划, |
23 250 000
|
79.08
|
||||
|
|
|
|
|||||
|
年度股东大会 |
向股东提出的建议 |
待注销股份 |
平均回购
股价(瑞士法郎) 1 |
||||
|
2020
|
·资本减少3,016万瑞士法郎(从1 263 687 410瑞士法郎减至1 233 530 460瑞士法郎)
|
60 313 900
|
88.18
|
||||
|
1 所有股票都是在Six Swiss Exchange的第二个交易线上回购的。
|
|||||||
|
2019
|
2018
|
2017
|
|||||
|
已发行股份
|
2 527 374 820
|
2 550 624 820
|
2 616 844 820
|
||||
|
国库股 1
|
262 366 332
|
239 453 391
|
299 388 321
|
||||
|
截至12月31日的流通股
|
2 265 008 488
|
2 311 171 429
|
2 317 456 499
|
||||
|
加权平均流通股数
|
2 290 792 782
|
2 319 322 369
|
2 345 783 843
|
||||
|
1 约1.18亿股库存股(2018年:1.22亿股;2017年:1.31亿股)由诺华实体持有,限制其使用。
|
|||||||
|
2019
|
2018
|
2017
|
|||||
|
持续经营基本每股收益(美元)
|
3.12
|
5.52
|
3.20
|
||||
|
非持续经营的基本每股收益(美元)
|
2.00
|
– 0.08
|
0.08
|
||||
|
每股基本收益合计(美元)
|
5.12
|
5.44
|
3.28
|
||||
|
持续运营摊薄后每股收益(美元)
|
3.08
|
5.46
|
3.17
|
||||
|
已终止经营业务之每股摊薄收益(美元)
|
1.98
|
– 0.08
|
0.08
|
||||
|
每股摊薄后总收益(美元)
|
5.06
|
5.38
|
3.25
|
||||
|
持续经营业务的经营活动现金流量净额(美元)
|
5.91
|
5.63
|
4.87
|
||||
|
诺华制药股东年终权益(美元)
|
24.49
|
34.01
|
32.00
|
||||
|
股息(瑞士法郎) 2
|
2.95
|
2.85
|
2.80
|
||||
|
1 按已发行股票的加权平均数计算,年终股本除外
|
|||||||
|
2 2019年:于2020年2月28日提交股东周年大会批准的提案
|
|||||||
|
2019
|
2018
|
2017
|
|||||
|
市盈率 1
|
18.5
|
15.7
|
25.7
|
||||
|
持续经营的市盈率 1
|
30.4
|
15.4
|
25.7
|
||||
|
股息率(%) 1
|
3.2
|
3.4
|
3.4
|
||||
|
1 基于诺华公司每年12月31日的股价
|
|||||||
|
2019 1
|
2018
|
2017
|
|||||
|
年终ADR价格(美元)
|
94.69
|
85.81
|
83.96
|
||||
|
高 2
|
96.14
|
93.91
|
86.65
|
||||
|
低 2
|
75.40
|
72.44
|
70.03
|
||||
|
未解决的不良反应数量 3
|
315 073 094
|
338 641 387
|
320 833 039
|
||||
|
|
|||||||
|
1 2019年不包括Alcon的业务,该业务于2019年4月分拆为独立交易的独立公司。
|
|||||||
|
2 以每日收盘价计算
|
|||||||
|
3 存托银行摩根大通银行每发行一份美国存托凭证,就会持有一股诺华制药的股票。
|
|||||||
|
2019 1
|
2018
|
2017
|
|||||
|
年终股价
|
91.90
|
84.04
|
82.40
|
||||
|
高 2
|
96.04
|
91.84
|
85.15
|
||||
|
低 2
|
77.03
|
72.42
|
69.55
|
||||
|
年终市值(十亿美元) 3
|
214.8
|
197.0
|
195.5
|
||||
|
年终市值(数十亿瑞士法郎) 3
|
208.2
|
194.2
|
191.0
|
||||
|
1 2019年不包括Alcon的业务,该业务于2019年4月分拆为独立交易的独立公司。
|
|||||||
|
2 以每日收盘价计算
|
|||||||
|
3 市值是根据流通股(不包括库存股)的数量计算的。美元市值是以年终瑞郎兑美元汇率换算的瑞郎市值为基础。
|
|||||||
股东参与
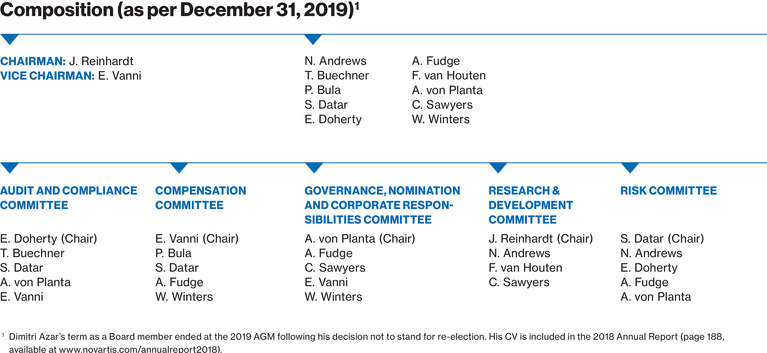
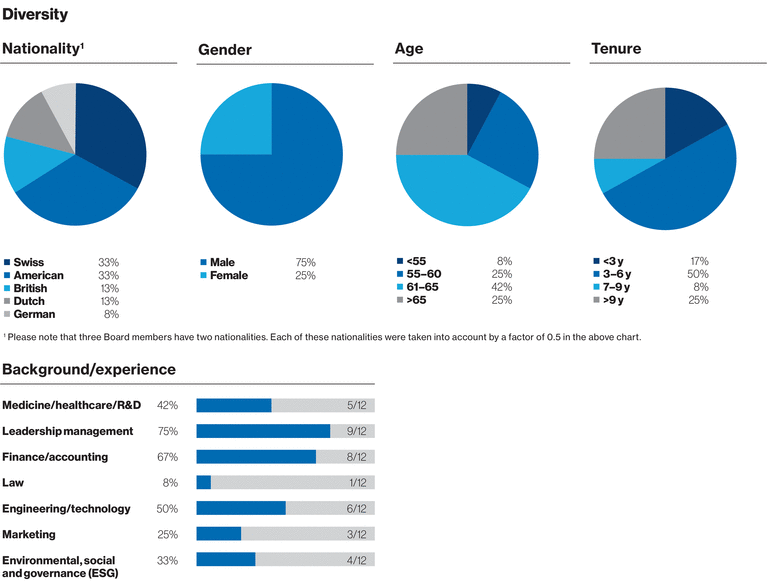
董事会成员

 医药/医疗保健/研发
医药/医疗保健/研发  领导力管理
领导力管理
 医药/医疗保健/研发
医药/医疗保健/研发  财务/会计
财务/会计  工程/技术
工程/技术
 医药/医疗保健/研发
医药/医疗保健/研发  领导管理
领导管理 
 领导管理
领导管理  财务/会计
财务/会计  环境、社会和治理(ESG)
环境、社会和治理(ESG)  工程/技术
工程/技术
 领导管理
领导管理  营销
营销  财务/会计
财务/会计  工程/技术
工程/技术
 *财务/会计
*财务/会计
 领导管理
领导管理  营销
营销  财务/会计
财务/会计  工程/技术
工程/技术
 领导管理
领导管理  营销
营销  环境、社会和治理(ESG)
环境、社会和治理(ESG)
 医药/医疗保健/研发
医药/医疗保健/研发  领导管理
领导管理  财务/会计
财务/会计  *工程/技术
*工程/技术
 财务/会计
财务/会计  法
法  环境、社会和治理(ESG)
环境、社会和治理(ESG)
 医药/医疗保健/研发
医药/医疗保健/研发  领导管理
领导管理  环境、社会和治理(ESG)
环境、社会和治理(ESG)
 领导管理
领导管理  财务/会计
财务/会计  工程/技术
工程/技术





|
最大数量
任务清单 |
|||
|
任务规定
|
10
|
||
|
其他上市公司 1
|
4
|
||
|
1 其他上市公司的董事会主席被视为两项授权。
|
|||
|
最大数量
任务清单 |
|||
|
诺华制药控制的公司中的委托
|
没有限制
|
||
|
应诺华制药或其控制的公司的要求而持有的委托
|
5
|
||
|
协会、慈善组织、基金会、信托基金和雇员福利基金会的任务
|
10
|
||

执行委员会

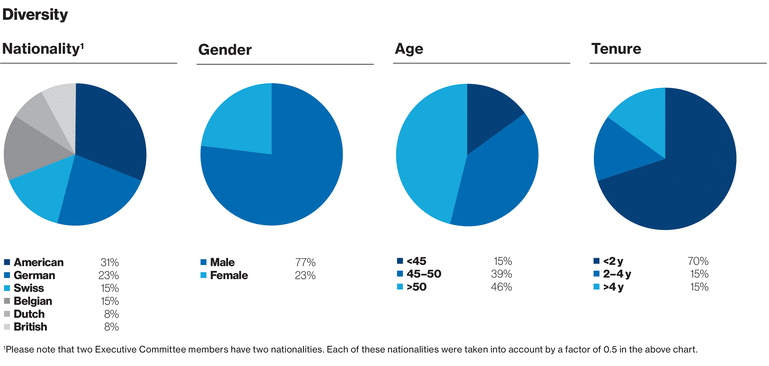
|
最大数量
任务清单 |
|||
|
任务规定
|
6
|
||
|
其他上市公司 1
|
2
|
||
|
1 其他上市公司不得担任董事长。
|
|||
|
最大数量
任务清单 |
|||
|
诺华制药控制的公司中的委托
|
没有限制
|
||
|
应诺华制药或其控制的公司的要求而持有的委托
|
5
|
||
|
协会、慈善组织、基金会、信托基金和雇员福利基金会的任务
|
10
|
||
执行委员会成员













审计师
|
2019
百万美元 |
2018
百万美元 |
||||
|
审计服务
|
21.2
|
25.6
|
|||
|
与审计相关的服务
|
1.0
|
13.4
|
|||
|
税务服务
|
0.7
|
0.7
|
|||
|
其他服务
|
1.4
|
2.4
|
|||
|
总计
|
24.3
|
42.1
|
|||
|
|
|||||
信息政策
|
主题
|
信息
|
||
|
股本
|
诺华制药的公司章程
Www.novartis.com/investors/company-overview/corporate-governance 诺华的关键份额数据 Www.novartis.com/key-share-data |
||
|
股东权利
|
诺华制药的公司章程
Www.novartis.com/investors/company-overview/corporate-governance |
||
|
股东周年大会
|
股东周年大会
Www.novartis.com/investors/shareholder-information/annual-general-meeting |
||
|
董事会规则
|
董事会规则
Www.novartis.com/investors/company-overview/corporate-governance |
||
|
诺华公司高级财务官代码
|
诺华首席执行官和高级财务官道德行为准则
Www.novartis.com/investors/company-overview/corporate-governance |
||
|
诺华进军社会ESG报告
|
诺华进军社会ESG报告
Www.novartis.com/nisreport2019 |
||
|
诺华财务数据
|
诺华财务数据
Www.novartis.com/Investors/Financial-data |
||
|
新闻稿
|
新闻稿
Www.novartis.com/news/news-archive?type=press_release 免费电子邮件服务 Www.novartis.com/News/保持最新状态 |
||
|
更多信息
(包括诺华投资者活动日历,注册办事处, 联系和电子邮件地址、电话号码等) |
诺华公司投资者关系
Www.novartis.com/Investors |
||
6.D级雇员
|
截至该年度为止
2019年12月31日 (相当于全日制职位) |
市场营销和 销售额 |
生产和销售 供应 |
研究和 发展 |
国家统计局 1 |
一般和 行政管理 |
总计 |
|||||||
|
美国
|
5 360
|
2 830
|
5 412
|
614
|
763
|
14 979
|
|||||||
|
加拿大和拉丁美洲
|
3 396
|
838
|
480
|
864
|
397
|
5 975
|
|||||||
|
欧洲
|
16 395
|
19 386
|
9 988
|
4 352
|
2 666
|
52 787
|
|||||||
|
亚洲/非洲/澳大拉西亚
|
17 455
|
3 163
|
4 296
|
4 233
|
1 026
|
30 173
|
|||||||
|
总计
|
42 606
|
26 217
|
20 176
|
10 063
|
4 852
|
103 914
|
|||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||
|
截至该年度为止
2018年12月31日 (相当于全日制职位) |
市场营销和 销售额 |
生产和销售 供应 |
研究和 发展 |
国家统计局 1 |
一般和 行政管理 |
总计 |
|||||||
|
美国
|
6 825
|
7 524
|
6 700
|
1 467
|
911
|
23 427
|
|||||||
|
加拿大和拉丁美洲
|
4 584
|
960
|
508
|
899
|
490
|
7 441
|
|||||||
|
欧洲
|
19 608
|
21 397
|
10 049
|
4 845
|
2 780
|
58 679
|
|||||||
|
亚洲/非洲/澳大拉西亚
|
20 099
|
6 636
|
3 977
|
3 613
|
1 289
|
35 614
|
|||||||
|
总计
|
51 116
|
36 517
|
21 234
|
10 824
|
5 470
|
125 161
|
|||||||
|
|
|
|
|
|
|
||||||||
|
其中继续开展业务2
|
43 954
|
25 862
|
19 803
|
10 824
|
4 337
|
104 780
|
|||||||
|
其中已终止业务2
|
7 162
|
10 655
|
1 431
|
0
|
1 133
|
20 381
|
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
||||||||
|
截至该年度为止
2017年12月31日 (相当于全日制职位) |
市场营销和 销售额 |
生产和销售 供应 |
研究和 发展 |
国家统计局 1 |
一般和 行政管理 |
总计 |
|||||||
|
美国
|
6 563
|
7 095
|
6 803
|
1 680
|
726
|
22 867
|
|||||||
|
加拿大和拉丁美洲
|
4 477
|
1 305
|
557
|
900
|
471
|
7 710
|
|||||||
|
欧洲
|
18 665
|
20 412
|
10 173
|
4 903
|
2 469
|
56 622
|
|||||||
|
亚洲/非洲/澳大拉西亚
|
19 005
|
6 970
|
3 883
|
3 386
|
1 154
|
34 398
|
|||||||
|
总计
|
48 710
|
35 782
|
21 416
|
10 869
|
4 820
|
121 597
|
|||||||
|
其中继续开展业务2
|
42 115
|
25 564
|
20 060
|
10 869
|
3 859
|
102 467
|
|||||||
|
其中已终止业务2
|
6 595
|
10 218
|
1 356
|
0
|
961
|
19 130
|
|||||||
|
1 NBS指的是诺华商业服务组织部门的全职同等员工。
|
|||||||||||||
|
2 持续经营业务包括创新药品和Sandoz部门的业务以及持续的企业活动,而已终止经营业务包括Alcon眼科护理设备业务以及分拆前Alcon应占的若干企业活动。见"项目18.财务报表—附注2。2019年重大交易”。
|
|||||||||||||
6.E股所有权
项目7.大股东和关联方交易
7.A大股东
|
|
在以下日期实益拥有的股本的百分比:
|
||||||||
|
普通股
实益拥有截至 2019年12月31日 |
2019年12月31日 |
2018年12月31日 |
2017年12月31日 |
||||||
|
登记在自己账户上的股东:
|
|
|
|
||||||
|
瑞士巴塞尔Emasan AG
|
89 193 765
|
3.5
|
3.5
|
3.4
|
|||||
|
诺华员工参与基金会,瑞士巴塞尔 1
|
53 983 628
|
2.1
|
2.3
|
2.5
|
|||||
|
瑞士巴塞尔瑞银基金管理(瑞士)股份公司
|
52 845 411
|
2.1
|
2.2
|
2.0
|
|||||
|
1 诺华员工参与基金会(以下简称“员工基金会”)是一个特殊目的实体,由诺华创立,但独立于诺华。
|
|||||||||
|
|
截至以下日期各自持有的股本百分比:
|
||||||||
|
普通股
持有日期为 2019年12月31日 |
2019年12月31日 |
2018年12月31日 |
2017年12月31日 |
||||||
|
登记为被提名人的股东:
|
|
|
|||||||
|
大通提名有限公司,英国伦敦
|
264 073 363
|
10.4
|
9.8
|
7.8
|
|||||
|
纽约梅隆银行,纽约
|
95 456 296
|
3.8
|
4.1
|
4.3
|
|||||
|
纽约梅隆银行(Bank of New York Mellon,Everett,MA)
|
50 207 591
|
2.0
|
2.1
|
2.0
|
|||||
|
通过纽约银行梅隆,纽约,NY
|
29 356 938
|
1.2
|
1.3
|
–
|
|||||
|
通过The Bank of New York Mellon,SA/NV,布鲁塞尔,比利时
|
15 891 767
|
0.6
|
0.7
|
2.3
|
|||||
|
诺瑞信被提名者有限公司,英国伦敦
|
98 354 215
|
3.9
|
3.6
|
3.8
|
|||||
|
作为美国存托股份(美国存托股份)存托的股东:
|
|
|
|
|
|||||
|
摩根大通银行,N.A.,纽约
|
314 717 099
|
12.5
|
13.3
|
12.3
|
|||||
7.关联方交易
7.c专家和律师的利益
项目8.财务信息
8.a合并报表和其他财务资料
8.B重大变化
项目9.报价和清单
9.报价和挂牌细节
9.B分配方案
9.C街市
9.D出售股东
9.E稀释
9.发行债券的开支
项目10.补充信息
10.A股本
10.B组织章程大纲及章程细则
10.C材料合同
10.外汇管制
10.电子课税
10.F派息及支付代理人
10.专家的发言
10.陈列的文件
10.一、附属信息
项目11.关于市场风险的定量和定性披露
项目12. 股本证券以外的证券描述
12.A债务证券
12.B认股权证及权利
12.c.其他证券
12.D美国存托股份
|
类别
|
存托诉讼
|
连带费用
|
|||
|
存放或替代
标的股份 |
接受交出的股份,并发行美国存托凭证作为交换,
包括就下列事项作出的交出及发出: -股份分配 -股票拆分 -权利 -合并 -交换股份或任何其他交易或事件或其他分发 影响美国存托凭证或存入股份 |
每100张美国存托凭证5美元
(or部分) 以新的, 交付的不良反应 |
|||
|
撤回
标的股份 |
接受为提取存放股份而交出的美国存托凭证
|
每100张美国存托凭证5美元
(or部分) 由ADR证明, 投降 |
|||
|
销售或
行使权利 |
分发或出售股份,所收取的费用为
执行和交付本应收取费用的ADR 由于该等股份的存放 |
每100张美国存托凭证5美元
(或其部分) |
|||
|
转移,
分裂或 分组收据 |
存托凭证的转让、合并或分组
|
每ADR 1.50美元
|
|||
|
该委员会的开支
托管人 |
代表持票人发生的与下列事项有关的费用:
-遵守外汇管理法规或任何法律或 关于外商投资的规定 -保管人或其托管人遵守适用法律的情况; 规章制度 -股票转让或其他税收和其他政府收费 -电报、电传和传真的传输和交付 -保管人与外国资产转换有关的费用 货币兑换成美元(用这种外币支付) -任何保管人或其代理人应支付的任何其他费用 |
应由独资支付的费用
保管人的酌处权 按帐单持有人或按 从一项中扣除费用 或更多现金股息或 其他现金分配 |
|||
|
预支税额减免
|
为合格持有人提供税务减免/回收流程
|
托管服务费
每美国存托股份0.008美元 |
|||
第II部
项目13.拖欠股息和拖欠股息
项目14.对担保持有人权利的实质性修改和收益的使用
项目15. 控制和程序
项目16A。审计委员会财务专家
项目16B。道德守则
项目16C。首席会计师费用及服务
项目16 D. 豁免审核委员会遵守上市准则
项目16E。发行人及关联购买人购买股权证券
|
2019 |
总人数 购入的股份 (a) 1 |
平均价格 按股支付 以美元为单位 (b) |
总数 的股份 购得 作为.的一部分 公开 宣布 计划或 节目 (c) 2 |
极大值
近似值 的价值 分享 可能还会是 购得 在 计划或 节目 (百万瑞士法郎) (d) |
极大值
近似值 的价值 分享 可能还会是 购得 在 计划或 节目 (百万美元) (e) 3 |
||||||
|
1月1日至31日
|
1 913 205
|
87.38
|
830 000
|
2 137
|
2 152
|
||||||
|
2月1日至28日
|
203 399
|
88.31
|
0
|
10 000
|
10 027
|
||||||
|
3月1日至31日
|
81 551
|
92.09
|
0
|
10 000
|
10 042
|
||||||
|
4月1日至30日
|
3 687 215
|
80.82
|
3 452 000
|
9 716
|
9 539
|
||||||
|
5月1日至31日
|
15 719 319
|
83.55
|
15 695 000
|
8 392
|
8 338
|
||||||
|
6月1日至30日
|
12 852 939
|
90.27
|
12 840 000
|
7 247
|
7 433
|
||||||
|
7月1日至31日
|
23 550 117
|
92.10
|
23 538 500
|
5 106
|
5 156
|
||||||
|
8月1日至31日
|
3 966 974
|
91.76
|
3 958 400
|
4 752
|
4 809
|
||||||
|
9月1日至30日
|
36 197
|
89.69
|
0
|
4 752
|
4 790
|
||||||
|
10月1日至31日
|
2 031
|
84.92
|
0
|
4 752
|
4 811
|
||||||
|
11月1日至30日
|
16 065
|
87.12
|
0
|
4 752
|
4 758
|
||||||
|
12月1日至31日
|
18 567
|
90.12
|
0
|
4 752
|
4 903
|
||||||
|
|
|
|
|
|
|||||||
|
总计
|
62 047 579
|
88.70
|
60 313 900
|
|
|
|
|
|
|||
|
1 第(a)栏显示了在瑞士证券交易所第二条交易线上回购的股份,加上我们从通过诺华员工所有权计划获得这些股份的员工手中购买的股份。见"项目18。财务报表—附注26联营公司的股权参与计划。”
|
|||||||||||
|
2 (c)栏显示根据2016年股东周年大会(AGM)批准的第七次100亿瑞士法郎股份回购授权在SIX瑞士交易所第二条交易线上回购的股份,以及根据2019年股东周年大会批准的第八次100亿瑞士法郎股份回购授权在该日期之后的交易。见"项目6。董事、高级管理人员和雇员—项目6C。董事会惯例—我们的资本结构—资本变动。”
|
|||||||||||
|
3 (e)栏显示截至月底将(d)栏中的瑞士法郎数额换算成美元,使用适用的月底瑞士法郎/美元汇率
|
|||||||||||
项目16F。更改注册人的认证会计师
项目16G。公司治理
第16H项。煤矿安全信息披露
第三部分
项目17. 财务报表
项目18. 财务报表
项目19.展品
签名
诺华集团合并财务报表
|
(除非另有说明,否则为百万美元)
|
注意事项
|
2019
|
2018
|
2017
|
|||||
|
持续运营对第三方的净销售额
|
3
|
47 445
|
44 751
|
42 338
|
|||||
|
已终止经营分部的销售额
|
|
53
|
82
|
43
|
|||||
|
持续经营的净销售额
|
|
47 498
|
44 833
|
42 381
|
|||||
|
其他收入
|
3
|
1 179
|
1 266
|
1 023
|
|||||
|
销货成本
|
|
– 14 425
|
– 14 510
|
– 13 633
|
|||||
|
持续经营毛利
|
|
34 252
|
31 589
|
29 771
|
|||||
|
销售、一般和行政管理
|
|
– 14 369
|
– 13 717
|
– 12 465
|
|||||
|
研发
|
|
– 9 402
|
– 8 489
|
– 8 389
|
|||||
|
其他收入
|
|
2 031
|
1 629
|
1 922
|
|||||
|
其他费用
|
|
– 3 426
|
– 2 609
|
– 2 137
|
|||||
|
持续经营的营业收入
|
|
9 086
|
8 403
|
8 702
|
|||||
|
来自相联公司的收入
|
4
|
659
|
6 438
|
1 108
|
|||||
|
利息支出
|
5
|
– 850
|
– 932
|
– 750
|
|||||
|
其他财务收支
|
5
|
45
|
186
|
42
|
|||||
|
持续经营的税前收入
|
|
8 940
|
14 095
|
9 102
|
|||||
|
税费
|
6
|
– 1 793
|
– 1 295
|
– 1 603
|
|||||
|
持续经营净收益
|
|
7 147
|
12 800
|
7 499
|
|||||
|
来自已终止经营业务之净(亏损)╱收入(扣除分派收益前)。诺华公司股东
|
30
|
– 101
|
– 186
|
204
|
|||||
|
Alcon Inc.诺华公司股东
|
2
|
4 691
|
|
|
|||||
|
非持续经营的净收益/(亏损)
|
30
|
4 590
|
– 186
|
204
|
|||||
|
净收入
|
|
11 737
|
12 614
|
7 703
|
|||||
|
归因于:
|
|
|
|
|
|||||
|
诺华制药的股东
|
|
11 732
|
12 611
|
7 703
|
|||||
|
非控制性权益
|
|
5
|
3
|
0
|
|||||
|
|
|
|
|
||||||
|
持续经营的基本每股收益(美元)
|
|
3.12
|
5.52
|
3.20
|
|||||
|
非持续经营的基本每股收益(美元)
|
|
2.00
|
– 0.08
|
0.08
|
|||||
|
每股基本收益合计(美元)
|
7
|
5.12
|
5.44
|
3.28
|
|||||
|
|
|
|
|
||||||
|
持续运营的稀释后每股收益(美元)
|
|
3.08
|
5.46
|
3.17
|
|||||
|
非持续经营的摊薄后每股收益(美元)
|
|
1.98
|
– 0.08
|
0.08
|
|||||
|
每股摊薄后总收益(美元)
|
7
|
5.06
|
5.38
|
3.25
|
|||||
|
附注是综合财务报表的组成部分。
|
|||||||||
|
(百万美元)
|
注意事项
|
2019
|
2018
|
2017
|
|||||
|
净收入
|
|
11 737
|
12 614
|
7 703
|
|||||
|
其他全面收益将最终拨回综合收益表:
|
|
|
|
|
|||||
|
有价证券公允价值调整,扣除税项
|
8.1
|
|
|
39
|
|||||
|
债务证券公允价值调整,扣除税项
|
8.1
|
1
|
|
– 1
|
|||||
|
递延现金流量对冲的公允价值调整,扣除税项
|
8.1
|
1
|
12
|
12
|
|||||
|
金融工具公允价值调整总额,扣除税项
|
|
2
|
12
|
50
|
|||||
|
诺华应占联营公司确认的其他综合收益(扣除税项)
|
4
|
– 94
|
– 482
|
– 37
|
|||||
|
净投资对冲
|
8
|
44
|
95
|
– 237
|
|||||
|
货币换算效应
|
8.2
|
352
|
315
|
2 210
|
|||||
|
最终要回收的项目总数
|
|
304
|
– 60
|
1 986
|
|||||
|
其他全面收益概不会重新拨回综合收益表:
|
|
|
|
|
|||||
|
精算(亏损)/受益确定型福利计划的收益,扣除税款
|
8.3
|
– 467
|
– 359
|
851
|
|||||
|
权益证券扣除税项后的公允价值调整
|
8.1
|
– 47
|
13
|
|
|||||
|
永远不能回收的物品总数
|
|
– 514
|
– 346
|
851
|
|||||
|
综合收益总额
|
|
11 527
|
12 208
|
10 540
|
|||||
|
归因于:
|
|
|
|
|
|||||
|
诺华制药的股东
|
|
11 525
|
12 210
|
10 538
|
|||||
|
持续运营
|
|
6 948
|
12 417
|
10 211
|
|||||
|
停产经营
|
|
4 577
|
– 207
|
327
|
|||||
|
非控制性权益
|
|
2
|
– 2
|
2
|
|||||
|
附注是综合财务报表的组成部分。
|
|||||||||
|
(百万美元)
|
注意事项
|
2019
|
2018
|
||||
|
资产
|
|
|
|
||||
|
非流动资产
|
|
|
|
||||
|
财产、厂房和设备
|
9
|
12 069
|
15 696
|
||||
|
使用权资产
|
10
|
1 677
|
|
||||
|
商誉
|
11
|
26 524
|
35 294
|
||||
|
商誉以外的无形资产
|
11
|
28 787
|
38 719
|
||||
|
对相联公司的投资
|
4
|
8 644
|
8 352
|
||||
|
递延税项资产
|
12
|
7 909
|
8 699
|
||||
|
金融资产
|
13
|
2 518
|
2 345
|
||||
|
其他非流动资产
|
13
|
738
|
895
|
||||
|
非流动资产总额
|
|
88 866
|
110 000
|
||||
|
流动资产
|
|
|
|
||||
|
盘存
|
14
|
5 982
|
6 956
|
||||
|
应收贸易账款
|
15
|
8 301
|
8 727
|
||||
|
应收所得税
|
|
254
|
248
|
||||
|
有价证券、商品、定期存款和衍生金融工具
|
16
|
334
|
2 693
|
||||
|
现金和现金等价物
|
16
|
11 112
|
13 271
|
||||
|
其他流动资产
|
17
|
2 680
|
2 861
|
||||
|
未处置组的流动资产合计
|
|
28 663
|
34 756
|
||||
|
出售集团持有待售资产
|
2
|
841
|
807
|
||||
|
流动资产总额
|
|
29 504
|
35 563
|
||||
|
总资产
|
|
118 370
|
145 563
|
||||
|
|
|
|
|||||
|
权益和负债
|
|
|
|
||||
|
权益
|
|
|
|
||||
|
股本
|
18
|
936
|
944
|
||||
|
国库股
|
18
|
– 80
|
– 69
|
||||
|
储量
|
|
54 618
|
77 739
|
||||
|
诺华制药股东应占已发行股本和公积金
|
|
55 474
|
78 614
|
||||
|
非控制性权益
|
|
77
|
78
|
||||
|
总股本
|
|
55 551
|
78 692
|
||||
|
负债
|
|
|
|
||||
|
非流动负债
|
|
|
|
||||
|
金融债务
|
19
|
20 353
|
22 470
|
||||
|
租赁负债
|
10
|
1 703
|
|
||||
|
递延税项负债
|
12
|
5 867
|
7 475
|
||||
|
准备金和其他非流动负债
|
20
|
6 632
|
7 319
|
||||
|
非流动负债总额
|
|
34 555
|
37 264
|
||||
|
流动负债
|
|
|
|
||||
|
贸易应付款
|
|
5 424
|
5 556
|
||||
|
金融债务和衍生金融工具
|
21
|
7 031
|
9 678
|
||||
|
租赁负债
|
10
|
246
|
|
||||
|
流动所得税负债
|
|
2 194
|
2 038
|
||||
|
准备金和其他流动负债
|
22
|
13 338
|
12 284
|
||||
|
未处置组的流动负债总额
|
|
28 233
|
29 556
|
||||
|
出售集团持有待售资产的负债
|
2
|
31
|
51
|
||||
|
流动负债总额
|
|
28 264
|
29 607
|
||||
|
总负债
|
|
62 819
|
66 871
|
||||
|
权益和负债总额
|
|
118 370
|
145 563
|
||||
|
附注是综合财务报表的组成部分。
|
|||||||
|
(百万美元) |
注意事项 |
分享 资本 |
财务处 股票 |
保留 收益 |
总价值 调整 |
已发行股份
资本和 储量 可归因性 致诺华制药 股东 |
非- 控管 利益 |
总计 股权 |
|||||||||
|
2017年1月1日的总股本
|
|
972
|
– 76
|
81 148
|
– 7 212
|
74 832
|
59
|
74 891
|
|||||||||
|
净收入
|
|
|
|
7 703
|
|
7 703
|
|
7 703
|
|||||||||
|
其他综合收益
|
8
|
|
|
– 37
|
2 872
|
2 835
|
2
|
2 837
|
|||||||||
|
综合收益总额
|
|
|
|
7 666
|
2 872
|
10 538
|
2
|
10 540
|
|||||||||
|
分红
|
18.1
|
|
|
– 6 495
|
|
– 6 495
|
|
– 6 495
|
|||||||||
|
购买库藏股
|
18.2
|
|
– 36
|
– 5 538
|
|
– 5 574
|
|
– 5 574
|
|||||||||
|
减少股本
|
18
|
– 3
|
5
|
– 2
|
|
|
|
|
|||||||||
|
行使期权和员工交易
|
18.2
|
|
2
|
253
|
|
255
|
|
255
|
|||||||||
|
基于股权的薪酬
|
18.2
|
|
5
|
607
|
|
612
|
|
612
|
|||||||||
|
非控股权益的变动
|
18.6
|
|
|
|
|
|
– 2
|
– 2
|
|||||||||
|
其他股票变动合计
|
|
– 3
|
– 24
|
– 11 175
|
|
– 11 202
|
– 2
|
– 11 204
|
|||||||||
|
截至2017年12月31日的总权益,如先前报告
|
|
969
|
– 100
|
77 639
|
– 4 340
|
74 168
|
59
|
74 227
|
|||||||||
|
会计政策变动的影响
|
1
|
|
|
237
|
– 177
|
60
|
|
60
|
|||||||||
|
2018年1月1日重列权益
|
|
969
|
– 100
|
77 876
|
– 4 517
|
74 228
|
59
|
74 287
|
|||||||||
|
净收入
|
|
|
|
12 611
|
|
12 611
|
3
|
12 614
|
|||||||||
|
其他综合收益
|
8
|
|
|
– 482
|
81
|
– 401
|
– 5
|
– 406
|
|||||||||
|
综合收益总额
|
|
|
|
12 129
|
81
|
12 210
|
– 2
|
12 208
|
|||||||||
|
分红
|
18.1
|
|
|
– 6 966
|
|
– 6 966
|
|
– 6 966
|
|||||||||
|
购买库藏股
|
18.2
|
|
– 13
|
– 1 960
|
|
– 1 973
|
|
– 1 973
|
|||||||||
|
减少股本
|
18
|
– 25
|
34
|
– 9
|
|
|
|
|
|||||||||
|
行使期权和员工交易
|
18.2
|
|
4
|
430
|
|
434
|
|
434
|
|||||||||
|
其他股份销售
|
18.2
|
|
2
|
261
|
|
263
|
|
263
|
|||||||||
|
基于股权的薪酬
|
18.2
|
|
4
|
752
|
|
756
|
|
756
|
|||||||||
|
根据股份回购交易计划增加库存股回购责任
|
18.3
|
|
|
– 284
|
|
– 284
|
|
– 284
|
|||||||||
|
交易成本,税后净额
|
18.4
|
|
|
– 79
|
|
– 79
|
|
– 79
|
|||||||||
|
出售金融资产的公允价值调整
|
8
|
|
|
16
|
– 16
|
|
|
|
|||||||||
|
合并实体所有权变更的影响
|
18.5
|
|
|
– 13
|
|
– 13
|
22
|
9
|
|||||||||
|
非控股权益的变动
|
18.6
|
|
|
|
|
|
– 1
|
– 1
|
|||||||||
|
其他动作
|
18.7
|
|
|
38
|
|
38
|
|
38
|
|||||||||
|
其他股票变动合计
|
|
– 25
|
31
|
– 7 814
|
– 16
|
– 7 824
|
21
|
– 7 803
|
|||||||||
|
截至2018年12月31日的总权益,如先前报告
|
|
944
|
|
– 69
|
|
82 191
|
|
– 4 452
|
|
78 614
|
|
78
|
|
78 692
|
|||
|
会计政策变动的影响
|
1
|
|
|
|
|
3
|
|
|
|
3
|
|
|
|
3
|
|||
|
2019年1月1日重列权益
|
|
944
|
|
– 69
|
|
82 194
|
|
– 4 452
|
|
78 617
|
|
78
|
|
78 695
|
|||
|
净收入
|
|
|
|
11 732
|
|
11 732
|
5
|
11 737
|
|||||||||
|
其他综合收益
|
8
|
|
|
– 94
|
– 113
|
– 207
|
– 3
|
– 210
|
|||||||||
|
综合收益总额
|
|
|
|
11 638
|
– 113
|
11 525
|
2
|
11 527
|
|||||||||
|
分红
|
18.1
|
|
|
– 6 645
|
|
– 6 645
|
|
– 6 645
|
|||||||||
|
实物股息,以实现爱尔康公司的剥离。
|
2
|
|
|
– 23 434
|
|
– 23 434
|
|
– 23 434
|
|||||||||
|
购买库藏股
|
18.2
|
|
– 31
|
– 5 480
|
|
– 5 511
|
|
– 5 511
|
|||||||||
|
减少股本
|
18
|
– 8
|
12
|
– 4
|
|
|
|
|
|||||||||
|
行使期权和员工交易
|
18.2
|
|
3
|
207
|
|
210
|
|
210
|
|||||||||
|
基于股权的薪酬
|
18.2
|
|
5
|
828
|
|
833
|
|
833
|
|||||||||
|
作为剥离爱尔康的结果,交付给爱尔康员工的股票
|
18.2
|
|
|
18
|
|
18
|
|
18
|
|||||||||
|
库藏股交易税
|
|
|
|
– 189
|
|
– 189
|
|
– 189
|
|||||||||
|
减少股份回购交易计划下的库存股回购责任
|
18.3
|
|
|
284
|
|
284
|
|
284
|
|||||||||
|
交易成本,税后净额
|
18.4
|
|
|
– 253
|
|
– 253
|
|
– 253
|
|||||||||
|
出售金融资产的公允价值调整
|
8
|
|
|
95
|
– 95
|
|
|
|
|||||||||
|
合并实体所有权变更的影响
|
18.5
|
|
|
– 3
|
|
– 3
|
– 2
|
– 5
|
|||||||||
|
非控股权益的变动
|
18.6
|
|
|
|
|
|
– 1
|
– 1
|
|||||||||
|
与剥离有关的公允价值调整
|
8
|
|
|
– 3
|
3
|
|
|
|
|||||||||
|
其他动作
|
18.7
|
|
|
22
|
|
22
|
|
22
|
|||||||||
|
其他股票变动合计
|
|
– 8
|
– 11
|
– 34 557
|
– 92
|
– 34 668
|
– 3
|
– 34 671
|
|||||||||
|
2019年12月31日的总权益
|
|
936
|
– 80
|
59 275
|
– 4 657
|
55 474
|
77
|
55 551
|
|||||||||
|
附注是综合财务报表的组成部分。
|
|||||||||||||||||
|
(百万美元)
|
注意事项
|
2019
|
2018
|
2017
|
|||||
|
持续经营净收益
|
|
7 147
|
12 800
|
7 499
|
|||||
|
将持续业务的净收入与持续业务的业务活动现金流量净额进行调整
|
|
|
|
|
|||||
|
冲销非现金项目和其他调整
|
23.1
|
9 122
|
1 486
|
5 787
|
|||||
|
从联营公司及其他公司收取的股息
|
|
463
|
719
|
987
|
|||||
|
收到的利息
|
|
214
|
241
|
97
|
|||||
|
支付的利息
|
|
– 793
|
– 816
|
– 697
|
|||||
|
其他财务收入
|
|
28
|
218
|
|
|||||
|
其他财务付款
|
|
– 33
|
– 31
|
– 270
|
|||||
|
已缴纳的税款
|
23.2
|
– 1 876
|
– 1 506
|
– 1 487
|
|||||
|
营运资金和拨备变动前持续经营活动产生的经营活动现金流量净额
|
|
14 272
|
13 111
|
11 916
|
|||||
|
从准备金和非流动负债中的其他净现金流动中支付
|
|
– 924
|
– 638
|
– 829
|
|||||
|
流动资产净值和其他经营性现金流量项目变动
|
23.3
|
199
|
576
|
332
|
|||||
|
来自持续经营的经营活动现金流量净额
|
|
13 547
|
13 049
|
11 419
|
|||||
|
来自非持续经营的经营活动的现金流量净额
|
|
78
|
1 223
|
1 202
|
|||||
|
业务活动现金流量净额共计
|
|
13 625
|
14 272
|
12 621
|
|||||
|
购置房产、厂房和设备
|
|
– 1 379
|
– 1 254
|
– 1 325
|
|||||
|
出售财产、厂房和设备所得收益
|
|
857
|
102
|
91
|
|||||
|
购买无形资产
|
|
– 878
|
– 1 394
|
– 969
|
|||||
|
出售无形资产所得款项
|
|
973
|
823
|
640
|
|||||
|
购买金融资产
|
|
– 302
|
– 205
|
– 354
|
|||||
|
出售金融资产所得收益
|
|
1 152
|
165
|
328
|
|||||
|
购买其他非流动资产
|
|
– 60
|
– 39
|
– 40
|
|||||
|
出售其他非流动资产所得款项
|
|
3
|
9
|
1
|
|||||
|
收购和撤资联营公司的权益,净额
|
23.4
|
– 6
|
12 854
|
29
|
|||||
|
企业收购和撤资,净额
|
23.5
|
– 3 760
|
– 13 683
|
– 714
|
|||||
|
购买有价证券和商品
|
|
– 228
|
– 2 440
|
– 580
|
|||||
|
出售有价证券和商品所得
|
|
2 561
|
472
|
549
|
|||||
|
用于持续经营的投资活动的现金流量净额
|
|
– 1 067
|
– 4 590
|
– 2 344
|
|||||
|
用于投资活动的非持续业务现金流量净额
|
30
|
– 1 159
|
– 1 001
|
– 775
|
|||||
|
投资活动所用现金流量净额共计
|
|
– 2 226
|
– 5 591
|
– 3 119
|
|||||
|
支付给诺华制药股东的股息
|
|
– 6 645
|
– 6 966
|
– 6 495
|
|||||
|
收购库藏股
|
|
– 5 533
|
– 2 036
|
– 5 490
|
|||||
|
行使期权及其他库藏股交易所得收益
|
|
201
|
700
|
252
|
|||||
|
非流动金融债务增加
|
23.6
|
93
|
2 856
|
4 933
|
|||||
|
偿还非流动金融债务
|
23.6
|
– 3 195
|
– 366
|
– 188
|
|||||
|
本期财政债务变动情况
|
23.6
|
– 1 582
|
1 687
|
– 644
|
|||||
|
支付租赁负债,净额
|
23.6
|
– 273
|
|
|
|||||
|
合并实体所有权变更的影响
|
|
– 6
|
– 19
|
0
|
|||||
|
其他融资现金流,净额
|
|
56
|
67
|
314
|
|||||
|
用于持续业务筹资活动的现金流量净额
|
|
– 16 884
|
– 4 077
|
– 7 318
|
|||||
|
来自/用于已终止经营业务融资活动的现金流量净额
|
30
|
3 257
|
– 167
|
– 415
|
|||||
|
用于筹资活动的现金流量净额总额
|
|
– 13 627
|
– 4 244
|
– 7 733
|
|||||
|
汇率变动影响前的现金和现金等价物净变化
|
|
– 2 228
|
4 437
|
1 769
|
|||||
|
汇率变动对现金及现金等价物的影响
|
|
69
|
– 26
|
84
|
|||||
|
现金和现金等价物净变化总额
|
|
– 2 159
|
4 411
|
1 853
|
|||||
|
1月1日的现金和现金等价物
|
|
13 271
|
8 860
|
7 007
|
|||||
|
12月31日的现金和现金等价物
|
|
11 112
|
13 271
|
8 860
|
|||||
|
附注是综合财务报表的组成部分。
|
|||||||||
|
|
|||||||||
诺华集团合并财务报表附注
|
使用寿命
|
|||
|
建筑物
|
20到40年
|
||
|
机械及其他设备
|
|
||
|
机器和设备
|
7到20年
|
||
|
家具和车辆
|
5至10年
|
||
|
计算机硬件
|
3至7年
|
||
|
使用寿命 |
损益表位置
用于摊销和 减值费用 |
||||
|
目前市场上销售的产品
|
5到20年
|
“销货成本”
|
|||
|
营销诀窍
|
25年
|
“销货成本”
|
|||
|
技术
|
10到20年
|
"销售货物成本" 或"研究 和发展"
|
|||
|
其他(包括计算机软件)
|
3至7年
|
在相应的 功能费用
|
|||
|
爱尔康品牌名称
|
未摊销,无限期使用寿命
|
“其他费用”
|
|||
|
(百万美元) |
4月8日,
2019 |
||
|
取消确认的净资产 1
|
– 20 025
|
||
|
对分销责任的不再确认
|
23 434
|
||
|
净资产和分配负债之间的差额
|
3 409
|
||
|
关于Alcon Inc.通过合并基金会获得的股份
|
1 273
|
||
|
货币换算收益循环至综合收益表
|
123
|
||
|
在综合收益表中确认的交易成本
|
– 114
|
||
|
Alcon Inc.诺华公司股东
|
4 691
|
||
|
1 更多信息见附注30。
|
|||
|
(百万美元) |
十二月三十一日,
2019 |
十二月三十一日,
2018 |
|||
|
分类为持作出售的出售组别资产
|
|
|
|||
|
财产、厂房和设备
|
169
|
148
|
|||
|
商誉以外的无形资产
|
475
|
478
|
|||
|
递延税项资产
|
11
|
8
|
|||
|
其他非流动资产
|
2
|
1
|
|||
|
盘存
|
181
|
165
|
|||
|
其他流动资产
|
3
|
7
|
|||
|
总计
|
841
|
807
|
|||
|
(百万美元) |
十二月三十一日,
2019 |
十二月三十一日,
2018 |
|||
|
分类为持作出售之出售组别负债
|
|
|
|||
|
递延税项负债
|
2
|
2
|
|||
|
准备金和其他非流动负债
|
4
|
4
|
|||
|
准备金和其他流动负债
|
25
|
45
|
|||
|
总计
|
31
|
51
|
|||
|
创新药物
|
桑多兹
|
公司(包括淘汰)
|
集团化
|
||||||||||||||
|
(百万美元)
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
|||||||||
|
持续运营对第三方的净销售额
|
37 714
|
34 892
|
9 731
|
9 859
|
|
|
47 445
|
44 751
|
|||||||||
|
向持续经营及终止经营分部的销售
|
783
|
741
|
141
|
177
|
– 871
|
– 836
|
53
|
82
|
|||||||||
|
持续经营的净销售额
|
38 497
|
35 633
|
9 872
|
10 036
|
– 871
|
– 836
|
47 498
|
44 833
|
|||||||||
|
其他收入
|
1 092
|
1 188
|
63
|
62
|
24
|
16
|
1 179
|
1 266
|
|||||||||
|
销货成本
|
– 10 050
|
– 9 870
|
– 5 334
|
– 5 530
|
959
|
890
|
– 14 425
|
– 14 510
|
|||||||||
|
持续经营毛利
|
29 539
|
26 951
|
4 601
|
4 568
|
112
|
70
|
34 252
|
31 589
|
|||||||||
|
销售、一般和行政管理
|
– 11 617
|
– 10 907
|
– 2 218
|
– 2 305
|
– 534
|
– 505
|
– 14 369
|
– 13 717
|
|||||||||
|
研发
|
– 8 152
|
– 7 675
|
– 1 250
|
– 814
|
|
|
– 9 402
|
– 8 489
|
|||||||||
|
其他收入
|
1 586
|
977
|
167
|
505
|
278
|
147
|
2 031
|
1 629
|
|||||||||
|
其他费用
|
– 2 069
|
– 1 475
|
– 749
|
– 622
|
– 608
|
– 512
|
– 3 426
|
– 2 609
|
|||||||||
|
持续经营的营业收入
|
9 287
|
7 871
|
551
|
1 332
|
– 752
|
– 800
|
9 086
|
8 403
|
|||||||||
|
来自相联公司的收入
|
1
|
1
|
2
|
5
|
656
|
6 432
|
659
|
6 438
|
|||||||||
|
利息支出
|
|
|
|
|
|
|
– 850
|
– 932
|
|||||||||
|
其他财务收支
|
|
|
|
|
|
|
45
|
186
|
|||||||||
|
持续经营的税前收入
|
|
|
|
|
|
|
8 940
|
14 095
|
|||||||||
|
税费
|
|
|
|
|
|
|
– 1 793
|
– 1 295
|
|||||||||
|
持续经营净收益
|
|
|
|
|
|
|
7 147
|
12 800
|
|||||||||
|
停止经营的净亏损扣除分配给诺华制药股东的收益前的净亏损
|
|
|
|
|
|
|
– 101
|
– 186
|
|||||||||
|
Alcon Inc.诺华公司股东
|
|
|
|
|
|
|
4 691
|
|
|||||||||
|
非持续经营的净收益/(亏损)
|
|
|
|
|
|
|
4 590
|
– 186
|
|||||||||
|
净收入
|
|
|
|
|
|
|
|
|
11 737
|
12 614
|
|
||||||
|
归因于:
|
|
|
|
|
|
|
|
|
|||||||||
|
诺华制药的股东
|
|
|
|
|
|
|
11 732
|
12 611
|
|||||||||
|
非控制性权益
|
|
|
|
|
|
|
5
|
3
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
持续经营的净收入包括:
|
|
|
|
|
|
|
|
|
|||||||||
|
利息收入
|
|
|
|
|
|
|
245
|
292
|
|||||||||
|
财产、厂房和设备折旧
|
– 952
|
– 1 075
|
– 283
|
– 285
|
– 110
|
– 122
|
– 1 345
|
– 1 482
|
|||||||||
|
使用权资产折旧 1
|
– 247
|
|
– 41
|
|
– 17
|
|
– 305
|
|
|||||||||
|
无形资产摊销
|
– 2 509
|
– 2 214
|
– 315
|
– 366
|
– 12
|
– 7
|
– 2 836
|
– 2 587
|
|||||||||
|
不动产、厂场和设备减值费用净额
|
– 100
|
– 239
|
– 101
|
– 60
|
– 1
|
– 2
|
– 202
|
– 301
|
|||||||||
|
无形资产减值费用净额
|
– 632
|
– 592
|
– 506
|
– 249
|
|
|
– 1 138
|
– 841
|
|||||||||
|
金融资产减值支出及公允价值变动净额
|
18
|
107
|
|
|
20
|
– 113
|
38
|
– 6
|
|||||||||
|
对重组条款的补充
|
– 229
|
– 395
|
– 165
|
– 32
|
– 98
|
– 94
|
– 492
|
– 521
|
|||||||||
|
诺华股权计划的股权补偿
|
– 761
|
– 645
|
– 67
|
– 53
|
– 239
|
– 220
|
– 1 067
|
– 918
|
|||||||||
|
|
|||||||||||||||||
|
1 使用权资产折旧自二零一九年一月一日(国际财务报告准则第16号租赁的实施日期)起确认。附注1和10提供了额外披露。
|
|||||||||||||||||
|
|
|||||||||||||||||
|
创新药物
|
桑多兹
|
公司(包括淘汰)
|
集团化
|
||||||||||||||
|
(百万美元)
|
2018
|
2017
|
2018
|
2017
|
2018
|
2017
|
2018
|
2017
|
|||||||||
|
持续运营对第三方的净销售额
|
34 892
|
32 278
|
9 859
|
10 060
|
|
|
44 751
|
42 338
|
|||||||||
|
向持续经营及终止经营分部的销售
|
741
|
668
|
177
|
118
|
– 836
|
– 743
|
82
|
43
|
|||||||||
|
持续经营的净销售额
|
35 633
|
32 946
|
10 036
|
10 178
|
– 836
|
– 743
|
44 833
|
42 381
|
|||||||||
|
其他收入
|
1 188
|
898
|
62
|
37
|
16
|
88
|
1 266
|
1 023
|
|||||||||
|
销货成本
|
– 9 870
|
– 8 650
|
– 5 530
|
– 5 800
|
890
|
817
|
– 14 510
|
– 13 633
|
|||||||||
|
持续经营毛利
|
26 951
|
25 194
|
4 568
|
4 415
|
70
|
162
|
31 589
|
29 771
|
|||||||||
|
销售、一般和行政管理
|
– 10 907
|
– 9 887
|
– 2 305
|
– 2 126
|
– 505
|
– 452
|
– 13 717
|
– 12 465
|
|||||||||
|
研发
|
– 7 675
|
– 7 615
|
– 814
|
– 774
|
|
|
– 8 489
|
– 8 389
|
|||||||||
|
其他收入
|
977
|
1 027
|
505
|
204
|
147
|
691
|
1 629
|
1 922
|
|||||||||
|
其他费用
|
– 1 475
|
– 1 124
|
– 622
|
– 351
|
– 512
|
– 662
|
– 2 609
|
– 2 137
|
|||||||||
|
持续经营的营业收入
|
7 871
|
7 595
|
1 332
|
1 368
|
– 800
|
– 261
|
8 403
|
8 702
|
|||||||||
|
来自相联公司的收入
|
1
|
– 1
|
5
|
23
|
6 432
|
1 086
|
6 438
|
1 108
|
|||||||||
|
利息支出
|
|
|
|
|
|
|
– 932
|
– 750
|
|||||||||
|
其他财务收支
|
|
|
|
|
|
|
186
|
42
|
|||||||||
|
持续经营的税前收入
|
|
|
|
|
|
|
14 095
|
9 102
|
|||||||||
|
税费
|
|
|
|
|
|
|
– 1 295
|
– 1 603
|
|||||||||
|
持续经营净收益
|
|
|
|
|
|
|
12 800
|
7 499
|
|||||||||
|
净(亏损)/非持续经营收入
|
|
|
|
|
|
|
– 186
|
204
|
|||||||||
|
净收入
|
|
|
|
|
|
|
|
|
|
12 614
|
7 703
|
|
|||||
|
归因于:
|
|
|
|
|
|
|
|
|
|||||||||
|
诺华制药的股东
|
|
|
|
|
|
|
12 611
|
7 703
|
|||||||||
|
非控制性权益
|
|
|
|
|
|
|
3
|
0
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
持续经营的净收入包括:
|
|
|
|
|
|
|
|
|
|||||||||
|
利息收入
|
|
|
|
|
|
|
292
|
110
|
|||||||||
|
财产、厂房和设备折旧
|
– 1 075
|
– 916
|
– 285
|
– 270
|
– 122
|
– 117
|
– 1 482
|
– 1 303
|
|||||||||
|
无形资产摊销
|
– 2 214
|
– 2 167
|
– 366
|
– 447
|
– 7
|
– 10
|
– 2 587
|
– 2 624
|
|||||||||
|
不动产、厂场和设备减值费用净额
|
– 239
|
– 84
|
– 60
|
– 73
|
– 2
|
|
– 301
|
– 157
|
|||||||||
|
无形资产减值费用净额
|
– 592
|
– 591
|
– 249
|
– 61
|
|
|
– 841
|
– 652
|
|||||||||
|
金融资产减值支出及公允价值变动净额
|
107
|
– 42
|
|
|
– 113
|
– 185
|
– 6
|
– 227
|
|||||||||
|
对重组条款的补充
|
– 395
|
– 122
|
– 32
|
– 61
|
– 94
|
– 3
|
– 521
|
– 186
|
|||||||||
|
诺华股权计划的股权补偿
|
– 645
|
– 593
|
– 53
|
– 52
|
– 220
|
– 208
|
– 918
|
– 853
|
|||||||||
|
|
|||||||||||||||||
|
|
|||||||||||||||||
|
创新药物
|
桑多兹
|
阿尔康1
|
公司(包括淘汰)
|
集团化
|
|||||||||||||||||
|
(百万美元)
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
|||||||||||
|
总资产
|
71 225
|
67 055
|
16 468
|
17 328
|
|
25 971
|
30 677
|
35 209
|
118 370
|
145 563
|
|||||||||||
|
总负债
|
– 15 332
|
– 13 056
|
– 3 804
|
– 3 377
|
|
– 1 964
|
– 43 683
|
– 48 474
|
– 62 819
|
– 66 871
|
|||||||||||
|
总股本
|
|
|
|
|
|
|
|
|
55 551
|
78 692
|
|||||||||||
|
净债务
|
|
|
|
|
|
|
|
|
15 938
|
16 184
|
|||||||||||
|
净营业资产
|
55 893
|
53 999
|
12 664
|
13 951
|
|
24 007
|
|
|
71 489
|
94 876
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
资产及负债包括:
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
财产、厂房和设备合计
|
9 632
|
10 098
|
1 888
|
2 159
|
|
2 878
|
549
|
561
|
12 069
|
15 696
|
|||||||||||
|
不动产、厂场和设备的增加 2
|
1 114
|
822
|
217
|
294
|
|
519
|
143
|
139
|
1 474
|
1 774
|
|||||||||||
|
使用权资产总额 3
|
1 487
|
|
136
|
|
|
|
54
|
|
1 677
|
|
|||||||||||
|
对使用权资产的补充 2, 3
|
454
|
|
49
|
|
|
|
34
|
|
537
|
|
|||||||||||
|
商誉和无形资产总额
|
46 336
|
44 593
|
8 892
|
9 712
|
|
19 578
|
83
|
130
|
55 311
|
74 013
|
|||||||||||
|
商誉和无形资产的增加 2
|
647
|
1 265
|
68
|
107
|
|
196
|
52
|
24
|
767
|
1 592
|
|||||||||||
|
对联营公司的总投资
|
128
|
81
|
7
|
7
|
|
|
8 509
|
8 264
|
8 644
|
8 352
|
|||||||||||
|
增加对相联公司的投资
|
44
|
18
|
|
|
|
|
11
|
11
|
55
|
29
|
|||||||||||
|
现金及现金等价物、有价证券、商品、定期存款和衍生金融工具
|
|
|
|
|
|
|
11 446
|
15 964
|
11 446
|
15 964
|
|||||||||||
|
金融债务和衍生金融工具
|
|
|
|
|
|
|
27 384
|
32 148
|
27 384
|
32 148
|
|||||||||||
|
当期所得税和递延税项负债
|
|
|
|
|
|
|
8 061
|
9 513
|
8 061
|
9 513
|
|||||||||||
|
1 据报告,自2019年2月28日起,阿尔孔司已停止运作(见附注1、2和30)。根据国际财务报告准则,2018年12月31日的综合资产负债表包括爱尔康眼科护理设备业务的资产和负债,以及阿尔康业务应占的某些公司资产和负债。附注30提供了关于停产业务的补充资料。
|
|||||||||||||||||||||
|
2 不包括企业合并的影响。
|
|||||||||||||||||||||
|
3 2019年1月1日实施IFRS 16租约后,2019年确认的总使用权资产和对使用权资产的增加。有关其他披露,请参阅附注1和10。
|
|||||||||||||||||||||
|
净销售额1
|
选定非流动资产合计2
|
||||||||||||||||||||
|
(百万美元)
|
2019
|
%
|
2018
|
%
|
2017
|
%
|
2019
|
%
|
2018
|
%
|
|||||||||||
|
国家
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
瑞士
|
848
|
2
|
795
|
2
|
780
|
2
|
33 032
|
43
|
41 972
|
43
|
|||||||||||
|
美国
|
16 280
|
34
|
14 618
|
33
|
14 135
|
33
|
28 893
|
37
|
39 082
|
40
|
|||||||||||
|
法国
|
2 442
|
5
|
2 505
|
6
|
2 289
|
5
|
3 933
|
5
|
3 976
|
4
|
|||||||||||
|
德国
|
4 120
|
9
|
3 972
|
9
|
3 484
|
8
|
2 554
|
3
|
3 124
|
3
|
|||||||||||
|
日本
|
2 656
|
6
|
2 575
|
6
|
2 617
|
6
|
309
|
|
144
|
|
|||||||||||
|
其他
|
21 099
|
44
|
20 286
|
44
|
19 033
|
46
|
8 980
|
12
|
9 763
|
10
|
|||||||||||
|
集团化
|
47 445
|
100
|
44 751
|
100
|
42 338
|
100
|
77 701
|
100
|
98 061
|
100
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
区域
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
欧洲
|
17 933
|
38
|
17 259
|
39
|
15 760
|
37
|
46 103
|
59
|
55 913
|
57
|
|||||||||||
|
美洲
|
19 713
|
41
|
18 032
|
39
|
17 485
|
41
|
29 389
|
38
|
39 082
|
40
|
|||||||||||
|
亚洲/非洲/澳大拉西亚
|
9 799
|
21
|
9 460
|
22
|
9 093
|
22
|
2 209
|
3
|
3 066
|
3
|
|||||||||||
|
集团化
|
47 445
|
100
|
44 751
|
100
|
42 338
|
100
|
77 701
|
100
|
98 061
|
100
|
|||||||||||
|
|
|||||||||||||||||||||
|
1 按第三方客户所在地划分的运营净销售额
|
|||||||||||||||||||||
|
2 物业、厂房及设备;商誉;无形资产;及于联营公司的投资,以及于二零一九年的使用权资产总额于二零一九年一月一日实施国际财务报告准则第16号租赁时确认。其他披露见附注1和10。
|
|||||||||||||||||||||
|
2019 百万美元 |
2018 百万美元 |
变化
(2018 至2019年) 美元% |
2017 百万美元 |
变化
(2017 至2018年) 美元% |
|||||||
|
创新药物
|
|
|
|
|
|
||||||
|
欧洲
|
12 818
|
12 296
|
4
|
11 127
|
11
|
||||||
|
我们
|
13 789
|
11 864
|
16
|
10 857
|
9
|
||||||
|
亚洲/非洲/澳大拉西亚
|
8 458
|
8 097
|
4
|
7 702
|
5
|
||||||
|
加拿大和拉丁美洲
|
2 649
|
2 635
|
1
|
2 592
|
2
|
||||||
|
总计
|
37 714
|
34 892
|
8
|
32 278
|
8
|
||||||
|
其中在成熟市场
|
28 573
|
26 258
|
9
|
24 174
|
9
|
||||||
|
其中新兴增长市场
|
9 141
|
8 634
|
6
|
8 104
|
7
|
||||||
|
|
|
|
|
|
|||||||
|
桑多兹
|
|
|
|
|
|
||||||
|
欧洲
|
5 115
|
4 963
|
3
|
4 633
|
7
|
||||||
|
我们
|
2 491
|
2 754
|
– 10
|
3 278
|
– 16
|
||||||
|
亚洲/非洲/澳大拉西亚
|
1 341
|
1 363
|
– 2
|
1 391
|
– 2
|
||||||
|
加拿大和拉丁美洲
|
784
|
779
|
1
|
758
|
3
|
||||||
|
总计
|
9 731
|
9 859
|
– 1
|
10 060
|
– 2
|
||||||
|
其中在成熟市场
|
7 111
|
7 233
|
– 2
|
7 383
|
– 2
|
||||||
|
其中新兴增长市场
|
2 620
|
2 626
|
0
|
2 677
|
– 2
|
||||||
|
|
|
|
|
|
|||||||
|
集团化
|
|
|
|
|
|
||||||
|
欧洲
|
17 933
|
17 259
|
4
|
15 760
|
10
|
||||||
|
我们
|
16 280
|
14 618
|
11
|
14 135
|
3
|
||||||
|
亚洲/非洲/澳大拉西亚
|
9 799
|
9 460
|
4
|
9 093
|
4
|
||||||
|
加拿大和拉丁美洲
|
3 433
|
3 414
|
1
|
3 350
|
2
|
||||||
|
总计
|
47 445
|
44 751
|
6
|
42 338
|
6
|
||||||
|
其中在成熟市场
|
35 684
|
33 491
|
7
|
31 557
|
6
|
||||||
|
其中新兴增长市场
|
11 761
|
11 260
|
4
|
10 781
|
4
|
||||||
|
1 按第三方客户所在地划分的经营净销售额。新兴增长市场包括除美国、加拿大、西欧、日本、澳大利亚和新西兰的成熟市场以外的所有市场。
|
|||||||||||
|
|
|||||||||||
|
2019 百万美元 |
2018 百万美元 |
变化
(2018到 2019) 美元% |
2017 百万美元 |
变化
(2017到 2018) 美元% |
|||||||
|
肿瘤学
|
|
|
|
|
|
||||||
|
塔西尼亚
|
1 880
|
1 874
|
0
|
1 841
|
2
|
||||||
|
善得定
|
1 585
|
1 587
|
0
|
1 612
|
– 2
|
||||||
|
Afinator/Votubia
|
1 539
|
1 556
|
– 1
|
1 525
|
2
|
||||||
|
Promacta/Revolade
|
1 416
|
1 174
|
21
|
867
|
35
|
||||||
|
塔芬拉尔 + 麦金主义者
|
1 338
|
1 155
|
16
|
873
|
32
|
||||||
|
Gleevec/Glivec
|
1 263
|
1 561
|
– 19
|
1 943
|
– 20
|
||||||
|
雅卡维
|
1 114
|
977
|
14
|
777
|
26
|
||||||
|
Exjade/Jadeu
|
975
|
1 099
|
– 11
|
1 059
|
4
|
||||||
|
Votrient
|
755
|
828
|
– 9
|
808
|
2
|
||||||
|
基斯卡利
|
480
|
235
|
104
|
76
|
NM
|
||||||
|
卢塔瑟罗岛
|
441
|
167
|
164
|
0
|
NM
|
||||||
|
金利亚
|
278
|
76
|
NM
|
6
|
NM
|
||||||
|
皮克雷
|
116
|
|
NM
|
|
NM
|
||||||
|
其他
|
1 190
|
1 139
|
4
|
887
|
28
|
||||||
|
诺华肿瘤学业务部门总数
|
14 370
|
13 428
|
7
|
12 274
|
9
|
||||||
|
|
|
|
|
|
|||||||
|
眼科
|
|
|
|
|
|
||||||
|
卢森提斯
|
2 086
|
2 046
|
2
|
1 888
|
8
|
||||||
|
曲伏前列素组
|
433
|
517
|
– 16
|
589
|
– 12
|
||||||
|
西得拉
|
192
|
|
NM
|
|
NM
|
||||||
|
Beovu
|
35
|
|
NM
|
|
NM
|
||||||
|
其他
|
2 030
|
1 995
|
2
|
2 144
|
– 7
|
||||||
|
全眼科
|
4 776
|
4 558
|
5
|
4 621
|
– 1
|
||||||
|
|
|
|
|
|
|||||||
|
免疫学、肝病学和皮肤病学
|
|
|
|
|
|
||||||
|
科森提克斯
|
3 551
|
2 837
|
25
|
2 071
|
37
|
||||||
|
伊拉里斯
|
671
|
554
|
21
|
402
|
38
|
||||||
|
其他
|
|
1
|
NM
|
1
|
0
|
||||||
|
全免疫学、肝病学和皮肤科
|
4 222
|
3 392
|
24
|
2 474
|
37
|
||||||
|
|
|
|
|
|
|||||||
|
神经科学
|
|
|
|
|
|
||||||
|
吉伦亚
|
3 223
|
3 341
|
– 4
|
3 185
|
5
|
||||||
|
佐尔根斯马
|
361
|
|
NM
|
|
NM
|
||||||
|
艾莫维格
|
103
|
8
|
NM
|
|
NM
|
||||||
|
梅曾特
|
26
|
|
NM
|
|
NM
|
||||||
|
其他
|
60
|
80
|
– 25
|
102
|
– 22
|
||||||
|
全神经科学
|
3 773
|
3 429
|
10
|
3 287
|
4
|
||||||
|
2019 百万美元 |
2018 百万美元 |
变化
(2018到 2019) 美元% |
2017 百万美元 |
变化
(2017到 2018) 美元% |
|||||||
|
|
|
|
|
|
|||||||
|
呼吸性
|
|
|
|
|
|
||||||
|
Xolair 1
|
1 173
|
1 039
|
13
|
920
|
13
|
||||||
|
Ultibro Breezhaler
|
427
|
454
|
– 6
|
411
|
10
|
||||||
|
Seebri Breezhaler
|
121
|
148
|
– 18
|
151
|
– 2
|
||||||
|
Onbrez Breezhaler
|
82
|
101
|
– 19
|
112
|
– 10
|
||||||
|
其他
|
22
|
25
|
– 12
|
23
|
9
|
||||||
|
全呼吸
|
1 825
|
1 767
|
3
|
1 617
|
9
|
||||||
|
|
|
|
|
|
|||||||
|
心血管、肾脏和代谢
|
|
|
|
|
|
||||||
|
Entresto
|
1 726
|
1 028
|
68
|
507
|
103
|
||||||
|
其他
|
24
|
22
|
9
|
17
|
29
|
||||||
|
总心血管、肾脏和代谢
|
1 750
|
1 050
|
67
|
524
|
100
|
||||||
|
|
|
|
|
|
|||||||
|
已建立的药物
|
|
|
|
|
|
||||||
|
加尔沃斯集团化
|
1 297
|
1 284
|
1
|
1 233
|
4
|
||||||
|
Diovan集团化
|
1 064
|
1 023
|
4
|
957
|
7
|
||||||
|
Exforge集团化
|
1 025
|
1 002
|
2
|
960
|
4
|
||||||
|
佐瑞斯/认证
|
485
|
464
|
5
|
414
|
12
|
||||||
|
Neoral/Sandimmun(e)
|
419
|
463
|
– 10
|
488
|
– 5
|
||||||
|
Voltaren/Cataflam
|
417
|
445
|
– 6
|
465
|
– 4
|
||||||
|
其他
|
2 291
|
2 587
|
– 11
|
2 964
|
– 13
|
||||||
|
已建立的药品总数
|
6 998
|
7 268
|
– 4
|
7 481
|
– 3
|
||||||
|
|
|
|
|
|
|||||||
|
诺华制药业务部门合计
|
23 344
|
21 464
|
9
|
20 004
|
7
|
||||||
|
|
|
|
|
|
|||||||
|
总事业部净销售额
|
37 714
|
34 892
|
8
|
32 278
|
8
|
||||||
|
1 净销售额反映Xolair所有适应症的销售额。
|
|||||||||||
|
|
|||||||||||
|
NM=没有意义
|
|||||||||||
|
品牌 |
商业特许经营权 |
指示 |
我们 百万美元 |
其余
世界 百万美元 |
总计 百万美元 |
||||||
|
科森提克斯
|
免疫学、肝病学和皮肤病学
|
银屑病、强直性脊柱炎和银屑病关节炎
|
2 220
|
1 331
|
3 551
|
||||||
|
吉伦亚
|
神经科学
|
复发性多发性硬化症
|
1 736
|
1 487
|
3 223
|
||||||
|
卢森提斯
|
眼科
|
老年性黄斑变性
|
|
2 086
|
2 086
|
||||||
|
塔西尼亚
|
肿瘤学
|
慢性髓系白血病
|
804
|
1 076
|
1 880
|
||||||
|
Entresto
|
心血管,肾脏 和代谢
|
慢性心力衰竭
|
925
|
801
|
1 726
|
||||||
|
善得定
|
肿瘤学
|
类癌和肢端肥大症
|
881
|
704
|
1 585
|
||||||
|
Afinator/Votubia
|
肿瘤学
|
乳腺癌/TSC
|
1 003
|
536
|
1 539
|
||||||
|
Promacta/Revolade
|
肿瘤学
|
免疫性血小板减少(ITP)、重型再生障碍性贫血(SAA)
|
691
|
725
|
1 416
|
||||||
|
塔芬拉尔 + 麦金主义者
|
肿瘤学
|
BRAF V600+转移性和 晚期辅助性黑色素瘤 非小细胞肺癌
|
481
|
857
|
1 338
|
||||||
|
加尔沃斯集团化
|
已建立的药物
|
糖尿病
|
|
1 297
|
1 297
|
||||||
|
Gleevec/Glivec
|
肿瘤学
|
慢性粒细胞白血病与胃肠道间质瘤
|
334
|
929
|
1 263
|
||||||
|
Xolair 1
|
呼吸性
|
重度过敏性哮喘(SAA) 慢性自发性荨麻疹 (CSU)
|
|
1 173
|
1 173
|
||||||
|
雅卡维
|
肿瘤学
|
骨髓纤维化(MF), 单纯性红细胞增多症
|
|
1 114
|
1 114
|
||||||
|
Diovan集团化
|
已建立的药物
|
高血压
|
86
|
978
|
1 064
|
||||||
|
Exforge集团化
|
已建立的药物
|
高血压
|
13
|
1 012
|
1 025
|
||||||
|
Exjade/Jadeu
|
肿瘤学
|
慢性铁超负荷
|
450
|
525
|
975
|
||||||
|
Votrient
|
肿瘤学
|
肾细胞癌
|
332
|
423
|
755
|
||||||
|
伊拉里斯
|
免疫学、肝病学和皮肤病学
|
自身炎症(CAPS, 陷阱,HIDS/MKD,FMF,SJIA, AOSD和痛风)
|
304
|
367
|
671
|
||||||
|
佐瑞斯/认证
|
已建立的药物
|
移植
|
169
|
316
|
485
|
||||||
|
基斯卡利
|
肿瘤学
|
HR +/HER2—转移性乳腺癌
|
250
|
230
|
480
|
||||||
|
前20名产品合计
|
|
|
10 679
|
17 967
|
28 646
|
||||||
|
投资组合的其余部分
|
|
|
3 110
|
5 958
|
9 068
|
||||||
|
部门销售总额
|
|
|
13 789
|
23 925
|
37 714
|
||||||
|
1 净销售额反映Xolair所有适应症的销售额。
|
|||||||||||
|
品牌 |
商业特许经营权 |
指示 |
我们 百万美元 |
其余
世界 百万美元 |
总计 百万美元 |
||||||
|
吉伦亚
|
神经科学
|
复发性多发性硬化症
|
1 765
|
1 576
|
3 341
|
||||||
|
科森提克斯
|
免疫学、肝病学和皮肤病学
|
银屑病、强直性脊柱炎和银屑病关节炎
|
1 674
|
1 163
|
2 837
|
||||||
|
卢森提斯
|
眼科
|
老年性黄斑变性
|
|
2 046
|
2 046
|
||||||
|
塔西尼亚
|
肿瘤学
|
慢性髓系白血病
|
806
|
1 068
|
1 874
|
||||||
|
善得定
|
肿瘤学
|
类癌和肢端肥大症
|
817
|
770
|
1 587
|
||||||
|
Gleevec/Glivec
|
肿瘤学
|
慢性粒细胞白血病与胃肠道间质瘤
|
440
|
1 121
|
1 561
|
||||||
|
Afinator/Votubia
|
肿瘤学
|
乳腺癌/TSC
|
929
|
627
|
1 556
|
||||||
|
加尔沃斯集团化
|
已建立的药物
|
糖尿病
|
|
1 284
|
1 284
|
||||||
|
Promacta/Revolade
|
肿瘤学
|
免疫性血小板减少(ITP)、重型再生障碍性贫血(SAA)
|
581
|
593
|
1 174
|
||||||
|
塔芬拉尔 + 麦金主义者
|
肿瘤学
|
BRAF V600+转移性和 晚期辅助性黑色素瘤 非小细胞肺癌
|
457
|
698
|
1 155
|
||||||
|
Exjade/Jadeu
|
肿瘤学
|
慢性铁超负荷
|
521
|
578
|
1 099
|
||||||
|
Xolair 1
|
呼吸性
|
重度过敏性哮喘(SAA) 慢性自发性荨麻疹 (CSU)
|
|
1 039
|
1 039
|
||||||
|
Entresto
|
心血管,肾脏 和代谢
|
慢性心力衰竭
|
556
|
472
|
1 028
|
||||||
|
Diovan集团化
|
已建立的药物
|
高血压
|
84
|
939
|
1 023
|
||||||
|
Exforge集团化
|
已建立的药物
|
高血压
|
19
|
983
|
1 002
|
||||||
|
雅卡维
|
肿瘤学
|
骨髓纤维化(MF), 单纯性红细胞增多症
|
|
977
|
977
|
||||||
|
Votrient
|
肿瘤学
|
肾细胞癌
|
404
|
424
|
828
|
||||||
|
伊拉里斯
|
免疫学、肝病学和皮肤病学
|
自身炎症(CAPS, 陷阱,HIDS/MKD,FMF,SJIA, AOSD和痛风)
|
262
|
292
|
554
|
||||||
|
曲伏前列素组
|
眼科
|
眼内抬高复位术 压力
|
194
|
323
|
517
|
||||||
|
佐瑞斯/认证
|
已建立的药物
|
移植
|
145
|
319
|
464
|
||||||
|
前20名产品合计
|
|
|
9 654
|
17 292
|
26 946
|
||||||
|
投资组合的其余部分
|
|
|
2 210
|
5 736
|
7 946
|
||||||
|
部门销售总额
|
|
|
11 864
|
23 028
|
34 892
|
||||||
|
1 净销售额反映Xolair所有适应症的销售额。
|
|||||||||||
|
|
|||||||||||
|
品牌 |
商业特许经营权 |
指示 |
我们 百万美元 |
其余
世界 百万美元 |
总计 百万美元 |
||||||
|
吉伦亚
|
神经科学
|
复发性多发性硬化症
|
1 709
|
1 476
|
3 185
|
||||||
|
科森提克斯
|
免疫学、肝病学和皮肤病学
|
银屑病、强直性脊柱炎和银屑病关节炎
|
1 275
|
796
|
2 071
|
||||||
|
Gleevec/Glivec
|
肿瘤学
|
慢性粒细胞白血病与胃肠道间质瘤
|
627
|
1 316
|
1 943
|
||||||
|
卢森提斯
|
眼科
|
老年性黄斑变性
|
|
1 888
|
1 888
|
||||||
|
塔西尼亚
|
肿瘤学
|
慢性髓系白血病
|
810
|
1 031
|
1 841
|
||||||
|
善得定
|
肿瘤学
|
类癌和肢端肥大症
|
832
|
780
|
1 612
|
||||||
|
Afinator/Votubia
|
肿瘤学
|
乳腺癌/TSC
|
819
|
706
|
1 525
|
||||||
|
加尔沃斯集团化
|
已建立的药物
|
糖尿病
|
|
1 233
|
1 233
|
||||||
|
Exjade/Jadeu
|
肿瘤学
|
慢性铁超负荷
|
515
|
544
|
1 059
|
||||||
|
Exforge集团化
|
已建立的药物
|
高血压
|
28
|
932
|
960
|
||||||
|
Diovan集团化
|
已建立的药物
|
高血压
|
87
|
870
|
957
|
||||||
|
Xolair 1
|
呼吸性
|
重度过敏性哮喘(SAA) 慢性自发性荨麻疹 (CSU)
|
|
920
|
920
|
||||||
|
塔芬拉尔 + 麦金主义者
|
肿瘤学
|
BRAF V600+转移性和 晚期辅助性黑色素瘤 非小细胞肺癌
|
339
|
534
|
873
|
||||||
|
Promacta/Revolade
|
肿瘤学
|
免疫性血小板减少(ITP)、重型再生障碍性贫血(SAA)
|
446
|
421
|
867
|
||||||
|
Votrient
|
肿瘤学
|
肾细胞癌
|
407
|
401
|
808
|
||||||
|
雅卡维
|
肿瘤学
|
骨髓纤维化(MF), 单纯性红细胞增多症
|
|
777
|
777
|
||||||
|
曲伏前列素组
|
眼科
|
降低升高的 眼压
|
216
|
373
|
589
|
||||||
|
Entresto
|
心血管,肾脏 和代谢
|
慢性心力衰竭
|
297
|
210
|
507
|
||||||
|
Neoral/Sandimmun(e)
|
免疫学、肝病学和皮肤病学
|
移植
|
38
|
450
|
488
|
||||||
|
Voltaren/Cataflam
|
已建立的药物
|
炎症/疼痛
|
|
465
|
465
|
||||||
|
前20名产品合计
|
|
|
8 445
|
16 123
|
24 568
|
||||||
|
投资组合的其余部分
|
|
|
2 412
|
5 298
|
7 710
|
||||||
|
部门销售总额
|
|
|
10 857
|
21 421
|
32 278
|
||||||
|
1 净销售额反映Xolair所有适应症的销售额。
|
|||||||||||
|
|
|||||||||||
|
2019 百万美元 |
2018 百万美元 |
变化
(2018到 2019) 美元% |
2017 百万美元 |
变化
(2017到 2018) 美元% |
|||||||
|
零售业泛型 1
|
7 590
|
7 880
|
– 4
|
8 409
|
– 6
|
||||||
|
生物制药
|
1 607
|
1 436
|
12
|
1 135
|
27
|
||||||
|
抗感染
|
534
|
543
|
– 2
|
516
|
5
|
||||||
|
部门销售净额共计
|
9 731
|
9 859
|
– 1
|
10 060
|
– 2
|
||||||
|
1 其中7.84亿美元(2018年:8.26亿美元;2017年:8.8亿美元)代表以Sandoz名义销售的抗感染药物
|
|||||||||||
|
创新药物
|
桑多兹
|
公司(包括淘汰)
|
集团化
|
||||||||||||||
|
(百万美元)
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
|||||||||
|
利润分享收入
|
732
|
874
|
2
|
3
|
|
|
734
|
877
|
|||||||||
|
特许使用费收入
|
104
|
162
|
19
|
10
|
24
|
16
|
147
|
188
|
|||||||||
|
里程碑式收入
|
201
|
128
|
30
|
45
|
|
|
231
|
173
|
|||||||||
|
其他 1
|
55
|
24
|
12
|
4
|
|
|
67
|
28
|
|||||||||
|
其他收入合计
|
1 092
|
1 188
|
63
|
62
|
24
|
16
|
1 179
|
1 266
|
|||||||||
|
1 其他包括制造或提供其他服务等活动的收入,但此类收入不计入净销售额。
|
|||||||||||||||||
|
创新药物
|
桑多兹
|
公司(包括淘汰)
|
集团化
|
||||||||||||||
|
(百万美元)
|
2018
|
2017
|
2018
|
2017
|
2018
|
2017
|
2018
|
2017
|
|||||||||
|
利润分享收入
|
874
|
648
|
3
|
4
|
|
|
877
|
652
|
|||||||||
|
特许使用费收入
|
162
|
186
|
10
|
24
|
16
|
88
|
188
|
298
|
|||||||||
|
里程碑式收入
|
128
|
28
|
45
|
|
|
|
173
|
28
|
|||||||||
|
其他 1
|
24
|
36
|
4
|
9
|
|
|
28
|
45
|
|||||||||
|
其他收入合计
|
1 188
|
898
|
62
|
37
|
16
|
88
|
1 266
|
1 023
|
|||||||||
|
1 其他包括制造或提供其他服务等活动的收入,但此类收入不计入净销售额。
|
|||||||||||||||||
|
净利润表效应
|
其他综合收益效应 1
|
总综合收益效应
|
|||||||||||||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
2019
|
2018
|
2017
|
2019
|
2018
|
2017
|
||||||||||
|
瑞士罗氏控股公司
|
662
|
526
|
456
|
– 94
|
75
|
108
|
568
|
601
|
564
|
||||||||||
|
葛兰素史克消费者医疗保健控股有限公司,英国
|
|
5 910
|
629
|
|
– 557
|
– 145
|
|
5 353
|
484
|
||||||||||
|
其他
|
– 3
|
2
|
23
|
|
|
|
– 3
|
2
|
23
|
||||||||||
|
与持续经营有关的联营公司
|
659
|
6 438
|
1 108
|
– 94
|
– 482
|
– 37
|
565
|
5 956
|
1 071
|
||||||||||
|
1 2018年,由于剥离对GSK Consumer Healthcare Holdings Ltd.的投资,诺华在关联公司确认的其他全面收益中的税后净额5.11亿美元被循环到综合收益表中。2019年和2017年,没有诺华份额的关联公司确认的其他全面收益中的税后净额被循环到综合收益表中。
|
|||||||||||||||||||
|
资产负债表价值
|
|||||
|
(百万美元) |
十二月三十一日,
2019 |
十二月三十一日,
2018 |
|||
|
瑞士罗氏控股公司
|
8 445
|
8 195
|
|||
|
其他
|
199
|
157
|
|||
|
总计
|
8 644
|
8 352
|
|||
|
(数十亿瑞士法郎) |
流动资产 |
非当前
资产 |
当前
负债 |
非当前
负债 |
|||||
|
2018年12月31日
|
32.2
|
53.7
|
23.0
|
25.1
|
|||||
|
2019年6月30日
|
32.3
|
53.8
|
23.4
|
25.7
|
|||||
|
(数十亿瑞士法郎) |
收入 |
净收入 |
其他
明白-- 高收入 |
总计
明白-- 高收入 |
|||||
|
2018年12月31日
|
59.5
|
8.6
|
– 0.1
|
8.5
|
|||||
|
2019年6月30日
|
31.8
|
8.3
|
– 0.6
|
7.7
|
|||||
|
(百万美元) |
十二月三十一日,
2019 |
||
|
诺华在罗氏估计净资产中的份额
|
2 404
|
||
|
诺华在重新评估的无形资产中所占份额
|
297
|
||
|
隐性诺华商誉
|
2 939
|
||
|
在可识别净资产和商誉中份额的现值
|
5 640
|
||
|
累计权益会计调整及换算影响减已收股息
|
2 805
|
||
|
资产负债表价值
|
8 445
|
||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
诺华在罗氏本年度估计合并净利润中的份额
|
910
|
799
|
669
|
||||
|
上年度调整
|
– 129
|
– 125
|
– 67
|
||||
|
与无形资产有关的公允价值调整摊销,税后净额为2400万美元(2018年:4000万美元;2017年:4200万美元)
|
– 162
|
– 148
|
– 146
|
||||
|
部分解除已确认的递延税项负债
|
43
|
|
|
||||
|
净收益效应
|
662
|
526
|
456
|
||||
|
(百万美元)
|
2018
|
2017
|
|||
|
诺华占GSK消费者医疗集团预计本年度合并净利润的份额
|
119
|
589
|
|||
|
上年度调整
|
4
|
47
|
|||
|
摊销无形资产及存货之公允价值调整,扣除税项100万美元(二零一七年:100万美元)
|
– 3
|
– 7
|
|||
|
剥离GSK Consumer Healthcare的税前收益
|
5 790
|
|
|||
|
净收益效应
|
5 910
|
629
|
|||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
利息支出
|
– 714
|
– 877
|
– 741
|
||||
|
租赁负债利息支出
|
– 66
|
|
|
||||
|
贴现长期负债和资本化借款成本产生的费用
|
– 70
|
– 55
|
– 9
|
||||
|
持续经营的利息支出总额
|
– 850
|
– 932
|
– 750
|
||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
利息收入
|
245
|
292
|
110
|
||||
|
其他财务收入
|
12
|
1
|
1
|
||||
|
财务费用
|
– 52
|
– 39
|
– 11
|
||||
|
货币结果,净额
|
– 160
|
– 68
|
– 58
|
||||
|
持续经营的其他财务收入和支出总额
|
45
|
186
|
42
|
||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
瑞士
|
8 097
|
11 887
|
5 385
|
||||
|
外国
|
843
|
2 208
|
3 717
|
||||
|
来自持续经营业务的税前收入
|
8 940
|
14 095
|
9 102
|
||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
瑞士
|
– 1 186
|
– 615
|
– 462
|
||||
|
外国
|
– 961
|
– 988
|
– 1 451
|
||||
|
当期所得税支出
|
– 2 147
|
– 1 603
|
– 1 913
|
||||
|
瑞士
|
– 93
|
– 120
|
– 305
|
||||
|
外国
|
447
|
428
|
615
|
||||
|
递延税项收入
|
354
|
308
|
310
|
||||
|
来自持续经营业务的所得税费用
|
– 1 793
|
– 1 295
|
– 1 603
|
||||
|
(As(百分比)
|
2019
|
2018
|
2017
|
||||
|
适用税率
|
11.7
|
14.3
|
14.3
|
||||
|
不准许开支的影响
|
4.8
|
1.7
|
3.1
|
||||
|
利用前期结转的税务亏损的影响
|
– 0.1
|
– 0.1
|
– 0.1
|
||||
|
减税后入息课税的影响
|
– 0.7
|
– 0.4
|
– 0.2
|
||||
|
无须缴税的入息的影响 1
|
0.0
|
– 3.7
|
0.0
|
||||
|
税收抵免和免税额的影响
|
– 2.3
|
– 2.3
|
– 2.1
|
||||
|
解除或有对价负债的效果
|
– 0.5
|
– 0.2
|
– 1.3
|
||||
|
税率变动对流动和递延税项资产负债的影响 2
|
– 1.4
|
– 0.1
|
4.8
|
||||
|
递延税项资产核销的影响 3
|
4.0
|
0.2
|
0.0
|
||||
|
附属公司投资减记及回减记的影响
|
– 0.6
|
0.0
|
– 1.1
|
||||
|
2017年到期的税收优惠
|
0.0
|
0.0
|
– 0.9
|
||||
|
上一年度项目的影响
|
2.2
|
– 0.5
|
1.2
|
||||
|
其他项目的效果 4
|
3.0
|
0.3
|
– 0.1
|
||||
|
持续经营的有效税率
|
20.1
|
9.2
|
17.6
|
||||
|
|
|||||||
|
1 于2018年计入本集团出售于瑞士的GSK Consumer Healthcare Holdings Ltd.投资所产生的免税收入(-3.7%)的影响。
|
|||||||
|
2 2019年主要与瑞士于2019年实施的税务改革导致的递延税项资产及负债重估有关,额外披露请参阅附注12。
于二零一七年包括与递延税项资产及负债及部分即期应付税项重估有关的4. 8%影响。该重估乃由于于二零一七年十二月二十二日颁布之美国税务改革法例所致,有关额外披露,请参阅附注12。 |
|||||||
|
3 2019年主要与因法人重组产生的递延税项资产核销的非现金一次性递延税项开支有关。
|
|||||||
|
4 2019年其他项目(+3.0%)包括不确定税位变动(+2.6%)和其他项目(+0.4%)。
|
|||||||
|
2019
|
2018
|
2017
|
|||||
|
诺华制药股东应占净收益(百万美元)
|
|
|
|
||||
|
-持续运营
|
7 142
|
12 797
|
7 499
|
||||
|
-停产业务
|
4 590
|
– 186
|
204
|
||||
|
总计
|
11 732
|
12 611
|
7 703
|
||||
|
|
|
|
|||||
|
股份数量(单位:百万)
|
|
|
|
||||
|
用于基本每股收益的加权平均流通股数量
|
2 291
|
2 319
|
2 346
|
||||
|
从期权中归属限制性股份、限制性股份单位和摊薄股份的调整
|
28
|
25
|
25
|
||||
|
稀释后每股收益中的加权平均股数
|
2 319
|
2 344
|
2 371
|
||||
|
|
|
|
|||||
|
基本每股收益(美元)
|
|
|
|
||||
|
-持续运营
|
3.12
|
5.52
|
3.20
|
||||
|
-停产业务
|
2.00
|
– 0.08
|
0.08
|
||||
|
总计
|
5.12
|
5.44
|
3.28
|
||||
|
|
|
|
|||||
|
稀释后每股收益(美元)
|
|
|
|
||||
|
-持续运营
|
3.08
|
5.46
|
3.17
|
||||
|
-停产业务
|
1.98
|
– 0.08
|
0.08
|
||||
|
总计
|
5.06
|
5.38
|
3.25
|
||||
|
(百万美元) |
公允价值
调整 论适销对路 证券 |
公允价值
调整 关于债务 证券 |
公允价值
调整 递延现金 流动套期保值 |
公允价值
调整 股本 证券 |
精算
得/(失) 从已定义的 福利计划 |
累计
货币 翻译 效果 |
总价值 调整 |
||||||||
|
2017年1月1日的价值调整
|
349
|
– 1
|
– 3
|
|
– 5 915
|
– 1 642
|
– 7 212
|
||||||||
|
金融工具公允价值调整
|
39
|
– 1
|
12
|
|
|
|
50
|
||||||||
|
净投资对冲
|
|
|
|
|
|
– 237
|
– 237
|
||||||||
|
福利确定型计划精算净损失
|
|
|
|
|
851
|
|
851
|
||||||||
|
货币换算效应
|
|
|
|
|
|
2 208
|
2 208
|
||||||||
|
2017年总价值调整数
|
39
|
– 1
|
12
|
|
851
|
1 971
|
2 872
|
||||||||
|
如先前报告所述,截至2017年12月31日的价值调整
|
388
|
– 2
|
9
|
|
– 5 064
|
329
|
– 4 340
|
||||||||
|
采用国际财务报告准则第9号对留存收益和保监局的影响 1
|
– 177
|
|
|
|
|
|
– 177
|
||||||||
|
重新分类为IFRS 9所要求的列报 1
|
– 211
|
|
|
211
|
|
|
|
||||||||
|
重述2018年1月1日的价值调整
|
|
– 2
|
9
|
211
|
– 5 064
|
329
|
– 4 517
|
||||||||
|
金融工具公允价值调整
|
|
|
12
|
13
|
|
|
25
|
||||||||
|
出售金融资产的公允价值调整
|
|
|
|
– 16
|
|
|
– 16
|
||||||||
|
净投资对冲
|
|
|
|
|
|
95
|
95
|
||||||||
|
固定福利计划的净精算收益
|
|
|
|
|
– 359
|
|
– 359
|
||||||||
|
货币换算效应
|
|
|
|
|
|
320
|
320
|
||||||||
|
2018年总价值调整
|
|
|
12
|
– 3
|
– 359
|
415
|
65
|
||||||||
|
2018年12月31日的价值调整
|
|
– 2
|
21
|
208
|
– 5 423
|
744
|
– 4 452
|
||||||||
|
金融工具公允价值调整
|
|
1
|
1
|
– 47
|
|
|
– 45
|
||||||||
|
出售金融资产的公允价值调整
|
|
|
|
– 95
|
|
|
– 95
|
||||||||
|
净投资对冲
|
|
|
|
|
|
44
|
44
|
||||||||
|
固定福利计划的净精算收益
|
|
|
|
|
– 466
|
|
– 466
|
||||||||
|
货币换算效应
|
|
|
|
|
|
354
|
354
|
||||||||
|
2019年总价值调整
|
|
1
|
1
|
– 142
|
– 466
|
398
|
– 208
|
||||||||
|
与剥离有关的公允价值调整
|
|
|
|
33
|
– 30
|
|
3
|
||||||||
|
2019年12月31日的价值调整
|
|
– 1
|
22
|
99
|
– 5 919
|
1 142
|
– 4 657
|
||||||||
|
1 附注1提供了与采用国际财务报告准则第9号金融工具的影响有关的额外披露。保监处:其他全面收入
|
|||||||||||||||
|
(百万美元) |
公允价值
调整 论公平性 证券 1 |
公允价值
调整 关于债务 证券 |
公允价值
调整 递延现金 流动套期保值 |
总计 |
|
||||||
|
2019年1月1日的公允价值调整
|
208
|
– 2
|
21
|
227
|
|||||||
|
公允价值变动:
|
|
|
|
|
|||||||
|
-出售的债务证券
|
|
1
|
|
1
|
|||||||
|
-股权证券
|
– 94
|
|
|
– 94
|
|||||||
|
转入综合损益表的现金流量对冲的摊销净亏损
|
|
|
1
|
1
|
|||||||
|
上述项目的递延税金
|
47
|
|
|
47
|
|||||||
|
重新分类至保留盈利的已实现净收益:
|
|
|
|
|
|||||||
|
—出售的其他金融资产
|
– 95
|
|
|
– 95
|
|||||||
|
年内公平值调整
|
– 142
|
1
|
1
|
– 140
|
|||||||
|
与剥离有关的公允价值调整
|
33
|
|
|
|
33
|
|
|||||
|
2019年12月31日的公允价值调整
|
99
|
– 1
|
22
|
120
|
|||||||
|
1 包括指定为金融资产的权益证券的公允价值调整,这些资产通过其他全面收益按公允价值估值,随后不会再循环进入综合损益表
|
|||||||||||
|
(百万美元) |
公允价值
调整 从有价 证券 |
公允价值
调整 论公平性 证券 1 |
公允价值
调整 关于债务 证券 |
公允价值
调整 递延现金 流动套期保值 |
总计 |
||||||
|
公允价值调整于2018年1月1日,如前所述
|
388
|
|
– 2
|
9
|
395
|
||||||
|
采用国际财务报告准则第9号对留存收益和其他全面收益的影响 2
|
– 177
|
|
|
|
– 177
|
||||||
|
重新分类为IFRS 9所要求的列报
|
– 211
|
211
|
|
|
|
||||||
|
于2018年1月1日重述公允价值调整
|
|
211
|
– 2
|
9
|
218
|
||||||
|
公允价值变动:
|
|
|
|
|
|
||||||
|
-股权证券
|
|
18
|
|
|
18
|
||||||
|
转入综合损益表的现金流量对冲的摊销净亏损
|
|
|
|
13
|
13
|
||||||
|
上述项目的递延税金
|
|
– 5
|
|
– 1
|
– 6
|
||||||
|
重新分类至保留盈利的已实现净收益:
|
|
|
|
|
|
||||||
|
—出售的其他金融资产
|
|
– 16
|
|
|
– 16
|
||||||
|
年内公平值调整
|
|
– 3
|
|
12
|
9
|
||||||
|
2018年12月31日的公允价值调整
|
|
208
|
– 2
|
21
|
227
|
||||||
|
1 包括指定为金融资产的权益证券的公允价值调整,这些资产通过其他全面收益按公允价值估值,随后不会再循环进入综合损益表
|
|||||||||||
|
2 附注1提供关于采用国际财务报告准则第9号金融工具的影响的补充披露。
|
|||||||||||
|
(百万美元) |
公允价值
调整 论适销对路 证券 |
公允价值
调整 关于债务 证券 |
公允价值
调整 递延现金 流动套期保值 |
总计 |
|||||
|
2017年1月1日的公允价值调整
|
349
|
– 1
|
– 3
|
345
|
|||||
|
公允价值变动:
|
|
|
|
|
|||||
|
—可供出售的有价证券
|
12
|
– 1
|
|
11
|
|||||
|
—可供出售金融投资
|
47
|
|
|
47
|
|||||
|
已实现收益净额转拨至综合收益表:
|
|
|
|
|
|||||
|
—出售的其他金融资产
|
– 109
|
|
|
– 109
|
|||||
|
转入综合损益表的现金流量对冲的摊销净亏损
|
|
|
13
|
13
|
|||||
|
转拨至综合收益表的减值金融资产
|
102
|
|
|
102
|
|||||
|
上述项目的递延税金 1
|
– 13
|
|
– 1
|
– 14
|
|||||
|
年内公平值调整
|
39
|
– 1
|
12
|
50
|
|||||
|
2017年12月31日的公允价值调整
|
388
|
– 2
|
9
|
395
|
|||||
|
1 包括与美国持有的可供出售金融投资的递延税项负债重估有关的1,800万美元的影响,该影响先前通过与持续经营有关的其他全面收益确认。此次重估是由于美国于2017年12月22日颁布的税务改革立法所致。有关额外披露,请参阅附注12。
|
|||||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
税前固定福利养老金计划
|
– 119
|
– 482
|
1 367
|
||||
|
其他税前离职后福利计划
|
– 35
|
54
|
76
|
||||
|
上述项目的征税 1
|
– 313
|
69
|
– 592
|
||||
|
税后共计
|
– 467
|
– 359
|
851
|
||||
|
归因于:
|
|
|
|
||||
|
诺华制药的股东
|
– 466
|
– 359
|
851
|
||||
|
非控制性权益
|
– 1
|
|
|
||||
|
|
|||||||
|
1 2019年包括与瑞士离职后福利递延税项资产重估有关的—3.58亿美元影响,该影响先前通过其他全面收益确认。这次重估是由于选民在2019年实施的瑞士税收改革。有关额外披露,请参阅附注12。
2017年包括与美国离职后福利递延税项资产重估有关的影响—2.72亿美元,该影响先前通过其他全面收益确认(持续经营业务—2.59亿美元及已终止经营业务—1300万美元)。此次重估是由于美国于2017年12月22日颁布的税务改革立法所致。有关额外披露,请参阅附注12。 |
|||||||
|
(百万美元) |
土地 |
建筑物 |
施工 正在进行中 |
机械设备
及其他 装备 |
总计 |
||||||
|
成本
|
|
|
|
|
|
||||||
|
2019年1月1日
|
696
|
14 135
|
2 042
|
17 155
|
34 028
|
||||||
|
与终止经营有关的资产成本 1
|
– 61
|
– 1 615
|
– 655
|
– 2 678
|
– 5 009
|
||||||
|
重新分类为使用权资产 2
|
– 122
|
– 3
|
|
– 2
|
– 127
|
||||||
|
与持作出售之出售组别有关之资产成本 3
|
|
– 3
|
– 12
|
– 8
|
– 23
|
||||||
|
企业合并的影响
|
10
|
24
|
1
|
9
|
44
|
||||||
|
重新分类 4
|
57
|
332
|
– 1 019
|
630
|
|
||||||
|
加法 5
|
6
|
112
|
1 001
|
355
|
1 474
|
||||||
|
处置和取消认可 6
|
– 75
|
– 1 551
|
– 9
|
– 1 774
|
– 3 409
|
||||||
|
货币换算效应
|
1
|
32
|
1
|
– 13
|
21
|
||||||
|
2019年12月31日
|
512
|
11 463
|
1 350
|
13 674
|
26 999
|
||||||
|
|
|
|
|
|
|||||||
|
累计折旧
|
|
|
|
|
|
||||||
|
2019年1月1日
|
– 43
|
– 6 328
|
– 37
|
– 11 924
|
– 18 332
|
||||||
|
与已终止业务有关的资产累计折旧 1
|
8
|
562
|
7
|
1 541
|
2 118
|
||||||
|
重新分类为使用权资产 2
|
26
|
|
|
|
26
|
||||||
|
与持作出售之出售组别相关之资产累计折旧 3
|
|
2
|
|
|
2
|
||||||
|
处置和解除确认的累计折旧 6
|
|
1 170
|
2
|
1 674
|
2 846
|
||||||
|
折旧费 7
|
|
– 447
|
|
– 898
|
– 1 345
|
||||||
|
减值费用 8
|
– 10
|
– 51
|
– 34
|
– 110
|
– 205
|
||||||
|
减值费用冲销
|
|
1
|
2
|
|
3
|
||||||
|
货币换算效应
|
– 1
|
– 33
|
|
– 9
|
– 43
|
||||||
|
2019年12月31日
|
– 20
|
– 5 124
|
– 60
|
– 9 726
|
– 14 930
|
||||||
|
2019年12月31日的账面净值
|
492
|
6 339
|
1 290
|
3 948
|
12 069
|
||||||
|
购买房产、厂房和设备的承诺
|
|
|
|
|
220
|
||||||
|
资本化借款成本
|
|
|
|
|
4
|
||||||
|
1 指于二零一九年一月一日与报告为已终止经营业务的Alcon业务有关的资产成本及累计折旧。附注1、2和30提供了与已终止业务有关的资料。
|
|||||||||||
|
2 采纳国际财务报告准则第16号租赁后,于二零一九年一月一日重新分类至使用权资产。有关额外披露,请参阅附注1及10。
|
|||||||||||
|
3 附注2提供有关持作出售之出售组别之额外披露。
|
|||||||||||
|
4 由于厂房和其他在建设备完工,各资产类别之间的重新分类
|
|||||||||||
|
5 2019年1月1日至2019年12月31日期间持作出售出售的出售组别的增加额为23百万美元。
|
|||||||||||
|
6 终止确认不再使用且被视为不具有重大出售价值或其他替代用途的资产
|
|||||||||||
|
7 于二零一九年一月一日至二零一九年十二月三十一日期间,持作出售之出售组别并无录得折旧开支。
|
|||||||||||
|
8 于二零一九年一月一日至二零一九年十二月三十一日期间,持作出售之出售组别之减值为200万美元。
|
|||||||||||
|
(百万美元) |
土地 |
建筑物 |
施工 正在进行中 |
机械设备
及其他 装备 |
总计 |
||||||
|
成本
|
|
|
|
|
|
||||||
|
2018年1月1日
|
720
|
14 064
|
2 368
|
16 858
|
34 010
|
||||||
|
与持作出售之出售组别有关之资产成本 1
|
– 11
|
– 114
|
– 24
|
– 160
|
– 309
|
||||||
|
企业合并的影响
|
2
|
40
|
15
|
80
|
137
|
||||||
|
重新分类 2
|
1
|
538
|
– 1 470
|
931
|
|
||||||
|
加法 3
|
7
|
110
|
1 250
|
407
|
1 774
|
||||||
|
处置和取消认可 4
|
– 7
|
– 212
|
– 21
|
– 457
|
– 697
|
||||||
|
货币换算效应
|
– 16
|
– 291
|
– 76
|
– 504
|
– 887
|
||||||
|
2018年12月31日
|
696
|
14 135
|
2 042
|
17 155
|
34 028
|
||||||
|
|
|
|
|
|
|||||||
|
累计折旧
|
|
|
|
|
|
||||||
|
2018年1月1日
|
– 40
|
– 5 983
|
– 38
|
– 11 485
|
– 17 546
|
||||||
|
与持作出售之出售组别相关之资产累计折旧 1
|
|
56
|
4
|
101
|
161
|
||||||
|
折旧费 5
|
– 3
|
– 574
|
|
– 1 140
|
– 1 717
|
||||||
|
处置和解除确认的累计折旧 4
|
|
180
|
3
|
412
|
595
|
||||||
|
减值费用
|
– 1
|
– 122
|
– 16
|
– 185
|
– 324
|
||||||
|
减值费用冲销
|
|
|
8
|
12
|
20
|
||||||
|
货币换算效应
|
1
|
115
|
2
|
361
|
479
|
||||||
|
2018年12月31日
|
– 43
|
– 6 328
|
– 37
|
– 11 924
|
– 18 332
|
||||||
|
2018年12月31日的账面净值
|
653
|
7 807
|
2 005
|
5 231
|
15 696
|
||||||
|
融资租赁合同项下的不动产、厂场和设备账面净值
|
|
79
|
|
|
79
|
||||||
|
购买房产、厂房和设备的承诺
|
|
|
|
|
289
|
||||||
|
资本化借款成本
|
|
|
|
|
6
|
||||||
|
1 附注2提供有关持作出售之出售组别之额外披露。
|
|||||||||||
|
2 由于厂房和其他在建设备完工,各资产类别之间的重新分类
|
|||||||||||
|
3 持作出售的出售集团的新增金额为2100万美元。
|
|||||||||||
|
4 终止确认不再使用且被视为不具有重大出售价值或其他替代用途的资产
|
|||||||||||
|
5 于二零一八年一月一日至重新分类至持作出售资产当日止期间,持作出售之出售组别之折旧支出为15百万美元。有关已终止经营业务的折旧费用,请参阅附注30。
|
|||||||||||
|
(百万美元)
|
|
||
|
经营租赁承诺2018年12月31日 1
|
3 612
|
||
|
经营租赁承诺2018年12月31日与已终止业务有关
|
– 222
|
||
|
经营租赁承诺2018年12月31日与持续经营有关
|
3 390
|
||
|
短期租赁的确认豁免
|
– 30
|
||
|
低价值租赁的确认例外
|
– 12
|
||
|
开始日期为2018年12月31日之后的租赁安排
|
– 65
|
||
|
截至2019年1月1日的未贴现未来租赁付款持续经营
|
3 283
|
||
|
贴现的效果
|
– 1 547
|
||
|
截至2019年1月1日确认的租赁负债 2
|
1 736
|
||
|
|
|||
|
1 如2018年年报附注27所述
|
|||
|
2 于二零一九年一月一日(即国际财务报告准则第16号租赁的实施日期)的加权平均增量借款利率为3. 5%。
|
|||
|
(百万美元)
|
2019年1月1日
|
||
|
土地
|
536
|
||
|
建筑物
|
848
|
||
|
车辆
|
147
|
||
|
机器设备及其他资产
|
23
|
||
|
使用权资产 1
|
1 554
|
||
|
|
|||
|
1 于国际财务报告准则第16号实施日期,使用权资产比租赁负债低1. 82亿美元,原因是就确认分租应收款项、预付款项及应计租赁付款以及于二零一八年十二月三十一日记录于物业、厂房及设备的租赁资产转移作出调整。
|
|||
|
(百万美元)
|
2019年1月1日
|
||
|
资产
|
|
||
|
非流动资产
|
|
||
|
财产、厂房和设备
|
– 101
|
||
|
使用权资产
|
1 554
|
||
|
其他非流动资产
|
74
|
||
|
非流动资产总额
|
1 527
|
||
|
总资产
|
1 527
|
||
|
|
|||
|
权益和负债
|
|
||
|
权益
|
|
||
|
储量
|
3
|
||
|
总股本
|
3
|
||
|
|
|||
|
负债
|
|
||
|
非流动负债
|
|
||
|
金融债务
|
– 2
|
||
|
租赁负债
|
1 471
|
||
|
拨备和其他非流动负债
|
– 212
|
||
|
非流动负债总额
|
1 257
|
||
|
流动负债
|
|
||
|
金融债务和衍生金融工具
|
– 1
|
||
|
租赁负债
|
268
|
||
|
流动负债总额
|
267
|
||
|
总负债
|
1 524
|
||
|
权益和负债总额
|
1 527
|
||
|
(百万美元)
|
|
||
|
2019年1月1日的使用权资产
|
1 554
|
||
|
加法
|
537
|
||
|
折旧费
|
– 305
|
||
|
租赁合同终止 1
|
– 98
|
||
|
跳水的影响
|
– 17
|
||
|
货币换算效应
|
6
|
||
|
于2019年12月31日的使用权资产总额
|
1 677
|
||
|
期内并无减值记录。
|
|||
|
1 租赁合约终止亦包括导致使用权资产减少的现有租赁修订及分租导致的减少。
|
|||
|
|
|||
|
(百万美元) |
2019年12月31日 账面价值 |
折旧
装药 2019 |
|||
|
土地
|
537
|
14
|
|||
|
建筑物
|
990
|
194
|
|||
|
车辆
|
129
|
87
|
|||
|
机器设备及其他资产
|
21
|
10
|
|||
|
使用权资产总额
|
1 677
|
305
|
|||
|
|
|
||||
|
(百万美元) |
租赁负债 2019 |
租赁负债
未打折 2019 |
||
|
不到一年
|
246
|
295
|
||
|
在一到两年之间
|
202
|
246
|
||
|
两到三年之间
|
163
|
202
|
||
|
在三到四年之间
|
138
|
173
|
||
|
在四到五年之间
|
119
|
150
|
||
|
五年后
|
1 081
|
2 419
|
||
|
租赁总负债
|
1 949
|
3 485
|
||
|
减去租赁负债的流动部分
|
– 246
|
– 295
|
||
|
租赁负债的非流动部分
|
1 703
|
3 190
|
||
|
(百万美元)
|
2019
|
||
|
租赁负债利息支出 1
|
66
|
||
|
短期租赁费用
|
7
|
||
|
低价租赁费用
|
8
|
||
|
租赁现金流出总额
|
339
|
||
|
其中:
|
|
||
|
短期租赁和低价值租赁的现金流出 2
|
15
|
||
|
利息的支付 3
|
51
|
||
|
支付租赁负债 4
|
273
|
||
|
1 加权平均利率为3. 9%。
|
|||
|
2 短期及低价值租赁之现金流量计入经营活动现金流量净额总额内。于二零一九年十二月三十一日,本集团承诺订立的短期租赁组合与本集团于二零一九年订立的短期租赁组合相似。
|
|||
|
3 包括在经营活动现金流量净额总额内。
|
|||
|
4 报告为融资活动中使用的现金流出,扣除已收到的租赁奖励3,300万美元。
|
|||
|
商誉
|
商誉以外的无形资产
|
||||||||||||||||
|
(百万美元) |
总计 |
正在进行中
研究和 发展 |
阿尔康 品牌名称 |
技术 |
目前
销售 产品 |
营销 专有技术 |
其他
无形的 资产 |
总计 |
|||||||||
|
成本
|
|
|
|
|
|
|
|
|
|||||||||
|
2019年1月1日
|
35 700
|
16 167
|
2 980
|
6 253
|
35 412
|
5 960
|
2 253
|
69 025
|
|||||||||
|
与非连续性业务有关的资产成本 1
|
– 9 000
|
– 249
|
– 2 980
|
– 5 369
|
– 4 440
|
– 5 960
|
– 572
|
– 19 570
|
|||||||||
|
与出售集团有关的资产成本,净额 2
|
|
– 1
|
|
|
4
|
|
|
3
|
|||||||||
|
企业合并的影响
|
186
|
342
|
|
|
3 550
|
|
22
|
3 914
|
|||||||||
|
重新分类 3
|
|
– 9 069
|
|
|
9 069
|
|
|
|
|||||||||
|
加法 4
|
|
265
|
|
|
243
|
|
259
|
767
|
|||||||||
|
处置和取消认可 5
|
|
– 75
|
|
|
– 544
|
|
– 436
|
– 1 055
|
|||||||||
|
货币换算效应
|
– 61
|
49
|
|
|
254
|
|
32
|
335
|
|||||||||
|
2019年12月31日
|
26 825
|
7 429
|
|
884
|
43 548
|
|
1 558
|
53 419
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
累计摊销
|
|
|
|
|
|
|
|
|
|||||||||
|
2019年1月1日
|
– 406
|
– 1 120
|
|
– 4 758
|
– 21 218
|
– 1 906
|
– 1 304
|
– 30 306
|
|||||||||
|
与停产业务有关的资产累计摊销/减值 1
|
101
|
3
|
|
4 184
|
|
2 592
|
1 906
|
128
|
8 813
|
||||||||
|
摊销费用 6
|
|
|
|
– 42
|
|
– 2 657
|
|
– 137
|
– 2 836
|
||||||||
|
处置和解除确认的累计减值 5
|
|
70
|
|
|
494
|
|
419
|
983
|
|||||||||
|
减值费用 6
|
|
– 984
|
|
– 105
|
– 54
|
|
– 32
|
– 1 175
|
|||||||||
|
减值费用冲销
|
|
37
|
|
|
|
|
|
37
|
|||||||||
|
货币换算效应
|
4
|
– 11
|
|
|
– 126
|
|
– 11
|
– 148
|
|||||||||
|
2019年12月31日
|
– 301
|
– 2 005
|
|
– 721
|
– 20 969
|
|
– 937
|
– 24 632
|
|||||||||
|
2019年12月31日的账面净值
|
26 524
|
5 424
|
|
163
|
22 579
|
|
621
|
28 787
|
|||||||||
|
1 指于2019年1月1日的资产成本和累计摊销,与报告为已终止经营的Alcon业务有关。附注1、2和30提供了与已终止业务有关的资料。
|
|||||||||||||||||
|
2 附注2提供有关持作出售之出售组别资产之额外披露。
|
|||||||||||||||||
|
3 由于收购的正在进行的研究和开发的产品发布以及软件开发的完成,不同资产类别之间的重新分类
|
|||||||||||||||||
|
4 2019年1月1日至2019年12月31日期间持有待售的处置组无新增
|
|||||||||||||||||
|
5 对不再使用或正在开发且被认为不具有重大处置价值或其他替代用途的资产的取消确认
|
|||||||||||||||||
|
6 无与出售集团于2019年1月1日至2019年12月31日期间持有待售期间相关的摊销或减值费用。
|
|||||||||||||||||
|
商誉
|
商誉以外的无形资产
|
||||||||||||||||
|
(百万美元) |
总计 |
正在进行中
研究和 发展 |
阿尔康 品牌名称 |
技术 |
目前
销售 产品 |
营销 专有技术 |
其他
无形的 资产 |
总计 |
|||||||||
|
成本
|
|
|
|
|
|
|
|
|
|||||||||
|
2018年1月1日
|
32 179
|
6 462
|
2 980
|
6 638
|
34 105
|
5 960
|
1 852
|
57 997
|
|||||||||
|
与持作出售之出售组别有关之资产成本 1
|
|
– 9
|
|
– 276
|
– 1 116
|
|
– 2
|
– 1 403
|
|||||||||
|
企业合并的影响
|
4 084
|
10 224
|
|
|
2 531
|
|
1
|
12 756
|
|||||||||
|
重新分类 2
|
|
– 697
|
|
|
479
|
|
218
|
|
|||||||||
|
加法 3
|
|
477
|
|
2
|
728
|
|
385
|
1 592
|
|||||||||
|
处置和取消认可 4
|
|
– 214
|
|
– 70
|
– 928
|
|
– 183
|
– 1 395
|
|||||||||
|
减值费用 5
|
– 183
|
|
|
|
|
|
|
|
|||||||||
|
货币换算效应
|
– 380
|
– 76
|
|
– 41
|
– 387
|
|
– 18
|
– 522
|
|||||||||
|
2018年12月31日
|
35 700
|
16 167
|
2 980
|
6 253
|
35 412
|
5 960
|
2 253
|
69 025
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
累计摊销
|
|
|
|
|
|
|
|
|
|||||||||
|
2018年1月1日
|
– 429
|
– 1 170
|
|
– 4 268
|
– 19 631
|
– 1 668
|
– 1 263
|
– 28 000
|
|||||||||
|
出售集团持有待售资产的累计摊销/减值 1
|
|
2
|
|
107
|
816
|
|
|
925
|
|||||||||
|
摊销费用 6
|
|
|
|
– 570
|
– 2 521
|
– 238
|
– 310
|
– 3 639
|
|||||||||
|
处置和解除确认的累计减值4
|
|
209
|
|
|
791
|
|
257
|
1 257
|
|||||||||
|
减值费用 5
|
|
– 167
|
|
– 53
|
– 825
|
|
– 4
|
– 1 049
|
|||||||||
|
货币换算效应
|
23
|
6
|
|
26
|
152
|
|
16
|
200
|
|||||||||
|
2018年12月31日
|
– 406
|
– 1 120
|
|
– 4 758
|
– 21 218
|
– 1 906
|
– 1 304
|
– 30 306
|
|||||||||
|
2018年12月31日的账面净值
|
35 294
|
15 047
|
2 980
|
1 495
|
14 194
|
4 054
|
949
|
38 719
|
|||||||||
|
1 附注2提供有关持作出售之出售组别资产之额外披露。
|
|||||||||||||||||
|
2 由于收购的正在进行的研究和开发的产品发布以及软件开发的完成,不同资产类别之间的重新分类
|
|||||||||||||||||
|
3 自2018年1月1日起至重新分类为持有待售资产之日止的待出售处置集团内无新增
|
|||||||||||||||||
|
4 对不再使用或正在开发且被认为不具有重大处置价值或其他替代用途的资产的取消确认
|
|||||||||||||||||
|
5 与出售集团因减记已分配商誉而持有的减值费用相关的减值费用为1.83亿美元,当前销售的产品的减值费用为3700万美元(其中900万美元从2018年1月1日至重新分类为待出售资产之日确认)。有关与停产业务有关的摊销,请参阅附注30。
|
|||||||||||||||||
|
6 自2018年1月1日至重新分类为持有待售资产之日为止,与出售集团持有待售资产相关之摊销为4,500万美元。
|
|||||||||||||||||
|
商誉
|
商誉以外的无形资产
|
||||||||||||
|
(百万美元) |
总计 |
正在进行中
研究和 发展 |
技术 |
目前
销售 产品 |
其他
无形的 资产 |
总计 |
|||||||
|
创新药物
|
18 750
|
5 339
|
7
|
21 720
|
520
|
27 586
|
|||||||
|
桑多兹
|
7 767
|
85
|
156
|
859
|
25
|
1 125
|
|||||||
|
公司
|
7
|
|
|
|
76
|
76
|
|||||||
|
2019年12月31日的账面净值
|
26 524
|
5 424
|
163
|
22 579
|
621
|
28 787
|
|||||||
|
商誉
|
商誉以外的无形资产
|
||||||||||||||||
|
(百万美元) |
总计 |
正在进行中
研究和 发展 |
阿尔康 品牌名称 |
技术 |
目前
销售 产品 |
营销 专有技术 |
其他
无形的 资产 |
总计 |
|||||||||
|
创新药物
|
18 551
|
14 377
|
|
6
|
11 228
|
|
431
|
26 042
|
|||||||||
|
桑多兹
|
7 837
|
419
|
|
304
|
1 115
|
|
37
|
1 875
|
|||||||||
|
阿尔康 1
|
8 899
|
246
|
2 980
|
1 185
|
1 851
|
4 054
|
363
|
10 679
|
|||||||||
|
公司
|
7
|
5
|
|
|
|
|
118
|
123
|
|||||||||
|
2018年12月31日的账面净值
|
35 294
|
15 047
|
2 980
|
1 495
|
14 194
|
4 054
|
949
|
38 719
|
|||||||||
|
1 据报告,自2019年2月28日起,阿尔孔司已停止运作(见附注1、2和30)。根据国际财务报告准则,2018年12月31日的综合资产负债表包括爱尔康眼科护理设备业务的资产和负债,以及阿尔康业务应占的某些公司资产和负债。附注30提供了关于停产业务的补充资料。
|
|||||||||||||||||
|
|
|||||||||||||||||
|
|
|||||||||||||||||
|
(As(百分比) |
创新
药品 |
桑多兹 |
|||
|
终端增长率
|
1.5
|
2.0
|
|||
|
贴现率(税后)
|
6.5
|
6.5
|
|||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
创新药物 1
|
– 669
|
– 592
|
– 591
|
||||
|
桑多兹 2
|
– 506
|
– 249
|
– 61
|
||||
|
总计
|
– 1 175
|
– 841
|
– 652
|
||||
|
1 2019年包括与通过2015年Spinifex Pharmaceuticals Inc.收购的知识产权& D减记有关的减值4.16亿美元。收购和1.08亿美元的减记,与停止特应性皮炎临床开发项目MOR106有关。
2018年包括与部分减记有关的4亿美元减值Votrient目前销售的产品。 2017年包括与Serelaxin知识产权& D减记相关的4.65亿美元减值。 |
|||||||
|
2 2019年包括与停用通用Advair相关的知识产权& D相关的减值4.42亿美元®发展计划。
2018年包括与分配商誉(1.83亿美元)减记相关的2.2亿美元减值,以及与Sandoz美国皮肤科业务和仿制美国口服固体产品组合即将剥离有关的当前上市产品(3700万美元)。见附注2。 |
|||||||
|
(百万美元) |
财产, 植物和 装备 |
无形的 资产 |
养老金和
其他好处 义务 联营公司 |
盘存 |
税损 进位- 远期 |
其他资产, 条文 和应计项目 |
总计 |
||||||||
|
截至2019年1月1日的递延税项总资产
|
191
|
1 233
|
1 188
|
3 722
|
273
|
2 175
|
8 782
|
||||||||
|
截至2019年1月1日的递延税项负债总额
|
– 622
|
– 5 384
|
– 273
|
– 474
|
|
– 805
|
– 7 558
|
||||||||
|
截至2019年1月1日的递延税金净余额
|
– 431
|
– 4 151
|
915
|
3 248
|
273
|
1 370
|
1 224
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
2019年1月1日
|
– 431
|
– 4 151
|
915
|
3 248
|
273
|
1 370
|
1 224
|
||||||||
|
与停产业务有关的递延税金净余额 1
|
82
|
1 403
|
– 123
|
– 248
|
– 39
|
– 217
|
858
|
||||||||
|
记入[记入]收入贷方
|
74
|
605
|
308
|
– 818
|
– 113
|
298
|
354
|
||||||||
|
记入股权
|
|
8
|
|
|
75
|
– 166
|
– 83
|
||||||||
|
记入其他全面收入
|
|
|
– 313
|
|
|
24
|
– 289
|
||||||||
|
企业合并的影响
|
3
|
– 45
|
|
|
21
|
– 26
|
– 47
|
||||||||
|
其他动作 2
|
– 10
|
39
|
|
– 23
|
31
|
– 12
|
25
|
||||||||
|
于2019年12月31日的递延税项结余净额
|
– 282
|
– 2 141
|
787
|
2 159
|
248
|
1 271
|
2 042
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
截至2019年12月31日的递延税项总资产
|
108
|
1 469
|
1 078
|
2 446
|
255
|
2 596
|
7 952
|
||||||||
|
于2019年12月31日的递延税项负债总额
|
– 390
|
– 3 610
|
– 291
|
– 287
|
– 7
|
– 1 325
|
– 5 910
|
||||||||
|
于2019年12月31日的递延税项结余净额
|
– 282
|
– 2 141
|
787
|
2 159
|
248
|
1 271
|
2 042
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
在同一税务管辖区内抵销下列金额的递延税项资产和负债后,余额为:
|
|
|
|
|
|
|
|
|
|
|
|
|
43
|
||
|
截至2019年12月31日的递延税项资产
|
|
|
|
|
|
|
7 909
|
||||||||
|
截至2019年12月31日的递延税项负债
|
|
|
|
|
|
|
– 5 867
|
||||||||
|
于2019年12月31日的递延税项结余净额
|
|
|
|
|
|
|
2 042
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
2018年1月1日递延税项资产总额
|
137
|
1 287
|
1 090
|
3 786
|
97
|
1 983
|
8 380
|
||||||||
|
2018年1月1日递延税项负债总额
|
– 613
|
– 2 985
|
– 254
|
– 455
|
– 9
|
– 1 003
|
– 5 319
|
||||||||
|
2018年1月1日递延税项净额结余
|
– 476
|
– 1 698
|
836
|
3 331
|
88
|
980
|
3 061
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
2018年1月1日
|
– 476
|
– 1 698
|
836
|
3 331
|
88
|
980
|
3 061
|
||||||||
|
与持作出售之出售组别有关之递延税项结余净额
|
1
|
|
1
|
|
|
|
– 6
|
|
– 1
|
|
– 1
|
|
– 6
|
||
|
记入[记入]收入贷方
|
31
|
378
|
4
|
– 86
|
– 113
|
368
|
582
|
||||||||
|
记入股权
|
|
|
|
|
|
– 17
|
– 17
|
||||||||
|
记入其他全面收入
|
|
|
69
|
|
|
8
|
77
|
||||||||
|
企业合并的影响
|
|
– 2 874
|
|
|
298
|
83
|
– 2 493
|
||||||||
|
其他动作
|
13
|
42
|
6
|
9
|
1
|
– 51
|
20
|
||||||||
|
2018年12月31日的递延税金净余额
|
– 431
|
– 4 151
|
915
|
3 248
|
273
|
1 370
|
1 224
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
截至2018年12月31日的递延税项总资产
|
191
|
1 233
|
1 188
|
3 722
|
273
|
2 175
|
8 782
|
||||||||
|
2018年12月31日的递延税项负债总额
|
– 622
|
– 5 384
|
– 273
|
– 474
|
|
– 805
|
– 7 558
|
||||||||
|
2018年12月31日的递延税金净余额
|
– 431
|
– 4 151
|
915
|
3 248
|
273
|
1 370
|
1 224
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
在同一税务管辖区内抵销下列金额的递延税项资产和负债后,余额为:
|
|
|
|
|
|
|
|
|
|
|
|
|
83
|
||
|
截至2018年12月31日的递延税项资产
|
|
|
|
|
|
|
8 699
|
||||||||
|
截至2018年12月31日的递延税项负债
|
|
|
|
|
|
|
– 7 475
|
||||||||
|
2018年12月31日的递延税金净余额
|
|
|
|
|
|
|
1 224
|
||||||||
|
|
|||||||||||||||
|
1 附注1、2和30提供了与已终止业务有关的资料。
|
|||||||||||||||
|
2 包括与出售集团有关的300万美元递延税金净额
|
|||||||||||||||
|
(数十亿美元)
|
2019
|
2018
|
|||
|
预计将对超过12个月后的当前应缴税款产生影响
|
|
|
|||
|
-递延税项资产
|
4.3
|
3.9
|
|||
|
-递延纳税义务
|
5.2
|
6.7
|
|||
|
(数十亿美元)
|
2019
|
2018
|
|||
|
合并实体保留作再投资的未汇出盈利
|
61
|
73
|
|||
|
(数十亿美元)
|
2019
|
2018
|
|||
|
对子公司的投资
|
3
|
3
|
|||
|
收购带来的商誉
|
– 24
|
– 33
|
|||
|
(百万美元)
|
不记作资本
|
大写
|
2019年合计
|
||||
|
一年
|
14
|
0
|
14
|
||||
|
两年
|
28
|
0
|
28
|
||||
|
三年
|
28
|
6
|
34
|
||||
|
四年
|
16
|
46
|
62
|
||||
|
五年
|
127
|
37
|
164
|
||||
|
五年多
|
435
|
2 249
|
2 684
|
||||
|
总计
|
648
|
2 338
|
2 986
|
||||
|
(百万美元)
|
不记作资本
|
大写
|
2018年总计
|
||||
|
一年
|
23
|
4
|
27
|
||||
|
两年
|
14
|
0
|
14
|
||||
|
三年
|
27
|
12
|
39
|
||||
|
四年
|
65
|
5
|
70
|
||||
|
五年
|
345
|
36
|
381
|
||||
|
五年多
|
522
|
2 288
|
2 810
|
||||
|
总计
|
996
|
2 345
|
3 341
|
||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
已到期结转的税损
|
9
|
8
|
1
|
||||
|
(百万美元) |
收入
陈述式 继续 运营 |
权益 |
总计 |
||||
|
递延税项资产及负债重估
|
|
|
|
||||
|
以前在综合损益表中确认的项目
|
234
|
|
234
|
||||
|
以前在其他全面收益中确认的项目 1
|
|
– 358
|
– 358
|
||||
|
递延税项资产及负债重估总额
|
234
|
– 358
|
– 124
|
||||
|
1 与离职后福利有关
|
|||||||
|
(百万美元) |
收入
陈述式 继续 运营 |
权益 |
总计 |
||||
|
递延税项资产及负债重估
|
|
|
|
||||
|
以前在综合损益表中确认的项目 1
|
– 440
|
|
– 440
|
||||
|
以前在其他全面收益中确认的项目 2
|
|
– 254
|
– 254
|
||||
|
以前在留存收益中确认的项目 3
|
|
– 71
|
– 71
|
||||
|
递延税项资产及负债重估总额
|
– 440
|
– 325
|
– 765
|
||||
|
本期应付税款重估总额 4
|
– 34
|
|
– 34
|
||||
|
递延所得税资产和负债及当期所得税负债的重估总额
|
– 474
|
– 325
|
– 799
|
||||
|
1 先前在已终止业务中确认的项目为4.16亿美元
|
|||||||
|
2 与离职后福利和可供出售金融投资相关(归属于持续经营业务—2.41亿美元,归属于已终止经营业务—1300万美元)
|
|||||||
|
3 与股权补偿计划相关(归属于持续经营业务—6,600万美元,归属于终止经营业务—500万美元)
|
|||||||
|
4 已终止经营业务应占本期应付税项重估为—300万美元。
|
|||||||
|
(百万美元)
|
2019
|
2018
|
|||
|
股权证券
|
1 524
|
1 155
|
|||
|
债务证券
|
33
|
31
|
|||
|
基金投资
|
233
|
251
|
|||
|
财务投资总额
|
1 790
|
1 437
|
|||
|
客户的长期应收账款
|
|
164
|
|||
|
融资租赁协议的最低租赁付款 1
|
|
91
|
|||
|
融资转租的长期应收账款
|
66
|
|
|||
|
其他长期应收账款
|
104
|
3
|
|||
|
或有代价应收账款 2
|
399
|
396
|
|||
|
长期贷款、垫款和保证金
|
159
|
254
|
|||
|
金融资产总额
|
2 518
|
2 345
|
|||
|
1 附注30提供与已终止经营业务有关的融资租赁协议最低租赁付款的额外披露。
|
|||||
|
2 附注29提供有关或然代价的额外披露。
|
|||||
|
(百万美元)
|
2019
|
2018
|
|||
|
递延补偿计划
|
414
|
468
|
|||
|
预付离职后福利计划
|
148
|
137
|
|||
|
其他非流动资产
|
176
|
290
|
|||
|
其他非流动资产合计
|
738
|
895
|
|||
|
(百万美元)
|
2019
|
2018
|
|||
|
原材料、消耗品
|
751
|
931
|
|||
|
正在进行的工作
|
3 024
|
3 087
|
|||
|
成品
|
2 207
|
2 938
|
|||
|
总库存
|
5 982
|
6 956
|
|||
|
(数十亿美元)
|
2019
|
2018
|
2017
|
||||
|
销货成本
|
– 8.5
|
– 8.3
|
– 8.2
|
||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
存货拨备
|
– 752
|
– 603
|
– 416
|
||||
|
库存准备金的撤销
|
218
|
216
|
172
|
||||
|
(百万美元)
|
2019
|
2018
|
|||
|
之应收贸易账款总额为本
|
8 396
|
8 853
|
|||
|
可疑贸易应收账款拨备
|
– 95
|
– 126
|
|||
|
应收贸易账款总额,净额
|
8 301
|
8 727
|
|||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
一月一日
|
– 126
|
– 190
|
– 162
|
||||
|
与停止经营有关的拨备 1
|
54
|
|
|
||||
|
跳水的影响
|
|
|
12
|
||||
|
企业合并的影响
|
|
– 1
|
|
||||
|
于综合收益表扣除之呆账应收账款拨备 2
|
– 89
|
– 47
|
– 119
|
||||
|
可疑贸易应收账款准备的使用
|
12
|
39
|
12
|
||||
|
拨回计入综合收益表的呆账应收账款拨备 3
|
53
|
61
|
76
|
||||
|
货币换算效应
|
1
|
12
|
– 9
|
||||
|
12月31日
|
– 95
|
– 126
|
– 190
|
||||
|
|
|||||||
|
1 附注1、2和30提供了与已终止业务有关的资料。
|
|||||||
|
2 于二零一八年及二零一七年,自持续经营业务自综合收益表扣除的拨备分别为3,000万美元及9,400万美元。
|
|||||||
|
3 2018年及2017年,来自持续经营业务的拨备拨回分别为4,400万美元及6,000万美元。
|
|||||||
|
(百万美元)
|
2019
|
2018
|
|||
|
未逾期
|
7 763
|
7 916
|
|||
|
逾期不超过一个月
|
161
|
296
|
|||
|
逾期一个月以上三个月以下
|
123
|
194
|
|||
|
逾期三个月以上六个月以下
|
103
|
136
|
|||
|
逾期六个月以上一年以下
|
96
|
98
|
|||
|
逾期一年以上
|
150
|
213
|
|||
|
可疑贸易应收账款拨备
|
– 95
|
– 126
|
|||
|
应收贸易账款总额,净额
|
8 301
|
8 727
|
|||
|
(百万美元)
|
2019
|
2018
|
|||
|
来自密切监测国家的贸易应收款总额余额
|
1 588
|
1 729
|
|||
|
逾期一年以上
|
61
|
97
|
|||
|
条文
|
24
|
44
|
|||
|
|
|||||
|
(百万美元)
|
2019
|
2018
|
|||
|
美元(U.S.)
|
3 466
|
3 510
|
|||
|
欧元(欧元)
|
1 384
|
1 551
|
|||
|
日元(JPY)
|
466
|
658
|
|||
|
俄罗斯卢布(卢布)
|
341
|
247
|
|||
|
人民币(CNY)
|
279
|
282
|
|||
|
英镑(GBP)
|
202
|
183
|
|||
|
巴西雷亚尔(BRL)
|
165
|
206
|
|||
|
加元(CAD)
|
129
|
136
|
|||
|
澳元(AUD)
|
125
|
161
|
|||
|
瑞士法郎(瑞士法郎)
|
89
|
100
|
|||
|
其他货币
|
1 655
|
1 693
|
|||
|
应收贸易账款总额,净额
|
8 301
|
8 727
|
|||
|
(百万美元)
|
2019
|
2018
|
|||
|
债务证券
|
24
|
325
|
|||
|
基金投资
|
37
|
35
|
|||
|
有价证券总额
|
61
|
360
|
|||
|
商品
|
110
|
104
|
|||
|
原始期限在90天以上的定期存款和短期投资
|
61
|
2 087
|
|||
|
衍生金融工具
|
102
|
130
|
|||
|
债务证券、定期存款和短期投资的应计利息
|
|
12
|
|||
|
有价证券、商品、定期存款和衍生金融工具总额
|
334
|
2 693
|
|||
|
(百万美元)
|
2019
|
2018
|
|||
|
美元(U.S.)
|
|
302
|
|||
|
欧元(欧元)
|
13
|
|
12
|
||
|
日元(JPY)
|
11
|
11
|
|||
|
债务证券总额
|
24
|
325
|
|||
|
(百万美元)
|
2019
|
2018
|
|||
|
经常账户
|
3 247
|
3 121
|
|||
|
原始到期日不足90天的定期存款和短期投资
|
7 865
|
10 150
|
|||
|
现金和现金等价物合计
|
11 112
|
13 271
|
|||
|
(百万美元)
|
2019
|
2018
|
|||
|
增值税应收账款
|
508
|
588
|
|||
|
可追回的预扣税
|
108
|
99
|
|||
|
预付费用
|
|
|
|||
|
-第三方
|
898
|
811
|
|||
|
-联营公司
|
|
1
|
|||
|
关联公司应收账款
|
1
|
2
|
|||
|
其他应收款和流动资产
|
1 165
|
1 360
|
|||
|
其他流动资产总额
|
2 680
|
2 861
|
|||
|
(百万美元) |
2017年1月1日 |
运动
以年计 |
2017年12月31日 |
运动
以年计 |
2018年12月31日 |
运动
以年计 |
2019年12月31日 |
||||||||
|
股本
|
972
|
– 3
|
969
|
– 25
|
944
|
– 8
|
936
|
||||||||
|
国库股
|
– 76
|
– 24
|
– 100
|
31
|
– 69
|
– 11
|
– 80
|
||||||||
|
已发行股本
|
896
|
– 27
|
869
|
6
|
875
|
– 19
|
856
|
||||||||
|
|
2019
|
2018
|
2017
|
||||||||||||||||||
|
流通股数量 (单位:百万) |
注意事项 |
总计
诺华公司 股票 |
总计
财政部 股票 1 |
总计
杰出的 股票 |
总计
诺华公司 股票 |
总计
财政部 股票 1 |
总计
杰出的 股票 |
总计
诺华公司 股票 |
总计
财政部 股票 1 |
总计
杰出的 股票 |
|||||||||||
|
年初余额
|
|
2 550.6
|
– 239.4
|
2 311.2
|
2 616.8
|
– 299.3
|
2 317.5
|
2 627.1
|
– 253.0
|
2 374.1
|
|||||||||||
|
股票因减资而被注销 2
|
|
– 23.3
|
23.3
|
|
– 66.2
|
66.2
|
|
– 10.3
|
10.3
|
|
|||||||||||
|
被收购的股份将被注销 3
|
|
|
– 60.3
|
– 60.3
|
|
– 23.3
|
– 23.3
|
|
– 66.2
|
– 66.2
|
|||||||||||
|
其他股票购买 4
|
|
|
– 1.7
|
– 1.7
|
|
– 1.2
|
– 1.2
|
|
– 3.8
|
– 3.8
|
|||||||||||
|
行使期权和员工交易 5
|
18.8
|
|
5.5
|
5.5
|
|
7.8
|
7.8
|
|
4.6
|
4.6
|
|||||||||||
|
基于股权的薪酬 5
|
|
|
9.4
|
9.4
|
|
7.4
|
7.4
|
|
8.8
|
8.8
|
|||||||||||
|
派发给爱尔康员工的股票
|
|
|
0.9
|
0.9
|
|
|
|
|
|
|
|||||||||||
|
其他股份销售
|
|
|
|
|
|
3.0
|
3.0
|
|
|
|
|||||||||||
|
总移动量
|
|
– 23.3
|
– 22.9
|
– 46.2
|
– 66.2
|
59.9
|
– 6.3
|
– 10.3
|
– 46.3
|
– 56.6
|
|||||||||||
|
年终余额
|
|
2 527.3
|
– 262.3
|
2 265.0
|
2 550.6
|
– 239.4
|
2 311.2
|
2 616.8
|
– 299.3
|
2 317.5
|
|||||||||||
|
|
|||||||||||||||||||||
|
1 约1.176亿股库存股(2018年:1.216亿股;2017年:1.313亿股)由诺华实体持有,限制其使用。
|
|||||||||||||||||||||
|
2 诺华通过取消前几年在瑞士证券交易所第二交易线回购的股票减少了股本。
|
|||||||||||||||||||||
|
3 根据2016年年度股东大会(AGM)批准的100亿瑞士法郎股份回购授权,用于2019年2月28日之前的交易,以及根据2019年年度股东大会批准的100亿瑞士法郎股份回购授权,用于该日期之后的交易
|
|||||||||||||||||||||
|
4 从雇员处获得的股份,这些股份以前根据各自的计划授予他们
|
|||||||||||||||||||||
|
5 因行使期权而交付的股票以及与基于股权的参与计划相关的实物股票交付
|
|||||||||||||||||||||
|
|
|||||||||||||||||||||
|
2019
|
2018
|
2017
|
|||||
|
每股股息(瑞士法郎)
|
2.85
|
2.80
|
2.75
|
||||
|
股息支付总额(十亿美元)
|
6.6
|
7.0
|
6.5
|
||||
|
|
2019
|
2018
|
2017
|
||||||||||||
|
注意事项 |
数量
杰出的 股票 (单位:百万) |
对股票的影响 百万美元 |
数量
杰出的 股票 (单位:百万) |
对股票的影响 百万美元 |
数量
杰出的 股票 (单位:百万) |
对股票的影响 百万美元 |
|||||||||
|
被收购的股份将被注销 1
|
|
– 60.3
|
– 5 351
|
– 23.3
|
– 1 859
|
– 66.2
|
– 5 270
|
||||||||
|
其他股票购买 2
|
|
– 1.7
|
– 160
|
– 1.2
|
– 114
|
– 3.8
|
– 304
|
||||||||
|
购买库藏股
|
|
– 62.0
|
– 5 511
|
– 24.5
|
– 1 973
|
– 70.0
|
– 5 574
|
||||||||
|
行使期权和员工交易 3
|
18.8
|
5.5
|
210
|
7.8
|
434
|
4.6
|
255
|
||||||||
|
基于股权的薪酬 4,5
|
|
9.4
|
833
|
7.4
|
756
|
8.8
|
612
|
||||||||
|
派发给爱尔康员工的股票
|
|
0.9
|
18
|
|
|
|
|
||||||||
|
其他股份销售
|
|
|
|
3.0
|
263
|
|
|
||||||||
|
总计
|
|
– 46.2
|
– 4 450
|
– 6.3
|
– 520
|
– 56.6
|
– 4 707
|
||||||||
|
|
|||||||||||||||
|
1 根据2016年股东大会批准的100亿瑞士法郎股份回购授权,用于2019年2月28日之前的交易,以及根据2019年股东大会批准的100亿瑞士法郎股份回购授权,用于该日期之后的交易
|
|||||||||||||||
|
2 从雇员处获得的股份,这些股份以前根据各自的计划授予他们
|
|||||||||||||||
|
3 因行使与股权参与计划和库存股交付有关的期权而交付的股份。所交付股份的平均股价显著低于市场价格,反映了行使的期权的执行价。
|
|||||||||||||||
|
4 股权结算股份薪酬根据股份薪酬计划的归属期间在综合收益表中列支。已授出股份及购股权的价值于各自归属期间记入综合股本。此外,超过损益表中确认的费用的可扣税金额所产生的税收优惠计入权益。
|
|||||||||||||||
|
5 2017年包括与先前通过保留收益确认的股权补偿递延税项资产重估有关的7100万美元影响。此次重估是由于美国于2017年12月22日颁布的税务改革立法所致。有关额外披露,请参阅附注12。
|
|||||||||||||||
|
|
|||||||||||||||
|
(百万美元)
|
2019
|
2018
|
|||
|
直通债券
|
22 167
|
25 283
|
|||
|
对银行和其他金融机构的负债 1
|
188
|
285
|
|||
|
融资租赁义务
|
|
92
|
|||
|
总额,包括非流动金融债务的当期部分
|
22 355
|
25 660
|
|||
|
非流动金融债务的较少流动部分
|
– 2 002
|
– 3 190
|
|||
|
非流动金融债务共计
|
20 353
|
22 470
|
|||
|
1 平均利率0. 2%(二零一八年:0. 3%)
|
|||||
|
息票 |
货币 |
名义上的 金额 |
发行 年 |
成熟性 年 |
发行人 |
发行价 |
2019
(美元 百万美元) |
2018
(美元 百万美元) |
|||||||||
|
5.125%
|
美元
|
3 000
|
2009
|
2019
|
诺华证券投资有限公司百慕大汉密尔顿
|
99.822%
|
|
3 000
|
|||||||||
|
4.400%
|
美元
|
1 000
|
2010
|
2020
|
诺华资本公司,纽约,美国
|
99.237%
|
1 000
|
998
|
|||||||||
|
2.400%
|
美元
|
1 500
|
2012
|
2022
|
诺华资本公司,纽约,美国
|
99.225%
|
1 495
|
1 493
|
|||||||||
|
3.700%
|
美元
|
500
|
2012
|
2042
|
诺华资本公司,纽约,美国
|
98.325%
|
489
|
489
|
|||||||||
|
3.400%
|
美元
|
2 150
|
2014
|
2024
|
诺华资本公司,纽约,美国
|
99.287%
|
2 139
|
2 137
|
|||||||||
|
4.400%
|
美元
|
1 850
|
2014
|
2044
|
诺华资本公司,纽约,美国
|
99.196%
|
1 825
|
1 825
|
|||||||||
|
0.750%
|
欧元
|
600
|
2014
|
2021
|
诺华金融公司卢森堡卢森堡
|
99.134%
|
670
|
683
|
|||||||||
|
1.625%
|
欧元
|
600
|
2014
|
2026
|
诺华金融公司卢森堡卢森堡
|
99.697%
|
670
|
684
|
|||||||||
|
0.250%
|
CHF
|
500
|
2015
|
2025
|
诺华制药,瑞士巴塞尔
|
100.640%
|
517
|
508
|
|||||||||
|
0.625%
|
CHF
|
550
|
2015
|
2029
|
诺华制药,瑞士巴塞尔
|
100.502%
|
568
|
558
|
|||||||||
|
1.050%
|
CHF
|
325
|
2015
|
2035
|
诺华制药,瑞士巴塞尔
|
100.479%
|
336
|
330
|
|||||||||
|
3.000%
|
美元
|
1 750
|
2015
|
2025
|
诺华资本公司,纽约,美国
|
99.010%
|
1 735
|
1 732
|
|||||||||
|
4.000%
|
美元
|
1 250
|
2015
|
2045
|
诺华资本公司,纽约,美国
|
98.029%
|
1 219
|
1 219
|
|||||||||
|
0.125%
|
欧元
|
1 250
|
2016
|
2023
|
诺华金融公司卢森堡卢森堡
|
99.127%
|
1 392
|
1 419
|
|||||||||
|
0.625%
|
欧元
|
500
|
2016
|
2028
|
诺华金融公司卢森堡卢森堡
|
98.480%
|
553
|
563
|
|||||||||
|
1.800%
|
美元
|
1 000
|
2017
|
2020
|
诺华资本公司,纽约,美国
|
99.609%
|
1 000
|
998
|
|||||||||
|
2.400%
|
美元
|
1 000
|
2017
|
2022
|
诺华资本公司,纽约,美国
|
99.449%
|
996
|
995
|
|||||||||
|
3.100%
|
美元
|
1 000
|
2017
|
2027
|
诺华资本公司,纽约,美国
|
99.109%
|
990
|
989
|
|||||||||
|
0.000%
|
欧元
|
1 250
|
2017
|
2021
|
诺华金融公司卢森堡卢森堡
|
99.133%
|
1 396
|
1 421
|
|||||||||
|
1.125%
|
欧元
|
600
|
2017
|
2027
|
诺华金融公司卢森堡卢森堡
|
99.874%
|
670
|
684
|
|||||||||
|
0.500%
|
欧元
|
750
|
2018
|
2023
|
诺华金融公司卢森堡卢森堡
|
99.655%
|
837
|
853
|
|||||||||
|
1.375%
|
欧元
|
750
|
2018
|
2030
|
诺华金融公司卢森堡卢森堡
|
99.957%
|
838
|
856
|
|||||||||
|
1.700%
|
欧元
|
750
|
2018
|
2038
|
诺华金融公司卢森堡卢森堡
|
99.217%
|
832
|
849
|
|||||||||
|
全额直通债券
|
|
|
|
|
|
|
22 167
|
25 283
|
|||||||||
|
(百万美元)
|
2019
|
2018
|
|||
|
2019
|
|
3 190
|
|||
|
2020
|
2 002
|
2 006
|
|||
|
2021
|
2 067
|
2 111
|
|||
|
2022
|
2 583
|
2 585
|
|||
|
2023
|
2 321
|
2 278
|
|||
|
2024
|
2 139
|
2 137
|
|||
|
2024年之后
|
11 243
|
11 353
|
|||
|
总计
|
22 355
|
25 660
|
|||
|
(百万美元)
|
2019
|
2018
|
|||
|
美元(U.S.)
|
12 889
|
15 964
|
|||
|
欧元(欧元)
|
7 861
|
8 028
|
|||
|
日元(JPY)
|
184
|
272
|
|||
|
瑞士法郎(瑞士法郎)
|
1 421
|
1 396
|
|||
|
总计
|
22 355
|
25 660
|
|||
|
(百万美元) |
2019
天平 板材 |
2019
公平 值 |
2018
天平 板材 |
2018
公平 值 |
|||||
|
直通债券
|
22 167
|
23 701
|
25 283
|
25 438
|
|||||
|
其他
|
188
|
188
|
377
|
377
|
|||||
|
总计
|
22 355
|
23 889
|
25 660
|
25 815
|
|||||
|
(百万美元)
|
2019
|
2018
|
|||
|
作为非流动金融债务抵押品的不动产、厂房及设备账面净值总额
|
3
|
96
|
|||
|
(百万美元)
|
2019
|
2018
|
|||
|
员工福利的应计负债:
|
|
|
|||
|
固定收益养老金计划 1
|
3 469
|
3 546
|
|||
|
其他长期雇员福利和递延薪酬
|
546
|
600
|
|||
|
其他离职后福利 1
|
612
|
954
|
|||
|
环境补救规定
|
592
|
634
|
|||
|
关于产品责任、政府调查和其他法律事项的规定
|
200
|
214
|
|||
|
或有对价 2
|
958
|
874
|
|||
|
其他非流动负债
|
255
|
497
|
|||
|
准备金和其他非流动负债总额
|
6 632
|
7 319
|
|||
|
1 附注25提供了与离职后福利有关的补充披露。
|
|||||
|
2 附注29提供有关或然代价的额外披露。
|
|||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
一月一日
|
692
|
761
|
773
|
||||
|
现金支付
|
– 30
|
– 48
|
– 46
|
||||
|
释放 1
|
– 83
|
– 21
|
– 153
|
||||
|
加法 2
|
124
|
7
|
154
|
||||
|
货币换算效应
|
11
|
– 7
|
33
|
||||
|
12月31日
|
714
|
692
|
761
|
||||
|
减去当期经费
|
– 122
|
– 58
|
– 55
|
||||
|
截至12月31日的非流动环境补救准备金
|
592
|
634
|
706
|
||||
|
|
|||||||
|
1 二零一八年及二零一七年,来自持续经营业务的拨备拨备分别为2,100万美元及1. 53亿美元。
|
|||||||
|
2 于二零一八年及二零一七年,自持续经营业务自综合收益表扣除的拨备分别为700万美元及154百万美元。
|
|||||||
|
(百万美元) |
预期
现金流出 |
||
|
在两年内到期
|
141
|
||
|
逾期两年但在五年内到期
|
210
|
||
|
应在5年后但在10年内支付
|
258
|
||
|
在10年后到期
|
105
|
||
|
环境补救责任规定总额
|
714
|
||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
一月一日
|
340
|
351
|
395
|
||||
|
与已终止业务有关的准备金 1
|
– 42
|
|
|
||||
|
企业合并的影响
|
10
|
|
|
||||
|
现金支付
|
– 116
|
– 118
|
– 69
|
||||
|
条文的发放 2
|
– 52
|
– 107
|
– 70
|
||||
|
对条文的增补 3
|
1 230
|
220
|
93
|
||||
|
货币换算效应
|
– 1
|
– 6
|
2
|
||||
|
12月31日
|
1 369
|
340
|
351
|
||||
|
较小电流部分
|
– 1 169
|
– 126
|
– 121
|
||||
|
12月31日非流动产品责任、政府调查和其他法律事项规定
|
200
|
214
|
230
|
||||
|
1 附注1、2和30提供了与已终止业务有关的资料。
|
|||||||
|
2 来自持续经营业务的拨备于二零一八年及二零一七年分别为1. 07亿美元及6,300万美元。
|
|||||||
|
3 于二零一八年及二零一七年,自持续经营业务自综合收益表扣除的拨备分别为2. 20亿美元及4,700万美元。
|
|||||||
|
(百万美元)
|
2019
|
2018
|
|||
|
联营公司应要求应付的应付账款 1
|
1 836
|
1 778
|
|||
|
银行和其他金融债务 2
|
719
|
701
|
|||
|
商业票据
|
2 289
|
3 951
|
|||
|
非流动金融债务的流动部分
|
2 002
|
3 190
|
|||
|
衍生金融工具的公允价值
|
185
|
58
|
|||
|
流动金融债务和衍生金融工具总额
|
7 031
|
9 678
|
|||
|
1 加权平均利率0. 5%(二零一八年:0. 5%)
|
|||||
|
2 加权平均利率12. 9%(二零一八年:9. 6%)
|
|||||
|
(百万美元)
|
2019
|
2018
|
|||
|
所得税以外的其他税种
|
471
|
528
|
|||
|
重组条文
|
438
|
507
|
|||
|
已收到但未开发票的货物和服务的应计费用
|
1 046
|
970
|
|||
|
应计特许权使用费
|
653
|
651
|
|||
|
金融债务的应计利息
|
98
|
156
|
|||
|
从收入中扣除的准备金
|
5 595
|
5 262
|
|||
|
应计报酬和福利,包括社会保障
|
2 464
|
2 527
|
|||
|
环境修复责任
|
122
|
58
|
|||
|
递延收入
|
114
|
236
|
|||
|
关于产品责任、政府调查和其他法律事项的规定 1
|
1 169
|
126
|
|||
|
应计股份支付
|
326
|
273
|
|||
|
或然代价 2
|
78
|
33
|
|||
|
回购自有股份的承诺 3
|
|
284
|
|||
|
其他应付款
|
764
|
673
|
|||
|
准备金总额和其他流动负债
|
13 338
|
12 284
|
|||
|
|
|||||
|
1 附注20提供了与法律规定有关的补充披露。
|
|||||
|
2 附注29提供有关或然代价的额外披露。
|
|||||
|
3 附注18提供有关购回本身股份承诺的额外披露。
|
|||||
|
|
|
|
|
|
损益表费用2
|
|
|
||||||||||
|
(百万美元) |
收入 扣除额 条文 一月一日 |
收入
扣除额 条文 相关内容 停产 运营1 |
的效果 货币 翻译 和商业 组合 |
付款/ 利用率 |
调整 前几年的 |
本年度 |
更改中 条文 偏移量 总贸易额 应收账款 |
收入 扣除额 条文 12月31日 |
|||||||||
|
2019
|
|
|
|
|
|
|
|
|
|||||||||
|
特定于美国的医疗保健计划和计划回扣
|
1 883
|
0
|
|
– 5 183
|
– 193
|
5 474
|
|
1 981
|
|||||||||
|
非特定于美国的医疗计划和计划回扣
|
1 625
|
– 28
|
– 19
|
– 2 467
|
– 2
|
2 659
|
1
|
1 769
|
|||||||||
|
非医疗保健计划和计划相关的回扣、退货和其他扣除
|
1 754
|
– 166
|
9
|
– 11 698
|
– 25
|
11 868
|
103
|
1 845
|
|||||||||
|
2019年总计
|
5 262
|
– 194
|
– 10
|
– 19 348
|
– 220
|
20 001
|
104
|
5 595
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
2018
|
|
|
|
|
|
|
|
|
|||||||||
|
特定于美国的医疗保健计划和计划回扣
|
1 590
|
|
|
– 4 158
|
– 90
|
4 541
|
|
1 883
|
|||||||||
|
非特定于美国的医疗计划和计划回扣
|
1 356
|
|
– 78
|
– 2 182
|
83
|
2 555
|
– 109
|
1 625
|
|||||||||
|
非医疗保健计划和计划相关的回扣、退货和其他扣除
|
1 726
|
|
– 51
|
– 12 227
|
– 91
|
11 956
|
441
|
1 754
|
|||||||||
|
2018年共计
|
4 672
|
|
– 129
|
– 18 567
|
– 98
|
19 052
|
332
|
5 262
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
2017
|
|
|
|
|
|
|
|
|
|||||||||
|
特定于美国的医疗保健计划和计划回扣
|
1 461
|
|
|
– 3 684
|
– 62
|
3 875
|
|
1 590
|
|||||||||
|
非特定于美国的医疗计划和计划回扣
|
1 020
|
|
131
|
– 1 954
|
80
|
2 186
|
– 107
|
1 356
|
|||||||||
|
非医疗保健计划和计划相关的回扣、退货和其他扣除
|
1 702
|
|
65
|
– 11 814
|
– 127
|
12 045
|
– 145
|
1 726
|
|||||||||
|
2017年共计
|
4 183
|
|
196
|
– 17 452
|
– 109
|
18 106
|
– 252
|
4 672
|
|||||||||
|
1 附注1、2和30提供了与已终止业务有关的资料。
|
|||||||||||||||||
|
2 2018年,来自持续经营业务的综合收益表的支出为182.48亿美元,2017年为177.72亿美元。
|
|||||||||||||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
一月一日
|
507
|
153
|
222
|
||||
|
与已终止业务有关的准备金 1
|
– 8
|
|
|
||||
|
加法 2
|
492
|
534
|
194
|
||||
|
现金支付
|
– 479
|
– 145
|
– 200
|
||||
|
释放 3
|
– 72
|
– 33
|
– 64
|
||||
|
转账
|
|
|
– 7
|
||||
|
货币换算效应
|
– 2
|
– 2
|
8
|
||||
|
12月31日
|
438
|
507
|
153
|
||||
|
|
|||||||
|
1 附注1、2和30提供了与已终止业务有关的资料。
|
|||||||
|
2 自持续经营业务自综合收益表扣除的拨备于二零一八年及二零一七年分别为5. 21亿美元及1. 86亿美元。
|
|||||||
|
3 2018年及2017年,来自持续经营业务的拨备拨回分别为3,100万美元及5,900万美元。
|
|||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
折旧、摊销和减值:
|
|
|
|
||||
|
财产、厂房和设备
|
1 547
|
1 783
|
1 460
|
||||
|
使用权资产 1
|
305
|
|
|
||||
|
无形资产
|
3 974
|
3 428
|
3 276
|
||||
|
金融资产 2
|
– 38
|
6
|
227
|
||||
|
准备金和其他非流动负债的非现金变动
|
1 871
|
895
|
86
|
||||
|
财产、厂房和设备的处置和其他调整收益;无形资产;金融资产;以及其他非流动资产,净额
|
– 1 234
|
– 902
|
– 1 077
|
||||
|
股权结算补偿费用
|
758
|
673
|
612
|
||||
|
来自相联公司的收入 3
|
– 659
|
– 6 438
|
– 1 108
|
||||
|
税费
|
1 793
|
1 295
|
1 603
|
||||
|
财务费用净额
|
805
|
746
|
708
|
||||
|
总计
|
9 122
|
1 486
|
5 787
|
||||
|
1 使用权资产折旧自二零一九年一月一日(国际财务报告准则第16号租赁的实施日期)起确认。附注1和10提供了额外披露。
|
|||||||
|
2 包括公允价值调整
|
|||||||
|
3 2018年包括从剥离GSK Consumer Healthcare Holdings Ltd.的投资确认的税前收益(58亿美元)的拨回(见附注2)。出售所得现金净额130亿美元已计入综合现金流量表“收购及出售联营公司权益净额”。”
|
|||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
库存(增加)
|
– 382
|
– 387
|
– 203
|
||||
|
贸易应收款(增加)
|
– 980
|
– 544
|
– 655
|
||||
|
贸易应付款增加
|
553
|
252
|
82
|
||||
|
其他流动资产变动
|
– 160
|
316
|
– 303
|
||||
|
其他流动负债变动
|
1 167
|
941
|
1 410
|
||||
|
其他调整,净额
|
1
|
– 2
|
1
|
||||
|
总计
|
199
|
576
|
332
|
||||
|
(百万美元)
|
注意事项
|
2019
|
2018
|
2017
|
|||||
|
确认为企业合并结果的净资产
|
24
|
– 4 124
|
– 13 660
|
– 874
|
|||||
|
以前持有的股权的公允价值
|
|
33
|
|
|
|||||
|
或有代价,净额
|
|
242
|
– 5
|
151
|
|||||
|
付款、递延对价和其他调整,净额
|
|
– 2
|
– 36
|
– 36
|
|||||
|
用于收购业务的现金流
|
|
– 3 851
|
– 13 701
|
– 759
|
|||||
|
业务剥离产生的现金流量净额 1
|
|
91
|
18
|
45
|
|||||
|
用于收购和撤资业务的现金流,净额
|
|
– 3 760
|
– 13 683
|
– 714
|
|||||
|
|
|||||||||
|
1 2019年,9100万美元包括往年剥离产生的400万美元净现金流出和2019年业务剥离产生的9500万美元净现金流入。二零一九年已剥离业务的可识别资产净值为1. 96亿美元,包括非流动资产1. 59亿美元、流动资产9,600万美元(包括1,100万美元现金及现金等价物)、非流动负债1,800万美元及流动负债4,100万美元。
2018年,1800万美元代表往年撤资后的净现金流入。 2017年,4500万美元的净现金流入与2017年剥离的可识别资产净额有关。2017年剥离的业务总额为4800万美元,包括非流动资产2900万美元、流动资产3400万美元和流动负债1500万美元。 |
|||||||||
|
(百万美元) |
非当前 金融 债务 |
当前
金融 债项及 导数 金融 仪器 |
非当前 租赁负债 |
当前租约 负债 |
|||||
|
2019年1月1日
|
22 470
|
9 678
|
|
|
|||||
|
采纳国际财务报告准则第16号的影响 1
|
– 2
|
– 1
|
1 471
|
268
|
|||||
|
采纳国际财务报告准则第16号的影响 2
|
– 89
|
|
246
|
40
|
|||||
|
与终止经营有关的金融债务和租赁负债 3
|
|
– 47
|
– 246
|
– 40
|
|||||
|
非流动金融债务增加
|
93
|
|
|
|
|||||
|
偿还非流动金融债务
|
|
– 3 195
|
|
|
|||||
|
本期财政债务变动情况
|
|
– 1 582
|
|
|
|||||
|
支付租赁负债,净额
|
|
|
|
– 273
|
|||||
|
租赁负债中列为经营活动现金流量的金额的利息支付
|
|
|
|
– 51
|
|||||
|
新租约
|
|
|
362
|
131
|
|||||
|
业务合并和剥离的影响
|
|
2
|
– 11
|
– 6
|
|||||
|
公允价值变动及其他变动净额
|
|
129
|
33
|
20
|
|||||
|
债券摊销折价
|
25
|
|
|
|
|||||
|
货币换算效应
|
– 141
|
44
|
4
|
1
|
|||||
|
从非流动重新分类为流动、净额
|
– 2 003
|
2 003
|
– 156
|
156
|
|||||
|
2019年12月31日
|
20 353
|
7 031
|
1 703
|
246
|
|||||
|
1 租赁负债于二零一九年一月一日(国际财务报告准则第16号租赁的实施日期)确认。附注10提供了补充披露。
|
|||||||||
|
2 2018年,金融债务包括Alcon业务先前报告的融资租赁责任89百万美元,该债务已于2019年1月1日重新分类至租赁负债,并采纳国际财务报告准则第16号租赁。附注30提供额外披露。
|
|||||||||
|
3 指于2019年1月1日与报告为已终止经营业务的Alcon业务有关的金融债务及租赁负债。见注1、2和30。
|
|||||||||
|
(百万美元) |
非当前 金融 债务 |
|
当前
金融 债项及 导数 金融 仪器 |
|
|
|
2018年1月1日
|
23 224
|
5 308
|
|||
|
非流动金融债务增加 1
|
2 856
|
|
|||
|
偿还非流动金融债务 2
|
|
– 366
|
|||
|
本期财政债务变动情况 3
|
|
1 681
|
|||
|
企业合并的影响
|
10
|
4
|
|
||
|
公允价值变动及其他变动
|
5
|
– 48
|
|||
|
债券摊销折价
|
27
|
2
|
|||
|
货币换算效应
|
– 462
|
– 93
|
|||
|
非流动金融债务的流动部分
|
– 3 190
|
3 190
|
|||
|
2018年12月31日
|
22 470
|
9 678
|
|||
|
1 非流动金融债务的增加仅记录于持续经营业务现金流量综合表。
|
|||||
|
2 偿还非流动金融债务仅计入持续经营业务现金流量综合表。
|
|||||
|
3 计入持续经营业务现金流量综合表的流动金融债务变动为16.87亿美元。
|
|||||
|
(百万美元) |
非当前 金融 债务 |
|
当前
金融 债项及 导数 金融 仪器 |
|
|
|
2017年1月1日
|
17 897
|
5 905
|
|||
|
非流动金融债务增加 1
|
4 933
|
|
|||
|
偿还非流动金融债务 2
|
– 1
|
– 187
|
|||
|
本期财政债务变动情况 3
|
|
– 755
|
|||
|
公允价值变动及其他变动
|
– 6
|
– 140
|
|||
|
债券摊销折价
|
16
|
|
|||
|
货币换算效应
|
744
|
126
|
|||
|
非流动金融债务的流动部分
|
– 359
|
359
|
|||
|
2017年12月31日
|
23 224
|
5 308
|
|||
|
1 非流动金融债务的增加仅记录于持续经营业务现金流量综合表。
|
|||||
|
2 偿还非流动金融债务仅计入持续经营业务现金流量综合表。
|
|||||
|
3 计入持续经营业务现金流量综合表的流动金融债务变动为6.44亿美元。
|
|||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
财产、厂房和设备
|
44
|
137
|
|
||||
|
目前市场上销售的产品
|
3 550
|
2 531
|
|
||||
|
获得的研究和开发
|
342
|
10 224
|
1 223
|
||||
|
其他无形资产
|
22
|
1
|
|
||||
|
递延税项资产
|
60
|
381
|
8
|
||||
|
财政资产和其他资产
|
8
|
19
|
|
||||
|
盘存
|
195
|
20
|
|
||||
|
应收贸易账款和其他流动资产
|
4
|
90
|
|
||||
|
现金和现金等价物
|
|
1 112
|
20
|
||||
|
递延税项负债
|
– 107
|
– 2 874
|
– 325
|
||||
|
经常和非流动金融债务
|
– 2
|
– 14
|
|
||||
|
应付贸易款项和其他负债
|
– 178
|
– 627
|
– 1
|
||||
|
取得的可确认净资产
|
3 938
|
11 000
|
925
|
||||
|
现金和现金等价物
|
|
– 1 112
|
– 20
|
||||
|
非控制性权益
|
|
– 26
|
|
||||
|
商誉
|
186
|
4 084
|
94
|
||||
|
确认为企业合并结果的净资产 1
|
4 124
|
13 946
|
999
|
||||
|
1 2018年,因持续经营业务合并而于合并资产负债表确认的净资产为136.6亿美元,2017年为8.74亿美元。
|
|||||||
|
养老金计划
|
其他离职后福利计划
|
||||||||
|
(百万美元)
|
2019
|
2018
|
2019
|
2018
|
|||||
|
1月1日的福利义务
|
22 179
|
23 210
|
1 073
|
1 115
|
|||||
|
与非持续经营有关的福利义务 1
|
– 662
|
|
– 385
|
|
|||||
|
当前服务成本
|
336
|
378
|
13
|
34
|
|||||
|
利息成本
|
330
|
321
|
29
|
39
|
|||||
|
过去的服务成本和结算
|
– 168
|
– 1
|
|
|
|||||
|
行政费用
|
24
|
26
|
|
|
|||||
|
财务假设变动引起的重新计量损失/(收益)
|
1 791
|
– 567
|
76
|
– 31
|
|||||
|
人口假设变化引起的重新计量(收益)/损失
|
– 193
|
5
|
– 9
|
1
|
|||||
|
与经验相关的重新计量损失/(收益)
|
184
|
264
|
– 22
|
– 32
|
|||||
|
货币换算效应
|
283
|
– 374
|
|
– 7
|
|||||
|
福利支付
|
– 1 256
|
– 1 263
|
– 30
|
– 46
|
|||||
|
相联者的供款
|
169
|
169
|
|
|
|||||
|
收购、撤资或转让的效果
|
49
|
11
|
1
|
|
|||||
|
12月31日的福利义务
|
23 066
|
22 179
|
746
|
1 073
|
|||||
|
1月1日计划资产的公允价值
|
18 838
|
20 275
|
119
|
162
|
|||||
|
计划与非持续运营相关的资产 1
|
– 424
|
|
– 40
|
|
|||||
|
利息收入
|
257
|
249
|
3
|
5
|
|||||
|
不含利息收入的计划资产回报率
|
1 656
|
– 805
|
10
|
– 8
|
|||||
|
货币换算效应
|
304
|
– 310
|
|
|
|||||
|
诺华集团贡献
|
420
|
520
|
74
|
6
|
|||||
|
相联者的供款
|
169
|
169
|
|
|
|||||
|
聚落
|
– 193
|
– 3
|
|
|
|||||
|
福利支付
|
– 1 256
|
– 1 263
|
– 30
|
– 46
|
|||||
|
收购、撤资或转让的效果
|
39
|
6
|
– 2
|
|
|||||
|
12月31日计划资产的公允价值
|
19 810
|
18 838
|
134
|
119
|
|||||
|
资金状况
|
– 3 256
|
– 3 341
|
– 612
|
– 954
|
|||||
|
1月1日确认基金盈余的限额
|
– 68
|
– 89
|
|
|
|||||
|
更改确认基金盈余的限额(包括汇率差异)
|
7
|
25
|
|
|
|||||
|
限制基金盈余的利息收入
|
– 4
|
– 4
|
|
|
|||||
|
12月31日确认基金盈余的限额
|
– 65
|
– 68
|
|
|
|||||
|
资产负债表于12月31日的净负债
|
– 3 321
|
– 3 409
|
– 612
|
– 954
|
|||||
|
|
|||||||||
|
1 附注1、2和30提供了与已终止业务有关的资料。
|
|||||||||
|
养老金计划
|
其他离职后福利计划
|
||||||||
|
(百万美元)
|
2019
|
2018
|
2019
|
2018
|
|||||
|
1月1日的净负债
|
– 3 409
|
– 3 024
|
– 954
|
– 953
|
|||||
|
减去:与停产业务有关的净负债 1
|
238
|
|
345
|
|
|||||
|
当前服务成本
|
– 336
|
– 378
|
– 13
|
– 34
|
|||||
|
净利息支出
|
– 77
|
– 76
|
– 26
|
– 34
|
|||||
|
行政费用
|
– 24
|
– 26
|
|
|
|||||
|
过去的服务成本和结算
|
– 25
|
– 2
|
|
|
|||||
|
重新测量
|
– 126
|
– 507
|
– 35
|
54
|
|||||
|
货币换算效应
|
21
|
64
|
|
7
|
|||||
|
诺华集团贡献
|
420
|
520
|
74
|
6
|
|||||
|
收购、撤资或转让的效果
|
– 10
|
– 5
|
– 3
|
|
|||||
|
更改确认基金盈余的限额
|
7
|
25
|
|
|
|||||
|
截至12月31日的负债净额
|
– 3 321
|
– 3 409
|
– 612
|
– 954
|
|||||
|
|
|
|
|
||||||
|
在综合资产负债表中确认的金额
|
|
||||||||
|
预付福利成本
|
148
|
137
|
|
|
|||||
|
应计福利负债
|
– 3 469
|
– 3 546
|
– 612
|
– 954
|
|||||
|
|
|||||||||
|
1 附注1、2和30提供了与已终止业务有关的资料。
|
|||||||||
|
2019
|
2018
|
||||||||||||||||
|
(百万美元) |
瑞士 |
美联航
州政府 |
其余部分
世界 |
总计 |
瑞士 |
美联航
州政府 |
其余部分
世界 |
总计 |
|||||||||
|
12月31日的福利义务
|
15 106
|
3 552
|
4 408
|
23 066
|
14 263
|
3 348
|
4 568
|
22 179
|
|||||||||
|
其中无资金来源
|
|
670
|
466
|
1 136
|
|
649
|
491
|
1 140
|
|||||||||
|
按成员类型
|
|
|
|
|
|
|
|
|
|||||||||
|
主动型
|
6 167
|
630
|
1 400
|
8 197
|
5 618
|
653
|
1 616
|
7 887
|
|||||||||
|
延期领取养老金的人
|
|
1 205
|
1 517
|
2 722
|
|
1 131
|
1 531
|
2 662
|
|||||||||
|
领取养老金的人
|
8 939
|
1 717
|
1 491
|
12 147
|
8 645
|
1 564
|
1 421
|
11 630
|
|||||||||
|
12月31日计划资产的公允价值
|
14 457
|
2 311
|
3 042
|
19 810
|
13 470
|
2 160
|
3 208
|
18 838
|
|||||||||
|
资金状况
|
– 649
|
– 1 241
|
– 1 366
|
– 3 256
|
– 793
|
– 1 188
|
– 1 360
|
– 3 341
|
|||||||||
|
2019
|
2018
|
||||||||||||
|
(百万美元) |
美联航
州政府 |
其余部分
世界 |
总计 |
美联航
州政府 |
其余部分
世界 |
总计 |
|||||||
|
12月31日的福利义务
|
658
|
88
|
746
|
1 001
|
72
|
1 073
|
|||||||
|
其中无资金来源
|
524
|
88
|
612
|
882
|
72
|
954
|
|||||||
|
按成员类型
|
|
|
|
|
|
|
|||||||
|
主动型
|
121
|
36
|
157
|
270
|
25
|
295
|
|||||||
|
延期领取养老金的人
|
15
|
0
|
15
|
18
|
0
|
18
|
|||||||
|
领取养老金的人
|
522
|
52
|
574
|
713
|
47
|
760
|
|||||||
|
12月31日计划资产的公允价值
|
134
|
0
|
134
|
119
|
0
|
119
|
|||||||
|
资金状况
|
– 524
|
– 88
|
– 612
|
– 882
|
– 72
|
– 954
|
|||||||
|
养老金计划
|
其他离职后福利计划
|
||||||||||||
|
2019
|
2018
|
2017
|
2019
|
2018
|
2017
|
||||||||
|
用于确定12月31日福利义务的加权平均假设
|
|
|
|
|
|
|
|||||||
|
贴现率
|
1.0%
|
1.6%
|
1.5%
|
3.6%
|
4.4%
|
3.7%
|
|||||||
|
养老金预期上升率
|
0.3%
|
0.4%
|
0.5%
|
|
|
|
|||||||
|
预期加薪幅度
|
2.8%
|
2.8%
|
2.8%
|
|
|
|
|||||||
|
储蓄存款利息
|
0.3%
|
0.8%
|
0.6%
|
|
|
|
|||||||
|
65岁男性目前的平均预期寿命(以年为单位)
|
22
|
22
|
22
|
21
|
21
|
21
|
|||||||
|
65岁女性当前平均预期寿命(以年为单位)
|
24
|
24
|
24
|
23
|
23
|
23
|
|||||||
|
(百万美元) |
2019年年底的变化
固定福利养恤金债务 |
||
|
贴现率上调25个基点
|
– 787
|
||
|
贴现率下调25个基点
|
837
|
||
|
预期寿命延长一年
|
848
|
||
|
养老金涨幅上调25个基点
|
546
|
||
|
养老金涨幅下调25个基点
|
– 135
|
||
|
储蓄存款利息上调25个基点
|
62
|
||
|
储蓄存款利息下调25个基点
|
– 60
|
||
|
加薪幅度上调25个基点
|
54
|
||
|
薪金增长率减少25个基点
|
– 55
|
||
|
2019
|
2018
|
2017
|
|||||
|
假设明年的医疗保健成本趋势率
|
6.5%
|
7.0%
|
6.5%
|
||||
|
假定成本趋势率将下降的比率
|
4.5%
|
4.5%
|
4.5%
|
||||
|
利率达到最终趋势利率的年份
|
2028
|
2028
|
2025
|
||||
|
养老金计划
|
|||||||||
|
(以百分比表示) |
长期的
目标 最小值 |
长期的
目标 最大值 |
2019 |
2018 |
|||||
|
股权证券
|
15
|
40
|
27
|
28
|
|||||
|
债务证券
|
20
|
60
|
36
|
35
|
|||||
|
房地产
|
5
|
20
|
17
|
17
|
|||||
|
另类投资
|
0
|
20
|
15
|
16
|
|||||
|
现金和其他投资
|
0
|
15
|
5
|
4
|
|||||
|
总计
|
|
|
100
|
100
|
|||||
|
十二月三十一日,
2019 |
十二月三十一日,
2018 |
||||
|
投资诺华制药的股份
|
|
|
|||
|
股份数量(单位:百万)
|
2.3
|
11.0
|
|||
|
市值(以十亿美元为单位)
|
0.2
|
0.9
|
|||
|
(百万美元) |
养老金计划 |
其他职位-
就业 福利计划 |
|||
|
诺华集团贡献
|
|
|
|||
|
2020年(估计数)
|
410
|
46
|
|||
|
预期未来的福利支付
|
|
|
|||
|
2020
|
1 201
|
46
|
|||
|
2021
|
1 116
|
47
|
|||
|
2022
|
1 106
|
48
|
|||
|
2023
|
1 096
|
48
|
|||
|
2024
|
1 087
|
48
|
|||
|
2025–2029
|
5 270
|
231
|
|||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
固定缴款计划持续业务的缴款
|
422
|
443
|
307
|
||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
与股权参与计划相关的费用
|
1 067
|
918
|
853
|
||||
|
股权支付交易产生的负债
|
326
|
273
|
261
|
||||
|
2019
|
2018
|
||||||||
|
选项 (百万) |
加权
平均值 锻炼 价格 (美元) |
选项 (百万) |
加权
平均值 锻炼 价格 (美元) |
||||||
|
1月1日未平仓期权
|
5.6
|
59.9
|
7.4
|
59.5
|
|||||
|
出售或行使
|
– 2.2
|
58.4
|
– 1.8
|
58.2
|
|||||
|
截至12月31日的未偿还款项
|
3.4
|
60.9
|
5.6
|
59.9
|
|||||
|
可于12月31日行使
|
3.4
|
60.9
|
5.6
|
59.9
|
|||||
|
未偿还期权 |
|
|
|
|
共计/
加权 平均值 |
||||||
|
未缴数目(百万)
|
0.3
|
0.7
|
0.9
|
1.5
|
3.4
|
||||||
|
剩余合同期限(年)
|
0.0
|
1.0
|
2.0
|
3.0
|
2.1
|
||||||
|
行权价(美元)
|
54.5
|
57.0
|
57.6
|
66.0
|
60.9
|
||||||
|
2019
|
2018
|
||||||||
|
adr 选项 (百万) |
加权
平均值 锻炼 价格 (美元) |
adr 选项 (百万) |
加权
平均值 锻炼 价格 (美元) |
||||||
|
1月1日未平仓期权
|
15.2
|
60.7
|
20.3
|
59.9
|
|||||
|
出售或行使
|
– 5.6
|
58.6
|
– 5.1
|
57.4
|
|||||
|
截至12月31日的未偿还款项
|
9.6
|
61.9
|
15.2
|
60.7
|
|||||
|
可于12月31日行使
|
9.6
|
61.9
|
15.2
|
60.7
|
|||||
|
未解决的ADR备选方案 |
|
|
|
|
共计/
加权 平均值 |
||||||
|
未缴数目(百万)
|
0.4
|
1.2
|
2.9
|
5.1
|
9.6
|
||||||
|
剩余合同期限(年)
|
0.0
|
1.0
|
2.0
|
3.0
|
2.3
|
||||||
|
行权价(美元)
|
54.5
|
57.0
|
57.6
|
66.0
|
61.9
|
||||||
|
2019
|
2018
|
||||||||||||
|
数 的股份 以百万计 |
加权
平均公平 授予价值 日期(美元) |
公允价值在 授出日期, 数百万美元 |
数 的股份 以百万计 |
加权
平均公平 授予价值 日期(美元) |
公允价值在 授出日期, 数百万美元 |
||||||||
|
1月1日的非既得股
|
25.7
|
77.1
|
1 981
|
23.9
|
80.6
|
1 926
|
|||||||
|
授与
|
|
|
|
|
|
|
|||||||
|
—年度奖励
|
1.1
|
78.4
|
86
|
1.3
|
83.9
|
109
|
|||||||
|
—股票储蓄计划
|
4.2
|
83.0
|
349
|
4.1
|
84.9
|
348
|
|||||||
|
—选择北美
|
5.3
|
64.0
|
339
|
3.9
|
77.8
|
303
|
|||||||
|
—选择北美以外地区
|
2.6
|
67.4
|
175
|
2.1
|
79.7
|
167
|
|||||||
|
—长期绩效计划
|
2.5
|
68.9
|
172
|
1.5
|
85.8
|
129
|
|||||||
|
—长期相对绩效计划
|
0.1
|
0.0
|
0
|
0.3
|
52.0
|
16
|
|||||||
|
—其他股份奖励
|
1.9
|
67.7
|
129
|
1.2
|
77.9
|
93
|
|||||||
|
既得
|
– 13.3
|
80.3
|
– 1 068
|
– 10.7
|
90.2
|
– 965
|
|||||||
|
被没收
|
– 4.3
|
76.3
|
– 328
|
– 1.9
|
76.4
|
– 145
|
|||||||
|
截至12月31日的非既得股
|
25.8
|
71.1
|
1 835
|
25.7
|
77.1
|
1 981
|
|||||||
|
行政人员
|
非执行董事
|
总计
|
|||||||||||||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
2019
|
2018
|
2017
|
2019
|
2018
|
2017
|
||||||||||
|
现金和其他补偿
|
20.7
|
22.5
|
18.4
|
4.1
|
4.0
|
4.0
|
24.8
|
26.5
|
22.4
|
||||||||||
|
离职后福利
|
2.6
|
2.5
|
2.0
|
|
|
|
2.6
|
2.5
|
2.0
|
||||||||||
|
基于股权的薪酬
|
40.6
|
42.5
|
49.9
|
4.6
|
4.8
|
4.8
|
45.2
|
47.3
|
54.7
|
||||||||||
|
总计
|
63.9
|
67.5
|
70.3
|
8.7
|
8.8
|
8.8
|
72.6
|
76.3
|
79.1
|
||||||||||
|
货币
|
2019
|
2018
|
2017
|
||||||
|
克劳尔医生
|
CHF
|
60 000
|
60 000
|
60 000
|
|||||
|
瓦塞拉医生
|
CHF
|
0
|
18 228
|
26 279
|
|||||
|
(百万美元)
|
2019
|
||
|
2020
|
809
|
||
|
2021
|
442
|
||
|
2022
|
319
|
||
|
2023
|
724
|
||
|
2024
|
167
|
||
|
此后
|
1 943
|
||
|
总计
|
4 404
|
||
|
(百万美元)
|
注意事项
|
2019 1
|
2018 1
|
||||
|
现金和现金等价物
|
16
|
11 112
|
13 271
|
||||
|
|
|
||||||
|
金融资产—按公平值计入其他全面收益计量
|
|
|
|
||||
|
有价证券
|
|
|
|
||||
|
债务证券
|
16
|
24
|
325
|
||||
|
|
|
||||||
|
长期财务投资
|
|
|
|
||||
|
股权证券
|
13
|
1 158
|
802
|
||||
|
债务证券
|
13
|
33
|
31
|
||||
|
长期金融投资总额—按公允价值计入其他全面收益
|
|
1 191
|
833
|
||||
|
|
|
|
|||||
|
金融资产总额—按公平值计入其他全面收益计量
|
|
1 215
|
1 158
|
||||
|
|
|
|
|||||
|
金融资产--按摊销成本计量
|
|
|
|
||||
|
应收贸易账款、应收所得税及其他流动资产(不包括预付款项)。
|
15/17
|
10 337
|
11 024
|
||||
|
债务证券、定期存款和短期投资的应计利息
|
16
|
|
12
|
||||
|
原始期限在90天以上的定期存款和短期投资
|
16
|
61
|
2 087
|
||||
|
长期贷款、垫款、保证金和其他长期应收款
|
13
|
329
|
512
|
||||
|
金融资产总额--按摊销成本计量
|
|
10 727
|
13 635
|
||||
|
|
|
|
|||||
|
金融资产—按公平值计入综合收益表计量
|
|
|
|
||||
|
股权证券
|
13
|
366
|
353
|
||||
|
基金投资
|
13/16
|
270
|
286
|
||||
|
相联公司按公允价值计入损益
|
|
186
|
145
|
||||
|
衍生金融工具
|
16
|
102
|
130
|
||||
|
或有代价应收账款
|
13
|
399
|
396
|
||||
|
金融资产总额—按公平值计入综合收益表计量
|
|
1 323
|
1 310
|
||||
|
|
|
|
|||||
|
金融资产总额
|
|
24 377
|
29 374
|
||||
|
|
|
||||||
|
金融负债—按摊余成本计量
|
|
|
|
||||
|
当前金融债务
|
|
|
|
||||
|
联营公司的附息账户须于即期付款
|
21
|
1 836
|
1 778
|
||||
|
银行和其他金融债务
|
21
|
719
|
701
|
||||
|
商业票据
|
21
|
2 289
|
3 951
|
||||
|
非流动债务的流动部分
|
21
|
2 002
|
3 190
|
||||
|
流动金融债务总额
|
|
6 846
|
9 620
|
||||
|
|
|
||||||
|
非流动金融债务
|
|
|
|
||||
|
直通债券
|
19
|
22 167
|
25 283
|
||||
|
对银行和其他金融机构的负债
|
19
|
188
|
285
|
||||
|
融资租赁义务
|
19
|
|
92
|
||||
|
非流动债务的流动部分
|
19
|
– 2 002
|
– 3 190
|
||||
|
非流动金融债务共计
|
|
20 353
|
22 470
|
||||
|
|
|
|
|||||
|
应付贸易账款及购回自有股份承担 2
|
|
5 424
|
5 840
|
||||
|
|
|
|
|||||
|
金融负债总额—按摊余成本计量
|
|
32 623
|
37 930
|
||||
|
|
|
||||||
|
金融负债—按公平值计入综合收益表计量
|
|
|
|
||||
|
或有代价(见附注20/22)和其他金融负债
|
|
1 065
|
917
|
||||
|
衍生金融工具
|
21
|
185
|
58
|
||||
|
金融负债总额—按公平值计入综合收益表计量
|
|
1 250
|
975
|
||||
|
|
|
|
|||||
|
租赁负债
|
10
|
1 949
|
|
||||
|
|
|
|
|||||
|
财务负债总额
|
|
35 822
|
38 905
|
||||
|
|
|||||||
|
1 除直接债券(见附注19)外,账面值与公平值合理相近。
|
|||||||
|
2 附注18及22提供有关购回本身股份承诺的额外披露。
|
|||||||
|
合同或基础本金金额
|
正公允价值
|
负公允价值
|
|||||||||||
|
(百万美元)
|
2019
|
2018
|
2019
|
2018
|
2019
|
2018
|
|||||||
|
远期外汇汇率合约
|
10 779
|
10 823
|
96
|
130
|
– 75
|
– 58
|
|||||||
|
商品采购合同
|
9
|
|
6
|
|
|
|
|||||||
|
股权证券期权
|
269
|
|
|
|
– 110
|
|
|||||||
|
包括在有价证券和本期金融债务中的衍生金融工具总额
|
11 057
|
10 823
|
102
|
130
|
– 185
|
– 58
|
|||||||
|
2019
|
|||||||||
|
(百万美元)
|
欧元
|
美元
|
其他
|
总计
|
|||||
|
远期外汇汇率合约
|
1 373
|
7 760
|
1 646
|
10 779
|
|||||
|
商品采购合同
|
|
9
|
|
9
|
|||||
|
股权证券期权
|
|
250
|
19
|
269
|
|||||
|
衍生金融工具总额
|
1 373
|
8 019
|
1 665
|
11 057
|
|||||
|
2018
|
|||||||||
|
(百万美元)
|
欧元
|
美元
|
其他
|
总计
|
|||||
|
远期外汇汇率合约
|
2 989
|
6 558
|
1 276
|
10 823
|
|||||
|
衍生金融工具总额
|
2 989
|
6 558
|
1 276
|
10 823
|
|||||
|
2019
|
|||||||||||
|
(百万美元) |
1级 |
2级 |
3级 |
价值
摊销成本 |
总计 |
||||||
|
金融资产
|
|
|
|
|
|
||||||
|
债务证券
|
|
24
|
|
|
24
|
||||||
|
基金投资
|
37
|
|
|
|
37
|
||||||
|
有价证券总额
|
37
|
24
|
|
|
61
|
||||||
|
原到期日超过90天的定期存款和短期投资
|
|
|
|
61
|
61
|
||||||
|
衍生金融工具
|
|
102
|
|
|
102
|
||||||
|
有价证券、定期存款和衍生金融工具共计
|
37
|
126
|
|
61
|
224
|
||||||
|
债务证券和股权证券
|
976
|
|
581
|
|
1 557
|
||||||
|
基金投资
|
|
|
233
|
|
233
|
||||||
|
或有代价应收账款
|
|
|
399
|
|
399
|
||||||
|
长期贷款、垫款、保证金和其他长期应收款
|
|
|
|
329
|
329
|
||||||
|
金融投资和长期贷款共计
|
976
|
|
1 213
|
329
|
2 518
|
||||||
|
相联公司按公允价值计入损益
|
|
|
186
|
|
186
|
||||||
|
|
|
|
|
|
|||||||
|
金融负债
|
|
|
|
|
|
||||||
|
或有对价应付款
|
|
|
– 1 036
|
|
– 1 036
|
||||||
|
其他财务负债
|
|
|
– 29
|
|
– 29
|
||||||
|
衍生金融工具
|
|
– 185
|
|
|
– 185
|
||||||
|
按公允价值计算的财务负债总额
|
|
– 185
|
– 1 065
|
|
– 1 250
|
||||||
|
2018
|
|||||||||||
|
(百万美元) |
1级 |
2级 |
3级 |
价值
摊销成本 |
总计 |
||||||
|
金融资产
|
|
|
|
|
|
||||||
|
债务证券
|
302
|
23
|
|
|
325
|
||||||
|
基金投资
|
35
|
|
|
|
35
|
||||||
|
有价证券总额
|
337
|
23
|
|
|
360
|
||||||
|
原到期日超过90天的定期存款和短期投资
|
|
|
|
2 087
|
2 087
|
||||||
|
衍生金融工具
|
|
130
|
|
|
130
|
||||||
|
债务证券、定期存款和短期投资的应计利息
|
|
|
|
12
|
12
|
||||||
|
有价证券、定期存款和衍生金融工具共计
|
337
|
153
|
|
2 099
|
2 589
|
||||||
|
债务证券和股权证券
|
698
|
|
488
|
|
1 186
|
||||||
|
基金投资
|
|
|
251
|
|
251
|
||||||
|
或有代价应收账款
|
|
|
396
|
|
396
|
||||||
|
长期借款、应收客户款项及融资租赁、垫款、保证金
|
|
|
|
512
|
512
|
||||||
|
金融投资和长期贷款共计
|
698
|
|
1 135
|
512
|
2 345
|
||||||
|
相联公司按公允价值计入损益
|
|
|
145
|
|
145
|
||||||
|
|
|
|
|
|
|||||||
|
金融负债
|
|
|
|
|
|
||||||
|
或有对价应付款
|
|
|
– 907
|
|
– 907
|
||||||
|
其他财务负债
|
|
|
– 10
|
|
– 10
|
||||||
|
衍生金融工具
|
|
– 58
|
|
|
– 58
|
||||||
|
按公允价值计算的财务负债总额
|
|
– 58
|
– 917
|
|
– 975
|
||||||
|
2019
|
||||||||||||||
|
(百万美元) |
关联的
公司位于 公允价值至 损益 |
基金 投资 |
长期的 金融 投资 |
或有条件 考虑 应收账款 |
或有条件 考虑 应付款 |
其他 金融 负债 |
||||||||
|
一月一日
|
145
|
251
|
488
|
396
|
– 907
|
– 10
|
||||||||
|
非连续性业务的影响 1
|
|
– 28
|
– 19
|
|
163
|
|
||||||||
|
公允价值收益及其他调整,包括在综合收益表中确认的剥离
|
|
12
|
6
|
35
|
195
|
1
|
||||||||
|
公允价值亏损(包括减值, 其他调整 于综合收益表
|
– 15
|
|
|
|
– 89
|
– 48
|
||||||||
|
综合全面收益表确认的公允价值调整
|
|
|
– 6
|
|
|
|
||||||||
|
购买
|
49
|
28
|
229
|
|
– 401
|
– 5
|
||||||||
|
现金收支
|
|
|
|
– 32
|
3
|
33
|
||||||||
|
处置
|
– 3
|
– 30
|
– 53
|
|
|
|
||||||||
|
重新分类
|
10
|
|
– 64
|
|
|
|
||||||||
|
12月31日
|
186
|
233
|
581
|
399
|
– 1 036
|
– 29
|
||||||||
|
|
|
|
|
|
|
|||||||||
|
确认的公允价值损益总额 在综合损益表中, 2019年12月31日持有的负债
|
– 15
|
12
|
6
|
35
|
106
|
– 47
|
||||||||
|
|
||||||||||||||
|
1 附注1、2和30提供了与已终止业务有关的资料。
|
||||||||||||||
|
2018
|
||||||||||||||
|
(百万美元) |
关联的
公司位于 公允价值至 损益 |
基金 投资 |
长期的 金融 投资 |
或有条件 考虑 应收账款 |
或有条件 考虑 应付款 |
其他 金融 负债 |
||||||||
|
一月一日
|
188
|
166
|
437
|
844
|
– 852
|
– 72
|
||||||||
|
公平值收益及其他调整, 包括潜水员公认的 于综合收益表
|
|
93
|
|
36
|
213
|
|
||||||||
|
公允价值亏损(包括减值, 其他调整 于综合收益表
|
– 22
|
|
– 5
|
|
– 100
|
|
||||||||
|
综合全面收益表确认的公允价值调整
|
|
|
– 10
|
|
|
|
||||||||
|
购买
|
24
|
22
|
123
|
|
– 182
|
|
||||||||
|
现金收支
|
|
|
|
– 484
|
11
|
62
|
||||||||
|
处置
|
– 6
|
– 30
|
– 25
|
|
|
|
||||||||
|
与出售集团持有待售有关的应付或有代价
|
|
|
|
|
3
|
|
||||||||
|
重新分类
|
– 39
|
|
– 32
|
|
|
|
||||||||
|
12月31日
|
145
|
251
|
488
|
396
|
– 907
|
– 10
|
||||||||
|
|
|
|
|
|
|
|||||||||
|
截至2018年12月31日的综合资产负债损益表确认的公允价值损益合计
|
– 22
|
93
|
– 5
|
36
|
113
|
|
||||||||
|
(百万美元)
|
2019
|
2018
|
|||
|
上市股权证券
|
843
|
597
|
|||
|
非上市股权证券
|
315
|
205
|
|||
|
总股本证券
|
1 158
|
802
|
|||
|
|
|||||
|
2019
|
|||||||||||||
|
(百万美元) |
截止日期为 一个月 |
截止日期晚于
一个月 但不到 三个月 |
截止日期晚于
三个月 但不到 一年 |
截止日期晚于
一年 但不到 五年 |
截止日期为 五年 |
总计 |
|||||||
|
流动资产
|
|
|
|
|
|
|
|||||||
|
原到期日超过90天的有价证券、定期存款和短期投资
|
20
|
26
|
16
|
3
|
57
|
122
|
|||||||
|
商品
|
|
|
|
|
110
|
110
|
|||||||
|
衍生金融工具和应计利息
|
14
|
79
|
3
|
3
|
3
|
102
|
|||||||
|
现金和现金等价物
|
9 712
|
1 400
|
|
|
|
11 112
|
|||||||
|
流动金融资产总额
|
9 746
|
1 505
|
19
|
6
|
170
|
11 446
|
|||||||
|
|
|
|
|
|
|
||||||||
|
非流动负债
|
|
|
|
|
|
|
|||||||
|
金融债务
|
|
|
|
– 9 110
|
– 11 243
|
– 20 353
|
|||||||
|
金融债务--未贴现
|
|
|
|
– 9 150
|
– 11 355
|
– 20 505
|
|||||||
|
非流动金融债务共计
|
|
|
|
– 9 110
|
– 11 243
|
– 20 353
|
|||||||
|
|
|
|
|
|
|
||||||||
|
流动负债
|
|
|
|
|
|
|
|||||||
|
金融债务
|
– 4 243
|
– 1 373
|
– 1 230
|
|
|
– 6 846
|
|||||||
|
金融债务--未贴现
|
– 4 243
|
– 1 373
|
– 1 230
|
|
|
– 6 846
|
|||||||
|
衍生金融工具
|
– 130
|
– 29
|
– 26
|
|
|
– 185
|
|||||||
|
流动金融债务总额
|
– 4 373
|
– 1 402
|
– 1 256
|
|
|
– 7 031
|
|||||||
|
|
|
|
|
|
|
||||||||
|
净债务
|
5 373
|
103
|
– 1 237
|
– 9 104
|
– 11 073
|
– 15 938
|
|||||||
|
2018
|
|||||||||||||
|
(百万美元) |
截止日期为 一个月 |
截止日期晚于
一个月 但不到 三个月 |
截止日期晚于
三个月 但不到 一年 |
截止日期晚于
一年 但不到 五年 |
截止日期为 五年 |
总计 |
|||||||
|
流动资产
|
|
|
|
|
|
|
|||||||
|
原到期日超过90天的有价证券、定期存款和短期投资
|
39
|
56
|
2 091
|
198
|
63
|
2 447
|
|||||||
|
商品
|
|
|
|
|
104
|
104
|
|||||||
|
衍生金融工具和应计利息
|
40
|
75
|
27
|
|
|
142
|
|||||||
|
现金和现金等价物
|
3 571
|
9 700
|
|
|
|
13 271
|
|||||||
|
流动金融资产总额
|
3 650
|
9 831
|
2 118
|
198
|
167
|
15 964
|
|||||||
|
|
|
|
|
|
|
||||||||
|
非流动负债
|
|
|
|
|
|
|
|||||||
|
金融债务
|
|
|
|
– 8 980
|
– 13 490
|
– 22 470
|
|||||||
|
金融债务--未贴现
|
|
|
|
– 9 025
|
– 13 623
|
– 22 648
|
|||||||
|
非流动金融债务共计
|
|
|
|
– 8 980
|
– 13 490
|
– 22 470
|
|||||||
|
|
|
|
|
|
|
||||||||
|
流动负债
|
|
|
|
|
|
|
|||||||
|
金融债务
|
– 5 217
|
– 4 084
|
– 319
|
|
|
– 9 620
|
|||||||
|
金融债务--未贴现
|
– 5 217
|
– 4 084
|
– 319
|
|
|
– 9 620
|
|||||||
|
衍生金融工具
|
– 16
|
– 34
|
– 8
|
|
|
– 58
|
|||||||
|
流动金融债务总额
|
– 5 233
|
– 4 118
|
– 327
|
|
|
– 9 678
|
|||||||
|
|
|
|
|
|
|
||||||||
|
净债务
|
– 1 583
|
5 713
|
1 791
|
– 8 782
|
– 13 323
|
– 16 184
|
|||||||
|
2019
|
|||||||||
|
(百万美元) |
截止日期为 一个月 |
截止日期晚于
一个月 但不到 三个月 |
截止日期晚于
三个月 但不到 一年 |
|
总计 |
||||
|
衍生金融工具和衍生金融工具的应计利息
|
|
|
|
||||||
|
各种货币的潜在资金外流--金融衍生品负债
|
– 814
|
– 4 624
|
– 952
|
– 6 390
|
|||||
|
各种货币的潜在流入--来自金融衍生品资产
|
807
|
4 656
|
922
|
6 385
|
|||||
|
2018
|
|||||||||
|
(百万美元) |
截止日期为 一个月 |
截止日期晚于
一个月 但不到 三个月 |
截止日期晚于
三个月 但不到 一年 |
|
总计 |
||||
|
衍生金融工具和衍生金融工具的应计利息
|
|
|
|
|
|||||
|
各种货币的潜在资金外流--金融衍生品负债
|
– 1 305
|
– 2 949
|
– 598
|
– 4 852
|
|||||
|
各种货币的潜在流入--来自金融衍生品资产
|
1 328
|
2 974
|
593
|
4 895
|
|||||
|
2019
|
|||||||||||
|
(百万美元) |
截止日期晚于
一个月 但不到 三个月 |
截止日期晚于
三个月 但不到 一年 |
截止日期晚于
一年 但不到 五年 |
截止日期为 五年 |
总计 |
||||||
|
非流动负债的合同利息
|
– 36
|
– 428
|
– 1 531
|
– 3 439
|
– 5 434
|
||||||
|
租赁负债
|
– 65
|
– 181
|
– 622
|
– 1 081
|
– 1 949
|
||||||
|
贸易应付款
|
– 5 222
|
– 202
|
|
|
– 5 424
|
||||||
|
或有对价负债
|
– 62
|
– 9
|
– 582
|
– 383
|
– 1 036
|
||||||
|
2018
|
|||||||||||
|
(百万美元) |
截止日期晚于
一个月 但不到 三个月 |
截止日期晚于
三个月 但不到 一年 |
截止日期晚于
一年 但不到 五年 |
截止日期为 五年 |
总计 |
||||||
|
非流动负债的合同利息
|
– 113
|
– 459
|
– 1 667
|
– 3 755
|
– 5 994
|
||||||
|
贸易应付款
|
– 5 556
|
|
|
|
– 5 556
|
||||||
|
或有对价负债
|
|
– 98
|
– 470
|
– 339
|
– 907
|
||||||
|
(百万美元)
|
2019
|
2018
|
|||
|
所有金融工具
|
355
|
337
|
|||
|
按成分分析:
|
|
|
|||
|
对外币汇率敏感的工具
|
89
|
217
|
|||
|
对股票市场波动敏感的工具
|
31
|
122
|
|||
|
对利率敏感的工具
|
187
|
221
|
|||
|
2019
|
|||||||
|
(百万美元)
|
平均值
|
高
|
低
|
||||
|
所有金融工具
|
348
|
385
|
303
|
||||
|
按成分分析:
|
|
|
|
||||
|
对外币汇率敏感的工具
|
143
|
195
|
86
|
||||
|
对股票市场波动敏感的工具
|
36
|
81
|
16
|
||||
|
对利率敏感的工具
|
233
|
303
|
187
|
||||
|
2018
|
|||||||
|
(百万美元)
|
平均值
|
高
|
低
|
||||
|
所有金融工具
|
443
|
553
|
337
|
||||
|
按成分分析:
|
|
|
|
||||
|
对外币汇率敏感的工具
|
324
|
473
|
217
|
||||
|
对股票市场波动敏感的工具
|
60
|
122
|
22
|
||||
|
对利率敏感的工具
|
253
|
361
|
169
|
||||
|
(百万美元)
|
2019 1
|
2018
|
2017
|
||||
|
非持续经营对第三方的净销售额
|
1 777
|
7 149
|
6 771
|
||||
|
对持续经营分部的销售
|
32
|
4
|
3
|
||||
|
来自已终止业务的净销售额
|
1 809
|
7 153
|
6 774
|
||||
|
其他收入
|
|
|
3
|
||||
|
销货成本
|
– 860
|
– 3 983
|
– 3 588
|
||||
|
非持续经营毛利
|
949
|
3 170
|
3 189
|
||||
|
销售、一般和行政管理
|
– 638
|
– 2 754
|
– 2 532
|
||||
|
研发
|
– 142
|
– 585
|
– 583
|
||||
|
其他收入
|
15
|
61
|
47
|
||||
|
其他费用
|
– 113
|
– 126
|
– 194
|
||||
|
来自已终止经营业务的营业收入/(亏损)
|
71
|
– 234
|
– 73
|
||||
|
利息支出
|
– 10
|
– 25
|
– 27
|
||||
|
其他财务收支
|
– 3
|
– 1
|
– 3
|
||||
|
来自终止经营业务的税前收入/(亏损)
|
58
|
– 260
|
– 103
|
||||
|
税费
|
– 159
|
74
|
307
|
||||
|
来自已终止经营业务之净(亏损)╱收入(扣除分派收益前)。 诺华公司股东
|
– 101
|
– 186
|
204
|
||||
|
爱尔康公司向诺华制药股东分派的收益 2
|
4 691
|
|
|
||||
|
非持续经营的净收益/(亏损)
|
4 590
|
– 186
|
204
|
||||
|
1 综合损益表金额为2019年1月1日至分拆完成为止的期间。
|
|||||||
|
2 有关分派Alcon Inc.(“Alcon Inc.”)的不应课税非现金收益的进一步详情,请参阅附注2。Novartis AG股东
|
|||||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
利息收入
|
|
2
|
|
||||
|
财产、厂房和设备折旧
|
– 42
|
– 235
|
– 217
|
||||
|
使用权资产折旧 1
|
– 9
|
|
|
||||
|
无形资产摊销
|
– 174
|
– 1 052
|
– 1 066
|
||||
|
财产、厂房和设备的减值费用
|
|
– 3
|
|
||||
|
无形资产减值准备 2
|
|
– 391
|
– 57
|
||||
|
对重组条款的补充
|
|
– 13
|
– 8
|
||||
|
诺华股权计划的股权补偿
|
– 9
|
– 93
|
– 71
|
||||
|
1 从2019年1月1日起确认的使用权资产折旧,也就是IFRS 16租赁的实施日期。有关其他披露,请参阅注1。
|
|||||||
|
2 2018年包括与CyPass目前上市产品的减记有关的减值3.37亿美元,该产品是2016年Alcon Division收购Transcend Medical,Inc.。
|
|||||||
|
(百万美元)
|
2019
|
2018
|
|||
|
物业、厂房和设备的附加费
|
113
|
519
|
|||
|
对使用权资产的补充 1
|
3
|
|
|||
|
商誉和无形资产的增加
|
36
|
196
|
|||
|
1 2019年1月1日实施IFRS 16租约后,2019年确认的使用权资产的增加。有关其他披露,请参阅注1。
|
|||||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
从可归因于剥离爱尔康业务的交易费用拨备中支出
|
– 29
|
|
|
||||
|
已剥离现金和现金等价物
|
– 628
|
|
|
||||
|
分拆Alcon业务应占的现金流量
|
– 657
|
|
|
||||
|
用于投资活动的其他现金流量,净额
|
– 502
|
– 1 001
|
– 775
|
||||
|
已终止经营业务投资活动所用现金流量净额
|
– 1 159
|
– 1 001
|
– 775
|
||||
|
2018
|
|||||||||||
|
(百万美元) |
总计
未来 付款 |
不劳而获
金融 收入 |
现在时 价值 |
规定 |
上网本 价值 |
||||||
|
不迟于一年 1
|
64
|
– 5
|
59
|
– 2
|
57
|
||||||
|
在一到五年之间
|
117
|
– 9
|
108
|
– 28
|
80
|
||||||
|
晚于五年
|
48
|
– 2
|
46
|
– 35
|
11
|
||||||
|
总计
|
229
|
– 16
|
213
|
– 65
|
148
|
||||||
|
1 最低租赁付款之流动部分记录于应收贸易账款或其他流动资产(以未开具发票为限)。
|
|||||||||||
|
(百万美元)
|
2019
|
||
|
财产、厂房和设备
|
2 858
|
||
|
使用权资产
|
269
|
||
|
商誉
|
8 906
|
||
|
商誉以外的无形资产
|
11 121
|
||
|
递延税项资产
|
732
|
||
|
金融资产和其他非流动资产
|
526
|
||
|
盘存
|
1 469
|
||
|
应收贸易账款和其他流动资产
|
1 787
|
||
|
现金和现金等价物
|
628
|
||
|
递延税项负债
|
– 1 713
|
||
|
流动和非流动租赁负债
|
– 269
|
||
|
经常和非流动金融债务
|
– 3 538
|
||
|
应付贸易账款、拨备及其他负债
|
– 2 751
|
||
|
取消确认的净资产
|
20 025
|
||
|
(百万美元)
|
2019
|
2018
|
2017
|
||||
|
固定缴款计划的缴款停止运作
|
33
|
104
|
99
|
||||
|
截至2019年12月31日 |
分享
资本 1 |
权益
利息 |
|||||||
|
阿尔及利亚
|
|||||||||
|
SANDOZ公司
|
阿尔及尔
|
DZD
|
650.0
|
m
|
100%
|
||||
|
阿根廷
|
|||||||||
|
诺华阿根廷公司
|
布宜诺斯艾利斯
|
阿尔斯
|
906.1
|
m
|
100%
|
||||
|
澳大利亚
|
|||||||||
|
诺华澳大利亚有限公司
|
麦格理公园,新南威尔士州
|
澳元
|
2
|
|
100%
|
||||
|
诺华制药澳大利亚有限公司
|
麦格理公园,新南威尔士州
|
澳元
|
3.8
|
m
|
100%
|
||||
|
桑多兹私人有限公司
|
麦格理公园,新南威尔士州
|
澳元
|
11.6
|
m
|
100%
|
||||
|
奥地利
|
|||||||||
|
诺华奥地利有限公司
|
维也纳
|
欧元
|
1.0
|
m
|
100%
|
||||
|
Novartis Pharma GmbH
|
维也纳
|
欧元
|
1.1
|
m
|
100%
|
||||
|
Sandoz GmbH
|
Kundl
|
欧元
|
32.7
|
m
|
100%
|
||||
|
EBEWE Pharma Ges.m.b.H Nfg. kg
|
阿特湖河畔温特拉赫
|
欧元
|
1.0
|
m
|
100%
|
||||
|
孟加拉国
|
|||||||||
|
诺华(孟加拉国)有限公司
|
加兹浦尔
|
BDT
|
162.5
|
m
|
60%
|
||||
|
比利时
|
|||||||||
|
诺华制药公司
|
Vilvoorde
|
欧元
|
7.1
|
m
|
100%
|
||||
|
Sandoz NV
|
Vilvoorde
|
欧元
|
19.2
|
m
|
100%
|
||||
|
Alcon - Couvreur NV
|
Puurs
|
欧元
|
110.6
|
m
|
100%
|
||||
|
百慕大群岛
|
|||||||||
|
诺华投资有限公司
|
哈密尔顿 3
|
美元
|
12 000
|
|
100%
|
||||
|
诺华证券投资有限公司
|
哈密尔顿
|
CHF
|
30 000
|
|
100%
|
||||
|
诺华金融服务有限公司
|
哈密尔顿
|
CHF
|
20 000
|
|
100%
|
||||
|
三角国际再保险有限公司
|
哈密尔顿
|
CHF
|
1.0
|
m
|
100%
|
||||
|
三一河保险有限公司。
|
哈密尔顿
|
美元
|
370 000
|
|
100%
|
||||
|
巴西
|
|||||||||
|
诺华生物科技股份有限公司
|
圣保罗
|
BRL
|
265.0
|
m
|
100%
|
||||
|
Sandoz do Brasil Indústria Farmacúutica Ltd.
|
宾夕法尼亚州坎贝
|
BRL
|
190.0
|
m
|
100%
|
||||
|
加拿大
|
|||||||||
|
诺华制药加拿大公司。
|
魁北克省多瓦尔
|
计算机辅助设计
|
1.2
|
m
|
100%
|
||||
|
Sandoz加拿大公司
|
魁北克省布切维尔
|
计算机辅助设计
|
80.8
|
m
|
100%
|
||||
|
CIBA Vision Canada Inc.
|
安大略省密西索加
|
计算机辅助设计
|
82 886
|
|
100%
|
||||
|
智利
|
|||||||||
|
诺华智利公司
|
智利圣地亚哥
|
中电
|
2.0
|
BN
|
100%
|
||||
|
中国
|
|||||||||
|
北京诺华制药有限公司公司
|
北京
|
美元
|
30.0
|
m
|
100%
|
||||
|
诺华制药(香港)有限公司
|
香港
|
港币
|
200
|
|
100%
|
||||
|
中国诺华生物医学研究院有限公司公司
|
上海
|
美元
|
320.0
|
m
|
100%
|
||||
|
苏州诺华科技发展有限公司公司
|
常熟
|
美元
|
12.0
|
m
|
100%
|
||||
|
上海诺华贸易有限公司
|
上海
|
美元
|
3.2
|
m
|
100%
|
||||
|
山德士(中国)制药有限公司公司
|
中山
|
美元
|
57.6
|
m
|
100%
|
||||
|
哥伦比亚
|
|||||||||
|
哥伦比亚诺华公司
|
桑塔菲德·波哥大
|
科普
|
7.9
|
BN
|
100%
|
||||
|
克罗地亚
|
|||||||||
|
桑多兹·迪奥。印度农家乐
|
萨格勒布
|
HRK
|
25.6
|
m
|
100%
|
||||
|
捷克共和国
|
|||||||||
|
Novartis s.r.o.
|
布拉格
|
捷克ZK
|
51.5
|
m
|
100%
|
||||
|
桑多兹S.r.o。
|
布拉格
|
捷克ZK
|
44.7
|
m
|
100%
|
||||
|
丹麦
|
|||||||||
|
Novartis Healthcare A/S
|
哥本哈根
|
DKK
|
14.0
|
m
|
100%
|
||||
|
桑多兹A/S
|
哥本哈根
|
DKK
|
12.0
|
m
|
100%
|
||||
|
厄瓜多尔
|
|||||||||
|
Novartis Ecuador S.A.
|
基多
|
美元
|
4.0
|
m
|
100%
|
||||
|
埃及
|
|||||||||
|
诺华制药有限公司
|
开罗
|
埃普
|
193.8
|
m
|
99.77%
|
||||
|
Sandoz Egypt Pharma S.A.E.
|
新开罗市
|
埃普
|
250 000
|
|
100%
|
||||
|
芬兰
|
|||||||||
|
诺华芬兰公司
|
埃斯波
|
欧元
|
459 000
|
|
100%
|
||||
|
截至2019年12月31日 |
分享
资本 1 |
权益
利息 |
|||||||
|
法国
|
|||||||||
|
诺华集团法国股份有限公司
|
Rueil-Malmaison
|
欧元
|
903.0
|
m
|
100%
|
||||
|
诺华制药有限公司
|
Rueil-Malmaison
|
欧元
|
43.4
|
m
|
100%
|
||||
|
Advanced Accelerator Applications S.A.
|
圣热尼斯-普利
|
欧元
|
9.6
|
m
|
99.2%
|
||||
|
CELLFORCURE
|
Les Ulis
|
欧元
|
4.2
|
m
|
100%
|
||||
|
山德士股份有限公司
|
Levallois—Perret
|
欧元
|
5.4
|
m
|
100%
|
||||
|
德国
|
|||||||||
|
诺华德国有限公司
|
纽伦堡
|
欧元
|
155.5
|
m
|
100%
|
||||
|
Novartis Pharma GmbH
|
纽伦堡
|
欧元
|
25.6
|
m
|
100%
|
||||
|
诺华制药有限公司
|
韦尔
|
欧元
|
2.0
|
m
|
100%
|
||||
|
诺华制造有限公司
|
马尔堡
|
欧元
|
25 000
|
|
100%
|
||||
|
Sandoz International GmbH
|
霍尔茨基兴
|
欧元
|
100 000
|
|
100%
|
||||
|
1 A Pharma GmbH
|
奥伯哈兴
|
欧元
|
26 000
|
|
100%
|
||||
|
HEXAL AG
|
霍尔茨基兴
|
欧元
|
93.7
|
m
|
100%
|
||||
|
Salutas Pharma GmbH
|
巴勒本
|
欧元
|
42.1
|
m
|
100%
|
||||
|
Aeropharm GmbH
|
鲁道夫施塔特
|
欧元
|
26 000
|
|
100%
|
||||
|
希腊
|
|||||||||
|
诺华(希腊)S.A.C.I.
|
《变形记》/雅典
|
欧元
|
23.4
|
m
|
100%
|
||||
|
匈牙利
|
|||||||||
|
诺华匈牙利医疗保健有限责任公司
|
布达佩斯
|
HUF
|
545.6
|
m
|
100%
|
||||
|
匈牙利山德士有限责任公司
|
布达佩斯
|
HUF
|
883.0
|
m
|
100%
|
||||
|
印度
|
|||||||||
|
诺华印度有限公司
|
孟买
|
INR
|
123.5
|
m
|
70.68%
|
||||
|
诺华医疗私人有限公司
|
孟买
|
INR
|
60.0
|
m
|
100%
|
||||
|
Sandoz Private Limited
|
孟买
|
INR
|
32.0
|
m
|
100%
|
||||
|
印度尼西亚
|
|||||||||
|
PT.诺华印尼公司
|
雅加达
|
IDR
|
7.7
|
BN
|
100%
|
||||
|
爱尔兰
|
|||||||||
|
诺华爱尔兰有限公司
|
都柏林
|
欧元
|
25 000
|
|
100%
|
||||
|
Novartis Ringaskiddy Limited
|
林加斯基迪
|
欧元
|
2.0
|
m
|
100%
|
||||
|
以色列
|
|||||||||
|
诺华以色列有限公司
|
特拉维夫
|
ILS
|
1 000
|
|
100%
|
||||
|
意大利
|
|||||||||
|
诺华制药公司
|
奥利焦
|
欧元
|
18.2
|
m
|
100%
|
||||
|
Advanced Accelerator Applications(Italy)S.r.l.
|
波齐利
|
欧元
|
119 000
|
|
99.2%
|
||||
|
Sandoz S.p.A.
|
奥利焦
|
欧元
|
1.7
|
m
|
100%
|
||||
|
日本
|
|||||||||
|
诺华控股日本公司
|
东京
|
日元
|
10.0
|
m
|
100%
|
||||
|
诺华制药公司
|
东京
|
日元
|
6.0
|
BN
|
100%
|
||||
|
汽巴-盖基日本有限公司
|
东京
|
日元
|
8.5
|
m
|
100%
|
||||
|
山德士K.K.
|
东京
|
日元
|
100.0
|
m
|
100%
|
||||
|
拉脱维亚
|
|||||||||
|
诺华波罗的海新航
|
里加
|
欧元
|
3.0
|
m
|
100%
|
||||
|
卢森堡
|
|||||||||
|
诺华投资股份有限公司
|
卢森堡市
|
美元
|
100.0
|
m
|
100%
|
||||
|
诺华财务公司
|
卢森堡市
|
美元
|
100 000
|
|
100%
|
||||
|
马来西亚
|
|||||||||
|
诺华公司(马来西亚)有限公司巴赫德。
|
吉隆坡
|
麦尔
|
3.3
|
m
|
100%
|
||||
|
墨西哥
|
|||||||||
|
诺华公司,S.A.de C.V.
|
墨西哥城
|
MXN
|
205.0
|
m
|
100%
|
||||
|
Sandoz,S.A. de C.V.
|
墨西哥城
|
MXN
|
468.2
|
m
|
100%
|
||||
|
摩洛哥
|
|||||||||
|
诺华制药公司Maroc SA
|
卡萨布兰卡
|
疯了
|
80.0
|
m
|
100%
|
||||
|
荷兰
|
|||||||||
|
诺华荷兰公司
|
阿姆斯特丹
|
欧元
|
1.4
|
m
|
100%
|
||||
|
诺华制药公司
|
阿姆斯特丹
|
欧元
|
4.5
|
m
|
100%
|
||||
|
IDB荷兰BV
|
巴勒-拿骚
|
欧元
|
18 000
|
|
99.2%
|
||||
|
山德士公司
|
阿尔梅勒
|
欧元
|
907 560
|
|
100%
|
||||
|
新西兰
|
|||||||||
|
诺华新西兰有限公司
|
奥克兰
|
NZD
|
820 000
|
|
100%
|
||||
|
截至2019年12月31日 |
分享
资本 1 |
权益
利息 |
|||||||
|
挪威
|
|||||||||
|
诺华公司作为
|
奥斯陆
|
诺克
|
1.5
|
m
|
100%
|
||||
|
巴基斯坦
|
|||||||||
|
诺华制药(巴基斯坦)有限公司
|
卡拉奇
|
PKR
|
6.7
|
BN
|
99.99%
|
||||
|
巴拿马
|
|||||||||
|
诺华制药(物流)公司
|
巴拿马城
|
美元
|
10 000
|
|
100%
|
||||
|
秘鲁
|
|||||||||
|
诺华生物科学秘鲁有限公司
|
利马
|
钢笔
|
6.1
|
m
|
100%
|
||||
|
菲律宾
|
|||||||||
|
诺华菲律宾医疗保健公司。
|
马卡蒂市
|
PHP
|
298.8
|
m
|
100%
|
||||
|
菲律宾山德士公司
|
马卡蒂市
|
PHP
|
30.0
|
m
|
100%
|
||||
|
波兰
|
|||||||||
|
诺华波兰公司ZO.O。
|
华沙
|
PLN
|
44.2
|
m
|
100%
|
||||
|
Sandoz Polska Sp. z o.o.
|
华沙
|
PLN
|
25.6
|
m
|
100%
|
||||
|
Lek S.A.
|
斯特雷库夫
|
PLN
|
11.4
|
m
|
100%
|
||||
|
葡萄牙
|
|||||||||
|
诺华葡萄牙SGPS Lda.
|
萨尔沃港
|
欧元
|
500 000
|
|
100%
|
||||
|
Novartis Farma—Produtos Farmacêuticos S.A.
|
萨尔沃港
|
欧元
|
2.4
|
m
|
100%
|
||||
|
桑多兹农场公司
|
萨尔沃港
|
欧元
|
499 900
|
|
100%
|
||||
|
罗马尼亚
|
|||||||||
|
诺华制药服务罗马尼亚公司
|
布加勒斯特
|
罗恩
|
3.0
|
m
|
100%
|
||||
|
Sandoz S.R.L.
|
Targu-Mures
|
罗恩
|
105.2
|
m
|
100%
|
||||
|
俄罗斯联邦
|
|||||||||
|
诺华制药有限公司
|
莫斯科
|
擦,擦
|
20.0
|
m
|
100%
|
||||
|
诺华Neva有限责任公司
|
圣彼得堡
|
擦,擦
|
500.0
|
m
|
100%
|
||||
|
赵三都士
|
莫斯科
|
擦,擦
|
57.4
|
m
|
100%
|
||||
|
沙特阿拉伯
|
|||||||||
|
诺华沙特有限公司
|
利雅得
|
撒尔
|
26.8
|
m
|
75%
|
||||
|
新加坡
|
|||||||||
|
诺华(新加坡)私人有限公司
|
新加坡
|
SGD
|
100 000
|
|
100%
|
||||
|
诺华新加坡制药私人有限公司
|
新加坡
|
SGD
|
45.0
|
m
|
100%
|
||||
|
诺华亚太制药有限公司
|
新加坡
|
SGD
|
39.0
|
m
|
100%
|
||||
|
斯洛伐克
|
|||||||||
|
诺华公司斯洛伐克公司。
|
布拉迪斯拉发
|
欧元
|
2.0
|
m
|
100%
|
||||
|
斯洛文尼亚
|
|||||||||
|
Lek Pharmaceuticals d.d.
|
卢布尔雅那
|
欧元
|
48.4
|
m
|
100%
|
||||
|
Sandoz Pharmaceuticals d.d.
|
卢布尔雅那
|
欧元
|
1.5
|
m
|
100%
|
||||
|
南非
|
|||||||||
|
诺华南非(私人)有限公司
|
米德兰德
|
扎尔
|
86.3
|
m
|
100%
|
||||
|
Sandoz南非(Pty)Ltd
|
Kempton Park
|
扎尔
|
3.0
|
m
|
100%
|
||||
|
韩国
|
|||||||||
|
诺华韩国有限公司
|
首尔
|
KRW
|
24.5
|
BN
|
98.55%
|
||||
|
西班牙
|
|||||||||
|
诺华FarmacéUtica,S.A.
|
巴塞罗那
|
欧元
|
63.0
|
m
|
100%
|
||||
|
高级加速器应用程序伊比利亚,S.L.U。
|
埃斯普古斯·德·洛贝雷加特
|
欧元
|
22.6
|
m
|
99.2%
|
||||
|
Sandoz Farmacéutica股份有限公司
|
马德里
|
欧元
|
270 450
|
|
100%
|
||||
|
山德士工业产品有限公司
|
Les Franqueses del Vallés/巴塞罗那
|
欧元
|
9.3
|
m
|
100%
|
||||
|
Alcon Cusi S.A.
|
El Masnou/巴塞罗那
|
欧元
|
10.1
|
m
|
100%
|
||||
|
Abadia Retuerta S.A.
|
萨隆·德·杜埃罗/巴拉多利德
|
欧元
|
6.0
|
m
|
100%
|
||||
|
瑞典
|
|||||||||
|
诺华Sverige AB
|
斯德哥尔摩
|
塞克
|
5.0
|
m
|
100%
|
||||
|
瑞士
|
|||||||||
|
诺华国际公司
|
巴塞尔
|
CHF
|
10.0
|
m
|
100%
|
||||
|
诺华控股公司
|
巴塞尔 3
|
CHF
|
100.2
|
m
|
100%
|
||||
|
诺华国际制药投资公司
|
巴塞尔
|
CHF
|
100 000
|
|
100%
|
||||
|
诺华生物风险投资公司
|
巴塞尔
|
CHF
|
100 000
|
|
100%
|
||||
|
诺华福尔施蒂夫通
|
巴塞尔
|
--
|
--
|
|
100%
|
||||
|
诺华Stiftung für Kaderosbildung
|
巴塞尔
|
--
|
--
|
|
100%
|
||||
|
诺华-米塔贝特公司
|
巴塞尔
|
--
|
--
|
|
100%
|
||||
|
诺华Stiftung für Mensch和Umwell
|
巴塞尔
|
--
|
--
|
|
100%
|
||||
|
Stiftung der Novartis AG für Erziehung,Ausbildung und Bildung
|
巴塞尔
|
--
|
--
|
|
100%
|
||||
|
诺华海外投资公司
|
巴塞尔
|
CHF
|
1.0
|
m
|
100%
|
||||
|
日本股份公司
|
巴塞尔
|
CHF
|
50 000
|
|
100%
|
||||
|
诺华制药公司
|
巴塞尔 3
|
CHF
|
350.0
|
m
|
100%
|
||||
|
诺华国际制药公司
|
巴塞尔 3
|
CHF
|
100 000
|
|
100%
|
||||
|
诺华制药服务公司
|
巴塞尔
|
CHF
|
20.0
|
m
|
100%
|
||||
|
诺华制药Schweizerhalle AG
|
穆滕茨
|
CHF
|
18.9
|
m
|
100%
|
||||
|
诺华制药公司
|
斯坦
|
CHF
|
251 000
|
|
100%
|
||||
|
诺华制药公司
|
里希
|
CHF
|
5.0
|
m
|
100%
|
||||
|
诺华眼科公司
|
弗里堡
|
CHF
|
100 000
|
|
100%
|
||||
|
高级加速器应用国际公司
|
日内瓦
|
CHF
|
9.3
|
m
|
99.2%
|
||||
|
Sandoz股份公司
|
巴塞尔
|
CHF
|
5.0
|
m
|
100%
|
||||
|
Sandoz制药公司
|
里希
|
CHF
|
100 000
|
|
100%
|
||||
|
罗氏控股公司
|
巴塞尔
|
CHF
|
160.0
|
m
|
33/6 2
|
||||
|
截至2019年12月31日 |
分享
资本 1 |
权益
利息 |
|||||||
|
台湾
|
|||||||||
|
诺华(台湾)有限公司
|
台北
|
台币
|
170.0
|
m
|
100%
|
||||
|
泰国
|
|||||||||
|
诺华(泰国)有限公司
|
曼谷
|
THB
|
302.0
|
m
|
100%
|
||||
|
土耳其
|
|||||||||
|
Novartis Saglik,Gida ve Tarim Ürünleri Sanayi ve Ticaret A.S.
|
伊斯坦布尔
|
试试看
|
98.0
|
m
|
100%
|
||||
|
Farmanova Saglik Hizmetleri Ltd.STI.
|
伊斯坦布尔
|
试试看
|
6.7
|
m
|
100%
|
||||
|
Sandoz IlaçSanayi ve Ticaret A.S.
|
伊斯坦布尔
|
试试看
|
165.2
|
m
|
99.99%
|
||||
|
Sandoz Grup Saglik Ürünleri Ilaçlari Sanayi ve Ticaret A.S.
|
格布兹-科卡埃利
|
试试看
|
50.0
|
m
|
100%
|
||||
|
乌克兰
|
|||||||||
|
Sandoz乌克兰有限责任公司
|
基辅
|
UAH
|
8.0
|
m
|
100%
|
||||
|
阿拉伯联合酋长国
|
|||||||||
|
诺华中东FZE
|
迪拜
|
AED
|
7.0
|
m
|
100%
|
||||
|
英国
|
|||||||||
|
诺华英国有限公司
|
伦敦
|
英镑
|
25.5
|
m
|
100%
|
||||
|
诺华制药英国有限公司
|
伦敦
|
英镑
|
5.4
|
m
|
100%
|
||||
|
诺华格里姆斯比有限公司
|
伦敦
|
英镑
|
250.0
|
m
|
100%
|
||||
|
影像设备有限公司
|
伦敦
|
英镑
|
100
|
|
99.2%
|
||||
|
Vivacta Limited
|
弗里姆利/坎伯利
|
英镑
|
2.9
|
m
|
100.0%
|
||||
|
Ziarco Group Limited
|
伦敦
|
英镑
|
3 904
|
|
100%
|
||||
|
Sandoz Limited
|
弗里姆利/坎伯利
|
英镑
|
2.0
|
m
|
100%
|
||||
|
美利坚合众国
|
|||||||||
|
诺华公司
|
East Hanover,NJ
|
美元
|
72.2
|
m
|
100%
|
||||
|
诺华金融公司
|
East Hanover,NJ 3
|
美元
|
1 000
|
|
100%
|
||||
|
诺华资本公司
|
East Hanover,NJ
|
美元
|
1
|
|
100%
|
||||
|
Novartis Services,Inc.
|
East Hanover,NJ
|
美元
|
1
|
|
100%
|
||||
|
诺华美国基金会
|
East Hanover,NJ
|
--
|
--
|
|
100%
|
||||
|
诺华制药公司
|
East Hanover,NJ
|
美元
|
650
|
|
100%
|
||||
|
Advanced Accelerator Applications USA,Inc.
|
新泽西州米尔本
|
美元
|
1
|
|
99.2%
|
||||
|
AveXis公司
|
Bannockburn,IL
|
美元
|
1
|
|
100%
|
||||
|
Novartis Inflamasome Research,Inc.
|
East Hanover,NJ
|
美元
|
1
|
|
100%
|
||||
|
诺华技术有限责任公司
|
East Hanover,NJ
|
--
|
--
|
|
100%
|
||||
|
诺华生物医学研究所
|
马萨诸塞州剑桥
|
美元
|
1
|
|
100%
|
||||
|
CoStim Pharmaceuticals Inc
|
马萨诸塞州剑桥
|
美元
|
1
|
|
100%
|
||||
|
Encore Vision,Inc.
|
East Hanover,NJ
|
美元
|
1
|
|
100%
|
||||
|
Endocyte公司
|
East Hanover,NJ
|
美元
|
1
|
|
100%
|
||||
|
导航生物制药服务公司。
|
加利福尼亚州卡尔斯巴德
|
美元
|
1
|
|
100%
|
||||
|
Reprixys制药公司
|
East Hanover,NJ
|
美元
|
1
|
|
100%
|
||||
|
Spinifex制药公司
|
East Hanover,NJ
|
美元
|
1
|
|
100%
|
||||
|
Novartis Institute for Functional Genomics,Inc.
|
加利福尼亚州圣地亚哥
|
美元
|
1 000
|
|
100%
|
||||
|
Sandoz Inc.
|
新泽西州普林斯顿
|
美元
|
25 000
|
|
100%
|
||||
|
Oriel Therapeutics公司
|
北卡罗来纳州达勒姆
|
美元
|
1
|
|
100%
|
||||
|
富格拉制药公司
|
纽约州梅尔维尔
|
美元
|
1
|
|
100%
|
||||
|
Eon Labs,Inc.
|
新泽西州普林斯顿
|
美元
|
1
|
|
100%
|
||||
|
Novartis Vaccines and Diagnostics,Inc.
|
East Hanover,NJ
|
美元
|
3
|
|
100%
|
||||
|
委内瑞拉
|
|||||||||
|
委内瑞拉诺华制药公司
|
加拉加斯
|
VES
|
14
|
|
100%
|
||||
|
此外,本集团在以下国家的子公司和联营公司的总资产或净销售额低于2500万美元:波斯尼亚/黑塞哥维那、保加利亚、多米尼加共和国、危地马拉、肯尼亚、北马其顿、尼日利亚、波多黎各、乌拉圭和越南
|
|||||||||
|
1 股本可以不反映应纳税股本,也不包括任何实收盈余。
|
|||||||||
|
2 约33%的有表决权股份;约6%的净收入和诺华应占权益。
|
|||||||||
|
3 美国证券交易委员会规则下的重要附属公司S-X规则1-02(W)
|
|||||||||
|
M=百万;BN=十亿
|
|||||||||
独立注册会计师事务所报告