

2024 年 3 月 GAD 投资者演示文稿附录 99.2 MM120

免责声明本演示文稿(“演示文稿”)由 Mind Medicine (MindMed) Inc.(“MindMed”、“公司”、“我们”、“我们的” 或 “我们”)编写,仅供参考。MindMed、其关联公司或其各自的员工、 董事、高级职员、承包商、顾问、成员、继任者、代表或代理均不对本演示文稿中包含的任何信息的准确性或完整性作出任何陈述或保证,也不对本演示文稿中包含的任何 陈述(明示或暗示)或任何遗漏承担任何责任。本演示文稿不构成MindMed证券的发行或收购要约的邀请,在任何情况下, 都不得将其解释为招股说明书、广告或证券公开发行。此处包含的任何商标均为其所有者的财产,仅用于参考目的。此类使用不应被解释为对 MindMed 产品或服务的认可 。除非另有说明,否则任何金额均以美元为单位。MindMed 的证券未经美国证券交易委员会(SEC)或任何州、省或其他 证券监管机构的批准或拒绝,美国证券交易委员会或任何州、省或其他证券监管机构也未透露本演示文稿的准确性或充分性。任何与此相反的陈述均属刑事犯罪。关于前瞻性陈述的警示说明 本演示文稿包含1995年美国私人 证券诉讼改革法案和其他适用的证券法安全港条款所指的 “前瞻性陈述”,我们的高级管理人员和代表可能会不时作出。前瞻性陈述通常可以用诸如 “计划”、“预期”、“预期”、 “预算”、“计划”、“估计”、“预测”、“打算”、“预期”、“将”、“项目” 或 “相信” 或变体(包括负面的 变体)等词语来识别,或某些行动、事件、结果或条件的陈述 “可能”、“可能”、“将”、“可能” 或 “将” 被采取、发生或实现, 对未来时期的类似提法。除历史事实陈述外,前瞻性陈述的示例包括与以下内容有关的陈述:任何药物或疗法的开发和商业化,或上述任一药物或疗法的 疗效,我们开发活动的成功和时机;我们计划进行的临床试验的成功和时机;我们实现本文规定的里程碑的能力;任何临床试验 成功或获得食品药品管理局或其他监管机构批准的可能性;我们的现金跑道通过关键临床为业务提供资金读数及2026年;获得专利的可能性或此类专利一旦获得批准的效力,以及MindMed预期进入的市场潜力 。前瞻性陈述既不是历史事实,也不是对未来表现的保证。相反,它们仅基于我们当前对我们 业务的未来、未来计划和战略、预测、预期事件和趋势、经济以及截至本演示文稿之日的其他未来状况的信念、预期和假设。尽管 MindMed 认为这些假设是合理的,但 本质上会受到难以预测的重大业务、社会、经济、政治、监管、竞争和其他风险和不确定性的影响,其中许多风险和不确定性不在 MindMed 的控制范围内,实际结果和 财务状况可能与前瞻性陈述中显示的存在重大差异。因此,您不应依赖这些前瞻性陈述中的任何一项。可能导致实际业绩和财务状况 与前瞻性陈述中显示的存在重大差异的重要因素包括:我们筹集资金以完成计划和资助其研究的能力;正在开发的 药物和治疗的医疗和商业可行性;MindMed的负现金流历史;MindMed的有限运营历史;未来出现亏损;遵守法律法规;相关困难研究和 开发;与临床试验或研究相关的风险;加强监管审查;早期产品开发;临床试验风险;监管批准程序;迷幻药行业的新颖性;以及 MindMed最近向美国证券交易委员会提交的10-K表年度报告以及我们未来向美国证券交易委员会和 证券监管机构提交的其他文件中的 “风险因素” 部分中讨论或提及的风险因素加拿大所有省份和地区,可在公司在 SEDAR 上的简介,网址为 www.sedar.com。MindMed在本演示文稿中做出的任何前瞻性陈述仅基于公司目前可用的信息 ,并且仅代表截至发表之日的信息。MindMed 没有义务公开更新可能不时发表的任何前瞻性陈述,无论是书面还是口头陈述,无论这些陈述是新信息、未来发展还是其他原因造成的。关于监管事项的警示说明美国联邦政府通过《管制物质法》对药物进行监管。MM120 是专有的、经过药物优化的 形式的 D-酒石酸麦角苷,而 MM402 或 R (-)-MDMA 是我们专有的 MDMA(3,4-亚甲二氧基甲基苯丙胺)的 R-对映异构体。根据《管制物质法》,Lysergide和MDMA是附表一物质。尽管公司 专注于使用迷幻或致幻化合物以及这些化合物的非致幻衍生物的项目,包括其 MM120、MM402 和其他候选产品,但该公司并未直接或间接参与 在其经营所在司法管辖区非法销售、生产或分销任何物质的活动。该公司是一家神经药物开发公司,不经营迷幻或致幻物质,除非是在批准的监管框架内进行的 实验室和临床试验环境中。公司的产品在获得适用的监管批准之前不会商业化,只有在成功开发出用于预期用途的安全性和有效性 的临床证据后,才会获得批准。市场和行业数据本演示文稿包括从第三方来源(包括行业出版物)获得的市场和行业数据。MindMed 认为行业数据 是准确的,估计和假设是合理的,但无法保证这些数据的准确性或完整性。第三方消息来源通常表示,其中包含的信息是从被认为可靠的 来源获得的,但无法保证所含信息的准确性或完整性。尽管数据被认为是可靠的,但MindMed尚未独立验证本演示文稿中提及 的第三方来源的任何数据,也没有确定这些来源所依据的基本经济假设。本演示文稿中对研究报告或文章和出版物的引用不应解释为描述了整个引用报告或文章的 的完整发现。MindMed 对此类信息的准确性不作任何陈述。投资者演示文稿 | 2024 年 3 月 2

介绍性发言罗伯特·巴罗首席执行官
我们的目标是成为大脑健康管道管理领域的全球领导者 针对开发和重大未满足的医疗需求商业化的药物项目临床专业知识渠道研究预期走向 通过关键临床研究 利用数十年的临床前和预期现金流 取得令人鼓舞的结果,以及到2026年*的2b期市场保护战略知识产权和研发战略旨在最大限度地提高市场排他性和保护*公司的现金和现金等价物为美元截至 12 月,9,970 万预计2023年31日和承诺信贷额度将为2026年的运营提供资金。投资者演示文稿 | 2024 年 3 月 5 日
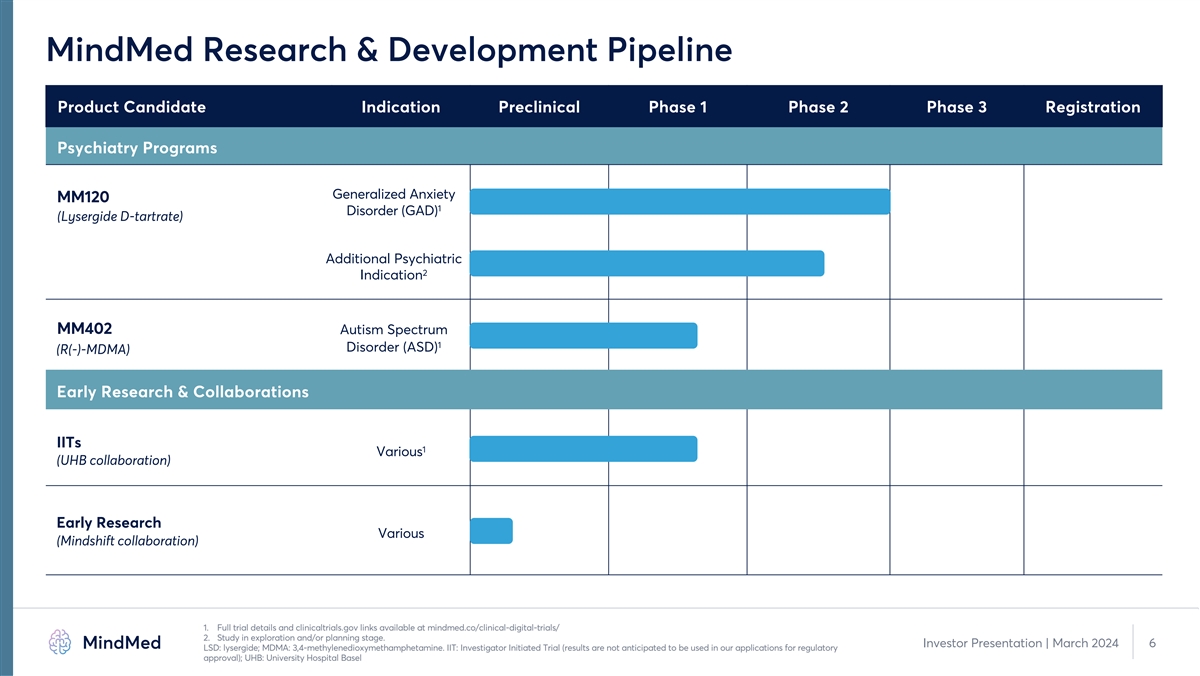
MindMed 研发管道产品候选适应症 临床前 1 期 2 期 3 期注册精神病学项目广泛性焦虑 MM120 1 障碍 (GAD) (Lysergide d-酒石酸盐) 其他精神病学 2 适应症 MM402 自闭症谱系 1 障碍 (ASD) (R (-)-MDMA) 早期研究和 合作 IITs 1 各种(UHB 合作)各种早期研究(Mindshift 合作)1.完整的试验详情和 clinicaltrials.gov 链接可在 mindmed.co/clinical-digital-trials/ 2 上获得。研究处于勘探和/或规划阶段。 投资者演示文稿 | 2024 年 3 月 6 日 LSD:lysergide;MDMA:3,4-亚甲二氧基甲基苯丙胺。IIT:研究者发起的试验(预计不会将结果用于我们的监管批准申请);UHB:巴塞尔大学医院

MM-120 有可能解决广泛性焦虑症 (GAD) 中大量未得到满足的需求 机会 1 • GAD 是成人中第二常见的精神障碍,可能是同类最佳但治疗选择有限使用新型 MOA 的治疗 • 症状可能会使人衰弱, 治疗无效会导致完全缓解和不可忍受的副作用。1 大型市场 1300 万 650 万人没有反应,大约 2,000 万患有 GAD 3 1 2 的美国成年人接受一线治疗的机会 77% 中度至重度 1 SSRI/SNRI:50%失败率常伴有不良副作用苯二氮卓类药物:成瘾、耐受风险;通常用于短期新疗法的重大需求 4 丁螺环酮:疗效不佳抗精神病药物:短期和长期风险; 耐受性差 1.精神和药物使用障碍患病率研究(MDPSU):2023年调查结果报告。2.凯斯勒 RC、Chiu WT、Demler O 等。全国合并症中12个月的DSM-IV疾病的患病率、严重程度和合并症 调查-复制。2005 Arch Gen Psychiatry;62 (6):617-627。7 投资者演示文稿 | 2024 年 3 月 3.安萨拉,耐药性广泛性焦虑症管理,Ment Health Clin 2020 年 11 月;10 (6) 326-334) 美国人口普查局, 公司计算。4.Garakani A等人,(2020)焦虑症的药物疗法:当前和新兴的治疗选择。正面。精神病学 11:595584. doi:10.3389/fpsyt.2020.595584

MM-120 更新的主要亮点 1 GAD 2b 期试验中 12 周耐久性阳性 • 主要和次要终点具有统计学意义 • 与安慰剂(d=0.81;p=0.003)相比改善了 7.7 个百分点 • 第 12 周使用 MM-120 ODT 增强产品概况• 在 PK 桥接研究中观察到的差异化特征 • 快速吸收、提高生物利用度和更高的治疗效果 AUC 1。来源:研究 MMED008 内部研究文件和计算。8 投资者演示文稿 | 2024 年 3 月 2.来源:研究 MM120-101 内部研究文件和计算。

单剂量 1,2 次后,GAD 中 MM120 的结果显示在目标产品概况中,所有终点均有显著改善,在 24 小时内快速起效 CGI-S 降低 1.8 个百分点(p
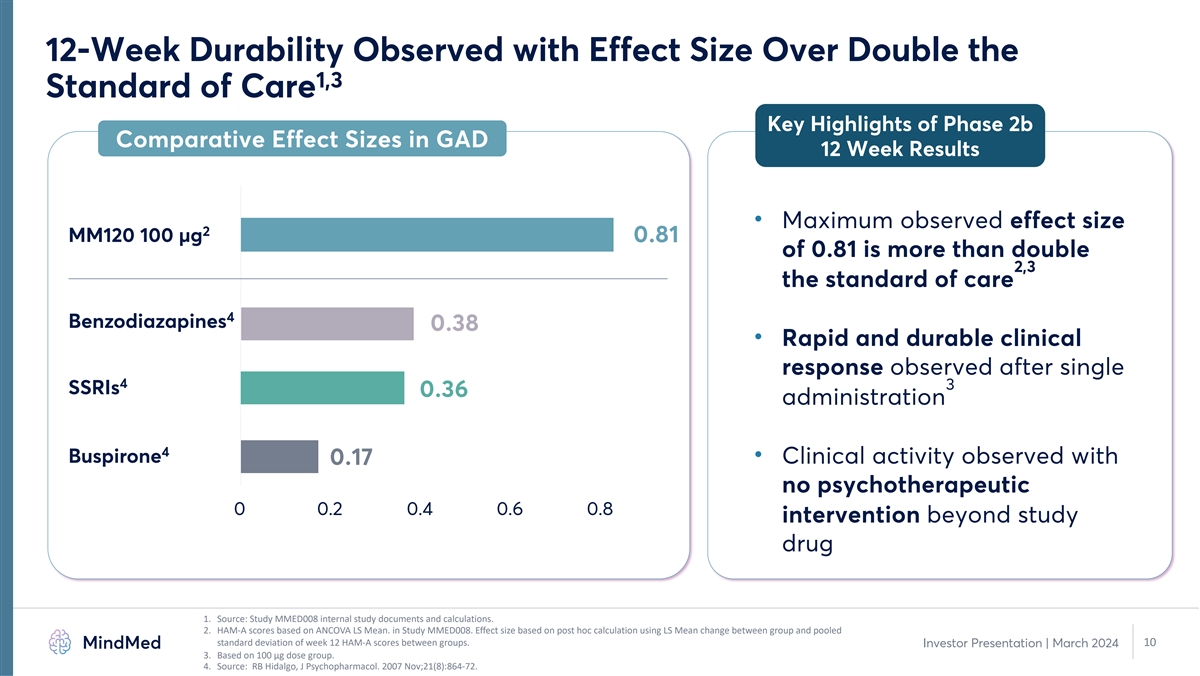
观察到 12 周的耐久性,效果大小是 GAD 12 周结果中 2b 期比较效果大小的两倍以上 • 最大观测效果尺寸 2 MM120 100 µg 0.81 of 0.81 是护理标准 4 苯二氮卓类 0.38 的两倍以上 • 在单 4 3 SSRI 0.36 给药 4 丁螺环酮后观察到的快速和 持久的临床反应 • 使用 0.17 no 观察到的临床活性心理治疗 0 0.2 0.4 0.6 0.8 研究药物 1 以外的干预措施。来源:研究 MMED008 内部研究 文件和计算。2.在 MMED008 研究中,HAM-A 分数基于 ANCOVA LS 平均值。效应大小基于事后计算,使用组间的 LS 平均值变化和第 12 周 HAM-A 分数的合并标准差。10 投资者 演示文稿 | 2024 年 3 月 3.基于 100 微克剂量组。4.资料来源:RB Hidalgo,J Psychopharmacol。2007 年 11 月;21 (8): 864-72。

PK 桥接研究表明,MM120 ODT 的产品特性得到增强 1 对比 PK Profile 2.5 MM120 胶囊的差异化性能 MM120 ODT MM120 ODT 2 2 起作用的速度加快 50% 1.5 3 17% 生物利用度提高 1 4 0.5 23%。AUC 0 5 0 2 4 6 8 10 12 14 16 18 20 22 24 减少胃肠道副作用时间(小时)1.公司对来自 MM120-101 研究的药代动力学数据的分析。PK 分析基于完成两次给药的 n=24 名受试者。2.基于达到大于 1 ng/mL 的目标浓度的时间。3.基于 曲线下总面积的几何平均比率的比较。投资者演示文稿 | 2024 年 3 月 11 4.基于平均AUC的比率。目标浓度定义为高于该水平会出现感知效应。>1ng/mL 5。基于 GAD 中 MM120 胶囊的 2b 期研究与 MM120 ODT 的 PK 桥接研究的 比较:曲线下方区域;胃肠道;ODT:口服溶解片;PK:药代动力学 MM120 浓度 (ng/mL)

MM120 LSD-D-酒石酸盐治疗广泛性焦虑症 (GAD) 2b 期试验 完整结果摘要 Daniel R Karlin,医学博士,马萨诸塞州首席医学官

GAD 2b 期研究的 12 周阳性主要结果:单剂量 MM120 2 后效果持久性强 1 • 符合具有统计学意义的主要和所有次要终点 • MCP-Mod 分析结果支持 GAD 3,4 中 MM120 的剂量反应关系 • 12 周观察到的 d=0.81 的大型 效应大小是护理标准的两倍多 o 观察到单剂 MM120 后至少 3 个月的耐久性 • 第12周(p=0.0025)3的HAM-A分数提高了21.9个百分点,具有统计学和临床意义与四周的头号数据相比有所改善 o 临床活性快速持久,在 12 周的观察期内,临床缓解率持续改善 5 至 48% 2 o 第 12 周所有分析的次要终点均有显著改善 • MM120 耐受性良好,无相关的严重不良事件 o 与药物类别和先前的研究一致,多为短暂的、轻度至中度的不良事件 6 o 没有 药物相关严重不良事件 (SAE) 且没有与自杀相关的安全信号 • 长期支持单次给药 MM120 的耐久性,我们认为这进一步支持将 100 µg MM120 推进 GAD 1 的第 3 阶段开发。 来源:研究 MMED008 内部研究文件和计算。报告了 100 µg 剂量组与安慰剂的个体组结果。2.代表第12周顶线分析中所有分析的次要终点,包括HAM-A、CGI-S和MADRS。 3。基于 100 µg 剂量组;HAM-A 分数基于 ANCOVA LS 平均值。效应大小基于研究统计学家使用组间的 LS 均值变化和各组期末 HAM-A 分数的合并标准差进行的事后计算。4. 检查所有研究的基线组分配(20项研究使用HAM-A(汉密尔顿焦虑量表),1项研究使用PARS(小儿焦虑量表)进行主要结局测量。资料来源:RB Hidalgo,J 13 Investor 演示文稿 | 2024 年 3 月 Psychopharmacol。2007 年 11 月;21 (8): 864-72. 5.缓解的定义是 HAM-A 分数为 ≤7. 6。根据报告的不良事件进行自杀性评估。

MM120 的 2b 期试验采用标准 GAD 设计和终点 1,与 FDA 药物类别指南草案一致 • 标准 GAD 研究设计,其终点支持批准药物的注册 • 随机、双盲、安慰剂对照 12 周试验 o 单次给药 或安慰剂 o 不进行心理治疗干预 2 o 试验设计与随后发布的 FDA 2023 年关于在随机分组之前退出焦虑药物治疗的患者指南草案紧密一致 • 入组 198 名 GAD 患者 • 五臂剂量 MM-120采用 1:1:1:1:1 随机化进行优化设计 • 主要终点:第 4 周汉密尔顿焦虑量表 (HAM-A) 的变化 o 由对治疗分配和就诊次数 1 视而不见的中心评估员进行评估。来源:研究 MMED008 内部研究文件和计算结果。14 投资者演示文稿 | 2024 年 3 月 2.FDA 2023 年指南草案:迷幻药物:临床研究注意事项。
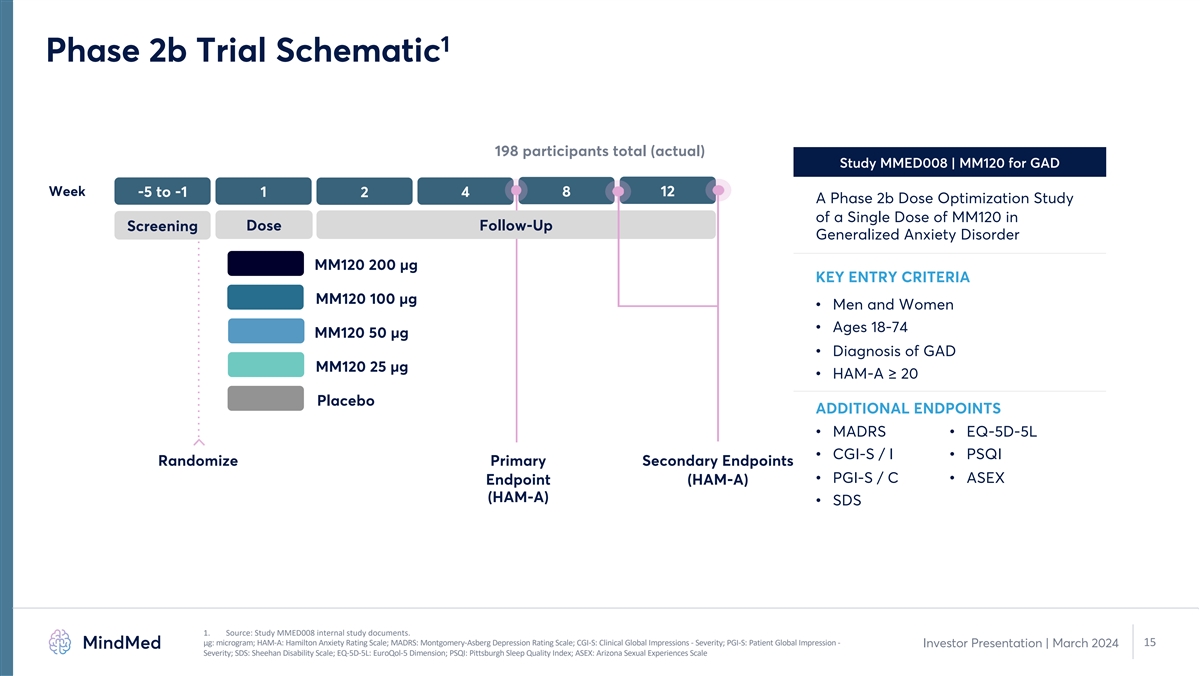
1 2b 期试验示意图共有 198 名参与者(实际)研究 MMED008 | MM120 用于 GAD 周 -5 至 -1 1 4 8 12 2 A 2b 期剂量优化研究在剂量随访筛查中单剂 MM120 的剂量优化研究 MM120 200 µg 关键进入标准 MM120 100 µg • 男性和女性 • 年龄 18-74 MM120 50 µg • GAD MM120 25 µg 的诊断 • HAM-A ≥ 20 安慰剂额外安慰剂终端 • MADRS • EQ-5D-5L • CGI-S/I • PSQI 随机分配主要次要终点 • PGI-S/C • ASEX 终点 (HAMA) (HAM-A) (HAM-A) • SDS 1。来源:MMED008 研究内部研究文件。μg:微克;HAM-A:汉密尔顿焦虑评级量表;MADRS:蒙哥马利-阿斯伯格抑郁评级量表;CGI-S:临床全球印象- 严重程度;PGI-S:患者全球印象——15 投资者报告 | 2024 年 3 月严重程度;SDS:希恩残疾量表;EQ-5D-5L:EuroQol-5 维度;PSQI:匹兹堡睡眠质量指数;ASEX:亚利桑那州性行为指数体验规模

2b 期治疗模式:独立药物效应,第 1 种心理治疗干预措施 • 房间内给药监视器 (DSM) 不提供心理治疗干预 2 • 交付方案与 2023 年 FDA 指南草案一致 • 治疗后治疗期间 2 期和第 3 阶段预治疗之间未计划更改药物递送 ü 全面的知情同意程序 ü DSM的持续监测 ü 随访仅用于评估的患者 ü 资格评估 ü 音乐、眼睛 shades、reading,在 MMED008 ü 中写作《旅程》当出院标准满足时得出结论 x 没有 “准备” x 没有 “辅助治疗” x 没有 “整合” 不是 x 预治疗活动中的患者旅程 包括 x 没有心理治疗,也没有治疗 x 没有持续的治疗参与,因为临床试验活动中研究药物部分之外的 MMED008 全面知情同意程序干预 1.来源:MMED008 研究内部研究 文件。16 投资者演示文稿 | 2024 年 3 月 2.FDA 2023 年指南草案:迷幻药物:临床研究注意事项。
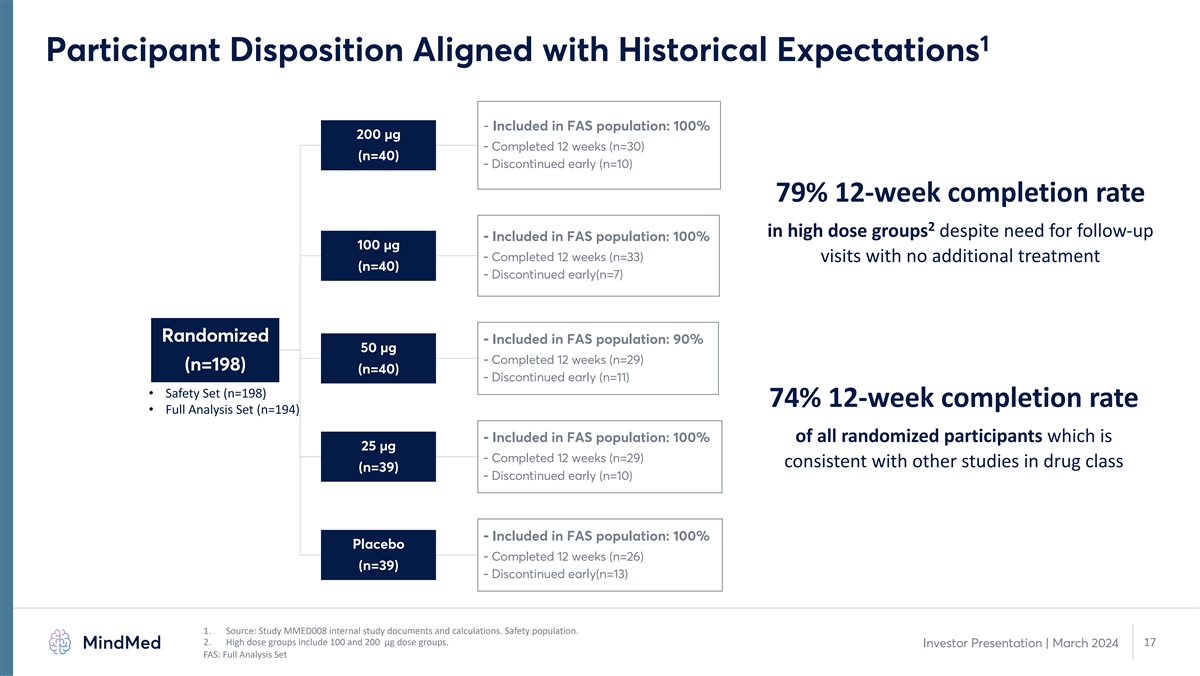
1 受试者倾向符合历史预期- 包括在 FAS 人群中:100% 200 µg-已完成 12 周 (n=30) (n=40)-尽管需要随访,但高剂量组 12 周完成率为 79% 2-包括在 FAS 人群中:100% 100 µg-已完成 12 周 (n=33) 次就诊,无需额外治疗 (n=40)-提前停诊 (n=7)) 随机化-包含在 FAS 人群中:90% 50 µg-已完成 12 周 (n=29) (n=198) (n=40)-提前停产 (n=11) • 安全套装 (n=198) 74% 12 周 完成率 • 已满分析集(n = 194)-包含在 FAS 人群中:100% 的随机参与者,即 25 µg-完成了 12 周(n = 29),与其他药物类别的研究(n=39)一致-提前停止(n = 10)- 包含在 FAS 人群中:100% 安慰剂-完成 12 周(n = 26)(n = 39)-提前停止(n = 13)1。来源:研究 MMED008 内部研究文件和计算。安全人群。2.高剂量组包括 100 和 200 µg 剂量 组。17 投资者演示文稿 | 2024 年 3 月 FAS:完整分析集
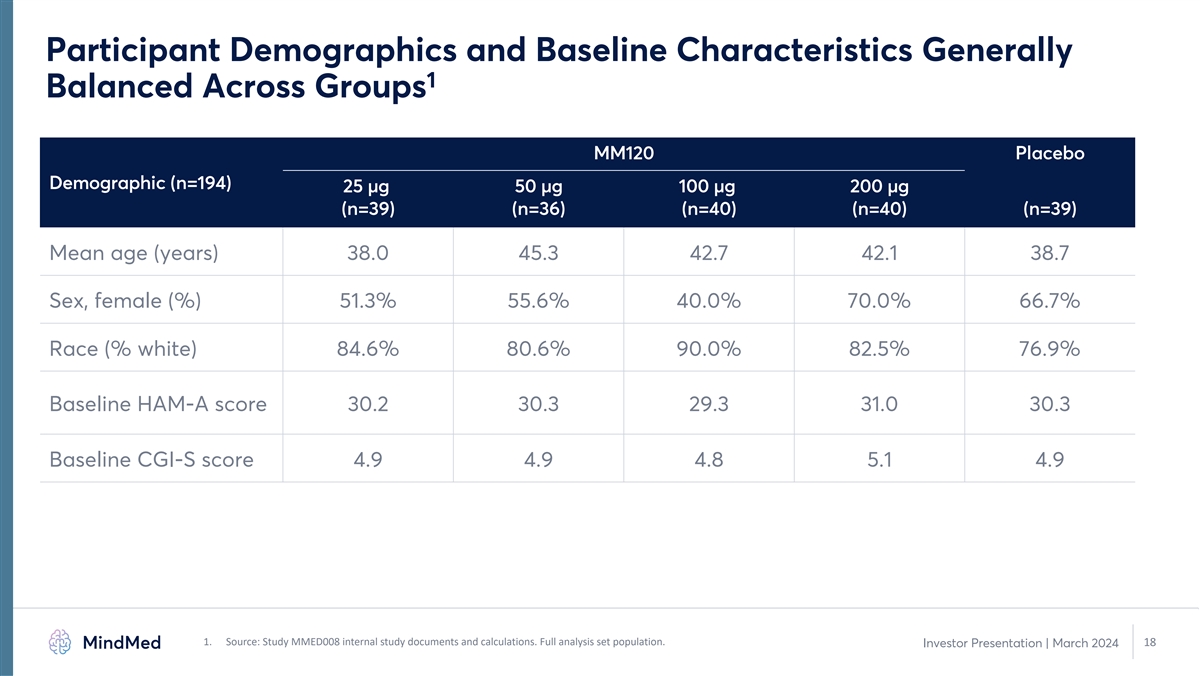
参与者人口统计学和基线特征通常 1 各组均衡 MM120 安慰剂人口统计 (n=194) 25 µg 50 µg 100 µg 200 µg (n=39) (n=36) (n=40) (n=40) (n=39) (n=39) 平均年龄 (岁) 38.0 45.3 42.7 38.7 性别、女性 (%) 51.3% 40.0% 70.0% 66.7% 种族(% 白人)84.6% 80.6% 90.0% 82.5% 76.9% 基线 HAM-A 分数 30.2 30.3 29.3 31.0 30.3 31.0 30.3 30.3 基线 CGI-S 分数 4.9 4.9 4.9 4.9 4.9 1。来源:研究 MMED008 内部研究文件和计算。完整分析集合人群。18 投资者演示文稿 | 2024 年 3 月
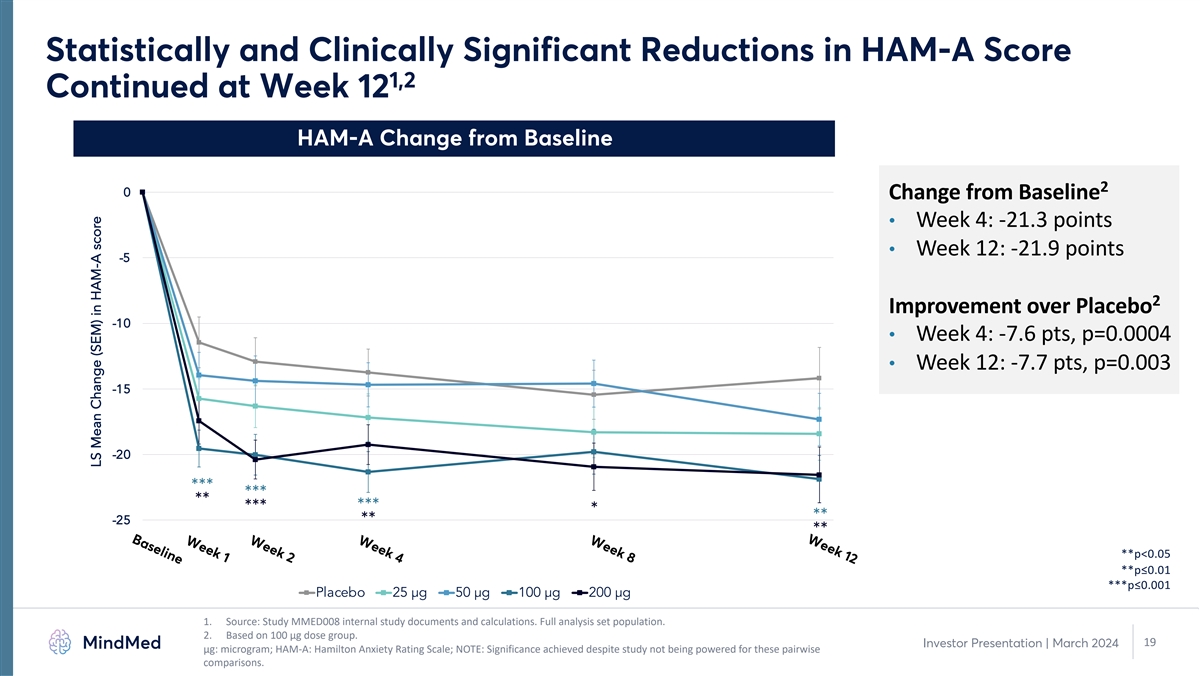
第 12 周第 8 周第 4 周第 2 周基线统计学和 HAM-A 分数 1,2 的临床显著下降第 12 周 HAM-A 与基线 2 的变化 0 与基线的变化 • 第 4 周:-21.3 分 • 第 12 周:-21.9 分 -5 2 比安慰剂改善 -10 • 第 4 周:-7.6 分, p=0.0004 • 第 12 周:-7.7 点,p=0.003 -15 -20 *** *** *** *** -25 ** **** **p

在第 12 周持续反应和缓解,临床缓解率为 65% 1,临床缓解率为 48% 2 2 HAM-A 第 12 周的缓解率 HAM-A 缓解率 12 周 50 48 70 65 45 63 60 56 40 33 50 30 28 40 21 31 20 30 20 10 10 0 0 安慰剂 25 µg 50 µg 100 µg 200 µg 安慰剂 25 µg 50 µg 100 µg 100 µg 100 µg 100 µg 100 µg 安慰剂 25 µg 50 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg p 值未计算 p 值未计算 p 值未计算 1。来源:研究 MMED008 内部研究文件和计算。完整分析集合群体。2.回应定义为比 HAM-A 分数提高50%或以上;缓解定义为HAM-A分数≤7。20 投资者演示文稿 | 2024 年 3 月 μg:微克;HAM-A:汉密尔顿焦虑评级量表受访者百分比汇款人

主要和关键二次分析 (MCP-Mod) 支持剂量反应 1 GAD 2 中 MM120 的关系 MCP-Mod 分析的关键要点 • 具有统计意义的剂量反应关系,多模型拟合的剂量反应关系具有统计学意义 • 支持 GAD 后续研究 100 µg 的剂量选择 • 预先指定的模型估计值和观察到的反应驱动 3 期研究剂量 1 的剂量选择。来源:研究 MMED008 内部研究文件和计算。完整分析集合群体。2.来源:诺华。“MCP-Mod 方法 — 剂量反应的统计方法。21 投资者演示文稿 | 2024 年 3 月 `模型意味着

全球临床印象快速持续改善 — 1 严重程度 (CGI-S) 从第 2 天开始持续到第 12 周 2 CGI-S 第 12 周 100 µg 组 CGI-S 分数有所改善 6 — 重病 • 到第 2 天统计学和临床均有显著改善 5 — 明显病情持续至第 12 周 4 — 中度疾病 • 截至第 12 周 CGI-S 评分改善超过 2 个单位 **** 3 — 轻度疾病 *** • 参与者平均只有 2 人 — 第 12 周处于临界病情的临界病情到轻度疾病 1 — 正常,基准第 2 天根本没有生病第 4 周第 12 周安慰剂 100 µg *p

第 12 周第 8 周第 4 周第 2 周基线统计学和 截至第 12 周的所有时间点合并抑郁症 1,2 (MADRS) 的临床显著下降 3 MADRS 与基线的变化 0 2,3 与基线的变化 • 第 4 周:-18.1 点 • 第 12 周:-18.7 点 -5 2,3 与安慰剂 -10 相比改善 • 第 4 周:-5.7 分,p
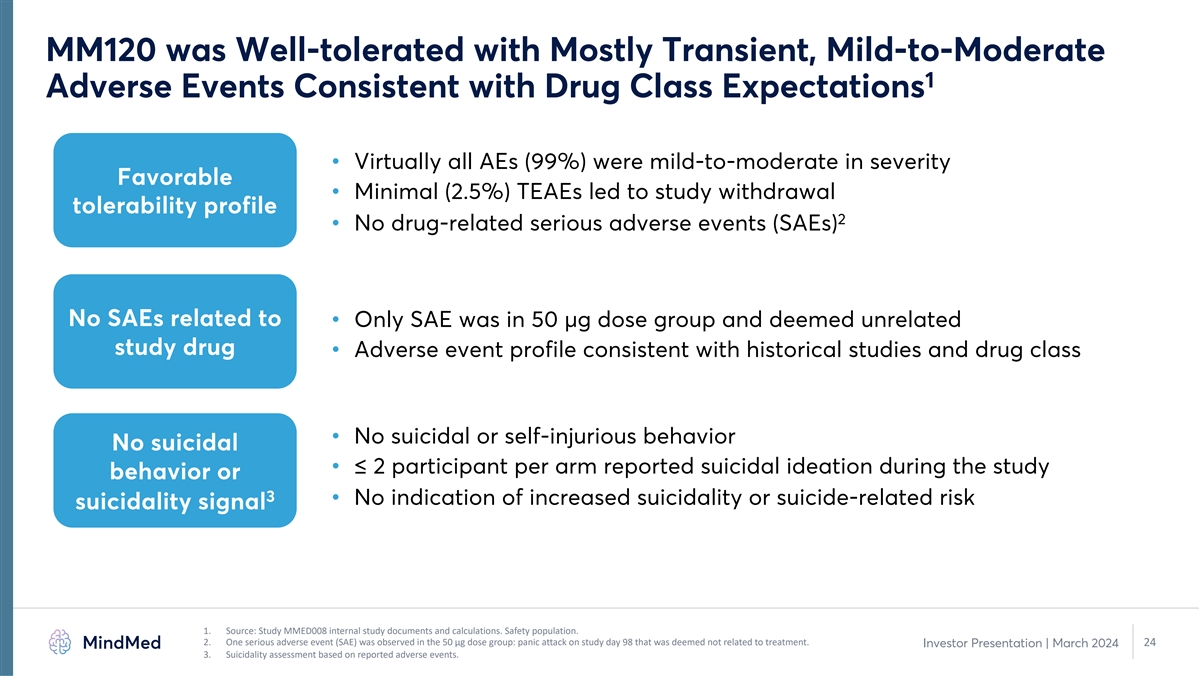
MM120 耐受性良好,多为短暂性、轻度至中度 1 种不良事件,符合药物类别预期 • 几乎所有 AE (99%) 的严重程度均为轻度至中度良好 • 极低 (2.5%) TEAE 导致了研究戒断耐受性概况 2 • 无药物相关严重不良事件 (SAE) 无关 • 只有 SAE 属于 50 µg 剂量组,被视为无关研究药物 • 不良事件概况与历史研究一致和药物类别 • 无自杀或自残行为无自杀行为 • 每组 ≤ 2 名受试者报告研究期间有自杀意念或 3 •没有自杀率增加的迹象或与自杀相关的风险自杀信号 1.来源:研究 MMED008 内部研究文件和 计算。安全人群。2.在50微克剂量组中观察到一种严重的不良事件(SAE):研究日第98天的惊恐发作,被认为与治疗无关。24 投资者演讲 | 2024年3月 3.根据报告的不良事件进行自杀性评估 。
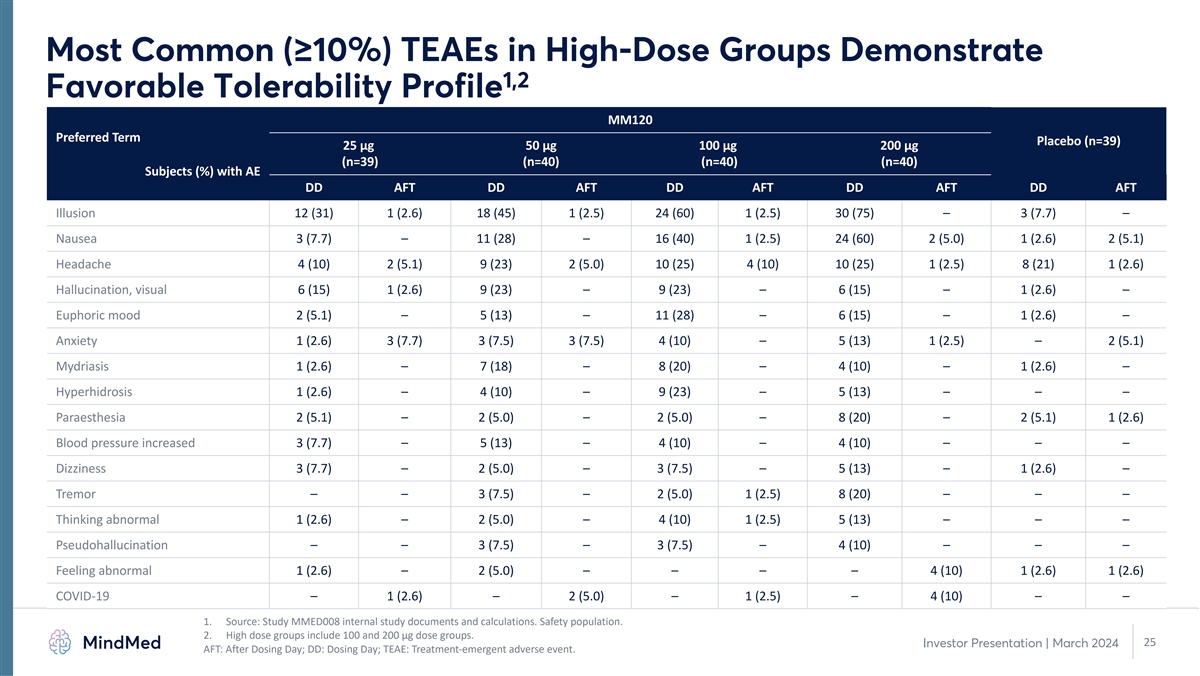
高剂量组中最常见 (≥ 10%) TEAE 表现出 1,2 良好的耐受性 MM120 首选术语安慰剂 (n=39) 25 µg 50 µg 100 µg 200 µg (n=39) (n=40) (n=40) (n=40) (%) AFT DD AFT DD AFT DD AFT DD AFT Illusion 12 (31) 1 (2.6) 18 (45) 1 (2.5) 24 (60) 1 (2.5) 30 (75) — 3 (7.7) — 恶心 3 (7.7) — 11 (28) — 16 (40) 1 (2.5) 24 (60) 2 (5.0) 1 (2.6) 2 (5.1) 头痛 4 (10) 2 (5.1) 9 (23) 2 (5.0) 10 (25) 1 (2.5) 8 (21) 1 (2.6) 幻觉,视觉 6 (15) 1 (2.6) 9 (23) — 9 (23) — 6 (15) — 1 (2.6) — 欣快情绪 2 (5.1)— 5 (13) — 11 (28) — 6 (15) — 1 (2.6) — 焦虑 1 (2.6) 3 (7.7) 3 (7.5) 3 (7.5) 4 (10) — 5 (13) 1 (2.5) — 2 (5.1) — 2 (5.1) — 2 (5.1) — 7 (18) — 8 (20) — 4 (10) — 1 (2.6) — 4 (10) — 9 (23) — 5 (13) — — — 麻醉 2 (5.1) — 2 (5.0) — 2 (5.0) — 8 (20) — 2 (5.1) 1 (2.6) 血压升高 3 (7.7) — 5 (13) — 4 (10) — 4 (10) — — 4 (10) — — — 头晕 3 (7.7) — 2 (5.0) — 3 (7.5) — 3 (7.5) — 5 (13) — 1 (2.6) — 震颤 — — 3 (7.5) — 2 (5.0) 1 (2.5) 8 (20) — — 思维异常 1 (2.6) — 2 (5.0) — 4 (10) 1 (2.5) 5 (13) — — — 假幻觉 — — 3 (7.5)— 3 (7.5) — 4 (10) — — — 感觉异常 1 (2.6) — 2 (5.0) — — — 4 (10) 1 (2.6) 1 (2.6) COVID-19 — 1 (2.6) — 2 (5.0) — 1 (2.5) — 1 (2.5) — 4 (10) — — 1.来源:研究 MMED008 内部研究文件和计算。安全 人口。2.高剂量组包括 100 和 200 微克剂量组。25 投资者演示文稿 | 2024 年 3 月 AFT:给药后;DD:给药日;TEAE:治疗紧急不良事件。

MM120 LSD-D-酒石酸盐治疗广泛性焦虑症 (GAD) MM120 ODT PK 桥接研究 Daniel R Karlin,医学博士,马萨诸塞州首席医学官

PK 桥接研究表明,MM120 ODTs 的产品特性得到增强 1 对比 PK Profile 2.5 MM120 胶囊的差异化性能 MM120 ODT MM120 ODT 2 2 起作用的速度加快 50% 1.5 3 17% 生物利用度提高 1 4 0.5 23%。AUC 0 5 0 2 4 6 8 10 12 14 16 18 20 22 24 减少胃肠道副作用时间(小时)1.公司对来自 MM120-101 研究的药代动力学数据的分析。2.基于达到大于 1 ng/mL 的目标浓度的时间。3.基于曲线下总面积的几何平均比率的比较。 投资者演示文稿 | 2024 年 3 月 27 日 4.基于平均AUC的比率。目标浓度定义为高于该水平会出现感知效应。>1ng/mL 5。基于 GAD 中 MM120 胶囊的 2b 期研究与 MM120 ODT 的 PK 桥接研究的比较 AUC:曲线下方区域;胃肠道;ODT:口服溶解片剂;PK:药代动力学 MM120 浓度 (ng/mL)

1 MM120 ODT PK 桥接研究示意性研究 MM120-101 | ODT-PK 共有 29 名参与者(实际)一项第一阶段的开放标签研究,旨在比较第 -21 天与 -1 1 2-13 14 15-29 两种冲洗剂量 MM120 配方 2 后续筛查剂量 1 健康志愿者 MM120 MM120 入标准 Zydis ODT Zydis ODT • 男性和女性 (100 µg) (100 µg) • 年龄 18-55 岁 • 健康志愿者 • 无违禁药物 MM120 MM120 胶囊胶囊(100 µg)(100 µg)(100 µg)注册人数 1。基于 MM120-101 研究投资者演示文稿的内部研究 文件 | ODT 2024 年 3 月 28 日:口服溶解片剂

MM120 ODT 与胶囊的对比 PK 显示 MM120 ODTs 2.5 MM120 胶囊 MM120 ODT 的 1 个特征 ODT MM120 MM120 1 2 PK 参数胶囊 ODT 1.5 T (hr) 2.25 2.0 max C (ng/mL) 2.63 2.68 最大 1 AUC (ng*hr/mL) 15.7 18.7 0-Ÿ 0.5 AUC (ng*HR/mL) 9.7 12.0 >1ng/mL 0 2 4 6 8 10 12 14 16 18 20 22 24 时间 (小时)1.公司对来自 MM120-101 研究的药代动力学数据的分析。PK 分析基于完成两次给药的 n=24 名受试者。投资者演示文稿 | 2024 年 3 月 29 日 AUC:曲线下方区域;C:最大达到浓度; ODT:口服溶解片剂;PK:药代动力学;T:达到最大浓度的时间 MM120 最大浓度 (ng/mL)

MM120 ODT 表现出更快的吸收速度和更短的达到 目标浓度的时间 1.2 MM120 胶囊 1 MM120 ODT MM120 ODT 1 2 的差异化 PK 分布图 0.8 0.6 3 17% 生物利用度提高 0.4 4 0.2 23% AUC 高于目标浓度 0.4 4 0.2 23%。AUC 0 0 10 20 30 时间(分钟)1. 公司对来自 MM120-101 研究的药代动力学数据的分析。PK 分析基于完成两次给药的 n=24 名受试者。2.基于达到大于 1 ng/mL 的目标浓度的时间。3.基于曲线下方 总面积的几何平均比率的比较。投资者演示文稿 | 2024 年 3 月 30 日 4.基于平均AUC的比率。目标浓度定义为高于该水平会产生感知效应。>1ng/mL AUC:曲线下方区域;ODT:口服溶解片剂; PK:药代动力学 MM120 浓度 (ng/mL)
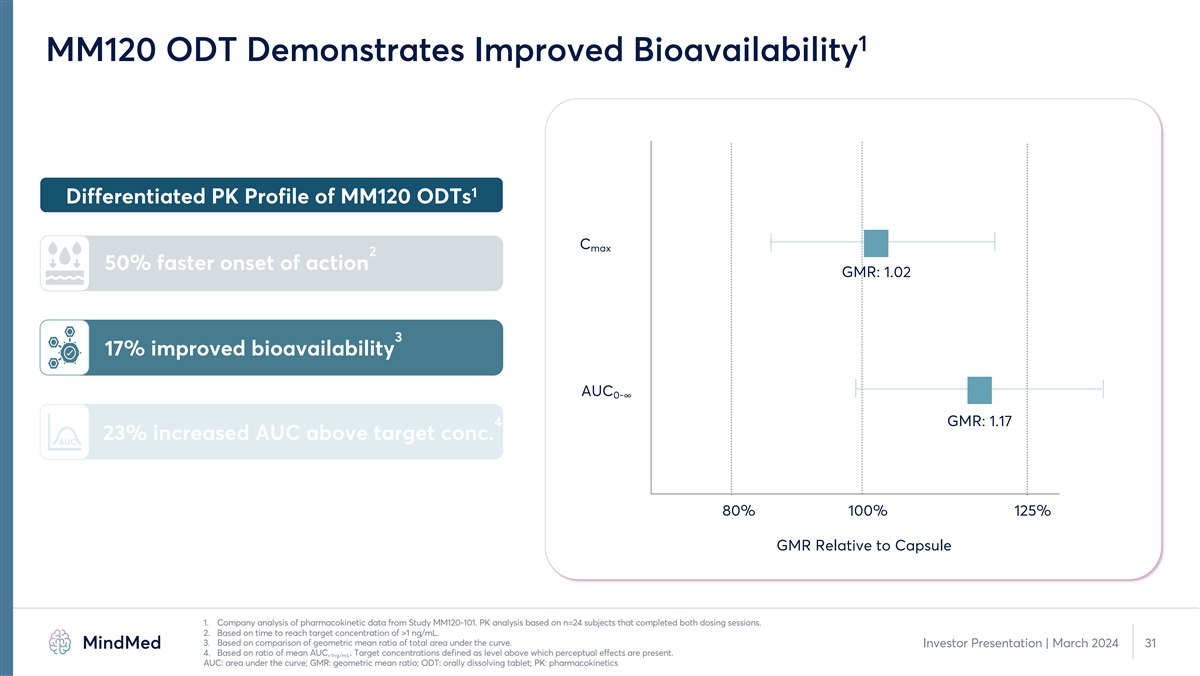
1 MM120 ODT 显示生物利用度得到提高 1 MM120 ODTs 的差异化 PK 概况 C 最大 2 起效快 50% GMR:1.02 3 生物利用度提高 17% AUC 0-Ÿ 4 GMR:AUC 比目标浓度增加 1.17 23%。AUC 80% 100% 125% GMR 相对于胶囊 1。公司对来自 MM120-101 研究的药代动力学数据的分析 。PK 分析基于完成两次给药的 n=24 名受试者。2.基于达到大于 1 ng/mL 的目标浓度的时间。3.基于曲线下总面积的几何平均比率的比较。投资者 演示文稿 | 2024 年 3 月 31 日 4.基于平均AUC的比率。目标浓度定义为高于该水平会产生感知效应。>1ng/mL AUC:曲线下方区域;GMR:几何平均比率;ODT:口服溶解片剂;PK: 药代动力学
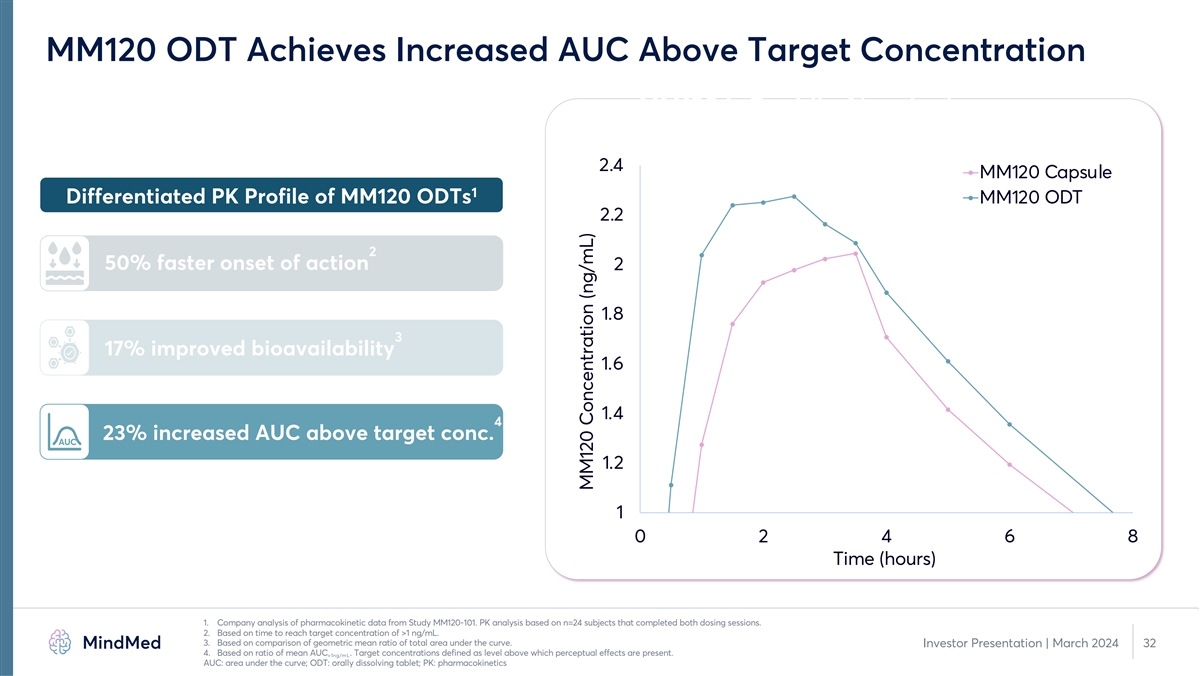
MM120 ODT 实现了高于目标浓度的AUC 增加 MM120 是 快速吸收的 2.4 MM120 胶囊 1 的差异化 MM120 ODT 2.2 2 的作用开始速度加快 50% 2 1.8 3 17% 生物利用度提高 1.6 1.4 4 23% AUC 高于目标浓度。MM120AUC 1.2 1 0 2 4 6 8 时间(小时)1.公司 分析来自 MM120-101 研究的药代动力学数据。PK 分析基于完成两次给药的 n=24 名受试者。2.基于达到大于 1 ng/mL 的目标浓度的时间。3.基于曲线下总 面积的几何平均比率的比较。投资者演示文稿 | 2024 年 3 月 32 4.基于平均AUC的比率。目标浓度定义为高于该水平会产生感知效应。>1ng/mL AUC:曲线下方区域;ODT:口服溶解片剂;PK: 药代动力学 MM120 浓度 (ng/mL)

MM120 发展计划摘要评论罗伯特·巴罗首席执行官 执行官

多项研究支持 MM120 1 的第 3 阶段开发 • 实现了 2 期开发的目标 o 为GAD中的剂量选择提供信息的特征剂量反应 o GAD 中具有统计学意义且具有临床意义的效果 o 在没有心理治疗干预的情况下对经过验证的终点 o 独立药物效果具有快速和持久的治疗益处 • 多项支持 MM120 o 2b 期随机、安慰剂对照试验活性的双盲、安慰剂对照研究在 GAD(研究 MMED008)o 一个前现代的 中,焦虑症中麦草吉的随机、安慰剂对照IIT o 超过二十多项关于麦角苷治疗焦虑症和其他神经质疾病的传统研究 • 2b 期数据支持剂量选择和进入第 3 阶段开发 1。来源:研究 MMED008 内部研究文件和计算。34 投资者演示文稿 | 2024 年 3 月

MM120 开发途径 1 • 两项三期关键临床试验 计划进行为期 12 周的随机、安慰剂对照的主要疗效研究设计 o 开放标签延期,以确定再治疗参数 o 预计将于 2024 年下半年启动 3 期开发 • 第 4 周汉密尔顿焦虑量表 (HAM-A) 的 2b 期和 3 期研究的关键设计要素预计将保持一致 预期主要终点 o 关键纳入/排除标准的变化有限 o 未计划更改剂量会话监控协议 1。第 3 阶段和 后续临床研究设计尚待监管机构讨论和审查,包括可能的第 2 阶段结束会议。35 投资者演讲 | 2024 年 3 月
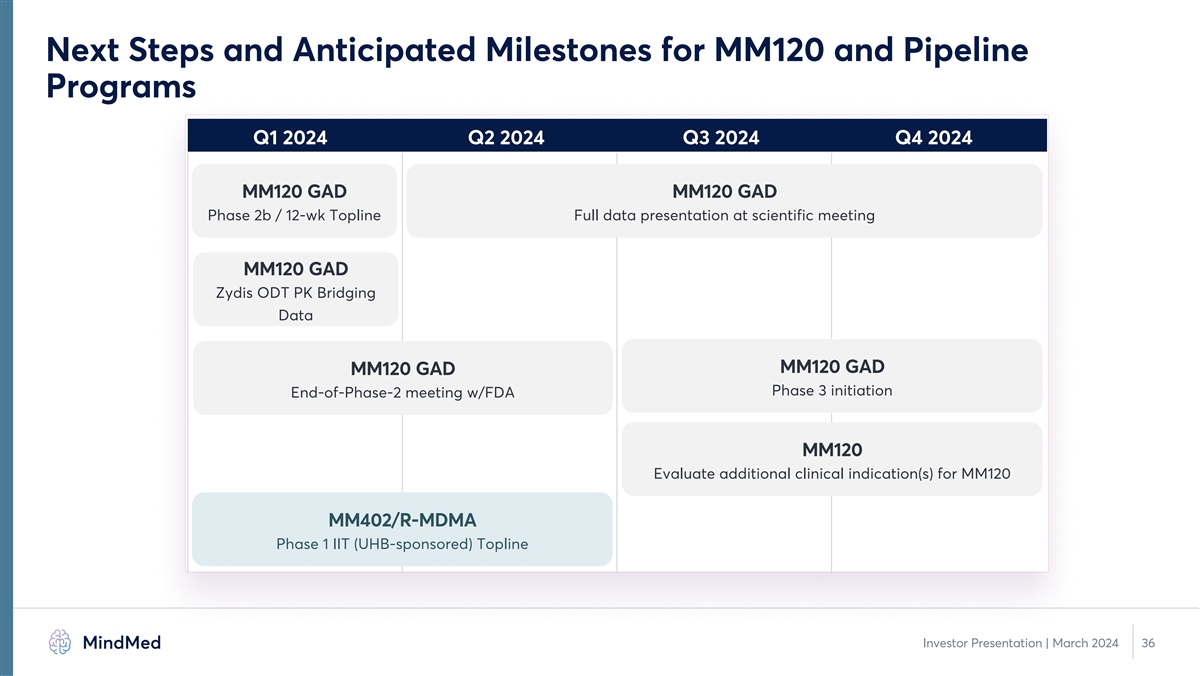
MM120 和管道项目的下一步措施和预期里程碑 2024 年第一季度第二季度 2024 年第四季度 MM120 GAD MM120 GAD 第 2b 期/12 周科研会议上的完整数据介绍 MM120 GAD Zydis ODT PK 桥接数据 MM120 GAD MM120 GAD 第 3 阶段启动会议与 FDA MM120 评估 UHB 赞助)Topline 投资者演示文稿 | 2024 年 3 月 36 日 MM120

问答 37 投资者演示文稿 | 2024 年 3 月

附录
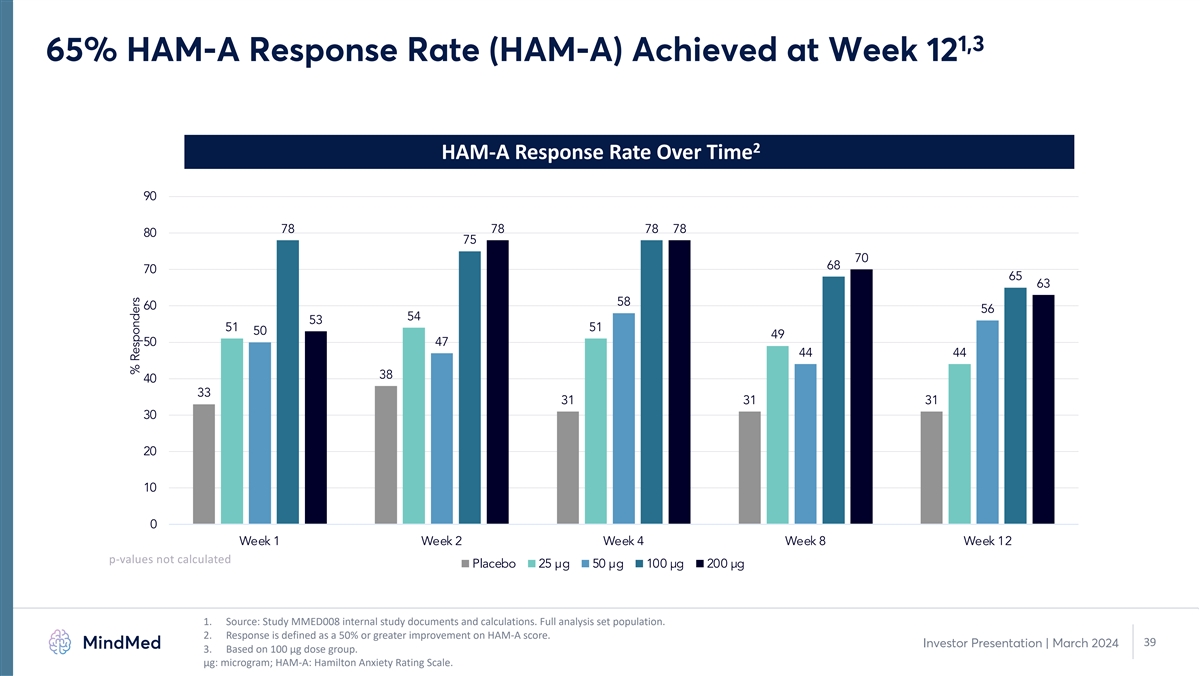
1,3 65% HAM-A 回复率 (HAM-A) 在第 12 周达到 HAM-A 一段时间内的回复率 90 78 78 78 80 75 70 68 70 68 65 63 58 60 54 53 51 50 49 50 47 44 44 38 31 31 31 30 20 10 0 第 1 周第 4 周 12 p 值未计算安慰剂 25 µg 50 µg 100 µg 200 µg 1。 来源:研究 MMED008 内部研究文件和计算。完整分析集合群体。2.回应的定义是HAM-A分数提高50%或以上。39 投资者演示文稿 | 2024年3月 3.基于 100 µg 剂量组。μg: 微克;HAM-A:汉密尔顿焦虑评级量表。受访者百分比

1,3 48% 的缓解率 (HAM-A) 在第 12 周达到 HAM-A 一段时间内的缓解率 60 50 50 48 45 45 45 45 45 43 40 38 33 33 33 33 33 33 33 33 33 33 28 26 25 21 21 21 20 18 15 10 0 第 1 周第 4 周第 8 周 p 值未计算安慰剂 25 µg 50 µg 100 µg 200 µg 1。来源: Study MMED008 内部研究文件和计算。完整分析集合群体。2.缓解定义为HAM-A分数≤7。40 投资者演示文稿 | 2024年3月 3.基于 100 µg 剂量组。μg:微克;HAM-A: 汉密尔顿焦虑评级量表。% 汇款者
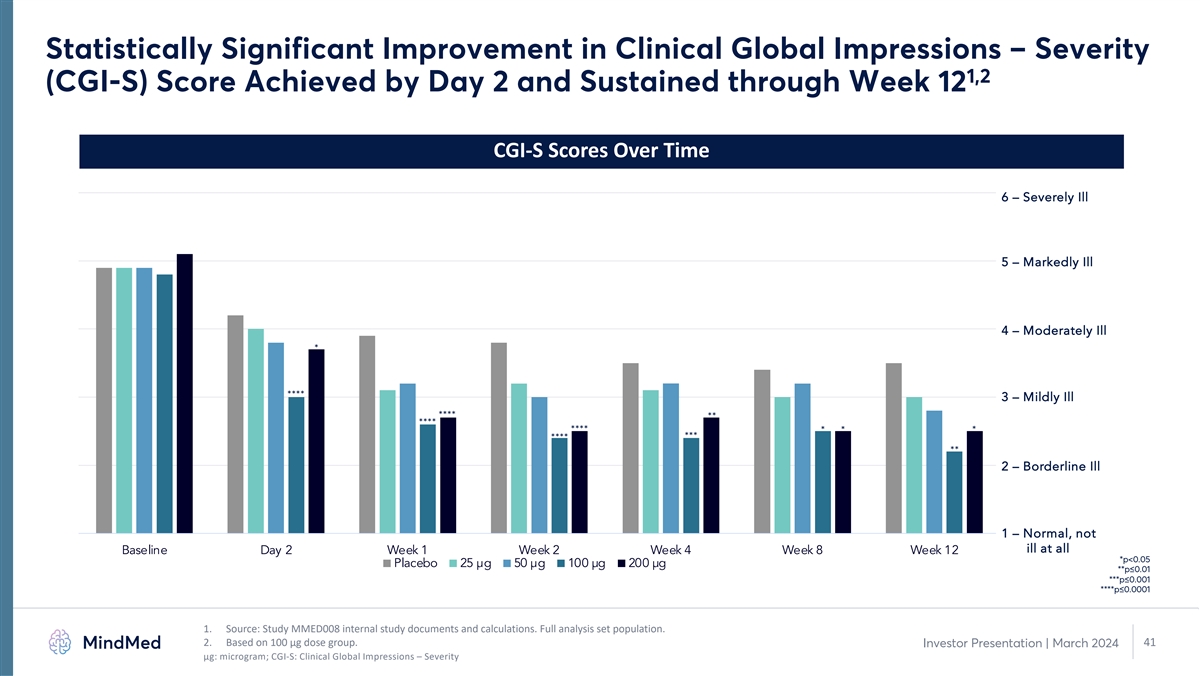
临床全球印象有统计学上的显著改善 — 第 2 天达到严重程度 1,2 (CGI-S) 分数并持续到第 12 周 CGI-S 分数 6 — 重病 5 — 明显疾病 4 — 中度疾病 * **** 3 — 轻度疾病 **** **** * *** ** 2 — 临界疾病 1 — 正常,基准第 2 周第 2 周第 4 周第 8 周 12 周*** p
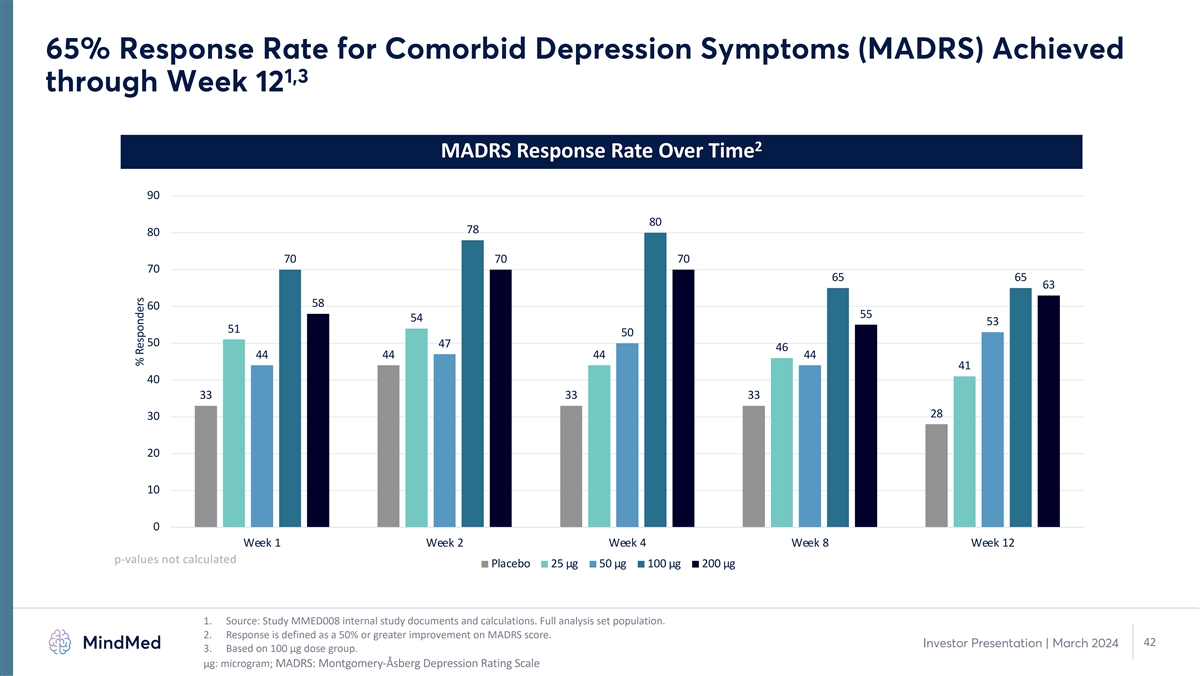
65% 的合并抑郁症状缓解率(MADRS)在第 12 周达到了 1,3 2 随时间推移的 MADRS 缓解率 90 80 70 70 70 70 70 65 65 63 58 60 54 53 53 50 47 46 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44来源:研究 MMED008 内部研究文件和计算。完整分析集合群体。2.回应定义为MADRS分数提高50%或以上。42 投资者演示文稿 | 2024年3月 3.基于 100 µg 剂量组。μg:微克;MADRS:蒙哥马利-阿斯伯格抑郁评级量表受访者百分比
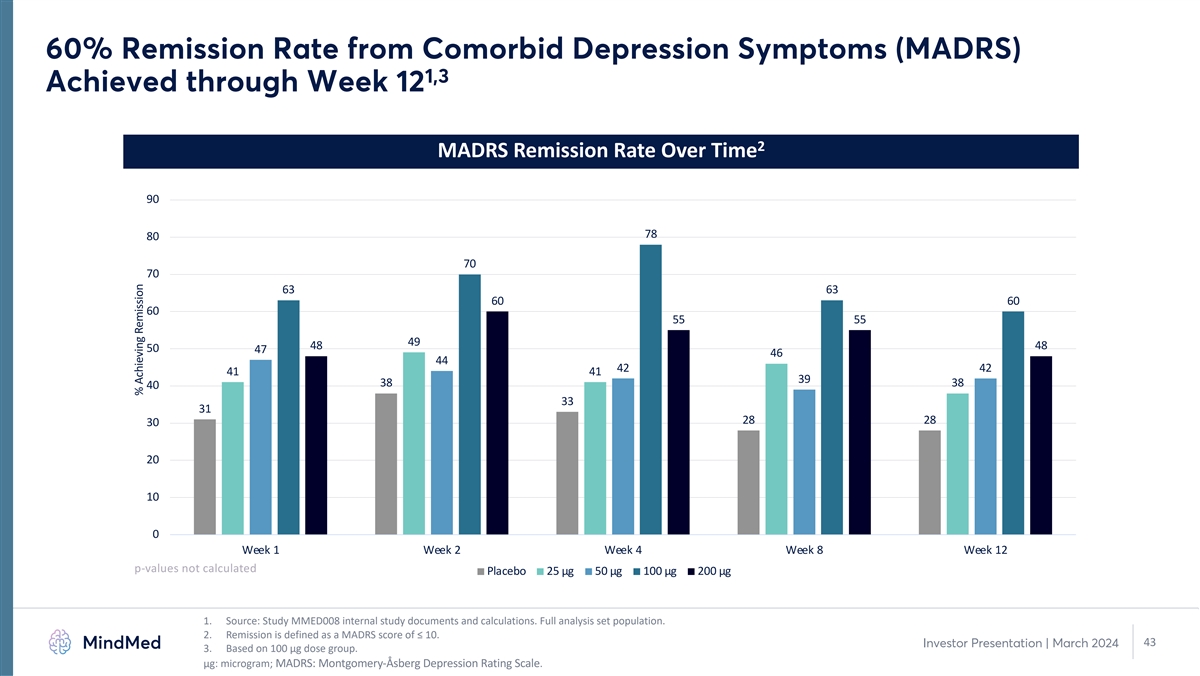
合并抑郁症状(MADRS)的缓解率为60% 1,3 在第 12 周达到 2 随时间推移的 MADRS 缓解率 90 78 80 70 70 63 63 60 60 55 55 49 48 50 47 46 44 42 41 41 38 38 40 33 31 28 28 30 20 10 0 第 1 周第 4 周 12 p 值未计算安慰剂 25 µg 50 µg 100 µg 200 µg 1。来源:研究 MMED008 内部研究文件和计算。完整分析集合群体。2.缓解是指MADRS分数≤10。43 投资者演示文稿 | 2024年3月 3.基于 100 µg 剂量组。μg:微克;MADRS:蒙哥马利-阿斯伯格抑郁症评级量表。实现缓解的百分比

1 所有剂量组中最常见 (≥ 10%) 的 TEAE MM120 耐受性良好 ,主要是短暂的、轻度至中度的不良事件 MM120 安慰剂 (n=39) 首选期限 25 µg 50 µg 100 µg 100 µg 200 µg (n=40) (n=40) (n=40) (%) AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD 幻觉 12 (31) 1 (2.6) 18 (45) 1 (2.5) 24 (60) 1 (2.5) 30 (75) — 3 (7.7) — 恶心 3 (7.7) — 11 (28) — 16 (40) 1 (2.5) 24 (60) 2 (5.0) 1 (2.6) 2 (5.1) 头痛 4 (10) 2 (5.1) 9 (23) 2 (5.0) 10 (25) 4 (5) 10) 10 (25) 1 (2.5) 8 (21) 1 (2.6) 幻觉,视觉 6 (15) 1(2.6) 9 (23) — 9 (23) — 6 (15) — 1 (2.6) — 欣快情绪 2 (5.1) — 5 (13) — 11 (28) — 6 (15) — 1 (2.6) — 焦虑 1 (2.6) 3 (7.7) 3 (7.5) 3 (7.5) 4 (10) — 5 (13) 1 (2.5) — 2 (5.1) Mydriasis 1 (2.6) — 2 (5.1) mydriasis 1 (2.6) — 2 (5.1) 2.6 (2.6) — 1 (2.6)) — 7 (18) — 8 (20) — 4 (10) — 1 (2.6) — 多汗症 1 (2.6) — 4 (10) — 9 (23) — 5 (13) — — — 疲劳 2 (5.1) — 6 (15) 2 (5.0) 3 (7.5) 1 (2.5) 3 (7.5) 1 (2.5) — 1 (2.6) — 2 (5.0) — 2 (5.0) — 8 (20) — 2 (5.1) 1 (2.6) 血压升高 3 (7.7) — 5 (13) — 4 (10) — 4 (10) — — — 头晕 3 (7.7) — 2 (5.0) — 3 (7.5) — 5 (13) — 1 (2.6) — 震颤 —— 3 (7.5) — 2 (5.0) 1 (2.5) 8 (20) — — — 思维异常 1 (2.6) — 2 (5.0) — 4 (10) 1 (2.5) 5 (13) — — 1.来源:研究 MMED008 内部研究文件和计算。安全人群。AFT:给药日后;DD:给药日;TEAE:治疗紧急不良事件。44 投资者演讲 | 2024 年 3 月
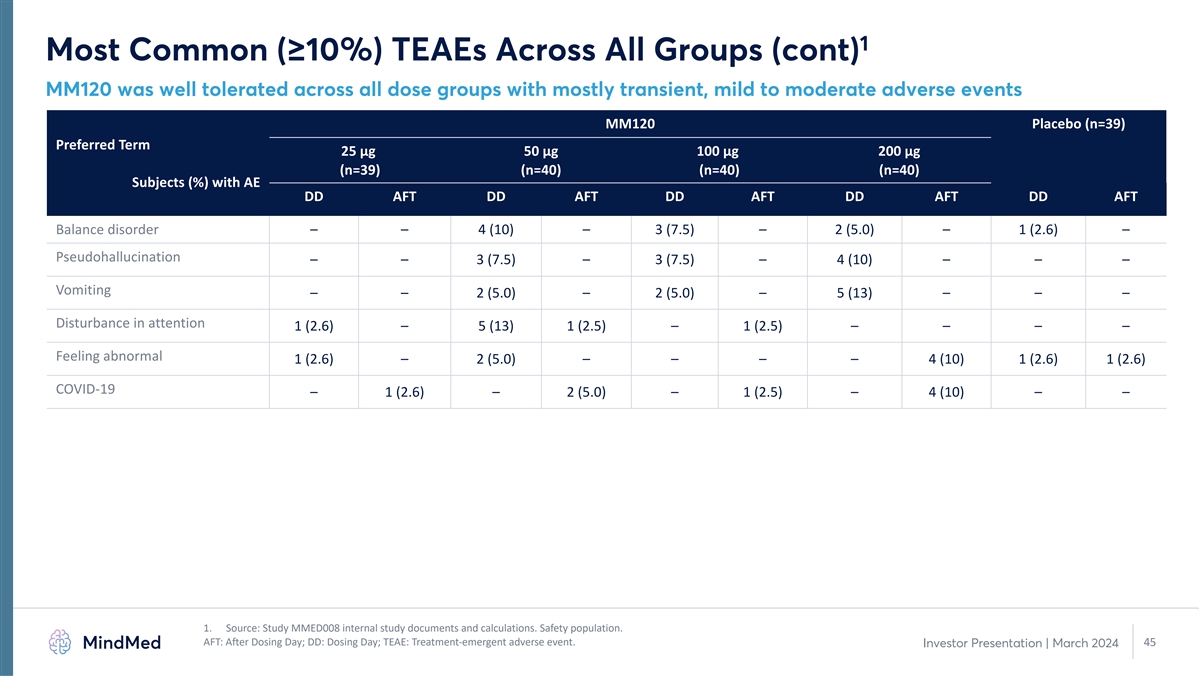
1 所有组中最常见(≥ 10%)TEAE(续)MM120 在所有剂量组中耐受性良好,主要是短暂的、轻度至中度的不良事件 MM120 安慰剂(n=39)首选术语 25 µg 50 µg 100 µg 100 µg 200 µg(n=39)(n=40)(n=40)(n=40)受试者(%)AE DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT 平衡障碍 — — 4 (10) — 3 (7.5) — 2 (5.0) — 1 (2.6) — 假幻觉 — — 3 (7.5) — 4 (10) — — — 呕吐 — — 2 (5.0) — 2 (5.0) — 5 (13) — 5 (13) — 1 (2.5) — 1 (2.5) — 1 (2.5) — — — 感觉异常 1 (2.6) — 2 (5.0) — — — — 4 (10) 1 (2.6) 1 (2.6) COVID-19 — 1 (2.6) — 2 (5.0) — 1 (2.5) — 4 (10) — — 1。来源:研究 MMED008 内部研究文件和计算。安全人群。AFT:给药日之后;DD:给药日;TEAE:治疗紧急不良 事件。45 投资者演讲 | 2024 年 3 月