
2023 年全年财务业绩和业务更新 2024 年 3 月 14 日 EX-99.2

免责声明 2开发下一代程序化T细胞疗法这些幻灯片包含1995年《私人证券诉讼改革法》“安全港” 条款所指的前瞻性陈述。前瞻性陈述是不是历史事实的陈述,在某些情况下,可以用 “可能”、“将”、“可能”、“期望”、“计划”、“预期” 和 “相信” 等术语来识别。这些陈述包括但不限于有关Autolus开发其候选产品的声明,包括obe-cel计划;obe-cel在其他疾病环境中的概况和潜在应用;公司候选产品的未来临床开发、疗效、安全性和治疗潜力,包括进展、对数据报告的预期、行为和时机以及未来的潜在临床和临床前活动和里程碑;对数据启动、设计和报告的预期来自临床试验和临床前研究;将产品线扩展到obe-cel以外的领域;对任何候选产品的监管审批程序的预期;Autolus与BioNTech合作的好处,包括战略合作条款规定的里程碑付款和特许权使用费的可能性和时机;公司当前和未来的制造能力;以及公司预期的现金跑道。任何前瞻性陈述均基于管理层当前的观点和假设,涉及风险和不确定性,可能导致实际业绩、业绩或事件与此类陈述中表达或暗示的结果存在重大差异。这些风险和不确定性包括但不限于Autolus的临床前或临床项目无法及时或根本无法推进或导致批准产品的风险;早期临床试验的结果并不总是可以预测未来的结果;临床试验的成本、时间和结果;许多候选产品无法及时或具有成本效益的基础上或根本没有成为批准的药物;招收患者参与临床试验的能力;以及可能的安全性和有效性问题。有关其他风险和不确定性以及其他重要因素的讨论,其中任何一个都可能导致Autolus的实际业绩与前瞻性陈述中包含的有所不同,请参阅Autolus于2023年3月7日向美国证券交易委员会(SEC)提交的20-F表年度报告以及Autolus于2023年11月9日向美国证券交易委员会提交的10-Q表季度报告中标题为 “风险因素” 的章节作为对Autolus中潜在风险、不确定性和其他重要因素的讨论随后向美国证券交易委员会提交的文件。本演示文稿中的所有信息均截至演示之日,除非法律要求,否则Autolus没有义务公开更新任何前瞻性陈述,无论是由于新信息、未来事件还是其他原因。因此,您不应依赖这些前瞻性陈述来代表本演示之日后任何日期的公司观点。
议程 • 欢迎和简介:投资者关系董事奥利维亚·曼瑟 • 运营亮点:首席执行官克里斯蒂安·伊廷博士 • 财务业绩:首席财务官罗布·多尔斯基 • 即将到来的里程碑和结论:首席执行官克里斯蒂安·伊廷博士 • 问答:克里斯蒂安·伊廷博士和罗伯·多尔斯基 3开发下一代程序化T细胞疗法

战略最新进展开发下一代程序化T细胞疗法 4 强劲的现金状况:2023年底现金为2.4亿美元,2024年2月活动总收益为6亿美元 • 2024年2月完成了承保的注册直接股权融资,总收益为3.5亿美元 • 同时与BioNTech建立了战略合作,旨在推进两家公司的自体CAR T项目——2亿美元股权,5000万美元预付现金——再增加高达5.82亿美元期权行使和里程碑付款 — BioNTech 支持 obe 的推出和扩展-cel 成人 ALL 按净销售额收取特许权使用费 — BioNTech 可以选择使用 Autolus 的 BNT211 制造能力 — BioNTech 为 Autolus 的 AUTO1/22 和 AUTO6NG 计划提供联合商业化选项,还有 Autolus 靶向粘合剂和细胞编程技术的期权融资 BioNTech 合作

Obe-cel 在 r/r B-ALL 开发下一代程序化 T 细胞疗法 5 FELIX 数据、监管审查和上市准备工作中重点介绍 • Obe-cel 在复发/难治性 (r/r) 成人 ALL 中——汇总分析于 2023 年 12 月在 ASH 上发表——FELIX 1b/2 期研究——所有队列的无事件存活时间延长,总体免疫毒性低,尤其是淋巴消耗导致白血病负担低的患者 — ALLCAR19 研究和 FELIX 阶段 1b-在中位随访后,将obe-cel作为独立疗法对一部分患者进行持久缓解>3 年 • 稳健的制造工艺和最先进的商业制造——于 2024 年 2 月完成了首次设施检查——斯蒂夫尼奇的 Nucleus 制造工厂已获得制造商进口授权 (MIA) 和随附的 GMP 证书 — 在 ASH 上展示了 obe-cel 制造业绩的海报 • 美国食品药品监督管理局 (FDA) 接受生物制剂许可申请 (BLA) — PDUFA 目标行动日期为 2024 年 11 月 16 日 • 营销最近向 EMA 提交的授权申请 (MAA)• 商业能力和基础设施准备工作步入正轨 — 商业系统建设步入正轨 — 专注于临床中心入职和医疗事务临床制造监管商业准备情况

其他研发项目亮点开发下一代程序化 T 细胞疗法 6 扩大机会 • Obe-cel 在 B 细胞介导的自身免疫性疾病中 — 1 期 CARLYSLE 研究 — 难治性系统性红斑狼疮患者 1 期剂量确认研究 — 首个试验地点于 2024 年第一季度开放入组 — 基于 FELIX 针对多发性骨髓瘤成人 ALL 8 的关键性试验 — 1 期 MCARTY 研究 OBE-CEL 的数据,潜在的最佳风险/收益概况多发性骨髓瘤中的自身免疫性疾病 AUTO8 AUTO6NG • AUTO8 — 1 期 MCARTY 研究 — 多项初步数据2023 年 12 月在 ASH 上发表的骨髓瘤表明 AUTO8 耐受性良好,所有患者均观察到反应 • 神经母细胞瘤中的 AUTO6NG — 1 期 MAGNETO 研究 — 一项针对复发/难发性神经母细胞瘤患儿的 1 期临床研究已于 2023 年第四季度开放报名

组织变革 • 克里斯·威廉姆斯博士晋升为首席商务官,亚历克斯·德里格斯晋升为高级副总裁、法律事务兼总法律顾问 • 埃德加·布伦德尔博士将辞去首席开发官职务,寻求其他机会。埃德加将继续通过BLA和MAA审查程序为公司提供建议 • 高级副总裁兼obe-cel项目负责人米兰达·内维尔将管理开发团队 • 任命伊丽莎白(Lis)莱德曼博士和罗伯特·阿泽尔比博士开发下一代程序化T细胞疗法,以加强董事会 7
Obe-cel 首席临床项目独立的、可能是同类最佳的 CD19 CAR T 细胞疗法候选药物

我们认为 obe-cel 具有独特的作用机制 • 避免 CAR T 细胞过度激活 • 增加 CAR T 峰值扩张 • 避免 CAR T 细胞耗尽 9 增强细胞毒性和增殖关闭率:Kd [S-1]]1-S 1 - [M aK:e Ra t-在其他 CD19 粘合剂上 obe-cel 粘合剂关闭率:Kd [S-1]O n-Ra te: K a [M -1 S-1 ]与经批准的产品中使用的粘合剂相比,相互作用的半衰期更短 • obe-cel = 9.8 秒 • Kymriah® = 21 分钟% T um 或 C el l L K 在 g Pro ol life ra tio n Ghorashian 等人身上。Nature Medicine 2019 快速脱离速率的CD19粘合剂专为提高活性和降低毒性而设计开发下一代程序化T细胞疗法差异化CD19粘合剂可能提高效力,降低毒性降低毒性降低持久性改善移植改善持久性

Obe-cel 合并分析 ASH 2023 FELIX 1b/2 期试验

FELIX 1b/2 期合并分析:患者倾向于开发下一代程序化 T 细胞疗法 11 127/153 (83%) 入组患者接受了 obe-cel* 已停产 n (%) 26 (17) 死亡 15 (10) 制造相关的 7 (5) 不良事件 2 (1) 医生决定 1 (0.7) 进展性疾病 1 (0.7) *七名患者仅接受 1 剂量;**所有资格标准均符合,白血球菌被接受制造业;obe-cel、obecabtagene autoleucel;Roddie 等人,ASH 2023,数据截止日期:2023 年 9 月 13 日注入 N = 127 (83%) 已注册** N = 153 个队列A n = 107 (84%) 筛查时有 ≥ 5% BM 爆发 ≥ 5% 队列 B n = 13 (10%) MRD 阳性队列 C n = 7 (6%) 筛查时分离的 EMD 形态学疾病*** (n = 98) • 74% 的患者有 CR/CRI (n = 73) • 95% 的受访者为 MRD 阴性‡ 无形态学疾病(n = 29)• 100% 的患者有 CR/CRI(n = 73)• 100% 的患者有 CR/CRI(n = 73)• 95% 的受访者是 MRD 阴性‡ 无形态学疾病(n = 29)• 100% 的可评估患者是 MRD 阴性§ ***形态学疾病定义为无论骨髓爆炸状态如何 ≥ 5% 的 BM 细胞或存在 EMD;经 NGS 或流式细胞仪评估,64/73 名患者可获得 MRD 状态;§27/29 名患者可获得 MRD 状态,由NGS 或流式细胞术;BM,骨髓;CR,完全缓解;血液学恢复不完全的 CRi、CR;EMD,髓外疾病;MRD,可测量的残留疾病;NGS,下一代测序;obe-cel,obecabtagene autoleucel
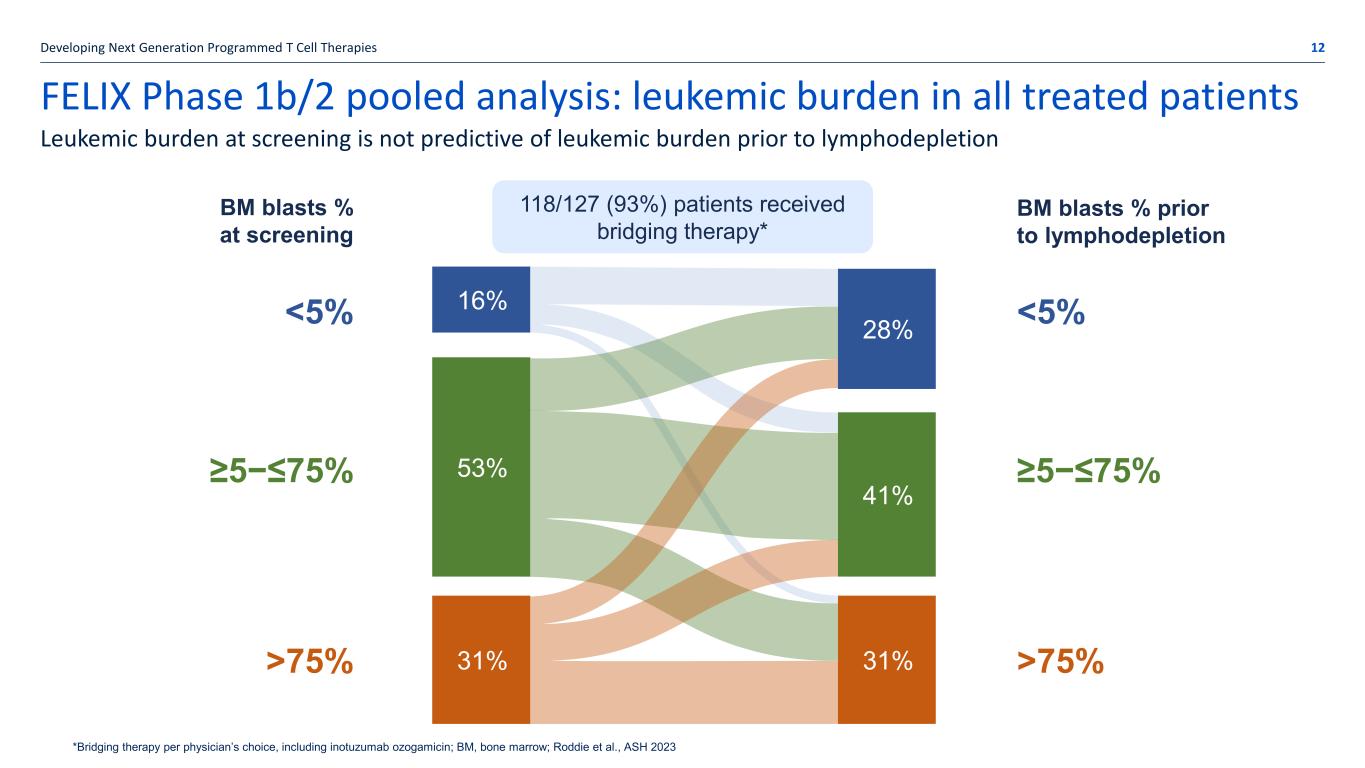
FELIX 1b/2 期合并分析:所有接受治疗的患者的白血病负担开发下一代程序化 T 细胞疗法 12 筛查时的白血病负担无法预测淋巴消耗前的白血病负担 *每个医生选择的桥接疗法,包括伊诺妥珠单抗奥佐加霉素;BM,骨髓;Roddie 等人,ASH 2023 16% 28% 53% 31% 31% 筛查时的 31% BM blasts% 淋巴消耗前 BM 母细胞百分比 118/127 (93%) 患者接受桥接疗法* 75% 53% 31% 31% 31% 75% 28% 41% 16%

FELIX pH1b/2 汇总:按淋巴消耗前的白血病负担计算的EFS*开发下一代程序化T细胞疗法 13 降低白血病负担与更好的疗效相关 BM 母细胞百分比淋巴消耗前 75%(n = 40)中位数(95% 置信区间),NE 15.0(6.6,NE)4.5(1.5,9.0)6个月EFS(95% CI),% 83(65,92)72(57、82) 40 (23、56) 12 个月 EFS(95% 置信区间),% 65(44、80)55(38、69)27(12、44)事件,n:75% 27 中位数(95% 置信区间):75% 4.5(1.5、9.0)风险患者 75%(n = 40)75%(n = 40)0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 17 18 20 2122 23 24 25 26 27 28 29 30 31 32 33 34 35 36 36 34 31 28 25 24 22 20 19 18 14 13 11 11 11 11 11 11 11 8 8 7 6 2 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 41 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 18 17 13 10 10 10 10 9 5 5 5 4 4 2 2 2 2 2 2 2 1 1 1 1 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 10 10 10 9 9 90 Pr ob ab ili ty (%) *审查新的非协议抗癌疗法,包括 SCT 和 IRRC 的疾病评估(数据截止日期:2023 年 9 月 13 日);BM,骨髓;CI,置信区间;EFS,无事件存活;IRRC,独立应对审查委员会;NE,不可评估;SCT,干细胞移植;Roddie 等人,ASH 2023

FELIX 第 1b/2 阶段合并分析:CRS 和 ICANS 正在开发下一代程序化 T 细胞疗法 14 观察到淋巴消耗时 BM 母细胞百分比为 2% 7% 20 0 40 60 80 100 在 ci de nc e,% CRS ICANS 0% 4% 3% 20 0 40 60 80 100 In ci de nc e,% 7% 0% 6% 15% 20 0 40 60 80 100 In ci de nc e,百分比75%所有患者中的CRS和ICANS按BM爆炸百分比计算ICANS按BM爆炸百分比计算浅色 = ≤2级深色 = 等级 ≥3 69% 23% 47% 69% 88% 8% 18% 43% •
患者未观察到等级 ≥3 CRS和/或ICANS

Obe-cel 合并分析 ASH 2023 ALLCAR19 第 1b 阶段 /FELIX Ph 1b

R/R B-ALL的长期随访显示,开发下一代程序化T细胞疗法的EF和操作系统有利 16中位随访36.5个月;合并分析第1b期Allcar19/Phase 1b FELIX *审查了allo-HSCT和其他抗癌治疗。研究者评估的疾病评估是通过对B-ALL的CT和BM活检在局部进行的。allo-HSCT,异基因造血干细胞移植;B-ALL,B 细胞急性淋巴细胞白血病;BM,骨髓;CI,置信区间;CT,计算机断层扫描;EFS,无事件存活;N/A,不可用;obe-cel,obecabtagene autoleucel;OS,总存活率;复发/难治性。罗迪等人,ASH 2023,海报 2114。操作系统中位数:16.4 个月(95% 置信区间:7.1—N/A)36 个月操作系统费率:41%(95% 置信区间:24—56)含审查*:• EFS 中位数:9.0 个月(95% 置信区间:5.1—N/A)• 36 个月 EFS 率:45%(95% 置信区间:27—62)未经审查:• EFS 中位数:9.6 个月(95% 置信区间:5.1—N/A)• 36 个月 EFS 率:36%(95% 置信区间:27—62)(95% 置信区间:21—51)
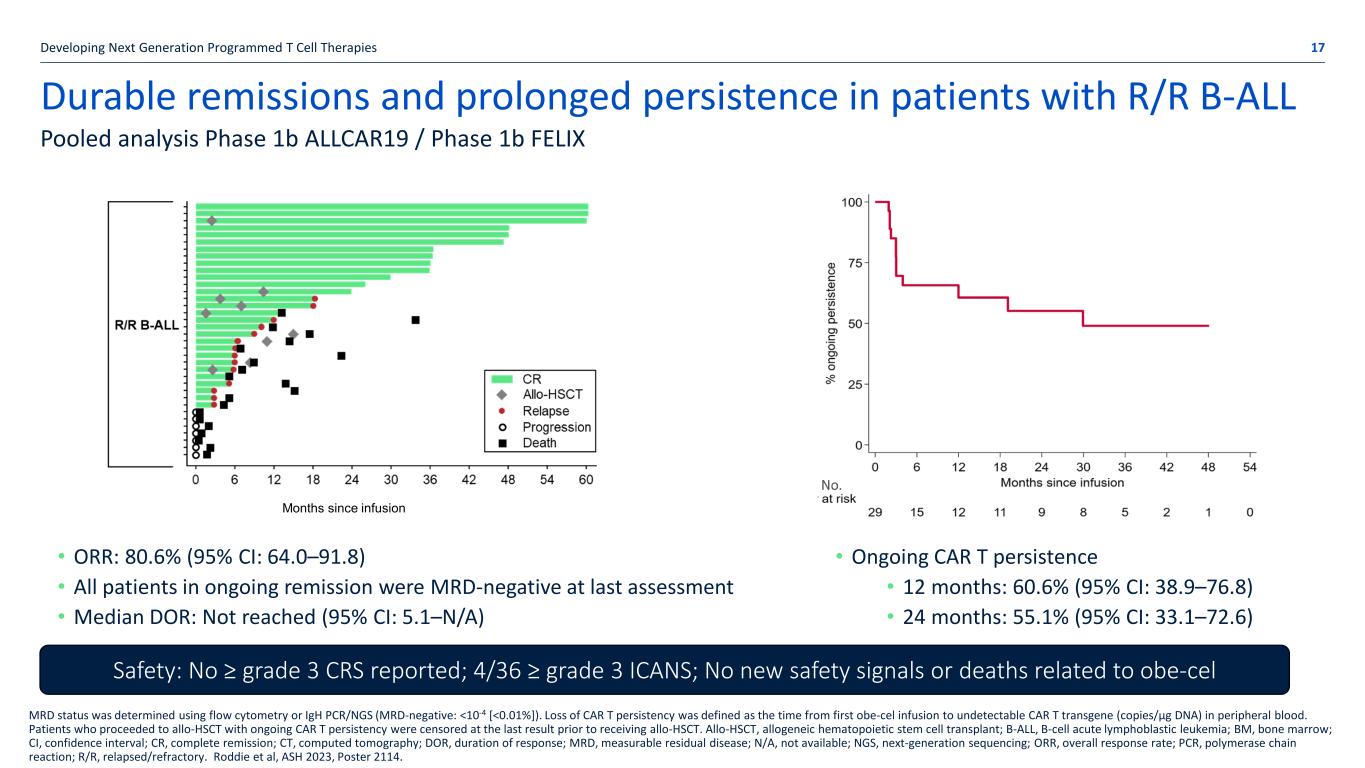
开发下一代程序化 T 细胞疗法的 R/R B-ALL 患者的持久缓解和长期持续耐药性 17 汇总分析 1b 期 ALLCAR19/1b 期 FELIX MRD 状态是使用流式细胞术或 iGH PCR/NGS(MRD 阴性:

商业发布准备情况
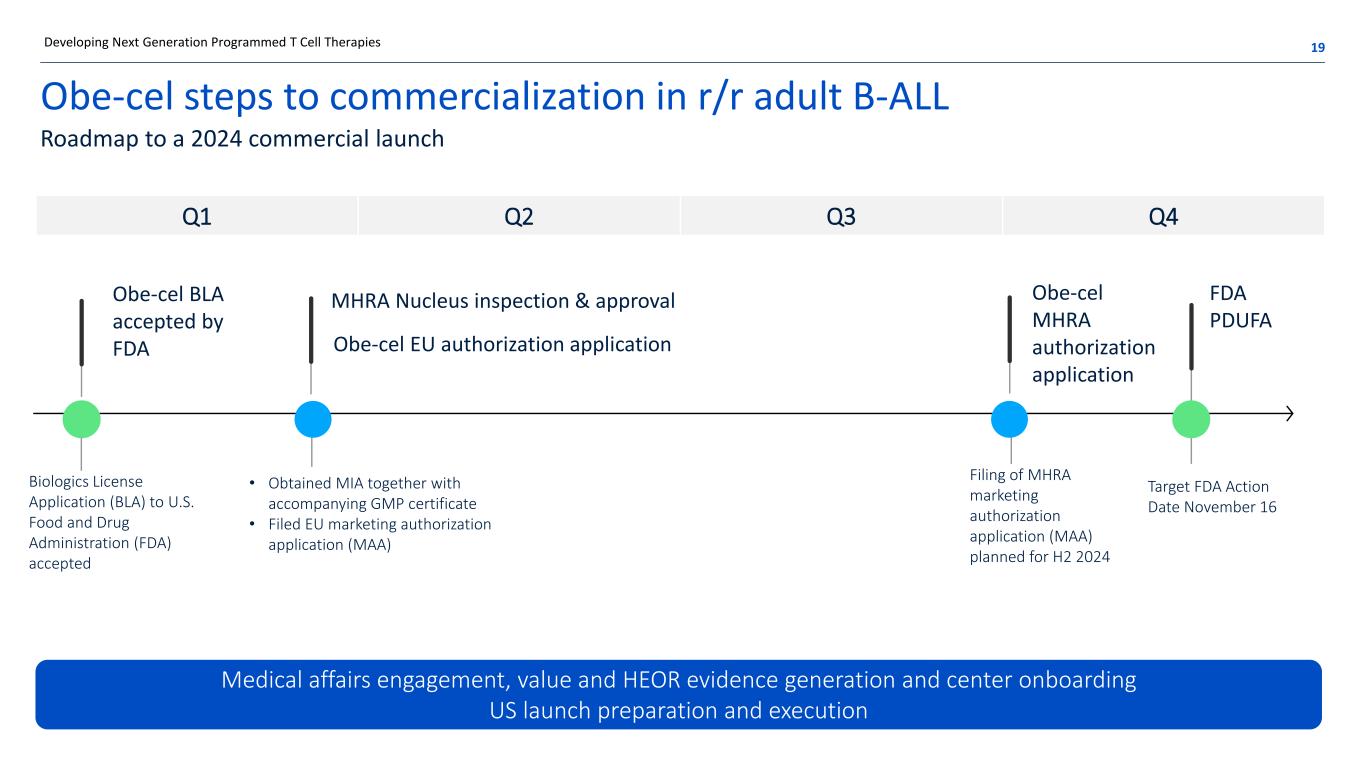
Obe-cel 在 r/r 成人 B-ALL 19 中实现商业化的步骤 2024 年商业上市路线图 Obe-CEL BLA 获得 FDA 接受 Obe-cel 欧盟授权申请 MHRA Nucleus 检验和批准医疗事务参与、价值和 HEOR 证据生成和中心入职美国上市准备和执行开发下一代程序化 T 细胞疗法 FDA PDUFA 行动日期 11 月 16 日美国食品药品监督管理局向美国食品药品监督管理局申请生物制剂许可证 (BLA) (BLA) FDA) 接受了 Obe-CEL MHRA 授权申请 MHRA 上市申请计划于 2024 年下半年提交授权申请 (MAA) • 获得 MIA 以及随附的 GMP 证书 • 第一季度第二季度第三季度第四季度提交了欧盟上市许可申请 (MAA)

扩大具有潜在广泛适用性的obe-cel机会深度价值计划
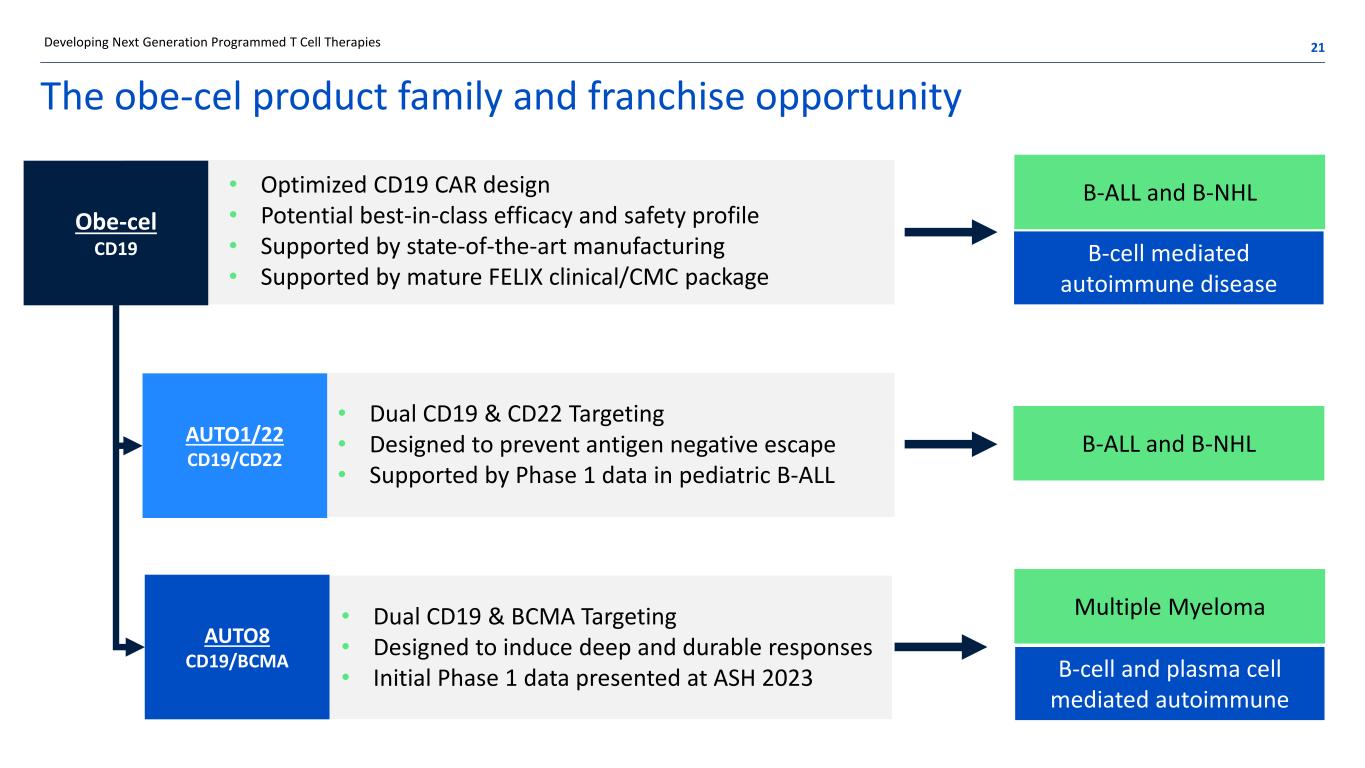
obe-cel 产品系列和特许经营机会 • 优化的 CD19 CAR 设计 • 潜在的一流疗效和安全性 • 由最先进的制造技术支持 • 由成熟的 FELIX 临床/CMC 套餐支持 • 双向 CD19 和 CD22 靶向 • 专为防止抗原阴性逃逸而设计 • 由儿科 B-ALL 的 1 期数据支持 • 双重 CD19 和 BCMA 靶向 • 旨在诱发深度持久反应 • 在 ASH 2023 B-ALL 上公布的初期 1 期数据以及 B-NHL B 细胞介导的自身免疫性疾病 B-ALL 和 B-NHL 多发性骨髓瘤 B 细胞和浆细胞介导的自身免疫开发下一代程序化 T 细胞疗法 21 OBE-CEL CD19 AUTO1/22 CD19/CD22 AUTO8 CD19/BCMA

1期系统性红斑狼疮(SLE)研究——开发下一代程序化T细胞疗法的CARLYSLE试验 22 一项单臂、开放标签的I期研究,旨在确定Obecabtagene Autoleucel对重度、难治性系统性红斑狼疮(SLE)患者的安全性、耐受性和初步疗效 • 研究详情 — 患者数量:6-(可选择再增加6名患者)— 主要终点:确定 obe-cel 对严重难治性系统性红斑狼疮患者的耐受性和安全性 — 次要终点:评估其初步疗效obe-cel 使用系统性红斑狼疮疾病活性测量 — 剂量:50 x 106 (± 20%) CD19 CAR阳性 T 细胞 — 随访:多发性骨髓瘤长达 12 个月 8 — 1 期 MCARTY 研究

其他研发项目和技术广泛的潜在下一代模块化T细胞疗法组合
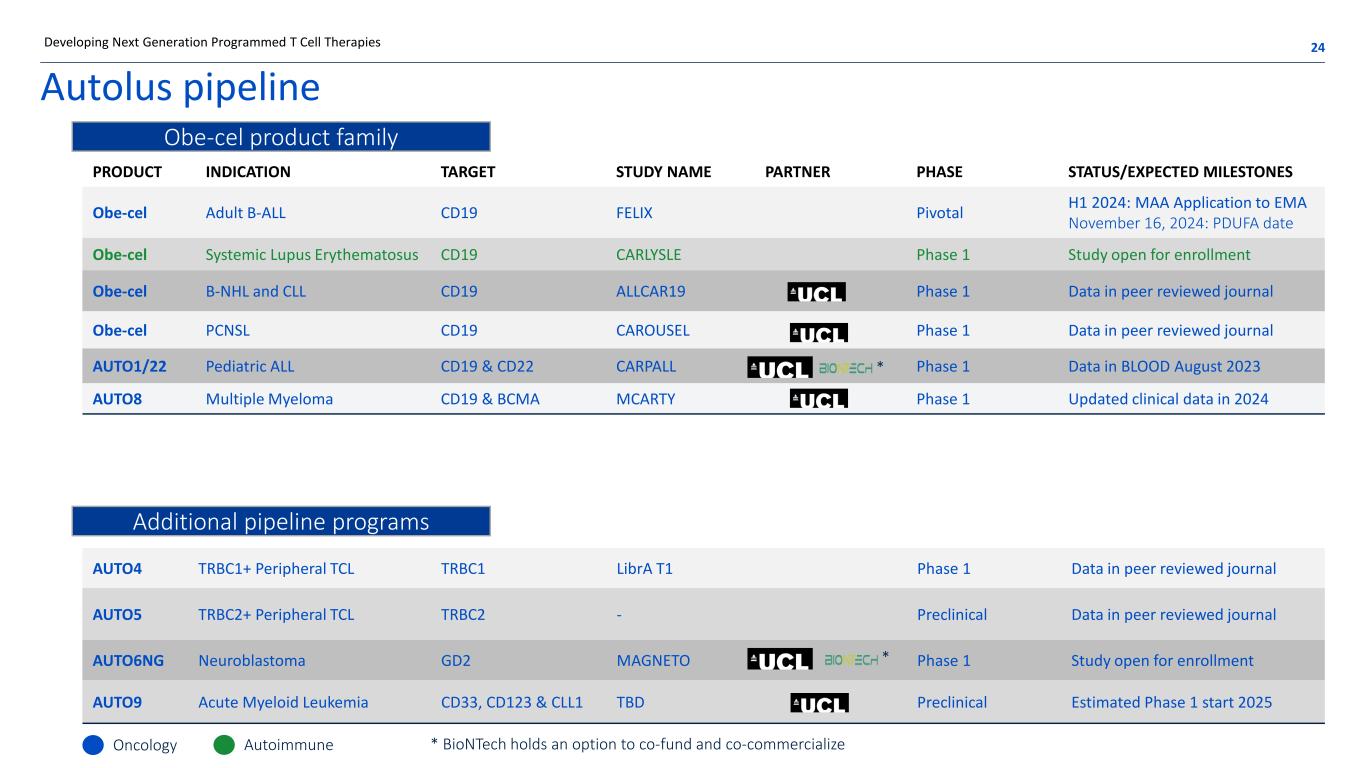
产品适应症目标研究名称合作伙伴阶段状态/预期里程碑 OBE-CEL 成人 B-ALL CD19 FELIX Pivotal H1 2024:MAA 向 EMA 申请 2024 年 11 月 16 日:PDUFA 日期 Obe-cel 系统性红斑狼疮 CD19 CARLYSLE 1 期研究开放入组 OBE-CEL B-NHL 和 CLL CD19 ALLCAR19 1 期数据中的第 1 期数据在同行评审期刊 AUTO1/22 Pediacrial ALL CD19 和 CD22 CARPALL 血液中的 1 期数据 2023 年 8 月 AUTO8 多发性骨髓瘤 CD19 和 BCMA MCARTY 第 1 阶段 2024 年更新的临床数据 Autolus管道 24开发下一代程序化 T 细胞疗法 AUTO4 TRBC1+ 外围 TCL TRBC1 Libra T1 1 期同行评审期刊 AUTO5 TRBC2+ 外围设备 TCL TRBC2-同行评审期刊 AUTO6NG 神经母细胞瘤 GD2 MAGNETO 1 期研究开放报名 AUTO9 急性髓系白血病 CD33、CD123 和 CLL1 待定临床前估计 1 期开始肿瘤学自身免疫 Obe-cel 产品系列其他管道项目 * BioNTech 可以选择共同资助和共同商业化 * *

财务业绩
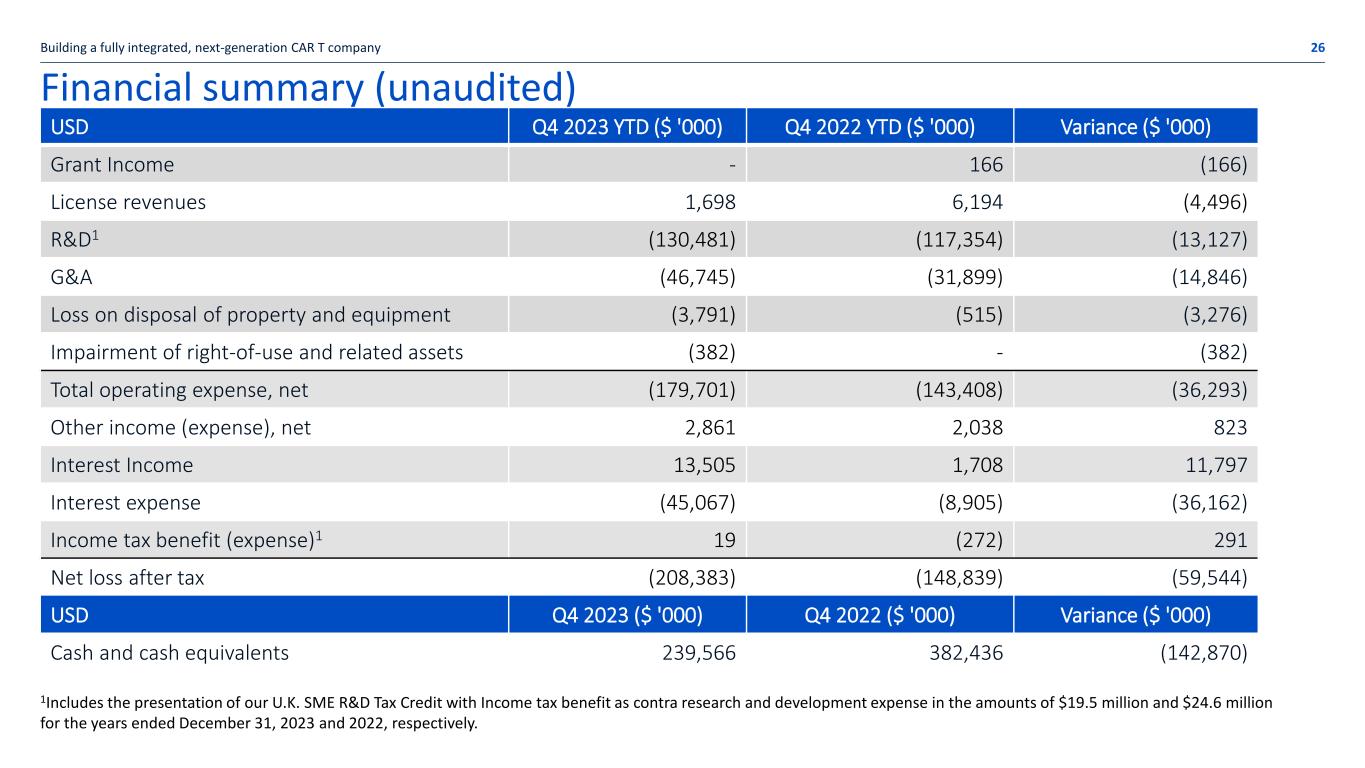
财务摘要(未经审计)2023年第四季度美元年初至今(000美元)2022年第四季度年初至今(000美元)差异(000美元)补助金收入——166(166)许可收入 1,698 6,194(4,496)R&D1(130,481)(117,354)(13,127)G&A(46,745)(31,899)(14,846)处置财产和设备损失 (3,791) (515) (3,276) 使用权及相关资产减值 (382)-(382) 总营业费用,净额 (179,701) (143,408) (36,293) 其他收入(支出),净额 2,861 2,038 823 利息收入 13,505 1,708 11,797 利息支出 (45,067) (8,905) (36,162) 所得税优惠(支出)1 19 (272) 291税后净亏损 (208,383) (148,839) (59,544) 2023年第四季度美元(000美元)2022年第四季度(000美元)差异(000美元)现金及现金等价物 239,566 382,436(142,870)建立一个完全整合的下一代CAR T公司 26 1包括介绍我们的英国中小企业研发税收抵免以所得税优惠作为对照截至2023年12月31日和2022年12月31日止年度的研发费用分别为1,950万美元和2,460万美元。

即将发布的新闻流
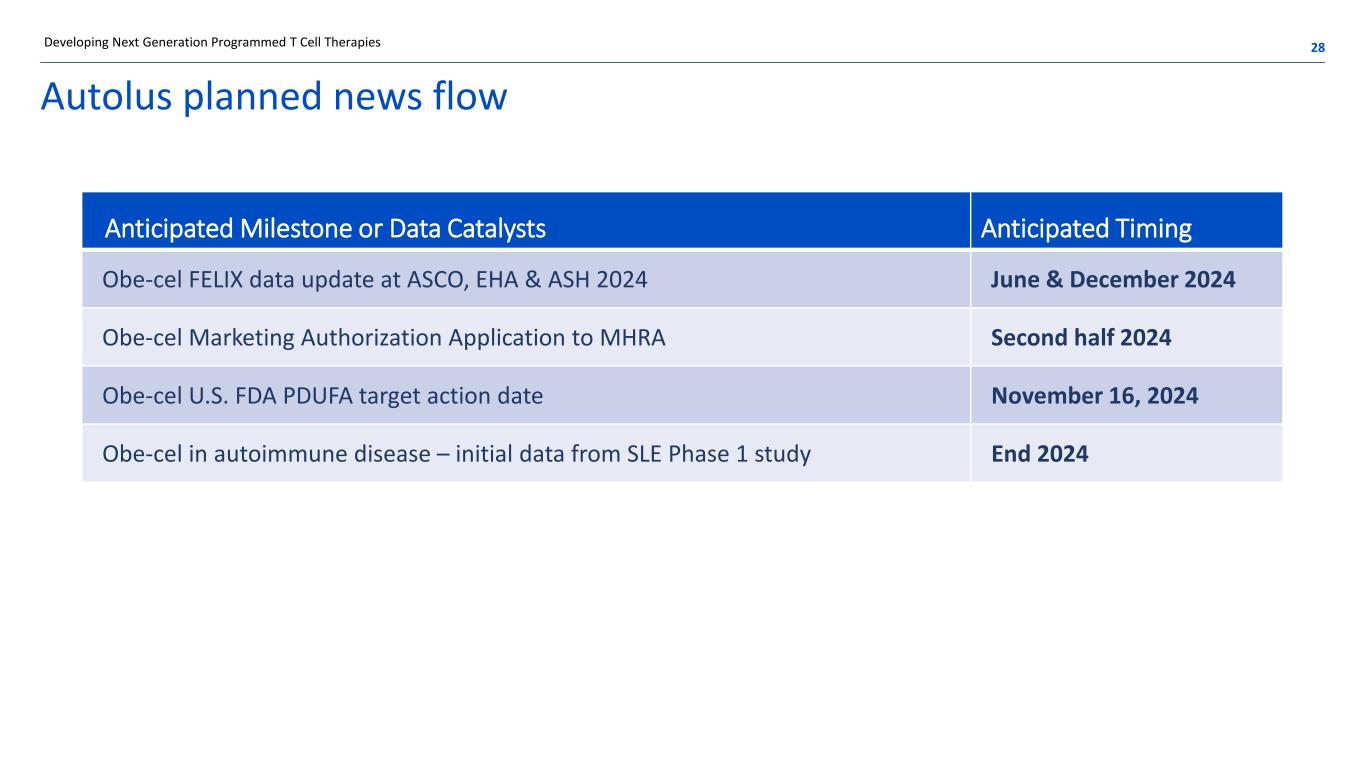
Autolus 计划的新闻流 28开发下一代程序化 T 细胞疗法的预期里程碑或数据催化剂预计时间 2024 年 6 月和 12 月 Obe-cel FELIX 在 ASCO、EHA 和 ASH 2024 年 6 月和 12 月更新 Obe-cel 向 MHRA 申请上市许可 Obe-cel 2024 年下半年 Obe-cel 美国食品药品管理局PDUFA的目标行动日期 2024年11月16日 Obe-Cel 在自身免疫性疾病中的目标行动日期 2024 年 11 月 16 日 Obe-Cel 第 1 期研究的初步数据

摘要

建立一家开发癌症和自身免疫性疾病疗法的领先的 CAR T 公司 30 • FELIX 关键试验显示 ORR 高、令人鼓舞的 EF 和良好的耐受性,而高级 CRS 和 ICANS 水平较低 • PDUFA 日期 2024 年 11 月 16 日 • EMA 文件已提交 • 与 BioNTech 的战略多平台研发合作 • 与 Moderna、BMS 和 Cabaletta 建立了长期的学术合作 • 与伦敦大学学院的长期学术合作 • 扩大 B 细胞 obe-cel 的机会恶性肿瘤、自身免疫性疾病和生命周期策略 — SLE —B-NHL 适应症 — 双特异性疗法(CD19/CD22;CD19/BCMA)• 单独或与合作伙伴一起使用新型 CAR T 疗法扩展到其他适应症 • 显示出可靠的临床试验供应(FELIX 关键研究达到 96% 的目标剂量)• 新的商用细胞制造设施处于资格认证阶段;计划年产能超过 2,000 批次 • OBE-Cel 推出时的预计静脉交付时间约为 16 天 Obe-cel 可能是复发用 CAR T 中同类最佳 r adult ALL 战略合作管道扩张战略可扩展的制造和内部设施 •2.4亿美元现金(2023年第四季度)以及来自融资和BioNTech交易的6亿美元总收益 • 为obe-cel的启动提供全额资金并允许加速自身免疫计划强劲的现金状况扩大公司走向商业化 $ 开发下一代程序化T细胞疗法缩写和注释:r/r ALL-复发/难治性急性淋巴细胞白血病;B-NHL — B细胞非霍奇金淋巴瘤;SLE — 系统性红斑狼疮。

autolus.com 谢谢