附录 99.1
Olema Oncology公布2023年第四季度和全年财务业绩,并提供公司最新情况
旧金山,2024 年 3 月 11 日 — 奥莱马制药公司(“Olema”,“Olema Oncology”,纳斯达克股票代码:OLMA)是一家临床阶段的生物制药公司,专注于女性癌症靶向疗法的发现、开发和商业化,今天公布了截至2023年12月31日的第四季度和全年财务业绩,并提供了公司最新情况。
“2023年,我们展示了palazestrant未来的难得机会,可以对改善ER+/HER2-乳腺癌女性的治疗选择产生有意义的影响。我们认为,palazestrant对野生型和ESR1突变乳腺癌的活性及其安全地与ribociclib联合使用的能力使这种新兴的雌激素受体靶向疗法具有高度差异。” Olema Oncology总裁兼首席执行官肖恩·博恩医学博士说。“我们最近完成了对60名患者的120毫克palazestrant与600毫克ribociclib联合使用的2期研究的入组,我们期待在2024年ESMO乳腺癌年度大会上分享这项研究的最新情况。除了 palazestrant 之外,我们最近还宣布了 KAT6 项目 OP-3136 的候选开发项目,并且我们正朝着在今年年底之前提交IND申请的方向迈进。我们在Olema的使命是改善患有癌症的女性的生活,我们对所取得的进展感到非常满意。”
近期企业要闻
即将举行的里程碑
第四季度和2023年全年财务业绩
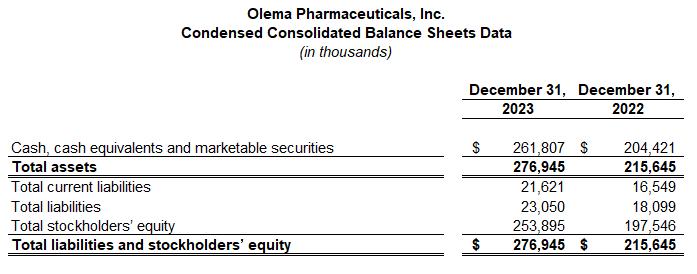
截至2023年12月31日,现金、现金等价物和有价证券为2.618亿美元。
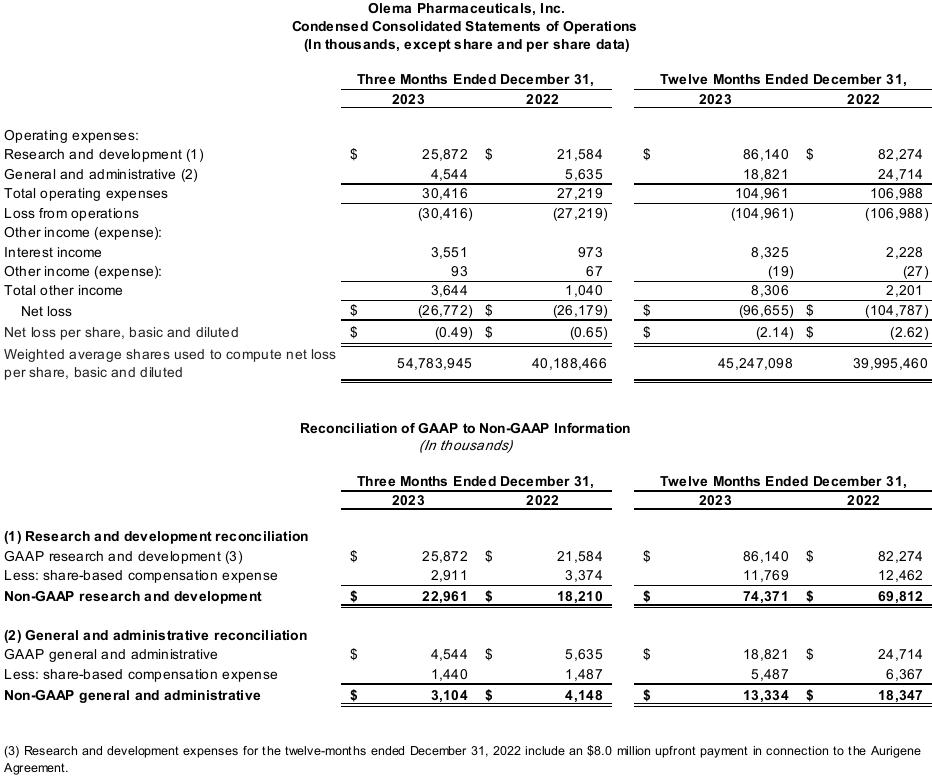
截至2023年12月31日的季度和年度的净亏损分别为2680万美元和9,670万美元,而截至2022年12月31日的季度和年度的净亏损分别为2620万美元和1.048亿美元。随着Olema继续将palazestrant推进到后期临床试验,第四季度净亏损的增加主要与临床运营和开发相关活动的支出增加有关,包括人事相关费用。这一增长被一般和行政活动支出的减少以及有价证券的利息收入增加所抵消。2023年全年净亏损的减少主要是由于有价证券的利息收入增加。
截至2023年12月31日的季度和年度,GAAP研发(R&D)支出分别为2590万美元和8,610万美元,而截至2022年12月31日的季度和年度的GAAP研发(研发)支出分别为2,160万美元和8,230万美元。的增加
研发费用主要是由于随着Olema继续将palazestrant推进到后期临床开发阶段,临床运营和开发相关活动的支出增加,包括人事相关成本,但这被研究相关活动支出的减少所抵消。
截至2023年12月31日的季度和年度的非公认会计准则研发费用分别为2300万美元和7,440万美元,其中分别不包括290万美元和1180万美元的非现金股票薪酬支出。截至2022年12月31日的季度和年度的非公认会计准则研发费用分别为1,820万美元和6,980万美元,其中分别不包括340万美元和1,250万美元的非现金股票薪酬支出。本新闻稿中使用的GAAP与非GAAP财务指标的对账可以在本新闻稿的末尾找到。
截至2023年12月31日的季度和年度,GAAP并购支出分别为450万美元和1,880万美元,而截至2022年12月31日的季度和年度的GAAP并购支出分别为560万美元和2,470万美元。并购费用的减少主要是由于公司和法律相关费用以及人事相关支出减少。
截至2023年12月31日的季度和年度的非公认会计准则并购支出分别为310万美元和1,330万美元,其中分别不包括140万美元和550万美元的非现金股票薪酬支出。截至2022年12月31日的季度和年度,非公认会计准则并购支出为410万美元和1,830万美元,分别不包括150万美元和640万美元的非现金股票薪酬支出。本新闻稿中使用的GAAP与非GAAP财务指标的对账可以在本新闻稿的末尾找到。
关于 Palazestrant (OP-1250)
Palazestrant(OP-1250)是一种新型的口服小分子,具有双重活性,既是完整的雌激素受体(ER)拮抗剂(CERAN),又是选择性ER降解剂(SERD)。目前正在复发、局部晚期或转移性ER阳性(ER+)、人类表皮生长因子受体2阴性(HER2-)乳腺癌患者中进行研究。在临床研究中,palazestrant完全阻断了野生型和突变型转移性ER+乳腺癌中ER驱动的转录活性,并显示出抗肿瘤活性以及诱人的药代动力学和暴露量、良好的耐受性、中枢神经系统穿透性以及与CDK4/6抑制剂的组合性。Palazestrant已被美国食品药品监督管理局(FDA)授予快速通道资格,用于治疗ER+/HER2-转移性乳腺癌,该转移性乳腺癌在一条或多条内分泌治疗中至少有一条药物与CDK4/6抑制剂联合使用。目前正在进行的 3 期临床试验 OPERA-01 和使用 CDK4/6 抑制剂(palbociclib 和 ribociclib)和 pi3KA 抑制剂(alpelisib)的 2 期联合研究中,它既是作为单一药物进行评估。欲了解更多信息,请访问 www.opera01study.com。
关于 Olema Oncol
Olema Oncology是一家处于临床阶段的生物制药公司,致力于改变癌症女性的护理标准并改善其疗效。Olema利用我们对内分泌驱动的癌症、核受体和获得性耐药机制的深刻理解,正在推进一系列新疗法。除了我们的主要候选产品palazestrant(OP-1250)(一种专有的口服完全雌激素受体(ER)拮抗剂(CERAN)和选择性ER降解剂(SERD)外,Olema还在开发一种有效的KAT6抑制剂。Olema 总部位于旧金山,在马萨诸塞州剑桥开展业务。欲了解更多信息,请访问我们的网站 www.olema.com。
非公认会计准则财务信息
本新闻稿中公布的结果包括GAAP信息和非GAAP信息。在本新闻稿中,Olema将非公认会计准则研发费用定义为不包括股票薪酬支出在内的GAAP研发费用,而非GAAP并购支出由Olema定义为不包括股票薪酬支出在内的GAAP并购费用。我们使用这些非公认会计准则财务指标来评估我们的持续运营以及内部规划和预测目的。我们认为,非公认会计准则财务信息合起来可能会对投资者有所帮助,因为它提供了与过去财务表现的一致性和可比性。但是,非公认会计准则财务信息仅用于补充信息的目的,作为分析工具存在局限性,不应孤立地考虑,也不能作为根据公认会计原则提供的财务信息的替代品。其他公司,包括我们行业中的公司,可能会以不同的方式计算标题相似的非公认会计准则指标,或者可能使用其他指标来评估其业绩,所有这些都可能降低我们的非公认会计准则财务指标作为比较工具的用处。鼓励投资者审查相关的GAAP财务指标以及这些非GAAP财务指标与其最直接可比的GAAP财务指标的对账情况,不要依赖任何单一财务指标来评估我们的业务。
前瞻性陈述
根据1933年《证券法》第27A条和1934年《证券交易法》第21E条的定义,本新闻稿中包含的有关非历史事实事项的陈述是 “前瞻性陈述”。诸如 “预期”、“相信”、“可能”、“期望”、“目标”、“可能”、“潜力”、“意愿” 等词语和类似表达(以及其他提及未来事件、条件或情况的词语或表达)旨在识别前瞻性陈述。这些陈述包括与Olema的财务状况和资源、经营业绩、现金状况、Olema关键的3期单一疗法临床试验(OPERA-01)的时间表、潜在临床研究的启动和注册时间表,以及作为单一疗法和联合试验的palazestrant(OP-1250)临床试验结果,潜在的有益特征,包括但不限于palazezestrant()的安全性、耐受性、疗效和治疗效果 palazestrant 的改善潜力ER+/HER2-乳腺癌女性的治疗选择或结果、palazestrant 与其他药物的复用性,以及 Olema 临床前计划的充足性和时机,包括其潜在的有益特征
其KAT6抑制剂化合物,对乳腺癌和其他癌症的适用性以及潜在的IND申请时机。由于此类声明涉及未来事件并基于Olema当前的预期,因此它们受到各种风险和不确定性的影响,并且Olema的实际业绩、表现或成就可能与本新闻稿中声明中描述或暗示的结果存在重大差异。这些前瞻性陈述受风险和不确定性的影响,包括但不限于Olema截至2023年12月31日止年度的10-K表年度报告中标题为 “风险因素” 的部分中讨论的风险和不确定性,以及Olema不时向美国证券交易委员会提交的未来文件和报告。除非法律要求,否则Olema没有义务更新这些前瞻性陈述,包括在实际业绩与前瞻性陈述中的预期有重大差异的情况下。

# # #
投资者关系和媒体联系人:
Geoffrey Mogilner,投资者关系与传播副总裁
ir@olema.com