sgmo-202402050001001233假的00010012332024-02-052024-02-05 美国
证券交易委员会
华盛顿特区 20549
表单 8-K
当前报告
根据第 13 条或第 15 (d) 条
1934 年《证券交易法》
报告日期(最早报告事件的日期): 2024年2月5日
SANGAMO 治疗公司
(注册人的确切姓名如其章程所示)
| | | | | | | | | | | | | | |
| | | | |
| 特拉华 | | 000-30171 | | 68-0359556 |
(州或其他司法管辖区
公司) | | (委员会
文件号) | | (国税局雇主
证件号码) |
运河大道 501 号。, 里士满, 加利福尼亚94084
(主要行政办公室地址)(邮政编码)
(510) 970-6000
(注册人的电话号码,包括区号)
不适用
(如果自上次报告以来发生了变化,则为以前的姓名或以前的地址)
如果提交8-K表格是为了同时履行注册人根据以下任何条款承担的申报义务,请勾选下面的相应方框:
| | | | | |
| ☐ | 根据《证券法》(17 CFR 230.425)第425条提交的书面通信 |
| | | | | |
| ☐ | 根据《交易法》(17 CFR 240.14a-12)第14a-12条征集材料 |
| | | | | |
| ☐ | 根据《交易法》(17 CFR 240.14d-2 (b))第14d-2(b)条进行的启动前通信 |
| | | | | |
| ☐ | 根据《交易法》(17 CFR 240.13e-4 (c))第13e-4(c)条进行的启动前通信 |
根据该法第12(b)条注册的证券: | | | | | | | | | | | | | | |
| | | | |
| 每个班级的标题 | | 交易品种 | | 注册的每个交易所的名称 |
| 普通股,每股面值0.01美元 | | SGMO | | 纳斯达克全球精选市场 |
用复选标记表明注册人是1933年《证券法》第405条(本章第230.405节)还是1934年《证券交易法》第12b-2条(本章第240.12b-2节)所定义的新兴成长型公司。
新兴成长型公司☐
如果是新兴成长型公司,请用复选标记表明注册人是否选择不使用延长的过渡期来遵守根据《交易法》第13(a)条规定的任何新的或修订后的财务会计准则。☐
项目 8.01 其他活动。
2024年2月5日,Sangamo Therapeutics, Inc.(“Sangamo” 或 “公司”)公布了其评估用于治疗法布里病的全资基因疗法候选产品isaralgagene civaparvovec或 ST-920 的第1/2期STAAR研究的最新初步临床数据,然后在20日发布了该研究第四年度世界座谈会2024 年 2 月 7 日。数据摘要如下。该公告包括截至2023年9月19日数据截止日期接受isaralgagene civaparvovec治疗的24名患者的数据。自数据截止日期以来,在第1/2期STAAR研究中又给了四名患者服药,截至本最新报告发布之日,共有28名患者服药。
第1/2期STAAR研究的筛查和入组已经完成,其余入组患者的给药预计将在2024年上半年进行。与美国食品药品管理局和其他卫生当局继续就注册途径进行富有成效的讨论。该公司将推迟对规划潜在注册试验的额外投资,直到获得合作伙伴关系或试用融资为止。
Isaralgagene Civaparvovec 1/2 期 STAAR 研究的最新初步临床数据摘要已于 2024 年 2 月 5 日公布,将在第 20 届年度世界博览会上发表之前座谈会于 2024 年 2 月 7 日
•STAAR研究是一项正在进行的1/2期多中心、开放标签、剂量范围的临床研究,旨在评估年龄在18岁以上的法布里病患者中单次输注isaralgagene civaparvovec的安全性和耐受性。患者静脉注射单剂量,随访52周。另一项长期随访研究正在进行中,以监测该研究中接受治疗的患者在治疗后长达五年的时间。研究设计规定,每个剂量队列中至少要给两名患者服药,每个队列都有可能扩大。接受稳定酶替代疗法(“ERT”)的患者可以在治疗后以受控和监测的方式退出ERT,由患者和研究人员自行决定。
•剂量递增阶段包括患有典型法布里病的男性。随后的研究扩展阶段始于2022年下半年,用于治疗女性以及患有更严重的法布里相关心脏或肾脏疾病的患者。该研究的主要终点是治疗紧急不良事件(“AEs”)的发生率。其他安全性评估包括常规血液学、化学和肝脏检查;生命体征监测;心电图;超声心动图;一系列α-胎蛋白检测和肝脏磁共振成像(“MRI”),以监测任何肝肿块的潜在形成。次要终点包括在一年研究期内特定时间点与基线相比的变化,血浆中α-半乳糖苷酶A(“α-Gal A”)活性、globotriaosylceramide(“Gb3”)和lyso‑GB3水平的变化;ERT输注频率;以及通过心脏磁共振成像和Raav2/6矢量清除率测得的肾功能和心脏功能(左心室肿块)的变化。关键的探索终点包括生活质量、Fabry 症状和神经病理性疼痛评分;以及对 AAV6 衣壳和 α-gal A 的免疫反应。
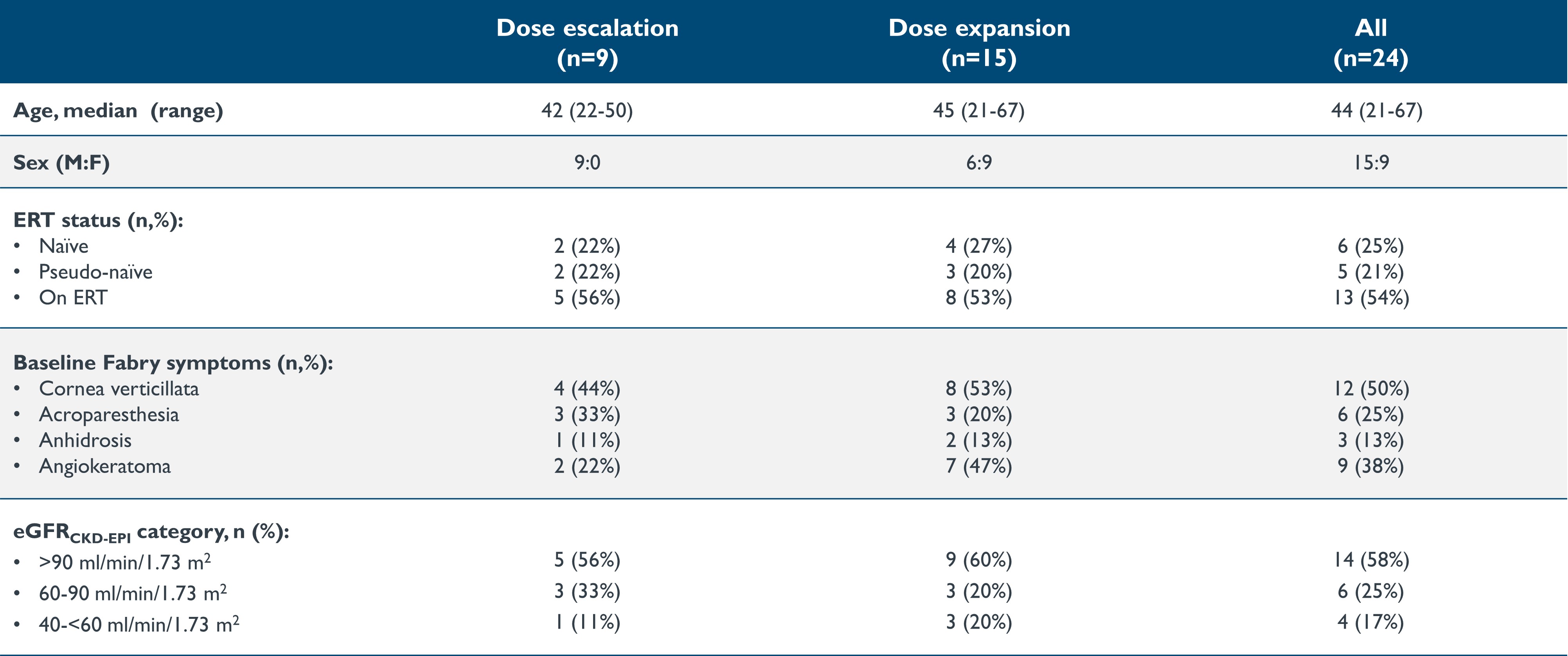
•截至2023年9月19日的数据截止日期,24名年龄在21至67岁的患者接受了isaralgagene civaparvovec的治疗,9名处于剂量递增阶段,15名处于研究的扩展阶段。这24名患者的基线特征如下表1所示。在剂量递增阶段,队列 1 中有两名患者以 0.26x10 的剂量给药13vg/kg,队列 2 中有两名患者以 0.53x10 的剂量给药13vg/kg,队列 3 中有三名患者以 1.58x10 的剂量给药13vg/kg,队列 4 中有两名患者以 2.63x10 的剂量给药13vg/kg。在扩张阶段,15名患者以2.63x10的剂量给药13vg/kg。截至2023年9月19日的数据截止日期,第一位接受治疗的患者在给药后已经进行了至少36.2个月的随访,最近接受治疗的患者在给药后进行了0.9周的随访。
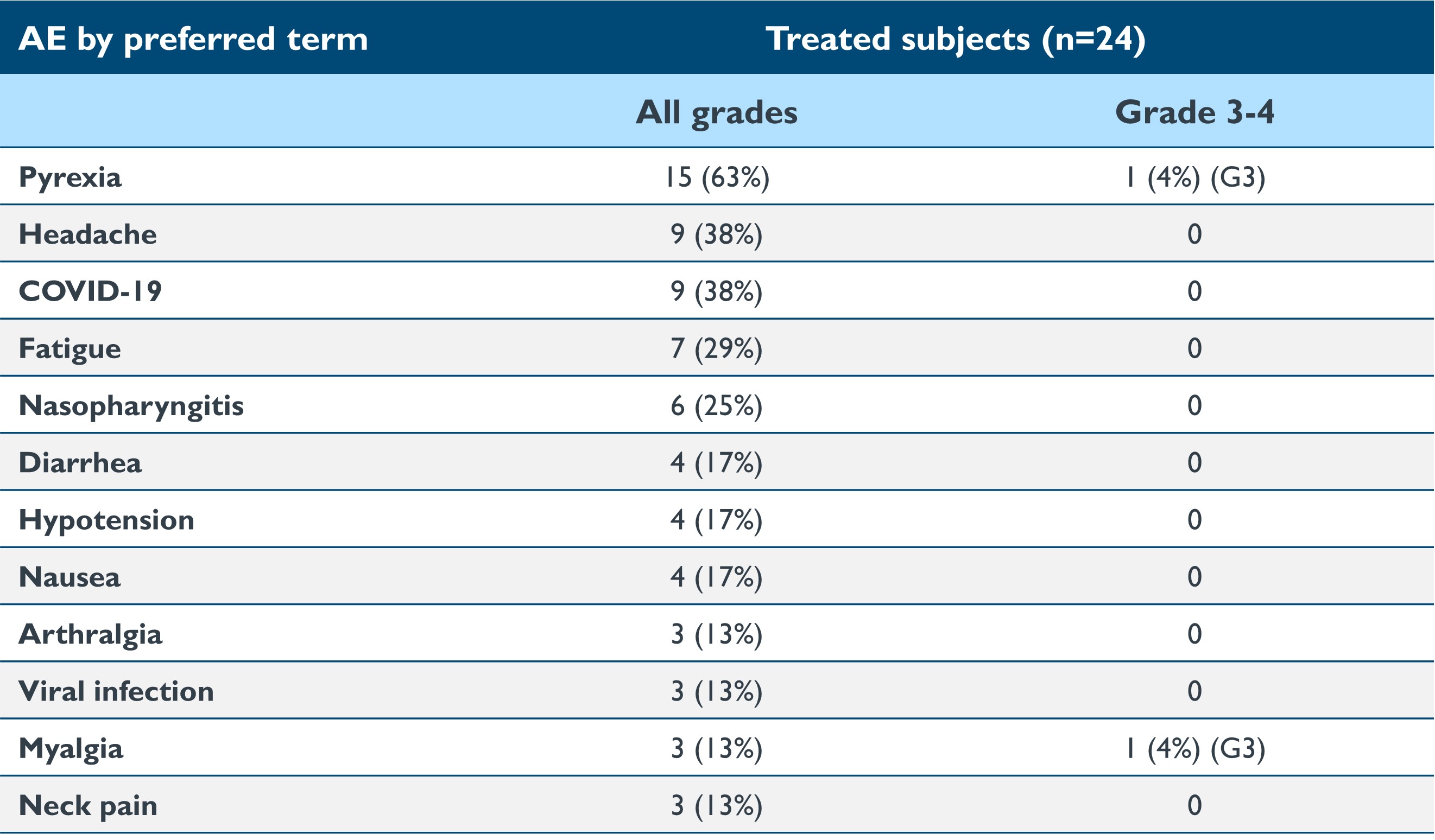
•截至2023年9月19日的数据截止日期,在24名接受治疗的患者中,isaralgagene civaparvovec在所有剂量组中的耐受性总体上仍然良好,其中大多数不良反应在本质上被分为轻度(1级)或中度(2级)。一名患者出现了 3 级发热不良事件。三名患者出现输液后高血压:2 级,使用类固醇(n=2),1 级,盐水注射(n=1)。无需使用类固醇进行肝功能检查升高。没有使用过预防性皮质类固醇或其他免疫调节剂。截至2023年9月19日截止日期,报告的治疗相关不良事件的摘要如下表2所示。四名患者报告了与治疗相关的严重不良事件(“SAE”):左臂疼痛(0.53×10)13vg/kg);败血症(1.58×10)13vg/kg); 集中症、中风/缺血性中风 (2.63×10)13vg/kg)。没有任何不良反应导致研究中止。
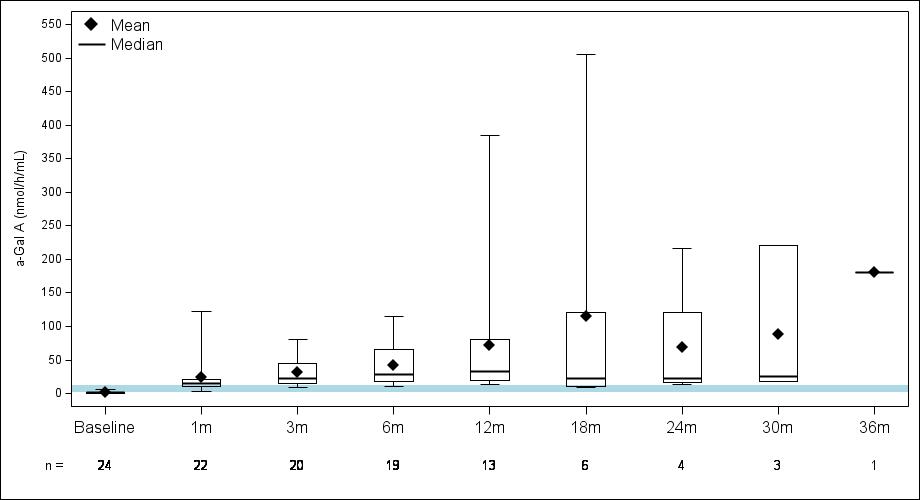
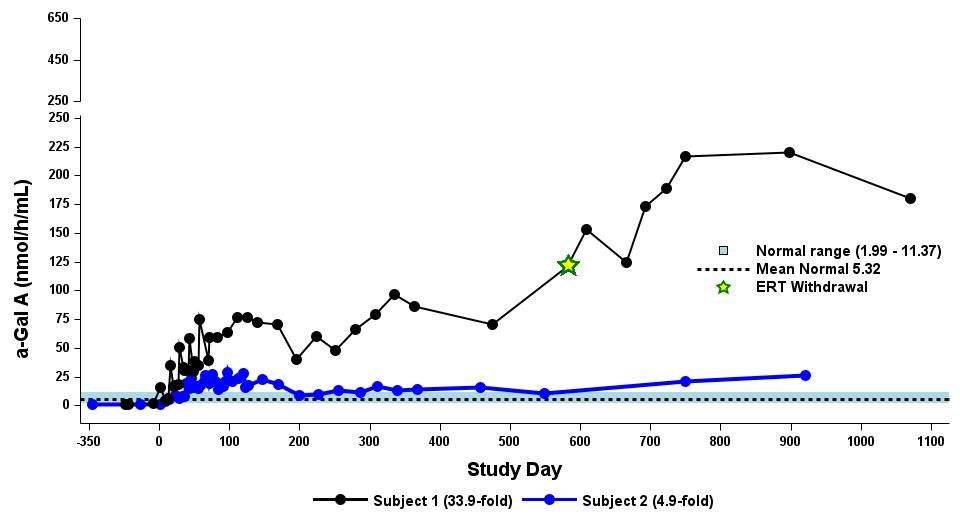
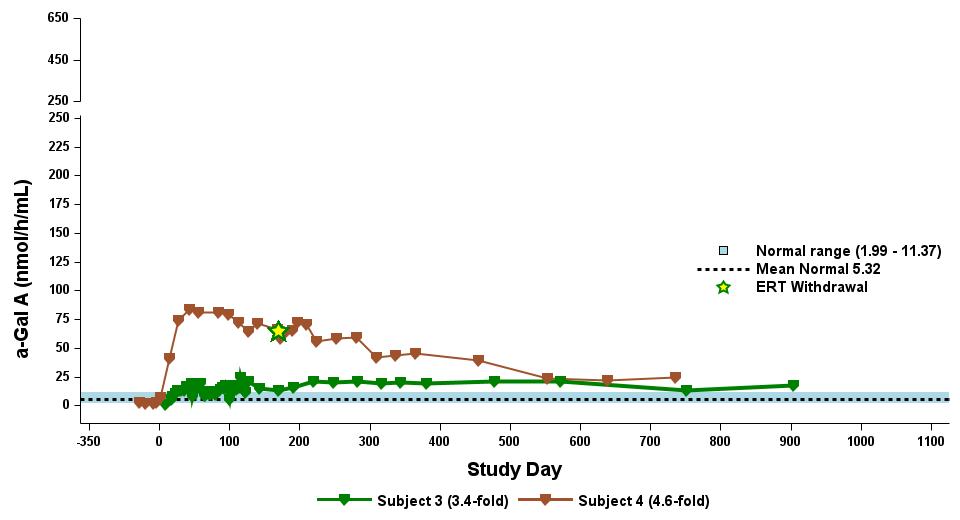
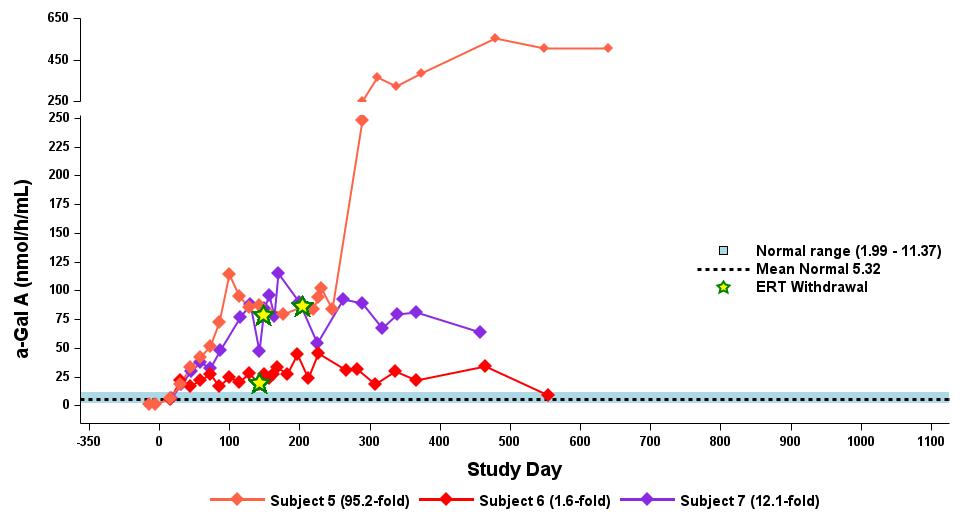
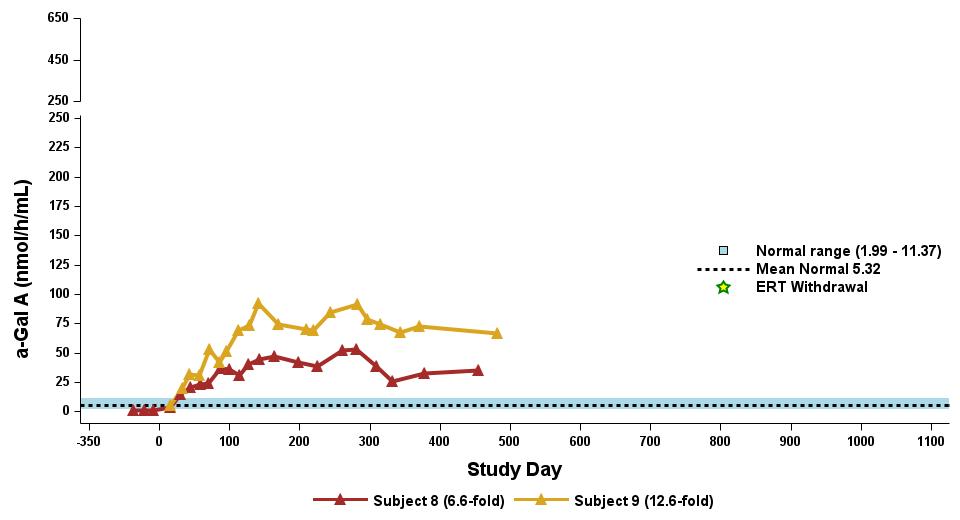
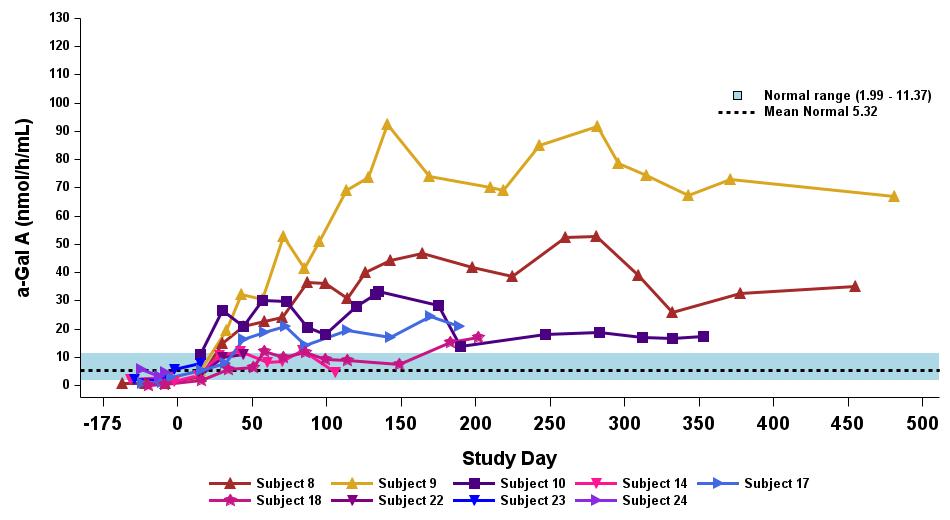
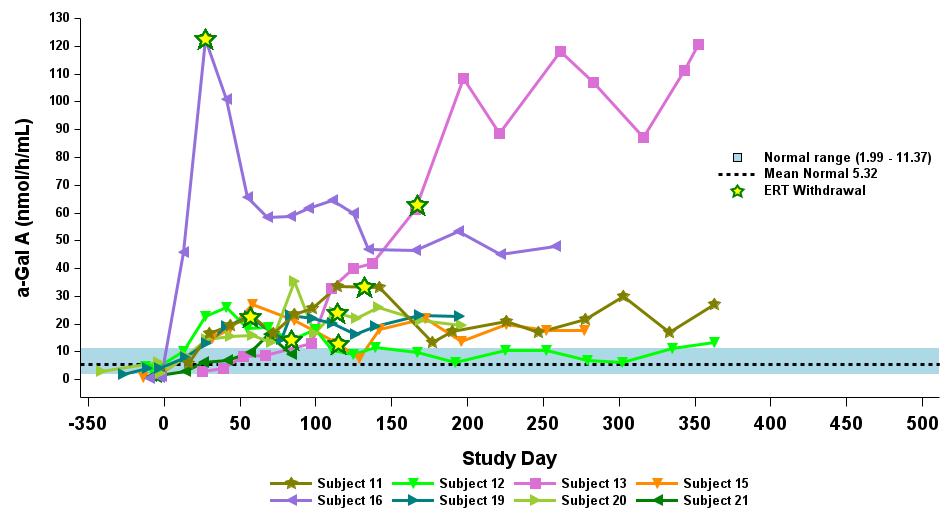
•截至2023年9月19日数据截止日期,所有24名处于剂量递增和扩张阶段的患者的血浆α-Gal A活性结果如表3所示,并在下文进行了进一步的详细描述。对于九名处于剂量递增阶段的接受治疗的患者,截至截止日期,所有九名患者均观察到α-GAL A活性的表达持续升高,持续升高,这是截至截止日期治疗时间最长的患者,如表4所示。对于这些患者,在给药 ST-920 四到八周后,观察到 α-GAL A 活性迅速增加。开始进行ERT研究的所有五名患者的ERT戒断均已完成,在ERT戒断后,α-Gal A活性水平持续升高。截至2024年2月5日,这些患者均未要求恢复ERT。对于处于剂量递增阶段的天真和假天真患者,最高剂量队列 4 中的患者的表现明显更高
与低剂量队列的患者相比,α-Gal A活性水平。截至2023年9月19日数据截止日期,所有这些患者的α-GAL A活性水平持续升高。
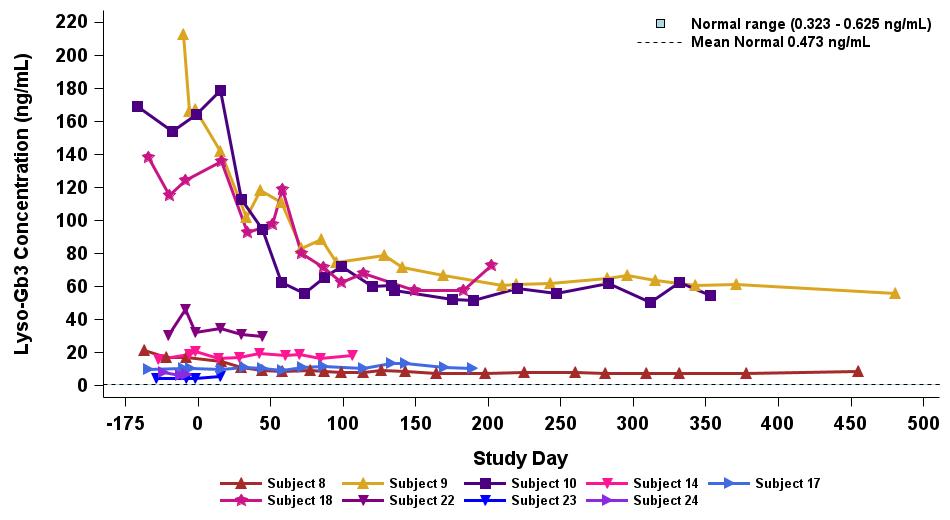
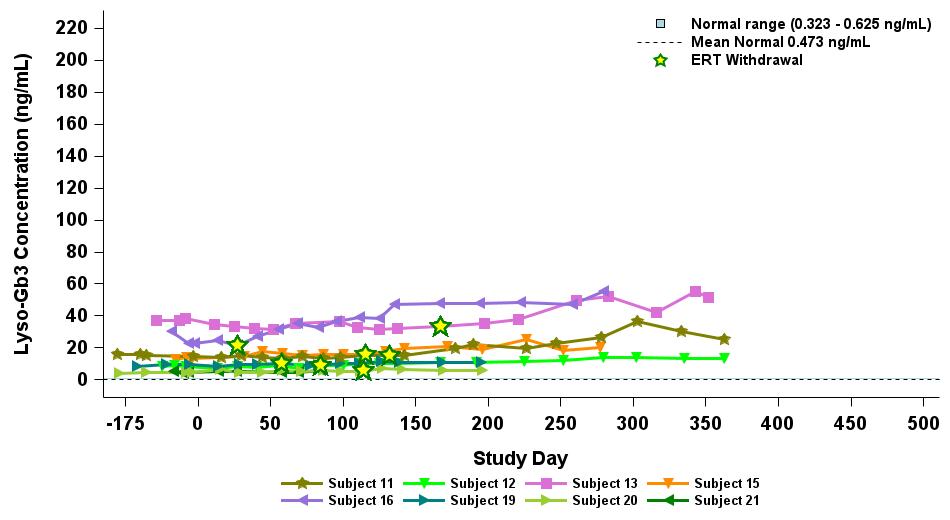
•截至2023年9月19日数据截止日期,ERT 天真或假天真患者接受的剂量水平最高(2.63 x 10)13vg/kg)显示持续的超生理学α-Gal A活性长达近500天,如表5所示。α-GAL A活性表达持续升高伴随着LYSO-GB3水平的降低和/或长期稳定,在基线水平最高的患者中,血浆lyso-GB3的下降幅度最大。
•截至2023年9月19日的截止日期,所有12名开始接受ERT研究并随后退出ERT的患者均未接受ERT,如表6所示。ERT的停药时间由调查人员自行决定,在给药isaralgagene civaparvovec后八周内停药。在12名接受ERT治疗的患者中,有11名患者在长达19个月的时间内继续表现出超生理学水平的α-Gal A活性,而一名患者维持生理水平。从输液后的第四周到第19周,扩增剂量队列中八名接受ERT治疗的患者的戒断情况各不相同。重要的是,在 ERT 戒断后,血浆 lyso-GB3 水平在长达一年的时间内保持稳定。
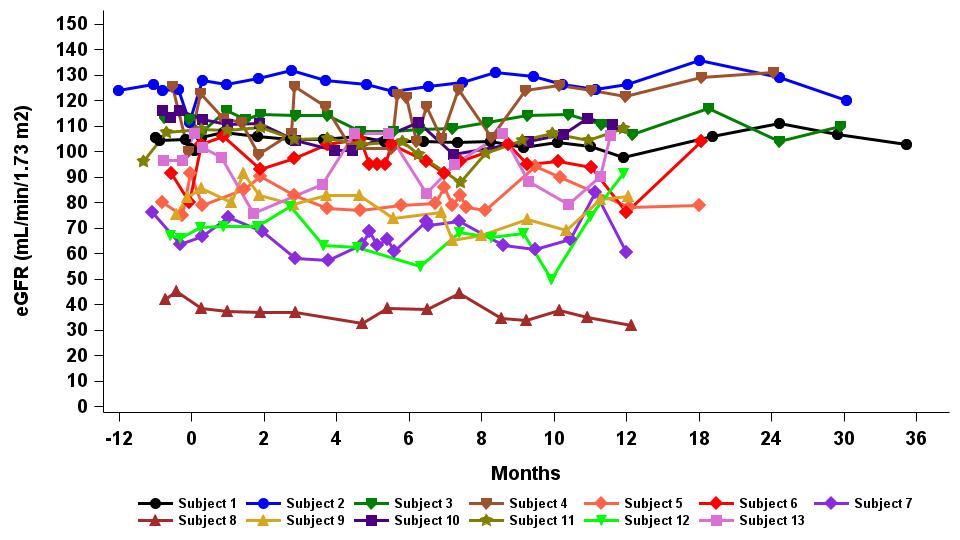
•截至2023年9月19日数据截止日期,所有13名接受12个月或更长随访的患者都将肾功能稳定作为次要终点,以估计的肾小球滤过率(“eGFR”)来衡量,如表7所示。患者的水平在12个月内保持不变,平均年化表皮生长因子斜率为-0.915 mL/min/1.73m2/年(95% 置信区间:-4.1,2.3)。
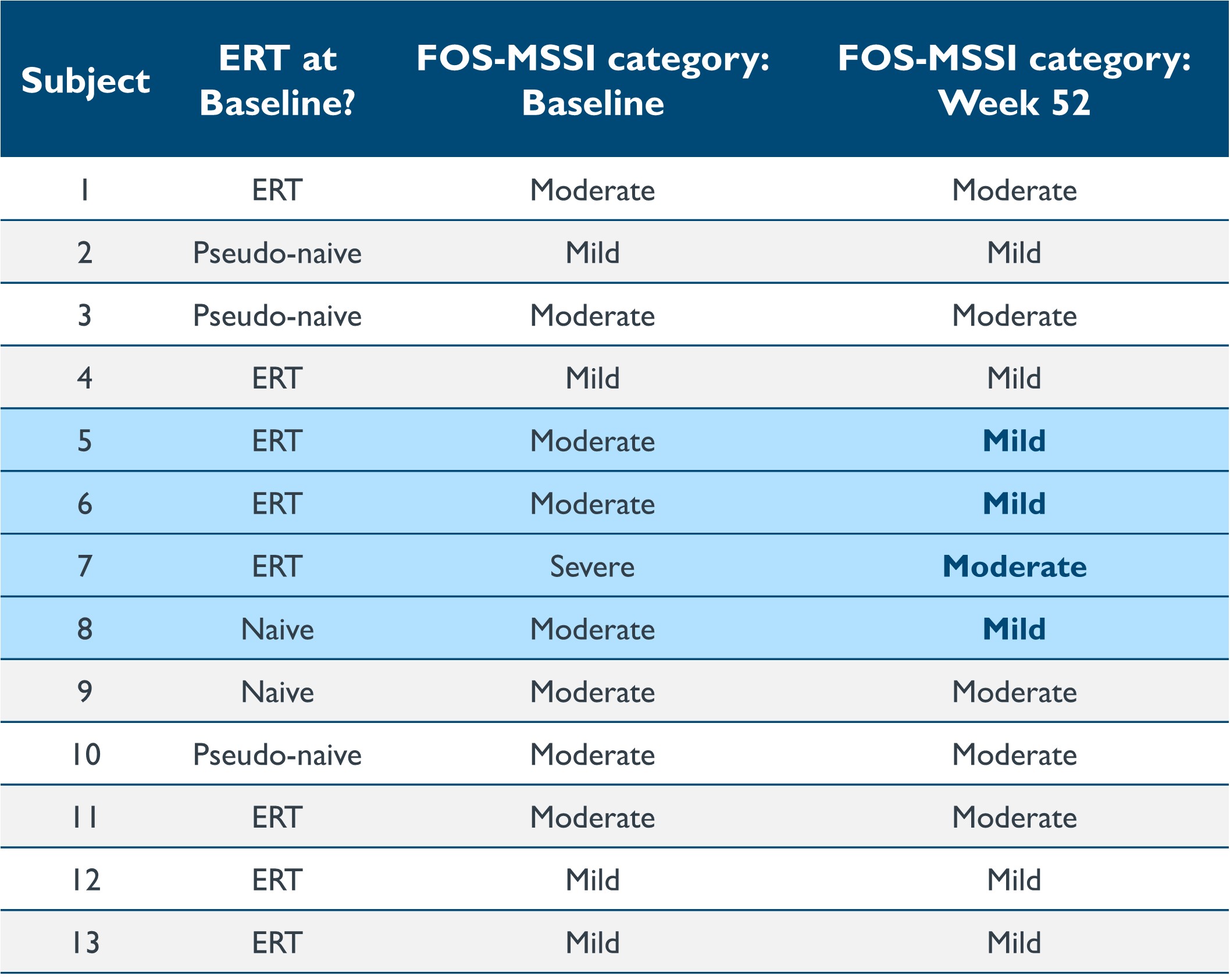
•对13名患者进行了为期12个月的随访,显示疾病严重程度、生活质量(“QoL”)和胃肠道(“GI”)症状有所改善。截至2023年9月19日的数据截止日期,改编自美因茨严重程度评分指数(“FOS-MSSI”)的Fabry结果调查显示,4个MSSI分区均有统计学上的显著改善,69%的患者在第12个月的总MSSI分数较基线有所提高。年龄调整分数与第 12 个月基线相比的平均变化为 -3.96(95% 置信区间: [-7.4.-0.5],p=0.0269)。重要的是,四名患者,包括一名未接受治疗的患者,在第52周与基线相比,他们的FOS-MSSI疾病类别总体有所改善(例如,与基线类别相比,Fabry病的分类从 “中度” 改为 “轻度”),如表8所示。其中三人在基线时接受了急诊治疗,这表明与目前批准的护理标准相比,isaralgagene civaparvovec具有潜在的临床益处。在此后退出的八名接受ERT治疗的患者中,有75%的患者将分数提高了-3.5至-14分,38%的患者的总体疾病类别有所改善。据报道,简表36(“SF-36”)生活质量分数有统计学上的显著改善,在第52周,一般健康和物理成分分的平均变化分别为10.5(p = 0.0158)和4.395(p = 0.0140)。就上下文而言,任何 SF-36 分数的变化 3 到 5 分是临床上最重要的区别。胃肠道症状评级量表(“GSRS”)也显示出显著改善,与第12个月的基线相比平均变化为-0.26(95%置信区间: [-0.5, -0.0], p=0.0226).
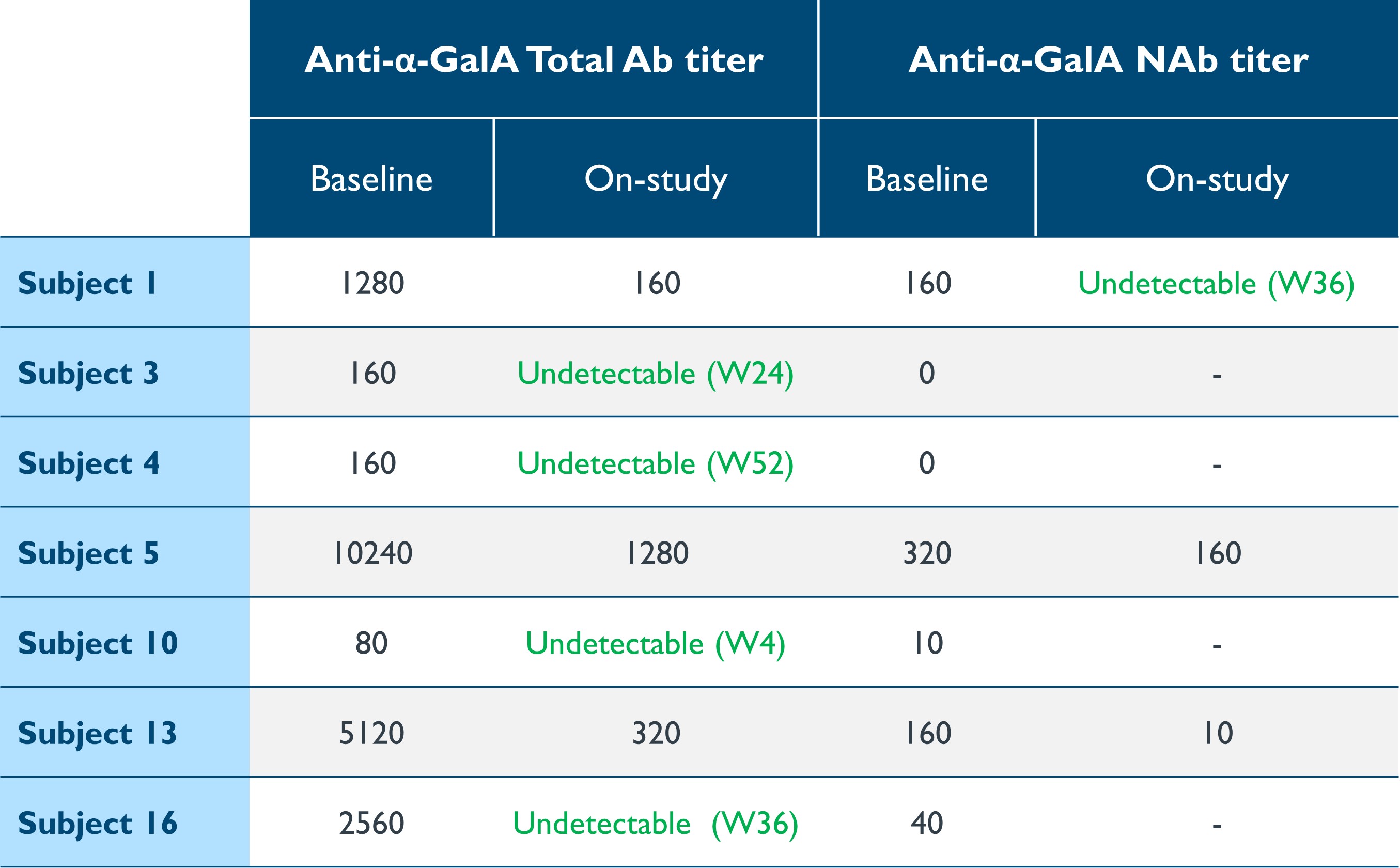
•与免疫原性相关的进行性器官损伤仍然是ERT的问题。在基线时,有七名患者对α-Gal A的总抗体(“Ab”)或中和抗体(“NaB”)的可测量滴度,与ERT有关。如表9所示,给药后,所有七名患者的总Ab或NaB滴度明显下降,五名患者(占71%)的总滴度变得无法检测到。治疗未在血清阴性患者中诱导抗α-GAL A抗体。
表 1:基线特征:剂量递增和剂量扩展阶段
数据截止日期:2023 年 9 月 19 日
eGFR,估计的肾小球滤过率(mL/min/1.73m2);ERT,酶替代疗法
表 2:>2 名患者的治疗急性不良反应摘要
数据截止日期:2023 年 9 月 19 日
在4名受试者中报告了治疗中出现的急性SAE:左臂疼痛(0.53×10)13vg/kg);败血症(1.58×10)13vg/kg); 集中症、中风/缺血性中风 (2.63×10)13vg/kg)。
表 3:α-gal A 活性的表达
数据截止日期:2023 年 9 月 19 日
14号患者在第148天退出了研究。
表 4:剂量递增阶段九名接受治疗患者的剂量依赖性对天真/假天真患者α-gal A活性的影响
2.63×1013vg/kg 被选为扩展阶段
剂量等级 1:0.26×1013vg/kg (n=2)
剂量等级 2:0.53×1013vg/kg (n=2)
剂量等级 3:1.58×1013vg/kg (n=3)
剂量等级 4:2.63×1013vg/kg (n=2)
数据截止日期:2023 年 9 月 19 日
α-gal A 活性使用 3 小时的反应时间测量。正常范围由健康的男性和女性决定。数据点 > 第 365 天学习来自长期随访研究。
α-gal A,α-半乳糖苷酶 A;vg/kg,每千克总体重的载体基因组(由 ddPCR 评估);ERT,基线时进行急性转录治疗;N,ERT-naieve;P-N,假天真,筛查前 ≥ 6 个月内没有 ERT
表 5:接受最高剂量水平 2.63×10 的 ERT 天真/假天真患者中 st-920 驱动的血浆 α-gal A 活性和 lyso-GB3 的降低13vg/kg (n=9)
血浆 α-gal A 活性
等离子 Lyso-Gb3
数据截止日期:2023 年 9 月 19 日
α-gal A 活性使用 3 小时的反应时间测量。正常范围由健康的男性和女性决定。长期随访数据:数据点 > 学习日 365。
α-gal A,α-半乳糖苷酶 A;ERT,酶替代疗法;lyso-GB3,globotriaosylsphingosylsphingosine;vg/kg,每千克总体重的载体基因组(由 ddPCR 评估)
表 6:接受最高剂量水平 2.63×10 的 ERT 治疗患者的血浆 α-gal A 和 lyso-GB313vg/kg (n=8)
血浆 α-gal A 活性
等离子 Lyso-Gb3
数据截止日期:2023 年 9 月 19 日
α-gal A 活性使用 3 小时的反应时间测量。正常范围由健康的男性和女性决定。
α-gal A,α-半乳糖苷酶 A;ERT,酶替代疗法;lyso-GB3,globotriaosylsphingosylsphingosylsphingosine;vg/kg,每千克总体重的载体基因组(由 ddPCR 评估);W,周
表 7:随访时间≥12 m的患者肾功能保持稳定
数据截止日期:2023 年 9 月 19 日
表皮生长因子,根据 2009 年 CKD-EPI 肌酐方程估算的肾小球滤过率(mL/min/1.73m2);95% 置信区间,95% 置信区间界限
表 8:疾病严重程度、生活质量和胃肠道症状的比较
数据截止日期:2023 年 9 月 19 日
对随访时间≥12 m(n = 13)的 ST-920 患者进行分析。“第 12 个月” 是第 52 周的学习时间点。所有 p 值均为未经调整的标称 p 值。
ERT,酶替代疗法;FOS-MSSI、Fabry 结果调查改编自美因兹严重程度评分指数;SF-36,简表 36(任何 SF-36 分数的变化 3 到 5 分是临床上最重要的区别)
表 9:减少或消除针对 α-Gal A 的抗体
数据截止日期:2023 年 9 月 19 日
α-gal A,α-半乳糖苷酶 A;Ab,抗体;NaB,中和抗体;W,周;(-) 表示总抗体滴度为 0 时未进行 NaB 测试
前瞻性陈述
本表8-K最新报告包含有关Sangamo当前预期的前瞻性陈述。这些前瞻性陈述包括但不限于:isaralgagene civaparvovec的安全性和有效性以及治疗和商业潜力,进行我们正在进行的和潜在的未来临床试验以及提供临床试验临床数据的预期计划和时间表,对我们1/2期STAAR研究给药结论的预期,isaralgagene civaparvovec进入后期开发的预期进展,包括桑加莫的计划寻求潜在的合作伙伴或额外的资金以继续进行isaralgagene civaparvovec 未来可能进行的第三阶段试验及其时机,以及其他非历史事实的陈述。这些陈述不能保证未来的表现,并且存在某些难以预测的风险和不确定性。可能导致实际结果不同的因素包括但不限于与我们缺乏资本资源来全面开发、获得监管部门批准和商业化候选产品相关的风险和不确定性,包括我们获得及时或根本启动isaralgagene civaparvovec可能的第三阶段试验所需的资金的能力;我们需要大量额外资金来执行运营计划并继续运营关注;宏观经济因素或金融挑战的影响,包括持续的海外冲突、当前或未来可能的银行倒闭、通货膨胀和利率上升对全球商业环境、医疗保健系统以及Sangamo及其合作者的业务和运营,包括临床试验的运营;研发过程,包括临床试验的运作和结果以及临床数据的呈现;临床试验延迟、暂停和暂停对临床试验时间表和候选产品商业化的影响;这临床试验结果的时间不确定和不可预测的性质,包括在1/2期STAAR研究的最新初步临床数据中观察到的治疗效果对患者来说不可持久,该研究的最终临床试验数据无法验证isaralgagene civaparvovec的安全性和有效性,以及退出ERT的患者将保持在ERT之外的风险;多个监管机构对候选产品的监管批准程序不可预测;依赖于早期临床试验,哪些结果不一定能预测未来的临床试验结果,包括我们候选产品的任何3期试验的结果;排除Sangamo使用的技术的可能性;我们对合作者的依赖以及我们可能无法获得更多合作;我们实现预期未来财务业绩的能力;以及Sangamo向美国证券交易委员会提交的文件,包括其年度10-K表年度报告中描述的其他风险和不确定性已结束2022年12月31日,由桑加莫截至2023年9月30日的季度10-Q表季度报告补充。本表8-K最新报告中包含的信息截至2024年2月5日,除非适用法律要求,否则Sangamo没有义务更新本8-K表最新报告中包含的前瞻性陈述。
签名
根据1934年《证券交易法》的要求,注册人已正式促使经正式授权的下列签署人代表其签署本报告。
| | | | | | | | | | | | | | | | | | | | |
| | | | | | |
| | | | SANGAMO 治疗公司 |
| | | |
| 日期:2024 年 2 月 6 日 | | | | 来自: | | /SCOTT B. WILLOUGHBY |
| | | | 姓名: | | 斯科特·B·威洛比 |
| | | | 标题: | | 高级副总裁、总法律顾问兼公司秘书 |