根据2024年1月29日提交给证券交易委员会的文件
注册编号333-_
美国 美国
证券交易委员会
华盛顿特区,20549
表格
根据1933年《证券法》登记的声明
(注册人在其章程中明确规定的名称)
| 7374 | ||||
(州或其他司法管辖区 公司(br}或组织) |
(主要 标准行业 分类 代码号) |
(I.R.S.雇主 标识 编号) |
电话:
(地址,包括邮政编码和电话号码,包括注册人主要执行办公室的区号)
首席执行官
牛蛙 AI控股公司。
电话:
(服务代理商的名称、地址,包括邮政编码,电话号码,包括区号)
将 份拷贝发送到:
| 亚瑟·S·马库斯,Esq. | 理查德·A·弗里德曼,Esq. | |
| 四川 Ross Ference Carmel LLP | 谢泼德、穆林、里希特和汉普顿律师事务所 | |
| 美洲大道1185号,31楼。纽约,邮编:10036 | 纽约洛克菲勒广场30号,邮编:10112 | |
| 电话: (212)930-9700 | 电话:(212)653-8700 | |
| 传真: (212)930-9725 | 传真:(212)653-8701 |
建议向公众销售的大约 开始日期:
在本注册声明生效日期后,在实际可行的范围内尽快提交。
如果根据《1933年证券法》第415条规定,本表格中登记的任何证券将以延迟或连续方式发售,请勾选下面的方框。☒
如果根据证券法下的规则462(B),本表格是为了注册发行的额外证券而提交的,请选中 下面的框,并列出相同产品的较早生效注册声明的证券法注册声明编号 。☐
如果此表格是根据证券法下的规则462(C)提交的生效后修订,请选中以下框并列出同一产品的较早有效注册声明的证券法注册声明编号。☐
如果此表格是根据证券法下的规则462(D)提交的生效后修订,请选中以下框并列出同一产品的较早有效注册声明的证券法注册声明编号。☐
通过复选标记确定注册人是大型加速注册人、加速注册人、非加速注册人、较小的报告 公司还是新兴成长型公司。请参阅《交易法》第12 b-2条中“大型加速申报公司”、“加速申报公司"、 “小型申报公司”和“新兴成长型公司”的定义:
| 大型 加速文件管理器 | 已加速 文件管理器☐ |
| 较小的报告公司
| |
| 新兴的
成长型公司 |
如果
是一家新兴成长型公司,则通过勾号表明注册人是否选择不使用延长的过渡期来遵守
第7(a)(2)(B)节规定的任何新的或修订的财务会计准则
注册人特此修改本注册声明的生效日期,以推迟其生效日期,直至注册人提交进一步的修正案,明确声明本注册声明此后将根据1933年证券法第8(A)条生效,或直至注册声明将于证券交易委员会根据上述第8(A)条决定的日期生效。
此初步招股说明书中的 信息不完整,可能会更改。在提交给美国证券交易委员会的注册声明生效之前,我们不能出售这些证券。本初步招股说明书不是出售这些证券的要约 ,也不是在任何不允许要约或出售的司法管辖区征求购买这些证券的要约。
| 初步招股说明书 | 主题 完成 | 日期 2024年1月29日 |
上涨 至786,938普通股股份 股票
认股权证购买最多786,938股普通股
786,938 认股权证相关股份
购买最多786,938股普通股的预融资权证
786,938 预筹资权证相关股份
牛蛙 AI控股公司。
此 为牛蛙AI控股有限公司(以下简称“公司”、“本公司”)每股面值0.00001美元的普通股(“本公司”、“本公司”)的确定承诺要约。在根据本招股说明书发售的全部股份中,本公司将发售786,938股普通股(“公司股份”)及配套认股权证(“公司认股权证”),以购买最多786,938股普通股(“公司认股权证”)。假设的每股公司股票和配套公司认股权证的合并公开发行价格为6.63美元,这是我们普通股在2024年1月25日在纳斯达克资本市场上报告的最后销售价格。作为补偿的一部分,公司还将向承销商代表发行47,216份认股权证(“承销商认股权证”,连同本公司 认股权证及预筹资金认股权证,“认股权证”),以购买47,216股普通股(“承销商认股权证股份”连同本公司认股权证股份及预筹资金认股权证股份,“认股权证股份”)。
我们 也向那些在本次发售中购买公司股票的购买者(如果有)提出要约,否则购买者 连同其关联公司和某些关联方将在本次发售完成后立即实益拥有我们已发行普通股的4.99%以上(或经购买者选择, 9.99%),如果购买者 选择购买,则有机会购买:预先出资的认股权证(每份是“预先出资的认股权证”)代替公司股份,否则将导致购买者的实益所有权超过我们已发行普通股的4.99%(或在购买者选择时,超过9.99%)。每一份预融资认股权证的持有者有权以每股0.001美元的行使价购买一股普通股(每股为“预融资认股权证”)。预付资金认股权证将可立即行使,并可随时行使 ,直至所有预付资金认股权证全部行使为止。每份预资资权证和公司权证的合并购买价格等于本次发行中向公众出售的每股公司股票和公司权证的综合价格减去0.001美元。 因此,我们以假设的合并公开发行价发售预资金权证和公司权证。
对于我们出售的每个预融资认股权证,我们提供的公司股票数量将一对一地减少。本公司股份 或预筹资权证(视情况而定)与本公司认股权证只能在本次发售中一并购买,但这些证券 可立即分开发行,并将分开发行。
承销商有权以公开发行价减去承销折扣的价格购买额外证券,以弥补超额配售(如果有的话)。超额配售选择权可用于(I)向吾等购买额外的公司股份,相当于本次发售初步售出的公司股份及/或预筹资权证数目的15% ,及/或(Ii)向吾等购买额外认股权证,相当于本次发售初步出售的公司认股权证的15%。超额配售选择权的行使期限为45天,自我们在此次发行中首次出售证券之日起计。
我们的普通股和可交易认股权证分别在纳斯达克资本市场有限责任公司(“纳斯达克”)上市,代码分别为“BFRG” 和“BFRGW”。我们没有也不打算申请在纳斯达克上挂牌预融资权证或本公司的权证。截至2024年1月25日,我们普通股在纳斯达克上的最新报告销售价格为每股6.63美元。 2024年1月25日,我们有6,094,644股普通股已发行。
我们 是一家新兴成长型公司,符合2012年Jumpstart Our Business Startups Act或JOBS Act,因此可以选择遵守 未来备案文件中某些降低的上市公司报告要求。投资我们的普通股涉及高度的风险。
投资我们的普通股具有高度的投机性和高度的风险。有关在投资我们的证券时应考虑的信息的讨论,请参阅本招股说明书第7页开始的“风险因素”。
| 按公司股份和公司计算 搜查令 | 按预付资金认股权证和公司认股权证 | 不含产品的产品 演练 超额配售 方案(4)(5) | 提供以下服务 充分行使 超额配售 方案(4) | |||||||||||||
| 公开发行价 | $ | $ | $ | $ | ||||||||||||
| 承保折扣及佣金(8.0%)(1)(2) | $ | $ | $ | $ | ||||||||||||
| 支付给公司的收益(未计费用)(3) | $ | $ | $ | $ | ||||||||||||
| (1) | 有关向承销商支付的赔偿的说明,请参阅 “承保”。 | |
| (2) | 是否不包括相当于支付给WallachBeth Capital LLC的公开发行价的1%的非实报实销费用津贴 (“代表“)、承销商代表或承销商的某些费用的报销 。有关向承保人支付的赔偿的说明,请参阅“承保”。 | |
| (3) | 不包括预计发售费用,包括但不限于法律、会计、审计、托管代理、转让代理、 其他专业人员、印刷、广告、旅行、营销、蓝天合规以及本次发售的其他费用。我们估计,不包括承销商的折扣和费用,此次发行的总费用约为258,000美元。 | |
| (4) | 假设 不行使公司认股权证。 | |
| (5) | 假设没有出售任何预融资权证。 |
美国证券交易委员会或任何州证券委员会都没有批准或不批准这些证券,也没有因本招股说明书的准确性或充分性而通过 。任何相反的陈述都是刑事犯罪。
承销商预计将在2024年左右将我们的股票交付给买家。
独家账簿管理 经理
WallachBeth Capital LLC
本招股说明书的日期为2024年
目录表
| 招股说明书 摘要 | 1 |
| 产品 | 5 |
| 风险因素 | 7 |
| 有关前瞻性陈述的警示说明 | 21 |
| 收益的使用 | 22 |
| 股利政策 | 22 |
| 大写 | 22 |
| 稀释 | 23 |
| 股本说明 | 25 |
| 管理层对财务状况和经营成果的讨论与分析 | 29 |
| 业务说明 | 35 |
| 管理 | 53 |
| 高管薪酬 | 55 |
| 某些关系和关联方交易 | 57 |
| 某些实益拥有人的担保所有权以及管理层和有关股东的事项 | 58 |
| 有资格在未来出售的股份 | 59 |
| 承销 | 60 |
| 发行价的确定 | 62 |
| 专家 | 64 |
| 法律事务 | 64 |
| 在那里您可以找到更多信息 | 65 |
| 财务报表索引 | F-1 |
您 应仅依赖此招股说明书中包含的信息。我们没有,承销商也没有授权任何人向您提供其他信息或与本招股说明书中包含的信息不同的信息。本招股说明书的交付和我们证券的出售都不意味着本招股说明书中包含的信息在本招股说明书日期后是正确的。 本招股说明书在要约或要约是非法的任何情况下,或在要约不被允许的任何州或其他司法管辖区,都不是出售要约或邀请买入我们证券的要约。
对于美国以外的投资者:我们和承销商均未采取任何行动,允许在除美国以外的任何司法管辖区发行、持有或分发本招股说明书。 持有本招股说明书的美国境外人士必须告知自己,并遵守与发行本招股说明书所涵盖的证券和将本招股说明书分发到美国境外有关的任何限制。
本招股说明书中的 信息仅以本招股说明书封面上的日期为准。自这些日期以来,我们的业务、财务状况、运营结果和前景可能发生了变化。
除本招股说明书中包含的信息和陈述外,任何人不得就本招股说明书提供与本公司、本招股说明书提供的证券或本招股说明书中讨论的任何事项有关的任何信息或陈述。 如果提供或作出任何其他信息或陈述,则不得将该信息或陈述视为经我们 授权。
我们和承销商均未在除美国以外的任何司法管辖区允许本招股说明书的发售、持有或分发 需要为此采取行动的任何司法管辖区。您需要告知您自己,并遵守与此次发行和分发本招股说明书相关的任何 限制。
| i |
招股说明书 摘要
此 摘要重点介绍了本招股说明书中其他部分包含的信息。此摘要不包含您在投资我们的证券之前应 考虑的所有信息。在投资我们的证券之前,您应仔细阅读整个招股说明书,包括 我们的合并财务报表及其相关附注,以及本招股说明书中“风险因素”、 “管理层对财务状况和经营结果的讨论和分析”以及我们的合并财务报表和相关附注中列出的信息。本招股说明书中的一些陈述构成了前瞻性陈述。请参阅“关于前瞻性陈述的告诫”。除另有说明外,凡提及“我们”、“我们”、“我们”及“本公司”时,均指牛蛙AI Holdings,Inc.及其全资附属公司。
业务 概述
大多数新疗法都会在临床前或临床开发的某个阶段失败。这是开发新疗法的高成本的主要驱动力。开发新疗法的一个主要困难是有效地整合在开发的每个阶段产生的复杂和高维的数据,以降低开发过程的后续阶段的风险。人工智能和机器学习(AI/ML)作为帮助解决这一问题的数字解决方案应运而生。
我们 使用人工智能和机器学习来推进内部和外部项目的药物。我们致力于增加成功的可能性,并减少开发疗法所涉及的时间和成本。目前大多数AI/ML平台在综合不同的高维数据以获得可操作的洞察力方面仍存在不足。我们的平台技术名为bfLEAP™,是一个分析性AI/ML平台,源自约翰·霍普金斯大学应用物理实验室(JHU-APL)开发的技术,它能够通过提供更精确的3,多维理解他们的数据。我们正在部署 bfLEAP™,用于内部计划的几个关键开发阶段,并通过战略合作伙伴关系和协作 来简化治疗开发中的数据分析,通过降低新疗法的失败率来降低总体开发成本,并影响无数可能无法获得所需治疗的患者的生活。
bfLEAP™平台同时使用监督和非监督机器学习-因此,它能够揭示数据中真实/有意义的 联系,而不需要事先假设。有监督的机器学习使用标记的输入和输出数据,而非监督学习算法不使用。在有监督学习中,该算法通过迭代地对数据进行预测并调整正确答案来从训练数据集中“学习”。无监督学习,也称为无监督机器学习,使用机器学习算法来分析和聚类未标记的数据集。这些算法无需人工干预即可发现隐藏模式或数据 分组。BfLEAP™平台中使用的算法旨在处理高度不平衡的数据集,以成功识别与感兴趣的结果相关的因素组合。
与我们的战略合作伙伴和合作伙伴一起,我们的主要目标是提高临床前和临床治疗发展的任何阶段的成功几率。我们的主要业务模式是提高药物开发的成功和效率,这是通过收购药物或与开发药物的公司建立伙伴关系和合作来实现的。我们希望通过战略收购当前临床阶段和失败的药物进行内部开发,或通过与生物制药行业公司建立战略合作伙伴关系来实现这一目标。我们能够通过利用一个强大且经过验证的AI/ML平台(商标:bfLEAP™)来开展我们的药物资产增强业务。我们认为,bfLEAP™分析平台对于分析临床前和/或临床数据集具有潜在的颠覆性,例如在转换式研发和临床试验环境中生成强大的临床前和临床试验数据集。2021年11月,我们修改了与JHU-APL的协议 ,加入了额外的先进人工智能技术。2022年7月8日,本公司从日本宇航获得了全球独家专利使用费许可,用于开发用于增强bfLEAP™平台的额外技术。2022年7月8日的JHU-APL许可证 为公司提供了新的知识产权,还包括2018年2月许可证中的大部分知识产权。
我们 相信bfLEAP™将在整个开发周期内通知/支持决策:
| ● | 1. 发现阶段-分析和分类发现阶段数据,以更好地定义候选群体中的最高价值线索, 以推进到临床前开发阶段。整合来自高通量筛查、药效学分析、药代动力学分析和其他关键数据集的数据,以创建最准确的候选治疗方案。候选库中密切相关的疗法之间通常有很高的相似性-bfLEAP™能够协调不同的数据流 ,以更细微地了解每个候选者的特征/效力。 |
| 3 | 在2021年8月发表在DeepAI.org(https://deepai.org/publication/random-subspace-mixture-models-for-interpretable-anomaly-detection),上 使用12个数据集,将bfLEAP中使用的算法与世界上最流行的10种群集算法进行了比较。最终结果表明,bfLEAP 中使用的算法在衡量预测速度和准确性时具有最高的平均得分。BfLEAP 平台目前拥有这些算法的更高级版本,并正在将其应用于 多个数据分析项目。 |
| 1 |
| ● | 2. 临床前数据-对临床前和/或早期临床数据集进行大规模/多变量分析。在这些情况下,bfLEAP 可用于寻找新的药物靶点,阐明作用机制,预测潜在的非靶点效应/副作用,揭示与治疗反应相关性最高的特定遗传/表型背景(S),等等。这些来自bfLEAP™ 分析的见解可用于为治疗/诊断开发的后续步骤(S)提供决策/研究设计信息,包括 第一-不人道/第一阶段随机对照试验。 |
| ● | 3. 临床开发-对Phi和/或PhII临床试验数据进行高级/多变量分析,以发现高反应患者的利基群体和/或为后期CT选择患者提供信息(S)。这可用于降低较大临床试验(包括第二阶段试验和任何第三阶段注册临床试验)的总体研究风险。BfLEAP™平台分析还可用于更精确地了解治疗与不良事件、副作用和其他可能危及临床试验成功的不良反应之间的复杂关联。 |
我们的平台与疾病适应症或治疗方式无关,因此我们相信它在生物制品或小分子的开发 中是有价值的。
我们药品资产增强计划的 流程是:
| ● | 从生物制药行业公司或学术界获得药品的权利; | |
| ● | 使用专有的bfLEAP™AI/ML平台来确定对药物有最佳反应的患者的多因素资料; | |
| ● | 迅速进行临床试验,以验证该药物在确定的“高反应者”人群中的使用情况;以及 | |
| ● | 在 临床试验取得积极结果后,将带有新信息的获救药物资产剥离/出售给制药行业的一家大型公司。 |
作为我们战略的一部分,我们将继续发展我们的知识产权、分析平台和技术,构建一个庞大的候选药物组合,并实施一种降低风险并提高拯救药物现金流频率的模式。这一战略 将包括整个药物开发价值链上的战略伙伴关系、合作和关系,以及收购 开发失败药物的权利,可能还包括收购相关公司。
到目前为止,我们还没有对任何药物进行临床试验,我们的平台也没有被用来识别已获得监管部门批准商业化的候选药物 。然而,我们目前与一家领先的罕见疾病非营利性组织建立了战略合作关系,用于对晚期临床数据进行AI/ML分析。我们还将公司定位为从大学获得一系列临床前和早期临床药物资产的权利,并与世界著名的研究机构进行战略合作,创建HSV1病毒治疗平台,设计针对各种疾病的免疫疗法。此外,我们还与约翰霍普金斯大学签署了针对胶质母细胞瘤(脑癌)、胰腺癌和其他癌症的抗癌药物的全球独家许可协议。我们还与乔治华盛顿大学签署了另一种针对肝细胞癌(肝癌)和其他肝脏疾病的抗癌药物的全球独家许可。
我们的 平台最初由JHU-APL开发。JHU-APL在与国防相关的应用中使用相同的技术。几年来,该软件和算法已用于识别关系、模式和异常,并预测否则可能找不到 。这些发现和洞察力在预测感兴趣的目标时提供了优势,而不受行业或行业的影响。我们已将该技术应用于各种临床数据集,并确定了可能提供新的知识产权、新的药物靶点和其他有价值的信息的新关系,这些信息可能有助于临床试验的患者分层 从而提高成功的几率。该平台尚未帮助开发已实现商业化的药物。 然而,我们拥有一种已完成第一阶段试验的候选药物和第二种处于临床前阶段的候选药物。我们的目标 是根据当前和未来可用的数据使用我们的技术,以帮助我们更好地确定最佳发展路径。
虽然我们尚未从AI/ML业务中获得可观的收入,但我们预计未来将从以下三个来源获得收入:
合同 服务
我们的 服务合作伙伴关系收费模式是为各种规模的生物制药公司和其他组织设计的,这些公司在药物开发过程中分析数据时遇到了困难。我们使用名为bfLEAP™的专有人工智能/机器学习平台为客户提供大型复杂 数据集分析。此平台旨在 预测感兴趣的目标、模式、关系和异常。我们的服务模式包括现金费用和分析产生的新知识产权的潜在权利,这些知识产权可以在药物开发的发现、临床前或临床阶段执行。
协作 安排
我们 计划与生物技术和制药公司达成合作安排,这些公司拥有正在开发的药物或已失败的晚期第二阶段或第三阶段试验。合作也可能处于药物开发的发现或临床前阶段。 我们的收入将是服务现金支付费用和成功费用的组合,基于实现每个特定安排确定的特定里程碑 。还可能有与开发新知识产权相关的费用或法律权利。
| 2 |
获得某些药品的权利
我们 可以通过使用我们的平台来准确地 确定对药物有反应的患者的概况,进行临床试验以独立 或与临床合作伙伴一起测试我们的发现,从而获得后期第二阶段或第三阶段试验失败的药物的权利并创造收入,最后将药物回售给制药公司。我们已经并可能继续获得尚未通过任何试验的药物的权利 。我们将使用我们的技术来提高成功机会、进行试验并剥离资产。 在剥离资产时,交易可能涉及预付款、基于临床成功的里程碑付款和产品销售的版税。
我们的 bfLEAP™分析平台
我们 能够利用一个强大且成熟的AI/ML平台(商标:bfLEAP™)开展我们的药物救援业务,该平台源自约翰霍普金斯大学应用物理实验室开发的技术。BfLEAP™平台基于约翰霍普金斯大学应用物理实验室授予的全球独家许可。许可证涵盖三(3)项已颁发的专利, 以及一项新的临时专利申请、算法专有库和其他商业机密的非专利权, 还包括修改和改进。2022年7月8日,本公司从日本宇航获得了全球独家专利使用费许可 ,用于开发用于增强bfLEAP™平台的额外技术。新许可证提供了额外的知识产权,包括专利、版权和将在公司的bfLEAP™分析AI/ML平台下使用的专有技术。根据新许可证协议的条款,公司向其他方提供的服务将有权获得净销售额的8%,使用JHU许可证的内部开发药物项目将有权获得3%的净销售额。新许可证还 包含分级子许可费,起步价为50%,根据收入降至25%。
我们 相信bfLEAP™分析平台是一个潜在的颠覆性工具,用于分析临床前和/或临床数据集,例如在转换式研发和临床试验环境中生成的强大的临床前和临床试验数据集。BfLEAP™的输入数据可以包括原始数据(临床前和/或临床读数)、分类数据、患者的社会人口学数据和各种其他输入。因此,bfLEAP™平台能够以无偏见的方式捕获患者的特定遗传和生理特征,并将其与来自患者的其他完全不同的数据源(例如,摩贝、生理数据等)联系起来。以获得更少偏见和更有意义的结论。它还具有独特的可扩展性--bfLEAP™平台能够 对大数据集(即‘大数据’)执行分析,还能够分析高度不同的“短数据和宽数据”。在可视化方面,bfLEAP™能够与最常用的图形分析可视化工具 集成。
我们 相信,a)可扩展的分析(即大数据或短/宽数据)、b)最先进的专有算法、c)无监督的机器学习和d)简化的数据接收/可视化的组合使bfLEAP™成为市场上最灵活和最强大的 新平台之一。
公司将继续发展和改进bfLEAP™,此次发行的部分收益可能会用于内部或与约翰·霍普金斯大学应用物理实验室等开发合作伙伴进行 。
风险因素摘要
我们的业务面临许多风险,如本招股说明书“风险因素”一节和其他部分所述。 在进行投资之前,您应仔细考虑这些风险。其中一些风险包括:
| ● | 我们 的运营历史有限,您可以根据它来评估我们的业绩,因此,必须根据任何新公司遇到的风险来考虑我们的前景。 | |
| ● | 为了使公司能够竞争和发展,它必须吸引、招聘、留住和培养具有所需经验的必要人员。 | |
| ● | 我们的技术、产品和服务的开发和商业化竞争非常激烈。 | |
| ● | 公司的成功有赖于董事会、高管和关键员工的经验和技能。 | |
| ● | 我们依赖各种知识产权,包括专利和许可证来运营我们的业务。 | |
| ● | 第三方可能会时不时地声称我们的一个或多个产品或服务侵犯了他们的知识产权。 | |
| ● | 新产品开发涉及漫长、昂贵和复杂的过程。 | |
| ● | 我们 可能无法进行商业化和销售我们建议的产品和配方所需的临床试验。 | |
| ● | 我们的长期生存和增长将取决于成功的临床试验。 | |
| ● | 我们面临着来自其他生物技术和制药公司的激烈竞争。 | |
| ● | 我们的研发工作可能无法成功开发出商业上成功的产品和技术,这可能会限制我们实现盈利的能力。 | |
| ● | 即使 如果我们能够获得新药品的监管批准,无论是仿制药还是品牌药,这些产品的成功 也取决于对此类产品的接受程度,特别是制药行业的接受程度。 |
| 3 |
| ● | 我们将我们的临床试验活动广泛外包,通常只在内部进行一小部分启动活动。 | |
| ● | 我们 可能无法获得任何失败药物的权利,或者由于我们的 技术或缺乏临床数据,我们可能无法通过分析挽救失败药物。 | |
| ● | 我们 目前没有针对很大一部分发行收益的具体计划,可能会以不会为您带来有利回报或任何回报的方式进行投资 。 |
作为一家新兴成长型公司的影响
作为一家在上一财年收入低于12.35亿美元的公司,我们符合《2012年快速启动我们的企业创业法案》或《就业法案》所定义的“新兴成长型公司”的资格。新兴成长型公司可能会利用规定的降低的报告要求,而这些要求本来适用于上市公司。这些降低的报告要求 包括:
| ● | 豁免遵守审计师关于财务报告内部控制有效性的认证要求; | |
| ● | 豁免遵守上市公司会计监督委员会可能通过的关于强制性审计的任何要求 公司轮换或提供有关审计和财务报表的额外信息的审计师报告的补充; | |
| ● | 豁免获得关于高管薪酬的不具约束力的咨询投票或股东批准任何黄金降落伞安排的要求; | |
| ● | 延长了遵守新会计准则或修订会计准则的过渡期; | |
| ● | 除本招股说明书中规定的任何未经审计的中期财务报表外,仅允许提交两年的已审计财务报表和两年的相关“管理层讨论和财务状况及经营结果分析”;以及 | |
| ● | 减少了 我们定期报告、委托书和注册声明中有关高管薪酬的披露,包括在本招股说明书中。 |
我们 将一直是一家新兴成长型公司,直到出现下列情况中最早的一次:(I)我们的年总收入为12.35亿美元或更多的第一个财政年度结束时;(Ii)我们被视为经修订的1934年《证券交易法》(以下简称《交易法》)所定义的“大型加速申请者”的第一个财政年度结束之时;(Iii)我们在前三年期间发行了超过1.00亿美元的不可转换债务证券的日期;以及(Iv)本次发行五周年的财政年度结束。我们可以选择利用《就业法案》规定的部分(但不是全部)福利。我们目前打算利用上面讨论的豁免。因此,此处包含的信息可能与您从您持有股票的其他上市公司收到的信息不同。
我们 也是美国证券交易委员会法规S-K定义的“较小的报告公司”。因此,我们也不受《萨班斯-奥克斯利法案》第404条的审计人员 认证要求的约束,并在我们的定期报告和委托书中遵守较不广泛的关于高管薪酬的披露要求。我们将继续被视为较小的报告公司,直到在上一财年第二财季的最后一天,我们的公开流通股超过7500万美元。
| 4 |
企业信息
牛蛙人工智能控股公司于2020年2月6日在内华达州注册成立。牛蛙人工智能控股公司是牛蛙人工智能公司和牛蛙人工智能管理有限责任公司的母公司。分别于2017年和2021年在特拉华州和马里兰州注册成立。我们所有的业务目前都是通过牛蛙AI控股公司进行的。该公司的主要业务地址是马里兰州盖瑟斯堡317号埃灵顿大道325号,邮编:20878。我们的网站地址是Www.bullfrogai.com。本招股说明书中对本公司网站的引用 仅为非活动文本参考。我们网站上的信息既不包含在本招股说明书中作为参考,也不打算 用于与此次发行相关的内容。我们所有的业务目前都是通过牛蛙AI,Inc.进行的。
正在进行 关注
公司打算通过扩大收入和额外的股权和债务融资相结合的方式,克服影响其持续经营能力的情况。公司预计在不久的将来通过公共或私人融资、战略关系或其他安排筹集更多资金,以支持其业务运营;然而,公司可能得不到第三方对足够数额的额外资本的承诺。公司不能确定任何此类融资是否能以可接受的条款获得,或者根本不能,如果在需要时未能筹集资金,可能会限制其继续运营的能力。 公司获得额外资金的能力将决定其作为一家持续经营企业继续经营的能力。如果不能及时以有利条件获得额外融资,将对公司的财务业绩、经营业绩和股价产生重大不利影响,并可能要求公司缩减或停止运营、出售资产、通过破产程序寻求债权人保护,或以其他方式寻求保护。此外,额外的股权融资可能会稀释本公司普通股的持有者 ,而债务融资(如果有)可能涉及限制性契约和战略关系,如有必要,可能会筹集额外资金,并可能要求本公司放弃宝贵的权利。有关详细信息,请参阅我们的财务 报表中的注1。本公司相信,于是次发售后,本公司将有足够资本维持至少未来15个月的营运,但不能保证下一年度或其后所需的足够资金将来自营运或来自外部来源,例如债务或股权融资 或其他潜在来源。
产品
下面的产品摘要 包含有关产品和普通股的基本信息,并不完整。 它不包含对您重要的所有信息。有关普通股的更全面了解,请参阅本招股说明书标题为“股本说明”的章节。
| 我们提供的证券 | 我们 发行(i)最多786,938股普通股(“公司股”),每股面值0.00001美元 股份,假设承销商不行使其超额配售权,或904,978股普通股,假设 承销商完全行使其超额配售权,(ii)预先准备好的认股权证,以购买最多786,938股普通股 股票(“预先注资认股权证”),和/或(iii)购买最多786,938股普通股的认股权证 股票(“公司认股权证”),假设承销商不行使其超额配售权,或认股权证 购买最多904,978股普通股,假设承销商全额行使其超额配售权。 | |
| 公司认股权证 | 购买最多786,938股普通股的认股权证 股票(或904,978股普通股,如果承销商完全行使其超额配售权)。认股权证将 可在发行后立即行使,并将于原发行日期的第五周年到期,并具有初始 行使价为7.29美元。有关说明,请参见“股本说明-公司认股权证” 这些逮捕令。 | |
| 预先出资认股权证 | 购买最多786,938股普通股的认股权证 车辆.每个预拨款权证和公司权证的假设合并价格为6.629美元,等于 假设每股公司股票和公司权证的合并价格在本次发行中向公众出售,减去0.001美元。 预先注资认股权证将于发行后立即行使,可随时行使,直至所有预先注资认股权证 全部行使,初始行使价为0.001美元。请参见“股本说明--预出资 认股权证”,以说明这些认股权证。 | |
| 假设的每股公司股票/预出资认股权证的合并公开发行价格, 公司权证 | $6.63 每股公司股份和随附的公司认股权证, 或每份预付款认股权证和随附的公司认股权证6.629美元(每份预付款认股权证的合并购买价 公司认股权证等于本次发行中向公众出售的每股公司股票和公司认股权证的合并价格, 减0.001美元) | |
| 纳斯达克 上市 | 我们的 普通股和可交易权证目前在纳斯达克资本市场交易,代码为“BFRG”, “BFRGW,”分别。 | |
| 编号 发行前发行在外的普通股: | 6,094,644股 | |
| 编号 发行后发行在外的普通股: | 6,881,582 股票(假设没有权证 (在本次发行中发行的股票被行使,代表不行使其超额配售权) | |
| 超额配售 选项 | 我们 已授予承销商一项选择权,可在本次发行结束后45天内行使,以购买(i) 我们额外发行118,040股公司股份,占公司股份(和/或预先出资认股权证 )数量的15% 代替公司股票发行),和/或(ii) 额外的118,040认股权证从我们,占15%的公司认股权证最初出售的这次发行。 |
| 5 |
| 承销商 | WallachBeth Capital LLC | |
| 承销商的认股权证 | 本次发行结束后,我们同意发行 向承销商代表授予认股权证(“承销商认股权证”),以购买 我们的普通股股份,相当于本次发行中出售的股份总数的百分之六(6%)。保险商的 认股权证将可于 {}{ 本次发行的生效日期,并在其五周年到期,每股行使价为7.29美元(110% 每股公司股份和公司认股权证的合并公开发行价),假设合并公开发行价为6.63美元 公司股票和公司认股权证。见“承销-承销商的认股权证”。注册声明 除本招股说明书外,还包括承销商认股权证和行使时可发行的普通股股份 保险商的授权书 | |
| 使用收益的 : | 我们 预计将从出售我们在此次发行中提供的证券中获得约4,546,007美元的净收益(如果承销商全面行使其超额配售选择权,则约为5,257,399美元),在扣除预计承保折扣和 佣金以及我们应支付的预计发售费用后。我们打算将从此次发行中获得的净收益 用于一般和营运资本用途,包括但不限于投资于研发,包括投资于我们的技术、偿还债务 以及用于营运资本和一般公司用途。
有关本次发行所得资金的预期用途的说明,请参阅第22页的 “收益的使用”。 | |
| 风险 因素: | 投资我们的证券具有高度的投机性和高度的风险。在决定是否投资我们的证券之前,您应仔细考虑本招股说明书中所述的信息,尤其是本招股说明书第 页开始的“风险因素”部分中所述的具体因素。 | |
| 禁售期 | 我们 以及我们持有10%(10%)或以上已发行证券的董事、高级管理人员和持有者已与承销商达成协议,除某些例外情况外,在本次发售完成后九十(90)天内,不得出售、发行、出售、合同出售、质押或以其他方式处置我们的任何普通股。见第60页的“承保”。 |
除非本招股说明书另有说明,否则本招股说明书中的信息假定:
| ● | 一种假设公开发行价为每股公司股票6.63美元和配套的公司认股权证; | |
| ● | 本次发行不出售预先出资的认股权证, 不行使本公司的认股权证,不行使承销商的超额配售选择权, 不行使承销商的认股权证;以及 | |
| ● | 786,938 本次发行中出售的公司股票。 |
| 6 |
风险因素
投资我们的证券具有高度的投机性和高度的风险。在决定是否购买本公司的证券时,投资者应仔细考虑以下所述的所有重大风险,以及本招股说明书中包含的其他信息。我们不能向您保证以下讨论的任何事件都不会发生。这些事件可能会对我们的业务、财务状况、运营结果和前景产生重大和 不利影响。如果发生这种情况,我们普通股的交易价格可能会下跌,您可能会损失全部或部分投资。
与公司业务和行业的流动资金有关的风险
我们 的运营历史有限,您可以据此评估我们的业绩,因此,我们的前景必须根据任何新公司遇到的风险 来考虑。
我们于2020年2月26日根据内华达州法律注册成立。因此,我们没有重要的历史可以对我们的前景和未来业绩进行评估。我们提议的运营受到与 新企业相关的所有业务风险的影响。我们创建可行业务的可能性必须考虑到与业务创建、在竞争激烈的行业中的运营以及我们的技术的持续发展和临床数据的结果相关的问题、费用、困难、并发症和经常遇到的延误。我们预计在不久的将来,我们的运营费用将 增加。不能保证我们永远都不会盈利。作为一家处于初创阶段的公司,您应该根据面临的风险、费用和挑战来考虑公司的业务、运营和前景。
如果我们不能吸引和留住关键的管理人员、科学人员和顾问,我们可能无法实现我们的业务目标。
我们的成功取决于我们高级管理团队成员的可用性和贡献。这些 个人中的任何人失去服务都可能延迟、减少或阻碍我们的药物开发和其他业务目标。此外,招聘和留住合格的科学人员进行药物开发工作将是我们成功的关键。我们面临着来自众多制药和生物技术公司、大学、政府实体以及其他公共和私人研究机构对合格人员的激烈竞争。我们可能无法吸引和留住这些人,如果我们不这样做,可能会对我们的业务和财务状况产生重大不利影响 。
| 7 |
我们的技术、产品和服务的发展竞争非常激烈。
我们在未来可能寻求开发或商业化的任何产品方面都面临竞争。我们的竞争对手包括全球主要的 公司。我们的许多竞争对手比我们拥有更多的财力、技术和人力资源,在研发和营销经批准的产品/服务方面拥有卓越的 专业知识,因此可能比我们更有能力开发产品/服务并将其 商业化。这些竞争对手还在招聘和留住合格人员以及获取技术方面与我们展开竞争。规模较小或处于早期阶段的公司也可能成为重要的竞争对手,尤其是通过与大公司和成熟公司的协作安排。因此,我们的竞争对手可能会比我们 更快或更有效地将产品商业化,这将对我们的竞争地位、我们的产品/服务获得初步市场认可的可能性以及我们从产品中产生有意义的额外收入的能力产生不利影响。
第三方可能会时不时地声称我们的一个或多个产品或服务侵犯了他们的知识产权。
由于知识产权诉讼的不确定性,任何有关专利或其他知识产权的纠纷或诉讼都可能代价高昂且耗时,并可能分散我们的管理层和关键人员的业务运营。知识产权侵权索赔可能迫使我们签订昂贵或限制性的许可协议,这可能无法在可接受的条款下获得 ,可能需要我们重新设计我们的产品,这将是昂贵和耗时的,和/或可能使我们受到禁止开发和销售我们的某些产品或服务的禁令。如果最终确定我们的产品侵犯了第三方的专有权,我们可能需要支付大量损害赔偿,包括过去 侵权的损害赔偿。即使这些指控 没有根据,为诉讼辩护也需要大量时间,成本可能很高,而且可能会将管理层的注意力从其他业务问题上转移开。任何与针对我们发起或威胁的诉讼或干扰诉讼有关的公开声明都可能导致我们的业务受到损害。我们的知识产权组合在提出反索赔或谈判许可证以回应知识产权侵权索赔方面可能没有用处。在我们的某些业务中,我们依赖第三方知识产权许可证,我们不能确保这些许可证将来会以优惠条款或根本不向我们提供。
虽然依赖于某些关键人员,但公司没有针对任何此类人员的关键人员人寿保险。
公司依赖Vininder Singh进行运营并执行其业务计划,Vininder Singh或董事会任何成员或高管的损失可能损害公司的业务、财务状况、现金流和经营结果;然而,公司没有为这些个人购买任何有关他们死亡或残疾的保险。因此,如果Vininder Singh或任何董事会成员或高管死亡或致残,公司将不会收到任何补偿,以帮助该人员的缺席。此类人员的流失可能会对公司及其运营产生负面影响。
| 8 |
新产品开发涉及漫长、昂贵和复杂的过程。
我们 可能无法开发或商业化任何候选产品。此外,即使我们开发这样的候选人,他们也可能受到 重要的监管审查、批准和其他政府法规的约束。根本不能保证我们的技术能够 开发产品并将其商业化。新产品开发涉及漫长、昂贵和复杂的过程,我们目前还没有经过充分验证的候选诊断方案。此外,在我们能够将任何新的候选产品商业化之前,我们需要:
| ● | 进行实质性的研究和开发; | |
| ● | 进行 验证研究; | |
| ● | 支出重大资金 ; | |
| ● | 开发和扩大我们的实验室流程;以及 | |
| ● | 获得 监管部门对我们的候选产品的批准和接受。 |
这一过程风险很高,需要数年时间。我们的产品开发工作可能会因多种原因而失败,包括:
| ● | 产品在研究或开发阶段失败;以及 | |
| ● | 缺乏支持该产品有效性的临床验证数据。 |
很少有研究和开发项目会产生商业化产品,早期临床试验中感知到的可行性通常不会在以后的研究中复制 。在任何时候,我们都可能放弃候选产品的开发,或者我们可能需要花费大量资源来重复临床试验,这将对从这些候选产品获得潜在收入的时机产生不利影响。此外,随着我们开发候选产品,我们将不得不在产品开发、市场营销和销售资源方面进行大量投资。
我们 可能无法进行必要的临床试验来增加我们建议的产品和配方的价值。
为了 进行获得FDA批准产品所必需的临床试验,必须获得FDA的许可 才能进行此类临床试验。FDA可以出于安全原因或因为我们或我们的临床 研究者未遵循FDA的临床试验要求而随时停止临床试验。如果我们无法获得进行临床试验的许可或试验被FDA停止,我们销售或许可我们产品的可能性将大大降低 ,因为FDA的批准将提高我们产品的价值。
我们 转售和/或许可我们产品的能力将取决于成功的临床试验。
Only a small number of research and development programs result in the development of a product that obtains FDA approval. Success in preclinical work or early stage clinical trials does not ensure that later stage or larger scale clinical trials will be successful. Conducting clinical trials is a complex, time-consuming and expensive process. Our ability to complete our clinical trials in a timely fashion depends in large part on a number of key factors including protocol design, regulatory and institutional review board approval, the rate of patient enrollment in clinical trials, and compliance with extensive current Good Clinical Practices. If we fail to adequately manage the design, execution and regulatory aspects of our clinical trials, our studies and ultimately our regulatory approvals may be delayed, or we may fail to gain approval for our product candidates. Clinical trials may indicate that our product candidates have harmful side effects or raise other safety concerns that may significantly reduce the likelihood of regulatory approval, result in significant restrictions on use and safety warnings in any approved label, adversely affect placement within the treatment paradigm, or otherwise significantly diminish the commercial potential of the product candidate. Also, positive results in a registrational trial may not be replicated in any subsequent confirmatory trials. Even if later stage clinical trials are successful, regulatory authorities may disagree with our view of the data or require additional studies, and may fail to approve or delay approval of our product candidates or may grant marketing approval that is more restricted than anticipated, including indications for a narrower patient population than expected and the imposition of safety monitoring or educational requirements or risk evaluation and mitigation strategies. In addition, if another Company is the first to file for marketing approval of a competing drug candidate, that Company may ultimately receive marketing exclusivity for its drug candidate, thereby reducing the value of our product.
| 9 |
我们面临着来自其他生物技术和制药公司的激烈竞争。
虽然我们相信我们的技术、开发经验和科学知识提供了竞争优势,但我们面临着来自许多不同来源的潜在竞争 ,包括主要的制药、专业制药和生物技术公司、学术机构和政府机构以及公共和私人研究机构。我们的许多现有或潜在竞争对手拥有比我们多得多的财力、技术和人力资源,在候选药物的开发以及在获得美国和外国监管机构批准方面的经验也要丰富得多。
制药和生物技术行业的合并和收购可能会导致更多的资源集中在我们的少数竞争对手中。由于技术商业适用性的进步和投资这些行业的更多资本,竞争可能会进一步加剧。我们的竞争对手可能会在独家基础上成功开发、获得或许可比我们可能开发的任何候选药物更有效或成本更低的候选药物。
我们成功竞争的能力将在很大程度上取决于我们的能力:
| ● | 确定 在临床开发和监管过程中遇到挫折的药物,我们相信这些药物可以通过我们平台设计更好的研究小组的能力得到帮助; |
| ● | 吸引 合格的科学、产品开发和商业人才; |
| ● | 为我们的药品和技术获得专利或其他专有保护; |
| ● | 获得所需的监管批准;在新药的发现、开发和商业化方面与制药公司成功合作 |
| ● | 与第三方付款人谈判具有竞争力的定价和报销 |
竞争对手技术的可用性可能会限制需求,以及我们能够为我们的服务和我们开发的任何候选药物 收取的价格。无法与现有或随后推出的药物开发技术竞争将对我们的业务、财务状况和前景产生重大不利影响。
老牌制药公司和研究机构可能会大举投资,以加快新化合物的发现和开发,或者 对可能降低bfLEAP™竞争力的新化合物进行许可,这将对我们的业务产生重大不利影响。
我们 可能无法获得任何失败药物的权利,或者由于我们的技术 或缺乏临床数据,我们可能无法通过分析挽救失败药物。
我们的 业务模式基于AI/ML技术的使用,该技术可能无法发现可操作的见解,或者我们可能无法 访问足够的临床数据来揭示导致项目、临床试验或产品成功的此类见解。 此类项目、临床试验或产品的失败将导致我们三个来源之一的收入损失,这可能会对我们的整体业务产生重大 不利影响。
我们 可能无法成功获得失败药物的权利,这可能会限制我们的主要收入来源之一。
我们的 业务模式部分基于我们获得未能通过FDA审批流程第二阶段或第三阶段的药物的能力; 然而,不能保证我们能够获得此类药物的权利,这将显著影响我们的创收能力 ,从而对我们的业务产生重大不利影响。
我们 打算投资于具有高失败风险的早期实验技术。
为了继续支持我们的业务模式,我们打算投资于早期和试验性技术,这些技术中的一些或全部可能对我们没有用处。我们可能会投资于最终不会对我们的项目成功做出贡献的技术,这可能会对我们的业务产生实质性的不利影响。
我们 依赖于产品开发和业务发展的合作协议,这使我们面临依赖第三方生存能力的风险 。
在进行我们的研发活动时,我们目前并将在未来依靠与制造商、合同研究组织、商业合作伙伴、大学、政府机构和非营利性组织等第三方的合作协议来获得战略和财政资源。我们或我们的合作伙伴失去或未能履行任何适用的 协议或安排,或我们未能就其他正在开发的产品获得额外协议,将严重扰乱我们的研发和商业化活动。任何此类损失都可能增加我们的费用,并对我们的业务、财务状况和经营结果造成实质性损害。
| 10 |
我们将我们的临床试验活动广泛外包,通常只在内部进行一小部分启动活动。
我们 依靠独立的第三方合同研究组织(CRO)执行我们的大部分临床研究,包括文件准备、 研究中心识别、筛选和准备、研究前访视、培训、项目管理和生物分析。CRO为我们提供的服务的 许多重要方面不受我们的直接控制。如果我们与CRO的关系 发生任何争议或中断,我们的临床试验可能会延迟。此外,在我们的监管申报中,我们依赖第三方CRO执行的 临床工作的质量和有效性。如果我们的CRO的任何流程、方法或结果被确定为无效 或不充分,我们自己的临床数据和结果以及相关的监管批准可能会受到不利影响。
我们 是一家生物技术公司,没有显著的收入。自成立以来,我们一直遭受运营亏损,我们预计在可预见的未来将遭受 亏损,并且可能永远无法实现盈利。
我们 自成立以来一直遭受重大运营亏损。迄今为止,我们尚未产生任何收入,并且在可预见的未来,我们可能不会从临床分析服务或候选药物的销售中产生任何 收入。我们预计将继续产生重大的 经营亏损,我们预计,随着我们扩大药物开发计划,我们的亏损可能会大幅增加。
为了 实现盈利,我们必须成功开发一种或多种药物并获得监管批准,并有效地将我们开发的任何药物商业化。即使我们成功地开发和商业化一种或多种候选药物,我们可能无法产生 足够的收入,我们可能永远无法实现或维持盈利能力。
在可预见的未来,我们将继续需要额外的资本。如果我们无法在需要时筹集额外资本,我们 可能被迫延迟、减少或取消我们的药品收购工作。
我们 预计将继续产生与我们正在进行的活动有关的大量运营费用,包括进行临床试验 和寻求候选药物的监管批准。我们未来的持续资本需求将取决于多种因素,包括:
| ● | 该 完成候选药物临床试验的进度、结果和费用; | |
| ● | 该 任何潜在的未来临床研究的规模、范围、进展速度、结果和完成成本 | |
| ● | 试验 以及我们可能启动的候选药物的临床前试验; | |
| ● | 该 获得候选药物的监管批准的费用; | |
| ● | 该 我们追求的药物开发计划的范围、优先顺序和数量; | |
| ● | 该 准备、提交、起诉、维护和执行我们的知识产权的费用 | |
| ● | 权利 并为知识产权相关的索赔进行辩护; | |
| ● | 该 我们收购或许可其他产品和技术的程度,以及获得 监管批准的成本 这些产品; | |
| ● | 我们的 建立战略合作和许可或其他条款安排的能力 | |
| ● | 有利 对我们来说;和 | |
| ● | 竞争 技术和市场发展。 |
任何 额外的筹款活动可能会分散我们管理层的日常活动,这可能会对我们 识别和获得新候选药物以及推进此类产品的监管流程的能力产生不利影响。我们筹集额外资金的能力 将部分取决于我们产品开发活动的成功以及与财务、经济和市场条件 相关的其他因素,其中许多因素超出了我们的控制范围。无法保证我们将能够在需要时筹集额外资本 或以对我们有利的条款筹集额外资本(如果有的话)。如果不能及时获得足够的资金,我们可能被迫:
| ● | 延迟, 减少或取消我们的一个或多个药物开发计划的范围; |
| 11 |
| ● | 限制 我们获得或放弃、许可或以其他方式以较不利的条款处置权利的新产品数量 如果我们能够推进监管审批程序;或 | |
| ● | 清算公司并解散公司。 |
如果我们的运营计划发生变化,我们可能需要比计划更早的额外资金。此类额外融资可能无法在 需要时或按对我们有利的条款提供。此外,由于有利的市场条件或战略考虑,我们可能会寻求额外的资本, 即使我们认为我们目前和未来的运营计划有足够的资金。
我们 越来越依赖信息技术系统来运营我们的业务,我们的系统受到网络攻击或其他入侵, 或我们可能依赖的第三方的攻击或攻击可能会使我们承担责任或中断我们的业务运营。
我们 越来越依赖信息技术系统来运营我们的业务。员工、其他有权访问我们系统的人员或未经授权的 人员对关键信息技术系统的崩溃、入侵、损坏、破坏或中断可能会对运营产生负面影响。在正常业务过程中,我们收集、存储和传输机密信息 ,我们必须以安全的方式这样做,以维护此类信息的机密性和完整性。此外, 我们将信息技术系统的某些元素外包给第三方。由于这种外包,我们的第三方供应商 可能或可能会访问我们的机密信息,从而使此类系统容易受到攻击。我们的信息技术系统或第三方供应商的数据泄露可能带来敏感数据可能暴露给未经授权的人或公众的风险。 例如,已完成或正在进行的临床试验或临床前研究中的临床试验数据丢失可能会导致我们的监管审批工作延迟 ,并显著增加我们恢复或复制数据的成本。虽然我们相信我们已 采取了适当的安全措施来保护我们的数据和信息技术系统,并且我们的第三方供应商也已通知我们,但不能保证我们的努力将防止我们的系统或我们的第三方供应商的系统出现故障或漏洞,这可能会对我们的业务和财务状况产生重大不利影响。
我们必须完成广泛的临床试验,以证明我们的候选药物的安全性和有效性。如果我们不能证明我们候选药物的安全性和有效性,我们将不会成功。
我们业务的成功主要取决于我们是否有能力进一步推进监管审批流程,以增加我们候选药物的价值 。候选药物必须满足严格的安全性和有效性标准,才能获准销售,这大大提高了它们的价值。为了满足这些标准,我们必须对候选药物进行昂贵而漫长的测试。
我们 可能无法从FDA或其他同等的外国监管机构获得授权,无法进入第二阶段或第三阶段临床试验的进一步疗效部分 ,或开始和完成我们任何候选药物的任何临床试验。候选药物的临床前研究中的阳性结果 可能不能预测人类临床试验中的类似结果,并且候选药物早期临床试验的有希望的结果可能不会在以后的临床试验中复制。制药和生物技术行业的许多公司在后期临床试验中遭遇了重大挫折,尽管它们在早期开发中取得了令人振奋的成果 。因此,我们候选药物的临床前测试或临床试验的结果可能无法预测我们在后期试验中可能获得的结果。如果临床试验不能证明我们的一个或多个候选药物的安全性和有效性,将对我们的业务和财务状况产生重大不利影响。
推迟我们的候选药物临床试验的开始可能会增加我们的成本,并推迟我们成功许可或销售此类产品的能力。
我们的候选药物将需要继续进行广泛的临床试验,以提高产品的价值和可取性。由于临床试验的性质,我们不知道未来计划中的临床试验是否会按时开始,如果可以的话。推迟临床试验的开始可能会显著增加我们的药物开发成本,并推迟我们成功销售或许可我们的候选药物的能力。此外,许多可能导致或导致临床试验延迟开始的因素也可能最终导致候选药物得不到监管部门的批准。临床试验的开始可能会因各种原因而推迟,包括:
| ● | 在过去的临床试验中证明了足够的安全性和有效性,以获得监管部门的批准 | |
| ● | 开始进一步的临床试验; |
| 12 |
| ● | 让FDA相信我们已经选择了有效的终点用于拟议的临床试验;以及 | |
| ● | 获得机构审查委员会的批准,以便在预期地点进行临床试验。 |
此外,由于患者登记人数不足,临床试验的开始可能会推迟,这是许多因素的作用,包括患者群体的大小、方案的性质、患者离临床地点的距离、相关疾病的有效治疗方法的可用性以及临床试验的资格标准。
如果 我们无法获得美国和/或外国监管部门的批准,我们将无法转售或许可我们的候选药物。
我们的候选药物将受到广泛的政府法规的约束,这些法规涉及药品的研究、测试、开发、制造、安全性、有效性、记录保存、标签、营销和分销。在美国和许多外国司法管辖区,在候选药物商业化销售之前,需要严格的临床前测试和临床试验以及广泛的监管批准程序。满足这些和其他法规要求的成本高、耗时长、不确定,并且会受到 意外延迟的影响。我们向FDA提交的候选药物可能不会获得上市批准,这将显著降低我们候选产品的价值和可取性。关于我们候选药物的临床试验,我们面临着以下风险:
| ● | 候选药物可能不会被证明有效; | |
| ● | 候选药物可能被证明不安全; | |
| ● | 候选药物可能不容易与其他药物或药物联合使用或联合使用 | |
| ● | 候选人; | |
| ● | 结果可能不能证实早期临床前研究或临床试验的阳性结果; | |
| ● | 结果可能不符合FDA或其他机构要求的统计意义级别 | |
| ● | 监管机构;以及 | |
| ● | FDA或其他监管机构可能会要求我们进行额外的研究。 |
我们在进行和管理后期临床试验方面的经验有限,这是获得监管批准所必需的,包括FDA的批准 。然而,如果该公司成功地与一家制药合作伙伴签订了后期临床开发的共同开发协议,则该风险将会降低。完成临床试验以及FDA和其他国家的监管审查程序所需的时间是不确定的,通常需要数年时间。我们对从临床前和临床试验中获得的数据的分析需要得到监管部门的确认和解释,这可能会延迟、限制或阻止监管部门的批准。 我们还可能遇到由于政府监管在产品开发、临床试验和FDA监管审查期间因未来立法或行政措施或FDA政策变化而导致的意外延迟或成本增加。
我们将依赖第三方生产我们的临床药物供应;我们对这些制造商的依赖可能会损害我们候选药物的开发 。
我们 没有能力为我们获得的产品进行临床试验所需的候选药物的内部生产。 在可预见的未来,我们预计将继续依赖第三方制造商和其他第三方来生产、包装和 存储足够数量的我们的候选药物和任何未来的候选药物,以用于我们的临床试验。我们可能面临与依赖第三方制造商相关的各种风险和不确定性,包括:
| ● | 依赖第三方制造商的法规遵从性和质量保证; | |
| ● | 第三方制造商违反制造协议的可能性,因为 | |
| ● | 超出我们控制范围的因素; | |
| ● | 第三方终止或不续订我们的制造协议的可能性 | |
| ● | 制造商 在一个对我们来说昂贵或不方便的时候; | |
| ● | 第三方制造商开发此类第三方拥有的专有技术的潜力 | |
| ● | 制造商 与我们的候选药物的生产有关,这是 | |
| ● | 生产我们的候选药物 ;以及 | |
| ● | 依赖第三方制造商帮助我们防止无意中泄露或窃取 | |
| ● | 我们的专有知识。 |
| 13 |
我们的候选药物可能很复杂,生产成本也很高。如果我们的第三方制造商未能及时、以足够的质量和合理的商业价格交付我们的候选药物供临床使用,我们可能会被要求推迟或暂停 临床试验,或以其他方式停止我们候选药物的开发。虽然我们可能能够确定替代第三方 制造商或为这些候选药物开发我们自己的制造能力,但这一过程可能会导致我们候选药物供应的延迟和成本的增加。此外,第三方制造商可以生产我们的候选药物的工厂数量可能有限 ,如果这些工厂因设备故障、故障或自然灾害损坏等事件而中断运营,可能会导致发货取消、制造过程中的产品丢失或可用候选药物短缺。
我们 可能依赖技术解决方案合作伙伴来开发和部署我们的人工智能技术
我们的 合作伙伴可能会遇到技术、财务、运营或安全问题,从而降低或丧失他们支持本公司的能力。 这可能会阻止本公司产生收入,并丧失我们的运营能力。
除上述风险外,企业还经常面临管理层未能预见或完全意识到的风险。 不可能预见到可能影响我们的所有风险。此外,公司无法预测公司是否会成功实现公司当前的业务计划。鼓励每位潜在买家仔细分析证券投资的风险和优点,在进行此类分析时应考虑以上讨论的风险因素。
有关知识产权的风险
我们依赖各种知识产权,包括专利和许可证来运营我们的业务。
我们的知识产权可能不够广泛,或者其他方面可能不会为我们提供显著的竞争优势。此外,我们为维护和保护我们的知识产权而采取的步骤可能无法阻止其受到挑战、无效、规避或绕过设计,尤其是在知识产权不是高度发达或不受保护的国家/地区。 在某些情况下,我们可能无法强制执行,因为侵权者占主导地位或出于其他商业原因,或者国家/地区可能要求强制许可我们的知识产权。我们未能获得或维护可传达竞争优势、充分保护我们的知识产权、检测或防止规避或未经授权使用此类财产的知识产权 ,可能会对我们的竞争地位和运营结果产生不利影响。我们还依靠与员工、顾问和其他各方签订的保密和竞业禁止协议来部分保护商业秘密和其他所有权 权利。不能保证这些协议将充分保护我们的商业秘密和其他专有权利并且 不会被违反,不能保证我们对任何违反行为有足够的补救措施,不能保证其他人不会独立开发基本上相等的专有信息,也不能保证第三方不会以其他方式访问我们的商业秘密或其他专有权利。
随着我们业务的扩大,保护我们的知识产权将变得越来越重要。我们采取的保护措施可能不足以阻止我们的竞争对手使用我们的专有信息。为了保护或执行我们的专利权,我们可能会被要求对第三方提起诉讼,例如侵权诉讼。此外,这些第三方可以在有挑衅或无挑衅的情况下对我们提出索赔。这些诉讼可能代价高昂、耗费大量时间,并可能转移管理层对其他业务问题的注意力。与我们运营的技术领域的索赔范围和有效性相关的法律仍在发展中 ,因此,我们行业的知识产权地位通常是不确定的。我们不能向您保证 我们将在任何这些潜在的诉讼中获胜,也不能保证所判给的损害赔偿或其他补救措施(如果有)将具有商业价值。
| 14 |
如果被发现侵犯了知识产权,该公司可能会受到负面影响。
技术 公司,包括公司的许多竞争对手,经常因专利侵权或其他侵犯知识产权的指控而提起诉讼。此外,专利持有公司寻求将他们购买的或以其他方式获得的专利货币化。随着公司的发展,针对它的知识产权索赔可能会增加。该公司打算 在法庭和美国国际贸易委员会面前积极为侵权行为辩护。这些诉讼中的原告经常寻求禁制令和实质性损害赔偿。无论此类专利或其他知识产权的范围或有效性如何,或者潜在或实际诉讼当事人的任何索赔的是非曲直,公司都可能不得不进行旷日持久的诉讼。如果 公司被发现侵犯了一项或多项专利或其他知识产权,无论它是否能够开发非侵权技术,它都可能被要求向第三方支付大量损害赔偿或使用费,或者可能受到禁止公司营销或销售某些产品的临时或永久 禁令的约束。在某些情况下,公司可能会考虑签订许可协议的可取性,但不能保证能够以可接受的条款获得此类许可,也不能保证不会发生诉讼。这些许可证还可能大幅增加公司的运营费用。无论特定索赔的是非曲直 ,诉讼可能昂贵、耗时、对公司运营造成干扰并分散管理层的注意力。 考虑到这些考虑因素,公司可能会达成和解诉讼的安排。如果一个或多个法律问题根据本公司在报告期内的综合财务报表得到解决,可能会对公司造成重大不利影响。 此外,这种结果可能导致重大的补偿性、惩罚性或三倍的金钱损害、收入或利润的返还、对公司的补救措施或禁令救济,从而可能对公司的财务状况和运营业绩产生不利影响 。
我们 严重依赖我们的技术和知识产权,但我们可能无法充分或经济高效地保护或执行我们的 知识产权,从而削弱我们的竞争地位并增加运营成本。
为了保护我们在服务和技术上的权利,我们依靠著作权法和商标法、专利、商业秘密、保密协议和保护性合同条款的组合。我们还依赖与商标和域名相关的法律来保护我们企业品牌和声誉的价值。尽管我们努力保护我们的专有权利,但未经授权的各方可能会复制我们的服务或技术的各个方面,获取和使用我们认为是专有的信息、标记或技术,或者以其他方式侵犯我们的知识产权。此外,其他公司也有可能独立开发基本上等同的知识产权。如果我们不有效地保护我们的知识产权,或者如果其他人独立开发基本上同等的知识产权,我们的竞争地位可能会被削弱。
有效地 监管未经授权使用我们的服务和技术既耗时又成本高昂,而且我们采取的步骤可能无法防止 盗用我们的技术或其他专有资产。我们为保护我们的专有权所做的努力可能 不够或有效,未经授权的各方可能复制我们服务的某些方面,使用类似的标记或域名,或获取并 使用我们认为是专有的信息、标记或技术。我们可能不得不提起诉讼以强制执行我们的知识产权, 以保护我们的商业秘密,或者确定他人专有权利的有效性和范围,这些有时并不明确 或可能会发生变化。诉讼可能既耗时又昂贵,结果可能很难预测。
我们 依赖与第三方达成的协议来提供使我们能够实施某些应用程序所需的某些服务、商品、技术和知识产权。
我们向客户实施和提供我们的应用程序和服务的能力在一定程度上取决于第三方拥有或控制的服务、商品、技术和知识产权。这些第三方可能无法或拒绝按照符合我们的商业惯例的商业合理条款继续提供这些服务、货物、技术或知识产权, 或以其他方式终止对我们继续运行我们的应用程序非常重要的服务。如果我们不能及时或按商业上合理的条款更换这些服务、商品、技术或知识产权,我们的经营业绩和财务状况可能会受到损害。此外,我们对第三方供应商的控制有限,这增加了我们在这些供应商提供的技术和服务出现问题时的脆弱性。如果第三方的服务、技术或知识产权 未能按预期执行,可能会使我们承担潜在责任,对我们的续约率产生不利影响,并对我们的财务状况和运营结果产生不利影响 。
如果 我们未来可能许可的知识产权的任何第三方所有者没有正确维护或执行此类许可所依据的专利,我们的竞争地位和业务前景将受到损害。
我们 将来可能会获得第三方知识产权许可。我们的成功将在一定程度上取决于我们的许可方 获得、维护和执行其知识产权的专利保护的能力,尤其是我们获得了专有权的那些专利。
| 15 |
如果适用,我们的许可方可能无法成功起诉我们获得许可的专利申请。即使针对任何此类专利申请颁发专利,我们的许可人也可能无法维护这些专利,可能决定不对侵犯这些专利的其他 公司提起诉讼,或者可能不像我们那样积极地提起诉讼。此外,如果我们违反适用的许可协议,并且未能在指定的 期限内纠正违规行为,我们的许可方 可能会终止与我们的协议。如果没有对我们许可的知识产权的保护,其他公司可能会提供基本相同的产品供销售,这可能会对我们的竞争业务地位、业务前景和财务状况产生重大不利影响。
Because our research and development of drug candidates often incorporates compounds and other information that is the intellectual property of third parties, we depend on continued access to such intellectual property to conduct and complete our preclinical and clinical research and commercialize the drug candidates that result from this research. We expect that future licenses would impose, numerous obligations on us. For example, under our existing and future license agreements, we may be required to pay (i) annual maintenance fees until a drug candidate is sold for the first time, (ii) running royalties on net sales of drug candidates, (iii) minimum annual royalties after a drug candidate is sold for the first time, and (iv) one-time payments upon the achievement of specified milestones. We may also be required to reimburse patent costs incurred by the licensor, or we may be obligated to pay additional royalties, at specified rates, based on net sales of our drug candidates that incorporate the licensed intellectual property rights. We may also be obligated under some of these agreements to pay a percentage of any future sublicensing revenues that we may receive. Future license agreements may also include payment obligations such as milestone payments or minimum expenditures for research and development. We expect that any future licenses would contain reporting, insurance and indemnification requirements. We are actively reviewing and preparing additional patent applications to expand our patent portfolio, but there can be no assurances that patents related to our existing patent applications or any applications we may file in the future will be issued or that any issued patents will provide meaningful protection for our drug candidates, which could materially adversely affect our 商业竞争力、商业前景和财务状况。
与员工和其他人签订的保密 协议可能无法充分防止商业秘密和其他专有信息的披露,也可能 无法充分保护我们的知识产权。
We rely on trade secrets to protect our technology, especially where we do not believe patent protection is appropriate or obtainable. However, trade secrets are difficult to protect. In order to protect our proprietary technology and processes, we also rely in part on confidentiality and intellectual property assignment agreements with our corporate partners, employees, consultants, outside scientific collaborators and sponsored researchers and other advisors. These agreements may not effectively prevent disclosure of confidential information nor result in the effective assignment to us of intellectual property, and may not provide an adequate remedy in the event of unauthorized disclosure of confidential information or other breaches of the agreements. In addition, others may independently discover our trade secrets and proprietary information, and in such case we could not assert any trade secret rights against such party. Enforcing a claim that a party illegally obtained and is using our trade secrets is difficult, expensive and time-consuming, and the outcome is unpredictable. In addition, courts outside the U.S. may be less willing to protect trade secrets. Costly and time-consuming litigation could be necessary to seek to enforce and determine the scope of our proprietary rights, and failure to obtain or maintain trade secret protection could materially adversely affect our business and financial condition.
与我们证券所有权和本次发行相关的风险
我们的 管理层将对本次发行的任何净收益的使用拥有广泛的自由裁量权,您可能不同意我们如何使用收益, 并且收益可能无法成功投资。
我们的 管理层将拥有广泛的自由裁量权,可以使用此次发行所得的任何净收益,并可以将其用于 此次发行时设想的用途以外的其他目的。因此,您将依赖我们管理层对此次发行所得收益的使用情况的判断,并且您将没有机会在您的投资决策中评估所得收益是否得到了适当的使用。我们目前没有针对很大一部分发行收益的具体计划, 收益可能会以不会为您带来有利回报或任何回报的方式进行投资。
此次发行的投资者 可能会因为此次和未来的股票发行而经历未来的稀释。
为了筹集额外资本,我们未来可能会提供额外的普通股或其他证券,可转换为 或可交换为我们的普通股。未来购买我们股票或其他证券的投资者可以享有高于现有普通股股东的权利,而我们在未来交易中出售额外普通股或其他可转换为我们普通股或可交换为我们普通股的证券的每股价格可能高于或低于本次发行的每股价格。
| 16 |
我们普通股的 价格可能会大幅波动。
您 应该认为投资我们的普通股是有风险的,并且只有在您能够承受投资的重大损失和市场价值的大幅波动的情况下,您才应该投资我们的普通股。除了本“风险因素”部分和本招股说明书中提到的其他风险外,可能导致我们普通股市场价格波动的一些因素 包括:
| ● | 股东、高管和董事出售我们的普通股; |
| ● | 波动性 以及我们普通股股票交易量的限制; |
| ● | 我们 获得资金进行和完成研究和开发活动的能力; |
| ● | 我们吸引新客户的能力; |
| ● | 变更我们收购药品的研发状态 ; |
| ● | 未能达到外部期望或管理指导; |
| ● | 改变我们的资本结构或股利政策或未来的证券发行; |
| ● | 我们的 现金状况; |
| ● | 关于融资努力的公告和活动,包括债务和股权证券; |
| ● | 声誉问题 ; |
| ● | 宣布我们或我们的竞争对手的收购、合作、合作、合资企业、新产品、资本承诺或其他活动; |
| ● | 在我们开展业务的地区或任何地区的总体经济、政治和市场状况的变化 ; |
| ● | 行业状况或看法的变化 ; |
| ● | 类似公司或公司集团的估值变动 ; |
| ● | 分析师 研究报告、推荐和建议变更、价格目标和撤回承保范围; |
| ● | 离职 和增加关键人员; |
| ● | 与知识产权、专有权利、合同义务有关的纠纷和诉讼; |
| ● | 更改适用的法律、规则、条例或会计惯例及其他动态;以及 |
| ● | 其他 事件或因素,其中许多可能不是我们所能控制的。 |
| 17 |
此外,如果我们行业的股票市场或与我们行业相关的行业或整个股票市场 遭遇投资者信心丧失,我们普通股的交易价格可能会因为与我们的业务、财务状况和经营业绩无关的原因而下降。如果发生上述任何一种情况,可能会导致我们的股价下跌,并可能使我们面临诉讼, 即使不成功,辩护也可能代价高昂,并分散管理层的注意力。
我们 不打算申请在任何交易所或国家认可的交易系统上上市预资金权证、公司权证或承销商的权证,我们预计不会为预资金权证、公司权证或承销商的权证发展市场。
我们 不打算申请在纳斯达克资本市场或任何其他证券交易所或国家认可的交易系统上上市任何预筹资助权证、公司权证或承销商权证 ,我们预计权证市场不会发展。如果没有活跃的市场,权证的流动性将受到限制。此外,认股权证的存在可能会降低我们普通股的交易量和交易价格。
这些认股权证具有投机性和持有人的性质。 在这些权证持有人行使其认股权证并收购我们的普通股股份之前,这些权证没有作为股东的权利。
在我们认股权证的 持有者在其行使时获得普通股股份之前,该等持有者对认股权证相关的普通股股份 没有任何权利。于行使认股权证后,持有人将只有权行使股东的权利 有关事项的记录日期出现在他们作为股东登记在本公司股东名册上之日之后。 认股权证发售后,认股权证的市值将不确定。不能保证我们普通股的市场价格将永远等于或超过本公司认股权证和承销商认股权证的行使价或预先出资的认股权证的价格,因此不能保证投资者行使其认股权证是否有利可图。
未来 现有股东出售股份可能会导致我们的股价下跌。
如果我们的现有股东在本招股说明书中讨论的九十(90)天合同禁售期和其他转售法律限制失效后,在公开市场上出售或表示有意出售大量普通股,我们普通股的交易价格 可能大幅下跌,并可能跌至公开发行价以下。假设承销商不行使其超额配售选择权,根据截至招股说明书日期 的流通股计算,本次发行完成后,我们将拥有6,881,582股普通股流通股。 和 本次发行发行的认股权证均未获行使 。在这些股份中,假设我们的现有股东在此次发行中没有购买任何股份,6,999,622股普通股,加上根据承销商购买额外股份的选择权出售的任何股份,将立即在公开市场上自由流通,不受限制。
此外,发行后,根据我们的2022年股权激励计划为未来发行预留的900,000股股票可能有资格在未来的公开市场上出售, 受某些法律和合同限制。如果我们的现有股东在公开市场上出售了大量我们的普通股,或者如果公众认为可能会发生此类出售,这可能会对我们普通股的市场价格产生不利的 影响,即使此类出售与我们的业务表现之间没有关系。
本次发行完成后,我们可能面临更大的证券集体诉讼风险。
从历史上看,证券集体诉讼通常是在一家公司的证券市场价格下跌后对其提起的。 如果我们被起诉,可能会导致巨额成本和管理层的注意力和资源分流,这可能会 损害我们的业务。
我们 从未为我们的股本支付过股息,我们预计在可预见的未来也不会支付任何股息。因此,投资我们普通股的任何收益很可能取决于我们普通股的价格是否上涨。
我们 迄今尚未对任何类别的股本支付股息,我们目前打算保留未来的收益(如果有的话), 为我们业务的发展和增长提供资金。此外,任何 我们未来可能承担的债务可能使我们无法支付股息。因此,在可预见的未来,我们普通股的资本增值(如果有的话)将是您投资我们普通股的唯一收益来源。因此,在可预见的未来,如果我们的普通股价格上涨,您可能只会从您对我们普通股的投资中获得收益。
| 18 |
如果 股票研究分析师不发布有关我们业务的研究或报告,或者他们发表不利的评论或下调我们 普通股的评级,我们普通股的价格可能会下跌。
我们普通股的 交易市场可能会受到股票研究分析师发布的有关我们和我们 业务的研究和报告的影响。我们无法控制这些分析师。如果一位或多位股票分析师下调我们的 普通股评级,或者分析师发布其他不利评论或停止发布有关我们或我们业务的报告,我们的普通股价格可能会下跌。
我们的章程文件或内华达州法律的条款 可能会延迟或阻止对我们公司的收购,即使收购对我们的股东有利,并可能使管理层变更更加困难。
我们的公司章程和章程的条款 可能会阻止、延迟或阻止股东 可能认为有利的合并、收购或其他控制权变更,包括股东可能因其股份而获得溢价的交易。 此外,这些条款可能会使更换或罢免董事会更加困难,从而挫败或阻止我们的股东更换或罢免我们当前管理层的任何企图。这些规定包括:
| ● | 限制 我们的股东召开股东特别会议的能力; | |
| ● | 一个 股东建议及提名本公司成员的预先通知规定 | |
| ● | 董事会; | |
| ● | 该 我们的董事会有权决定董事会董事席位的数量; | |
| ● | 该 董事会有权填补董事会出现的空缺; | |
| ● | 该 我们的董事会有权发行优先股,其条款由我们的董事会决定。 |
我们的 公司章程授予董事会指定和发行额外普通股和/或优先股的权力。
我们的 法定资本包括100,000,000股普通股和10,000,000股优先股。我们的优先股可以 根据公司章程授予的权限并经董事会批准指定为系列。 董事会可在股东不采取任何行动的情况下,指定并发行 董事会认为适当的类别或系列的股票,并确立此类股票的权利、优先权和特权,包括股息、清算和 投票权。可能发行的其他类别或系列股票的持有人的权利可能优于我们普通股持有人的权利。指定和发行具有优先权的股本股份可能会对我们普通股股份附带的其他 权利产生不利影响。
我们 将在内华达州法律允许的最大范围内对我们的高级管理人员和董事进行赔偿和保护,并保持其无害。
我们的章程规定,我们将在内华达州法律未禁止的最大程度上,对我们的高级管理人员和董事因我们的活动而提出的索赔进行赔偿并使其无害。如果我们被要求根据我们的赔偿协议履行义务,那么我们为此目的花费的资产的 部分将减少我们业务的其他可用金额。
| 19 |
根据2012年的《就业法案》,我们 是一家“新兴成长型公司”,我们无法确定适用于新兴成长型公司的信息披露要求的降低是否会降低我们的普通股对投资者的吸引力。
我们 是2012年Jumpstart Our Business Startups Act(“JOBS Act”)中定义的“新兴成长型公司”,我们可以利用不适用于其他非“新兴成长型公司”的上市公司的各种报告要求的某些豁免,包括但不限于,不需要遵守萨班斯-奥克斯利法案第404条的审计师认证要求 ,减少我们定期报告和委托书中关于高管薪酬的披露义务,免除对高管薪酬进行不具约束力的咨询投票的要求,以及免除股东批准之前未批准的任何黄金降落伞付款的要求。我们无法预测投资者是否会发现我们的普通股 吸引力降低,因为我们可能依赖这些豁免。如果一些投资者因此发现我们的普通股吸引力下降,我们的普通股交易市场可能会变得不那么活跃,我们的股价可能会更加波动。
此外,《就业法案》第107条还规定,“新兴成长型公司”可以利用1933年《证券法》(《证券法》)第7(A)(2)(B)节规定的延长过渡期来遵守新的或修订的会计准则。换句话说,“新兴成长型公司”可以推迟采用某些会计准则,直到这些准则适用于非上市公司。我们选择利用延长的过渡期来遵守新的或修订的会计准则。
根据《证券法》的有效注册声明,我们 将一直是一家“新兴成长型公司”,直至本财年的最后一天,即根据证券法的有效注册声明首次出售我们的普通股的五周年纪念日,尽管如果我们的收入超过10.7亿美元,如果我们在三年内发行了超过10亿美元的不可转换债券, 或者如果截至我们最近 第二财季结束的最后一天,我们由非关联公司持有的普通股的市值超过7亿美元,我们将更快失去这一地位。
如果投资者 认为我们的财务会计不如我们行业的其他公司透明,他们可能无法将我们的业务与我们行业的其他公司进行比较。如果我们无法在需要时筹集额外资本,我们的财务状况和 经营业绩可能会受到重大不利影响。
由于我们的首席执行官兼董事首席执行官Vininder Singh控制着我们有投票权的股本中的相当数量的股份,他 有效地控制了需要股东批准的行动。
董事首席执行官维尼德·辛格先生实益拥有公司约43%的普通股。因此,辛格先生对提交给我们股东批准的事项的结果具有重大影响力,包括 董事选举以及我们所有或几乎所有资产的任何合并、合并或出售。因此,购买股票的任何投资者都将是少数股东,因此对我们的方向和董事选举几乎没有发言权。 此外,这种所有权集中可能会通过以下方式损害我们普通股的市场价格:
| ● | 推迟、推迟或阻止公司控制权的变更; |
| ● | 阻碍涉及我们的合并、合并、接管或其他业务合并;或 |
| ● | 阻止潜在收购者提出收购要约或以其他方式试图控制我们。 |
| 20 |
有关前瞻性陈述的警示性说明
本招股说明书包含涉及重大风险和不确定性的前瞻性陈述。前瞻性陈述主要包含在“招股说明书摘要”、“风险因素”、“管理层讨论”、“财务状况和经营结果分析”和“业务”部分,但也包含在本招股说明书中。 在某些情况下,您可以通过“可能”、“可能”、“将会”、“可能”、“将会”、“应该”、“期望”、“打算”、“计划”等词语来识别前瞻性陈述。“目标”、“目标”、“预期”、“相信”、“估计”、“预测”、“项目”、“潜力”、“ ”、“继续”、“正在进行”、“目标”、“寻求”或这些术语的否定或其他类似的术语,旨在标识有关未来的陈述。本招股说明书中包含的前瞻性陈述包括但不限于以下陈述:
| ● | 我们未来的财务业绩,包括我们的收入、收入成本、运营费用和盈利能力; |
| ● | 我们的现金和现金等价物是否足以满足我们的流动性需求; |
| ● | 我们对房地产开发、数字转型技术和生物健康业务及其各自的市场趋势的预测 ; |
| ● | 我们的 能够吸引和留住我们所有业务部门的客户购买我们的产品和服务 ; |
| ● | 为我们这样规模较小的上市公司提供融资; |
| ● | 我们 有能力在我们的三个主要业务市场成功扩张,并进入新市场和行业垂直市场 ;以及 |
| ● | 我们 有效管理我们的增长和未来支出的能力。 |
我们 提醒您,上述列表可能不包含本招股说明书中所作的所有前瞻性陈述。
这些 陈述涉及已知和未知的风险、不确定性和其他因素,可能会导致我们的实际结果、活动水平、业绩或成就与这些前瞻性陈述中明示或暗示的信息大不相同。尽管我们 相信本招股说明书中包含的每一项前瞻性陈述都有合理的依据,但我们提醒您,这些陈述 是基于我们目前已知的事实和因素以及我们对未来的预期,而我们不能确定这些事实和因素。
您 应参考本招股说明书的“风险因素”部分,讨论可能导致我们的实际 结果与我们的前瞻性陈述中明示或暗示的结果大不相同的重要因素。因此,在这些因素中,我们不能向您保证本招股说明书中的前瞻性陈述将被证明是准确的。此外,如果我们的前瞻性陈述 被证明是不准确的,这种不准确可能是实质性的。鉴于这些前瞻性陈述中存在重大不确定性, 您不应将这些陈述视为我们或任何其他人对我们将在任何特定时间范围内实现我们的目标和计划的声明或保证。我们没有义务公开更新任何前瞻性陈述,无论是由于新信息、未来事件或其他原因,除非联邦证券法要求。
您 应完整阅读本招股说明书以及我们在本招股说明书中引用并已作为注册说明书的一部分提交的文件,并了解我们未来的实际结果可能与我们预期的大不相同 。我们通过这些警告性声明来限定我们所有的前瞻性声明。
| 21 |
使用收益的
假设 出售786,938股公司股票和公司权证,假设合并价格为每股公司股票和公司权证6.63美元 ,我们的普通股最后一次公布的销售价格是2024年1月25日纳斯达克资本市场报告的 ,而不出售假设组合价格为每股预筹资金权证和公司权证6.629美元的预融资权证和公司权证,在扣除估计的承销商折扣和费用以及我们应支付的发售费用后,我们预计 将从此次发行中获得约4,546,007美元的净收益。如果承销商完全行使其超额配售选择权,我们估计,在扣除承销商折扣和估计的 我们应支付的发售费用后,我们的净收益约为5,257,399美元。
假设本招股说明书封面所载本公司发售的股份数目保持不变,假设本公司股票及认股权证的合并公开发行价每增加(减少)$1.00$1.00,本公司的净收益将增加(减少)约$786,938美元。我们还可以 增加或减少我们提供的公司股票和公司认股权证的数量。假设假设合并公开发行价保持不变,并在扣除估计承销折扣和佣金后,我们的公司股票和公司认股权证数量每增加(减少)100,000股,我们获得的净收益将增加(减少)约 $603,330。
截至本招股说明书发布之日,我们不能肯定地说明我们从此次发行中获得的净收益的所有特定用途。因此,我们将保留对这些收益的使用(如果有的话)的广泛酌情权。一般来说,我们打算将从此次发行中获得的净收益 用于一般和营运资本目的,包括但不限于投资于研究和开发,包括我们的技术。
分红政策
普通股持有者 有权从合法可用资金中按比例获得董事会宣布的股息。我们自成立以来没有支付任何股息,目前我们预计,如果有任何收益,将保留 用于我们的业务发展。未来对股息的任何处置将由我们的董事会酌情决定,并将取决于我们未来的收益、运营和财务状况、资本要求和其他因素。
大写
下表列出了我们截至2023年9月30日的现金、现金等价物、资本和负债情况:
| ● | 以实际为基础;以及 | |
| ● | 在扣除估计承销折扣及佣金及吾等应支付的估计发售费用后,按经调整基准的备考数字 按假设的每股6.63美元的合并公开发售价格出售本公司股份及附带的公司认股权证。 |
| 22 |
以下 备考信息仅供参考,我们在本次发行完成后的资本总额将根据本公司股票和公司认股权证的综合公开发行价以及本次发行的其他定价条款进行调整。您应阅读下表,同时阅读本招股说明书的“收益使用”和 “管理层对财务状况和经营结果的讨论和分析”部分 以及我们的合并财务报表和本招股说明书其他部分的相关说明。
| 2023年9月30日(未经审计) | ||||||||
| 实际 | PRO 表格(1)(2)(3) | |||||||
| 现金和现金等价物 | $ | 3,856,037 | $ | 8,402,044 | ||||
| 债务 | $ | 446,050 | $ | 446,050 | ||||
| 股东亏损: | ||||||||
| A系列可转换优先股,面值0.00001美元,授权5,500,000股;73,449股已发行和已发行(实际);73,449股已发行和已发行(预计) | 1 | |||||||
| 普通股,面值0.00001美元,授权100,000,000股;6,094,644股已发行和已发行(实际); 6,881,582股已发行和已发行(预计) | 61 | 69 | ||||||
| 额外实收资本 | 12,226,742 | 16,772,741 | ||||||
| 累计赤字 | (8,457,978 | ) | (8,457,978 | ) | ||||
| 股东总亏损额 | 3,768,826 | 8,314,833 | ||||||
| 总市值 | $ | 3,768,826 | $ | 8,314,833 | ||||
| (1) | 反映 在本次发行中以每股6.63美元的假定公开发行价格出售公司股票,并在扣除 预计承销折扣和预计我们应付的发行费用。预计信息仅供参考, 我们将根据实际公开发行价格和定价时确定的本次发行的其他条款对这些信息进行调整。 |
| (2) | 每个 假设每股公司股票和公司认股权证的合并发行价为6.63美元,如果增加(减少)1.00美元, 增加(减少)现金及现金等价物、营运资金、总资产和总股东的预计金额 股权(赤字)约786,938美元,假设我们提供的证券数量,如封面所示 在扣除承销折扣和佣金以及预计发行费用后,本招股说明书第页的金额保持不变 由我们支付。同样,每增加(减少)100,000股公司股份和 假设每股公司股票和随附公司认股权证的合并公开发行价格,将增加(减少) 现金及现金等价物、营运资本、总资产和总股东权益的调整后的备考金额 (亏损)约786,938美元。 |
| (3) | 如果 承销商以任何组合购买最多118,040股公司股票和/或公司认股权证的选择权 其中,行使我们将收到约711,391美元的额外净收益,基于假设的合并公共 发行价为每股公司股票和公司权证6.63美元,扣除估计承销折扣和佣金后 以及我们应付的预计发行费用;以及(ii)现金及现金等价物、股东权益总额和资本总额 也将增加约0.73美元。 |
上表中列出的实际和预计信息中反映的普通股股份总数不包括:
| ● | 认股权证 购买2,893,954股普通股发行的IPO单位的一部分,平均行使价为每股7.96美元,到期日为 2028年2月13日; | |
| ● | 认股权证 以每股5.29美元的行使价购买108,849股普通股,条款将于2026年4月1日至2026年2月到期。 13,2028年; | |
| ● | 认股权证 以每股2.64美元的行使价购买403,890股普通股,条款将于2026年4月1日至5月到期。 3,2032年; | |
| ● | 选项 以每股4.41美元的加权平均行使价购买438,500股普通股; | |
| ● | 认股权证 以每股0.0007美元的行使价购买274,284股普通股,条款于2030年2月7日到期; | |
| ● | 认股权证 以每股2.50美元的行使价购买115,185股普通股,条款于2031年8月19日到期。 |
稀释
如果 您在本次发行中购买了公司股票和公司认股权证,您的所有权权益将被稀释到每股公司股票和随附公司认股权证的合并公开发行价格与本次发行后立即调整的每股普通股有形 账面净值之间的差额 。我们在本讨论中提供的部分信息 是形式上的,以进一步影响我们以每股公司股份和公司认股权证6.63美元的假设合并公开发行价格 发行和销售786,938股公司股票和随附的公司认股权证 ,扣除估计承销 折扣和佣金以及我们应付的估计发行费用。
截至2023年9月30日,我们普通股的 有形账面净值为3,768,826美元或每股0.62美元。每股净有形账面价值 代表我们的有形资产总额(不包括递延发行成本,截至2023年9月30日为0美元减去我们的总负债, 除以已发行普通股的股数)。
| 23 |
在 进一步实现我们在本次发行中出售786,938股公司股票和随附公司认股权证 的净收益后,假设合并公开发行价格为每股公司股票和公司认股权证6.63美元,扣除 估计承销折扣和佣金以及我们应付的估计发行费用,截至2023年9月30日,我们的备考有形账面净值约为8,760,883美元,即每股1.27美元。这一金额代表了我们现有股东每股0.65美元的形式净有形账面价值的立即 增加,以及在本次发行中购买公司股票的新投资者每股5.36美元的立即稀释。
我们 通过从参与本次发行的投资者支付的假设公开发行价格中减去本次发行后调整后的每股有形账面净值形式来确定参与本次发行的投资者的每股摊薄。 下表说明了对新投资者的每股摊薄情况:
| 每股公司股份和公司认股权证的假设公开发行价格 | $ | 6.63 | ||
| 截至2023年9月30日的每股有形账面净值 | $ | 0.62 | ||
| 预计2023年9月30日每股有形账面净值(亏损) | $ | 1.27 | ||
| 备考增加,调整后每股有形账面净值可归因于新投资者购买股票 | $ | 0.65 | ||
| 预计为本次发行后调整后的每股有形账面净值 | $ | 1.27 | ||
| 在此次发行中向新投资者摊薄每股有形账面净值 | $ | 5.36 |
假设本招股说明书封面所载的本公司股份及随附的公司认股权证数目保持不变,假设本公司股份及公司认股权证的合并发行价每增加(减少)1.00美元,预计每股有形账面净值将增加(减少)786,938美元,每股对新投资者的摊薄将增加(减少)(1.00美元)。
同样,假设假定的合并公开发行价格6.63美元保持不变,我们每增加(减少)100,000股公司股票和伴随公司认股权证,我们的预计有形账面净值将增加(减少)约603,330美元,或每股0.68美元,并将对参与此次发行的新投资者的每股摊薄 减少(增加)5.53美元。
以上讨论的备考信息仅为说明性信息,将根据实际合并的公开发行价格、股份数量和定价时确定的本次发行的其他条款进行更改。
如果 承销商行使选择权,在本次发行中按假设的每股公司股票和认股权证6.63美元的合并公开发行价全额购买额外的公司股票和/或公司认股权证,并假设我们在本招股说明书封面上提出的公司股票和配套公司认股权证的数量保持不变,扣除 预计承销折扣和佣金以及估计发行费用后,预计有形账面净值约为每股1.35美元。此次发行对投资者的预计每股有形账面净值稀释约为每股5.28美元。
下表汇总了截至2023年9月30日,根据上述调整后的备考基准,我们普通股的股份数量, 总对价和每股平均价格(I)由现有股东支付给我们,以及(Ii)由新投资者在本次发行中购买我们的普通股,假设的公开发行价为每股公司股票和公司认股权证6.63美元 在扣除承销折扣和佣金以及估计发售费用之前。
| 购入的股份 | 总对价 | 每件商品的平均价格 | ||||||||||||||||||
| 数 | 百分比 | 金额 | 百分比 | 分享 | ||||||||||||||||
| 现有股东 | 6,094,644 | 88.6 | % | $ | 12,224,742 | 70.1 | % | $ | 2.01 | |||||||||||
| 新投资者 | 786,938 | 11.4 | % | $ | 5,217,399 | 29.9 | % | $ | 6.63 | |||||||||||
| 总计 | 6,881,582 | 100.0 | % | $ | 17,444,141 | 100.0 | % | $ | 2.53 | |||||||||||
此外,如果承销商行使选择权全数购买额外的公司股票和/或公司认股权证,则在本次发行结束时,现有股东持有的普通股数量将减少至普通股总数的2.7% ,参与此次发行的新投资者持有的普通股数量将进一步增加118,041股,或本次发行结束时普通股总数的2.7%。
| 24 |
假设本招股说明书封面所载的公司股份及随附的公司认股权证数目保持不变,假设假设公司股份及公司认股权证的合并发行价每增加(减少)1.00美元,新投资者支付的总代价将增加(减少)约938,938美元。我们还可以增加或减少我们提供的公司股票和附带的公司认股权证的数量。假设假设的综合公开发行价保持不变,在扣除估计的承销折扣和佣金后,我们每增加(减少)100,000股公司股票和配套的公司认股权证 将增加(减少)新投资者支付的总对价约603,330美元。
上表中列出的实际和预计信息中反映的普通股股份总数不包括:
| ● | 认股权证 购买2,893,954股普通股发行的IPO单位的一部分,平均行使价为每股7.96美元,到期日为 2028年2月13日; | |
| ● | 认股权证 以每股5.29美元的行使价购买108,849股普通股,条款将于2026年4月1日至2026年2月到期。 13,2028年; | |
| ● | 认股权证 以每股2.64美元的行使价购买403,890股普通股,条款将于2026年4月1日至5月到期。 3,2032年; | |
| ● | 以加权平均行权价每股4.21美元购买635,500股普通股的期权 ; | |
| ● | 认股权证 以每股0.0007美元的行使价购买274,284股普通股,条款于2030年2月7日到期; | |
| ● | 认股权证 以每股2.50美元的行使价购买115,185股普通股,条款于2031年8月19日到期。 |
以上 讨论和表格假定不行使认股权证。只要认股权证被行使,任何未偿还的权证或期权被行使,任何未偿还的可转换票据被转换为任何未偿还的限制性股票单位归属,或者新的 期权或限制性股票单位被发行我们的股权激励计划,您可能会经历进一步的稀释。此外,由于市场状况或战略考虑,我们可能会选择 筹集额外资本,即使我们认为我们有足够的资金用于当前或未来的运营计划。如果额外资本是通过出售股权或可转换债务证券筹集的, 这些证券的发行可能会进一步稀释我们的股东。
股本说明
以下对本公司股本的重大条款以及本公司经修订及重述的公司章程及细则的条文的描述为摘要,并以经修订及重述的公司细则及细则副本为参考而有保留, 作为本招股说明书的证物存档于本公司的注册说明书内。
一般信息
我们的法定股本包括100,000,000股普通股,每股面值0.00001美元,以及10,000,000股优先股,每股面值0.00001美元,其中包括5,500,000股A系列优先股。
普通股 股票
普通股 流通股
截至2024年1月25日,已发行普通股数量为6,094,644股。
投票权
每一股普通股使股东有权亲自或委托代表在股东会议上投一票。持有者不允许 累计投票。
分红 权利
普通股持有者 有权从合法可用资金中按比例获得董事会宣布的股息。
清算时的权利
在我们清算、解散或清盘时,我们普通股的持有者将有权按比例分享在偿还我们所有债务和其他债务后可分配给股东的合法净资产。
其他 权利
我们普通股的持有者 没有任何优先购买权或其他认购权、转换权、赎回或偿债基金条款。
| 25 |
优先股 股票
优先股 已发行股票
截至2024年1月25日,已发行和已发行的A系列优先股共有73,449股。
转换 权限
A系列优先股的每名 持有人可不时将A系列优先股的任何或全部此类持有人的股份转换为缴足股款且不可评估的普通股,其金额相当于交出的每1股A系列优先股换10股普通股。
A系列优先股的持有者无权转换A系列优先股,条件是在转换时,将收到的普通股数量,连同转换日期持有人及其关联公司实益拥有的普通股数量,将导致持有者及其关联公司在转换日期实益拥有超过4.99%的公司普通股流通股。
投票权
A系列优先股的每个 持有者没有投票权。
清算时的权利
在我们清算、解散或清盘时,我们A系列优先股的持有人将不享有任何清算优先权 ,并将获得任何清算,就像他们被转换为普通股一样。
认股权证
公司 认股权证
本招股说明书所属的注册说明书还登记出售公司认股权证,最多可购买786,938股普通股 (或904,978股普通股,如果承销商全面行使超额配售选择权)。
每份公司认股权证可行使一股我们的普通股,假定初始行权价等于每股7.29美元(假设行权价等于每股公开发行价),自本次发行结束之日起至多五(5)年内的任何时间。本次发行中发行的公司认股权证将受公司认股权证的条款管辖。 在公司认股权证被行使之前,公司认股权证持有人不会被视为我们相关普通股的持有人。
在以下所述的若干限制的规限下,本公司认股权证可于截止日期发行时立即行使,并于截止日期五周年时失效 。除有限的例外情况外,公司认股权证持有人将无权行使其公司认股权证的任何部分,条件是该持有人(连同该持有人的联营公司,以及作为一个团体与该持有人或任何该持有人的联属公司一起行事的任何人士)将实益拥有超过4.99%(或在发行日期前经买方选择,为9.99%)的当时已发行普通股的4.99%以上的普通股 。
在 持有人行使公司认股权证后,我们将在收到行使通知后的两个交易日内 发行因行使公司认股权证而可发行的普通股,前提是已支付行使价(除非 通过“无现金”行使条款在允许的范围内行使)。在行使任何公司认股权证以 购买普通股之前,公司认股权证持有人将不享有 行使时购买的普通股持有人的任何权利,包括投票权,除非其中规定。
权证持有人只有在以下情况下方可行使公司认股权证:在行使公司认股权证时发行普通股时,必须有有效的登记声明,或根据证券法和持有人所在州的证券法,可获豁免登记。我们打算尽商业上合理的努力使注册说明书在公司认股权证行使时生效,本招股说明书是注册说明书的一部分。公司认股权证持有人必须在行使公司认股权证时以现金支付行使价 ,除非没有有效的登记声明,或如有需要,没有 有效的州法律登记或豁免发行公司认股权证的股份(在这种情况下,公司认股权证只能通过“无现金”行使条款行使)。
我们 不打算申请在任何证券交易所或其他交易系统上市本公司认股权证。
| 26 |
预付资金 认股权证
术语“预配资金”是指我们在本次发行中的普通股购买价格几乎包括将根据预配资金认股权证支付的全部 行使价6.629美元,但名义剩余行使价0.001美元除外。 预先注资认股权证的目的是使可能对其能力有限制的投资者能够实益拥有超过 4.99%(或,在持有人的选择,9.99%),我们已发行的普通股完成后,本次发行的机会 ,使投资于该公司,而不会触发他们的所有权限制,通过接收预先注资认股权证代替我们的 普通股,这将导致超过4.99%(或9.99%)的所有权,并获得在稍后日期以该名义价格行使其购买预先注资认股权证相关股份的选择权的能力。
每一 预先注资认股权证可在 预先注资认股权证尚未行使的任何时间行使一股我们的普通股,行使价等于每股0.001美元。预先注资认股权证并无到期日。在预注资认股权证被行使之前,预注资认股权证 的持有人将不被视为我们基础普通股的持有人。
除 有限的例外情况外,如果 持有人(连同该持有人的关联公司,以及与该持有人或任何该 持有人的关联公司一起作为一个集团行事的任何人)将实益拥有超过4.99%的普通股股份。(或,在发行日期之前,购买者选择9.99%)我们的普通股,然后在执行该行使后发行在外的股份。
在资本重组事件、股票股息、股票拆分、股票合并、重新分类、重组或影响我们普通股的类似事件 发生时, 行使价和行使预先注资认股权证时可发行的股票数量将进行适当调整。预先注资认股权证持有人必须在行使预先注资认股权证时以现金支付行使价, 除非该等预先注资认股权证持有人正在使用预先注资认股权证的无现金行使条款。
在 持有人行使预先注资认股权证后,我们将在收到行使通知后的两个交易日内发行因行使预先注资 认股权证而可发行的普通股,前提是已支付行使价 (除非通过“无现金”行使条款在允许的范围内行使)。在行使任何预先注资 认股权证以购买普通股之前,预先注资认股权证的持有人将不享有行使时购买的普通股 持有人的任何权利,包括投票权,除非其中规定。
权证 持有人只有在行使预配资权证 时发行普通股的情况下,才可以行使预配资权证 ,前提是有效的登记声明涵盖了发行普通股的情况,或者根据《证券法》和持有人所在州的证券法 ,可以豁免登记。我们拟作出商业上合理的努力,使本招股章程所载的登记声明 于预拨资金认股权证获行使时生效。预先注资认股权证持有人必须在行使预先注资认股权证时以现金支付 行使价,除非没有有效的登记声明,或 (如需要)没有涵盖发行预先注资认股权证相关股份的有效州法律登记或豁免(在此情况下,预先注资认股权证只能通过“无现金”行使条款行使)。
如果我们完成了与他人的合并或整合,或其他重组事件,其中我们的普通股 被转换或交换为证券、现金或其他财产,或我们出售、租赁、许可、转让、转让、让与或以其他方式 处置我们的全部或绝大部分资产,或我们或其他人获得50%或以上的普通股流通股, 在该事件发生后,预先注资认股权证的持有人将有权在行使该预先注资认股权证时收取 与持有人在紧接该基本交易之前行使其预先注资认股权证时所收取的相同种类及金额的证券、现金或财产。我们的任何继任者或存续实体应承担预先注资 权证项下的义务。
我们 无意申请预先注资认股权证在任何证券交易所或其他交易系统上市。
承销商的认股权证
作为本招股说明书一部分的 登记声明还登记了向承销商代表购买最多47,216股 普通股的销售权证,作为应向承销商支付的与本次发行 相关的承销补偿的一部分。承销商认股权证将在发行生效日期起六个月至发行生效日期起五年期间内行使,行使价等于普通股公开发行价格的110%。有关该等认股权证的描述,请参阅“包销-包销商认股权证”。
授权代理
预先出资的认股权证及公司认股权证将根据吾等与吾等的认股权证代理VStock Transfer LLC(“认股权证代理”)之间的认股权证代理协议(“认股权证代理协议”)以注册形式发行。预出资认股权证和公司认股权证的重要条款列于此,权证代理协议副本 已提交美国证券交易委员会,作为注册说明书的证据,本招股说明书是其中的一部分, 通过引用并入本文。
股票 期权
截至2023年9月30日,我们共发行了458,500份股票期权。我们的董事和首席财务官被授予股票 期权,以购买总计195,000股额外的公司普通股。这些期权的行权价在2.80美元至6.82美元之间,期限为10年。2023年4月16日,公司向董事、埃尔西先生、恩赖特先生和汉森先生发行了40,000份股票期权,行权价为每股6.82美元,期权期限为10年。2023年3月17日,公司 向我们的首席财务官Saglio先生发行了75,000份股票期权,行权价为每股2.80美元,期限为10年。 我们的员工获得了股票期权,可以购买总计196,500股普通股,这些股票的期限为10年,行权价在2.80美元到5.45美元之间。我们还授予服务提供商购买总计67,000股普通股的股票期权,这些股票的期限为10年,行权价在2.59美元到5.45美元之间。使用布莱克-斯科尔斯估值模型的2023年股票期权的相对公允价值总计738,600美元。截至2023年9月30日,根据2022年股权激励计划,该公司拥有461,500个授权但未发放的股权奖励 。
反收购 内华达州法律条款、公司章程和我们的附则
我们的公司章程和章程包含某些条款,可能会延迟、推迟或阻止一方获得对我们的控制权,并鼓励考虑主动收购要约或其他单方面收购提议的人 与我们的董事会进行谈判,而不是进行非谈判的收购尝试。根据我们的公司章程和章程,我们普通股的持有人和优先股的持有人在选举我们的董事时都没有累计投票权。少数股东目前持有我们相当大一部分已发行和已发行普通股,再加上缺乏累计投票权,这使得其他股东更难取代我们的董事会,或者 第三方更难通过更换我们的董事会来获得对我们公司的控制权。
如果适用,内华达州修订法规(“NRS”)的以下条款可能会阻止对本公司的收购 。
与利益相关股东的交易 。NRS禁止上市的内华达州公司在股东成为利益股东之日起三年内与利益相关的股东进行任何业务合并,除非在该日期之前,公司董事会批准了业务合并本身或导致股东成为利益股东的交易。
| 27 |
“利益股东”是指直接或间接实益拥有公司10%或以上已发行有表决权股票的任何实体或个人,以及与这些实体或个人有关联、控制或控制的任何实体或个人。“企业合并”的定义非常宽泛,几乎涵盖了任何类型的交易,使潜在的收购人能够利用公司的资产为收购提供资金或以其他方式使自己的利益受益 而不是公司及其股东的利益。
此外,未经批准而在三年等待期之后发生的企业合并也可以被禁止 ,除非得到董事会和股东的批准,或者利害关系股东支付的价格等于(I)利害关系股东在紧接企业合并公告日期前3年内支付的每股最高价格或在其成为利害关系股东的交易中支付的最高价格,以较高者为准;(Ii)业务合并公告日期或有利害关系的股东收购股份之日的每股普通股市值,两者以较高者为准;或。(Iii)如优先股持有人较高,则优先股的最高清算价值。
收购控股权。《国税法》包含有关收购“控股权”的条款,并规定 任何人如收购“发行公司”20%或以上的已发行有表决权股份,定义为拥有200名或以上股东,其中至少有100名内华达州居民的内华达州公司(如该公司的股票分类账所述);并且直接或通过关联公司在内华达州开展业务,可被剥夺对所收购股份的投票权,除非该公司的大多数无利害关系的股东选择全部或部分恢复此类投票权 。
法规侧重于收购“控股权益”,其定义为拥有足够的流通股, 如果没有控制权股份法,收购人可以直接或间接、单独或与他人联合行使:(I)五分之一或以上,但不到三分之一;(Ii)三分之一或以上,但少于多数;或(Iii)公司在董事选举中的多数或 更多投票权。
是否授予投票权的问题 股东只能考虑一次,一旦做出决定,就不能 重新讨论。此外,除非公司的公司章程或章程另有规定:(1)如果收购人没有及时向发行公司提供信息声明,或者如果股东投票决定不授予收购人的证券投票权 ,发行公司可按30天内为该证券支付的平均价格赎回全部或部分获得表决权的证券;以及(2)如果投票权授予收购人,则投票反对授予投票权的任何股东可要求以公允价值向发行公司购买其全部或任何部分证券。
本节的规定不适用于根据继承法和分配法、判决的执行、担保权益的清偿、或与某些合并或重组有关的收购。
上市
我们的普通股和可交易认股权证分别在纳斯达克资本市场上市,代码为“BFRG”和“BFRGW”。 我们没有也不打算申请将预融资权证或本公司权证在 纳斯达克资本市场上市。
转接 代理和注册表
我们普通股的转让代理和登记商是VStock Transfer,LLC。
| 28 |
管理层对财务状况和经营结果的讨论和分析
以下对本公司财务状况和经营结果的讨论和分析应结合本招股说明书其他部分中标题为“选定的综合财务和其他数据”的章节以及综合财务报表和相关附注 阅读。本讨论包含涉及风险和不确定性的前瞻性陈述。我们的 实际结果可能与下面讨论的结果大不相同。可能导致或导致此类差异的因素包括但不限于以下确定的因素和本招股说明书中其他部分的“风险因素”部分中讨论的因素 。
概述
牛蛙人工智能控股公司于2020年2月6日在内华达州注册成立。牛蛙人工智能控股公司是牛蛙人工智能公司和牛蛙人工智能管理有限公司的母公司,这两家公司分别于2017年和2021年在特拉华州和马里兰州注册成立。业务 目前通过牛蛙AI Holdings,Inc.进行,该公司于2020年2月6日开始运营。我们是一家专注于对医学进步中的复杂数据进行高级人工智能/机器学习(AI/ML)分析的公司。我们的AI/ML平台(商标:bfLEAP™)是由约翰霍普金斯大学应用物理实验室(JHU-APL)最初开发的技术创建的。
2018年2月,Bullfrog AI Holdings从JHU-APL获得了该技术的原始独家全球版税许可。 该许可证涵盖三(3)项已颁发的专利、一(1)项新的临时专利申请、 算法专有库的非专利权以及包括修改和改进在内的其他商业机密。我们于2022年7月签订了一份许可协议,该协议为 公司提供了新的知识产权,并涵盖了2018年2月许可的大部分知识产权。我们的 目标是利用bfLEAP™与生物制药合作者 以及我们自己的内部临床开发计划一起进行药物开发的精确医学方法。我们相信bfLEAP™平台非常适合评估转化研究和临床试验环境中生成的临床前 和临床试验数据,从而更快、更便宜地获得药物批准。
我们的 目标是提高药物开发各个阶段的成功几率,从早期临床前到后期临床 开发。我们的最终目标是利用bfLEAP™来实现正在进行的临床试验的成功或挽救晚期 失败药物(即,2期或3期临床试验失败)进行开发和剥离;尽管如此,我们也将考虑早期药物的合作 。我们希望通过战略性收购当前临床阶段和失败的药物进行内部开发,或通过与生物制药行业公司的战略合作伙伴关系来实现这一目标。
On July 8, 2022, the Company entered into an exclusive, worldwide, royalty-bearing license from JHU-APL for the additional technology. The new license provides additional intellectual property rights including patents, copyrights, and knowhow to be utilized under the Company’s bfLEAP™ analytical AI/ML platform. In consideration of the new license, the Company issued to JHU-APL 39,879 shares of common stock. In September 2020 and October of 2021, the Company executed amendments to the original license which represents improvements and new advanced analytics capabilities. In consideration of the rights granted to the Company under the original License Agreement, the Company granted JHU 178,571 warrants exercisable to purchase shares of common stock at $2.10 per share. Under the terms of the new License Agreement, JHU will be entitled to eight percent (8%) of net sales for the services provided by the Company to other parties and three percent (3%) for internally developed drug projects in which the JHU license was utilized. The new license also contains tiered sub licensing fees that start at 50% and reduce to 25% based on revenues. On May 31, 2023, the Company and JHU-APL entered into Amendment number 1 of the July 8, 2022 License Agreement whereby the Company gained access to certain improvements including additional patents and knowhow in exchange for a series of payments totaling $275,000. The first of these payments for $75,000 was due in July 2023 followed by annual payments of $75,000, $75,000 and $50,000 in years 2024, 2025 and 2026, respectively. The amendment also reduced the 2023 minimum annual royalty payment to $60,000, all other financial terms remain the same. As a result of this Amendment, the minimum annual payments are set to be $30,000 for 2022, $60,000 for 2023, and $300,000 for 2024 and beyond, all of which are creditable by royalties.
| 29 |
我们 打算继续发展和改进bfLEAP™,无论是在内部还是与JHU-APL等开发伙伴合作。我们计划利用我们几年来在世界顶级创新机构之一开发的专有AI/ML平台,该机构已经 在多个行业成功应用。
我们 利用首次公开募股的资金为我们的业务配备了人员,并建立了合作伙伴关系,最近 完成了我们与领先的罕见疾病非营利性组织的第一份商业服务合同,用于对晚期临床数据进行AI/ML分析 。我们还从大学获得了一系列临床前和早期临床药物资产的权利,以及与世界知名研究机构的战略合作,以创建HSV1病毒治疗平台,为各种疾病设计免疫疗法 。我们已经与JHU签署了针对胶质母细胞瘤(脑癌)、胰腺癌等的抗癌药物的全球独家许可协议。我们还签署了乔治华盛顿大学另一种针对肝细胞癌(肝癌)和其他肝病的抗癌药物的全球独家许可。此外,我们打算通过合作伙伴关系或获得药物救援失败的候选治疗药物的权利, 获得后期临床资产。在 某些情况下,我们打算进行后期临床试验,以挽救之前失败的治疗资产。 在这些情况下,将要求药品供应和监管服务进行临床试验。我们临床开发计划的成功将需要找到合作伙伴来支持临床开发,为我们的研发和临床试验提供足够的原材料和/或药物产品,在某些情况下,还可能需要建立第三方安排,以获得根据(GMP)行业标准指南适当制造并包装用于临床或销售的成品药物。 由于我们是一家专注于使用我们的人工智能技术来推动药物发展的公司,任何临床开发计划在所有情况下都将需要 合作伙伴以及为执行和完成临床试验而建立的第三方关系。在接下来的24个月里,该公司预计将在提供服务的产品、临床前IND支持活动和研发上花费约210万美元,以使我们能够在未来的临床试验中评估我们的药物资产以确定新的疾病适应症。
自2023年2月14日完成首次公开募股以来,在收到首次公开募股收益的帮助下,我们启动了几项举措:投资者关系和营销,以促进和提高公司在金融和商业领域的知名度,研发,与J·克雷格·文特尔研究所的合作 ,并在截至2023年9月30日的季度,完成了我们的甲苯咪唑前体药物 计划的临床前研究。该公司正积极开发和寻找新的知识产权,努力不断发展其AI/ML平台。此外,该公司还聘请了一家专门从事生物制药行业的业务发展公司 ,以寻找并确保我们的甲苯咪唑计划的战略发展合作伙伴。
在内部, 公司增加了额外的员工,以加快执行,并开发用于为客户执行 分析服务的流程和定制脚本,同时还启动了针对大型公共卫生数据源的计划,并寻求访问 专有卫生数据源。我们还转变了我们的会计和财务报告系统和流程,以增强我们作为上市公司的内部控制环境。首次公开募股的资金还用于注销通过首次公开募股为公司提供资金的两笔票据,这两笔票据没有转换为普通股,以及随着时间的推移对我们的员工、员工和顾问积累的其他债务,以及与收购我们的特许药物计划相关的债务。
| 30 |
我们的 战略
该公司有一个独特的战略,旨在降低风险和增加现金流的频率。该战略的第一部分是通过与生物制药公司的战略关系创造收入。根据项目的具体范围,这些关系将构建为费用和 知识产权的组合。这些项目的目标将是发现有价值的见解 ,以降低风险和/或提高药物开发过程的速度,这可以通过将 手动或自动集成到客户的工作流程或分析离散数据集来实现。
在 未来,我们战略的第二部分涉及获得临床阶段药物的权利,使用我们的bfLEAP™技术 设计精确药物试验,与合作伙伴进行试验,并出售资产。这种方法也可能适用于药物开发过程的早期阶段,如发现和临床前。无论如何,我们的目标都是创造短期价值,并尽快退出并实现盈利,最好是在大约30个月内。
关键会计政策和估算
我们的财务报表根据美国公认会计准则编制。在编制这些财务报表时,我们需要做出影响资产、负债、收入和费用报告金额以及相关披露的估计和假设。我们会持续评估我们的估计和假设。我们的估计是基于历史经验和各种其他假设, 我们认为在这种情况下是合理的。我们的实际结果可能与这些估计不同。我们的关键会计政策和估计没有发生重大变化,如我们的10-K报表所述。
财务 运营概述
收入
我们在2022年末通过向制药客户提供的服务获得了第一笔收入,而在2023年第3季度,我们完成了第一份商业服务合同,确认的收入为65,000美元。我们与两个组织签订了服务合同,目前 正在进行多次讨论,但无法保证在2023年签订其他服务协议和业务关系 。
运营费用
我们 将我们的运营费用分为两类:研发费用和一般管理费用。在2022年前,我们的大部分活动与:技术评估、收购和验证、资本收购和业务发展活动有关 我们相信这些活动已经为公司在探索战略合作和资产收购的同时获得合同服务做好了准备。 这些活动和相关支出已被记录并在我们的财务报表中报告为一般和行政。 2022年,我们从大学获得了两个药物开发项目的许可,并与JHU-APL签订了新的许可,用于新的IP和 与我们的bfLEAP™平台一起使用的其他增强功能。2022年,我们为我们的bfLEAP™AI/ML平台和我们来自大学的两个药物开发项目相应地花费了608,000美元用于与许可证相关的付款。我们预计,随着我们启动旨在开发服务产品、协作 (JCVI)和临床前研究的活动,以生成数据以支持研究新药(IND)申请的提交,我们的研发费用将在2024年增加。
| 31 |
研究和开发成本和费用
2022年的研发成本和支出主要包括与获得许可技术相关的成本。2023年,我们 启动了关于我们的许可候选药物的开发活动,以及我们与JCVI的发现合作。除了支付给外部服务提供商的费用外,我们还为从事这些工作的人员分配内部成本,以及与我们使用bfLEAP™开发产品和服务的内部工作相关的人员成本。我们预计,随着我们执行业务计划并开始进行临床前研究和开发活动,我们的研究和开发成本可能会变得很大。 旨在确保开发合作伙伴的安全,并为本申请中所述的我们的许可药物开发计划以及战略合作伙伴关系和我们可能收购的其他药物开发计划提交IND。研发费用 计入发生期间的运营费用。估计数将用于确定已执行服务但尚未开具发票的某些成本的费用负债。我们将通过与服务提供商的沟通来监控每个重要的外部服务合同的绩效水平,以反映实际支出金额。
一般费用 和管理费用
在 首次公开招股的预期中,物色了一支具有深厚行业经验的管理团队,并聘请他们担任员工和顾问,以协助本公司筹备首次公开招股,并随后作为一家上市公司运营和运作。截至2022年,主要活动 包括:技术评估、收购和验证、资本收购和业务开发活动,这些活动总体上使公司在探索战略合作伙伴关系和资产收购的同时,为合同服务做好了准备。2023年2月,公司实现了首次公开募股并在纳斯达克上市的目标。由于几个因素,我们2023年的一般和管理费用明显高于我们2022年的一般和管理费用。2023年的主要增长涉及 与上市公司相关的新成本,如D&O保险、支持美国证券交易委员会合规的专业服务 ,以及更高的工资和咨询费用,因为我们已经聘请了更多的员工和顾问。我们还加大了业务发展、投资者关系和营销力度。我们预计未来我们的一般和管理费用可能会增加,以支持与战略合作和协作相关的服务产品、临床和临床前研发活动 。
运营结果
截至2023年9月30日和2022年9月30日的三个月的比较
销售收入 和成本
我们 在截至2023年9月30日的三个月中确认了65,000美元的收入和5,200美元的销售成本,而2022年为零。
截至三个月 9月30日, | 净变化 | |||||||||||
| 2023 | 2022 | |||||||||||
| 运营费用: | ||||||||||||
| 研发 | $ | 380,015 | $ | 39,421 | $ | 340,594 | ||||||
| 一般和行政 | 983,929 | 601,131 | 382,798 | |||||||||
| 总运营费用 | $ | 1,363,944 | $ | 640,552 | $ | 723,392 | ||||||
研究和开发
与截至2022年9月30日的同期相比,我们截至2023年9月30日的三个月的研发费用增加了340,594美元,这主要是由于计入了2023年的工资和咨询费成本,以及根据2022年7月许可协议修正案1从JHU-APL获得与bfLEAP™相关的额外技术的成本。我们 还在2023年第三季度完成了与我们的甲苯咪唑计划相关的临床前研究。2022年,大部分研发费用与收购包括甲苯咪唑在内的两个候选药物开发产品直接相关。
常规 和管理
与截至2022年9月30日的同期相比,截至2023年9月30日的三个月,我们的一般和行政费用增加了382,798美元,这主要是由于工资和咨询成本增加,反映了服务水平的提高,以及 启动投资者关系和营销工作,以及我们的会计和财务报告流程转变为支持 上市公司。
| 32 |
其他 收入(费用),净额
与截至2022年9月30日的同期相比,截至2023年9月30日的三个月的利息支出减少了118,401美元,这是由于我们的大部分债务在2023年第一季度转换或偿还。其他收入增加56,906美元,原因是我们在隔夜清扫账户中持有的IPO收益赚取了利息 。
截至2023年9月30日和2022年9月30日的9个月的比较
销售收入 和成本
在截至2023年9月30日的9个月中,我们确认了65,000美元的收入和5,200美元的销售成本,而2022年的收入为零。
| 截至9月30日的9个月, | 净变化 | |||||||||||
| 2023 | 2022 | |||||||||||
| 运营费用: | ||||||||||||
| 研发 | $ | 1,023,619 | $ | 448,375 | $ | 575,244 | ||||||
| 一般和行政 | 3,067,940 | 1,424,383 | 1,643,557 | |||||||||
| 总运营费用 | $ | 4,091,559 | $ | 1,872,758 | $ | 2,218,801 | ||||||
研究和开发
截至2023年9月30日的9个月,我们的研发费用比截至2022年9月30日的同期增加了575,244美元,这主要是由于我们开始与J Craig Venter Institute合作并完成了我们的甲苯咪唑前体药物计划的临床前研究,以及根据2022年7月许可协议修正案1从JHU-APL获得与bfLEAP™相关的额外技术的成本。在 2022年,大部分研发费用直接与收购包括甲苯咪唑在内的两个候选药物开发产品有关。
常规 和管理
与截至2022年9月30日的同期相比,截至2023年9月30日的9个月,我们的一般和行政费用增加了1,643,557美元,这主要是由于工资和咨询成本增加,反映了服务水平的提高,以及投资者关系和营销工作的启动,以及我们的会计和财务报告流程的转变,以支持上市公司 。2023年期间还反映了与增加工作人员有关的大约120 000美元的征聘费用。
其他 收入(费用),净额
利息 截至2023年9月30日的9个月,与截至2022年9月30日的同期相比,利息支出减少了157,788美元,这是由于我们的大部分债务在2023年第一季度转换或偿还。截至2023年9月30日的9个月,票据转换亏损92,959美元,原因是转换可转换票据。其他收入增加142,218美元,原因是我们在隔夜清扫账户中持有的IPO收益产生了 利息。
2022年和2021年12月31日终了年度的业务结果比较
2022年末,该公司确认了其与一家小型制药公司签订的分析合同带来的10,000美元的第一笔服务收入。 该公司之前没有记录任何收入。截至2022年底,本公司的累计赤字约为4,399,000美元。2022年运营净亏损约为2,455,000美元,而2021年为555,000美元。2022年的增长反映了聘请顾问和顾问的全年成本,以及与准备公司首次公开募股相关的其他成本 ,包括与审计公司过去和当前财务报表相关的成本。2022年运营中使用的现金约为911,000美元,而2021年约为382,000美元;2022年融资活动的现金净流入约为967,000美元,2021年约为387,000美元。
| 33 |
流动性 与资本资源
于2022年,本公司从出售可转换桥梁票据所得款项净额约1,016,000美元,并偿还于2021年出售的无抵押本票49,000美元。该公司于2023年1月售出一张额外的本票,并收到净收益100,000美元。
在截至2022年12月31日的年度内,公司在经营活动上的支出约为911,000美元,而2021年同期的运营活动支出约为382,000美元。2022年的现金使用包括约548,000美元的工资,约634,000美元的咨询和专业费用,包括法律、会计和审计费用,以及运营活动的咨询费,以及约609,000美元的技术许可费、专利成本报销和最低年度特许权使用费,已记录为研发费用 。
截至2023年9月30日,该公司累计亏损8,457,978美元,并通过出售普通股和债务为其运营提供资金。我们预计未来我们的支出将增加,以支持我们的服务产品、临床和临床前研究以及与战略合作伙伴关系和协作相关的开发活动,以及收购的候选产品和作为上市公司运营增加的 成本。这些增加可能包括与雇用更多人员有关的费用增加,以及支付给外部顾问、律师和会计师的费用,以及其他费用。此外,我们预计与上市公司相关的成本会增加,包括与维护符合交易所上市和证券 以及交易委员会要求的服务相关的费用、保险和投资者关系成本。
公司目前的业务包括BullFrog AI,Inc.和BullFrog Management,LLC,这两家公司是BullFrog AI Holdings,Inc.的全资子公司,BullFrog AI Holdings,Inc.是一家控股公司,依赖出售其子公司 产生的证券和现金来为合并业务提供资金。
于2023年2月16日,本公司完成首次公开招股1,297,318个单位(每个单位,统称为“单位”) ,单位价格为每单位6.50美元,合共为公司带来约840万美元的毛收入。每个单位包括一股公司普通股、一份流通权证(每份为“可流通权证”,统称为“可流通权证”),以每股7.80美元的行使价购买一股普通股,以及一份非流通权证(每份为“非流通权证”,统称为“非流通权证”);连同可交易认股权证,每个“认股权证”,统称为“认股权证”),以8.125美元的行使价购买一股本公司普通股。在首次公开募股方面,公司还完成了普通股的7股1股反向拆分。
与IPO相关,一家关联方持有的外管局和可转换贷款协议转换为反向拆分后的55,787股普通股。此外,截至2022年11月30日的所有未转换可转换过渡票据和应计利息已转换为 276,289股普通股,并在转换时向可转换过渡票据持有人发行了276,289份购买普通股的认股权证。 可转换过渡票据转换和认股权证行使定价是在首次公开募股前使用2500万美元的公司估值 确定的。
在 2023年4月5日至4月13日期间,认股权证持有人以不同的行使价行使了436,533份普通股认股权证,公司 获得了约1,495,000美元的收益。
在2023年没有大量收入的情况下,管理层相信公司的资本资源足以为计划中的 自本申请之日起约9个月的运营提供资金。
表外安排 表内安排
我们 没有任何表外安排,因为这一术语在S-K条例第303(A)(4)项中定义。
| 34 |
我们的业务
我们的公司历史和背景
牛蛙人工智能控股公司于2020年2月18日在内华达州注册成立。我们的主要业务地址是马里兰州盖瑟斯堡,317单元,埃灵顿大道325号,邮编:20878。我们的所有业务目前都是通过牛蛙AI Holdings,Inc.进行的。牛蛙AI,Inc.是一家通过换股收购的全资子公司,其唯一目的是存放和保护组织的所有知识产权。牛蛙人工智能管理有限责任公司是一家全资子公司,负责处理所有人力资源和薪资活动。
收购牛蛙AI
2020年3月,牛蛙AI公司获得了TEDCO(马里兰州技术发展公司,马里兰州投资基金)的投资,发行了20万美元的可转换票据,期限18个月,年利率6%,折扣20%。 2020年6月,牛蛙AI控股公司根据一项交换协议收购了牛蛙AI,Inc.,Inc.根据一项交换协议,牛蛙AI,Inc.的普通股与牛蛙AI控股公司的普通股进行了交换。就在换股之前,牛蛙AI,Inc.的每股已发行普通股被拆分为25股普通股。我们2021年和2020年财务报表中的股份金额已进行调整,以反映这一前瞻性股份拆分和换股。根据协议,本公司向牛蛙AI,Inc.股东发行24,223,975股普通股,以换取牛蛙AI,Inc.100%的已发行普通股。交换完成后,牛蛙AI,Inc.成为本公司的全资子公司,牛蛙AI,Inc.的股东 持有本公司100%的普通股。因此,牛蛙AI Holdings,Inc.承担了牛蛙AI,Inc.总计330,442美元的净负债。交易前后,这两个实体都由同一控股股东控制。这笔交易将作为共同控制交易入账,所有实体的列报都如同交易 发生在列报的最早期间开始时一样。
牛蛙 AI公司历史
牛蛙人工智能公司于2017年8月25日在特拉华州注册成立。Vininder Singh是牛蛙AI的创始人、首席执行官和董事长。
我们的 战略
我们 计划通过我们专有的人工智能平台bfLEAP,使用精确医学方法实现药物和生物制剂的成功开发,从而实现我们的业务目标。我们将通过执行以下所有或任何一项操作来执行我们的计划:与生物制药公司以收费服务模式合作,以帮助和支持他们的药物开发计划,获得 在关键第二阶段或第三阶段临床试验后未通过FDA审查的药物的权利并对其进行救援(我们将此救援 流程称为“药物救援”),获得处于早期临床试验且未通过FDA审查的药物的权利, 以及发现新药和生物制品。
加强和开发晚期失败药物的 流程如下:
| ● | 从生物制药行业公司或大学获得失败药物的权利, | |
| ● | 使用专有的bfLEAP™AI/ML平台来确定对药物最有效的患者的多因素简档, | |
| ● | 迅速 可能与合作伙伴一起进行临床试验,以验证该药物是否适用于确定的“高响应者”人群; 和 | |
| ● | 在临床试验取得积极结果后,将带有新信息的获救药物资产剥离/出售给制药业。 |
我们 还计划为所有发现和早期临床候选人部署此策略。我们的共同目标是尽快将我们的资产货币化 ,目前没有任何资产商业化计划。作为我们战略的一部分,我们将继续发展我们的知识产权、分析平台和技术,建立一个庞大的候选药物组合,并实施一种降低风险和 增加拯救药物现金流频率的模式。该战略将包括整个业务价值链上的战略合作伙伴关系、协作和关系 。
| 35 |
我们 在2021年前没有产生任何收入;我们在2022年末通过与一家制药公司的关系相关的服务产生了第一笔收入。
到目前为止,我们还没有对任何药物进行临床试验,我们的平台也没有被用来识别已获得监管部门批准商业化的候选药物 。然而,我们目前与一家领先的罕见疾病非营利性组织建立了战略合作关系,该组织用于对晚期临床数据进行人工智能/机器学习(AI/ML)分析。 我们已从大学获得了一系列临床前和早期临床药物资产的权利,并与一家世界知名研究机构达成战略 合作,创建HSV1病毒治疗平台,以设计针对结直肠癌的免疫疗法。我们已经与约翰·霍普金斯大学签署了一项针对胶质母细胞瘤(脑癌)、胰腺癌和其他癌症的抗癌药物的全球独家许可协议。我们还与乔治华盛顿大学签署了另一种针对肝细胞癌(肝癌)和其他肝脏疾病的抗癌药物的全球独家许可。
我们的平台最初是由约翰霍普金斯大学应用物理实验室(JHU-APL)开发的。JHU-APL在国防相关应用中使用了 相同的技术。几年来,软件和算法已被用来识别关系、模式和异常,并做出否则可能找不到的预测。这些发现和见解为预测感兴趣的目标提供了优势,而不受行业或部门的影响。我们已将该技术应用于各种临床数据集,并确定了可能提供新知识产权、新药靶点和其他有价值信息的新关系 ,这些信息可能有助于临床试验的患者分层,从而提高成功的几率。该平台尚未帮助 开发已实现商业化的药物。然而,我们已经批准了一种已完成1期试验的候选药物和另一种处于临床前阶段的候选药物。我们的目标是在当前和未来可用的数据上使用我们的技术 ,以帮助我们更好地确定最佳发展路径。
合同 服务
我们的 服务合作伙伴费用是为各种规模的生物制药公司以及其他组织设计的,这些公司在整个药物开发过程中面临数据分析方面的困难。我们使用名为bfLEAP™的专有人工智能/机器学习平台为客户提供大型复杂数据集的分析。此平台旨在预测 感兴趣的目标、模式、关系和异常。我们的服务模式包括现金费用外加从分析中产生的新知识产权的潜在权利,这些知识产权可以在药物开发的发现、临床前或临床阶段执行。 2022年9月28日,牛蛙AI与Oncotelic Treateutics(OTCQB:OTLC)的子公司Sapu Biosciences,LLC签订了一份价值18.5万美元的服务合同。合同的范围集中在为他们的一个候选项目 揭示与肿瘤学临床数据相关的新见解。
协作 安排
我们 还将寻求与药物未通过第二阶段后期试验或第三阶段试验的制药公司达成合作安排。我们从此类合作中获得的收入将基于实现每项具体安排所确定的某些里程碑。
获得某些药品的权利
在 某些情况下,我们还可能获得处于早期临床试验阶段的药物的权利,使用我们的技术成功地进行 后期精准医学试验,并剥离资产。同样的过程也可能适用于新药的发现。
| 36 |
我们的 产品
| 产品/平台 | 说明 | 目标 市场/适应症 | ||
| BfLEAP™ -用于分析临床前和/或临床数据的AI/ML平台 | AI/ML 分析平台源自JHU-APL开发并获得公司许可的技术。 | 生物技术 以及制药公司和其他组织。 | ||
| 小干扰RNA | 靶向Beta2-Spectrin的siRNA 在乔治华盛顿大学开发的治疗人类疾病的药物,该公司获得了许可 | 肝细胞癌、肥胖、非酒精性脂肪性肝病和非酒精性脂肪性肝炎的治疗。尚未启动 临床测试。 | ||
| 甲苯咪唑 | 由约翰霍普金斯大学开发并获得该公司许可的甲苯咪唑的改进配方 | 胶质母细胞瘤。 已开始临床测试过程,但尚未获得监管部门的商业化批准。 |
2022年1月14日,该公司从乔治华盛顿大学(GWU)获得了全球独家版税许可, 有权将针对Beta2-Spectrin的siRNA用于治疗包括肝细胞癌(HCC)在内的人类疾病。许可证 涵盖三项美国和全球专利申请中要求的方法,还包括将该方法用于治疗肥胖症、非酒精性脂肪性肝病和非酒精性脂肪性肝炎。该计划目前处于临床前开发阶段。 该公司尚未启动关于该资产的开发活动或启用IND的研究;但计划在未来24个月内开展这项工作。到目前为止,该候选人的所有研发都是由该技术的许可方乔治华盛顿大学进行的。
非酒精性脂肪性肝病(NAFLD)是一种过量的脂肪在肝脏中积聚的疾病。这种情况在患有肥胖症和相关代谢性疾病(包括2型糖尿病)的人中更为常见 ,在美国有多达24%的成年人受到影响,并且与进展为更严重疾病的风险有关,包括非酒精性脂肪性肝炎(NASH)、相关的肝脏炎症和纤维化以及肝细胞癌。在肥胖动物模型中的证据表明,一种名为β2-光谱蛋白的蛋白质可能在脂质堆积、组织纤维化和肝损伤中发挥关键作用,并且该蛋白质的靶向表达或活性可能是治疗NASH和肝癌的有用方法(Rao等人,2021年)。
2022年2月,该公司从约翰·霍普金斯大学(JHU)获得了全球独家专利使用费许可,可 使用改良的甲苯咪唑配方治疗任何人类癌症或肿瘤疾病。该配方在不同类型癌症的动物模型中显示出强大的活性,并已在高级别胶质瘤患者的I期临床试验中进行评估(NCT01729260)。这项试验是一项开放标签的剂量递增研究,评估了在24名新诊断的胶质瘤患者中使用替莫唑胺的改进配方的安全性。研究人员观察到,除了最高测试剂量(200 mg/kg/天)外,接受所有药物治疗的患者都没有剂量限制性毒性。在接受最大试验剂量200毫克/公斤/天的15名患者中,有4名患者出现了剂量限制性毒性, 所有这些毒性都通过减少或取消给药剂量而逆转。在试验期间,任何剂量的甲苯咪唑都没有发生严重的不良反应。该公司目前正在制定一项战略,寻找合作伙伴利用该资产进行额外的临床试验 ,以实现对人体的安全性评估。
我们 能够利用强大且成熟的AI/ML平台(商标:bfLEAP™)来利用我们的毒品救援业务。BfLEAP™分析平台是一个潜在的颠覆性工具,用于分析临床前和/或临床数据集,例如在转换式研发和临床试验环境中生成的强大的临床前和临床试验数据集。BfLEAP™的输入数据可以包括原始数据(临床前和/或临床读数)、分类数据、患者的社会人口学数据和各种其他输入。因此,bfLEAP™平台能够以公正的方式捕获患者的“人类体验”,并将其与来自患者的其他完全不同的数据源(例如,摩贝、生理数据等)联系起来。获得更少偏见和更有意义的结论(即更符合伦理的AI/ML)。它还具有独特的可扩展性--bfLEAP™平台能够对大数据集(即“大数据”)执行分析,还能够分析高度不同的“短数据和宽数据”。在可视化方面,bfLEAP™能够将 与最常用的图形分析可视化工具集成在一起。
我们 相信,a)可扩展的分析(即大数据或短/宽数据)、b)最先进的算法、c)无监督的 机器学习,以及d)简化的数据接收/可视化使bfLEAP™成为市场上最灵活、最强大的新平台之一 。
| 37 |
我们的 平台技术
我们 将继续发展和改进bfLEAP™,无论是在内部还是与JHU-APL等开发伙伴合作。BfLEAP™平台 基于日本大学授予的全球独家许可证。
我们 计划利用我们在全球顶尖创新机构之一多年开发的专有AI/ML平台, 已在多个领域成功应用。在基础知识产权方面,我们已经从JHU-APL获得了该技术的全球独家许可证-该许可证包括3项已颁发的专利,以及1项新的临时专利申请, 对专有库算法和其他商业机密的非专利权,还包括修改和改进。此外,我们还拥有独特的商业模式,旨在降低风险并提高现金流的频率。
公司最近从JHU-APL获得了新技术的许可,以将bfLEAP平台发展到bfLEAP 2.0。这一新的改进平台 将实现更强大的数据分析,并对最重要的变量进行更快、更精确的预测,以确定 患者对药物的反应。
展望未来,该公司将继续发展该平台,开发或获取新的功能和技术。这些开发工作可能是内部进行的,也可能是与现有或新技术合作伙伴合作进行的。该公司计划招聘数据科学和软件开发方面的人才,以增强其内部能力。
Catie精神分裂症病例研究总结
该公司与利伯脑发育研究所合作,分析了具有里程碑意义的CATIE试验的数据。CATIE试验是有史以来针对抗精神病药物进行的最大规模试验。牛蛙分析了大约200名精神分裂症患者的CATIE数据, 每个患者的近100万个遗传数据点的库,每个患者200多个非遗传属性,以及试验中使用的4种不同的药物。对于所使用的四种药物中的每一种,bfLEAP™分析都揭示了个体基因变异与阴性患者症状之间的新的、以前未知的关系。已确定的基因座代表了潜在的可用药靶点,以及未来精神分裂症临床试验的潜在分层标准。
我们 使用新的高级聚类算法bfLEAP 2.0对数据进行了另一次分析,但重点关注了一种名为 奥氮平的特定药物。我们的bfLEAP™2.0分析结果确定了精神分裂症患者中新发现的遗传变异、药物清除、临床试验地点和临床结果变量之间以前未知的多维关联。

| 38 |
图1-bfLEAP™分析地图
每个 绿色节点代表不同的数据采样,箭头指向根据该采样发现为关键指标的属性(蓝色节点)。属性重要性取决于将该属性标识为指示符的采样次数(即每个蓝色节点的入射箭头数 )。

| 39 |
识别成簇的多变量关联(例如,新的遗传变异、药物清除、药物滥用)可以帮助我们1)识别新的药物靶点,2)预测哪些患者最有可能做出反应,以及3)识别可能有助于更好的结果的可修改因素。
心血管案例研究总结
该公司与心血管设备领域的一家国际合作者合作,分析了正在进行的一项新设备临床试验的数据。牛蛙分析了大约55名患者的数据,每个患者的数据库中有近15,000个独特的数据属性。数据 还包括不良事件和关键人口统计信息。对于该合作者,bfLEAP™分析能够为公司提供基本的真相-确认数据中的多个相关性和非相关性。就可操作的结果而言,分析 结果证实了正在进行的试验的至少两个人口统计协变量,并为更深入的生理和分子研究提供了起点。
我们的供应链和客户群
我们 利用首次公开募股的资金以及我们的合作伙伴和关系启动了我们的业务。我们与领先的非政府组织FSHD Society建立了战略合作关系,为患有一种罕见神经肌肉疾病的患者进行AI/ML临床试验数据分析。在项目设计阶段,我们还有其他几个发展中的战略关系。公司 执行了一项针对靶向癌症治疗的生物制剂发现阶段机会的联合开发协议。 公司还从大学获得了一种第二阶段的胶质母细胞瘤药物和一种发现阶段的肝细胞癌药物的全球独家权利。由于我们打算与合作伙伴就挽救的治疗资产进行后期临床试验,因此将需要药物产品或其他重要服务来规划和执行我们的临床开发计划。 我们合作的临床开发计划的成功将需要为我们的研发和临床试验提供足够的原材料和/或药物产品,在某些情况下,还可能需要建立第三方安排,以获得根据行业标准指南适当制造并包装用于临床或销售的成品药物。由于我们是一家数字生物制药公司,我们的临床开发计划在某些情况下还需要建立执行和完成临床试验的第三方关系。
我们的 市场机会
我们业务的一个目标是使用我们的技术分析所有 可用的数据,以设计一项更有可能成功的精确药物临床试验,以拯救在第三阶段临床试验中失败的药物。下图 显示了这些失败药物的估计市场机会。顶部箭头显示了5年内几种疾病类别的3期试验失败次数。以下箭头提供了我们的假设,用于缩小或折现与市场规模计算相关的某些参数 。最后一个箭头显示了471亿美元背后的数学原理。然而,到目前为止,我们还没有进入失败的药品市场;我们正在积极寻找失败的药品机会。
| 40 |

确定具有救援潜力的候选资产可能具有挑战性,需要大量资源,一旦确定了这些资产,公司可能会发现以优惠条款许可这些资产以为股东创造价值具有挑战性。后续开发用于临床测试的这些资产可能需要大量的工作和资源。最终,这些资产必须经过严格的临床测试和FDA或其他国家/地区类似监管机构的批准才能上市。我们战略的一个关键部分是与我们的研发项目合作。此外,我们不打算将药物商业化,而是将寻求将每种药物的资产剥离给将药物商业化的公司。该公司可能在未来的交易中获得特许权使用费。
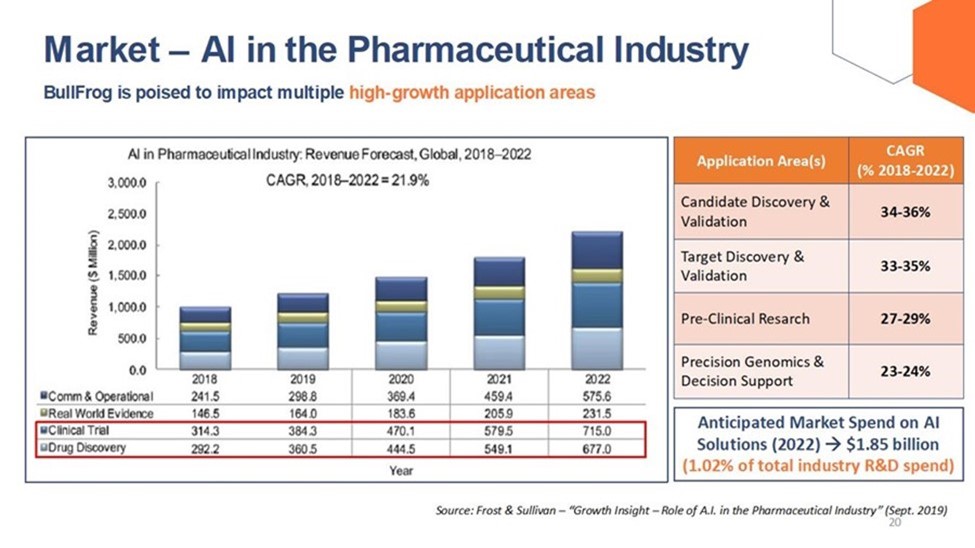
下图显示了将人工智能应用于制药行业的全球收入预测,以及针对特定应用领域的人工智能解决方案的预期市场支出和年增长率的增长。
| 41 |
知识产权
专利
我们 拥有与我们的知识产权相关的以下专利的全球独家权利:
约翰斯·霍普金斯大学授权的知识产权:
| 标题 | 序列号 | 文件 日期 | 应用程序 类型 | 国家 | 状态 | 专利编号 | 过期日期 | 受让人 | ||||||||
| 甲苯咪唑和药物组合物的改进配方以提高抗癌活性 | 62/112,706 | 2015年2月6日 | 临时性的 | 我们 | 过期 | 约翰·霍普金斯大学 | ||||||||||
| 甲苯咪唑和药物组合物的改进配方以提高抗癌活性 | %/美国2016/016968 | 2016年2月8日 | % | 百分比 -父级 | 过期 | 2016年8月11日 | 约翰·霍普金斯大学 | |||||||||
| 甲苯咪唑(Br)晶型在肿瘤治疗和预防中的应用 | 15/548,959 | 2017年8月4日 | % | 我们 | 已批准 | 11,110,079 | 2036年2月8日 | 约翰·霍普金斯大学 | ||||||||
| 甲苯咪唑(Br)晶型在肿瘤治疗和预防中的应用 | 16747414.7 | 2016年2月8日 | % | 促红细胞生成素 | 已批准 | 待定 | 2036年2月8日 | 约翰·霍普金斯大学 | ||||||||
| 甲苯咪唑(Br)晶型在肿瘤治疗和预防中的应用 | 253854 | 2016年2月8日 | % | 以色列 | 已批准 | 253854 | 2036年2月8日 | 约翰·霍普金斯大学 | ||||||||
| 甲苯咪唑和药物组合物的改进配方以提高抗癌活性 | 2016800144274 | 2016年2月8日 | % | 中国 | 已批准 | 1ZL20168-0014427.4 | 2036年2月8日 | 约翰·霍普金斯大学 | ||||||||
| 甲苯咪唑和药物组合物的改进配方以提高抗癌活性 | 201717028684 | 2016年2月8日 | % | 印度 | 已批准 | 352734 | 2036年2月8日 | 约翰·霍普金斯大学 | ||||||||
| 甲苯咪唑(Br)晶型在肿瘤治疗和预防中的应用 | 2017-541687 | 2016年2月8日 | % | 日本 | 已批准 | 6796586 | 2036年2月8日 | 约翰·霍普金斯大学 | ||||||||
| 续:用于治疗和预防肿瘤的甲苯咪唑多晶型 | 17/402,131 | 2021年8月13日 | 圆锥体 | 美国 美国 | 待决 | 约翰·霍普金斯大学 |
| 42 |
乔治 华盛顿大学授权知识产权:
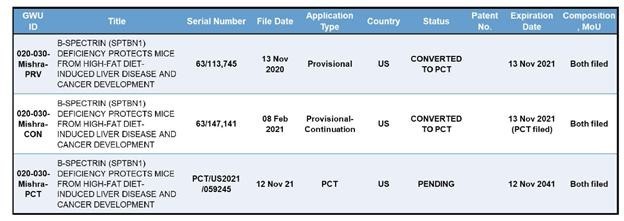
临时专利号63/113,745和63/147,141均被转换为一项PCT申请(PCT/US2021/059245),截止日期为2041年11月12日,如下表所示。

John 霍普金斯大学应用物理实验室许可知识产权:
| 标题 | 序列号 | 文件 日期 | 国家 | 状态 | 过期日期 | 受让人 | ||||||
| 用于分布式图形处理的装置和方法 | 美国专利10,146,801 | 7/13/2015 | 我们 | 授与 | 3/2/2037 | 约翰·霍普金斯大学 | ||||||
| 用于分析和分类高维数据集的方法和装置 | 美国专利10,936,965 | 10/5/2017 | 我们 | 授与 | 9/25/2038 | 约翰·霍普金斯大学 | ||||||
| 广义 低熵混合模型 | 美国 专利10,839,256 | 4/2/2018 | 我们 | 授与 | 12/15/2038 | 约翰·霍普金斯大学 |
许可证
我们 持有以下与我们的知识产权相关的许可证:
| 许可方 | 被许可方 | 说明 授予的权利 | ||
| 约翰 霍普金斯大学应用物理实验室 | 牛蛙 AI公司 | 全球范围内, 治疗开发和分析服务的独家权利 | ||
| 乔治·华盛顿大学 | 牛蛙 AI控股 | 全球范围内, 治疗开发的专有权 | ||
| 约翰 霍普金斯大学 | 牛蛙 AI控股 | 全球范围内, 治疗开发的专有权 |
| 43 |
2018年2月7日,我们与马里兰州有限责任公司JHU-APL(“JHU”)签订了许可协议(“许可协议”)。根据许可协议,JHU-APL授予本公司与JHU在生物和化学衍生药物疗法中应用的分析服务相关的知识产权的独家权利。许可协议 规定JHU向公司授予独家的、全球范围的、承担版税的许可,并有权进行再许可,以便 使用专利权和专有技术进行研究,并使用专利权和专有技术在该领域开发产品并将其商业化。作为根据许可协议授予本公司的权利的代价,本公司授予JHU的认股权证 收到相当于本公司当时完全摊薄的股本基础的5%(5%)的认股权证,该认股权证在我们公开发售后摊薄。根据许可协议的条款,公司必须作出商业上合理的努力以达到某些开发里程碑和最低净销售额里程碑,JHU将有权就使用JHU许可的公司提供的服务获得净销售额的8%,以及公司收到的所有分许可收入的50%。此外,公司还需要向JHU支付每年1,500美元的维护费。本公司还有义务支付最低年度付款。 这些向JHU支付的最低年度付款于2020年9月3日修订为2022日历年为20,000美元,2023日历年为80,000美元,2024日历年为300,000美元,2025日历年及以后每年为300,000美元,这些费用可能会从公司为最低年度特许权使用费到期时支付的特许权使用费中抵消。
除非提前终止,否则许可协议将在每个国家/地区继续生效,直到该国家/地区专利权中包含的最后一个到期专利 到期之日为止,或者如果没有颁发专利,则有效期为10年。公司可自行决定提前60天书面通知终止许可协议 。如果公司 严重违反许可协议,并且未能在通知开始的60天补救期限内纠正,则许可协议也可由JHU终止。公司的重大违约可能包括拖欠付款或公司未能及时达到指定的里程碑。
我们 还拥有JHU的其他知识产权的全球独家许可,这些知识产权被作为与我们的算法 库、模式识别、浅层和宽层数据集以及时间序列关联相关的商业秘密持有。我们预计新的知识产权 (专利、版权、商标、商业秘密等)将通过执行我们的战略开发项目以及改进、修改和扩展我们的bfLEAP™平台来产生。2021年10月,我们修改了与JHU-APL的协议 ,加入了额外的先进人工智能技术。目前,最新的专利授予日期是2021年3月。
2022年7月8日,公司与JHU-APL签订了额外技术的全球独家许可协议(《2022年许可协议》)。本许可证提供其他知识产权,包括专利、版权和将在公司的bfLEAP™分析AI/ML平台下使用的技术诀窍。根据2022年许可协议的条款,对于公司向其他方提供的服务,JHU将有权获得净销售额的8%,对于使用JHU许可的内部 开发药物项目,将有权获得3%的净销售额。2022年许可协议还包含分级子许可费,起步价为50%,根据收入降至25%。此外,公司还需要向JHU支付1,500美元的年度维护费。 2022年的最低年费为30,000美元,2023年的最低年费为80,000美元,2024年及以后的最低年费为300,000美元,所有这些费用都可以通过版税计入 。新许可协议的财务条款取代了原来的条款,不会重复。
George 华盛顿大学-Beta2-Spectrin siRNA许可证
2022年1月14日,该公司从GWU获得了独家的、全球范围的、具有特许权使用费的许可证,有权将针对 Beta2-Spectrin的siRNA用于治疗人类疾病,包括肝细胞癌。该许可证涵盖了三项美国和全球专利申请中要求的方法,还包括将该方法用于治疗肥胖症、非酒精性脂肪性肝病和非酒精性脂肪性肝炎。 该计划目前处于临床前开发阶段。该公司尚未启动对该资产的开发活动或启用IND的 研究;但计划在未来24个月内开展这项工作。到目前为止,该候选人的所有研发都是由该技术的许可方乔治·华盛顿大学进行的。协议期限自2022年1月14日开始,截止于最后一项专利到期之日,或在首次销售许可产品后10年(如果未颁发专利)终止。 许可证可由被许可方提前60天书面通知终止,如果公司拖欠许可方欠款超过30天且未按要求付款,则由许可方终止 ,或在45天内未治愈的任何重大许可违约 。
非酒精性脂肪性肝病(NAFLD)是一种过量的脂肪在肝脏中积聚的疾病。这种情况在患有肥胖症和相关代谢性疾病(包括2型糖尿病)的人中更为常见,在美国,多达24%的成年人会受到影响, 这种情况与进展为更严重疾病的风险有关,包括非酒精性脂肪性肝炎(NASH)、相关的肝脏炎症和纤维化以及肝细胞癌(HCC)。在肥胖动物模型中的证据表明,一种名为β2-Spectrin的蛋白质可能在脂质堆积、组织纤维化和肝损伤中发挥关键作用,并且该蛋白质的靶向表达或活性可能是治疗NASH和肝癌的有用方法(Rao等人,2021年)。
| 44 |
作为根据许可协议授予公司的权利的对价,GWU收到了20,000美元的许可启动费。根据许可协议的条款,GWU在监管部门批准后首次销售后,将有权对净销售额收取3%(3%)的版税,但不得低于季度最低限额,如果公司再许可或转让其使用技术的权利,GWU将有权收取从属许可或转让费用。公司还将报销GWU以前发生的和正在进行的专利费用。 随着公司推进许可技术的临床开发,再许可和转让费用金额将下降。许可证协议还包含通过批准保密协议和商业化来支付临床开发的里程碑式付款。
到目前为止,向GWU支付的总额包括20,000美元的许可证启动费和6,550美元的额外费用,以偿还许可方过去的专利 成本。如果该药物成功完成临床试验,并且是向美国FDA提交的新药申请(NDA)的对象,未来里程碑的总成本可能达到860,000美元。未来销售收入的里程碑被限制在前2000万美元净销售额的100万美元以内。
约翰斯·霍普金斯大学--甲苯咪唑许可证
2022年2月22日,该公司从JHU获得了全球独家专利使用费许可,可使用改进配方的甲苯咪唑用于治疗任何人类癌症或肿瘤疾病。该配方在不同类型癌症的动物模型中显示出强大的活性,并已在高级别胶质瘤患者的I期临床试验(NCT01729260)中进行了评估。这项试验是一项开放标签的剂量递增研究,评估了在24名新诊断的胶质瘤患者中使用替莫唑胺的改进配方的安全性。研究人员观察到,除了接受最高测试剂量(200 mg/kg/天)外,所有患者都没有剂量限制性毒性。 接受最大测试剂量200 mg/kg/天的15名患者中有4人出现剂量限制性毒性,所有这些毒性都通过减少或取消给药剂量而逆转。在试验期间,任何剂量的甲苯咪唑都没有发生严重的不良反应。 该公司目前正在制定一项战略,利用该资产进行额外的临床试验,以评估人体的安全性 。
许可证涵盖六(6)项已发布专利和一(1)项待定申请,协议期限自2022年2月22日开始,截止于最后一项到期专利的到期日期。许可证可由被许可方在90天内发出书面通知后终止,或在许可证的任何重大违规行为在30天内未得到纠正的情况下由许可方终止。考虑到根据许可协议授予本公司的权利,JHU将收到250,000美元的交错预付许可费, 第一笔50,000美元的款项应在生效日期后30天内支付。该公司还将报销JHU以前发生的和持续的 专利费用。根据许可协议的条款,JHU将有权对公司的净销售额 收取3.5%(3.5%)的特许权使用费。此外,本公司须于2023年、2024年、2025年、2026年及2027年每年支付JHU最低5,000元、10,000元、20,000元、30,000元及50,000元的专利权使用费,直至首次商业销售为止,其后每年的最低使用费为250,000元。许可协议还包含临床开发步骤的里程碑式付款,通过批准保密协议和商业化。到目前为止,支付的总金额包括最初的50,000美元预付款和额外的79,232.53美元,以补偿许可人过去的专利费用。如果该药物成功完成第二阶段和第三阶段临床试验,并获得美国FDA批准销售和营销,未来里程碑总成本可能达到1500,000美元。未来销售收入的里程碑是:前2000万美元的销售收入为100万美元,第一年的累计销售收入为200万美元,第一年的累计销售收入超过1亿美元,第一年的累计销售收入超过5亿美元,第一年的累计销售收入超过10亿美元。
JHU -甲苯咪唑前药许可证
2022年10月13日,该公司从JHU和捷克科学院有机化学和生物化学研究所(IOCB)获得了全球范围内的独家许可,获得了将甲苯咪唑的N-取代前体药物商业化的权利,这些药物具有更好的溶解性和生物利用度。该许可证涵盖前药组合物和用于治疗疾病的药物,如美国和世界各地的多项专利申请所述。协议的有效期从2022年10月13日开始,一直持续到 最后一个到期的专利到期之日,如果没有颁发专利,则自协议生效之日起持续20年。许可证可由公司提前90天书面通知终止 ,或在本公司未在30天内纠正的任何重大违反许可证的情况下由许可方终止。
| 45 |
作为根据许可协议授予公司的权利的 对价,JHU和IOCB将收到交错的预付许可费 $100,000。该公司还将偿还JHU和IOCB之前发生的总计33,265美元的专利费用,并将负责 偿还许可人未来的专利费用。根据许可协议的条款,许可人将有权在许可产品首次商业销售时按净销售额收取4%(4%)的特许权使用费,并在公司再许可或转让其技术使用权的情况下收取再许可或转让费用。随着公司推进许可技术的临床开发,再许可费金额下降 。从协议的第4年开始,公司需要支付最低年度版税 (3月)。第四年的三月份是5,000元,第五年增加到10,000美元,第六年增加到20,000美元,第七年增加到30,000美元,第八年和以后的年份增加到50,000美元。该公司将负责发放高达50,000美元的专利和临床开发里程碑的里程碑式付款,包括批准总额高达230万美元的保密协议。当在美国的销售额达到2000万美元时,该公司将被要求支付100万美元的商业里程碑;当在美国的销售额达到1亿美元时,该公司将被要求支付200万美元;当美国销售额达到5亿美元时,该公司将被要求支付1000万美元;当美国销售额超过10亿美元时,该公司将被要求支付2000万美元。
竞争
制药和生物技术行业的特点是技术进步迅速、竞争激烈,并且非常重视专有产品。该行业的免疫肿瘤学、神经科学和罕见疾病领域竞争尤其激烈。 虽然我们相信我们的技术、开发经验和科学知识提供了竞争优势,但我们面临着来自许多不同来源的潜在竞争,包括主要的制药、专业制药和生物技术公司、学术机构和政府机构以及公共和私人研究机构。
与我们相比,我们的许多竞争对手在研发、制造、临床前研究、进行临床试验、获得监管批准和营销批准药品方面可能拥有更多的财务资源和专业知识。制药、生物技术和诊断行业的合并和收购 可能会导致更多的资源集中在我们数量较少的竞争对手中。这些竞争对手还在招聘和留住合格的科学和管理人员 、建立临床试验场地和临床试验患者注册以及获取与我们的计划互补或必要的技术方面与我们展开竞争。规模较小或处于早期阶段的公司也可能成为重要的竞争对手,尤其是通过与大公司和成熟公司的协作安排。
如果获得批准,影响我们所有候选产品成功的关键竞争因素可能是它们的有效性、安全性、便利性、价格、辅助诊断在指导相关疗法使用方面的有效性(如果有)、仿制药竞争水平以及政府和其他第三方付款人是否可以报销。
如果我们的竞争对手开发和商业化比我们可能开发的任何药物更安全、更有效、副作用更少或更少、更方便或更便宜的药物,我们的商业机会可能会减少或消失。我们的竞争对手 也可能比我们更快地获得FDA或其他监管机构对其药品的批准,这可能会导致我们的竞争对手在我们能够进入市场之前建立强大的市场地位。此外,我们的竞争能力 在许多情况下可能会受到保险公司或其他第三方付款人鼓励使用仿制药的影响。目前市场上有许多针对我们正在研究的某些适应症的仿制药,预计未来几年将有更多的仿制药 上市。如果我们的候选治疗产品获得批准,我们预计它们的定价将显著高于竞争对手的仿制药。
我们成功开发和商业化的任何候选产品都将与现有疗法和未来可能出现的新疗法展开竞争。如果我们优先计划的候选产品被批准用于我们目前正在计划临床试验的适应症,它们将与下面讨论的药物竞争,并可能与目前正在开发的其他药物竞争。
BfLEAP
分析行业和人工智能在医疗保健中的应用正在快速增长。竞争存在于药物开发过程的整个连续体中,从发现到商业化,甚至更远。我们认为该行业的弱点是数据质量 ,我们相信bfLEAP提供了几个竞争优势,这将使公司成功:首先,bfLEAP具有高度的可扩展性 ,可以处理从小到大的复杂数据集,而不需要开发额外的代码。其次,它 擅长处理和分析不完整的数据,并做出我们认为其他技术 无法做到的预测。最后,bfLEAP能够使用 无监督机器学习算法从超大的复杂数据集中提取最重要的特征进行分析,从而极大地简化复杂问题。由于数据质量是医疗保健行业存在的问题,我们认为这些是主要的差异化因素。应用物理实验室已在其他应用程序和部门展示了在超大型复杂数据集中进行预测、发现关系和模式以及 异常的能力。最后,bfLEAP使用的算法是受保护的专有算法,由约翰霍普金斯大学应用物理实验室开发。我们 相信大多数竞争对手依赖于开源算法,我们也相信我们已经通过2021年8月发表在DeepAI.org上的文章展示了我们的优势 。
| 46 |
政府 法规
FDA目前并不要求批准用于辅助治疗的人工智能技术,但这种情况未来可能会改变。FDA 将规范该公司进行的任何临床试验。
在某些情况下,我们的临床开发计划将要求FDA或其他管理机构对临床前和/或临床数据进行监管审查,并随后遵守适用的联邦、州、地方和外国法规。我们进行的临床试验的结果将由FDA和其他监管机构进行评估。 获得的意见和批准预计将导致合作协议下的里程碑付款。因此,我们驾驭监管流程的能力对公司的成功至关重要。我们相信,我们在这一过程中拥有竞争优势,因为 主要专注于已经在临床试验中取得一定程度成功的候选药物。之前在试验中成功的特定候选 与我们使用bfLEAP平台进行临床试验设计的精确医学方法相结合,将降低开发 过程的风险,并提高成功的机会。
政府 法规和产品审批
美国联邦、州和地方各级以及其他国家和司法管辖区的政府当局对药品的研究、开发、测试、制造、质量控制、批准、包装、储存、记录保存、标签、广告、推广、分销、营销、批准后的监测和报告以及进出口等进行广泛监管。 在美国及其他国家和司法管辖区获得监管批准的流程,以及随后适用的法律法规和其他监管机构的遵守情况,需要花费大量的时间和 财力。
FDA 审批流程
在美国,药品受到FDA的广泛监管。《联邦食品、药品和化妆品法》(FD&C法案)以及其他联邦和州法律法规对药品的研究、开发、测试、制造、 储存、记录保存、批准、标签、推广和营销、分销、批准后监测和报告、抽样和 进出口等进行管理。不遵守适用的美国要求可能会使公司受到各种行政或司法制裁,例如FDA拒绝批准待决的新药申请(NDA)、警告或无标题信件、产品召回、产品扣押、完全或部分暂停生产或分销、禁令、罚款、民事处罚和 刑事起诉。
药品 在美国,针对新产品或批准产品的某些更改的产品开发通常涉及临床前实验室和动物试验、向FDA提交必须在临床 试验开始之前生效的试验性新药申请(IND),以及充分和受控的临床试验,以确定该药物对于寻求FDA批准的每个 适应症的安全性和有效性。满足FDA上市前审批要求通常需要数年时间,根据产品或疾病的类型、复杂性和新颖性,所需的实际时间可能会有很大差异。
临床前测试包括产品化学、配方和毒性的实验室评估,以及评估产品特性和潜在安全性和有效性的动物试验。临床前试验的实施必须符合联邦法规和要求,包括良好的实验室实践。临床前试验的结果作为IND的一部分与其他信息一起提交给FDA,包括有关产品化学、制造和控制的信息,以及建议的临床试验方案。在IND提交后,可能会继续进行长期的临床前测试,例如生殖毒性和致癌性的动物测试。在开始人体临床试验之前,需要在提交每个IND之后有30天的等待期。如果FDA在这30天内既没有对IND发表评论,也没有对IND提出质疑,IND中提议的临床试验可能会开始。临床试验涉及在合格研究人员的监督下给健康志愿者或患者使用研究用新药。临床试验必须:(I)符合联邦法规;(Ii)符合良好临床实践或GCP,这是一个旨在保护患者权利和健康并定义临床试验发起人、管理者和监督者角色的国际标准; 以及(Iii)根据详细说明试验目标的协议,用于监测安全性和有效性的参数将被评估 标准。每个涉及对美国患者进行检测的方案和后续方案修正案必须作为IND的一部分提交给FDA 。
| 47 |
支持NDA获得上市批准的临床试验通常分三个连续阶段进行,但这些阶段可能会重叠。在第一阶段,即首次将药物引入健康的人体受试者或患者时,对药物进行测试,以评估新陈代谢、药代动力学、药理作用、与增加剂量相关的副作用,以及如果可能的话,评估有效性的早期证据。第二阶段通常涉及在有限的患者群体中进行试验,以确定该药物在特定适应症、剂量耐受性和最佳剂量下的有效性,并确定常见的不良反应和安全风险。如果一种药物在第二阶段评估中表现出有效性和可接受的安全性,则进行第三阶段试验,以获得有关临床疗效和安全性的更多信息,通常是在地理上分散的临床试验地点,以使FDA能够评估该药物的总体效益-风险关系,并为该药物的标签提供足够的信息。在大多数情况下,FDA需要 两个充分且受控良好的3期临床试验来证明该药物的疗效。在极少数情况下,具有其他确凿证据的单一3期试验可能就足够了,例如该研究是一项大型多中心试验,证明了内部一致性 ,而且在统计学上非常有说服力的发现对死亡率、不可逆转的发病率或疾病的预防具有临床意义,并可能产生严重的后果,而在第二次试验中确认结果实际上或在伦理上是不可能的。
在完成所需的临床测试后,将准备一份保密协议并提交给FDA。在该产品开始在美国市场销售之前,需要FDA批准该产品 。该产品必须包括所有临床前、临床和其他测试的结果以及与该产品的药理、化学、制造和控制相关的数据汇编。准备和提交保密协议的成本非常高 。大多数NDA的提交还需缴纳高额的申请使用费,根据 批准的NDA的申请者还需缴纳每个处方药的年度计划费。这些费用通常每年都会增加。申请获得孤儿药物指定的药物的发起人 免收这些使用费。
FDA 还可以将新药产品的申请或提出安全性或有效性难题的药物产品的申请提交给外部的 咨询委员会-通常是包括临床医生和其他专家的小组-以进行审查、评估并就是否应批准申请提出建议。FDA不受咨询委员会建议的约束,但它通常遵循此类建议。
在批准保密协议之前,FDA通常会检查一个或多个临床站点,以确保符合GCP。此外,FDA还将检查生产该药物的工厂。FDA将不会批准该产品,除非符合当前良好的 生产规范(CGMP)令人满意,并且NDA包含的数据提供了大量证据,证明该药物在所研究的适应症中是安全和有效的。
快速 路径指定
FDA 需要促进用于治疗严重或危及生命的疾病或疾病的药物的开发和加快审查,这些药物没有有效的治疗方法,并且证明有可能满足 这种疾病的未得到满足的医疗需求。根据Fast Track计划,候选新药的赞助商可以要求FDA在候选药物IND备案的同时或之后,将候选药物的特定适应症指定为Fast Track药物。FDA必须在收到赞助商请求后60天内确定候选药物是否有资格获得快速通道指定。
如果提交获得快速通道认证,赞助商可以与FDA进行更频繁的互动,FDA可以在申请完成之前审查NDA的第 节。如果申请人提供了提交剩余信息的时间表 ,并且申请人支付了适用的使用费,则可以进行滚动审查。然而,FDA审查申请的时间段目标直到提交保密协议的最后一节后才开始。虽然我们可能会寻求快速通道认证,但不能保证我们会成功获得任何此类认证。即使我们确实获得了这样的认证,我们也可能不会体验到与传统FDA程序相比更快的开发过程、审查或批准。指定快速通道并不能确保 候选产品将获得营销批准或在任何特定时间范围内获得批准。此外,如果FDA认为快速通道指定不再得到临床试验过程中出现的数据的支持,则FDA可能会撤回该指定。
审批后要求
一旦NDA获得批准,产品将受到某些审批后要求的约束。例如,FDA密切监管药品审批后的销售和促销,包括直接面向消费者的广告、标签外促销、行业赞助的科学和教育活动以及涉及互联网的促销活动的标准和法规。药品只能根据批准的适应症和批准的标签的规定进行销售。
FDA批准保密协议后,需要提交不良事件报告和定期报告。FDA还可能要求进行上市后 测试,即第4阶段测试、REMS和监督,以监控批准产品的效果,或者FDA可能会对可能限制产品分销或使用的批准 施加条件。此外,质量控制、药品制造、包装和标签程序在获得批准后必须继续符合cGMP。药品制造商及其某些分包商被要求 向FDA和某些州机构登记其机构。向FDA注册后,实体必须接受FDA的定期突击检查,在此期间,FDA会检查生产设施,以评估是否符合cGMP。因此,制造商 必须继续在生产和质量控制领域花费时间、金钱和精力,以保持符合cGMP。如果一家公司未能遵守监管标准,如果该公司在初始营销后遇到 问题,或者后来发现了以前未发现的问题,监管机构可能会撤回产品审批或要求产品召回。
| 48 |
一般性竞争
在通过保密协议寻求药物批准的过程中,申请人被要求向FDA列出其权利要求涵盖申请人的产品的每一项专利。在一种药物获得批准后,该药物申请中列出的每一项专利都将在FDA批准的 带有治疗等效性评估的药物产品中公布,通常被称为橙皮书。反过来,橙色手册中列出的药物可以被潜在的仿制药竞争对手引用,以支持简化新药申请(ANDA)的批准。ANDA规定销售的药物产品具有与所列药物相同强度和剂型的相同有效成分,并且已通过生物等效性测试证明在治疗上与所列药物相同。除了生物等效性测试的要求外,ANDA申请者不需要进行临床前或临床测试或提交结果,以证明其药物产品的安全性或有效性 。以这种方式批准的药物通常被称为所列药物的“仿制药”,药剂师通常可以根据为原始所列药物开出的处方来替代。
ANDA申请人需要向FDA证明FDA批准的产品所列的任何专利。 具体地说,申请人必须证明(I)所需的专利信息尚未提交;(Ii)所列专利已到期; (Iii)所列专利尚未到期,但将在特定日期到期,并在专利到期后寻求批准;或(Iv) 所列专利无效或不会受到新产品的侵犯(第四段证明)。ANDA申请人还可以 选择提交第VIII节声明,证明其建议的ANDA标签不包含(或雕刻)任何与专利使用方法有关的语言,而不是证明列出的使用方法专利。如果申请人没有对所列专利提出异议,或者证明所列专利不会受到新产品的侵犯,则ANDA申请将在要求参考产品的所有所列专利均已到期之前不会被批准。如果ANDA申请人提供了第四段证明,NDA和专利持有人可以提起专利侵权诉讼作为回应。在收到此类认证后45天内提起专利侵权诉讼,将自动阻止FDA批准ANDA,直到30个月前、专利到期、诉讼和解或侵权案件中对ANDA申请人有利的裁决。
排他性
在新的化学实体(NCE)获得NDA批准后,该药物将获得五年的市场独家经营权,在此期间FDA不能获得任何寻求批准该药物仿制药版本的ANDA。如果提交了第(Br)段IV认证,则ANDA可在NCE独家经营权到期前一年提交。如果Orange Book中没有列出的专利,则可能不会有第四段认证,因此,在排他期到期之前,不能提交ANDA。如果申请包含赞助商进行或赞助的对批准申请至关重要的新临床研究 (生物利用度研究除外)的报告,则药物的某些更改,例如在包装插入中增加新的适应症 ,可能是三年排他期的主题。FDA不能 批准包含排他性期间更改的仿制药的ANDA。
专利延期
在NDA批准后,相关药物专利的所有者可以申请长达五年的专利延期。允许的专利期限延长 计算为药物测试阶段(IND申请和NDA提交之间的时间)的一半和整个审查阶段 (NDA提交和批准之间的时间,最长为五年)。如果FDA确定申请人 未尽职尽责地寻求批准,则可以缩短时间。延长后的总专利期限不得超过14年,并且只能延长一项专利。对于可能在申请阶段到期的专利,专利所有人可以请求临时专利延期。 临时专利延期将专利期限延长一年,最多可续期四次。对于每一次授予的临时专利延期 ,批准后的专利延期将减少一年。美国专利和商标局局长必须 确定申请专利延期的专利所涵盖的药物有可能获得批准。临时专利延长 不适用于未提交NDA的药物。
其他 医保法
在 美国,生物技术公司的活动除 FDA外,还受各种联邦、州和地方当局的监管,包括但不限于医疗保险和医疗补助服务中心(CMS)、美国卫生与公众服务部的其他部门(例如,监察长办公室和民权办公室)、美国司法部 (DOJ)和司法部内的各个美国检察官办公室,以及州和地方政府。例如,研究、销售、营销和 科学/教育资助计划必须遵守《社会保障法》的反欺诈和滥用规定、联邦 虚假索赔法、《健康保险流通与责任法》(HIPAA)的隐私和安全规定以及类似的 州法律(每项法律均经修订)(如适用)。
| 49 |
此外, 许多州都有类似的欺诈和滥用法规或条例,适用于Medicaid和其他 州计划报销的项目和服务,或者在几个州,适用于任何付款人。
Data privacy and security regulations by both the federal government and the states in which business is conducted may also be applicable. HIPAA, as amended by the Health Information Technology for Economic and Clinical Health Act, or HITECH, and its implementing regulations, imposes requirements relating to the privacy, security and transmission of individually identifiable health information. HIPAA requires covered entities to limit the use and disclosure of protected health information to specifically authorized situations and requires covered entities to implement security measures to protect health information that they maintain in electronic form. Among other things, HITECH made HIPAA’s security standards directly applicable to business associates, independent contractors or agents of covered entities that receive or obtain protected health information in connection with providing a service on behalf of a covered entity. HITECH also created four new tiers of civil monetary penalties, amended HIPAA to make civil and criminal penalties directly applicable to business associates, and gave state attorneys general new authority to file civil actions for damages or injunctions in federal courts to enforce the federal HIPAA laws and seek attorneys’ fees and costs associated with pursuing federal civil actions. In addition, state laws govern the privacy and security of health information in specified circumstances, many of which differ from each other in significant ways and may not have the same effect, thus complicating compliance efforts.
保险 承保范围和报销
Significant uncertainty exists as to the insurance coverage and reimbursement status of any products for which we may obtain regulatory approval. In the United States, sales of any product candidates for which regulatory approval for commercial sale is obtained will depend in part on the availability of coverage and adequate reimbursement from third-party payors. Third-party payors include government authorities and health programs in the United States such as Medicare and Medicaid, managed care providers, private health insurers and other organizations. These third-party payors are increasingly reducing reimbursements for medical products and services. The process for determining whether a payor will provide coverage for a drug product may be separate from the process for setting the reimbursement rate that the payor will pay for the drug product. Third-party payors may limit coverage to specific drug products on an approved list, or formulary, which might not include all of FDA-approved drugs for a particular indication. A payor’s decision to provide coverage for a drug product does not imply that an adequate reimbursement rate will be approved. Further, coverage and reimbursement for drug products can differ significantly from payor to payor. As a result, the coverage determination process is often a time-consuming and costly process that will require us to provide scientific and clinical support for the use of our products to each payor separately, with no assurance that coverage and adequate reimbursement will be applied consistently or obtained in the first instance.
| 50 |
最近的发展
自 我们于2023年2月进行首次公开募股以来,我们的业务出现了以下重大发展。
APL
2023年5月31日,公司与JHU-APL签订了2022年7月8日许可协议第1号修正案,根据该协议,公司获得了某些改进,包括额外的专利和专有技术,以换取总计275,000美元的一系列付款。本公司于2023年7月支付了第一笔付款,金额为75,000美元,随后将分别在2025、2026和2027年支付75,000美元、75,000美元和50,000美元。该修正案还将2023年的最低年特许权使用费支付降至6万美元。许可协议的所有其他财务条款保持不变。
伦敦政治经济学院
2023年9月8日,公司与Lieber Institute for Brain Development(LIBD)签订了数据使用和技术合作协议(“合作协议”)。该合作协议涵盖了BullFrog AI利用其bfLEAP™ 平台挖掘LIBD全面的大脑数据的权利,包括转录组、基因组、DNA甲基化、细胞系、临床和 成像数据,以识别以前未识别的关系。该合作伙伴关系的目标是确定大脑中基因和通路与神经系统和精神疾病发展之间以前未被认识的关系,从而促进人类大脑疾病更有效治疗的发展。该合作将分两个阶段进行,第一阶段涉及图形模型的无监督构建,以揭示脑部疾病与基因组/生物属性之间的关系,目标是确定新的生物标志物和药物靶标。第二阶段将涉及创建疾病特异性模型 ,从而能够识别这些相应疾病中的基因和途径。合作伙伴协议有一年的数据独占期 ,以完成第一阶段的分析,如果达到绩效里程碑,则可以选择延长两年。,
As contemplated in the Partnership Agreement, on October 16, 2023, the Company and LIBD entered into a commercial agreement (the “Commercial Agreement”) that sets forth the key terms for commercialization of products and services developed under the Partnership Agreement. Pursuant to the Commercial Agreement, LIBD granted the Company a worldwide, royalty-bearing exclusive license so long as the Company receives net sales or income from the licensing of “Licensed Products” (as defined in the Commercial Agreement) in the application of machine learning and/or artificial intelligence for research and development in drug development, and specifically includes therapeutic products, patient selection strategies, and target identification, but excludes diagnostics and incidental uses of machine learning and/or artificial intelligence on data derived from research. Generally, “Licensed products” are any product or service which incorporates, results from, or is derived from LIBD’s Data (meaning finished brain-related data, including but not limited to DNA methylation, RNAseq, genomic, DNA methylation, cell-line, clinical, and imaging data, and the specified data set forth in the Partnership Agreement) and that the Company or its affiliate develops during the term of the Partnership Agreement, and any improvements thereof after the term of the Partnership Agreement, and all Licensed Products or services derived therefrom by the Company or its affiliates. Licensed Products may include, but are not limited to, biomarker and target identification, target validation, mapping unmet needs, identifying genetic risk factors and predictive modeling.
公司还被授予以下权利:分许可、使用《合作协议》项下的可交付成果以及LIBD 在数据中的知识产权:(i)使用、销售、为销售而分发、为销售而分发、为销售而提供、销售、进口和 进口许可产品,以及(ii)开发、已开发、制造、已经制造了许可产品,这些许可产品源自于在《合作伙伴协议》期限内开发的许可 产品,以及在该期限之后所做的任何改进。禁止 公司对LIBD数据进行分许可。公司应根据公司和/或 其关联公司销售的所有许可产品的净销售额向LIBD支付特许权使用费。
一般而言,如果任何一方违约或违反协议的任何 重要条款或根据破产法申请保护、为债权人的利益进行转让、任命 或接受任命接管人、受托人或类似的财产代理人,则公司或LIBD可随时终止 商业协议。
| 51 |
前药
2023年9月26日,公司公布了一项临床前研究的积极数据,该研究调查了甲苯咪唑的一种新型前药 用于治疗胶质母细胞瘤的抗癌活性。该研究评估了BF-222(一种已在临床试验中评估的甲苯咪唑的新型制剂)和BF-223(一种相对于BF-222具有改善的溶解度和生物利用度的甲苯咪唑的新型前药)与安慰剂相比在已植入肿瘤细胞作为人胶质母细胞瘤模型的小鼠中的相对功效。用BF-223治疗的动物的平均存活时间为27.9天,而用BF-222治疗的小鼠为27.3天,给予 安慰剂的小鼠为23.4天。用BF-223治疗的小鼠被给予用BF-222治疗的小鼠接受的剂量的80%,并且与安慰剂相比, 两个治疗组的改善的结果在统计学上是显著的。此外,在研究期间,与对照动物相比,用等效剂量的BF-222和BF-223处理的动物显示出相当的且显著的肿瘤生长减少。
员工
截至 2024年1月1日,公司拥有8名全职员工和顾问,包括首席执行官Vininder Singh和 首席财务官Dane Saglio以及7名兼职员工、顾问和顾问。这些员工都不受集体 谈判协议的保护,我们相信我们与员工的关系良好。我们还根据需要聘请顾问,以 补充现有员工。
属性
目前, 公司不拥有任何不动产。公司所有员工都在虚拟环境中工作。
法律诉讼
公司不是任何法律诉讼的当事方。
企业信息
牛蛙控股AI,Inc.于2020年2月6日在内华达州注册成立。我们的主要业务地址是马里兰州盖瑟斯堡,317单元,埃灵顿大道325号,邮编:20878。我们的网站地址是www.BullFrogai.com。本招股说明书中对本公司网站的引用 仅为非活动文本参考。我们网站上的信息既不包含在本招股说明书中作为参考,也不打算 用于与此次发行相关的内容。我们目前的所有业务都是通过牛蛙AI控股公司进行的。
可用信息
我们根据《交易法》向美国证券交易委员会(美国证券交易委员会)提交的报告,包括年度和季度报告,以及我们提交的其他 报告,可以在美国证券交易委员会维护的公共参考设施中查阅和复制,该公共参考设施位于华盛顿特区20549。
| 52 |
管理层和董事会
执行官员和董事
下表列出了我们每一位高管、主要员工和董事的姓名、年龄和职位。
| 名字 | 年龄 | 职位 | ||
| 执行官员 : | ||||
| 文 辛格 | 54 | 首席执行官兼董事 | ||
| Dane 萨格里奥 | 66 | 首席财务官 | ||
| 非执行董事 董事: | ||||
| 唐·埃尔西 | 70 | 董事 和审计委员会主席 | ||
| 威廉·恩赖特 | 60 | 董事 兼薪酬委员会主席 | ||
| 杰森·汉森 | 54 | 董事 兼提名和公司治理委员会主席 |
Vininder (Vin)Singh自牛蛙AI控股公司于2017年8月成立以来,一直担任该公司的创始人、董事长兼首席执行官。在过去的五年里,他白手起家创建了公司,在此期间,他领导了战略,建立了一支经验丰富的领导者团队,领导了牛蛙核心人工智能技术和药物资产的收购和开发,获得了第一笔收入,并筹集了约200万美元的融资。2020年2月,他成立了牛蛙AI控股公司,牛蛙AI公司成为指定为核心知识产权持有者的全资子公司。Vin是一位连续创业者和经验丰富的高管,在生命科学和生物技术行业拥有25年的经验。他拥有丰富的创业经验,创立并建立了几家由投资者支持的开创性公司,包括使用机器学习/人工智能实现药物开发的牛蛙AI,个性化诊断和成人细胞库服务公司Next Healthcare Inc.,以及细胞治疗公司MaxCyte Inc.(MXCT)。他也是GlobalStem Inc.和ThermoFisher Science的高管,领导其全球细胞治疗服务业务。Vin拥有罗格斯大学的电气工程学士学位、伦斯勒理工学院的生物医学工程硕士学位和约翰霍普金斯大学的MBA学位。我们相信辛格先生有资格担任我们的董事会成员,因为他作为我们的创始人和首席执行官带来了 的视角和经验,他在科学和生物技术行业以及在创业公司管理方面的丰富经验 。
Dane Saglio于2021年9月加入牛蛙控股AI,Inc.担任首席财务官。Saglio先生在多个商业部门的公共和私营公司拥有40多年的财务管理经验。在此之前,Saglio先生曾在Seneca Biophma、RegeneRx BiopPharmticals(自2011年起)、新一代生物燃料公司(2010至2011年)和EntreMed(从2000年至2008年)担任首席财务官(均为生物技术领域的上市公司)。在加入本公司之前,Saglio先生是Seneca Biophma的首席财务官,于2019年8月担任顾问,然后于2020年4月成为一名员工,直到公司与领先的生物科学公司合并,于2021年4月成立Palisade Bio,Inc.。他之前曾在2017年10月至2019年7月期间担任Celios Corporation和2014年10月至2017年7月期间担任癌症个性化药物公司HelEconomics Corporation的首席财务官。他的职业生涯始于Informatics Corp,现在是Computer Associates International,然后是位于华盛顿的房地产开发商和住宅建筑商Bressler&Reiner。Dane拥有马里兰大学的学士学位,是马里兰的注册会计师(非注册会计师)。
自2023年2月14日以来,唐·埃尔西一直担任董事的董事和董事会审计委员会主席。目前,埃尔西先生是精准医药公司OpGen,Inc.的审计主席。埃尔西在2020年12月退休之前一直担任Lyra的首席财务官。此前,从2015年2月至2019年2月,埃尔西先生曾在医疗器械公司Senseonics,Inc.担任首席财务官。从2014年5月至2015年2月,埃尔西先生担任生物制药公司Regado Biosciences,Inc.的首席财务官。2012年12月至2014年2月,埃尔西先生在私人持股的再生医学公司LifeCell Corporation担任首席财务官。埃尔西先生拥有密歇根州立大学的经济学学士学位和金融MBA学位。我们相信,埃斯利先生有资格 担任我们的董事会成员,因为他在科学和生物技术公司拥有丰富的专业经验。
威廉·恩赖特自2023年2月14日起担任董事董事会薪酬委员会主席。他是一位经验丰富的生物技术高管,在私人持股和上市公司的建立和融资方面拥有34年以上的经验,目前是巴林索斯生物疗法有限公司(纳斯达克:BRNS)的首席执行官和董事,他帮助该公司于2021年4月上市 。在加入巴林瑟斯之前,比尔在董事(纳斯达克代码:ALT)工作了十多年,担任董事总裁首席执行官,将多个项目投入临床测试,完成了几笔收购,最终使公司上市。在加入Altimmune之前,Bill在GenVec,Inc.(被Precigen收购)工作了六年,并承担了越来越多的职责,最终担任业务发展主管。Bill在生命科学/生物技术行业的各种职位上拥有丰富的经验,包括担任顾问、板凳科学家和在Life Technologies,Inc.(被Thermo-Fisher收购)工作12年,在各种高级许可、商业管理、制造和研究职位 工作。比尔在布法罗获得纽约州立大学分子生物学硕士学位,并在约翰·霍普金斯大学获得商业管理理学硕士学位。我们相信,恩赖特先生有资格担任我们的董事会成员,因为他在生命科学/生物技术公司以及上市公司的管理方面拥有丰富的专业经验。
| 53 |
詹森·汉森自2023年2月14日以来一直担任董事提名和公司治理委员会主席。Hanson 先生自2018年7月以来一直担任engene Inc.的首席执行官和董事。2018年7月至2022年12月,他还担任Engene Inc.的总裁。Hanson先生有效地将engene从一家在GI发现领域工作的小型私人公司 重新启动为在纳斯达克交易的临床阶段基因治疗肿瘤学公司,实现了公司的新的科学、技术和战略愿景 。2016年8月至2017年11月,Hanson先生担任位于马萨诸塞州剑桥市的生物技术公司Ohana Biosciences的总裁兼首席执行官,并于2017年11月至2018年6月担任Ohana董事会成员和顾问。汉森先生曾于2015年11月至2016年8月担任NuVasive,Inc.执行副总裁总裁兼首席战略官。2014年5月至2015年10月,汉森先生担任通用电气公司企业副总裁总裁,并担任全球制药、医疗器械和医疗服务企业GE Healthcare的高级管理团队成员。2013年1月,Hanson先生担任Valeant制药国际公司(现为博世健康公司)公司集团董事长兼执行副总裁总裁。在此之前,他曾在美第奇制药公司担任过各种职务,包括在2006年7月至2012年12月期间担任执行副总裁总裁和首席运营官。从1999年4月至2006年7月,Hanson先生还在GE Healthcare担任过多个职位,包括总法律顾问的职位。汉森先生拥有康奈尔大学的学士学位和杜克大学法学院的法学博士学位。
公司治理
董事会在风险监督过程中的作用
董事会广泛参与对与我们和我们的业务相关的风险管理的监督,并通过审计委员会的定期报告来完成这一监督。
董事 独立
根据纳斯达克上市规则第5605(A)(2)条对独立性的定义和美国证券交易委员会确立的标准,艾尔西先生、恩赖特先生和汉森先生是独立的。
我们董事会的委员会
审计委员会
我们的审计委员会由Don Elsey、William Enright和Jason Hanson组成,Elsey先生担任主席。我们的董事会已经 肯定地认定,每个人都符合董事资本市场规则下的“独立纳斯达克”的定义, 并且符合规则10A-3下的独立性标准。我们审计委员会的每位成员都符合纳斯达克规则的金融知识要求 。我们的董事会已经通过了审计委员会的书面章程,可以在我们的网站https://ir.bullfrogai.com/corporate-governance/governance-documents.上找到
审计委员会由董事会任命,以协助董事会履行其职责,监督公司的会计、财务报告和内部控制职能以及对公司财务报表的审计。审计委员会的作用是监督管理层履行其对公司会计和财务报告及其内部控制制度的完整性的责任,监督公司独立审计师的业绩和资格,包括 独立审计师的独立性,公司内部审计职能的履行情况,以及公司遵守法律和法规要求的情况。审计委员会在2023年召开了四次会议。
薪酬委员会
我们的薪酬委员会由威廉·恩赖特、唐·埃尔西和杰森·汉森组成,恩赖特先生担任主席。我们的董事会已经通过了薪酬委员会的书面章程,该章程可以在我们的网站https://ir.bullfrogai.com/corporate-governance/governance-documents.上找到
薪酬委员会负责审查和建议,其中包括:
| ● | 董事会的充分性和薪酬形式; | |
| ● | 首席执行官的薪酬,包括基本工资、奖励奖金、股票期权和其他津贴、奖励和福利 聘用时和按年计算; | |
| ● | 其他高级管理人员在聘用时和每年的薪酬;以及 | |
| ● | 公司的激励性薪酬和其他基于股权的计划,并在必要时向我们的董事会建议更改此类计划。 |
提名 和公司治理委员会
我们的提名和公司治理委员会由詹森·汉森、威廉·恩赖特和唐·埃尔西组成,汉森先生担任主席。 我们的董事会已经通过了提名和公司治理委员会的书面章程,可以在我们的 网站https://ir.bullfrogai.com/corporate-governance/governance-documents.上找到
除其他事项外,提名委员会负责:
| ● | 制定董事会和委员会成员资格标准; | |
| ● | 确定 名有资格成为董事会成员的个人; | |
| ● | 推荐 名董事候选人和董事会各委员会成员; | |
| ● | 每年 审查我们的公司治理准则;以及 | |
| ● | 监督和评估董事会的业绩,并领导董事会对其做法和 有效性进行年度自我评估。 |
任期
所有 董事任职至公司下一次股东年会,并直至他们的继任者正式选出 并获得资格。高级职员由董事会选举产生,并由董事会酌情决定。
| 54 |
商业行为和道德准则
我们 通过了适用于我们的首席执行官、首席财务官、首席会计官或财务总监、员工或执行类似职能的人员的商业行为和道德准则。我们的道德准则可以在https://ir.bullfrogai.com/corporate-governance/governance-documents.上找到
家庭关系
发行人的董事、高级管理人员、发行人提名或选择成为 董事或高级管理人员的人,或发行人持有任何类别股权证券超过10%的实益拥有人之间没有 家族关系。
参与某些法律程序
我们可能会不时卷入与其在正常业务过程中的运营所引起的索赔有关的诉讼。 目前没有针对我们的法律诉讼、政府行动、行政行动、调查或索赔待决 或涉及本公司或其任何关联公司管理层认为的法律诉讼、政府行动、行政行动、调查或索赔。
高管 和董事薪酬
汇总表 薪酬表
下表列出了过去两个财年授予或支付给我们的首席执行官和另外两名薪酬最高的 高管的所有薪酬。
名称和负责人 职位 | 年 | 薪金 ($) | 奖金 ($) | 股票奖励(美元) | 期权奖励(美元) | 所有其他补偿(美元) | 总补偿(美元) | |||||||||||||||||||||
| 维宁德·辛格 | 2023 | $ | 707,666 | $ | - | $ | - | $ | - | $ | - | $ | 707,666 | |||||||||||||||
| 董事首席执行官兼首席执行官 | 2022 | $ | 179,000 | - | - | - | - | $ | 179,000 | |||||||||||||||||||
| 戴恩·萨格里奥 | 2023 | $ | 310,000 | $ | 50,000 | $ | - | $ | 147,000 | $ | - | $ | 507,000 | |||||||||||||||
| 首席财务官 | 2022 | $ | 30,000 | $ | - | $ | - | $ | - | $ | - | $ | 30,000 | |||||||||||||||
雇佣协议
2022年5月16日,我们与Vininder Singh签订了一项雇佣协议,根据协议,他将获得400,000美元的年基本工资,该工资须由公司进行半年一次的审查。根据董事会确定的某些目标和业绩标准的实现情况,辛格先生还将有资格获得年度奖金。辛格在截至2022年至2025年的财年的目标年度奖金将至少是当前基本工资的20%,根据目标完成情况,最高奖金将达到100%。2023年,确定辛格先生奖金的标准将包括: (I)公司实现500,000美元的销售额;(Ii)向FDA提交关于甲班唑的新药(IND)研究申请; (Iii)公司建立两(2)个战略合作伙伴关系;以及(Iv)公司开始与第三方 就HSV-1、bf-114或bf-222进行合作伙伴谈判。如果董事会批准,辛格先生还将有资格参与公司的股票激励计划。与辛格先生的协议将持续到辛格先生辞职、因公司原因终止或辛格先生去世或残疾为止。
| 55 |
未偿还的 财政年末的股权奖励
下表汇总了截至2023年12月31日每位被任命的高管所持有的未偿还股权奖励。此表包括 未行使和未授予的期权和股权奖励。
| 截至2023年12月31日的未偿还股权奖 | ||||||||||||||||||||
| 期权大奖 | ||||||||||||||||||||
| 名字 | 日期 格兰特 | 数量 证券 潜在的 未锻炼身体 选项(#) 可操练 | 数量 证券 潜在的 未锻炼身体 选项(#) 不能行使 | 权益 激励措施 平面图 奖项: 数量 证券 潜在的 未锻炼身体 不劳而获 选项(#) | 选择权 锻炼 价格(美元) | 选择权 期满 日期 | ||||||||||||||
| 戴恩·萨格里奥 | 2023年3月17日 | 43,750 | 31,250 | — | 2.80 | 2033年3月17日 | ||||||||||||||
董事 薪酬
下表汇总了截至2023年12月31日止年度内支付予本公司执行董事及非执行董事的薪酬。
| 名字 | 费用 已赚取或 已缴入 现金 ($)(1) | 库存 奖项 ($) | 选择权 奖项 ($)(2) | 所有其他 补偿 ($) | 总计 ($) | |||||||||||||||
| 维宁德·辛格(3) | — | — | — | — | — | |||||||||||||||
| 唐·埃尔西 | 39,375 | — | 197,200 | — | 236,575 | |||||||||||||||
| 威廉·恩赖特 | 39,375 | — | 197,200 | — | 236,575 | |||||||||||||||
| 杰森·汉森 | 39,375 | — | 197,200 | — | 236,575 | |||||||||||||||
| (1) | 代表在2023财年担任董事和董事会委员会主席的 现金薪酬。 |
| (2) | 表示2023财年根据我们的2022股权激励计划发行的股票期权的年价值 。 |
| (3) | 辛格先生在2023财年没有因作为我们公司的董事服务而获得额外报酬 。 |
2022年股权激励计划
2022年11月30日,本公司董事会和股东通过了《2022年股权激励计划》(以下简称《计划》)。根据该计划,我们有权向高级管理人员、董事、员工和顾问授予期权和其他股权奖励。根据本计划颁发的奖励可购买的每股普通股的行权价格应由我们的薪酬委员会在授予时自行决定,但不得低于授予奖励之日该普通股的公平市场份额的100%,受本计划进一步描述的调整和条件的制约。我们的薪酬委员会也将在授予时拥有制定所有奖励条款的独家权力。截至2023年12月31日,该计划下有461,500股可用股票 。
| 56 |
某些 关系和关联方交易
以下是对过去三个会计年度中发生的每笔交易的描述,以及每笔当前拟议的交易,其中:(I)涉及的金额超过或将超过(A)120,000美元或(B)截至2022年12月31日或2022年12月31日的财政年度平均总资产的1%, 其中涉及的金额超过或将超过(A)120,000美元或(B)截至2022年12月31日的财政年度平均总资产的1%。 及(Ii)本公司任何董事、行政人员或持有超过5%股本的人士,或与上述人士同住的直系亲属 的任何成员曾经或将会拥有直接或间接的重大利益。
2021年7月8日,本公司与关联方Tivoli Trust(本公司第二大股东(“投资者”))签订了一份未来股权简单协议(SAFE),金额为150,000美元,利息为0%。根据外管局协议,如果在本外汇局终止前存在股权融资,则在该股权融资最初完成时,该外汇局将自动将 转换为等于购买金额除以转换价格的外管局优先股数量,这意味着:(1) 安全价格(每股价格等于货币后估值上限除以公司资本)或(2)折扣 价格(股权融资中出售的标准优先股每股价格乘以贴现率),无论哪一种计算都会产生更多的安全优先股股票。本外管局将自动终止(不免除本公司因先前违反或不遵守本外管局而产生的任何义务),在下列最早发生的情况下立即终止:(I) 根据本外管局根据协议自动转换向投资者发行股本;或(Ii)根据协议向投资者支付应支付的金额,或将其留作支付。2023年2月公司首次公开发行时,外汇局转换为32,967股普通股 。
2021年8月19日,该公司与关联方签订了一项可转换贷款协议,本金余额为99,900美元,利息为9%。票据持有人有权将本金和利息转换为公司的普通股。这笔贷款包括5%的原始发行折扣,并包括99,900份认股权证,行使价为1美元,可于认股权证面值发行日期起计5年内行使。贷款到期日为2022年2月19日。于2022年5月,本公司与票据持有人同意 取消及废止先前的认股权证,并就115,185份认股权证订立新协议,行使价为2.50美元。票据持有人 选择在公司2023年2月首次公开发行时将贷款转换为21,747股普通股。
于2021年6月15日,该公司与投资者订立一项无抵押短期贷款协议,本金总额为34,000美元,到期日为一年,应计利息5%,额外计入1%利息。贷款的全部金额,包括利息,已于2022年偿还。
于2021年11月19日,该公司与投资者订立无抵押短期贷款协议,本金总额为5,000美元,到期日为一年,应计利息为5%,并额外计入1%的利息。贷款包括利息在内的全部金额已于2022年偿还。
于2021年12月13日,该公司与投资者订立一项无抵押短期贷款协议,本金总额为10,000美元,到期日为一年,应计利息5%,额外计入1%利息。贷款的全部金额,包括利息,已于2022年偿还。
于2022年10月5日,本公司与投资者订立一项交换协议,据此将其所有普通股734,493股 交换为A系列可转换优先股。A系列优先股在经济上等同于普通股,但没有投票权,并受到禁止转换为普通股的限制,如果这会导致 投资者当时拥有公司已发行普通股的4.99%以上。有关A系列优先股的权利和优先股的说明 ,请参阅“证券-A系列可转换优先股说明”。
相关 人员交易政策
仅就我们的政策而言,关联人交易是指我们和任何关联人正在、曾经或将成为参与者的交易、安排或关系,或任何一系列类似的交易、安排或关系,涉及的金额超过 12万美元或年末我们总资产平均水平的1%。作为员工或董事向我们提供的服务涉及补偿的交易不在本政策的涵盖范围内。关联人是指持有我们任何类别有表决权证券超过5%的任何高管、董事或实益拥有人,包括他们的任何直系亲属和由该等人士拥有或控制的任何实体。
根据该政策,如果一项交易已被确定为关联人交易,包括任何最初完成时不是关联人的交易,或者任何在完成之前最初未被确定为关联人交易的交易,我们的管理层必须向我们的审计委员会提交关于该关联人交易的信息,或者,如果审计委员会 批准不适当,则向我们董事会的另一个独立机构提交有关该关联人交易的信息,以供审查、审议和批准或批准。 陈述必须包括对重大事实、利益、直接和间接、在相关的 人中,交易给我们带来的好处,以及交易的条款是否可与 或无关第三方或一般员工之间的条款相媲美。根据该政策,我们将从每一位董事、高管以及(在可行的情况下)重要股东那里收集我们认为合理必要的信息,以便 我们能够识别任何现有的或潜在的关联人交易,并执行该政策的条款。此外,根据我们的商业行为和道德准则,我们的员工和董事有明确的责任披露任何可能导致利益冲突的交易或关系。在考虑关联人交易时,我们的审计委员会或我们董事会的其他独立机构将考虑相关的现有事实和情况 ,包括但不限于:
| ● | 给我们带来的风险、成本和收益; | |
| ● | 如果关系人是董事、董事的直系亲属或董事所属实体,对董事独立性的影响; | |
| ● | 类似服务或产品的其他来源的可用性;以及 | |
| ● | 根据具体情况,可提供给无关第三方或员工提供或来自员工的条款。 |
政策要求,在决定是否批准、批准或拒绝关联人交易时,我们的审计委员会或我们的董事会的其他独立机构必须根据已知情况,考虑交易是否符合我们和我们股东的最佳利益,因为我们的审计委员会或我们的董事会的其他独立机构真诚地行使其自由裁量权。
| 57 |
安全 某些受益所有者和管理层的所有权,以及
相关的 股东事项
下表列出了截至2024年1月25日我们普通股的受益所有权的某些信息,具体如下:
| ● | 我们任命的每一位执行官员; | |
| ● | 我们的每一位董事; | |
| ● | 作为一个整体,我们所有的现任董事和高管;以及 | |
| ● | 我们所知的每一位实益持有我们普通股5%以上的股东。 |
受益 所有权是根据美国证券交易委员会的规则确定的,包括对证券的投票权或投资权。 个人或集团可能在2024年1月25日起60天内根据期权或认股权证的行使 以及可转换债务获得的普通股股份,在计算该个人或集团的所有权百分比时视为未偿还。所有权百分比基于2024年1月25日发行的6,094,644股普通股和在本次发行中出售786,938股后的6,881,582股。
除本表脚注所示的 外,根据该等股东向吾等提供的资料,吾等相信本表所指名的股东对其实益拥有的所有普通股拥有独家投票权及投资权。 除非另有说明,否则所有上市股东的地址为c/o BullFrog AI Holdings,Inc.,325 Ellington Blvd.,Unit317, Gaithersburg,MD 20878。
| 实益拥有人姓名或名称 | 实益拥有的普通股 | 百分比 发行前普通股 | 发行后普通股比例 (1) | |||||||||
| 董事及高级职员: | ||||||||||||
维宁德·辛格 (2) 董事首席执行官兼首席执行官 | 2,618,779 | 42.97 | % | 37.27 | % | |||||||
戴恩 萨廖 (3) 首席财务官 | 108,642 | 1.76 | % | 1.54 | % | |||||||
| R.唐·埃尔西 (4) | 21,110 | * | * | |||||||||
| 威廉·恩莱特 (5) | 21,110 | * | * | |||||||||
| 杰森·汉森 (6) | 21,110 | * | * | |||||||||
| 所有高级职员和董事(5人) | 2,790,721 | 44.53 | % | 39.71 | % | |||||||
| 5%以上的受益人 | ||||||||||||
| Tivoli Trust (7) | 904,391 | 13.02 | % | 11.52 | % | |||||||
* 表示 小于1%。
| (1) | 假设 (i)承销商未行使其购买额外普通股以弥补超额配售(如有)的选择权; (ii)没有行使认股权证;及(iii)786,938股普通股在本次发行中出售。 |
| (2) | 包括(i)2,592,446股普通股和 (ii)26,333股普通股可在行使普通股购买股票期权时发行,行使价为每股3.89美元 股 |
| (3) | 组成 (i)47,142股普通股和(ii)61,500股可在行使普通股购买股票时发行的普通股 期权的加权平均行使价为每股3.00美元。 |
| (4) | 包括 21,110股普通股可在行使股票期权时发行,行使价为每股6.82美元。 |
| (5) | 包括 21,110股普通股可在行使股票期权时发行,行使价为每股6.82美元。 |
| (6) | 包括 21,110股普通股可在行使股票期权时发行,行使价为每股6.82美元。 |
| (7) | 组成 (i)73,449股无投票权A系列优先股,(ii)115,185份认股权证,可按每股普通股2.50美元行使, 及(iii)54,714股普通股与两项以低于首次公开发售价格转换的可换股债务工具有关。 假设将所有A系列优先股转换为普通股,每股转换为10股普通股。 A系列优先股的一股。 |
| 58 |
可供未来转售的股份
未来在公开 市场上出售大量普通股或认为可能发生此类出售可能会对市场价格产生不利影响。此外, 由于现有的合同和法律 对转售的限制(如下所述),本次发行后不久将只有有限数量的股票可供出售,因此在 限制失效后,可能会在公开市场上出售大量我们的普通股。这可能会对我们普通股的现行市场价格和我们未来筹集股本的能力 产生不利影响。
本次发行完成后,我们将有6,881,582股普通股发行在外(如果承销商购买额外股份的 选择权被完全行使,则为6,999,622股)。
本次发行中出售的所有 普通股股票将可以自由交易,不受限制,也不受证券法 规定的进一步登记,除非这些股票是由规则144中定义的我们的“关联公司”购买的,并且在本次发行完成后, 将受到以下描述的禁售期的某些股票除外。除非符合规则144的数量限制、销售方式和通知要求、另一项适用的注册豁免或有效的注册声明,否则不得转售我们关联公司拥有的任何股票。
本公司董事、高级职员及持有本公司至少10%已发行证券的持有人所持有的任何 股份,将受到第60页“包销”一节所述的 九十(90)天禁售期限制。因此,锁定期届满后符合出售资格的股份数目将相应增加。由于这些协议,在遵守规则144或规则701的规定的前提下,股票将可在公开市场上出售,具体如下:
| ● | 开始 在本招股说明书发布之日,本次发行中出售的所有股票将立即在公开市场上出售 (除上述情况外); | |
| ● | 开始 本次发行完成后九十(90)天,我们的管理人员、董事和 持有至少10%的公司已发行证券,3,695,112股额外股份将成为合格 在公开市场上出售,所有这些股份将由关联公司持有,并受 第144条和第701条如下所述。 |
公司 认股权证
作为本招股说明书一部分的 登记声明还登记了购买最多786,938股 普通股的销售权证(或904,978股普通股,如果承销商完全行使其超额配售选择权)。公司认股权证 将在发行后立即行使,并将在原发行日期的第五周年到期,假设 初始行使价为7.29美元。
预付资金 认股权证
作为本招股说明书一部分的 登记声明还登记出售预融资认股权证,以购买最多786,938股普通股,假设发行价为每股认股权证6.629美元(本次发行中向公众出售的每股公司股份和公司 认股权证的合并价格减去0.001美元)。预先注资认股权证将可于发行后立即行使, 可随时行使,直至所有预先注资认股权证悉数行使为止,且初始行使价等于 0.001美元。有关该等认股权证的说明,请参阅“股本说明-预拨资金认股权证”。
承销商的认股权证
除现金补偿外,我们还同意向承销商发行认股权证,以购买相当于本次发行中发行的公司股票和/或预先注资认股权证总数 6%的普通股(不包括为弥补超额配售而出售的股票, 如果有)。假设每股公司股票和公司认股权证的合并公开发行价为6.63美元,承销商认股权证的每股行使价为7.29美元(每股公司股票和公司认股权证合并公开发行价 的110%)。 承销商认股权证将在本次发行结束后180天起的五年期间内不时全部或部分行使。我们已在登记声明(本招股说明书是其中一部分)中登记了最多47,216股在行使 承销商认股权证时可发行的普通股(不包括为弥补超额配售而出售的股份, 如有)。
| 59 |
规则 144
总体而言,根据目前有效的第144条规则,一旦我们受到上市公司报告要求至少90天的约束, 在出售前90天内的任何时间,根据证券法,任何人都不被视为我们的附属公司之一,并且实益拥有拟出售的股票至少六个月,包括我们附属公司以外的任何先前所有者的持有期, 有权出售这些股票,而不遵守规则144的出售方式、成交量限制或通知 条款。须遵守规则第144条的公开信息要求。如果该人实益拥有拟出售的股份至少一年,包括我们关联公司以外的任何先前所有人的持有期,则该人将有权在不遵守第144条任何要求的情况下出售该等股份。
一般来说,根据目前有效的第144条规则,我们的关联公司或代表我们关联公司出售股票的人员有权在上述锁定协议到期后的任何三个月内,在任何三个月内出售不超过 以下较大者的股份:
| ● | 1% 我们当时已发行的普通股的数量,在本次发行后将立即相当于约100股; 或 | |
| ● | 在提交表格144中关于此次出售的通知之前的四个日历周内,我们普通股的平均每周交易量。 |
我们的联属公司或代表我们的联属公司出售股份的人根据规则144进行的销售 也受某些销售条款和通知要求的约束,并受制于关于我们的当前公开信息的可用性。
规则 701
规则 701一般允许根据书面补偿计划或合同购买我们普通股的股东,并且 在紧接之前的90天内不被视为我公司的关联公司的股东,可以依据规则144出售这些股票,但不需要遵守规则144的公开信息、持有期、数量限制或通知条款。规则701还允许我们公司的关联公司根据规则144出售其规则701股票,而不遵守规则144的持有期要求。然而,根据该规则,所有规则701股票的持有者必须等到本招股说明书日期 之后90天,才能根据规则701出售该等股票,并受上述锁定协议的约束。
承销
WallachBeth Capital LLC是此次发行的唯一簿记管理人和承销商的代表(“代表”)。 根据我们和代表之间的承销协议的条款和条件,我们已同意向承销商出售 ,承销商同意以公司股票的综合公开发行价和附带的公司认股权证向我们购买,减去本招股说明书封面上列出的承销折扣、公司股票数量 和下表中其名称旁边列出的伴随公司认股权证:
| 承销商 |
数 公司股份和配套公司认股权证 | |||
| WallachBeth Capital LLC | ||||
| 总计 | ||||
如果承销商购买任何此类证券,则承销商承诺购买我们提供的所有公司股票和随附公司认股权证,以下所述购买额外公司股票和随附公司认股权证的选择权所涵盖的 除外。承销协议中约定的事项发生时,承销商的义务可以终止。此外,根据承销协议,承销商的责任须受承保协议所载的惯常条件、陈述及保证所规限,例如承销商收到高级人员的 证书及法律意见。
| 60 |
我们 已同意赔偿承销商的特定责任,包括证券法下的责任,并支付承销商可能需要为此支付的款项。
承销商在向承销商发出并接受承销产品时、在承销协议中规定的其他条件和法律 事项批准的前提下,向承销商提供该等产品,但须事先出售。承销商保留撤回、取消或修改对公众的报价以及拒绝全部或部分订单的权利。
超额配售 选项
我们 已授予承销商代表在本招股说明书发布之日起45天内按公开发行价减去承销折扣和佣金、最多额外118,040股公司股票(和/或为取代公司股票而发行的预先出资认股权证)和/或118,040份公司认股权证的任何组合减去承销折扣和佣金的选择权, 以弥补超额配售。
折扣和佣金;费用
我们已同意向承销商支付相当于所售证券销售总价的8%(8%)的现金费用。 下表显示了我们的公开发行价、承销折扣和扣除费用前的收益。信息 假定承销商不行使或完全行使其超额配售选择权。
按 公司股份和随附的公司认股权证 | 总计 如果没有过多- 分配 选择权 | 总计 随着时间的推移- 分配 选择权 | ||||||||||
| 公开发行价 | $ | $ | $ | |||||||||
| 承销折扣(8%) | $ | $ | $ | |||||||||
| 扣除费用前的收益,付给我们 | $ | $ | $ | |||||||||
承销商建议以本招股说明书封面所载的每股公司股份和随附公司认股权证的合并公开 发行价向公众发售我们发售的公司股份和随附公司认股权证。此外,承销商 可以以减去每股公司股票0.53美元和随附的 公司权证的优惠的价格向其他证券交易商提供部分证券。如果我们发售的所有公司股票未按合并公开发行价格出售,承销商可以 通过补充本招股说明书的方式更改合并发行价格和其他出售条款。
我们 还同意向承销商报销合理的自付费用,总额不超过115,000美元,无论 本次发行是否结束。我们估计,除 承销折扣外,我们与此次发行有关的应付费用总额约为258,091美元。此外,我们还同意向承销商支付非实报实销的 费用补贴,金额为总发行额的1%(包括行使超额配售权时购买的股票)。
但是, 承销协议规定,如果终止发行,则根据FINRA规则5110(g)(4)(A),支付给承销商的任何预付费用保证金 将被退还,但前提是发行费用并未实际发生。
承销商的认股权证
作为对承销商的 额外补偿,在本次发行完成后,我们将向代表或其指定人发行 认股权证,以购买我们的普通股,其总数等于本次发行中发行的公司股票数量的6% (不包括为弥补超额配售而出售的任何股份(如有)),每股行使价相当于公开发行价的110% (“承销商认股权证”)。
承销商的认股权证和普通股的基础股份将不会被行使、出售、转让、转让、质押或 抵押,也不会成为任何对冲、卖空、衍生、看跌、会导致任何人在登记声明生效日期 起180天内有效经济 处置承销商权证的认购或赎回交易(“生效日期”)根据FINRA规则5110(e)(1)。承销商认股权证 将在本次发行结束后180天内全部或部分行使,并将在发行第五周年 到期。我们已在本招股说明书所属的登记声明中登记了承销商认股权证和行使承销商认股权证时可发行的最多47,216股普通股。
右 参与
我们 已授予代表参与权,在本次发行结束后的九(9)个月内, 公司将授予代表担任公司每次 和未来每次公开和私募股权和债券发行的主承销商或账簿管理经理或配售代理的权利,或本公司的任何继承人或任何子公司在上述九(9)个月期间内在任何美国证券交易所上市,根据配售代理协议中双方商定的机制。优先参与权仅在发行导致总收益至少为4,500,000美元的情况下有效。
| 61 |
可自由支配的 帐户
承销商不打算确认将在此发售的证券出售给他们拥有自由裁量权的任何账户。
赔偿
我们 已同意赔偿承销商的特定责任,包括证券法下的责任,并支付承销商可能需要为此支付的款项。
发行价的确定
本招股说明书封面所载的公开招股价格是根据承销商和我们之间的公平谈判确定的,其中包括发行前我们普通股的交易情况。
锁定协议
除某些例外情况外,吾等与吾等的每位高级职员、董事及10%或以上的股东已同意,在本次发售完成后九十(90)天内,在未经代表事先书面同意的情况下,在九十(90)天内不得提出、发行、出售、订立出售合约、设定产权、授予任何出售或以其他方式处置可转换为或可行使或可交换为普通股的任何普通股或其他证券的选择权。锁定不会阻止公司首席执行官根据其10B-5计划计划出售任何 股票。
代表人可在禁售期届满前,在没有通知的情况下,随时自行决定解除部分或全部受禁售期协议约束的股份。在决定是否解除禁售协议的股份时,代表 会考虑证券持有人要求解除股份的理由、要求解除股份的股份数目,以及当时的市场情况。
| 62 |
价格稳定、空头和惩罚性出价
在此次发行中,承销商可根据《交易法》规定的规则M从事稳定交易、超额配售交易、银团交易和惩罚性出价:
| ● | 稳定的交易允许出价购买证券,只要稳定的出价不超过指定的最大值。 |
| ● | 超额配售 指承销商出售的证券数量超过承销商有义务购买的证券数量,这就形成了辛迪加空头头寸。空头头寸可以是回补空头头寸,也可以是裸空头寸。在回补空头头寸中,承销商超额配售的证券数量不超过他们可以在超额配售期权中购买的证券数量 。在裸空头头寸中,涉及的证券数量超过超额配售期权中的证券数量。承销商可以通过行使其超额配售选择权和/或在公开市场购买证券来平仓任何有担保的空头头寸。 |
| ● | 辛迪加 回补交易涉及在分销完成后在公开市场购买证券,以 回补辛迪加空头头寸。在确定平仓的证券来源时,承销商除其他事项外,将考虑公开市场上可供购买的证券价格与他们可通过超额配售选择权购买证券的价格。如果承销商出售的证券超过超额配售选择权可以覆盖的证券数量,就会出现裸空头头寸。这一头寸只能通过在公开市场买入证券来平仓。如果承销商担心定价后证券在公开市场上的价格可能存在下行压力,可能对购买此次发行的投资者产生不利影响,则更有可能建立裸 空头头寸。 |
| ● | 罚金 出价允许承销商在辛迪加 成员最初出售的证券通过稳定或辛迪加回补交易购买以回补辛迪加空头头寸时,从该辛迪加成员那里收回出售特许权。 |
这些 稳定交易、银团覆盖交易和惩罚性出价可能具有提高或维持我们证券的市场价格或防止或延缓证券市场价格下跌的效果。因此,我们的普通股和认股权证的价格可能会高于公开市场上可能存在的价格。这些交易可随时终止 。
对于上述交易对我们普通股和认股权证的价格可能产生的任何影响的方向或大小,我们和承销商均不做任何陈述或预测。此外,吾等和承销商均不表示承销商将参与这些交易,或任何交易一旦开始,将不会在没有通知的情况下终止。
电子股份要约、出售和分配
电子格式的招股说明书可在代表维护的网站上查阅,也可在其他承销商维护的网站上查阅。承销商可同意向承销商分配一定数量的股票,以出售给其 在线经纪账户持有人。互联网分销将由代表在与其他分销相同的基础上分配给可能进行互联网分销的承销商。对于此次发行,承销商或银团成员可以电子方式分发招股说明书。除可打印为Adobe®PDF的招股说明书外,任何形式的电子招股说明书都不会用于此次发售 。
承销商已通知我们,他们不希望确认将本招股说明书提供的股票出售给他们 行使自由裁量权的账户。
除电子形式的招股说明书外,任何承销商网站上的信息以及承销商维护的任何其他 网站上的任何信息都不是招股说明书或本招股说明书的一部分, 未经吾等或任何承销商以承销商身份批准和/或背书,投资者不应依赖。
| 63 |
交易; 纳斯达克资本市场上市
我们的 普通股和可交易认股权证在纳斯达克资本市场上市,代码分别为“BFRG”和“BFRGW " 。我们并无申请,亦无意申请将预先注资认股权证或公司认股权证在纳斯达克上市。
其他 关系
承销商和/或其关联公司不时为我们提供并可能在未来提供各种投资银行和其他 金融服务,承销商和/或其关联公司已收到并可能在未来收到惯常费用。除提供与本次发行有关的服务 以及下文所述的服务外,承销商在本招股说明书日期前180天内未提供任何投资银行或其他金融服务。
美国以外的报价
除美国以外,我们或承销商尚未采取任何行动,允许本招股说明书提供的证券在需要采取行动的任何司法管辖区进行公开发行。本招股说明书提供的证券不得直接或间接发售或出售,本招股说明书或任何其他与发售和出售任何此类证券有关的发售材料或广告不得在任何司法管辖区分发或发布,除非在符合该司法管辖区适用规则的情况下。建议持有本招股说明书的人告知自己,并遵守与本招股说明书的发行和分发有关的任何限制。 本招股说明书不构成在 任何司法管辖区出售或邀请购买本招股说明书所提供的任何证券的要约,而此类要约或要约是非法的。
专家
Bullfrog AI Holdings,Inc.的 财务报表。截至2022年12月31日及2021年12月31日止财政年度,本招股说明书 及注册声明其他部分所载的资料乃依据独立注册会计师事务所M&K CPA(M&K CPA)作为会计及审计专家所出具的报告而载列。
法律事务
Sichenzia Ross Ference Carmel LLP(纽约州纽约市)将在本次 发行中出售的我们普通股股份的有效性之后进行转让。谢泼德,穆林,里希特和汉普顿有限责任公司,纽约,纽约,将通过在某些法律问题的承销商。
| 64 |
此处 您可以找到其他信息
我们 已根据《证券法》以S-1表格向SEC提交了关于我们 出售的证券的注册声明。本招股章程构成注册声明的一部分,并不包括 注册声明中所载的所有信息以及注册声明的附件、附表和修订。有关 我们和我们的证券的进一步信息,请参阅注册声明以及注册声明的附件和附表。 本招股说明书中有关任何合同、协议或其他文件内容的陈述不一定完整, 在每种情况下,我们请您参考作为注册声明附件提交的合同、协议或其他文件的副本。 这些陈述中的每一个在所有方面都受到这一参考的限制。
SEC维护一个网站,该网站位于 Www.sec.gov,其中包含以电子方式向SEC提交的报告、代理和信息声明以及有关发行人的其他信息 。您可以在SEC的网站上访问注册声明, 本招股说明书是其中的一部分。
本次发行完成后,我们将遵守《1934年证券交易法》的信息报告要求, 我们将向SEC提交报告、代理声明和其他信息。提交给SEC的所有文件均可在上述SEC的公共参考资料室和网站上查阅和复制。我们有一个网站www.bullfrogai.com。您可以 在本网站上免费访问我们的报告、代理声明和其他信息, 此类材料以电子方式提交给或提供给SEC后,在合理可行的情况下尽快访问。该网站上的信息并非以引用方式并入, 并非本招股说明书的一部分。
| 65 |
牛蛙 AI控股公司。
财务报表索引
| 已审核 截至2022年及2021年12月31日止年度的财务报表 | |
| 独立注册会计师事务所报告 | F-2 |
| 合并资产负债表 | F-3 |
| 合并业务报表 | F-4 |
| 合并股东亏损表 | F-5 |
| 合并现金流量表 | F-6 |
| 合并财务报表附注 | F-7 |
| 截至2023年9月30日和2022年9月30日的三个月和九个月的未经审计的 简明合并财务报表 | |
| 简明综合资产负债表 | F-21 |
| 简明综合业务报表 | F-22 |
| 股东亏损变动表简明综合报表 | F-23 |
| 现金流量表简明合并报表 | F-24 |
| 简明合并财务报表附注 | F-25 |
| F-1 |
牛蛙 AI控股公司。
经审计的 财务报表
2022年和2021年
独立注册会计师事务所报告{br
致 董事会和
牛蛙AI控股公司的股东
对财务报表的意见
我们 审计了所附牛蛙人工智能控股公司(本公司)截至2022年和2021年12月31日的综合资产负债表和截至2022年和2021年12月31日的相关综合经营报表、股东赤字变化和现金流量 以及相关附注(统称财务报表)。吾等认为,该等财务报表在各重大方面均公平地反映本公司于2022年12月31日及2021年12月31日的财务状况,以及截至2022年12月31日止两年期间的营运结果及现金流量,符合美国公认的会计原则。
征求意见的依据
这些 合并财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须对公司保持独立。
我们 根据PCAOB的标准进行了审计。这些标准要求我们计划和执行审计,以获得关于合并财务报表是否没有重大错报的合理保证,无论是由于错误还是欺诈。 本公司不需要也不需要我们对其财务报告内部控制进行审计。作为我们审计的一部分,我们需要了解财务报告的内部控制,但不是为了对公司财务报告内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的 审计包括执行评估合并财务报表重大错报风险的程序(无论是由于错误还是欺诈),以及执行应对这些风险的程序。这些程序包括在测试的基础上审查与财务报表中的数额和披露有关的证据。我们的审计还包括评估使用的会计原则和管理层作出的重大估计,以及评估财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的基础。
重大审计事项
下文所述的 关键审计事项是本期审计综合财务报表产生的事项, 已向或须向审核委员会传达,且:(1)与对财务报表重大的账目或披露事项有关 及(2)涉及我们特别具有挑战性、主观或复杂的判断。传达关键 审计事项并不以任何方式改变我们对综合财务报表整体的意见,我们在下文传达 关键审计事项,并非对关键审计事项或与之相关的账目或披露 提供单独意见。
如附注2中所述,由于经营净亏损持续存在和经营现金流为负,公司在上一年度进行了持续经营披露。鉴于 公司使用管理层对未来收入和费用的估计,这是很难证实的,因此审计管理层对持续经营的评估可能是一个重要的判断。
我们 评估了取消持续经营的适当性,我们检查和评估了财务信息以及管理层 减轻持续经营的计划和管理层对持续经营的披露。
| /S/ M&K CPAS,PLLC | |
| 我们 自2021年以来一直担任本公司的审计师。 | |
| 德克萨斯州休斯顿 | |
| 2023年4月25日 |
| F-2 |
牛蛙 AI控股公司。
合并资产负债表
| 12月31日 | 12月31日 | |||||||
| 2022 | 2021 | |||||||
| (经审计) | (经审计) | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金 | $ | $ | ||||||
| 预付费用 | ||||||||
| 流动资产总额 | $ | $ | ||||||
| 非流动资产: | ||||||||
| 财产和设备,净额 | ||||||||
| 非流动资产总额 | $ | |||||||
| 总资产 | $ | $ | ||||||
| 负债和股东赤字 | ||||||||
| 流动负债: | ||||||||
| 应付帐款 | $ | $ | ||||||
| 应计费用 | ||||||||
| 应计费用-关联方 | ||||||||
| 递延收入 | ||||||||
| 应付票据-关联方 | ||||||||
| 可换股票据,扣除美元 | ||||||||
| 可换股票据-关连人士,扣除 | ||||||||
| 流动负债总额 | $ | $ | ||||||
| 总负债 | $ | $ | ||||||
| 股东赤字: | ||||||||
| A系列优先股,$面值,授权股份; 和股票分别发行和流通股, | ||||||||
| 普通股,$面值,授权股份;和 股票分别于2022年12月31日和2021年12月31日发行和发行 | ||||||||
| 额外实收资本 | ||||||||
| 累计赤字 | ( | ) | ( | ) | ||||
| 牛蛙股东的总亏损 | $ | ( | ) | $ | ( | ) | ||
| 股东总亏损额 | ( | ) | ( | ) | ||||
| 总负债和股东赤字 | $ | $ | ||||||
附注是这些财务报表不可分割的一部分
| F-3 |
牛蛙 AI控股公司。
合并的 运营报表
| 截至12月31日的年度 | ||||||||
| 2022 | 2021 | |||||||
| 净收入: | ||||||||
| 收入,净额 | $ | $ | ||||||
| 净收入合计 | $ | |||||||
| 售出商品成本: | ||||||||
| 销货成本 | ||||||||
| 商品销售总成本 | ||||||||
| 毛利 | ||||||||
| 运营费用: | ||||||||
| 研发费用 | ||||||||
| 一般和行政费用 | ||||||||
| 工资总额和薪金 | ||||||||
| 薪水册及薪酬相关方 | ||||||||
| 总运营费用 | ||||||||
| 运营(亏损) | ( | ) | ( | ) | ||||
| 其他收入(支出): | ||||||||
| 利息支出 | ( | ) | ( | ) | ||||
| 其他收入 | ||||||||
| 其他(费用)合计 | ( | ) | ( | ) | ||||
| 净收益(亏损) | ( | ) | ( | ) | ||||
| 每股普通股净(亏损): | ||||||||
| 基本的和稀释的 | $ | ) | $ | ) | ||||
| 已发行普通股加权平均数: | ||||||||
| 基本的和稀释的 | ||||||||
附注是这些财务报表的组成部分
| F-4 |
牛蛙 AI控股公司。
合并 股东(不足)权益变动表
截至2022年12月31日和2021年12月31日的年度
| A系列优先股 | 普通股 | 其他内容 已缴入 | 订阅 | 累计 | ||||||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 资本 | 应收账款 | 赤字 | 总计 | |||||||||||||||||||||||||
| 余额,2020年12月31日 | $ | $ | $ | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||||||||||||||||||
| 认购应收账款的现金 | - | - | ||||||||||||||||||||||||||||||
| 以可转换票据发行的认股权证 | - | - | ||||||||||||||||||||||||||||||
| 推定利息 | - | - | ||||||||||||||||||||||||||||||
| 股权补偿 | - | - | ||||||||||||||||||||||||||||||
| 股权补偿 | - | |||||||||||||||||||||||||||||||
| - | ||||||||||||||||||||||||||||||||
| 净额(亏损) | - | - | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 余额,2021年12月31日 | $ | $ | $ | $ | ( | ) | $ | ( | ) | |||||||||||||||||||||||
| 推定利息 | - | - | ||||||||||||||||||||||||||||||
| 股权补偿 | - | - | ||||||||||||||||||||||||||||||
| 可转换票据的转换 | - | |||||||||||||||||||||||||||||||
| 手令的重新分类 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 股份注销 | - | ( | ) | ( | ) | |||||||||||||||||||||||||||
| 股份发行许可证 | - | |||||||||||||||||||||||||||||||
| 普通股转换为A系列优先股 | ( | ) | ( | ) | ||||||||||||||||||||||||||||
| 净额(亏损) | - | - | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 余额,2022年12月31日 | $ | $ | $ | ( | ) | $ | ( | ) | ||||||||||||||||||||||||
附注是这些财务报表的组成部分
| F-5 |
牛蛙 AI控股公司。
合并 现金流量表
| 截至12月31日的年度 | ||||||||
| 2022 | 2021 | |||||||
| 经营活动的现金流: | ||||||||
| 净额(亏损) | $ | ( | ) | $ | ( | ) | ||
| 对净(亏损)变动与经营活动中使用的净现金和现金等价物进行调整 : | ||||||||
| 债务减免带来的收益 | ( | ) | ||||||
| 折旧费用 | ||||||||
| 股份发行许可证 | ||||||||
| 基于股票的薪酬 | ||||||||
| 债务贴现摊销 | ||||||||
| 推定利息 | ||||||||
| 经营性资产和负债变动情况: | ||||||||
| 预付费用 | ( | ) | ||||||
| 应付帐款 | ( | ) | ||||||
| 应计费用 | ||||||||
| 应计费用-关联方 | ||||||||
| 递延收入 | ||||||||
| 用于经营活动的现金净额 | ( | ) | ( | ) | ||||
| 投资活动产生的现金流: | ||||||||
| 购置财产和设备 | ( | ) | ||||||
| 投资活动的现金净额 | ( | ) | ||||||
| 融资活动的现金流: | ||||||||
| 应付可转换票据收益 | ||||||||
| 可转换票据收益--应付款关联方 | ||||||||
| 应付票据的偿还和利息关联方 | ( | ) | ||||||
| 应付票据的收益与关联方 | ||||||||
| 应支付认购收益 | ||||||||
| 融资活动的现金净额 | ||||||||
| 现金和现金等价物净增加/(减少) | ||||||||
| 现金,年初 | ||||||||
| 期末现金 | $ | $ | ||||||
| 补充现金流信息: | ||||||||
| 支付利息的现金 | $ | $ | ||||||
| 缴纳税款的现金 | $ | $ | ||||||
| 补充披露非现金活动: | ||||||||
| 手令的重新分类 | $ | $ | ||||||
| 可转换应付票据的折算 | $ | $ | ||||||
| 普通股注销 | $ | $ | ||||||
| 为获得牌照而发行的股份 | $ | $ | ||||||
| 为服务而发行的股票 | $ | $ | ||||||
| 以可转换票据发行的认股权证 | $ | $ | ||||||
附注是这些财务报表不可分割的一部分
| F-6 |
牛蛙 AI控股公司。
财务报表附注
2022年12月31日和2021年12月31日
注 1-业务的组织和性质
牛蛙人工智能控股公司于2020年2月6日在内华达州注册成立。牛蛙人工智能控股公司是牛蛙人工智能公司和牛蛙人工智能管理有限责任公司的母公司。分别于2017年和2021年在特拉华州和马里兰州注册成立。我们所有的业务目前都是通过牛蛙AI Holdings,Inc.进行的,该公司于2020年2月6日开始运营。我们是一家专注于对医药和医疗保健中的复杂数据集进行高级AI/ML驱动的分析的公司。我们的目标是利用我们的平台 ,通过外部合作伙伴关系和有选择的内部开发,采用精确医学方法来实现药物资产。
大多数新疗法都会在临床前或临床开发的某个阶段失败。这是开发新疗法的高成本的主要驱动力。开发新疗法的一个主要困难是有效地整合在开发的每个阶段产生的复杂和高维的数据,以降低开发过程的后续阶段的风险。人工智能和机器学习(AI/ML)作为帮助解决这一问题的数字解决方案应运而生。
我们 使用人工智能和机器学习来推进内部和外部项目的药物。目前大多数AI/ML平台在综合不同的高维数据以获得可操作的洞察力方面仍存在不足。我们的平台技术名为bfLEAP™,是约翰霍普金斯大学应用物理实验室(JHU-APL)开发的分析型AI/ML平台,通过提供对他们的数据的更精确的、 多维的理解, 能够克服目前阻碍研究人员和临床医生的可扩展性和灵活性方面的挑战。我们正在部署bfLEAP™,用于内部计划的几个关键开发阶段,并通过战略合作伙伴关系和合作,旨在简化治疗开发中的数据分析, 通过降低新疗法的失败率来降低总体开发成本,并影响无数可能无法获得所需治疗的患者的生活 。
bfLEAP™平台同时使用监督和非监督机器学习-因此,它能够揭示数据中真实/有意义的 联系,而不需要先验假设。BfLEAP™平台中使用的算法旨在处理高度不平衡的数据集,以成功识别与感兴趣的结果相关的因素组合。
我们的主要目标是提高内部计划、我们的战略合作伙伴和合作者在临床前和临床治疗发展的任何阶段的成功几率。我们的主要业务模式是使正在进行的临床试验取得成功或挽救晚期失败药物(即第二阶段或第三阶段临床试验失败)用于开发和剥离;尽管如此,我们也将 考虑早期药物的合作。我们希望通过战略收购当前临床阶段的药物和失败的药物进行内部开发,或通过与生物制药行业公司建立战略合作伙伴关系来实现这一目标。我们能够通过利用最初在JHU-APL开发的强大且经过验证的AI/ML平台(商标:bfLEAP™)来 开展我们的药物资产增强业务。我们相信,bfLEAP™分析平台是一个潜在的颠覆性工具,用于分析临床前和/或临床 数据集,例如在转换式研发和临床试验环境中生成的强大的临床前和临床试验数据集。
注: 2-重要会计政策摘要
在编制财务报表时使用估计的
按照美国公认的会计原则编制财务报表要求我们作出影响财务报表和附注中报告金额的估计和假设。估计包括但不限于收入确认、坏账准备、递延税项资产的可回收性以及我们应计负债的某些其他方面。实际结果可能与这些估计不同。
| F-7 |
金融工具
短期票据的账面价值,包括现金及现金等价物、应付账款及应计开支,由于该等票据的到期日相对较短,故账面价值接近公允价值。
公允价值是指在计量之日,在市场参与者之间有序交易的资产或负债的本金或最有利市场上为转移负债而收取的交换价格(退出价格)。用于计量公允价值的估值技术最大限度地利用了可观察到的投入,最大限度地减少了不可观测投入的使用。 公司对公允价值计量的披露采用三级估值层次结构,定义如下:
第1级-对估值方法的投入是对活跃市场中相同资产或负债的报价(未经调整)。
第 2级-估值方法的投入包括活跃市场中类似资产和负债的报价,以及在金融工具的基本完整期限内可直接或间接观察到的资产或负债的投入。
第 3级-对估值方法的投入不可观察,并对公允价值具有重要意义。
本公司并无任何须按公允价值经常性计量及记录的资产或负债。
收入 确认
对于2017年12月15日之后的年度报告期,财务会计准则委员会(FASB)制定了生效的ASU
2014-09“与客户签订合同的收入”,以取代之前美国现行GAAP下的收入确认指引。收入现在根据FASB ASC主题606,收入确认进行确认。本指南的目的是确立实体应适用于向财务报表用户报告有关与客户合同所产生的收入和现金流的性质、金额、时间和不确定性的有用信息的原则。核心原则是确认收入,以描述向客户转让承诺的商品或服务的金额,该金额反映了公司预期有权换取这些商品或服务的对价。为标准的实施提供了两种选择:完全追溯法或修正的追溯法。该指南自2017年12月15日之后的年度报告期起生效,包括报告期内的过渡期,并允许提前采用
。截至2019年12月31日的报告期,我们已采用FASB ASC主题606。截至2021年12月31日,我们已拥有
收入。在2022年第四季度,该公司确认了其第一次服务收入为$
收入 根据以下五步模型确认:
| - | 与客户的合同标识 此 步骤概述了在与客户签订提供商品或服务的合同时必须满足的标准 | |
| - | 合同中履约义务的识别 此 步骤描述了合同中必须如何处理不同的履约义务 | |
| - | 成交价的确定 此 步骤概述了在确定交易价格时必须考虑的因素,交易价格是企业将商品和服务转移给客户时预期收到的金额 | |
| - | 将交易价格分配给合同中的履约义务 此 步骤概述了在合同的不同履约义务之间分配交易价格的指导原则,并且是客户同意为商品和服务支付的价格 | |
| - | 认可 当公司履行履约义务时, 收入 可以确认为企业履行了各项绩效义务。此步骤指定应如何实现这一点 |
| F-8 |
合同 服务
公司预计,在不久的将来将确认的大部分收入将来自我们为生物制药公司和其他各种规模的组织设计的服务合作伙伴关系费用 ,这些组织在药物开发过程中分析数据 时遇到了困难。该公司使用名为bfLEAP™的公司专有人工智能/机器学习平台为客户提供大型复杂数据集的分析。此平台旨在预测 感兴趣的目标、模式、关系和异常。该公司认为,合作伙伴将要求进行额外的持续工作 因此,该服务模式利用主服务协议,其中包含为在药物开发的 发现、临床前或临床阶段执行的离散分析而发布的工作或任务订单。公司收到现金费用,在某些情况下还可能获得分析产生的新知识产权的权利。
协作 安排
公司还打算与其药物在第二阶段后期试验或第三阶段试验中失败的制药公司达成合作安排。这些安排可以采取几种形式,包括真正的合作伙伴关系,牛蛙利用bfLEAP™平台提供数据分析,合作伙伴提供候选药物,以及继续开发商业化所需的其他资源,牛蛙获得商业化产品的股权或特许权使用费。在其他安排中,公司 可根据根据每项具体安排确定的某些里程碑来赚取现金付款。
获得某些药品的权利
在 某些情况下,我们还可能获得处于早期临床试验阶段的药物的权利,使用我们的技术赞助和支持成功的后期精准医学试验,并剥离资产。同样的过程可能适用于新药的发现。 在这些情况下,剥离可能采取完全出售所有权利的形式,或者可能以开发和商业化增强开发候选药物的许可证的形式进行。 许可协议可以包括开发和商业里程碑,除了特许权使用费。
使用预估的
根据公认会计原则编制财务报表要求管理层作出估计和假设,以影响报告期内报告的资产和负债额、披露财务报表日期的或有资产和负债以及报告的收入和支出。重大估计包括公司股票的公允价值、基于股票的薪酬、与衍生负债相关的公允价值、债务贴现以及与递延税项资产相关的估值津贴。实际结果可能与这些估计不同。
现金
公司认为现金包括手头现金和原始到期日为90天或更短的临时投资,这些投资可以很容易地转换为现金。截至2022年12月31日和2021年12月31日,现金余额为
信用风险集中度
公司面临集中信用风险的金融工具是现金和应收账款。 公司计息账户中的现金偶尔会超过FDIC的保险限额。高级管理层定期审查这些机构的财务稳定性 。
| F-9 |
应收账款
贸易应收账款按其预估应收金额入账。贸易信贷一般是短期发放的。因此,贸易应收账款不计息。应收贸易账款根据客户过去的信用记录和他们目前的财务状况定期评估应收账款的可收回性。
坏账准备
应收账款坏账准备的任何费用均计入运营部门,其金额足以将坏账准备维持在管理层认为足以弥补任何可能损失的水平。管理层根据历史核销百分比和应收账款的当前状况确定拨备的充分性。当应收账款被确定为永久减值时,应收账款
从备抵中注销。截至2022年12月31日和2021年12月31日,坏账准备为$
盘存
公司没有库存,近期也不打算有库存。
销售成本
销售成本
包括特许权使用费和向公司提供与客户服务合同相关的外包服务的成本。
我们确认了$
财产 和设备
财产和设备按成本列报。当报废或以其他方式处置时,相关账面价值和累计折旧将从各自的账户中扣除,净差额减去从处置中变现的任何金额后反映在收益中。出于财务报表目的,财产和设备按成本入账,并在其估计使用年限内使用直线折旧。
广告
公司遵循将广告费用计入已发生费用的政策。
所得税 税
递延 所得税资产和负债是根据净营业亏损和信贷结转的估计未来税务影响以及资产和负债的计税基准与各自按现行制定税率计量的财务报告金额之间的临时差异而确定的。如果该等递延所得税资产变现的可能性不大,则本公司就其递延所得税资产计入估计估值拨备。
公司只有在税务机关根据税务状况的技术优点进行审查后更有可能维持该税务状况的情况下,才会确认来自不确定税收状况的税收优惠。在简明综合财务报表中确认的来自该状况的税收优惠是根据最终结算时实现可能性大于50%的最大优惠来计量的 。截至2022年12月31日、2022年12月31日和2021年12月31日,公司未记录任何未确认的税收优惠。
基于股票的薪酬
员工 和非员工股份薪酬在授予之日根据奖励的公允价值计算,并确认为必要服务期间的 支出。
我们按照ASC 260计算每股净亏损,每股收益。我们报告每股基本亏损和摊薄亏损。每股亏损收益是根据已发行普通股的加权平均股数计算的,不包括认股权证、股票期权或任何其他类型的可转换证券的摊薄影响。鉴于本公司普通股于2022年12月31日尚未公开买卖,或有可换股票据及相关摊薄股份不计入首次公开发售(IPO)时的摊薄股份计算。每股摊薄亏损按已发行普通股的加权平均股数计算 ,股票期权、认股权证和其他类型的可转换证券的摊薄效应计入 计算。稀释证券不包括在稀释每股收益计算中,因为它们的影响是反稀释的。 截至2021年12月31日和2022年12月31日,和认股权证(股票反向拆分后)分别不包括在每股净亏损的计算中。此外,和 普通股期权(股票反向拆分后)不包括在计算每股净亏损中, 。
| F-10 |
最近 会计声明
2016年2月,FASB发布了ASU 2016-02,租赁(主题842)。本ASU要求承租人在折扣的基础上确认几乎所有租赁的租赁负债和使用权资产,以及关于租赁安排的额外披露。2018年7月,FASB发布了ASU 2018-11租赁(主题842),其中提供了应用新租赁标准的可选过渡方法。 主题842可以在提交的最早期间开始时使用修改的追溯方法应用,也可以在采用主题842的期间开始时根据ASU 2018-11允许的 应用。
自公司成立以来,我们 采用了修改后的追溯方法来采用此标准。经修订的追溯法包括 若干可选的实际权宜之计,涉及识别和分类自公司成立时开始的租约 ;自公司成立时开始的租约的初始直接成本;以及在评估 承租人延长或终止租约或购买标的资产时使用事后评估的能力。
公司选择了ASC 842允许的一揽子实际权宜之计,允许其将在采用日期之前开始的之前的经营租赁作为新指南下的经营租赁,而无需重新评估(I)合同是否包含 租赁;(Ii)租赁的分类;或(Iii)ASC 842中定义的间接成本的核算。
所有 员工都在远程工作;因此,公司目前没有租赁或租赁办公空间。
根据ASC 842-20-50-4的规定,本公司截至2022年和2021年12月31日止年度的财务报表不承担月租义务。 本公司没有租赁产生的现金流、没有融资租赁成本、短期租赁成本或可变租赁成本。本公司不产生任何分租收入或从出售和回租交易中确认的任何净收益或亏损。因此,本公司 不需要对租赁负债计量中包括的现金支付融资和经营租赁之间的金额,将运营和融资现金流分开;关于获得使用权资产产生的租赁负债的补充非现金信息;剩余租赁期限的加权平均计算;或加权平均贴现率。
采用本指引并未对公司的经营业绩或现金流造成重大影响。
2019年12月,FASB发布了ASU 2019-12-所得税(主题740):简化所得税会计(ASU 2019-12)。ASU 2019-12是FASB整体简化计划的一部分,旨在通过更新某些指导方针和删除某些例外来简化所得税的会计处理。更新的指导意见适用于2020年12月15日之后的财政年度和这些财政年度内的过渡期。允许及早领养。采用此更新并未对公司财务报表产生实质性影响 。
2020年8月,财务会计准则委员会发布了ASU 2020-06、债务转换和其他期权(分主题470-20)和衍生工具和对冲 -实体自有股权合同(分主题815-40):实体自有股权中可转换工具和合同的会计(“ASU 2020-06”),简化了某些具有负债和股权特征的金融工具的会计处理。本ASU(1)简化了可转换债务工具和可转换优先股的会计核算,删除了ASC 470-20《债务:带有转换的债务和其他选项》中现有的 指南,该指南要求实体将受益转换特征和现金转换特征与托管的可转换债务或优先股分开核算在权益中;(2)通过取消股权分类所需的某些标准,修订了ASC 815-40中独立金融工具和嵌入特征的衍生会计例外范围 。以及(3)修订ASC 260《每股收益》中的指导意见,要求实体使用IF-转换法计算可转换工具的稀释每股收益(EPS)。此外,当票据可以现金或股票结算时,实体必须假定为计算稀释每股收益而进行的股票结算。对于美国证券交易委员会申请者,不包括较小的报告公司,ASU 2020-06在2021年12月15日之后开始的 财年有效,包括这些财年内的过渡期。允许提前采用,但不得早于2020年12月15日之后的财政年度。对于所有其他实体,ASU 2020-06在2023年12月15日之后开始的财政年度有效,包括这些财政年度内的过渡期。各实体应在采用该指南的财政年度开始时采用该指南,不能在中期报告期内采用该指南。公司选择提前采用,自2021年1月1日起生效。考虑到本公司普通股于2022年12月31日尚未公开交易,可换股期权 不被视为可随时转换为现金。此外,ASU 2020-06取消了受益转换功能。因此,这些可转换票据不会触发衍生品负债。
2020年10月,美国财务会计准则委员会发布了ASU 2020-10《编纂改进》,通过澄清或改进 披露要求以与美国证券交易委员会的法规保持一致,更新了各种编纂主题。自2021年1月1日起的报告期内,公司采用了ASU 2020-10。这一更新的采用并未对公司的财务报表产生实质性影响。
| F-11 |
公司不认为最近发布的任何其他有效公告或发布但尚未生效的公告如果被采纳,将不会对所附财务报表产生实质性影响。
新冠肺炎
2020年3月,世界卫生组织宣布新冠肺炎在全球范围内出现疫情。新冠肺炎对公司业务的影响目前尚不清楚。本公司将继续监控联邦、州和地方当局发布的关于新冠肺炎的指导和命令 。因此,本公司可能会根据该指引的要求采取行动改变其业务运营,并下令或采取本公司认为最符合其员工、客户、合作伙伴、供应商和股东利益的其他步骤。
任何此类变更或修改都可能导致公司业务的重大中断,并可能对公司的业务、经营业绩、财务状况和公司普通股的交易价格产生实质性的不利影响, 可能包括暂时关闭公司的一个或多个设施;临时或长期劳动力短缺;对公司供应链和分销渠道的临时或长期不利影响;以及增加使用远程访问和从公司设施中删除数据可能增加的网络漏洞 和数据丢失风险。此外, 新冠肺炎可能会对受影响地区或全球范围内的资本支出和整体经济活动产生负面影响 ,这可能会影响对公司产品和服务的需求。
如果新冠肺炎大流行持续很长一段时间,或者其广度或严重程度 增加,包括公司必须遵守的监管要求的豁免或紧急法规的实施, 公司是否会受到影响以及如何受到影响,这是未知的。新冠肺炎疫情带来的风险是,公司或其员工、承包商、供应商和其他合作伙伴可能被无限期禁止开展业务活动。
公司可能因非其所能控制的此类事件而产生费用或延误,这可能对公司的业务、经营业绩、财务状况和普通股的交易价格产生重大不利影响。
正在进行 关注
该公司自成立以来一直有来自运营的负现金流,并处于净亏损状态。在前一年,我们的审计师在他们的意见中加入了一段关于我们作为持续经营的企业是否有能力继续存在的严重怀疑的段落。如附注14所述,我们于年底后完成首次公开招股。我们相信,从债务转换为股权的募集资金和票据 现在提供了足够的流动性来缓解这一重大疑虑。不能保证我们未来不需要额外资金 。
注: 3-财产和设备
财产和设备包括:
在截至2022年12月31日的年度内,公司收购了$
折旧
费用总额为$
注: 4-应付账款和应计费用
截至2022年12月31日、2022年12月31日和2021年12月31日,公司的应付帐款和应计费用共计$
注: 5-应付票据
2020年5月5日,公司获得了SBA PPP贷款,金额为#
注: 6-应付票据关联方
2021年6月15日,该公司与关联方签订了一项无担保短期贷款协议,总本金余额为
美元
于2021年11月19日,该公司与关联方签订无担保短期贷款协议,本金总额为$。
2021年12月13日,该公司与关联方签订了一项无担保短期贷款协议,总本金余额为
美元
| F-12 |
注: 7-可转换应付票据
2020年3月27日,该公司与马里兰技术开发公司签订了一项可转换贷款协议,本金余额为$
2021年8月9日,该公司与一名非关联方签订了一项可转换贷款协议,最高贷款额为$
2021年12月20日,本公司与一名无关联方订立借款协议,本金余额为$
于2022年4月11日,本公司与WallachBeth Capital LLC就本公司拟进行的私募及/或公开发售订立独家配售代理及/或承销商协议。如脚注2所述,本公司获取资本的计划的一个重要组成部分是本公司打算通过其普通股的首次公开发行(IPO)在全国交易所上市。WallachBeth参与了这方面的工作,2022年4月28日,公司收到了大约#美元的净收益
截至2022年12月31日,下表反映了根据2022年4月11日与WallachBeth达成的协议出售的可转换桥票据的余额。所有票据均按上述换股比率于首次公开发售时强制转换,而购买者亦将获发认股权证 换股后发行的每股普通股,行使价由换股比率厘定。由于年底的IPO价格尚未确定,这些认股权证的当前会计尚未记入日记账。
| F-13 |
| 注意事项 | 购买 | 本金 | 原创问题 | 应计 | ||||||||||||
| 日期 | 价格 | 天平 | 折扣 | 利息 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 总计 | $ | $ | $ | $ | ||||||||||||
| * |
2020年8月,财务会计准则委员会发布了ASU 2020-06、债务转换和其他期权(分主题470-20)和衍生工具和对冲 -实体自有股权合同(分主题815-40):实体自有股权中可转换工具和合同的会计(“ASU 2020-06”),简化了某些具有负债和股权特征的金融工具的会计处理。该公司明确规定,一个实体应在其年度会计年度开始时采用该指导意见。在采用ASU 2020-06后,如果转换期权标的的股权证券不能随时转换为现金,而转换期权 要求对标的股份进行总实物结算,则嵌入的转换期权可能不符合净结算标准 ,因此不符合衍生工具的定义。考虑到本公司普通股于2022年12月31日尚未公开交易 ,可转换购股权不被视为可随时转换为现金。此外,在ASU 2020-06中取消了受益转换 功能。因此,这些可转换票据不会触发任何衍生债务。所有转换 都取决于有效的首次公开募股,而首次公开募股尚未被认为是可能的。
注: 8-可转换应付票据关联方
2021年7月8日,该公司与关联方签订了一份未来股权简单协议(SAFE),金额为$
如果 在此终止之前发生流动性事件安全, 这个安全 在符合下文第1(D)节规定的清算优先权的情况下, 是否自动有权获得在紧接该流动资金事项完成之前或同时应支付给投资者的部分收益,相当于(I)购买金额(“套现金额”)或(Ii)普通股数量的应付金额等于购买金额除以流动资金价格(“转换金额”)中较大的 。如果本公司任何证券持有人 可选择在流动资金活动中收取收益的形式和金额,投资者将获得同样的选择,但投资者不得选择收取因投资者未能满足一般适用于本公司证券持有人的任何要求或限制或根据任何适用法律而没有资格获得的对价表格。
这个 安全 是否自动终止(不解除公司因先前违反或不遵守本协议而产生的任何义务) 安全) 紧随以下最早发生的情况发生:(I)根据协议自动转换本外管局向投资者发行股本;或(Ii)根据协议支付或预留投资者应支付的金额。
| F-14 |
截至2022年12月31日和2021年12月31日,美元
2021年8月19日,公司与关联方签订可转换贷款协议,本金余额为$
外管局和计息可转换贷款协议在首次公开募股时转换为普通股。
公司规定,某一实体应在其年度财政年度开始时采用ASU 2020-06。采用ASU 2020-06后,这些可转换票据将不会触发任何衍生负债。有关详细信息,请参阅注7。
注: 9-关联方
在截至2021年12月31日的年度内, 发行给CFO Dane Saglio的普通股(反向股票拆分后),以奖励所提供的服务。
截至2022年12月31日、2022年12月31日和2021年12月31日,关联方应计工资为$
截至2022年12月31日,本公司累计向关联方收取咨询费$
在截至2021年12月31日的年度内,本公司发行了总计 向关联方支付普通股(反向股票拆分后),以换取所提供的服务。 期权的原始寿命为十年,在长达24个月的时间内以不同的费率授予。于截至2022年12月31日止年度内,本公司并无发行任何期权及确认$ 与未偿还股票期权相关的基于股票的薪酬。
注: 10-股东违纪行为
优先股 股票
该公司拥有
面值为$的授权优先股。
截至2021年12月31日,有
发行的优先股。2022年10月5日,本公司与投资者签订了一项交换协议,根据该协议,其所有普通股,
普通股股票(反向股票拆分后),被交换为
A系列可转换优先股的股份(反向股票拆分后)。根据协议,交换的基础是1系列A可转换优先股普通股
股票。A系列优先股的每名持有人可不时将任何或全部A系列优先股持有人的股份转换为缴足股款且不可评估的普通股,金额
相当于交出的每一股A系列优先股换10股普通股。A系列优先股在经济上等同于普通股,但没有投票权,并且受到禁止转换为普通股的限制,如果这会导致投资者当时拥有公司已发行普通股超过4.99%
,则禁止转换为普通股。T本公司评估了
交换的条款,并确定公允价值不会发生重大变化,因此没有因交换而记录的会计事项。A系列优先股的价值被确定为$
普通股 股票
在2020年6月,
该公司拥有
授权面值为$的普通股。
截至2022年12月31日的年度内,
如上所述,普通股(反向股票拆分后)换成了优先股,
发行普通股(反向股票拆分后),用于本金和利息的转换,金额为$
| F-15 |
在 公司于2022年上半年从大学签署了两个药物项目的两个许可证后,它聘请了一家独立的估值公司 进行股票估值。这项工作的结果导致了在布莱克-斯科尔斯期权定价模型中使用的普通股每股价值的增加,该模型用于对公司的股权授予和认股权证发行进行估值。
我们的
董事会和股东批准了对公司注册证书的修订,
股票 期权
2022年第一季度期间, 期权份额 (post反向股票分割)由于 雇佣关系终止而被没收。
截至2021年12月31日止年度,本公司共授予 向公司员工提供服务的期权份额(反向股票分割后)。期权的初始有效期为 以不同的利率投资, .截至2021年12月31日止年度,本公司归属 这些期权(反向股票分割后)和已确认的$ 与未行使股票期权相关的股票报酬。截至二零二二年十二月三十一日止年度, 这些期权的股份(反向股票分割后)已归属, 确认了基于股票的薪酬。
| 批准和未偿还,2020年12月31日 | ||||
| 在2021年期间发放 | ||||
| 已锻炼 | ||||
| 被没收 | ||||
| 2021年到期 | ( | ) | ||
| 已批准和未偿还,2021年12月31日 | ||||
| 在2022年期间发放 | ||||
| 已锻炼 | ||||
| 被没收 | ( | ) | ||
| 2022年到期 | ||||
| 已批准和未偿还,2022年12月31日 |
| 选项 | 既得期权的内在价值 | 平均重量锻炼价格 | ||||||||||
| 既得和未偿还,2020年12月31日 | ||||||||||||
| 于2021年授予及归属 | ||||||||||||
| 已锻炼 | ||||||||||||
| 被没收 | ||||||||||||
| 过期 | ( | ) | ( | ) | ( | ) | ||||||
| 既得利益和未偿还债务,2021年12月31日 | ||||||||||||
| 在2022年6月期间授予和归属 | ||||||||||||
| 已锻炼 | ||||||||||||
| 被没收 | ||||||||||||
| 过期 | ||||||||||||
| 既得利益和未偿还债务,2022年12月31日 | ||||||||||||
截至2022年12月31日和2021年12月31日, 和 分别授予的期权(反向股票拆分后), 和(股票反向拆分后) 期权到期,未偿还股票期权的加权平均剩余寿命为 和分别为 年。
截至2022年12月31日和2021年12月31日,已授予和未偿还的期权的公允价值为$及$,分别为。在截至2022年12月31日和2021年12月31日的年度内计量的期权的公允价值合计 是基于以下假设使用Black-Scholes期权定价模型计算的:
| 2022年12月31日 | 2021年12月31日 | |||||||
| 普通股在计量日的公允价值 | $ | $ | ||||||
| 无风险利率 | 来自 %至 | % | 来自 %至 | % | ||||
| 波动率 | % | % | ||||||
| 股息率 | % | % | ||||||
| 预期期限 | - | |||||||
| (1) | 无风险利率由管理层使用截至测量日期的具有可比条款的美国国债的市场收益率来确定。 | |
| (2) | 交易波动率是通过计算本公司同业集团的波动率来确定的。 | |
| (3) | 公司预计在可预见的未来不会派发股息。 |
| F-16 |
认股权证
在截至2022年12月31日的年度内,本公司共批准
认股权证(post反向股票分割). 在截至2022年12月31日的年度内,
认股权证股份(post反向股票分割)已授予并修改,其内在价值为$,
截至2021年12月31日止年度,本公司共授予
认股权证(post反向股票分割)。这个数额的
认股权证(post反向股票分割),公允价值为$
在截至2021年12月31日的年度内,公司发行了
这个
下表汇总了截至2022年12月31日和2021年12月31日的年度权证活动(股票反向拆分后),
| 认股权证 | ||||
| 批准和未偿还,2020年12月31日 | ||||
| 在2021年期间发放 | ||||
| 已锻炼 | ||||
| 被没收 | ||||
| 2021年到期 | ||||
| 已批准和未偿还,2021年12月31日 | ||||
| 在2022年期间发放 | ||||
| 已锻炼 | ||||
| 被没收 | ( | ) | ||
| 2022年到期 | ||||
| 已批准和未偿还,2022年12月31日 | ||||
| 认股权证 | 权证的内在价值 | 平均重量锻炼价格 | ||||||||||
| 既得和未偿还,2020年12月31日 | ||||||||||||
| 2021年授予和归属 | ||||||||||||
| 已锻炼 | ||||||||||||
| 被没收 | ||||||||||||
| 过期 | ||||||||||||
| 既得利益和未偿还债务,2021年12月31日 | ||||||||||||
| 2022年授予和归属 | ||||||||||||
| 已锻炼 | ||||||||||||
| 被没收 | ( | ) | ( | ) | ||||||||
| 过期 | ||||||||||||
| 既得利益和未偿还债务,2022年12月31日 | ||||||||||||
| F-17 |
截至2022年12月31日,
截至2022年12月31日止年度,已归属认股权证的公允价值总额为$.于截至2022年12月31日止年度计量的认股权证 的总公平值乃使用柏力克-舒尔斯期权定价模式计算,并记录为以股票为基础的 补偿。
截至2021年12月31日止年度,
截至2021年12月31日,已归属认股权证的公允价值总额为$.于截至2021年12月31日止年度计量的认股权证的总公平值乃使用柏力克-舒尔斯期权定价模式计算。
由于附注8所讨论的部分条款尚未完成,故与附注7所讨论的可换股过渡票据有关的认股权证的 数目尚未确定。因此,将予发行的认股权证并不计入我们尚未行使的认股权证。 由于首次公开招股价格于2022年12月31日尚未完成,因此该等认股权证的现行会计处理并无入账。
| 2022年12月31日 | 2021年12月31日 | |||||||
| 普通股在计量日的公允价值 | $ | $ | ||||||
| 无风险利率 | 来自 %至 | % | 来自 %至 | % | ||||
| 波动率 | % | % | ||||||
| 股息率 | % | % | ||||||
| 预期期限 | 年 | - 年 | ||||||
| (1) | 无风险利率由管理层使用截至测量日期的具有可比条款的美国国债的市场收益率来确定。 | |
| (2) | 交易波动率是通过计算本公司同业集团的波动率来确定的。 | |
| (3) | 公司预计在可预见的未来不会派发股息。 | |
| (4) | 在 该公司在2022年上半年从大学签署了两个药物项目的两个许可证后 它聘请了一家独立的评估公司进行企业股权评估。 该项目的结果导致了每布莱克·斯科尔斯期权定价模型中使用的普通股股份 ,用于评估公司在所有2022年授予日股票价格下的股权授予和认股权证发行。 |
注: 11-所得税
截至2022年12月31日,本公司可用于联邦所得税的净营业亏损结转约为$
我们 采纳了ASC 740-10-25的规定,该规定为所得税申报单中采取或预期采取的不确定税收头寸 提供了确认标准和相关计量模型。ASC 740-10-25要求在税务机关审查后更有可能维持的情况下,在财务报表中确认纳税申报单中已采取或预期将采取的立场。
然后,使用概率加权方法来衡量达到最大可能性阈值的税收 头寸,以确定最终结算时实现的可能性大于50%的最大税收优惠金额。本公司没有与被认为是不确定的未结所得税申报单有关的税务头寸。我们在美国、加利福尼亚州和犹他州提交所得税申报单,但诉讼时效各不相同。
公司截至2022年12月31日和2021年12月31日的递延税金包括:
| 2022 | 2021 | |||||||
| 非流动递延税项资产: | ||||||||
| 净营业亏损结转 | $ | $ | ||||||
| 估值免税额 | ( | ) | ( | ) | ||||
| 非流动递延税项净资产 | $ | $ | ||||||
| F-18 |
注: 12-材料协议
JHU-APL 技术许可证
2018年2月7日,该公司与JHU-APL签订了该技术的全球独家许可协议。许可证
包括三(3)项已颁发的专利、一项新的临时专利申请、算法专有库的非专利权和其他
商业秘密,许可证还包括修改和改进。2021年10月,该公司对原始许可证执行了一项修正案,该修正案代表改进和新的高级分析功能。考虑到根据许可协议授予
公司的权利,JHU收到了相当于五(
George 华盛顿大学-Beta2-Spectrin siRNA许可证
2022年1月14日,公司与乔治华盛顿大学(GWU) 签订了一项全球独家、含版税的许可证,有权使用靶向β 2-血影蛋白的siRNA治疗人类疾病,包括肝细胞癌(HCC)。许可证 涵盖了三项美国和全球专利申请中要求保护的方法,还包括将该方法用于治疗肥胖症、 非酒精性脂肪性肝病和非酒精性脂肪性肝炎。
作为根据许可协议授予公司的权利的对价,GWU收到了$
约翰斯·霍普金斯大学--甲苯咪唑许可证
2022年2月22日,该公司从约翰·霍普金斯大学(JHU)获得了独家的、全球范围的特许权使用费许可证, 使用改良的甲苯咪唑配方治疗任何人类癌症或肿瘤疾病。该配方在不同类型癌症的动物模型中显示出强大的活性,并已在高级别胶质瘤患者的I期临床试验中进行评估(NCT01729260)。这项试验是一项开放标签的剂量递增研究,评估了使用替莫唑胺的改进配方在24名新诊断的胶质瘤患者中的安全性和有效性。研究人员观察到,除了最高测试剂量(200毫克/公斤/天)外,所有接受测试剂量的患者都没有剂量限制性毒性。在接受最大试验剂量200毫克/公斤/天的15名患者中,有4名患者出现了剂量限制性毒性,所有这些毒性都可以通过减少或取消给予的剂量而逆转。在试验期间,任何剂量的甲苯咪唑都没有发生严重的不良反应。接受甲苯咪唑治疗的患者中,41.7%的患者在登记后两年内存活,25%的患者在登记后四年内存活(Gallia等人,2021年)。
| F-19 |
许可证涵盖六(6)项已发布专利和一(1)项待定申请。考虑到根据许可协议授予公司的权利,JHU将收到一笔交错的预付许可费$
约翰斯·霍普金斯大学-前药物许可证
2022年10月13日,该公司从约翰·霍普金斯大学(JHU)和捷克科学院有机化学和生物化学研究所(IOCB)获得了全球范围内的独家许可,获得了将具有更好的溶解性和生物利用度的N-取代甲苯咪唑前体药物商业化的权利。该许可证涵盖前药组合物和用于治疗疾病的
在美国和世界各地的多项专利申请中声称的用途。作为根据许可协议授予公司的权利的代价,JHU和IOCB将收到一笔交错的预付许可费$
注: 13-承付款和或有事项
公司遵循ASC 450,或有事项,这要求公司评估因发生或未发生一个或多个未来事件而发生损失的可能性。这种评估本身就涉及到一种判断。在评估法律诉讼或未主张的索赔可能造成的或有损失时,公司会评估此类诉讼或索赔的可知是非曲直,以及所寻求或预期寻求的救济。
如果对或有事项的评估表明可能会发生重大损失,且负债金额可以 估算,则估算负债将计入公司的财务报表。如果评估表明 潜在的重大或有损失不可能但合理地可能发生,或可能发生但无法估计,则应披露或有负债的性质,以及可能损失范围的估计(如果可确定且具有重大意义)。 被视为遥远的或有损失一般不会披露,除非涉及担保,在这种情况下,担保将被披露。
虽然 不能得到保证,但根据目前掌握的信息,管理层不相信或有亏损会对公司的财务状况、经营业绩或现金流产生重大不利影响。
注: 14-后续事件
2023年2月14日,该公司进行了首次公开募股
单位(每个单位,统称为单位),价格为#美元。每个单位,总计约
$
在与产品相关的
中,
在2023年4月5日至4月13日期间,权证持有人行使了
| F-20 |
牛蛙 AI控股公司。
压缩的 合并资产负债表
截至 2023年9月30日和2022年12月31日
(未经审计)
| 2023年9月30日 | 2022年12月31日 | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金和现金等价物 | $ | $ | ||||||
| 预付费用 | ||||||||
| 流动资产总额 | ||||||||
| 财产和设备,净额 | ||||||||
| 总资产 | $ | $ | ||||||
| 负债和股东赤字 | ||||||||
| 流动负债: | ||||||||
| 应付帐款 | $ | $ | ||||||
| 应计费用 | ||||||||
| 递延收入 | ||||||||
| 短期保险融资 | ||||||||
| 可转换票据 | ||||||||
| 可转换票据关联方 | ||||||||
| 流动负债总额 | ||||||||
| 股东赤字: | ||||||||
| A系列可转换优先股,$面值,授权股份;截至2023年9月30日和2022年12月31日的已发行和已发行股票。 | ||||||||
| 普通股,$面值,授权股份;和分别于2023年9月30日和2022年12月31日发行和发行的股票。 | ||||||||
| 额外实收资本 | ||||||||
| 累计赤字 | ( | ) | ( | ) | ||||
| 股东总亏损额 | ( | ) | ||||||
| 总负债和股东赤字 | $ | $ | ||||||
见 未经审计的简明合并财务报表附注。
| F-21 |
牛蛙 AI控股公司。
精简的 合并业务报表
截至2023年9月30日和2022年9月30日的三个月和九个月
(未经审计)
| 截至三个月 | 九个月结束 | |||||||||||||||
| 9月30日, | 9月30日, | |||||||||||||||
| 2023 | 2022 | 2023 | 2022 | |||||||||||||
| 收入: | ||||||||||||||||
| 收入,净额 | $ | $ | $ | $ | ||||||||||||
| 总收入 | ||||||||||||||||
| 售出商品成本: | ||||||||||||||||
| 销货成本 | ||||||||||||||||
| 商品销售总成本 | ||||||||||||||||
| 毛利 | ||||||||||||||||
| 运营费用: | ||||||||||||||||
| 研发 | ||||||||||||||||
| 一般和行政 | ||||||||||||||||
| 总运营费用 | ||||||||||||||||
| 运营亏损 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 其他收入(费用),净额 | ||||||||||||||||
| 利息支出,净额 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 票据兑换损失 | ( | ) | ||||||||||||||
| 其他(费用)收入,净额 | ||||||||||||||||
| 其他收入(费用)合计,净额 | ( | ) | ( | ) | ( | ) | ||||||||||
| 净亏损 | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
| 普通股股东应占每股普通股净亏损--基本亏损和摊薄亏损 | $ | ) | $ | ) | $ | ) | $ | ) | ||||||||
| 加权平均流通股数量--基本和稀释 | ||||||||||||||||
见 未经审计的简明合并财务报表附注。
| F-22 |
牛蛙 AI控股公司。
简明合并股东亏损变动表
截至二零二三年九月三十日及二零二二年十二月三十一日止三个月
(未经审计)
| A系列优先股 | 普通股 | 额外实收 | 累计 | 股东合计 | ||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 资本 | 赤字 | 赤字 | ||||||||||||||||||||||
| 2022年12月31日的余额 | $ | $ | $ | $ | ( | ) | $ | ( | ) | |||||||||||||||||||
| 基于股票的薪酬 | - | - | ||||||||||||||||||||||||||
| 普通股发行(首次公开发行),扣除发行成本 | - | |||||||||||||||||||||||||||
| 发行服务普通股 | - | |||||||||||||||||||||||||||
| 将可转换债券转换为普通股 | - | |||||||||||||||||||||||||||
| 净亏损 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||
| 2023年3月31日的余额 | ( | ) | ||||||||||||||||||||||||||
| 基于股票的薪酬 | ||||||||||||||||||||||||||||
| 根据认股权证行使发行普通股 | ||||||||||||||||||||||||||||
| 净亏损 | ( | ) | ( | ) | ||||||||||||||||||||||||
| 2023年6月30日的余额 | ( | ) | ||||||||||||||||||||||||||
| 基于股票的薪酬 | ||||||||||||||||||||||||||||
| 净亏损 | ( | ) | ( | ) | ||||||||||||||||||||||||
| 2023年9月30日的余额 | $ | $ | $ | $ | ( | ) | $ | |||||||||||||||||||||
| 2021年12月31日的余额 | $ | $ | $ | $ | ( | ) | ( | ) | ||||||||||||||||||||
| 推定利息 | - | - | ||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | ||||||||||||||||||||||||||
| 手令的重新分类 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||
| 净亏损 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||
| 2022年3月31日的余额 | ( | ) | ( | ) | ||||||||||||||||||||||||
| 推定利息 | - | - | ||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | ||||||||||||||||||||||||||
| 可转换票据的转换 | - | |||||||||||||||||||||||||||
| 股份注销 | - | ( | ) | ( | ) | |||||||||||||||||||||||
| 净亏损 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||
| 2022年6月30日的余额 | ( | ) | ( | ) | ||||||||||||||||||||||||
| 推定利息 | - | - | ||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | ||||||||||||||||||||||||||
| 股份发行许可证 | - | |||||||||||||||||||||||||||
| 净亏损 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||
| 2022年9月30日的余额 | $ | $ | $ | $ | ( | ) | $ | ( | ) | |||||||||||||||||||
见 未经审计的简明合并财务报表附注。
| F-23 |
牛蛙 AI控股公司。
精简 现金流量表合并报表
截至2023年和2022年9月30日的9个月
(未经审计)
| 截至9月30日的9个月, | ||||||||
| 2023 | 2022 | |||||||
| 经营活动的现金流: | ||||||||
| 净亏损 | $ | ( | ) | $ | ( | ) | ||
| 对净亏损与经营活动中使用的现金净额进行的调整: | ||||||||
| 折旧 | ||||||||
| 基于股票的薪酬 | ||||||||
| 为获得牌照而发行的股份 | ||||||||
| 为服务而发行的股票 | ||||||||
| 票据兑换损失 | ||||||||
| 债务贴现摊销 | ||||||||
| 推定利息 | ||||||||
| 经营性资产和负债变动情况: | ||||||||
| 预付费用 | ( | ) | ( | ) | ||||
| 应付帐款 | ( | ) | ||||||
| 应计费用 | ( | ) | ||||||
| 应计费用关联方 | ||||||||
| 递延收入 | ( | ) | ||||||
| 用于经营活动的现金净额 | ( | ) | ( | ) | ||||
| 投资活动产生的现金流: | ||||||||
| 购置财产和设备 | ( | ) | ||||||
| 用于投资活动的现金净额 | ( | ) | ||||||
| 融资活动的现金流: | ||||||||
| 发行普通股(首次公开发行)的收益,扣除发行成本 | ||||||||
| 行使认股权证所得收益 | ||||||||
| 可转换应付票据的收益 | ||||||||
| 应付票据收益 | ||||||||
| 应付票据的付款 | ( | ) | ||||||
| 应付票据的偿还和利息关联方 | ( | ) | ||||||
| 收益扣除付款后的净额短期保险融资 | ||||||||
| 融资活动提供的现金净额 | ||||||||
| 现金及现金等价物净增加情况 | ||||||||
| 期初现金及现金等价物 | ||||||||
| 期末现金和现金等价物 | $ | $ | ||||||
| 补充现金流信息: | ||||||||
| 支付利息的现金 | $ | $ | ||||||
| 缴纳税款的现金 | ||||||||
| 补充性非现金活动 | ||||||||
| 手令的重新分类 | $ | $ | ||||||
| 转换应付票据时发行普通股 | $ | $ | ||||||
| 转换可转换应付票据 | $ | $ | ||||||
见 未经审计的简明合并财务报表附注。
| F-24 |
牛蛙 AI控股公司。
简明合并财务报表附注 (未经审计)
1. 企业的组织和性质
业务描述
牛蛙人工智能控股公司(“我们”,“我们”或“公司”)于2020年2月6日在内华达州注册成立。牛蛙人工智能控股公司是牛蛙人工智能公司和牛蛙人工智能管理有限责任公司的母公司。它们分别于2017年和2021年在特拉华州和马里兰州注册成立。我们的所有业务目前都是通过牛蛙AI Holdings, Inc.进行的,该公司于2020年2月6日开始运营。我们是一家专注于高级AI/ML驱动的医药和医疗保健领域复杂数据集分析的公司。我们的目标是利用我们的精准医学平台,通过外部合作伙伴关系和有选择的内部开发来实现药品资产。
大多数新疗法都会在临床前或临床开发的某个阶段失败。这是开发新疗法的高成本的主要驱动力。开发新疗法的一个主要困难是有效地整合在开发的每个阶段产生的复杂和高维的数据,以降低开发过程的后续阶段的风险。人工智能和机器学习(AI/ML)作为帮助解决这一问题的数字解决方案应运而生。
我们 使用人工智能和机器学习来推进内部和外部项目的药物。目前大多数AI/ML平台在综合不同的高维数据以获得可操作的洞察力方面仍存在不足。我们的平台技术名为bfLEAP™,是约翰霍普金斯大学应用物理实验室(JHU-APL)开发的分析型AI/ML平台,通过提供对他们的数据的更精确的、 多维的理解, 能够克服目前阻碍研究人员和临床医生的可扩展性和灵活性方面的挑战。我们正在部署bfLEAP™,用于内部计划的几个关键开发阶段,并通过战略合作伙伴关系和合作,旨在简化治疗开发中的数据分析, 通过降低新疗法的失败率来降低总体开发成本,并影响无数可能无法获得所需治疗的患者的生活 。
bfLEAP™平台同时使用监督和非监督机器学习-因此,它能够揭示数据中真实/有意义的 联系,而不需要先验假设。BfLEAP™平台中使用的算法旨在处理高度不平衡的数据集,以成功识别与感兴趣的结果相关的因素组合。
我们的主要目标是提高内部计划以及我们的战略合作伙伴和合作者在临床前和临床治疗发展的任何阶段的成功几率。我们的主要业务模式是使正在进行的临床试验取得成功或挽救晚期失败药物(即第二阶段或第三阶段临床试验失败)用于开发和剥离;尽管如此,我们也将 考虑早期药物的合作。我们希望通过战略收购当前临床阶段的药物和失败的药物进行内部开发,或通过与生物制药行业公司建立战略合作伙伴关系来实现这一目标。我们能够通过利用最初在JHU-APL开发的强大且经过验证的AI/ML平台(商标:bfLEAP™)来 开展我们的药物资产增强业务。我们相信,bfLEAP™分析平台是一个潜在的颠覆性工具,用于分析临床前和/或临床 数据集,例如在转换式研发和临床试验环境中生成的强大的临床前和临床试验数据集。
流动性 和持续经营
公司自成立以来运营现金流为负,运营出现净亏损。2023年第一季度,我们完成了首次公开募股(IPO)。我们相信,与IPO相关的从债务转换为股权的募集资金和票据现在提供了足够的流动资金,为自本申请日期起计9个月后的运营提供资金。
2. 重要会计政策摘要
演示基础
随附的简明综合财务报表包括BullFrog AI Holdings,Inc.及其全资子公司的账目 ,并已按照美国公认会计原则(“GAAP”)为中期财务信息编制 。在合并中,所有公司间账户和交易都已取消。
| F-25 |
简明合并报表未经审计,应与我们于2023年4月25日提交给美国证券交易委员会的2022年年度报告Form 10-K中包含的合并财务报表和相关的 注释一起阅读。未经审计的简明综合财务报表是在与10-K报表中包括的经审计年度综合财务报表一致的基础上编制的,管理层认为包括为公平陈述我们的财务状况、我们的经营业绩和现金流量而需要的所有正常经常性调整。
截至2023年9月30日的9个月的业绩并不一定代表截至2023年12月31日的年度或任何其他未来期间的预期经营业绩。
2023年2月13日,我们
收入 确认
公司根据以下五步模型确认收入:
| - | 与客户的合同标识 |
| 此 步骤概述了在与客户签订供应商品或服务的合同时必须满足的标准。 | |
| - | 合同中履约义务的识别 |
| 此 步骤描述了合同中必须如何处理不同的履约义务。 | |
| - | 成交价的确定 |
| 此 步骤概述了在确定交易价格时必须考虑的因素,交易价格是企业将商品和服务转移给客户时预期收到的金额。 | |
| - | 将交易价格分配给合同中的履约义务 |
| 此步骤概述了在合同的各个履约义务中分配交易价格的指导原则,也是客户同意 为商品和服务支付的价格。 | |
| - | 在公司履行业绩义务时或在履行义务时确认收入 |
| 收入 可以确认为企业履行了各项绩效义务。这一步指定了如何实现这一点。 |
合同 服务
公司预计,在不久的将来将确认的大部分收入将来自我们为生物制药公司和其他各种规模的组织设计的服务合作伙伴关系费用 ,这些组织在药物开发过程中分析数据 时遇到了困难。该公司使用名为bfLEAP™的公司专有人工智能/机器学习平台为客户提供大型复杂数据集的分析。此平台旨在预测 感兴趣的目标、模式、关系和异常。该公司认为,合作伙伴将要求进行额外的持续工作 因此,该服务模式利用主服务协议,其中包含为在药物开发的 发现、临床前或临床阶段执行的离散分析而发布的工作或任务订单。公司收到现金费用,在某些情况下还可能获得分析产生的新知识产权的权利。数据分析和分析报告完成后,公司 将分析集交付给客户,并在该时间点确认收入。
重要的会计政策
在截至2022年12月31日的财政年度中,公司经审计的财务报表及其附注中讨论的重大会计政策没有新的或重大的变化。
最近发布的会计准则的影响
本公司已评估尚未采纳的已发布会计准则更新(“华硕”),并相信采纳该等准则不会对其综合财务报表产生重大影响。
| F-26 |
3. 应付票据关联方
于2021年不同时间,本公司与关联方订立无抵押短期贷款协议,本金总额为$。
4. 可转换票据
2020年3月注意事项
2020年3月27日,公司与马里兰州技术开发公司签订了一项可转换贷款协议,本金为$
2021年8月 笔记
于2021年8月,本公司与一名非关联方订立一项可兑换贷款协议,承诺额最高可达$
截至2022年12月31日,贷款未偿还,本金余额为$
关于可转换贷款协议,本公司还发行了
2021年12月 备注
于2021年12月20日,本公司与一名非关联方订立贷款协议。这笔贷款规定了
票据可按低于首次公开发行价格或基于公司估值的价格自动转换为普通股, 以更有利于持有人的价格为准。
最初,
该贷款预计将与
在公司IPO结束的同时,该票据根据其条款转换为 普通股股份。转换时未确认任何收益或 损失。
可转换 桥接注释
于
2022年4月11日,本公司与WallachBeth Capital LLC就本公司拟进行的私人及/或公开发售订立独家配售代理及/或包销商协议。于2022年4月28日,本公司收到约$
| F-27 |
可转换过渡票据最初可在首次公开募股时以
就可换股过渡票据而言,买方亦有权于本公司首次公开发售完成后获发有条件认股权证。
于2022年第四季度,本公司修订了可转换桥票据,以(A)将到期日延长至2022年12月31日
(B)规定转换权将包括2022年11月30日之前的利息,超过该日期应计利息
以现金支付,以及(C)将转换价格修订为$基于$
与本公司于2023年2月完成首次公开招股同时,所有可转换桥票据根据其条款转换为普通股。转换时未确认任何收益或损失。
5. 可转换票据关联方
外管局 协议
2021年7月8日,本公司与关联方签订了一份未来股权简单协议(SAFE),收购价为$
2023年2月,保险箱终止并转换为在本公司首次公开招股完成时,根据其条款发行普通股。这一转换被认为是会计目的的赎回,因此,公司确认了一美元
截至2022年12月31日,$
2021年8月 笔记
于2021年8月19日,本公司与关联方订立可转换贷款协议,本金余额为$
2023年2月,关联方选择将可转换贷款转换为在公司首次公开招股结束时,根据其条款发行普通股。转换被认为是会计目的的赎回,因此,公司
确认了$
关于可转换贷款协议,本公司还发行了
| F-28 |
6. 应付票据
公司于2023年1月签订一份本金余额为#美元的短期应付票据。
于2023年2月,本公司订立协议,为其董事及高级职员保险提供部分保费。该协议规定提供#美元的资金。
7. 关联方
在截至2023年9月30日的9个月内,公司发布了向其首席财务官提供股票期权,以表彰其提供的服务。
在截至2021年12月31日的年度内,公司发行了 向关联方提供普通股期权,以换取提供的服务。期权的原始生命周期为 年限,分不同期限,最长24个月。在截至2023年9月30日和2022年9月30日的三个月内,公司 确认 和$, ,分别为与这些期权相关的股票薪酬。在截至2023年9月30日和2022年9月30日的9个月中,公司确认了$ 和$, ,分别为与这些期权相关的股票薪酬。
8. 股东权益
优先股 股票
该公司拥有面值为$的授权优先股使用被指定为A系列可转换优先股
。于2022年10月5日,本公司与投资者订立交换协议,规定交换
普通股入股A系列可转换优先股。A系列可转换优先股
的每股可随时转换为 公司的普通股。A系列优先股是普通股的经济等价物
,但没有投票权,并且如果投资者在此时拥有超过4.99%的公司流通普通股,则受禁止转换为普通股的限制。公司评估了
交换条款,确定公允价值没有重大变化,因此A系列优先股的估值为
美元。
普通股 股票
该公司拥有按面值$发行的普通股.截至二零二二年十二月三十一日止年度,本公司:
| ● | 已交换 A系列可转换优先股的普通股股份如上所述, | |
| ● | 已发布
普通股股份根据转换$ | |
| ● | 已取消 普通股股份作为取消先前协议和新 与顾问的协议,以及 | |
| ● | 已发布
根据许可协议,价值为美元的普通股 |
在 公司于2022年上半年从大学签署了两个药物项目的两个许可证后,它聘请了一家独立的估值公司 进行股票估值。这项工作的结果导致了在布莱克-斯科尔斯期权定价模型中使用的普通股每股价值的增加,该模型用于对公司的股权授予和认股权证发行进行估值。
| F-29 |
2023年2月,本公司完成首次公开募股,出售 单位(每个单位,统称为“单位”)
,价格为$每单位,总计约$
为配合首次公开招股的完成,本公司发行合共转换某些已发行的可转换债券时的普通股。
关于2023年2月的首次公开募股,本公司
2023年2月,公司发布了用于咨询服务的普通股和确认的$
在2023年第二季度,我们发布了行权后的普通股股份认股权证所得款项为$
稀释证券 不包括在稀释每股收益计算中,因为它们的影响是反稀释的。截至2023年9月30日 认股权证及普通股期权不包括在每股净亏损的计算中。截至2022年9月30日,认股权证及普通股期权不包括在每股净亏损的计算中。
2022年股权激励计划
2022年11月,公司董事会通过,股东批准了《2022年股权激励计划》(《计划》)。 该计划规定向员工、董事和顾问授予股权奖励。该计划规定了基于股权的奖励,包括激励性股票期权、非限定股票期权、股票增值权、业绩股票奖励、现金奖励 和其他基于股权的奖励。奖项的最长任期为任何行权价格不得低于授予日一股普通股公允市值的100%。该计划批准的初始最高奖励股票数量为具有自动的年度从2024年开始增长%。截至2023年9月30日,有授权但未发放的奖励 根据本计划可用。
股票 期权
| 股份数量 | 加权平均行权价 | 加权平均剩余合同期限(年) | 聚合内在价值 | |||||||||||||
| 在2022年12月31日未偿还 | $ | $ | ||||||||||||||
| 授与 | $ | - | $ | |||||||||||||
| 已锻炼 | $ | - | $ | |||||||||||||
| 被没收/取消 | $ | - | $ | |||||||||||||
| 截至2023年9月30日的未偿还债务 | $ | $ | ||||||||||||||
| 归属于2023年9月30日 | $ | $ | ||||||||||||||
| F-30 |
| 2023 | ||||
| 预期股息收益率 | ||||
| 预期波动率 | % - | |||
| 无风险利率 | %-% | |||
| 预期寿命(单位:10年) | - | |||
截至2023年9月30日的9个月内授予的期权的加权平均授予日公允价值为$。截至2022年9月30日的9个月内,未发行任何期权。
在提交的任何期间内,均未行使任何 期权。
在截至2023年9月30日的三个月和九个月内,公司确认了$及$,分别与股票期权相关的薪酬费用 。在截至2022年9月30日的三个月和九个月内,公司确认了及$薪酬支出中的 分别与股票期权有关。
截至2023年9月30日,与未归属股票期权相关的未确认薪酬支出总额约为$, 公司预计将在加权平均期内确认好几年了。
认股权证
在截至2023年9月30日和2022年9月30日的9个月内,公司共批准和分别是搜查令。在截至2023年9月30日的9个月内,认股权证
已归属的股份,其公允价值为$。在截至2022年12月31日的年度内,权证股份
已归属并经修订,公允价值为#美元,
截至2021年12月31日止年度,本公司共授予 搜查令。在这一数额中,权证,公允价值为$
在截至2021年12月31日的年度内,公司发行了
| F-31 |
在截至2023年9月30日的9个月内,公司发行了以下认股权证:
| ● | 2023年2月,为配合首次公开招股的完成,本公司发出向某些债券持有人发行的或有认股权证,行权价为$和过期日期从发行之日起数年。 | |
| ● | 2023年2月,为配合首次公开招股的完成,本公司发出或有权证作为向公司承销商支付的费用,行使价为$和过期日期从发行之日起数年。 | |
| ● | 作为公司首次公开募股中单位销售的一部分,公司发行了行权价格为$的可交易权证 和过期日期从发行之日起数年。此外,作为公司首次公开募股的单位销售的一部分,公司发行了行权价为$的非流通权证和过期日期从 发行起数年。 | |
| ● | 2023年2月,作为公司首次公开募股的一部分,公司发行了根据行使价为$的超额配售期权,向我们的承销商发行可交易认股权证 和过期日期从发行之日起数年。同样在2023年2月,作为公司首次公开募股的一部分,公司发行了根据行使价为$的超额配售期权向我们的承销商发行非流通权证 和过期日期从发行之日起数年。 |
在截至2023年9月30日的三个月和九个月内,公司确认了$及$与某些认股权证相关的补偿费用。在截至2022年9月30日的三个月和九个月内,公司确认了及$薪酬
与某些认股权证相关的费用。截至2023年9月30日,与未授权证相关的未确认补偿支出总额为$
下表提供了截至2023年9月30日该公司尚未发行的认股权证的详情:
| 行权价格 | 期满 | 手令的数目 | ||||||
| $ | ||||||||
| $ | ||||||||
| $ | ||||||||
| $ | ||||||||
| $ | ||||||||
9. 所得税
截至2023年9月30日和2022年9月30日的三个月和九个月,公司没有记录任何税收拨备或优惠。自在2023年9月30日和2022年12月31日实现任何未来可扣除的临时差异、净营业亏损结转和研发抵免的任何未来利益以来,本公司已为其全额递延税项净资产提供了估值准备金 。
| F-32 |
10. 材料协议
JHU-APL 技术许可证
2018年2月7日,该公司与JHU-APL签订了该技术的全球独家许可协议。许可证
包括三(3)项已颁发的专利、一(1)项新的临时专利申请、算法专有库的非专利权
和其他商业秘密,许可证还包括修改和改进。2021年10月,该公司执行了对原始许可证的修订
,代表改进和新的高级分析功能。考虑到根据许可协议授予公司的权利,JHU收到了相当于5%(
于
2023年5月31日,本公司与JHU-APL订立2022年7月8日许可协议第1号修订案,据此,本公司获得
包括额外专利和专有技术在内的若干改进,以换取一系列付款,总额为$
George 华盛顿大学-Beta2-Spectrin siRNA许可证
2022年1月14日,公司与乔治华盛顿大学(GWU) 签订了一项全球独家、含版税的许可证,有权使用靶向β 2-血影蛋白的siRNA治疗人类疾病,包括肝细胞癌(HCC)。许可证 涵盖了三项美国和全球专利申请中要求保护的方法,还包括将该方法用于治疗肥胖症、 非酒精性脂肪性肝病和非酒精性脂肪性肝炎。
作为根据许可协议授予公司的权利的代价,公司向GWU支付了$
| F-33 |
约翰斯·霍普金斯大学--甲苯咪唑许可证
2022年2月22日,该公司从约翰·霍普金斯大学(JHU)获得了独家的、全球范围的特许权使用费许可证, 使用改良的甲苯咪唑配方治疗任何人类癌症或肿瘤疾病。该配方在不同类型癌症的动物模型中显示出强大的活性,并已在高级别胶质瘤患者的I期临床试验中进行评估(NCT01729260)。这项试验是一项开放标签的剂量递增研究,评估了使用替莫唑胺的改进配方在24名新诊断的胶质瘤患者中的安全性和有效性。研究人员观察到,除了最高测试剂量(200毫克/公斤/天)外,所有接受测试剂量的患者都没有剂量限制性毒性。在接受最大试验剂量200毫克/公斤/天的15名患者中,有4名患者出现了剂量限制性毒性,所有这些毒性都可以通过减少或取消给予的剂量而逆转。在试验期间,任何剂量的甲苯咪唑都没有发生严重的不良反应。接受甲苯咪唑治疗的患者中,41.7%的患者在登记后两年内存活,25%的患者在登记后四年内存活(Gallia等人,2021年)。
许可证涵盖六(6)项已发布专利和一(1)项待定申请。考虑到根据许可协议授予公司的权利,JHU将收到一笔交错的预付许可费$
约翰斯·霍普金斯大学-前药物许可证
2022年10月13日,该公司从JHU和捷克科学院有机化学和生物化学研究所(IOCB)获得了全球范围内的独家许可,获得了甲苯咪唑N-取代前体药物的商业化权利,这些药物证明了
改善了溶解性和生物利用度。该许可证涵盖前药组合物和用于治疗疾病的药物,如美国和世界各地的多项专利申请所述。作为根据许可协议授予公司的权利的对价,JHU和IOCB
将收到一笔交错的预付许可费$
| F-34 |
招股说明书
牛蛙 AI控股公司。
上涨 至786,938普通股股份 股票
认股权证购买最多786,938股普通股
认股权证相关股份786,938股
预筹资金 认股权证最多购买786,938股普通股
786,938 预筹资权证相关股份
WallachBeth Capital LLC
, 2024
通过 并包括在2024年(本招股说明书发布后第25天)之前发行的股票, 所有对这些证券进行交易的交易商,无论是否参与此次发行,都可能被要求提交招股说明书。这是交易商在作为承销商时交付招股说明书的义务之外,并尊重 未售出的配售或认购。
第(Br)II部分-招股章程中不需要的信息
第 项13.发行发行的其他费用
下表列出了与所登记证券的发行和分配有关的各种费用的分项清单,我们将支付所有这些费用。除美国证券交易委员会注册费和FINRA备案费外,所有显示的金额都是估计的。
| 美国证券交易委员会 注册费 | $ | 1,591 | ||
| FINRA 申请费 | $ | 2,500 | ||
| 法律费用和开支 | $ | 235,000 | ||
| 费用和支出会计 | $ | 9,000 | ||
| 转账 代理费和注册费 | $ | 5,000 | ||
| 杂项费用和开支 | $ | 5,000 | ||
| 总计 | $ | 258,091 |
第 项14.对董事和高级职员的赔偿
内华达州法律规定,内华达州公司可以赔偿任何曾经或现在是公司的高级管理人员、雇员或代理人,或作为公司的高级管理人员、雇员或代理人,或目前或过去应公司的请求作为董事高级管理人员、高级管理人员或代理人而受到威胁、悬而未决或完成的任何诉讼、诉讼或法律程序(民事、刑事、行政或调查除外)的任何人,而该等诉讼、诉讼或法律程序并非由该公司提起的诉讼或该公司有权提起的诉讼(即“非衍生法律程序”)。另一家公司、合伙企业、合资企业、信托公司或其他企业的雇员或代理人支付的费用,包括律师费、判决、罚款和他在与诉讼、诉讼或诉讼有关的情况下实际和合理地支付的和解金额,如果他或她:
| ● | 根据内华达州修订的法规第78.138条,是否不对违反其对公司的受托责任承担责任;或 |
| ● | 以他或她合理地相信符合或不违反公司最大利益的方式行事, 并且就任何刑事诉讼或法律程序而言,没有合理理由相信他或她的行为是非法的。 |
此外,内华达州公司可以赔偿任何曾经或现在是公司一方或被威胁成为任何受威胁的、 待决或已完成的诉讼或诉讼的一方,以促使公司获得对其有利的判决(即“衍生法律程序”),原因是该人是或曾经是该公司的董事、高级管理人员、雇员或代理人,或 应该公司的请求作为另一公司、合伙企业、合资企业的高级管理人员、雇员或代理人服务。 信托或其他企业不承担费用,包括在和解中支付的金额和他或她实际和合理地因诉讼或诉讼的抗辩或和解而产生的律师费,如果他:
| ● | 根据内华达州修订后的法规78.138节,是否不对违反其对公司的受托责任承担责任;或 |
| ● | 本着善意行事,并以他或她合理地认为符合或不反对公司最佳利益的方式行事。 |
| II-1 |
根据内华达州法律,此人在用尽所有上诉后被有管辖权的法院判决对公司负有责任或支付给公司的和解金额的任何索赔、问题或事项不得进行赔偿,除非且仅限于提起诉讼或诉讼的法院或其他有管辖权的法院在提出申请后裁定,鉴于案件的所有情况,此人有公平和合理的权利获得赔偿,以支付法院认为适当的费用。
NRS 第78.747节规定,除非特定法规另有规定,任何董事或公司高管均不对公司的债务或责任承担个人责任,除非董事或高管是公司的另一个自我。从法律上讲,法院必须确定董事或高管是否作为公司的另一个自我。
对于公司的董事人员、高级职员、雇员或代理人在为任何非派生诉讼或任何派生诉讼辩护,或为其中的任何索赔、问题或事项辩护而取得成功的范围内,公司有义务 赔偿他或她实际和合理地与辩护相关的费用,包括律师费。
此外,内华达州法律允许内华达州公司购买和维护保险或代表任何人 购买和维护保险或作出其他财务安排, 此人是或曾经是公司的董事人员、员工或代理人,或应公司的请求作为另一公司、合伙企业、合资企业、信托公司或其他企业的人员、人员、员工或代理为其承担的任何责任以及因其作为董事人员、高管、员工或代理的身份或因其身份而产生的责任和费用,公司是否有权就此类责任和费用向他或她进行赔偿。
鉴于根据证券法产生的责任的赔偿可能根据前述条款或其他规定允许本公司的董事、高级管理人员和控制人 ,我们已被告知,美国证券交易委员会认为这种赔偿 违反证券法所表达的公共政策,因此无法执行。
公司计划就此次发行订立承销协议,规定承销商在某些情况下有义务赔偿公司董事、高级管理人员和控制人的特定责任,包括证券法下的责任。
第 项15.近期发行的未注册证券
在提交本注册声明之前的 三年中,我们发行了以下未根据证券法注册的证券。以下提供的信息不适用于随附的招股说明书中所述的反向股票拆分建议。
| II-2 |
2021年6月23日,公司与参与的实体签署了两份咨询/顾问协议,以促进公司实现其证券公开上市的目标 。根据这些协议,每位顾问将获得:(I)紧接在纳斯达克或任何其他国家证券交易所上市前通过权益表衡量的公司完全稀释后股本的3%,并在预期上市日前三十(30)天内交付;及(Ii)为期五年的认股权证,按每股1.00美元购买1,000,000股(在一宗情况下)及400,000股本公司普通股,该认股权证将于预期上市交易前三十(30)日授予。根据这些协议,向每名顾问发行了817,786股普通股 以及上述认股权证。2022年5月,这些协议都进行了修改,一名顾问(纽曼)获得了500,000股,另一名顾问获得了350,000股普通股。所有的认股权证都被取消了。
2021年7月,本公司与关联方签订了一份价值150,000美元的安全票据协议。本公司于八月订立两项过渡性票据协议,一项与同一关联方作为外汇局,金额为99,900美元,另一项与非关联方订立,金额为195,000美元。 该等票据以5%的原始发行折扣发行,买方分别收到115,185及225,000份认股权证。
2021年11月,根据与Dane Saglio的咨询协议,发行了400,000股普通股,提供符合首席财务官职责的服务。此外,共向受聘为公司管理层和顾问的顾问发行了972,500份认股权证,行使价格为0.30-0.38美元。这些认股权证协议的归属条款从 到36个月不等。此外,公司还向员工发行了205,000份期权,行权价为0.38美元,授予期限为12-24个月。
2021年12月,公司发起配售过桥票据,寻求150万美元的运营资本,以确保公司在完成财务报表审计和编制与首次公开募股相关的S-1注册说明书的同时拥有运营资本。去年12月,该公司以25,000美元的价格将一张可转换本票出售给了一家非关联方。2022年4月11日,本公司与WallachBeth Capital LLC就本公司拟进行的私募及/或公开发售 订立独家配售代理及/或承销商协议。如脚注2所述,本公司融资计划的一个重要组成部分是本公司有意寻求通过其普通股的首次公开发行(IPO)在全国交易所上市。WallachBeth 参与了这方面的工作,2022年4月28日,公司通过向几家机构投资者以及几家经认可的个人投资者出售可转换桥接票据和认股权证,获得了净收益或约775,000美元。除了4月28日收到的资金外,公司还在4月初通过向关联方出售可转换桥票据和认股权证获得了10万美元 。2022年9月,该公司还通过出售一张额外的可转换桥接票据获得了20,000美元的净收益。过渡性票据可在IPO时以IPO价格20%的折扣价转换,购买者还将获得转换后发行的每股普通股 股的认股权证。认股权证行权价将为每股招股价的90%。
| II-3 |
项目 16.证物和财务报表附表
(a) 陈列品
| 附件 编号: | 描述 | |
| 1.1* | 承销协议的格式 | |
| 3.1 | 参考本公司于2023年2月13日向美国证券交易委员会提交的《S-1表格注册说明书修正案》(第333-267951号)附件3.1,对牛蛙AI控股有限公司的公司章程进行了修订和重述。 | |
| 3.2 | 参考本公司于2023年2月13日向美国证券交易委员会提交的《S-1表格注册说明书修正案》(第333-267951号)附件3.2成立的《牛蛙AI控股有限公司附例》。 | |
| 4.1* | 公司授权书表格(附于附件4.3) | |
| 4.2* | 保险人授权书的格式 | |
| 4.3* | 委托书代理协议格式 | |
| 5.1* | 四川罗斯·费伦斯·卡梅尔有限责任公司的意见 | |
| 10.1 | 与BullFrog AI,Inc.订立的收购协议参考了本公司于2023年2月13日向美国证券交易委员会提交的S-1表格(第333-267951号)注册说明书修正案附件10.1。 | |
| 10.2 | 本公司与格林豪泰金融集团有限公司签订的顾问协议,参照本公司于2023年2月13日向美国证券交易委员会提交的S-1表格(第333-267951号)注册说明书修正案附件10.2而成立。 | |
| 10.3 | 本公司与Garrett Newman之间的咨询协议,通过引用本公司于2023年2月13日提交给美国证券交易委员会的《公司对S-1表格(第333-267951号)注册说明书修正案》的附件10.3而成立。 | |
| 10.4+ | 与Vininder Singh的雇佣协议通过引用公司对2023年2月13日提交给美国证券交易委员会的S-1表格(第333-267951号)注册声明修正案的附件10.4而并入。 | |
| 10.5 | 公司与乔治华盛顿大学的专利许可协议,日期为2022年1月14日,通过引用公司于2023年2月13日提交给美国证券交易委员会的《S-1表格注册声明修正案》(第333-267951号)附件10.6而并入。 | |
| 10.6 | 公司与约翰霍普金斯大学的独家许可协议,日期为2022年2月22日,通过引用公司于2023年2月13日提交给美国证券交易委员会的S-1表格注册声明修正案(第333-267951号)附件10.7而并入。 | |
| 10.7 | 公司与约翰霍普金斯应用物理实验室有限责任公司的许可协议,日期为2022年7月8日,通过引用公司于2023年2月13日提交给美国证券交易委员会的S-1表格(第333-267951号)注册声明修正案的附件10.8而并入。 | |
| 10.8 | 公司与约翰霍普金斯应用物理实验室有限责任公司的许可协议,日期为2018年2月7日,通过引用公司于2023年2月13日提交给美国证券交易委员会的S-1表格(第333-267951号)注册声明修正案的附件10.5而并入。 | |
| 10.9 | 公司与约翰·霍普金斯大学和捷克科学院有机化学和生物化学研究所签订的许可协议,日期为2022年10月13日,通过引用公司于2023年2月13日提交给美国证券交易委员会的S-1表格注册声明修正案(第333-267951号)的附件10.9而并入。 | |
| 10.10 | 2022年股权补偿计划参考公司于2023年4月25日提交给美国证券交易委员会的10-K表格年度报告附件10.10而纳入 | |
| 10.11 | 牛蛙AI,Inc.与约翰·霍普金斯大学应用物理实验室有限责任公司于2023年6月1日签订的许可协议的第1号修正案,通过引用附件10.1并入该公司于2023年6月5日提交给美国证券交易委员会的当前8-K表格报告中 | |
| 10.12 | 日期为2023年9月7日的数据使用和技术合作协议引用本公司于2023年9月14日提交给美国证券交易委员会的当前8-K表格中的附件10.1 | |
| 10.13++ | 公司与利伯脑开发研究所于2023年10月13日签订的商业协议,与公司于2023年10月20日提交给美国证券交易委员会的当前8-K表格报告的商业协议 | |
| 21.1 | 参考本公司于2023年2月13日向美国证券交易委员会提交的《S-1表格注册说明书修正案》(第333-267951号)附件21.1成立的牛蛙AI控股有限公司重要子公司名单。 | |
| 23.1* | 独立注册会计师事务所M&K CPAS PLLC的同意 | |
| 23.2* | Sinhenzia Ross Ference Carmel LLP的同意书(包含在作为本合同附件5.1提交的意见书中) | |
| 24.1 | 授权书(包括在本登记声明的签名页中) | |
| 107* | 备案费表 |
| * | 在此提交 |
| + | 管理层 需要作为本招股说明书证物提交的补偿计划或安排 |
| ++ | 根据美国证券交易委员会颁布的S-K法规第601(B)(10)(Iv)项,本附件的某些部分已被遗漏 ,因为它既不是重大信息,也不是公司视为私人或机密的信息类型。 |
| II-4 |
项目 17.承诺
| (a) | 以下签署的注册人承诺: |
| (1) | 在提供报价或销售的任何期间, 提交对本注册声明的生效后修正案: |
| (i) | 包括1933年《证券法》第10(A)(3)节要求的任何招股说明书; |
| (Ii) | 在招股说明书中反映在注册说明书生效日期(或注册说明书生效后的最新修订)之后发生的、个别地或总体上代表注册说明书中所列信息发生根本变化的任何事实或事件。尽管如上所述,证券发行量的任何增加或减少(如果所发行证券的总美元价值不超过登记的证券)以及与估计最高发售范围的低端或高端的任何偏离,可在根据第424(B)条提交给证监会的招股说明书中反映 如果总量和价格的变化合计不超过有效登记说明书“注册费计算”表中规定的最高发售总价的20%; |
| (Iii) | 将以前未在登记说明中披露的与分配计划有关的任何重大信息包括在登记说明中 ,或在登记说明中对此类信息进行任何重大更改; |
| (2) | 为了确定1933年《证券法》规定的任何责任,每一项生效后的修订应被视为与其中所提供的证券有关的新的登记声明,而当时发行此类证券应被视为初始证券。善意的它的供品。 |
| (3) | 通过生效后的修订将在发行终止时仍未售出的任何正在登记的证券从登记中删除。 |
| (4) | 为了根据1933年证券法确定对任何买方的责任,根据规则424(B)提交的每份招股说明书应被视为注册说明书的一部分,但根据规则430B提交的注册说明书或根据规则430A提交的招股说明书除外,应视为注册说明书的一部分并包括在注册说明书生效后首次使用的日期 。但是,对于在首次使用之前有销售合同的买方而言,作为注册声明的一部分的注册声明或招股说明书 中所作的任何声明,或通过引用并入或被视为并入注册声明或招股说明书的文件中所作的任何声明,都不会取代或修改在注册声明或招股说明书中所作的任何声明,而该声明是注册声明或招股说明书中的注册声明的一部分,或在紧接首次使用日期之前的任何此类文件中所作的声明。 |
| II-5 |
| (5) | 为了确定注册人根据1933年《证券法》对证券初次分发中的任何买方的责任,以下签署的注册人承诺,在根据本注册声明 向以下签署的注册人的证券进行的首次发售中,无论用于向购买者出售证券的承销方式如何,如果证券是通过下列任何通信方式向购买者提供或出售的,则以下签署的注册人将是购买者的卖方,并将被视为向购买者提供或出售此类证券: |
| (i) | 与规则424规定必须提交的发行有关的任何初步招股说明书或以下签署注册人的招股说明书; |
| (Ii) | 任何与招股有关的免费书面招股说明书,这些招股说明书是由以下签署的注册人或其代表编写的,或由签署的注册人使用或提及的; |
| (Iii) | 与发行有关的任何其他免费书面招股说明书的 部分,其中包含关于下文签署的注册人的重要信息 或由下文签署的注册人或其代表提供的证券;以及 |
| (Iv) | 以下签署的注册人向买方发出的要约中的任何其他信息。 |
| (b) | 根据上述条款或其他规定,注册人的董事、高级管理人员和控制人员可根据《1933年证券法》对责任进行赔偿,但注册人已被告知,根据证券交易委员会的意见,此类赔偿违反了该法案所表达的公共政策,因此, 不可执行。如果上述董事、高级职员或控制人就正在登记的证券提出赔偿要求,则除非注册人的律师认为此事已通过控制先例解决,否则登记人将对此类责任(登记人支付因成功抗辩任何诉讼、诉讼或诉讼而招致或支付的费用除外)提出赔偿要求。向具有适当管辖权的法院提交是否违反该法所述公共政策的问题, 将以该问题的最终裁决为准。 |
| II-6 |
签名
根据修订后的1933年证券法的要求,注册人已于2024年1月29日在纽约州纽约市正式安排S-1表格中的本注册声明 由正式授权的下列签署人代表注册人签署。
| 牛蛙 AI控股公司。 (注册人) | ||
| 发信人: | /S/ 维因德·辛格 | |
| 姓名: | 维因德·辛格 | |
| 标题: | 首席执行干事(首席执行干事) | |
授权书
通过此等证明,所有人都知道,以下签名的每个人在此构成并任命Vininder Singh和Dane Saglio,以及他们中的每一个人(拥有他们各自单独行事的全部权力),他真正合法的事实律师和代理人,完全有权以他和他的名义、地点和替代的身份,以任何和所有身份签署、签署和提交本注册声明,根据修订的1933年证券法以及任何或所有修正案(包括但不限于,(br}生效后修正案)本注册说明书,连同所有证物和所有需向美国证券交易委员会或任何其他监管机构提交的文件,授予该等实名律师和代理人及他们每一人全面的权力和授权,以作出和执行每项适当或必须作出的作为和事情,以达到其本人可能或可以亲自作出的所有意图和目的,特此批准并确认 所有该等实名律师和代理人,或它们中的任何一个或多个代用品,可根据本协议合法地实施或导致实施。
根据修订后的1933年证券法的要求,本S-1表格登记声明已由 下列人员以指定的身份和日期签署。
| 名字 | 标题 | 日期 | ||
| /S/ 维因德·辛格 | 首席执行官兼董事(首席行政主任) | 1月29日 2024 | ||
| 维因德·辛格 | ||||
| /S/ 戴恩·萨格里奥 | 首席财务官(首席财务和会计官) | 1月29日 2024 | ||
| Dane 萨格里奥 | ||||
| /S/ 唐·埃尔西 | 董事 | 1月29日 2024 | ||
| 唐·埃尔西 | ||||
| /S/ 威廉·恩赖特 | 董事 | 1月29日 2024 | ||
| 威廉·恩赖特 | ||||
| /S/ 杰森·汉森 | 董事 | 1月29日 2024 | ||
| 杰森·汉森 |
| II-7 |