

© 2024 SAB BIOTHERAPEUTICS, INC.为延缓 1 型糖尿病的发作或进展而开发的全人源抗胸腺细胞生物制剂 NASDAQ:SABS SAB 生物疗法简介 2024 年 1 月附录 99.1

前瞻性陈述 2 本演示文稿中的材料由SAB Biotherapeutics, Inc.(“SAB”)编写,是截至本演讲之日有关SAB活动的一般背景信息。此信息以摘要形式提供,并不完整。本演示文稿中的信息,包括财务预测,不应被视为就持有、购买或出售证券或其他金融产品或工具向投资者或潜在投资者提出的建议或推荐,并且不考虑任何特定的投资目标、财务状况或需求。本演示文稿可能包含前瞻性陈述,包括有关我们对SAB业务和运营的意图、信念或当前预期、市场状况、经营业绩和财务状况、资本充足率、具体条款和风险管理实践的陈述。提醒读者不要过分依赖这些前瞻性陈述。除非法律要求,否则SAB不承担任何义务出于任何原因更新此处的任何信息,也没有义务公开发布对这些前瞻性陈述的任何修订结果,以反映本文发布之日之后的事件或情况,以反映意外事件的发生。尽管在编制预测信息时采取了应有的谨慎态度,但实际结果可能存在重大正面或负面的差异,并且陈述可能包含错误或遗漏。预测和假设示例受SAB无法控制的不确定性和突发事件的影响。过去的表现并不能可靠地表明未来的表现。本演示文稿中包含或暗示的前瞻性陈述受其他风险和不确定性的影响,包括SAB向美国证券交易委员会(“SEC”)发布的最新10-K表年度报告以及SAB向美国证券交易委员会提交的其他文件中,在 “风险因素” 标题下讨论的那些风险和不确定性。除非另有说明,否则信息是截至本文发布之日的最新信息。本演示文稿中出现的SAB徽标和其他商标均为SAB的财产。本演示文稿中的所有其他商标、服务商标和商品名称均为其各自所有者的财产。© 2024 SAB BIOTHERAPEUTICS, INC.

Investment Thesis 3 SAB Biotherapeutics是一家下一代抗体平台公司,在三种适应症中拥有超过700名患者的人体数据,目前专注于预防1型糖尿病。T1D 中 SAB-142 的 MoA 是一种行之有效的治疗方法,得到了临床医生、意见领袖和青少年糖尿病研究基金会 (JDRF) 的支持和热情。新发的 T1D 被视为孤儿病启动的 SAB-142-101 FIM 研究;开发计划是与 JDRF 1 期数据合作设计的,预计到 2024 年;旨在证明与 rAtG(零血清病和 NaDA)相比具有安全优势,因为它是可以重做的人类抗体用于预防和改变疾病预防1型新药的战略验证赛诺菲以29亿美元的价格收购了另一家由JDRF赞助的公司Provention © 2024 SAB BIOTHERAPEUTICS, INC.,INC.,这证明了糖尿病。

经验丰富的管理团队 Christoph Bausch,博士,工商管理硕士执行副总裁兼首席运营官 20 多年的研究和发现、生物制造、业务开发和平台技术商业化 MilliporeSigma(默沙东 KGaA)斯托尔斯医学研究所博士后 Eddie J. Sullivan,博士总裁兼首席执行官/联合创始人 20 年以上新技术开发 25 年以上生物技术前日本制药生物执行委员会生殖生理学家 Michael G. King, Jr.执行副总裁兼首席财务官在丰泽生物科技(FBIO)担任屡获殊荣的生物技术行业分析师驻校企业家 Ziopharm Oncology (ZIOP) 高级副总裁兼企业发展总监塞缪尔·赖希执行董事长、董事长 20 年以上生物制药高管兼生物企业家联合创始人 Acuity Pharmicals、OPKO Health、Biscayne 神经疗法分子生物学家亚历山德拉·克罗波托娃,医学博士,执行副总裁兼首席医学官 20 多年的全球临床开发生物制药研发负责人,辉瑞、惠氏、赛诺菲、梯瓦专业研发委员会成员,iBio为从一期到BLA和NDA批准的众多专利和化合物领先组合做出了贡献 © 2024 SAB BIOTHERAPEUTICS, INC.

唯一携带全人类免疫球蛋白 (Ig) 重链和轻链 (q) 位点的转基因动物。HAC 与其他60 Tc Bovine染色体一起受到有丝分裂的影响。Tc Bovine 中存在的 HAC 可以最大限度地产生与人类最相似的人体免疫球蛋白库。Tc Bovine Human Immunoglobulin G 在转染体牛中产生 Tc Bovine 含有所有的人类免疫球蛋白基因人类人工染色体 (HAC) ~17Mb 包含整个未排列的 VDJ 人类免疫球蛋白位点 (iGH + IgΩ) © 2024 SAB BIOTHERAPEUTICS, INC.

SAB-142:人类抗胸腺细胞球蛋白(HaTG)——针对1型糖尿病的重点项目开发 © 2024 SAB BIOTHERAPEUTICS, INC.
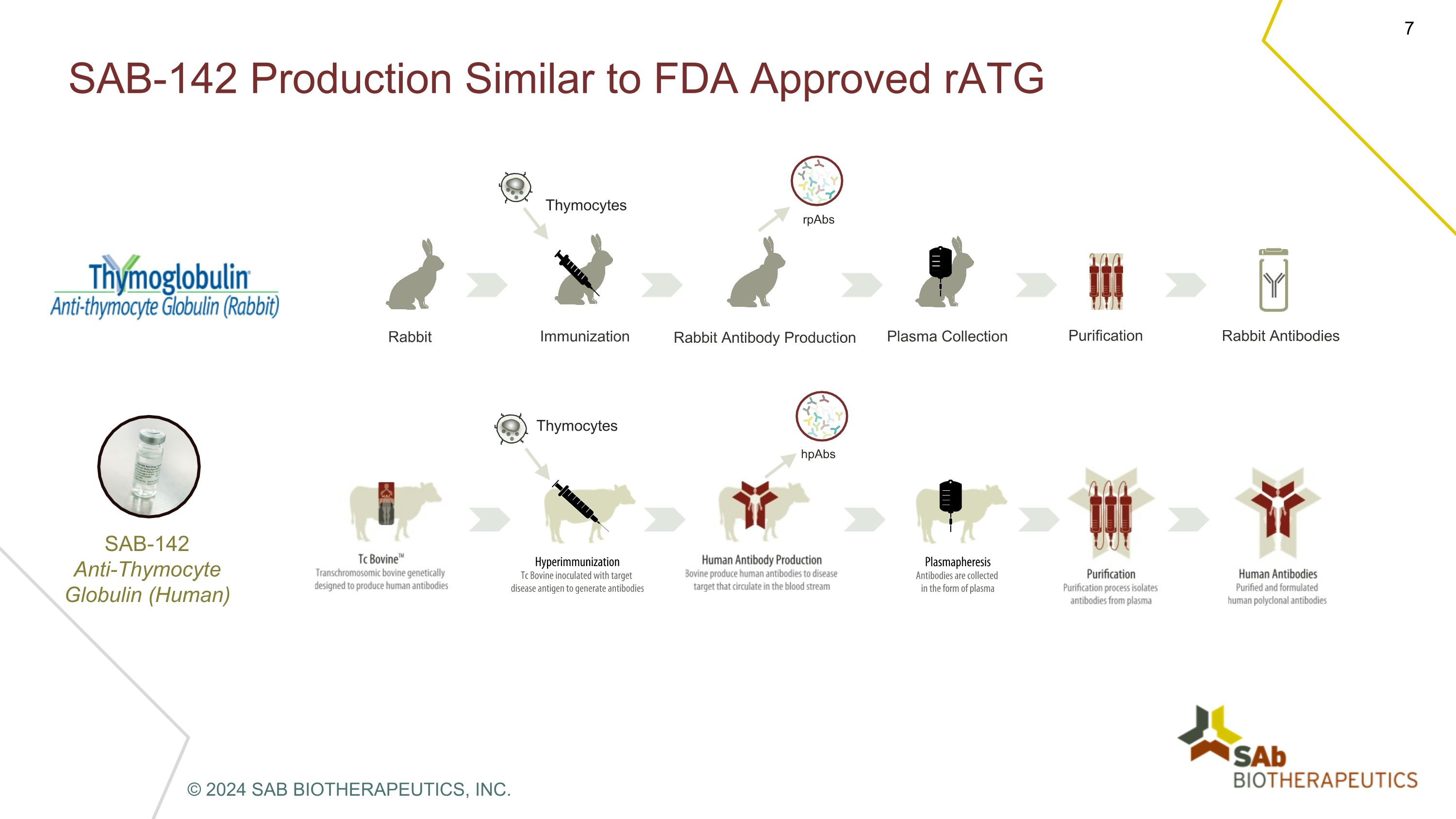
SAB-142 产量与美国食品药品管理局批准的 rATG rPab hPabs 胸腺细胞胸腺细胞兔子免疫兔抗体生产血浆收集纯化兔抗体 sab-142抗胸腺细胞球蛋白(人类)© 2024 SAB BIOTHERAPEUTICS, INC.
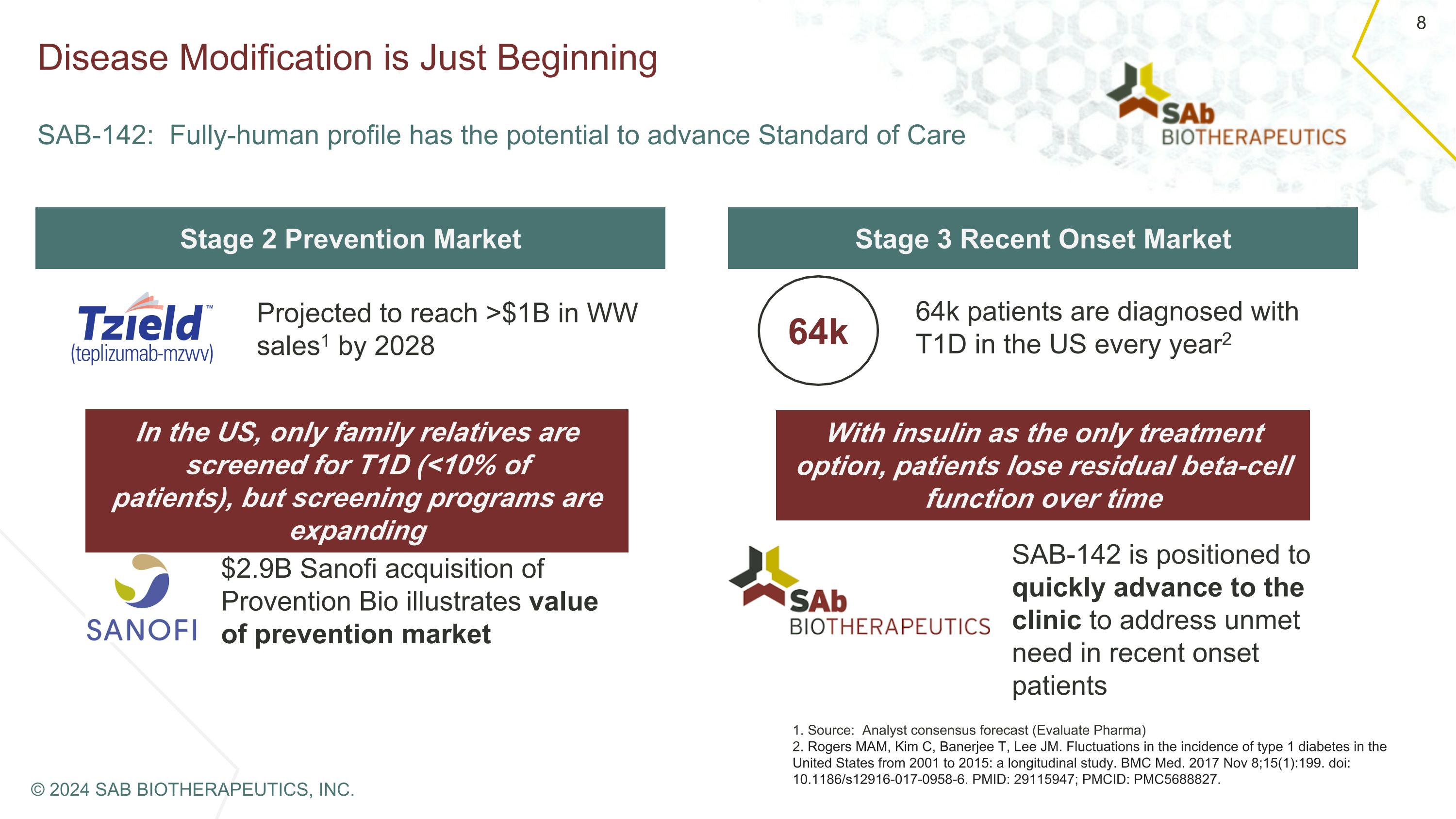
疾病改变才刚刚开始 SAB-142:全人概况有可能推进标准护理第二阶段预防市场第三阶段近期发病市场预计到2028年全球销售额将达到超过10亿美元1 在美国,只有家庭亲属接受T1D筛查 (
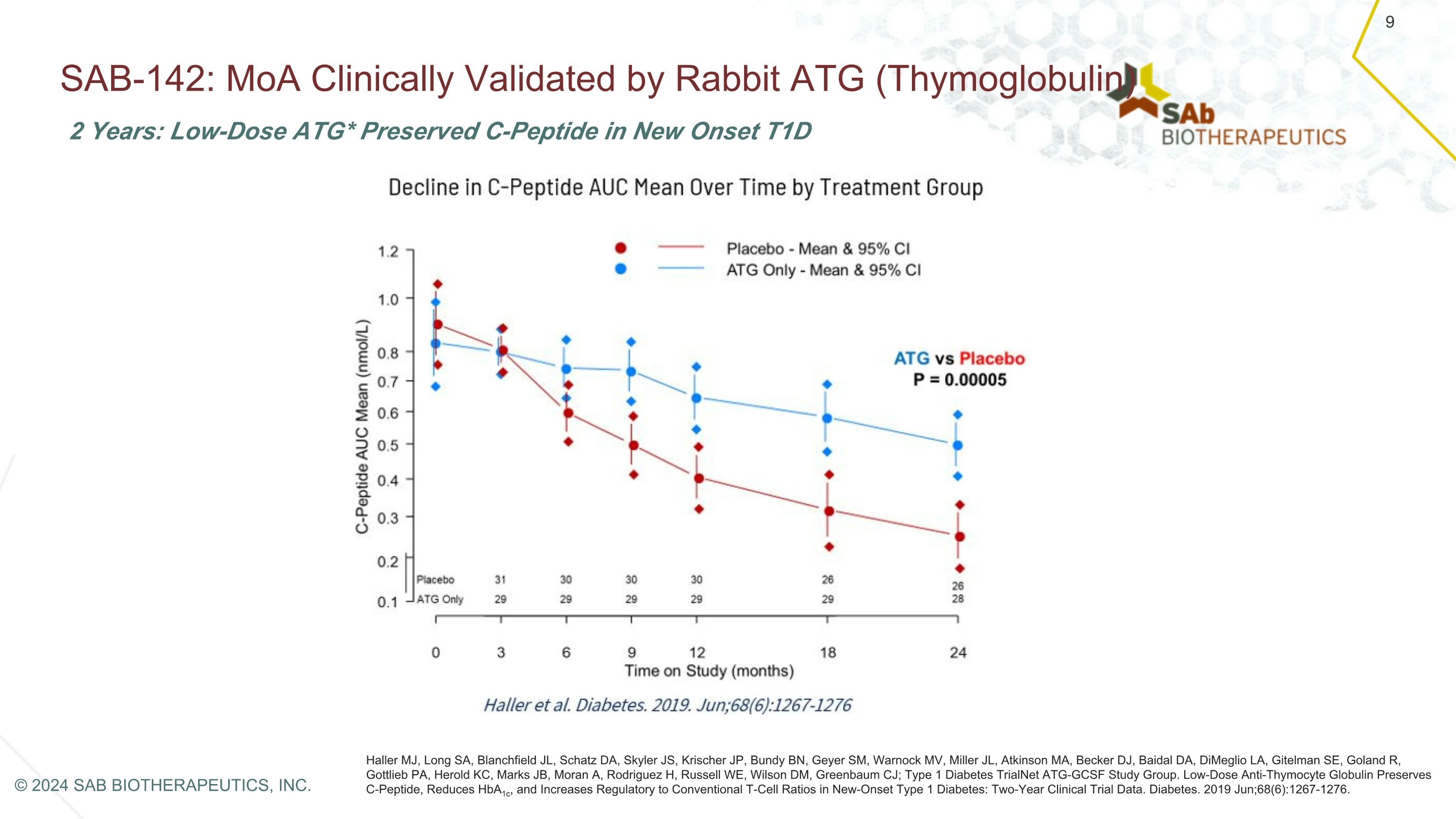
SAB-142:MoA 经过 Rabbit ATG(胸腺球蛋白)Haller MJ、Long SA、Blanchfield JL、Schatz DA、Skyler JS、Krischer JP、Bundy BN、Geyer SM、Warnock MV、Miller JL、Atkinson MA、Becker DJ、Baidal DA、Dimeglio LA、Gitelman SE、Goland R、PA Gottlieb 的临床验证 Herold KC、Marks JB、Moran A、Rodriguez H、Russell WE、Wilson DM、Greenbaum CJ;1 型糖尿病 TrialNet ATG-GCSF 研究组。低剂量抗胸腺细胞球蛋白可保存 C 肽,降低 HbA1c,并增强对新发型 1 型糖尿病的传统 T 细胞比率的监管:两年临床试验数据。糖尿病。2019 年 6 月;68 (6): 1267-1276。2 年:低剂量 ATG* 在新发的 T1D 9 中保留了 C 肽 © 2024 SAB BIOTHERAPEUTICS, INC.
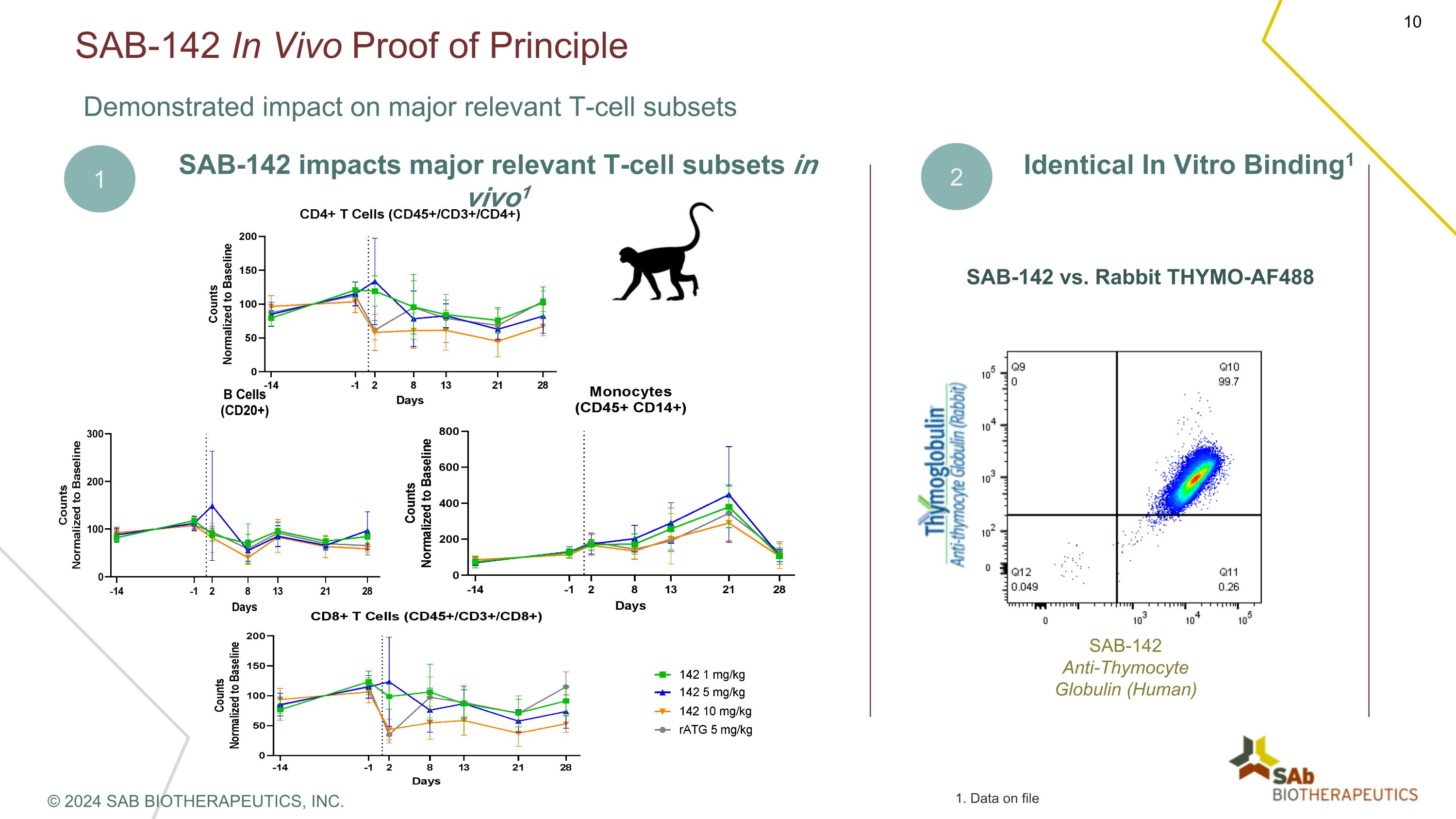
SAB-142 体内原理证明对主要相关 T 细胞亚群产生影响 SAB-142 影响 vivo1 中主要相关 T 细胞亚群 2 相同体外结合1 SAB-142 与兔子 THYMO-AF488 sab-142抗胸腺细胞球蛋白(人类)1 © 2024 SAB BIOTHERAPEUTICS, INC. 1.存档数据

Teplizumab(Tzield)3期研究胸腺球蛋白2期数据外卖/附加值年龄8-17岁 12-45岁 rATG显示适用于更广泛的患者,即成人和儿科/青少年。使用TZIELD剂量显著的市场规模将没有资格使用TZIELD给药两个疗程的每日静脉注射,为期12天,在第1个月和第6个月进行单剂量的静脉注射,在2天内给药 ATG 更便于患者的给药方案,有可能节省与药物管理和患者监测主要时间点第 78 周(1.5 年)第 52 周相关的成本(1 年) 需要 2 个疗程和更长的时间到达主要终点的样本量 TZIELD 样本量 200 个,ATG 的 PBO 29 上的 31 个,PBO ATG 上的 31 个样本量更强,需要较小的样本量才能显示出显著的统计结果功效 C肽 C肽水平的主要终点在第 78 周达到 AUC 的主要终点 ATG 显示出 AUC 与 PBO 的功效相比 c 无统计重要数据:在第52周,ATG和ATG-GCSF ATG均有统计学意义的数据,显示了HbA1v功效胰岛素的显著临床结果数字趋势与 PBO 相比数值更好(ATG 组与 PBO 组中添加的胰岛素较少)数据持平 SAB-142 在第 3 阶段的潜在优势:Teplizumab 与胸腺球蛋白 © 2024 SAB BIOTHERAPEUTICS, INC.
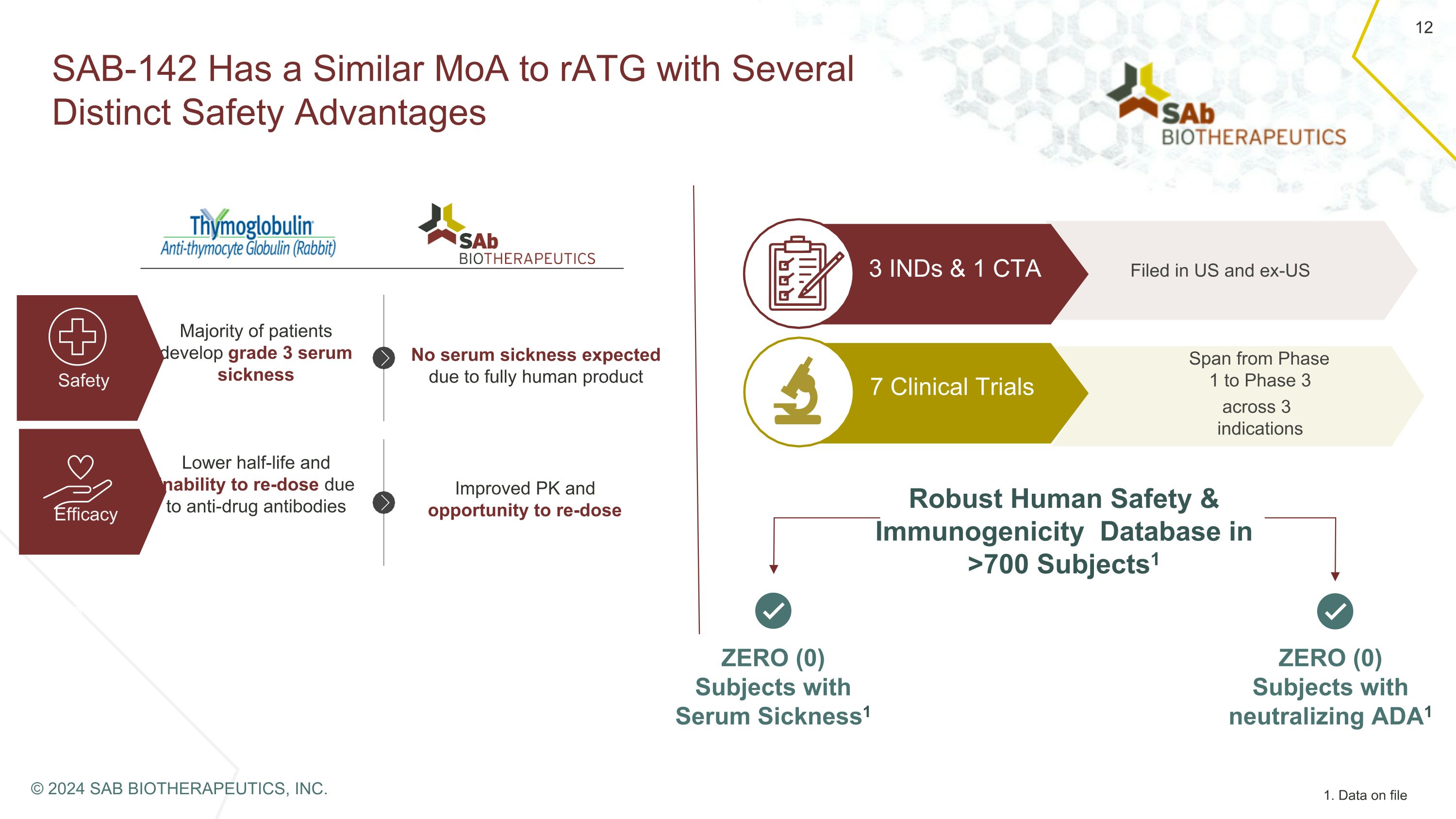
SAB-142 与 rAtG 相似,具有多种明显的安全优势。大多数患者会出现 3 级血清病安全功效由于完全人体产物而预计不会出现血清疾病;由于抗药抗体,半衰期较短,无法再给药。改善的 PK 和重剂机会在美国和美国以外的 7 个临床试验涵盖了 3 个适应症 3 个 IND 和 1 个 CTA > 700 个主题中的强大人类安全性和免疫原性数据库 ts1 零 (0) 血清病受试者1 零 (0) 中和 ADA1 受试者 1 1.存档数据 © 2024 SAB BIOTHERAPEUTICS, INC.

SAB-142:T1D 研究设计中的临床开发计划 “首次人体临床研究(人体试验)中采用全人类抗胸腺细胞生物制剂” 第 1 阶段:首次进入人体、随机、单次递增剂量试验 SAB-142 剂量范围:0.03mg/kg 至 2.5mg/kg 终点主要终点:急性(血清病,CRS)和长期(感染率)安全性次要终点:药代动力学、药效学,免疫原性/ADA 主要结果:根据预期的 0% 的血清病和 NAB 验证人体 SAB-142 的 MoA 证明生物活性(POBA):CD3、CD8、CD4、CD8/CD4比率、Tregs与rAtG相比与基线的变化(交叉研究)© 2024 SAB BIOTHERAPEUTICS, INC.**截至 2024 年 12 月底的收入数据
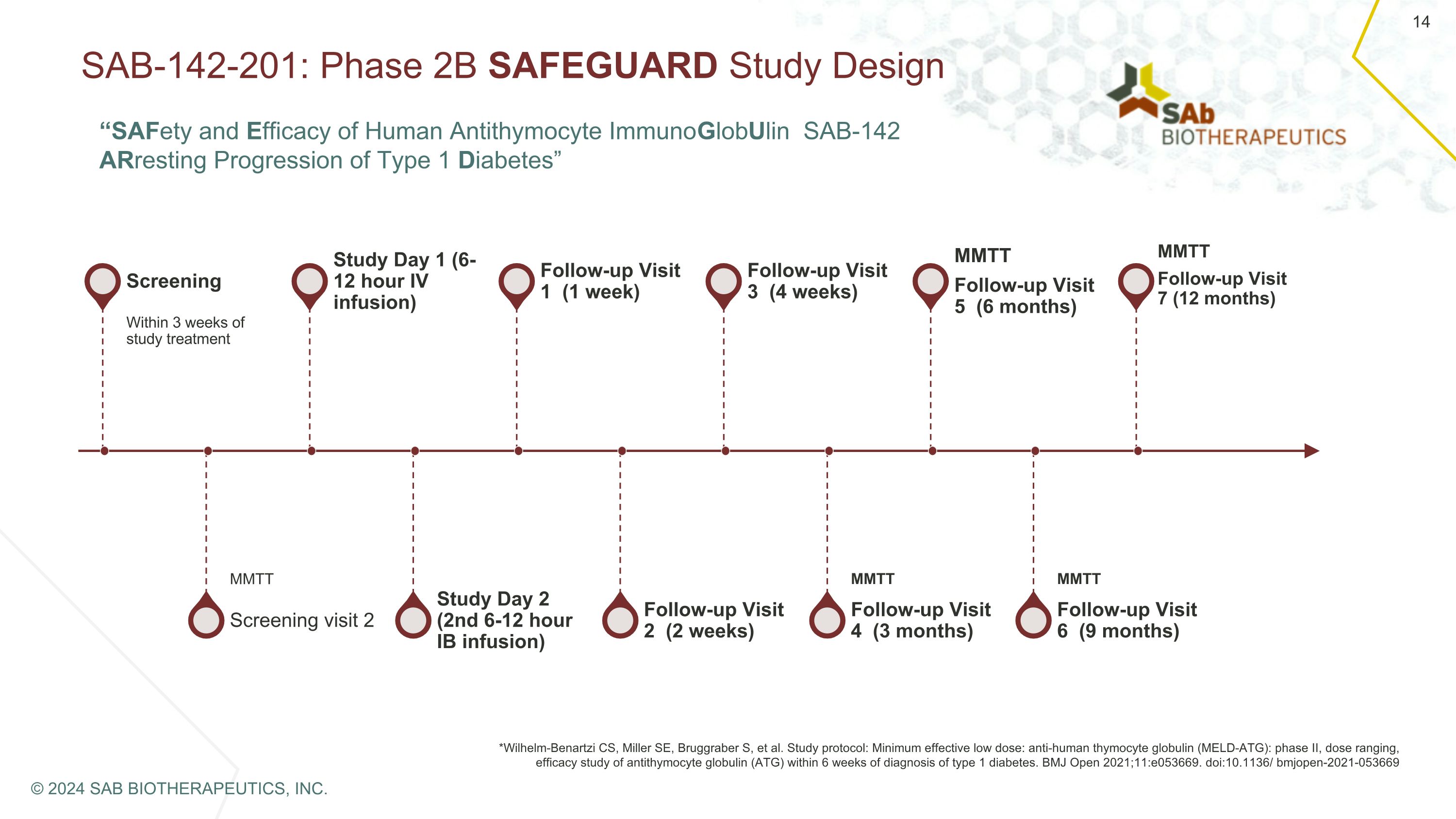
SAB-142-201:2B 期 SAFEGUARD 研究设计筛查在研究治疗后 3 周内筛查 2 MMTT 研究第 1 天(6-12 小时静脉输注)研究第 2 天(第 2 次 6-12 小时 IB 输液)随访 1(1 周)随访 2(2 周)随访 3(4 周)随访 4(3 个月)MMTT 随访 5(6 个月)后续就诊 6(9 个月)MMTT *Wilhelm-BenArtMartt Zi CS、Miller SE、Bruggraber S 等研究方案:最低有效低剂量:抗人胸腺细胞球蛋白(MELD-ATG):第二阶段,剂量范围,在诊断为1型糖尿病后的6周内进行抗胸腺细胞球蛋白(ATG)的疗效研究。BMJ Open 2021;11:e053669。doi: 10.1136/ bmjopen-2021-053669 MMTT 后续访问 7(12 个月)© 2024 SAB BIOTHERAPEUTICS, INC.“人类抗胸腺细胞免疫球蛋白 SAB-142 的安全性和有效性阻止 1 型糖尿病的进展”
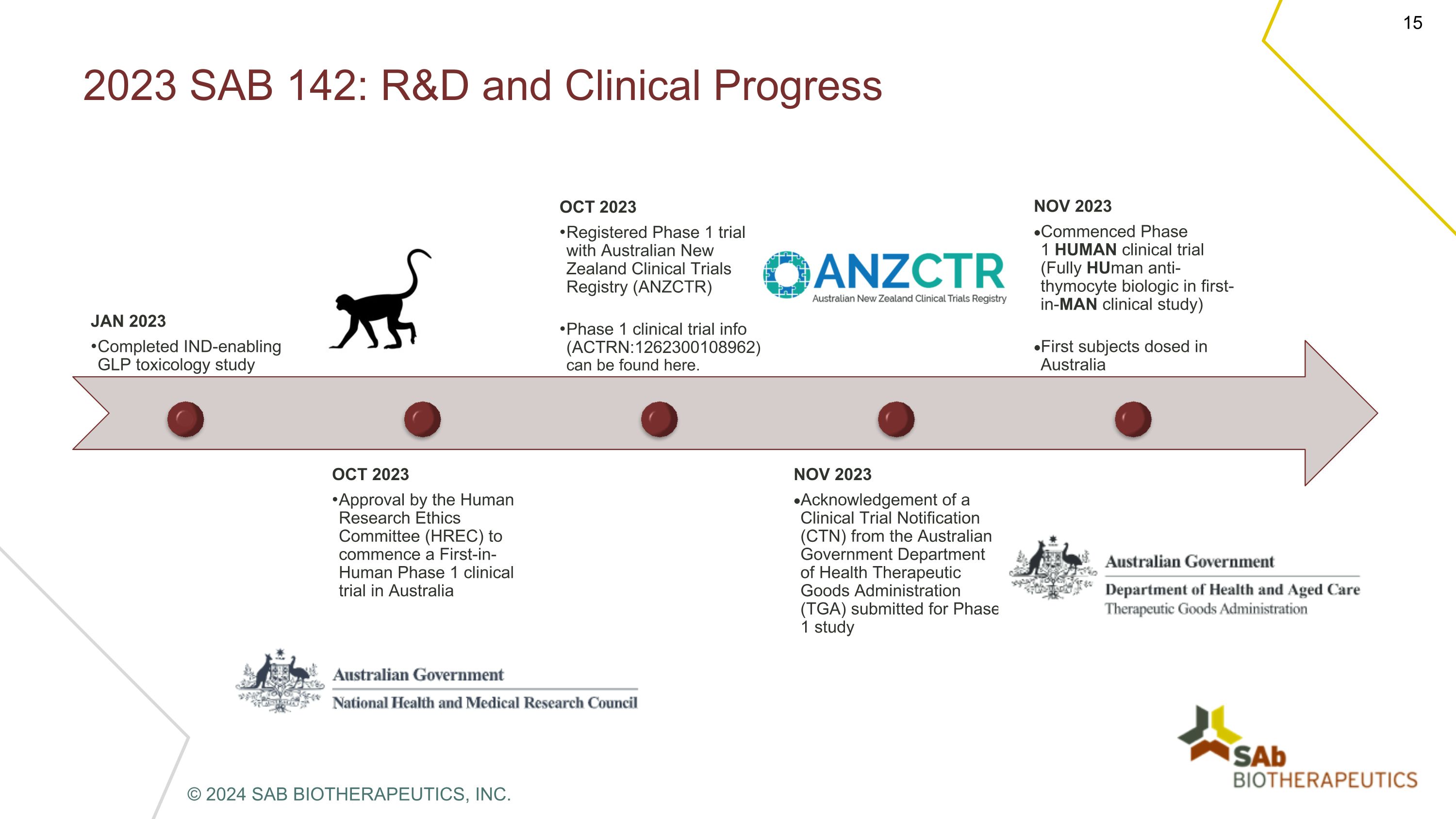
2023 SAB 142:研发和临床进展 2023 年 1 月完成支持临床试验的 GLP 毒理学研究 2023 年 10 月经人类研究伦理委员会 (HREC) 批准在澳大利亚启动首次人体 1 期临床试验 2023 年 10 月澳大利亚新西兰临床试验注册局 (ANZCTR) 的1期临床试验信息 (ACTRN: 1262300108962) 可在此处找到。2023 年 11 月澳大利亚政府卫生部治疗用品管理局 (TGA) 提交的临床试验通知 (CTN) 确认函 2023 年 11 月开始了 1 期人体临床试验(首次人体临床研究中为全人类抗胸腺细胞生物制剂)澳大利亚首批受试者给药 © 2024 SAB BIOTHERAPEUTICS, INC.
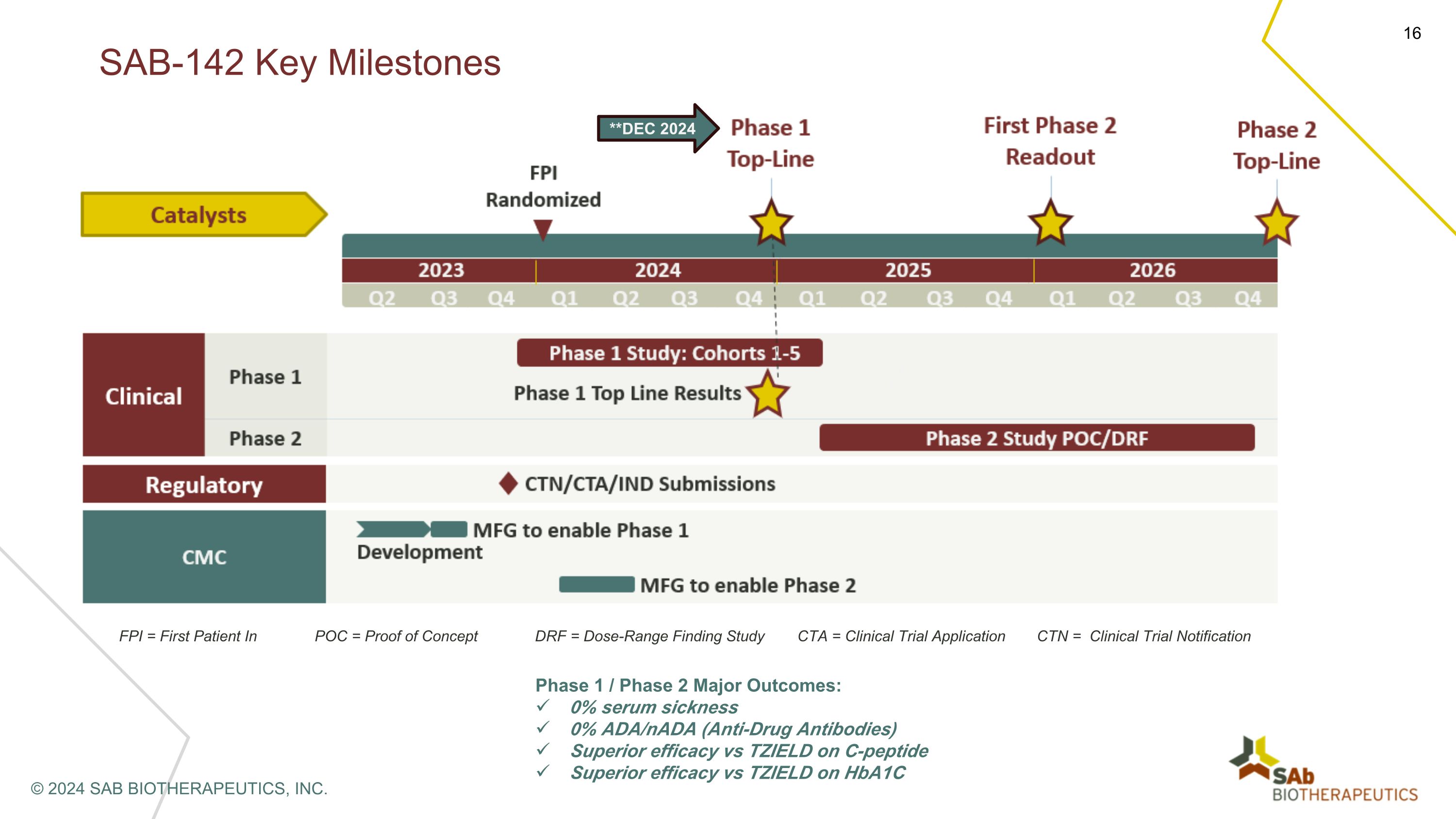
FPI = POC 中的第一位患者 = 概念验证 DRF = 剂量范围调查研究 CTA = 临床试验申请 CTN = 临床试验通知 1 期/第 2 期主要结果:0% 血清病 0% ADA/NADA(抗药抗体)与 TZIELD 相比 TZIELD 对于 Hba1c SAB-142 的卓越疗效关键里程碑 © 2024 SAB BIOTHERAPEUTICS, INC.**2024 年 12 月

承诺的 T1D 临床开发和投资者合作伙伴 17 个 T1D 承诺投资者合作伙伴:总收益高达 1.1 亿美元的融资,专门用于在 2026 年之前推进 SAB-142 的临床进展以及 Topline 第 2 阶段业绩:Sessa Capital BVF Partners RTW Investments Marshall Wace ATW JDRF T1D 基金 T1D 临床开发合作伙伴:SAB-142 临床开发计划与青少年发展研究基金会 (JDRF) 合作设计 © 2024 SAB 生物疗法公司
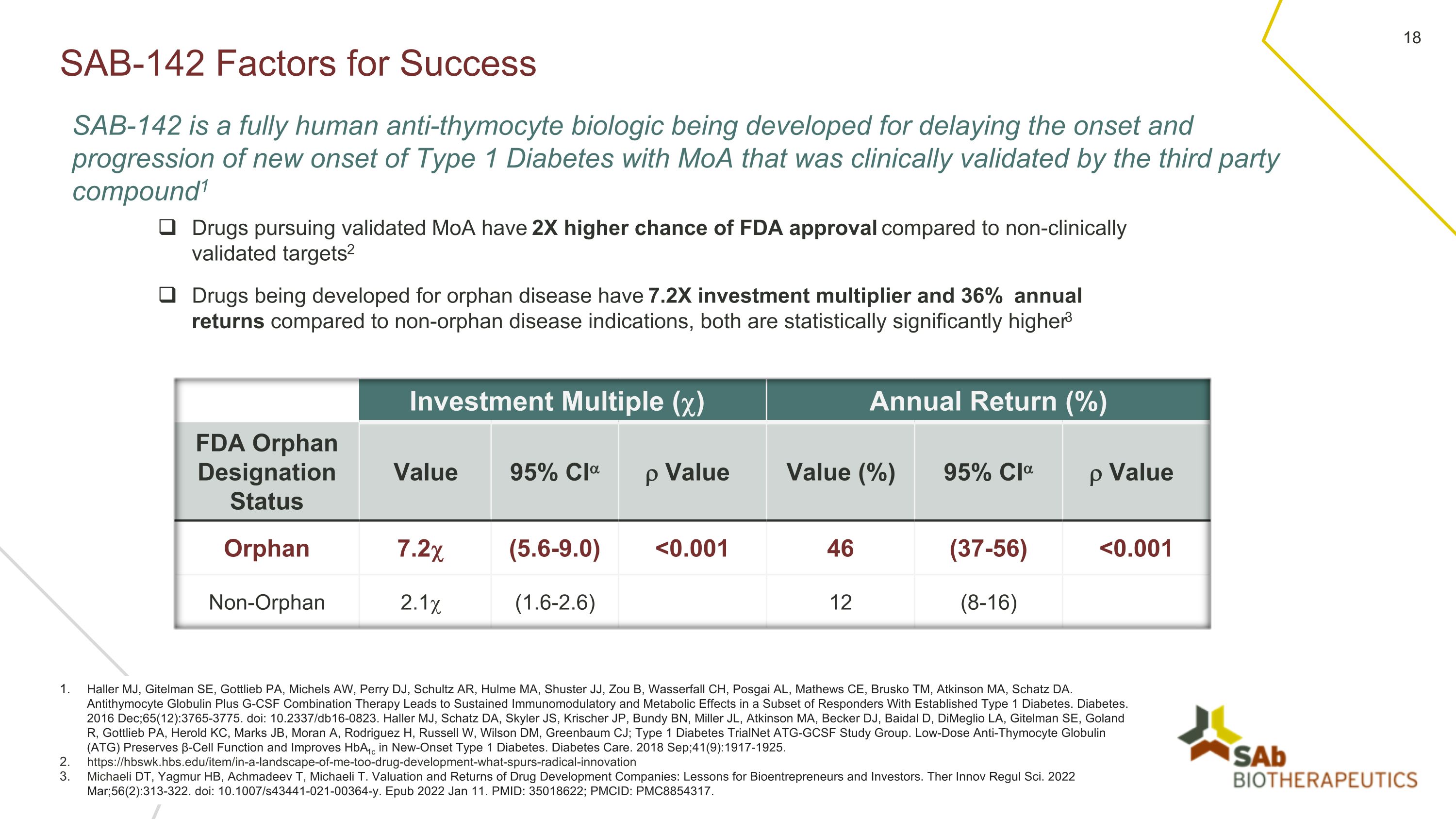
SAB-142 成功因素 Haller MJ、Gitelman SE、Gottlieb PA、Michels AW、Perry DJ、Schultz AR、Hulme MA、Shuster JJ、Zou B、Wasserfall CH、Posgai AL、Mathews CE、Brusko TM、马萨诸塞州阿特金森、沙茨 DA。抗胸腺细胞球蛋白加G-CSF联合疗法可对一部分已确诊的1型糖尿病应答者产生持续的免疫调节和代谢作用。糖尿病。2016 年 12 月;65 (12): 3765-3775. doi:10.2337/db16-0823。Haller MJ、Schatz DA、Skyler JS、Krischer JP、Bundy BN、Miller JL、Atkinson MA、Becker DJ、Baidal D、Dimeglio LA、Gitelman SE、Goland R、Gottlieb PA、Herold KC、Marks JB、Moran A、Rodriguez H、Russell W、Wilson DM、Greenbaum CJ;1 型糖尿病 TrialNet ATGG-Net CSF 研究小组。低剂量抗胸腺细胞球蛋白(ATG)可保留β细胞功能并改善新发的1型糖尿病的HbA1c。糖尿病护理。2018 年 9 月;41 (9): 1917-1925。https://hbswk.hbs.edu/item/in-a-landscape-of-me-too-drug-development-what-spurs-radical-innovation Michaeli DT、Yagmur HB、Achmadeev T、Michaeli T.《药物开发公司的估值和回报:生物企业家和投资者的教训》。Ther Innov Regul Sci.2022年3月;56 (2): 313-322. doi:10.1007/s43441-021-00364-y。Epub 2022 年 1 月 11 日。PMID:35018622;PMCID:PMC8854317。SAB-142 是一种全人源抗胸腺细胞生物制剂,正在开发用于延缓新发的 MoA 型 1 型糖尿病的发作和进展,已通过第三方化合物的临床验证。1 与未经临床验证的靶点相比,追求经验证的 MoA 药物获得 FDA 批准的几率高出 2 倍2 与非孤儿病适应症相比,投资倍数和年回报率均高达 36%,两者在统计学上均显著提高 er3 投资倍数 () 年回报率 (%) FDA 孤儿称号状态值 95% 置信区间值值 (%) 95% 置信区间值 Orphan 7.2 (5.6-9.0)

附录 © 2024 SAB BIOTHERAPEUTICS, INC.

IgG 多克隆抗体产品的行之有效的临床监管路径人类 IgG 多克隆抗体(Tc 牛源性产品)人源性多克隆抗体(人类源性免疫球蛋白产品)动物多克隆抗体(动物源性免疫球蛋白产品)肉毒中毒双价(马)A 型和 B 型 IgG1 多克隆抗体免疫疗法已通过 FDA 批准生物制剂评估与研究中心 (CBER) © 2024 SAB BIOTHERAPEUTICS, INC.
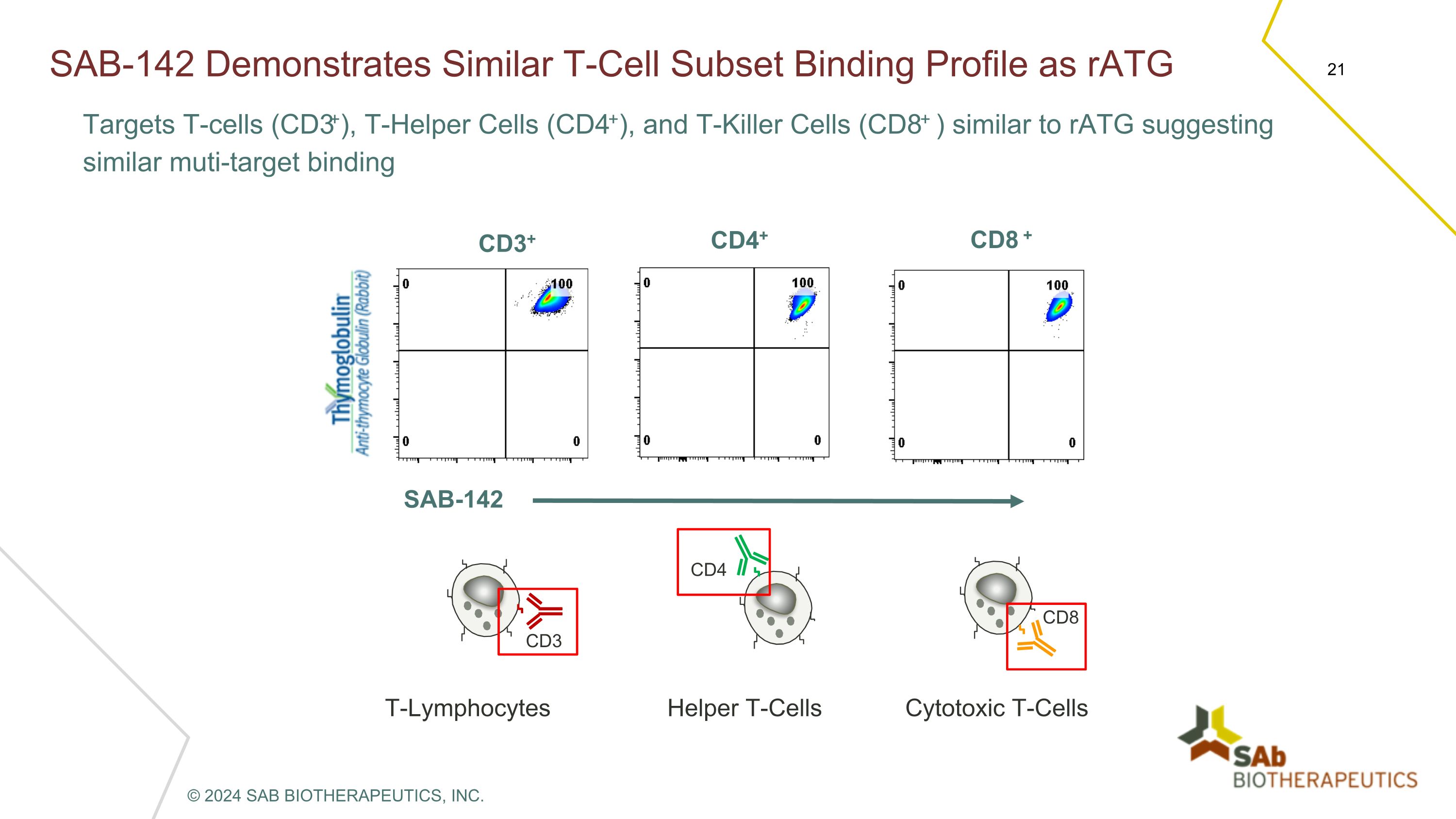
SAB-142 表现出与 raTG 靶向 T 细胞 (CD3+)、T 辅助细胞 (CD4+) 和 T 杀伤细胞 (CD8+) 相似的 T 细胞亚集结合特征,类似于 raTG,表明多靶结合 CD3+ CD4+ CD8 + SAB-142 T淋巴细胞 CD3 辅助性 T 细胞 CD4 细胞毒性 T 细胞 CD8 © 2024 SAB BIOTHERAPEUTICS, INC.
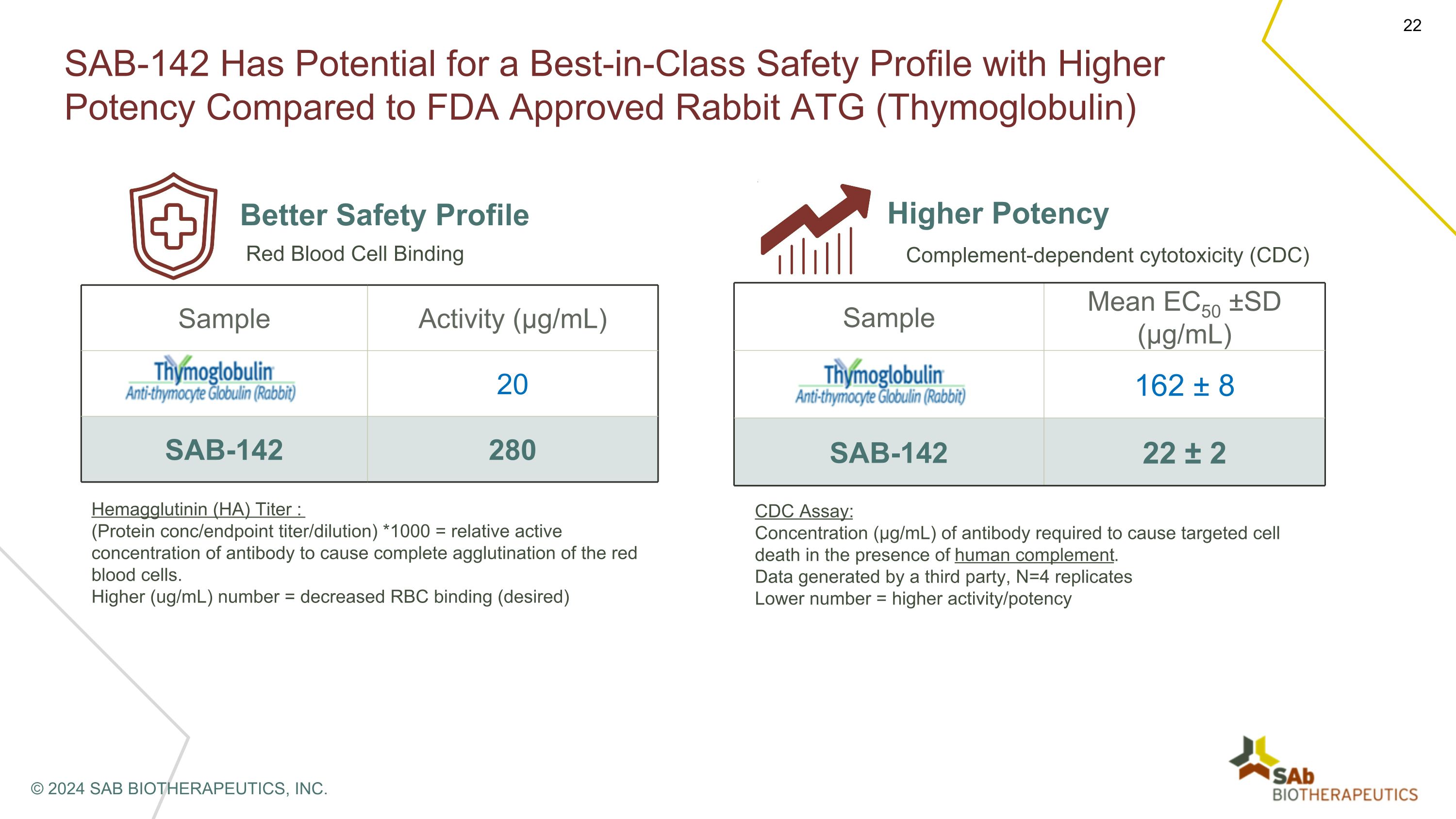
与美国食品药品管理局批准的兔子 ATG(胸腺球蛋白)相比,SAB-142 有可能获得同类最佳的安全特征和更高的效力。更好的安全概况样本活性(µg/mL)胸腺球蛋白® 20 SAB-142 280 红细胞结合血凝素(HA)滴度:(蛋白质浓度/终点滴度/稀释)*1000 = 导致红细胞完全凝集的抗体的相对活性浓度。(微克/毫升)数值越高 = 红细胞结合力降低(所需)更高效力的样本平均值 EC50 ±SD(µg/mL)胸腺球蛋白 162 ± 8 SAB-142 22 ± 2 补体依赖性细胞毒性(CDC)CDC 测定:在存在人类补体的情况下导致靶向细胞死亡所需的抗体浓度(µg/mL)。第三方生成的数据,N=4 重复较低的数字 = 更高的活性/效力 © 2024 SAB BIOTHERAPEUTICS, INC.
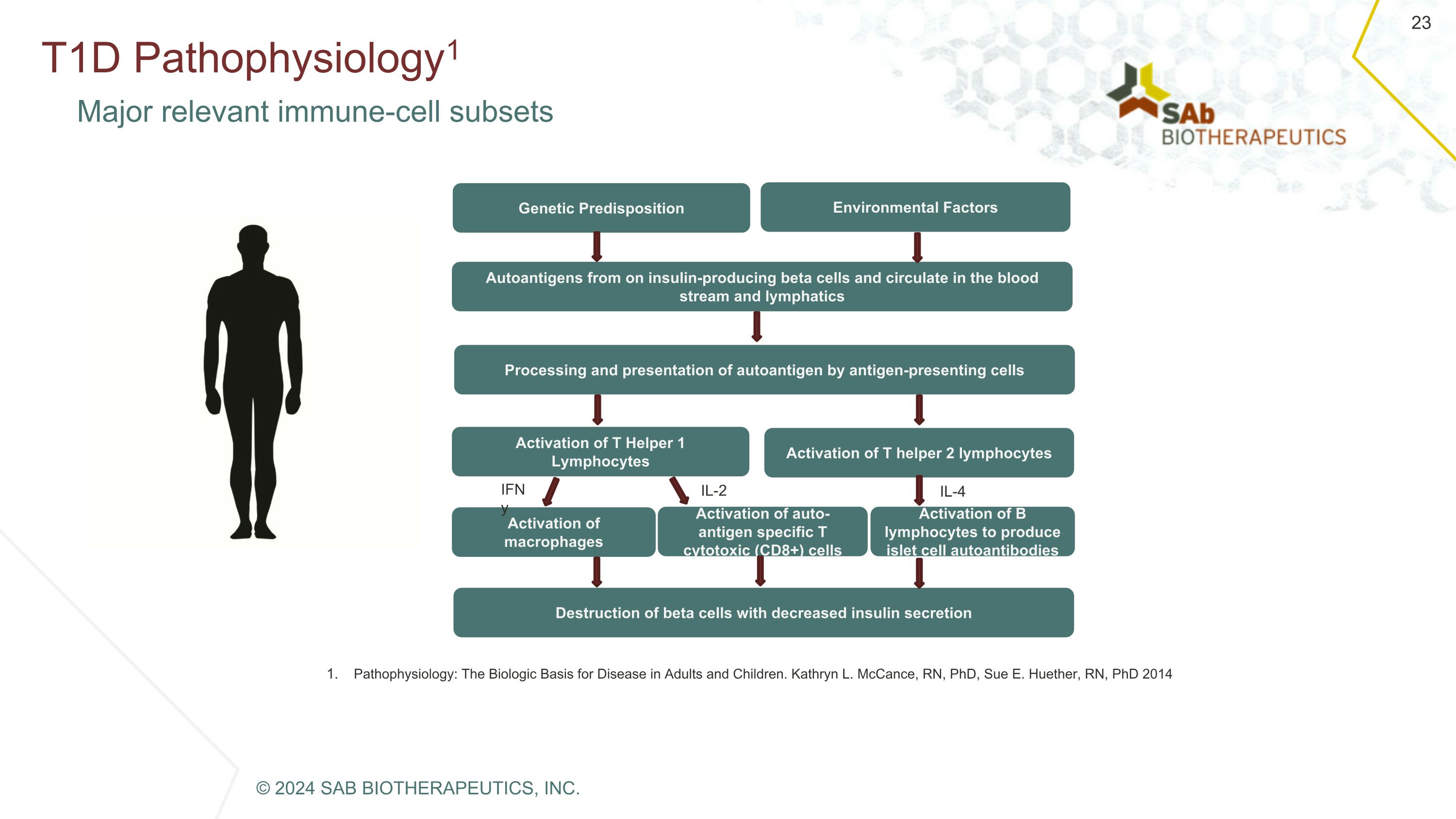
T1D Pathophysiology1 主要的相关免疫细胞亚群在胰岛素分泌减少的情况下破坏 β 细胞的自身抗原从产生胰岛素的 β 细胞中循环通过抗原呈递细胞处理和呈现自身抗原通过抗原呈递细胞激活 T Helper 1 淋巴细胞激活 T Helper 2 淋巴细胞激活巨噬细胞产生胰岛细胞自身抗体激活自身抗原特异性 T 细胞毒性 (CD8+) 细胞环境因素遗传易感性 iFNY IL-2 IL-4病理生理学:成人和儿童疾病的生物学基础。Kathryn L. McCance,注册护士,博士,Sue E. Huether,注册护士,博士 2014 © 2024 SAB BIOTHERAPEUTICS, INC.
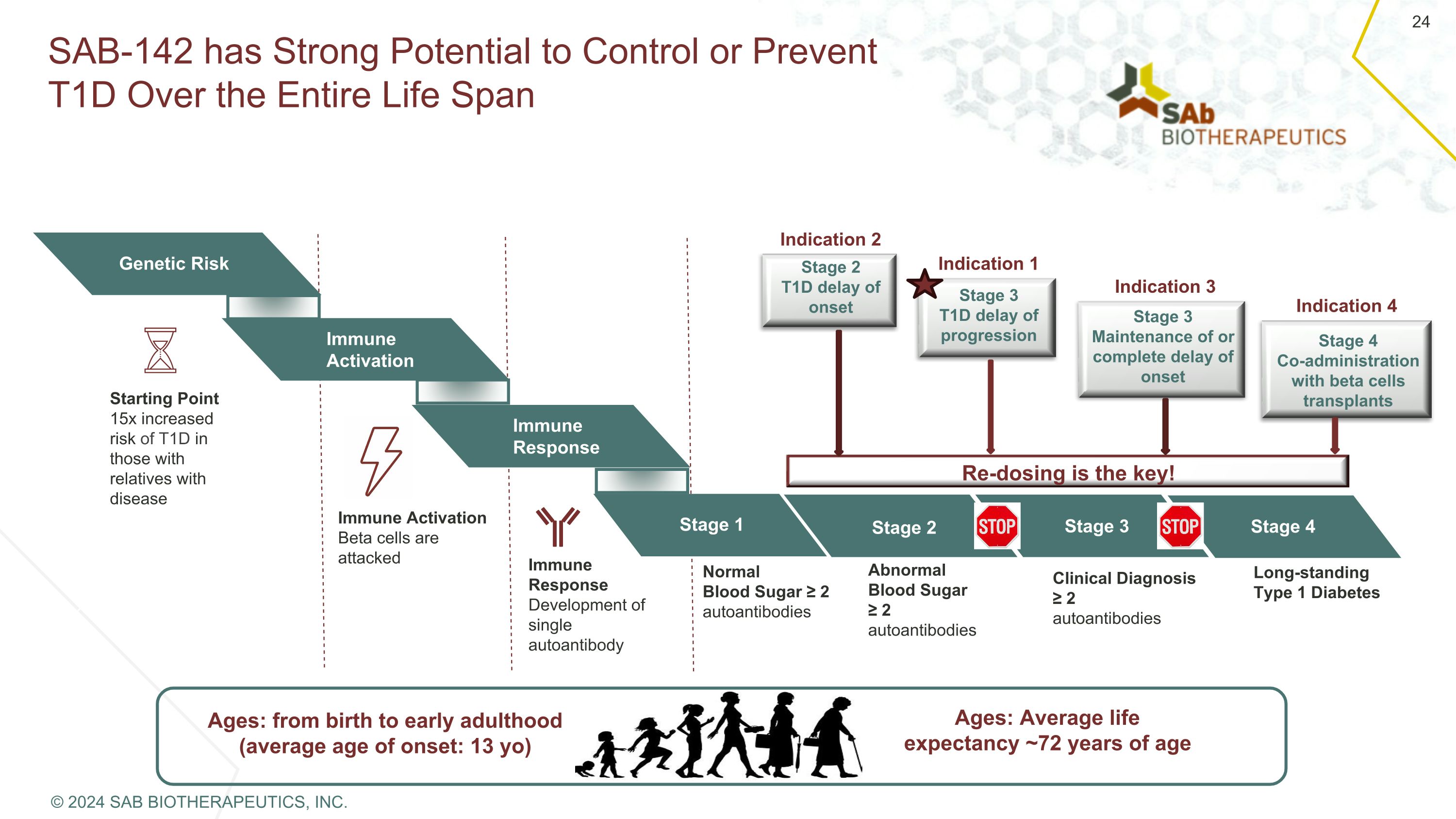
SAB-142 具有在整个生命周期中控制或预防 T1D 的强大潜力:从出生到成年早期(平均发病年龄:13 岁)年龄:平均预期寿命约 72 岁遗传风险免疫激活免疫反应第 1 阶段起点有疾病亲属的患者出现 T1D 的风险增加 15 倍免疫激活 β 细胞受到攻击免疫反应单一自身抗体的开发正常血糖 ≥ 2 自身抗体异常血糖 ≥ 2 自身抗体临床诊断 ≥ 2 种自身抗体长期存在的 1 型糖尿病第 2 阶段第 3 阶段第 4 阶段重新给药是关键!第 2 阶段 T1D 发病延迟第 3 阶段 T1D 进展延迟阶段 3 维持或完全延迟发作 4 期与 β 细胞移植联合给药适应症 2 适应症 1 适应症 3 适应症 4 © 2024 SAB BIOTHERAPEUTICS, INC.
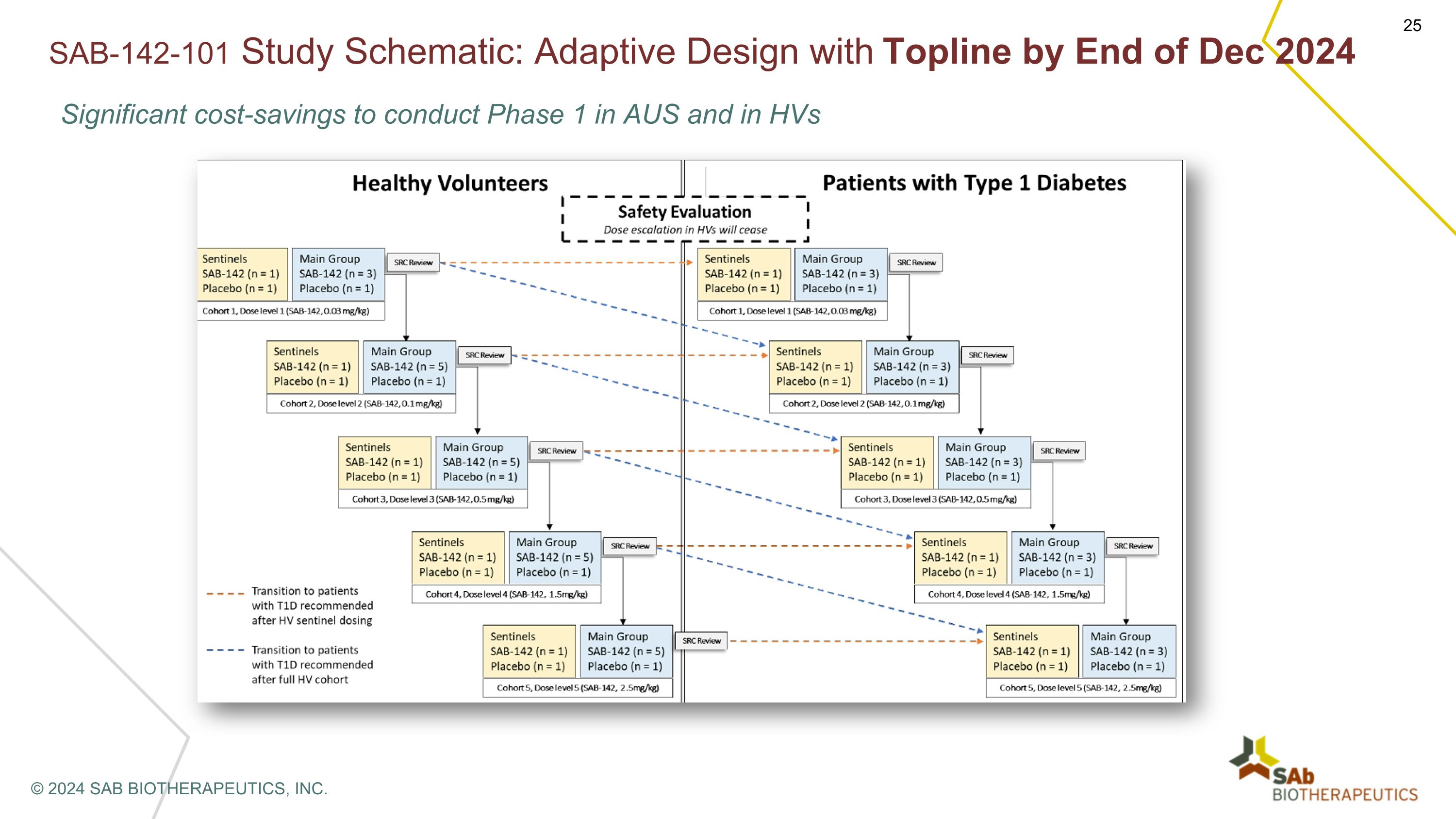
SAB-142-101 研究示意图:截至 2024 年 12 月底,在澳大利亚和混合动力汽车进行第一阶段可节省大量成本 © 2024 SAB BIOTHERAPEUTICS, INC.

SAB-142-201 SAFEGUARD 研究的关键设计包括 111 名 T1D 患者入组 SAB-142 高、SAB-142 低、安慰剂 1:1:1 入组 37 名患者/组 SAB-142 剂量:高剂量待定基于 1 期数据低剂量:待定基于 1 期数据注册开始 Q12025 注册期限:如果允许将青少年包括在内,则目标 12 个月国家:*澳大利亚/新西兰-提早开始 *英国提前开始欧盟美国/加拿大地点:30 多个密钥包括纳入/排除年龄:随机对前 15 名患者(10 名活跃患者)进行随机分组和治疗后,18-25 岁降至 12 岁潜在降至 12 岁年龄在 8 或 5 岁后,又有 15 名成人和青少年在第 1 天的最后 9 周内被诊断出患有 T1D(定义为第一剂胰岛素)C-肽大于 200pmol/L 一种或多种与糖尿病相关的自身抗体排除 2 型糖尿病具有临床意义的实验室全血细胞数、肾功能、肝功能。使用免疫抑制或免疫调节疗法先前或当前结核病筛查时或进入治疗时活性或慢性感染恶性肿瘤史使用其他非胰岛素产品控制血糖先前使用 ATG、abatacept 或抗 CD3 抗体治疗 A 2B 期、随机、双盲、安慰剂对照、剂量范围研究评估 SAB-142 延缓进展的疗效和安全性新发/最近发作的 3 期 T1D 患者中的 1 型糖尿病 DRF 与 POC 当前剂量范围测定 (DRF) 2B 期设计允许:两只活跃的手臂使POS升高人抗胸腺细胞免疫球蛋白 SAB-142 的安全性和有效性阻止 1 型糖尿病的进展 © 2024 SAB BIOTHERAPEUTICS, INC.

一项 2B 期、随机、双盲、安慰剂对照、剂量范围研究,评估 SAB-142 对延缓 1 型糖尿病在新发/最近发病的 3 期 T1D 患者中的疗效和安全性 SAB-142-201:2B 期研究 27 主要目标:评估单剂量 SAB-142 后第 12 个月受刺激 C 肽反应的变化次要目标:确定 SAB-142 对时间范围内的影响 (TIR) 确定 SAB-142 对 T1D Beta 分数(复合终点)的影响以确定SAB-142 在 3、6、9 和 12 个月时对 HbA1c 进行测定 SAB-142 在 3、6、9 个月时对刺激 C 肽的影响。确定 SAB-142 对胰岛素需求的影响确定 SAB-142 对 CD4+ T 细胞还原和保存 CD8+-T 细胞的影响评估与 SAB-142 相关的安全参数评估第 3 期 T1D 患者中 SAB-142 的 PK 和免疫原性探索目标:研究治疗对与 1 型糖尿病相关的 “应答者” 生物标志物的影响 © 2024 SAB BIOTHERAPEUTICS, INC.

摘要 28 SAB-142:首创的全人源多靶点抗体治疗旨在为延迟 1 型糖尿病的发作或进展提供卓越的安全性和有效性。T1D 中 SAB-142 的 MoA 已在众多临床试验中得到临床验证,兔子 ATG 安全数据库包含超过 700 名患者的人体数据 DIVERSITABTM 平台生产的 SAB 抗体支持即将进行的 T1D 研究中预期的零 (0) 个血清病和零 (0) 个 SAB-142 中和抗体建立了监管路径,SAB-142 资产为全人类多表位多靶点模式下一步:完成 2024 年底前首次进行人体 1 期 SAB-142-101 研究 © 2024 SAB BIOTHERAPEUTICS, INC.