

附录 99.1 公司概述 2024 年 1 月

前瞻性陈述本演示文稿包含涉及重大风险和不确定性的前瞻性 陈述。除本演示文稿中包含的历史事实陈述以外的所有陈述,包括有关ORIC Pharmicals, Inc.(“ORIC”、 “我们”、“我们” 或 “我们的”)未来财务状况、经营业绩、业务战略和计划以及未来运营管理目标的陈述,以及有关行业趋势的陈述,均为 前瞻性陈述。在某些情况下,您可以通过诸如 “预测”、“相信”、“继续”、“可能”、“估计”、“预期”、 “打算”、“可能”、“计划”、“可能”、“可能”、“可能”、“可能”、“应该”、“将” 或这些术语的否定词或其他类似表达方式来识别前瞻性陈述。本演示文稿中包含的前瞻性陈述还包括但不限于以下方面的陈述:我们的开发计划和时间表;我们的候选产品和项目的潜在优势;ORIC-114、 ORIC-944 和 ORIC-533 的临床试验和开发计划;报告临床试验数据的预期时间;我们的预期里程碑和临床更新;以及我们估计现有现金和投资足以为当前 提供资金的时期运营计划。我们的这些前瞻性陈述主要基于我们当前对未来事件和趋势的预期和预测,我们认为这些事件和趋势可能会影响我们的财务状况、经营业绩、业务战略和 财务需求。这些前瞻性陈述受许多风险、不确定性和假设的影响,其中包括:我们的临床前研究和临床试验的启动时间、进展和结果; 与发现、开发和商业化可安全有效用于人体并作为早期临床阶段公司运营的药物的过程相关的风险;COVID-19 疫情对我们运营的负面影响, 包括临床试验;当前或产品的未来临床试验候选药物与临床前、初始、中期、初步或预期结果不同;我们推进候选产品进入临床试验并成功完成 临床试验的能力;监管机构申请和批准的时间或可能性;我们开发和商业化候选产品计划的变化;我们对患有我们所针对疾病的患者人数的估计 以及可能参加临床试验的患者数量;我们的商业化候选产品(如果获得批准);我们的成功能力如果 获得批准,制造和供应我们的临床试验和商业用途候选产品;战略安排、许可和/或合作的潜在收益和成本;可能导致我们的许可或合作 协议终止的任何事件、变更或其他情况发生的风险;我们对支出、未来收入、资本要求和融资需求以及我们获得资本能力的估计;我们现有现金和投资的充足性为我们未来的运营提供资金支出和资本 支出要求;我们保留关键人员持续服务以及确定、雇用和留住更多合格专业人员的能力;我们对业务和产品 候选人的业务模式和战略计划的实施;我们能够为知识产权、候选产品和我们的产品线建立和维持的保护范围;我们与第三方合同研究机构、供应商和制造商签订合同的能力 及其充分表现的能力;候选产品的定价、承保范围和报销(如果获得批准);与竞争对手和行业相关的发展,包括竞争产品候选产品和疗法;总体经济和市场状况;以及我们在向美国证券交易委员会(“SEC”)提交和将要提交的公开文件中讨论的其他风险、不确定性和假设。这些风险并非穷尽无遗。新的风险 因素不时出现,我们的管理层无法预测所有风险因素,也无法评估所有因素对我们业务的影响,也无法评估任何因素或因素组合在多大程度上可能导致实际 结果与任何前瞻性陈述中包含或暗示的结果存在重大差异。您不应依赖前瞻性陈述作为对未来事件的预测。尽管我们认为 前瞻性陈述中反映的预期是合理的,但我们无法保证未来的业绩、活动水平、业绩或成就。本演示文稿还包含独立方和我们做出的与 市场规模相关的估计和其他统计数据以及有关我们行业的其他数据。这些数据涉及许多假设和局限性,提醒您不要过分重视此类数据和估计值。此外,对我们未来 业绩的预测、假设和估计以及我们经营的市场的未来表现必然受到高度的不确定性和风险的影响。除非法律要求,否则在本演示文稿发布之日之后,我们没有义务出于任何 原因更新本演示文稿中的任何陈述。我们已经向美国证券交易委员会提交了表格8-K的当前报告,10-Q表的季度报告,10-K表的年度报告以及其他文件。您应该阅读这些文档,了解有关 我们的更完整信息。你可以访问美国证券交易委员会网站www.sec.gov上的EDGAR,免费获得这些文件。本演示文稿讨论了我们正在进行临床前或临床研究但尚未获得 美国食品药品监督管理局批准上市的候选产品。对于我们正在研究的治疗用途候选产品的安全性或有效性,没有作出任何陈述。2

ORIC 制药:致力于克服癌症耐药性 • 两个潜在的同类最佳项目推进关键研究的潜在首创和同类最佳项目渠道广泛 • 其他针对新颖和经过验证的靶标的临床前项目精准肿瘤学 专业知识支持 • 由生物标志物驱动的、由患者选择的临床加速时间表试验和转化专业知识推动了快速进度 • 通过内部研发和业务 双引擎开发建立管道的往绩记录管道扩张 • 目标是每 18 个月推出一款新的 IND 候选药物 • 经验丰富的管理团队 Ignyta、Medivation、Aragon 和 Genentech 有发现和开发多种获批肿瘤药物的传承 (1) 强劲的财务状况 • 2.35 亿美元的现金和投资预计将为 2026 年公司提供资金 • ORIC-944 启动与 AR 抑制剂的联合研究:2024 年上半年 • ORIC-944 项目更新:2024 年中期预期里程碑 • ORIC-114 启动多个剂量扩展群组:2024 年上半年 • ORIC-114 已更新第 1b 阶段数据:2025 年上半年 (1)截至 2023 年 12 月 31 日的大致未经审计余额。3

具有打造领先肿瘤学公司专业知识的高管团队 • 曾任Ignyta(被罗氏收购)的首席财务官,筹集了超过5亿美元的资本,总经理雅各布·查科 • TPG Capital(完成了100亿美元的总收购)和麦肯锡 • 4D Molecular Therapeutics董事会成员兼Bright Peak Therapeutics董事会主席;曾任Turning Point、Bonti、RentPath、EnvisionRX,Par Pharma、IMS和Quintiles • 曾任基因泰克转化肿瘤学主管;向Lori Friedman推荐了20多种候选药物,博士学位开发,迄今已获得两项批准首席科学官 • Exelixis信号转导总监;领导了与BMS的新靶标发现合作 • 发明者发布了28项专利,撰写了99份经过同行评审的 出版物 • NextrNA Therapeutics董事会成员 • 曾任Ignyta首席营销官,领导恩特替尼的开发和监管,医学博士首席医学官 • Fate Therapeutics首席营销官做出了贡献;在 Idec 开发 Rituxan 和 Zevalin,在 Salmedix 开发 Treanda;早些时候在 Dana Farber 和 MGH 开发 • Erasca 和 Chimerix 的董事会成员 •曾任Prothena业务发展高级副总裁,与Celgene建立了高达22亿美元的合作关系 Matt Panuwat首席商务官 • Medivation(被辉瑞收购)的业务开发主管,领导的并购包括收购塔拉佐帕里布 • 美林证券全球医疗投资银行 • 曾任AnaptysBio首席财务官,筹集了超过5亿美元的资本(首次公开募股和后续融资)) Dominic Piscitelli 首席财务官 • Medivation 财务、战略和投资者关系副总裁 • OSI Pharmicals 财务和财务副总裁(被安斯泰来收购)) • Celyad Oncology董事会成员 • 曾任Synthorx总法律顾问(被赛诺菲收购),完成了1.51亿美元的首次公开募股,总法律顾问克里斯蒂安·库伦 • Ignyta和Genoptix(被诺华收购)的总法律顾问 执行了多项融资和并购 • 库利律师事务所律师 Edna Chow Maneval 博士 • 曾任Ignyta高级副总裁;临床负责人恩特雷替尼领导过渡团队完成全球申请临床开发高级副总裁 • Seragon 和 Aragon 临床开发副总裁,阿帕鲁他胺临床负责人 • 领导RCC的关键性3期研究辉瑞4的Sutent

临床产品线侧重于推进 ORIC-114 和 ORIC-944 铅 先导项目适应症鉴定优化 IND 启用 1 期 2 期 3 期关键差异化候选产品 NSCLC、乳腺和 ✓ CNS 活性 ORIC-114 1b 期:ORIC-114 单一药物肿瘤无关型 ✓ 耐受性良好 EGFR/HER2 外显子 20 抑制剂 ✓ 潜在同类最佳 ORIC-944 1b 期:ORIC-944 单药前列腺癌药物特性 PRC2 抑制剂已退出许可候选药物 ✓ 单剂活性 ORIC-533 第 1b 阶段:ORIC-533 组合 就绪 ✓ 清洁安全概况多发性骨髓瘤 CD73 抑制剂 ✓ 免疫激活探索研究项目 ORIC-613 乳腺癌 ✓ 同类首创潜在的 PLK4 抑制剂实体瘤多种靶向耐药性的项目 机制实体瘤 5

2023 年取得实质性进展:完全有能力在 2024 年和 2023 年之后创造价值 成就和下一步行动 ✓ 在 ESMO 2023 上公布的 1b 期剂量递增数据显示了潜在的同类最佳概况,ORIC-114 具有良好的安全性,且经过大量预处理的 NSCLC 患者具有全身和中枢神经系统活性 EGFR/HER2 外显子 20 抑制剂 ✓ 在 2024 年上半年启动多剂量扩张队列 ✓ 1b 期剂量递增数据显示出潜在的最佳剂量递增队列同类药物特性和良好的 ORIC-944 安全性,支持 向组合的发展前列腺癌的开发 PRC2 抑制剂 ✓ 于 2024 年上半年启动与 AR 抑制剂的联合开发 ✓ 在 ASH 2023 上公布的 1b 期剂量递增数据显示,经过大量预治疗的多发性骨髓瘤患者具有良好的安全性和临床 ORIC-533 活性 CD73 抑制剂 ✓ 寻求联合研究的战略伙伴关系 ✓ 提供的临床前数据证实了高选择性 PLK4 抑制剂作为合成致死性的 TRIM37 扩增乳腺癌研究的治疗潜力 ✓ ORIC-613,一本小说,非常好选择性 PLK4 抑制剂,通过 IND 赋能研究 ✓ 通过医疗保健专业基金的 8,500 万美元融资 加强资产负债表 Corporate ✓ 将现金流延至 2026 年 ORIC-114 和 944,这两个项目的潜在注册研究预计将于 2025 年启动 6

ORIC-114 脑穿透剂 EGFR/HER2 外显子 20 抑制剂

ORIC-114 是包含 表皮生长因子和 HER2 外显子 20 插入突变的肿瘤患者的前景候选药物,包括脑转移患者 ORIC-114 目标产品简介 • 选择性靶向 EGFR 和 HER2,对外显子 20 插入突变具有高效力 • 激素组选择性极好 ,潜在的选择性和脱靶活性 800 600 • 多外显子 20 400 插入模型中肿瘤明显消退 200 有望的 1b 期结果 0 0 5 10 15 20 25 天后 • 体内优异的 治疗指数与竞争对手分子相比,其疗效和耐受性更高 ✓ 耐受性良好的体内功效 ✓ 阿米凡坦单抗后的全身活性 ✓ 中枢神经系统活性 • 体内非结合性(游离) 脑部暴露量高 • 颅内功效研究中肿瘤大幅倒退高度脑穿透剂 ORIC-114 可能是同类中最好的 EGFR 和 HER2 外显子 20 抑制剂,具有出色的选择性和脑穿透力 8 3 平均值 肿瘤体积 (mm)

ORIC-114 专为选择性靶向 EGFR 和 HER2 而设计,对外显子 20 插入突变具有高 效力的激素基因组选择性比较 CLN-081 Furmonertinib BLU-451* Mobocertinib ORIC-114 脱靶野型 (WT) 激酶在 1mm 时被抑制 80-100% ORIC-114 CLN-081 弗莫那替尼 BLU-451 Mobocertinib 0 7 4 7* 7 ORIC-114 表现出精湛的表皮生长因子 (WT) clean kinome panel,这对共价抑制剂尤其重要来源:Junttila 等人ESMO 海报 (2023) 和 Murray 等人AACR 海报(2022 年)。注意:ORIC-114、 mobocertinib、CLN-081,数据在 468 个激酶中以 1μM 的频率进行头对头传输。显示了前 10%。*BLU-451 数据未在 1µM 的 409 个激酶中正面传输。9

ORIC-114 在 EGFR 外显子 20 插入 模型中表现出强大的体内活性 — NSCLC 表皮生长因子 20 插入模型 EGFR Exon 20 inSNPH EGFR Exon 20 inSASV EGFR Exon 20 inSSV EGFR Exon 20 insG 3000 800 800 车载车辆 ORIC-114 (4 mg/kg QD) ORIC-114 (4 mg/kg QD) 600 600 400 1000 200 112% TD 127% TGI 110% TGI 0 0 0 0 5 10 15 20 25 0 5 10 15 20 25 0 5 10 15 20 25 0 5 10 20 治疗后几天治疗几天后治疗几天后 25 天 ORIC-114 在多个 NSCLC 表皮生长因子 20 插入中表现出强效的肿瘤消退 ORIC-114体重没有明显减轻的模型来源:Junttila等人。AACR 海报 (2021)。10 3 平均肿瘤体积 (mm) 3 平均肿瘤体积 (mm) 3 平均肿瘤体积 (mm) 3 平均肿瘤体积 (mm)

缺乏中枢神经系统活性的药物在 NSCLC 无中枢神经系统活性的非小细胞肺癌靶向治疗的案例研究:莫博切替尼 • 在莫博切替尼的1/2期试验中,约35%的患者在基线时出现中枢神经系统转移的患者基线时没有8.1例中枢神经系统转移的患者 • 基线时中枢神经系统 转移患者的预后明显差——Brain是第一个部位基线时有 68% 的中枢神经系统转移患者和 38% 的基线时中枢神经系统转移患者中有 3.7% 的进展——在 的中枢神经系统转移患者中,ORR 为 25%基线对比所有患者的基线比例为 43% 0.0 2.0 4.0 6.0 8.0 10.0 中位数无进展存活率(月)大约 35% 的表皮生长因子 20 非小细胞肺癌患者在基线时出现中枢神经系统转移,大脑是基线有或没有中枢神经系统转移的患者的常见进展部位,因此使用缺乏中枢神经系统活性的疗法可缩短PFS来源:Janne等人ASCO 演讲(2019 年)和 Ramalingam 等人ASCO 海报 (2021). 11

ORIC-114 卓越的大脑穿透力与比较器不同 Exon 20 靶向药物 ORIC-114 特性允许 ORIC-114 对小鼠大脑暴露表现出较高的游离(非绑定)优化比例 • 最低的泵吸量 10 ─ 限制大脑穿透的关键泵,PGP 和 BCRP 药物转运蛋白,在细胞分析中对 1 ORIC-114 的影响微乎其微 • 合适的物理化学特性 0.1 ─ logP、logD、TPSA、MW,HBD/HBA,pKa • 脑组织中游离未结合暴露量高 0.01 ─ 小鼠 Kp,uu 0.5 ─ Dog Kp,uu 1.5 * 0.001 ORIC-114Mobocertinib CLN-081 BDTX-189 Osimertinib 广泛的临床前分析显示 ORIC-114 与竞争对手相比具有优异的中枢神经系统特性;正如 Kp、uu 所展示的 所示 ORIC-114 的跨物种大脑自由暴露量极佳。来源:Junttila 等人AACR Poster (2021),Junttila 等人。AACR-NCI-EORTC 演示文稿(2021 年)和存档的 ORIC 数据。* 大脑暴露量低于量化极限。12 自由大脑/血浆比率(@ 4 小时)

ORIC-114 首次人体 1b 期研究 1b 期,多中心, 开放标签研究剂量扩大(第二部分)加速批准剂量提升(第一部分)所有患者 +/-中枢神经系统与队列(Ph 2)EGFR ex20 NSCLC +/-CNS 关键资格 EGFR ex20 治疗尚不熟悉 • 晚期实体瘤 RP2D 1 表皮生长因子外显子 20 EGFR ex20 NS20 CLC +/-中枢神经系统 ORIC-114 ─ HER2 外显子 20 后阿米凡坦单抗 • 单剂 ─ HER2+ • i3+3 设计 ─ 表皮生长因子非典型表皮生长因子非典型突变 NSCLC +/-CNS • 活性中枢神经系统 • 口服 QD/BID 每日剂量 RP2D 2 候选转移 rp2D • 先前的表皮生长因子外显子20 个选定的 HER2 ex20 非小细胞肺癌 +/-中枢神经系统治疗允许主要终点:第一部分:安全性和候选 RP2D;第二部分:剂量扩大(RP2D 选择)和 ORR(根据 RECIST v1.1)关键 次要终点:第一部分:PK;第二部分:安全;DOR、CBR 和 PFS,包括颅内 ORR/PFS 初始安全性、PK/PD 和来自的初步抗肿瘤数据在 2023 年 ESMO 上发布的剂量递增(第一部分)注意:ClinicalTrials.gov 标识符: NCT05315700。剂量扩大可能包括 QD 和 BID 剂量、补给/快速剂量。RP2D = 推荐的第 2 期剂量 13 筛查/入组

ORIC-114 1 期患者性格和基线特征 患者性格和基线特征 EGFR Ex20 EX20 HER2+ 总计 (n=21) (n=24) (n=5) (N=50) 63 (31,80) 63 (25,86) 63 (48,68) 63 (48,68) 63 (25,86) 63 (25,86) 年龄、年龄、中位数(范围)• 50 名患者接受了 10 (48) 11 (46) 3 的治疗 (60) 24 (48) 女性,n (%) 增加 ORIC-114 心电图表现分数的剂量,n (%) • 在 1 (5) 10 (42) 3 (60) 14 (28) 0 EGFR 外显子 20 20 (95) 14 (95) 14 (95) 14 (58) 2 (40) 36 (72) 1 12 (57) 16 (68) 3 (60) 31 (62) 非吸烟者的非小细胞肺癌患者中, n (%) ─ ≥1 之前的表皮生长因子 ex20:81%2 (1,6) 2 (0,7) 4 (1,7) 2 (0,7) 先前的疗法,中位数(最小,最大)─ ≥2 先前的表皮生长因子 ex20:19% 先前的疗法,n(%)21(100)23(96)5(100)49(98)化疗 ─ 中枢神经系统在基线时会合:86% 18 (86) 1 (4) — 19 (38) EGFR 靶向药物 • Of 使用表皮生长因子 20 外显子 20 靶向药物的非小细胞肺癌患者 17 (81) — — 17 (34) HER2 外显子 20 15 (71) — — 15 (30) Amivantamab Mobocertinib 4 (19) — — 4 (8) ≥1 先前 HER2 药物:30% 其他(CLN-081、BLU-451)2 (10) — — 2 (4) 中枢神经系统在基线时会合:38%% HER2 靶向药物 — 7 (30) 3 (60) 10 (20) 18 (86) 9 (38) 1 (20) 28 (56)) 基线时出现中枢神经系统转移,n (%) 期 1b 招收了大量预先治疗的患者,先前的 exon 20 靶向治疗和基线时中枢神经系统转移的发生率都异常高。注:截至2023年9月26日数据截止日期的所有数据。14

尽管有更多的 名患者接受了大量预先治疗,而且在 ≥ 10% 的患者中发生的先前治疗和中枢神经系统疾病治疗相关不良事件的入组标准不那么严格,ORIC-114 的耐受性总体良好

表皮生长因子外显子 20:在所有活性 ORIC-114 剂量中观察到肿瘤回归初步活性(非小细胞肺癌患者,表皮生长因子外显子 20 且在 ≥ 45 mg TDD 下治疗)60 40 20 0 -20 uPR 90 mg 90 mg -60 75 mg 60 mg -80 45 mg -100 CR Prior EGFR +--+ + + + + +-+ + 外显子 20 疗法 CNS 转移瘤酶 + + + + + +-+-+ + + + + + 在基线最佳中枢神经系统 ND PD SD/PR PD ― SD/PR PD ― SD/PR SD/PR SD/PR SD/PR SD/PR SD/PR CR 反应 3 个中枢神经系统病变中的 4 个病变消退了在重度 预治疗患者中观察到的全身性和中枢神经系统活性消退,包括之前的表皮生长因子20外显子治疗和活性脑转移注意:所有数据截至2023年9月26日数据截止日期。ND:未完成,SD/PR:非 CR/Non-PD(RECIST 1.1),反应可评估:剂量水平 ≥45 mg TDD 和 至少进行一次基线后肿瘤评估。靶损与基线相比的最佳变化百分比

经证实 表皮生长因子 20 突变非小细胞肺癌和活性中枢神经系统转移的患者在先前的表皮生长因子 20 外显子靶向治疗中出现完全的颅内和全身反应 • 患者:55F 伴有表皮生长因子 20 突变非小细胞肺癌 • 先前治疗:培美曲塞/顺铂和阿米万坦单抗 • 基线转移瘤 :四种活性中枢神经系统非靶向病症 ─ 以前未接受过治疗 ─ 之前未进行过手术 ─ 事先没有接受过辐射基线 2 周期结束:完全反应 • ORIC-114 剂量:75 mg QD • 全身反应:第 1 周期后的部分反应 (所有靶点和非靶点减少 60%)目标病变),然后在第 2 周期结束时出现完全缓解(所有靶病变和非靶损减少 100%),随后得到证实 • 中枢神经系统反应:第 2 周期 1(所有 4 个中枢神经系统病变减少 100%)确认后完全缓解 • 治疗相关不良事件:2 级粘膜炎和甲沟炎 • 治疗持续时间:第 9 周期(持续)基线(显示了 4 个病变中的 1 个)) 第 1 周期结束: 完全响应 ORIC-114 在关键癌症和分子亚型(即 NSCLC 和 EGFR 外显子 20)中显示出单一药物临床活性患者通常被排除在临床试验(即活动性脑转移)之外,之前曾接受过表皮生长因子 20 外显子疗法治疗 注意:截至2023年9月26日数据截止日期的所有数据。17

ORIC-114 是唯一表现出系统性 完全反应和中枢神经系统完全反应的表皮生长因子 20 外显子抑制剂,尽管患者比较选定的资格标准、基线特征和临床活性更具挑战性 • 表皮生长因子 20 外显子抑制剂临床 Amivantamab CLN-081 Sunvozertinib furmonertinib BLU-451 ORIC-114 研究通常不包括:试验 1 期 1 期 1 期 1 期 1 期第 1 阶段 exon 20 治疗入组 (1) ─ 未经治疗的中枢神经系统转移先前的表皮生长因子 ex20i 允许否否否是 • ORIC-114 试验入组率显著提高了先前的表皮生长因子 ex20i 1% 4% 3% NR 75% 未经治疗的中枢神经系统允许的患者比例高出 71% 否否是之前的表皮生长因子 20 外显子治疗和基线中枢神经系统转移% 基线中枢神经系统转移 22% 38% 32% 34% 586% • 尽管患者更具挑战性,但 ORIC-114 的临床活动表明:全身完全反应是不是不是 ─ 全身完全反应中枢神经系统完成否否否否否不是 (2) 未经治疗的中枢神经系统 Mets ─ 未经治疗的中枢神经系统转移中枢神经系统完全反应 ORR 表皮生长因子 ex20i 天真 ~ 40% ~ 41% ~ 61% 42% 待定待定 33% 已确认 ─ 阿米凡坦单抗后反应后的反应 NA 否是不是 ORR(75 mg)即使允许患者先前接受过 外显子 20 治疗且脑转移未经治疗,ORIC-114 是唯一表现出已确认的完全全身反应和完全中枢神经系统反应的 EGFR 外显子 20 抑制剂。注:所有数据截止于 2023 年 9 月 26 日。资料来源:朴等人。J Clin Oncol (2021)、Zhou 等人。JAMA Oncology (2021),Piotrowska 等人。J Clin Oncol(2023),Han 等人。WCLC 演讲 (2023),Wang 等人ASCO 演示文稿(2023 年),以及 Nguyen 等人ASCO 海报 (2023)。(1) Amivantamab 禁止先前进行表皮生长因子 20 外显子治疗,以扩大剂量。CLN-081 仅允许在加速滴定剂量递增期间选择性地进行先前的 EGFR 外显子 20 治疗。(2) 未透露 BLU-451 脑转移的治疗史。 18

HER2 外显子 20:在所有活性 ORIC-114 剂量中观察到肿瘤回归初步活性(非小细胞肺癌患者 HER2 外显子 20 且在 ≥ 45 mg TDD 下接受治疗)60 40 20 0 -20 uPR uPR 每日总剂量 -40 PR 90 mg -60 pr 75 mg 60 mg -80 45 mg -100 PR PR Prior HER2-+----+---+--治疗 CNS 转移瘤 +--br} +----+--+-在基线最佳中枢神经系统 SD/PR ― ― ND ― ― ― ― ― SD/PR SD/PR ― ― ― 中枢神经系统病变的反应收缩 ORIC-114 在 HER2 外显子 20 NSCLC 患者中表现出临床活性, 包括基线脑转移患者注意:全部截至 2023 年 9 月 26 日数据截止的数据。ND:未完成,SD/PR:非 CR/Non-PD(RECIST 1.1),反应可评估:剂量水平 ≥45 mg TDD 和至少一次基线后肿瘤 评估。靶损与基线相比变化百分比最佳 19
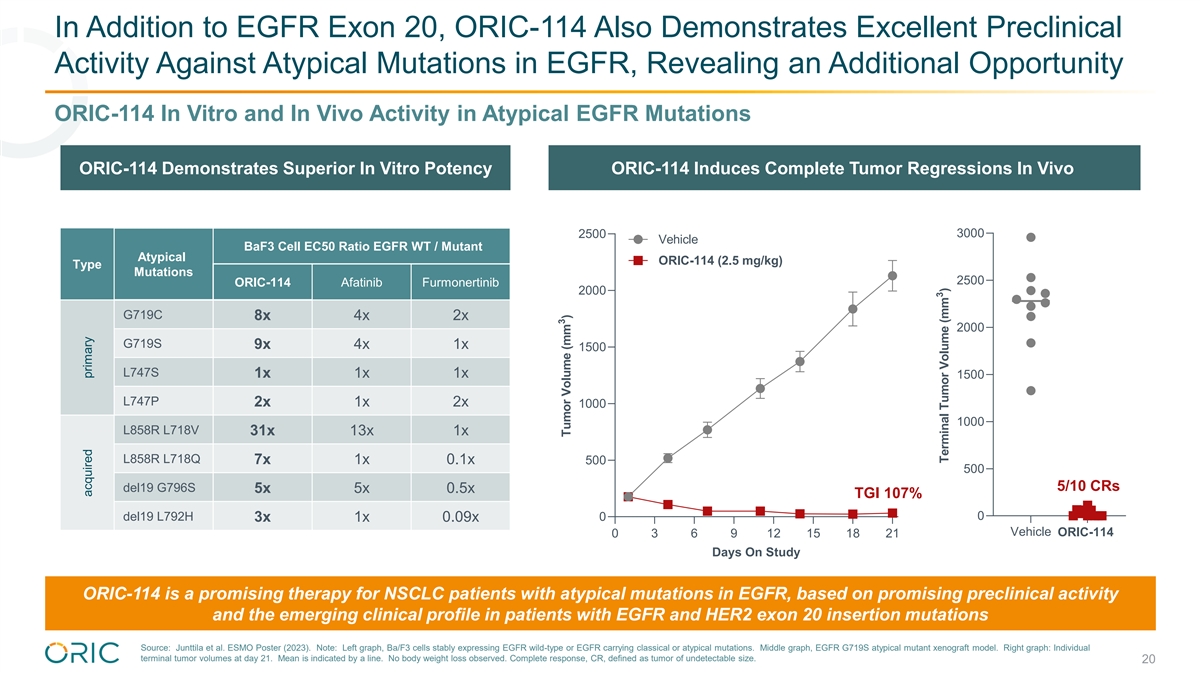
除表皮生长因子外显子 20 外,ORIC-114 还对表皮生长因子中的非典型突变表现出卓越的 临床前活性,揭示了另一个机会 ORIC-114 在非典型 EGFR 突变中的体外和体内活性 ORIC-114 表现出卓越的体外效力 ORIC-114 在体内诱导完全肿瘤 回归 3000 2500 载体 baF3 细胞 EC50 比率 EGFR WT/突变体非典型 (ORIC-114 2.5 mg/kg) 类型突变 2500 ORIC-114 Afatinib Furmonertinib 2000 G719C 8x 4x 2x 2x 2000 G719S 9x 4x 1x 1500 L747S 1x 1x 1500 1x 1x 1x 1500 L747P 2x 1x 2x 2x 1000 1000 L858R L718V31x 13x 1x L858R L718Q 7x 1x 0.1x 500 500 5/10 CR del19 G796S 5x 5x 0.5x TGI 107% 0 del19 L792H 0 3x 1x 0.09x 载体 ORIC-114 0 3 6 9 12 15 18 21 天研究中 ORIC-114 是表皮生长因子非典型突变 患者的前景看好的疗法,表皮生长因子和表皮生长因子患者新出现的临床特征 HER2 外显子 20 插入突变来源:Junttila 等人。ESMO 海报 (2023)。注意:左图,Ba/F3 细胞稳定地表达 EGFR 野生型 或 EGFR,携带经典或非典型突变。中间图,表皮生长因子 G719S 非典型突变体异种移植模型。右图:第 21 天的个体末期肿瘤体积。均值由一条线表示。未观察到体重减轻。完全反应,CR, 定义为大小无法检测的肿瘤。20 获得性原发性 3 肿瘤体积 (mm) 3 末期肿瘤体积 (mm)

ORIC-114 计划采取的后续步骤和潜在的注册路径 2024 2025-2026 2027 ❑ 表皮生长因子 20 外显子抑制剂-naieve 1b 期剂量 ❑ 表皮生长因子非典型突变扩展 ❑ HER2 外显子 20 EGFR 外显子 20,对之前的外显子 20 表皮生长因子 20 外显子 20 很幼稚,2027 年阿米万坦单抗多潜在第 2 期保密协议申请加速批准 NSCLC 表皮生长因子非典型突变获得批准 HER2 exon 20 预计将于 2025 年上半年更新 1b 期数据;2025 年可能启动多个加速注册队列 21

ORIC-114 正在寻求在未获批准中枢神经系统活性药物或处于后期开发阶段的 多个患者群体中寻找重大的商业机会。据估计,美国外显子 20 插入患病率(占非小细胞肺癌的百分比)10 14.0% .0% ORIC-114 目标人群:12.5% 6.5% NSCLC 18 2.. 0 0% 2.9% 6.0% 4.0% 4.0% 4.0% 4.0% 4.0% 2.0% 2.0% 1.5% EGFR 外显子 20 HER2 Exon 20 非典型表皮生长因子 RET ALK 表皮生长因子批准的含有普拉西替尼/Selpercatinib Osimertinib 中枢神经系统活性的药物:全球年化 ─ ─ 3.25 亿美元(同比增长 54%)17亿美元(同比增长 1%) 6亿美元(同比增长 7%)23 年第二季度预计销售额:ORIC-114 的商业机会可能占美国每年 NSCLC(>12,500 名患者)的 6.5% 来源:美国癌症协会癌症事实与数据 2023,Gainor 等人。临床癌症研究 (2013),Hirsch 等人。《柳叶刀》(2017),罗森等人。《临床癌症研究》(2021),Heymach 等人。WCLC 演示文稿(2018 年)和 Robichaux 等人。自然 (2021)。阿斯利康、罗氏和礼来公司申报。注意:全球按年计算的 23 年第 2 季度预计销售额 使用 23 年第二季度报告的销售额计算并根据年运行率进行调整。美国 NSCLC 的估计百分比

ORIC-944 变构的 PRC2 抑制剂

ORIC-944 是一种前景广阔的下一代 PRC2 抑制剂,专注于 前列腺癌患者 ORIC-944 目标产品简介 • 通过选择性靶向 EED 来实现 PRC2 的变构抑制剂 • Picomolar 生化效力选择性和有效性 1b 期 • 耐药前列腺癌模型显示出显著的单药活性 ✓ 同类最佳药物 • ORIC-944 在强大的体内功效特性临床前模型中似乎比 EZH2 抑制剂更有效 ✓ 强大的目标接合力 ✓ 耐受性良好 •已获批准的和正在开发的其他 PRC2 抑制剂似乎受制于药物特性不佳同类药物 • ORIC-944 专为改善药物特性而设计的其它 PRC2 抑制剂 ORIC-944 是一种潜在的同类最佳 PRC2 抑制剂,具有优异的药物特性,适合前列腺癌的联合开发 24

PRC2 在转录调控和癌症 PRC2 功能中起关键作用 PRC2 背景 PRC2 • 两个可药物亚单位:— EED:负责组蛋白结合;ORIC-944 的靶标 EZH2 — EZH2:负责组蛋白甲基化;第一代 EED 抑制剂的靶标 • PRC2 失调 与多种癌症有关 SUZ12 — 与三甲基不良相关的靶基因表达降低 H3K27 前列腺癌的预后 (1) • 旨在抑制 EZH2 的第一代抑制剂已显示出令人鼓舞的临床活性 —获准用于上皮样肉瘤和滤泡性淋巴瘤肿瘤发生——前列腺癌的新兴潜力基因沉默细胞命运/分化 PRC2 是几种 癌症的经过验证的致癌靶标,在前列腺癌中具有良好的治疗潜力注:EZH1,zeste 同系物 1 的增强。EZH2,zeste 同源物的增强 2.EED,胚胎外胚层发育。SUZ12,zeste 12 的抑制剂。H3K27,组蛋白 H3 和赖氨酸 27. (1) Yu 等 al。《癌症研究》(2007)。25

ORIC-944 靶向 PRC2 的 EED 亚单位,表现出卓越的 单一药物体内疗效和良好的药物特性 EED 抑制剂可能会改善 EZH2 抑制剂 ORIC-944 在 DLBCL 模型 1250 中诱导完全回归 • ORIC-944 通过靶向 EED 变构抑制 PRC2 • 通过 EED 对 PRC2 的变构 抑制可以解决 EZH2 抑制剂的 1000 个载体的局限性 (1) — Active 对抗 EZH2 先天耐药 PRC2 突变体 750 — 防止通过 EZH2 500 (3) 中的继发 (2) 突变获得性抵抗 — 抑制补偿性旁路EZH1 Tazemetostat 的活性 • 与其他 PRC2 抑制剂相比,ORIC-944 与改善药物特性 250(200 mg/kg BID)(4)相关 ORIC-944 • ORIC-944 在临床前模型中似乎比 EZH2 抑制剂(200 mg/kg QD)0 0 0 10 20 30 40 50 治疗后几天通过 EED 抑制 PRC2 具有许多潜在益处;值得注意的是,ORIC-944 的药物特性已超过其他 PRC2 抑制剂来源:Daemen 等 al。AACR 海报 (2021)。(1) Qi 等人。Nat Chem Biol (2017)。(2) Bisserier 等人。Blood (2018). (3) Shen 等人。Mol Cell (2008) 和 Honma 等人。癌症科学(2017)。(4)Italiano等人。Lancet Oncol(2018),Harb 等人。TAT(2018)和 Yap 等人。克林 癌症研究(2019)。注意:DLBCL,弥漫性大 B 细胞淋巴瘤。右移植:KARPAS-422 异种移植模型。26 3 肿瘤体积 (mm)

ORIC-944 在前列腺癌中表现出强大的单药活性 模型体内功效 — 前列腺癌模型对雄激素不敏感的前列腺癌恩扎鲁胺耐药 ar-v7+ 前列腺癌 2000 1000 载体 1500 750 车辆恩扎鲁胺 1000 500 恩扎鲁胺 ********** ORIC-944 500 250 ORIC-944 79% 肿瘤生长抑制 86% 肿瘤生长抑制 0 0 0 10 20 30 0 10 20 20 20 10 20 20 20 20 10 20 20 20 20 20 10 20 20 20 20 20 20 10 20 20 20 20 20 10 20 20 20 20 10 20 20 20 20 10 20 20 20 20 10 20 20 20 10 20 20 20 20 20 10 20 20 20 10 20 20 20 10 20 20 20 20 10 20 20 20 10 20 20 20 10 20 20 20 治疗后根据在多种前列腺癌模型中观察到的体内疗效和药物特性的改善,ORIC-944 被定位为 潜在的治疗前列腺癌的同类最佳PRC2抑制剂来源:ORIC数据和Daemen等人AACR 海报 (2021)。注意:使用的 ORIC-944 剂量为 200 mg/kg QD。恩扎鲁胺使用的剂量为30 mg/kg QD。****p

PRC2 表观遗传学失调在 逐步重编程使用 AR 抑制剂治疗的前列腺癌过程中起着关键的机制作用 AR 独立前列腺癌 AR 依赖性前列腺癌 • 前列腺癌细胞通过细胞重编程至 AR 独立状态来逃避治疗 • PRC2 抑制可以去势敏感的去势抗性异质谱系改变逆转这一过程,从而使前列腺癌细胞恢复对 AR 的依赖 AR 导向疗法 • 机械原理组合支持含有 AR 的 PRC2 抑制剂腔细胞(AR+)抑制剂 PRC2 抑制剂基底细胞(无 AR)神经内分泌细胞(无 AR)与 AR 抑制剂联合使用可最大限度地发挥 PRC2 抑制剂在前列腺癌中的治疗潜力来源:Mu 等人。科学 (2017),Dardenne 等人。癌细胞(2016),戴维斯等人。Nat Cell Biol (2021),Nouruzi 等人。Nat Commun (2022) 和 Goel 等人。Semin Cancer Bio (2022)。28

ORIC-944 在临床前前列腺癌中与 AR 抑制剂协同作用 模型 PRC2 和 AR 抑制的组合潜力临床前协同评估协同评分结果 10 及以上 = 协同作用 ORIC-944 PF-1497 协同作用 • ORIC-944 与恩扎鲁胺 + 恩扎鲁胺 联合观察到协同效应,临床前前列腺癌模型中的恩扎鲁胺 14 天细胞生长试验 Bliss 10.6 9.9 恩扎鲁胺和 PRC2 抑制剂的浓度范围不等,单独使用或联合使用 — 通过 多个模型进行协同评分 Loewe 15.814.1 • 在基于转录的分析、与其他 AR 抑制剂联合使用以及其他前列腺癌中 HSA 16.7 15.4 细胞系 -10 及以下 = 拮抗性 ORIC-944 与前列腺癌模型中的 AR 抑制剂协同作用,为临床开发提供依据来源:C4-2 前列腺癌细胞中的数据显示。29 协同作用评分解释 ORIC-944

辉瑞 1 期数据临床验证了 PRC2 抑制剂和 AR 抑制剂在前列腺癌中的协同作用更新的 PF-06821497 前列腺癌 1 期数据(辉瑞财报电话会议)早期的 RPF 数据令人鼓舞,明显长于历史对照组在 CARD 研究的对照组中,XTANDI-天真患者的 RPF 为 4.8 个月这些结果,再加上新兴患者客观反应率和 PSA50 反应,支持我们的 EZH2 候选抑制剂在推动这些反应方面的贡献 — Mikael Dolsten,在XTANDI天真和有经验的mcRPC患者中均观察到首席科学官兼全球研究、开发和耐用抗肿瘤活性总裁,两者的时间都明显长于历史对照组——第二阶段随机数据预计将于2024年发布来源:辉瑞2023年第一季度财报电话会议将于2023年5月2日举行。30
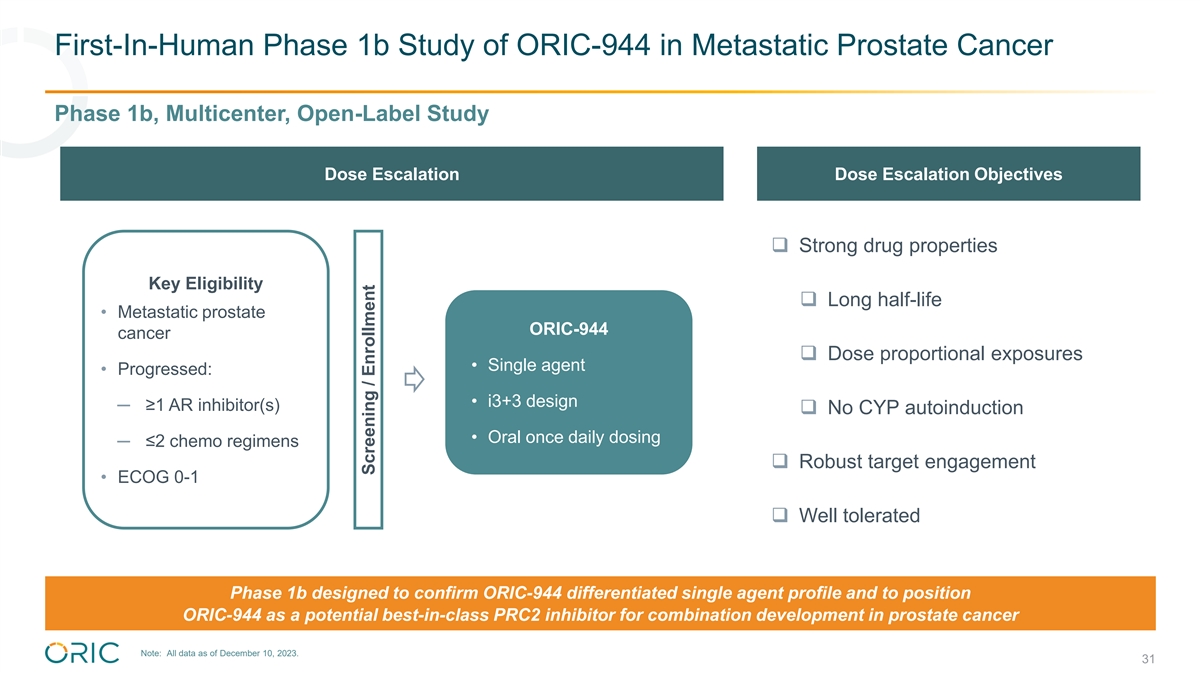
ORIC-944 在转移性前列腺癌中的首次人体 1b 期研究 1b 期、多中心、开放标签研究剂量递增目标 ❑ 强大的药物特性关键资格 ❑ 半衰期长 • 转移性前列腺癌 ❑ 剂量比例暴露 • 单剂 • 进展:• i3+3 设计 ─ ≥1 个 AR 抑制剂 ❑ 无 CYP 自动诱导 • 每日口服一次 ≤2 化疗治疗方案 ❑ 强劲的靶标参与度 • ECOG 0-1 ❑ 耐受性良好 1b 期旨在确认 ORIC-944 的差异化单一药物特征和定位 ORIC-944ORIC-944 作为潜在的用于前列腺癌联合开发的同类最佳 PRC2 抑制剂注意:所有数据截至 2023 年 12 月 10 日。31 筛查/入组

ORIC-944 已显示出潜在的同类最佳药代动力学 概况初步 1b 期药代动力学数据临床半衰期比较关键要点 15 • 迄今观察到的出色药代动力学特征 ─ 剂量水平 >10 小时时暴露量增加 ─ 患者间变异性低 10 • 第一代 PRC2 抑制剂未观察到 CYP 自诱发迹象 5 • 临床半衰期与临床前预测一致 10 小时,它优于其他 PRC2 抑制剂并且 支持 QD 剂量 • 暴露量超过 600 mg QD目标 Cmin that 0 Tazemetostat PF-1497 ORIC-944 在临床前体内前列腺中提供 90% 的 TGI 缺乏 CYP 癌症模型和 ✓✓ 自动诱导剂量探索 继续保持良好的血浆半衰期,暴露与同类最佳药物特性一致。注意:所有数据截至2023年12月10日。资料来源:Tazemetostat的半衰期来自美国食品药品管理局的标签。PF-06821497 的半衰期由 Schweizer 等人估计。ESMO 海报 (2022)。32 临床半衰期(小时)

ORIC-944 已显示出稳健而稳定的靶点作用 初步阶段 1b 药效学数据抑制 PRC2 活性关键要点(H3k27me3 单核细胞减少百分比)每日给药 (QD) 200 mg 400 mg 600 mg 900 mg 900 mg • 每日单一疗法 剂量-25 • H3K27me的最大降低(≥ 75%)外周血样本中单核细胞在多个剂量水平下均达到 3,起始低至 200 mg QD -50 • 观察到的患者间变异性低 -75 -100 ORIC-944 显示前景看好药效学数据,表明靶点参与度很强注意:所有数据截至2023年12月10日。注意:图中显示了1b期患者单核细胞中H3k27me3抑制的百分比。在 1 周期 1 天 15 或周期 第 22 天采集样本,针对 2 名患者,采集 400 mg QD 的样本。H3k27me3,组蛋白 H3 的赖氨酸 27 的三甲基化。C1D15(平均值± SEM)与 H3k27me3/H3 的基线相比变化 33%

根据 1 期结果,ORIC-944 正进入组合开发 1b 期、多中心、开放标签研究初期 1b 期结果 1b 期剂量扩大 • 潜在的同类最佳药物特性,半衰期关键资格 >10 小时支持每日给药一次 • 转移性前列腺 ORIC-944 癌 • 与 AR 联合应用显示出强劲的靶向参与度 • 抑制剂中 H3K27me3 的最大降低(≥ 75%)阿比特龙(不含来自外周血 样本的前二代 AR 单核细胞 • i3+3 设计抑制剂)• 口服每日给药一次 • 迄今为止耐受性良好 • 最多 1 次化疗 • ECOG 0-1 ─ 只有剂量低于 900 mg 的 1 级和 2 级 TRAE 主要终点:安全性和 推荐的 2 期剂量关键次要终点:安全性;DOR、CBR 和 PFS 探索性终点:H3K27 三甲基化、PRC2 靶基因表达、PSA 和基因组学 ORIC-944 显示出潜在的同类最佳药物特性具有良好的 安全性和强大的 PK 特征支持 QD 给药;与 AR 抑制剂的联合研究将于 2024 年上半年启动。注意:所有数据截至 12 月 10 日,2023. 34 筛选/注册
ORIC-533 口服生物可利用的 CD73 小分子抑制剂

ORIC-533 是潜在的同类最佳抑制剂 CD73 和 治疗多发性骨髓瘤的同类首创 ORIC-533 靶产品简介 • 腺苷具有免疫抑制作用,会损害抗肿瘤免疫力 • CD73 在临床前研究中可逆转免疫抑制 CD73 具有显著性 • CD73 抑制已显示出阳性 NSCLC 与 PD-L1 抑制在有前景的肿瘤学阶段联合治疗潜力 1b 结果 • 在 T 细胞活化测定中比基准抑制剂更有效 ✓ 每日口服给药一次 •口服小分子比抗体更有益处 ORIC-533 是一种潜力(易于给药和增加肿瘤穿透率)✓ 清洁的安全性概况一流 • 临床前毒理学研究中观察到的干净 安全特征 ✓ 剂量依赖性 CD73 抑制剂免疫激活 ✓ 临床活性为 • CD73 和腺苷在多发性骨髓瘤中的作用由单一药物支持,达纳法伯癌症经过重度预处理的肯尼斯 安德森博士实验室的研究研究所 ORIC-533 是多发性骨髓瘤的同类首创 • 活性显示在对患者的体外骨髓分析多发性骨髓瘤伴复发/难治性多发性骨髓瘤 ORIC-533 显示出免疫激活且安全性极为简洁,这转化为临床上所有 CD73 抑制剂的首个单一药物活性;为多发性骨髓瘤的联合研究做好了充分准备 36

ORIC-533 在复发性多发性 骨髓瘤中的首次人体 1b 期结果已在 ASH 2023 年 1b 期多中心、开放标签研究 1b 期剂量递增初始阶段 1b 结果中公布 ✓ 临床半衰期约 24 小时的临床半衰期支持 QD 给药关键资格 ✓ 耐受性良好,没有 级≥3 traE • 复发性多发性骨髓瘤 ORIC-533 • 难治或 ✓ 完全/实质抑制血清中CD73活性不符合治疗条件 • 已知的单一药物和骨髓方案 • i3+3 设计提供临床益处 ✓ 免疫证据调节 CD8+ T 细胞和 NK • 每日口服一次(即三类以上细胞难治性)• ECOG 0-2 ✓ sbcMA 水平显著降低,提示 抗脊髓瘤活性主要终点:安全性和推荐的 2 期剂量 ✓ 临床抗脊髓瘤活性的初步证据,关键次要终点:PK 包括副蛋白降低,在 (1) 多名 r/患者中得到证实 r 多发性骨髓瘤探索性终点:探索性生物标志物 1b 期作为单一疗法仍在进行中,旨在选择临时 RP2D 进行组合发展;正在寻求战略伙伴关系以实现组合研究(1)探索性 生物标志物分析包括CD73酶功能以及免疫细胞和细胞因子分析。注意:r/r,复发/难治。NK,自然杀手。sbcMA,可溶性 B 细胞成熟抗原。37 筛查/入组

ORIC-613 高选择性 PLK4 抑制剂

ORIC 正在开发通过合成杀伤力靶向 trim37 扩增乳腺癌的 PLK4 小分子抑制剂 PLK4 抑制剂对具有 TRIM37 扩增的 PLK4 肿瘤细胞的合成致死性发现和开发基本原理正常细胞 • POLO样激酶 4 (PLK4) 是一种丝氨酸/苏氨酸蛋白激酶,可控制细胞分裂期间的中心体复制可逆的 PLK4 K4 + 细胞周期 = 抑制阻止 • 有 TRIM37 扩增的细胞需要 PLK4 功能才能生长和存活 TRIM37 扩增细胞 ─为靶向有丝分裂的合成致死性提供机会 • TRIM37 扩增发生在乳腺癌(约 20%)PLK4 灾难 = + 抑制和神经母细胞瘤(约 55%)中,细胞死亡与 早期复发和预后不佳有关,母中心粒子中心粒周层材料使用强效和选择性的 PLK4 抑制剂靶向 TRIM37 扩增癌症是潜在的首创药物上课机会来源:Meitinger 等人Nature (2020),Yeow 等人。《自然》(2020),辛克莱等人。乳腺癌研究治疗(2003 年)和 Bown 等人。N Engl J Med (1999)。39

ORIC PLK4 小分子抑制剂具有很强的效力和选择性, 并在体内表现出单一药物活性 ORIC PLK4 抑制剂是有效的选择性 ORIC PLK4 抑制剂在 TRIM37 扩增的异种移植模型 1200 中具有靶向活性的单一药物 ORIC PLK4 抑制剂 ORIC PLK4 抑制剂 ORIC PLK4 抑制剂 ORIC PLK4 抑制剂 ORIC PLK4 抑制剂 ORIC PLK4 抑制剂 ORIC PLK4 抑制剂载体(化合物 Y))(化合物 X)(化合物 Z)化合物 Z BID 1000 100000 100000 800 800 600 10000 10000 10000 10000 1000 1000 100% TGI 1000 1000 0 0 0 3 6 9 12 15 18 21 天研究时间 100 100 高低点高低点 TRIM3720 TRIM37 TRIM37 10 0 ORIC PLK4 抑制剂 -10 化合物 X 化合物 Y 化合物 Z -20 0 3 6 9 12 15 18 21 PLK4 生化 IC (nM) 0.43 1.58 1.79 50 天研究中 ORIC PLK4 抑制剂具有很强的选择性,在 TRIM37 扩增的异种移植物中表现出很强的单药抗肿瘤 活性;通过 IND 授权研究开发的高级新候选药物 ORIC-613 来源:Edgar 等所有。AACR 海报(2022 年)。左图:1 μM 处的基因组分布图。细胞组由乳腺癌和 神经母细胞瘤细胞系组成。右图:CHP-134 神经母细胞瘤异种移植模型中 ORIC PLK4 抑制剂的口服剂量。40 IC (nM) 50 3% 体重变化肿瘤体积 (mm)

关键要点

临床产品线侧重于推进 ORIC-114 和 ORIC-944 铅 先导项目适应症鉴定优化 IND 启用 1 期 2 期 3 期关键差异化候选产品 NSCLC、乳腺和 ✓ CNS 活性 ORIC-114 1b 期:ORIC-114 单一药物肿瘤无关型 ✓ 耐受性良好 EGFR/HER2 外显子 20 抑制剂 ✓ 潜在同类最佳 ORIC-944 1b 期:ORIC-944 单药前列腺癌药物特性 PRC2 抑制剂已退出许可候选药物 ✓ 单剂活性 ORIC-533 第 1b 阶段:ORIC-533 组合 就绪 ✓ 清洁安全概况多发性骨髓瘤 CD73 抑制剂 ✓ 免疫激活探索研究项目 ORIC-613 乳腺癌 ✓ 同类首创潜在的 PLK4 抑制剂实体瘤多种靶向耐药性的项目 机制实体瘤 42

ORIC 制药:致力于克服癌症耐药性 • 两个潜在的同类最佳项目推进关键研究的潜在首创和同类最佳项目渠道广泛 • 其他针对新颖和经过验证的靶标的临床前项目精准肿瘤学 专业知识支持 • 由生物标志物驱动的、由患者选择的临床加速时间表试验和转化专业知识推动了快速进度 • 通过内部研发和业务 双引擎开发建立管道的往绩记录管道扩张 • 目标是每 18 个月推出一款新的 IND 候选药物 • 经验丰富的管理团队 Ignyta、Medivation、Aragon 和 Genentech 有发现和开发多种获批肿瘤药物的传承 (1) 强劲的财务状况 • 2.35 亿美元的现金和投资预计将为 2026 年公司提供资金 • ORIC-944 启动与 AR 抑制剂的联合研究:2024 年上半年 • ORIC-944 项目更新:2024 年中期预期里程碑 • ORIC-114 启动多个剂量扩展群组:2024 年上半年 • ORIC-114 已更新第 1b 阶段数据:2025 年上半年 (1)截至 2023 年 12 月 31 日的大致未经审计的余额。43