| Safe harbor 根据经修订的1933年《证券法》第27A条和经修订的1934年《证券交易法》第21E条 所指的前瞻性陈述, 包括有关我们临床试验的进展、时机和充足性、现有和 计划临床试验的患者注册情况以及时机的陈述其中,我们的临床试验结果、临床数据的时间和发布、声明 关于我们对现金流的期望、我们开发和商业化候选产品的目标、我们对获准用于商业用途的候选产品的患者群体规模的预期 以及其他以 “可能”、“期望”、“打算”、“可能”、“计划”、“潜在”、“应该”、“将” 或类似表述等词语标识的 以及负面因素 br} 这些条款。前瞻性陈述不是对未来业绩的承诺或保证,受各种风险 和不确定性的影响,其中许多是我们无法控制的,可能导致实际结果与此类前瞻性陈述中设想的 存在重大差异。这些因素包括与我们有限的运营历史相关的风险、我们 为候选产品产生积极临床试验结果的能力、运营内部制造设施的成本和时间、 监管批准的时间和范围、我们所受法律和法规的变化、竞争压力、我们 确定其他候选产品的能力、政治和全球宏观因素,包括 SARS-COV-2 冠状病毒作为 全球疫情的影响,以及相关的公共卫生问题等风险可能会在我们的 10-K表年度报告、10-Q表季度报告以及我们向美国证券交易委员会提交的其他报告中不时详细说明。我们的实际业绩可能与此类前瞻性陈述中描述或暗示的结果存在重大差异。前瞻性陈述仅代表本文发布之日的 ,除非法律要求,否则我们没有义务更新或修改这些前瞻性陈述。 激发全身免疫 对癌症的反应 摩根大通 2024 年 1 月 |
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 2 安全港 根据经修订的1933年《证券法》第27A条和经修订的1934年《证券交易法》第21E条 所指的前瞻性陈述, 包括有关我们临床试验的进展、时机和充足性的声明,我们现有和 计划中的临床试验的患者登记人数及其时间,我们的临床试验结果,临床数据的时间和发布、关于我们对现金流预期的声明 、我们开发和商业化候选产品的目标、我们对候选产品获准用于商业用途后患者群体规模的预期 以及其他用 “可能”、“期望”、“打算”、“可能”、“计划”、“潜力”、“应该”、“将” 等词语确定 的陈述,” “would” 或类似的表达方式以及这些术语的 否定词。前瞻性陈述不是对未来业绩的承诺或保证,受各种风险和不确定性的影响,其中许多风险和不确定性是我们无法控制的,可能导致实际结果与此类前瞻性陈述中设想的 存在重大差异。这些因素包括与我们有限的运营历史相关的风险、我们 为候选产品产生积极临床试验结果的能力、运营内部制造 设施的成本和时间、监管批准的时间和范围、我们所受法律和法规的变化、竞争压力、 我们确定其他候选产品的能力、政治和全球宏观因素,包括 SARS-COV-2 冠状病毒作为全球疫情和相关公共卫生的影响问题,正在进行的俄罗斯和乌克兰之间的军事冲突以及 对全球经济的影响和相关政府实施的制裁,以及 我们的10-K表年度报告、10-Q表季度报告以及我们向美国证券交易所 委员会提交的其他报告中不时详述的其他风险。我们的实际业绩可能与此类前瞻性陈述中描述或暗示的结果存在重大差异。 前瞻性陈述仅代表截至本文发布之日,除非法律要求,否则我们没有义务更新或 修改这些前瞻性陈述。 |
| © 2022 Replimune Group Inc. 3 3 • RP1 — 对多种皮肤癌的活性支持广泛的皮肤癌策略 • 140 名患者注册研究 IGNYTE 抗PD1 失效黑色素瘤 • 100% 的反应在 6 个月以上,DOR 中位数 >24 个月 • BLA 计划在 2024 年下半年提交 • 211 名患者 1L CSCC 随机对照 CERC PASS 研究;初步分析报告于 2023 年 12 月 • 稀有癌症特许经营权的 P 潜力未达到重要意义 • 截至2023年12月31日,资产负债表强劲约为4.66亿美元 (1);跑道进入 2026 年下半年 Replimune;溶瘤免疫疗法行业领导者 1根据协议 p |
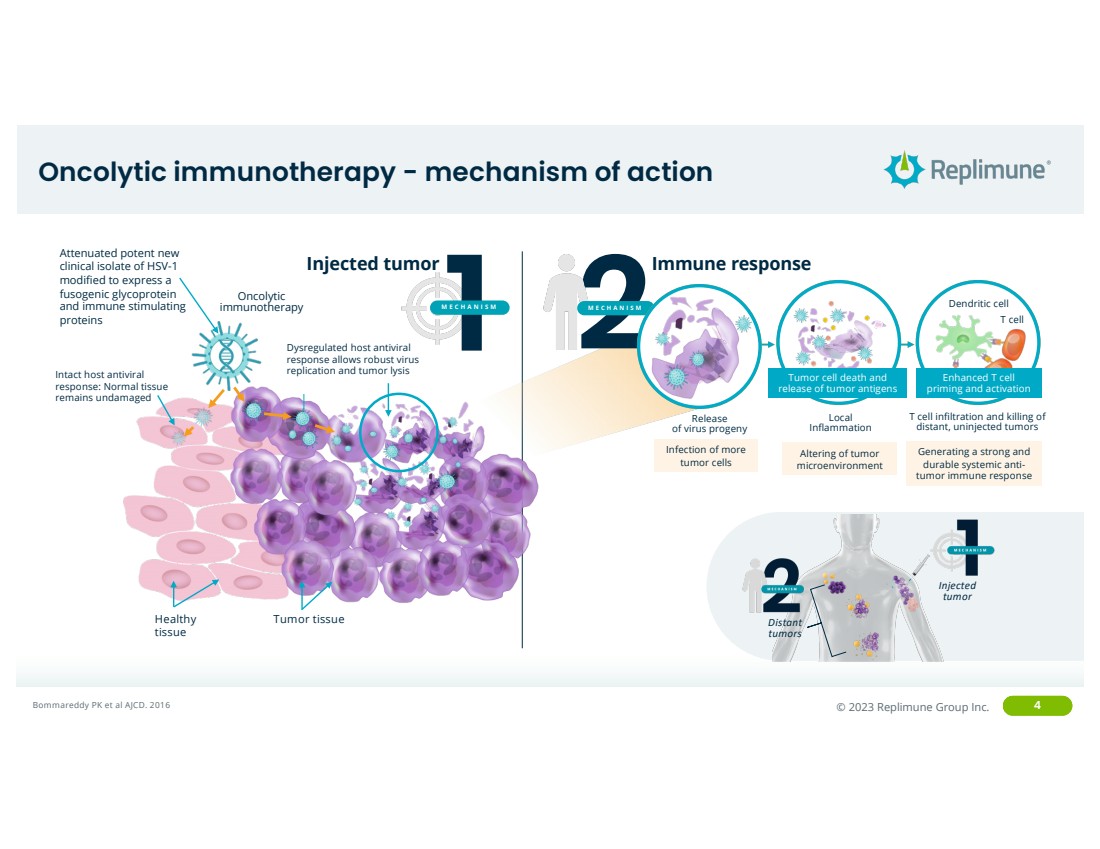
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 4 溶瘤免疫疗法-作用机制 注射 肿瘤 远处 Bommareddy PK 等人 AJCD。2016 年健康 组织 肿瘤组织 溶瘤免疫疗法 完整宿主抗病毒 反应:正常组织 未受损 br} 失调的宿主抗病毒 反应允许病毒 强效复制和肿瘤溶解 经过修饰后表达 共生糖蛋白 和免疫刺激 蛋白 的减毒全新 临床分离物 注射肿瘤 1 HSV-1机制 2 机制 改变肿瘤 微环境 感染更多 肿瘤细胞 释放病毒后代 局部 炎症 T 细胞浸润并杀死 远处未注射的肿瘤 树突状细胞 T细胞 产生强大而持久的全身性抗肿瘤免疫反应 免疫反应 肿瘤细胞死亡和 肿瘤抗原释放 增强型 T 细胞 启动和激活 |
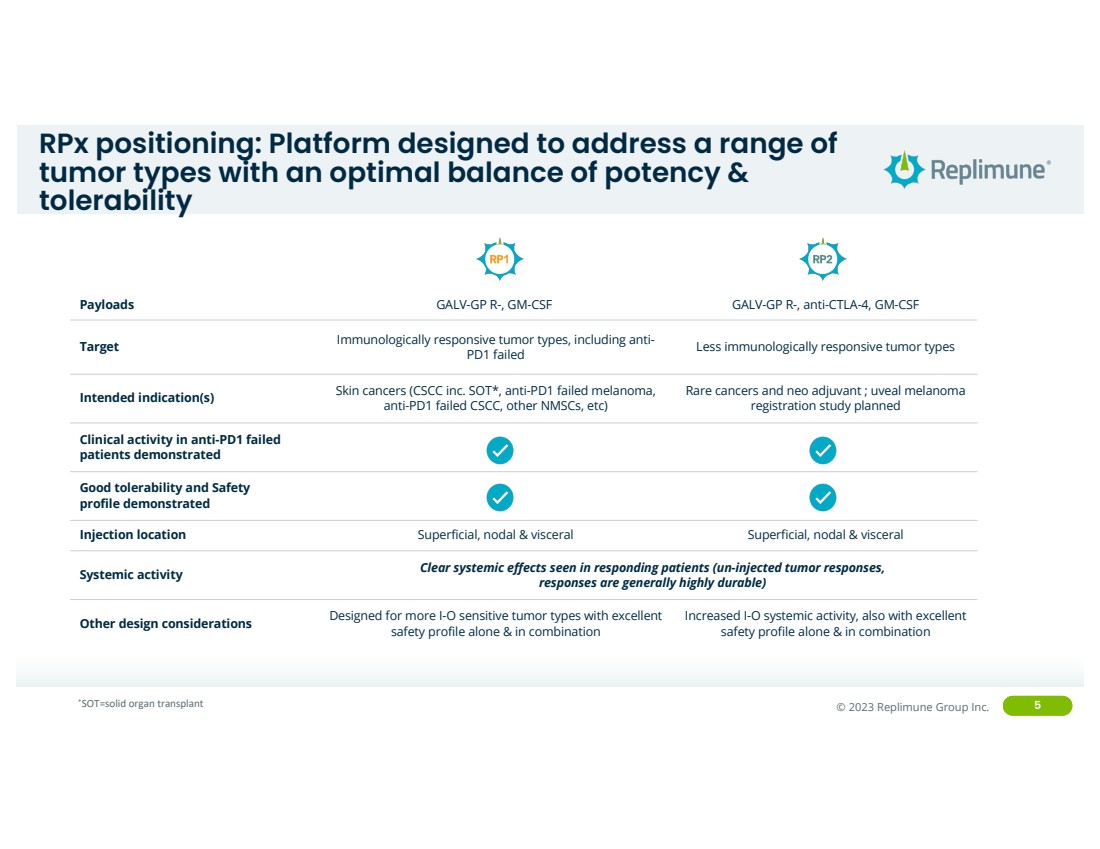
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 5 RpX 定位:该平台旨在解决一系列 肿瘤类型,实现效力和 耐受性的最佳平衡 有效载荷 GALV-GP R-、GM-CSF GALV-GP R-、抗 CTLA-4、GM-CSF 靶向免疫反应性肿瘤类型,包括抗 PD1 失效免疫反应较差的肿瘤类型肿瘤类型 预期适应症(s)皮肤癌(CSCC inc.SOT*、抗 PD1 失效的黑色素瘤、 抗 PD1 失效的 CSCC、其他 NMSC 等) 罕见癌症和新辅助药物;葡萄膜黑色素瘤 计划进行注册研究 对抗 PD1 失败患者的临床活性显示 良好的耐受性和安全性 概况显示 注射位置浅面、节点和外观颈部表面、淋巴和内脏 全身活动反应患者出现明显的全身效应(未注射的肿瘤反应, 反应通常具有很强的耐久性) 其他设计注意事项专为 I-O 敏感度更高而设计单独和组合使用均具有优异的 安全特征的肿瘤类型 I-O 系统活性增加,单独使用和组合时也具有出色的 安全性 *SOT=实体器官移植 |
| © 2022 Replimune Group Inc. 6 议程 © 2023 Replimune Group Inc. RP1:建立主要的 皮肤癌特许经营权 |
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 7 IGNYTE RP1 + nivolumab 在抗 PD1 失败的黑色素瘤中 注册研究数据 所有亚组均具有一致的 ORR 益处 包括 1 名未经证实的 PR (uPR) 患者。还有5名患者仍在研究中,有机会得到回应。 提供的反应数据由研究者评估得出;该研究的主要分析将由盲目独立的中心审查进行。bor=最佳总体反应 • 三分之一的患者出现了反应 • 难以治疗的Ipi+Nivo失败患者(约占总研究人群的50%)的ORR为26.4% • 100%的反应持续了>6个月,中位DOR >24个月 n (%) 所有患者 (n=156) Prior 队列 (n=16) 抗 PD1 失败队列 (n=140) 所有患者 (n=156) 之前的单一药物 anti-pd1 (n=84) 先前组合 抗 PD-1 和抗— CTLA-4* (n=72) 阶段 IIIB/IIIC/iiic/iiC/iiC/iiC/iiC/iiC/iiC/iiC/iiC/iiC/iiC/iiC/iiC/iiC/iiC/iiC/iiC/va (n=76) 阶段 ivb/c/D (n=80) 主要 阻力 到 抗 PD1 (n=91) 次要 抗 PD1 (n=63) 抗 PD1 (n=63) CR 2 (12.5) 17 (12.1) 19 (12.2) 14 (16.7) 5 (6.9) 15 (19.7) 4 (5.0) 12 (13.2) 6 (9.5) PR 4 (25.0) 26 (18.6) 30 (19.2) 16 (19.0) 14 (19.4) 14 (18.4) 16 (20.0) 19 (20.9) 11 (17.5) SD 2 (12.5) 29 (20.7) 31 (19.9) 21 (25.0) 10 (13.9) 18 (23.7) 13 (16.3) 15 (16.5) 16 (25.4) PD 8 (50.0) 68 (48.0) 6) 76 (48.7) 33 (39.3) 43 (59.7) 29 (38.2) 47 (58.8) 45 (49.5) 30 (47.6) ORR 6 (37.5) 43 (30.7) 49 (31.4) 30 (35.7) 19 (26.4) 29 (38.2) 20 (25.0) 31 (34.1) 17 (27.0) |
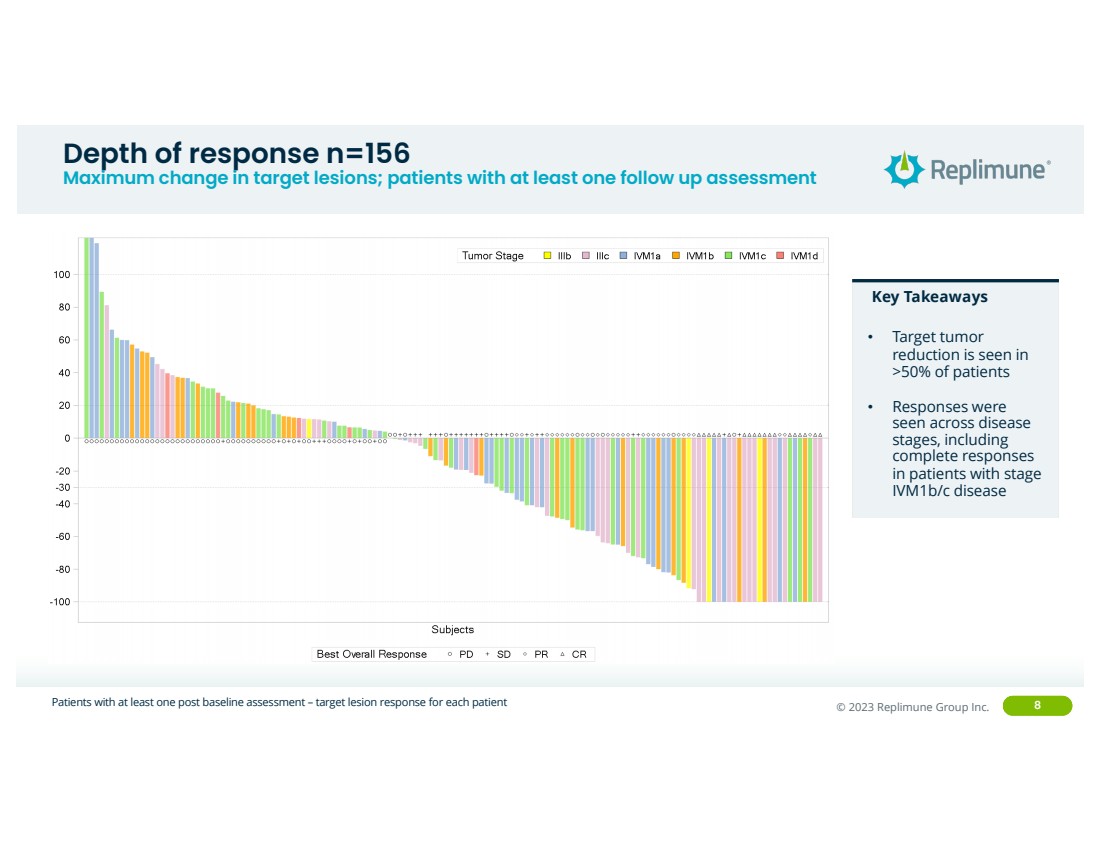
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 8 反应深度 n=156 目标病变的最大变化;至少进行过一次随访评估的患者 接受至少一次基线后评估的患者 — 每位患者的目标病变反应 关键要点 • 有 的患者出现靶肿瘤 减少 。疾病 阶段,包括 IVm1b/C 期疾病患者的 完全反应 |
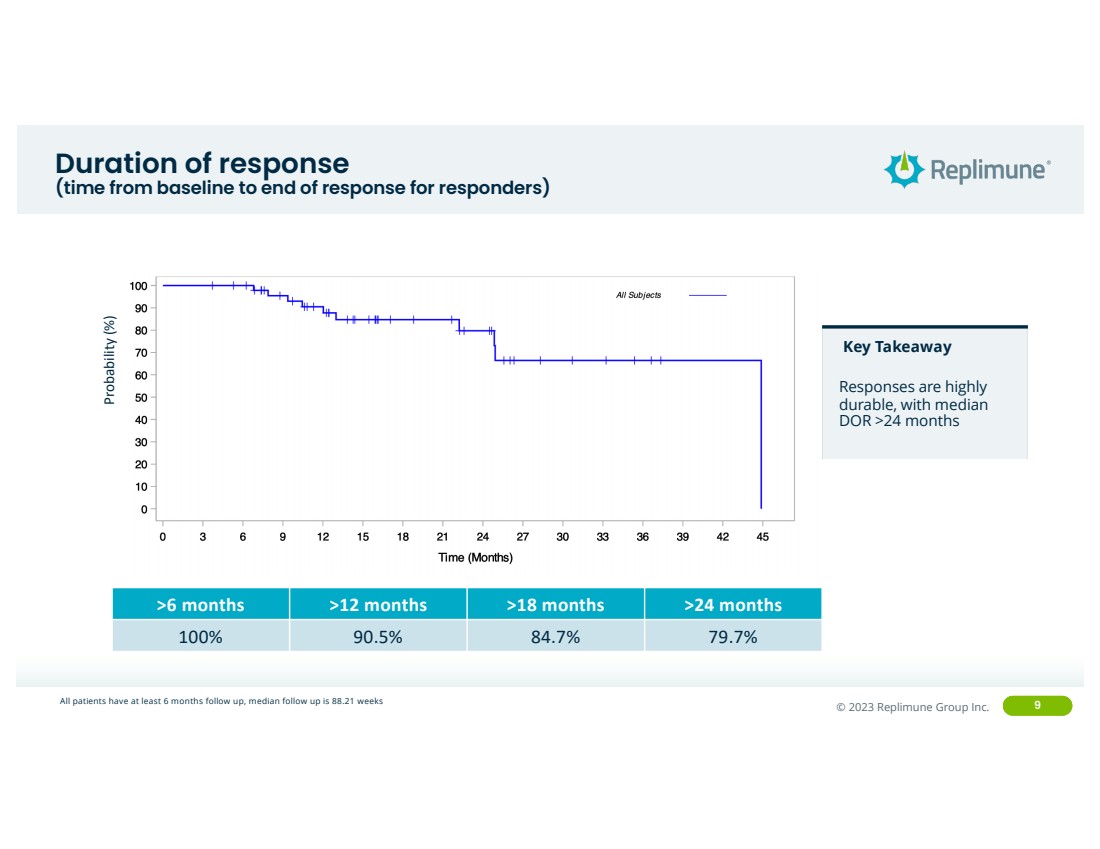
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 9 响应时间 (响应者从基线到反应结束的时间)概率(%) 关键要点 反应非常持久,中位数 >24 个月 >24 个月 100% 90.5% 79.7% 79.7% 所有患者至少接受6个月的随访,中位随访时间为88.21周 |
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 10 种前景看好的操作系统涵盖所有疾病亚群,包括 需求未得到满足最大的患者 IIIB/IIIC/IVM1a 与 IV 期 m1b/c/D 先前抗CTLA-4+抗PD1对比单独使用抗PD1 所有患者都至少有 6 个月的随访,随访时间中位数为 88.21 周 |
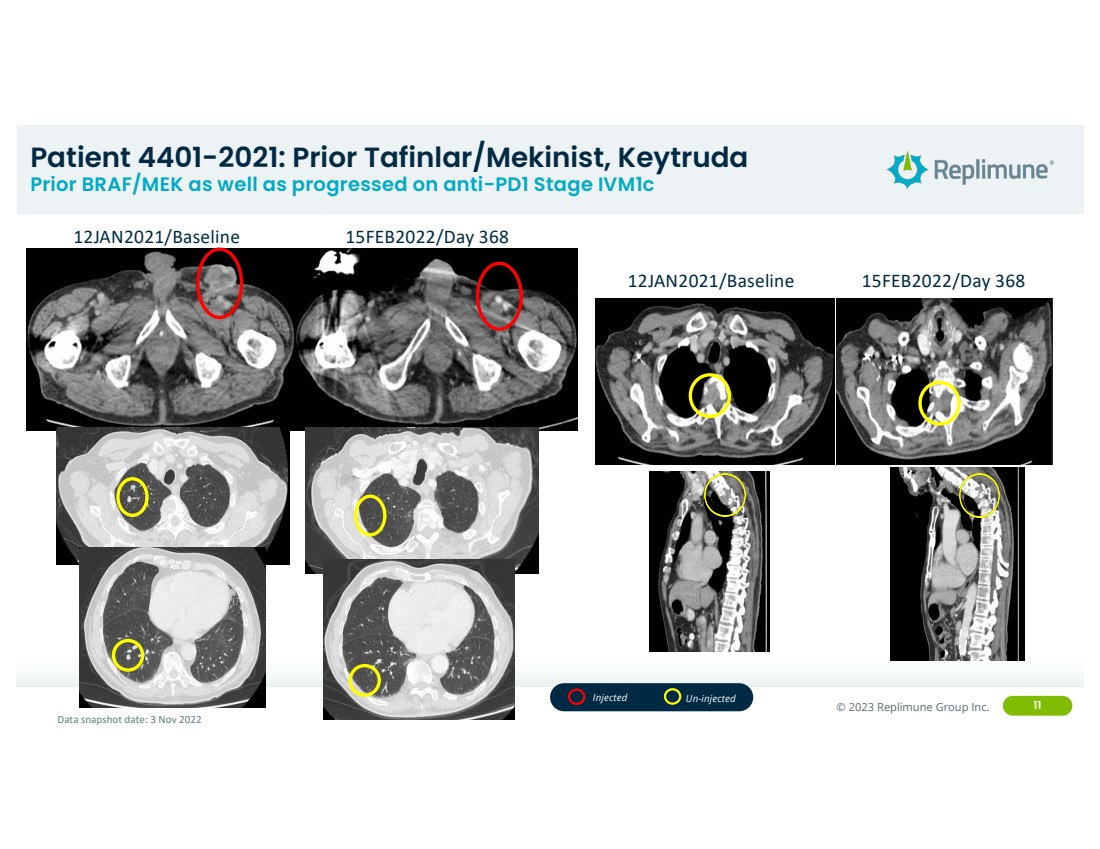
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 11 位患者 4401-2021:Prior Tafinlar/Mekinist、Keytruda Prior BRAF/MEK 以及抗PD1阶段 iVM1C 2021/基线 368 年 1 月 12 日/基线 152 年 2 月 2022/第 368 天数据快照日期:2022 年 11 月 3 日注射未注射 |
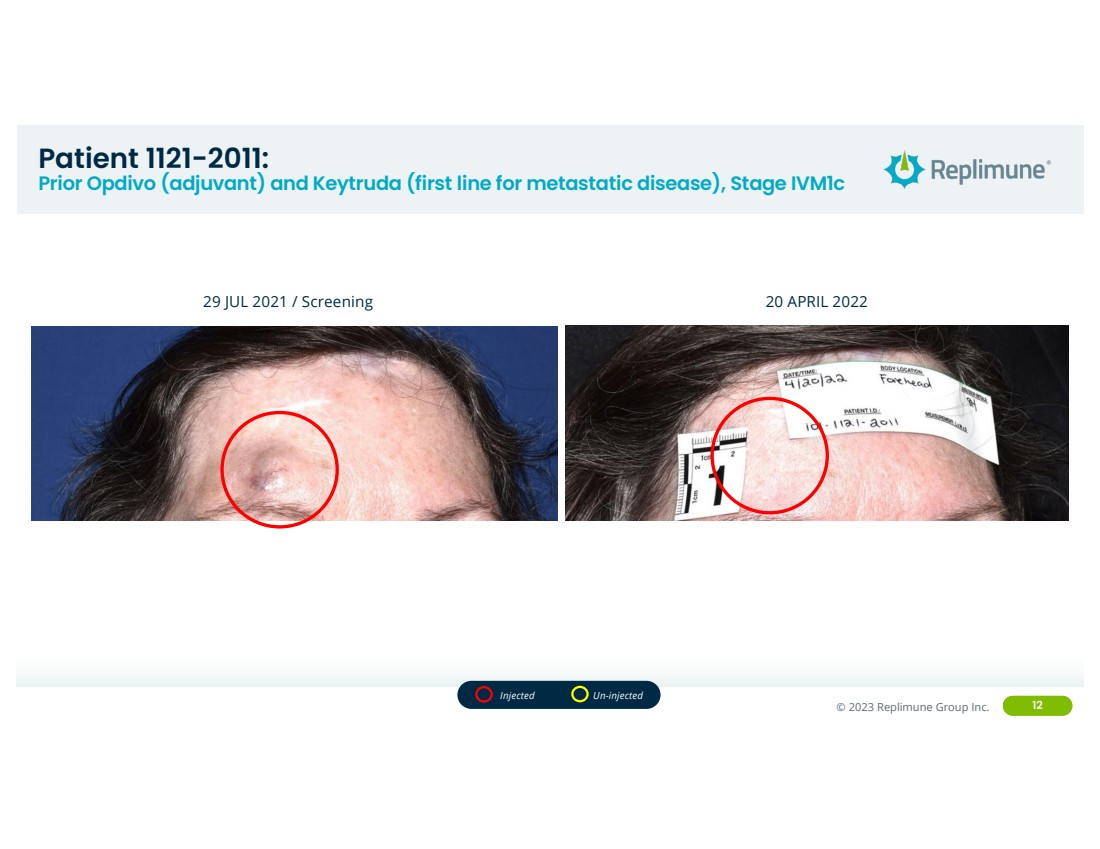
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 12 位患者 1121-2011: Prior Opdivo(辅助剂)和 Keytruda(转移性疾病的第一线),Ivm1c 阶段 2021 年 7 月 29 日/筛查 2022 年 4 月 20 日注射未注射 |
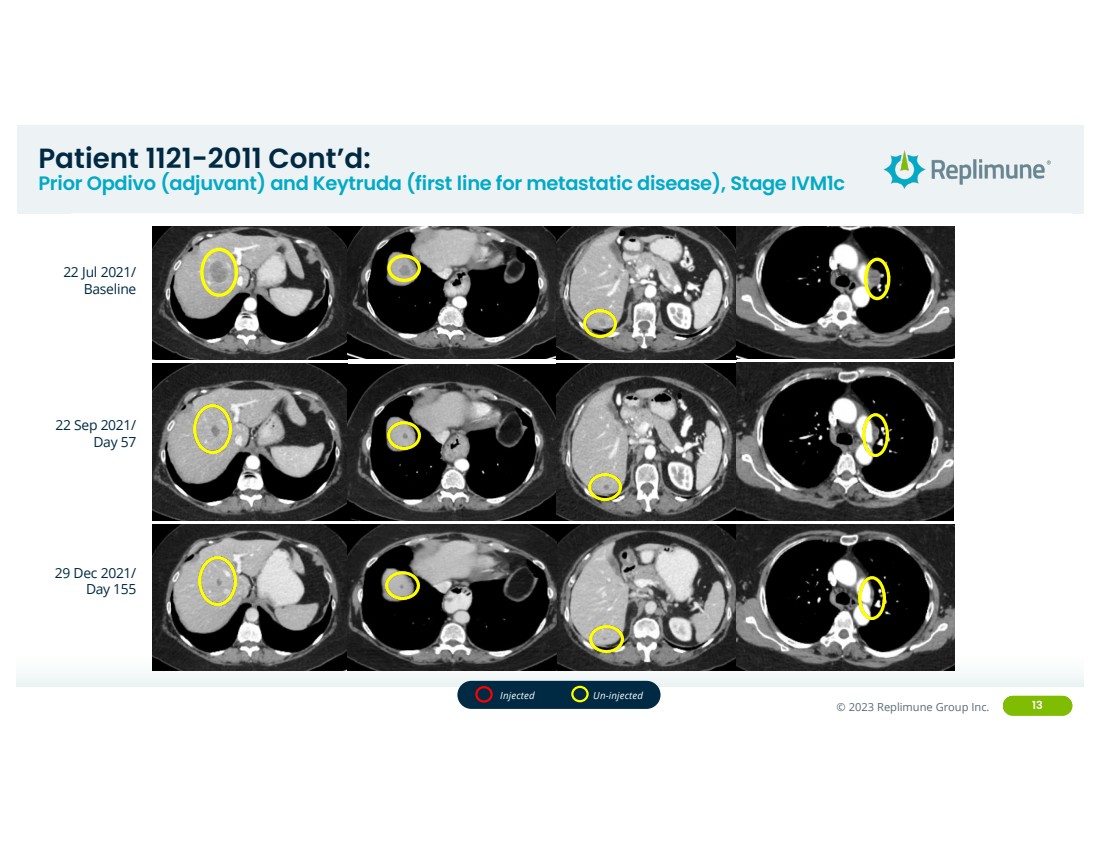
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 2021 年 7 月 13 日 22 日/ 2021 年 9 月 22 日/ 第 57 天 2021 年 12 月 29 日/ 第 155 天未注射的 患者 1121-2011 续: Prior Opdivo(辅助)和 Keytruda(转移性疾病的第一线),IVM1C 阶段 |
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 14 IGNYTE-监管摘要/后续步骤 IGNYTE FDA C型抗PD1失效黑色素瘤会议 • 美国食品药品管理局同意由医生选择的抗PD1失效黑色素瘤的双臂随机试验设计 作为研究人群中的比较组 • 该研究应在提交 BLA 时开始 • 计划于 2024 年下半年提交抗 PD1 失效黑色素瘤的 BLA 申请,待定 • 集中审查的数据作者 RECIST v 1.1 • 所有患者随访了至少 12 个月(这是每个方案的主要分析时间点) • 所有出现反应的患者自反应开始后随访了至少 6 个月 |
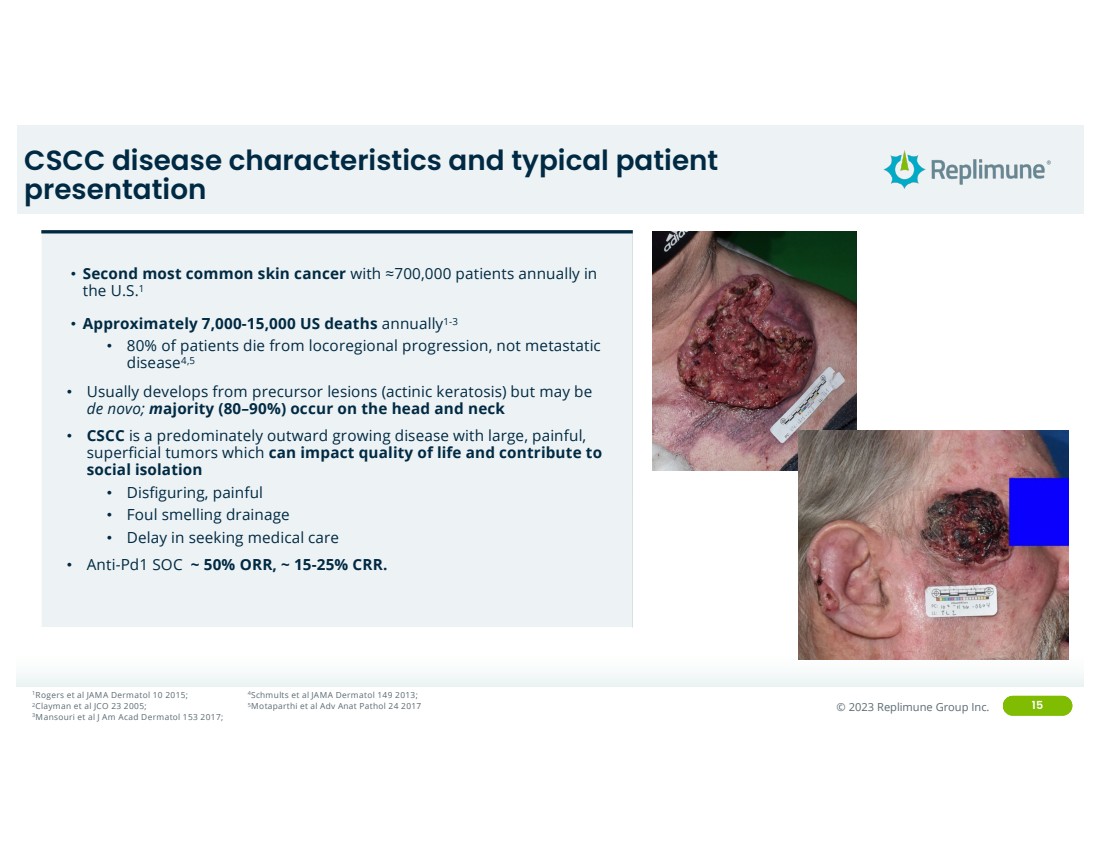
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 15 种CSCC疾病特征和典型患者 表现 • 美国第二常见的皮肤癌每年约有 700,000 名患者1 • 美国每年约有 7,000-15,000 例死亡 1-3 • 80% 的患者死于局部病变,非转移性 疾病4,5 • 通常由前体病变(光化角膜病)发展而来 atosis)但可能是 从头开始;大多数(80— 90%)发生在头部和颈部 • CSCC 是一种主要向外生长的疾病,伴有大、疼痛的 浅表肿瘤这会影响生活质量并导致 社交隔离 • 毁容、痛苦 • 恶臭引流 • 延迟就医 • Anti-Pd1 SOC ~ 50% ORR,约 15-25% CRR。 1Rogers 等人 JAMA Dermatol 10 2015; 2Clayman 等人 JCO 23 2005; 3Mansouri 等人 J Am Acad Dermatol 153 2017; 4Schmults 等人 JAMA Dermatol 149 2013;5Motaparthi 等人 Adv Anat Pathol 24 2017 |
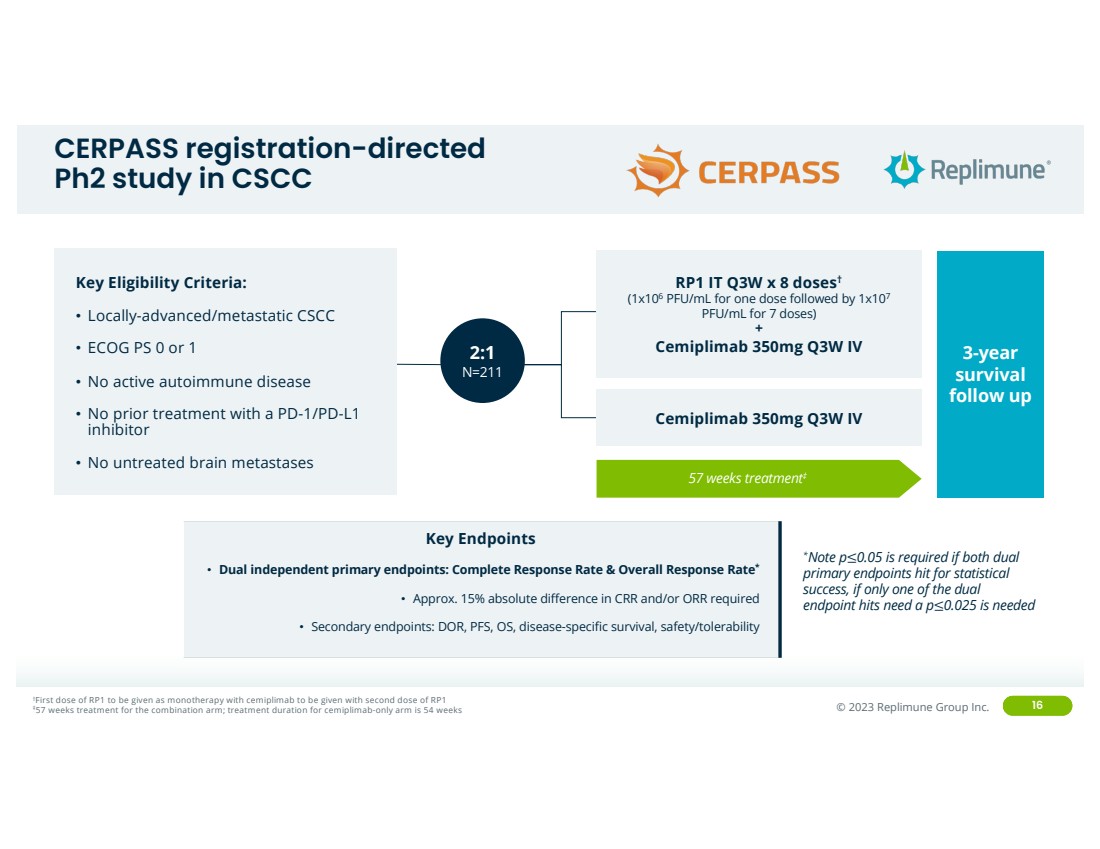
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 在 CSCC 中进行的 16 项以 CERPASS 注册为导向 的Ph2研究关键资格标准: • 局部晚期/转移性 CSCC • ECOG PS 0 或 1 • 无活动性自身免疫性疾病 • 没有未经治疗的脑部重组治疗 stases 57 周治疗‡ 3 年 存活率 随访 †第一剂 RP1 将作为单一疗法使用 cemiplimab 与第二剂 RP1 同时给予复方组 57 周治疗;仅使用塞米普利单抗的治疗持续时间为54 周 关键终点 • 双独立主要终点:完整反应率和总体反应率* • 所需的 CRR 和/或 ORR 的绝对差异约为 15% • 次要终点:DOR、PFS、操作系统、疾病特异性存活率、安全性/耐受性 2:1 N=211 RP1 IT Q3W x 8 剂量† (一次 1x106 PFU/mL 剂量然后是 1x107 pfu/mL(7 剂量) + Cemiplimab 350mg Q3W IV Cemiplimab 350mg Q3W IV *注意 p≤0.05 如果两个双 主要终点都达到统计学上的 成功率,如果只有一个双 终点命中,则需要 p≤0.05需要 p≤0.025 |
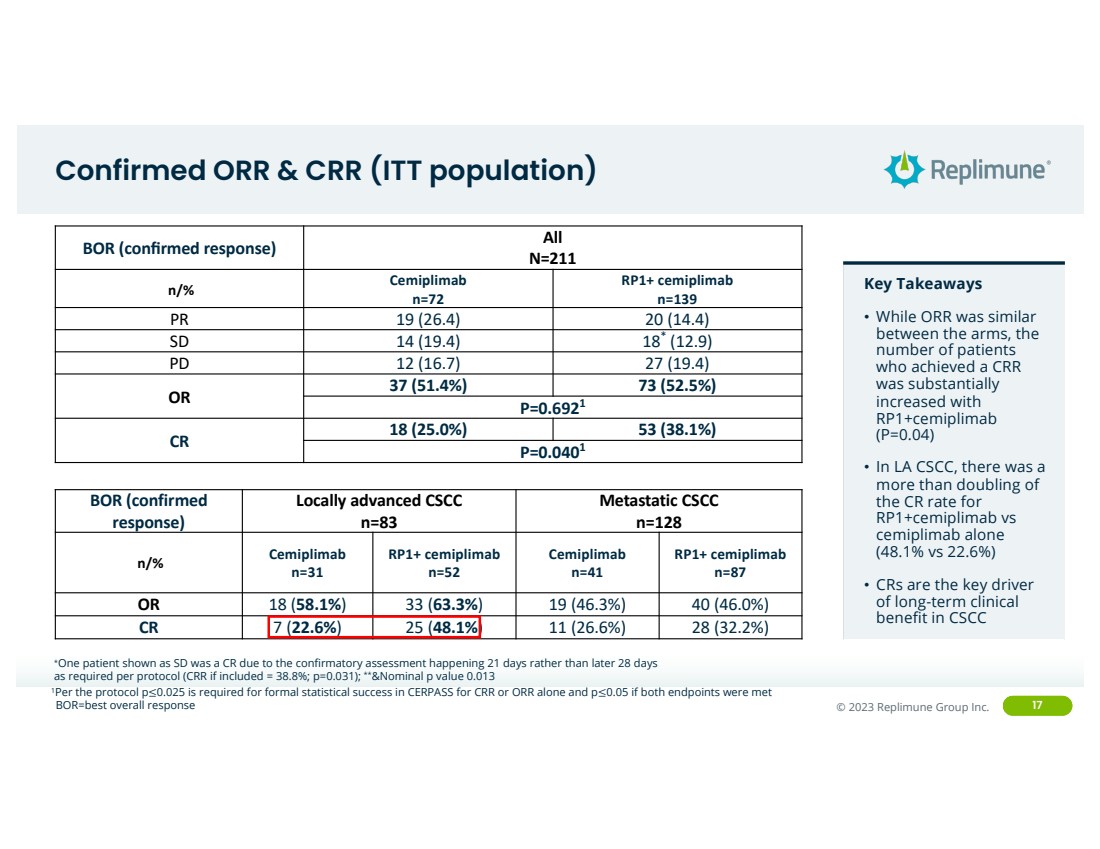
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 17 已确诊的 ORR 和 CRR(ITT 人群) 关键要点 • 虽然两组之间的 ORR 类似 ,但获得 CRR 的患者 数量大幅增加 br} • 在洛杉矶CSCC, rp1+cemiplimab 与单独使用 cemiplimab 相比 的 CR 率翻了一倍多(48.1% 对 22.6%) • CR 是CSCC BOR 长期临床 获益的关键驱动力 (已确认的反应)所有 br} N=211 n/% 塞米普利单抗 n=72 RP1+ 塞米普利单抗 n=139 PR 19 (26.4) 20 (14.4) SD 14 (19.4) 18* (12.9) PD 12 (16.7) 27 (19.4) OR 37 (51.4%) 73 (52.5%) P=0.041 根据协议的要求,在 21 天而不是晚于 28 天后进行的确认性评估 (如果包括 CRR = 38.8%;p=0.031);**&标称 p 值 0.013 bor=最佳总体反应 1根据协议,仅在 CERPASS 中获得 CERRR 或 ORR 的正式统计成功需要 p≤0.05,如果两个终点都满足 BOR(已确认 反应) 本地高级 CSCC n=83 转移性 CSCC n=128 n/% Cemiplimab n=31 RP1+ cemiplimab n=52 Cemiplimab n=41 RP1+ cemiplimab n=87 OR 18 (58.1%) 33 (63.3%) 19 (46.3%) 19 (46.3%)) 40 (46.0%) CR 7 (22.6%) 25 (48.1%) 11 (26.6%) 28 (32.2%) |
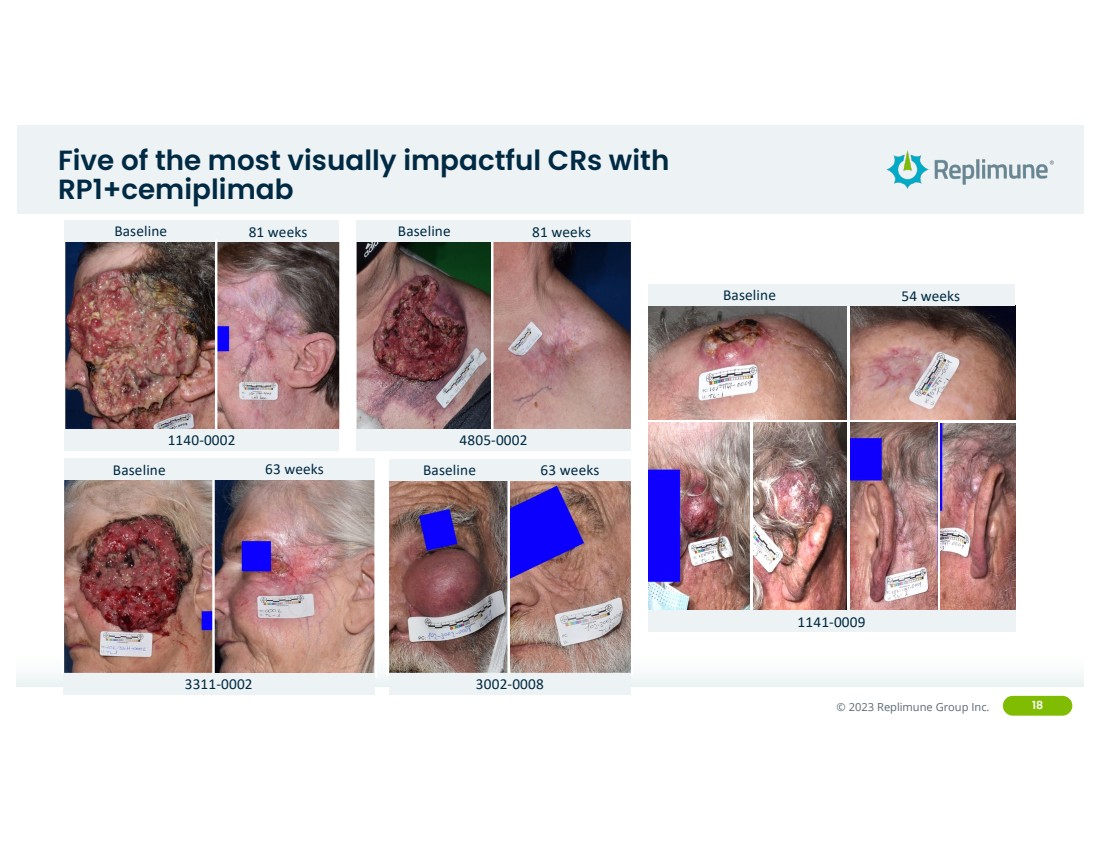
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 18 五个视觉效果最强的 CR, rp1+cemiplimab 基线 81 周 4805-0002 基线 81 周 1140-0002 基线 63 周 3002-0008 基线 54 周 1141-0002 基线 54 周 1141-0002 基线 63 周 3002-0008 基线 54 周 1141-0002 9 |
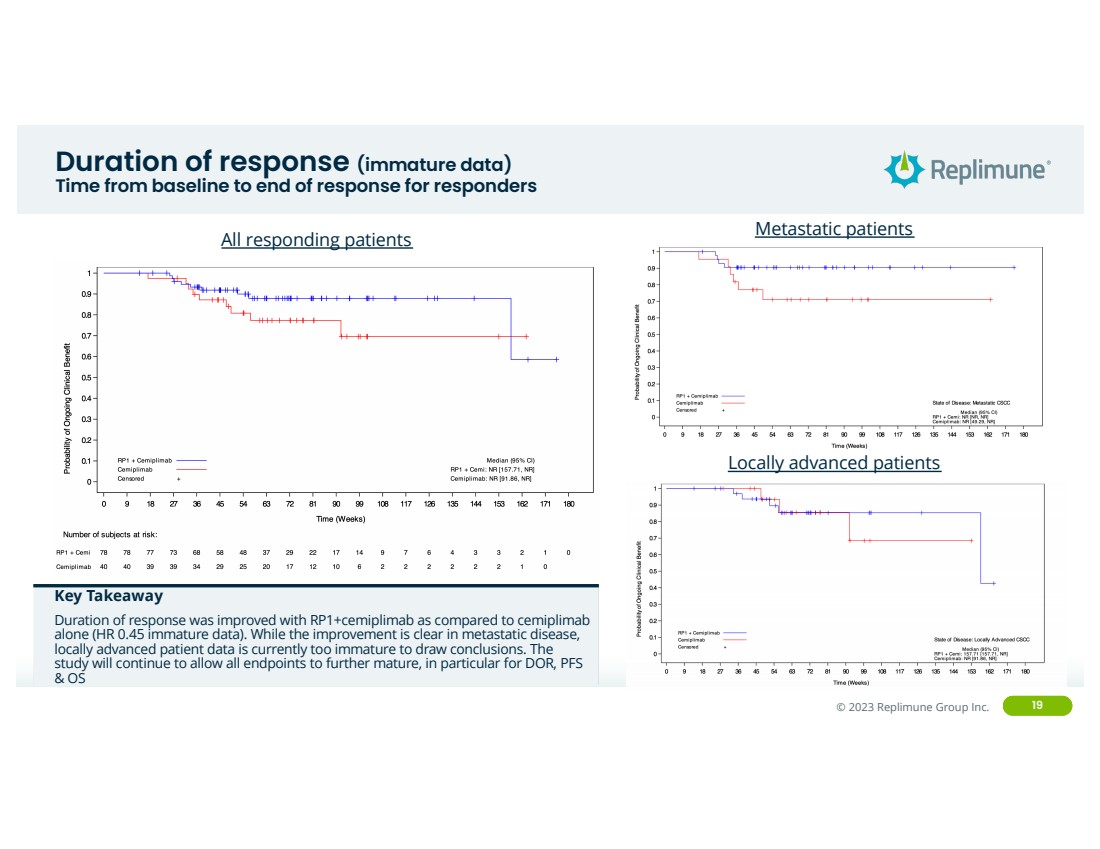
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 19 反应持续时间(未成熟数据) 反应者从基线到反应结束的时间 所有反应患者 关键要点 与单独使用塞米普利单抗 相比,使用RP1+塞米普利单抗可以改善反应时间(HR 0.45 未成熟数据)。尽管转移性疾病的改善显而易见,但 局部晚期患者数据目前尚不成熟,无法得出结论。 研究将继续使所有终点进一步成熟,特别是对于 DOR、PFS 和 OS 转移患者 局部晚期患者 |
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 20 CERPASS-后续步骤 CERPASS • CERPASS 在展示治疗效果时未达到主要终点 • 缓解期限 • 所有基于时间的终点都不成熟(DOR、PFS 和操作系统),将持续到成熟 • 确定是否提交申请或提交申请所需的成熟数据 compendia 的上市策略是有根据的 |
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 21 CSCC/NMSC ARTACUS STUDY 中其他未满足的需求 • 治疗患皮肤癌的高风险免疫受损人群 • 抗PD1的使用可能导致移植物流失 • RP1 单一疗法;35% ORR (N=23) IGNYTE Anti-PD1 失效 NMSC • 没有获得美国食品药品管理局批准的抗PD1失效的CSCC/NMSC的选项;大约70%的接受治疗的患者最终仍能取得进展 • RP1 + nivo 30% ORR(N=30) 1Lam JKS 等人Head Neck。2018;40:985-992。2Friman T 等人Int J Cancer. 2022; 150 (11): 1779-91。3Marin-Acevedo 等人 Cancers 2023, 15 (12), 3180 |
| 议程 © 2023 Replimune Group Inc. RP1 商业机会 |
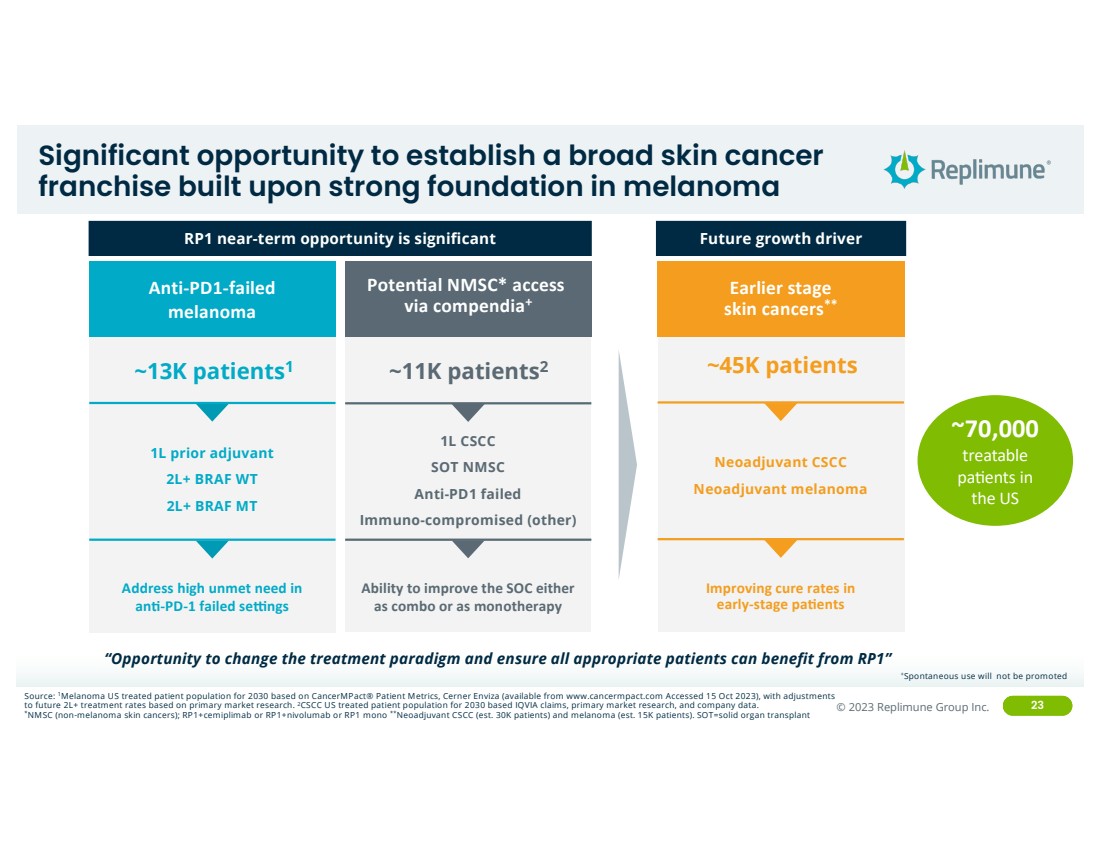
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 23 在黑色素瘤的坚实基础上建立广泛的皮肤癌 特许经营权的重大机遇 未来增长动力 ~1.3万名患者1 能够以组合或单一疗法改善 SOC 满足 ang-PD-1 失败 sekngs } Poten0al NMSC* 通过 compendia+ 1L 先期辅助剂 2L+ BRAF WT 2L+ BRAF MT ~45K 患者 提高 早期 pAgents 的治愈率 早期阶段 皮肤癌** 抗 PD1 失败 黑色素瘤 1L CSCC SOT NMSC 抗 PD1 失效 免疫受损(其他) 新辅助性黑色素瘤 新辅助黑色素瘤 RP1 近期机会巨大 来源:1根据CancermPact® 患者指标,美国2030年黑色素瘤接受治疗的患者群体,Cerner Enviza(可从 CancermPact® 患者指标获得)www.cancermpact.com(2023年10月15日访问),根据主要市场研究,对未来的2L+治疗率进行了调整。2CSCC基于IQVIA索赔、主要市场研究和公司数据,对2030年的治疗患者群体进行了调整。*NMSC(非黑色素瘤皮肤癌);rp1+cemiplimab 或 rp1+nivolumab 或 RP1 mono **新辅助CSCC(大约 3 万名患者)和黑色素瘤(大约 1.5 万名患者)。sot=固体器官移植 “有机会改变治疗模式,确保所有合适的患者都能从 RP1 中受益” ~70,000 可治疗 pa; 美国 +不提倡自发使用 |
| © 2023 Replimune Group Inc. 24 投资制造业以支持 的全面商业化 • 占地 63,000 平方英尺的最先进的 GMP 制造设施 • CMO 的 RP1-2 技术转让成功完成 • RP1 在可比性分析后向临床发布 • RP1 BLA 一致性批量运行完成 • 规模预计将足以涵盖所有 Replimune 产品的全球商业化 满负荷的候选人 • 具有商业吸引力的商品成本和 “现成” 产品 实用性 商业 商业 已建立内部规模 制造 |
| © 2022 Replimune Group Inc. 25 议程 © 2023 Replimune Group Inc. RP2 更新 |
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 26 RP2 利用 Replimune 的平台表达 抗 CTLA-4 • 抗 CTLA-4 可防止 APC/T 细胞界面的免疫阻滞 § 抗 CTLA-4 已通过临床验证;Ipilimumab、tremelimumab • RP2 在多种免疫不敏感的情况下显示出持久的单一疗法反应肿瘤类型 § 唾液腺癌 § 脊索瘤 § 葡萄膜黑色素瘤 § 食管癌 • 2L 葡萄膜黑色素瘤中有 30% ORR (N=17),持续时间长 § 计划进行随机对照试验;罕见的基础疾病策略 • 罕见的头颈部癌症 • 肉瘤 • HPV 相关;外阴、肛门 |
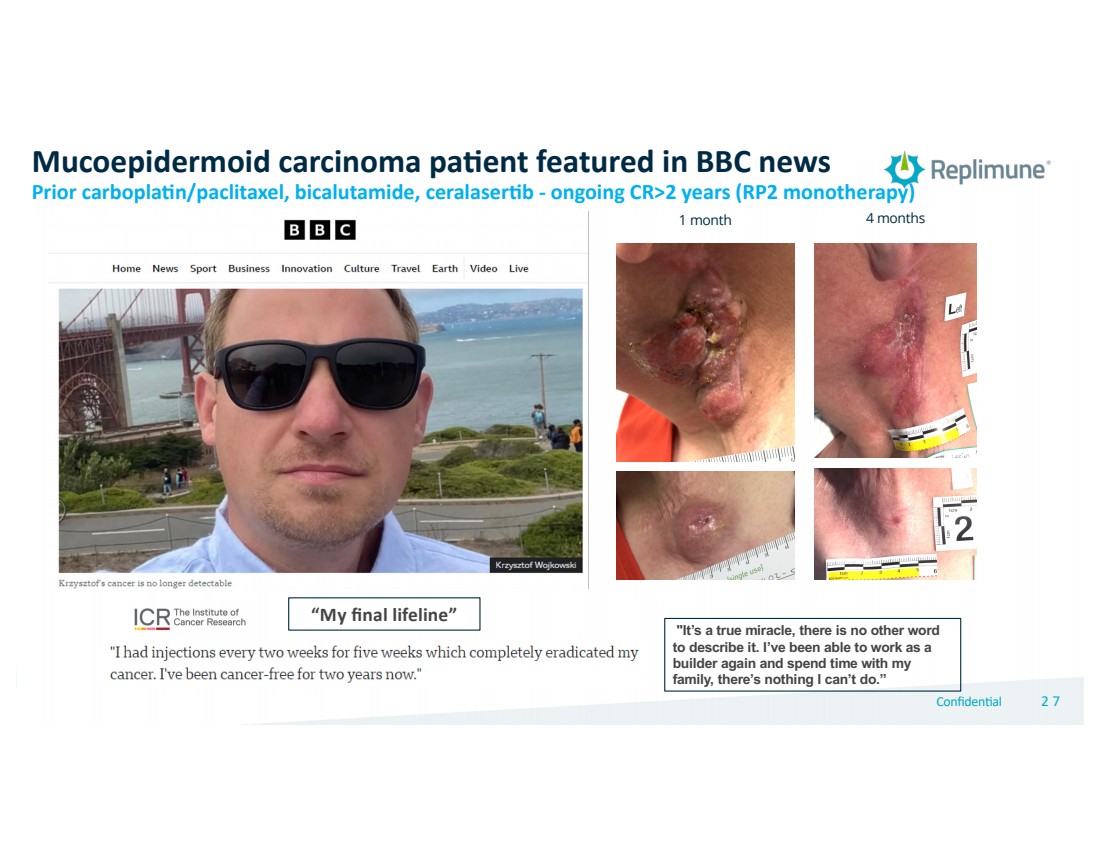
| © 2022 Replimune Group Inc. Confiden'al 272 7 “这是个真正的奇迹,没有其他词可以形容它了。我能够再次担任 建筑商并与我的 家人共度时光,没有什么我做不到的。” “我的最后生命线” 英国广播公司新闻报道的粘表皮样癌 pa.ent Prior carbopla+n/紫杉醇、比卡鲁胺、ceralaser+b——持续 CR>2 年(RP2 单一疗法) 1 个月 4 个月 |
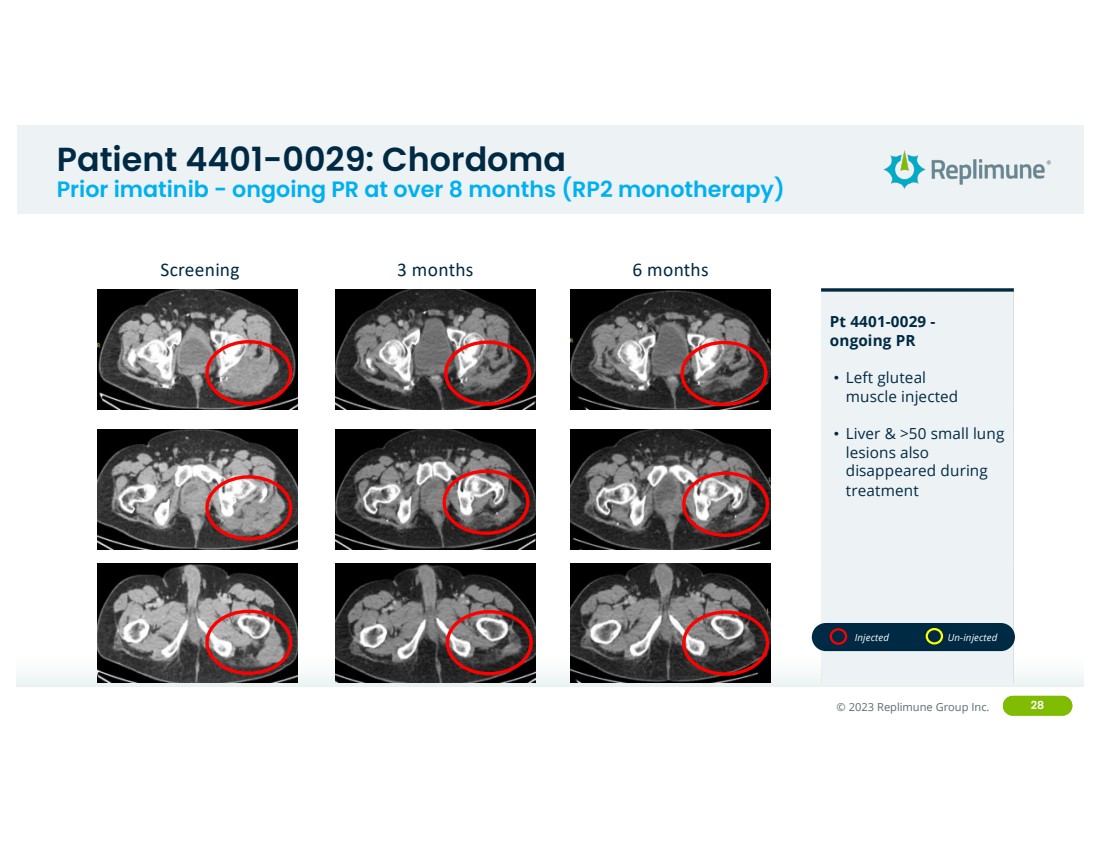
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 28 位患者 4401-0029:脊索瘤 Prior imatinib-8 个月以上的持续公关(RP2 单一疗法) - 正在进行的 PR • 注射左臀部 肌肉 • 肝脏和 >50 个小肺 病变 在 治疗期间消失 筛查 3 个月 6 个月 注射未注射 |
| © 2022 Replimune Group Inc. Confiden'al 292 9 pa.ent 4401-0029:脊索瘤 Prior ima+nib-持续 PR 超过 8 个月(RP2 单一疗法) - 正在进行的 PR • 注射左臀肌 病变 • 肝脏和 >50 个小肺 病变 br} 在 治疗期间消失 注射未注射 基线 3 个月 6 个月 |
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 30 RP2 在葡萄膜黑色素瘤中 1Carvajal RD 等人Br J Othalmol 2017;2Nathan P 等人N Engl J Med. 2021;385 (13): 1196-1206;3Pelsterms 等人J Clin Oncol. 2021;39 (6): 599-607;4Lukzky J 等人 SMR 2022; * 与研究人员的选择相比,pembrolizumab、ipilimumab 或达卡巴嗪 • 眼部或 “葡萄膜” 黑色素瘤是一种罕见的癌症,每年在美国约有 1,000 例1 • 起源于黑色素细胞并且可能发生在多个眼部位 • 历史平均操作系统约为 12 个月1 • 葡萄膜黑色素瘤的行为与皮肤 黑色素瘤 完全不同 • 主要转移到肝脏(约占病例的 70-90%),一旦发生这种情况,这些患者中只有大约 10% 的存活时间超过一年 • A在 CPI 此前表现出有限的 活性有限的情况下难以治疗肿瘤2,3,4 • Kimmtrak(tebentafusp)是 HLA-A-02:01 阳性成年患者(约占总人口的 50%)中首款获准治疗葡萄膜黑色素瘤的药物* • 葡萄膜黑色素瘤患者未得到满足的需求仍然很高, 包括疗效提高/耐受性, HLA 阴性患者的有效选择,以及 Kimmtrak 和抗 PD1 失败患者的选择 |
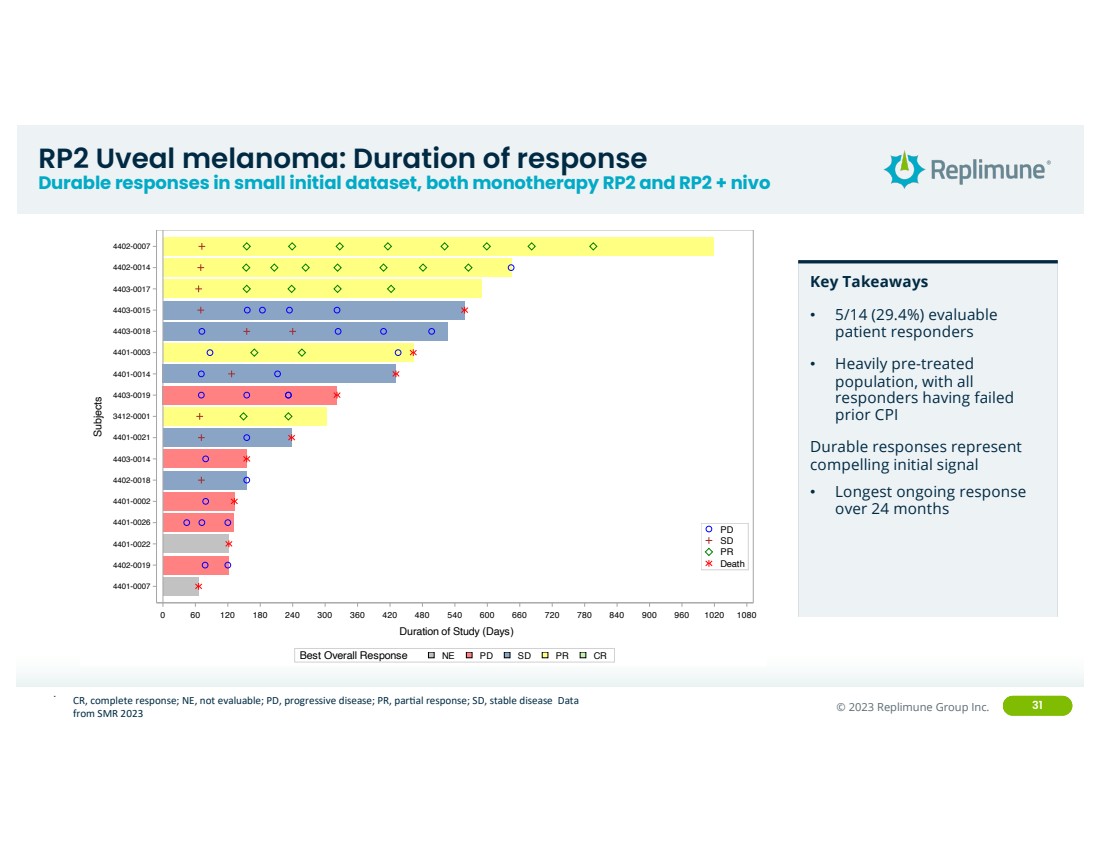
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 31 RP2 葡萄膜黑色素瘤:反应持续时间 小型初始数据集中的耐久反应,包括单一疗法 RP2 和 RP2 + nivo 。 0 60 120 180 240 300 360 420 480 540 600 660 720 780 840 900 960 1020 1080 学习时间(天) 4401-0007 4402-0019 4401-0022 4401-0026 4401-0026 4402-0018 4403-0014 4401-0021 4403-0019 4401-0014 4401-0014 4401-0014 4401-0014 4401-0019 4401-0014 4401-0014 4401-0014 4401-0019 4401-0014 4401-0014 4401-0014 4401-0014 4401-0019 4401-0014 4401-0014 4401-0014 4401-0014 4401-0014 4400003 4403-0018 4403-0015 4403-0017 4402-0014 4402-0007 受试者 死亡 PR SD PD PD 最佳总体反应 NE PD SD PR CR Replimune 研究编号RP2-001-18 图:研究时间(眼部黑色素瘤:Uveal) 关键要点 • 5/14 (29.4%) 可评估 患者反应者 • 经过大量预处理的 人群,所有 反应者都失败了 之前的 CPI 耐久反应代表 令人信服的初始信号 • 24 个月内最长的持续反应 } CR,完全反应;NE,不可评估;PD,进行性疾病;PR,pareAl 反应;SD,稳定疾病数据 来自 SMR 2023 |
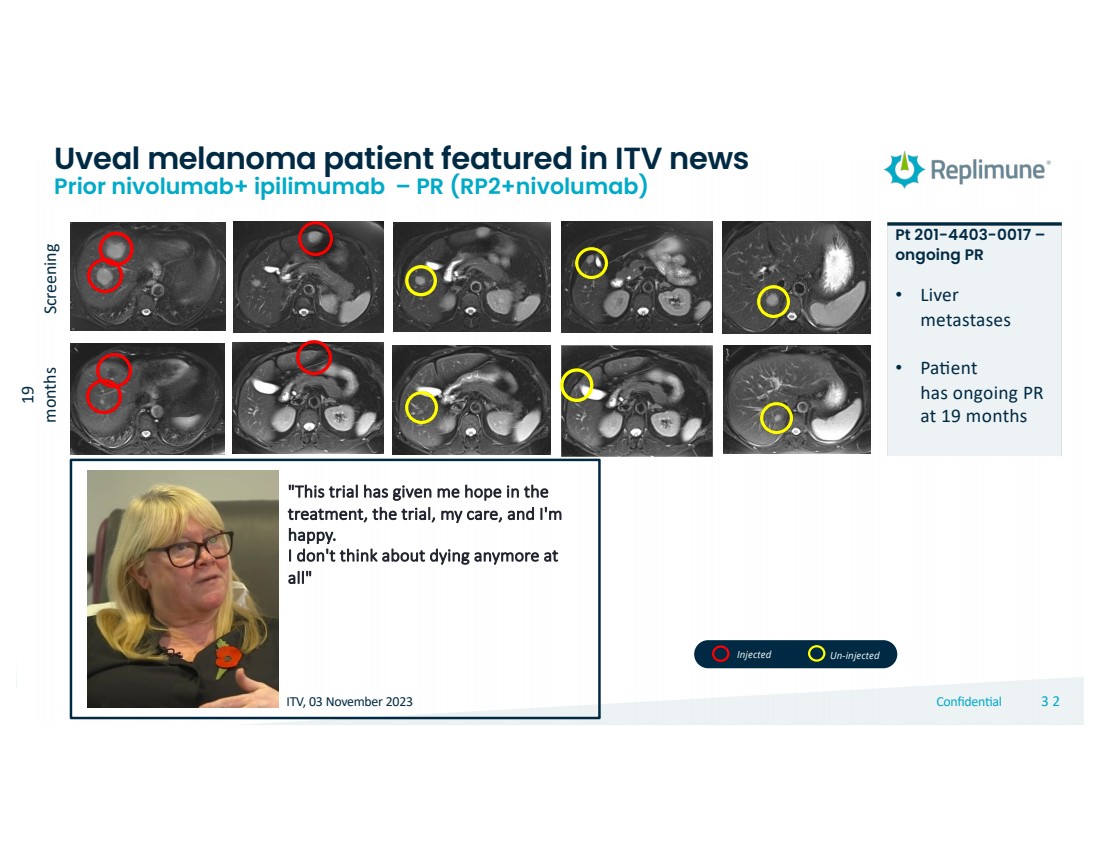
| © 2022 Replimune Group Inc. Confiden'al 323 2 筛查 19 个月 Pt 201-4403-0017 — 正在进行的 PR • 肝脏 在 19 个月时持续 PR 在 ITV 新闻中报道的葡萄膜黑色素瘤患者 Prior nivolumab+ ipilimumab — PR (rp2+nivolumab) “这个试验给了我希望 治疗、试验、我的护理,我感到非常高兴。 我不想再死在 了” ITV,2023 年 11 月 3 日注射未注射 |
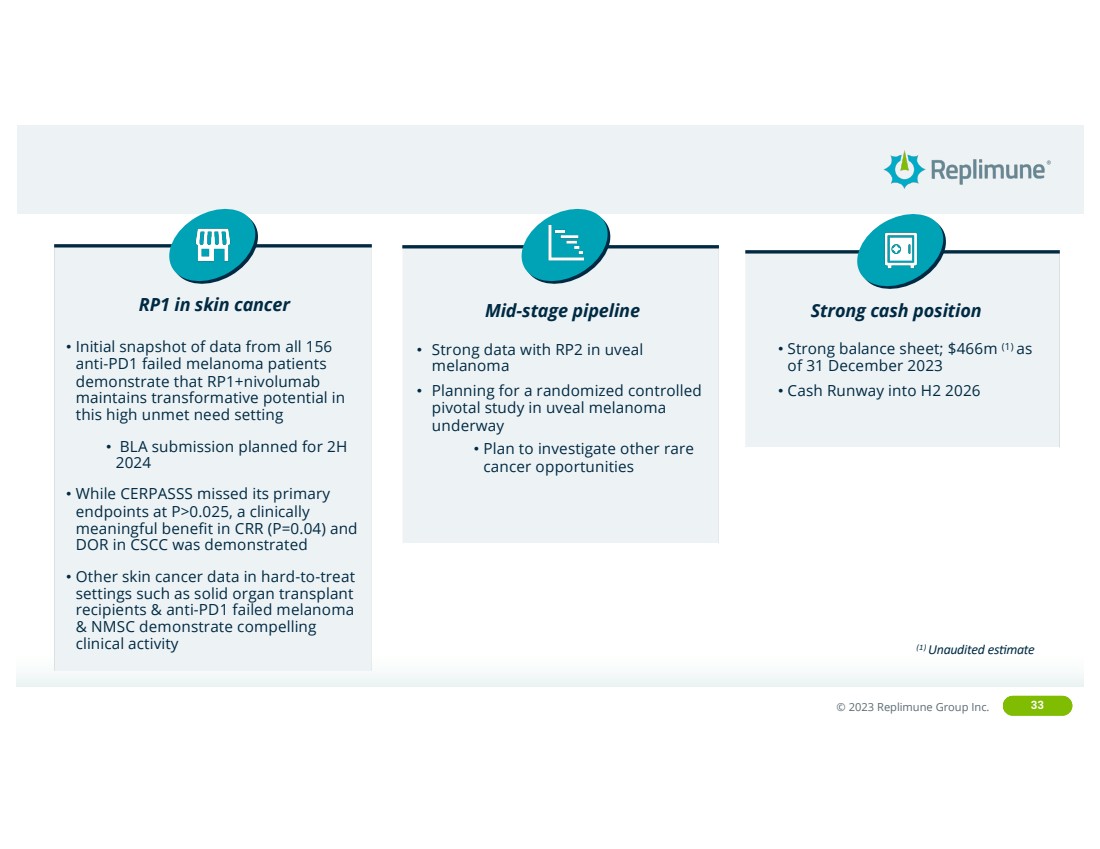
| ©© 2022 Replimune Group Inc. 2023 Replimune Group Inc. 33 RP1 in skin cancer Mid-stage pipeline Strong cash position • Strong balance sheet; $466m (1) as of 31 December 2023 • Cash Runway into H2 2026 • Initial snapshot of data from all 156 anti-PD1 failed melanoma patients demonstrate that RP1+nivolumab maintains transformative potential in this high unmet need setting • BLA submission planned for 2H 2024 • While CERPASSS missed its primary endpoints at P>0.025, a clinically meaningful benefit in CRR (P=0.04) and DOR in CSCC was demonstrated • Other skin cancer data in hard-to-treat settings such as solid organ transplant recipients & anti-PD1 failed melanoma & NMSC demonstrate compelling clinical activity • Strong data with RP2 in uveal melanoma • Planning for a randomized controlled pivotal study in uveal melanoma underway • Plan to investigate other rare cancer opportunities (1) Unaudited es,mate |
| MISSION To enable tumor directed oncolytic immunotherapy (TDOI) to become a cornerstone in the treatment of cancer VISION To deliver transformational results for patients across cancers using tumor directed oncolytic immunotherapy to induce a powerful and durable systemic anti-tumor immune response resulting in quality survival and a chance for a cure THANK YOU |