
免疫肿瘤学公司的条件活性抗体 | 2024 年 1 月附录 99.1

免责声明本演示文稿由 Sensei Biotherapeutics, Inc.(“公司”、“我们”、“我们”)编写,仅供参考。此处列出的信息并不声称完整,也不包含您可能想要的所有信息。除非另有说明,否则此处包含的 声明均自本演示之日起作出,在任何情况下,本演示文稿的交付或任何证券出售均不暗示此处包含的 信息在该日期之后的任何时候都是正确的,或者该信息将进行更新或修改,以反映随后可用的信息或在本演示之日之后发生的变化。本演示文稿 包含独立方以及我们对市场份额和其他行业数据所做的估算和其他统计数据。本演示文稿还包含 “前瞻性” 陈述,该术语在1995年《私人 证券诉讼改革法》中定义,这些陈述基于我们管理层的信念和假设以及管理层目前可获得的信息。这些前瞻性陈述包括但不限于对候选产品的 开发和潜在治疗益处的预期;包括 SNS-101 在内的候选产品的预期安全性、药代动力学和疗效概况;我们 SNS-101 1/2 期临床试验 的预期临床数据发布时间;扩大1期临床试验以包括更多特定肿瘤类型的患者;以及我们认为我们现有的现金和现金等价物将足以提供资金至少我们的业务进入 2025 年第四季度 ,并进入 SNS-101 的 2 期临床研究的中途。在本演示中,“设计为”、“可能”、“相信”、“打算”、“预期”、“计划”、“估计”、“期望”、“应该”、“假设、” “继续”、“可能”、“将”、“未来” 等词语和短语以及这些或类似术语和短语的否定部分旨在识别前瞻性陈述。前瞻性陈述涉及已知和未知的风险、不确定性和其他因素,这些因素可能 导致我们的实际业绩、业绩或成就与前瞻性陈述所表达或暗示的任何未来业绩、业绩或成就存在重大差异。可能导致 实际结果存在重大差异的风险和不确定性包括候选治疗产品开发中固有的不确定性,例如临床前发现和开发;临床试验的进行和相关监管要求,包括延迟或 停止对Sensei候选产品进行任何临床试验的风险;先前结果,例如安全性、活性或效果持久性信号,从临床前试验和临床试验的早期结果中观察到的风险 SNS-101, 不会在涉及Sensei候选产品(包括 SNS-101)的正在进行或将来的研究或临床试验中重复或不会继续;我们对第三方的依赖,但我们可能并不总是能完全控制的;与 支出估计、资本要求和额外融资需求的准确性有关的风险;以及我们在2023年11月7日左右向美国证券交易委员会提交的10-Q表季度报告和我们提交的 其他定期报告中描述的其他风险和不确定性与美国证券交易委员会合作。前瞻性陈述仅代表我们管理层截至本演示之日的信念和假设,并包括所有非历史事实的事项。我们未来的实际结果可能与我们的预期有重大差异。除非法律要求,否则即使将来有新的信息,我们也没有义务公开更新这些前瞻性陈述,也没有义务更新实际结果可能与 前瞻性陈述中预期的结果存在重大差异的原因。本演示文稿中包含的某些信息涉及或基于从第三方 来源获得的研究、出版物、调查和其他数据以及公司自己的内部估计和研究。尽管公司认为截至本演示文稿之日这些第三方来源是可靠的,但它尚未独立核实,也没有对从第三方来源获得的任何信息的 充足性、公平性、准确性或完整性做出任何陈述。此外,本演示文稿中包含的所有市场数据都涉及许多假设和局限性,无法保证 此类假设的准确性或可靠性。最后,尽管我们认为自己的内部研究是可靠的,但此类研究尚未得到任何独立来源的证实。

公司亮点 Sensei Bio 的 专有平台旨在利用独特的酸性肿瘤微环境来扩大治疗窗口,实现有前景的肿瘤靶标 SNS-101 的可药性是该公司的主要资产,靶向 VISTA,这是一种 T 细胞功能的关键阴性 调节剂和有前景的免疫检查点靶标 SNS-101 目前正处于 1 期临床测试,迄今为止的数据显示出极具吸引力的安全性,可能还具有一流的药代动力学另外三个 早期候选药物的现金流进入了2025 年第四季度,预计将为 SNS-101 第二阶段研究中途的运营提供资金。预期的近期里程碑包括 2024 年第二季度的 1 期单一疗法主要数据

拥有 抗体肿瘤学成功历史的领导团队艾琳·科尔根首席财务官约翰·塞莱比,工商管理硕士总裁兼首席执行官克里斯托弗·格里,法学博士副总裁,总法律顾问爱德华·范德霍斯特博士首席科学官斯蒂芬妮·克雷布斯,理学硕士,工商管理硕士首席商务官 Ron Weitzman,医学博士首席医学官(兼职)
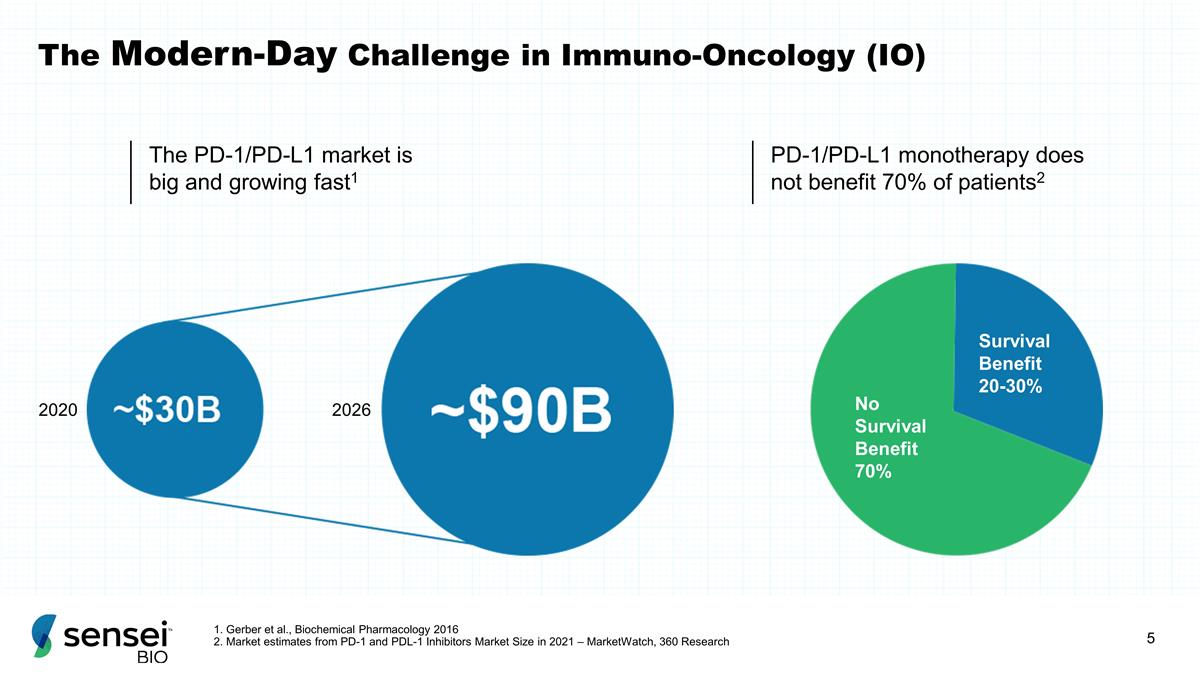
PD-1/PD-L1市场庞大, 增长快速1 PD-1/PD-L1单一疗法并未使70%的患者受益2 2020 2026 生存受益 20-30% 无生存益处 70% 无生存益处 70% 免疫肿瘤学的现代挑战(IO)1。Gerber 等人,《2016 年生化药理学》2.来自 2021 年 PD-1 和 PDL-1 抑制剂市场规模的市场估计 — MarketWatch,360 Research
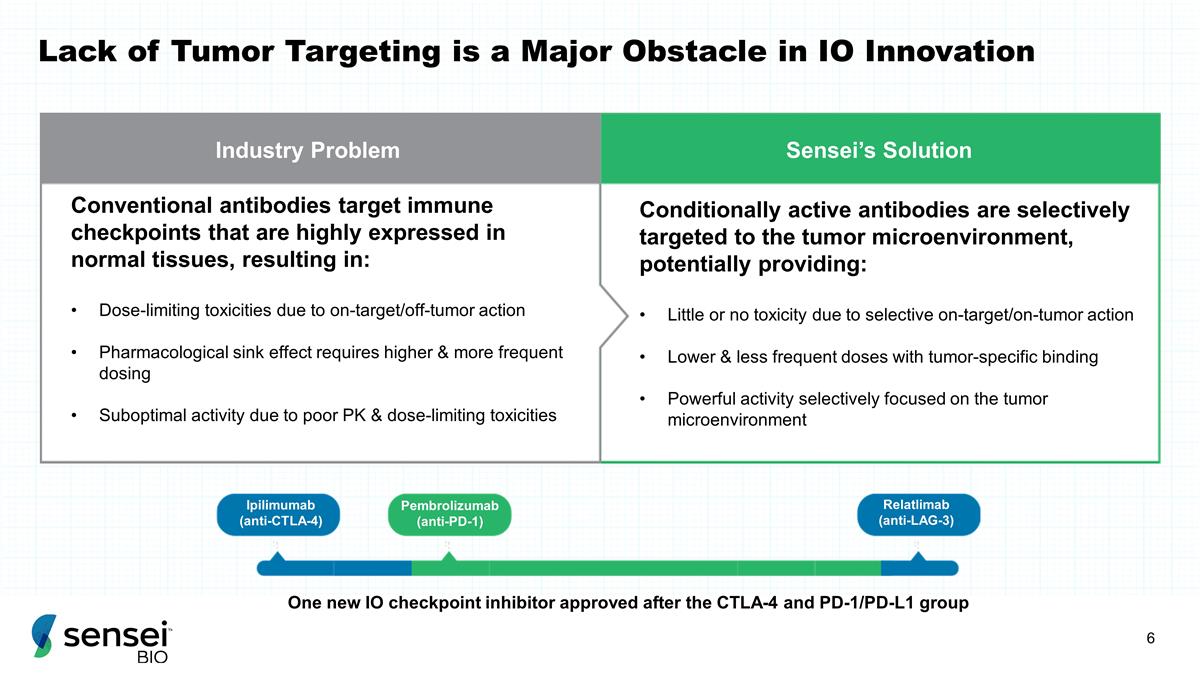
行业问题 Sensei 的 解决方案常规抗体靶向在正常组织中高度表达的免疫检查点,导致:由于靶向/非肿瘤作用而导致剂量限制药理沉降效应需要更高、更频繁的剂量 由于 PK 和剂量限制毒性不佳,活性不佳;有条件地活性抗体选择性靶向肿瘤微环境,可能具有:由于选择性非靶向而产生的毒性很小或根本没有 /对抗肿瘤的作用降低 和减少肿瘤特异性剂量结合选择性地聚焦肿瘤微环境的强大活性在 CTLA-4 和 PD-1/PD-L1 组之后获得批准的一种新的 IO 检查点抑制剂缺乏肿瘤靶向是 IO 创新的主要障碍 Ipilimumab(抗 CTLA-4)Pembrolizumab(抗 PD-1)Relatlimab(抗 Lag-3)
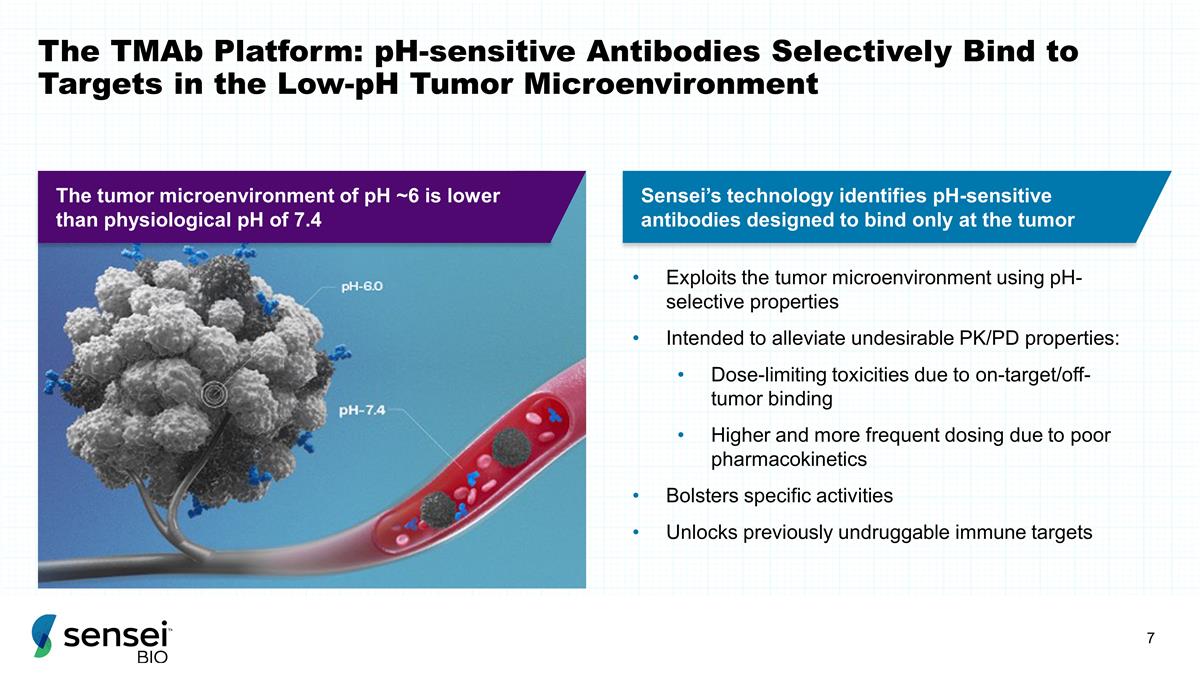
TMAb 平台:pH 敏感 抗体在低 pH 值肿瘤微环境中选择性结合靶标利用 pH 值选择性特性利用肿瘤微环境旨在缓解不良的 PK/PD 特性: 非靶向/非肿瘤结合导致剂量限制由于药代动力学不佳而导致剂量更高、更频繁的剂量增强特异活性解锁先前不可药物的免疫靶标 Sensei 的技术可识别出更高、更频繁的剂量 pH 敏感抗体设计仅在肿瘤 处结合 pH ~6 的肿瘤微环境低于生理 pH 值为 7.4
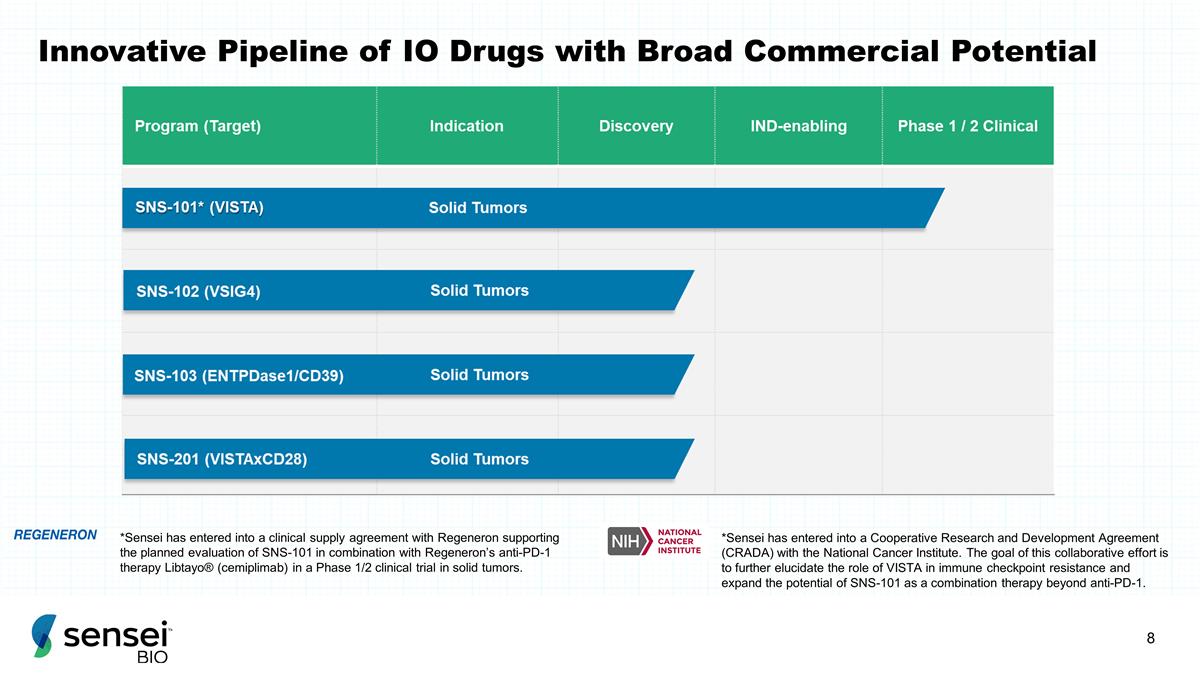
具有 广泛商业潜力的创新IO药物管道*Sensei已与Regeneron签订了临床供应协议,支持计划在实体瘤的1/2期临床 试验中对 SNS-101 与再生元的抗 PD-1 疗法 Libtayo®(cemiplimab)联合进行评估。*Sensei已与美国国家癌症研究所签订了合作研发协议(CRADA)。这项合作的目标是进一步阐明 VISTA 在免疫检查点 耐药性中的作用,并扩大 SNS-101 作为抗PD-1以外的联合疗法的潜力。
SNS-101 (VISTA)
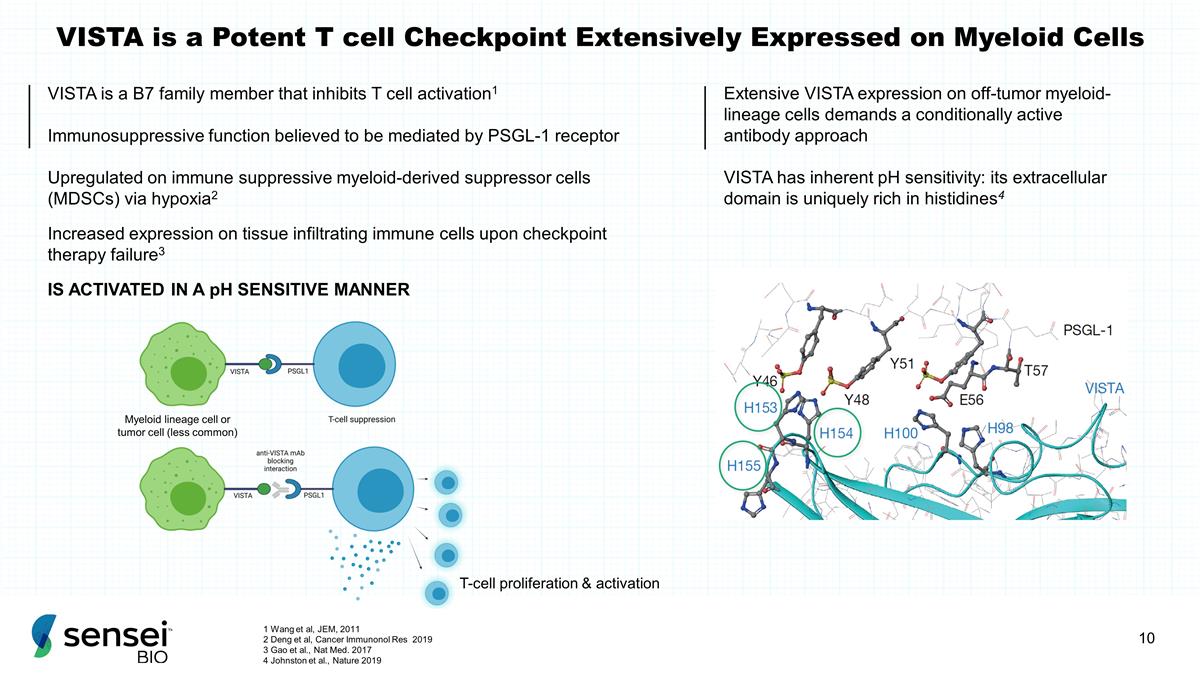
VISTA 是一种强效的 T 细胞检查点 广泛表达于骨髓细胞 VISTA 是 B7 家族成员,可抑制 T 细胞激活1 据信由 PSGL-1 受体介导的免疫抑制功能通过缺氧对免疫抑制性髓系衍生抑制细胞 (MDSC) 进行上调2 检查点治疗失败后组织浸润免疫细胞的表达增加3 在 A 中被激活 pH 敏感方式 T 细胞增殖和激活 VISTA 在非肿瘤髓系细胞上大量表达 VISTA 需要有条件的活性抗体方法 VISTA 具有固有的 pH 敏感性:其细胞外结构域特别富含组氨酸4 骨髓谱系细胞或肿瘤细胞(不太常见)1 Wang 等人,JEM,2011 2 Deng 等人,《癌症免疫学研究 2019 3 Gao 等人,Nat Med。2017 4 Johnston 等人,Nature 2019
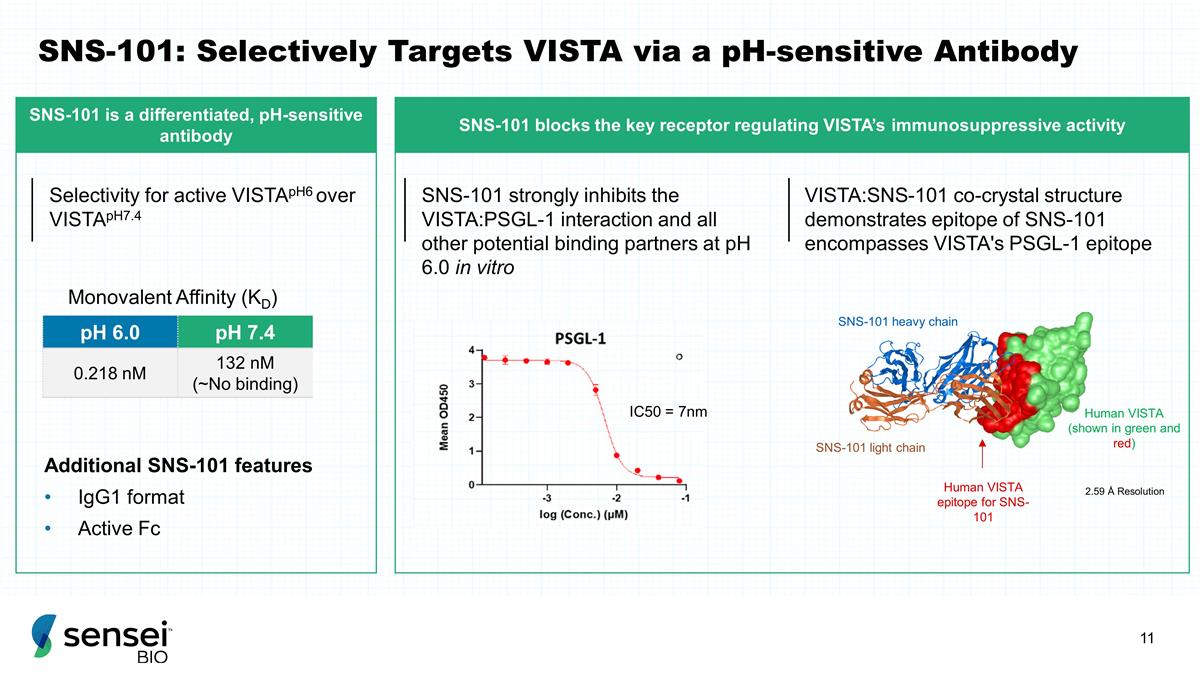
SNS-101:通过 pH 敏感抗体 pH 6.0 选择性靶向 VISTA pH 7.4 0.218 nM 132 nM(~无结合)其他 SNS-101 特性 IgG1 格式活性 Fc 单价亲和力 (KD) SNS-101 在体外 pH 6.0 下强烈抑制 VISTA: PSGL-1 和所有其他潜在的 结合伙伴 IC50 = 7nm 2.59 Å 分辨率 SNS-101 重链 SNS-101 轻链人类 VISTA(以绿色和红色显示)) 人类 VISTA 表位对活性 VistaPH6 的选择性优于 vistaph7.4 的 SNS-101 选择性 VISTA: SNS-101 共晶结构演示了 SNS-101 的表位包括VISTA 的 PSGL-1 表位 SNS-101 是一种差异化的 pH 敏感抗体 SNS-101 可阻断调节 VISTA 免疫抑制活性的关键受体
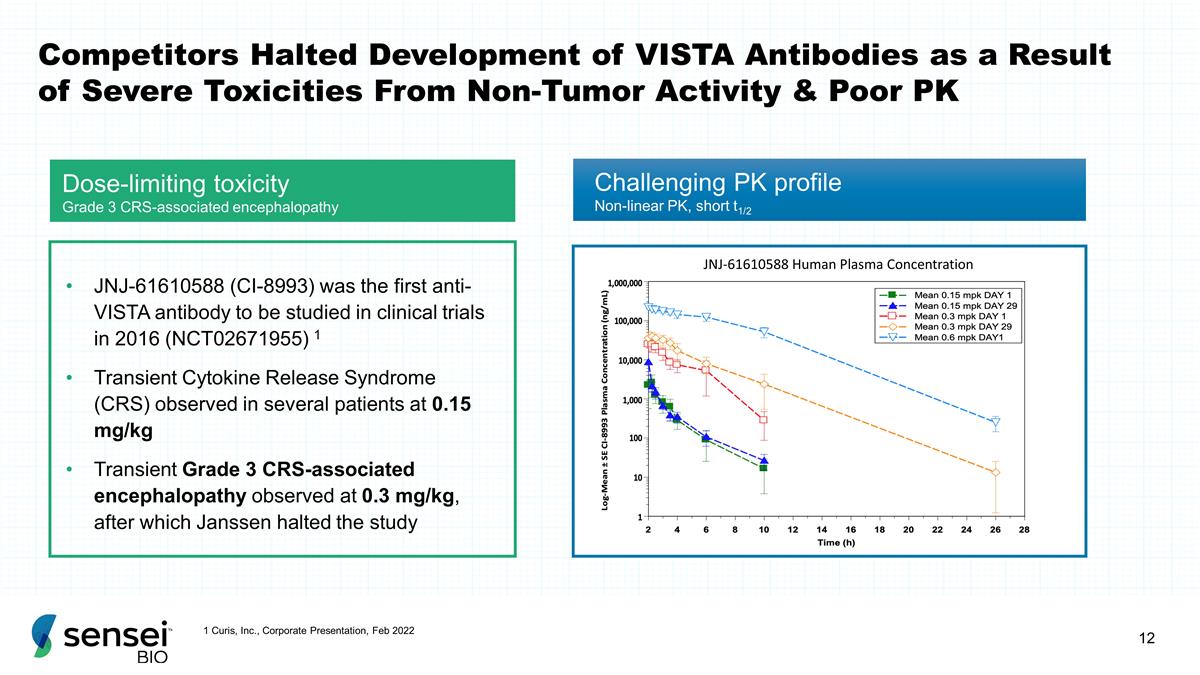
由于非肿瘤活性严重毒性和 PK 不佳,竞争对手停止了 VISTA 抗体的开发 3 级 CRS 相关脑病 JNJ-61610588 人类血浆浓度 JNJ-61610588 (CI-8993) 是 2016 年临床试验中第一个研究的 抗体 (NCT02671955) 1 短暂性细胞因子释放综合征 (CRS) 在几名患者中观察到 0.15 mg/kg 瞬时性 3 级 CRS 相关性在 0.3 mg/kg 时观察到脑病,之后詹森停止了研究 具有挑战性的 PK 分布非线性PK,空头 t1/2 1 Curis, Inc.,公司介绍,2022年2月

SNS-101 旨在克服 VISTA 的独特挑战潜在的同类最佳安全性和 PK 概况得到初步临床数据支持,未观察到 CRS 或剂量限制毒性,也没有证据表明通过 3 mg/kg 单一疗法进行靶向介导药物处置* 作为单一药物并与 PD-1 抑制剂 Libtayo® 联合应用的美国多中心研究 Libtayo® 首款预计剂量为治疗剂量的 Vista 阻断抗体在没有 引起剂量限制毒性的情况下具有相关性**实现 VISTA 的 “第一”现场差异化设计和机制 IgG1,旨在选择性地阻断酸性肿瘤微环境中的VISTA的FC活性抗体预期的近期临床 里程碑 2024 年第一季度的初始组合 PK/安全性数据 2024 年第二季度的单一疗法剂量递增数据 2024 年第三季度顶级组合剂量递增数据 2024 年底前的初始剂量扩展数据 *截至2023 年 10 月 3 日的数据截止日期 **预计与治疗相关的临床剂量约为根据临床前研究,3mg/kg 或更高
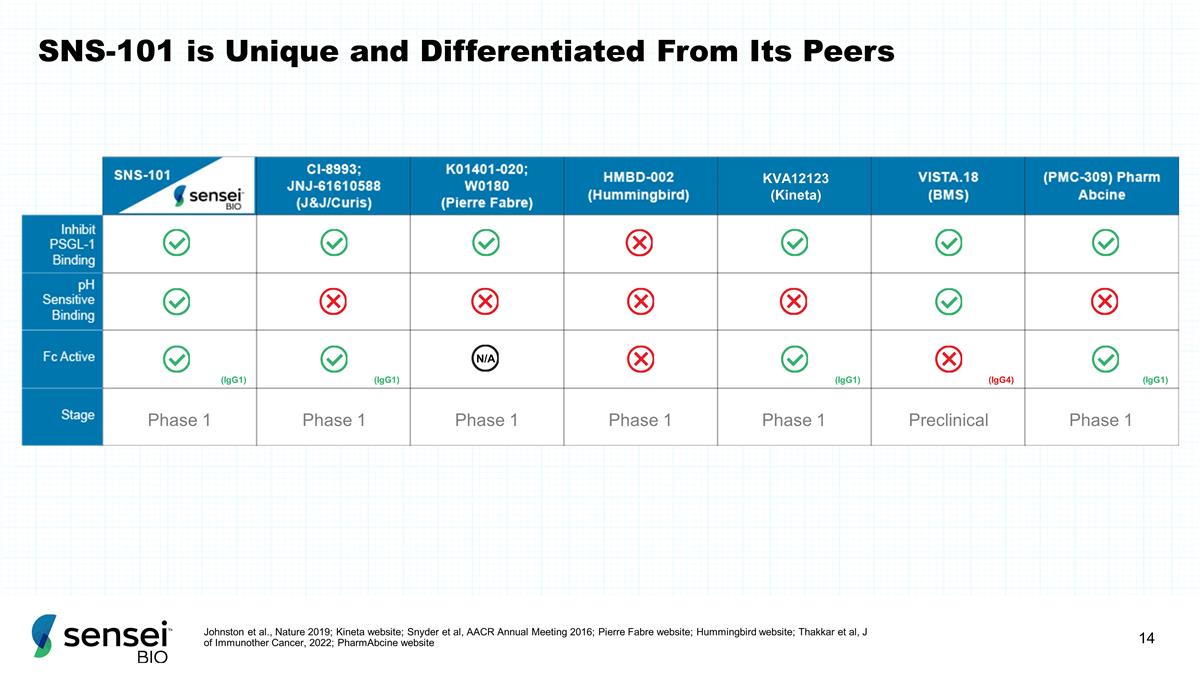
SNS-101 独一无二, 与同行不同 Johnston 等人,《2019 年自然》;Kineta 网站;Snyder 等人,2016 年 AACR 年会;皮尔法伯网站;Thakkar 等人,《免疫其他癌症杂志》,2022年;PharmAbcine 网站 KVA12123(Kineta)第 1 阶段 1 期 1 期临床前 1 期 (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) (IgG1) 1) (IgG4) (IgG1)
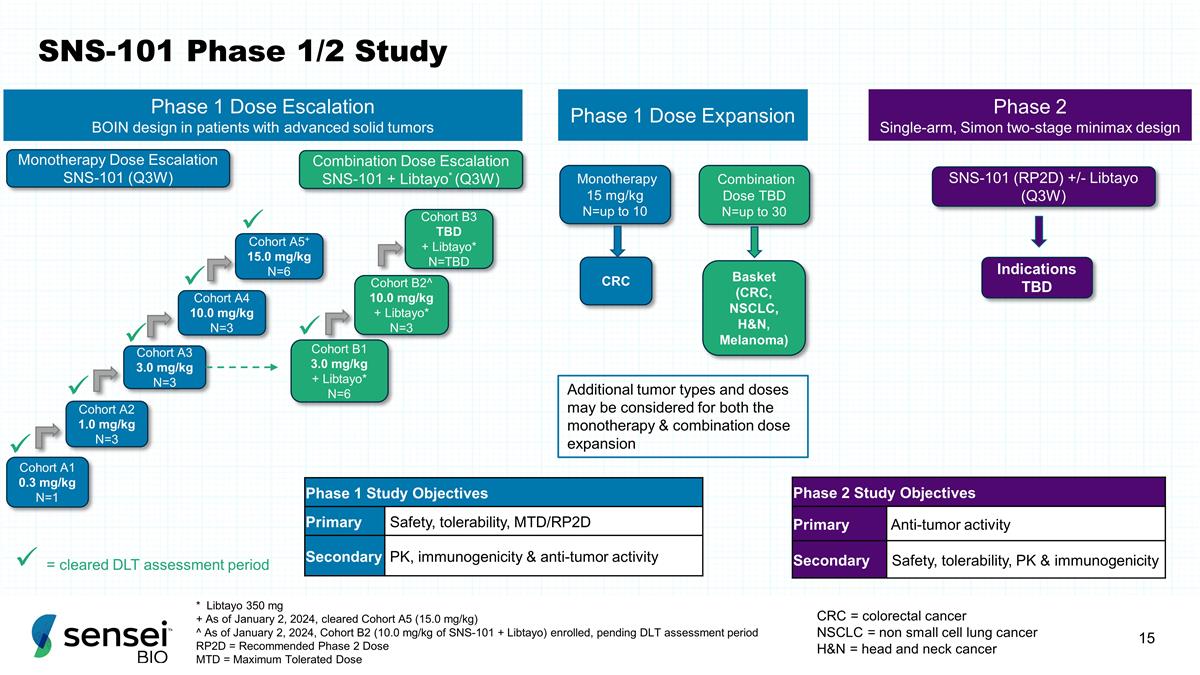
SNS-101 1/2 期研究 * Libtayo 350 mg + 截至 2024 年 1 月 2 日,已批准队列 A5(15.0 mg/kg)^ 截至 2024 年 1 月 2 日,B2 队列(10.0 mg/kg SNS-101 + Libtayo)入组,待定 DLT 评估期 RP2D = 推荐的 2 期剂量 MTD = 最大耐受剂量 A1 0.3 mg/kg N=1 队列 B1 3.0 mg/kg + Libtayo * N=6 队列 A2 1.0 mg/kg N=3 队列 A3 3.0 mg/kg N=3 队列 A4 10.0 mg/kg N=3 队列 A5+ 15.0 mg/kg N=6 队列 B2^ 10.0 mg/kg + Libtayo* N=3 队列 B3 待定 + Libtayo* N=TBD 单一疗法 15 mg/kg N=最多 10 种组合剂量待定 n=最多 30 CRC 篮子(CRC、NSCLC、H&N、黑色素瘤)单一疗法剂量递增 SNS-101 (Q3W) 组合剂量递增 SNS-101 + Libtayo* (Q3W) 1 期剂量扩展阶段 1 剂量递增 BOIN 设计针对 晚期实体瘤患者 ü ü ü ü 1 期研究目标主要安全性、耐受性、MTD/RP2D 二级 PK、免疫原性和抗肿瘤活性 2 期单臂,西蒙两阶段 minimax design SNS-101 (RP2D) +/- Libtayo (Q3W) 适应症待定 2 期研究目标主要抗肿瘤活性次要安全性、耐受性、PK 和免疫原性 CRC =结直肠癌 NSCLC = 非小细胞肺癌 H&N = 头颈癌 ü ü ü = 已通过的 DLT 评估期限单一疗法和联合剂量扩大均可考虑其他肿瘤类型和剂量
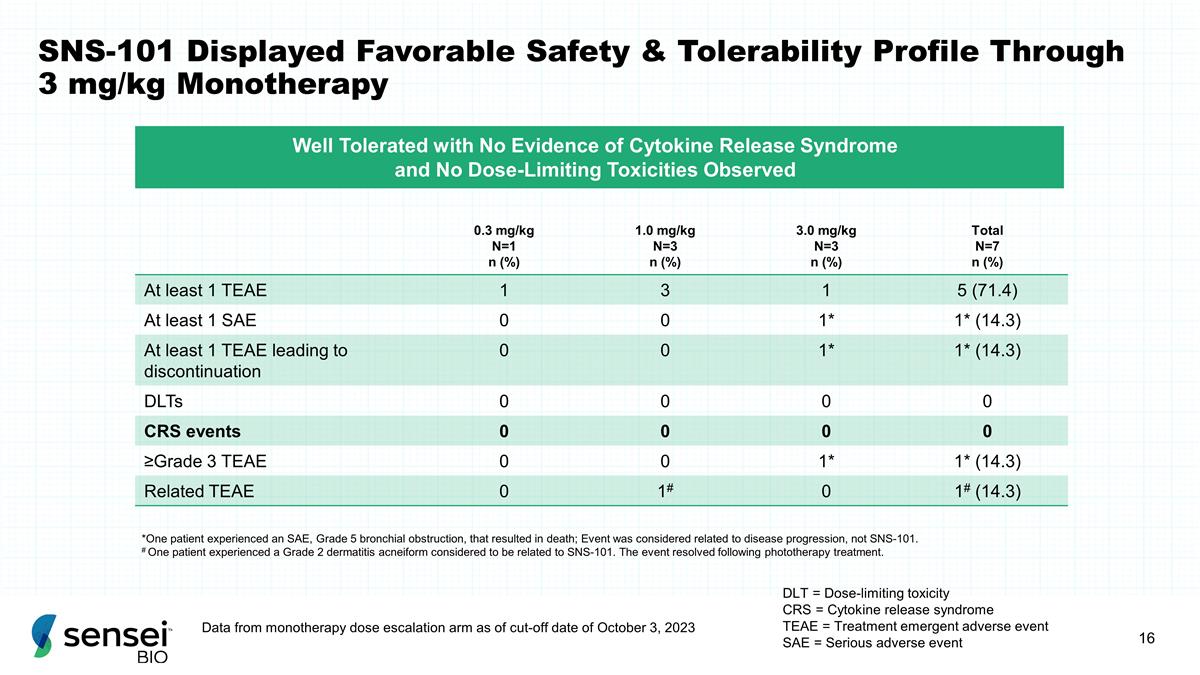
SNS-101 通过 3 mg/kg 单一疗法表现出良好的安全性 和耐受性 DLT = 剂量限制毒性 CRS = 细胞因子释放综合征 TEAE = 治疗紧急不良事件 SAE = 严重不良事件 0.3 mg/kg N=1 n (%) 1.0 mg/kg N=3 n (%) 总计 N=7 n (%) 至少 1 TEAE 1 3 1 5 (71.4) 至少 1 个 SAE 0 0 1* 1* (14.3) 至少 1 个 TEAE 导致停药 0 0 1* 1* (14.3) DLT 0 0 0 0 ≥ 3 级 TEAE 0 0 1* 1* (14.3) 相关的 TEAE 0 1# 0 1# (14.3) *一名患者 出现了 SAE,5 级支气管梗阻,导致死亡;该事件被认为与疾病进展有关,而不是 SNS-101。# 一名患者患有被认为与 SNS-101 有关的 2 级痤疮样皮炎。光疗治疗后,事件 得到了解决。耐受性良好,没有细胞因子释放综合征的证据,也没有剂量限制毒性。截至2023年10月3日截止日期,来自单一疗法剂量递增组的数据
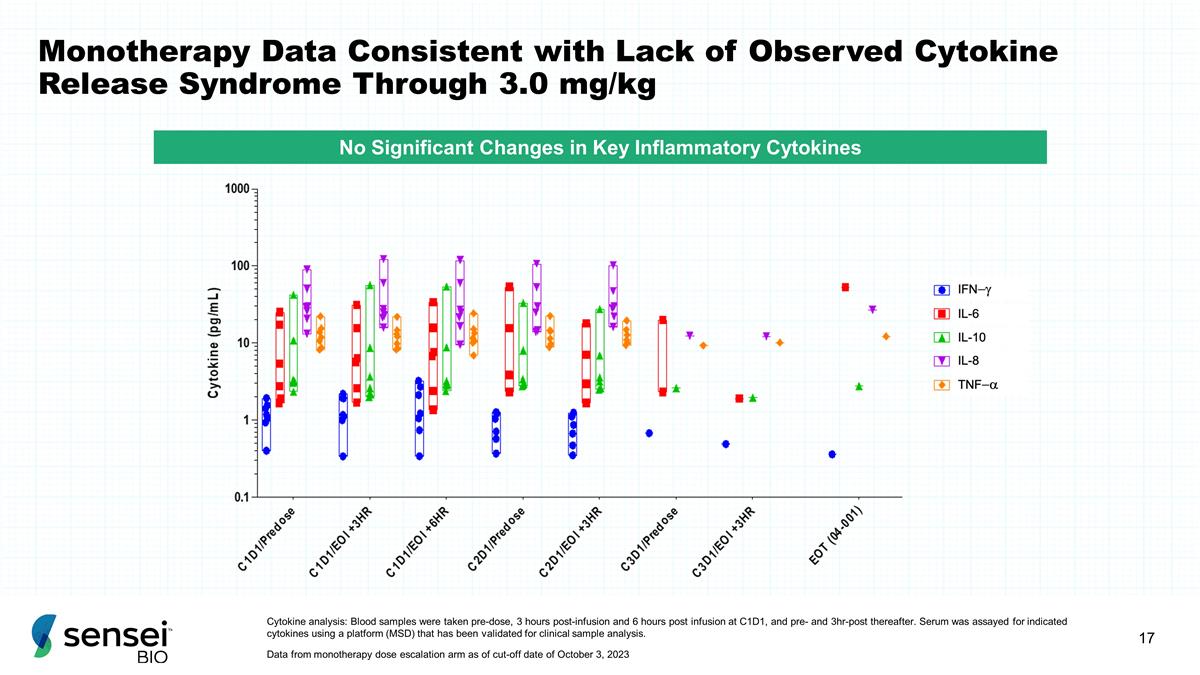
通过 3.0 mg/kg 细胞因子分析,单一疗法数据与 缺乏观察到的细胞因子释放综合征一致:在给药前、输液后 3 小时和输液后 6 小时在 C1D1 采集血液样本,以及之后在 3 小时之前和之后 3 小时采集血液样本。使用经临床样本分析验证的平台(MSD)对血清中是否存在指定的细胞因子 进行了检测。截至2023年10月3日截止日期,来自单一疗法剂量递增组的数据关键炎性细胞因子没有显著变化
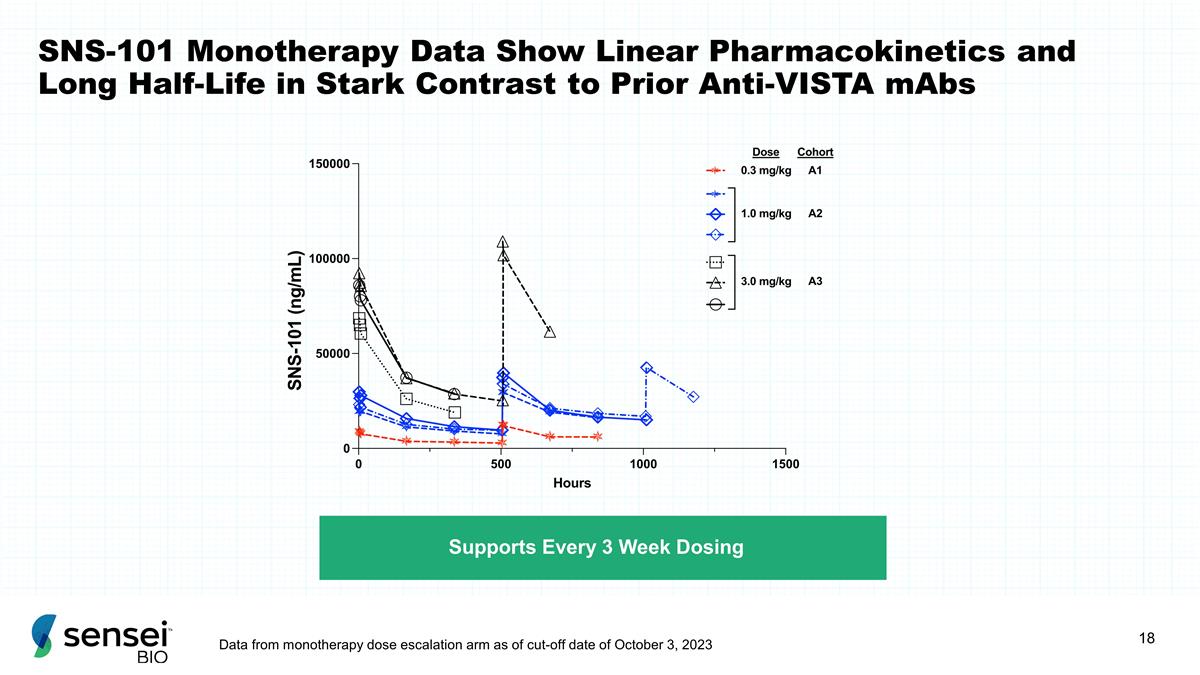
SNS-101 单一疗法数据显示 线性药代动力学和较长的半衰期与之前的抗 Vista mAb 形成鲜明对比的是,截止日期 2023 年 10 月 3 日,来自单一疗法剂量递增组每 3 周的剂量数据
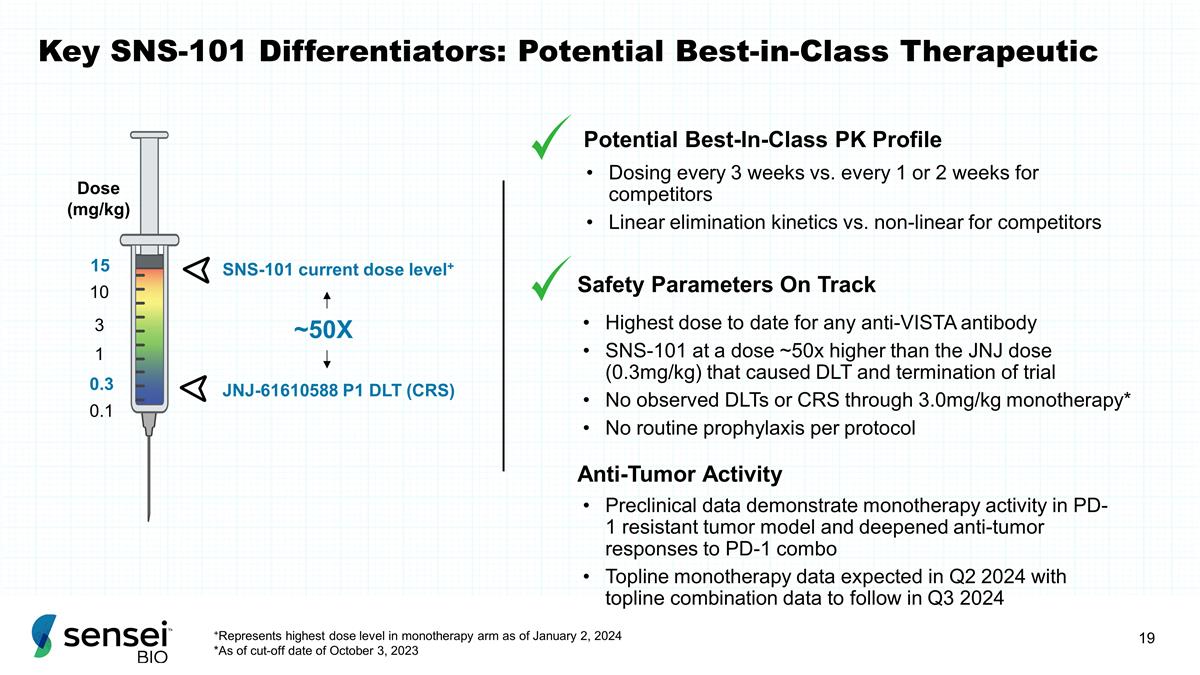
SNS-101 的关键差异化因素: 潜在的同类最佳治疗 0.1 剂量 (mg/kg) 0.3 3 10 1 JNJ-61610588 P1 DLT (CRS) SNS-101 当前剂量水平+ 约 50X 15 剂量对比竞争对手每 1 或 2 周给药一次 安全参数任何抗 Vista SNS-101 抗体的最高剂量,剂量比 JNJ 剂量高约 50 倍 (0.3mg/gg) kg) 导致 DLT 和试验终止的 3.0mg/kg 单一疗法未观察到 DLT 或 CRS * 没有根据协议进行常规 预防措施潜在的最佳疗法类别PK概况 +代表截至2024年1月2日单一疗法组的最高剂量水平 *截至2023年10月3日的截止日期,抗肿瘤活性临床前数据显示PD-1耐药肿瘤模型中的单一疗法活性以及对PD-1组合的抗肿瘤反应加深 Topline单一疗法数据预计将在2024年第二季度公布,顶线组合数据将在2024年第三季度公布
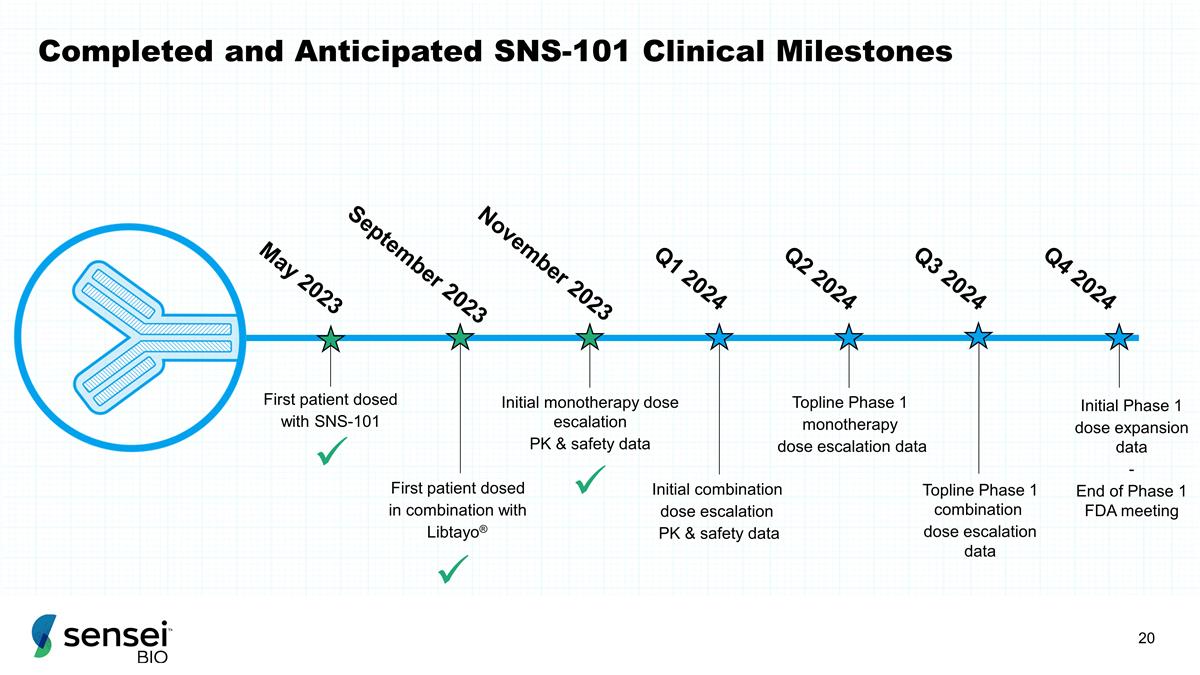
已完成和预期的 SNS-101 临床里程碑首例患者给药 SNS-101 的首位患者与 Libtayo® 联合给药的初始单一疗法剂量递增 PK 和安全性数据 Topline 1 期单一疗法剂量递增数据 Topline 1 期组合剂量递增数据初始第 1 阶段剂量递增数据-2023 年 5 月 2023 年 11 月 FDA 会议结束 2024 年第 3 季度 2024 年第 1 季度 2024 年第 1 季度第 1 季度 br} ü ü

SNS-102 (VSIG-4)
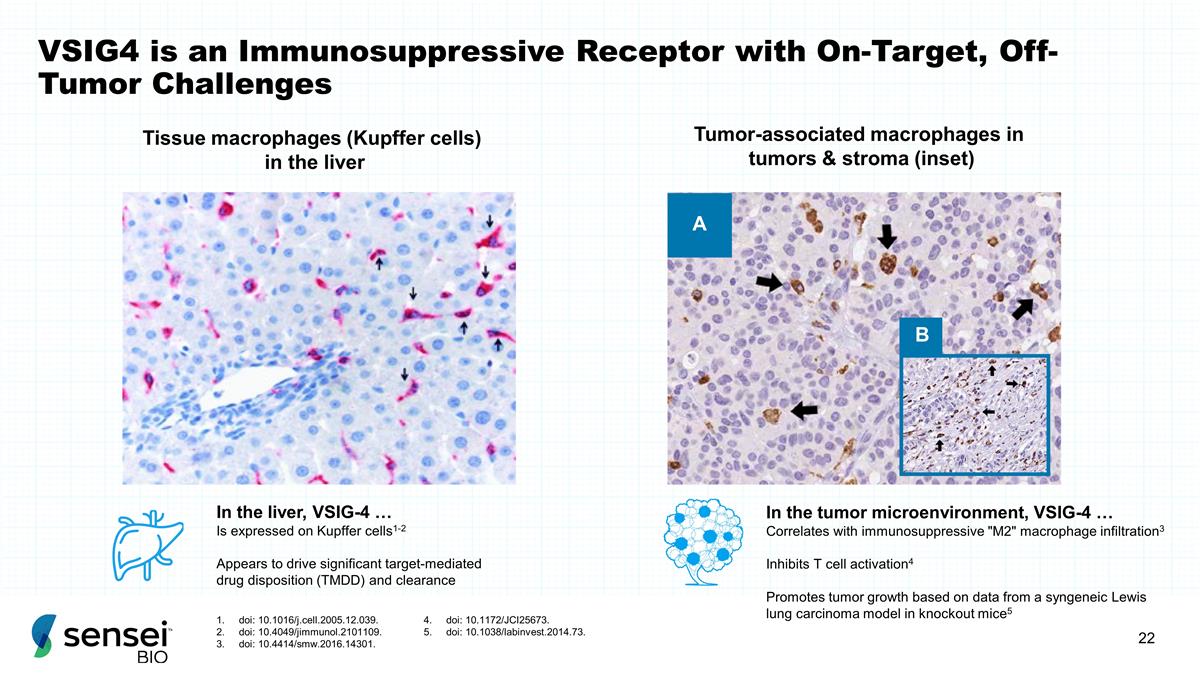
A B 组织巨噬细胞(Kupffer 细胞)肿瘤和基质中的肿瘤相关巨噬细胞(插图)在肝脏中,VSIG-4... 在 Kupffer 细胞上表达 1-2 似乎能推动显著的靶介导药物处置(TMDD)和清除在肿瘤 微环境中,VSIG-4... 与免疫抑制性 “M2” 巨噬细胞浸润相关3 抑制 T 细胞根据基因敲除小鼠中的同源刘易斯肺癌模型的数据,activation4 促进肿瘤生长。5 VSIG4 是一种 免疫抑制受体,具有靶向、非肿瘤挑战 doi: 10。1016/j.cell.2005.12.039. doi:10.4049/jimmunol.2101109. doi:10.4414/smw.2016.14301. doi:10.1172/JCI25673。doi:10.1038/labinvest.2014.73。
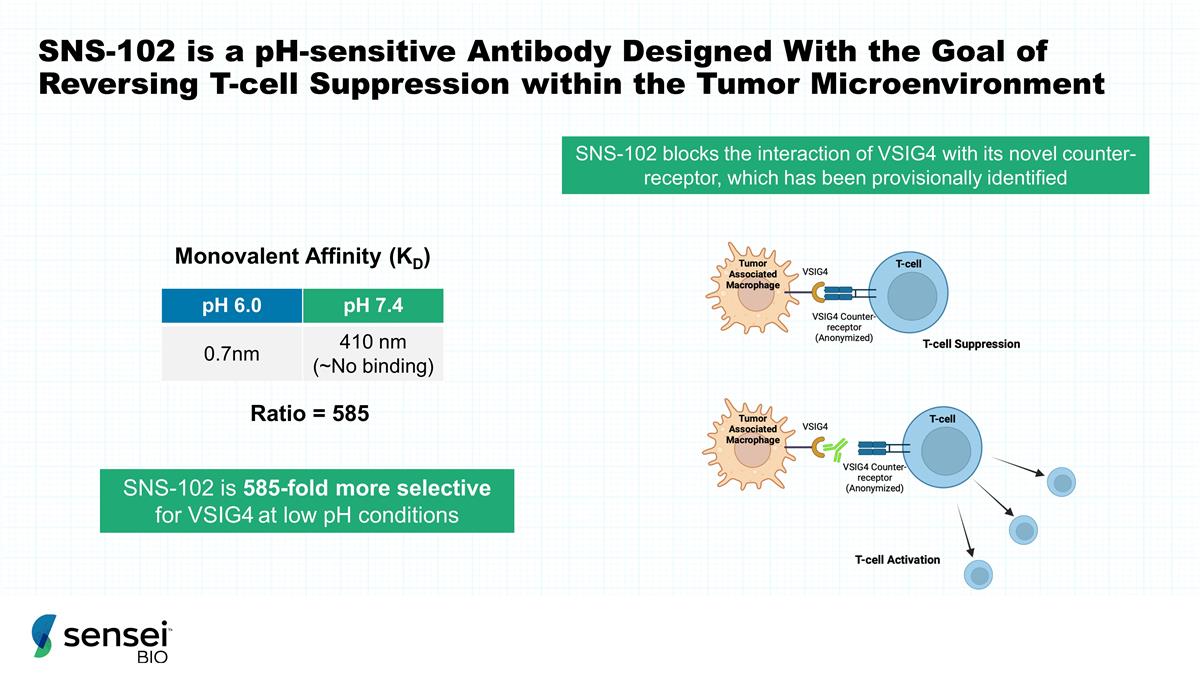
SNS-102 是一种 pH 敏感抗体 设计的目的是逆转肿瘤微环境中 T 细胞的抑制 SNS-102 阻断 VSIG4 与其新型反受体的相互作用,后者已初步确定 SNS-102 在 低 pH 条件下对 VSIG4 的选择性高 585 倍 pH 6.0 pH 7.4 0.7nm 410 nm(~无结合)单价亲和力 (KD) 比 = 585

SNS-103 (entpdase1/CD39)
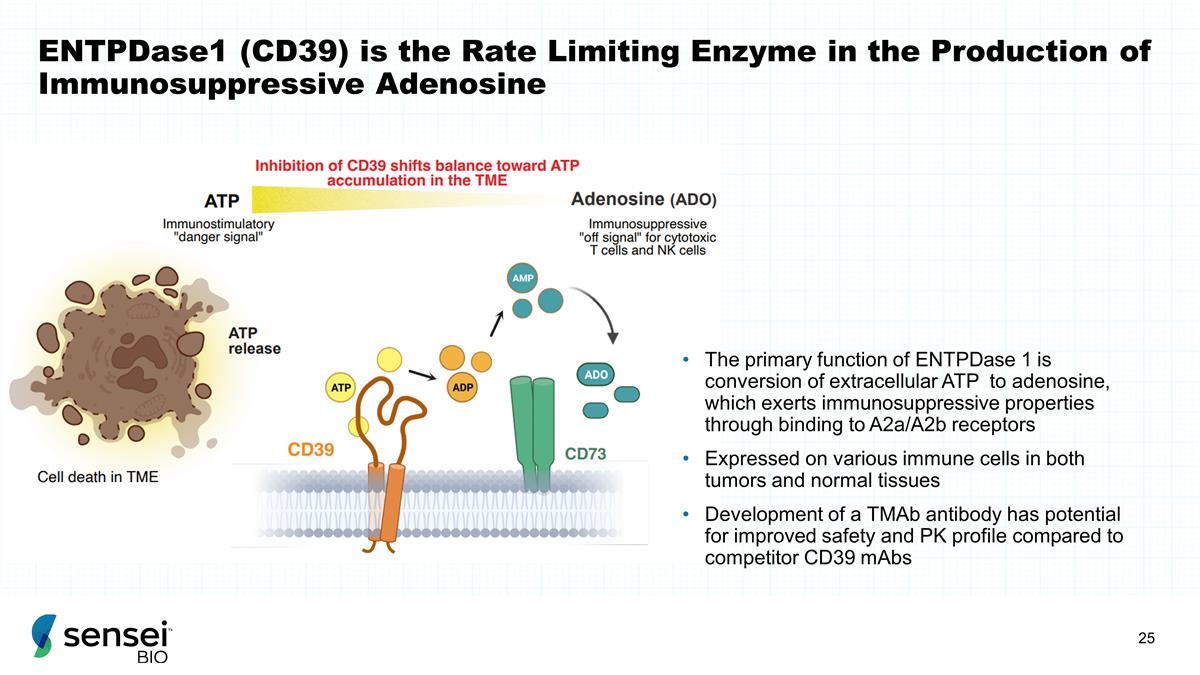
EntpDase1 (CD39) 是产生免疫抑制性腺苷的速率 限制酶 Entpase 1 的主要功能是将细胞外 ATP 转化为腺苷,腺苷通过与 A2A/A2b 受体结合发挥免疫抑制特性,表达在 肿瘤和正常组织中的各种免疫细胞上 TMAB 抗体的开发有可能提高安全性和 PK 与竞争对手 CD39 mAB 相比的概况

SNS-201 (VistaxCD28)
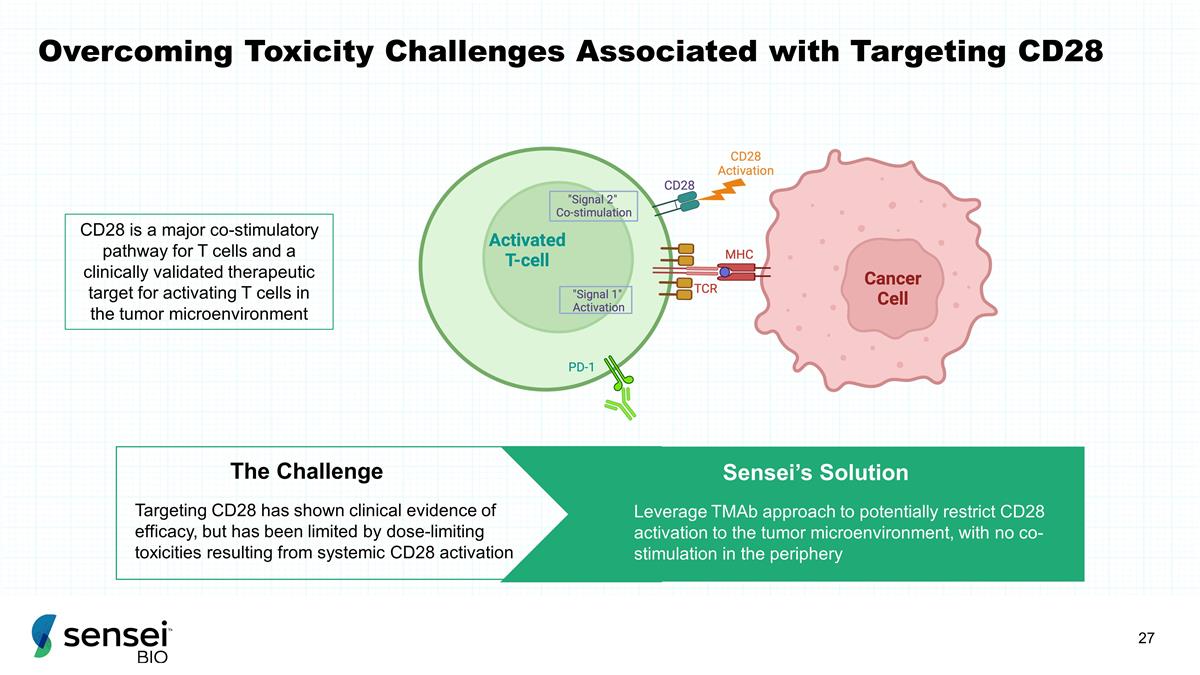
克服毒性挑战 与靶向CD28相关的毒性挑战已显示出疗效的临床证据,但受到全身CD28激活产生的剂量限制毒性的限制。Challenge Sensei的解决方案利用tMAb方法 可能会限制肿瘤微环境中CD28的激活,而外周没有共刺激 CD28 是T细胞的主要共刺激途径,也是经过临床验证的激活T细胞的治疗靶标在肿瘤 微环境中
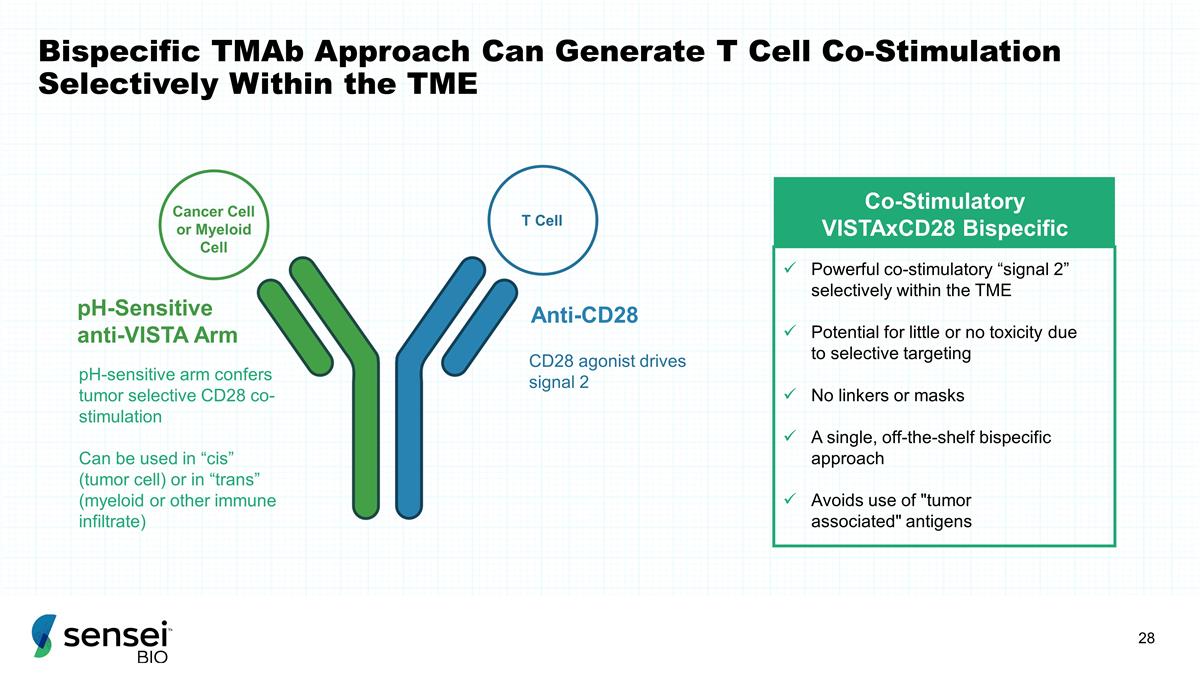
双特异性 tMAB 方法可在 TME 共刺激剂 VistaxCD28 内选择性地产生 T 细胞共刺激 VistaxCD28 双特异性强效共刺激 “信号 2” 由于选择性靶向可能几乎没有毒性没有连接剂或 口罩单一的、现成的双特异性方法避免使用 “肿瘤相关” 抗原抗 CD28 pH 敏感抗Vista Arm Cell 或骨髓细胞 T 细胞 pH 敏感臂可提供肿瘤选择性 CD28 协同刺激 可用于 “顺式”(肿瘤细胞)或 “反式”(髓系或其他免疫)潜入) CD28 激动剂驱动信号 2
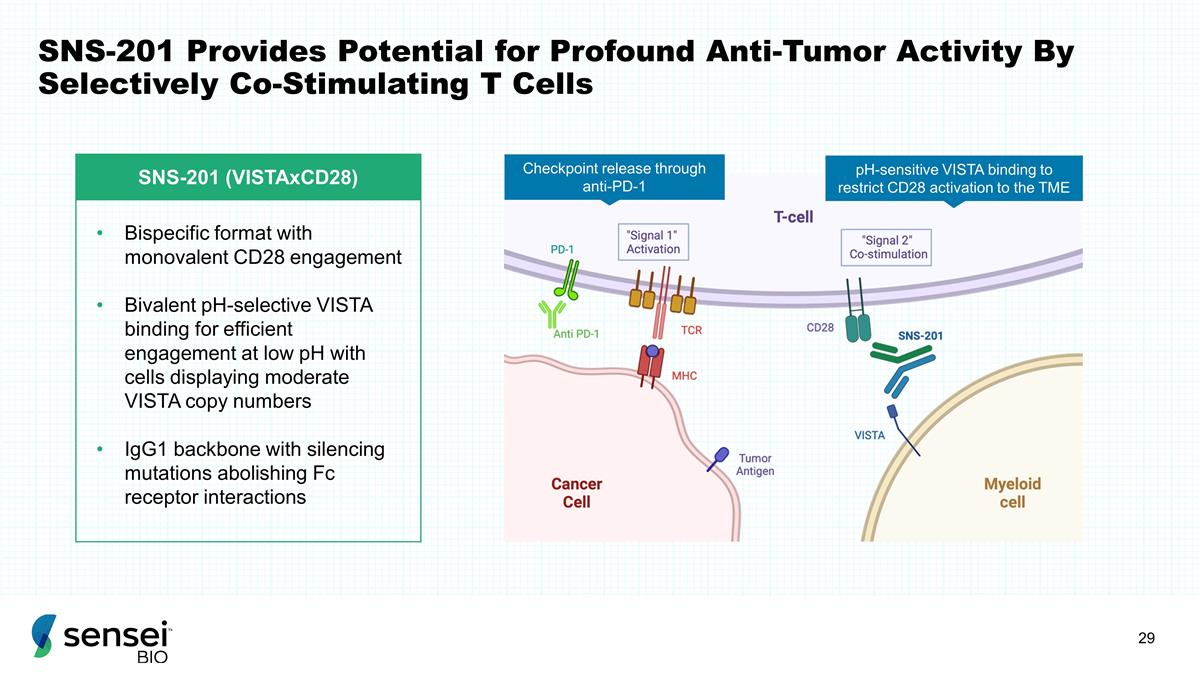
SNS-201 通过选择性地共同刺激 T 细胞 SNS-201 (vistaxCD28) 双特异性形式提供潜在的 深度抗肿瘤活性。双价 pH 选择性 VISTA 结合可在低 pH 值下与表现出中等 VISTA 拷贝数的细胞有效接合 IgG1 骨干和沉默突变消除 Fc 受体相互作用 pH 敏感 VISTA 结合通过抗 PD-1 限制 CD28 激活到 TME 检查点释放
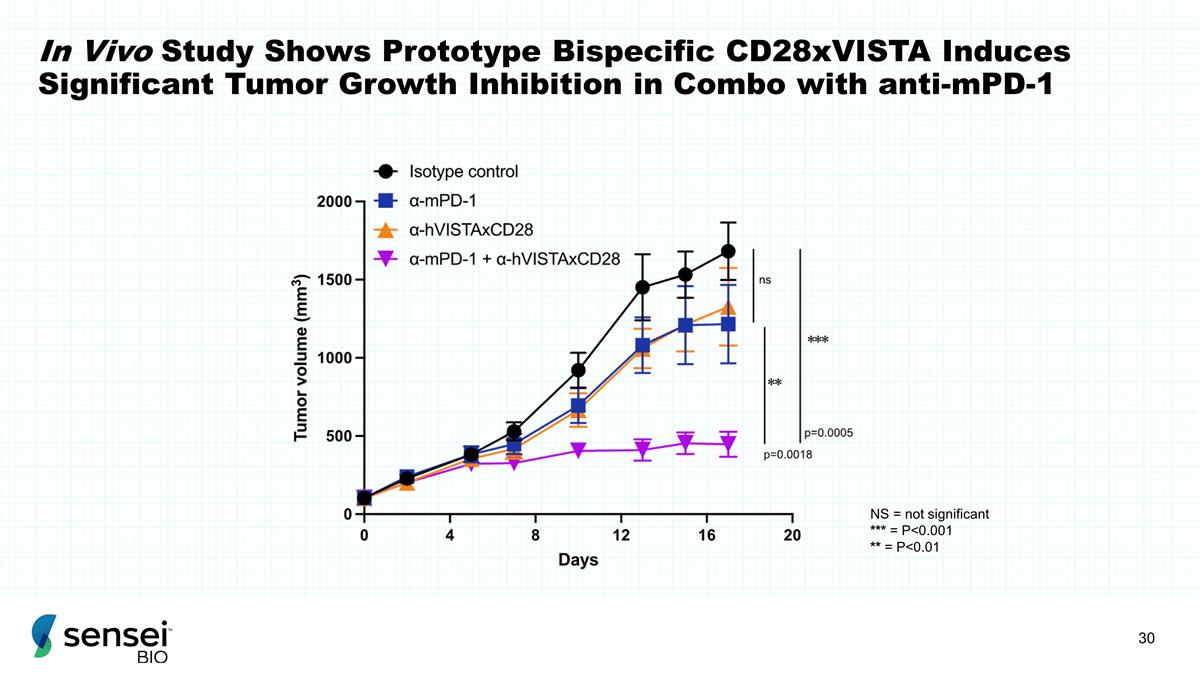
体内研究表明,原型 双特异性 CD28xVista 与抗 mPD-1 的组合可诱导显著的肿瘤生长抑制作用 NS = 不显著 *** = P
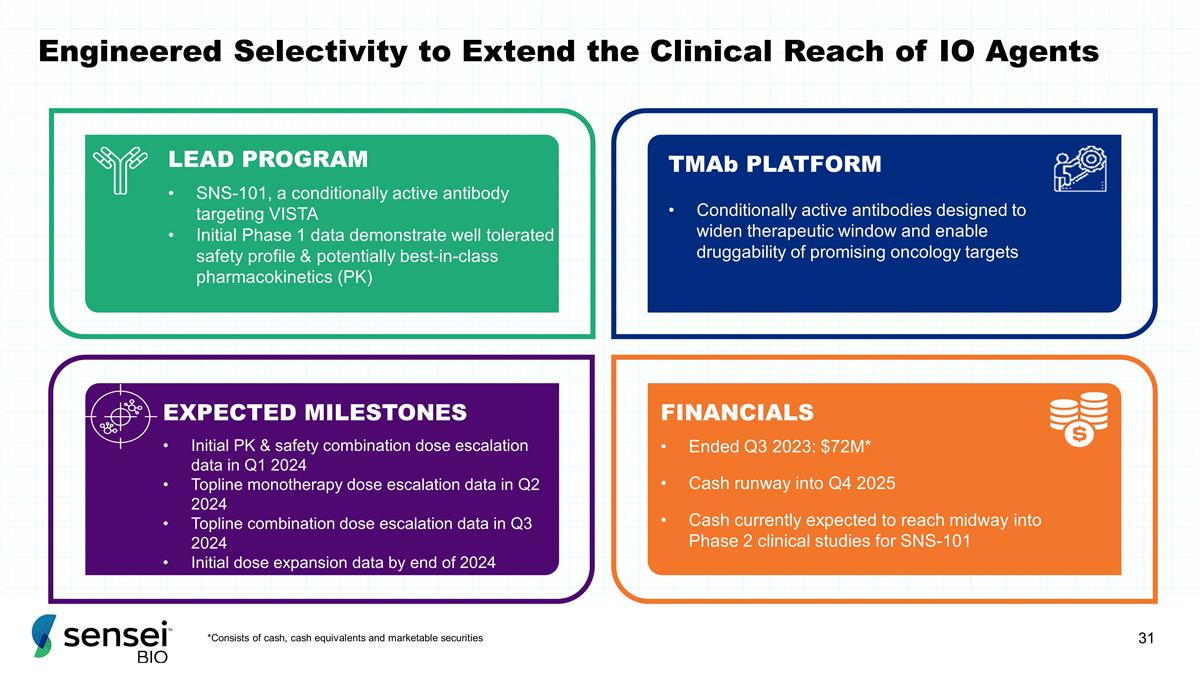
*由现金、现金等价物 和有价证券组成,旨在扩大 IO 药物临床覆盖范围的工程选择性 LEAD PROGRAM SNS-101,一种靶向 VISTA 的有条件活性抗体,初始 1 期数据显示出良好的耐受性,可能还有 一流的药代动力学 (PK) tMAB 平台条件性活性抗体旨在扩大治疗窗口,实现有前景的肿瘤靶标的可药性预期里程碑初始和安全组合剂量 2024 年第一季度 Topline 单一疗法剂量的升级数据 2024 年第二季度的上升数据 2024 年第三季度的关键组合剂量递增数据 2024 年底的初始剂量扩张数据 2023 年第三季度结束的财务状况:7200 万美元* 到 2025 年第四季度的现金流目前预计 SNS-101 二期临床研究的中途将达到

总部:1405 研究大道,125 套房, 马里兰州罗克维尔 20850 /马萨诸塞州:马萨诸塞州波士顿码头路 22 号,7 楼 02210 senseibio.com

支持 SNS-101 临床开发的关键合作伙伴联合疗法和生物标志物鉴定的潜在机会合作伙伴/合作者目标描述临床供应协议支持在计划的 1/2 期临床试验中评估 SNS-101 与 Libtayo®(cemiplimab)联合使用 Sensei 为计划中的临床试验 Regeneron 提供 Libtayo® Sensei 保持 SNS-101 合作研发 协议的全球开发和商业权利 协议进一步阐明 VISTA在免疫检查点耐药性中的作用以及扩大 SNS-101 作为联合疗法的潜力超越抗 PD-1 Sensei 与 NCI 免疫肿瘤学中心联合主任 Jeffrey Schlom 博士和 医学博士 James Gulley,医学博士。临床前研究将评估 SNS-101 与抗 PD-1 研究合作以外的疗法的作用机制进一步研究 SNS-101 的抗肿瘤活性 Sensei 与 免疫肿瘤学实验室 KOL Robert Schlom 合作的机制 Reiber 博士临床前研究将包括 SNS-101 反应生物标志物的鉴定

经过商业验证的 pH 敏感方法 Soliris (Eculizumab) 的先例 KD pH 7.4 (nM) 0.03 KD pH 6.0 (nM) 0.6 t½ (d) 3.9 Ultomiris(Ravulizumab,ALXN1210)0.49 22 13.4 由于半衰期更长(13.4d 与 3.9d),与之相比,每隔 8 瓦的拉武利珠单抗获得非劣性 依库利珠单抗在所有疗效终点每隔2瓦给药一次,同时保持相似的安全性。2018年:美国食品药品管理局批准2020年Ultomiris®(ravulizumab,ALXN1210):Ultomiris的销售额为10.8亿美元 Revulizumab在CDR区域(VH_Y27H,VH_S57H)中使用组氨酸 注入组氨酸 而抗C5单克隆抗体(mAb)eculizumab Soliris®(eculizumab)的Fc替代品(M428L,N434S)被认为是阵发性夜间活动 血红蛋白尿症(PNH)和非典型溶血尿毒综合征患者的标准护理,但由于大量的TMDD,其半衰期很短。使用组氨酸替代品设计依库珠单抗可产生对pH敏感的单抗体,其半衰期显著改善。Sheridan 等 al,PLOS One,2018 年 4 月 (https://doi.org/10.1371/journal.pone.0195909) Lee 等人,Blood,(doi: 10.1182/blood-2018-09-876136)销售数据: https://media.alexion.com/news-releases/news-release-details/alexion-reports-fourth-quarter-and-full-year-2020-results Solaris 的抗体工程导致 pH 灵敏度和半衰期改善
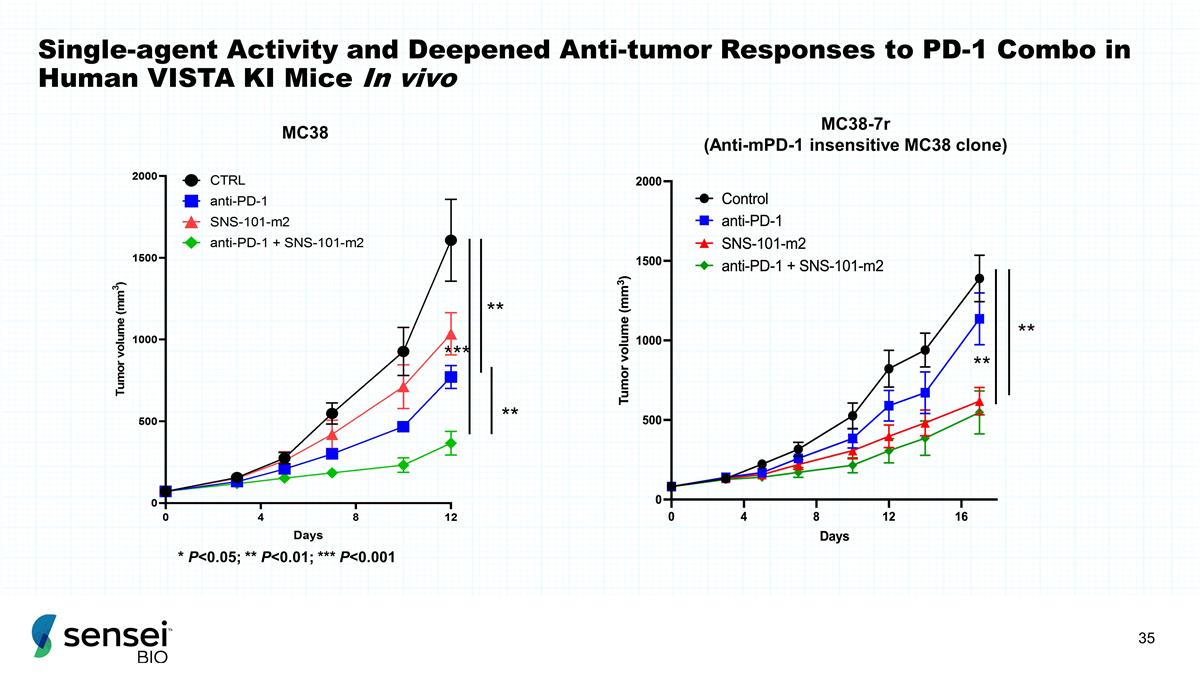
人类 VISTA KI 小鼠体内单药活性和对 PD-1 组合的抗肿瘤反应加深 ** ** mc38-7R(抗 mpD-1 不敏感 MC38 克隆)*** ** * P
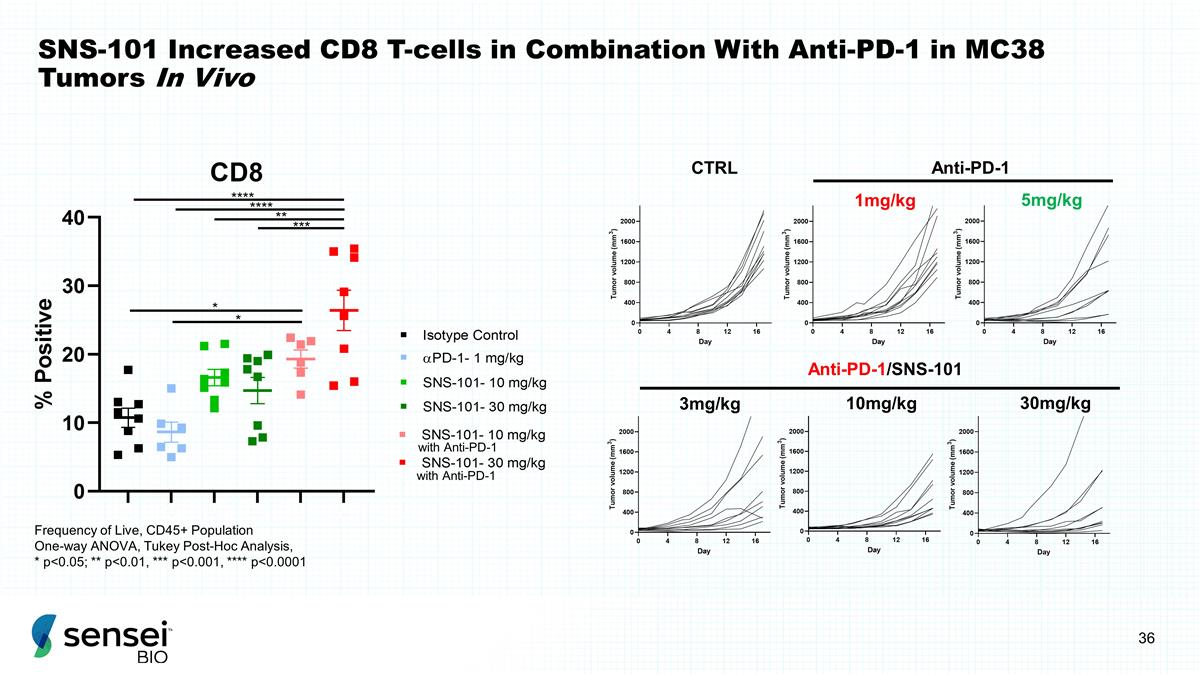
SNS-101 在 MC38 肿瘤中 与抗 PD-1 联合使用 CD8 T 细胞增加 CTRL 抗 PD-1 1mg/kg 5mg/kg 抗 PD-1/SNS-101 3mg/kg 10mg/kg 10mg/kg 活体频率 30mg/kg 活体频率,CD45+ 群体单向方差分析,土耳其事后分析,* p
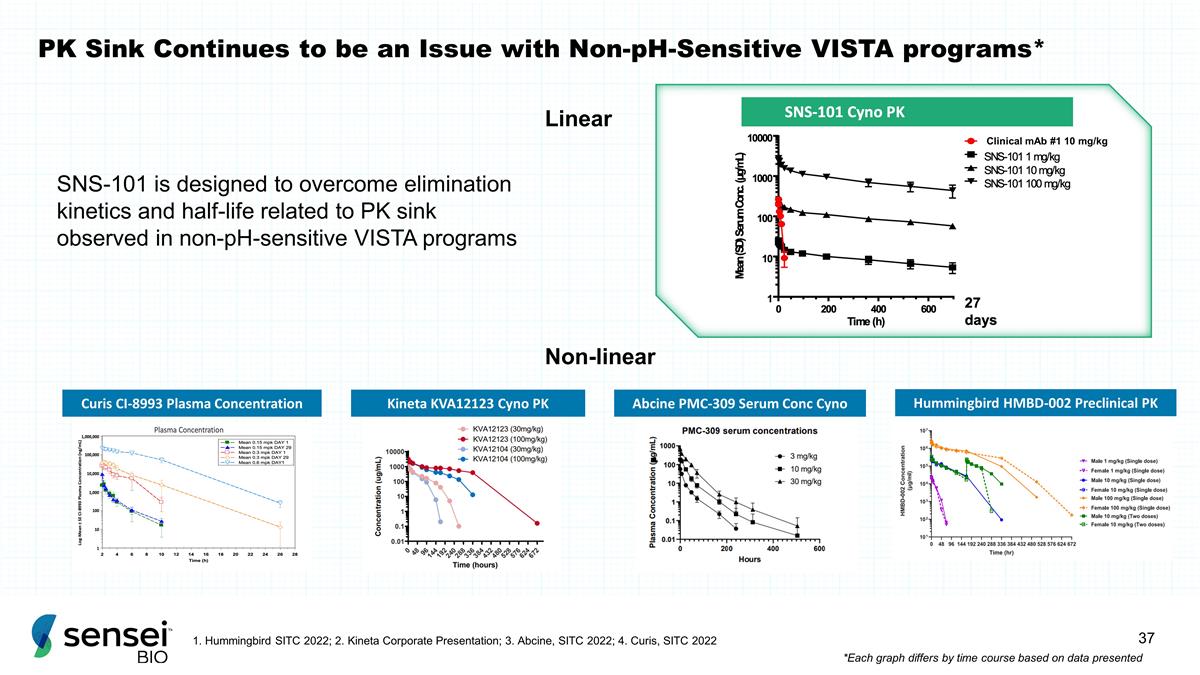
PK Sink 仍然是非 pH 敏感的 VISTA 程序的问题 * SNS-101 旨在克服在非 pH 敏感的 VISTA 程序中观察到的与 PK 汇相关的消除动力学和半衰期 Curis CI-8993 血浆浓度 Kineta KVA12123 Cyno PK Abcine PMC-309 血清 Conc Cyno Hummingbird HMBD-002 临床前 PK 线性非线性 1。Hummingbird SITC 2022;2.Kineta 公司介绍;3.Abcine,SITC 2022年;4.Curis,SITC 2022 *根据提供的数据,每张图表因时间而异 Clinical mAb #1 10 mg/kg
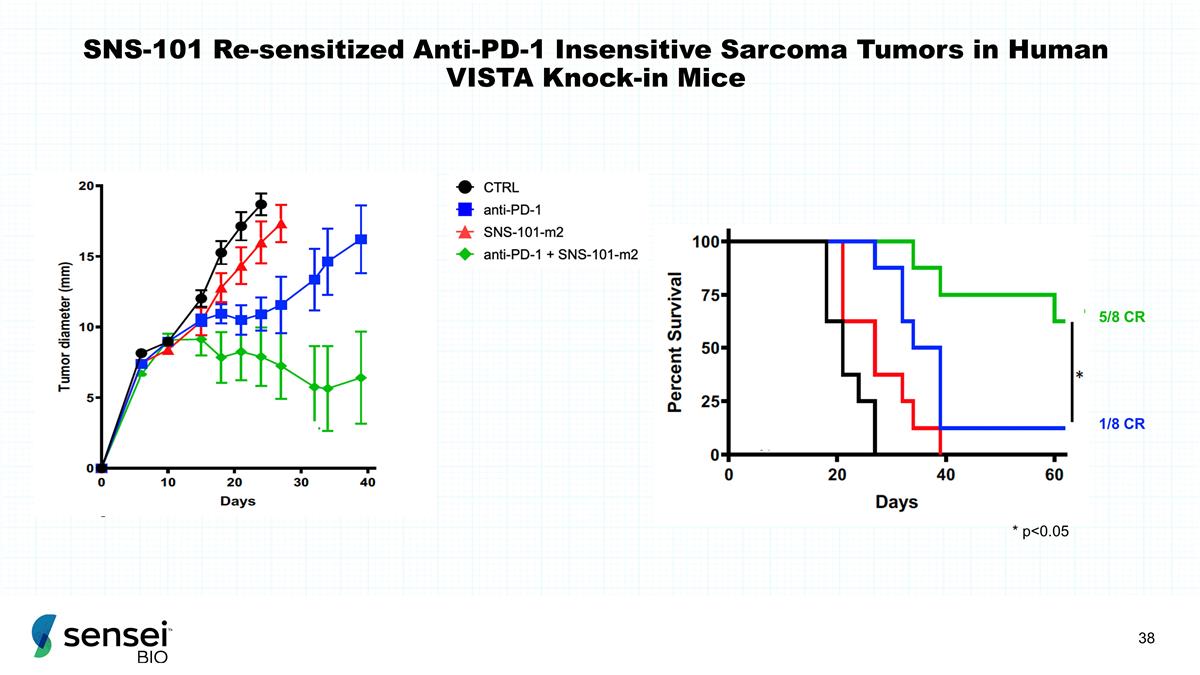
SNS-101 在人类 VISTA 敲入小鼠体内重新致敏的抗 PD-1 不敏感肉瘤肿瘤 5/8 CR 1/8 CR * p
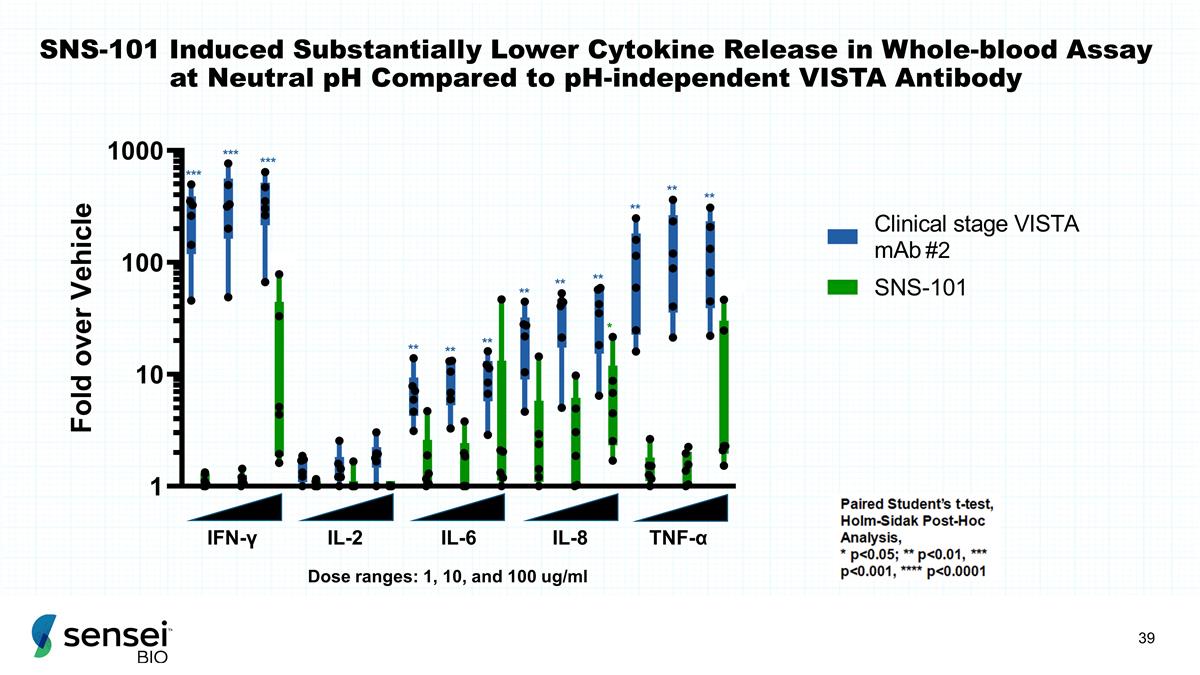
SNS-101 与无关 pH 值的 VISTA 抗体 IFN-γIL-8 TNF-α IL-6 IL-2 相比,在中性 pH 值下全血测定中诱导的 细胞因子释放明显降低 *** *** ** ** ** ** 剂量范围:1、10 和 100 ug/ml #2
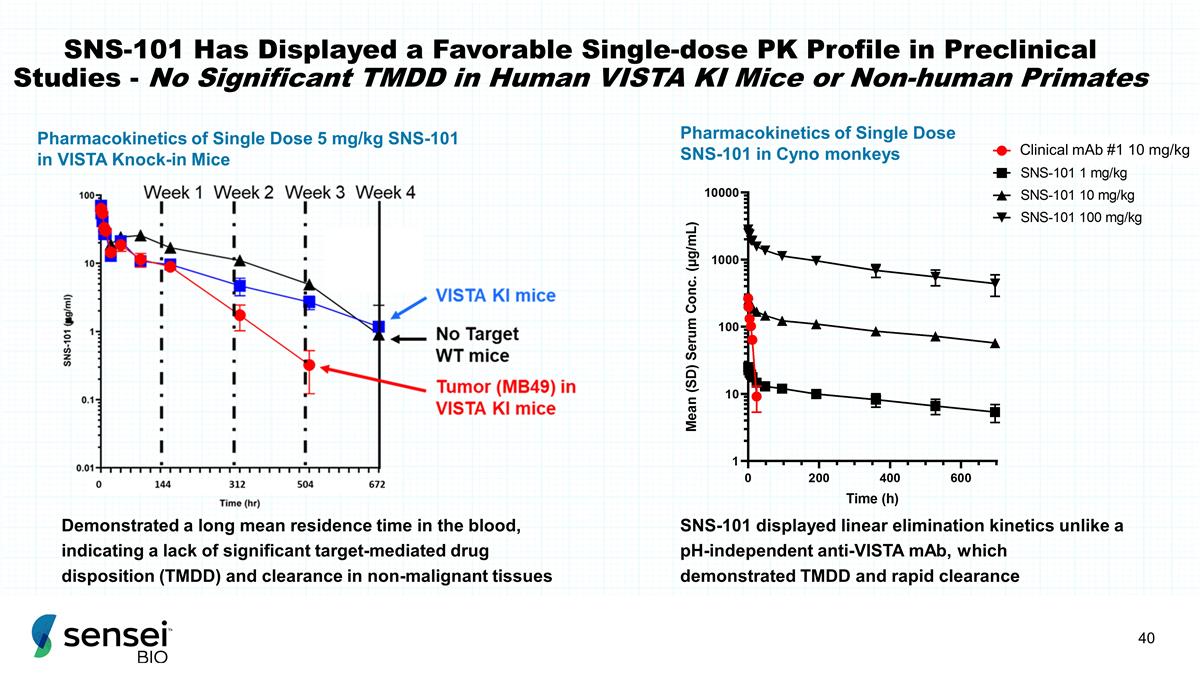
SNS-101 在临床前研究中表现出良好的 单剂量 PK 特征——人类 VISTA KI 小鼠或非人类灵长类动物中没有显著的 TMDD 单剂量 5 mg/kg SNS-101 在 VISTA 敲入小鼠中表现出较长的平均停留时间,这表明 缺乏显著的靶向介导药物处置 (TMDD) 和非恶性组织中的清除率 SNS-101 显示出线性消除动力学,这与 pH 值无关的抗 VISTA mAb 不同,它证明了 Cyno 中单剂量 SNS-101 的 TMDD 和快速清除药代动力学 猴子临床单克隆抗体 #1 10 mg/kg
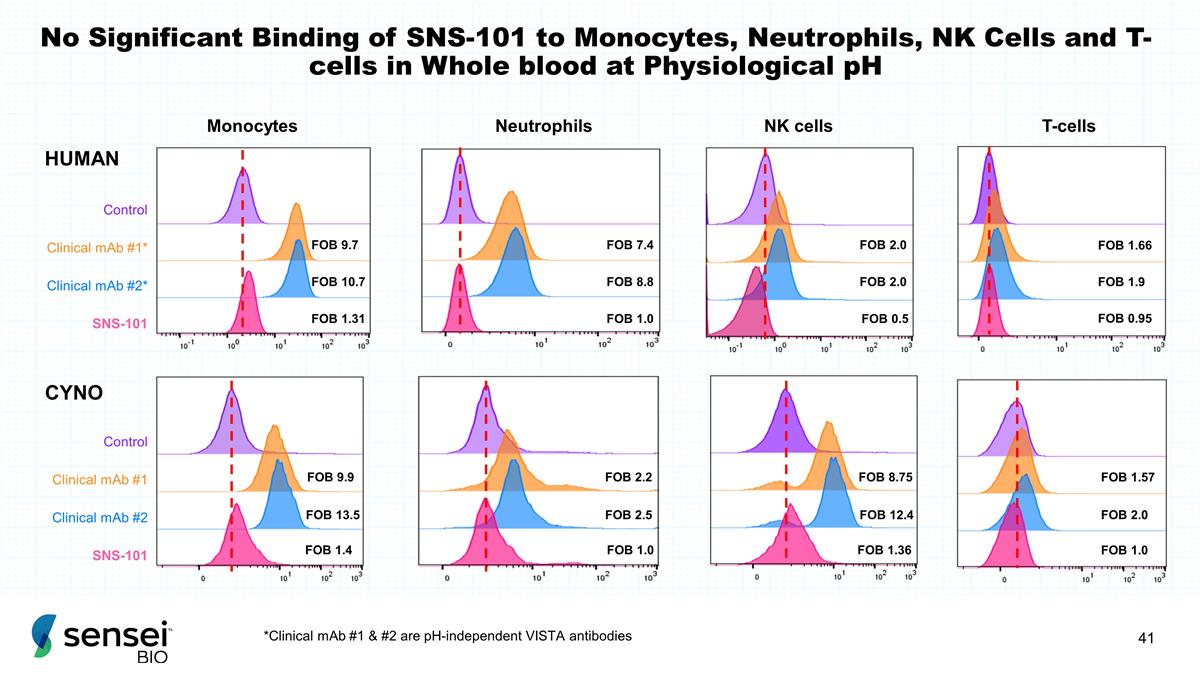
在生理 pH 值下,SNS-101 与全血中的单核细胞、中性粒细胞、NK 细胞和 T 细胞没有显著结合 T 细胞 NK 细胞 FOB 1.0 FOB 1.0 FOB 8.75 FOB 12.4 FOB 1.36 单核细胞 FOB 9.9 FOB 13.5 FOB 1.4 FOB 2.5 FOB 1.0 中性粒细胞 CYNO HUMAN FOB 7.4 FOB 8.8 FOB 1.0 临床单抗 #2 * SNS-101 对照 2.0 FOB 2.0 FOB 2.0 FOB 0.5 Clinical mAb #1 临床单抗 #2 SNS-101 对照 FOB 1.66 FOB 1.9 FOB 0.95 FOB 9.7 FOB 10.7 FOB 1.31 *临床单抗体 #1 和 #2 是与 pH 无关的 VISTA 抗体 #1
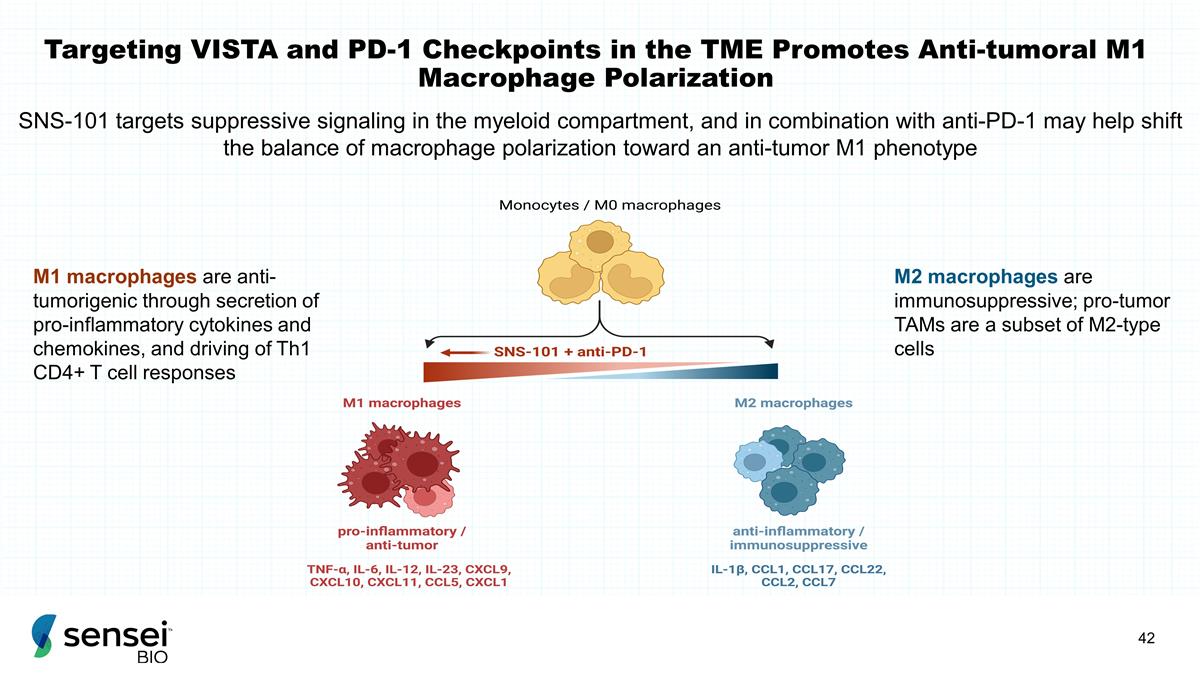
靶向 TME 中的 VISTA 和 PD-1 检查点可促进抗肿瘤 M1 巨噬细胞极化 M1 巨噬细胞通过分泌促炎细胞因子和趋化因子具有抗肿瘤作用,驱动 Th1 CD4+ T 细胞反应 M2 巨噬细胞具有免疫抑制作用;促肿瘤 TAM 是 M2 型细胞的子集 SNS-101 靶向髓系隔室中的抑制信号传导,与抗PD-1联合使用可能有助于将巨噬细胞两极分化的平衡转向抗肿瘤 M1 表型