
美国 美国
证券交易委员会
华盛顿特区,20549
表格
(标记 一)
| 根据1934年《证券交易法》第13或15(D)节提交的年度报告 |
对于
截止的财政年度
或
| 根据1934年《证券交易法》第13或15(D)条提交的过渡报告 |
对于 从过去到现在、从现在到现在的过渡期
佣金
文件编号:
(注册人的确切名称与其章程中规定的名称相同)
(州或其他司法管辖区 公司(br}或组织) |
(I.R.S.雇主 标识 编号) |
| (主要执行办公室地址 ) | (邮政编码) |
注册人的电话号码,包括区号:
根据该法第12(B)条登记的证券:
| 每个班级的标题 | 交易 个符号 | 注册的每个交易所的名称 | ||
| 这个 |
根据该法第12(G)条登记的证券:无
如果登记人是《证券法》第405条规定的知名的经验丰富的发行人,则应进行检查。
是
如果注册人不需要根据该法第13条或第15(D)条提交报告,请用勾号表示
。是的☐
用复选标记表示注册人(1)是否在过去12个月内(或注册人被要求提交此类报告的较短期限内)提交了1934年《证券交易法》第13或15(D)节要求提交的所有报告,以及(2)
在过去90天内是否符合此类提交要求。
用复选标记表示注册人是否在过去12个月内(或在注册人被要求提交此类文件的较短时间内)以电子方式提交了根据S-T规则(本章232.405节)第405条要求提交的每个交互数据文件。
用复选标记表示注册人是大型加速申报公司、加速申报公司、非加速申报公司、较小的申报公司或新兴成长型公司。请参阅《交易法》第12b-2条规则中“大型加速申报公司”、“加速申报公司”、“较小申报公司”和“新兴成长型公司”的定义。
| 大型加速文件服务器 | ☐ | 加速文件管理器 | ☐ |
| ☒ | 规模较小的报告公司 | ||
| 新兴成长型公司 |
如果 是一家新兴成长型公司,请用复选标记表示注册人是否已选择不使用延长的过渡期来遵守根据《交易法》第13(A)节提供的任何新的或修订的财务会计准则。☐
用复选标记表示注册人是否提交了一份报告,并证明其管理层根据《萨班斯-奥克斯利法案》(《美国法典》第15编第7262(B)节)第404(B)条对其财务报告内部控制的有效性进行了评估
编制或发布其审计报告的注册会计师事务所。
如果证券是根据该法第12(B)条登记的,请用复选标记表示备案文件中包括的注册人的财务报表是否反映了对以前发布的财务报表的错误更正。
如果注册人是空壳公司(如该法第12b-2条所界定),则用勾号表示
。是的☐
注册人的非关联公司持有的有投票权和无投票权普通股的总市值为#美元。
表明 截至2023年12月11日,注册人的每一类普通股的流通股数量:
| 班级 | 股份数量: | |
| 普通股,面值0.0001美元 |
通过引用并入的文档
目录表
| 第 部分I | 1. | 业务 | 4 |
| 1A. | 风险因素 | 34 | |
| 1B. | 未解决的员工意见 | 75 | |
| 2. | 属性 | 75 | |
| 3. | 法律诉讼 | 75 | |
| 4. | 煤矿安全信息披露 | 75 | |
| 第 第二部分 | 5. | 注册人普通股市场、相关股东事项与发行人购买股权证券 | 76 |
| 7. | 管理层对财务状况和经营成果的探讨与分析 | 77 | |
| 7A. | 关于市场风险的定量和定性披露 | 88 | |
| 8. | 财务报表和补充数据 | 89 | |
| 9. | 会计与财务信息披露的变更与分歧 | 114 | |
| 9A. | 控制和程序 | 114 | |
| 9B. | 其他信息 | 114 | |
| 第 第三部分 | 10. | 董事、高管与公司治理 | 115 |
| 11. | 高管薪酬 | 119 | |
| 12. | 某些实益拥有人的担保所有权以及管理层和相关股东的事项 | 123 | |
| 13. | 某些关系和相关交易,以及董事的独立性 | 125 | |
| 14. | 首席会计费及服务 | 126 | |
| 第四部分 | 15. | 展示、财务报表明细表 | 127 |
| 16. | 表格10-K摘要 | 127 |
| 2 |
有关前瞻性陈述的特别说明
本报告包含1995年《私人证券诉讼改革法》所指的前瞻性陈述。前瞻性 陈述包括所有非历史事实的陈述。在某些情况下,您可以使用术语 来识别前瞻性陈述,例如“可能”、“将”、“应该”、“可能”、“将”、“预期”、“ ”、“计划”、“预期”、“相信”、“估计”、“项目”、“预测”、“潜在”或这些术语的负面含义,以及旨在识别前瞻性陈述的类似表述和类似术语。这些陈述反映了公司对未来事件的当前看法,是基于假设和受风险和不确定因素影响的,这些风险和不确定因素包括本10-K年度报告中第I部分第1A项“风险因素”中所述的风险和不确定因素。鉴于这些不确定性,您不应过度依赖这些前瞻性陈述。这些前瞻性 陈述仅代表公司截至本10-K年度报告之日的估计和假设,除法律规定的 外,公司没有义务因本年度报告以10-K形式发布之后的新信息、未来事件或其他原因而公开更新或审查任何前瞻性陈述。您应阅读此Form 10-K年度报告和此Form 10-K年度报告中引用并作为附件存档的文件,并了解公司未来的实际结果可能与公司预期的大不相同。本公司通过这些警告性声明对其所有 前瞻性声明进行限定。此类陈述可能包括但不限于以下有关 的陈述:
● 我们缺乏经营历史和经营亏损历史;
● 我们对大量额外资本的需求以及我们满足资本需求的能力;
● 我们完成产品所需临床试验并获得FDA或不同 司法管辖区其他监管机构批准的能力;
● 我们维持或保护我们的专利和其他知识产权的有效性的能力;
● 我们留住关键执行成员的能力;
● 我们内部开发新发明和知识产权的能力;
● 对现行法律的解释和未来法律的通过;
● 投资者接受我们的商业模式;
● 我们对费用和资本要求的估计的准确性;以及
● 我们充分支持增长的能力。
| 3 |
第 部分I
第 项1.业务
概述
Sonnet BioTherapeutics Holdings,Inc.,是一家临床阶段的肿瘤生物技术公司,拥有一个专有平台,用于创新单功能或双功能生物药物。被称为FHAB™(全人血白蛋白结合),该技术利用 一种全人单链抗体片段,其结合人血清白蛋白(HSA)并在其上“搭便车”以转运至 靶组织。我们设计了FHAB构建体以改善肿瘤中的药物积累,以及延长体内 活性的持续时间。FHAB发育候选物在哺乳动物细胞培养物中产生,其能够实现糖基化和 类似于天然细胞因子的生物结构 体内.我们相信我们的FHAB技术于二零二一年六月获得 一项美国专利,是我们生物制药平台的显著特色,非常适合未来在一系列人类疾病领域进行药物开发 ,包括肿瘤学、自身免疫性、致病性、炎症和血液学病症。
我们目前的内部流水线开发活动专注于细胞因子,这是一类细胞信号肽,在其他重要功能中,它是有效的免疫调节剂。在独立和协同作用下,特定的细胞因子已经显示出调节免疫细胞的激活和成熟的能力,这些免疫细胞对抗癌症和病原体。然而,细胞因子本身并不会优先在特定的组织中积聚,很快就会从体内排出。通过细胞因子治疗达到治疗效果的传统方法通常需要使用高剂量和频繁剂量。这可能会导致治疗效果降低,并伴随着潜在的全身毒性,这对这类药物的治疗应用构成了挑战。
十四行诗 构建了一个高效的研发平台,其中包括外包供应商网络,以帮助补救费用并改进执行时间 。大多数供应商都是战略合作伙伴,为公司提供优先地位,并通过谈判获得成本。此方法的主要 优势包括对项目的优化直接投资,费用可根据项目数量快速调整 。Sonnet平台的成本优势始于供应商网络选择过程,CMC是最初药物开发步骤中最昂贵的组件之一。十四行诗已经选择了CMC在印度的战略合作伙伴,并通过谈判将成本大大低于类似的美国或欧洲供应商所产生的费用。十四行诗正在澳大利亚进行该公司正在进行的三项临床试验中的两项,通过澳大利亚政府的研发税收抵免计划,相对于美国的试验,该试验的成本大幅降低。十四行诗还与来自美国、英国、德国和瑞士的顶级研发供应商协调印度和澳大利亚的执行工作,目标是将该公司运营的 费用基础设施的大部分用于其药物开发管道。
管道
我们有一系列治疗化合物,主要集中在高度未得到满足的医疗需求的肿瘤学适应症上。
| ● | 我们的领先专利资产SON-1010是白介素12(IL-12)的全人类单链版本,与FHAB 结构,为此,我们正在进行实体肿瘤的临床开发。十四行诗已经完成了根据当前良好实验室规范(CGLP)进行的非人类灵长类(NHP)毒性研究 ,并成功地生产了该药物产品的液体和冻干 临床使用。2022年3月,FDA批准了Sonnet的研究新药(IND)申请 SON-1010。这使得该公司能够在2022年第二个日历季度启动一项针对实体肿瘤肿瘤学患者的美国临床试验(SB101)。2021年9月,公司成立了一家全资拥有的澳大利亚子公司SonnetBio Pty Ltd(“子公司”), 用于进行某些临床试验。十四行诗获得批准,并在2022年第三季度在澳大利亚健康志愿者中启动了一项关于SON-1010的临床研究(SB102)。SB101和SB102研究的临时安全性和耐受性数据于2023年4月报告。2023年1月,Sonnet宣布与罗氏达成合作协议,使用atezolizumab(Tecentriq)对SON-1010进行临床评估®)。这两家公司已经签订了主临床试验和供应协议(MCSA)以及辅助质量和安全协议,以研究SON-1010和阿替唑单抗在铂类耐药卵巢癌(PROC)患者环境中的安全性和有效性。此外,两家公司将分别提供SON-1010和阿特唑珠单抗,用于1b期/2a期联合安全性、剂量递增和疗效研究(SB221)。该试验包括第1部分中修改的3+3剂量递增设计,以确定具有固定剂量的SON-1010的最大耐受剂量(MTD)。PROC的临床益处将在一个扩展组中得到确认,以确定推荐的第二阶段剂量(RP2D)。这项研究的第二部分随后将通过随机比较研究SON-1010单一疗法或将其与阿替唑单抗和 PROC的护理标准(SOC)联合使用,以显示概念验证(POC)。作为该公司正在进行的 成本削减评估的一部分,已暂停所有SON-1010的抗病毒开发。 |
| 4 |
| ● | 公司于2020年4月获得了白介素6(IL-6)完全人类版本的全球开发权。我们将此候选对象称为SON-080,因为它的目标适应症是化疗诱导的周围神经病变(CIPN)和糖尿病周围神经病变(DPN)。Sonnet的CIPN 1b/2a阶段临床试验SB221正在澳大利亚进行。SB211研究的第一部分的登记即将完成,这将使DSMB在2024年第一个日历季度完成对初步安全性数据的审查。根据公司于2021年5月与新加坡新生命治疗有限公司(“新生命”)签订的许可协议,十四行诗和新生命将共同负责开发DPN中的SON-080 ,目的是在分析CIPN安全数据后评估一项前美国试点疗效研究。 | |
| ● | SON-1210(IL12-FHAB-IL15),我们的先导双功能化合物,将FH用单链IL-12和完全的人白介素15(IL-15)构建AB。这种化合物正在开发用于实体肿瘤的适应症,包括结直肠癌。2023年2月,该公司宣布在NHP中成功完成了两项启用IND的SON-1210毒理学研究。十四行诗已准备好 启动SON-1210的监管授权流程,等待任何合作活动的结果。 |
在我们的发现渠道中,我们正在调查:
| ● | SON-1410(IL18-FHAB-IL12),白介素18(IL-18)和IL-12的双功能组合,用于治疗黑色素瘤和肾癌。CELL 系列开发和工艺开发正在进行中,早期实验药物供应适合于配方和分析方法开发活动。经过2023年的一些开发延迟后,活动将持续到2024年,有可能产生一种适合于非临床研究和后续人体研究的药物。 |
| ● | SON-3015(抗IL6-FHAB-抗转化生长因子β)是一种抗白介素6和抗肿瘤生长因子β(β)的双功能组合物,用于治疗肿瘤和骨转移。已生产出早期双功能药物,并已储存以供将来使用体内老鼠研究。出于削减开支的目的,十四行诗选择搁置SON-3015开发计划。 |
在我们的治疗化合物的开发和商业化方面,我们面临着许多挑战和不确定性,包括我们的FHAB技术。请参阅本招股说明书中其他部分包含的“风险因素”,以及通过引用并入本招股说明书的文件中标题为“风险因素”的章节。
战略
我们的目标是快速推进我们的产品线,并利用我们的治疗FHAB平台成为生物药物发现、开发和商业化的领导者。自成立以来,Sonnet一直专注于快速发展的管道候选人向 诊所,同时也致力于建立与合适的合作伙伴的合作。随着合作伙伴关系对话的发展,Sonnet打算 优先考虑具有最大战略利益的资产的费用分配。为此,Sonnet在2023财年减少了运营费用,并打算谈判一项许可协议,以帮助为未来的管道扩张提供资金。作为2022年10月宣布的项目早期阶段的一个例子,杨森对我们的三种管道化合物SON-1010、SON-1210和SON-1410及其细胞治疗产品的评估仍在进行中。
FHAB 计划进展:SON-1010已进入1b/2a期临床开发,以确定最大耐受剂量(MTD)并评估铂类耐药卵巢癌(PROC)的临床获益。关于我们的第一个双功能候选药物SON-1210,已经成功完成了两项在NHP中进行的IND启动 毒理学研究,公司准备启动监管授权程序, 等待任何合作活动的结果。
| 5 |
将 SON-080推进到下一阶段的临床开发:SON-080是一种完全人用的低剂量IL-6,正在研究其用于化疗诱导的 周围神经病变(CIPN)。IL-6已在癌症患者的I期和II期临床试验中成功进行研究,我们于2022年下半年在CIPN患者中开展了 一项初步疗效1b/2a期研究。
制造 平台:Sonnet化合物使用行业标准哺乳动物细胞(中国卵巢(CHO))宿主细胞系生产, 允许使用最先进的生产工艺和技术进行快速放大和商业生产。哺乳动物 细胞培养系统使糖基化和类似的生物结构的天然细胞因子 体内,这降低了免疫原性的 机会。用于临床应用的细胞因子的制造,即它们的生产和纯化,提出了独特的 技术挑战。为此,Sonnet开发了一种专有的连续强化灌注生产工艺,包括 用于高效下游加工的专有配体以及稳定的冻干制剂,我们正在为这些生产和下游工艺开发步骤寻求知识产权保护。
监管 策略:我们相信,Sonnet的候选药物与现有疗法有显著差异,代表了生物制药药物开发的潜在突破。我们将努力寻求监管机构的突破性治疗指定, 这可能会加快临床开发时间表。
管道 许可机会:我们正在寻求与领先的生物制药公司合作的机会,以开发和 商业化我们的管道资产。
FHAB 技术扩展:Sonnet正在探索FHAB技术与有意扩大其 治疗部署的外部合作伙伴进行了许可,我们相信这可能会导致该平台在其他领域的应用,例如疫苗、抗体药物 结合物,以及作为嵌合抗原受体(CAR)T细胞技术的补充 体内.一旦获得支持性数据, 将提交临时专利,以确保FHAB在这些领域
FHAB科技
我们的 专有FHAB技术被设计用于解决生物制药 药物开发的现有方法的几个重要缺点。我们设计了FHAB结构域作为一种即插即用的模块化构建体,用于创新新的化学实体, 易于重新配置用于不同的治疗有效载荷。与所有生物药物一样,给药的剂量水平和频率 是关键变量,通常会对开发过程造成障碍。注射后,大分子治疗剂,包括 肽、蛋白质、融合蛋白、抗体等,必须保持完整,并且能够到达体内的指定靶点 ,而不超过特定的毒性阈值。最后,它们还必须使用具有商业吸引力的手段来生产。
十四行诗的平台技术旨在将HSA作为一种治疗性的穿梭分子。人血清白蛋白自然存在于血液中,是血浆中的主要蛋白质。白蛋白是发炎、高代谢组织的能量来源,包括肿瘤。由于对营养的需求旺盛,癌细胞过度表达白蛋白结合蛋白,如“富含半胱氨酸的酸性分泌蛋白”(SPARC)和gp60(白蛋白糖蛋白)。
根据2012年7月23日的发现合作协议和2019年5月7日的发现合作协议修正案(统称为“合作协议”),XOMA(US)LLC(“XOMA”)向Sonnet授予非独家、不可转让的 许可证和/或使用与发现、优化和开发 抗体和相关蛋白质有关的某些材料、技术和信息的权利,并据此开发和商业化产品(每个产品为“产品”)。合作协议包括使用全人噬菌体文库的许可证,该文库旨在产生完整的人类单链抗体 可变片段(ScFv),该片段包含完整的人类重链和轻链,用于为特定的 功能寻找生物序列。应用严格的标准,十四行诗将数百万单链抗体结合到人血清白蛋白中以生成十四行诗的FHAB,它与人血清白蛋白(HSA)结合,是一种具有三个主要功能结构域的球状蛋白。已知白蛋白结构域1和3参与了与FcRN的结合。这使得十四行诗能够选择和表征特定于域2的单链抗体结合剂,这是十四行诗F的一个基本方面HAB站台。
| 6 |
十四行诗 有义务在实现与产品相关的某些开发和审批里程碑时,按产品向XOMA支付总计375万美元的或有里程碑付款。在这一点上,下一个预计为75万美元的临床开发里程碑 预计将是开始注册一种产品(即,Son-1010)在第二阶段试验中。十四行诗还同意为十四行诗销售的产品的净销售额向XOMA支付较低的个位数版税。每种产品的版税应按国家/地区支付 ,直至(I)首次商业销售(定义见合作协议)后十二(12)年和(Ii)合作协议涵盖的已发布专利的最后一项有效主张的最后到期日期两者中较晚者为止。此外,十四行诗有权通过向XOMA支付指定金额来降低逐个产品的版税费率。 合作协议可由任何一方因故终止,并包含惯常的赔偿条款。
十四行诗的FHAB已显示出跨物种(人、小鼠和食蟹猴)与血清白蛋白的高结合亲和力,几乎没有免疫原性,并保留了新生儿FcRN介导的白蛋白循环延长血清半衰期的好处。与单抗不同,这种结合不会引起抗体依赖的细胞毒性(ADCC)或补体依赖的细胞毒性(CDC)。《F》HAB结构通过离子疏水机制物理结合血清白蛋白(图1),我们认为这比依赖化学、共价结合的技术提供了明显的优势。共价键一旦断裂,就不能改革,而十四行诗的FHAB能够在动态平衡中与白蛋白结合、解除结合和重新结合。白蛋白还与白蛋白受体gp60和SPARC,F结合HAB利用先天的生物机制将靶向传递到肿瘤微环境并在肿瘤微环境中积累治疗有效载荷。
临床前放射性标记研究已经验证了F的肿瘤靶向性HAB结构,与没有F的相同结构相比,肿瘤中有蓄积 HAB,不出所料,在肝脏、肾脏和其他器官中是一过性的。HAB在引流的淋巴结内也有可测量的蓄积。这些发现对任何单(ILX-F)的治疗应用具有重要意义HAB)或双功能(ILX-FH展示了增强的肿瘤靶向性和蓄积性,以及提高疗效的潜力。
十四行诗F的另一个独特优势HAB是它的连接体设计(图1),用于连接一个或两个大分子 治疗有效载荷,用于单功能或双功能活性。我们的G4S(甘氨酸、丝氨酸)多肽连接体是灵活的,同时足够长 以防止空间位阻,并可以采用棒状结构以增强对紧密组织基质的渗透。除了保持治疗功能区域之间的距离外,十四行诗连接体完全是人类的,在连接体结构上是非免疫原性的,包括在有效载荷结合区域。在双功能结构中,可以操纵治疗有效载荷的方向以改善潜在的治疗效果。

| 7 |
作为 最后一个关键设计组件,FHAB在哺乳动物细胞培养物中产生,特别是中国人卵巢(CHO)细胞, 其能够进行糖基化以降低或潜在消除免疫原性。使用CHO,我们已经产生了几种不同的具有各种低分子量治疗性蛋白质(例如,重组细胞因子,如IL-12、IL-15、IL-18、抗IL-6和抗TGF β)。重组治疗性蛋白质,包括细胞因子,已经显示出巨大的治疗潜力,但可能缺乏组织 特异性,这可能导致毒性。由于它们的小尺寸(HAB衍生的化合物 已经显示出显著更长的血清半衰期,改善的组织积累,并且当 与它们各自的裸重组细胞因子相比时具有显著的肿瘤减少活性。
总之,我们的FHAB技术支持模块化的多功能支架,可定制以产生广泛的多靶向 治疗候选物。相对于现有的白蛋白结合技术,FHAB的区别在于具有线性、 棒状形状,其设计用于更好的靶组织渗透,是一种全人类设计,以降低免疫原性、哺乳动物糖基化、 和FcRn结合,从而延长血清半衰期。重要的是,FHAB衍生的治疗剂具有靶向递送 至肿瘤和淋巴组织、降低毒性和更宽治疗窗的潜力,具有利用定制的单 或双功能作用机制的额外益处。
F的扩展 应用HAB技术:
免疫疗法: 我们相信,HAB平台可以创新靶向特定组织的生物药物,同时还可以延长治疗半衰期。如FHAB构建体被设计为能够同时部署两种协同免疫治疗化合物, 我们设想了一条通往先前未开发的免疫治疗进步的道路。
药物结合:使用FHAB技术,可将各种药物化合物连接到FHAB支架组合 超出了我们的第一波细胞因子管道,这为无数疾病领域的发展提供了机会。
疫苗: 疫苗开发人员正在寻求通过将疫苗与天然载体(如白蛋白)结合来提高疫苗效率。我们相信 FH具有模块化支架结构的AB平台可以成为将疫苗递送至淋巴结的有效载体, 改善渗透和呈递,并延长半衰期。
CAR T细胞疗法:CAR T细胞疗法涉及遗传修饰患者自身的T细胞以识别癌细胞,从而更有效地靶向和杀死肿瘤。我们相信利用白细胞介素的靶向Sonnet构建体可以全身共同施用 以增强CAR T细胞功效。
管道 概述
下表总结了我们已披露特定目标适应症的管道计划的相关信息:

| 8 |
SON-1010
IL-12是一种循环细胞因子,已被证明对先天免疫和获得性免疫有多种影响。这些免疫功能在攻击癌细胞和病原体方面至关重要。IL-12是一种由树突状细胞、单核细胞和巨噬细胞产生的异源二聚体细胞因子,也称为抗原提呈细胞(APC)。IL-12可诱导T细胞和自然杀伤细胞(NK细胞)分泌干扰素-ɣ,促进活化的T细胞和NK细胞的扩增和存活,增强细胞毒T细胞的杀伤活性,支持Th1辅助效应细胞的分化,增强抗体依赖的细胞毒作用。IL-12也被证明具有刺激作用体外培养癌症患者外周血淋巴细胞的抗肿瘤活性体内黑色素瘤、结肠癌、乳腺癌和肉瘤小鼠模型的抗肿瘤活性。
小鼠的临床前研究
最初,Son-1010(mIL12-F)的小鼠版本H与不含F的重组mIL-12相比,临床前显示出更大的肿瘤生长抑制HAB(裸露/独立IL-12)在黑色素瘤小鼠模型中的作用。图2,来自这项小鼠黑色素瘤研究,显示了使用mIL12-F后肿瘤减少率增加了30到50倍HAB与独立的MIL-12相比。
此外, 在同一型号中,mIL12-FHAB在肿瘤中积累的浓度较高,并在血清、脾和肿瘤中滞留 明显长于未加F的mIL-12HAB,可能使给药频率更低,剂量更低。
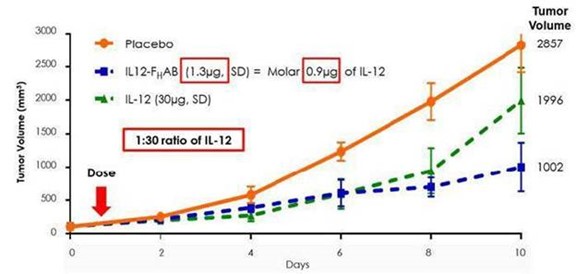
图2:IL-12(0.9微克)的摩尔当量为IL-12-FHAB(1.3微克)和它们在体外具有相似的生物活性;而在体内,IL12-FHAB的效力大约是IL-12的30倍(在第10天,1.3微克IL-12-FHAB>IL-12 30微克)。
在另一项使用B16F10肿瘤模型mIL12-F的临床前研究中H与重组小鼠IL-12相比,AB显示出更好的剂量反应,以及更长的生存时间(图3和图4)。这项研究的结果表明mIL12-FHAB 在缩小肿瘤体积和延长生存期方面可能比单独使用mIL-12有更大的效果。
| 9 |

图 3:对肿瘤体积的分析显示,两者的肿瘤均呈剂量依赖性减少mIL-12和mIL12-FHAB处理的 只小鼠,与载体对照组相比。IL12-FH与等摩尔剂量相比,AB处理的小鼠的肿瘤体积在统计上显著减少,mIL-12处理的小鼠。结果表明,IL-12的抗肿瘤活性可能随着血清半衰期的延长而增强HAB连锁。
在图4中,进行了Kaplan-Meier分析以比较用mIL12-F或mIL12-F处理的动物的存活率H这些数据说明了肿瘤生长减少(图3)和生存期延长(图4)之间的相关性。 在这项研究中,用mIL12-F治疗的动物肿瘤生长较慢H与裸露mIL-12治疗观察到的更快的肿瘤生长相比,AB与更长的生存时间相关。最低剂量mIL12-F的存活率HAB(3微克) 相当于最高剂量的mIL-12(30微克)。所有剂量的mIL12-FH在第14天和17.5天,AB的存活率比赋形剂提高了50%。

图 4:Kaplan-Meier对小鼠B16F肿瘤存活率的评估显示,使用IL12-F可提高存活率HAB治疗。 剂量为10微克和20微克的独立mIL-12在第2天和第4天的存活率分别比赋形剂对照组(10天)高出50%。所有剂量的IL12-FHAB在第14天和17.5天的存活率分别为50%。IL12-F在最低剂量下的存活率HAB 相当于最高剂量的独立IL-12
| 10 |
SON-1010的非人灵长类研究
我们 已完成体外培养亲和力和结合动力学的药理学研究表明,SON-1010对仓鼠、大鼠、食蟹猴和人的血清白蛋白具有物种交叉反应。结果表明,SON-1010对食蟹猴和人具有种属特异性,为进一步的临床前毒理工作提供了物种选择的指导。人源化小鼠模型(SCID) 旨在评估PK/PD和剂量反应的研究已经完成。这项工作为我们在一项非人类灵长类(NHP)研究中决定给药提供了依据。
2021年2月,我们宣布成功完成了SON-1010的NHP非GLP重复剂量毒理学研究,其中的数据被用于为cGLP毒性研究的设计提供信息,为IND提交做准备。非GLP研究的目标是评估SON-1010在几个剂量水平重复给药方案中的毒性,并为进一步的安全性和毒性研究的设计收集关键数据。研究包括静脉(IV)和SC两种给药途径,总共两次注射,相隔14天。在这项研究中使用的最高剂量率大于患者暴露于患者的预期临床水平的50倍。研究结果包括:
| ● | 在检查的两个剂量水平下,静脉和SC给药途径重复给药是耐受的。正如通常使用IL-12所观察到的那样,白血球计数下降,肝酶(ALT和AST)升高。这些都是短暂的影响,在第二次服药后7天内恢复到基线水平。 | |
| ● | SON-1010在生理观察、体重、病理、细胞因子和免疫表型等方面发生了相关变化,所有这些变化都与以前在单剂研究中观察到的靶向效应一致。 | |
| ● | 在第一次注射SON-1010后,干扰素-γ水平显著升高,而第二次注射后,干扰素-γ水平降低。这一趋势遵循了发表的关于IL-12在人类和NHP中的其他研究的数据。在研究中测试的所有剂量水平中,明显没有细胞因子失衡的迹象,或包括肿瘤坏死因子-α、IL-1β和IL-6在内的促炎细胞因子的不受控制的增加。 | |
| ● | 药代动力学分析表明,通过SC注射SON-1010的动物的平均血清半衰期约为40小时。这与该研究先前进行的剂量递增阶段的数据是一致的,该阶段的数据表明,与裸露的重组人IL-12 13-19小时的半衰期相比,半衰期有了显著的改善。 | |
| ● | 这些结果建立在与B16F10黑色素瘤小鼠模型研究的基础上,其中小鼠版本的SON-1010显示,与小鼠IL-12相比,达到类似治疗效果所需的剂量减少了20倍。综上所述,我们认为,通过Sonnet的FHAB技术,观察到的延长的半衰期、改善的治疗窗口和减少的剂量需求代表了SON-1010作为潜在的免疫肿瘤治疗的关键优势。 |
2021年5月,我们宣布成功完成了在NHP中对SON-1010进行的cGLP重复剂量研究。该研究的目的是评估SON-1010在NHP中的毒性,采用三种不同剂量水平的皮下(SC)重复给药方案与未治疗的对照组进行比较,并评估任何不良结果的潜在可逆性。研究结果包括:
| ● | 重复服用NHP后未观察到的不良事件水平(NOAEL)是预期等量人类临床剂量的50倍以上,没有细胞因子释放综合征的证据。 | |
| ● | 血清样本的药代动力学(PK)分析证实了IL12-F的增强特征HAB高于重组人IL-12,在NHP中的半衰期约为40小时。 | |
| ● | 在给予IL12-F后,观察到与抗肿瘤机制相关的关键多效性细胞因子干扰素-γ显著增加H阿布。 | |
| ● | SON-1010在临床观察、体重、临床病理、细胞因子和免疫表型方面发生了相关变化,所有这些都与以前在非人类灵长类动物中观察到的靶向效应一致。 | |
| ● | 到第38天,所有研究对象恢复到基线(研究前)实验室数值。 | |
| ● | 在检查的所有剂量水平下,重复给药都是耐受的。 |
| 11 |
生物分布研究
在2023年9月,我们宣布完成了两个独立的体内概念验证(POC)研究显示白细胞介素F的生物分布HAB分子到肿瘤微环境(TME),使用在放射性标记生物制剂和 方面具有专业知识的实验室体内生物分布分析。这些实验室采用了不同的放射性标记方法(99mTC或89Zr) 用于mIL-12和mIL12-FHAB,有或没有多组氨酸标签(His-Tag)。这两项研究是使用B16F10小鼠黑色素瘤模型完成的,以测量不同时间点放射性标记产物的累积和肿瘤体积的抑制。H与mIL-12相比,AB的肿瘤积累量明显更高,在较长时间点的平均水平是mIL-12的2.5-4.7倍,并增加了滞留。与正常小鼠相比,肿瘤中发现了蓄积,正如预期的那样,肝、肾和其他器官中的蓄积是暂时的。重要的是,放射性标记的mIL12-FHAB还显示可测量的蓄积在引流的淋巴结中。总体而言,这些发现对任何单(ILX-F)的治疗应用具有重要意义HAB)或双功能(ILX-FH展示了增强肿瘤靶向性和聚集性的分子,以及可能导致各种候选药物的疗效提高的可能性。
制造业 发展
除了药物产品展示(液体或冻干)外,表达SON-1010的主细胞库的制造工作、配方开发和工艺开发活动都已完成。多个cGMP药物产品批次已成功生产 并为正在进行的临床试验提供库存。
诊所里的SON-1010
我们于2022年4月启动了首个人类(FIH)1期试验(SB101),以评估患有晚期实体瘤和铂耐药卵巢癌(PROC)的成年患者的最大耐受剂量(MTD),并于2023年4月在AACR上公布了该研究的初步数据。更多的PROC患者将被纳入这项研究的扩展部分,以确认推荐的第二阶段剂量(RP2D)。在SB101的前五个队列中的15名患者中,有9名患者在第一次随访扫描时病情稳定,其中4名患者在进入研究阶段时已经进展。经过4个月的随访,14名患者中有5名在第二次扫描时保持稳定,表明SON-1010在36%的患者中临床受益。第一位接受治疗的患者患有侵袭性子宫内膜肉瘤,肿瘤明显缩小,腹水一度完全消退,临床和放射学表现稳定了一年多。前3个队列中的剂量是每4周进行一次,但现在新的队列中每3周进行一次,以提高更高剂量的安全性。
我们 于2022年7月在澳大利亚健康志愿者中启动了一项单次递增剂量(SAD)1期临床研究(SB102),以仔细研究PK和PD,为可能的联合研究做准备。SB102研究的数据是在2023年第一个日历季度 报告的。在SC给药后,使用经过验证的电化学发光分析(Meso Scale,LLC(MSD)),可以看到SON-1010在血清中的典型剂量相关增加。药物浓度在约11小时内达到峰值,几何平均最大浓度(C最大值50、100和150 ng/kg剂量组分别为29、68和125 pg/ml)(图5)。平均消除半衰期(T½) 150 ng/kg剂量的SON-1010为112小时,而rh IL-12 SC为12小时。
| 12 |

图5:在给药后频繁地评估SON-1010水平,然后在SB102研究的其余部分指示的日期进行评估。插图 更详细地显示了第一周的相同数据。
在细胞因子PD反应中,干扰素-ɣ的升高最为明显,且呈剂量依赖性、可控性和持续时间。在所有活性药物受试者中,SON-1010诱导的干扰素-ɣ在24~48小时达到高峰,2周后恢复到基线水平(图6)。干扰素-ɣ基因工程C最大值在50、100或150 ng/kg的SON-1010后的AUC分别为398、384和666 pg/mL,而在50、100或150 ng/kg的SON-1010后的AUC分别为398、384和666 pg/mL,0-48h为6050、10200和14600 h*pg/mL。用线性回归法预测IFN-γ C最大值在较高的 剂量下,这仍然在安全范围内。以剂量依赖性方式诱导低量的IL-10,这也可能是对IFN-γ增加的响应。给药后IL-6、IL-8和TNF-α出现小幅一过性升高 ,但IL-1β、IL-2或IL-4未观察到一致模式,且无细胞因子释放综合征(CRS)证据。安全性 与之前报告的一致;不良事件通常为轻度/中度、一过性, 均可耐受。

图 6:在PD给药后频繁评估细胞因子水平,然后在SB 102研究剩余时间的指定日期进行随访。
SON-1010在迄今为止测试的所有剂量下都是安全和可耐受的。不良事件通常为轻度/中度和一过性, 无因安全性原因而终止研究。此外,后续剂量的不良反应数量较少,强度较低。 几何半衰期(T½SON-1010在SB 101中的作用时间为113小时,而在先前的研究中观察到SC给予重组hIL-12的作用时间为12小时。我们两项研究之间PK曲线的比较表明,SON-1010可能靶向 肿瘤,因为FHAB是为了做。与健康志愿者一样,癌症患者每次给药后的细胞因子分析 显示,IFN-γ的诱导作用类似,在24至48小时达到峰值,2至4周后恢复至基线水平 。与对IFN-γ的反应预期一致,每次给药后观察到IL-10小幅增加。在这些 剂量下,IL-1β、IL-6、IL-8或TNF-α的信号极小 或无信号,且无任何迹象表明可能发生细胞因子释放综合征(CRS)。
| 13 |
SON-080治疗化疗引起的周围神经病变
通过 我们的管道扩展工作,我们已经确定IL-6是一种细胞因子,当作为独立的 分子递送时具有重要的生物学特性。我们的主要临床阶段资产SON-080是IL-6的天然人类版本,也是在中国人卵巢(CHO)细胞中生产的。在患有血小板减少症的癌症患者 和健康志愿者中进行的I期和II期临床试验中研究了先前版本的重组IL-6。Sonnet的类似版本将推进到化疗诱导的周围神经病(CIPN)的下一个发展阶段,CIPN是癌症中使用化疗药物治疗的常见副作用。CIPN是一种使人衰弱的病症,其表现为四肢的疼痛、麻木和刺痛。据报道,在接受特定癌症 治疗方案的患者中,有多达70%的患者发生了这种情况,这是患者过早放弃化疗的主要原因。在设计用于复制CIPN临床症状的动物实验中,重组IL-6呈现出改善疾病的特征,包括修复受损神经的潜力。
Based on the preclinical work, we believe that SON-080 can potentially regenerate damaged nerves, thereby addressing not only the pain-related symptoms, but also the profound discomfort and motor disability CIPN patients often experience. In the nervous system, IL-6 has exhibited neurotrophic-like properties, inducing anti-apoptotic gene expression, protecting neurons from toxic injuries, and promoting nerve regeneration and remyelination. IL-6 has demonstrated the potential to elicit nerve regrowth and to re-establish both normal nerve function (Figure 7) and sensations (Figure 6) in various preclinical models of CIPN induced by cisplatin, taxol, or vincristine. Activity from treatment with SON-080 was also observed in preclinical models of type 2 diabetic neuropathy, outlining the potential for benefit in DPN, and other diseases affecting the nervous system or other organs. This broad activity suggests that the SON-080 mechanism of action might not be restricted to a given class of chemotherapeutic drugs and could elicit a universal neuroprotective-neurorestorative response. Additionally, preclinical data point to the potential of SON-080 to elicit both preventive and curative activity in neuropathies (Figure 8). This introduces the possibility of treating cancer survivors who still suffer from neuropathies, a population representing between 10% and 60% of the 14 million cancer survivors in the US.

图 7:在组织学(IENFD)或生理学(SNCV)水平上测量的IL-6对紫杉醇或顺铂诱导的大鼠神经病变的活性 .
| 14 |

图 8:数据显示预防和治疗活性增强正常敏感性的恢复(在此,在顺铂诱导的周围神经病变中使用对热 刺激的行为反应)。
IL-6已在超过200名患有化疗诱导的血小板减少症的癌症患者的I期和II期研究中进行了研究。试验入组者 接受的SC剂量范围为0.25 - 32 µg/kg,每日一次或每周三次。在这些试验中,实体瘤癌症 存在于超过75%的治疗患者中,IL-6的累积剂量平均在8000 μg范围内(122 - 54880 μg), 平均治疗持续时间等于28天。其中一项试验涵盖6个化疗周期,IL-6治疗期延长至203天。在这些试验中均未观察到癌症或神经病加重。
SON-080的MTD是在四项研究中通过使用已建立的共同毒性标准通过连续的IL-6剂量组的队列剂量递增来确定的。每天给药时,每日注射SC后的MTD被确定为3至8μg/kg; 当每周给药3次时,MTD估计>10μg/kg。在这些研究中,确定治疗限制剂量的临床上最相关的毒性是流感样症状和神经皮质毒性,表现为嗜睡、躁动、困惑、幻觉、 和定向障碍。我们预计使用的SON-080剂量比之前的IL-6 MTD少50倍,并预计未来会有更良性的不良事件发生。
这些 数据构成了我们在CIPN进行的临床试验的基础,根据临床前研究的支持,剂量预计将大大低于MTD。作为比较,我们的目标剂量将提供的累积剂量是类似剂量期间达到的平均累积剂量的25倍。我们还相信,SON-080在治疗包括DPN在内的其他神经疾病以及其他神经系统疾病方面具有巨大的潜力,我们目前正在评估这些机会的未来发展路径。十四行诗于2022年7月在CIPN使用SON-080启动了前美国阶段1b/2a试点规模的疗效研究。数据安全监控委员会(DSMB)计划 在第1部分注册完成后审查初步安全调查结果,预计在2024年第一个日历季度。
治疗糖尿病周围神经病变的SON-080
除了我们与SON-080的CIPN计划外,我们的DPN计划可能会根据我们计划与SON-080进行的CIPN研究收集的数据, 探索IL-6在糖尿病周围神经病变(DPN)中的临床应用。目前有50%-80%的糖尿病患者被诊断为DPN。根据世界卫生组织(WHO)的预测,到2030年,糖尿病患病率估计将超过3.5亿人。神经病变是进行性的,并在糖尿病的连续过程中发展。这种情况包括无明显原因的顽固性疼痛,以及与疼痛无关的症状,如失去平衡、感觉缺乏和自主神经功能障碍等。这些赤字损害了生活质量,并导致预期寿命缩短。糖尿病足溃疡是与糖尿病医疗护理相关的主要成本,也与DPN的发展直接相关。
| 15 |
尽管病情严重,但目前的治疗只针对DPN的疼痛部分,而没有解决疾病进展和与疼痛无关的 症状。此外,目前用于止痛的少数药物(即欣百达、Lyrica、大麻素、阿片类药物)仅部分有效,且与主要副作用相关,这通常会推迟它们进入患者的护理。因此,DPN仍然是一种具有很大商业市场潜力的未得到满足的医疗需求。
长期以来,锻炼一直被世卫组织和护理人员视为治疗和潜在预防糖尿病的有效手段,几项试点研究已提供证据支持其在改善糖尿病营养方面的作用。然而,大多数糖尿病患者身体上无法进行锻炼。众所周知,定期锻炼可以改善糖尿病相关指标,如糖化血红蛋白和血糖稳态,改善心率变异性,并刺激神经功能和血流的恢复。最近的证据表明,IL-6在运动过程中被释放,并介导了体力活动的一些有益效果。十四行诗已经完成了DPN动物模型的临床前工作,在该动物模型中,外源性给予IL-6在表皮神经密度、神经功能、血流和对疼痛或干扰刺激的反应方面显示出恢复活性。在这种情况下,SON-080可能成为未来治疗DPN的关键疾病修正疗法。
在试管中有关少突胶质细胞或器官培养的数据表明,IL-6可能通过雪旺细胞或少突胶质细胞诱导髓鞘基因的表达(图9)。

图9:髓鞘碱性蛋白(MBP)、蛋白脂蛋白(PLP)及其剪接变异体表达(B)评估少突胶质细胞的存活(A)和分化。
Valerio 等人,Mol Cell Neurosci 21(2002)602-615。
Pizzi 等人,Mol Cell Neurosci 25(2004)301-311。
IL-6的神经保护活性已被用多种范式进行评估,包括兴奋性毒性。除了保护神经元,IL-6还可能促进轴突再生和功能性突触的恢复(图10)。
| 16 |

图1011:海马体切片轴突再生活性(A),损伤切片中生长相关蛋白43(GAP43)表达增加,而正常切片(NL)中未见表达(B)。受抑制的(A)兴奋性突触后电位(EPSP)的轴突再生活性(C)和功能恢复(D).Hakkoum等,J Neurochem 100(2007)747-757.
DPN临床前模型中IL-6的活性已经由三个独立的实验室进行了评估。这项工作表明,IL-6在神经病变中以剂量依赖的方式显示出 阳性活性,也可能有助于在神经病变建立后(即糖尿病和继发性神经病变诱导后4周)恢复正常的生理参数。在运动(图11A)和感觉(图11B)神经功能(传导速度)上观察到有益的活动,并通过测量热(图11C)和触觉(图11D)在行为上观察到有益的活动。除了先前观察到的对髓鞘和轴突的直接影响体外培养,IL-6也被观察到在恢复神经中的微血管血流方面具有活性体内(图11e),这是糖尿病神经病变的主要驱动因素。在神经病的发展过程中接受IL-6预防性治疗的动物的神经的组织学分析表明,IL-6对髓鞘具有保护活性,并可能在保护神经纤维完整性、神经传导速度和感觉方面发挥作用。
| 17 |

图11:IL-6对链脲佐菌素诱导的糖尿病神经病变大鼠的根治治疗。卡梅伦等人,Exp Neurol 207(2007)23-29。
除了肿瘤学的适应症,15项试验性研究共167名受试者,包括27名2型糖尿病患者,由不隶属于十四行诗的独立学术团体进行,以评估IL-6在运动和代谢中的作用。同行评议的结果表明,低剂量的IL-6模拟了运动的几个有益方面,包括表达抗炎分子,增加脂肪代谢,减少胰岛素分泌,以及激活肌肉中的STAT3信号通路。
我们相信这些数据为IL-6在DPN中的临床开发提供了强有力的支持。通过其作用机制和潜在的疾病改善活性,低剂量的IL-6可能为糖尿病患者的神经病变症状和心脏自主神经病变(CAN)提供治疗方案。我们打算使用从我们对SON-080进行的CIPN研究中收集的数据来为我们的决策提供信息,以确定SON-080在DPN中可能的下一步开发步骤。根据公司于2021年5月与新加坡新生命签订的许可协议,我们和新生命将共同负责在DPN开发SON-080,目标是在2023年下半年启动一项前美国试点 疗效研究。
SON-080: 新生命治疗协议
2021年5月,我们宣布签署一项许可协议,具体内容如下(“新生活协议”),该协议导致我们的IL-6(SON-080)资产被授予新加坡新生活。许可的领土包括新加坡、马来西亚、印度尼西亚、泰国、菲律宾、柬埔寨、文莱、越南、缅甸和老挝人民民主共和国这10个东盟国家。在2021年6月和7月, 我们修改了新生命协议,使Sonnet BioTreateutics,CH,SA(而不是Sonnet BioTreateutics,Inc.)新生命协议(第一修正案)的缔约方和我们还分别使Sonnet BioTreeutics,Inc.成为新生命协议(第二修正案)下的履约担保人。除了Sonnet在2020年8月签署意向书时收到的最初500,000美元之外,Sonnet在签署新生活协议时还收到了另一笔不可退还的预付款500,000美元。根据新生活协议的条款,十四行诗可以在实现早期商业销售里程碑后30天内获得100万美元的递延许可费、总计高达1900万美元的里程碑付款和商业销售12%至30%不等的分级特许权使用费。十四行诗 和New Life打算在决定是否继续进行DPN适应症的临床研究之前,对CIPN研究的安全性数据进行评估。
| 18 |
SON-1210
SON-1210, 我们的主要双功能构建体,将IL-12和IL-15结合到FH阿布。这些细胞因子是基于协同生物活性而选择的。IL-15通过其特异性受体IL15Rα发挥作用,该受体表达于抗原提呈树突状细胞、单核细胞和巨噬细胞。除了上述IL-12的潜在抗肿瘤特性外,我们认为IL-15还可以潜在地增加以下互补活性:
| ● | 诱导T、自然杀伤(NK)和B细胞分化和增殖 | |
| ● | 增强CD8的细胞杀伤活性+T细胞 | |
| ● | 诱导长效CD8+ 记忆性T细胞在数月/数年内加强对癌症的免疫监视 | |
| ● | B细胞刺激分化和免疫球蛋白合成 | |
| ● | 诱导树突状细胞成熟 | |
| ● | Up调节IL-12β1受体表达 |
我们 已经对SON-1210(mIL12-F)的小鼠版本进行了一些临床前研究HAB-hIL15)。与对照组相比,注射所示剂量一次的小鼠抑制了B16F10黑色素瘤模型中的肿瘤生长(图12)。白介素12和白介素15的联合应用顺式使用FHAB显示出超出mIL12-F抑瘤作用的协同活性HAb (图13)。总体而言,IL-12和IL-15的相互生物学活性表明:
| ● | IL-12:增加IL-15Rα受体、干扰素-ɣ、NK/T细胞、TH1(肿瘤杀伤),降低Treg | |
| ● | IL-15:增加IL-12β-1受体、NK细胞、CD8记忆力,减少细胞凋亡 |

图 12:这些数据显示增强了肿瘤生长的抑制作用MIL12-FHAB-hIL15与同时给药相比, 裸体mIL-12和hIL-15在黑色素瘤小鼠模型中的作用。

图 13:IL-12和IL-15在顺式使用FH与IL12-F相比,AB显示出协同活性,导致肿瘤体积缩小H在黑色素瘤小鼠模型中单独使用AB。
2023年2月,该公司宣布在NHP中成功完成了两项启用IND的SON-1210毒理学研究。SON-1210的NHP非GLP 剂量递增研究于2022年9月完成,GLP重复剂量NHP研究于2022年第四个日历季完成。原料药的cGMP生产完成,并于2023年初生产了冻干制剂,以支持FIH的临床研究。最初的毒性材料支持非GLP研究,而GLP研究正在对与第一阶段临床研究相同批次的GMP药物进行 。SON-1210的监管授权流程定于 开始,等待任何合作活动的结果。
| 19 |
发现 资产:SON-1410(IL18-FHAB-IL12)和SON-3015(抗IL6-FHAB-抗转化生长因子β)
2021年8月,我们在完成了对小鼠黑色素瘤模型的比较研究后,宣布选择了一种新的开发候选者。 该候选者代表了Sonnet的第二个双功能化合物,将IL-12和IL18与该公司的FHAB 平台。SON-1410的目标适应症将是黑色素瘤和肾癌。
IL18-FH与安慰剂相比,AB-IL12在一项小鼠黑色素瘤研究中显示出统计上显著的肿瘤体积缩小,以及剂量反应。 数据显示:
| 化合物 | 第0天,单剂 肿瘤 @100 mm3 | 第8天肿瘤体积(mm3 +/-扫描电子显微镜),N=8 | 第8天肿瘤缩小8% | |||||
| 安慰剂 | 北美 | 1747 +/- 301 | - | |||||
| IL18-FHAB-IL12 | 1 µg | 918 +/- 130 | 47 | % | ||||
| IL18-FHAB-IL12 | 5 µg | 619 +/- 141 | 65 | % | ||||
还进行了单独的小鼠研究,比较了所选的IL18-F版本HAB-IL12和另外两个候选者,GMCSF-FHAB-IL18和GMCSF-FHAB-IL12。比较数据显示,使用IL18-F后,肿瘤体积显著缩小,干扰素-γ水平和免疫细胞反应(NK、NKT、Th1和细胞毒性CD8T细胞)显著增加HAB-IL12与GMCSF-F的比较HAB-IL12或GMCSF-FHAB-IL18。SON-1410(IL18-F)的临床前开发仍在继续HAB-IL12),用于GMP应用的细胞系开发正在进行中。经过2023年的一些延迟之后,过程开发活动将持续到2024年,有可能产生一种适合NHP的GLP非临床研究和随后的人体研究的药物。
转化生长因子-β/IL-6生物学效应是预测肿瘤总生存期的重要指标,联合应用SON-3015靶向抑制IL-6和转化生长因子β信号通路有望成为治疗肿瘤和骨转移的有效策略。转化生长因子β从降解的骨中释放出来,促进IL-6的产生,导致骨转移的恶性循环。FcRN在骨环境中的高表达会导致双重构建的抗IL6-F在骨中蓄积HAB-抗转化生长因子β,从而潜在地抑制或阻断骨转移。 十四行诗已选择搁置SON-3015开发计划,以降低费用。
在我们的治疗化合物的开发和商业化方面,我们面临着许多挑战和不确定性,包括我们的FHAB技术。请参阅本招股说明书中其他部分包含的“风险因素”,以及通过引用并入本招股说明书的文件中标题为“风险因素”的章节。
竞争
制药和生物技术行业的特点是技术快速进步、竞争激烈以及对专有产品的高度重视。虽然我们相信我们的技术、开发经验和科学知识为我们提供了竞争优势,但我们面临着来自许多不同来源的潜在竞争,包括大型制药和生物技术公司、学术机构、政府机构和其他进行研究、寻求专利保护并为癌症免疫疗法的研究、开发、制造和商业化建立合作安排的公共和私人研究组织。我们成功开发和商业化的任何候选产品都将与未来可能推出的新免疫疗法竞争。
我们 在制药、生物技术和其他开发免疫肿瘤治疗的相关市场领域展开竞争。还有许多其他公司已经商业化和/或正在开发癌症免疫肿瘤学治疗方法,包括大型制药公司和生物技术公司,如安进、阿斯利康/医学免疫公司、百时美施贵宝、默克、诺华、辉瑞和罗氏/基因泰克。
| 20 |
我们面临着来自制药和生物技术公司的激烈竞争,这些公司的目标是在癌症环境中使用特定的细胞因子或其他大分子作为免疫调节疗法。这些通常包括单特异性或双特异性抗体、融合蛋白、抗体药物结合物和靶向疫苗。
对于我们的主要候选产品SON-080,我们知道还有其他公司正在开发治疗CIPN的产品,包括但不限于Aphios Corporation、Asahi Kasei Corporation、MundiPharma EDO和Regenacy PharmPharmticals,Inc.;然而,我们相信我们是 唯一研究将疾病修改细胞因子用于适应症的公司。
对于我们的第一个FH除了AB派生的候选方案SON-1010,我们知道还有其他竞争对手的IL-12计划,包括但不限于Celsion Corporation、Eli Lilly、Inovio PharmPharmticals,Inc.、Intrexon Corporation、Codiak Biosciences、Xolio Treeutics、Werewolf Treeutics、蜻蜓Treeutics和OncoSec Medical正在开发的计划。我们相信我们的FH集成的IL-12是以肿瘤为靶点的,具有增强的PK配置文件,使其有别于竞争对手。
关于我们早期的流水线FHAB产品候选产品SON-1210、SON-2014和SON-3105,我们不知道有任何其他 竞争公司在这些特定的双功能计划上工作。
与我们相比,我们正在竞争或未来可能竞争的许多公司在研发、制造、临床前测试、进行临床试验、获得监管批准和营销批准药物方面拥有更多的财务资源和专业知识。制药、生物技术和诊断行业的合并和收购可能会导致更多的资源集中在我们数量较少的竞争对手中。规模较小或处于早期阶段的公司也可能成为重要的竞争对手,特别是通过与大公司和成熟公司的合作安排。这些竞争对手 还在招聘和留住合格的科学和管理人员、建立临床试验场地、为我们的临床试验招募受试者以及获取与我们的计划相辅相成或必要的技术方面与我们竞争。
如果我们的竞争对手开发和商业化比我们或我们的合作者 可能开发的任何产品更安全、更有效、副作用更少或更少、更方便或更便宜的产品,我们 可能会看到我们的商业机会减少或消失。我们的竞争对手也可能比我们更快地获得FDA或外国监管机构对其产品的批准 ,这可能会导致我们的竞争对手在我们或我们的合作者能够进入市场之前建立强大的市场地位 。如果获得批准,影响我们所有候选产品成功的关键竞争因素可能是它们的疗效、安全性、便利性、价格、配套诊断的有效性(如果需要)、生物相似或仿制药竞争水平以及 政府和其他第三方付款人是否可以报销。
制造业
我们依赖合同开发和生产组织(CDMO)根据FDA的 当前良好生产规范(CGMP)生产我们的候选药物,以用于我们的临床试验。生物药品的生产受到广泛的cGMP法规的约束,这些法规规定了各种程序和文件要求,并管理记录保存、生产工艺和控制、人员和质量控制的所有领域。我们的流水线分子使用标准的工业中国仓鼠卵巢(CHO)平台,使用现成的原材料进行常见的生化工程。
为了满足我们对临床用品的预期需求,以通过监管审批和商业制造来支持我们的活动,我们目前与之合作的CDMO之一已经扩大了生产规模,并正在美国 建设一个cGMP制造基地,将于2024年第三季度投入使用。CDMO的前景很强劲,而且有多个潜在的代工来源。 我们尚未与替代供应商接洽,因为我们目前的CDMO能够规模化生产,并继续成功地生产 十四行诗的流水线。我们与CDMO的关系由在药品开发和制造方面拥有丰富经验的内部人员管理。
| 21 |
许可证 和其他商业安排
杨森 制药公司(强生)
2022年10月,十四行诗宣布与强生旗下的扬森制药公司之一的扬森生物技术公司(Janssen Biotech,Inc.)达成合作协议,其中体外培养和体内药效SON-1010(IL12-FHAB)、SON-1210(IL12-FHAB-IL15) 和SON-1410(IL18-FHAB-IL12)将与某些Janssen专利细胞治疗资产一起进行评估。协议 由强生创新促成。根据协议条款,十四行诗应提供三种参考化合物 ,以供面对面使用在……里面体外培养和体内功效研究。如果成功并受协议条款的约束, Janssen可以行使其选择权,然后Sonnet可以寻求许可证和/或扩大合作。
罗氏
2023年1月,Sonnet宣布与罗氏就SON-1010与泰唑珠单抗(Tecentriq®)的临床评估达成合作协议。 两家公司已签订主临床试验和供应协议,以及辅助质量和安全 协议,以研究SON-1010和阿替唑单抗在铂耐药卵巢癌(“PROC”)患者环境中的安全性和有效性。此外,两家公司将分别提供SON-1010和阿特唑珠单抗,用于1b期/2a期安全性、剂量递增和疗效研究(SB221)。
新生活
于2021年5月,本公司与新生命治疗私人有限公司(“新生命”)订立许可协议(“新生命协议”)。根据新生命协议,本公司授予新生命于马来西亚、新加坡、印度尼西亚、泰国、菲律宾、越南、文莱、缅甸、老挝人民民主共和国及柬埔寨(专属地区)开发及商业化含有特定重组人IL-6、SON-080(“化合物”)(该等 制剂,“产品”)以预防、治疗或缓解人类糖尿病周围神经病变的药物制剂(“DPN领域”)的独家许可(连同再许可权利)。新生命可行使一项选择权,以扩大(1)独家许可的范围以包括预防、治疗或缓解人类化疗引起的周围神经病(“CIPN领域”),该选项是非独家的 ,将于2021年12月31日到期;和/或(2)许可证的地区范围包括人民Republic of China、 香港和/或印度,该选项是独家的,也将于2021年12月31日到期。如果行使这些选项,CIPN油田和领土扩展的条款 将由双方协商。2021年6月和7月,我们修改了新生命协议 ,将Sonnet BioTreateutics CH SA(而不是Sonnet BioTreateutics,Inc.)新生命协议(第一修正案)的当事人 和我们还分别使Sonnet BioTreateutics,Inc.成为新生命协议(第二修正案)下的履约担保人。
该公司将保留在世界任何地方生产化合物和产品的所有权利。本公司与新生活将订立 后续供应协议,根据该协议,本公司将按双方协商的条款,在专属地区的DPN油田(及CIPN油田,如适用)向新生活供应产品以供开发及商业化。公司 还将协助转让有助于新生活 从许可证中获益的某些临床前和临床开发技术。
New Life将承担并负责在专属区域内进行临床研究和额外的非临床研究,以及DPN领域(和CIPN领域,如果适用)产品的其他开发和监管活动以及产品商业化的费用 。
New Life于2020年8月向公司支付了50万美元不可退还的预付现金款项,并于2021年6月就执行New Life协议向公司支付了50万美元不可退还的预付现金 。新生命还有义务在满足某些里程碑时额外支付100万美元的不可退还的延期许可费,以及根据某些开发和商业化里程碑的实现 可能向公司支付的高达1,900万美元的额外里程碑付款。此外,在特许权使用费期限内(定义如下),新生命有义务 根据产品在专属地区的年净销售额向公司支付12%至30%不等的分级两位数特许权使用费。 “特许权使用费条款”是指在专属地区内按产品和国家/地区的基础上,从此类产品在专属地区内首次商业销售之日(视某些条件而定)起至 起至新生命停止在DPN领域(或CIPN领域)进行商业化为止。(如适用)。
| 22 |
新生命协议将按产品逐个国家/地区继续有效,并将于最后到期国家/地区的最后到期产品的特许权使用费期限届满时终止,但须受以下条件限制:(I)各方的提前解约权 ,包括因另一方重大违约或破产或破产而提前终止的权利,以及(Ii)本公司的回购权和新生命的 回退权(定义如下)。
此外,New Life授予本公司回购本公司授予New Life的权利的独家选择权,而公司 授予New Life权利按待商定的条款在专属地区的一个或多个国家或地区回购有关DPN现场和/或CIPN现场(如适用)的产品的权利,该等选择权将于适用产品的第三阶段试验开始时终止。
Xoma
十四行诗 (作为Oncobiologics,Inc.(“Oncobiologics”)的利益继承人,在Oncobiologics于2015年4月6日将某些资产剥离到Soncobiologics 并同时按比例向OncoBioics的股东分配其在Sonnet的所有股份后, 与XOMA(US)LLC(“XOMA”)是2012年7月23日的发现合作协议和2019年5月7日的发现 合作协议修正案(统称为“合作协议”)的一方),根据该协议,XOMA向Sonnet 授予了一份非排他性的合作协议不可转让的许可证和/或使用与发现、优化和开发抗体及相关蛋白质相关的某些材料、技术和相关信息的权利,并据此开发和商业化产品(每个产品)。 十四行诗有义务在实现与产品相关的某些开发和批准里程碑时,按产品向XOMA支付总计375万美元的或有里程碑付款。在这一点上,下一个预计为75万美元的临床开发里程碑 预计将是开始注册一种产品(即,Son-1010)在第二阶段试验中。十四行诗还同意为十四行诗销售的产品的净销售额向XOMA支付较低的个位数版税。每种产品的版税应按国家/地区支付 ,直至(I)第一次商业销售(如合作协议中所定义)之后的指定时间段、 和(Ii)合作协议涵盖的已颁发专利的最后一项有效索赔到期之日两者中较晚的一个为止。 此外,十四行诗有权通过向XOMA支付指定的金额来降低逐个产品的版税费率。 合作协议可由任何一方以原因终止,并包含惯例赔偿条款。
阿瑞斯
2015年8月28日,现为Sonnet全资子公司的救济与默克KGaA(“ARES”)的全资子公司Ares Trading签署了一份许可协议(“ARES许可协议”) 。根据ARES许可协议的条款,ARES已向本公司授予可再许可的、独家的、全球范围内的、有版税负担的专有专利许可,以研究、开发、使用和商业化使用阿特克沙金阿尔法(“Atex akin”)的产品(每个,一个“产品”),阿特克沙金是一种治疗周围神经疾病和血管并发症的低剂量人类IL-6制剂。ARES许可协议中包括三项专利,保护使用Atex akin治疗i)糖尿病神经病变、ii)化疗引起的周围神经病变和iii)血管并发症。
根据ARES许可协议,我们将根据公司销售的产品的净销售额向ARES支付个位数的高额版税。版税按产品和国家/地区支付,直至(I)在该国家/地区进行第一次商业销售(如ARES许可协议中所定义)后的指定时间段,以及(Ii)该产品在该国家/地区的有效索赔所涵盖的最后日期 。如果产品不在国家/地区的有效索赔范围内,或者在该产品在该国家/地区首次商业销售之日起十二(12)周年之前,该有效索赔已过期或失效,则版税税率将减少50%(50%)。我们还将向ARES支付再许可费用,该费用是从再许可 事件(“再许可收据”)收到的收益的百分比,使用浮动比例表(在发生再许可事件的临床开发的后期阶段,该百分比会下降),从较低的两位数开始,然后减少到较高的个位数。为方便起见,公司可随时终止ARES许可协议,或在任何一方违反协议时由另一方终止。许可证 协议包含惯例的赔偿条款。
| 23 |
《Ares许可协议》已于2021年11月1日修订,以澄清其中包含的与再许可相关的部分条款和条件的适用范围。尤其是:
| ● | 十四行诗 现在被授权在未经ARES事先书面同意的情况下向第三方授予再许可,前提是任何此类再许可的财务状况 应反映十四行诗善意确定的公平市场价值。 | |
| ● | 由于 十四行诗从再许可收据中向ARE支付报酬的初始条件尚不清楚,因此澄清了ARES许可协议 ,规定如果在第一阶段临床试验完成之前或之后签署相关的再许可 协议,则十四行诗必须向ARES支付所有再许可收据的一定比例(而不是仅在最初的ARES许可协议中设定的在第一阶段临床试验完成后签署相关的 再许可协议的情况下)。 | |
| ● | 双方同意,上述澄清仅适用于未来的再许可协议,并适用于新生命协议可能产生的特许权使用费 (但不适用于里程碑付款)。 |
知识产权
在我们的专利组合方面,我们拥有四项已颁发的专利(美国、日本、新西兰和俄罗斯),我们还提交了针对许多融合蛋白的专利申请 ,其中包括完全人类白蛋白结合结构域(FHAB)。如果获得批准,由此产生的专利将在2038年至2041年之间到期,但在某些情况下可能会延长专利期限。专利申请 申请包括:
● 与WO/2018年/151868相对应的国家备案文件-此申请针对的是完全人类的白蛋白结合结构域(FHAB) 融合蛋白,“包括与scFv‘s(例如,抗转化生长因子β、PD-L1、肿瘤坏死因子、IL-1、IL-6、IL-8等)、与细胞因子的融合蛋白(例如,IL-2-FHAB,IL-12-FHAB,IL-15-FHAB,IL-7-FHAb、 等。)以及两种细胞因子的组合,如IL-12-FH单抗-IL-15、GM-CSF-FHAB-IL-18和IL-18-FHAB-IL-12; 以及使用该F的处理方法HAB融合蛋白。一项专利于2021年6月8日在美国颁发,名称为美国专利号11,028,166。一项专利于2022年12月23日在日本授予,名称为日本专利7200138号。一项专利于2022年12月21日在俄罗斯颁发,专利号为2786444。一项专利于2023年10月3日在新西兰颁发,新西兰专利号为 756674。美国专利号11,028,166目前预计将于2039年3月26日到期,而日本专利7200138号、俄罗斯专利2786444号和新西兰专利756674号预计将于2038年2月20日到期。澳大利亚、巴西、加拿大、中国、欧洲、香港和印度也在等待申请。继续申请和分区申请分别在美国和日本悬而未决。
● 美国专利第11,028,166号和PCT专利申请(PCT/US 2018/00085)最初收到的申请申请日期为2018年2月20日,这是美国临时专利申请美国62/459,975和美国62/459,981都要求优先利益的美国临时专利申请提交日期 一周年之后的四天。对于美国专利和PCT专利申请,批准了将优先权恢复到美国临时专利申请US 62/459,975和US 62/459,981的申请。随后,PCT专利申请在澳大利亚、巴西、加拿大、中国、欧洲、印度、日本、新西兰和俄罗斯提交了国家阶段专利申请。然而,由于这些司法管辖区的专利法不同,到目前为止,澳大利亚、欧洲、印度、日本、新西兰和俄罗斯只接受了美国62/459,975和美国62/459,981的优先权权利要求。
● 美国针对抗IL-6-F的临时申请HAB融合蛋白,包括抗IL-6-FHAB,抗IL-6-FH抗转化生长因子β和抗IL-6-FHAB-抗-IL8融合蛋白;以及使用这种融合蛋白的治疗方法于2021年9月22日重新提交US 63/245,702。然而,很大程度上由于科学上的挑战,在申请临时专利后的一年内没有获得支持数据,因此,该专利被放弃。
| 24 |
●美国临时申请涉及抗原/白蛋白结合结构域结合物,以及使用这种结合物的治疗方法于2021年5月11日重新提交US 63/187,278。没有生成支持临时专利权利要求的数据,因此,该专利 被放弃。
●美国临时申请针对使用白介素6治疗年龄相关性虚弱的方法,于2021年6月4日提交,申请号为63/197,097,并于2022年6月3日转换为PCT专利。
● 美国针对基于抗体的药物结合物的临时申请于2021年12月7日提交,申请号为第63/286,996。由于一年时间内支持数据不足,此临时 专利被放弃。
●于2022年5月27日作为申请号63/346,368提交的针对IL-12-白蛋白结合结构域融合蛋白制剂及其使用方法的美国临时申请。这项临时专利于2023年5月26日转化为PCT申请(PCT/US2023/067566)。
●于2023年3月14日提交了针对低剂量IL-6制剂及其使用方法的美国临时申请,作为申请编号63/490,202。
●于2022年9月30日提交了针对低剂量IL-6制剂及其使用方法的美国临时申请,作为申请编号63/377,971。这项临时专利于2023年9月29日转化为PCT申请(PCT/US2023/075593)。
●美国临时申请针对使用重组IL-12白蛋白结合结构域融合蛋白治疗癌症的方法,于2022年11月2日提交,申请号为63/421,846。该临时专利于2023年11月1日转换为PCT申请(PCT/US2023/078366) 。
关于我们的商标组合,我们获得了世界知识产权局(WIPO)对Sonnet BioTreateutics和F的国际注册批准HAB标记,每个标记的生效日期为9月1日。17、2020年。此外,这两个商标均由欧盟知识产权局(EUIPO)公布,生效日期分别为2020年11月30日和2020年12月6日。2021年,美国专利商标局发布了这两个商标的补贴通知,表明这两个申请都已成功完成了反对期,并已成熟到提交了可接受的使用声明进行注册。为此,USPTO发布了Sonnet BioTreateutics和F的每一种使用声明的津贴通知HAB申请和Sonnet BioTreeutics标志已经获得了注册号为6,790,475的注册证书。
● 瑞士商标局于9月9日授予Sonnet BioTreeutics和FHAB商标保护。分别于2021年10月14日和2021年10月26日 ,受国际商标注册号保护。1558330和1558471。
● 加拿大知识产权局于2022年6月8日授予Sonnet BioTreateutics商标保护权,受国际商标注册号1558330保护,而FHAB商标受国际商标注册号15584471保护,反对期从2022年11月16日开始,为期18个月。
● 除了瑞士和加拿大,Sonnet BioTreeutics商标还在澳大利亚、欧盟、日本、墨西哥、韩国和英国获得保护,每个国家都有一个注册号。的有效注册日期为1558330年9月17日,续订日期为9月17日。17年,2030年。同样,FHAB商标在澳大利亚、中国、欧盟、日本、墨西哥、韩国和英国获得了保护,每个案例都有一个注册号。1558471,授予保护日期为9月1日。2020年7月17日,续订日期为9月9日17年,2030年。
● 尽管十四行诗生物治疗商标最初在中国被驳回,原因是针对某些竞争对手 公司的潜在非使用索赔,但我们律师事务所非常有信心,由于最初的42类驳回被成功取消,同一商标的两个新商标申请 也可以在2021年注册和/或发布;然而,我们要到2025年才能针对这些商标启动 非使用注销申请,这是预计这些未决的42类申请 可能在中国注册的时间框架。
| 25 |
员工
截至2023年9月30日,我们有12名全职员工。我们的员工没有工会代表,也没有集体谈判协议的覆盖范围,我们相信我们与员工的关系很好。此外,我们还利用独立承包商和 其他第三方协助其业务的各个方面。
政府 法规
药品(包括生物产品)的研究、开发、测试、制造、质量控制、批准、包装、储存、记录保存、标签、广告、促销、分销、营销、批准后监控和报告以及进出口均受到美国联邦、州和地方政府当局以及其他国家和司法管辖区的广泛监管。一些司法管辖区还对药品的定价进行监管。在美国及其他国家和司法管辖区获得营销批准的流程,以及随后对适用法规和法规及其他监管机构的遵守,都需要花费大量的时间和财力。
美国的生物制品许可证和监管
在美国,生物制品或生物制品受《公共卫生服务法》(PHSA)和《联邦食品、药品和化妆品法》(FDCA)及其实施条例的监管。在产品开发过程中的任何时间未能遵守适用的要求 可能会使申请人在进行研究、监管审查和批准、 和/或行政或司法处罚方面受到延误。这些制裁可能包括但不限于FDA拒绝允许申请者继续进行临床试验、拒绝批准未决申请、吊销或吊销执照、撤回批准、 产品召回、产品扣押、暂停生产或分销、禁令、罚款、调查以及民事和刑事处罚。生物制品候选产品必须获得FDA颁发的生物许可证,才能在美国合法上市。
FDA在美国获得生物许可证所需的 流程通常涉及以下内容:
● 完成广泛的非临床或临床前实验室试验和临床前动物试验,以及根据适用法规对实验动物的人道使用和配方研究的适用要求,包括良好的实验室实践、或GLP;
● 在启动任何人体临床试验之前,向美国食品和药物管理局提交正在研究的新药或IND申请。必须在此类审判开始之前获得继续进行的许可;
● 进行充分且控制良好的人体临床试验,以根据FDA的法规(通常称为良好临床实践)或GCP以及保护人体研究对象及其健康信息的任何附加要求,为每个建议的适应症确定候选产品的安全性、效力和纯度,以确定建议的生物制品用于其预期用途的安全性和有效性。FDA还可能在我们的临床试验之前或期间的任何时间,出于安全考虑或不符合规定的原因,对生物制品候选产品 实施临床搁置。如果FDA强制实施临床搁置,试验 不能在没有FDA授权的情况下重新开始,然后只能根据FDA授权的条款进行;
● 为请求营销一个或多个建议适应症的生物制品准备并向食品和药物管理局提交生物许可证申请,包括提交有关该产品在临床开发和建议标签方面的制造和成分的详细信息。
●由食品和药物管理局审查部门确定的食品和药物管理局顾问委员会对产品的审查;
● 圆满完成FDA对生产产品或其组件的一个或多个制造设施(包括第三方)的一次或多次检查,以评估符合当前良好制造规范或cGMP要求的情况,并确保设施、方法和控制足以保持产品的特性、强度、质量和纯度;
| 26 |
●满意地完成了一项或多项临床研究场地的FDA审核,以确保符合GCP,以及支持BLA的临床数据的完整性;
● 支付使用费,并确保FDA批准BLA和新生物制品的许可;
● 遵守任何审批后要求,包括实施风险评估和缓解战略的潜在要求, 或REMS,以及FDA要求的任何审批后研究。
非临床研究和探索性新药应用
每个候选产品在进行人体测试之前都必须经过非临床测试。这些测试包括产品化学、配方和稳定性的实验室评估,以及评估活性和毒性潜力的动物研究,并且必须遵守适用的法规进行。非临床试验的结果与生产信息和分析数据一起作为IND申请的一部分提交给FDA。IND在FDA收到后30天自动生效,除非在此之前FDA对拟议的临床试验的产品或进行提出担忧或问题,包括担心人类研究对象将暴露在不合理的健康风险中。在这种情况下,IND赞助商和FDA必须在临床试验开始之前解决FDA的任何悬而未决的问题。
提交IND可能导致FDA不允许试验开始,或不允许试验按发起人最初在IND中指定的条款进行。如果FDA提出担忧或问题,它可以选择在 临床试验之前或期间的任何时间对生物制品候选产品实施临床搁置,原因是安全问题或不符合规定。如果FDA强制临床搁置,试验不得在没有FDA授权的情况下重新开始 ,并且只有在FDA授权的条款下才能重新开始。
人类 支持血乳酸的临床试验
临床 试验涉及根据GCP要求,在合格首席研究人员的监督下,将研究产品候选给健康志愿者或要接受治疗的疾病患者 。作为IND的一部分,必须向FDA提交每项临床试验的方案和任何后续方案修改。希望在美国境外进行临床试验的赞助商可以(但不需要)获得FDA的授权,根据IND进行临床试验。如果外国临床试验不是在IND下进行的,赞助商可以将临床试验的数据提交给FDA以支持BLA,只要临床试验设计良好并符合GCP,包括由独立的道德 委员会审查和批准,并且FDA能够通过现场检查(如有必要)验证研究数据。
此外, 每项临床试验都必须由机构审查委员会或IRB进行审查和批准,审查委员会或IRB在将进行临床试验的每个机构集中或单独进行,对于在美国境外进行的试验,则必须由上文提到的独立伦理委员会进行审查和批准。IRB将考虑临床试验设计、患者知情同意、伦理因素和人类受试者的安全等因素。IRB的运作必须符合FDA的规定。FDA、IRB或临床试验赞助商可随时出于各种原因暂停或中止临床试验,包括发现临床试验未按照FDA要求进行,或受试者或患者面临不可接受的健康风险。临床检测还必须满足广泛的GCP规则和知情同意的要求。此外,一些临床试验由临床试验赞助商组织的独立的合格专家小组监督,称为数据安全监测委员会或委员会。 该小组可根据对研究中某些数据的访问,建议按计划继续研究、改变研究方法或在指定检查点停止研究。
临床试验通常分三个连续阶段进行,这些阶段可能重叠,也可能合并。批准后可能需要进行额外的研究。
● 第一阶段:该生物制品首先被引入健康的人体志愿者中,并进行安全性测试。在一些严重或危及生命的疾病的产品的情况下,特别是当产品本身的毒性可能太高而无法合乎道德地给健康志愿者使用时,最初的人体测试通常在患者身上进行,例如癌症患者。
| 27 |
● 第二阶段:在有限的患者群体中对候选生物制品进行评估,以确定可能的不良反应和安全风险,初步评估该产品对特定目标疾病的疗效,并确定剂量耐受性、最佳剂量和剂量计划。
● 第三阶段:在扩大的患者群体和地理分散的临床研究地点进行临床试验,以进一步评估剂量、临床疗效、效力和安全性。这些试验旨在确定产品的总体风险/收益比率,并为产品标签提供充分的依据。
● 第四阶段:批准后临床试验或第四阶段临床试验可在初步上市批准后进行。它们为预期治疗适应症患者的治疗提供了 额外经验,特别是长期安全跟踪。 如果FDA批准了一种产品,而一家公司正在进行不需要批准的临床试验,公司可以 使用这些临床试验的数据来满足任何第四阶段临床试验的全部或部分要求,或请求更改 产品标签。如果未能在进行所需的4期临床试验方面进行尽职调查,可能会导致撤回对产品的批准。
符合cGMP要求
在批准BLA之前,FDA通常会检查生产该产品的工厂,以确保制造工艺和工厂完全符合cGMP要求,并与所需规格保持一致。制造商和其他涉及产品制造和分销的企业也必须向FDA和某些州的机构进行登记。国内和国外的制造企业必须在首次参与生产过程时向FDA登记并提供附加信息。由未注册的工厂制造或从其进口的任何产品均被视为FDCA下的错误品牌。机构可能会受到政府当局的定期突击检查。制造商 可能需要提供有关其工厂的记录。
审查和批准BLA
产品候选开发、非临床测试和临床试验的结果作为BLA的一部分提交给FDA,以申请该产品的销售许可证 。BLA必须包含有关产品制造和组成的广泛而详细的信息,以及建议的标签和用户费用的支付。FDA在提交申请后有60天的时间进行初步审查,以确定BLA是否足以接受申请。一旦提交的申请被接受,FDA就开始进行深入的审查。FDA有12个月的时间完成对标准申请的初步审查(如果是优先审查,则有6个月的时间)并对申请人做出回应。FDA并不总是达到其目标日期,审查过程可能会因FDA要求提供更多信息或澄清而显著延长 。如果FDA要求,或者如果申请人在目标日期之前的最后三个月内提供了关于已在提交中提供的信息的其他信息或澄清,则审查过程和目标日期可以延长三个月。
根据FDA对申请的评估和相关信息,FDA可签发批准信、拒绝函或完整的回复信。批准函授权该产品的商业营销,并提供特定适应症的具体处方信息 。根据PHSA,如果FDA确定产品是安全、纯净和有效的,并且将生产该产品的设施符合旨在确保其继续安全、纯净和有效的标准,则FDA可以批准BLA。如果申请未获批准,FDA可能会发出完整的回复信,其中将包含为确保申请获得最终批准而必须满足的条件,并在可能的情况下列出赞助商为获得申请批准而可能采取的建议行动。收到完整回复信的赞助商可向FDA提交代表对FDA确定的问题的完整回复的信息。根据《处方药使用费法案》(PDUFA),此类重新提交根据申请人在回复行动信函时提交的信息,被分为 1类或2类。根据FDA根据PDUFA同意的目标和政策,FDA有两个月的时间审查1类重新提交的申请,有6个月的时间审查2类重新提交的申请。 FDA不会批准申请,直到完整的回复信中确定的问题得到解决。如果FDA确定该机构或产品不符合该机构的要求,则会发出一封否认信。
| 28 |
FDA还可以将申请提交给咨询委员会进行审查、评估和不具约束力的建议,以确定是否应批准申请 。特别是,FDA可能会将新的生物制品或提出安全性或有效性难题的生物制品的申请提交给咨询委员会。
如果FDA批准一种新产品,FDA可以限制其批准的适应症使用,并要求在产品标签中包括禁忌症、警告或预防措施。此外,FDA可能会要求进行批准后研究,包括4期临床试验,以进一步评估批准后该产品的安全性。FDA还可能要求测试和监控计划在产品商业化后对其进行监控,或者施加其他条件,包括分销限制或其他风险管理机制,包括REMS,以帮助确保产品的益处大于潜在风险。FDA可能会根据上市后研究或监测计划的结果,阻止或限制产品的进一步营销。经批准后,对经批准的产品的许多类型的更改,如增加新的适应症、制造更改和额外的标签声明,都要接受进一步的测试要求 和FDA的审查和批准。
快速跟踪、突破性治疗和优先审查指定
FDA有权指定某些产品进行快速审查,如果这些产品旨在满足在治疗严重或危及生命的疾病或状况时未得到满足的医疗需求。这些计划被称为(I)快速通道指定、(Ii)突破性治疗指定和(Iii)优先审查指定。
● 快速审查:如果一种产品打算(单独或与一种或多种其他产品联合使用)用于治疗严重或危及生命的疾病或状况,并且它显示出解决此类疾病或状况未得到满足的医疗需求的潜力,则FDA可指定该产品进行快速轨道审查。赞助商可能会与FDA有更多的互动,FDA可能会在申请完成之前对Fast Track产品申请的部分进行审查。赞助商还必须提供提交剩余信息的时间表,并且必须得到FDA的批准,并且赞助商必须支付适用的使用费。但是,FDA审查快速通道申请的时间段目标直到申请的最后部分提交后才开始。 FDA可能会撤回快速通道指定。
● 突破性疗法:产品可被指定为突破性疗法,如果该产品旨在单独或与一个或多个其他产品联合用于治疗严重或危及生命的疾病或状况,且初步临床证据表明该产品可能在一个或多个临床重要终点(如临床开发早期观察到的重大治疗效果)方面显示出显著改善,则该产品可能被指定为突破性疗法,并有资格获得快速审查。FDA可能会在突破性疗法方面采取某些行动。
● 优先审查:如果一种产品治疗严重情况,FDA可以指定该产品进行优先审查,如果获得批准,与其他可用的治疗方法相比, 将在安全性或有效性方面提供显著改善。这项评估是由FDA根据具体情况进行的。优先指定旨在将整体注意力和资源引导到对此类申请的评估上,并将FDA对营销申请采取行动的目标从10个月缩短至6个月。
加速了 审批途径
FDA可以加速批准一种严重或危及生命的疾病的产品,该产品为患者提供了比现有治疗更有意义的治疗优势 ,其基础是确定该产品对替代终点有影响,而该替代终点很有可能预测临床益处。如果产品对中间临床终点有影响,且可早于对不可逆发病率或死亡率或IMM的影响进行测量,并且考虑到疾病的严重性、稀有性或流行率以及可用或缺乏替代治疗, 合理地有可能预测对IMM或其他临床益处的影响,FDA也可批准加速批准此类疾病。获得加速批准的产品必须符合与获得传统批准的产品相同的安全和有效性法定 标准。
就加速审批而言,替代终点是一个标记,如实验室测量、放射图像、体征或其他被认为可预测临床益处但本身不是临床益处的衡量标准。代理终端 通常比临床终端更容易或更快速地进行测量。中间临床终点是对治疗效果的测量,它被认为合理地可能预测产品的临床益处,例如对IMM的效果。加速审批路径最常用于病程较长且需要延长时间来衡量产品的预期临床益处的环境中,即使对代用或中间临床终点的影响发生得很快。因此,加速批准已被广泛用于开发和批准用于治疗各种癌症的产品,其中治疗的目标通常是提高存活率或降低发病率,典型病程的持续时间需要漫长的 ,有时还需要大型试验来证明临床或生存益处。
| 29 |
加速审批途径通常取决于赞助商同意以勤奋的方式在批准后进行额外的验证性研究,以验证和描述产品的临床益处。因此,在此基础上批准的候选产品 必须遵守严格的上市后合规性要求,包括完成4期或批准后临床试验以确认对临床终点的影响。如果不进行所需的批准后研究,或在上市后研究期间未能确认临床益处,将允许FDA加速将该产品从市场上召回。所有根据加速法规批准的候选产品的促销材料 都必须经过FDA的事先审查。
审批后条例
即使获得监管部门的批准,上市产品也必须遵守联邦、州和外国法律法规的持续全面要求,包括不良事件报告、记录保存、营销和cGMP合规性方面的要求和限制。药物批准后报告的不良事件可能会导致对上市产品的使用施加额外限制,或要求进行额外的上市后研究或临床试验。
要基本遵守适用的联邦、州和地方法律法规,需要花费大量的时间和财力。FDA对生物制品的严格和广泛的监管在获得批准后仍在继续,特别是在cGMP要求方面。生物制品制造商和其他涉及经批准的生物制品的制造和分销的实体必须向FDA和某些州机构登记其机构,并接受FDA和某些州机构的定期突击检查,以确保其遵守cGMP要求和其他法律。我们将依赖,并预计将继续依赖第三方来生产我们可能商业化的任何产品的临床和商业批量。我们产品的制造商 必须遵守cGMP法规中适用的要求,包括质量控制和质量保证 以及记录和文档的维护。其他适用于生物制品的审批后要求包括记录保存要求、不良反应报告和报告最新的安全和疗效信息。
如果发现 以前未知的问题,或未能遵守与批准产品的制造商或促销相关的适用法规要求 ,可能会导致限制该产品的销售或将该产品从市场上召回 以及重大的行政、民事或刑事制裁。
孤儿 药品名称
美国的孤儿 药物指定旨在鼓励赞助商开发针对罕见疾病或疾病的产品。 在美国,法律将罕见疾病或疾病定义为在美国影响少于200,000人的疾病或疾病,或在美国影响超过200,000人的疾病,并且无法合理预期 针对该疾病或疾病的产品的开发和提供成本将从产品在美国的销售中收回 。
孤儿药 认定使公司有资格获得税收抵免和市场独占权,期限为产品 上市批准之日起七年(如果获得FDA批准)。可在提交产品上市批准申请之前的任何时间提出指定为孤儿药的申请。根据可接受的申请,FDA孤儿药开发办公室 或OOPD可将产品指定为孤儿药。然后,该产品必须像任何其他 产品一样通过审核和批准流程。孤儿药指定可以根据疾病发生率的变化而撤销。
| 30 |
申办者可以申请将以前未经批准的产品指定为孤儿药,或将已上市产品指定为新的孤儿药适应症。 此外,如果申办者能够提出合理的假设,证明其 产品在临床上可能优于第一种药物,则与已批准的孤儿药相同的产品的申办者可以为用于相同罕见疾病或病症的后续产品寻求并获得孤儿药 认定。针对同一罕见疾病或病症的同一产品 ,可能有多个申办者获得孤儿药认定,但每个寻求孤儿药认定的申办者必须提交完整的认定申请。
专营期从FDA批准上市申请之日开始,仅适用于该产品已被指定的 适应症。FDA可以批准同一产品的第二次申请用于不同的用途,或第二次申请该产品的临床更优版本用于相同的用途。然而,FDA不能在市场独占期内批准由另一制造商生产的相同产品用于相同的适应症,除非征得赞助商的同意或 赞助商无法提供足够的数量。
儿科 研究
根据《儿科研究公平法》,某些审批申请必须包括通常基于临床研究数据的对受试药物在相关儿科人群中的安全性和有效性的评估。FDA可以应公司的要求或FDA的倡议,免除或推迟儿科评估的要求。FDA可能会认定,风险评估和缓解策略对于确保新产品的益处大于风险是必要的。REM可能包括各种元素, 从药物指南或患者包装插入到对谁可以开出或分配药物的限制,这取决于FDA认为安全使用药物所必需的 。赞助商需要在与FDA的第二阶段会议结束后向其IND 提交初步儿科研究计划
欧盟药品审批条例和程序
为了在美国以外销售任何产品,公司还必须遵守其他国家/地区和司法管辖区的众多法规要求。无论产品是否获得FDA批准,申请人都需要获得 可比外国监管机构的必要批准,然后才能在这些国家或司法管辖区启动该产品的临床试验或营销。
临床试验批准
根据目前适用的临床试验指令2001/20/EC和关于GCP的指令2005/28/EC,欧盟已通过成员国的国家立法实施了临床试验审批制度。根据这一制度,申请人必须获得将在其中进行临床试验的欧盟成员国的主管国家当局的批准,如果要在多个成员国进行临床试验,则必须在多个成员国获得批准。此外,只有在独立的伦理委员会发表了赞成的意见后,申请者才可以在特定的研究地点开始临床试验。临床试验申请或CTA必须附有一份研究用药品档案,其中包含2001/20/EC号指令和2005/28/EC号指令以及成员国的相应国家法律规定的支持信息,并在适用的指南文件中进一步详细说明。
2014年4月,欧盟通过了新的临床试验条例(EU)第536/2014号,该条例将取代目前的临床试验指令2001/20/EC。预计新的临床试验条例将于2019年或2020年适用。它将彻底改革欧盟目前的临床试验审批制度。具体地说,这项将在所有成员国直接适用的新规定旨在简化欧盟临床试验的审批程序。例如,新的 临床试验条例规定了简化的申请程序,使用单一入口点和严格定义的截止日期进行临床试验申请的评估。
营销 授权
要根据欧盟监管体系获得产品的营销授权,申请者必须提交MAA,该MAA由欧盟监管机构管理的中央程序或欧盟成员国主管当局管理的程序之一(分散程序、国家程序或互认程序)提交。只有在欧盟设立的申请者才能获得营销授权。申请人必须证明符合EMA批准的涵盖儿科人群所有子集的儿科调查计划(PIP)中包括的所有措施,除非EMA已批准特定产品的豁免、类别豁免或推迟PIP中包括的一项或多项措施。
| 31 |
集中化程序规定由欧盟委员会授予对所有欧洲联盟成员国均有效的单一营销授权。对于特定产品是强制性的,包括通过某些生物技术工艺生产的药品、被指定为孤儿药品的产品、高级治疗产品以及含有用于治疗某些疾病的新活性物质的产品,包括用于治疗癌症的产品。对于含有用于治疗其他疾病的新活性物质的产品,以及高度创新的产品或符合患者利益的集中流程, 集中流程可能是可选的。
根据 集中程序,EMA设立的人用药品委员会(CHMP)负责 对产品进行评估,以确定其风险/获益特征。在集中程序下, MAA评估的最长时限为210天,不包括申请人在回应CHMP问题时提供额外信息或书面或口头解释的时钟停止。在特殊情况下,当 药品从公共卫生的角度,特别是从治疗 创新的角度来看具有重大意义时,CHMP可以批准加速评价。
授权和续订的期限
原则上, 上市许可的有效期为5年,5年后可根据EMA或授权成员国的主管机构对风险受益平衡的重新评估 进行更新。一旦更新,上市许可 无限期有效,除非欧盟委员会或主管机构基于与 药物警戒相关的合理理由决定再进行一次为期五年的更新。在授权失效后 三年内,未将药品 投放欧盟市场(在集中程序的情况下)或授权成员国市场的任何授权失效。
上市许可后的监管 要求
获得 批准后,上市许可证持有人必须遵守适用于药品生产、 上市、推广和销售的一系列要求。其中包括遵守欧盟严格的药物警戒 或安全性报告规则,根据这些规则,可以实施许可后研究和额外的监测义务。此外, 授权产品的生产(必须获得单独的生产商许可证)也必须严格 遵守EMA的GMP要求和欧盟其他监管机构的类似要求,这些要求 规定了药品生产、加工和包装中使用的方法、设施和控制措施,以确保其安全性和特性。 最后,授权产品的营销和推广,包括行业赞助的针对药物处方者和/或公众的继续医学教育和广告 ,在欧盟受到经修订的指令2001/83 EC 的严格监管。
孤儿 药品名称和排他性
Regulation (EC) No. 141/2000 and Regulation (EC) No. 847/2000 provide that a product can be designated as an orphan drug by the European Commission if its sponsor can establish: that the product is intended for the diagnosis, prevention or treatment of (1) a life-threatening or chronically debilitating condition affecting not more than five in ten thousand persons in the European Union when the application is made, or (2) a life-threatening, seriously debilitating or serious and chronic condition in the European Union and that without incentives it is unlikely that the marketing of the drug in the European Union would generate sufficient return to justify the necessary investment. For either of these conditions, the applicant must demonstrate that there exists no satisfactory method of diagnosis, prevention, or treatment of the condition in question that has been authorized in the European Union or, if such method exists, the drug has to be of significant benefit compared to products available for the condition. An orphan drug designation provides benefits such as fee reductions, regulatory assistance and the possibility to apply for a centralized European Union marketing authorization. Marketing authorization for an orphan drug leads to a ten-year period of market exclusivity. The market exclusivity period may however be reduced to six years if, at the end of the fifth year, it is established that the product no longer meets the criteria for orphan drug designation.
美国的组合 产品
某些 产品,即组合产品,可能由通常由不同类型的监管机构监管的成分组成,通常由FDA的不同中心监管。组合产品可以是(I)由两个或两个以上受监管的 成分组成的产品,这些成分以物理、化学或其他方式组合或混合,作为一个单一实体生产;(Ii)两个或两个以上单独的产品,包装在一个单独的包装中或作为一个单元,由药品和器械产品、器械和生物制品或生物和药品产品组成;(3)单独包装的药品、器械或生物制品,根据其研究计划或拟议的标签仅拟与经批准的单独指定的药品、器械或生物制品一起使用,如果两者都需要达到预期的用途、适应症或效果,并且在拟议的产品获得批准后,需要更改 核准产品的标签,例如,以反映预期用途、剂型、浓度、给药途径的变化、 或剂量的重大变化;或(Iv)单独包装的任何研究用药物、装置或生物制品,根据 其建议的标签仅用于另一单独指定的研究用药、装置或生物制品,而这两种药物、装置或生物制品都需要 以达到预期的用途、适应症或效果。FDA负责指定具有主要管辖权的中心或牵头中心对组合产品进行审查,这一决定基于组合产品的 “主要行动模式”。赞助商可以通过向组合药品办公室提交指定请求来请求管辖权确定。
| 32 |
与强安蒂克利尔合并并收购Relipment
本10-K表格年度报告由Sonnet BioTreateutics Holdings,Inc.(“Sonnet Holdings”、“WE”、“Us”、 “Our”或“Company”)提交,前身为强安蒂克利尔控股公司。在2020年3月31日之前,该公司一直在国内和国际拥有、经营和特许经营快速休闲餐饮概念。如先前披露,本公司于2020年4月1日完成与十四行诗生物治疗公司(“十四行诗”)的合并交易,而十四行诗成为本公司的全资附属公司(“合并”)。2020年4月1日,与合并有关,公司更名为“Sonnet BioTreateutics Holdings,Inc.”。十四行诗于2015年4月6日注册成立为新泽西州公司。
合并被本公司视为反向合并,并根据美国公认会计原则(“美国公认会计原则”)作为反向资本重组入账。就会计目的而言,十四行诗被视为已收购该公司。
在合并后及合并前,本公司将与本公司餐饮业务有关的所有资产及负债转让给新成立的本公司全资附属公司amergent Hotel Group,Inc.(“amergent”)。该股息连同上述对公司餐饮业务的贡献和转让,称为“分拆”。在剥离之前,阿美金特没有从事任何业务或运营。
作为分拆和合并的结果,自2020年4月1日以来,公司一直通过十四行诗及其直接和间接子公司运营 ,公司的持续业务是十四行诗业务。
此外,于2020年4月1日,与合并有关及于合并前,十四行诗已完成向救济治疗控股公司(“救济 控股”)收购阿特沙金阿尔法(低剂量白介素6,IL-6,现为“SON-080”的低剂量制剂)的全球开发权,收购救济控股的全资附属公司救济治疗公司(“救济”),以换取在合并中向救济控股发行合共2,460股公司普通股的十四网普通股。
公司 和现有信息
根据特拉华州的法律,该公司成立于1999年10月21日,原名为Tulvine Systems,Inc.。2005年4月25日,Tulvine Systems,Inc.成立了全资子公司Chonancleer Holdings,Inc.,2005年5月2日,Tulvine Systems,Inc.与Chancleer Holdings,Inc.合并并更名为Chancleer Holdings,Inc.。2020年4月1日,根据本公司、Sonnet和Biosub Inc.之间日期为2019年10月10日的合并协议和计划的条款,本公司完成了与Sonnet BioTreateutics,Inc.(以下简称Sonnet)的业务合并。本公司的全资附属公司(“合并附属公司”)(“合并协议”),根据该协议,合并附属公司与十四行诗合并并并入十四行诗,而十四行诗作为本公司的全资附属公司(“合并”)继续存在(“合并”)。根据合并协议的条款,本公司于紧接合并前向十四行诗股东发行普通股 ,汇率为每股已发行十四行诗普通股换0.106572股已发行普通股 。与合并相关的是,该公司将其名称从“强安蒂克利尔控股公司”改为“Sonnet BioTreateutics Holdings,Inc.”,公司经营的业务变成了Sonnet开展的业务。
我们的主要执行办公室位于新泽西州普林斯顿08540号第102室俯瞰中心100号。我们的电话号码是(609) 375-2227,公司网址是https://www.sonnetbio.com/.我们将网站地址包含在本年度报告的表格 10-K中,仅作为非活动文本参考,并不打算将其作为指向我们网站的活动链接。网站上的信息未以参考方式并入本10-K表格年度报告中。
本 年度报告Form 10-K、季度报告Form 10-Q、当前报告Form 8-K和对这些报告的所有修订,以及我们提交给美国证券交易委员会(“美国证券交易委员会”)的其他文件,在以电子方式提交给美国证券交易委员会或以电子方式提交给美国证券交易委员会后,可在合理可行的范围内尽快通过我们网站的投资者部分免费获取。公众可以获得我们向美国证券交易委员会备案的文件,网址为Www.sec.gov。
| 33 |
第 1a项。风险因素。
投资我们的普通股涉及很高的风险,包括您的全部投资损失的风险。您应仔细 考虑以下描述的风险和不确定性,以及本报告和我们提交给美国证券交易委员会的其他报告中包含的其他信息。下面列出的风险并不是我们面临的唯一风险。可能存在其他风险和不确定因素,这些风险和不确定性也可能对我们的业务、运营和财务状况产生不利影响。如果实际发生以下任何风险,我们的业务、财务状况和/或运营都可能受到影响。在这种情况下,我们普通股的价值可能会下降,您可能会损失所有 或您为我们普通股支付的很大一部分钱。
风险因素摘要
| ● | 我们 有重大运营亏损的历史,预计在可预见的未来将出现重大且不断增加的亏损, 我们可能永远不会实现或保持盈利。 | |
| ● | 我们在运营中的反复亏损令人对我们作为持续经营企业的持续经营能力产生了极大的怀疑。 | |
| ● | 我们 将需要大量额外资金,如果我们无法在需要时筹集资金,我们可能会被迫推迟、减少 或取消我们的产品发现和开发计划或商业化努力。 | |
| ● | 我们 在很大程度上依赖于我们内部开发计划的成功,我们的候选产品可能无法 成功完成临床试验、获得监管批准或成功商业化。 | |
| ● | 我们 处于开发工作的非常早期阶段,我们的候选产品代表着一种新的药物类别,可能会 受到更严格的监管审查,直到它们被确立为治疗方式。 | |
| ● | 即使我们完成了必要的临床前研究和临床试验,营销审批流程也非常昂贵、耗时 且不确定,可能会阻止我们或任何合作伙伴获得部分或全部候选产品商业化的审批。 因此,我们无法预测我们或任何合作伙伴将在何时、是否以及在哪些地区获得将候选产品商业化的营销批准。 | |
| ● | 我们面临着激烈的竞争,如果我们的竞争对手开发和销售比我们开发的候选产品更有效、更安全或更便宜的产品 ,我们的商业机会将受到负面影响。 | |
| ● | 任何当前或未来候选产品的商业成功将取决于医生、患者、付款人和医学界其他人对市场的接受程度。 | |
| ● | 对于 某些候选产品,我们可能依赖开发和商业化合作伙伴来开发和进行临床试验 ,获得监管部门对候选产品的批准,如果获得批准,则营销和销售候选产品。如果此类合作者未能按预期执行 ,我们从此类候选产品中获得未来收入的潜力将显著降低,我们的业务将受到损害。 | |
| ● | 我们 将依靠包括独立临床研究人员和CRO在内的第三方来进行和赞助我们候选产品的一些临床试验 。第三方未能履行其在候选产品临床开发方面的义务 候选产品可能会推迟或削弱我们获得监管部门批准候选产品的能力。 | |
| ● | 如果我们无法为我们的产品和候选产品获得并维护专利和其他知识产权保护,或者 如果获得的专利和其他知识产权保护的范围不够广泛,我们的竞争对手可能会开发 与我们相似或相同的产品并将其商业化,我们成功将我们的产品和候选产品商业化的能力可能会受到不利影响 。 | |
| ● | 我们 希望扩大我们的组织,因此,我们在管理我们的增长时可能会遇到困难,这可能会中断我们的 运营。 | |
| ● | 我们 预计在可预见的未来不会支付现金股息,因此投资者不应预期他们的 投资将获得现金股息。 |
| 34 |
与我们的财务状况和额外资本需求相关的风险
我们 有重大运营亏损的历史,预计在可预见的未来将出现重大且不断增加的亏损, 我们可能永远不会实现或保持盈利。
我们 预计短期内不会产生为我们的运营融资所必需的收入或盈利能力。截至2023年9月30日和2022年9月30日,我们的净亏损分别为1,880万美元和2,970万美元。截至2023年9月30日,我们的累计赤字为1.102亿美元。
到目前为止,我们还没有将任何产品商业化,也没有从产品销售中获得任何收入,如果没有实现足够的产品销售收入,我们未来可能永远不会实现盈利。我们将几乎所有的财政资源和努力都投入到研究和开发上,包括临床前研究和临床试验。我们的净亏损可能会因季度和年度而大幅波动 。净亏损和负现金流已经并将继续对我们的股东(赤字)权益和营运资本产生不利影响。
我们 预计,如果我们:
● 继续针对我们的主要候选产品SON-080和其他候选产品进行开发和临床试验;
● 为任何未来的候选产品启动并继续研究、临床前和临床开发工作;
● 寻求发现和开发更多候选产品,并进一步扩大我们的临床产品线;
● 为成功完成临床试验的任何候选产品寻求营销和监管批准;
● 需要为临床开发和潜在的商业化生产更大数量的候选产品;
● 维护、扩大和保护我们的知识产权组合;
● 扩展我们的研发基础设施,包括招聘和保留更多人员,如临床、质量控制和科学人员;
● 在未来建立销售、营销、分销和其他商业基础设施,以便将我们获得 市场批准的产品商业化(如果有);
● 增加运营、财务和管理信息系统和人员,包括支持我们的产品开发和商业化的人员,并帮助我们履行上市公司的义务;以及
● 添加设备和物理基础设施以支持我们的研发。
我们实现盈利并保持盈利的能力取决于我们授权产品和创造收入的能力。产品收入的产生 将取决于我们是否有能力为我们的一个或多个候选产品获得市场批准,并成功将其商业化。
成功的 商业化将需要实现关键里程碑,包括完成我们的候选产品的临床试验,获得这些候选产品的营销批准,制造、营销和销售我们或任何合作伙伴可以获得营销批准的产品,满足任何上市后要求,并从私人保险 或政府付款人那里获得我们产品的报销。由于与这些活动相关的不确定性和风险,我们无法准确预测收入的时间和金额,以及我们是否或何时可能实现盈利。我们和任何合作者可能永远不会在这些活动中成功 ,即使我们或任何合作者成功了,我们也可能永远不会产生足够大的收入来实现盈利。即使我们确实实现了盈利,我们也可能无法维持或提高季度或年度盈利能力。
我们的 如果不能盈利并保持盈利,将压低我们普通股的市场价格,并可能削弱我们筹集资金、扩大业务、使产品多样化或继续运营的能力。如果我们继续蒙受损失,投资者可能无法从他们的投资中获得任何回报,并可能失去他们的全部投资。
| 35 |
我们有限的运营历史可能会使您很难评估我们业务到目前为止的成功程度,也难以评估我们未来的生存能力。
我们的业务于2015年开始运营。到目前为止,我们的业务仅限于为我们的公司提供资金和人员,开发我们的 技术,为我们的候选产品进行临床前研究和早期临床试验,并寻求战略合作 来推进我们的候选产品。我们尚未证明有能力成功进行后期临床试验、获得 上市批准、制造商业规模的产品或安排第三方代表我们这样做,或进行成功的产品商业化所需的销售和营销活动。因此,您应该根据公司在开发早期阶段经常遇到的成本、不确定性、延误和困难来考虑我们的前景,特别是像我们这样的临床阶段的生物制药公司。如果我们拥有更长的运营历史或成功开发和商业化医药产品的历史,您对我们未来成功或生存能力的任何预测都可能不像 那样准确。
我们 在实现我们的业务目标时可能会遇到不可预见的费用、困难、复杂情况、延误和其他已知或未知因素。 我们最终需要从一家专注于发展的公司过渡到一家能够支持商业活动的公司。 我们在这种过渡中可能不会成功。
我们 预计,由于各种因素,我们的财务状况和经营业绩将继续在每个季度和每年大幅波动 ,其中许多因素是我们无法控制的。因此,您不应依赖任何季度或年度业绩作为未来运营业绩的指标。
我们在运营中的反复亏损令人对我们作为持续经营企业的持续经营能力产生了极大的怀疑。
我们 自成立以来一直在运营活动中产生经常性亏损和负现金流,我们预计在可预见的未来,主要由于我们潜在产品的研发成本,运营活动将产生亏损和负现金流 。截至2023年9月30日,我们拥有230万美元的现金,股东赤字为20万美元。我们相信,我们在2023年9月30日的现金,加上我们在2023年10月24日公开发行普通股和认股权证所获得的410万美元净收益,将为我们预计到2024年3月的运营提供资金。我们还预计将从澳大利亚的研发税收激励计划获得80万美元的现金净退款(请参阅综合财务报表的附注2),并且最近初步批准了我们的申请,即通过技术营业税证书转让计划出售最多480万美元的新泽西州净营业亏损 ,但须执行此类销售(请参阅综合财务报表的附注10)。我们将需要大量额外资金来为我们的运营提供资金。这些因素使人对我们作为一家持续经营的公司继续经营的能力产生很大怀疑。随附的综合财务报表 乃以持续经营为基础编制,考虑正常业务过程中的资产变现及负债清偿情况 。合并财务报表不包括这种不确定性的结果 可能导致的任何调整。
我们 未来将通过股权或债务融资、合作伙伴关系、合作或其他来源需要更多资金,以开展我们计划的开发活动。如果在需要时无法获得额外资金,我们可能需要推迟或缩减运营 ,直到收到此类资金。各种内部和外部因素将影响我们的候选产品是否以及何时获得市场营销和成功商业化的批准 。我们候选产品的监管批准和市场接受度、开发和商业化这些候选产品的时间长度 以及这些候选产品的开发和商业化成本和/或它们在审批过程的任何阶段失败都将对我们的财务状况和未来运营产生重大影响。
自成立以来,运营 主要包括组织我们、获得融资、通过进行研究和开发来开发技术以及进行临床前研究。我们面临着与其产品正在开发中的公司相关的风险。这些 风险包括需要额外资金来完成其研发、实现其研发目标、 保护其知识产权、招聘和留住技术人员以及对关键管理层成员的依赖。
我们作为持续经营企业的持续经营能力取决于我们筹集额外股本或债务资本或剥离非核心资产的能力 以筹集额外现金。如果我们无法筹集足够的额外资金,我们可能需要采取成本削减措施 ,包括推迟或停止某些临床活动。
未来任何融资的来源、时间和可用性将主要取决于市场状况,更具体地说,取决于我们临床开发计划的进展。在需要的时候,可能根本就没有资金,或者是在我们可以接受的条件下。由于缺乏必要的资金,我们可能需要推迟、缩减或取消部分或全部计划中的临床试验。除其他因素外,这些 因素使人对我们作为一家持续经营企业的持续经营能力产生了极大的怀疑。
| 36 |
我们 将需要大量额外资金,如果我们无法在需要时筹集资金,我们可能会被迫推迟、减少或取消我们的产品发现和开发计划或商业化努力。
开发药物产品,包括进行临床前研究和临床试验,是一个非常耗时、昂贵和不确定的过程,需要数年时间才能完成。例如,在截至2023年9月30日和2022年9月30日的年度中,我们分别使用了2,130万美元和2,780万美元的净现金用于我们的经营活动,基本上所有这些活动都与研发活动有关。我们 预计与我们正在进行的活动相关的费用将增加,特别是当我们启动新的临床试验,为我们当前的候选产品或任何未来的候选产品 启动新的研究和临床前开发工作并寻求营销批准 。此外,如果我们的任何候选产品获得营销批准,我们可能会产生与产品销售、营销、制造和分销相关的巨额商业化费用 ,因为此类销售、营销、制造和分销不是合作伙伴的责任。此外,由于合并,我们将继续产生与上市公司运营相关的巨额成本。因此,我们将需要获得与我们持续运营相关的大量额外资金。如果我们无法在需要时或在有吸引力的条件下筹集资金,我们可能会被迫推迟、减少或取消我们的研发计划或任何未来的商业化努力。
我们 将需要花费大量资金来推进我们正在开发的候选产品以及我们可能寻求开发的其他候选产品的开发。此外,虽然我们可能会为我们的 候选产品的未来开发寻找一个或多个合作伙伴,但我们可能无法以合适的 条款及时或根本无法与我们的任何候选产品合作。无论如何,我们现有的现金将不足以为我们计划进行的所有工作提供资金,也不足以为我们的任何候选产品的开发完成提供资金。因此,我们将被要求通过公开或私募股权发行、债务融资、合作和许可安排或其他来源获得更多 资金。我们没有任何承诺的外部资金来源。我们可能无法按可接受的条款或全部获得足够的额外融资。我们未能在需要时筹集资金,将对我们的财务状况和我们实施业务战略的能力产生负面影响。
我们的 估计可能被证明是错误的,我们可以比目前预期的更快地使用可用的资本资源。此外,不断变化的情况,其中一些情况可能超出我们的控制,可能会导致我们消耗资本的速度大大快于我们目前的预期,我们 可能需要比计划更早地寻求额外资金。我们未来的资金需求,无论是短期还是长期,将取决于许多因素,包括:
● 我们当前和未来的候选产品的临床试验的范围、进度、时间、成本和结果,以及研究和临床前开发工作;
● 我们订立任何合作、许可或其他安排的能力、条款和时间安排;
● 我们为我们的管道确定一个或多个未来候选产品的能力;
● 我们追求的未来候选产品的数量及其开发要求;
● 寻求监管批准的结果、时间和成本;
● 任何获得营销批准的候选产品的商业化活动的成本,只要此类成本 不是任何合作者的责任,包括建立产品销售、营销、分销 和制造能力的成本和时间;
● 从我们当前和未来候选产品的商业销售中获得的营销批准、收入(如果有);
● 随着我们扩大研发和建立商业基础设施,我们的员工人数增长和相关成本;
● 准备、提交和起诉专利申请、维护和保护我们的知识产权(包括 执行和辩护知识产权相关索赔)的成本;以及
● 作为上市公司运营的成本。
| 37 |
筹集 额外资本可能会稀释我们现有股东的权益,限制我们的运营或导致我们放弃宝贵的权利。
We may seek additional capital through a combination of public and private equity offerings, debt financings, strategic partnerships and alliances, licensing arrangements or monetization transactions. To the extent that we raise additional capital through the sale of equity, convertible debt securities or other equity-based derivative securities, your ownership interest will be diluted and the terms may include liquidation or other preferences that adversely affect your rights as a shareholder. Any indebtedness we incur would result in increased fixed payment obligations and could involve restrictive covenants, such as limitations on our ability to incur additional debt, limitations on our ability to acquire or license intellectual property rights and other operating restrictions that could adversely impact our ability to conduct our business. Furthermore, the issuance of additional securities, whether equity or debt, by us, or the possibility of such issuance, may cause the market price of our common stock to decline and existing shareholders may not agree with our financing plans or the terms of such financings. If we raise additional funds through strategic partnerships and alliances, licensing arrangements or monetization transactions with third parties, we may have to relinquish valuable rights to our technologies, or our product candidates, or grant licenses on terms unfavorable to us. Adequate additional financing may not be available to us on acceptable terms, or at all. If we are unable to raise additional funds when needed, we may be required to delay, limit, reduce or terminate our product development or future commercialization efforts or grant rights to develop and market product candidates that we would otherwise prefer to develop and market ourselves.
与我们候选产品的发现、开发和监管批准相关的风险
冠状病毒COVID-19大流行或任何其他传染病的广泛爆发可能对我们的 业务、财务状况及经营业绩造成重大不利影响。
我们 面临与流行病或传染病爆发相关的风险,例如,最近在世界各地爆发的 高传染性和致病性冠状病毒COVID-19。此类传染病的爆发可能导致广泛的健康 危机,从而对许多国家的一般商业活动以及经济和金融市场产生不利影响。
于 2019年12月,一种新型冠状病毒株COVID-19据报道在中国武汉出现,并于2020年3月11日被世界卫生组织宣布为大流行。COVID-19对我们临床前和临床试验运营的影响程度将 取决于未来的发展,这些发展具有高度不确定性,无法有信心地预测,例如爆发的持续时间和地理范围、COVID-19的严重程度以及遏制和治疗COVID-19的行动的有效性。
世界各地许多 国家对旅行和大型集会实施禁令和限制,以减缓COVID-19的传播,并关闭了非必要的业务,尽管这些限制目前在大多数情况下已经失效。此类事件可能导致 业务、供应和药品生产中断,并导致运营减少,其中任何一项都可能对我们的业务、 财务状况和运营结果产生重大影响。
这种 大流行或爆发可能导致难以确保临床试验中心位置、CRO和/或试验监查员以及支持试验的其他关键 供应商和顾问的安全。此外,在临床试验地点附近爆发或感知到爆发 可能会影响我们招募患者的能力。这些情况或其他与COVID-19相关的情况可能导致我们的临床 试验计划延迟,并可能增加预期成本,所有这些都可能对我们的业务及其财务状况产生重大不利影响。
特别是,我们的管道产品(SON-1010除外)的生产因COVID-19相关供应链问题而延迟,特别是原材料(包括培养基、树脂和分析试剂盒)的供应,加上国际运输延迟。然而,COVID-19目前并未影响我们的业务。
| 38 |
虽然 新冠肺炎或任何其他传染病的广泛爆发可能带来的潜在经济影响及其持续时间可能难以评估或预测 但大流行可能导致全球金融市场严重混乱, 降低我们获得资本的能力,这可能在未来对我们的流动性产生负面影响。此外,新冠肺炎或任何其他传染性疾病传播导致的经济衰退或 市场回调可能会对我们的业务和 我们普通股的价值产生重大影响。
疫情还可能影响我们的员工和与我们合作的各方开展我们的非临床、临床和药物生产活动的能力。我们依赖或将来可能依赖临床站点、研究人员和其他研究人员、顾问、独立承包商、合同研究组织和其他第三方服务提供商来帮助我们管理、监控 以及以其他方式执行我们的非临床研究和临床试验。我们还依赖或将来可能依赖顾问、独立承包商、合同制造组织和其他第三方服务提供商来协助我们管理、监控和以其他方式执行我们的原料药生产、配方和药品制造活动。大流行将影响任何这些外部人员、组织或公司将足够的时间和资源投入到我们的计划或为我们执行工作的旅行的能力。
新冠肺炎爆发或任何其他传染病的广泛爆发对当前或未来临床研究的进行可能产生的负面影响包括延迟从监管机构获得反馈、启动新的临床研究以及招募 受试者参加正在登记的研究。潜在的负面影响还包括无法在研究地点进行研究访问, 安全性和有效性数据收集不完整,正在进行的研究中受试者辍学率较高,研究数据进入数据库的地点延迟,由于对研究地点的物理访问限制,研究数据的监控延迟,站点对查询的响应延迟,数据库锁定延迟,数据分析延迟,顶级数据的时间延迟,以及完成研究报告的延迟 。新的或恶化的新冠肺炎(或任何其他传染性疾病)中断或限制可能会 对我们的非临床研究、临床试验和药物生产活动产生进一步的负面影响。
我们 在很大程度上依赖于我们内部开发计划的成功,我们的候选产品可能无法 成功完成临床试验、获得监管批准或成功商业化。
我们未来的成功将在很大程度上取决于我们内部开发计划和我们渠道计划候选产品的成功。
我们成功地将我们的渠道和其他候选产品商业化的能力将取决于我们的能力,其中包括:
● 成功完成临床前研究和临床试验;
● 获得美国食品和药物管理局、欧洲药品管理局和其他类似监管机构的监管批准;
● 建立并维护与第三方的合作,以开发和/或商业化我们的候选产品,或者 建立并维护强大的开发、销售、分销和营销能力,足以开发产品并启动任何经批准的产品的商业销售 ;
● 从政府医疗保健系统和保险公司等付款人那里获得保险和足够的补偿,并实现具有商业吸引力的定价水平;
● 确保医生、医疗保健付款人、患者和医学界接受我们的产品候选;
● 通过验证的流程,在经过监管机构(包括食品和药物管理局)检查和批准的制造设施中生产足够数量的候选产品,以实现成功的商业化;
● 在临床试验和商业化导致费用增加的情况下管理我们的支出;以及
● 为任何经批准的产品和候选产品获取并强制执行足够的知识产权。
| 39 |
在制药业大量正在开发的药物中,只有一小部分药物 向FDA提交了新药申请(NDA)或生物制品许可申请(BLA),更少的药物获得了商业化批准。此外, 即使我们确实获得了营销我们的候选产品的监管批准,任何此类批准也可能会受到我们可能营销该产品的指定用途或患者群体的限制。因此,即使我们能够获得必要的资金以继续为我们的开发计划提供资金,我们也不能向您保证我们的候选产品将成功开发或商业化。 如果我们无法开发或获得监管部门的批准,或者如果我们的候选产品无法成功商业化, 我们可能无法产生足够的收入来继续我们的业务。
我们 处于开发工作的非常早期阶段,我们的候选产品代表着一种新的药物类别,可能会 受到更严格的监管审查,直到它们被确立为一种治疗方式。
我们的 候选流水线产品代表了一种新的治疗方式,包括使用完全人类白蛋白结合结构域来提供 治疗产品。我们的候选产品可能无法在患者身上展示我们认为它们 可能具有的任何或全部药理益处。我们还没有、也可能永远不会成功地证明这些或任何其他候选产品的有效性和安全性 在临床试验中或之后获得市场批准。
监管机构对我们的候选产品没有经验,可能要求提供超出我们 在开发计划中所包含的安全性和有效性的证据。在这种情况下,我们候选产品的开发可能比 预期的成本或时间更高,我们的候选产品可能被证明是不可行的。
如果我们的开发努力不成功,我们可能无法推进候选产品的开发、将 产品商业化、筹集资金、扩大业务或继续运营。
我们的候选产品和任何合作伙伴的产品都将需要经过耗时且昂贵的临床前和临床试验, 其结果不可预测,而且失败的风险很高。如果我们或他们的候选产品的临床前或临床试验未能令人满意地向FDA、EMA和任何其他类似的监管机构证明安全性和有效性, 可能会产生额外的成本或延迟完成,这些候选产品的开发或他们的开发可能会被放弃 。
美国的FDA、欧盟和欧洲经济区的EMA以及其他司法管辖区的其他类似监管机构必须批准新的候选产品,然后才能在这些地区进行营销、推广或销售。我们之前没有 向FDA提交过IND或BLA,也没有向类似的外国监管机构提交过类似的药品审批文件。我们必须向这些监管机构提供来自临床前研究和临床试验的数据,以证明我们的候选产品对于特定适应症是安全有效的,然后才能被批准用于商业销售。 我们不能确定我们的候选产品的临床试验是否会成功,或者我们的任何候选产品将 获得FDA、EMA或任何其他类似监管机构的批准。
临床前研究和临床试验是漫长、昂贵和不可预测的过程,可能会受到广泛延误的影响。我们不能保证 任何临床试验将按计划进行或按计划完成(如果有的话)。完成候选产品商业化所需的临床前研究和临床试验可能需要数年时间并需要大量的 支出,而延迟或失败在本质上是不可预测的,并且在任何阶段都可能发生。除了我们预期的试验和测试之外,我们还可能需要对我们的候选产品进行额外的临床试验或其他测试 ,这可能会导致我们产生额外的计划外成本 或导致临床开发的延迟。此外,我们可能需要重新设计或以其他方式修改与正在进行或计划中的临床试验有关的计划,而更改临床试验的设计可能既昂贵又耗时。在一个或多个试验中出现不利的 结果将是我们的候选产品和我们的重大挫折。一个或多个试验中的不利结果 可能需要我们推迟、缩小或取消一个或多个产品开发计划,这可能会对我们的业务、财务状况、运营结果和未来增长前景产生实质性的不利影响。
许多导致或导致临床试验延迟开始或完成的因素也可能最终导致我们的候选产品被拒绝上市批准。FDA、EMA或任何其他类似的监管机构可能不同意我们的临床试验设计和我们对临床试验数据的解释,或者即使在审查了 并对我们的临床试验设计进行了评论后,也可能更改审批要求。
| 40 |
在我们候选产品的临床试验中,我们面临许多风险,包括以下风险:
● 对于相同的适应症,候选产品无效或劣于现有批准的产品;
● 候选产品导致或与不可接受的毒性或具有不可接受的副作用相关;
● 患者可能死亡或遭受不良反应,其原因可能与正在测试的候选产品有关,也可能与之无关;
● 该结果可能不能证实早期试验的阳性结果;
● 结果可能不符合食品和药物管理局、食品药品监督管理局或其他相关监管机构所要求的统计显著性水平,以确定我们的候选产品的安全性和有效性,以供继续试验或上市批准;以及
● 我们的协作者可能无法或不愿履行其合同。
此外, 出于规划目的,我们有时会估计完成各种科学、临床、法规和其他产品开发目标的时间。 这些里程碑可能包括我们对开始或完成科学研究、临床试验、提交监管文件或商业化目标的期望。我们可能会不时地公开宣布其中一些里程碑的预期时间,例如完成正在进行的临床试验、启动其他临床计划、 收到市场批准或产品的商业发布。其中许多里程碑的实现可能超出了我们的控制范围。所有这些里程碑都基于各种假设,这可能会导致里程碑的实现时间与我们的估计大不相同。如果我们未能在预期的时间范围内实现里程碑,我们的候选产品的商业化可能会被推迟,我们可能没有资格获得某些合同付款,这可能会对我们的业务、财务状况、运营结果和未来增长前景产生实质性的不利影响 。
我们 可能会发现很难将患者纳入我们的临床试验,这可能会推迟或阻止我们继续进行候选产品的临床试验 。
确定 并使患者有资格参与我们候选产品的临床试验对我们的成功至关重要。我们临床试验的时间取决于我们招募患者参与的能力以及所需的随访期的完成情况。由于与新治疗方法相关的不良事件的负面宣传、类似患者群体的竞争性临床试验、当前治疗方法的存在或其他原因,患者可能 不愿参与我们的临床试验。对于我们可能针对一个或多个可能是罕见疾病的候选产品的某些迹象,登记风险 会增加,这可能会限制我们计划的临床试验中可能登记的患者池。招募患者、进行 试验和获得我们候选产品的监管批准的时间表可能会延迟,这可能会导致成本增加、延迟推进我们的候选产品、延迟测试候选产品的有效性或完全终止临床试验。
我们 可能无法识别、招募和招募足够数量的患者或具有所需或所需特征的患者, 无法及时完成我们的临床试验。例如,由于我们最初针对的适应症的性质,具有晚期疾病进展的患者可能不适合使用我们的候选产品进行治疗,并且可能没有资格参加我们的临床试验。因此,我们的目标疾病患者的早期诊断对我们的成功至关重要。患者 登记和试验完成受以下因素影响:
● 患者群体的规模和识别受试者的流程;
● 试验方案设计;
| 41 |
● 资格和排除标准;
● 到目前为止,正在研究的候选产品的安全概况;
● 被研究的产品候选产品的感知风险和收益;
● 我们治疗疾病的方法的风险和益处;
● 竞争疗法和临床试验的可用性;
● 正在调查的疾病的严重程度;
● 入组时受试者疾病的进展程度;
● 潜在受试者的临床试验地点的邻近性和可用性;
● 获得和保持受试者知情同意的能力;
● 入组受试者在完成试验前退出的风险;
● 医生的患者转诊实践;以及
● 在治疗期间和治疗后充分监测受试者的能力。
此外,SON-080中试规模可行性研究的临床开发目前计划在美国境外进行。我们 在任何外国成功启动、入组和完成临床试验的能力受制于 在外国开展业务所特有的众多风险,包括:
● 难以建立或管理与学术合作伙伴或合同研究组织或CRO和医生的关系;
● 开展临床试验的不同标准;
● 在一些国家,缺乏具有足够监管专业知识的既定小组来审查与我们的新 方法相关的协议;
● 我们无法找到合格的当地顾问、医生和合作伙伴;以及
● 遵守各种外国法律、医疗标准和监管要求的潜在负担,包括药品和生物技术产品和治疗的监管 。
如果 我们难以招募足够数量的患者来按计划开展临床试验,我们可能需要延迟、限制或 终止正在进行或计划进行的临床试验,任何此类措施都将对我们的业务、财务状况、 经营业绩和前景产生不利影响。
临床前研究和早期临床试验的结果可能不能预测未来临床试验的结果。
临床前研究和早期临床试验的 结果可能无法预测后期临床试验的成功,临床试验的中期结果 也不一定能预测已完成临床试验结果的成功。制药 和生物技术行业的许多公司在早期 开发取得积极成果后,在后期临床试验中遭遇重大挫折,我们也可能面临类似的挫折。例如,SON-080的IIa期试验将在美国境外进行,并且 在我们或 我们的合作者进行的后期临床试验中,这些发现可能不会在全球临床试验中心的未来试验中重现。临床试验的设计可以确定其结果是否支持产品的批准,并且临床试验设计中的缺陷可能在临床试验充分推进之前不会变得明显。我们可能无法设计和执行 临床试验以支持上市批准。
| 42 |
临床前 和临床数据通常容易受到不同解释和分析的影响。许多公司认为其候选产品 在临床前研究和临床试验中表现令人满意,但未能获得候选产品的上市批准。即使我们或任何合作者认为我们候选产品的临床试验结果值得上市 批准,FDA或类似的外国监管机构可能不同意,并且可能不会授予我们候选产品的上市批准。
在 某些情况下,由于许多因素,包括方案中规定的试验程序的变化、 患者人群的规模和类型的差异、给药方案和其他临床试验方案的变化和依从性以及 临床试验参与者的脱落率,同一候选产品 的不同临床试验之间的安全性或有效性结果可能存在显著差异。如果我们的候选产品的临床试验未能收到积极的结果,我们最先进的候选产品的开发时间轴 和监管批准以及商业化前景,以及相应地,我们的业务 和财务前景将受到负面影响。
我们的 当前或未来候选产品在单独使用或与 其他获批产品或研究性新药联合使用时,可能会导致不良副作用或具有其他特性,从而可能停止其临床开发、阻止其上市批准、限制 其商业潜力或导致重大负面后果。
可能会发生不良 或临床上无法管理的副作用,导致我们或监管机构中断、延迟或停止临床试验 ,并可能导致FDA或类似的外国监管机构对标签进行更严格的限制或延迟或拒绝上市批准 。我们的试验结果可能会揭示出副作用或意外特征的高和不可接受的严重程度和患病率。
如果我们的候选产品在开发过程中出现不可接受的副作用,我们、FDA或类似的外国监管机构、机构审查委员会或IRBs或我们进行研究的机构的独立道德委员会,或者 数据安全监控委员会或DSMB可以暂停或终止我们的临床试验,或者FDA或类似的外国监管机构可以命令我们停止临床试验或拒绝批准我们的产品候选产品的任何或所有目标适应症。与治疗相关的副作用也可能影响患者招募或受试者完成试验的能力,或导致潜在的产品责任索赔。此外,治疗医务人员可能无法正确识别或管理这些副作用。 我们可能需要对使用我们的候选产品的医务人员进行培训,以了解我们的临床试验以及我们的任何候选产品商业化后的副作用概况。在识别或管理我们的候选产品的潜在副作用方面培训不足 可能会导致患者受伤或死亡。这些情况中的任何一种都可能阻止我们实现或保持 市场对受影响候选产品的接受程度,并可能严重损害我们的业务、财务状况和前景。
此外,我们候选产品的临床试验是在精心定义的患者组中进行的,这些患者已同意进入临床 试验。因此,我们的临床试验可能会显示候选产品的明显正面效果大于实际正面效果(如果有的话),或者无法识别不良副作用。如果在 候选产品批准后,我们或其他人发现该产品的效果不如之前认为的那样有效,或者造成了以前未确定的不良副作用 ,则可能会发生以下任何后果:
● 监管部门可以撤销对该产品的批准或扣押该产品;
● 我们或任何合作者可能需要召回产品,或被要求更改产品的给药方式,或进行额外的 临床试验;
● 可对特定产品的营销或制造工艺施加额外限制;
| 43 |
● 我们可能会受到罚款、禁令或施加民事或刑事处罚;
● 监管机构可能要求添加标签声明,如方框警告或禁忌症;
● 我们或任何合作者可能被要求创建一份药物指南,概述以前未确定的副作用的风险 以分发给患者;
● 我们或任何合作者可能会被起诉,并对给患者造成的伤害承担责任;
● 产品可能变得不那么有竞争力;以及
● 我们的声誉可能会受到影响。
如果我们当前或未来的任何候选产品在临床试验中不能证明安全性和有效性,或者没有获得市场批准,我们将无法产生收入,我们的业务将受到损害。这些事件中的任何一个都可能损害我们的业务和运营, 并可能对我们普通股的价格产生负面影响。
我们 在确定或发现其他候选产品方面可能不会成功。
尽管 除了我们目前正在开发的候选产品外,我们打算探索其他治疗机会,但由于多种原因,我们可能无法确定用于临床开发的其他候选产品。例如,我们的研究方法可能无法成功识别潜在的候选产品,或者我们发现的产品可能具有有害的副作用或其他特征,使其无法销售或不太可能获得监管部门的批准。在商业销售之前,其他候选产品将需要额外、耗时的 开发工作,包括临床前研究、临床试验和FDA和/或适用的外国监管机构的批准。所有候选产品都容易出现药品开发中固有的失败风险 。如果我们不能发现和开发更多潜在的候选产品,我们可能无法发展我们的业务,我们的运营结果可能会受到实质性的损害。
我们 可能会花费有限的资源来追求特定的候选产品或指示,而无法利用可能更有利可图或成功可能性更大的候选产品或指示 。
由于 我们的财务和管理资源有限,因此我们打算专注于为 我们认为最有可能成功的特定适应症开发候选产品,无论是在市场批准方面还是在商业化方面。因此,我们 可能会放弃或推迟寻求其他候选产品或可能被证明具有更大商业潜力的其他指示 。
我们的资源分配决策可能会导致我们无法利用可行的商业产品或有利可图的市场机会。我们在当前和未来研发计划以及特定适应症候选产品上的支出可能不会产生任何商业上可行的候选产品。如果我们不能准确评估特定候选产品的商业潜力或目标市场, 在保留候选产品的独家开发和商业化权利对我们更有利的情况下,我们可能会通过协作、许可或其他版税安排放弃对该候选产品的宝贵权利。
| 44 |
我们 面临潜在的产品责任,如果针对我们的索赔成功,我们可能会招致大量责任和成本。如果 使用我们的候选产品伤害了患者,或者即使这种伤害与我们的候选产品无关,也被认为伤害了患者, 我们的监管批准可能会被撤销或以其他方式受到负面影响,我们可能会受到代价高昂且具有破坏性的产品责任索赔 。
在临床试验中使用我们的候选产品以及销售我们获得市场批准的任何产品,都会使我们面临产品责任索赔的风险。患者、医疗保健提供者、制药公司或销售或以其他方式接触我们产品的其他人可能会向我们提出产品责任索赔。我们的候选产品可能会引发 不良事件。如果我们不能成功地抗辩产品责任索赔,我们可能会招致大量的责任和成本。此外,无论优点或最终结果如何,产品责任索赔可能会导致:
| ● | 我们的商业声誉受到损害; | |
| ● | 临床试验参与者的退出; | |
| ● | 给予患者或其他索赔人巨额的金钱奖励; | |
| ● | 因相关诉讼产生的费用 ; | |
| ● | 将管理层的注意力从我们的主要业务上分散; | |
| ● | 无法将我们的候选产品商业化;以及 | |
| ● | 减少了对我们的候选产品的需求(如果获得批准用于商业销售)。 |
鉴于我们目前的临床计划,我们 打算购买产品责任保险;但是,我们可能无法以合理的成本或足够的金额维持 保险范围,以保护我们免受因责任造成的损失。我们打算在每次商业化新产品时扩大我们的保险范围;但是,我们可能无法以商业上合理的条款或足够的金额获得产品责任保险。有时,在基于 具有意想不到的不良影响的药物或治疗的集体诉讼中,会做出大额判决。成功的产品责任索赔或针对我们提出的一系列索赔 可能会导致我们的股票价格下跌,如果判决超出我们的保险范围,可能会对我们的运营和业务业绩产生不利影响 。
患有我们的某些候选产品所针对的疾病的患者 通常已经处于严重的 和晚期疾病,并且具有已知和未知的重大预先存在的和潜在威胁生命的健康风险。 在治疗过程中,患者可能会因可能与我们的候选产品相关的原因而遭受包括死亡在内的不良事件。 此类事件可能会使我们面临代价高昂的诉讼,要求我们向受伤的患者支付巨额费用,延误、产生负面影响或终止我们获得或保持监管部门批准以营销我们产品的机会,或要求我们暂停或放弃我们的商业化努力。即使在我们不认为不良事件与我们的产品相关的情况下,对该情况的 调查也可能很耗时或不确定。这些调查可能会中断我们的销售工作,推迟我们的监管审批流程,或者影响和限制我们的产品候选接收或维护的监管审批类型。由于这些因素,产品责任索赔即使成功辩护,也可能对我们的业务、财务状况或运营结果产生重大不利影响。
我们 可以向FDA和其他类似的监管机构为我们的候选产品寻求认证,这些认证旨在提供更快的开发过程或更快的监管途径等好处,但不能保证我们会成功 获得此类认证。此外,即使我们的一个或多个候选产品获得此类指定,我们也可能无法 实现此类指定的预期好处。
FDA和其他类似的监管机构为候选产品提供了特定的名称,旨在鼓励 针对重大未得到满足的医疗需求的情况进行药物产品的研发。这些指定可能会 带来好处,例如与监管机构的额外互动、可能加速的监管途径和优先审查。我们不能保证我们的任何其他候选产品都能成功获得这样的认证。此外,虽然此类指定可以加快开发或审批流程,但它们通常不会更改审批标准。 即使我们获得了一个或多个候选产品的此类指定,也不能保证我们将实现预期的 好处。
| 45 |
例如,我们可能会为我们的一个或多个候选产品寻求突破性治疗认证。突破性疗法被定义为:如果初步临床证据表明,突破性疗法在一个或多个临床重要终点(例如在临床开发早期观察到的实质性治疗效果)较现有疗法有显著改善,则该疗法旨在单独或与一种或多种其他疗法相结合来治疗严重或危及生命的疾病或状况。对于已被指定为突破性疗法的疗法,FDA和试验赞助商之间的互动和沟通可以帮助 确定临床开发的最有效途径,同时将无效对照方案的患者数量降至最低。 被FDA指定为突破性疗法的疗法也有资格获得加速批准。指定为突破性疗法 是FDA的自由裁量权。因此,即使我们认为我们的候选产品之一符合指定为突破性疗法的标准,FDA也可能不同意,而是决定不进行此类指定。在任何情况下,与根据FDA传统程序考虑批准的疗法相比,收到针对候选产品的突破性治疗指定 可能不会导致更快的开发过程、审查或批准,也不能确保FDA最终批准。此外,即使我们的一个或多个候选产品符合突破性疗法的条件,FDA也可能在以后决定这些候选产品不再 符合资格条件。
我们 可能还会为我们的一些候选产品寻求快速通道认证。如果一种疗法旨在治疗一种严重或危及生命的疾病,并且该疗法显示出解决这种疾病未得到满足的医疗需求的潜力,则治疗赞助商可以申请 快速通道认证。FDA拥有广泛的自由裁量权来决定是否授予该称号,因此,即使我们认为特定的候选产品有资格获得该称号,也不能保证FDA会决定授予该称号。即使我们确实获得了快速通道认证,与传统的FDA程序相比,我们可能不会体验到更快的开发流程、审查或批准, 而且获得快速通道认证并不能保证FDA的最终批准。如果FDA认为我们的临床开发计划的数据不再支持该指定,它可能会撤回该指定 。
我们 可能会为我们的一个或多个候选产品寻求优先审查指定,但我们可能不会收到这样的指定,即使我们这样做了,这样的指定也可能不会带来更快的监管审查或审批过程。
如果FDA确定一种候选产品提供了治疗严重疾病的方法,并且如果获得批准,该产品将在安全性或有效性方面提供 显著改善,FDA可以指定该候选产品进行优先审查。指定优先审查 意味着FDA审查申请的目标是六个月,而不是标准的十个月审查期。 我们可能会要求对我们的候选产品进行优先审查。FDA在是否向候选产品授予优先审查地位方面拥有广泛的自由裁量权,因此,即使我们认为特定候选产品有资格获得此类资格或地位, 特别是如果该候选产品已获得突破疗法指定,FDA也可能决定不授予该资格。此外,与FDA的传统程序相比,优先审查指定并不一定会加快开发,也不一定会加快监管审查或审批过程,也不一定会带来任何批准方面的优势。获得FDA的优先审查并不保证在六个月的审查周期内或根本不能获得批准。
在一个司法管辖区获得并保持我们当前和未来候选产品的营销批准,并不意味着我们将成功 在其他司法管辖区获得当前和未来候选产品的营销批准。
在一个司法管辖区获得并维护我们当前和未来候选产品的营销批准并不能保证我们将能够在任何其他司法管辖区获得或保持营销批准,而在一个司法管辖区未能或延迟获得营销批准可能会对其他司法管辖区的营销审批流程产生负面影响。例如,即使FDA批准销售候选产品,外国司法管辖区的可比监管机构也必须批准候选产品在这些国家/地区的制造、营销和推广。审批程序因司法管辖区而异,可能涉及与美国不同或大于美国的要求 和行政审查期限,包括额外的临床前研究 或临床试验,因为在一个司法管辖区进行的临床研究可能不会被其他司法管辖区的监管机构接受。 在美国以外的许多司法管辖区,候选产品必须先获得报销批准,然后才能在该司法管辖区 销售。在某些情况下,我们打算为我们的产品收取的价格也需要得到批准。我们没有在国际市场获得报销或定价审批的经验。
| 46 |
获得市场批准并遵守监管要求可能会给我们带来重大延误、困难和成本,而 可能会推迟或阻止我们的产品在美国以外的某些国家/地区推出。如果我们不遵守国际市场的监管要求和/或获得相应的营销批准,我们的目标市场将会减少 ,我们充分发挥候选产品市场潜力的能力将受到损害。
与我们的候选产品商业化相关的风险以及其他合规问题
即使我们完成了必要的临床前研究和临床试验,营销审批流程也是昂贵、耗时且不确定的,可能会阻止我们或任何合作者获得将部分或全部候选产品商业化的批准。 因此,我们无法预测我们或任何合作者将在何时、是否以及在哪些地区获得将候选产品商业化的营销审批。
在美国和国外获得营销批准的过程漫长、昂贵且不确定。如果最终获得批准,可能需要 年,而且可能会根据各种因素而变化很大,这些因素包括所涉及的候选产品的类型、复杂性和新颖性。要获得上市批准,需要针对每个治疗适应症向监管机构提交广泛的临床前和临床 数据和支持信息,以确定候选产品的安全性和有效性。要获得市场批准,还需要向监管机构提交有关产品制造过程的信息,并由监管机构检查制造设施。FDA或其他监管机构可能会认定我们的候选产品不安全有效、仅有中等效果或有不良或意外的副作用、毒性或其他使我们无法获得上市批准或阻止或限制商业使用的特征。我们 最终获得的任何营销批准都可能受到限制,或受到限制或批准后的承诺,从而使批准的产品在商业上无法 生存。
此外,开发期间市场审批政策的更改、附加法规、法规或指南的制定或颁布的更改,或针对每个提交的产品申请的监管审查的更改,都可能导致申请审批的延迟 或拒绝。监管机构在审批过程中拥有相当大的自由裁量权,可能拒绝接受任何 申请,或可能决定我们的数据不足以获得批准,需要进行额外的临床前、临床或其他研究。 对从临床前和临床测试中获得的数据的不同解释可能会推迟、限制或阻止候选产品的上市批准。在适当的监管机构审核并批准候选产品之前,我们不能将产品商业化。即使我们的候选产品在临床试验中表现出安全性和有效性,监管机构也可能无法及时完成其审查流程,或者我们可能无法获得监管部门的批准。如果FDA咨询委员会或其他监管机构建议不批准或限制批准,可能会导致额外的延迟。此外,在产品开发、临床试验和审查过程中,我们可能会因未来立法或行政行动中的额外政府监管或监管机构政策的变化而出现延误或拒绝。我们最终 获得的任何营销批准都可能受到限制,或受到限制或批准后的承诺,从而使批准的产品在商业上不可行。
此外,我们临床试验的首席研究员可能会不时担任我们的科学顾问或顾问,并获得与此类服务相关的报酬 。在某些情况下,我们可能需要向FDA或其他监管机构报告其中一些关系。FDA或其他监管机构可能会得出结论,认为我们与主要调查员之间的财务关系造成了利益冲突或以其他方式影响了对研究的解释。因此,FDA或其他监管机构可能会质疑在适用的临床试验现场生成的数据的完整性,临床试验本身的效用可能会受到威胁。这可能会导致FDA或其他监管机构延迟批准或拒绝我们的上市申请,并可能最终导致我们的一个或多个候选产品的上市审批被拒绝。
此外,监管机构可能不会批准我们的候选产品成功商业化所必需或需要的标签声明 。例如,监管机构可能批准的候选产品的适应症比要求的更少或更少,也可能根据上市后研究的表现给予批准。监管机构可能会批准适用于患者人数较少、不同药物配方或不同制造工艺的候选产品,而不是我们正在寻求的产品。如果我们无法 获得必要的监管批准,或者监管批准比我们预期的更有限,我们的业务、前景、财务状况 和运营结果可能会受到影响。
任何延迟获得或未能获得所需批准的 都可能对我们从特定候选产品获得收入的能力产生负面影响,这可能会对我们的财务状况造成重大损害,并对我们的普通股价格产生不利影响。
| 47 |
我们 目前没有与我们的候选产品相关的营销、销售或分销基础设施。如果我们不能通过自己或通过与营销合作伙伴的合作来发展我们的销售、营销和分销能力,我们将不会成功地将我们的候选产品商业化。
我们 目前没有营销、销售或分销能力,在我们组织内的销售或营销经验有限。 如果我们的一个或多个候选产品获得批准,我们打算建立一个具有技术专业知识和支持分销能力的销售和营销组织,以将该候选产品商业化,或者将此功能外包给第三方 。建立我们自己的销售和营销能力并与 第三方达成协议来执行这些服务都存在风险。
招聘和培训内部商业组织既昂贵又耗时,可能会推迟任何产品发布。这些 部分或全部费用可能会在我们的任何候选产品获得批准之前发生。如果我们招聘销售团队并建立营销能力的 候选产品的商业发布因任何原因而推迟或没有发生,我们将过早地 或不必要地产生这些商业化费用。如果我们不能留住或重新定位我们的销售和营销人员,成本可能会很高,而且我们的投资将会损失。此外,我们可能无法在美国或在我们打算瞄准的医疗市场中拥有足够规模或具有足够专业知识的其他目标市场招聘销售人员。
可能会阻碍我们将候选产品商业化的因素 包括:
● 无法招聘、培训和留住足够数量的有效销售和营销人员;
● 销售人员无法接触医生或说服足够数量的医生开出我们可能开发的任何未来产品的处方 ;
● 销售人员提供的补充治疗不足,这可能使我们相对于拥有更广泛产品线的公司 处于竞争劣势;以及
● 与创建独立的销售和营销组织相关的意外成本和费用。
如果我们与第三方达成协议来执行销售、营销和分销服务,我们的产品收入或从这些收入流中为我们带来的盈利能力可能会低于我们营销和销售我们自己开发的任何候选产品的情况。 此外,我们可能无法成功地与第三方达成协议来销售和营销我们的候选产品,或者 可能无法以对我们有利的条款这样做。我们可能对这些第三方几乎没有控制权,他们中的任何一方都可能 无法投入必要的资源和注意力来有效地销售和营销我们的候选产品。如果我们不能成功地建立销售 和营销能力,无论是我们自己还是与第三方合作,我们都可能无法成功地将我们的候选产品商业化。
如果获得批准,我们开发的任何当前或未来候选产品的 市场机会可能仅限于那些 没有资格接受现有疗法或之前的疗法失败的患者,因此可能很小。
癌症疗法有时被描述为一线、二线或三线,FDA通常最初只批准三线使用的新疗法。当癌症被发现得足够早时,一线治疗,通常是化疗、激素治疗、手术、放射治疗、免疫治疗或这些疗法的组合,有时足以治愈癌症或延长生命,而不需要治愈。当先前的治疗无效时,对患者实施二线和三线治疗。我们最初可能会寻求SON-080和 我们开发的任何其他候选产品的批准,作为对接受过一种或多种先前治疗的患者的治疗。随后,对于那些被证明具有足够益处的产品(如果有的话),我们预计可能会寻求批准作为一线疗法,但 不能保证我们开发的候选产品即使获得批准也会被批准用于一线疗法,在获得任何此类批准之前,我们可能必须进行额外的临床试验。
| 48 |
我们所针对的癌症患者数量可能会低于预期。此外,如果获得批准,我们当前计划或未来候选产品的潜在可寻址患者数量可能会受到限制。即使我们为任何候选产品获得了相当大的市场份额,如果获得批准,如果潜在目标人群较少,我们可能永远无法实现盈利 如果没有获得额外适应症的营销批准,包括用作一线或二线治疗。
即使我们获得了候选产品的上市批准,我们也将受到持续的监管义务和持续的监管 审查,这可能会导致大量额外费用,如果我们未能遵守监管要求 或遇到意外的产品问题(如果获得批准),我们可能会受到处罚。
对于任何当前或未来的候选产品,我们收到的任何 营销批准可能会受到产品上市的批准指示用途或批准条件的限制,或者包含可能代价高昂的上市后 测试和监控要求,以监控候选产品的安全性和有效性。FDA还可能要求将风险评估和缓解策略或REMS作为批准任何候选产品的条件,其中可能包括对药物指南、医生沟通计划或确保安全使用的其他要素的要求,例如受限分配方法、患者登记 和其他风险最小化工具。如果FDA或类似的外国监管机构批准候选产品,候选产品的制造、标签、包装、分销、不良事件报告、储存、广告、促销、进出口和记录 将受到广泛和持续的监管要求。这些要求包括禁止推广批准的产品用于产品批准的标签中未包括的用途,提交安全和其他上市后信息和报告,注册,以及对于我们在批准后进行的任何临床试验,继续遵守当前的良好制造实践(CGMP)和良好临床实践(GCP)。后来发现任何已批准的候选对象存在以前未知的问题,包括意外严重性或频率的不良事件,或我们的第三方制造商或制造流程,或未能遵守监管要求,可能会导致以下情况,其中包括:
● 限制产品的标签、分销、营销或制造,将产品从市场上召回,或 产品召回;
● 无标题和警告信,或暂停临床试验;
● 食品和药物管理局拒绝批准未决申请或对我们提交的已批准申请的补充,或暂停或吊销许可证批准 ;
● 进行上市后研究或临床试验的要求;
● 对第三方付款人承保的限制;
● 罚款、返还或返还利润或收入;
● 暂停或撤回上市审批;
● 产品被扣押或扣留,或拒绝允许产品进口或出口;以及
● 禁止令或施加民事或刑事处罚。
FDA和其他监管机构的政策可能会改变,可能会颁布额外的政府法规,以阻止、限制或推迟产品的上市审批。我们无法预测美国或国外未来的立法或行政行动可能产生的政府监管的可能性、性质或程度。如果我们缓慢或无法使 适应现有要求的变化或采用新的要求或政策,或者如果我们无法保持合规性, 我们可能会失去我们可能获得的任何营销批准,我们可能无法实现或保持盈利。
| 49 |
我们 面临激烈的竞争,如果我们的竞争对手开发和销售比我们开发的候选产品更有效、更安全或更便宜的产品,我们的商业机会将受到负面影响。
生命科学行业竞争激烈。我们目前正在开发的疗法如果获得批准,将与其他产品和目前存在的、正在开发的或未来将开发的疗法 竞争,其中一些我们目前可能还不知道。
我们在美国和国际上都有竞争对手,包括大型跨国制药公司、老牌生物技术公司、专业制药公司、大学和其他研究机构。与我们相比,我们的许多竞争对手拥有更多的财务、制造、营销、产品开发、技术和人力资源。大型制药公司,尤其是大型制药公司,在临床测试、获得市场批准、招募患者和制造药品 产品方面拥有丰富的经验。这些公司的研究和营销能力也比我们强得多,可能还拥有已获批准或处于开发后期阶段的产品,以及在我们的目标市场与领先公司和研究机构的合作安排。老牌制药公司还可能大举投资,以加快新化合物的发现和开发,或者授权使用可能使我们开发的候选产品过时的新化合物。制药和生物技术行业的合并和收购 可能导致更多的资源集中在我们数量较少的竞争对手 中。由于所有这些因素,我们的竞争对手可能会在我们之前成功获得专利保护和/或营销批准,或者在我们之前发现、开发和商业化我们领域的产品。
有大量的公司开发或营销癌症治疗方法,包括许多主要的制药和生物技术公司。 这些治疗方法既包括传统化疗等小分子药物产品,也包括新型免疫疗法。例如,许多跨国公司以及大型生物技术公司,包括Astellas Pharma Inc.、Seattle Genetics、 Inc.、阿斯利康和葛兰素史克,正在为我们的流水线项目探索的目标开发项目。
如果我们的竞争对手开发和商业化比我们可能开发的任何产品更安全、更有效、影响更少或更不严重、更方便、更广泛的标签、更有效的营销、得到报销或更便宜的产品,我们的商业机会可能会减少或消失。我们的竞争对手也可能比我们更快地获得FDA、EMA或其他产品的市场批准 ,这可能会使我们的竞争对手在我们能够进入市场之前建立强大的市场地位。即使我们开发的候选产品获得了市场批准,它们的定价也可能比竞争产品高出显著的 溢价(如果到那时已获得批准),从而导致竞争力下降。
规模较小的 和其他初创公司也可能被证明是重要的竞争对手。这些第三方在招聘和留住合格的科学和管理人员、建立临床试验场地和临床试验患者注册方面以及在获取与我们的计划互补或必要的技术方面与我们展开竞争。此外,生物制药行业的特点是技术变化迅速。如果我们不能保持在技术变革的前沿,我们就可能无法有效地竞争。 技术进步或竞争对手开发的产品可能会使我们的候选产品过时、竞争力下降或不经济。
任何当前或未来候选产品的商业成功将取决于医生、患者、付款人和医学界其他人对市场的接受程度。
我们 从未将产品商业化,即使我们为我们的候选产品获得任何监管批准,我们候选产品的商业成功也将在一定程度上取决于医疗界、患者和付款人是否接受我们的候选产品是有效、 安全和经济高效的。我们向市场推出的任何产品都可能得不到医生、患者、付款人和医学界其他人的认可。医生通常不愿将患者从现有的治疗方法中转换出来,即使是在新的、可能更有效或更方便的治疗方法进入市场时也是如此。此外,患者通常适应他们目前正在接受的治疗 ,除非医生建议他们更换产品,或者由于现有治疗缺乏 报销而要求他们更换治疗,否则患者不想更换。
| 50 |
如果这些候选产品获准用于商业销售,其市场接受度将取决于许多因素,包括:
| ● | 与替代疗法相比的潜在疗效和潜在优势; |
| ● | 任何副作用的频率和严重程度,包括产品批准的标签中包含的任何限制或警告; |
| ● | 对我们的候选产品进行管理的后续要求导致的任何副作用的频率和严重程度; |
| ● | 相对方便和容易管理; |
| ● | 目标患者群体尝试新疗法的意愿以及医生开出这些疗法的意愿; |
| ● | 市场营销和分销支持的实力以及竞争产品进入市场的时机; |
| ● | 宣传我们的产品或竞争对手的产品和治疗方法;以及 |
| ● | 充足的第三方保险覆盖范围和充足的报销。 |
即使 如果候选产品在临床前研究和临床试验中表现出良好的疗效和安全性,如果该产品被批准用于商业销售,市场接受程度也要等到该产品推出后才能知道。我们努力让医疗界和付款人了解我们的候选产品的好处,这可能需要大量资源,而且可能永远不会成功。这种教育市场的努力可能需要比我们的竞争对手销售的传统技术所需的更多的资源,特别是 由于我们的十四行诗接近。如果这些产品没有达到足够的接受度,我们可能不会产生显著的产品收入,也可能无法盈利。
如果我们的候选产品的市场机会比我们认为的要小,我们的产品收入可能会受到不利影响 ,我们的业务可能会受到影响。
我们 目前将我们的研究和产品开发重点放在肿瘤适应症的治疗和我们的产品FHAB候选对象 旨在针对实体肿瘤。我们对患有这些疾病的人数以及有可能从我们的候选产品治疗中受益的这些疾病患者的子集的了解是基于估计的。这些估计可能被证明是不正确的,新的研究可能会降低这些疾病的估计发病率或流行率。患者识别 工作也会影响解决患者群体的能力。如果在患者识别方面的努力不成功或效果不如预期 ,我们可能无法解决我们正在寻找的整个机会。
新批准产品的保险覆盖范围和报销状态不确定。如果我们的任何候选产品未能获得或保持足够的承保范围和报销,如果获得批准,可能会限制我们营销这些产品的能力,并降低我们创造收入的能力 。
我们 预计,当我们的候选产品获得市场批准时,他们的成本将会很高。政府和私人付款人的可获得性和报销范围是大多数患者能够负担得起昂贵治疗费用的关键。我们候选产品的销售将在很大程度上取决于我们的候选产品在国内和国外的销售情况 我们候选产品的费用将在多大程度上由私人付款人支付,如私人健康保险公司、健康维护、管理式医疗、药房福利和类似的医疗保健管理组织,或由政府医疗保健计划(如Medicare和Medicaid)报销。我们可能无法 提供足够的数据来获得承保和报销方面的认可。如果无法获得报销或仅限量获得报销,我们可能无法成功地将我们的候选产品商业化,即使获得批准。即使提供了保险 ,批准的报销金额也可能不足以让我们建立或保持足够的定价来实现足够的投资回报。
| 51 |
与新批准产品的保险覆盖范围和报销相关的重大不确定性。在美国,有关新药承保和报销的主要决定通常由医疗保险和医疗补助服务中心(CMS)做出,CMS是美国卫生与公众服务部的一个机构,由CMS决定新药是否在Medicare下承保和报销,以及在多大程度上报销。私人支付者倾向于在很大程度上遵循CMS。很难预测CMS将就像我们这样的新产品的承保范围和报销做出什么决定,因为这些新产品没有既定的 实践和先例。第三方付款人的承保范围和报销可能取决于许多因素, 包括第三方付款人对产品使用的确定:(1)其医疗计划下的承保福利;(2)安全、 有效且具有医疗必要性;(3)适用于特定患者;(4)成本效益;以及(5)既不是试验性的,也不是试验性的。 在美国,第三方付款人之间没有统一的产品承保和报销政策。因此,保险范围确定过程通常是一个耗时且昂贵的过程,需要我们为每个付款人分别提供使用我们产品的科学和临床支持 ,但不能保证保险范围和足够的报销将始终如一地应用 或首先获得。即使我们获得了特定产品的保险,由此产生的报销付款率也可能不足以 使我们实现或维持盈利能力,或者可能需要患者认为不可接受的高额自付费用。第三方付款人 可以将承保范围限制到已批准清单(也称为处方)上的特定药品,该清单可能不包括特定适应症的所有已批准 药物。
此外, 第三方付款人可能无法支付或提供足够的补偿,用于使用 候选产品后所需的长期后续评估。患者不太可能使用我们的候选产品,除非提供了覆盖范围,并且报销足以 覆盖我们候选产品的大部分成本。由于我们的候选产品的商品成本可能高于 传统疗法,并且可能需要长期随访评估,因此承保范围和报销率可能不足以 使我们实现盈利的风险可能更大。新 批准产品的保险范围和报销存在重大不确定性。目前很难预测第三方付款人将如何决定我们候选产品的承保范围和报销 。
此外, 美国和国外的政府和第三方付款人越来越多地限制或降低医疗保健成本,可能会导致 此类组织限制新批准产品的承保范围和报销水平,因此,他们可能无法为我们的候选产品承保 或提供足够的付款。 美国对特殊药品定价实践的立法和执法兴趣越来越大。具体而言,最近美国国会进行了几次调查,并 提出了联邦和州立法,旨在提高药品定价的透明度,降低Medicare下处方药的成本,审查定价与制造商患者计划之间的关系,以及改革政府计划药品报销 方法。由于 医疗保健管理的趋势、健康维护组织的影响力日益增强、成本控制计划和其他 立法变化,我们预计在销售任何候选产品时都会遇到定价压力。
Outside the United States, certain countries, including a number of member states of the European Union, set prices and reimbursement for pharmaceutical products, or medicinal products, as they are commonly referred to in the European Union. These countries have broad discretion in setting prices and we cannot be sure that such prices and reimbursement will be acceptable to us or our collaborators. If the regulatory authorities in these jurisdictions set prices or reimbursement levels that are not commercially attractive for us or our collaborators, our revenues from sales by us or our collaborators, and the potential profitability of our drug products, in those countries would be negatively affected. An increasing number of countries are taking initiatives to attempt to reduce large budget deficits by focusing cost-cutting efforts on pharmaceuticals for their state-run health care systems. These international price control efforts have impacted all regions of the world, but have been most drastic in the European Union. Additionally, some countries require approval of the sale price of a product before it can be lawfully marketed. In many countries, the pricing review period begins after marketing or product licensing approval is granted. To obtain reimbursement or pricing approval in some countries, we, or any collaborators, may be required to conduct a clinical trial that compares the cost-effectiveness of our product to other available therapies. As a result, we might obtain marketing approval for a product in a particular country, but then may experience delays in the reimbursement approval of our product or be subject to price regulations that would delay our commercial launch of the product, possibly for lengthy time periods, which could negatively impact the revenues we are able to generate from the sale of the product in that particular country.
| 52 |
Moreover, efforts by governments and payors, in the United States and abroad, to cap or reduce healthcare costs may cause such organizations to limit both coverage and level of reimbursement for new products approved and, as a result, they may not cover or provide adequate reimbursement for our product candidates. There has been increasing legislative and enforcement interest in the United States with respect to specialty drug practices. Specifically, there have been several recent U.S. Congressional inquiries and proposed federal and state legislation designed to, among other things, bring more transparency to drug pricing, reduce the cost of prescription drugs under Medicare, review the relationship between pricing and manufacturer patient programs, and reform government program reimbursement methodologies for drugs. We expect to experience pricing pressures in connection with the sale of any of our product candidates, due to the trend toward managed healthcare, the increasing influence of health maintenance organizations and additional legislative changes. The downward pressure on healthcare costs in general, particularly prescription drugs and other treatments, has become very intense. As a result, increasingly high barriers are being erected to the entry of new products. If reimbursement of our products is unavailable or limited in scope or amount, or if pricing is set at unsatisfactory levels, our business could be harmed.
如果 FDA或类似的外国监管机构批准了我们任何获得上市 批准的候选产品的仿制药版本,或者此类机构在批准 此类产品的仿制药版本之前未授予此类产品适当的数据独占期,则此类产品的销售可能会受到不利影响。
在美国,制造商可以通过提交简化的生物许可证申请或ABLAS来寻求FDA根据BLA批准的生物相似版本的批准。为了支持ABLA,生物相似制造商通常必须证明其产品与原始生物产品相似。生物相似产品推向市场的成本可能低于原始生物产品 ,生产生物相似产品的公司有时能够以更低的价格提供这些产品。因此,在推出生物相似产品后,原始生物产品的销售额可能会有很大一部分被生物相似产品抢走,原始生物产品的价格可能会降低。
在原始生物的任何适用的非专利专有期到期之前,FDA不得接受或批准生物相似产品的ABLA进行审查或批准。公共卫生服务(PHS)法案为根据BLA批准的生物提供了12年的非专利专有期。
我们的产品可能面临来自生物相似版本产品的竞争 可能会对我们未来的收入、盈利能力和现金流产生负面影响,并极大地限制我们从这些候选产品中获得投资回报的能力。
我们 可能直接或间接受到联邦和州医疗欺诈和滥用法律、虚假声明法律、健康信息隐私和安全法律以及其他医疗法律和法规的约束。如果我们不能遵守或没有完全遵守这些法律, 我们可能面临巨额处罚。
如果 我们的任何候选产品获得了FDA的批准,并开始在美国将这些产品商业化,我们的运营 将直接或间接通过我们的处方者、客户和购买者遵守各种联邦和州欺诈和滥用法律法规,包括但不限于联邦医疗保健计划反回扣法规、 联邦民事和刑事虚假索赔法案以及医生支付阳光法案和法规。这些法律将影响我们提议的销售、营销和教育计划等。此外,我们可能受到联邦政府和我们开展业务所在州的患者隐私法的约束。将影响我们运营的法律包括但不限于:
| ● | 《反回扣条例》,除其他事项外,禁止个人或实体直接或间接、公开或隐蔽地以现金或实物形式直接或间接、公开或隐蔽地索要、收受、提供或支付任何报酬(包括任何回扣、贿赂或回扣),以引诱或回报个人推荐,或购买、租赁、订购、安排或推荐根据联邦医疗保健计划可全部或部分支付的任何商品、设施、物品或服务。例如联邦医疗保险和医疗补助计划。“报酬”一词被广泛解释为包括任何有价值的东西。个人或实体不需要实际了解《反回扣法规》或违反该法规的特定意图即可实施 违规。此外,政府可以断言,根据联邦虚假索赔法案或联邦民事罚款的目的,包括因违反反回扣法规而产生的物品或服务的索赔构成虚假或欺诈性索赔。 反回扣法规已被解释为适用于药品制造商与 处方者、购买者和处方经理之间的安排。有一些法定例外和监管避风港可以保护一些常见活动免受起诉; |
| 53 |
| ● | 联邦民事和刑事虚假申报法和民事金钱惩罚法,包括FCA,对个人或实体处以刑事和民事处罚,原因包括:故意向联邦政府提交或导致向联邦政府提交虚假或欺诈性的付款索赔;故意对向联邦政府支付或转移金钱或财产的虚假或欺诈性索赔或义务作出、使用或导致做出或使用记录材料的虚假陈述 。制造商 可以根据FCA承担责任,即使他们没有直接向政府付款人提交索赔,但如果他们被认为“导致” 提交虚假或欺诈性索赔。FCA还允许充当“告密者”的个人代表联邦政府提起诉讼,指控违反FCA的行为,并分享任何金钱追回; |
| ● | 《议定书》的 受益人诱因条款,除其他事项外,禁止提供或给予报酬,其中包括但不限于免费或低于公平市场价值的任何物品或服务的转让(有限的例外情况), 个人知道或应该知道可能影响受益人选择可由联邦或州政府计划报销的物品或服务的特定供应商; |
| ● | 1996年联邦健康保险携带和责任法案,或HIPAA,创建了新的联邦刑法,禁止 任何人故意和故意执行或试图执行诈骗任何医疗福利计划的计划,或 通过虚假或欺诈性的借口、陈述或承诺,获得任何医疗福利计划拥有或托管或控制的任何金钱或财产,而无论付款人(例如,公共或私人),并故意和故意伪造,以任何诡计或手段隐瞒或掩盖重大事实,或作出任何重大虚假、虚构或欺诈性的陈述或陈述,涉及与医疗事宜有关的医疗福利、项目或服务的交付或付款 ;与《反回扣法规》类似,个人或实体不需要实际了解法规或违反法规的具体意图即可实施违规; |
| ● | HIPAA,经2009年《卫生信息技术促进经济和临床健康法》及其各自的实施条例修订的《HIPAA》, 对某些医疗保健提供者、健康计划和医疗信息交换所(称为覆盖实体)及其各自的商业伙伴、代表其提供服务的个人和实体提出要求,涉及使用或披露涉及个人可识别健康信息的隐私、安全和传输的个人可识别健康信息 ; |
| ● | 经《医疗保健和教育协调法》修订的《患者保护和平价医疗法案》(或统称为ACA)规定的美国联邦透明度要求,包括通常称为《医生支付阳光法案》的条款,该条款要求适用的药品、设备、生物制品和医疗用品制造商可根据Medicare付款,医疗补助或儿童健康保险计划(某些例外情况除外)每年向CMS报告与向医生(定义为包括医生、牙医、视光师、足科医生和脊椎按摩师) 和教学医院,以及上述医生及其直系亲属持有的所有权和投资权益。从2022年开始,适用的制造商还将被要求报告向医生助理、护士从业者、临床护士专家、注册护士麻醉师和注册护士助产士支付和转移价值的信息; |
| ● | 联邦政府价格报告法,要求我们准确、及时地计算并向政府项目报告复杂的定价指标 ;以及 |
| ● | 联邦 消费者保护和不正当竞争法,对市场活动和可能损害消费者的活动进行广泛监管 。 |
此外, 我们受制于上述每个医疗保健法律法规的州和国外等价物,其中包括一些可能范围更广且可能适用于任何付款人的 。美国许多州已经通过了类似于《反回扣法规和虚假索赔法案》的法律,可能适用于我们的商业实践,包括但不限于研究、分销、销售或营销安排以及涉及由非政府付款人(包括私人保险公司)报销的医疗项目或服务的索赔。 此外,一些州还通过了法律,要求制药公司遵守2003年4月总监察长办公室 药品制造商合规计划指南和/或美国药品研究和制造商与医疗保健专业人员互动的 守则。几个州还实施了其他营销限制,或要求制药公司向州政府进行营销或价格披露。对于需要遵守这些州的要求存在歧义 ,如果我们不遵守适用的州法律要求,我们可能会受到处罚。最后,还有管理健康信息隐私和安全的国家法律和外国法律,其中许多法律在很大程度上彼此不同,而且HIPAA往往不会先发制人,从而使合规工作复杂化。
| 54 |
由于这些法律的广度,以及可用的法定例外和监管安全港的狭窄,我们的一些业务活动可能会受到一项或多项此类法律的挑战。执法部门越来越多地 专注于执行欺诈和滥用法律,我们的一些做法可能会受到这些法律的挑战。确保我们当前和未来与第三方的业务安排以及我们的业务总体上符合适用的医疗法律法规的努力 将涉及大量成本。如果我们的业务,包括我们与医生和其他医疗保健提供者的安排,其中一些获得股票期权作为所提供服务的补偿,被发现违反了适用于我们的任何此类法律或任何其他政府法规,我们可能会受到惩罚,包括但不限于行政、民事和刑事处罚、损害赔偿、罚款、返还、合同损害、声誉损害、利润减少和未来收入, 我们业务的削减或重组,被排除在联邦和州医疗保健计划(如Medicare 和Medicaid)的参与之外,如果我们受到公司诚信协议或类似的 协议的约束,以解决有关不遵守这些法律的指控和个人监禁,则会有额外的报告要求和/或监督,其中任何一项都可能对我们的业务运营能力和财务业绩产生不利影响。任何违反这些法律的行为,即使成功辩护, 也可能导致制药商招致巨额法律费用,并转移管理层对业务运营的注意力 。禁止或限制销售或撤回未来上市的产品可能会以不利的方式对业务产生重大影响。
医疗保健 立法改革措施和对国家预算社会保障制度的限制可能会对我们的业务和运营结果产生实质性的不利影响 。
付款方,无论是国内还是国外,或政府或私人,都在开发越来越复杂的方法来控制医疗成本 这些方法并不总是专门适用于我们正在开发的那些新技术。在美国和某些外国司法管辖区,医疗保健系统的立法和监管发生了许多变化, 可能会影响我们销售产品盈利的能力。尤其是在美国,ACA于2010年颁布,除其他事项外,它使生物产品受到低成本生物仿制药的潜在竞争;解决了一种新的方法,通过该方法,对于吸入、输液、滴注、植入或注射的药物,计算制造商在Medicaid药品回扣计划下所欠的回扣;增加了大多数制造商在Medicaid药品回扣计划下所欠的最低Medicaid回扣;将Medicaid 药品回扣计划扩大到使用在Medicaid管理的护理组织中登记的个人的处方;要求制造商 对某些品牌处方药征收新的年费和税;并为增加联邦政府比较有效性研究的项目提供激励。
自颁布以来,ACA的某些方面一直受到司法和国会的挑战,以及 本届政府最近为废除或取代ACA的某些方面所做的努力。此外,自2017年1月以来,总裁·特朗普签署了两项行政命令和其他指令,旨在推迟ACA某些条款的实施,或以其他方式规避ACA授权的一些医疗保险要求。此外,CMS最近发布了一项最终规则,从2020年开始,将给予各州更大的灵活性,在为个人和小团体市场的保险公司设定基准方面,这可能会放宽ACA对通过此类市场销售的保险计划所要求的基本健康福利。
同时, 国会审议了将废除和取代全部或部分ACA的立法。虽然国会还没有通过全面的废止立法,但两项影响ACA下某些税收实施的法案已经签署成为法律。2017年减税和就业法案(TCJA)包括一项条款,从2019年1月1日起废除ACA对未能在一年的全部或部分时间内维持合格医疗保险的个人实施的基于税收的分担责任付款, 通常被称为“个人强制医保”。此外,2018年1月22日,总裁·特朗普签署了一项关于2018财年拨款的持续决议 ,推迟了ACA规定的某些费用的实施,包括对某些高成本雇主赞助的保险计划征收所谓的“凯迪拉克”税 ,对某些高成本雇主赞助的保险计划征收年费,根据市场份额向某些医疗保险提供者征收年费,以及对非豁免的医疗器械征收医疗器械税 。此外,2018年两党预算法案(BBA)等修订了ACA,自2019年1月1日起生效, 将参与Medicare D部分的制药制造商所欠的销售点折扣从50%提高到70%,并缩小大多数Medicare药物计划的覆盖缺口,通常被称为“甜甜圈洞”。最近, 在2018年7月,CMS发布了一项最终规则,允许根据ACA风险调整计划对某些ACA合格健康计划和 健康保险发行商进行进一步的收款和付款,以回应联邦地区法院关于CMS确定此风险调整的方法的诉讼结果。国会还可以考虑额外的立法,以废除或取代ACA的其他要素。因此,ACA的全部影响、任何废除或取代它的内容的法律,以及围绕我们业务的任何废除或取代立法的政治不确定性仍不清楚。
| 55 |
此外,自ACA颁布以来,美国还提出并通过了其他立法修改。2011年8月,除其他事项外,《2011年预算控制法案》制定了国会削减开支的措施。赤字削减联合特别委员会的任务是建议2013年至2021年至少削减1.5万亿美元的赤字,但该委员会无法 达到所需的目标,从而触发了立法对几个政府计划的自动削减。这包括在2013年4月生效的每个财年向提供商支付的医疗保险总金额减少2%,并且由于随后的立法修订,包括BBA,除非采取额外的国会行动,否则将一直有效到2027年。2013年1月,2012年《美国纳税人救济法》签署成为法律,除其他事项外,进一步减少了对包括医院和癌症治疗中心在内的几家医疗服务提供者的医疗保险支付,并将政府 追回向医疗服务提供者多付款项的诉讼时效从三年延长至五年。
此外, 政府最近加强了对药品制造商为其上市产品定价的方式的审查,这导致了几次国会调查,并提出并颁布了联邦和州立法,旨在提高产品定价的透明度,审查定价与制造商患者计划之间的关系,并改革 政府计划药品报销方法。例如,本届政府发布了一份《蓝图》 ,以降低药品价格和降低药品的自付成本,其中包含增加制造商竞争的额外建议, 增加某些联邦医疗保健计划的谈判力,激励制造商降低其产品的标价 ,并减少消费者支付的药品的自付成本。例如,2018年11月,CMS发布了一项建议规则,以征求 意见,其中将为D部分下的Medicare处方药计划提供更大的定价透明度和更大的 灵活性,以谈判六个受保护的处方类别中的药物的折扣,并在某些情况下排除这些药物,并允许Medicare Advantage计划使用特定的药物管理工具,如医生管理的药物的阶梯疗法。尽管其中许多措施和其他拟议措施需要通过额外的立法授权才能生效,但国会和特朗普政府都表示将继续寻求新的立法和/或行政措施来控制 药品成本。
外国、联邦和州各级已经并可能继续提出立法和监管建议,旨在 扩大医疗保健的可获得性,并控制或降低医疗保健成本。我们无法预测未来可能采用的计划。这些政府和其他付款人继续努力控制或降低医疗保健成本和/或实施价格管制,可能会对以下方面产生不利影响:
● 对我们候选产品的需求,如果我们获得监管部门的批准;
● 我们有能力为我们的产品设定一个我们认为是公平的价格;
● 我们创造收入、实现或保持盈利的能力;
● 我们须缴交的税项水平;及
● 资金的可得性。
任何拒绝承保或减少联邦医疗保险或其他政府计划的报销都可能导致类似的拒绝或减少私人支付者的付款 ,这可能会对我们未来的盈利能力产生不利影响。
| 56 |
我们 受修订后的美国1977年《反海外腐败法》或《反海外腐败法》和其他反腐败法律以及出口管制法律、进口和海关法、贸易和经济制裁法律以及其他管理我们业务的法律的约束。
我们的运营受到反腐败法律的约束,包括《反海外腐败法》、美国《反海外腐败法》第18章第201节中包含的美国国内贿赂法规、《美国旅行法》以及适用于我们开展业务的国家/地区的其他反腐败法律。《反贿赂法》、《反海外腐败法》和其他 法律一般禁止我们以及我们的员工和中介机构直接或间接授权、承诺、提供或提供不正当或被禁止的款项或任何其他有价值的东西给政府官员或其他人员,以获得或保留业务或 获得其他业务优势。根据《反贿赂法》,我们还可能因未能阻止与我们有关联的人实施贿赂犯罪而承担责任。我们和我们的商业合作伙伴在多个司法管辖区开展业务,这些司法管辖区可能存在违反《反贿赂法》或《反海外腐败法》的风险,我们参与与第三方的合作和关系,这些第三方的腐败或非法活动 可能使我们根据《反贿赂法》、《反海外腐败法》或当地反腐败法承担责任,即使我们没有明确授权 或实际了解此类活动。此外,我们无法预测未来监管要求的性质、范围或效果 我们的国际业务可能受制于这些监管要求,也无法预测现有法律可能被管理或解释的方式。
我们 还受制于管理我们国际业务的其他法律和法规,包括由英国和美国政府以及欧盟当局管理的法规,包括适用的出口管制法规、对某些国家和人员的经济制裁和禁运、反洗钱法、进口和海关要求以及货币兑换法规,统称为贸易管制法。
不能保证我们将完全有效地确保我们遵守所有适用的反腐败法律,包括《反贿赂法》、《反海外腐败法》或其他法律要求,包括贸易控制法。如果我们不遵守《反贿赂法》、《反海外腐败法》和其他反腐败法或贸易控制法,我们可能会受到刑事和民事处罚、返还和其他 制裁和补救措施,以及法律费用,这可能会对我们的业务、财务状况、运营结果和流动性产生不利影响。同样,对英国、美国或其他当局可能违反《反贿赂法》、《反海外腐败法》、其他反腐败法律或贸易管制法律的任何调查也可能对我们的声誉、我们的业务、经营结果和财务状况产生不利影响。
如果 我们未能遵守环境、健康和安全法律法规,我们可能会受到罚款或处罚,或产生 成本,这可能会对我们的业务成功产生重大不利影响。
我们 受众多环境、健康和安全法律法规的约束,包括管理实验室程序以及危险材料和废物的处理、使用、储存、处理和处置的法律法规。我们的业务涉及使用危险和易燃材料,包括化学品和生物材料。我们的业务还会产生危险废物产品。我们通常与第三方签订处理这些材料和废物的合同。我们无法消除这些材料造成污染或伤害的风险。如果我们使用危险材料造成污染或伤害,我们可能要对由此产生的任何损害承担责任,任何责任都可能超出我们的资源范围。我们还可能产生与民事或刑事罚款相关的巨额成本 和处罚。此外,环境法律和法规复杂,变化频繁,并有变得更加严格的趋势。 我们无法预测此类变化的影响,也无法确定我们未来的合规性。此外,为了遵守当前或未来的环境、健康和安全法律法规,我们可能会产生巨额成本 。这些当前或未来的法律法规 可能会损害我们的研究、开发或生产努力。不遵守这些法律法规还可能导致巨额罚款、处罚或其他制裁。
虽然 我们维持工人补偿保险,以支付因使用危险材料或其他与工作有关的伤害而对员工造成的伤害所产生的成本和开支,但该保险可能无法为潜在的 责任提供足够的保险。此外,为了遵守当前或未来的环境、健康和安全法律和法规,我们可能会产生巨额成本。这些现行或未来的法律法规可能会损害我们的研究、开发或生产努力。不遵守这些法律法规还可能导致巨额罚款、处罚或其他制裁或责任,这可能会对我们的业务、财务状况、运营结果和前景产生重大不利影响。
| 57 |
与我们国际业务相关的风险
由于我们的子公司救济位于美国境外,因此我们面临与国际业务相关的经济、政治、监管和其他风险 。
由于Relipment的总部设在瑞士,我们的业务在美国以外的地区开展业务会受到风险的影响。 我们的许多供应商和临床试验关系都位于美国以外。因此,我们未来的业绩可能会受到多种因素的影响,包括:
| ● | 经济疲软,包括通货膨胀,或特别是非美国经济体和市场的政治不稳定; |
| ● | 不同的 和不断变化的产品审批法规要求; |
| ● | 不同的法域在确保、维持或获得在此类法域运作的自由方面可能会出现不同的问题; |
| ● | 可能会减少对知识产权的保护; |
| ● | 在遵守多个司法管辖区不同、复杂和不断变化的法律、法规和法院系统以及遵守各种外国法律、条约和法规方面遇到困难 ; |
| ● | 改变美国以外的法规和关税、关税和贸易壁垒; |
| ● | 英镑、美元、欧元和货币管制的非美国货币汇率变化 ; |
| ● | 贸易 各国政府的保护措施、进出口许可要求或其他限制行动; |
| ● | 在某些非美国市场实行不同的报销制度和价格管制; |
| ● | 税法变更带来的负面后果; |
| ● | 遵守国外居住或旅行员工的税法、就业法、移民法和劳动法,包括在不同司法管辖区对根据我们的股票期权计划或股权激励计划授予的期权的可变税收 待遇; |
| ● | 劳动力 劳工骚乱比美国更普遍的国家的不确定性; |
| ● | 诉讼 或因现任或前任员工或顾问单独或作为集体诉讼的一部分而对我们提起的行政诉讼,包括对错误解雇、歧视、错误分类或其他违反劳动法的索赔或 其他被指控的行为; |
| ● | 与人员配置和管理国际业务有关的困难,包括不同的劳资关系; |
| ● | 生产 任何影响国外原材料供应或制造能力的事件造成的短缺; |
| ● | 业务 由于地缘政治行动(包括战争和恐怖主义)或自然灾害(包括地震、台风、洪水和火灾)造成的中断。 |
| 58 |
欧洲 数据收集受有关个人信息的使用、处理和跨境传输的限制性法规管辖。
欧盟信息系统中个人健康数据的收集和使用受数据保护指令的规定管辖,自2018年5月25日起,该指令已被GDPR取代。这些指令对个人数据涉及的个人的同意、向个人提供的信息、向主管国家数据保护机构通知数据处理义务以及个人数据的安全和保密提出了几项要求。数据保护指令和GDPR还对将个人数据从欧盟转移到美国实施了严格的规则。如果 未能遵守数据保护指令、GDPR以及欧盟成员国的相关国家数据保护法的要求,可能会受到罚款和其他行政处罚。虽然数据保护指令不适用于总部位于欧盟以外的组织,但GDPR已将其覆盖范围扩大到向欧盟居民提供商品或服务的任何企业,无论其位置如何 。这一扩展将纳入欧盟成员国的任何潜在临床试验活动。GDPR对个人数据的控制器和处理器施加了 严格的要求,包括对包括居住在欧盟的数据对象的健康和遗传信息的“敏感信息” 的特殊保护。GDPR允许个人有机会反对 处理其个人信息,允许他们在某些情况下请求删除个人信息,并且 为个人提供了明确的权利,在个人认为其权利受到侵犯的情况下寻求法律补救。此外,GDPR对将个人数据从欧盟转移到美国或其他被认为没有提供“充分”隐私保护的地区实施了严格的规则。如果不遵守GDPR和欧盟成员国的相关国家数据保护法的要求,可能会稍微偏离GDPR, 可能会被处以高达全球收入的4%或20,000,000欧元的罚款,以金额较大者为准。作为实施GDPR的结果,我们可能需要建立额外的机制,以确保遵守新的数据保护规则。
与我们依赖第三方相关的风险
对于 某些候选产品,我们可能依赖开发和商业化合作伙伴来开发和进行临床试验, 获得监管部门对候选产品的批准,如果获得批准,则营销和销售候选产品。如果此类合作者的表现达不到预期, 我们从这些候选产品中获得未来收入的潜力将显著降低,我们的业务将受到损害。
对于 某些候选产品,我们依赖或将依赖我们的开发和商业合作伙伴来开发、进行候选产品的临床 试验,并在获得批准后将其商业化。
我们当前的合作以及我们未来参与的任何合作都会面临许多风险,包括:
| ● | 协作者 在确定他们将应用于协作的工作和资源方面有很大的自由裁量权; |
| ● | 协作者 可能未按预期履行义务,或未能及时履行责任,或根本不履行责任; |
| ● | 合作者 不得继续开发和商业化获得监管批准的任何候选产品,或选择不继续 或基于临床前研究或临床试验结果更新开发或商业化计划,合作者 战略重点或可用资金或外部因素,如转移资源或产生竞争优先事项的收购; |
| ● | 合作者 可能会延迟临床前研究或临床试验,为临床试验提供的资金不足,停止临床前研究或临床 试验或放弃候选产品,重复或进行新的临床试验,或需要候选产品的新配方,以 临床试验; |
| 59 |
| ● | 我们 可能无法访问或可能被限制披露有关正在开发的候选产品的某些信息,或 在合作下商业化,因此可能无法向我们的股东告知此类 候选产品; |
| ● | 合作者 可以独立开发或与第三方合作开发与我们的候选产品直接或间接竞争的产品 如果合作者认为竞争产品更有可能在 在经济上比我们更具吸引力的条件; |
| ● | 该 合作可能不会导致候选产品的开发和/或临床前研究或临床试验作为 合作可能不会成功; |
| ● | 产品 与合作者共同开发的候选产品可能会被我们的合作者视为与他们自己的候选产品或产品竞争, 这可能导致合作者停止我们的候选产品的商业化; |
| ● | a 拥有我们一个或多个获得监管批准的候选产品的营销和分销权的合作者可以 不投入足够的资源用于任何此类候选产品的营销和分销;以及 |
| ● | 合作者 可能无法正确维护或捍卫我们的知识产权,或可能以邀请 可能危及或使我们的知识产权或专有信息无效或使我们面临潜在诉讼的诉讼。 |
此外,某些合作和商业化协议为我们的合作者提供了终止此类协议的权利, 这些权利可能受条件限制,也可能不受条件限制,如果行使这些权利,将对我们的产品开发工作产生不利影响, 并可能使我们难以吸引新的合作者。在这种情况下,我们可能需要限制此类候选产品或产品的开发和商业化的规模和范围;我们可能需要 寻求额外融资,以资助进一步开发或确定替代战略合作;我们从这些候选产品或产品的特许权使用费和里程碑付款产生未来收入的潜力将显著降低,延迟或取消; 而且可能会对我们的业务和未来增长前景产生不利影响。我们收回有形和无形资产的权利 以及在合作终止后推进候选产品或产品所需的知识产权可能受到合同的限制 ,我们可能无法在终止后推进计划。
如果与我们的开发和商业化合作者或许可人发生冲突,他们可能会出于自身利益行事,这可能会对我们公司的利益不利。
我们 未来可能会与我们的开发和商业化合作者或许可方发生分歧。由于以下一项或多项原因,我们与第三方的协作和许可安排可能会出现冲突:
| ● | 争议 关于里程碑、特许权使用费和其他根据适用协议应支付的款项; |
| ● | 分歧 关于知识产权的归属或者许可范围; |
| ● | 分歧 关于任何报告义务的范围; |
| ● | 不情愿 作为合作者,让我们了解其开发和商业化活动的进展情况,或 允许公开披露这些活动;以及 |
| ● | 争议 关于合作者或我们对我们的产品和候选产品的开发或商业化努力。 |
| 60 |
与我们的开发和商业化合作伙伴或许可方的冲突 可能会对我们的业务、财务状况或运营结果和未来增长前景产生重大不利影响。
我们 将依赖第三方(包括独立临床研究者和CRO)来开展和赞助我们候选产品的部分临床试验 。第三方未能履行其在候选产品临床开发方面的义务可能会延迟或损害我们获得候选产品监管批准的能力。
我们 将依赖并计划继续依赖第三方(包括独立临床研究者、学术合作伙伴、 法规事务顾问和第三方CRO)来开展我们的临床前研究和临床试验(包括在某些情况下 赞助此类临床试验),并与监管机构合作,监测和管理我们正在进行的临床前和 临床项目的数据。鉴于我们认为我们的候选产品可能具有实用性的临床治疗领域的广度,我们打算 继续依赖外部服务提供商,而不是建立内部监管专业知识。
在某些情况下,这些第三方中的任何一方都可以终止与我们的合同。我们可能无法达成替代的 安排或以商业上合理的条款这样做。此外,当新的合同研究机构开始工作时,还有一个自然的过渡期。因此,可能会出现延迟,这可能会对我们满足预期临床开发时间表的能力产生负面影响,并损害我们的业务、财务状况和前景。
We remain responsible for ensuring that each of our preclinical studies and clinical trials is conducted in accordance with the applicable protocol and legal, regulatory and scientific standards, and our reliance on these third parties does not relieve us of our regulatory responsibilities. We and our third-party contractors and CROs are required to comply with GCP requirements, which are regulations and guidelines enforced by the FDA, the Competent Authorities of the Member States of the European Economic Area, or EEA, and comparable foreign regulatory authorities for all of our products in clinical development. Regulatory authorities enforce these GCP requirements through periodic inspections of trial sponsors, principal investigators and trial sites. If we fail to exercise adequate oversight over any of our academic partners or CROs or if we or any of our academic partners or CROs do not successfully carry out their contractual duties or obligations, fail to meet expected deadlines, or if the quality or accuracy of the clinical data they obtain is compromised due to the failure to adhere to our clinical protocols or regulatory requirements, or for any other reasons, the clinical data generated in our clinical trials may be deemed unreliable and the FDA, the EMA or comparable foreign regulatory authorities may require us to perform additional clinical trials before approving our marketing applications. We cannot assure you that upon a regulatory inspection of us, our academic partners or our CROs or other third parties performing services in connection with our clinical trials, such regulatory authority will determine that any of our clinical trials complies with GCP regulations. In addition, our clinical trials must be conducted with product produced under applicable CGMP regulations. Our failure to comply with these regulations may require us to repeat clinical trials, which would delay the regulatory approval process.
此外, 代表我们进行临床试验的第三方不是我们的员工,除了根据我们与此类承包商的协议向我们提供的补救措施外,我们无法控制他们是否将足够的时间、技能和资源投入到我们正在进行的开发项目中。 这些承包商还可能与其他商业实体有关系,包括我们的竞争对手,他们也可能为这些实体进行临床试验或其他药物开发活动,这可能会阻碍他们将适当的时间投入我们的临床项目的能力。 如果这些第三方,包括临床研究人员,没有成功履行合同职责,如果我们无法在预期的最后期限内完成 或根据法规要求或我们规定的方案进行临床试验,我们可能无法获得或延迟获得我们候选产品的上市批准。如果发生这种情况,我们将无法或可能会推迟将我们的候选产品成功商业化的努力。
| 61 |
In addition, with respect to investigator-sponsored trials that may be conducted, we would not control the design or conduct of these trials, and it is possible that the FDA or EMA will not view these investigator-sponsored trials as providing adequate support for future clinical trials or market approval, whether controlled by us or third parties, for any one or more reasons, including elements of the design or execution of the trials or safety concerns or other trial results. We expect that such arrangements will provide us certain information rights with respect to the investigator-sponsored trials, including access to and the ability to use and reference the data, including for our own regulatory submissions, resulting from the investigator-sponsored trials. However, we would not have control over the timing and reporting of the data from investigator-sponsored trials, nor would we own the data from the investigator- sponsored trials. If we are unable to confirm or replicate the results from the investigator-sponsored trials or if negative results are obtained, we would likely be further delayed or prevented from advancing further clinical development. Further, if investigators or institutions breach their obligations with respect to the clinical development of our product candidates, or if the data proves to be inadequate compared to the firsthand knowledge we might have gained had the investigator-sponsored trials been sponsored and conducted by us, then our ability to design and conduct any future clinical trials ourselves may be adversely affected. Additionally, the FDA or EMA may disagree with the sufficiency of our right of reference to the preclinical, manufacturing or clinical data generated by these investigator-sponsored trials, or our interpretation of preclinical, manufacturing or clinical data from these investigator-sponsored trials. If so, the FDA or EMA may require us to obtain and submit additional preclinical, manufacturing, or clinical data.
我们 打算依赖第三方生产候选产品,这增加了我们无法以可接受的成本获得足够数量的此类候选产品或产品或此类数量的风险,这可能会延迟、阻止或损害我们的开发 或商业化努力。
我们 不拥有或经营生产我们 在开发计划中正在开发或评估的候选产品的临床或商业供应的生产设施。我们拥有药品生产经验的人员有限,并且缺乏 资源和能力来生产临床或商业规模的任何候选产品。我们依赖第三方 提供候选产品,我们的策略是将所有候选产品和产品的制造外包给第三方 。
为了对候选产品进行临床试验,我们可能需要大量生产这些产品。我们的第三方制造商可能无法及时或以具有成本效益的方式或根本不能成功地提高我们的任何候选产品的生产能力。此外,在扩展活动期间和任何其他时间都可能出现质量问题。例如, 有关我们候选产品稳定性的持续数据可能会缩短我们候选产品的有效期,并导致临床试验材料供应短缺,并可能导致临床试验延迟。如果这些第三方制造商无法以足够的质量和数量成功扩大我们候选产品的生产 ,则该候选产品的开发、测试和临床试验可能会被推迟或不可行,该候选产品的监管批准或商业发布可能会延迟或无法获得, 这可能会严重损害我们的业务。
我们使用新的第三方制造商会增加生产延迟或候选产品供应不足的风险,因为 我们将制造技术转让给这些制造商,随着他们获得制造我们候选产品的经验。即使 第三方制造商在制造我们的候选产品方面获得了丰富的经验,或者即使我们认为我们已经成功地优化了制造流程,也不能保证该制造商将及时或随着时间的推移连续生产足够数量的我们候选产品,或者根本不能保证。
如果我们需要更改第三方使用的制造流程,我们 可能会延迟。此外,如果我们更改批准的制造流程 ,如果FDA或类似的外国机构需要在新的制造流程可以使用之前对其进行审查,则我们可能会被推迟。
| 62 |
我们 采用外包模式生产我们的候选产品,并与获得许可的药品合同开发和制造组织签订了良好的制造规范或GMP。虽然我们已经聘请了几家第三方供应商来提供临床用品和非临床用品以及填充剂服务,但我们目前没有与第三方制造商签订任何长期商业用品的协议。未来,我们可能无法与第三方制造商就我们开发的任何候选产品的商业供应 达成协议,或者无法以可接受的条款这样做。即使我们能够与第三方制造商建立并维护 安排,依赖第三方制造商也会带来风险,包括:
| ● | 依赖第三方进行制造流程开发、合规和质量保证; |
| ● | 由于第三方的能力和进度限制而造成的供应可用性限制 ; |
| ● | 由于我们无法控制的因素,第三方可能违反制造协议;以及 |
| ● | 在对我们来说代价高昂或不方便的情况下, 第三方可能终止或不续订制造协议。 |
第三方 制造商可能无法遵守cGMP要求或美国以外的类似监管要求。我们未能遵守适用要求或第三方制造商未能遵守相关要求可能导致对我们实施制裁,包括罚款、禁令、民事处罚、延迟、暂停或撤回审批、吊销许可证、扣押或召回候选产品或产品、运营限制和/或刑事起诉,其中任何一项都可能对我们候选产品的供应造成重大和不利的 影响。此外,我们打算开发的一些候选产品,包括SON-080,使用毒素 或其他只能在具有特定授权和许可的专门设施中生产的物质,并且无法 保证我们或我们的制造商能够保持此类授权和许可。这些专业化要求还可能限制我们可以聘请的潜在制造商的数量,以生产我们的候选产品,并破坏过渡到替代制造商的任何努力 。
我们未来的候选产品和我们可能开发的任何产品都可能与其他候选产品和产品竞争生产设施。按照cGMP要求运营并有能力为我们生产产品的制造商数量有限。
如果受聘为我们的临床前测试和临床试验提供任何材料或产品的第三方因任何原因而停止提供任何材料或产品,我们很可能会在确定和 确定替换供应商或制造商资格时延迟推进这些测试和试验,并且我们可能无法以对我们有利的条款获得替换供应。 此外,如果我们无法获得足够的候选产品或用于制造这些候选产品的物质,我们将更难开发候选产品并有效竞争。
我们目前和预期的未来对其他候选产品生产的依赖可能会对我们未来的利润率以及我们开发候选产品和将任何及时获得市场批准的产品进行商业化的能力产生不利影响。
我们对第三方的依赖要求我们共享我们的商业秘密,这增加了竞争对手发现这些秘密或我们的商业秘密被盗用或泄露的可能性。
由于 我们依赖第三方来生产候选产品,并且由于我们与各种组织和学术机构 合作开发候选产品,因此我们有时必须与他们分享商业秘密。我们在开始研究或披露专有信息之前, 通过与我们的合作者、顾问、员工和顾问签订保密协议,以及材料转让协议、合作研究协议、 咨询协议或其他类似协议(如适用)来保护我们的专有技术。这些协议通常会限制第三方使用或披露我们的机密 信息(如商业机密)的权利。
| 63 |
尽管与第三方合作时采用了合同条款,但共享商业秘密和其他机密信息的需要 会增加此类商业秘密被我们的竞争对手知晓、被无意中并入其他人的技术中、或在违反这些协议的情况下被披露或使用的风险。鉴于我们的专有地位在一定程度上基于我们的专有技术和商业秘密,竞争对手发现我们的商业秘密或其他未经授权的使用或披露将损害我们的竞争地位,并可能对我们的业务产生实质性的不利影响。
此外,这些协议通常会限制我们的合作者、顾问、员工和顾问发布可能与我们的商业秘密相关的数据。我们的学术合作者通常有权发布数据,前提是提前通知我们 ,并且可能会将发布推迟一段指定的时间,以保护我们因合作而产生的知识产权。在 其他情况下,发布权由我们独家控制,尽管在某些情况下我们可能与其他各方共享这些权利。 尽管我们努力保护我们的商业秘密,但我们的竞争对手可能会通过违反这些协议、独立开发或发布信息(包括我们的商业秘密)来发现我们的商业秘密,在发布时我们没有专有权或其他 受保护的权利。竞争对手发现我们的商业机密将损害我们的竞争地位 并对我们的业务产生不利影响。
与我们知识产权相关的风险
如果 我们无法为我们的产品和候选产品获得并维护专利和其他知识产权保护,或者如果 获得的专利和其他知识产权保护的范围不够广泛,我们的竞争对手可能会开发 与我们相似或相同的产品并将其商业化,我们成功将我们的产品和候选产品商业化的能力可能会受到不利影响。
我们有效竞争的能力将在一定程度上取决于我们保持技术和制造流程的专有性质的能力 。我们依靠研究、制造和其他技术、专利、商业秘密、许可协议和合同条款来确立我们的知识产权并保护我们的产品和候选产品。然而,这些法律手段只能提供有限的保护,可能无法充分保护我们的权利。截至2023年12月11日,我们的知识产权组合包括19项未决专利申请和已颁发专利,包括在美国的1项已发布专利,日本、俄罗斯和新西兰各1项授权决定,以及5007专利系列中的9项PCT申请-此外,还有6项未决的临时申请,涉及配方、制造工艺和使用方法。
在 某些情况下,在被认为合适的情况下,我们已经并打算继续寻求通过在美国提交专利申请来保护我们的专有地位,在至少某些情况下,在美国以外的一个或多个国家/地区提交与当前和未来的产品以及对我们业务重要的候选产品有关的专利申请。然而,我们无法预测目前正在申请的专利 是否会作为专利颁发,或者任何由此产生的专利的权利要求是否会为我们提供竞争优势,或者我们是否能够在未来成功地申请与我们当前或未来的产品和候选产品相关的专利申请 。此外,专利申请和审批过程既昂贵又耗时。我们可能无法以合理的成本或及时提交和起诉所有必要或可取的专利申请。此外,我们或任何未来的合作伙伴、合作者或被许可人可能无法在获得专利保护之前确定在开发和商业化活动中的发明的可申请专利的方面。因此,我们可能会错过寻求额外专利保护的预期潜在机会 。专利申请的准备或提交过程中可能存在形式上的缺陷, 或将来可能会出现,例如,在适当的优先权权利要求、清单、权利要求范围或专利期限调整请求方面。如果我们未能建立、维护或保护此类专利和其他知识产权,此类权利可能会减少或取消。如果我们的专利或专利申请在形式、准备、起诉或执行方面存在重大缺陷, 此类专利可能无效和/或无法强制执行,并且此类申请可能永远不会产生有效的、可强制执行的专利。
即使我们的专利和专利申请不受质疑,但如果它们被颁发,我们的专利和专利申请可能不会为我们提供任何有意义的保护,或者阻止 竞争对手通过以非侵权方式开发类似或替代技术或疗法来绕过我们的专利主张进行设计 。例如,第三方可能开发一种竞争性疗法,提供与我们的一个或多个候选产品类似的益处 ,但这超出了我们的专利保护范围。如果我们对候选产品持有或申请的专利和专利申请提供的专利保护不够广泛,不足以阻碍此类竞争,我们将候选产品成功商业化的能力可能会受到负面影响。
| 64 |
正如在“业务”标题下讨论的那样,我们的国际专利申请号为PCT/US2018/00085的PCT专利申请收到的申请提交日期为2018年2月20日,这是在美国临时专利申请US 62/459,975和US 62/459,981提交日期一周年之后的四天,PCT专利申请要求因PCT接收办公室的计算机问题而享有优先权。尽管PCT已将优先权恢复到美国临时专利申请的申请日(美国62/459,975和美国62/459,981),但一些从本PCT专利申请中提交的国家阶段专利申请的国家阶段申请不接受这种恢复,包括加拿大和中国,恢复程序在巴西悬而未决 。在优先权未恢复的情况下,现有技术可能适用于这些专利申请,否则这些专利申请可能不适用于PCT/US2018/00085提交的其他专利申请。这可能会影响我们 在巴西、加拿大和中国提出的专利申请的范围或广度,或者可能导致无法在这些国家/地区获得专利。
其他 方,其中许多人拥有更多的资源,并在竞争技术方面进行了大量投资,已经开发出 或可能开发出与我们的方法相关或竞争的技术,并且可能已经提交或可能提交专利申请 ,并且可能已经颁发或可能颁发专利,其权利要求与我们的专利申请重叠或冲突,或者通过要求 相同的成分,配方或方法,或要求保护可能主导我们专利地位的主题。此外,外国的 法律可能无法像美国法律那样保护我们的权利。因此,我们 将来可能获得的任何专利可能无法为我们提供充分和持续的专利保护,足以阻止其他人将与我们的产品和候选产品类似的 产品商业化。
The patent position of biotechnology and pharmaceutical companies generally is highly uncertain. No consistent policy regarding the breadth of claims allowed in biotechnology and pharmaceutical patents has emerged to date in the United States or in many foreign jurisdictions. In addition, the determination of patent rights with respect to pharmaceutical compounds commonly involves complex legal and factual questions, which has in recent years been the subject of much litigation. As a result, the issuance, scope, validity, enforceability and commercial value of our patent rights are highly uncertain. Our competitors may also seek approval to market their own products similar to or otherwise competitive with our products. Alternatively, our competitors may seek to market generic versions of any approved products by submitting ANDAs to the FDA in which they claim that our patents are invalid, unenforceable or not infringed. In these circumstances, we may need to defend or assert our patents, or both, including by filing lawsuits alleging patent infringement. In any of these types of proceedings, a court or other agency with jurisdiction may find our patents invalid or unenforceable, or that our competitors are competing in a non-infringing manner. Thus, even if we have valid and enforceable patents, these patents still may not provide protection against competing products or processes sufficient to achieve our business objectives.
将来,我们的一个或多个产品和候选产品可能会从第三方获得许可。因此,在某些情况下,潜在专利保护的 可用性和范围会根据我们的许可方或发明人先前的决定而受到限制,例如 关于何时提交专利申请或是否提交专利申请的决定。我们因任何原因未能获得、维护、执行 或捍卫此类知识产权,可能会允许第三方,特别是其他已建立的、资金更充足的 竞争对手(具有已建立的开发、制造和分销能力)生产竞争产品或影响我们开发、制造和营销我们的产品和候选产品的能力, 即使这些产品和候选产品在商业上可行的基础上获得批准,如果有话, 这可能对我们的业务产生重大不利影响。
除专利保护外,我们预计还将严重依赖商业秘密、专有技术和其他难以 保护的非专利技术。尽管我们通过与我们的供应商、员工、顾问 和其他可能访问专有信息的人签订保密协议来寻求此类保护,但我们无法确定这些协议不会被违反,是否有足够的 补救措施来应对任何违约行为,或者我们的商业秘密,专有技术和其他非专利专有技术不会 被我们的竞争对手所知或独立开发。如果我们未能成功保护我们的知识产权, 我们产品的销售可能会受到影响,我们产生收入的能力可能会受到严重影响。
| 65 |
如果在法庭或行政 诉讼中受到质疑,则涵盖我们的产品和候选产品的已颁发 专利可能被认定无效或不可执行。在法庭上我们可能无法保护我们的商业秘密。
如果 我们针对第三方发起法律诉讼以强制执行覆盖我们的产品或候选产品的专利,如果 出现此类专利问题,被告可以反诉覆盖我们的产品或候选产品的专利无效或不可强制执行。 在美国的专利诉讼中,被告声称无效或不可强制执行的反诉很常见。 质疑有效性的理由可能是据称未能满足几项法定要求中的任何一项,包括缺乏新颖性、明显、 书面描述或未启用。不可执行性主张的理由可能是,与专利起诉有关的人在起诉期间向美国专利商标局隐瞒了有关专利可专利性的信息,或做出了误导性的声明。 第三方也可以向美国或国外的行政机构提出类似的索赔,即使在 诉讼的背景之外也是如此。此类机制包括重新审查、授权后审查、各方间审查以及在外国司法管辖区进行的同等程序。 在上述任何程序中做出不利裁决可能会导致我们的 专利被撤销、取消或修改,从而不再涵盖我们的产品或候选产品。在法律上断言无效和不可强制执行之后的结果是不可预测的。例如,关于有效性问题,我们不能确定没有使专利审查员和我们在起诉期间不知道的现有技术无效。如果被告或第三方胜诉,则我们可能至少部分甚至全部失去对我们的一个或多个产品和候选产品的专利保护。这种专利保护的丧失可能会对我们的业务产生实质性的不利影响。
此外,我们的商业秘密可能会被竞争对手知晓或独立发现。竞争对手和其他第三方 可能购买我们的产品和候选产品,并试图复制我们从我们的开发工作中获得的部分或全部竞争优势,故意侵犯、挪用或以其他方式侵犯我们的知识产权,围绕我们 受保护的技术进行设计,或开发他们自己的不属于我们知识产权的竞争技术。如果我们的任何商业秘密是由竞争对手或其他第三方合法获取或独立开发的,我们将无权 阻止他们或他们向其传达信息的人使用该技术或信息与我们竞争。如果我们的商业秘密没有得到充分保护或不足以提供相对于竞争对手的优势,我们的竞争地位可能会受到不利的 影响,我们的业务也可能受到影响。此外,如果为保护我们的商业秘密而采取的措施被认为是不充分的,我们可能没有足够的追索权 针对第三方盗用我们的商业秘密。
我们 可能会受到质疑专利和其他知识产权的发明权或所有权的索赔。
我们 可能会受到前员工、合作者或其他第三方对我们拥有或将来可能拥有或许可的专利和知识产权的所有权权益的索赔。虽然我们的政策是要求 可能参与知识产权开发的员工和承包商执行将此类知识产权转让给我们的协议,但我们可能无法与实际开发我们视为自己的知识产权的每一方执行此类协议,或者 此类转让可能不是自动执行的或可能被违反。例如,由于参与开发我们产品或候选产品的员工、顾问或其他人的义务冲突,我们可能会受到所有权纠纷的影响。可能需要 针对任何质疑库存或所有权的索赔进行辩护。如果我们或未能为任何此类索赔辩护,我们可能需要支付金钱损害赔偿,并可能失去宝贵的知识产权,如知识产权的独家所有权或使用权 ,这可能会对我们的业务、运营结果和财务状况产生不利影响。
获得和维持专利保护取决于遵守政府专利机构提出的各种程序、文件提交、费用支付和其他要求 ,如果不符合这些要求,我们的专利保护可能会减少或取消。
定期 专利和申请的维护费、续期费、年费和各种其他政府费用需要在专利和申请的有效期内分几个阶段向USPTO和美国以外的各种政府专利机构支付 。美国专利商标局和各种非政府专利机构要求在专利申请过程中和专利颁发后遵守一些程序、文件、费用支付和其他类似条款。在 情况下,不遵守规定可能会导致专利或专利申请被放弃或失效,从而导致相关司法管辖区的专利权部分或全部丧失。我们未来签订的一个或多个许可证的条款可能无法为我们提供 维护或起诉产品组合中的专利的能力,因此必须依赖第三方来维护或起诉。
| 66 |
如果我们没有为我们的产品和候选产品获得专利期延长和数据独占权,我们的业务可能会受到严重损害。
专利 的寿命有限。在美国,如果及时支付所有维护费,专利的自然有效期通常为自其在美国最早的非临时申请日期起计 20年。可能有各种延期,但专利的有效期及其提供的保护是有限的。即使获得了涵盖我们候选产品的专利,一旦候选产品的专利有效期过期,我们可能会接受来自竞争产品的竞争。考虑到新产品候选产品的开发、测试和监管审查所需的时间,保护这些候选产品的专利可能会在这些候选产品商业化之前或之后不久 到期。因此,我们的专利组合可能无法为我们提供足够的权利来排除其他公司将与我们相似或相同的产品商业化。
In the future, if we obtain an issued patent covering one of our present or future product candidates, depending upon the timing, duration and specifics of any FDA marketing approval of such product candidates, such patent may be eligible for limited patent term extension under the Drug Price Competition and Patent Term Restoration Act of 1984, or Hatch-Waxman Amendments. The Hatch-Waxman Amendments permit a patent extension term of up to five years as compensation for patent term lost during the FDA regulatory review process. A patent term extension cannot extend the remaining term of a patent beyond a total of 14 years from the date of product approval, only one patent may be extended and only those claims covering the approved drug, a method for using it or a method for manufacturing it may be extended. A patent may only be extended once and only based on a single approved product. However, we may not be granted an extension because of, for example, failure to obtain a granted patent before approval of a product candidate, failure to exercise due diligence during the testing phase or regulatory review process, failure to apply within applicable deadlines, failure to apply prior to expiration of relevant patents or otherwise our failure to satisfy applicable requirements. A patent licensed to us by a third party may not be available for patent term extension. Moreover, the applicable time period or the scope of patent protection afforded could be less than we request. If we are unable to obtain patent term extension or the term of any such extension is less than we request, our competitors may obtain approval of competing products following our patent expiration, and our revenue could be reduced, possibly materially.
美国和其他司法管辖区专利法的变化 可能会降低专利的价值,从而削弱我们保护产品和候选产品的能力。
Changes in either the patent laws or the interpretation of the patent laws in the United States or other jurisdictions could increase the uncertainties and costs surrounding the prosecution of patent applications and the enforcement or defense of issued patents. On September 16, 2011, the Leahy-Smith America Invents Act, or the Leahy-Smith Act, was signed into law. When implemented, the Leahy-Smith Act included several significant changes to U.S. patent law that impacted how patent rights could be prosecuted, enforced and defended. In particular, the Leahy-Smith Act also included provisions that switched the United States from a “first-to-invent” system to a “first-to-file” system, allowed third- party submission of prior art to the USPTO during patent prosecution and set forth additional procedures to attack the validity of a patent by the USPTO administered post grant proceedings. Under a first-to-file system, assuming the other requirements for patentability are met, the first inventor to file a patent application generally will be entitled to the patent on an invention regardless of whether another inventor had made the invention earlier. The USPTO developed new regulations and procedures governing the administration of the Leahy-Smith Act, and many of the substantive changes to patent law associated with the Leahy-Smith Act, and in particular, the first to file provisions, only became effective on March 16, 2013. It remains unclear what, if any, impact the Leahy-Smith Act will have on the operation of our business. However, the Leahy-Smith Act and its implementation could increase the uncertainties and costs surrounding the prosecution of our patent applications and the enforcement or defense of our issued patents, all of which could have a material adverse effect on our business.
此外,公司在生物制剂和药品开发和商业化中的专利地位尤其不确定。美国联邦巡回上诉法院和美国最高法院最近的裁决缩小了在某些情况下专利保护的范围,并削弱了专利所有人在某些情况下的权利。这些事件的组合 已经对专利的有效性和可撤销性(一旦获得)产生了不确定性。根据美国国会、联邦法院和USPTO未来的行动 ,管理专利的法律和法规可能会以不可预测的方式发生变化 ,这可能会对我们现有的专利组合以及我们未来保护和执行知识产权的能力 产生重大不利影响。
| 67 |
我们 无法向您保证,我们为一种或多种产品和候选产品寻求专利保护的努力不会受到上述决定、其他案件的裁决或USPTO发布的指南或程序变更的负面影响。我们无法 完全预测法院在历史和未来案件中的判决可能会对生命科学公司 未来获得或执行与其产品相关的专利的能力产生什么影响。这些决定、USPTO发布的指南以及 其他案例中的裁决或USPTO指南或程序的变更可能会对我们现有的专利权以及 未来保护和执行我们知识产权的能力产生重大不利影响。
我们 可能无法在全球范围内保护我们的知识产权。
在全球所有国家/地区对产品和候选产品申请、起诉、维护、辩护和强制执行专利的费用将高得令人望而却步,而且我们在美国以外的一些国家/地区的知识产权可能没有美国的知识产权那么广泛。对专利性的要求在某些国家可能有所不同,特别是在发展中国家; 因此,即使在我们确实寻求专利保护的国家,也不能保证任何专利都会发布 涵盖我们产品的声明。不能保证我们将根据未来的任何许可协议在美国境内或境外获得或维护专利权。此外,一些国家的法律对知识产权的保护程度不如美国的联邦法律和州法律。因此,我们可能无法阻止第三方在美国以外的所有国家/地区实施我们的发明,即使在我们寻求专利保护的司法管辖区,也无法阻止第三方在美国或其他司法管辖区销售或进口使用我们的发明制造的产品。竞争对手可以在我们没有申请和获得专利保护的司法管辖区使用我们的技术来开发他们自己的产品,并进一步将其他侵权产品出口到我们拥有专利保护的地区,但执法力度不如美国。这些产品 可能与我们的产品和候选产品竞争,而我们的专利或其他知识产权可能无法有效或不足以阻止它们竞争。
许多公司在保护和捍卫外国司法管辖区的知识产权方面遇到了严重的问题。某些国家的法律制度,尤其是某些发展中国家的法律制度,不支持专利、商业秘密和其他知识产权保护的实施,特别是与生物技术和医药产品有关的保护,这可能使我们很难在总体上阻止侵犯我们的专利或营销竞争对手产品侵犯我们的专有权 。例如,许多外国国家都有强制许可法,根据这些法律,专利所有者必须将许可授予第三方 。在外国司法管辖区执行我们的专利权的诉讼,即使获得,也可能导致巨额成本,并将我们的努力和注意力从我们业务的其他方面转移,可能使我们的专利面临被无效或狭义解释的风险 ,我们的专利申请有可能无法发布,并可能引发第三方对我们提出索赔。我们可能不会在我们发起的任何诉讼中获胜,并且如果有损害赔偿或其他补救措施,可能没有商业意义。虽然我们打算 保护我们产品在主要市场的知识产权,但我们不能确保我们能够在我们希望销售产品的所有司法管辖区开展或保持类似的努力。因此,我们在全球范围内执行知识产权的努力可能不足以从我们 开发的知识产权中获得显著的商业优势。
如果我们因侵犯第三方知识产权而被起诉,此类诉讼可能代价高昂且耗时,并可能 阻止或推迟我们的候选产品的开发或商业化。
我们的商业成功在一定程度上取决于我们在不侵犯第三方知识产权和其他专有权利的情况下开发、制造、营销和销售我们的候选产品的能力。第三方可能拥有美国和非美国颁发的专利,以及与化合物、化合物制造方法和/或用于治疗我们正在开发的候选产品的疾病适应症的使用方法相关的 未决专利申请。如果发现任何第三方专利或专利申请 涵盖我们的候选产品或其使用或制造方法,我们和我们的合作者或分被许可人可能无法在未获得许可的情况下按计划自由生产或销售我们的候选产品,而许可可能无法以商业合理的条款获得, 或根本无法获得。在这种情况下,我们还可能被要求对我们的合作者或分被许可人进行赔偿。
| 68 |
在生物技术和制药行业有大量的知识产权诉讼,我们可能成为与我们的产品知识产权有关的诉讼或其他对抗诉讼的一方,或受到威胁 候选产品,包括干扰和美国专利商标局的授权后诉讼。可能存在与我们候选产品的组成、使用或制造有关的材料、配方、制造方法或处理方法的第三方专利或专利申请 。我们不能保证我们的任何专利搜索或分析,包括但不限于相关专利的识别、专利权利要求的范围或相关专利的到期,都是完整或彻底的,我们也不能确定 我们已经识别了与我们的候选产品在任何司法管辖区商业化或必要的 在美国和国外的每一项专利和待决申请。由于专利申请可能需要数年时间才能发布,因此可能存在当前正在处理的专利申请,这些申请可能会导致我们的候选产品被指控侵犯已颁发的专利。 此外,第三方可能会在未来获得专利,并声称使用我们的技术侵犯了这些专利。因此, 第三方可能会根据现在存在或将来出现的知识产权向我们提出侵权索赔。知识产权诉讼的结果受到不确定因素的影响,这些不确定因素事先无法充分量化。制药和生物技术行业产生了大量专利,包括我们在内的行业参与者可能并不总是清楚哪些专利涵盖各种类型的产品或使用或制造方法。专利提供的保护范围受到法院的解释,解释并不总是一致的。如果我们因专利侵权而被起诉,我们 需要证明我们的候选产品、产品或方法没有侵犯相关专利的专利主张 ,或者专利主张无效或不可执行,而我们可能无法做到这一点。证明无效性是困难的。例如,在美国, 要证明无效性,需要出示清楚且令人信服的证据,以推翻已颁发专利所享有的有效性的推定。即使我们在这些诉讼中胜诉,我们也可能会产生巨额成本,我们的管理层和科学人员的时间和注意力可能会被转移到这些诉讼中,这可能会严重损害我们的业务 和经营业绩。此外,我们可能没有足够的资源来圆满完成这些行动。
如果 我们被发现侵犯了第三方的知识产权,我们可能会被迫停止开发、制造或商业化侵权候选产品或产品,包括法院命令。或者,我们可能需要获得此类第三方的许可,才能使用侵权技术并继续开发、制造或营销侵权产品 候选产品或产品。
但是, 我们可能无法以商业合理的条款或根本无法获得任何所需的许可证。即使我们能够获得许可证,它也可能是非排他性的,从而使我们的竞争对手能够访问授权给我们的相同技术;此外,它可能包含阻碍或破坏我们在商业市场上成功竞争的能力的条款。此外,如果我们被发现故意侵犯了一项专利,我们可能会被判承担金钱损害赔偿责任,包括三倍损害赔偿和律师费。侵权发现可能会阻止我们将候选产品商业化或迫使我们停止部分业务 ,这可能会损害我们的业务。有关我们盗用第三方的机密信息或商业秘密的指控可能会对我们的业务产生类似的负面影响。
我们 可能会受到第三方的索赔,声称我们的员工或我们挪用了他们的知识产权,或者要求 拥有我们认为是我们自己的知识产权。
我们的许多现任和前任员工,包括我们的高级管理层,以前受雇于大学或其他生物技术 或制药公司,包括一些可能是竞争对手或潜在竞争对手的公司。其中一些员工可能 受制于与此类先前工作相关的专有权利、保密和竞业禁止协议或类似协议。 尽管我们尽力确保我们的员工在为我们工作时不使用他人的专有信息或专有技术,但我们 可能会受到指控,即我们或这些员工使用或披露了任何此类第三方的知识产权,包括商业秘密或其他专有 信息。可能有必要提起诉讼来对此类索赔进行辩护。如果我们未能为任何此类索赔辩护, 除了支付金钱损害赔偿外,我们还可能失去宝贵的知识产权或人员,或遭受损害。此类知识产权 可以授予第三方,我们可能需要从该第三方获得许可才能将我们的技术或产品商业化。这样的许可可能不会以商业上合理的条款或根本不存在。即使我们成功地对此类索赔进行了辩护,诉讼也可能导致巨额成本,并分散管理层的注意力。
| 69 |
此外,虽然我们通常要求可能参与知识产权开发的员工、顾问和承包商执行将此类知识产权转让给我们的协议,但我们可能无法成功地与 实际开发我们视为自己的知识产权的每一方执行此类协议,这可能会导致我们向或针对我们提出与此类知识产权所有权相关的索赔。如果我们不能起诉或为任何此类索赔辩护,除了支付金钱损害赔偿外,我们还可能失去宝贵的知识产权。即使我们成功地起诉或抗辩此类索赔, 诉讼也可能导致巨额成本,并分散我们高级管理人员和科学人员的注意力。
我们 可能会卷入保护或强制执行我们的专利和其他知识产权的诉讼,这可能是昂贵、耗时的 ,而且不会成功。
竞争对手 可能会侵犯我们的专利、商标、版权或其他知识产权。为了反击侵权或未经授权的使用,我们可能会被要求提出侵权索赔,这可能既昂贵又耗时,并分散了我们的管理人员和科学人员的时间和注意力。此外,我们的专利可能会卷入发明权、优先权或有效性纠纷。对此类索赔进行反击或 辩护可能既昂贵又耗时,而且我们的对手可能有能力投入比我们更多的 资源来起诉这些法律行动。我们对被认定的侵权者提出的任何索赔都可能促使这些当事人 对我们提出反索赔,声称我们侵犯了他们的专利,此外还声称我们的专利无效或不可强制执行,或两者兼而有之。
在侵权诉讼中,法院可以裁定某项专利无效或不可强制执行,或以我们的专利不涵盖相关技术为由,拒绝阻止另一方使用相关技术。因此,尽管我们做出了努力,但我们可能无法阻止第三方侵犯或挪用我们拥有或控制的知识产权。 任何诉讼程序中的不利结果可能会使我们拥有或授权的一个或多个专利面临被无效或狭义解释的风险。此外,由于与知识产权诉讼相关的大量发现, 在此类诉讼期间,我们的一些机密信息可能会因披露而泄露。
即使 如果裁决对我们有利,法院也可能决定不授予禁止进一步侵权活动的禁令,而只判给 金钱损害赔偿,这可能是也可能不是足够的补救措施。与知识产权索赔有关的诉讼或其他法律程序可能会导致我们产生巨额费用,并可能分散我们人员的正常责任。此外, 可能会公布听证会、动议或其他临时程序或事态发展的结果,如果证券分析师或投资者认为这些结果是负面的,可能会对我们普通股的价格产生重大不利影响。此类 诉讼或诉讼可能大幅增加我们的运营亏损,并减少可用于开发活动或任何未来销售、营销或分销活动的资源。
我们 可能没有足够的财政或其他资源来充分开展此类诉讼或诉讼程序。我们的一些竞争对手可能 能够比我们更有效地承担此类诉讼或诉讼的费用,因为他们拥有更多的财力 以及更成熟和发展的知识产权组合。专利 诉讼或其他诉讼的发起和继续所产生的不确定性可能会对我们在市场上的竞争能力产生重大不利影响。
如果 我们未能履行未来与第三方的任何知识产权许可义务,我们可能会失去对我们的业务非常重要的许可权 。
鉴于我们正在努力建立我们的候选产品渠道,我们可能会在未来签订许可协议。我们预计 此类许可协议将对我们施加各种尽职调查、里程碑付款、特许权使用费、保险和其他义务。如果我们未能遵守这些许可下的义务,我们的许可人可能有权终止这些许可协议,在这种情况下,我们可能无法销售这些协议涵盖的任何产品,或者我们的许可人可能会将许可转换为非独家许可,这可能会对根据许可协议开发的候选产品的价值产生负面影响。 终止这些许可协议或减少或取消我们的许可权利也可能导致我们不得不协商条款较差的新许可或恢复许可。
| 70 |
如果 我们的商标和商号没有得到充分保护,那么我们可能无法在我们感兴趣的标记中建立名称认知度 ,我们的业务可能会受到不利影响。
我们的商标或商号可能会受到质疑、侵犯、规避或宣布为通用商标,或被认定为侵犯了其他商标。 我们的商标依赖于注册和普通法保护。我们可能无法保护我们对这些商标和商品名称的权利,或者可能会被迫停止使用这些名称,我们需要这些名称才能在我们感兴趣的市场中获得潜在合作伙伴或客户的名称认可。在商标注册过程中,我们可能会收到拒绝。尽管我们将有机会 回应这些拒绝,但我们可能无法克服这些拒绝。此外,在美国专利商标局和许多外国司法管辖区的类似机构中,第三方有机会反对未决的商标申请并寻求注销注册商标。可能会对我们的商标提起反对或取消诉讼,我们的商标可能无法继续存在。 如果我们不能根据我们的商标和商号建立名称认可,我们可能无法有效竞争, 我们的业务可能会受到不利影响。
与员工事务和管理增长相关的风险
我们 只有有限的员工来管理和运营我们的业务。
截至2023年9月30日,我们约有12名全职员工。此外,我们利用独立承包商和其他第三方 来协助我们业务的各个方面。我们对候选产品开发的关注要求我们优化现金使用 并以高效的方式管理和运营我们的业务。我们不能向您保证我们将能够雇用或保留足够的 人员水平来开发我们的候选产品或运营我们的业务,或实现我们本来会 寻求实现的所有目标。
网络攻击 或电信或信息技术系统中的其他故障可能导致信息被盗、数据损坏和严重的业务运营中断。
我们 利用信息技术或IT、系统和网络来处理、传输和存储与我们的业务活动相关的电子信息。随着数字技术的使用越来越多,网络事件,包括蓄意攻击和企图未经授权进入计算机系统和网络,也增加了频率和复杂性。这些威胁对我们的系统和网络的安全、数据的保密性以及可用性和完整性构成了风险。
我们未来的成功取决于我们能否留住关键员工、顾问和顾问,以及吸引、留住和激励合格的 人员。
我们 高度依赖高管团队的主要成员和关键员工,失去他们的服务可能会对我们目标的实现 产生不利影响。虽然我们已经与我们的某些高管签订了雇佣协议,但他们中的任何人都可以在任何时间 离开我们的工作岗位。我们不为这些个人的生命或我们任何其他员工的生命维护“关键人物”保险单。失去一名或多名现有员工的服务可能会阻碍我们实现研发和商业化目标。此外,更换高管或其他关键员工可能很困难,而且可能需要较长的时间,因为我们行业中拥有成功开发、获得营销批准和产品商业化所需的技能和经验的人员数量有限。
为我们的业务招聘和留住其他合格的员工、顾问和顾问,包括科学和技术人员,也将是我们成功的关键。目前,我们的行业缺乏有技能的高管,这种情况很可能会持续下去。因此,对技能人才的竞争非常激烈,流失率可能很高。我们可能无法以可接受的条件吸引和留住人才 ,因为众多制药和生物技术公司都在争夺拥有类似技能的人员 。此外,未能在临床前或临床试验中取得成功,可能会使招聘和留住合格人员变得更具挑战性。
此外,我们还依赖顾问和顾问,包括科学和临床顾问,来帮助我们制定我们的研究、开发和商业化战略。我们的顾问和顾问可能受雇于其他实体,并可能根据与这些实体的咨询或咨询合同作出承诺,这可能会限制他们对我们的可用性。如果我们无法继续吸引和留住高素质人才,我们开发和商业化候选产品的能力将受到限制。
| 71 |
无法招聘或失去任何高管、关键员工、顾问或顾问的服务可能会阻碍我们 研发和商业化目标的进展。
我们的 员工、独立承包商、顾问、合作者和合同研究组织可能从事不当行为或其他 不当活动,包括不遵守监管标准和要求,这可能会给我们造成重大责任并损害我们的声誉。
我们 面临员工、独立承包商、顾问、合作者和合同研究组织可能 从事欺诈行为或其他非法活动的风险。这些各方的不当行为可能包括故意、鲁莽和/或疏忽 从事或向我们披露违反以下规定的未经授权的活动:(1)FDA的法规或类似的非美国监管机构的类似法规,包括要求向这些机构报告真实、完整和准确信息的法律, (2)制造标准,(3)联邦和州医疗欺诈和滥用法律法规以及由类似的非美国监管机构制定并执行的类似法律法规,以及(4)要求准确报告财务信息或数据的法律。特别是,医疗保健行业的销售、营销和业务安排受到旨在防止欺诈、不当行为、回扣、自我交易、贿赂和其他滥用行为的广泛法律法规的约束。这些法律法规限制或禁止广泛的定价、折扣、营销和促销、销售佣金、客户激励计划和其他业务安排 。员工或合作者的不当行为还可能涉及不当使用(包括交易)在临床试验过程中获得的信息,这可能会导致监管制裁并严重损害我们的声誉。虽然我们有行为和商业道德准则,但并不总是能够识别和阻止不当行为,我们为检测和防止此类活动而采取的预防措施可能无法有效控制未知或未管理的风险或损失,或保护我们免受政府 调查或因未能遵守此类法律、标准或法规而引发的其他行动或诉讼。如果对我们提起任何此类诉讼,而我们未能成功为自己辩护或维护自己的权利,这些诉讼可能会对我们的业务和运营结果产生重大影响,包括施加民事、刑事和行政处罚, 损害赔偿,罚款,可能被排除在联邦医疗保险、医疗补助和其他联邦医疗保健计划之外,如果我们受到公司诚信协议或类似协议的约束,如果我们受到公司诚信协议或类似协议的约束,以解决有关违反这些法律的指控、监禁、合同损害、声誉损害、利润减少和未来收益,则可能会受到额外的报告要求和/或监督。以及 削减我们的业务,其中任何一项都可能对我们的业务运营能力和我们的运营结果产生重大不利影响 。
我们 希望扩大我们的组织,因此,我们在管理我们的增长时可能会遇到困难,这可能会中断我们的运营。
我们 预计我们的员工数量和业务范围将大幅增长,特别是在药品制造、监管事务和销售、营销和分销领域,并支持我们的上市公司运营。要管理这些增长活动,我们必须继续实施和改进我们的管理、运营和财务系统,扩大我们的设施,并继续招聘和培训更多合格的人员。我们的管理层可能需要投入大量精力来管理这些增长活动。此外,我们的预期增长可能需要我们搬迁到我们历史上所在地区以外的地理区域。例如,我们在新泽西州普林斯顿设有办事处,我们的许多财务、管理和行政人员都在那里工作。由于我们的财务资源有限,而且我们的管理团队在管理具有如此预期增长的公司方面的经验也有限 ,我们可能无法有效地管理我们业务的扩张或搬迁, 留住关键员工,或确定、招聘和培训更多合格的人员。我们无法有效地管理我们业务的扩展或搬迁 可能会导致我们的基础设施薄弱,导致操作错误、失去商机、员工流失以及剩余员工的生产率下降。我们的预期增长还可能需要大量的资本支出 ,并可能会将财务资源从其他项目中转移出来,例如开发更多候选产品。如果我们不能 有效管理我们的预期增长,我们的支出可能会比预期增加得更多,我们的创收能力可能会降低 ,我们可能无法实施我们的业务战略,包括我们候选产品的成功商业化。
| 72 |
与我们的普通股相关的风险
我们普通股的市场价格可能会有很大波动。
我们普通股的市场价格可能波动较大,可能会受到以下因素的影响:
| ● | 本公司季度或年度经营业绩的实际或预期波动; |
| ● | 财务或业务估计或预测的变化 ; |
| ● | 一般的市场状况; |
| ● | 与我们类似的公司的经济表现或市场估值的变化 ;以及 |
| ● | 美国或其他地方的一般经济或政治状况。 |
特别是,像我们这样的生物技术公司的市场价格一直非常不稳定,原因包括但不限于 :
| ● | 任何延误或未能对我们的产品进行临床试验或获得FDA和其他监管机构的批准; |
| ● | 有关公司知识产权的事态发展或纠纷; |
| ● | 此类公司或其竞争对手的技术创新; |
| ● | 类似公司的市场估值变化 ; |
| ● | 此类公司或其竞争对手宣布重大合同、收购、战略伙伴关系、合资企业、资本承诺、新技术或专利;以及 |
| ● | 未能完成重大交易或与供应商合作生产产品。 |
证券市场不时经历与特定公司的经营业绩无关的重大价格和成交量波动。这些市场波动也可能对我们普通股的市场价格产生实质性的不利影响。
我们 预计在可预见的未来不会支付现金股息,因此投资者不应预期他们的投资会有现金股息。
我们的董事会不打算在可预见的未来支付现金股息,而是打算保留任何和所有收益 为业务增长提供资金。到目前为止,我们没有支付任何现金股息,也不能保证我们的普通股将永远支付现金股息 。
作为一家上市公司,我们 会产生巨大的成本并投入大量的管理时间,我们预计这些成本 将会增加。
作为一家上市公司,我们承担了大量的法律、会计和其他费用。例如,我们被要求遵守《萨班斯-奥克斯利法案》和《多德-弗兰克华尔街改革和消费者保护法案》的某些 要求,以及美国证券交易委员会随后实施的规则和条例 ,包括建立和维持有效的信息披露和财务控制,以及公司治理实践中的变化 。我们预计,遵守这些要求将增加我们的法律和财务合规成本 ,并将使某些活动更加耗时和成本高昂。此外,我们预计我们的管理层和其他人员将需要 将注意力从运营和其他业务事务上转移,以便将大量时间用于这些上市公司要求。 尤其是,我们预计将产生巨额费用,并投入大量管理工作以确保遵守《萨班斯-奥克斯利法案》第404条的要求 。我们目前没有内部审计职能,我们可能需要招聘或签约聘请具有适当上市公司经验和技术会计知识的额外会计和财务人员。
我们的内部控制的有效性可能存在限制,如果我们的控制系统不能防止错误或欺诈,可能会对我们的公司造成重大损害。
根据《萨班斯-奥克斯利法案》第404条,我们 必须由我们的管理层提交一份关于财务报告内部控制有效性的报告。这项评估将需要包括披露我们管理层在财务报告内部控制中发现的任何重大弱点。重大缺陷是指财务报告的内部控制存在缺陷或缺陷的组合,使得年度或中期合并财务报表的重大错报有合理的可能性无法及时防止或发现。
| 73 |
有效的财务报告内部控制对于我们提供可靠和及时的财务报告是必要的,并与适当的 披露控制和程序一起旨在合理地发现和防止欺诈。任何未能实施所需的新的或改进的控制措施,或在实施过程中遇到的困难,都可能导致我们无法履行我们的报告义务。未发现的材料 我们对财务报告的内部控制存在弱点,可能导致财务报表重述,并要求我们产生补救费用 。
此外, 我们预计财务报告的披露控制或内部控制不会阻止所有错误和所有欺诈。控制系统,无论设计和操作有多好,都只能提供合理的保证,而不是绝对的保证,以确保控制系统的目标能够实现。此外,控制系统的设计必须反映这样一个事实,即存在资源限制,并且必须考虑控制相对于其成本的好处。由于所有控制系统的固有局限性,任何对控制的评估都不能绝对保证所有控制问题和舞弊实例(如果有)都已被检测到。如果我们的控制系统未能检测或防止错误或欺诈,可能会对我们造成严重的负面影响。
如果发生上述任何情况,都可能对公众对我们公司的看法产生负面影响,这可能会对我们的股价产生负面影响。
我们 可能无法及时完成我们对财务报告的内部控制的分析,或者这些内部控制 可能无法确定为有效,这可能会对投资者对我们公司的信心产生不利影响,从而影响我们的 普通股的价值。
我们 可能无法完成对财务报告内部控制的评估和测试。在评估和测试过程中 如果我们在财务报告的内部控制中发现一个或多个重大弱点,我们将无法断言我们的内部控制有效。
如果我们无法断言我们对财务报告的内部控制是有效的,或者如果适用,我们的独立注册会计师事务所无法对我们的内部控制的有效性发表意见,我们可能会失去投资者对我们财务报告的准确性和完整性的信心 ,这将导致我们的普通股价格下跌,我们可能 受到美国证券交易委员会的调查或处罚。我们还将被要求每季度披露在内部控制和程序方面所做的更改。
特拉华州法律的反收购条款可能会使收购合并后的公司变得更加困难,并可能阻止合并后的公司股东试图更换或撤换合并后的公司管理层。
由于合并后的公司将在特拉华州注册成立,因此它受特拉华州通用公司法第203节或DGCL的条款管辖,该条款禁止持有已发行合并公司投票权股票超过15%的股东合并 或与合并后的公司合并。尽管我们相信这些条款将通过要求潜在收购者与合并后的公司董事会进行谈判,从而提供获得更高出价的机会,但如果某些股东可能认为要约是有益的,这些条款甚至可以适用。此外,这些规定可能会使股东更难更换负责任命管理层成员的董事会成员,从而挫败或阻止 合并后公司股东更换或撤换现有管理层的任何企图。
董事 和高级船员责任有限。
由于 特拉华州法律允许,我们的章程限制了董事因违反董事的受托责任而承担的金钱损害赔偿责任,但在某些情况下的责任除外。由于我们的章程条款和特拉华州法律,股东可能只有有限的权利 向违反受托责任的董事追偿。
| 74 |
一般风险因素
网络攻击 或电信或信息技术系统中的其他故障可能导致信息被盗、数据损坏和严重的业务运营中断。
我们 利用信息技术或IT、系统和网络来处理、传输和存储与我们的业务活动相关的电子信息。随着数字技术的使用越来越多,网络事件,包括蓄意攻击和企图未经授权进入计算机系统和网络,也增加了频率和复杂性。这些威胁对我们的系统和网络的安全、数据的保密性以及可用性和完整性构成了风险。
由于增发普通股、可转换证券、认股权证或期权,我们的普通股可能会进一步稀释。
过去,为了筹集资金,我们发行了普通股、可转换证券(如可转换票据)和权证。我们 还发行了普通股,作为对我们的员工、董事和某些供应商的服务补偿和激励性补偿。 我们保留了普通股,以便在行使其中某些证券时发行,并可能在未来增加为这些目的保留的股份 。我们增发普通股、可转换证券、期权和认股权证可能会影响我们股东的权利,可能会降低我们普通股的市场价格,或者可能导致对已发行认股权证的行权价格进行调整(导致这些证券可以行使更多的普通股 股票),或者可能迫使我们向某些股东发行额外的普通股。
有资格未来出售的股票 可能会对市场产生不利影响。
根据证券法颁布的第144条规则,我们的某些股东可能不时有资格通过普通经纪交易在公开市场上出售其全部或部分普通股,但受某些限制。总体而言,根据第144条,前三个月为非关联公司的股东可以在六个月后自由出售我们普通股的股票,但必须遵守当前的公开信息要求。关联公司可以在六个月后根据规则144的数量、销售方式、最新公开信息和通知要求出售我们普通股的股票。根据规则144出售我们的普通股,可能会对我们普通股的市场价格产生重大不利影响。
项目 1B。未解决的员工评论。
不适用 。
第 项2.属性。
该公司依赖短期办公使用合同来采购办公和会议空间。
第3项:法律诉讼。
我们 目前没有受到任何重大法律程序的影响。但是,我们可能会不时地成为我们正常业务过程中出现的各种法律程序的一方。
第 项4.矿山安全信息披露
不适用 。
| 75 |
第 第二部分
第 项5.注册人普通股市场、相关股东事项和发行人购买股权证券。
市场信息
该公司的普通股在纳斯达克资本市场上交易,代码为“SONN”。
持有者
截至2023年12月11日,我们共有76名普通股持有者。记录持有人的数量是根据转让代理的记录确定的,不包括普通股的受益所有人,其股票以各种证券经纪人、交易商和注册结算机构的名义持有。我们普通股的转让代理是证券转让公司,地址:达拉斯公园路北2901号,地址:380Suite380,Plano,TX 75093。
分红
我们 从未宣布或支付过普通股的现金股息。在可预见的未来,我们不打算宣布或支付普通股的现金股息 ,但目前打算保留任何未来的收益,为我们业务的发展和增长提供资金。 普通股支付现金股息(如果有的话)将完全由我们的董事会酌情决定,并将取决于我们的收益、资本要求、财务状况和其他相关因素。
第 项6.[已保留]
| 76 |
第 项7.管理层对财务状况和经营成果的讨论和分析
以下 管理层对财务状况和运营结果的讨论和分析(“MD&A”)旨在 帮助了解我们的财务状况和我们在本报告所述期间的历史运营结果。本MD&A应与本年度报告(Form 10-K)中包含的经审计的合并财务报表及其附注一并阅读。本MD&A可能包含涉及风险和不确定因素的前瞻性陈述。有关前瞻性陈述的讨论,请参阅上文“关于前瞻性陈述的特别说明”标题下的信息,该信息通过引用并入本文。
概述
十四行诗 BioTreateutics Holdings,Inc.(“十四行诗”,“我们”或“公司”), 是一家临床阶段、专注于肿瘤学的生物技术公司,拥有创新单一或双功能生物药物的专利平台。称为FHAB™(完全人血白蛋白结合),该技术利用完全人单链 抗体片段,其结合人血白蛋白并在人血白蛋白上“搭便车”以运输至靶组织。我们设计了 结构,以改善药物在特定组织中的积累,以及延长体内活性的持续时间。FHAB 发育候选物在哺乳动物细胞培养物中产生,其能够糖基化,从而降低免疫原性的风险。 我们相信我们的FHAB技术于二零二一年六月获得美国专利,是我们生物制药 平台的显著特色,非常适合未来在一系列人类疾病领域进行药物开发,包括肿瘤学、自身免疫性、致病性、 炎症和血液学疾病。
我们 目前的内部管道开发活动主要集中在细胞因子上,这是一类细胞信号肽,除其他重要功能外,还可用作强效免疫调节剂。特异性细胞因子既可独立发挥作用,也可协同发挥作用, 能够调节对抗癌症和病原体的免疫细胞的激活和成熟。然而,因为它们不优先 在特定组织中积累并从体内快速消除,所以用 细胞因子疗法实现治疗效果的常规方法通常需要高剂量和频繁剂量的施用。这可能导致治疗效果降低,伴随 全身毒性的可能性,这对这类药物的治疗应用提出了挑战。
我们的 主要专有资产SON-1010是一种完全人源化的白细胞介素12(“IL-12”),与FHAB 构建体,我们正在实体瘤适应症中进行临床开发,包括卵巢癌、非小细胞肺癌 和头颈癌。于2022年3月,FDA批准我们的SON-1010新药研究(“IND”)申请。 这使我们能够在 2022年第二季度在实体瘤患者中启动美国临床试验(SB 101)。于2021年9月,我们成立了一家全资拥有的澳大利亚附属公司SonnetBio Pty Ltd(“附属公司”),以进行若干临床试验。我们获得批准,并于2022年第三季度在健康 志愿者中启动了SON-1010的澳大利亚临床研究(SB 102)。SB 101和SB 102研究的中期安全性和耐受性数据于2023年4月报告 。
2023年1月,我们宣布与罗氏达成合作协议,对SON-1010与atezolizumab(Tecentriq®)进行临床评价。 两家公司已签署了一份临床试验和供应主协议(“MCSA”)以及辅助质量和安全性协议 ,以研究SON-1010和atezolizumab联合治疗铂类耐药卵巢癌(“PROC”)患者的安全性和有效性 。此外,两家公司将分别提供SON-1010和atezolizumab,用于1b期/2a期联合用药的安全性、剂量递增和疗效研究(SB 221)。本2部分研究的第1部分于2023年6月由澳大利亚当地人类研究伦理委员会 根据CT-2023-CTN-01399-1批准,并已通知治疗产品管理局。2023年8月,FDA接受了SB 221的IND。 该试验包括第1部分的改良3+3剂量递增设计,以确定SON-1010与 固定剂量atezolizumab的最大耐受剂量(MTD)。将在扩展组中确认PROC的临床获益,以确定推荐的II期剂量 (RP 2D)。然后,研究的第2部分将在随机比较中研究SON-1010单药治疗、其与atezolizumab联合使用或PROC的标准治疗 (SOC),以显示概念验证(POC)。
| 77 |
我们 于二零二零年四月透过收购Relief Therapeutics SA的流通股份,取得我们最先进的化合物SON-080(一种全人类版本的白细胞介素6(“IL-6”))的全球开发权。我们正在推进 SON-080在化疗诱导的周围神经病变(“CIPN”)和糖尿病周围神经病变 (“DPN”)目标适应症中的应用。我们获得批准,在CIPN中启动SON-080的美国以外1b/2a期研究。SB 211化疗诱导的周围神经病变(CIPN)研究的第一 部分入组工作即将完成,这将使 DSMB能够在2024年第一个日历季度完成对初步安全性数据的审查。根据我们于二零二一年五月与新加坡的New Life Therapeutics Pte,Ltd.(“New Life”)订立的许可协议,Sonnet及New Life将共同负责在DPN开发SON-080。目的是分析数据,并在评估CIPN安全性数据后考虑启动 II期研究。
SON-1210(IL12-F)HAB-IL 15),我们的领先双特异性构建体,结合FHAB与完全人IL-12和完全人白细胞介素 15(“IL-15”)。该化合物正在开发用于实体瘤适应症,包括结直肠癌。2023年2月,我们宣布成功完成了两项SON-1210在非人类灵长类动物中的IND毒理学研究。我们准备 启动SON-1210的监管授权流程,等待任何合作活动的结果。
SON-1410(IL18-F)HAB-IL12)是白细胞介素18(“IL-18”)和IL-12治疗实体瘤的双特异性组合。细胞系开发和工艺开发正在进行中,早期实验性药物供应适合配方和分析方法开发活动。经过2023年的一些延迟之后,活动将持续到2024年,有可能产生一种适合临床前研究和后续人体研究的药物。
我们 已完成SON-3015(抗IL6-F)的序列确认HAB-抗转化生长因子β)。已生产出早期双特效药物 ,并正在储存以备将来使用体内老鼠研究。出于降低费用的目的,我们已选择搁置SON-3015开发计划 。
作为正在进行的成本削减评估的一部分,SON-1010的所有抗病毒开发已暂停。
自成立以来,我们 发生了经常性的运营亏损和负现金流。我们能否产生足以实现盈利的产品或许可收入 将在很大程度上取决于我们当前或未来的一个或多个候选产品的成功开发和最终商业化。截至2023年9月30日和2022年9月30日的年度,我们的净亏损分别为1880万美元和2970万美元。截至2023年9月30日,我们拥有230万美元的现金。我们预计,至少在未来几年内,我们将继续产生巨额费用并 增加运营亏损。我们预计,与我们正在进行的活动相关的费用和资本需求将大幅增加 ,特别是当我们:
| ● | 为候选产品进行 个额外的临床试验; | |
| ● | 继续 发现和开发其他候选产品; | |
| ● | 获取 或许可其他候选产品和技术; | |
| ● | 维护, 扩大和保护我们的知识产权组合; | |
| ● | 雇用 增加临床、科学和商业人员; |
| 78 |
| ● | 建立 商业制造来源和安全的供应链能力,足以提供 我们可能获得监管批准的任何候选产品的商业数量; | |
| ● | 查找 成功完成临床试验的候选产品的监管批准; | |
| ● | 建立 销售、市场营销和分销基础架构,用于将 我们可能会获得监管批准;以及 | |
| ● | 添加 业务、财务和管理信息系统和人员,包括人事 以支持我们的产品开发和计划的未来商业化工作,以及 以支持我们作为一家公开报道公司的运作。 |
我们 不会从产品销售中获得收入(如果有),除非我们获得许可收入和/或成功完成临床 开发并获得候选产品的监管批准。如果我们的任何候选产品 获得监管部门的批准,但没有建立商业化合作伙伴关系,我们预计将产生与开发我们的内部商业化能力相关的大量费用, 以支持产品销售、营销和分销。我们将继续承担与作为上市公司运营 相关的重大成本。
因此,我们将需要大量的额外资金来支持我们的持续运营和实现我们的增长战略。在 我们能够从产品销售中获得可观收入之前(如果有的话),我们希望通过出售股权、 债务融资或其他资本来源(可能包括与其他公司合作或其他战略交易)为我们的运营提供资金。我们可能 无法筹集额外资金或在需要时以优惠条款订立此类其他协议或安排,或根本无法订立此类协议或安排。 如果我们未能在需要时筹集资金或签订此类协议,我们可能不得不大幅推迟、减少或取消 一个或多个候选产品的开发和商业化,或推迟我们寻求潜在的许可或收购。
由于 与产品开发相关的众多风险和不确定性,我们无法预测 费用增加的时间或金额,也无法预测我们何时或是否能够实现或保持盈利能力。即使我们能够产生产品销售,我们也可能 无法盈利。如果我们无法实现盈利,或无法在持续基础上保持盈利能力,或无法筹集额外资本 或签订合作或许可协议,则我们可能无法继续按计划水平运营,并被迫 减少或终止运营。
自 2015年成立以来,我们投入了大量的精力和财务资源来组织和配备公司人员, 业务规划,筹集资金,收购或发现候选产品并确保相关知识产权,以及 为候选产品进行发现,研究和开发活动。我们没有任何批准销售的产品, 也没有从产品销售中获得任何收入。迄今为止,我们的运营资金主要来自出售普通股、 认股权证和发行可转换债券的收益。
| 79 |
运营结果的组成部分
协作 收入
协作 收入目前来自于2021年5月与New Life签订的许可协议,该协议授予New Life 独家许可权(具有分许可权)开发和商业化含有特定重组人IL-6 SON-080的药物制剂(“化合物”)(此类制剂,“产品”)用于预防、治疗或缓解人类糖尿病周围神经病变(“DPN领域”)。我们确定了协议项下的以下义务 :(i)在专属区域内开发、销售、进口、使用和商业化产品的许可 (下称“许可”);以及(ii)转让专有技术和临床开发及监管活动(下称“研发活动”)。 我们确定,许可证和研发活动彼此并无区别,因此,将这些重大承诺 合并为一项履约义务。根据该协议,我们收到了总额为100万美元的预付现金付款,这些款项已完全 分配给单一履约义务,并在研发服务的估计履约期内确认。
运营费用
研究和开发费用
研究 和开发费用主要包括与发现和开发我们的候选产品有关的成本。 我们按实际发生的研究和开发成本支出,此类成本包括:
| ● | 与销售相关的 员工的开支,包括工资、基于股份的薪酬和相关福利 从事研究和开发工作; | |
| ● | 与我们候选产品的临床前和临床开发相关的费用 ,包括与第三方(如顾问和临床研究组织)达成的协议; | |
| ● | 生产用于我们的临床前研究和临床试验的药物产品的成本,包括与第三方(如顾问和合同制造组织)达成的协议; | |
| ● | 设施、 折旧和其他费用,包括租金和设施维护和保险的直接费用或分摊费用; | |
| ● | 与遵守法规要求有关的成本 ; | |
| ● | 根据第三方许可协议进行付款 。 |
我们 根据服务提供商提供的信息对完成特定任务的进度进行评估,从而确认外部开发成本。此流程包括审核未结合同和采购订单,与其人员沟通以确定已代表我们执行的服务,以及在我们尚未收到发票或以其他方式通知实际成本的情况下,估算执行的服务级别和为该服务产生的相关成本。未来收到的用于研发活动的货物或服务的预付款不可退还 记为预付费用。当货物已交付或服务已完成时,此类金额将确认为费用。
我们的直接研发费用主要包括外部成本,例如支付给外部顾问、CRO、CMO和研究实验室的费用,这些费用与临床前开发、流程开发、制造和临床开发活动有关。 我们的直接研发费用还包括根据第三方许可协议产生的费用。我们不会将员工成本和与发现工作、实验室用品和设施相关的成本(包括折旧或其他间接成本)分配给特定的候选产品,因为这些成本部署在多个计划中,因此没有单独分类。 我们主要使用内部资源进行研究和发现,以及管理临床前开发、流程开发、制造和临床开发活动。这些员工在多个计划中工作,因此,我们不按候选产品跟踪成本 。
| 80 |
我们 在可预见的未来将继续产生研发费用,因为我们试图推进我们的候选产品的开发 。我们的候选产品能否成功开发具有很大的不确定性。目前,由于与临床开发相关的许多风险和不确定性,包括以下方面的风险和不确定性,我们无法合理估计或 知道完成我们当前管道的剩余开发或我们可能开发的任何未来候选产品所需的工作的性质、时间和成本:
| ● | 临床前和临床开发活动的时间和进度; | |
| ● | 我们决定开展的临床前和临床项目的数量和范围; | |
| ● | 我们 有能力维持当前的研发计划并建立新的计划; | |
| ● | 通过研究性新药使能研究建立适当的安全概况; | |
| ● | 成功的 患者登记,并启动和完成临床试验; | |
| ● | 成功完成临床试验,其安全性、耐受性和疗效状况令FDA或任何类似的外国监管机构满意; | |
| ● | 收到适用监管机构的监管批准; | |
| ● | 来自适用监管机构的任何上市批准的时间、接收和条款; | |
| ● | 我们 能够建立新的许可或协作安排; | |
| ● | 与第三方制造商建立 协议,为我们的临床试验和商业生产(如果我们的任何候选产品获得批准)提供临床供应; | |
| ● | 开发并及时交付可用于我们的临床试验和商业投放的临床级和商业级药物配方; | |
| ● | 取得、维护、捍卫和执行专利权利要求和其他知识产权; | |
| ● | 启动 候选产品的商业销售(如果获得批准),无论是单独还是与其他合作 ; | |
| ● | 在批准后,保持候选产品的持续可接受的安全概况;以及 | |
| ● | 新冠肺炎对运营的潜在影响,可能会影响临床试验的时间、原材料的可用性以及访问和保护检测设施的能力 。 |
| 81 |
对于我们的候选产品的开发,这些变量中的任何一个的结果发生变化都可能显著改变与该候选产品的开发相关的成本和时间安排。我们的任何候选产品可能永远无法获得监管部门的批准 。
一般费用 和管理费用
一般费用和行政费用主要包括行政、财务和行政职能人员的薪金和相关费用,包括按股份计算的薪酬。一般和行政费用还包括直接和分摊的设施相关成本,如 以及法律、专利、咨询、会计和审计服务的专业费用。
随着我们增加员工人数以支持持续的研究活动和候选产品的开发,我们的 一般和管理费用未来将会增加。我们将继续产生更多与上市公司相关的会计、审计、法律、监管、合规和董事 和高管保险成本,以及投资者和公关费用。
外汇损失
外汇损失包括以美元以外货币计价的交易的汇率变动。
运营结果
2023年和2022年9月30日终了年度比较
下表汇总了截至2023年9月30日和2022年9月30日的年度运营结果:
| 截至9月30日止年度, | ||||||||||||
| 2023 | 2022 | 变化 | ||||||||||
| 协作收入 | $ | 147,805 | $ | 349,943 | $ | (202,138 | ) | |||||
| 运营费用: | ||||||||||||
| 研发 | 11,814,690 | 21,444,019 | $ | (9,629,329 | ) | |||||||
| 一般和行政 | 7,125,732 | 8,575,283 | (1,449,551 | ) | ||||||||
| 总运营费用 | 18,940,422 | 30,019,302 | (11,078,880 | ) | ||||||||
| 运营亏损 | (18,8792,617 | ) | (29,669,359 | ) | 10,876,742 | |||||||
| 汇兑损失 | (40,077 | ) | (52,482 | ) | 12,405 | |||||||
| 净亏损 | $ | (18,832,694 | ) | $ | (29,721,841 | ) | $ | 10,889,147 | ||||
协作 收入
我们 在截至2023年9月30日的年度内确认了与新生活协议相关的收入10万美元,而截至2022年9月30日的年度内为30万美元。减少20万美元是由于延迟提供研发服务。
| 82 |
研究和开发费用
截至2023年9月30日止年度的研究和开发费用为1180万美元,而截至2022年9月30日止年度为2140万美元。减少960万美元的主要原因是通过将产品开发活动 转移到印度和澳大利亚等成本较低的地区,通过减少三级项目(如SON-3015)的支出(该项目已被搁置开发),以及暂停与SON-1010相关的抗病毒药物开发,以及基于股票的薪酬 费用的减少。
一般费用 和管理费用
截至2023年9月30日止年度的一般及行政开支为710万美元,而截至2022年9月30日止年度为860万美元。150万美元的减少主要与基于股份的薪酬、法律和业务开发费用的减少有关, 因为我们正在出于流动性目的管理费用,并正在加紧关注我们评估 具有最大近期潜力的研发项目。
流动性 与资本资源
我们 迄今为止主要通过出售普通股、认股权证和发行可转换债券的收益为运营提供资金。如果我们认为需要此类融资计划来推进我们的业务计划,并且符合我们股东的最佳利益,我们可能会根据市场状况或其他情况提供额外的证券供销售。无法确定 将来是否会提供股权或债务融资,也无法确定其条款是否可以接受,目前无法 预测这些事项的结果。
我们 截至2023年和2022年9月30日止年度分别产生净亏损1880万美元和2970万美元。我们预计 在未来12个月及以后将继续产生大量运营费用和净亏损。我们的净亏损 可能会在季度和年度之间大幅波动,这取决于我们的研发研究和相关支出的阶段和复杂性, 我们技术许可的额外付款(如果有),以及我们可能进入的任何当前或未来 合作下的付款。
我们 已评估是否存在对我们 继续作为持续经营的能力产生重大疑问的情况或事件(总体考虑)。我们相信,我们在2023年9月30日的现金,以及 我们在2023年10月24日公开发行普通股和认股权证收到的410万美元净收益,将为我们预计到2024年3月的运营提供资金。我们还预计将从澳大利亚的研发税收激励计划中获得 80万美元的净现金返还(见合并财务报表附注2),并于最近获得初步批准,我们申请通过技术营业税证书转让计划出售高达480万美元的新泽西州净经营亏损,视乎有关出售的执行情况而定(见综合 财务报表附注10)。我们将需要大量 额外融资来为我们的运营提供资金。这些因素对我们继续 持续经营的能力提出了重大质疑。
下表 总结了我们在每个所列期间的现金来源和使用情况:
| 截至九月三十日止年度, | ||||||||
| 2023 | 2022 | |||||||
| 用于经营活动的现金净额 | $ | (21,341,842 | ) | $ | (27,773,528 | ) | ||
| 用于投资活动的现金净额 | (443,250 | ) | (810,227 | ) | ||||
| 融资活动提供的现金净额 | 21,006,472 | 4,014,567 | ||||||
| 现金净减少 | $ | (778,620 | ) | $ | (24,569,188 | ) | ||
| 83 |
操作 活动
在截至2023年9月30日的 年度,我们在经营活动中使用了2130万美元的现金,这主要归因于我们的净 亏损1880万美元,预付费用和其他资产净增加50万美元,主要是由于研究和 开发活动的现金流出,应付账款和应计费用净减少240万美元,主要是由于研究和开发费用减少,被收购的正在进行的研究和开发费用30万美元和基于股票的薪酬费用20万美元所抵消。
在截至2022年9月30日的 年度,我们在经营活动中使用了2780万美元的现金,这主要归因于我们的净 亏损2970万美元。这一金额被90万美元的股份薪酬费用和100万美元的收购过程中 研究和开发费用以及10万美元的运营资产和负债净减少所抵消。
投资 活动
在截至2023年9月30日的年度内,我们在投资活动中使用了40万美元现金,用于购买收购的正在进行的研究和开发 。
在截至2022年9月30日的年度内,我们在投资活动中使用了80万美元现金,用于购买收购的正在进行的研究和开发 。
为 活动提供资金
在截至2023年9月30日的年度内,融资活动提供的现金净额为2,100万美元,主要包括在市场融资机制下出售普通股以及通过包销的公开发行和登记直接发行所得的净收益。
在截至2022年9月30日的年度内,融资活动提供的现金净额为400万美元,主要包括出售优先股和认股权证的净收益以及出售普通股的净收益。
资金需求
我们 预计将继续产生与我们正在进行的活动相关的巨额费用,特别是在我们推进临床前活动和正在开发的候选产品的临床试验的情况下。此外,我们预计将继续产生与上市公司运营 相关的成本。我们的营运开支的时间和数额将主要视乎:
| ● | 我们当前或未来候选产品的 范围、数量、启动、进度、时间、成本、设计、持续时间、任何潜在延迟、 临床试验和非临床研究的结果 ; | |
| ● | 我们为这些候选产品制定的 临床开发计划; | |
| ● | 我们开发或可能获得许可的候选产品和程序的数量和特征; |
| 84 |
| ● | 监管审查、批准或其他行动的结果、时间和成本,以满足FDA和类似的外国监管机构建立的监管要求,包括 FDA或类似的外国监管机构可能要求我们 对我们的候选产品进行比我们目前预期的更多的研究; | |
| ● | 我们 获得候选产品上市批准的能力; | |
| ● | 申请、起诉、辩护和执行专利主张和涵盖我们候选产品的其他知识产权的 成本; | |
| ● | 我们 维护、扩展和捍卫我们的知识产权组合范围的能力,包括为知识产权纠纷辩护的成本,包括第三方对我们或我们的候选产品提起的专利侵权诉讼 ; | |
| ● | 与候选产品有关的商业规模外包制造活动的 成本和完成时间; | |
| ● | 我们 以优惠条款建立和维护许可、协作或类似安排的能力,以及我们是否以及在多大程度上根据任何新的许可、协作或类似安排保留开发或商业化责任 ; | |
| ● | 为我们选择自行商业化产品的地区获得监管批准的任何候选产品建立销售、营销和分销能力的 成本 ; | |
| ● | 我们收购或投资的任何其他业务、产品或技术的成功; | |
| ● | 收购、许可或投资企业、候选产品和技术的成本; | |
| ● | 我们需要和有能力聘请更多的管理人员以及科学和医疗人员; | |
| ● | 在美国作为上市公司运营的 成本,包括为我们的业务实施额外的财务和报告系统以及其他内部系统和基础设施的需要 ; | |
| ● | 市场接受我们的候选产品,只要任何产品被批准用于商业销售; | |
| ● | 竞争的技术和市场发展的影响;以及 | |
| ● | 新冠肺炎疫情对我们的临床试验和运营的潜在影响。 |
在 我们能够产生可观的产品收入之前,我们预计将通过股权发行、债务融资、合作、战略联盟以及与第三方的营销、分销或许可安排的组合来满足我们的现金需求。 如果我们通过出售股权或可转换债务证券筹集额外资本,我们的所有权权益可能会被大幅稀释,此类证券的条款可能包括清算或其他对我们股东权利产生不利影响的优惠。债务融资和优先股权融资(如果可用)可能涉及包括限制性 契约的协议,这些契约限制我们采取特定行动的能力,例如招致额外债务、进行资本支出或宣布 股息。如果我们通过与第三方合作、战略联盟或营销、分销或许可安排来筹集资金,我们可能不得不放弃对技术、未来收入流、研究计划或候选产品的宝贵权利,或者 以可能对我们不利的条款授予许可证。如果我们无法在需要时通过股权或债务融资或其他安排筹集更多资金,我们可能需要推迟、减少或取消产品开发或未来的商业化努力, 出售资产,或授予开发和营销我们原本更愿意开发和营销的候选产品的权利。
| 85 |
2023年2月提供
2023年2月10日,我们通过Chardan Capital Markets,LLC和EF Hutton,Benchmark Investments LLC的部门作为承销商,完成了普通股和某些认股权证的公开发行,通过发行和出售530,222股普通股,向某些投资者发行和出售预资金权证,获得1360万美元的净收益,购买101,090股普通股,以及随附的普通权证,购买最多1,262,618股普通股(“2月发售”)。每股普通股和购买一股普通股的预融资权证与购买两股普通股的普通权证一起出售。普通股和配套普通权证的公开发行价为每股23.76美元,每份预筹资权证和配套普通权证的公开发行价为23.7578美元。普通权证可立即以每股普通股23.76美元的价格行使,自发行之日起满五年,并载有替代的无现金行使条款 ,根据该条款,在符合某些条件的情况下,可在普通股的无现金交易中以每股普通股0.5股的费率行使认股权证,否则可通过现金行使。预先出资的认股权证可在任何时间立即行使,直至全部行使为止,价格为每股普通股0.0022美元。此外,向承销商发行了购买44,190股普通股的认股权证,作为对承销商与此次发行相关服务的补偿。这些普通股认股权证 的行使价为每股29.70美元,自发行之日起五年到期。
2023年6月产品
2023年6月30日,我们通过Chardan Capital Markets LLC作为配售代理完成了登记直接发售普通股(以及普通股等价物)和同时私募若干普通股认股权证,通过发行和出售166,363股我们的普通股以及向某些投资者发行购买60,909股普通股的预融资权证和随附的认股权证以购买最多227,272股我们的普通股 (“六月发售”),获得190万美元的净收益。每股普通股和购买一股普通股的预融资权证与购买一股普通股的普通权证一起出售。每股普通股及配套普通权证的公开发行价为9.90美元。普通股认股权证从2023年12月30日起以普通股每股14.8478美元的价格行使,自发行之日起三年半到期,并包含替代的无现金行使条款。预先出资的认股权证可随时立即行使,直至全部行使为止,价格为每股普通股0.0022美元。此外,向配售代理发行了购买6,818股普通股的认股权证,作为对其与发行相关服务的补偿。 这些普通股认股权证的行使价为每股14.8478美元,自发行之日起三年半到期。
| 86 |
2023年10月提供服务
2023年10月26日,我们通过Chardan Capital Markets、LLC和Ldenburg Thalmann&Co.Inc.作为承销商完成了普通股和某些认股权证的公开发行,通过发行和出售1,306,250股普通股获得净收益410万美元,并向某些投资者发行了购买1,537,500股普通股的预资金权证,以及 购买最多5,687,500股普通股的配套普通权证(“十月发售”)。每股普通股 和购买一股普通股的预付资金权证与购买两股普通股的普通权证一起出售。每股普通股及附带普通权证的公开发行价为1.6美元,每份预筹资权证及附带普通权证的公开发行价为1.5999美元。普通权证可立即按普通股每股1.6美元的价格行使,自发行之日起满五年,并包含替代的无现金行使条款。 预先出资的权证可随时立即行使,直至全部行使,普通股价格为每股0.0001美元。 此外,还向承销商发行了购买85,312股普通股的权证,作为对承销商提供的与发行相关的服务的补偿。这些普通股认股权证的行权价为每股2.00美元,自发行之日起5年内到期。
在市场上发行普通股
我们 于2022年8月15日与BTIG,LLC(“BTIG”)订立市场销售协议(“2022年销售协议”)。 根据2022年销售协议,我们可不时透过BTIG作为销售代理及/或委托人发售及出售我们普通股的股份 ,总发行价最高可达2,500万美元,但须受2022年销售协议对我们可提供及出售的普通股 金额的若干限制所规限。由于适用于我们的发售限制,我们 根据2022年销售协议 为出售我们普通股的股份提交了招股说明书补充资料,总发行价高达780万美元。在截至2023年9月30日的年度内,我们根据与BTIG的2022年销售协议,出售了总计136,701股普通股,总收益为580万美元,净收益为540万美元。截至2023年9月30日, 根据《2022年销售协议》,已无登记股份待售。
合同义务和承诺
下表汇总了截至2023年9月30日我们的合同义务,以及此类义务预计将对我们未来的流动性和现金流产生的影响:
| 不到1年 | 1至3年 | 4至5年 | 5年以上 | 总计 | ||||||||||||||||
| 经营租赁(1) | $ | 93,614 | $ | 143,703 | $ | — | $ | — | $ | 237,317 | ||||||||||
| 总计 | $ | 93,614 | $ | 143,703 | $ | — | $ | — | $ | 237,317 | ||||||||||
(1) 反映了我们在新泽西州普林斯顿的办公室租约规定的义务。
除了我们在上表中反映的具有付款承诺的合同外,我们还在 正常业务过程中与某些CRO、CMO和其他第三方就临床前研究和测试、临床 试验和制造服务签订了其他合同。这些合同不包含任何最低采购承诺,可在事先通知后取消 ,因此不包括在上述合同义务和承诺表中。取消时应支付的款项仅包括所提供服务的付款和所发生的费用,包括对我们的服务提供商的不可取消义务,直至取消日期。
| 87 |
关键会计政策和估算
我们管理层对财务状况和运营结果的讨论和分析基于我们的合并财务报表, 该报表是根据美国公认会计准则编制的。在编制这些合并财务报表时,我们需要做出影响资产、负债和费用报告金额以及或有资产和负债在财务报表中的披露的估计和判断。我们会持续评估我们的估计和判断,包括与研发费用应计相关的估计和判断。我们的估计基于历史经验、已知趋势和事件以及各种被认为在当时情况下是合理的其他因素,这些因素的结果构成了对资产和负债的账面价值作出判断的基础,而这些资产和负债的账面价值从其他来源看起来并不是很明显。在不同的假设或条件下,实际结果可能与这些 估计值不同。
虽然我们的主要会计政策在本10-K表格中其他地方包括的综合财务报表附注中有更详细的描述,但我们认为以下会计政策对编制综合财务报表所使用的判断和估计最为关键。
研究和开发费用
研究和开发费用包括与我们的生物制药产品开发相关的所有直接和间接成本。这些 费用包括人员成本、咨询费以及向第三方支付的研发和制造服务费用。 这些成本在发生时计入费用。
在每个报告期结束时,我们会根据合同中定义的进度衡量标准,将向第三方服务提供商支付的款项与相关项目完成的估计进度进行比较。我们在编制评估时考虑的因素包括: 服务提供商产生的成本、实现的里程碑以及与我们的服务提供商的努力相关的其他标准。随着获得更多信息,此类 估计值可能会发生变化。根据向第三方服务提供商付款的时间 以及我们估计所提供服务取得的进展,我们将记录与这些成本相关的预付费用或应计负债。或有发展或监管里程碑付款在此类或有事项的相关解决方案 中确认。截至2023年9月30日,我们没有对应计研究和开发费用的先前估计进行任何实质性调整。
最近 发布了会计公告
最近发布的可能影响我们财务状况和经营结果的会计声明的说明 在本表格10-K其他部分包括的合并财务报表的附注2中披露。
第 7A项。关于市场风险的定性和定量披露。
不适用 。
| 88 |
第 项财务报表和补充数据
十四行诗 生物治疗控股公司
合并财务报表索引
| 页面 | |
| 独立注册会计师事务所报告(毕马威,LLP,费城,宾夕法尼亚州,审计师事务所ID: |
90 |
| 合并资产负债表 | 91 |
| 合并业务报表 | 92 |
| 合并股东权益变动表(亏损) | 93 |
| 合并现金流量表 | 94 |
| 合并财务报表附注 | 95 |
| 89 |
独立注册会计师事务所报告
致股东和董事会 Sonnet BioTreeutics Holdings,Inc.
关于合并财务报表的意见
我们已审计了所附的Sonnet BioTreateutics Holdings,Inc.及其子公司(本公司)截至2023年9月30日、2023年9月和2022年9月30日的合并资产负债表、截至2023年9月30日和2022年9月30日的相关合并经营报表、截至2023年9月30日的股东赤字变化和现金流量以及相关的 附注(统称为合并财务报表)。我们认为,合并财务报表公平地反映了公司截至2023年9月30日、2023年9月和2022年9月30日的财务状况,以及截至2023年9月30日和2022年9月30日的经营业绩和现金流量。符合美国公认的会计原则。
正在进行 关注
随附的综合财务报表已于 编制时假设本公司将继续作为持续经营企业。正如综合财务报表附注1所述,本公司自成立以来已出现经常性亏损及营运现金流为负的情况,并将需要大量额外的 融资以继续为其研发活动提供资金,这令人对其作为持续经营企业的能力产生重大怀疑。附注1也说明了管理层在这些事项上的计划。合并财务报表 不包括可能因这种不确定性的结果而产生的任何调整。
征求意见的依据
这些合并财务报表由公司管理层负责。我们的责任是根据我们的 审计对这些合并财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们按照PCAOB的标准进行审核。这些标准要求我们计划和执行审计,以获得关于合并财务报表是否没有重大错报的合理保证,无论是由于错误还是欺诈。本公司不需要,也没有聘请 对其财务报告的内部控制进行审计。作为我们审计的一部分,我们需要了解财务报告的内部控制,但不是为了对公司财务报告内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的审计包括执行评估合并财务报表重大错报的风险的程序 ,无论是由于错误还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试的基础上审查关于合并财务报表中的金额和披露的证据。我们的审计还包括评估管理层使用的会计原则和作出的重大估计,以及评估合并财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的 基础。
| 90 |
重大审计事项
下文所述的关键审计事项是指已向审计委员会传达或要求传达给审计委员会的、因本期对合并财务报表进行审计而产生的事项,并且:(1)涉及对综合财务报表具有重大意义的账目或披露,以及(2)涉及我们特别具有挑战性的、主观或复杂的判断。关键审计事项的传达不会以任何方式改变我们对综合财务报表的整体意见,我们不会通过传达下面的关键审计事项来提供对关键审计事项或与之相关的账目或披露的单独意见。
预付 研发费用和应计研发费用
如综合财务报表附注2及附注3所述,研究及发展成本于产生时计提,包括应付第三方的研究、发展及制造服务费用。在每个报告期结束时,公司根据合同规定的进度衡量标准,将向第三方服务提供商支付的款项与相关项目完成的估计进度进行比较。公司在编制估算时考虑的因素包括服务提供商产生的成本、实现的里程碑以及与其服务提供商的努力相关的其他标准。根据向第三方服务提供商付款的时间和公司估计所提供的服务取得的进展,公司将记录与这些成本相关的预付费用或应计负债 。截至2023年9月30日,该公司报告的预付费用和其他流动资产为170万美元,其中一部分与这些成本有关,应计研发费用为90万美元。
我们将评估第三方服务提供商的某些预付和应计研发费用确定为一项重要的审计事项。评估完成研发项目的估计进度,包括上述因素,尤其需要审计师的主观判断。
以下是我们为解决这一关键审计问题而执行的主要程序。为了评估公司对截至2023年9月30日发生的费用的估计,对于选定的预付和应计研发费用,我们(1)检查了从第三方服务提供商收到的合同、发票和通信 中与项目状态有关的条款;(2)向第三方服务提供商发送了确认书; 和(3)询问了负责监测和跟踪研发活动状况的个人
/s/
自2015年以来,我们一直担任本公司的审计师。
2023年12月14日
| 91 |
十四行诗 生物治疗控股公司
合并资产负债表
| 9月30日, | ||||||||
| 2023 | 2022 | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金和现金等价物 | $ | $ | ||||||
| 预付费用和其他流动资产 | ||||||||
| 激励性应收税款 | ||||||||
| 流动资产总额 | ||||||||
| 财产和设备,净额 | ||||||||
| 经营性租赁使用权资产 | ||||||||
| 递延发售成本 | ||||||||
| 其他资产 | ||||||||
| 总资产 | $ | $ | ||||||
| 负债和股东赤字 | ||||||||
| 流动负债: | ||||||||
| 关联方票据 | $ | $ | ||||||
| 应付帐款 | ||||||||
| 应计费用和其他流动负债 | ||||||||
| 经营租赁负债的当期部分 | ||||||||
| 递延收入 | ||||||||
| 流动负债总额 | ||||||||
| 经营租赁负债,扣除当期部分 | ||||||||
| 总负债 | ||||||||
| 承付款和或有事项(附注4) | ||||||||
| 股东赤字: | ||||||||
| 普通股,$面值:授权股份;和分别于2023年9月30日及2022年9月30日发行及未偿还 | ||||||||
| 额外实收资本 | ||||||||
| 累计赤字 | ( | ) | ( | ) | ||||
| 股东总亏损额 | ( | ) | ( | ) | ||||
| 总负债和股东赤字 | $ | $ | ||||||
见 合并财务报表附注
| 92 |
十四行诗 生物治疗控股公司
合并的操作报表
| 截至9月30日止年度, | ||||||||
| 2023 | 2022 | |||||||
| 协作收入 | $ | $ | ||||||
| 运营费用: | ||||||||
| 研发 | ||||||||
| 一般和行政 | ||||||||
| 总运营费用 | ||||||||
| 运营亏损 | ( | ) | ( | ) | ||||
| 汇兑损失 | ( | ) | ( | ) | ||||
| 净亏损 | $ | ( | ) | $ | ( | ) | ||
| 每股信息: | ||||||||
| 每股基本和稀释后净亏损 | $ | ) | $ | ) | ||||
| 加权平均流通股、基本股和稀释股 | $ | $ | ||||||
见 合并财务报表附注
| 93 |
十四行诗 生物治疗控股公司
合并 股东权益变动表(亏损)
| 优先股 | 普通股 | 额外实收 | 累计 | |||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 资本 | 赤字 | 总计 | ||||||||||||||||||||||
| 2021年10月1日的余额 | $ | $ | $ | $ | ( | ) | $ | |||||||||||||||||||||
| 出售优先股和普通股认股权证,扣除发行成本 | ||||||||||||||||||||||||||||
| 将优先股转换为普通股 | ( | ) | ( | ) | ||||||||||||||||||||||||
| 出售普通股,扣除发行成本 | ||||||||||||||||||||||||||||
| 限制性股票单位归属时发行普通股 | ||||||||||||||||||||||||||||
| 基于股份的薪酬 | — | — | ||||||||||||||||||||||||||
| 净亏损 | — | — | ( | ) | ( | ) | ||||||||||||||||||||||
| 2022年9月30日的余额 | ( | ) | ( | ) | ||||||||||||||||||||||||
| 出售普通股,扣除发行成本 | ||||||||||||||||||||||||||||
| 认股权证净股份结算 | ( | ) | ||||||||||||||||||||||||||
| 限制性股票单位归属时发行普通股 | ( | ) | ||||||||||||||||||||||||||
| 认股权证的行使 | ||||||||||||||||||||||||||||
| 基于股份的薪酬 | — | — | ||||||||||||||||||||||||||
| 净亏损 | — | — | ( | ) | ( | ) | ||||||||||||||||||||||
| 2023年9月30日的余额 | $ | $ | $ | $ | ( | ) | $ | ( | ) | |||||||||||||||||||
见 合并财务报表附注
| 94 |
十四行诗 生物治疗控股公司
合并的现金流量表
| 截至9月30日止年度, | ||||||||
| 2023 | 2022 | |||||||
| 经营活动的现金流: | ||||||||
| 净亏损 | $ | ( | ) | $ | ( | ) | ||
| 对净亏损与经营活动中使用的现金净额进行的调整: | ||||||||
| 收购正在进行的研究和开发 | ||||||||
| 折旧 | ||||||||
| 经营性租赁使用权资产摊销 | ||||||||
| 基于股份的薪酬 | ||||||||
| 经营性资产和负债变动情况: | ||||||||
| 预付费用和其他流动资产 | ( | ) | ( | ) | ||||
| 应收所得税 | ( | ) | ( | ) | ||||
| 其他资产 | ( | ) | ||||||
| 应付帐款 | ( | ) | ||||||
| 应计费用和其他流动负债 | ||||||||
| 经营租赁负债 | ( | ) | ( | ) | ||||
| 递延收入 | ( | ) | ( | ) | ||||
| 用于经营活动的现金净额 | ( | ) | ( | ) | ||||
| 投资活动产生的现金流: | ||||||||
| 购买正在进行的研究和开发 | ( | ) | ( | ) | ||||
| 用于投资活动的现金净额 | ( | ) | ( | ) | ||||
| 融资活动的现金流: | ||||||||
| 出售优先股和普通股认股权证所得款项,扣除发行成本 | ||||||||
| 出售普通股所得收益,扣除发行成本 | ||||||||
| 行使认股权证所得收益,扣除发行成本 | ||||||||
| 偿还关联方票据 | ( | ) | ||||||
| 融资活动提供的现金净额 | ||||||||
| 现金净减少 | ( | ) | ( | ) | ||||
| 现金,年初 | ||||||||
| 年终现金 | $ | $ | ||||||
| 补充披露非现金经营、投资和融资活动: | ||||||||
| 因修改租赁而引起的经营租赁使用权资产和负债的变化 | $ | $ | ||||||
| 从出售普通股所得款项中扣除的递延发行成本 | $ | $ | ||||||
| 应付账款和应计费用中的递延发售成本 | $ | $ | ||||||
| 认股权证的净结算额 | $ | $ | ||||||
| 应计费用中的正在进行的研究和开发 | $ | $ | ||||||
| 应付账款和应计费用中的普通股发行成本 | $ | $ | ||||||
见 合并财务报表附注
| 95 |
十四行诗 生物治疗控股公司
合并财务报表附注
1. 业务的组织和描述
业务说明
十四行诗 生物治疗公司(“之前的十四行诗”)于2015年4月6日注册为新泽西州的一家公司。Pre Sonnet于2020年4月1日完成了与公开持股的强啼克利尔控股公司(“强啼克利尔”)的合并。合并后,强啼克利尔更名为Sonnet BioTreateutics Holdings,Inc.(“Sonnet”或“公司”)。十四行诗是一家临床阶段、专注于肿瘤学的生物技术公司,拥有创新单一或双功能生物药物的专有平台。称为FHAB™ (完全人白蛋白结合),该技术利用完全人类单链抗体片段(ScFv)与人血清白蛋白(“hSA”)结合并在其上“搭便车” ,从而将其输送到靶组织。
十四行诗的主要专有资产SON-1010是白介素12(IL-12)的完全人类版本,共价链接到FHAB 结构,Sonnet正在寻求实体肿瘤适应症的临床开发,包括卵巢癌、非小细胞肺癌和头颈癌。2022年3月,FDA批准了Sonnet用于SON-1010的研究新药(IND)申请 。这使得该公司能够在2022年第二个日历季度启动一项针对实体肿瘤肿瘤学患者的美国临床试验(SB101)。2021年9月,公司成立了一家全资拥有的澳大利亚子公司SonnetBio Pty Ltd(“子公司”), 用于进行某些临床试验。十四行诗获得批准,并在2022年第三季度启动了一项针对健康志愿者的澳大利亚临床研究(SB102)。SB101和SB102研究的临时安全性和耐受性数据于2023年4月报告。
2023年1月,Sonnet宣布与罗氏就SON-1010与泰唑珠单抗(Tecentriq®)的临床评估达成合作协议。 两家公司已签订主临床试验和供应协议,以及辅助质量和安全 协议,以研究SON-1010和阿替唑单抗在铂耐药卵巢癌(“PROC”)患者环境中的安全性和有效性。此外,两家公司将分别提供SON-1010和阿特唑珠单抗,用于1b期/2a期安全性、剂量递增和疗效研究(SB221)。这项由两部分组成的研究的第一部分于2023年6月由澳大利亚当地人类研究伦理委员会根据CT-2023-CTN-01399-1批准,并已通知治疗用品管理局。2023年8月,FDA接受了SB221的IND。该试验包括第1部分中修改的3+3剂量递增设计,以确定具有固定剂量的阿替唑单抗的SON-1010的最大耐受剂量(MTD)。PROC的临床益处将在一个扩展组中得到确认,以确定推荐的第二阶段剂量(RP2D)。研究的第二部分随后将通过随机比较研究SON-1010单一疗法、其与阿替唑单抗的联合使用,或PROC的护理标准(SOC),以显示概念验证(POC)。
作为正在进行的成本削减评估的一部分,所有SON-1010的抗病毒开发都已暂停。
该公司于2020年4月通过收购Relipment Treeutics SA的已发行股份,获得了其最先进的化合物SON-080的全球开发权,SON-080是白介素6(IL-6)的完全人类版本。十四行诗正在推进SON-080治疗化疗引起的周围神经病变(CIPN)和糖尿病周围神经病变(DPN)的目标适应症。十四行诗获准在2022年第三季度与CIPN的SON-080一起启动前美国1b/2a阶段研究。监督这项研究的数据安全监测委员会预计将在2024年第一个日历季度召开会议。在完成DSMB审查后,Sonnet预计将公布CIPN研究的初步安全数据 。根据公司于2021年5月与新加坡新生命治疗私人有限公司(“新生命”) 签订的许可协议,十四行诗和新生命将共同负责在DPN中开发SON-080。目标将是分析数据,并考虑在评估CIPN安全数据后启动第二阶段研究。
SON-1210(IL12-F)HAB-IL15),十四行诗的主要双特定构建体,结合了FHAB含有全人IL-12和全人白介素15(“IL-15”)。这种化合物正在开发用于实体肿瘤的适应症,包括结直肠癌。2023年2月,该公司宣布成功完成了两项使用SON-1210对非人类灵长类动物进行的IND毒理学研究。十四行诗 准备启动SON-1210的监管授权流程,等待任何合作活动的结果。
| 96 |
十四行诗 生物治疗控股公司
合并财务报表附注
SON-1410(IL18-F)HAB-IL12)是白细胞介素18(“IL-18”)和IL-12治疗实体瘤的双特异性组合。细胞系开发和工艺开发正在进行中,早期实验性药物供应适合配方和分析方法开发活动。经过2023年的一些延迟之后,活动将持续到2024年,有可能产生一种适合临床前研究和后续人体研究的药物。
公司已完成SON-3015(抗IL6-F)序列确认HAB-抗转化生长因子β)。已生成早期双特效药物 ,并正在储存以备将来使用体内老鼠研究。十四行诗已选择搁置SON-3015开发 计划以降低费用。
流动性
自成立以来,该公司因运营而出现经常性亏损和负现金流,预计在可预见的未来,主要由于其潜在产品候选产品的研发成本,运营将产生亏损。公司
相信其现金为$
2023年10月26日,公司通过Chardan Capital Markets,LLC和Ladenburg Thalmann & Co. Inc完成了普通股和某些认股权证的公开发行。作为承销商,净收益为
公司计划在未来通过股权或债务融资、合作伙伴关系、合作或其他来源 获得额外资本,以开展公司计划的开发活动。如果在需要时无法获得额外资本,则公司可能 需要延迟或缩减其运营,直到收到此类资金。各种内部和外部因素将影响公司的候选产品是否以及 何时被批准上市和成功商业化。公司候选产品的监管批准和 市场接受度、开发和商业化这些候选产品的时间长度和成本 和/或在批准过程的任何阶段的失败将对公司的财务状况 和未来运营产生重大影响。
自成立以来, 的运营主要包括组织公司、获得融资、通过研究和 开发开发技术以及进行临床前研究。本公司面临与其产品正在开发中的公司相关的风险。 这些风险包括需要额外的资金来完成其研究和开发、实现其研究和开发 目标、维护其知识产权、招聘和留住熟练人员以及依赖 管理层的关键成员。
| 97 |
十四行诗 生物治疗控股公司
合并财务报表附注
2. 重要会计政策摘要
a. 陈述的基础
随附的合并财务报表已按照美国公认会计原则(“美国会计准则”)编制。 GAAP”)。这些注释中对适用指南的任何引用均指财务会计准则委员会(“FASB”)颁布的会计准则 编码(“ASC”)和会计准则更新(“ASU”)中的美国GAAP。
b. 整固
合并财务报表包括本公司及其全资子公司的账目。所有公司间账户和 交易已在合并中取消。
c. 预算的使用
根据美国公认会计原则编制综合财务报表需要管理层作出影响综合财务报表及附注所报金额的估计及假设 。反映在这些合并财务报表中的重大估计和假设 包括研发费用的应计费用。根据情况、事实和经验的变化,定期审查估计和假设 。估计的变化记录在它们被知道的时间段 。实际结果可能与管理层的估计不同。
d. 重新分类
上期的某些 金额已重新分类,以符合本期列报。
e. 细分市场信息
运营部门被定义为企业的组成部分,其独立的离散信息可供首席运营决策者或决策小组在决定如何分配资源和评估业绩时进行评估。公司在一个细分市场中查看其 运营并管理其业务。
f. 金融工具的公允价值
管理层 认为,由于该等金融工具的短期性质,本公司金融工具(包括应付账款)的账面价值大致为公允价值。
g. 财产和设备
财产和设备按成本入账,并在资产的估计使用年限内采用直线法折旧。未延长预计使用寿命或改善资产的维修和维护支出 在发生时计入费用。在报废或出售时,处置资产的成本及相关累计折旧和摊销将从账目中扣除,由此产生的任何损益将计入综合经营报表。
| 98 |
十四行诗 生物治疗控股公司
合并财务报表附注
h. 长期资产减值准备
当事件或环境变化表明资产的账面价值可能无法收回时,公司将审查长期资产,如财产和设备的减值。将持有和使用的资产的可回收性是通过将资产的账面价值与该资产预期产生的未贴现未来现金流量进行比较来衡量的。如果一项资产的账面金额
超过其估计的未贴现未来现金流量,则就该资产的账面价值超过该资产的估计公允价值的金额确认减值费用。有几个
i. 递延发售成本
与股权发行有关的法律成本和其他成本在收到时计入递延发行成本,并从股权发行的收益
中扣除。如果放弃融资,递延发行成本将被计入费用。截至2023年9月30日,该公司拥有
j. 激励性应收税款
子公司
有资格参加澳大利亚研发税收激励计划。作为该计划的一部分,子公司
有资格获得澳大利亚税务局的现金退款,以支付子公司在澳大利亚的研发费用的一定比例。
k. 协作收入
协作 安排可能包含多个组成部分,其中可能包括(I)许可证;(Ii)研发活动;以及(Iii)制造和供应某些材料。根据这些安排支付的款项可能包括不可退还的付款、预付款、在完成重大监管和开发活动时的里程碑付款、销售里程碑和产品销售的版税。 可变对价金额受到限制,直到收入很可能在未来一段时间内不存在重大逆转风险。
在确定公司履行合作安排义务时应确认的适当收入金额时,公司执行以下步骤:(I)确定合同中承诺的货物或服务;(Ii)确定承诺的货物或服务是否是履约义务,包括它们是否能够区分;(Iii)交易价格的计量,包括可变对价的限制;(Iv)将交易价格分配给履约义务 ;以及(V)确认收入为公司履行每项履约义务。
| 99 |
十四行诗 生物治疗控股公司
合并财务报表附注
在评估合同义务是否代表不同的履约义务、将交易价格分配给合同内的履约义务、确定何时履行了履约义务以及评估 可变对价的确认时,公司应用重大判断。如果在公司根据合同条款履行其履约义务之前收到对价,则合同负债被记为递延收入。预计在资产负债表日后12个月内确认为收入的递延收入 归类为流动负债。于2021年5月,本公司与新生活订立许可协议(“新生活协议”)。有关新生命协议的进一步讨论,见附注6。
l. 研发费用
研究和开发费用包括与公司生物制药 产品开发相关的所有直接和间接成本。这些费用包括人员成本、咨询费以及向第三方支付的研发和制造服务费用。 这些成本在发生时计入费用。
在报告期结束时,公司根据合同中定义的进度衡量标准,将向第三方服务提供商支付的款项与相关项目完成的估计进度进行比较。公司在准备时考虑的因素 估计包括服务提供商产生的成本、实现的里程碑以及与其服务提供商的努力相关的其他标准。随着获得更多信息,这些估计可能会发生变化。根据向服务提供商付款的时间和公司估计所提供的服务取得的进展,公司将记录与这些成本相关的预付费用或应计负债。向代表公司执行研究和开发服务的第三方支付的里程碑预付款在提供服务时计入费用。或有发展或监管里程碑 付款在相关的或有事项解决后予以确认。
m. 外币
交易 以美元以外货币计价的交易因汇率变化而产生的损益计入交易发生期间的经营活动,并在合并经营报表的汇兑损失项目中报告。
本公司根据授予日的估计公允价值计量授予员工和非员工的股权分类股份奖励,并确认该等奖励在必要服务期(即相应奖励的归属期间)内的补偿费用。本公司对发生的没收行为进行核算。对于基于服务的归属条件的股票奖励, 公司在服务期内以直线方式确认薪酬支出。本公司在其综合经营报表中对以股份为基础的薪酬 费用进行分类,其方式与对获奖者的工资成本进行分类或对获奖者的服务付款进行分类的方式相同。
| 100 |
十四行诗 生物治疗控股公司
合并财务报表附注
o. 所得税
公司采用资产负债法核算所得税。递延税项资产及负债按可归因于现有资产及负债的账面金额与其各自计税基础之间的差额,以及营业亏损及信贷结转之间的差额而产生的估计未来税项后果确认。递延税项资产及负债以制定税率计量,预期适用于预计收回或结算该等暂时性差额的年度的应税收入。当递延税项资产的部分或全部很可能无法变现时,可提供估值准备。本公司确认其所得税申报单上已采取或预期采取的不确定税收状况的好处 如果这种状况更有可能持续下去的话。
p. 反向股票拆分
2023年8月31日,该公司向特拉华州国务卿提交了经修订的公司注册证书修正案证书,该证书实现了
基本 每股净亏损的计算方法是净亏损除以每个 期间已发行普通股的加权平均股数(以及可以很少或不需要对价行使的潜在普通股)。
稀释后每股亏损包括可能行使或转换普通股认股权证及股票期权等证券所产生的影响(如有),而该等证券将会导致发行普通股的增量股份。对于稀释每股净亏损,普通股的加权平均股数与每股基本净亏损相同,这是因为当净亏损存在时,稀释证券 不包括在计算中,因为影响是反稀释的。
| 101 |
十四行诗 生物治疗控股公司
合并财务报表附注
| 9月30日 | ||||||||
| 2023 | 2022 | |||||||
| 普通权证 2021年8月 | ||||||||
| 承销商 担保2021年8月 | ||||||||
| 私人 认股权证 | ||||||||
| 强安提克利尔 认股权证 | ||||||||
| C系列认股权证 | ||||||||
| 系列 3认股权证 | ||||||||
| 未授予的 限制性股票单位和奖励 | ||||||||
| 普通权证 2023年2月 | ||||||||
| 承销商 担保2023年2月 | ||||||||
| 普通股私募认股权证2023年6月 | ||||||||
| 配售 代理人认股权证2023年6月 | ||||||||
r. 最近的会计声明
最近采用了
2021年5月,FASB发布了ASU 2021-04,每股收益(主题260),债务修改和清偿(分主题470-50),补偿-股票补偿(主题718),以及衍生工具和对冲-实体自有股权的合同(分主题815-40):发行人对独立股权的某些修改或交换的会计 -分类书面看涨期权。ASU 2021-04中的修订提供了 指导,以澄清和减少发行人对修改或交换独立股权分类 书面看涨期权(例如,权证)的会计处理的多样性,这些期权在修改或交换后仍保持股权分类。2022年10月1日采用ASU 2021-04对合并财务报表没有任何影响。
2021年11月,财务会计准则委员会或FASB发布了会计准则更新第2021-10号,政府援助 (主题832):企业实体关于政府援助的披露,或ASU 2021-10,提高了大多数企业实体接受政府援助的透明度 要求披露:(1)接受的政府援助的类型;(2)对这种援助的核算;以及(3)援助对企业实体财务报表的影响。本指导意见 适用于2021年12月15日之后发布的年度财务报表。该指导意见于2022年10月1日采用,并未对我们的合并财务报表产生实质性影响。
| 102 |
十四行诗 生物治疗控股公司
合并财务报表附注
3. 应计费用和其他流动负债
应计费用和其他流动负债包括:
| 9月30日 | ||||||||
| 2023 | 2022 | |||||||
| 薪酬 和福利 | $ | $ | ||||||
| 研发 | ||||||||
| 专业费用 | ||||||||
| 其他 | ||||||||
| $ | $ | |||||||
4. 租契
本公司于2019年12月签订为期36个月的新泽西州普林斯顿写字楼租约,租期自2020年2月1日起生效。
于2022年5月,本公司修订现有租赁协议,将租期延长约三年,
已计入租约修订。经营租赁使用权资产和负债在修改之日重新计量,导致两项余额均增加#美元。
截至2023年9月30日和2022年9月30日止年度的租赁费用 构成如下:
| 租赁费用 | 2023 | 2022 | ||||||
| 运营 租赁费 | $ | $ | ||||||
| 可变 租赁费 | ||||||||
| 租赁总成本 | $ | $ | ||||||
于2023年9月30日,加权平均剩余租期为
截至2023年9月30日和2022年9月30日的年度与经营租赁有关的现金流量信息如下:
| 为计量租赁负债所包括的金额支付的现金: | 2023 | 2022 | ||||||
| 运营 来自运营租赁的现金流 | $ | $ | ||||||
截至2023年9月30日,不可取消租赁的未来 最低租赁付款如下:
| 财年 年 | ||||
| 2024 | $ | |||
| 2025 | ||||
| 2026 | ||||
| 未贴现的租赁付款合计 | ||||
| 减去: 计入利息 | ( | ) | ||
| 租赁负债合计 | $ |
| 103 |
十四行诗 生物治疗控股公司
合并财务报表附注
5. 承付款和或有事项
法律程序
本公司不时地参与其正常业务过程中出现的各种诉讼、索赔和其他法律程序。虽然这些问题的结果不确定,但管理层预计解决这些问题的最终成本不会对公司的综合财务状况、经营业绩或现金流产生重大不利影响。
许可证 协议
于2012年7月,本公司与XOMA(US)LLC
(“XOMA”)订立发现合作协议(“合作协议”),据此,XOMA向本公司授予非排他性、不可转让许可及/或权利,以使用与发现、优化及开发抗体及相关蛋白质有关的某些
材料、技术及相关资料,并据此开发及商业化产品。公司有义务向XOMA支付或有里程碑付款,总额为
$
于2015年8月,本公司与默克KGaA(“ARES”)的全资附属公司Ares Trading订立许可协议(“ARES许可协议”)。根据ARES许可协议的条款,ARES已向该公司授予可再许可的全球独家专利使用费许可,用于研究、开发、使用和商业化使用阿特克沙金(“阿特沙金”)的产品,阿特克沙金是一种治疗周围神经疾病和血管并发症的低剂量人类IL-6制剂。根据ARES许可协议,公司将按其销售产品的净销售额向ARES支付个位数的高额特许权使用费。版税 按产品和国家/地区支付,直至(I)在该国家/地区首次商业销售后的指定时间段内和(Ii)该产品在该国家/地区被有效索赔的最后日期(以较晚者为准)为止。
于2019年1月,本公司与Sartorius Stedim
Cellca GmbH(“Cellca”)订立框架服务及许可协议(“Cellca协议”),根据该协议,Cellca已授予本公司一项全球性、非排他性、永久性及不可转让的
许可证,以开发、制造或已制造、使用、销售、进口、出口及/或以其他方式商业化基于Cellca生产指定转基因细胞系及为该等细胞系开发上游生产工序的产品。Cellca协议
有效,除非任何一方发出六个月的通知终止,或如果出于正当理由终止,则给予14天通知。
| 104 |
十四行诗 生物治疗控股公司
合并财务报表附注
于2021年10月,本公司与Brink Biologics Inc.
(“Brink”)订立非独家许可协议(“Brink协议”),据此Brink授予本公司非独家、不可转让许可及有限权利
再许可若干材料及相关资料以发展以细胞为基础的分析,以进行产品生产及商业化所需的批次、质量控制、稳定性、效力、效力或任何其他类型的分析。在产品开发阶段,公司
有义务每年支付约$的产品开发许可费
于2022年2月,本公司与InvivoGen
SAS(“InvivoGen”)订立生物材料许可协议(“InvivoGen协议”),据此InvivoGen已向本公司授予全球非独家许可,允许本公司使用某些
报告电池进行研究、开发及/或质量控制。InvivoGen协议的初始期限为三年
,在公司书面通知并支付约欧元的情况下,可再延长两次三年期限
于2022年3月,本公司与ProteoNic
B.V.(“ProteoNic”)订立材料转让及许可协议(“ProteoNic协议”),据此ProteoNic已向本公司授予非排他性、不可转让、不可再许可的
许可证(ProteoNic协议另有规定者除外),包括用于产生本公司细胞系所用载体的质粒及DNA序列,以供本公司用于产品的研究、开发及商业化。
许可证将持续至任何一方终止。公司发生了一笔$
| 105 |
十四行诗 生物治疗控股公司
合并财务报表附注
研究和开发协议
于2021年12月,本公司与Navigo Proteins GmbH(“Navigo”)订立研发协议(“Navigo协议”),根据该协议,Navigo将执行特定的评估及开发程序,以评估某些 材料以确定其商业潜力。根据Navigo协议的条款,公司已授予Navigo使用某些技术进行评估和开发活动的免版税、 非独家、全球、不可再许可、不可转让的权利和许可,而Navigo已授予公司(I)研究、开发、使用、销售、分销、进口或以其他方式商业利用某些材料的独家、全球、永久、不可撤销、可再许可、可转让、 免版税的权利和许可,以及(Ii)非独家、全球、永久、可再许可、制造或已经制造此类材料的权利和许可证不可转让 。公司发生了一笔$签署Navigo协议时,技术访问费为100万欧元,当时将其记为收购的正在进行的研发,并在截至2022年9月30日的年度综合运营报表中计入研发费用 。公司有义务向Navigo支付2023年3月修订的或有里程碑付款,总额最高可达$在实现《导航协定》中概述的某些评价和发展里程碑的基础上达到100万美元。 2023年实现了某些评价里程碑,总额为#美元。5,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,
雇佣协议
公司已与其高级管理人员和某些员工签订雇佣合同,规定在公司无故终止雇佣或员工有充分理由终止雇佣的情况下,提供遣散费和延续福利,两者均符合合同中的定义 。此外,如果在控制权变更后终止雇佣关系,无论是由公司 无故终止,还是由员工出于正当理由终止,员工初始股票期权授予的任何未授予部分将立即归属 。
6. 协作收入
根据新生命协议,本公司于马来西亚、新加坡、印度尼西亚、泰国、菲律宾、越南、文莱、缅甸、马来西亚、新加坡、印度尼西亚、泰国、菲律宾、越南、文莱、缅甸开发及销售含有特定重组人IL-6、SON-080(“化合物”)的药物制剂(该等制剂为“产品”)以预防、治疗或缓解人类糖尿病周围神经病变(“DPN领域”)。老挝人民民主共和国和柬埔寨(“专属领土”)。 新生活有权扩大(1)专属许可证的范围,包括预防、治疗或缓解化疗引起的人类周围神经病(“CIPN领域”),该选项是非专属的,于2021年12月31日到期;和/或 (2)许可证的地域范围,包括人民Republic of China、香港和/或印度,该选项是独家的 ,于2021年12月31日到期。
该公司将保留在世界任何地方生产化合物和产品的所有权利。本公司与新生活将订立 后续供应协议,根据该协议,本公司将按双方协商的条款向新生活供应产品,以供其在专属地区的DPN油田进行开发及商业化。该公司还将协助转让对新生命能够从许可证中受益的某些临床前和临床开发技术诀窍。
| 106 |
十四行诗 生物治疗控股公司
合并财务报表附注
新人寿将承担并负责在专属区域内的DPN领域进行临床研究和其他非临床研究以及其他开发和监管活动以及产品商业化的费用和责任。
New Life向该公司支付了$
新生命协议将按产品逐个国家/地区继续有效,并将于最后到期国家/地区的最后到期产品的特许权使用费期限届满时终止,但须受以下条件限制:(I)各方的提前解约权 ,包括因另一方重大违约或破产或破产而提前终止的权利,以及(Ii)本公司的回购权和新生命的 回退权(定义如下)。
此外,New Life授予本公司回购本公司授予New Life的权利的独家选择权,而公司 授予New Life按待商定的条款在专属地区的一个或多个国家回购DPN现场产品的权利,该等选择权将于适用产品的第三阶段试验开始时终止。
收入 确认
该公司首先根据ASC 808评估了新生命协议,协作安排(“ASC 808”),以确定新生活协议或新生活协议内的账户单位是否代表基于双方的风险、回报和活动的合作安排。本公司适用ASC 606的相关指导意见,与客户签订合同的收入 (“ASC 606”),以评估与新生活的合作安排的适当会计处理。根据本指南,公司根据该安排确定了以下义务:(I)许可在专属区域内现场开发、营销、进口、使用产品并将其商业化(“许可”);以及(Ii)转让专有技术和临床 开发和监管活动(“研发活动”)。扩大CIPN领域和地区以及未来供应协议的选项 为可选采购,作为单独的合同入账。该公司评估了这些 个单独的合同,没有确定有任何实质性权利在场。公司确定许可证和研发服务 彼此没有区别,因此将这些重大承诺合并为一项履约义务。
公司确定单一履约义务的初始交易价格为$
| 107 |
十四行诗 生物治疗控股公司
合并财务报表附注
协作
从单一绩效义务中获得的收入将在研发服务的估计绩效中确认。公司
确认了$
7. 股东亏损额
2023年赛事
公司于2022年8月15日与BTIG,LLC订立市场销售协议(“BTIG”)(“2022年销售协议”)。
根据2022年销售协议,本公司可不时透过BTIG作为销售代理及/或委托人发售其普通股
股份,总发行价最高可达$
2023年2月10日,该公司通过Chardan Capital Markets LLC和Benchmark Investments LLC的部门EF Hutton作为承销商完成了普通股和某些认股权证的公开发行,总收益为$
普通股认股权证可立即以$的价格行使。
在
另外,购买认股权证
2023年6月30日,公司通过Chardan Capital Markets,LLC作为配售代理,完成了登记直接发行普通股(及其普通股等价物)和同时私募若干普通股认股权证,总收益为$
| 108 |
十四行诗 生物治疗控股公司
合并财务报表附注
普通股认股权证从2023年12月30日起可行使,价格为$
在
另外,购买认股权证
2022年活动
于2022年8月,本公司与数名认可投资者订立证券购买协议(“优先SPA”),以发行及出售(I)合共其第三系列可转换优先股的股票,陈述价值$每股,
(Ii)其第4系列可转换优先股的股票,陈述价值$每股,以及(Iii)系列3认股权证,最多购买
系列3和系列4可转换优先股的
股票没有投票权,但作为单一类别的普通股股东有权就修订后的公司公司注册证书进行投票,以实现普通股流通股的反向拆分
。系列3可转换优先股的每股股票有权在折算后的基础上投票,以及
私募于2022年8月15日结束,股东投票通过了
在截至2022年9月30日的年度内,公司共销售了根据与BTIG的2022年销售协议
发行普通股,总收益为$
此外,在截至2022年9月30日的年度内,本公司发出限制性股票单位归属时的普通股。
| 109 |
十四行诗 生物治疗控股公司
合并财务报表附注
普通认股权证
截至2023年9月30日,以下股权分类认股权证及相关条款尚未到期:
| 未偿还认股权证 | 演练 价格 | 过期日期 | ||||||||
| 普通权证 2021年8月 | $ | |||||||||
| 承销商 担保2021年8月 | $ | |||||||||
| 强安提克利尔 认股权证 | $ | |||||||||
| C系列认股权证 | $ | |||||||||
| 系列 3认股权证 | $ | |||||||||
| 普通权证 2023年2月 | $ | |||||||||
| 承销商 担保2023年2月 | $ | |||||||||
| 普通股私募认股权证2023年6月 | $ | |||||||||
| 配售 代理人认股权证2023年6月 | $ | |||||||||
| 总计 | ||||||||||
在截至2023年9月30日的年度内,认股权证净额结算后,发行了普通股。
在截至2023年9月30日的年度内,认股权证是以现金方式行使的。本公司收到了最低限度的收益,以换取发行普通股。
在截至2023年9月30日的年度内,
2020年4月,本公司通过了《2020年综合股权激励计划》(以下简称《计划》)。2023年1月1日,根据该计划授权的股份总数 增至。有几个自2023年9月30日起,可根据本计划发行的股票。 该计划将根据该计划可发行的股票数量增加普通股流通股的4%,每年1月1日。该计划允许根据本计划的条款授予基于股票的奖励,包括股票期权、限制性股票单位和奖励、股票增值权和其他被认为适当的奖励类型。奖励条款由公司董事会决定。
| 110 |
十四行诗 生物治疗控股公司
合并财务报表附注
受限 股票单位和奖励
. . . .
在2023年1月,在2022年12月授予的RSU中,有1个被注销,随后作为本公司普通股的限制性股票(“限制性股票奖励”或“RSA”)重新发行。RSA的归属条件与2022年12月签发的原始RSU相同。该公司将此作为股票薪酬调整进行会计处理,结果为$将在剩余的授权期内确认的增量 费用。
任何未授权的RSU或RSA将在服务终止时被没收。RSU或RSA的公允价值等于授予日公司普通股的公允市场价值。RSU和RSA费用在授权期内按直线摊销。
| 截至9月30日的年度, | ||||||||
| 2023 | 2022 | |||||||
| 研发 | $ | $ | ||||||
| 常规 和管理 | ||||||||
| $ | $ | |||||||
下表总结了该计划下的RSU活动:
| 加权 | ||||||||
| 平均助学金 | ||||||||
| RSU | 日期 公允价值 | |||||||
| 2021年10月1日的未归属余额 | $ | |||||||
| 授与 | $ | |||||||
| 既得 | ( | ) | $ | |||||
| 被没收 | ( | ) | $ | |||||
| 2022年10月1日的未归属余额 | $ | |||||||
| 授与 | $ | |||||||
| 既得 | ( | ) | $ | |||||
| 被没收 | ( | ) | $ | |||||
| 截至2023年9月30日的未归属余额 | $ | |||||||
截至2023年9月30日,与未归属RSU相关的未确认补偿支出总额为$,预计将在加权平均期间内 确认.
下表总结了该计划下的RSA活动:
| 加权 | ||||||||
| 平均助学金 | ||||||||
| RSA | 日期 公允价值 | |||||||
| 2022年10月1日的未归属余额 | ||||||||
| 授与 | $ | |||||||
| 截至2023年9月30日的未归属余额 | $ | |||||||
截至2023年9月30日,与未授权RSA相关的未确认补偿支出总额为$,预计将在加权平均期间内 确认.
| 111 |
十四行诗 生物治疗控股公司
合并财务报表附注
9. 所得税
截至2023年9月30日,该公司拥有$
由于国税法所有权条款的变更,本公司净营业亏损结转的可获得性 可能会受到未来期间应纳税收入的年度限制,这可能会大大限制此类结转的最终使用 。本公司并无分析其股权融资对实益拥有权的历史或潜在影响 ,因此尚未确定结转的净营业亏损是否受《国内收入法典》第382节的限制。在有限制的范围内,递延税项资产将会减少,但估值免税额会有抵消性的减少。
当存在不确定的税收头寸时,本公司确认税收头寸的税收优惠,以使其更有可能实现 。有关税务优惠是否更有可能实现的决定是基于税务状况的技术优点以及可获得的事实和情况的考虑。本公司在其综合经营报表的所得税拨备内确认因任何未确认的税收优惠而应计的利息和罚金。未记录未确认的 税收优惠。
造成递延税金的暂时性差异的税收影响如下:
| 9月30日 | ||||||||
| 2023 | 2022 | |||||||
| 递延 纳税资产: | ||||||||
| 净营业亏损结转 | $ | $ | ||||||
| 研究和开发信用结转 | ||||||||
| 摊销 | ||||||||
| 基于股份的薪酬 | ||||||||
| 运营 租赁负债 | ||||||||
| 应计费用和其他 | ||||||||
| 第 163(J)节不允许的利息支出 | ||||||||
| 财产 和设备 | ||||||||
| 递延税项资产总额 | ||||||||
| 减去: 估值免税额 | ( | ) | ( | ) | ||||
| 递延 纳税义务: | ||||||||
| 财产 和设备 | ( | ) | ||||||
| 运营 租赁使用权资产 | ( | ) | ( | ) | ||||
| 净额 递延税项资产 | $ | $ | ||||||
| 112 |
十四行诗 生物治疗控股公司
合并财务报表附注
在截至2023年9月30日和2022年9月30日的年度内,公司未记录任何所得税支出或福利。合并财务报表中反映的按法定联邦所得税率计算的所得税(费用) 福利与所得税的对账如下:
| 截至9月30日的年度, | ||||||||
| 2023 | 2022 | |||||||
| 美国联邦法定利率 | ( | )% | ( | )% | ||||
| 州税,扣除联邦福利的净额 | ( | ) | ( | ) | ||||
| 更改估值免税额 | ||||||||
| 研究和开发信用 | ( | ) | ( | ) | ||||
| 永久性差异 | ( | ) | ||||||
| 国外 税率差异 | ||||||||
| 国家NOL | ||||||||
| 其他 | ||||||||
| 实际所得税率 | % | % | ||||||
2022年8月,美国颁布了《2022年通胀削减法案》(IRA)。爱尔兰共和军包含一些与税务有关的规定
,这些规定将在2022年12月31日之后的纳税年度生效,包括公司替代最低税额为
10. 后续事件
公司评估了从资产负债表日期到2023年12月14日的后续事件,2023年12月14日是可以发布合并财务报表的日期 。有关10月产品的信息,请参阅注1。
2023年12月,该公司的销售申请获得初步批准,最高可达$
| 113 |
第 项9.会计和财务披露方面的变更和分歧。
没有。
第 9A项。控制和程序。
关于我们的信息披露控制评估的结论
我们 维持披露控制和程序,旨在提供合理的保证,确保在我们根据1934年证券交易法(经修订的《证券交易法》)提交的定期报告中披露的重大信息在美国证券交易委员会规则和表格中指定的时间段内被记录、处理、汇总和报告,并提供合理的保证 此类信息被积累并传达给我们的管理层、我们的首席执行官和我们的首席财务官, 以便及时就所需披露做出决定。我们在管理层(包括我们的主要高管和首席财务官)的监督和参与下,对我们的披露控制和程序的设计和操作 的有效性进行了评估,这符合《交易法》规则13(A)-15(E)的定义。根据这项评估,我们的首席执行官和首席财务官得出结论,截至2023年9月30日,我们的披露控制程序和程序是有效的。
管理层财务报告内部控制年度报告
我们的管理层负责按照《交易法》规则13a-15(F) 和15d-15(F)的规定,建立和维护对财务报告的充分内部控制。财务报告内部控制是根据美国公认会计原则,为财务报告的可靠性和为外部报告目的编制财务报表提供合理保证的过程。
对财务报告的内部控制包括以下政策和程序:(1)与维护记录相关的政策和程序,这些记录合理、详细、准确和公平地反映交易和资产处置;(2)提供合理的保证,确保交易按必要记录,以便根据美国公认会计原则编制财务报表,并且仅根据管理层和董事的授权进行收支;以及(3) 就防止或及时发现可能对TIS财务报表产生重大影响的未经授权获取、使用或处置我们的资产提供合理保证。
在我们管理层(包括首席执行官和首席财务官)的监督和参与下,我们根据 框架中确定的标准对财务报告内部控制的有效性进行了 评估内部控制--综合框架(2013)由特雷德韦委员会赞助组织委员会发布。 根据这项评估,我们的管理层得出结论,我们对财务报告的内部控制自2023年9月30日起有效。
由于其固有的局限性,财务报告的内部控制可能无法防止或发现错误陈述。此外,对未来期间进行任何有效性评估的预测可能会受到以下风险的影响:由于 条件的变化,控制可能会变得不充分,或者政策或程序的遵守程度可能会恶化。
本 年度报告不包括我们独立注册会计师事务所的认证报告,因为我们是“非加速申请者”,可能会利用适用于加速申请者的上市公司的各种报告要求的某些豁免,包括但不限于不需要遵守萨班斯-奥克斯利法案 第404(B)节的审计师认证要求。
财务报告内部控制变更
在截至2023年9月30日的第四季度内,我们对财务报告的内部控制(根据《交易法》第13a-15(F)和15d-15(F)条的定义) 没有发生任何变化,这对我们对财务报告的内部控制产生了重大影响,或很可能会对其产生重大影响。
第 9B项。其他信息。
2023年12月11日,Sonnet BioTreateutics Holdings,Inc.(“本公司”)董事会薪酬委员会(“委员会”)根据本公司的“2020综合股权激励计划”(“本计划”)批准了对公司某些高管的限制性股票单位(“RSU”)奖励(使用公司标准格式的RSU奖励协议,其副本作为本公司的附件10.10存档并纳入本文作为参考)。每个RSU代表在归属时获得一股公司普通股的权利,受下述条款和条件的限制。授权书于2024年1月1日生效,但须视乎根据该计划可供授出的股份是否可供授出,并视乎有关承授人于该日期继续受雇于本公司而定 承授人可于2023年12月31日或之前通知本公司行政总裁,条件是该承授人选择接受限制性股票奖励而非RSU,在此情况下,承授人将获得采用本公司先前批准表格的限制性股票奖励 。
首席执行官Pankaj Mohan博士获得了RSU奖,相当于公司普通股的60,433股。首席财务官Jay Cross获得了RSU奖,相当于公司普通股的11,622股。首席科学官John Cini获得了RSU奖,相当于公司普通股的15,108股。首席技术官Susan Dexter获得了相当于11,622股公司普通股的RSU奖励。首席医疗官Rick Kenney获得了相当于公司普通股10,169股的RSU奖励。每个RSU奖项将于2025年1月1日100%授予。如果受让人停止连续服务(如本计划所定义),截至停止服务之日仍未归属的任何RSU将被没收。
第 9C项。披露妨碍检查的外国司法管辖区。
不适用 。
| 114 |
第 第三部分
项目 10.董事、行政人员和公司治理
董事
下表列出了有关本公司现任董事的某些信息。董事任期至下一届年度股东大会及继任者选出并获得资格为止。
| 董事 | 年龄 | 第一年 变成了 董事 | ||
| Pankaj 莫汉博士 | 59 | 2020 | ||
| Nailesh 巴特 | 51 | 2020 | ||
| 艾伯特·戴尔内斯 | 61 | 2020 | ||
| 唐纳德·格里菲斯 | 75 | 2020 | ||
| 拉古 拉奥 | 61 | 2020 | ||
| 洛莉 麦克尼尔 | 51 | 2022 |
以下是目前担任本公司董事的个人的简要简历,其依据是该等人士向本公司提供的资料。
Pankaj Mohan博士
Pankaj Mohan博士于2015年创立十四行诗,此后一直担任其董事会成员,并在合并结束时被任命为我们的董事会(“董事会”)的主席。莫汉博士于2018年6月出任十四行诗主席,并于2019年1月出任十四行诗首席执行官,并于合并完成时被任命为总裁兼本公司首席执行官。2011年1月至2018年6月,他担任他于2011年创立的肿瘤生物制剂公司(现为Outlook治疗公司;纳斯达克:OTLK)首席执行官兼董事长总裁。在此之前,莫汉博士曾在百时美施贵宝公司担任生物工艺和产品开发的业务运营和投资组合管理主管,并在基因泰克公司担任生物工艺工程部门的董事 负责人。在此之前,莫汉博士曾在礼来公司担任高级经理。1993年5月至1996年4月,莫汉博士在英国伦敦大学学院生物化学工程高级中心担任助理教授(讲师/研究员)。Mohan博士拥有英国伯明翰伯明翰大学化学工程学院的生化工程博士学位、英国伦敦米德尔塞克斯大学商学院的财务管理硕士学位、杜克大学福库商学院的高管管理课程(AMP)以及印度罗基印度理工学院的化学工程学士学位。他也是一本关于生物过程操作的行业参考书(McGraw Hill)的作者。公司相信莫汉博士能够为董事会做出宝贵的贡献,因为他对生物制药行业有广泛的了解,而且他以前担任高管的经验。
Nailesh 巴特
Nailesh Bhatt自2018年7月以来一直在Sonnet董事会任职,并在合并结束时被任命为我们的董事会成员。自2018年1月以来,巴特先生一直担任VGYAAN PharmPharmticals LLC的首席执行官兼董事会成员,VGYAAN PharmPharmticals LLC是一家专注于开发临床关键药物并将其商业化的公司。在此之前,巴特先生于2001年11月创立了Proximare公司,并担任董事的总经理。 Proximare是一家专注于制药行业的战略咨询公司。自2018年4月以来,巴特先生还担任Azity制药公司的董事会成员。2015年6月,巴特先生创立了Proximare生命科学基金。巴特先生在波士顿大学攻读文学学士学位,主修生物学。公司相信巴特先生能够为董事会做出宝贵的贡献,因为他在制药行业与财富500强公司的初创公司合作多年的经验。
| 115 |
艾伯特·戴尔内斯
Albert Dyrness has served on Sonnet’s board of directors since October 2019, and was appointed to our Board at the closing of the Merger. Mr. Dyrness is a recognized biopharmaceutical industry expert in bio-process engineering with expertise in upstream, downstream, and fill/finish processes. Since July 2019, Mr. Dyrness has been the Managing Director of ADVENT Engineering Services, Inc., a Trinity Consultants Company, which serves as its life-sciences division. In 1988, Mr. Dyrness Co-Founded ADVENT Engineering Services, Inc., an engineering consulting firm serving the energy and life sciences industries. Starting with only 4 employees in the San Francisco Bay Area, ADVENT has grown to a staff of over 130 engineers with offices in Toronto, Canada, Singapore, Raleigh, North Carolina, Portland Oregon, Boston, Massachusetts, Irvine and San Ramon, California. In 2016, Mr. Dyrness became President and Chief Technical Officer of ADVENT and, in 2017, guided the company to a merger with Trinity Consultants, a 700-person engineering consulting firm. He also served as a member of the board of directors of Oncobiologics, Inc. (now Outlook Therapeutics, Inc.; Nasdaq: OTLK) from December 2015 to September 2017. In 1986, Mr. Dyrness graduated from the Massachusetts Institute of Technology where he studied mechanical engineering and entrepreneurism. The Company believes Mr. Dyrness is capable of making valuable contributions to the Board due to his years of experience in a Nasdaq-listed public company, along with years of entrepreneurial experience, including in the biopharmaceutical industry.
Donald Griffith,CPA
Donald Griffith,CPA自Sonnet于2015年4月成立以来一直在Sonnet董事会任职,2015年4月至2018年6月担任Sonnet董事会主席,并在合并结束时被任命为董事会成员。Griffith先生自2019年1月1日起担任Sonnet的财务 总监,自合并以来担任我们的总监。在担任财务总监之前,他于2015年4月至2016年12月担任Sonnet的 首席执行官兼首席财务官。在此之前,Griffith先生是Oncobiologics Inc.的首席财务官、董事兼秘书。(now Outlook Therapeutics; Nasdaq:OTLK),2011年至2018年。Griffith先生在财务和会计方面拥有超过 40年的经验,是Stolz & Griffith,LLC(新泽西州会计师事务所)的创始人和合伙人。本公司相信,Griffith先生凭借其多年的财务 和制药行业经验,能够为董事会做出宝贵贡献。
Raghu Rao
Raghu Rao has served on Sonnet’s board of directors since November 2019, and was appointed to our Board at the closing of the Merger. Mr. Rao is a serial entrepreneur, strategic business advisor and angel investor. Mr. Rao has founded, scaled and had successful exits with several high-technology companies. In his 33-year career, Mr. Rao has advised clients on the strategy and roll-out of high-profile projects, such as USA.gov, TSA Screening Gateway, Cancer.gov and other eGovernment initiatives. As the Vistage Princeton Chair, from July 2012 to March 2017, Mr. Rao ran three high-performing peer advisory boards for middle-market CEOs and business leaders of companies with total revenues exceeding $2 Billion. As the Chairman & President of InfoZen from August 1995 to July 2008, Mr. Rao has managed over $1 Billion in U.S. Federal Government contracts. Mr. Rao is a 20-year Charter Member of The Indus Entrepreneurs (TiE.org) and a 5-year patron of the Indiaspora. He has held board positions at several companies including Cellix BioSciences (Jan 2016 - Jan 2017), Paper Battery Company (Jan 2009 - Dec 2018), Kovid Group (Feb 2016 - Oct 2017) , WizNucleus (Jun 2010 - present) and InfoZen (Aug 1995 - Jul 2008). Mr. Rao is active in social entrepreneurship and community service. He co-founded the Hindu Jewish Coalition in December 2012 and Forum for Religious Freedom in March 2007, to preserve religious diversity worldwide. He has held non-profit board positions at the Infinity Foundation (New Jersey), Arsha Vidya Gurukulam (Pennsylvania) and the Family Services Agency (Maryland). Mr. Rao has an MBA in Finance from George Washington University (Dec 1991), an M.S. in Computer Science from Virginia Tech (Dec 1986), and a B.Tech. in Electrical Engineering from Indian Institute of Technology Madras (June 1984). The Company believes Mr. Rao is capable of making valuable contributions to the Board due to his 15 years of experience as an executive, along with 25 years of entrepreneurial experience, including in the biotech industry.
| 116 |
Lori McNeill
Lori McNeill has served on our Board since September 2022 and as Chairperson of our Business Advisory Committee since September 2019. Ms. McNeill is the founder and Chief Executive Officer of McNeill Consulting, LLC since 2016, a management consulting company focused on developing leaders to be more effective and ensuring that change management initiatives are seamless. Ms. McNeill has over twenty years’ experience in the healthcare industry, thirteen of which were at Pfizer Inc., which included working as the Chief of Staff of Global Operations in the Integrated Health Business unit. From 2020 to 2021, Ms. McNeill was the Chief Operating Officer and Chairperson of the board of directors of Global PPE, Inc., a worldwide supplier of personal protective equipment and safety supplies focused on healthcare and government entities to fight the COVID-19 pandemic. She has been recognized by several institutions: Top 100 Global Women in Leadership - Global Council for the Promotion of International Trade, 2021; Changemakers Summit Award Winner, 2021; The State of Women in Leadership - Cover article for HR.com, 2020; and Pfizer International Innovation Excellence Award, 2011 and is currently Global Chairperson of Womenomics. The Company believes Ms. McNeill is capable of making valuable contributions to the Board due to her over 20 years of experience in the healthcare industry, including in senior leadership positions.
执行官员
下表载列有关本公司现任行政人员的若干资料:
| 执行官员 | 年龄 | 位置 和办公 | ||
| Pankaj Mohan博士 | 59 | 总裁 和首席执行官 | ||
| Jay 克罗斯 | 53 | 首席财务官 | ||
| John K. Cini博士 | 71 | 首席科学官 | ||
| Susan 德克斯特 | 68 | 主任 技术官 | ||
| 理查德·肯尼,医学博士。 | 65 | 首席医疗官 |
以下是目前担任本公司高管的个人的简要简历,其依据是此等人士向本公司提供的信息。
Pankaj Mohan博士
请参阅导向器下的 说明。
Jay 克罗斯
Jay 克罗斯于2019年5月加入十四行诗,此后一直担任该公司的首席财务官和首席业务官,并在合并完成时被任命为公司首席财务官。在加入十四行诗之前,克罗斯先生于2015年11月至2019年3月在查尔丹资本的医疗保健投资银行团队担任董事董事总经理,期间专注于生物制药。在此之前,从2014年5月至2015年6月,克罗斯先生在Alere Financial Partners担任董事,并于2011年5月至2013年10月在Balyasny Asset Management担任高级分析师 。他于1999年在Hambrecht&Quist的医疗保健股票研究团队担任负责生物技术的助理分析师,开始了他的金融职业生涯。克罗斯先生拥有耶鲁大学医学院的硕士学位和华盛顿与李大学的心理学学士学位。
约翰·K·西尼,博士。
John K.Cini博士于2015年共同创立了十四行诗,此后一直担任该公司的首席科学官,并在合并结束时被任命为该公司的首席科学官,负责监督和指导该公司的发现和开发计划。他的职责包括监督癌症和免疫肿瘤学靶标的选择过程以及概念验证测试。在加入十四行诗之前,他于2011年1月至2015年4月在肿瘤学公司担任发现与发展科学部总裁副主任。Cini博士已成功地将20多种新型单抗产品从发现阶段推向了IND阶段。他拥有多项新产品和配方专利及应用。他还通过早期发现、研发和生产、临床试验和商业化,直接参与了几种成功的新型生物制品。之前的职位包括在美德士(2010年被百时美施贵宝收购)担任董事高管,在强生(生物科技整形外科和药物研究)担任发现科学领导职务,以及拜耳。西尼博士在系统生物学方面的专业治疗领域包括肿瘤学、免疫肿瘤学、炎症、骨质疏松症、伤口愈合、外科粘连和细胞老化。西尼博士拥有北得克萨斯大学生物化学博士学位。
| 117 |
苏珊·德克斯特
苏珊·德克斯特自2019年5月以来一直以首席技术官的身份担任十四行诗的合同顾问,并于2020年4月1日合并完成时被任命为公司的全职首席技术官。她在Sonnet的角色是管理药物开发的运营 ,从细胞系开发到药物物质和临床药物产品的cGMP制造, 启动人体临床试验的监管提交,以及标签/包装和分发到临床仓库的供应链。所有活动均受FDA的生物药物化学制造和控制(“CMC”)管辖。她还负责药品供应和非临床动物研究的管理,以支持与首例人类研究相关的监管文件。她来到十四行诗 ,在生物技术科学、制造和商业发展方面拥有30多年的经验, 直接参与了三家初创公司和多项并购活动。她在CMC生物制药工艺开发方面的专业知识范围从细胞生产线开发到通过商业制造的工艺开发。从2008年9月到合并完成,德克斯特女士在莱瑟姆生物制药集团(“莱瑟姆生物制药”) 担任董事经理,负责产品开发服务,管理与临床前毒理学研究相关的活动和学科,以及与CMC相关的活动,包括IND备案、cGMP活动的质量监督和其他CMC供应链活动。她从Xcellerex,Inc.来到LBG,Xcellerex,Inc.是一家CDMO和生物处理一次性使用技术的开发商。2004年4月至2008年9月,她担任Xcellerex的首席商务官。在加入Xcellerex之前,从1998年7月到2004年4月,她在陶氏化学公司的CDMO担任业务发展副总裁,在Dexter女士的推动下于2000年收购了Collaborative BioAlliance,以及Assoc。Celltech Biologics的业务发展董事,被龙沙生物收购, 生物CDMO。1986年至1998年7月,她在Celltech/Lonza工作。德克斯特女士拥有位于华盛顿特区的美国大学免疫学和市场营销学荣誉专业的双学位,以及哈佛大学颁发的“律师谈判”和“非金融经理的金融”证书。她也是伦敦大学学院生物工程系荣誉退休教授,在1999至2006年间,为毕业生、博士和研究生专业人员讲授“生物制药设施的项目管理”的荣誉课程讲座和研讨会。自2015年以来,她一直担任Sartorius Stedim Biotech的非执行董事会成员,自2019年以来担任薪酬委员会成员,自2022年以来担任审计委员会成员。2023年2月,苏珊被任命为英国伦敦一家公司Virocell的董事会成员,该公司是一家技术开发商和CDMO公司,致力于制造用于细胞和基因治疗的病毒载体。
理查德·肯尼,医学博士。
Richard Kenney,医学博士自2021年4月起担任公司首席医疗官。Kenney博士在生物制剂的预防阶段开发以及临床前、临床阶段和商业化疫苗和免疫疗法的商业化战略和企业管理方面拥有20多年的经验。作为ClinReg Biologics的总裁,他以多种身份为生物制剂的临床和法规事务以及医学监测和药物警戒提供战略咨询。因此,Kenney博士还担任 公共卫生疫苗马尔堡疫苗项目的CMO。他曾在X-VAX Technology 担任首席开发官,在此之前,他曾在Immune Design和Crucell Holland担任首席医疗官,领导临床开发和法规 事务小组。Kenney博士是FDA的研究员/评审员超过六年,并在杜克大学和NIH进行了研究生培训。博士 肯尼获得了学士学位。乔治·华盛顿大学化学博士来自哈佛医学院
第16(A)节实益所有权报告合规性
1934年《证券交易法》第 16(a)条(经修订)要求公司董事和高管、高级职员以及持有公司注册类别股本证券10%以上的受益所有人 向SEC提交所有权和所有权变更报告。证券交易委员会的规定要求这些人员向公司提供他们提交的所有第16(a)节表格的副本。
仅根据公司对提供给公司的表格3、4和5副本的审查,公司认为其所有董事、 执行官和任何其他适用的股东在截至2023年9月30日的 财政年度内及时提交了《交易法》第16(a)节要求的所有报告,但以下情况除外:应于2022年12月16日提交的表格4于2022年12月22日提交给Nailesh Bhatt,Albert Dyrness,Raghu Rao,Lori McNeil,Pankaj Mohan,John Cini,Jay Cross,Susan Dexter和Rick Kenney; Pankaj Mohan、John Cini、Susan Dexter和Rick Kenney于 2023年2月17日提交了应于2023年1月10日提交的表格4; Donald Griffith于 2023年2月17日提交了应于2022年12月13日提交的表格4。
| 118 |
商业行为和道德准则
公司已采用适用于其董事、高级职员和员工的《商业行为和道德准则》。《商业行为和道德准则》 的目的是阻止不法行为,并为公司的董事、管理人员和员工 提供指导,帮助他们认识和处理道德问题,提供报告不道德或非法行为的机制,并为公司的诚实和责任文化做出积极贡献 。公司https://www.sonnetbio.com/如果公司对《商业 行为和道德准则》进行任何实质性修订或授予任何豁免,包括对 其董事或执行官的《商业行为和道德准则》条款的任何默示豁免,公司将在其网站上或在表格8-K的当前 报告中披露此类修订或豁免的性质。
审计委员会
董事会已成立审计委员会,目前由Bhatt先生(主席)、Dyrness先生和Rao先生组成。审计委员会的 主要职能是监督和审查:公司的合并财务报表和公司提供的其他财务 信息的完整性,公司遵守法律和监管要求的情况,公司的内部会计和财务控制系统 ,独立审计师的聘用、资格、业绩、薪酬 和独立性,关联方交易,并遵守公司的商业行为和道德准则。
审计委员会的每名成员都是“独立的”,因为该术语是根据美国证券交易委员会的适用规则和纳斯达克股票市场的适用规则来定义的。董事会已确定,每名审计委员会成员在财务和审计事务方面拥有足够的知识,可在审计委员会任职。董事会认定Rao先生为“美国证券交易委员会适用规则及纳斯达克证券市场适用规则所界定的审计委员会财务专家”。公司董事会已通过了审计委员会章程,可在https://www.sonnetbio.com/.上查看
项目 11.高管薪酬
汇总表 薪酬表
下表显示了在2023财年担任本公司首席执行官的每位高管、截至2023年9月30日担任本公司高管的两名薪酬最高的高管以及至多另外两名本应获得披露信息的个人在2023财年获得的薪酬 。下表中所列人员在本文中称为“指定的执行官员”。
汇总表 薪酬表
| 姓名 和主要职位 | 年 | 薪金 ($) | 奖金 ($) | 库存 奖项 ($)(1) | 选择权 奖项 ($)(1) | 所有 其他 补偿 ($) | 总计 ($) | ||||||||||||||||||||
| Pankaj Mohan博士 | 2023 | 538,998 | 309,924 | 95,724 | - | 78,074 | 1,022,720 | ||||||||||||||||||||
| 总裁 和首席执行官 | 2022 | 559,729 | 218,680 | 144,061 | - | 82,923 | 1,005,393 | ||||||||||||||||||||
| 约翰·西尼,博士。 | 2023 | 417,750 | 146,490 | 23,931 | - | 38,240 | 626,411 | ||||||||||||||||||||
| 首席科学官 | 2022 | 413,048 | 113,899 | 36,015 | - | 52,014 | 614,976 | ||||||||||||||||||||
| Jay 克罗斯 | 2023 | 388,725 | 178,813 | 15,829 | - | 35,882 | 619,250 | ||||||||||||||||||||
| 首席财务官 | 2022 | 403,676 | 127,649 | 30,128 | - | 43,358 | 604,811 | ||||||||||||||||||||
| (1) | 代表根据财务会计准则委员会(“FASB”)会计准则编纂(“ASC”)主题718计算的2023年和2022年赠款的公允价值总额。此计算不会对与基于服务的归属相关的没收进行任何 估计,但假设执行人员将为全额归属的 奖励执行必要的服务。 |
| 119 |
Narrative 薪酬汇总表披露
雇佣协议
每名被提名的执行干事的雇用协议或安排的具体条款如下所述。
十四行诗 于2018年12月31日与Mohan博士订立经修订的雇佣协议(“Mohan协议”),列明其担任首席执行官的雇用条款,该协议由本公司于合并完成时承担。根据雇佣协议,Mohan博士有权(其中包括)(I)每年490,000美元的总基本工资,(Ii)有资格获得相当于本公司从战略交易中获得的毛收入5.4%的奖金,以及(Iii)对于上一条款中的奖金 低于基本工资的50%的任何年度,额外发放基于业绩的现金奖金,使该年度的现金奖金总额达到董事会确定的基本工资的50%。雇佣协议应根据其条款终止。根据莫汉博士的雇佣协议,如果他在“控制权变更”之前或之后的2个月内或之后的12个月内被无故终止或因“好的 原因”而被终止,他有权获得(I)18个月的基本工资,(Ii)相当于他在终止发生当年的绩效奖金的奖金,除以12,然后 乘以18,以及(Iii)如果他及时根据COBRA继续投保,则支付继续投保所需的COBRA保费,直至(A)终止日期后的最早18个月,(B)他有资格获得与新就业或自雇相关的基本等值医疗保险的日期 ,或(C)他不再有资格享受COBRA继续保险的日期。 如果莫汉博士被无故终止或因与“控制权变更”不一致的“充分理由”而被解雇, 他有权获得(I)18个月的基本工资,(Ii)他被终止时所在业绩年度的任何绩效奖金, 和(Iii)如果他及时根据COBRA继续承保,支付继续承保所需的眼镜蛇保费,直至(A)终止日期后18个月,(B)他有资格获得与新就业或自雇相关的实质等值医疗保险之日,或(C)他不符合眼镜蛇继续承保资格之日。
十四行诗 于2020年1月10日与Cini博士订立经修订的雇佣协议(“Cini协议”),列明其担任首席科学官的雇用条款,该协议由本公司于合并完成时承担。根据雇佣协议,Cini博士有权(其中包括)(I)370,000美元的年度总基本工资,(Ii)有资格获得相当于本公司从战略交易中获得的毛收入1.1%的奖金,以及(Iii)对于上一条款中的奖金 低于基本工资的35%的任何年度,额外发放一笔基于业绩的现金奖金,使该年度的现金奖金总额最高可达基本工资的35%,由董事会决定。雇佣协议应根据其条款终止。根据Cini博士的雇佣协议,如果他在“控制权变更”之前或之后的2个月内或之后的12个月内因“原因”或“正当理由”而被解雇,他有权获得(I)12个月的基本工资和(Ii)如果他及时根据COBRA继续承保,支付继续承保所需的COBRA保费 直到(A)终止日期后18个月,(B)他有资格获得与新就业或自雇相关的基本同等的健康保险之日,或(C)他不符合COBRA续保资格的日期 。如果Cini博士在“原因”或不符合“控制权变更”的“充分理由”下被解雇,他有权获得(I)9个月的基本工资和(Ii)如果他及时继续在COBRA下承保,支付继续承保所需的 COBRA保费,直到(A)终止日期后12个月,(B)他有资格获得与新就业或自雇相关的实质上同等的医疗保险之日,或(C)他没有资格获得COBRA继续承保之日。
十四行诗 于二零二零年一月十日与克罗斯先生订立雇佣协议(“交叉协议”),列明其担任首席财务官的聘用条款 ,该协议由本公司于合并完成时承担。根据雇佣协议,江乐士先生有权(其中包括)(I)年度基本薪金总额365,000美元及(Ii)有资格获得董事会厘定的最高达基本薪金40%的以工作表现为基础的现金花红。雇佣协议将根据其条款终止 。根据克罗斯先生的雇佣协议,如果他在“控制权变更”之前或之后的2个月内或12个月内因“正当理由”而被解雇,他有权 获得(I)12个月的基本工资,(Ii)发生解雇的业绩年度的任何绩效奖金,以及(Iii) 如果他及时根据COBRA继续投保,支付继续投保所需的COBRA保费,直至(A)终止日期后18个月 ,(B)他有资格获得与新就业或自雇相关的基本等值健康保险的日期,或(C)他没有资格享受眼镜蛇延续保险的日期。如果克罗斯先生因“原因”或不符合“控制权变更”的“充分理由”而被解雇,他有权获得 (I)9个月的基本工资,(Ii)发生解雇的业绩年度的任何绩效奖金,以及(Iii)如果他 及时继续在COBRA下投保,支付继续投保所需的COBRA保费,直到(A)终止日期后12个月 ,(B)他有资格获得与新就业或自雇相关的基本同等的医疗保险之日,或(C)他不符合《眼镜蛇》续保资格的日期。
| 120 |
其他 协议
本公司于2020年4月1日与Dexter女士订立雇佣协议(“Dexter协议”),列明其担任首席技术官的雇佣条款。根据雇佣协议,德克斯特女士有权(其中包括)(I)每年310,000美元的基薪总额及(Ii)有资格获得董事会厘定的高达基薪35%的绩效现金花红。雇佣协议应根据其条款终止。根据德克斯特女士的雇佣协议,如果她在“控制权变更”之前或之后的2个月内因“原因”或“正当理由”而被解雇,她有权获得(I)12个月的基本工资,(Ii)她被解雇所在业绩年度的任何绩效奖金,以及(Iii)如果她及时根据COBRA继续承保,则支付继续承保所需的COBRA保费 ,直至(A)终止日期后18个月,(B)她有资格获得与新就业或自雇相关的基本同等医疗保险的日期,或(C)她不符合COBRA延续保险资格的日期。如果德克斯特女士在没有“原因”或不符合“控制权变更”的情况下被解雇,她有权获得(I)他9个月的基本工资,(Ii)她被解雇所在业绩年度的任何绩效奖金,以及(Iii)如果她及时根据COBRA继续承保,支付COBRA保费,以继续承保,直到(A)终止日期后12个月,(B)她有资格获得与新就业或自雇相关的实质上同等的医疗保险之日,或(C)她不符合COBRA继续承保资格的日期。
财政年度末未偿还的 股权奖励
下表逐个列出了有关购买普通股的未行使期权、尚未授予每位指定高管且截至2023年9月30日已发行的普通股和普通股的限制性股票的某些信息。
2023财年末未偿还的 股权奖励
| 股票 奖励 | ||||||||
| 名字 | 股权 激励计划奖励:尚未授予的未赚取的股份、单位或其他权利的数量(#) | 股权 激励计划奖励:尚未授予的未赚取的股份、单位或其他权利的市场或派息价值($) | ||||||
| Pankaj 莫汉博士 | 3,343 | (1) | 9,680 | |||||
| 约翰·西尼,博士。 | 843 | (1) | 2,420 | |||||
| Jay 克罗斯 | 705 | (2) | 2,025 | |||||
| (1) | 每个 限制性股票奖励在2024年1月1日100%授予。 |
| (2) | 每个 限制性股票单位(“RSU”)奖在2024年1月1日100%授予 |
| 121 |
董事 薪酬
非员工 董事薪酬政策
与合并相关的是,董事会批准了董事非雇员董事的新薪酬政策。除报销 出席董事会和委员会会议的合理费用外,本政策还规定以下现金 补偿:
● 每个非员工董事有权从我们那里获得35,000美元的年费;
● 我们的审计委员会主席将从我们那里获得15,000美元的年费;
● 我们的薪酬委员会主席将从我们那里获得10,000美元的年费;
● 我们的提名和公司治理委员会主席将从我们那里获得8,000美元的年费;以及
● 审计委员会、薪酬委员会和提名和公司治理委员会的每位非主席成员将分别从我们那里获得7,500美元、5,000美元和4,000美元的年费。
每位加入董事会的非雇员董事将获得一项初始期权授予,可在合并完成时购买公司已完全稀释的已发行普通股的0.080%,这将在三年内每年授予33%,第一个归属日期发生在授予日期的一年 周年纪念日。每位非员工董事还将获得年度期权授予,在合并完成时购买公司0.040%的完全稀释后已发行普通股,并将在授予日期一周年或下一次年度股东大会中较早的日期授予100%。一旦控制权发生变更,如本公司的股权激励计划所界定,这些期权相关股份的100%将在控制权变更之前归属并可行使。
除下表所列的 外,在2023财年,非雇员董事未收到任何现金或股权薪酬:
董事 薪酬
| 名字 | 赚取的费用 或 已支付 在 现金中(美元) | 库存 奖项 ($)(1) | 选择权 奖项 ($)(1) | 所有 其他 补偿 ($) | 总计 ($) | |||||||||||||||
| Nailesh 宾馆(2) | 54,000 | 3,845 | - | - | 57,845 | |||||||||||||||
| Albert Dyrness(3) | 55,500 | 3,845 | - | - | 59,345 | |||||||||||||||
| Donald 格里菲斯(4) | - | 3,278 | - | 134,048 | 137,326 | |||||||||||||||
| Raghu 拉奥(5) | 116,500 | 3,845 | - | - | 120,345 | |||||||||||||||
| Lori 麦克尼尔(6) | 70,000 | 3,845 | - | - | 73,845 | |||||||||||||||
| (1) | 代表 根据FASB ASC Topic 718计算的2023年授予的总授予日公允价值。此计算 不对与基于服务的归属相关的任何没收估计生效,但假设执行官将执行 所需的服务,以授予充分。 |
| (2) | 先生 截至2023年9月30日,Bhatt共持有171个限制性股票单位。 |
| (3) | 先生 截至2023年9月30日,Dyrness共持有171个限制性股票单位。 |
| (4) | 先生 Griffith自2019年1月1日起担任Sonnet的财务总监,自合并以来担任我们的财务总监。 上表“所有其他薪酬”项下的金额代表Griffith先生 2023财年。见下面与格里菲斯先生的就业协议的描述。格里菲斯先生总共持有146 限制性股票单位,截至2023年9月30日。 |
| (5) | 先生 截至2023年9月30日,Rao共持有171股限制性股票单位。 |
| (6) | 女士 截至2023年9月30日,McNeill共持有171股限制性股票。 |
与董事达成的其他 协议
Sonnet 于2019年1月1日与Griffith先生签订了一份雇佣协议,规定了其担任财务总监的雇佣条款。 根据雇佣协议,Griffith先生有权(除其他事项外)(i)按比例计算的年基本工资总额为150,000美元,以及(ii)有资格获得相当于工资总额25%的目标奖金。就业协议没有具体期限,构成 随意就业。
| 122 |
第 项12.某些实益所有人和管理层的担保所有权及相关股东事项。
安全 某些受益所有者和管理层的所有权
下表列载截至2023年12月11日本公司普通股实益拥有权的若干资料:(I)本公司每名现任董事;(Ii)每名被点名的行政人员;(Iii)所有现任行政人员及董事作为一个整体;及(Iv)本公司所知实益拥有本公司普通股已发行股份超过5%(5%)的每名人士。
就下表而言,实益所有权是根据适用的美国证券交易委员会规则确定的,信息为 不一定表示实益所有权用于任何其他目的。除表内附注另有注明外,本公司相信表中所列的每名个人或实体对该个人或实体实益拥有的所有本公司普通股股份拥有独家投票权及投资权(或与其配偶分享该等权力)。根据美国证券交易委员会的规则,根据可于2023年12月11日或之后60天内行使的期权(“目前可行使的期权”)可发行的本公司普通股被视为已发行股票,因此包括在表中点名的个人或实体报告为实益拥有的股份数量中,并用于计算该个人或实体实益拥有的普通股的百分比。然而,在计算任何其他个人或实体实益拥有的普通股的百分比时,这些股票不被视为流通股。
下表所列每个个人或实体实益拥有的普通股的百分比是基于截至2023年12月11日已发行和已发行的普通股3,069,516股,加上该个人或实体持有的任何因行使目前可行使的期权而可发行的股份。
第 个标题 班级 | 受益人姓名或名称及地址* | 受益所有权的金额和性质 | 班级百分比 | |||||||
| 任命了 名高管和董事: | ||||||||||
| Pankaj Mohan博士 | 131,322 | (1) | 4.2 | % | ||||||
| Nailesh 巴特 | 1,396 | (2) | ** | |||||||
| 艾伯特·戴尔内斯 | 1,316 | (3) | ** | |||||||
| 唐纳德·格里菲斯 | 468 | (4) | ** | |||||||
| 拉古 拉奥 | 47,117 | (5) | 1.5 | % | ||||||
| 洛莉 麦克尼尔 | 171 | (6) | ** | |||||||
| 约翰·K·西尼博士。 | 1,830 | ** | ||||||||
| Jay 克罗斯 | 1,087 | (7) | ** | |||||||
| 全体 现任执行干事和董事(10人) | 187,064 | 5.9 | % | |||||||
| 5% 持有者 | ||||||||||
| 约翰·马基 | 231,115 | 7.5 | % | |||||||
| (*) | 除非 除非另有说明,地址为Sonnet BioTherapeutics,Inc.,100俯瞰中心,套房102,普林斯顿,新泽西州,08540。 |
| (**) | 不到1%。 |
| (1) | 包括 (i)Mohan家族办公室持有的3,021股普通股,Mohan博士与 Swati Mohan,他的配偶,以及(ii)Mohan博士的孩子Pankhuri Mohan个人持有的25股普通股, 莫汉博士与潘库里·莫汉分享投票和处置权。包括68,750股普通股,目前可发行于 认股权证的行使。 |
| 123 |
| (2) | 包括 171个限制性股票单位,将以普通股股份结算,并于2023年12月11日起60天内归属。 |
| (3) | 包括 171个限制性股票单位,将以普通股股份结算,并于2023年12月11日起60天内归属。 |
| (4) | 包括 146个限制性股票单位,将以普通股股份结算,并于2023年12月11日起60天内归属。 |
| (5) | 包括 31,250股普通股可于2023年12月11日起60天内行使认股权证时发行。包括 171个限制性股票单位,将以普通股股份结算,并于2023年12月11日起60天内归属。 |
| (6) | 包括 171个限制性股票单位,将以普通股股份结算,并于2023年12月11日起60天内归属。 |
| (7) | 不包括 705个限制性股票单位,将以普通股股份结算,并于2023年12月11日起60天内归属。 |
权益 薪酬计划信息
下表提供了截至2023年9月30日的有关可能根据公司现有股权薪酬计划(包括2020年综合股权激励计划(“2020年计划”))发行的公司普通股股份的信息。
| 权益 薪酬计划信息 | ||||||||||||
| 计划 类别 | (a) 证券数量 到 予发行 关于 未行使的期权、认股权证 和 权利 | (b) 加权 平均值 执行 价格 未偿还 期权、认股权证 和 权利 | (c) 证券数量 剩余的 可用于 未来 发行 在 权益下 薪酬 计划 (不包括证券 第(A)栏反映了 ) | |||||||||
| 股权 证券持有人批准的薪酬计划(1) | 2,326 | 不适用 | - | |||||||||
| 股权 未经证券持有人批准的薪酬计划 | 不适用 | 不适用 | 不适用 | |||||||||
| 总计 | 2,326 | - | - | |||||||||
| (1) | 由于 RSU没有行权价格,因此加权平均行权价格不反映与RSU结算相关的将发行的股份。截至2023年9月30日,除RSU外,我们的股权补偿计划中没有未偿还的期权、认股权证或权利。 |
| 124 |
第 项13.某些关系和关联交易,以及董事独立性。
除指定高管和董事的薪酬安排外,本公司还介绍了自2022财年开始以来本公司参与或将参与的每笔交易和一系列类似交易,其中:
| ● | 所涉金额超过或将超过12万美元或较小报告公司过去两个完整财政年度年底总资产平均值的百分之一,两者以较小者为准;以及 |
| ● | 本公司任何董事、董事的被提名人、高管或持有超过5%的本公司普通股的 任何成员或上述人士的任何直系亲属曾经或将会拥有直接或间接的重大利益。 |
薪酬 本公司指定高管及董事的薪酬安排载于“高管薪酬”一节。
公开服务
我们的董事长兼首席执行官Pankaj Mohan购买了34,375股普通股和68,750股认股权证,以购买68,750股普通股 根据美国以每股1.60美元的价格进行的承销公开发行,并伴随着两份认股权证。此次发售 于2023年10月27日结束。
董事的拉古·拉奥购买了15,625股普通股和31,250股认股权证,以购买31,250股普通股。此次发行于2023年10月27日结束。
赔偿协议
公司已与每一位现任董事和高管签订了赔偿协议。这些协议将 要求公司在特拉华州法律允许的最大范围内赔偿这些个人因向公司提供服务而可能产生的责任,并预支因起诉他们而产生的费用,因为他们 可能会得到赔偿。该公司还打算与其未来的董事和高管签订赔偿协议。
董事 独立
公司目前由一个六人董事会管理。本公司已确定,巴特先生、戴尔尼斯先生、拉奥先生和麦克尼尔女士是“独立的”,这一术语是根据纳斯达克股票市场规则定义的。
| 125 |
第 项14.总会计师费用和服务
下表汇总了毕马威会计师事务所、本公司的独立注册会计师事务所(以及合并前的十四行诗)在过去两个会计年度各自每年提供的专业服务费用:
| 费用 类别 | 2023 | 2022 | ||||||
| 审计费用 | $ | 540,000 | $ | 435,000 | ||||
| 与审计相关的费用 | - | - | ||||||
| 税 手续费 | 61,565 | 33,500 | ||||||
| 所有 其他费用 | - | - | ||||||
| 总费用 | $ | 601,565 | $ | 468,500 | ||||
审计费用
代表与审计公司年度综合财务报表和审查公司季度中期综合财务报表相关的专业服务费用,以及与注册报表、慰问函和同意书相关的费用。
与审计相关的费用
我们 在2023年或2022年没有从我们的独立审计师那里产生任何与审计相关的费用。
税 手续费
税务 费用与税务合规、税务咨询、税务规划和税务准备服务相关。
所有 其他费用
与总会计师提供的产品和服务有关的费用,但不包括上述各节所报告的服务。
审计委员会负责任命、确定薪酬和监督独立审计师的工作。审计委员会 需要审查和批准保留独立审计师的提议,以执行其章程中概述的任何拟议的审计和非审计服务 。审计委员会没有在其章程之外制定关于预先批准审计和非审计相关服务的政策和程序。根据《交易法》第10A条的要求,我们的审计委员会已授权毕马威有限责任公司在2023年至2022年期间提供的所有审计和非审计服务以及为这些服务支付的费用。但是,如果符合《交易法》第10A(I)(1)(B)节的“最低限度”条款,则可免除为公司提供非审计服务的预先审批要求 。
审计委员会已考虑上述与审计相关的费用、税费和所有其他费用的提供是否符合保持毕马威会计师事务所的独立性,并已确定2023年和2022年的此类服务是兼容的。 所有此类服务均经审计委员会根据交易所法案S-X法规第2-01条批准,但 规则适用。
审计委员会负责与管理层审查和讨论经审计的合并财务报表,与独立注册会计师讨论上市公司会计监督委员会第1301号审计准则所要求的事项与审计委员会的沟通根据上市公司会计监督委员会的适用要求,收到独立注册会计师关于独立注册会计师与审计委员会就独立性进行沟通的书面披露 ,并与独立注册会计师讨论其独立性,并建议董事会将经审计的合并财务报表纳入本公司的10-K表格年度报告。
| 126 |
第四部分
第 项15.物证、财务报表附表。
(a)(1) 财务报表。作为本报告一部分提交的财务报表列于综合财务报表索引 。
(a)(2) 财务报表明细表。表被省略是因为它们不适用,或者所需信息显示在合并财务报表或附注中。
(a)(3) 展品。请参考《展品索引》。本年度报告以表格10-K的形式包含或通过引用并入本年度报告,并根据S-K法规第601项进行编号。
第 项16.表格10-K摘要。
没有。
| 127 |
签名
根据1934年《证券交易法》第13或15(D)节的要求,注册人已正式促使本报告由经正式授权的签署人代表其签署。
十四行诗 生物治疗公司 (注册人) | |
| 日期: 2023年12月14日 | /s/ Pankaj Mohan,博士 |
| Pankaj 莫汉博士 | |
总裁 和首席执行官 (首席执行官和 及时 授权签字人) | |
| 日期: 2023年12月14日 | /s/ 杰伊·克罗斯 |
| Jay 克罗斯 | |
首席财务官 (首席财务会计官 ) |
签名 和委托书
通过这些陈述,兹确认以下签名的每一位人士构成并任命Pankaj Mohan,Ph.D.和Jay Cross, 以及他们中的每一个人,他的真实和合法的代理人,代理人和代理人,具有完全的替代和重新替代的权力,以他的名义,地点和代替,以任何和所有身份,(i)采取行动,签署并向证券交易委员会 提交本年度报告的任何和所有修订,表格10-K,连同所有附表和附件,(ii)采取行动,签署和存档 与此相关的必要或适当的证书,文书,协议和其他文件,(iii) 采取任何和所有必要或适当的行动,尽可能完全出于所有意图和目的,他可以或可以亲自做,特此批准,批准和确认所有该代理人,代理人和实际代理人或其任何替代人可以合法地进行或导致进行。
根据 《1934年证券交易法》的要求,本报告已由以下人员代表注册人 签署,其身份和日期均已注明。
| 签名 | 标题 | 日期 | ||
| /s/ Pankaj Mohan,博士 | 总裁,首席执行官兼董事长 | 2023年12月14日 | ||
| Pankaj 莫汉博士 | (首席执行官 ) | |||
| /s/ 杰伊·克罗斯 | 首席财务官 | 2023年12月14日 | ||
| Jay 克罗斯 | (首席财务会计官 ) | |||
| /S/ 阿尔伯特·戴尔尼斯 | 董事 | 2023年12月14日 | ||
| 艾伯特·戴尔内斯 | ||||
| /S/ 纳伊莱什·巴特 | 董事 | 2023年12月14日 | ||
| Nailesh 巴特 | ||||
| /S/ 拉古拉奥 | 董事 | 2023年12月14日 | ||
| 拉古 拉奥 | ||||
| /S/ 唐纳德·格里菲斯 | 董事 | 2023年12月14日 | ||
| 唐纳德·格里菲斯 | ||||
| /S/ 洛里·麦克尼尔 | 董事 | 2023年12月14日 | ||
| 洛莉 麦克尼尔 | ||||
| 128 |
展品索引
展品 不是的。 |
描述 | |
| 2.1 | 协议 和合并计划,日期为2019年10月10日,由公司和公司之间,十四行诗子公司。和合并子公司(作为公司于2019年10月11日提交的表格8-K当前报告的附件2.1提交,并通过引用并入本文)。# | |
| 2.2 | 本公司、十四行子公司和合并子公司之间于2020年2月7日对合并协议和计划的第1号修正案(作为2020年2月7日提交的公司当前8-K报表的附件2.1提交,并通过引用并入本文)。 | |
| 2.3 | Sonnet BioTreateutics,Inc.和Relipment Treateutics Holding SA之间的股票交换协议,日期为2019年8月9日(通过引用该公司于2019年11月27日提交给美国证券交易委员会的S-4表格注册声明的附件2.10纳入)。# | |
| 3.1 | 经修订的Sonnet BioTreateutics Holdings,Inc.公司注册证书(通过引用公司于2020年12月17日提交给美国证券交易委员会的10-K表格年度报告的附件3.1合并而成)。 | |
| 3.2 | 3系列优先股的优先股、权利和限制指定证书(通过引用合并到我们于2022年8月15日提交给美国证券交易委员会的8-K表格当前报告的附件3.1)。 | |
| 3.3 | 4系列优先股的优先股、权利和限制指定证书(通过引用合并到我们于2022年8月15日提交给美国证券交易委员会的8-K表格当前报告的附件3.2)。 | |
| 3.4 | Sonnet BioTreateutics Holdings,Inc.于2022年9月16日修订的注册证书修正案证书(通过引用附件3.1并入我们于2022年9月19日提交给美国证券交易委员会的当前8-K表格报告中)。 | |
| 3.5 | 日期为2023年8月31日的Sonnet BioTreateutics Holdings,Inc.公司注册证书修正案证书(通过引用附件3.1并入我们于2023年9月1日提交给美国证券交易委员会的当前8-K表格报告中)。 | |
| 3.6 | 修订和重新修订了Sonnet BioTreateutics Holdings,Inc.的章程(通过引用附件3.3并入我们于2022年8月15日提交给美国证券交易委员会的 Form 8-K的当前报告中)。 | |
| 4.1 | 普通股证书表格 (于2011年12月2日向美国证券交易委员会备案的我们的S-1表格注册说明书附件4.1(注册号: 333-178307))。 | |
| 4.2 | 2017年5月4日的认股权证表格 (通过引用附件4.2并入我们于2017年5月5日提交给美国证券交易委员会的当前8-K表格报告中)。 | |
| 4.3 | 剥离 实体认股权证,日期为2020年4月1日(通过引用附件4.1并入公司于2020年4月3日提交给美国证券交易委员会的当前8-K表格报告 )。 | |
| 4.4 | Sonnet BioTreateutics,Inc.转换的Form (通过引用公司于2020年8月14日提交给美国证券交易委员会的Form 10-Q季度报告的附件4.2并入)。 | |
| 4.5 | A/B系列认股权证表格 (参考公司于2020年2月7日向美国证券交易委员会提交的S-4/A表格注册说明书附件4.16)。 | |
| 4.6 | C系列认股权证的表格 (通过参考我们于2020年8月4日提交给美国证券交易委员会的当前8-K表格报告的附件4.1并入)。 | |
| 4.7 | 登记 本公司与其中所列若干投资者之间于2020年2月7日订立的配股协议(以引用方式并入本公司于2020年2月7日提交予美国证券交易委员会的S-4/A表格注册说明书附件4.17)。 |
| 129 |
| 4.8 | 证券说明 * | |
| 4.9 | 日期为2021年8月24日的预筹资权证表格 (通过参考2021年8月25日提交给美国证券交易委员会的公司当前报告的8-K表格的附件4.2并入)。 | |
| 4.10 | 日期为2021年8月24日的承销商认股权证表格 (参照本公司于2021年8月16日向美国证券交易委员会提交的S-1/A表格注册说明书的附件4.9并入)。 | |
| 4.11 | 日期为2021年8月24日的普通权证表格 (通过引用本公司2021年8月25日提交给美国证券交易委员会的8-K表格的附件4.4并入)。 | |
| 4.12 | 日期为2023年2月10日的预融资认股权证表格 (通过引用附件4.2并入我们于2023年2月13日向美国证券交易委员会提交的当前8-K表格报告中)。 | |
| 4.13 | 日期为2023年2月10日的承销商认股权证表格 (通过引用我们于2023年2月13日向美国证券交易委员会提交的当前8-K表格报告的附件4.3并入)。 | |
| 4.14 | 日期为2023年2月10日的普通权证表格 (通过引用附件4.4并入我们于2023年2月13日向美国证券交易委员会提交的当前报告中的表格8-K)。 | |
| 4.15 | 日期为2023年6月30日的预融资认股权证表格 (通过参考2023年6月30日提交给美国证券交易委员会的当前8-K表格报告的附件4.1并入)。 | |
| 4.16 | 日期为2023年6月30日的授权书表格 (通过引用附件4.2并入2023年6月30日提交给美国证券交易委员会的当前8-K表格报告中)。 | |
| 4.17 | 2023年6月30日的配售代理认股权证表格(通过参考2023年6月30日提交给美国证券交易委员会的8-K表格当前报告的附件4.3并入)。 | |
| 10.1 | GEM Global Year Fund LLC SCS与Sonnet BioTreateutics,Inc.于2019年8月6日签订的普通股购买协议(通过引用2019年11月27日提交给美国证券交易委员会的公司S-4表格注册说明书附件10.54纳入该协议)。 | |
| 10.2 | GEM Global Year Fund LLC SCS与Sonnet BioTreateutics,Inc.于2019年9月25日签订的普通股购买协议修正案(通过引用2019年11月27日提交给美国证券交易委员会的公司S-4表格注册说明书附件10.55而并入)。 | |
| 10.3 | GEM Global Year Fund LLC SCS,Sonnet BioTreateutics,Inc.和Chancleer Holdings,Inc.于2020年2月7日签订的普通股购买协议第 面函件和修正案2(通过引用2020年2月7日提交给美国证券交易委员会的公司注册表格S-4中的附件10.60并入)。 | |
| 10.4 | Pankaj Mohan和Sonnet BioTreateutics,Inc.于2018年12月31日签订的雇佣协议(通过参考2020年2月7日提交给美国证券交易委员会的公司S-4表格注册声明的附件10.56而并入)。† | |
| 10.5 | John Cini和Sonnet BioTreateutics,Inc.于2020年1月10日签订的雇佣协议(通过引用附件10.58纳入公司于2020年2月7日提交给美国证券交易委员会的S-4表格注册声明中的附件10.58)。† | |
| 10.6 | Jay Cross和Sonnet BioTreateutics,Inc.之间的雇佣协议,日期为2020年1月10日(通过引用附件10.57纳入公司于2020年2月7日提交给美国证券交易委员会的S-4表格注册声明中的附件10.57)。† | |
| 10.7 | 苏珊·德克斯特与公司签订的雇佣协议,日期为2020年4月1日(通过引用附件10.7并入公司于2020年4月3日提交给美国证券交易委员会的当前8-K表格报告中)。† |
| 130 |
| 10.8 | 唐纳德·格里菲斯与Sonnet BioTreateutics,Inc.于2019年1月1日签署的要约函(通过引用公司于2020年2月7日提交给美国证券交易委员会的S-4表格注册声明的附件10.59而并入)。† | |
| 10.9 | 十四行诗 生物治疗控股公司2020年综合性股权激励计划(通过引用公司于2020年5月20日提交给美国证券交易委员会的S-8表格注册说明书的附件4.2纳入)。† | |
| 10.10 | 限制性股票单位奖表格 (参考我们于2020年7月9日提交给美国证券交易委员会的8-K表格(文件号:001-35570)附件10.1并入)。† | |
| 10.11 | 许可证 ARES Trading SA和Relipment Treeutics SA之间的协议,日期为2015年8月28日(通过引用公司于2020年2月7日提交给美国证券交易委员会的S-4表格注册声明的附件10.51而并入)。* | |
| 10.12 | Discovery XOMA(US)LLC和Oncobiologics,Inc.于2012年7月23日签署的合作协议(通过引用附件10.52并入该公司于2020年2月7日提交给美国证券交易委员会的S-4表格注册声明中)。* | |
| 10.13 | XOMA(US)LLC和Sonnet BioTreateutics,Inc.于2019年5月7日签订的Discovery合作协议修正案(合并于 参考该公司于2020年2月7日提交给美国证券交易委员会的S-4表格注册声明附件10.53)。* | |
| 10.14 | 证券购买协议,日期为2020年2月7日,由强第克利尔控股公司、十四网生物治疗公司及其投资者 方签署(通过引用2020年2月7日提交给美国证券交易委员会的公司S-4表格注册说明书第10.64号附件纳入)。 | |
| 10.15 | 由Sonnet BioTreateutics Holdings, Inc.和持有人(通过引用附件10.1并入我们于2020年8月4日提交给美国证券交易委员会的当前8-K表格(文件编号001-35570)中),于2020年8月3日由Sonnet BioTreateutics Holdings和持有人之间签署的认股权证行使和综合修订协议表格 。 | |
| 10.16 | Sonnet BioTreateutics Holdings,Inc.的转让和假设雇佣协议,2020年4月1日生效(通过引用并入该公司于2020年12月17日提交给美国证券交易委员会的Form 10-K年度报告的附件10.16)。† | |
| 10.17 | Pankaj Mohan与本公司于2020年11月23日签订的高管聘用协议第1号修正案(通过引用并入本公司于2020年12月17日提交给美国证券交易委员会的Form 10-K年度报告附件10.17)。† | |
| 10.18 | 约翰·西尼与公司于2020年11月23日签订的高管聘用协议的第1号修正案(通过引用2020年12月17日提交给美国证券交易委员会的公司10-K表格年度报告的附件10.18纳入)。† | |
| 10.19 | 赔偿协议表格 (通过引用公司于2020年12月17日提交给美国证券交易委员会的10-K表格年度报告的附件10.19并入)。† | |
| 10.20 | 本公司与必和必拓于2020年2月5日签订的场外销售协议(于2021年2月5日提交给美国证券交易委员会的8-K表格(文件编号001-35570)引用附件1.1并入其中)。 | |
| 10.21 | 许可证 Sonnet BioTherapeutics,Inc.与Sonnet BioTherapeutics,Inc.和New Life Therapeutics PTE,LTD(通过引用并入 我们于2021年5月17日向SEC提交的10-Q表格季度报告的附件10.1)。 | |
| 10.22 | 第一个 Sonnet BioTherapeutics,Inc.与Sonnet BioTherapeutics,Inc.于2021年6月11日签署的许可协议修正案和New Life Therapeutics PTE,LTD(注册成立 参考我们于2021年12月17日向SEC提交的10-K表格年度报告的附件10.22)。 | |
| 10.23 | 第二次 Sonnet Biotherapeutics CH SA、Sonnet BioTherapeutics,Inc.于2021年7月7日签署的许可协议修正案新生活(New Life) Therapeutics PTE,Ltd.(通过引用并入我们于 年12月向SEC提交的10-K表格年度报告的附件10.23) 17,2021)。 | |
10.24
|
修正案 ARES TRADING SA和Sonnet BioTherapeutics CH SA(注册成立 )于2021年11月1日签订的许可协议和和解协议 参考我们于2021年12月17日向SEC提交的10-K表格年度报告的附件10.24)。 |
| 131 |
| 10.25 | 在市场上 公司与BTIG签订的销售协议,日期为2022年8月15日(通过引用纳入我们当前报告的附件1.1 于2022年8月15日向SEC提交的8-K表格)。 | |
| 10.26 | 承保 公司与Chardan Capital Markets,LLC于2023年2月8日签订的协议(通过参考附件1.1合并 我们于2023年2月13日向SEC提交的8-K表格的当前报告)。 | |
| 10.27 | 表格 证券购买协议,日期为2023年6月28日,由本公司和 买方(通过引用纳入我们提交的表格8-K的当前报告的附件10.1 于2023年6月30日与SEC签署)。 | |
| 21.1 | 子公司 公司的 * | |
| 23.1 | 同意 毕马威会计师事务所 * | |
| 24.1 | 功率 (见签名页)* | |
| 31.1 | 认证 根据1934年证券交易法颁布的规则13 a-14(a)和15 d-14(a), 经修订的 * | |
| 31.2 | 认证 根据1934年证券交易法颁布的规则13 a-14(a)和15 d-14(a), 经修订的 * | |
| 32.1 | 认证 根据18 U.S.C.第1350条,根据 年《萨班斯-奥克斯利法案》第906条通过 2002年 ** | |
| 32.2 | 认证 根据18 U.S.C.第1350条,根据 年《萨班斯-奥克斯利法案》第906条通过 2002年 ** | |
| 97.1 | 追回政策 * | |
| 101.INS | 内联 XBRL实例文档-实例文档不显示在交互式数据文件中,因为它的XBRL标记嵌入在 内联XBRL文档。* | |
| 101.SCH | 内联 XBRL分类扩展架构文档。* | |
| 101.CAL | 内联 XBRL分类扩展计算链接库文档。* | |
| 101.DEF | 内联 XBRL分类扩展定义链接库文档。* | |
| 101.LAB | 内联 XBRL分类扩展标签链接库文档。* | |
| 101.PRE | 内联 XBRL分类扩展演示链接库文档。* | |
| 104 | 封面 页面交互式数据文件(格式为内联XBRL,包含在附件101中)。* |
| * | 随函存档。 |
| ** | 随函提供。 |
| *** | 兹存档;根据S-K法规第601(B)(10)项的规定,部分展品已被省略。任何遗漏部分的副本 将根据要求提供给证券交易委员会。 |
| # | 根据S-K法规第601(B)(2)项,本协议的附表和证物已被省略。如有任何遗漏的时间表和/或证物,应要求提供给美国证券交易委员会。 |
| † | 表示 管理合同或补偿计划、合同或安排。 |
| 132 |