美国
美国证券交易委员会
华盛顿特区,20549
表格
(标记一)
或
截至本财政年度止
或
的过渡期 至
或
需要此空壳公司报告的事件日期
委托文件编号:
(注册人的确切姓名载于其章程和注册人姓名的英文翻译)
(注册成立或组织的司法管辖权)
(主要执行办公室地址)
电话:
(姓名、电话、电子邮件和/或传真号码 和公司联系人地址)
根据该法第12(B)节登记或将登记的证券。
| 每个班级的标题 | 交易代码 | 注册的每个交易所的名称 | ||
| 这个 |
根据该法第12(G)节 登记或将登记的证券。无
根据该法第15(D)节负有报告义务的证券 。无
截至2023年6月30日,已发行普通股数量为
用复选标记表示注册人是否为证券法第405条规定的知名经验丰富的发行人。☐:是,☒:
如果此报告是年度报告或过渡报告,
请用复选标记表示注册人是否不需要根据1934年《证券交易法》第13或15(D)节提交报告。
☐:是,☒:
勾选标记表示注册人
(1)是否已在前12个月内(或注册人被要求提交此类报告的较短时间内)提交了1934年《证券交易法》第13或15(D)节要求提交的所有报告,以及(2)在过去90天内是否符合此类提交要求。-☒
用复选标记表示注册人
是否在过去12个月内(或在注册人被要求提交此类文件的较短时间内)以电子方式提交了根据S-T规则405(本章232.405节)要求提交的每个交互数据文件。-☒
用复选标记表示注册者 是大型加速文件服务器、加速文件服务器、非加速文件服务器还是新兴成长型公司。请参阅《交易法》第12b-2条规则中“大型加速申请者”、“加速申请者”和“新兴成长型公司”的定义。
| 大型数据库加速的文件管理器 | ☐ | 加速文件管理器 | ☐ |
| ☐ | 新兴市场和成长型公司 |
如果是按照美国公认会计原则编制
财务报表的新兴成长型公司,请通过复选标记表明注册人是否选择不使用延长的过渡期
来遵守根据《交易法》第13(a)节规定的任何新的或修订的财务会计准则。
用复选标记表示注册人
是否已提交报告并证明其管理层根据《萨班斯-奥克斯利法案》(《美国法典》第15编第7262(B)节)第404(B)条对其财务报告进行内部控制的有效性的评估,该报告是由编制或发布其审计报告的注册会计师事务所进行的。
如果证券是根据该法第12(B)条登记的,请用复选标记表示备案文件中包括的注册人的财务报表是否反映了对以前发布的财务报表的错误更正。
勾选任何错误更正是否是重述,要求对注册人的任何执行官在相关恢复期内根据§240.10D-1(b)收到的基于激励的薪酬 进行恢复分析。☐
用复选标记表示注册人使用了哪种会计基础来编制本备案文件中包含的财务报表:
| 美国《公认会计准则》和☐ | 其他客户:☐ |
如果 在回答上一个问题时勾选了“其他”,请通过勾选标记指明注册人选择遵循的财务报表项目。 第17项第18项
如果这是年度报告,请通过勾选
标记表明注册人是否为空壳公司(如《交易法》第12 b-2条所定义)。 是的
目录
| 第一部分 | 1 | |
| 第1项。 | 董事、高级管理人员和顾问的身份 | 1 |
| 第二项。 | 优惠统计和预期 时间表 | 1 |
| 第三项。 | 关键信息 | 1 |
| 第四项。 | 关于公司的信息 | 26 |
| 项目4a。 | 未解决的员工意见 | 77 |
| 第五项。 | 运营和财务 回顾和展望 | 77 |
| 第六项。 | 董事、高级管理人员和员工 | 84 |
| 第7项。 | 大股东和关联方交易 | 92 |
| 第八项。 | 财务信息 | 93 |
| 第九项。 | 报价和挂牌 | 93 |
| 第10项。 | 附加信息 | 94 |
| 第11项。 | 关于市场风险的定量和定性披露 | 105 |
| 第12项。 | 除股权证券外的其他证券说明 | 106 |
| 第II部 | 108 | |
| 第13项。 | 违约、股息拖欠 和拖欠 | 108 |
| 第14项。 | 对担保持有人权利和收益使用的实质性修改 | 108 |
| 第15项。 | 控制和程序 | 108 |
| 第16项。 | 已保留 | 108 |
| 项目16a。 | 审计委员会财务 专家 | 108 |
| 项目16B。 | 道德守则 | 108 |
| 项目16C。 | 首席会计师费用 和服务 | 109 |
| 项目16 d. | 豁免上市 审计委员会标准 | 109 |
| 项目16 e. | 购买权益证券 发行人和关联购买人 | 109 |
| 项目16 f. | 更改注册人的认证会计师 | 109 |
| 项目16 g. | 公司治理 | 110 |
| 项目16 h. | 煤矿安全信息披露 | 110 |
| 项目16 i. | 关于外国的披露 妨碍检查的司法管辖区 | 110 |
| 项目16J | 内幕交易政策 | 110 |
| 项目16 K | 网络安全 | 110 |
| 第三部分 | 111 | |
| 第17项。 | 财务报表 | 111 |
| 第18项。 | 财务报表 | 111 |
| 项目19. | 陈列品 | 112 |
i
引言
Incannex Healthcare Limited 于2001年根据澳大利亚法律注册成立。我们的普通股自2016年起在澳大利亚证券交易所(“ASX”)上市,自2022年2月起以美国存托股份(“ADS”)的形式在纳斯达克全球市场上市, 每股ADS代表25股普通股。德意志银行信托公司美洲公司担任美国存托股份的存托人。
如本年度报告 表格20-F中所用,除非另有说明,否则术语“我们”、“我们的”、“英康耐克斯”和“公司”是指 英康耐克斯医疗有限公司及其子公司。
财务和其他信息
本年度报告中的20-F表格中的合并财务 报表以澳元为单位,并按照国际会计准则理事会(“IASB”)发布的国际财务 报告准则(“IFRS”)编制。本年度报告中的 合并财务报表采用20-F表格,符合IFRS和澳大利亚会计准则。在本 年度报告中,所有提及的“美元”或“US$”均指美国货币,所有提及的 “澳元”或“$”或“A$”均指澳大利亚货币。
在本年度报告中, 术语“财政”是指从7月1日开始到次年6月30日结束的财政年度。
本年度 报告表20-F中关于任何合同、协议或其他文件内容的声明是此类合同、协议或 文件的摘要,并非对其所有条款的完整描述。如果我们将任何这些文件作为本年度报告 或我们之前提交的任何注册声明的附件提交,您可以阅读文件本身以了解其条款的完整描述。
关于前瞻性陈述的特别说明
除本年度报告中包含的历史 信息外,本年度报告中包含的陈述均为“前瞻性 陈述”,反映了我们对未来事件和财务业绩的当前看法。我们敦促您考虑使用术语“预期”、“相信”、“不相信”、“预期”、“计划"、 “打算”、“估计”和类似表述的陈述 旨在识别前瞻性陈述,这些前瞻性 陈述包括但不限于与以下内容相关的任何陈述:
| ● | 我们的产品开发和业务战略,包括我们产品的潜在市场规模以及我们产品和疗法在我们市场的未来开发和/或扩展; |
| ● | 我们的研究和开发活动,包括临床试验和生产以及相关成本和时间; |
| ● | 大流行病可能对业务运营造成的影响; |
| ● | 我们的现金资源是否充足; |
| ● | 我们将产品商业化并创造产品收入的能力; |
| ● | 我们有能力在需要时筹集额外资金; |
| ● | 有关预期监管活动或许可或合作安排的任何声明,包括我们获得监管许可的能力; |
| ● | 我们的研发费用; |
| ● | 我们的知识产权;以及 |
| ● | 任何前述假设的陈述。 |
我们提醒投资者,前瞻性 陈述仅为预测,因此固有地受到不确定性和其他因素的影响,涉及已知和未知风险 ,这些风险可能会导致实际结果、业绩、活动水平、我们的成就或行业结果与此类前瞻性陈述明示或暗示的任何未来结果、表现、活动水平或我们的成就大不相同。 敬请投资者不要过度依赖这些前瞻性陈述,这些前瞻性陈述仅在本新闻稿发布之日起使用。除适用法律(包括美国证券法)要求的 以外,我们没有义务公开发布对任何前瞻性陈述的任何 更新或修订,以反映新信息、未来事件或情况,或在本声明的 日期之后的其他情况。请参阅“项目3.关键信息-D.风险因素”中出现的风险因素部分。
II
第一部分
| 第1项。 | 董事、高级管理人员和顾问的身份 |
| A. | 董事和高级管理人员 |
不适用。
| B. | 顾问 |
不适用。
| C. | 审计师 |
不适用。
| 第二项。 | 优惠统计数据和预期时间表 |
不适用。
| 第三项。 | 关键信息 |
| A. | [已保留] |
| B. | 大写 |
不适用。
| C. | 提供和使用收益的原因 |
不适用。
| D. | 风险因素 |
以下风险与我们的业务相关,应慎重考虑。我们的业务、财务状况和经营结果可能会受到以下任何风险的影响。因此,我们普通股和美国存托股票(ADS)的交易价格可能会下跌,持有者可能会损失部分或全部投资。
1
与我们的业务相关的风险
我们有运营亏损的历史,未来可能无法实现或保持盈利.
自成立以来,我们经历了重大的经常性运营亏损和来自运营活动的负现金流。例如,在截至2023年和2022年6月30日的财年中,我们的综合亏损总额分别为2,000万澳元和1,490万澳元,我们的运营活动现金流分别为负1,590万澳元和1,280万澳元。截至2023年6月30日,我们累计亏损7880万澳元。
我们是一家临床阶段药物开发公司,因此我们的候选药物能否成功尚不确定。我们专注于医用合成大麻二醇药物和迷幻药物治疗。
我们预计,在可预见的未来,手术将继续蒙受损失,随着更多的患者被招募进行临床试验,未来药物开发的成本将会增加。特别是,我们预计我们的候选药物的开发将继续遭受重大损失。 由于与我们的候选药物的开发、制造、销售和营销相关的众多风险和不确定性,我们未来可能会经历比预期更大的亏损,并且可能永远不会盈利。
此外,我们或我们的开发合作伙伴可能无法完成当前候选药物的开发或开发其他 医药产品,这是一个很大的风险。它们可能都不会成功商业化,这可能会阻止我们实现 盈利。
如果我们的资金来源不足,我们的研发活动可能会受到不利影响.
我们预计与我们的临床试验开发相关的成本 将会增加,我们将需要额外的资金来实现我们的长期目标: 商业化和进一步开发我们的候选药物。此外,我们将需要资金进行监管申请, 保护知识产权,合同制造能力,发展营销和销售能力,并为运营费用提供资金。 我们打算通过公共或私人融资和/或通过许可我们的资产或与公司合作伙伴达成其他安排来寻求此类额外资金。 但是,此类融资、许可机会或其他安排可能无法以可接受的条款从任何来源获得 ,或者根本无法获得。任何资金短缺都可能导致我们不得不削减或停止我们的研发活动,从而对我们的业务、财务状况和运营结果产生不利影响。
此外,由于与我们的候选药物开发相关的许多风险和不确定性,我们无法预测研发成本增加的时间或金额,也无法预测我们何时或是否能够实现或保持盈利。如果适用的监管机构要求在目前预期的基础上进行进一步的研究,我们的成本可能会大幅增加 。 无论如何,即使我们的候选药物获准商业化销售,我们预计也会产生与此类候选药物的商业推出相关的巨额成本,并且不能保证我们会产生可观的收入。
我们目前没有产品收入来源 ,可能永远不会盈利。
我们的候选药物 都没有获得商业销售的批准,我们预计需要几年时间才能批准任何候选药物,然后我们就可以开始销售我们的候选药物了。到目前为止,我们还没有从我们的候选药物的许可或商业化中获得任何收入,预计在未来几年内也不会从他们那里获得收入。在我们的候选药物单独或与未来的合作伙伴成功完成临床试验、获得监管部门的批准并成功商业化之前,我们将无法产生产品 收入。尽管我们可能寻求从与第三方的协作或许可协议中获得收入,但我们目前没有此类协议可以为我们提供大量持续的未来收入,并且我们可能永远不会签订任何此类协议。
2
我们将需要额外的资金,并且 可能无法筹集足够的资金,这可能会对我们的研发计划或候选药物的商业化产生实质性影响 。
我们历来将 大部分财务资源用于研发,包括临床前和临床开发活动。到目前为止,我们已经通过股权融资为我们的运营提供了大量资金。我们未来的净亏损额将部分取决于 我们未来的支出率以及我们通过股权或债务融资或战略合作获得资金的能力。此类未来净亏损的 金额以及未来盈利的可能性也将取决于我们能否成功开发和 商业化能够产生可观收入的产品。如果我们无法实现并保持盈利, 美国存托股份的价值将受到抑制,并可能削弱我们筹集资金、扩大业务、维持研发努力、 产品多样化甚至继续运营的能力。
我们预计,在可预见的未来,我们的费用 将大幅增加,如果我们:
| ● | 继续我们对候选药物的研究和临床前和临床开发; |
| ● | 扩大我们目前针对候选药物的拟议临床研究的范围; |
| ● | 为我们的候选药物启动额外的临床前、临床或其他研究; |
| ● | 更换或增加更多的制造商或供应商; |
| ● | 为我们成功完成临床研究的候选药物寻求监管和市场批准; |
| ● | 寻求确定和验证更多的候选药物; |
| ● | 收购或许可其他候选药物和技术; |
| ● | 维护、保护和扩大我们的知识产权组合; |
| ● | 吸引和留住技术人才; |
| ● | 创建额外的基础设施,以支持我们作为上市公司的运营以及我们的产品开发和计划的未来商业化努力; |
| ● | 增加一支内部销售队伍;以及 |
| ● | 遇到任何延迟或遇到上述任何问题。 |
在我们的候选药物 上市之前,我们将需要获得与我们候选药物的进一步开发相关的额外资金。 我们获得额外融资的能力将取决于许多因素,包括市场状况、我们的经营业绩 和投资者情绪。因此,我们可能无法在需要时、在可接受的条件下或根本无法获得额外的融资。如果我们 无法在需要时或按有吸引力的条款筹集资金,我们可能会被迫推迟、减少或取消我们的研发计划或任何未来的商业化努力,或通过以不具吸引力的条款签订协议来获得资金。
此外,资本市场上任何额外的股权融资可能会稀释股东的权益,任何基于债务的融资可能会约束我们遵守限制性契约 ,并限制我们的经营活动和支付潜在未来股息的能力,即使在盈利的情况下也是如此。我们不能保证未来的 融资将以足够的金额或可接受的条款提供(如果有的话)。如果我们无法以足够的金额或可接受的条款筹集更多资金,我们将无法进行研发工作。这可能会损害我们的业务、运营业绩和财务状况,并导致我们的美国存托凭证价格下降。
3
如果我们无法获得 足够的资金来支持我们的运营,则我们可能被要求推迟、限制、减少或终止我们的产品开发或未来的商业化努力,或者授予第三方开发和营销我们原本更愿意开发和营销的候选药物的权利。例如,战略合作可能要求我们与第三方 共享我们候选药物的商业权利,而我们目前并不打算以这种方式或以可能对我们不利的条款进行共享。此外,我们还可能不得不放弃对我们的技术、未来收入来源、研究计划或候选药物的宝贵权利,或者以可能对我们不利的条款授予许可证。
我们可能会发现很难在我们的临床试验中招募患者 ,并且患者可能会停止参与我们的临床试验,这可能会延迟或阻止我们当前的 和我们候选药物的任何未来临床试验,并使这些试验的进行成本更高。
确定并使 患者有资格参与我们候选药物的当前和未来临床试验,这对我们的成功至关重要。我们临床试验的时间取决于我们招募患者参与测试候选药物的速度。由于生物技术行业不良事件的负面宣传,患者可能不愿参与任何未来的临床试验。患者 可能由于其他原因而无法使用,包括类似患者群体的竞争性临床试验,招募 患者、进行试验和获得监管部门对潜在产品的批准的时间表可能会推迟。如果我们难以招募足够数量的患者来按计划进行任何未来的临床试验,我们可能需要推迟、限制或中止这些临床试验 。临床试验延迟可能导致成本增加、产品开发速度减慢、在测试我们技术的安全性和有效性方面受挫 或完全停止临床试验。
任何未能执行我们的业务战略的行为都可能对我们的业务、财务状况和运营结果产生负面影响.
我们候选药物的开发和商业化面临许多风险,包括:
| ● | 可能需要额外的临床或临床前试验,超出我们目前的预期; |
| ● | 监管机构可能不同意我们对临床前研究和临床研究数据的解释,或者可能要求我们进行额外的研究; |
| ● | 监管机构可能不同意我们提出的未来临床试验的设计方案; |
| ● | 监管机构可能会推迟批准我们的候选药物,从而阻止我们的合作伙伴支付里程碑式的款项; |
| ● | 监管机构可能不接受在我们的临床研究地点产生的数据; |
| ● | 我们可能无法在任何司法管辖区获得并保持对我们候选药物的监管批准; |
| ● | 任何候选药物的任何副作用的流行和严重程度可能会推迟或阻止商业化,限制任何已批准的候选药物的适应症,要求建立风险评估和缓解战略,或导致已批准的候选药物退出市场; |
| ● | 监管当局可能会发现制造过程中的缺陷; |
| ● | 监管部门可能会改变其审批政策或采取新的规定; |
| ● | 我们期望依赖的第三方制造商供应或生产我们的候选药物可能不会产生足够的供应; |
4
| ● | 我们或我们的第三方制造商可能无法采购或生产符合当前良好制造规范(“cGMP”)标准的材料来生产我们的候选药物; |
| ● | 我们可能无法以生产商业上成功的产品所需的成本或数量生产我们的候选药物; |
| ● | 我们可能无法为我们的临床试验获得足够的候选药物供应; |
| ● | 我们可能会在临床试验的开始、患者招募和时间安排方面遇到延误; |
| ● | 我们可能无法证明我们的候选药物对于其适应症的治疗是安全和有效的,令监管部门满意,并且我们可能无法实现并保持对适用于我们候选药物的所有监管要求的遵守; |
| ● | 经批准后,我们的产品可能不能继续保持可接受的安全状况; |
| ● | 我们可能无法建立或维持合作、许可或其他安排; |
| ● | 市场可能不会接受我们的候选药物; |
| ● | 我们可能无法通过创建商业基础设施或通过战略合作来建立和维护有效的销售和营销基础设施,而我们自己或任何未来战略合作伙伴的营销、销售和分销战略和运营的有效性将影响我们的盈利能力; |
| ● | 我们可能会遇到来自现有产品或可能出现的新产品的竞争; |
| ● | 我们和我们的许可方可能无法成功地获得、维护、捍卫和执行对保护我们的候选药物至关重要的知识产权;以及 |
| ● | 我们可能无法从第三方付款人那里获得并维持承保范围和足够的补偿。 |
如果这些风险中的任何一项成为现实, 我们可能会遇到重大延误或无法成功开发我们或我们的合作伙伴可能开发的候选药物并将其商业化 ,这将对我们的业务、财务状况和运营结果产生重大不利影响。
我们候选药物的临床前研究的阳性结果不一定能预测我们计划的候选药物临床试验的结果。.
我们候选药物的临床前概念验证和动物实验的阳性结果可能不会在人体临床试验中产生阳性结果。制药和生物技术行业的许多公司 在临床前开发或早期临床试验中取得积极结果后,在临床试验中遭遇重大挫折 ,我们不能确定我们不会面临类似的挫折。这些挫折 可由临床试验进行期间的临床前发现或在临床试验中进行的安全性或有效性观察(包括不良事件)引起。此外,临床前和临床数据往往容易受到不同解释和分析的影响。许多公司认为他们的候选药物在临床前研究和临床试验中表现令人满意,但未能 获得美国食品和药物管理局(FDA)或其他监管机构的批准。如果我们未能在候选药物的临床试验中产生积极的结果 ,我们候选药物的开发时间表和监管批准以及商业化前景将受到负面影响,相应地,我们的业务和财务前景也将受到负面影响。
5
候选药物正在进行的和未来的临床试验可能不会显示出足够的安全性和有效性,无法获得必要的监管批准才能进行商业销售.
第一阶段和第二阶段临床试验主要不是为了测试候选药物的疗效,而是为了测试安全性和了解候选药物在不同剂量和时间表下的副作用。此外,临床前和早期临床试验的成功并不能确保以后的大规模试验也不能成功,也不能预测最终结果。早期试验中可接受的结果可能不会在以后的试验中重复 。此外,第三阶段临床试验可能不会显示出足够的安全性或有效性,无法获得上市监管部门的批准。此外,临床结果经常容易受到不同解释的影响,这些解释可能会推迟、限制或阻止监管部门的批准。 临床试验期间的阴性或非决定性结果或不良医疗事件可能需要重新进行临床试验或 终止。根据所涉及候选药物的类型、复杂性和新颖性以及 其他因素,完成临床试验和提交上市审批申请所需的时间长度也可能有很大差异。如果我们的临床试验出现任何重大延误、质量问题、挫折或负面结果或终止, 我们可能无法继续开发我们的候选药物或产生收入,我们的业务可能会受到严重损害。
如果我们没有获得必要的监管批准,我们将无法将我们的候选药物商业化.
我们候选药物的临床开发、制造、销售和营销都受到美国、英国、欧盟、澳大利亚和其他地方监管机构的广泛监管。尽管在准备和提交生物许可证申请或其他司法管辖区的等价物上投入了大量的时间和费用,但永远不能保证获得监管部门的批准。所需的临床前研究和临床试验的数量、规模和设计将因产品、产品拟用于治疗的疾病或情况以及适用于任何特定产品的法规和指导文件而异。此外,在审查过程中和批准之前,FDA和/或其他监管机构可能需要额外的数据,包括关于我们的产品是否有可能被滥用的数据,这可能会推迟批准和任何潜在的受控物质调度过程。 FDA或其他监管机构可以出于许多原因推迟、限制或拒绝对产品的批准,包括但不限于, 监管机构可能不批准我们或第三方制造商的工艺或设施,或者可能颁布新的法律,或者监管机构 可能改变其批准政策,或采用新的法规,要求提供新的或不同的安全和功效证据,以满足产品的预期用途。
不能保证在临床试验和随后的上市审批中取得成功结果。如果我们无法获得监管部门的批准,我们 将无法从我们的候选药物中获得收入。即使我们的任何候选药物获得监管部门的批准,我们的盈利能力也将取决于我们从销售或我们的技术许可中创造收入的能力。
即使我们的候选药物获得监管机构的批准,我们仍可能面临开发和监管方面的困难,这可能会推迟或损害候选药物的未来销售.
即使我们或我们的许可合作伙伴获得了销售任何候选药物的监管批准,相关监管机构仍可能对指定用途、制造、标签、包装、不良事件报告、储存、广告、促销和 记录保存施加重大限制,或对批准后研究施加持续要求。此外,监管机构对上市产品、其制造商和制造商的设施进行持续审查和定期检查。候选药物存在以前未知的问题,包括预料不到的严重程度或频率的不良事件,可能会导致 产品的营销受到限制,并可能包括将该产品从市场上撤回。此外,可能会颁布新的法定要求或附加法规 ,以阻止或推迟对我们候选药物的监管批准。
我们在候选药物方面的制造经验有限 .
我们没有制造能力 ,我们的候选药物的制造和制造流程开发依赖于第三方的经济高效的制造和制造流程。第三方制造商或制造工艺的问题,或生产活动的扩大,可能会推迟我们候选药物的临床试验和商业化。
6
由于我们严重依赖承包商, 我们将面临与承包商的业务和运营条件相关的风险.
我们是一家小公司,内部员工很少,设施有限。我们现在和将来都需要依靠各种承包商来制造和运输我们的候选药物、进行临床测试和准备监管档案。影响我们的一个或多个承包商的不良事件 可能会对我们产生不利影响,例如:
| ● | 承包商无法留住一直在研究我们的候选药物的关键工作人员; |
| ● | 承包商因财务或其他业务问题而无法维持运营; |
| ● | 承包商失去生产我们的候选药物所需的许可或执照;或 |
| ● | 承包商内部发生的错误、疏忽或不当行为可能会对我们的业务造成不利影响。 |
我们依赖并将继续依赖与第三方合作伙伴的协作和战略联盟。只要我们能够达成协作安排或战略联盟,我们就会面临与这些协作和联盟相关的风险.
我们开发、制造和商业化候选药物的战略的一个重要元素是与 其他制药公司或其他行业参与者建立合作伙伴关系和战略联盟。
我们已有或将来可能拥有的任何合作伙伴关系或联盟可能会因我们无法控制的原因而终止,或者我们可能无法以可接受的条款谈判未来的联盟关系 。这些安排可能导致我们获得的收入少于我们直接销售产品的收入,可能 将我们产品的开发、销售和营销置于我们的控制之外,可能要求我们放弃重要的权利,或者可能 以其他方式处于不利条件。协作安排或战略联盟也将使我们面临一系列风险,包括:
| ● | 我们可能无法控制我们的战略合作伙伴/合作者可能向候选药物投入的资源的数量和时间; |
| ● | 战略合作伙伴/协作者可能会遇到财务困难; |
| ● | 未能与第三方成功合作可能会延迟、阻止或以其他方式损害我们候选药物的开发或商业化或收入预期; |
| ● | 合作伙伴/合作伙伴正在开发的产品可能永远不会达到商业阶段,从而导致里程碑或版税支付减少甚至没有支付; |
| ● | 业务合并或协作者业务战略的重大变化也可能对协作者在任何安排下履行其义务的意愿或能力产生不利影响; |
| ● | 合作者可以独立开发竞争产品,也可以与其他人(包括我们的竞争对手)合作开发;以及 |
| ● | 合作安排经常被终止或到期,这将推迟开发,并可能增加开发候选药物的成本。 |
由于我们依赖第三方制造和供应合作伙伴,我们的研发、临床前和临床开发材料的供应可能会变得有限或中断 ,或者数量或质量可能不令人满意.
我们依赖第三方供应 和制造合作伙伴来制造和供应我们的研发以及临床前和临床研究用品 。我们不拥有制造设施,也不提供此类材料的来源。
7
不能保证我们的研发、临床前和临床开发生物制品和其他材料的供应不会受到限制、中断或限制在某些地理区域、具有令人满意的质量或继续以可接受的价格供应。更换第三方制造商可能需要大量的工作、成本和专业知识,因为合格的 更换数量可能有限。
候选药物的制造流程 要接受FDA和外国监管机构的审查。供应商和制造商必须满足适用的制造 要求,并接受监管机构要求的严格设施和工艺验证测试,以符合监管 标准。如果我们的任何供应商或制造商未能遵守此类要求或履行其在质量、时间或其他方面对我们的义务,或者如果我们的组件或其他材料的供应因 其他原因而受到限制或中断,我们可能被迫自己制造材料或与其他第三方达成协议,这将 成本高昂并推迟任何未来的临床试验。
此外,如果任何第三方供应商未能履行其生产我们产品的义务,或未能维持或达到令人满意的法规遵从性, 此类物质的开发和任何疗法的商业化(如果获得批准)可能会被停止、推迟或在商业上变得不可行、利润下降,或可能导致针对我们的执法行动。
如果我们不能留住关键人员并培养关键的学术和科学合作,我们的研发工作将受到威胁。.
我们高级管理层的变动 可能会对我们的业务造成干扰,并可能对我们的运营产生不利影响。例如,当我们的高级管理职位发生变化时, 我们可能会选择采用不同的业务战略或计划。任何新的战略或计划,如果被采用,可能不会成功,如果任何新的战略或计划没有产生预期的结果,我们的业务可能会受到影响。
此外,生物技术和制药公司之间对合格员工的竞争非常激烈,因此我们可能无法吸引和留住对我们的成功至关重要的人员 。我们的成功取决于我们继续吸引、留住和激励高素质的管理人员、临床和科学人员、制造人员、销售和营销人员,以及我们与临床医生、科学家以及领先的学术和医疗机构发展和保持重要关系的能力。如果我们不能发现、吸引、留住和激励这些高技能人才,我们可能无法继续我们的产品开发和商业化活动。
此外,生物技术和制药行业也受到快速而重大的技术变革的影响。我们的候选药物可能会失去竞争力。 为了保持竞争力,我们必须聘用和保留受过持续教育以跟上不断变化的技术步伐的合格员工。 但可能无法做到这一点。
我们在管理我们的增长时可能会遇到困难,这可能会对我们的运营产生负面影响。
随着我们推进候选药物的临床开发计划,寻求美国和其他地方的监管批准,并增加正在进行的产品开发计划的数量,我们预计将需要增加产品开发、科学和管理人员。 我们还将需要建立商业能力,以便将任何可能获得批准的候选药物商业化。这种演变 可能会影响我们的战略重点以及资源的部署和分配。
我们能否有效地管理我们的运营和增长取决于我们的程序、报告系统以及运营、财务和管理控制的持续改进。我们可能无法高效或及时地实施管理和运营改进 ,并可能发现现有系统和控制中的缺陷。如果我们不能应对这些挑战,我们可能无法执行我们的业务战略,并可能被迫花费比预期更多的资源来解决这些问题。
我们未来可能会收购其他 技术和补充业务。收购涉及许多风险,其中任何一项都可能对我们的业务造成实质性损害, 包括管理层将注意力从核心业务上转移、未能有效利用收购的技术、未能成功整合收购的业务或实现预期的协同效应,或失去我们业务或收购业务的关键员工 。
8
此外,为了继续 履行我们作为澳大利亚和美国上市公司的义务,并支持我们预期的长期增长,我们将需要提高我们的一般和行政能力。我们的管理、人员和系统可能不足以支持未来的增长。
如果我们不能成功地 管理我们的增长和我们日益复杂的运营,我们的业务、财务状况、运营结果和前景可能会受到损害 。
APIRx与我们业务的整合 可能会破坏我们的运营结果。
2022年8月,我们完成了对APIRx Pharmtics USA,LLC的100%股权的收购(“收购”)。然而,我们成功整合APIRx的能力将取决于操作、设施、程序、政策和技术的及时集成和整合,以及APIRx和我们之间业务文化差异的协调。这种集成和整合可能很复杂且耗时 ,会涉及额外费用,并可能扰乱我们的业务,并将管理层的注意力从持续的业务关注和我们的临床试验上转移开。任何未能成功整合APIRx的业务、运营和员工的情况都可能破坏我们的运营结果。
收购后,我们可能无法实现预期的 协同效应。
我们相信,此次收购将为我们提供在IncanneX的临床试验和APIRx的临床项目之间实现协同效应的机会。 我们期望通过此次收购实现的协同效应必须基于对合并后业务的预测和假设 ,并假设APIRx的业务成功整合到我们的业务和运营中。然而,我们对此次收购的预测和假设可能被证明是不准确的,我们可能无法及时成功地整合APIRx和我们的运营, 或者根本不能。我们还可能面临APIRx的意外或意外事件或责任,或与APIRx的知识产权投资组合有关的诉讼。如果我们不能从收购中实现预期的协同效应,我们的增长战略和未来的盈利能力可能会受到不利影响。
如果我们的候选药物不被医生、患者和医学界接受,其未来的潜在销售可能会受到影响.
我们的候选药物 可能无法获得医生、患者和医学界的市场认可,即使它们获得监管部门的批准也存在风险。市场对我们批准的任何候选药物的接受程度将取决于各种因素,包括:
| ● | 推出市场的时机、竞争产品的数量和临床概况; |
| ● | 我们提供可接受的安全性和有效性证据的能力,以及我们确保关键临床医生和医生对我们的候选药物的支持的能力; |
| ● | 与现有疗法和新疗法相比的成本效益; |
| ● | 医疗保健组织和其他第三方付款人是否提供保险、报销和适当付款; |
| ● | 不良副作用的发生率和严重程度;以及 |
| ● | 其他治疗方法无法比拟的优点。 |
作为受控物质, 该产品可能会引起公众争议。医生、患者、付款人或医疗界可能不愿接受、使用或推荐我们的候选药物,这将对我们的潜在收入和未来的盈利能力产生不利影响。公众对使用大麻和裸盖菇素的研究疗法的负面宣传或看法可能会对这些疗法的成功产生负面影响 。
9
我们面临着来自可能为我们的目标疾病适应症开发候选药物的实体的竞争,包括基于与我们类似的模式和技术开发新疗法和技术平台的公司。
候选药物的开发和商业化竞争非常激烈。跨国制药公司和专业生物技术公司可以开发 与我们的候选药物竞争的候选药物和工艺。竞争性治疗包括那些已经被医学界、患者和第三方付款人批准和接受的治疗方法,以及任何进入市场的新治疗方法。
可能有相当数量的产品目前正在开发中,并可能在未来投入商业使用,用于治疗我们正在开发、并可能在未来尝试开发的候选药物。
跨国制药公司和专业生物技术公司可能比我们拥有更多的财务、技术、制造、营销、销售 以及供应资源和经验。如果我们成功获得对任何候选药物的批准,我们可能会面临基于许多不同因素的竞争 ,包括我们候选药物的安全性和有效性、我们候选药物的给药难易程度和患者接受相对较新的给药途径、这些候选药物获得监管批准的时间和范围、制造、营销和销售能力的可用性和成本、价格、报销 覆盖范围和专利地位。
竞争产品可以提供 更好的治疗替代方案,包括比我们可能开发的任何产品更有效、更安全、更便宜或更有效地营销和销售。在我们收回开发和商业化候选药物的费用之前,竞争性产品可能会使我们开发的任何产品过时或不具竞争力。此类竞争对手还可能招聘我们的员工,这可能会对我们的专业水平和执行业务计划的能力产生负面影响。
如果医疗保险公司和其他组织不为我们的候选药物支付费用或限制报销,我们未来的业务可能会受到影响。
我们的候选药物可能会由于包括成本在内的许多因素而被市场拒绝。政府、保险公司和医疗成本的其他付款人 为控制或降低医疗成本所做的持续努力可能会影响我们未来的收入和盈利能力。在澳大利亚和某些国外市场,药品的定价受到政府的管制。我们预计,类似的政府控制举措将在美国和其他地方继续下去。采用任何此类立法或监管建议都可能损害我们的业务和前景。
我们候选药物的成功商业化 在一定程度上将取决于政府卫生行政部门、私人健康保险公司和其他组织对我们产品和相关治疗费用的报销程度。我们的候选药物可能不被认为具有成本效益,消费者可能无法获得报销,或者可能不足以让我们的产品 在竞争的基础上销售。第三方付款人正越来越多地挑战医疗产品和治疗的价格。如果第三方 不适用于我们的候选药物,这些候选药物的市场接受度将会降低。成本控制措施 可能会降低我们可能为候选药物制定的价格,从而可能导致产品收入低于预期。如果我们候选药物的价格下降,或者如果政府和其他第三方付款人没有提供足够的保险和报销 水平,我们的潜在收入和盈利前景将受到影响。
我们可能面临产品责任索赔 ,这可能会对我们的业务产生不利影响。
治疗产品的测试、营销和销售存在固有的产品责任风险。我们依赖许多第三方研究人员和承包商 来生产、收集和分析有关我们候选药物的安全性和有效性的数据。我们还制定了质量控制和质量保证,以降低这些风险,并提供专业责任和临床试验保险,以在人体测试错误或数据分析错误的情况下承担经济损失 。
10
尽管我们有控制程序,但我们可能面临与我们的候选药物在人体临床试验中进行测试相关的产品责任风险。如果我们的任何候选药物被批准销售,一旦我们的候选药物开始营销、分销和销售,我们可能面临比参与临床试验的人数更多的人提出的索赔。无论是非曲直或最终结果,责任索赔 可能导致:
| ● | 对我们的候选药物的需求减少; |
| ● | 损害我们的声誉; |
| ● | 临床试验参与者的退出; |
| ● | 相关诉讼费用; |
| ● | 给予病人和其他人大量的金钱奖励; |
| ● | 收入损失;以及 |
| ● | 无法将候选药物商业化。 |
关于产品责任索赔 如果检测错误危及任何人类受试者,我们可能面临超出保险限额的额外责任。此外, 如果在这些研究测试活动中对我们提出索赔,我们的美国存托凭证的市场价格可能会受到负面影响。
大流行的爆发可能会对我们的业务产生不利影响,包括我们的非临床研究和临床试验。
大流行或类似疫情等公共卫生危机可能会对我们的业务产生不利影响。2019年12月,一种新的冠状病毒株(“新冠肺炎”) 在中国身上浮出水面,随后传播到世界大多数国家。
由于新冠肺炎疫情或未来的任何大流行,我们已经并可能在未来经历可能严重影响我们的业务、临床前研究和临床试验的中断,包括:
| ● | 延迟或难以招募患者参加我们的临床试验; |
| ● | 临床站点启动的延迟或困难,包括在招聘临床站点调查员和临床站点工作人员方面的困难; |
| ● | 非临床试验和研究性新药应用的延误或中断--由于供应链上的合同研究机构和供应商的不可预见的情况,使良好的实验室实践成为标准的毒理学研究; |
| ● | 患者在登记后因感染病毒、被迫隔离或不想去医院就诊而退出临床试验的比率增加; |
| ● | 将医疗资源从临床试验的进行中转移出来,包括将作为我们临床试验地点的医院和支持我们进行临床试验的医院工作人员转移到其他地方; |
| ● | 由于国家、州或地方政府、雇主和其他人强加或建议的旅行限制,或临床试验受试者访问和研究程序(特别是任何可能被认为不必要的程序)中断,可能影响受试者数据和临床研究终点的完整性,导致关键临床试验活动中断,如临床试验现场数据监测; |
11
| ● | FDA、欧洲药品管理局、澳大利亚治疗用品管理局或其他外国监管机构的运作中断或延迟,这可能会影响审批时间表; |
| ● | 由于人员短缺、生产减速或停顿以及供应链或分销供应商运输候选药物的能力中断或延误,从我们的合同制造组织接收候选药物的供应中断或延迟;以及 |
| ● | 员工资源受到限制,否则将专注于进行我们的非临床研究和临床试验,包括员工或其家人生病、员工希望避免与大量人群接触、越来越依赖在家工作或公共交通中断。 |
产品发货延迟可能会对我们的业务、运营结果和财务状况产生重大不利影响。
我们的候选药物和用于制造它们的活性药物成分(“原料药”),以及我们迷幻辅助心理治疗服务中使用的药物 的运输、进出口 将需要进出口许可证。在美国,FDA、美国海关和边境保护局以及美国缉毒署(DEA);在加拿大,加拿大边境服务局,加拿大卫生部;在欧洲,欧洲药品管理局(EMA)和欧盟委员会;在澳大利亚和新西兰,澳大利亚海关和董事会保护局、治疗商品管理局(TGA)、新西兰药品和医疗器械安全局以及新西兰海关;在其他国家,类似的监管机构对含有受管制物质的药品的进出口进行监管。具体而言,进出口流程要求进出口双方的相关受控物质主管部门颁发进出口许可证。
我们可能不会从某些国家/地区的当局那里获得此类许可证,或者 如果被授予,也不会继续持有此类许可证。即使我们获得了相关许可证,原料药 和我们的候选药物的发货也可能在运输过程中被耽搁或丢失,这可能会导致重大延误,并可能导致产品批次存储在要求的温度范围之外。不适当的存储可能会损坏产品发货,导致临床试验延迟 ,或者在商业化后,一次或多次发货的原料药或我们的候选药物造成部分或全部收入损失。临床试验延迟,或在商业化后,一批或多批原料药或我们的候选药物的部分或全部收入损失, 可能会对我们的业务、运营结果和财务状况产生重大不利影响。
我们的候选药物将受到受管制的 物质法律法规的约束。如果不能获得必要的批准,可能会推迟我们候选药物的推出,如果不遵守这些法律法规,可能会对我们的业务运营结果产生不利影响。
我们的候选药物包含 受控物质,如《受控物质法案》(CSA)所定义。作为药品 产品的受控物质受到CSA的高度监管,其中除其他事项外,规定了某些注册、制造配额、安全、记录保存、报告、进口、出口和DEA管理的其他要求。DEA将受管制物质分为五个附表:附表I、II、III、IV或V。根据定义,附表I物质有很高的滥用可能性,目前在美国尚未“接受医疗用途”,在医疗监督下使用缺乏公认的安全性, 并且不能在美国开具处方、销售或销售。在美国获准使用的药品可能被列为附表II、III、IV或V,其中附表II被认为是滥用或依赖的可能性最大的物质,而附表V物质是此类物质中滥用的相对风险最低的物质。附表一和附表二的药物受到CSA下最严格的管制,包括制造和采购配额、安全要求和进口标准。此外,附表二药物的配发也受到进一步限制。例如,如果没有新的处方,他们可能不会被重新灌装。
12
作为含有致幻剂的合成大麻素类药物,我们的候选药物很可能被列为附表II或III受控物质。 我们需要确定具有适当DEA注册的批发商,并有权将产品分销给药房 和其他医疗保健提供商,这些经销商需要获得附表II或III的分销注册。 获取失败、延迟获取或丢失任何这些注册都可能导致我们的成本增加。如果我们的任何候选药物 是附表II药物,药店将必须通过警报和监控系统保持更高的安全性,并且他们必须 遵守额外的记录保存和库存要求。这可能会阻止一些药店销售该产品。此外,旨在减少处方药滥用的州和联邦执法行动、监管要求和立法,例如 要求医生咨询州处方药监测计划,可能会降低医生开处方的意愿,并使药房 分发附表II产品。
我们打算在美国以外的地方生产我们的候选药物的商业供应。如果我们的任何产品获得FDA批准,并被归类为附表II或III物质,进口商可以出于商业目的进口,前提是进口商从DEA获得进口商登记,并向DEA提交每次进口的进口许可证申请。未能确定进口商或获得必要的进口授权可能会影响我们候选药物的供应,并对我们的业务、运营结果和财务状况产生重大不利影响。此外,附表II进口商的注册申请必须在《联邦登记册》上公布,而且第三方意见的提交有一个等待期。未能保持必要的注册或未能遵守适用法律可能会推迟我们候选药物的商业化,并可能推迟临床研究的完成。 此外,未能保持遵守CSA,特别是不符合CSA导致的损失或转移,可能会导致 监管行动,这可能会对我们的业务、财务状况和运营结果产生实质性的不利影响。缉毒局可以 寻求民事处罚,拒绝续签必要的登记,或者启动限制、暂停或撤销这些登记的程序。 在某些情况下,违反规定可能导致刑事诉讼。此外,如果FDA、DEA或任何外国监管机构 确定我们的候选药物可能有滥用的可能性,可能需要我们生成比我们目前 预期的更多的临床或其他数据,以确定该物质是否或在多大程度上具有滥用潜力,这可能会增加成本和/或推迟我们候选药物的发布。
各州也制定了受控物质法律法规。虽然州管制物质法通常反映联邦法律,但由于各州 是单独的司法管辖区,它们可能也会单独安排我们的候选药物。有些州根据联邦行动自动安排药品,而另一些州则通过制定规则或立法行动来安排药品。州日程安排可能会推迟我们获得联邦监管批准的任何产品的商业销售,而不利的日程安排可能会对此类产品的商业吸引力产生重大不利影响。我们或我们的合作伙伴还必须获得单独的州注册、许可或许可证,才能获得、处理和分发用于临床试验或商业销售的受控物质,如果未能满足适用的监管要求,可能会导致除DEA的强制执行和制裁外,各州还可能执行和制裁 联邦法律。
我们打算与澳大利亚的制造商 签订合同,为我们的临床试验生产药物产品,并为我们的候选药物生产原料药。此外,我们可能会决定在其他国家/地区开发、生产或商业化我们的候选药物。因此,我们还将遵守澳大利亚TGA和其他国家/地区的受控物质 法律法规,未来我们将在这些国家/地区开发、制造或 商业化我们的候选药物。我们计划在完成所有必需的临床试验后向FDA提交候选药物的新药申请(“NDA”),并可能需要在此时做出额外的DEA时间表决定。
美国医保法和实施的法规的变化,以及医疗政策的变化,可能会以我们目前无法预测的方式影响我们的业务,并可能损害我们的业务和运营结果。
有关医疗保健系统的多项行政、立法和法规变化以及拟议的变化已经发生,并且可能继续存在,这些变化可能会 阻止或推迟候选药物的上市审批,限制或规范审批后活动,并影响我们盈利的 销售任何获得上市批准的候选药物的能力。在美国的政策制定者和支付者中,有很大的兴趣推动医疗保健系统的变革,其既定目标是控制医疗保健成本、提高质量和/或扩大服务范围 。制药业一直是这些努力的重点,并受到重大立法倡议的重大影响。
13
经2010年《医疗保健和教育协调法案》修订的《患者保护和平价医疗法案》,统称为《平价医疗法案》,极大地改变了政府和私营保险公司为医疗保健提供资金的方式,并对美国制药业产生了重大影响。《平价医疗法案》除其他事项外:(1)为吸入、输液、滴注、植入或注射且一般不通过零售社区药店分发的药品和生物制品引入了新的制造商平均价格定义 ;(2)增加了制造商在医疗补助药品回扣计划下欠下的最低医疗补助回扣,并扩大了医疗补助使用费的回扣 也包括使用医疗补助管理的护理组织;(3)建立了品牌处方药的制药商必须向联邦政府支付的品牌处方药费用;(4) 扩大了有资格参与340B药品定价计划的承保实体名单,增加了符合 计划资格的新实体;(5)建立了新的Medicare Part D Coverage Gap折扣计划,制造商必须同意提供50%(根据2018年两党预算法(BBA)从2019年1月起增加到70%)销售点折扣,在适用品牌药物的协议价格的基础上, 在承保间隔期内向符合条件的受益人提供 适用于Medicare Part D的门诊药物;(6)将制造商的医疗补助退税责任扩大到分配给参加医疗补助管理保健组织的个人的承保药品 ;(7)扩大医疗补助计划的资格标准,其中包括允许各州向更多个人提供医疗补助保险,包括收入低于联邦贫困水平133%的个人,从而潜在地增加制造商的医疗补助退税责任;(8)为后续 生物产品创建许可证框架;以及(9)在CMS建立了医疗保险和医疗补助创新中心,以测试创新的支付和服务交付模式,以降低医疗保险和医疗补助支出。我们将继续关注《平价医疗法案》的任何变化或挑战,而这些变化或挑战反过来又可能影响我们未来的业务。
Other legislative changes have been proposed and adopted since the Affordable Care Act was enacted. These changes include aggregate reductions to Medicare payments to providers of 2% per fiscal year pursuant to the Budget Control Act of 2011 and subsequent laws, which began in 2013 and will remain in effect through 2030, unless additional Congressional action is taken. Subsequently, the American Taxpayer Relief Act of 2012 further reduced Medicare payments to several types of providers, including hospitals, imaging centers and cancer treatment centers, and increased the statute of limitations period for the government to recover overpayments to providers from three to five years. New laws could result in additional reductions in Medicare and other healthcare funding, which may materially negatively affect customer demand and affordability for our drug candidates and, accordingly, the results of our financial operations. Also, there has been heightened governmental scrutiny recently over the manner in which pharmaceutical companies set prices for their marketed products, which have resulted in several Congressional inquiries and proposed federal legislation, as well as state efforts, designed to, among other things, bring more transparency to product pricing, reduce the cost of prescription drugs under Medicare, review the relationship between pricing and manufacturer patient programs, and reform government program reimbursement methodologies for drug products. At the state level, individual states in the United States are increasingly active in passing legislation and implementing regulations designed to control pharmaceutical and biological product pricing, including price or patient reimbursement constraints, discounts, restrictions on certain product access and marketing cost disclosure and transparency measures, and, in some cases, designed to encourage importation from other countries and bulk purchasing. Legally mandated price controls on payment amounts by third-party payors or other restrictions on coverage or access could harm our business, results of operations, financial condition and prospects. In addition, regional healthcare authorities and individual hospitals are increasingly using bidding procedures to determine what pharmaceutical products and which suppliers will be included in their prescription drug and other healthcare programs. This could reduce the ultimate demand for our drug candidates that we successfully commercialize or put pressure on our product pricing.
此外,拟议的联邦和州立法可能会增加竞争,因为它涉及大麻衍生产品。根据《大麻管理和机会法案》,美国参议院提议通过修改《联邦食品、药品和化妆品法案》(FDCA),使大麻衍生的CBD在膳食补充剂中的使用合法化。2021年的大麻获取和消费者安全法案(SB 1698)也允许大麻衍生的CBD用于膳食补充剂。各州正在考虑偿还医用大麻。随着大麻衍生产品的可用性和报销可能扩大,制药行业可能会直接与国家监管的大麻企业竞争市场份额。
我们预计,未来可能采取的这些和其他 医疗改革措施可能会导致更严格的覆盖标准和更低的报销,并 对我们收到的任何获批产品的价格施加额外的下行压力。政府可能会采取额外行动 以应对COVID-19大流行。我们无法预测美国未来的立法或行政行为可能产生的政府监管的可能性、性质或程度。如果我们或我们可能聘用的任何第三方在适应现有要求的变化或新要求或政策的采用方面进展缓慢或无法 适应,或者如果我们或此类第三方无法 保持合规性,则我们的候选药物可能会失去可能已获得的任何监管批准,我们可能无法实现 或维持盈利能力。
14
有关知识产权的风险
我们的成功取决于我们保护 知识产权和专有技术的能力。
我们的成功在一定程度上还取决于我们获得和维护知识产权组合保护的能力,包括通过收购 获得的资产,或者在适用的情况下,获得/维护孤儿药认定/地位以及 候选药物的市场独占权。
我们可能会因未能或无力保护我们的知识产权而受到重大不利 影响。如果不授予这些权利, 追究侵权损害赔偿的能力将受到限制。同样,任何专有或特定于我们技术的专有技术可能 受到员工或顾问披露的风险,尽管有保密协议。
未来的任何成功将在一定程度上取决于我们是否能够获得并保持专利以保护我们自己的产品和技术;获得第三方专利技术的许可 ;以及在不侵犯第三方专有权的情况下运营。生物技术专利问题可能涉及复杂的法律和科学问题,无法预测生物技术和制药专利申请的结果。 我们未来的任何专利申请可能都不会获得批准,或者我们可能不会开发其他可申请专利的产品或工艺。 我们可能在某些国家/地区销售我们的候选药物或许可我们的知识产权,但可能无法像在美国或澳大利亚那样保护我们的知识产权 。一些法律原则仍然悬而未决 对于美国、英国、欧盟、澳大利亚或其他地方的专利中允许的权利要求的广度或解释没有一致的政策。此外,由于相关法律、科学和事实问题的复杂性, 支持和解释专利权利要求所需的专利和专利申请的具体内容高度不确定。澳大利亚、美国、英国、欧盟或其他地方专利法或专利法解释的变化可能会降低我们知识产权的价值或缩小我们专利保护的范围。即使我们能够获得专利,它们也可能不会以能够为我们提供任何有意义的保护、阻止竞争对手与我们竞争或以其他方式为我们提供任何竞争优势的形式发布。我们的竞争对手可以通过 以非侵权方式开发类似或替代技术或产品来规避我们的专利。我们也可能无法采取必要的措施或 支付必要的费用来维护我们的专利。
此外,我们的任何悬而未决的 申请可能需要第三方将现有技术提交给美国专利商标局或USPTO、 欧洲专利局或欧洲专利局、英国的知识产权局或IPO、澳大利亚专利商标局和/或在其上颁发的任何专利可能会涉及反对、派生、复审、授权后审查、干扰诉讼或其他专利局诉讼或诉讼,在美国或其他地方挑战我们的专利权。任何此类提交、诉讼或诉讼中的不利裁决 可能会缩小我们专利权的范围或使其无效,并允许第三方 将我们的技术或产品商业化并直接与我们竞争,而无需向我们付款。此外,如果我们的专利和专利申请提供的保护的广度或强度受到威胁,可能会阻止公司与我们合作, 利用我们的知识产权或开发和商业化候选药物。
专利的颁发对于发明性、范围、有效性或可执行性并不是决定性的,我们的专利可能会在美国、欧盟、澳大利亚和其他地方的法院或专利局受到挑战。此类挑战可能导致所有权的丧失或专利主张的范围缩小、全部或部分无效或无法强制执行,这可能会限制我们的 技术和产品的专利保护期限。因此,我们的专利组合可能无法为我们提供足够的权利来排除其他公司将与我们相似或相同的产品商业化。
此外,其他公司 可能试图规避我们根据适用法律获得的任何监管数据保护或市场排他性,这可能要求我们 分配大量资源来防止此类规避。这样的发展可能使其他公司能够规避我们的知识产权,并使用我们的临床试验数据在欧盟、澳大利亚和其他司法管辖区获得营销授权。此类发展还可能需要我们分配大量资源,以防止其他公司规避或侵犯我们的知识产权。
15
第三方的知识产权 可能会对我们将候选药物商业化的能力产生不利影响,因此我们可能需要与第三方提起诉讼或从第三方获得许可证 以开发或营销我们的候选药物。
我们的商业成功可能 取决于我们未来的能力以及我们的潜在合作伙伴在不侵犯第三方有效知识产权的情况下开发、制造、营销和销售我们的候选药物的能力。如果存在第三方知识产权,则可能需要 提起诉讼或行政诉讼,以使相关第三方知识产权无效或无效, 或与知识产权持有人签订许可协议,这可能无法以商业上合理的条款获得, 如果有的话。
第三方知识产权权利人,包括我们的竞争对手,可能会向我们提出侵权索赔。我们可能无法成功解决或以其他方式解决此类侵权索赔。如果我们不能成功解决未来的索赔或以我们可以接受的条款以其他方式解决此类索赔,我们可能被要求进行或继续昂贵、不可预测和耗时的诉讼,并可能被阻止或在销售我们的候选药物时遇到 大幅延误。
如果我们未能解决或以其他方式解决任何此类纠纷,除了被迫支付损害赔偿外,我们或我们的潜在合作者可能被禁止在专利期内将我们可能开发的任何侵权候选药物商业化 。如果可能,我们还可能被迫重新设计我们的配方,以便我们不再侵犯此类第三方知识产权。这些事件中的任何一项, 即使我们最终获胜,都可能损害我们的声誉,或者需要我们转移大量的财务和管理资源,否则我们将能够投入到我们的业务中。
我们对第三方的依赖要求我们 共享我们的商业秘密,这增加了竞争对手发现这些秘密或我们的商业秘密被盗用或披露的可能性。.
由于我们与不同的组织和学术机构合作,以推动我们的技术和候选药物的发展,因此我们有时可能会与他们分享交易秘密。我们寻求通过在开始研究或披露专有信息之前与我们的合作者、顾问、员工和顾问签订保密协议以及 材料转让协议、协作研究协议、咨询协议或其他类似协议来部分保护我们的专有技术。这些协议通常限制第三方使用或披露我们的机密信息(如商业秘密)的权利。尽管有这些合同条款,但 需要共享商业秘密和其他机密信息会增加此类商业秘密被潜在竞争对手知晓、被无意中纳入他人的技术,或被披露或使用违反这些协议的风险。 鉴于我们的专有地位在一定程度上基于我们的技术诀窍和商业秘密,第三方发现我们的商业秘密或其他未经授权的使用或披露将损害我们的知识产权和对我们候选药物的保护。
此外,这些协议 通常会限制我们的合作者、顾问、员工和顾问发布可能与我们的行业机密相关的数据的能力 。我们的学术合作者通常有权发布数据,前提是提前通知我们,并且可能会将发布推迟指定的时间 ,以保护我们因合作而产生的知识产权。在其他情况下,出版权 由我们独家控制。在其他情况下,我们可能会与其他各方分享这些权利。尽管我们努力保护我们的商业秘密 ,但我们的竞争对手可能会通过违反这些协议、独立开发或发布包括我们的商业秘密在内的信息来发现我们的商业秘密,在发布时我们没有专有权或其他保护权利的情况下。
16
获得和维护我们的专利保护 取决于遵守政府专利机构施加的各种程序、文件提交、费用支付和其他要求,如果不符合这些要求,我们的专利保护可能会减少或取消。
在专利和申请的有效期内,需要分几个阶段向美国专利商标局和美国以外的其他政府专利机构支付定期维护费、 续期费、年费和各种其他关于专利和申请的政府费用。在专利申请过程中和专利颁发后,美国专利商标局和美国以外的各种相应的政府专利机构要求遵守一些程序、文件、费用支付和其他类似条款 。在某些情况下,不遵守规定可能会导致专利或专利申请的放弃或失效,从而导致相关司法管辖区的专利权部分或全部丧失。
我们可能会卷入保护 和捍卫我们的专利或其他知识产权的诉讼,这可能是昂贵、耗时和不成功的。
竞争对手可能会侵犯我们的专利或其他知识产权,我们可能会无意中侵犯他人的专利或知识产权。为了对抗侵权或未经授权的使用,我们可能会被要求提出索赔,任何相关的诉讼和/或此类索赔的起诉都可能是昂贵的 和耗时的。我们对被认定的侵权者提出的任何索赔都可能促使这些当事人对我们提出反索赔,声称我们侵犯了他们的知识产权。此外,在专利侵权诉讼中,法院可以裁定我们的专利全部或部分无效、不可强制执行,或以我们的专利不包括此类产品为理由,狭隘地允许对方将竞争产品商业化。
即使解决方案对我们有利, 与知识产权索赔相关的诉讼或其他法律程序也可能导致我们产生巨额费用,并可能 分散我们的技术和管理人员的正常责任。此类诉讼或诉讼可能会大幅增加我们的运营亏损,并减少我们可用于开发活动的资源。我们可能没有足够的财政或其他资源 来适当地进行此类诉讼或诉讼。我们的一些竞争对手可能比我们更有效地承担此类诉讼或诉讼的费用 因为他们的财力要大得多。因此,专利诉讼或其他诉讼程序的影响可能会对我们在市场上的竞争能力产生重大不利影响。
与我们的员工、顾问和顾问签订的保密和发明转让 协议可能无法充分防止商业秘密泄露和保护其他专有 信息。
我们认为专有贸易 秘密和/或机密技术和非专利技术对我们的业务非常重要。我们可能会依靠商业秘密和/或保密的技术诀窍来保护我们的技术,特别是在我们认为专利保护的价值有限的情况下。但是,商业秘密 和/或机密技术可能很难作为机密进行维护。
为防止此类信息 被竞争对手披露或窃取,我们的政策是要求我们的员工、顾问和顾问与我们签订保密协议和发明转让协议。但是,现任或前任员工、顾问和顾问可能无意或故意 将我们的机密信息泄露给竞争对手,保密和发明转让协议可能无法在未经授权泄露机密信息的情况下提供足够的补救措施。强制要求第三方非法获取并且 正在使用商业秘密和/或机密专有技术是昂贵、耗时且不可预测的。保密协议和发明转让协议的可执行性因司法管辖区而异。
未能获取或维护商业秘密和/或保密的专有技术贸易保护可能会对我们的竞争地位产生不利影响。此外,我们的竞争对手可以独立开发基本上等同的专有信息,甚至可以为此申请专利保护。如果成功获得这种专利保护,我们的竞争对手可能会限制我们使用我们的商业秘密和/或机密技术,我们的竞争地位或商业优势可能会受到损害,我们的业务和运营结果可能会受到不利影响。
17
知识产权并不能解决我们竞争优势面临的所有潜在威胁。
我们的知识产权提供的未来保护程度 是不确定的,因为知识产权具有局限性,可能无法充分 保护我们的业务,或允许我们保持竞争优势。以下示例是说明性的:
| ● | 其他公司可能能够生产与我们类似但不在我们知识产权范围内的产品。 |
| ● | 其他公司可能会独立开发类似或替代技术,或以其他方式绕过我们的任何技术,而不侵犯我们的知识产权。 |
| ● | 我们或我们的任何协作合作伙伴可能不是第一个构思并减少实践我们拥有、许可或将拥有或许可的专利或专利申请所涵盖的发明的人。 |
| ● | 我们或我们的任何协作合作伙伴可能不是第一个提交专利申请的人,这些申请涵盖我们或他们拥有或已获得许可、或将拥有或将已获得许可的某些专利或专利申请。 |
| ● | 我们已经提交或将提交的任何未决专利申请都有可能不会导致获得专利。 |
| ● | 我们拥有的已颁发专利可能不会为我们提供任何竞争优势,或者可能会因为竞争对手的法律挑战而被认定为无效或不可执行。 |
| ● | 我们的竞争对手可能会在我们没有专利权的国家或有研究和开发安全港法律的国家进行研究和开发活动,然后利用从这些活动中获得的信息来开发有竞争力的产品,在我们的主要商业市场销售。 |
| ● | 我们的专利或专利申请的所有权可能会受到第三方的挑战。 |
| ● | 第三方的专利或第三方的待定或未来的申请,如果被颁发,可能会对我们的业务产生不利影响。 |
我们在某些司法管辖区保护我们的知识产权可能会遇到困难,这可能会降低我们在这些司法管辖区的知识产权价值。
某些司法管辖区的法律对知识产权的保护程度不及美国和欧盟的法律,许多公司 在这些司法管辖区保护和捍卫此类权利时遇到了很大困难。如果我们或我们的协作合作伙伴 在保护知识产权方面遇到困难,或因其他原因无法有效保护对我们在这些司法管辖区的业务非常重要的知识产权,这些权利的价值可能会降低,我们可能会在这些司法管辖区面临来自其他人的额外竞争 。
欧洲的一些国家和中国 有强制许可法,根据这些法律,专利权人可以被强制向第三方授予许可。此外,许多国家限制专利对政府机构或政府承包商的可执行性。在这些国家,专利所有人的补救措施可能有限,这可能会大幅降低此类专利的价值。如果我们或我们的任何许可人被迫向第三方授予与我们业务相关的任何专利的许可,我们的竞争地位或商业优势可能会受到损害 ,我们的业务和运营结果可能会受到不利影响。
专利法的改变可能会降低专利的整体价值,从而削弱我们保护我们的候选药物和任何未来候选药物的能力。
与其他生物技术和制药公司一样,我们的成功在很大程度上依赖于知识产权,特别是专利。在生物制药行业获得和实施专利涉及技术和法律的复杂性,而获得和实施生物制药 专利既昂贵又耗时,而且本质上是不确定的。近年来,美国最高法院做出裁决,要么缩小了在某些情况下可获得的专利保护范围,要么在某些情况下削弱了专利所有者的权利,或者裁定某些主题不符合专利保护的条件。除了对我们未来获得专利的能力产生越来越大的不确定性外,这种事件的组合还对获得专利后的价值产生了不确定性。 根据国会、联邦法院、USPTO和非美国司法管辖区的同等机构的决定,管理专利的法律和法规 可能会以不可预测的方式发生变化,从而削弱我们获得新专利或强制执行现有专利的能力 以及我们未来可能获得的专利。
18
专利改革法,如《Leahy-Smith America发明法》或《Leahy-Smith Act》,以及专利法解释方式的变化,可能会增加围绕我们专利申请的起诉以及我们已颁发专利的实施或保护的不确定性和成本。《莱希-史密斯法案》对美国专利法进行了多项重大修改。这些条款包括影响与专利申请相关的提交和起诉战略的条款,包括从“发明第一”改为“发明人第一”的专利制度,允许第三方在专利起诉期间向美国专利商标局提交先前技术,以及通过由美国专利商标局管理的授权后程序攻击专利有效性的附加程序,包括授权后审查,各方间回顾 和派生程序。美国专利商标局制定了管理《莱希-史密斯法案》的法规和程序,并对与《莱希-史密斯法案》相关的专利法进行了许多实质性修改,特别是“发明人优先申请”条款。Leahy-Smith法案及其实施可能会增加围绕起诉我们的专利申请以及执行或保护我们已颁发的专利的不确定性和成本,所有这些都可能损害我们的业务、财务状况和运营结果 。
价格控制可能会在美国以外的市场实施,这可能会对我们未来的盈利能力产生负面影响。
在一些国家,特别是欧盟成员国、日本、澳大利亚和加拿大,处方药的定价受到政府的管制。在这些国家/地区,在收到产品的上市批准后,与政府当局进行定价谈判可能需要相当长的时间。此外,政府和其他利益攸关方可能会在价格和报销水平上施加相当大的压力,包括作为成本控制措施的一部分。政治、经济和监管方面的发展可能会使定价谈判进一步复杂化,在获得补偿后,定价谈判可能会继续 。欧盟各成员国使用的参考定价以及低价和高价成员国之间的平行分配或套利 可以进一步降低价格。在某些国家/地区,我们或我们的合作者可能被要求 进行临床试验或其他研究,将我们候选药物的成本效益与其他可用疗法进行比较,以获得或维持报销或定价审批。第三方付款人或当局公布折扣可能导致 公布国家和其他国家/地区的价格或报销水平进一步承压。如果我们的候选药物无法获得报销或报销范围或金额有限,或者如果定价水平不令人满意,我们的业务、收入或 盈利能力可能会受到损害。
与美国存托凭证所有权相关的风险
美国存托凭证的交易价格可能会波动, 而美国存托凭证的购买者可能会遭受重大损失。
我们普通股的市场价格在历史上一直是,我们预计我们的普通股和美国存托凭证的市场价格将继续保持不变,受到 短期大幅波动的影响。这些波动可能是由于我们特有的因素、分析师建议和收益估计的变化、我们在澳大利亚上市的普通股和在纳斯达克上市的美国存托凭证之间的套利、汇率的变化,或者影响生物制药行业或整个证券市场的 因素。市场波动,以及一般政治和经济状况,如经济衰退、利率或货币波动,都可能对我们证券的市场价格产生不利影响。
无论我们的经营业绩如何,我们的股票市场价格都可能出现实质性的 下跌。因此,我们的美国存托凭证持有人可能无法 以该持有人为该等美国存托凭证支付的价格或高于该等美国存托凭证的价格出售该等美国存托凭证。我们的美国存托凭证价格下降可能是多种因素造成的,包括许多我们无法控制的因素。这些因素包括:
| ● | 我们和我们的竞争对手的临床前试验和临床试验结果; |
| ● | 因候选药物的临床试验或商业使用而产生的不可预见的安全问题或不良副作用; |
19
| ● | 对我们的任何候选药物或我们的任何竞争对手的产品和服务采取的监管行动; |
| ● | 我们或我们的竞争对手推出新产品或服务的公告; |
| ● | 市场状况,包括制药和生物技术部门的市场状况; |
| ● | 由于外汇汇率的不利变动,我们的成本增加或收入减少; |
| ● | 与专利、许可和其他知识产权有关的开发或诉讼; |
| ● | 诉讼或公众对我们的候选药物安全性的担忧; |
| ● | 变更证券分析师的推荐或盈利预期; |
| ● | 我们季度经营业绩的实际和预期波动; |
| ● | 我们的经营业绩与证券分析师的估计存在偏差; |
| ● | 有关我们或我们的竞争对手的谣言; |
| ● | 关键人员的增减; |
| ● | 第三方报销政策的变化;以及 |
| ● | 关于当前或未来的战略联盟或收购的发展。 |
此外,我们美国存托凭证的波动性和较低的市场价格可能会对投资者对我们证券的兴趣产生不利影响。投资者兴趣下降 可能会促使市场价格进一步波动和下跌。
如果我们是或将成为被动外国投资公司(“PFIC”),那么我们的美国股东将受到不利的税收规则的约束。
如果我们是PFIC,我们的美国存托凭证的持有者是美国纳税人,将受到特定的所得税规则的约束。这些规则可能会导致税后退还给我们的美国存托凭证“美国持有人”的费用减少,并降低我们的美国存托凭证的价值。出于美国联邦所得税的目的,我们将在以下任何纳税年度被归类为PFIC:(I)我们总收入的75%或更多是被动收入,或者(Ii)在该纳税年度我们所有资产的平均价值中至少有50%是为产生被动收入而生产或持有的。
如果我们在美国持有人拥有ADS的任何一年被归类为PFIC,则该美国持有人在随后的所有 年通常将继续被视为持有PFIC的ADS,尽管我们在下一年未被归类为PFIC。美国持有者收到的股息和出售我们的美国存托凭证所实现的收益将作为普通收入征税,并收取利息费用。我们敦促美国投资者就PFIC规则的应用和某些选举咨询他们自己的税务顾问,这些选举可能有助于在其特定情况下将美国联邦所得税的不利后果降至最低。有关详细信息,请参阅第10.E项-附加信息- 税收-美国税收。
作为一家上市公司的要求 可能会使我们的资源紧张,并转移管理层的注意力。
作为一家在美国上市的公司,IncanneX必须遵守1934年《美国证券交易法》(以下简称《证券交易法》)、《萨班斯-奥克斯利法案》和适用的证券规则和条例的报告要求。遵守这些法律将增加我们的法律 和合规成本,使某些活动更加困难、耗时或成本高昂,并增加对我们系统和资源的需求。 《交易法》要求我们以Form 20-F和某些其他报告的形式提交本年度报告。《萨班斯-奥克斯利法案》要求我们对财务报告保持有效的披露控制和程序以及内部控制。为了维持并在需要时改进我们对财务报告的披露控制和程序以及内部控制以达到这一标准,需要大量资源 和管理监督。因此,管理层的注意力可能会被转移到其他业务上,从而对我们的业务和运营结果产生不利影响。
20
《萨班斯-奥克斯利法案》(Sarbanes-Oxley Act)要求我们评估我们对年度财务报告以及披露控制和程序的内部控制的有效性。如果我们发现重大弱点或不能及时遵守第404节的要求,我们报告的财务业绩可能会被重述,和/或我们可能受到监管机构的调查或制裁,这将需要额外的 财务和管理资源,我们证券的市场价格可能会下跌。
我们可能会受到《萨班斯-奥克斯利法案》(Sarbanes-Oxley Act)下的审计师认证要求的约束,即使我们的收入很少或没有收入,这也会给我们带来巨大的成本和管理负担 。
我们目前符合 “新兴成长型公司”的资格,因此,在评估财务报告的内部控制时,不受2002年萨班斯-奥克斯利法案第404条的审计师认证要求的限制。我们预计将一直是一家新兴的成长型公司,直到我们的财政年度的最后一天,即我们在美国首次公开募股完成五周年之后的最后一天。一旦 我们不再是一家新兴成长型公司,并且截至我们最近完成的第二财季,我们的非关联公司持有的有投票权股权的全球总市值超过了7,500万美元,我们将在评估财务报告的内部控制时遵守审计师的认证要求 。
虽然美国证券交易委员会(“美国证券交易委员会”)已经承认小公司的审计师认证要求的巨大成本,并为收入低于1亿美元的美国“较小的报告公司”提供了豁免,但美国证券交易委员会已决定 不对外国私人发行人(如IncanneX)进行类似的豁免,除非它们遵守美国公司的报告要求, 包括根据美国公认会计原则提交财务报表。鉴于美国证券交易委员会和澳交所规则下不一致的报告义务导致的巨额成本和行政负担,如果IncanneX不再是一家“新兴的成长型公司”,并且我们的非关联公司持有的投票权股权的全球市场总价值超过7,500万美元,我们可能不可能遵守美国证券交易委员会对美国公司的报告要求 。
在这种情况下,考虑到我们有限的人员数量,我们可能 有义务产生巨额合规成本(美国证券交易委员会估计,2019年为遵守萨班斯-奥克斯利法案第404条下的认证要求,这笔费用为每年210,000美元)和行政负担。如果此类成本 变得太大,我们可以重新考虑在纳斯达克上市,因为正如美国证券交易委员会已经承认的那样,为一家小公司节省的成本可以用于更具生产力的用途,如发展公司。
我们因融资、收购、投资或其他原因而增发普通股 将稀释所有其他美国存托股份持有者的权益。
我们预计未来将增发 普通股,这将导致对所有其他美国存托股份持有者的稀释。我们未来还可能通过股权融资来筹集资金 。作为我们业务战略的一部分,我们可能会收购或投资于互补的公司、产品或技术,并发行股权证券来支付任何此类收购或投资。虽然我们将受到澳交所上市规则 关于我们能够在12个月内发行的资本百分比的限制(视适用的例外情况而定),但任何此类额外发行普通股的 都可能导致美国存托股份持有人的所有权权益大幅稀释,以及我们的美国存托凭证的每股美国存托凭证价值下降。
只要我们仍然遵守澳交所的规则 ,我们可能无法在没有股东批准的情况下进行某些类型的融资,如果此类融资会导致 股票发行超过监管门槛,因此,如果我们未能获得必要的股东批准,我们可能无法获得足够的融资来维持我们的业务 。
我们获得股权资本的能力受到ASX上市规则7.1的限制,该规则规定,除某些类型的 发行的股票外,公司不得(E.g.、配股要约)或经股东批准,在任何连续的12个月期间内发行或同意发行任何股权证券或其他有权转换为股权的证券,前提是该等证券的总数将超过该12个月期间开始时已发行普通证券数量的15%。
21
只要我们继续在澳交所上市,我们的股票发行将 受到澳交所上市规则7.1的限制,这一限制可能会阻止我们在未经股东事先批准的情况下筹集运营所需的全部股本,或在这一限制的 例外情况(如配股发行)内安排融资。
我们受到与汇率波动相关的风险的影响,外币汇率的变化可能会影响我们的运营结果。
我们的普通股在澳交所以澳元报价,美国存托凭证将以美元报价。澳元币值的任何重大变化 都可能对美国存托凭证的美元价值产生负面影响。此外,如果澳元兑美元走弱,那么,如果我们决定出于任何商业目的将澳元兑换成美元,美元兑澳元的升值将对我们可用的美元数量产生负面影响。由于我们需要将我们收到的美元兑换成澳元用于我们的运营,因此澳元对美元的升值将对我们从兑换中获得的澳元金额产生负面影响。因此,澳元相对于美元的升值或贬值 将影响我们以美元计价的财务业绩,而不会影响我们业务或经营业绩的任何潜在变化。由于这种外币波动, 可能更难发现我们业务和运营结果的潜在趋势。
我们的美国存托股份持有者不是股东, 没有股东权利。
德意志银行作为存托机构,登记和交付我们的美国存托股份或ADS。我们的美国存托股份持有者不会被视为股东,也不享有股东权利。托管银行将是我们美国存托凭证相关股票的持有者。我们的美国存托凭证持有者将拥有美国存托股份持有者 权利。我们、托管银行和我们的美国存托股份持有人以及美国存托凭证的实益拥有人之间的存款协议规定了美国存托股份持有人的权利以及托管银行的权利和义务。纽约州法律管辖存款协议和美国存托凭证。美国存托股份持有人权利说明见本年报《证券说明》。
我们的股东拥有股东权利 。澳大利亚法律和我国宪法规定了股东权利。有关我们股东权利的说明,请参阅本年度报告中的“备忘录和公司章程”。股东有权获得我们的股东大会通知,并有权出席我们的股东大会并在股东大会上投票。在股东大会上,每位出席并有权投票的股东(亲身或委派代表、代理人或代表) 在举手表决时有一票。每位有权投票的出席股东(亲身或委派代表、代理人或代表)及 每股缴足股款的普通股在投票表决中有一票投票权。这受任何股份可能附带的任何其他权利或限制的约束。
我们的美国存托股份持有者不具有与我们的股东相同的投票权。根据存款协议的规定,美国存托股份持有人只能对标的普通股行使投票权 。根据存款协议,美国存托股份持有者通过向托管机构发出投票指令进行投票。一旦收到指示,保管人将尝试按照这些指示进行表决。否则,美国存托股份 持有者将无法投票,除非他们提取其美国存托凭证相关的普通股。
如果我们要求我们的美国存托股份持有者的 指示,托管银行将通知我们的美国存托股份持有者即将进行的投票,并安排将我们的投票材料和 通知格式发送给他们。托管人将在实际可行的情况下,根据澳大利亚法律和托管协议的规定,尝试按照我们美国存托股份持有人的指示对股票进行投票。除非按照美国存托股份持有人的指示,否则托管银行不会投票或试图行使投票权。我们不能向我们的美国存托股份持有人保证,他们会了解到普通股东大会的情况,并及时收到投票材料,以通知托管人或撤回相关普通股。这意味着 我们的美国存托股份持有者可能无法行使投票权,如果他们的股票没有按他们的要求进行投票,他们可能无能为力。
22
我们的美国存托股份持有者不具有与我们的股东相同的权利 来获得股息或其他分配。
在任何特别权利或股份附带的限制的规限下,董事可厘定股份将派发股息,并厘定股息的金额、支付时间及支付方式(尽管吾等从未就普通股宣布或支付任何现金股息,且我们 预期在可预见的将来不会派发任何现金股息)。股息可以支付给一个类别的股票,但不能支付另一个类别的股票,并且不同类别的股票按不同的 比率支付股息。就普通股而言,应付予股东的股息及其他分派将直接支付予股东。与普通股有关的任何应付股息或分派将支付给托管人, 托管人同意在扣除费用和支出后,将其或托管人从股票或其他已交存证券上收到的现金股息或其他分派支付给我们的美国存托股份持有人。我们的美国存托股份持有者将根据其美国存托凭证所代表的股份数量按比例获得这些分配。 此外,在某些情况下,托管机构可能不会向我们的美国存托股份持有人支付我们作为股息或分派分发的金额 。
在某些情况下,向我们的美国存托凭证持有人分发产品可能是违法或不切实际的。
与托管银行签订的托管协议一般要求托管银行将其从托管证券中获得的外币兑换成美元,并将美元分发给美国存托股份持有人,前提是托管银行能够在合理的基础上这样做。如果不兑换外币,托管银行只能将外币分发给美国存托股份持有者。如果分销 由我们以澳元支付,则托管机构将持有无法转换的外币,用于尚未支付的美国存托股份持有人的账户中。它不会投资外币,也不会对任何利息负责。如果汇率在托管人无法兑换外币期间波动,我们的美国存托股份持有人可能会损失部分分派的价值。 如果托管人认为向任何美国存托股份持有人提供分派是非法或不切实际的,则托管人不承担任何责任。 这意味着如果我们向美国存托股份持有人提供股票或他们的任何价值是非法或不切实际的,则他们可能无法收到我们对我们的股票或他们的任何价值进行的分派。
美国存托凭证持有人可能无权对存款协议项下产生的索赔进行陪审团审判,这可能预示着原告(S)在任何此类诉讼中的不利结果 。
管理代表我们普通股的美国存托凭证的存款协议规定,美国存托凭证的持有人和实益拥有人在适用法律允许的最大限度内,在因存款协议或美国存托凭证而引起或与之相关的任何法律诉讼中,不可撤销地放弃由 陪审团进行审判的权利。如果此陪审团审判豁免条款被适用法律禁止,诉讼仍可根据陪审团审判的存款协议条款继续进行。据我们所知,根据联邦证券法,陪审团审判豁免的可执行性尚未由联邦法院最终裁决。然而,我们认为,根据管辖存款协议的纽约州法律,陪审团审判豁免条款通常可由纽约州法院或联邦法院执行,该法院或联邦法院对存款协议项下产生的事项具有非排他性管辖权,适用此类法律。
在确定是否执行陪审团审判豁免条款时,纽约法院和联邦法院将考虑协议中陪审团审判豁免条款的可见性是否足够突出,以至于一方当事人故意放弃任何由陪审团审判的权利。我们认为 存款协议和美国存托凭证都是如此。此外,纽约法院将不会强制执行陪审团审判豁免条款,以阻止可行的抵销或反索赔听起来像欺诈或基于债权人疏忽的抵押品未能应担保人的要求清算抵押品,或在故意侵权索赔的情况下(相对于合同纠纷),我们认为这些都不适用于存款协议或美国存托凭证的情况。存款协议或美国存托凭证的任何条件、规定或条款 均不构成美国存托凭证的任何持有人或实益所有人、或我们或合规托管机构对联邦证券法任何规定的放弃。如果您或美国存托凭证的任何其他持有人或实益拥有人就存款协议或美国存托凭证项下所产生的事宜向吾等或 托管银行提出索赔,阁下或该等其他持有人或实益拥有人可能无权就该等索赔进行陪审团审判,这可能会限制和阻止针对吾等和/或托管银行的诉讼。
如果根据存款协议对我们和/或托管人提起诉讼,则只能由适用的初审法院的法官或法官进行审理, 将根据不同的民事程序进行审理,并可能决定与陪审团审判不同的结果,包括在任何此类诉讼中可能对原告(S)不利的结果,具体取决于索赔的性质、审理此类索赔的法官或法官以及听证地点等。
23
由于陪审团审判豁免涉及 由ADS或存款协议产生或与ADS或存款协议相关的索赔,我们认为该豁免可能继续适用于二级交易中ADS的 购买者。此外,我们认为,豁免可能会继续适用于从ADS设施中撤回普通股的ADS持有人或 受益所有人,这些持有人或受益所有人涉及在取消 ADS和撤回普通股之前产生的索赔,豁免可能不适用于ADS持有人或受益所有人,他们随后 从ADS融资中撤回由ADS代表的普通股,以解决撤回后产生的索赔。然而,据 我们所知,对于从ADS设施中撤回 ADS所代表的普通股的ADS持有人或受益所有人,没有适用陪审团审判豁免的判例法。然而,如果适用的 法律不允许陪审团审判豁免,则诉讼可以根据存款协议的条款进行陪审团审判。 存款协议或美国存托证券的任何条件、规定或条款均不构成美国存托证券的任何所有人或持有人或我们或存托人放弃遵守美国联邦证券法的任何实质性 条款以及据此颁布的规则和法规。
与我们在澳大利亚的位置有关的风险
澳大利亚的收购法可能会阻碍 对我们的收购要约,或可能会阻碍对我们大量股份的收购。
Incannex在 澳大利亚注册成立,并受澳大利亚收购法和2001年公司法(澳大利亚联邦)的约束。受一系列例外情况 的影响,《公司法》禁止收购我们已发行的有表决权的股份的直接或间接权益(包括 通过收购ADS),如果收购该权益将导致某人或其他人在我们的投票权 从20%或以下增加到20%以上,或从20%以上和90%以下的起点增加。除此之外, 一般禁止包括以下情况:该人对我们提出正式收购要约,该人获得股东批准收购,或者该人在任何连续六个月内获得的投票权少于我们的3%。澳大利亚的收购 法律可能会阻碍对我们的收购要约,或可能会阻碍对我们大量股份的收购。
我们的普通股或ADS的持有人可能 在美国执行法律程序或执行在美国获得的判决方面遇到困难。
我们的普通股 或ADS的持有人在向美国境外司法管辖区的法院提起诉讼时,美国债务 证券法。特别是,如果此类持有人寻求根据美国证券法在澳大利亚提起诉讼,澳大利亚 法院可能会考虑:
| ● | 它没有管辖权; |
| ● | 它不是进行这种程序的适当论坛; |
| ● | 适用澳大利亚法律冲突规则,美国法律不适用于我们的普通股或ADS持有人与我们或我们的董事和高级职员之间的关系;和/或 |
| ● | 美国证券法具有公共或刑事性质,不应由澳大利亚法院执行。 |
我们的普通股 和ADS的持有人也可能难以在美国以外的法院执行在美国法院获得的针对我们的任何董事 和执行官或我们的判决,包括根据美国证券法的民事责任条款提起的诉讼。
24
作为一家外国私人发行人,其股票 在纳斯达克全球市场上市,我们可能会遵循某些母国公司治理惯例,而不是某些纳斯达克要求。
作为ADS在纳斯达克全球市场上市的“外国私人 发行人”(如SEC规则所定义),我们被允许遵循某些 母国公司治理惯例,而不是纳斯达克市场规则的某些要求。作为一家澳大利亚公司, 我们在董事会的组成和董事提名流程方面可能会遵循澳大利亚本国的惯例。 此外,我们可能会遵循澳大利亚法律,而不是纳斯达克市场规则,该规则要求我们就 某些事件获得股东批准。因此,我们的美国股东可能无法获得适用于美国公司的纳斯达克公司治理规则所提供的相同保护。
作为一家外国私人发行人,我们 不受美国证券法规定的许多规则的约束,并且允许向SEC提交的信息少于美国公司。
作为外国私人发行人, 我们不受适用于美国上市公司的相同披露要求的约束。例如,我们不受《交易法》下的某些规则的约束,这些规则规范了与《交易法》下的委托书征集相关的披露义务和程序要求。此外,我们的高级管理层和董事免于遵守《交易法》第16条的报告和“短期”利润回收规定以及与他们购买和销售我们的证券有关的相关规则。此外, 虽然我们目前每年和每半年提交一次报告,但我们不需要像美国上市公司那样频繁或及时地向 SEC提交定期报告和财务报表,这些公司使用10-Q表格提交季度报告。因此,我们的美国股东将 不会从我们那里获得适用于美国公司的相同水平的披露。
未来我们的外国私人发行人地位的任何丧失都可能导致显著的额外成本。
虽然我们目前有资格 作为外国私人发行人,但外国私人发行人地位的确定每年在发行人最近完成的第二财季的最后一个工作日进行。在未来,如果我们未能达到在相关确定日期保持我们的外国私人发行人地位所需的 要求,我们将失去外国私人发行人身份。例如,如果我们50%或更多的证券由美国居民持有,而我们的高级管理人员或董事超过50%是美国居民或公民,我们可能会失去外国私人发行人的身份。
根据美国证券法,我们作为美国国内发行人的监管和合规成本可能远远高于我们作为外国私人发行人的成本 。如果我们不再是外国私人发行人,我们将被要求就美国国内发行人表格向美国证券交易委员会提交定期报告和注册声明,这些表格在某些方面比外国私人发行人提供的表格更详细和广泛。我们将被要求按照美国公认会计准则而不是国际财务报告准则编制财务报表。将我们的财务报表转换为美国公认会计原则将涉及大量的时间和成本。此外,我们可能无法 依赖美国证券交易所向外国私人发行人提供的某些公司治理要求的豁免 ,以及与征求委托书相关的程序要求的豁免。
美国投资者可能难以对本年度报告中提到的我们的公司、我们的董事或高级管理人员执行民事责任。
本年度报告中点名的我们的高级管理层和董事会中的某些成员是非美国居民,这些人的资产有很大一部分位于美国以外。因此,根据美国证券法的民事责任条款,在美国向这类人送达诉讼程序或执行在美国法院获得的针对他们的判决可能是不切实际的。即使您成功提起此类诉讼,澳大利亚法院是否会根据这些民事责任条款在最初的诉讼或美国法院的判决中执行美国证券法规定的某些民事责任也是值得怀疑的 。此外,在美国或其他地方提起的诉讼中,惩罚性赔偿的裁决可能在澳大利亚或美国以外的其他地方不可执行。如果根据美国证券法作出的金钱损害赔偿裁决不寻求赔偿索赔人所遭受的损失或损害,而是为了惩罚被告,则将被视为惩罚性裁决。任何判决在澳大利亚的可执行性 将取决于案件的具体事实以及当时生效的法律和条约。
因此,与在美国司法管辖区注册的公司的股东 相比,我们的美国股东 可能更难通过针对我们、我们的管理层或董事的诉讼来保护他们的利益。此外,作为一家在澳大利亚注册成立的公司,2001年《澳大利亚公司法》的条款 规定了可以启动股东派生诉讼的情况,这些情况可能与在美国注册成立的公司不同,而且在许多方面不那么宽松。
25
第4项:本公司的相关信息。
| A. | 公司的历史与发展 |
我们的法定名称是IncanneX Healthcare Limited(“IncanneX”)。我们于2001年4月在澳大利亚注册成立,名称为mount Magnet South Limited。 2016年11月,我们更名为Impression Healthcare Limited,并于2020年6月更名为IncanneX Healthcare Limited。IncanneX于2016年在澳交所上市,2022年2月在纳斯达克上市。
自2019年以来,我们一直在进行医用大麻药品和迷幻药物疗法的研发,用于治疗一系列适应症 。
2019年1月,维多利亚州卫生部向我们发放了销售或供应大麻类物质的许可证,特别是大麻、大麻二醇(CBD)、四氢大麻酚(THC)和Dronabinol。
2020年6月,我们停止销售用于体育活动的口罩,将我们的资源集中在大麻类药物的销售和开发活动上。因此,在2020年6月30日,我们出售了我们的全资子公司Gameday International Pty Ltd.。
2021年6月,为了 专注于开发我们的候选药物,我们终止了销售大麻类产品的分销协议,因此,自那时以来,一直没有销售过此类产品。
2022年8月,我们收购了专注于处方药大麻类药物研发的APIRx Pharmtics USA,LLC。我们以每股0.225澳元的价格发行了218,169,497股普通股,以换取APIRx的100%股权。收购完成后,APIRx的创始人George Anastassov博士和Lekhram Changoer先生分别以董事和首席技术官的身份加入IncanneX。虽然APIRx在收购时拥有知识产权,但它没有任何其他重大资产或负债 。收购APIRx为IncanneX提供了实现重大价值增长的长期和短期机会。APIRx 拥有二十二(22)个活跃的临床和临床前研究和开发项目,其中包括18项已授权专利和21项正在申请的专利。它拥有多种有前途的候选治疗方案,目标是治疗各种疾病,包括疼痛障碍、成瘾障碍、精神疾病、胃肠道疾病、牙周病、皮肤疾病和眼科疾病。所追求的指标代表了每年4000亿美元的潜在市场总额。
我们于2023年7月10日宣布,我们打算根据我们与股东之间的澳大利亚法律(“股票计划”)以及我们与我们的购股权持有人(“购股权计划”) 根据澳大利亚法律建议的安排计划(“计划”)从澳大利亚迁至美国特拉华州。 计划的实施需要得到我们的股东(关于股票计划)和我们的购股权持有人(关于期权计划)的批准以及澳大利亚其他监管和法院的批准。如果计划获得批准,我们的所有股东和期权持有人 将分别是IncanneX Healthcare Inc.的普通股或期权持有人,IncanneX Healthcare Inc.是在特拉华州注册的新母公司,将在纳斯达克作为我们的继任者上市。。这些计划的实施日期预计为2023年11月28日。我们的普通股预计将在该日期之前在澳交所停止交易,我们的美国存托凭证预计将于2023年11月27日在纳斯达克 停止交易。IncanneX Healthcare Inc.将根据股票计划发行的普通股预计将于2023年11月29日在纳斯达克开始交易。
我们的注册办事处位于澳大利亚新南威尔士州西北2153号8世纪电路105室,我们的电话号码是+61 409 840 786。我们在美国的流程服务代理是Vcorp Services,LLC(“流程代理”),现位于纽约州蒙西市罗伯特·皮特大道25号Suite204,邮编:10952。我们在互联网上的地址是www。Incexene.com.au。我们网站上的信息或通过我们网站访问的信息不属于本《Form 20-F》年度报告的一部分。我们向美国证券交易委员会(“美国证券交易委员会”)提交的所有信息均可通过美国证券交易委员会的电子数据收集、分析和检索系统获取,该系统可通过美国证券交易委员会的网站www.sec.gov访问。
| B. | 业务概述 |
IncanneX是一家开发大麻类和迷幻复合药物的生物技术公司。
最近对APIRx的收购为IncanneX带来了一系列前景看好的候选治疗产品组合,旨在治疗各种疾病,包括疼痛、不宁腿综合症、胃肠道疾病、牙周炎、皮肤疾病和眼科疾病。
收购APIRx加强了我们在大麻素和迷幻治疗开发领域的地位。特别是,它:
| ● | 增加了一大批知识产权,包括已授予和正在申请的专利; |
| ● | 显著扩大IncanneX的全球可寻址市场和可寻址市场规模; |
| ● | 进一步加强IncanneX的技术和药物开发能力;以及 |
| ● | 扩大IncanneX的药物输送能力,将APIRx的专利输送技术包括在内。 |
26
战略
我们的使命是为未得到满足或未得到满足的医疗需求的患者创造最好的 合乎道德的药物和疗法,在所有情况下满足FDA和其他相关监管机构的监管要求。我们的目标是被公认为领先的特种药物开发公司, 致力于通过开发新的药物产品和治疗方法来恢复健康并改变患者的生活。
我们与仿制合作伙伴、独特的大麻素配方和迷幻剂一起开发有针对性的、经过科学验证的固定剂量大麻类药物组合, 应用专有见解努力为我们的患者和股东创造长期价值。我们专注于临床适应症 ,我们认为这些适应症代表了未得到满足或未得到充分解决的医疗需求,也代表了引人注目的商业机会。特别是,我们正在开发三种独特的药物成分,针对五种适应症:阻塞性睡眠呼吸暂停(OSA)、创伤性脑损伤和脑震荡(TBI)、类风湿性关节炎(RA)、炎症性肠道疾病(IBD) 和炎症性肺部疾病(ARDS、COPD、哮喘、支气管炎)。我们还利用裸盖菇素和创新的心理治疗方法开发了一种治疗广泛性焦虑症(GAD)的方法。通过收购APIRx,我们还在开发针对另外22种适应症的大麻素产品。其中进展最快的是与多发性硬化症、肠易激综合征、阿片成瘾、戒烟、大麻使用障碍、白癜风、特应性皮炎和牛皮癣相关的疼痛和痉挛。我们正在为正在开发的每一种产品和疗法寻求FDA的注册和营销批准。
此外,我们寻求与我们的医疗和科学人员、顾问和研究研究的调查人员一起确保我们候选药物的专利 ,这些人员构成了我们的顾问委员会。我们的顾问委员会由熟悉我们业务的行业和学术专家组成,我们 定期与顾问委员会会面。我们顾问委员会的现任成员是Mark Bleackley博士(我们的首席科学官)、 George Anastassov博士(非执行董事)、Lekhram Changoer(我们的首席技术官)、Rosemarie Walsh(我们的临床运营副总裁) 和Paul Liounaitsky博士(来自莫纳什大学的迷幻首席研究员)。
为了实现我们的目标,我们打算 :
| ● | 推动我们的新型研究候选药物在美国和其他地方获得批准。我们正在寻求FDA批准我们目前正在开发的所有候选药物。所有临床前和临床试验的结构都是为了确保每个项目都符合FDA的要求。我们将针对我们的每一种候选药物向FDA申请新药申请(NDA)。如果保密协议获得批准,该产品可能会在美国上市。一旦我们候选药物的NDA在美国获得批准,我们计划在欧盟、日本、澳大利亚和以色列等其他地区寻求我们候选药物的上市批准。 | |
| ● | 利用我们候选药物的加速商业化途径选项. 我们和我们的监管顾问认为,我们的每个候选药物都将有资格获得一个或多个FDA快速审查计划(突破性指定、加速批准、优先审查和/或快速通道),因为美国批准的治疗我们候选药物的适应症的药物治疗数量有限,而且确实存在的药物治疗提供的治疗有限且成本高昂。与传统的监管途径相比,这些快速审查计划通常会导致审批的监管途径更快、成本更低。我们还没有就我们的产品是否适合这些加速审批途径与FDA接洽,这样的指定并不能保证FDA加快审查。 | |
| ● | 开发针对未得到满足的医疗需求的未来候选药物。我们打算开发治疗未得到满足的医疗或未充分解决的疾病的候选药物。因此,我们可能有机会加快此类产品的商业化进程。 | |
| ● | 保持强大的知识产权组合。我们制定了一项全球知识产权战略,以支持我们的商业目标。我们正在监测我们的研究和开发计划的结果,以确定符合这些商业目标的新知识产权。我们打算以全球的方式实施我们的知识产权战略,并打算在包括美国、欧洲、日本和以色列在内的关键全球市场寻求专利保护。我们有与我们的候选药物IHL-42X、IHL-216A和IHL-675A相关的未决专利申请,我们还拥有另外18项已授予专利和21项未决专利,这些专利来自对APIRx的收购。我们的专利方法与我们的监管战略一致,包括为我们的临床计划向FDA提交研究前新药申请(Pre-IND)满足请求和研究新药(IND)申请。 |
27
临床方法
我们正在为目前正在开发的所有候选药物寻求FDA的批准。我们将继续与FDA合作,确保每个临床项目的结构符合法规要求。在成功完成3期研究后,将寻求FDA的批准。一旦我们的候选药物获得FDA的批准,我们将能够在美国将我们的候选药物商业化,并寻求监管部门的批准 该药物将在其他司法管辖区上市,包括欧洲、日本、澳大利亚和以色列。
市场机遇
我们所瞄准的适应症的全球年市场规模合计超过4200亿美元,这源于我们正在开发候选药物的所有适应症的治疗 的总目标市场。正在寻求的适应症包括:阻塞性睡眠呼吸暂停综合征、脑外伤、脑震荡、类风湿性关节炎、炎症性肠道疾病、炎症性肺部疾病(ARDS、COPD、哮喘、支气管炎)、广泛性AD、疼痛、痉挛、不宁腿综合征、胃肠道疾病、牙周炎、皮肤状况和眼科状况。因此,股东有巨大的经济潜力,这些疾病的患者也能从中受益。
我们的候选药物
IHL-42X
阻塞性睡眠呼吸暂停
阻塞性睡眠呼吸暂停(“OSA”) 的特征是睡眠时上呼吸道狭窄或阻塞,干扰呼吸,干扰睡眠。阻塞性睡眠呼吸暂停综合症是一种睡眠呼吸紊乱的疾病,在睡眠中上呼吸道反复完全或部分塌陷。这会扰乱气流,减少氧气摄取,导致睡眠质量不佳。OSA的表现通常包括打鼾声和醒来时喘气。 这种相对常见的慢性疾病没有得到充分的诊断和治疗。据了解,它会导致一系列严重的长期后果,包括心血管疾病、认知障碍,如记忆力丧失、注意力不集中和判断力差、抑郁和因白天过度嗜睡导致的交通事故造成的死亡或受伤。与OSA相关的成本是巨大的,涉及医疗保健利用率损失、工作场所和机动车辆事故。
《柳叶刀》2019年发表的一篇文章基于对16个国家的17项研究的文献分析,估计阻塞性睡眠呼吸暂停综合征影响全球约9.36亿成年人 。这一令人担忧的统计数据也被认为由于肥胖的流行和全球人口老龄化而增加。 许多OSA患者患高血压(高血压),这会增加患心血管疾病的风险。阻塞性睡眠呼吸暂停越严重,患冠状动脉疾病、心脏病发作、心力衰竭和中风的风险就越大。
没有用于OSA的注册药物 。目前的治疗方案包括:持续气道正压(“CPAP”),即外部设备以气动方式将呼吸道打开,以防止呼吸中断;口腔矫治器,以推进下颌或保留舌头,使口腔处于更有利于呼吸的位置;手术,以消除气流的物理障碍;以及植入式电子刺激器 ,以激活舌根肌肉,使呼吸道与呼吸同步打开。然而,所有这些疗法都耐受性差、不够用、价格昂贵,而且对于植入式刺激器和手术来说,是侵入性的。
标准的治疗方案是机械CPAP设备,然而,由于睡眠期间将加压空气泵入患者的鼻子和/或口腔而导致的不适和幽闭恐惧症,患者对CPAP设备的依从性较低。尽管存在这些不适,但全球睡眠呼吸暂停设备的年市场规模仍超过80亿美元,而且还在不断增长。从2023年到2033年,使用CPAP设备检测和治疗阻塞性睡眠呼吸暂停综合征的复合年增长率(CAGR)估计为9.5%。
IHL-42X与阻塞性睡眠呼吸暂停
IHL-42X是一种固定剂量的药物组合,由注册药物乙酰唑胺和羟丙基-9-四氢大麻酚(“THC”)的合成形式屈奴麻酚组成;这两种药物都已被证明可以降低呼吸暂停低通气指数(“AHI”)。我们认为,Dronabinol在大麻素受体上的活性会导致呼吸道扩张,而乙酰唑胺会引起轻微的代谢性酸中毒,向身体发出血液中有过量二氧化碳的信号,从而增加呼吸。通过利用两种机制,在一个药物配方中都可以降低AHI,我们 相信IHL-42X在每种成分药物的剂量都是安全和耐受的情况下具有治疗益处。
28
IHL-42X治疗阻塞性睡眠呼吸暂停2期临床试验(“OSA”)
我们最近在澳大利亚完成了一项概念验证第二阶段临床试验,以确定IHL-42X治疗阻塞性睡眠呼吸暂停的安全性和有效性 支持我们与FDA的研究新药(“IND”)申请,并为关键的2/3阶段临床试验的临床设计提供信息。
我们于2020年9月获得了Alfred医院人类研究伦理委员会的批准,可以在澳大利亚继续进行试验。2020年12月,我们招募了第一批患者参加随机、双盲、安慰剂对照临床试验,评估三种不同剂量IHL-42X的治疗益处。试验的主要终点是AHI相对于基线的变化,次要终点包括氧减饱和指数(ODI)的变化,用Epworth嗜睡量表测量的日间嗜睡,用情绪状态简表(POMS)测量的情绪改善 ,用简表36测量的幸福感,通过不良事件监测评估IHL-42X联合用药的安全性。
这项研究是在澳大利亚墨尔本的阿尔弗雷德医院和珀斯的西澳大利亚大学睡眠科学中心进行的。全球合同研究机构Novotech受聘管理和监督这项研究。2021年7月,对第二阶段双盲随机安慰剂对照临床试验的数据进行了保密的中期分析,这些结果被用来支持一项关于治疗阻塞性睡眠呼吸暂停的组合物和使用方法的专利申请。2021年12月,我们完成了第二阶段临床试验参与者的剂量分配。
2022年3月,我们宣布完成了对第2阶段概念验证临床试验的完整患者数据集的初步分析。这项研究评估了与安慰剂相比,三种剂量的IHL-42X在降低AHI方面的作用。试验参与者在四个为期七天的疗程中分别接受三种剂量的IHL-42X、低、中、高剂量的IHL-42X和安慰剂,间隔一周的洗脱期。共有11名参与者被招募到这项研究中,10名参与者参加了治疗周期的竞争。这项试验的交叉设计评估了所有10名试验参与者的低、中、高剂量的IHL-42X和安慰剂,与传统的平行手臂设计相比,增加了研究的力量。
在基线时,平均AHI 为42.84。在所有IHL-42X治疗期间(使用低、中、高剂量),平均呼吸抑制指数为23.81%,与基线呼吸抑制指数相比下降了44.4%(p值为0.0067)。在安慰剂治疗期间,平均AHI为40.08,与基线相比下降了6.4%(p值0.75)。总体而言,在至少一个剂量强度的IHL-42X治疗期间,60%的参与者经历了AHI下降超过50%(范围从55.0%到91.5%),从而导致的AHI低于20。此外,在IHL-42X的至少一个剂量强度的治疗期间,20%的参与者经历了 与基线相比超过80%(范围:82.7%至91.5%)的AHI下降。
2022年5月,在IND前的一次会议之后,FDA证实我们不需要在动物身上进行研究就可以批准用于IHL-42X的IND申请。FDA的这一决定将节省IncanneX的时间和成本。FDA为我们提议的长期开发战略提供了指导,包括在第二阶段和第三阶段关键研究中证明安全性和有效性的具体参数,这将确保我们能够根据持续的临床成功生成我们 向FDA申请新药所需的数据。
2022年6月,我们宣布对研究IHL-42X治疗阻塞性睡眠呼吸暂停综合征的第二阶段概念验证临床试验的数据进行了全面和完整的分析:
| ● | 下表列出了基线和每个治疗期的平均AHI数据。与基线相比,所有剂量的IHL-42X均可降低睡眠呼吸暂停患者的AHI。这一下降幅度大大超过了安慰剂的观察结果。 |
基线和每个治疗周期的平均AHI数据
| 基线 | 安慰剂 | 低 | 5~6成熟 | 高 | ||||||||||||||||
| 平均AHI | 42.84 | 40.08 | 21.13 | 22.22 | 27.78 | |||||||||||||||
| 标准偏差 | 20.33 | 18.16 | 15.92 | 15.52 | 17.61 | |||||||||||||||
| 相对于基准的减少百分比 | 不适用 | 6.44 | 50.69 | 48.13 | 35.16 | |||||||||||||||
| 与基线相比的P值 | 不适用 | 0.76 | 0.029 | 0.031 | 0.12 | |||||||||||||||
29
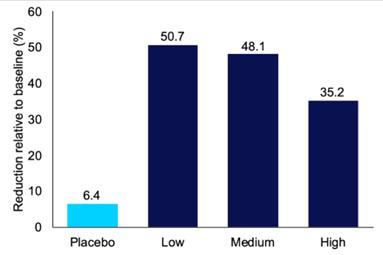
图1.在IHL-42X概念验证第二阶段临床试验中,与基线相比,每个治疗期的呼吸暂停低通气指数(AHI) 平均降低。
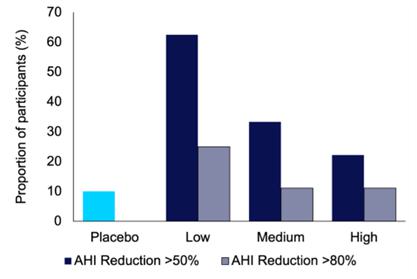
图2.与基线相比,在每个IHL-42X概念性治疗期间经历AHI降低>50%和>80%的患者比例。
| ● | 在组水平上,低剂量和中剂量组相对于基线的差异有统计学意义(p |
| ● | 当在患者体内直接与基线进行比较时,所有三种剂量和安慰剂之间的AHI与基线相比在统计学上有显著差异(p |
30
受试者内AHI较基线的变化(最小 均数)
| 平均变化
AHI来自 基线 | P值 相对于 安慰剂 (Bonferroni 调整) | 比例 个主题 AHI 减少 >50% 相对于 基线 (%) | 比例 个主题 AHI 减少 >80% 相对于 基线 (%) | |||||||||||||
| 安慰剂 | 1.95 | 不适用 | 10 | 0 | ||||||||||||
| 低 | 17.51 | 62.5 | 25 | |||||||||||||
| 5~6成熟 | 14.86 | 33.3 | 11.1 | |||||||||||||
| 高 | 16.18 | 22.2 | 11.1 | |||||||||||||
| ● | 与基线相比,低剂量IHL-42X可使62.5%的患者呼吸暂停低通气指数降低50%以上,25%的患者AHI降低80%以上。 |
| ● | 低剂量IHL-42X在组水平和比较患者内相对于基线的减少时,都最大程度地降低了AHI。 |
| ● | 低剂量的IHL-42X降低AHI的程度超过了仅根据已公布的屈诺比诺和乙酰唑胺数据所预测的程度(表3)。 |
根据已报道的数据,比较低剂量IHL-42X的AHI相对基线的降低和等剂量的成分药物作为单一疗法的预测降低。
| 在AHI中减少
相比于 基线 (%) | ||||
| 2.5毫克屈萝卜醇(1) | 23.4 | |||
| 125毫克乙酰唑胺(2) | 23.4 | |||
| 低剂量IHL-42X | 50.7 | |||
在IHL-42X治疗期间观察到的AHI的减少 意味着当使用我们的专利药物治疗时,患者在睡眠期间呼吸中断的次数较少 。这支持了我们的假设,即IHL-42X是治疗OSA的有效方法。此外,与同等剂量的屈诺比诺和乙酰唑胺相比,低剂量IHL-42X的AHI降低幅度更大,这支持了我们的假设,即这两种药物协同作用,产生了比屈诺比诺和乙酰唑胺作为单一疗法预期的更好的结果。
ODI是一种类似于AHI的测量方法,但它测量的是血氧水平不足或发生减饱和事件的次数。关于氧气减饱和指数(“ODI”),来自2期概念验证临床试验的数据支持如下:
| ● | 与安慰剂相比,与基线相比,所有三剂IHL-42X都能更大程度地减少ODI。 |
| ● | 对于低剂量和中剂量IHL-42X,与安慰剂相比,ODI相对于基线的减少差异具有统计学意义 (p |
31
在每个治疗期间,与基线相比,ODI减少了 。
| 相对于基线的对外直接投资减少(最小二乘平均值) | 相对于基线的对外直接投资减少(%) | 与安慰剂相比的P值(Bonferroni调整后) | ||||||||||
| 安慰剂 | 1.8 | 18.3 | 不适用: | |||||||||
| 低 | 11.7 | 59.7 | 0.021 | |||||||||
| 5~6成熟 | 12 | 59.0 | 0.012 | |||||||||
| 高 | 8.32 | 28.5 | 0.162 | |||||||||
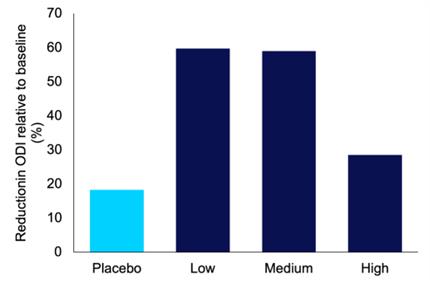
图3.在IHL-42X概念验证第二阶段临床试验中,与基线相比,每个治疗期的氧气减饱和指数(ODI)的平均降低。
这项研究还测量了患者血液中的血浆THC水平。在每次治疗期间,分别在服药后2小时和服药7天早上采集血浆样本。在注射7剂后的第二天早上,低剂量IHL-42X样本中的THC水平平均为0.20 ng/ml,最高为0.45 ng/ml, 这两个水平都低于已设定THC限制的国家规定的驾驶障碍阈值。中剂量和大剂量的IHL-42X在给药后第二天早晨的平均浓度分别为0.86和0.52。下图显示了在IHL-42X概念验证临床试验的每个治疗期间收集的血浆样本中THC的平均浓度。平均值是为检测到THC的样本计算的;在安慰剂治疗期间,这是一个单一样本。
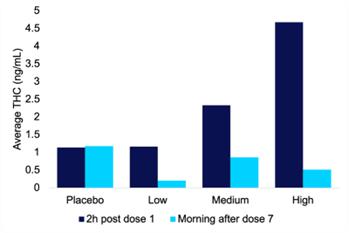
32
图4.采集的血浆样本中THC的平均浓度
在IHL-42X治疗期间,与安慰剂相比,患者更频繁地报告他们的睡眠质量很好或非常好。患者报告的睡眠质量最高的是低剂量和高剂量的IHL-42X。
患者报告在每个治疗期间的睡眠质量
| 受试者比例
报告 好或非常好 睡得好 质量 | ||||
| 安慰剂 | 26.50 | % | ||
| 低 | 49.49 | % | ||
| 5~6成熟 | 38.47 | % | ||
| 高 | 50.13 | % | ||
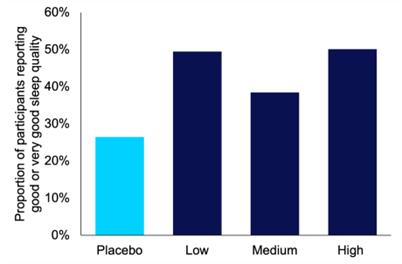
图5.在每个IHL-42X概念治疗期内报告良好或非常良好睡眠质量的患者比例。
在临床试验期间,患者佩戴了Actiwatch,这是一种类似手表的设备,使用动作记录仪来捕捉活动和睡眠的数据。与安慰剂(表6)相比,所有剂量的IHL-42X都能提高睡眠效率(患者在床上睡着的时间百分比)、每晚醒来的次数和每个患者夜间清醒的总分钟数(WASO)(表6)。这些改善在低剂量和高剂量的IHL-42X中最大。这意味着,在接受IHL-42X试验时,参与者在床上睡的时间更长,醒来的次数更少。
动作记录仪捕获的睡眠指标
| 安慰剂 | 低 | 5~6成熟 | 高 | |||||||||||||||
| 睡眠效率 | 平均值 | 76.83 | 84.81 | 81.34 | 84.17 | |||||||||||||
| 与安慰剂相比的P值 | 不适用 | 0.0048 | 0.058 | 0.0078 | ||||||||||||||
| 每晚的唤醒次数 | 平均值 | 49.31 | 35.8 | 41.44 | 37.33 | |||||||||||||
| 与安慰剂相比的P值 | 不适用 | 0.0053 | 0.055 | 0.012 | ||||||||||||||
| 瓦索(分钟) | 平均值 | 62.59 | 37.55 | 47.22 | 38.55 | |||||||||||||
| 与安慰剂相比的P值 | 北美 | 0.00011 | 0.0031 | 0.0010 | ||||||||||||||
33
从患者参加试验开始到研究访问结束,记录不良事件。在记录了治疗突发不良事件(“TEAE”)后,包括研究人员和医学监测人员在内的研究小组对TEAE进行了审查,以确定它们是否可能与研究产品有关。TEAE与已报道的单用屈诺比诺和乙酰唑胺的结果一致。对于每个治疗周期 报告一个或多个TEAE的患者的比例(表7)以及TEAE的总数(表8)从临床研究报告(“CSR”)中提取。低剂量IHL-42X的患者报告TEAE的比例与安慰剂组相似,而TEAE总数低于安慰剂组。这表明低剂量的IHL-42X耐受性很好,事实上,与安慰剂相比,试验参与者更容易耐受。
每个治疗周期内报告的TEAE受试者比例
| 安慰剂 | 低 | 5~6成熟 | 高 | |||||||||||||
| 总TEAE(%) | 81.8 | 33.3 | 55.6 | 66.7 | ||||||||||||
| 相关TEAE(%) | 27.3 | 22.2 | 44.4 | 55.6 | ||||||||||||
每次治疗期间报告的TEAE总数
| 安慰剂 | 低 | 5~6成熟 | 高 | |||||||||||||
| 总TEAE | 15 | 6 | 22 | 16 | ||||||||||||
| 相关TEAE | 7 | 4 | 16 | 12 | ||||||||||||
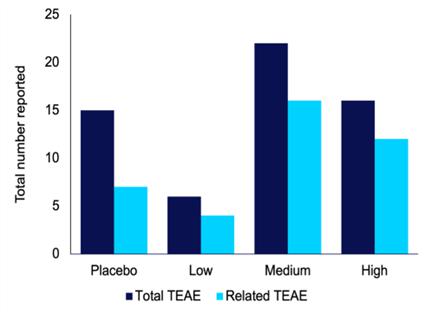
图6.在每个IHL-42X治疗期内报告的治疗紧急不良事件(TEAE)和可能与治疗有关的TEAE总数。
IHL-42X的配方开发与生产
2021年10月,IncanneX 聘请Procaps开发和制造IHL-42X固定剂量组合产品。ProCaps能够提供从配方开发到GMP商业规模生产的最终解决方案。
扩大了IHL-42X的专利地位
2022年12月,IncanneX 宣布已经为保护IHL-42X提交了额外的临时专利申请。这项专利申请基于对IHL-42X第二阶段概念验证临床试验数据的进一步分析结果,在该临床试验中,IHL-42X被证明对环路增益具有剂量依赖效应,而低剂量IHL-42X对呼吸道塌陷性有统计上的显著影响。这为为什么观察到低剂量的IHL-42X比中剂量或高剂量更有效地降低AHI提供了一些解释。
生物利用度/生物等效性临床试验
2022年11月,IncanneX 宣布已聘请CMAX临床研究和Novotech CRO进行IHL-42X的生物等效性/生物利用度(BA/BE)临床试验 。BA/BE研究的重点是评估IHL-42X的活性药物成分 (“原料药”)、屈诺比诺(THC)和乙酰唑胺的药代动力学和耐受性,并分别与FDA参考上市药物Marinol和Taro乙酰唑胺片进行比较 。这项研究还将调查食物对IHL-42X耐受性和药代动力学的影响。BA/BE研究涉及116名参与者,将在48小时内评估血液样本中原料药和代谢物的浓度。该研究设计遵循FDA关于生物等效性研究的建议。BA/BE试验的结果将是即将到来的NDA的关键组成部分,作为与参考上市药物的桥梁机制,从而促进通过FDA505(B)2监管途径获得监管批准。
Bellberry人类研究伦理委员会(“HREC”)于2023年7月批准进行BA/BE临床试验。
34
研究阻塞性睡眠呼吸暂停综合征患者IHL-42X的2/3期临床试验
IHL-42X开发的下一步是一项全球2/3期临床试验,调查该药物在阻塞性睡眠呼吸暂停综合征患者中的效果,这些患者对CPAP等正压设备没有依从性、不耐受或天真。这项研究将包括分布在世界各地的45个临床试验地点的至少385名患者。FDA在IND前期会议上的反馈指导了这项临床试验的设计。该药物的疗效将通过共同的主要终点进行评估,该终点包括52周时AHI较基线的变化和睡眠功能结果的变化 。次要和探索性终点将包括其他PSG和睡眠参数、认知功能的变化以及一系列以安全性和有效性为重点的生物标志物。
任命首席调查员进行第二阶段/第三阶段试验
2023年6月,IncanneX宣布,德克萨斯州奥斯汀FutureSearch Trials of Neuroology的John Douglas Hudson博士和佐治亚州亚特兰大NeuroTrials Research Inc.的Russell Rosenberg博士已被聘为IHL-42X 2/3期研究的联席首席研究员。
J·道格拉斯·哈德森博士,医学博士,神经病学和睡眠医学委员会认证。他是德克萨斯州奥斯汀神经病学未来研究试验的首席研究员。Hudson博士在过去20年中监督了300多项临床试验,主要与神经和睡眠障碍有关,并一直是这些障碍的国家和国际演讲者。哈德森博士在爱荷华大学完成了神经学实习,是奥斯汀首位获得董事会认证的睡眠专家。过去的活动包括创建奥斯汀神经诊所和睡眠医学顾问。 他曾担任德克萨斯州神经学会总裁的职务,获得终身成就奖,并是首都地区美国心脏协会的总裁。
FutureSearch Trials由位于德克萨斯州奥斯汀和达拉斯的两个临床研究机构组成,这两个机构已经运营了15年以上。Hudson博士担任首席研究员的奥斯汀网站专注于治疗神经、疼痛和睡眠障碍的临床研究研究 ,并设有现场睡眠实验室。
罗森博格博士目前是佐治亚州亚特兰大神经试验研究公司的首席科学官兼首席执行官。Rosenberg博士是圣路易斯人,在俄亥俄州立大学获得临床和研究心理学博士学位,并在芝加哥拉什长老会圣卢克医学中心接受睡眠障碍医学和研究方面的专门培训。他在临床睡眠医学和研究方面拥有超过35年的经验,在300多项临床试验中担任研究员,其中14项用于阻塞性睡眠呼吸暂停综合征,211项用于其他睡眠相关障碍。他是董事会认证的睡眠专家和美国睡眠医学学会会员。罗森博格博士也是国家睡眠基金会的前主席和发言人。
NeuroTrials Research Inc.是一家位于佐治亚州亚特兰大的临床研究机构,已运营超过25年。NeuroTrials Research专注于神经学/中枢神经系统和睡眠适应症方面的试验的交付。
正在研究中的新药应用
2023年7月20日,IncanneX 向FDA提交了IND申请供审查。IncanneX团队汇编的IND档案包括有关IHL-42X及其活性药物成分的安全性和有效性的综合模块。它还包括有关IHL-42X药物产品的开发、制造、质量和稳定性的详细信息,以及2/3期IND开放临床试验的临床方案和研究人员信息。
IND的模块包括:
| ● | 模块1-管理信息和预制信息 信息 |
| ● | 模块2-非临床/临床概述和摘要 |
| ● | 单元3-高质量数据 |
| ● | 模块4-非临床研究报告和主要文献参考文献 |
| ● | 模块5-临床研究报告、临床方案和研究人员信息 |
向FDA提交并批准IND对于公司获得监管批准、进行临床试验并与FDA进行科学对话至关重要,同时他们在美国的研发阶段推进研究药物。FDA对IND申请的审查流程涉及对科学、临床和安全性方面的评估,以确保拟议的临床试验符合法规 要求。
35
2023年8月,FDA在分配的30天期限内完成了对IND申请的审查,IncanneX收到了FDA的确认,即IND申请已获得批准,在对试验方案、主要试验调查人员以及试验和预期产品的风险效益分析进行评估后,可以继续进行IND开放研究。IND申请的批准是在美国进行临床试验所需的一个关键里程碑。IND开放试验将评估IHL-42X在阻塞性睡眠呼吸暂停患者中的效果,这些患者对正压治疗不顺从、不耐受或天真,例如通过CPAP设备进行的治疗。
IncanneX目前正在与受聘管理2/3期临床试验的CRO Fortrea合作,为主导试验 地点准备机构审查委员会申请,完成其余试验地点的选择和批准,并进一步准备 临床试验的患者招募和剂量。在IND开放2/3期临床试验中,参与者将在整个试验期间接受一剂IHL-42X、屈诺比诺、乙酰唑胺或安慰剂。所有参与者将完成对他们睡眠质量的每日调查,每月进行临床访问,以评估睡眠的功能结果、认知功能和其他安全和有效的衡量标准。每三个月,将进行通宵多导睡眠监测,以确定治疗对患者AHI以及一系列其他睡眠参数的影响。所有药物 治疗将与安慰剂进行比较。
IHL-216A
IHL-216A用于震荡/创伤性脑损伤和慢性创伤性脑病
脑震荡/创伤性脑损伤 脑震荡/创伤性脑损伤(“TBI”)是由于头部受到直接打击或身体突然受到冲击而震动头骨而导致脑部快速加速/减速造成的。这会导致大脑对头骨进行压缩。脑部撞击颅骨会对脑部造成宏观和微观两方面的损伤,一系列的生理事件称为继发性损伤下跌。 这些继发性损伤下跌是导致颅脑损伤患者许多神经认知功能障碍的原因。
跌倒、车辆碰撞、暴力、运动和战斗伤害是导致颅脑损伤和脑震荡的主要活动。脑震荡的体征和症状可能很微妙,可能不会立即出现。症状可以持续几天、几周甚至更长时间。脑震荡创伤性损伤后的常见症状包括头痛、记忆力丧失(健忘症)和神志不清。健忘症通常包括忘记导致脑震荡的事件。其他症状包括恶心、呕吐、疲劳、视力模糊和耳鸣。
并发症可以立即发生,也可以在创伤性脑损伤后不久发生。严重的伤害增加了更多更严重的并发症的风险。中度至重度创伤性脑损伤会导致一个人的意识状态、意识或反应能力发生长期或永久性的变化。许多受过严重脑损伤的人会经历认知能力的变化,出现执行功能问题和/或沟通、情绪和行为问题。一些研究表明,反复或严重的创伤性脑损伤可能会增加患退行性脑部疾病的风险,但这种风险对个人来说是无法预测的。
36
慢性创伤性脑病(CTE)是用来描述反复头部创伤可能引起的脑变性的术语。CTE是只有在尸检时通过研究大脑的部分才能做出的诊断。CTE是一种罕见的疾病,尚未得到很好的了解。CTE与晚年头部创伤发作的直接后果无关。CTE与头部创伤有复杂的关系 ,如生命早期发生的持续性脑震荡后症状和二次冲击综合征。
专家们仍在试图 了解反复的头部创伤,包括多少次头部创伤和这些伤害的严重程度,以及其他因素可能会导致导致CTE的大脑变化。
在足球运动员、拳击手和其他从事接触性运动的运动员以及暴露在爆炸爆炸中的军事人员的大脑中发现了CTE。一些CTE的体征和症状被认为包括思维(认知)和情绪方面的困难, 身体问题和其他行为。CTE的症状通常在头部创伤发生后几十年出现。
CTE不能作为生命中的诊断,除非是那些罕见的高风险接触者。研究人员还不知道人群中CTE基因突变的频率,也不了解其原因。CTE是没有治愈方法的。研究人员目前正在为CTE开发诊断生物标记物 ,但尚未得到验证。
2020年全球TBI潜在市场总额估计为67亿美元,2018年至2030年该市场的预期复合年增长率为5.5%。 目前还没有针对脑损伤的继发性神经影响的药物治疗。
用于临床试验的IHL-216A制剂开发
IHL-216A是注册药物异氟醚和CBD的固定剂量组合,旨在原发钝性脑损伤后立即给药 以防止脑损伤的发展。异氟醚在美国被批准用于麻醉的诱导和维持。CBD 已被批准用于癫痫障碍,并已显示出对脑损伤的神经炎性反应的影响。异氟烷是一种注册药物,在脑外伤的动物研究中也显示出神经保护活性(神经保护活性,或神经保护,定义为减少神经细胞死亡或破坏),被认为通过调节谷氨酸释放和钙摄取,以及通过对线粒体膜去极化和兴奋性神经传递的影响发挥作用。因此,我们认为IHL-216A可能影响神经兴奋、神经炎症、脑血流量和脑氧耗,从而发挥整体神经保护作用。我们还在评估其保护大脑免受继发性损伤机制的能力,这些继发性损伤机制会导致神经细胞死亡,并在运动和所有其他适用情况下导致头部创伤(摔倒、车辆碰撞、暴力、战斗等原因)导致颅内压力升高。减少继发性脑损伤可能会改善包括CTE在内的长期神经系统后遗症的积极结果,CTE是与接触性运动相关的主要健康风险。
IHL-216A的配方提供了一个独特的研究和开发机会。我们已经将IHL-216A作为一种与雾化给药相结合的吸入性产品,涉及到使用空气压力或超声波振动将液体药物溶液转变为气雾剂。我们聘请了英国合同开发和制造组织Vectura来开发雾化CBD配方和设备,用于将CBD输送到异氟醚麻醉回路。Vectura专门从事吸入性药物的开发,在将产品推向市场方面有着出色的记录,并已为拜耳、Sandoz和诺华等跨国制药公司配制过药物。雾化配方的开发是一个迭代过程,首先根据溶液的性质、产生的气雾剂和剂量传递进行三个步骤的精炼。
2022年8月,我们聘请Curia Global,Inc.(“Curia”) 进一步开发和制造GMP级IHL-216A。库里亚已经开发了可扩展的制造工艺。已完成实验批次 生产,并将样品放入进行稳定性分析。然而,由于全球经济环境和市场状况的变化,GMP制造已被搁置 公司优先事项的变化。
37
2022年10月,FDA通过书面的IND前会议通信,就IHL-216A的拟议临床开发提供了宝贵的多学科反馈,并承认中度脑外伤的治疗是一个重要的未得到满足的医疗需求。FDA还证实,FDA505(B)2可能是IHL-216A的适当调控途径,由此上市批准所需的一些信息可能来自已经完成的关于IHL-216A药物成分的研究和公共领域。
FDA就为IHL-216A开设IND的数据要求提供了关键指导 ,特别是与开发吸入性药物产品和进行涉及麻醉剂的临床试验的复杂性有关。IncanneX正在起草一份后续请求,要求提供有关FDA建议的更多信息,并将在收到后向澳交所和纳斯达克投资者平台提供最新情况。
由于该产品在接触性运动中具有潜在的治疗作用,IHL-216A已被开发为满足世界反兴奋剂机构(WADA) 规范,供有脑外伤和CTE风险的精英和业余运动员使用。
IHL-216A治疗脑外伤和CTE的第1期临床前研究
2020年12月,我们完成了一项动物研究,以正式评估IHL-216A的神经保护能力。这项研究以高度可控的方式将啮齿动物引入头部创伤,以造成可复制的损伤。在创伤性脑损伤后不久,给8组啮齿动物注射不同剂量的IHL-216A或其活性药物成分。行为测试用于评估随时间推移的神经认知和运动功能。我们还监测了下跌的继发性损伤,并在死后进行了微观细胞分析,以识别和比较队列中的神经元损伤。
如下所述,我们发现IHL-216A组分CBD和异氟醚协同作用,减少了作为脑外伤后果的神经元损伤、神经炎症和行为缺陷的指标,因为IHL-216A的影响比CBD和异氟烷的预期效果加在一起更大。通过独立分析异氟烷和CBD的结果来确定 预测结果,然后根据这些结果预测 这两种药物联合使用的效果如何;如果IHL-216A超过预测结果,我们可以得出结论:这两种药物相互增强 效果,存在协同作用。研究还发现,在脑外伤啮齿动物模型中,IHL-216A比CBD或异氟醚单独应用在更大程度上减少了神经元损伤、神经炎症和认知缺陷。这些结果 未经统计意义评估。
对大鼠大脑的尸检分析也发现了CBD和异氟醚之间的协同作用。在尼氏染色之前固定并切片大脑以识别神经元损伤。尼氏染色是一种显示尼氏小体的显微镜技术。正常神经元通常比受损神经元有更多的尼氏小体。神经元损伤由海马区不同部分的尼氏小体与神经元的比率表示,尼氏小体/神经元的比率较低表明神经元损伤增加。在海马区检测到CBD和异氟醚的协同作用阿蒙尼角 1(CA1)和阿蒙尼角2(CA2)。大脑的这些区域在记忆的形成和存储中是重要的。在这项研究中,在接受IHL-216A治疗的动物中,观察到的尼氏/神经元比率的改善相对于单独的CBD,CA1和CA2分别增加了53%和60%,相对于单独的异氟醚,CA1和CA2分别增加了28%和145%,相对于CBD和异氟烷的联合预测效果,CA1和CA2分别增加了20%和53%。这些结果表明,与预测值相比,IHL-216A处理的大鼠神经元损伤较轻。
38
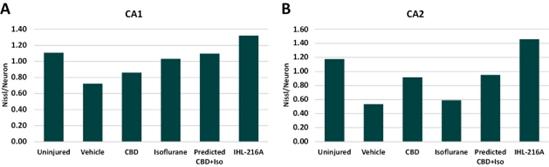
图7.尼氏染色评估CBD和异氟醚(IHL-216A)在神经元损伤中的协同活性。对接受颅脑损伤并使用CBD和/或异氟醚或赋形剂治疗的啮齿动物进行了神经元损伤的评估,方法是对固定的脑切片进行尼氏染色的尸检分析。尼氏染色可以定量尼氏小体与总神经元的比率,较低的比率表明神经元损伤增加。在IHL-216A治疗组中,在损伤部位的海马区(A)CA1和(B)CA2区观察到的Nissl/神经元比率 大于基于每种药物单独治疗组的预测,这表明了协同作用。数值为各自治疗组的平均值。组大小:未损伤组6例,交通工具组6例,CBD组6例,异氟醚组5例,IHL-216A组6例。神经炎标志物IBA1。
对大鼠大脑进行的尸检分析还确定,CBD和异氟醚在降低免疫荧光检测到的神经炎症标志物Iba1水平方面具有协同作用。IBA1是一种在小胶质细胞中表达的蛋白质,小胶质细胞是大脑中一种天然免疫细胞,是小胶质细胞激活和神经炎症的公认标志物。使用免疫荧光检测大脑中Iba1的水平,这是一种使用荧光标记检测到的针对Iba1的特异性抗体的显微技术。Iba1水平升高表明神经炎症加重。在接受IHL-216A治疗的组中,Iba1神经炎症标志物的水平比单用CBD多35%,比单用异氟醚多123%。IHL-216A还降低了IBA1神经炎症标志物,比CBD和异氟醚联合治疗的预测值高出10%。
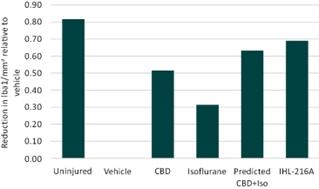
图8。CBD和异氟醚(IHL-216A)在降低神经炎症标志物Iba1水平方面的协同活性。通过神经炎症标记物Iba1的免疫荧光分析,对接受脑外伤并使用CBD和/或异氟醚或赋形剂治疗的啮齿类动物进行了神经炎症评估。脑外伤后Iba1水平升高,Iba1水平降低表明神经炎症减轻。在用IHL-216A治疗的组中,损伤部位同侧脑切片中IBA1水平的下降幅度超过了基于每种药物单独治疗组的下降幅度的预测,这表明了协同作用。数值为各自治疗组的平均值。团体规模:未受伤6人,车辆5人,CBD 6人,异氟醚3人,IHL-216A n=5人.
在用Morris水迷宫评估的行为结果中,检测到CBD和异氟醚之间的协同作用。在莫里斯水迷宫中,动物们被训练在水池中寻找平台。在多次训练后,平台被移走,并对老鼠进行监测,以确定它们是否 回到平台的位置,这是空间学习和记忆的一种衡量标准。每组经IHL-216A处理的动物数量和返回平台位置的大鼠比例 分别比基于CBD和异氟醚作用预测的大鼠数量高87%和24%。与预期效果相比,IHL-216A 治疗大鼠的表现有所改善,这表明CBD和异氟烷具有协同作用。
39
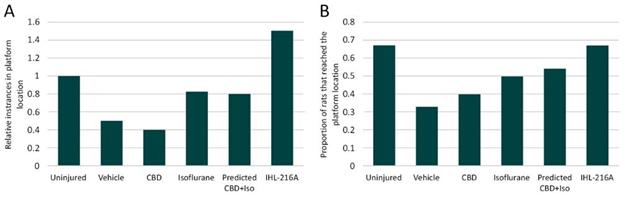
图9.在Morris水迷宫评估中,CBD和异氟醚(IHL-216A)的协同活性。使用Morris水迷宫对接受脑创伤并使用CBD和/或异氟醚或赋形剂治疗的啮齿类动物进行空间学习和记忆评估。在CBD异氟醚联合(IHL-216A)治疗组中,在(A)动物在平台位置的相对实例和(B)到达平台位置的动物比例方面,观察到的 表现优于基于单独使用每种药物的 组的预测表现,这表明了协同作用。数值为各自治疗组的平均值。团体规模:未受伤6人,车辆6人,CBD 5人,异氟醚6人,IHL-216A n=6人。
IHL-216A的第二阶段临床前研究
2022年5月,我们宣布第二阶段研究已经完成,在与NFL合作开发的广为人知的运动性脑震荡模型中,观察到IHL-216A具有强大的神经保护作用 ,以准确代表运动相关脑震荡中发生的脑损伤类型 。这项研究比较了六组24只SD大鼠。当动物在Y迷宫任务中进行测试时,发现接受IHL-216A治疗的动物与假(未受伤)动物相比,辨别指数没有差异(平均差异=0.0598,p=0.5855)(图10)。Y迷宫任务通过确定动物区分新的(新的)和熟悉的手臂的能力来评估空间记忆。相比之下,与假手术组相比,伤后单独使用异氟醚或赋形剂的动物的辨别指数显著降低(平均差异分别为0.2704,p=0.0498和0.3095,p=0.0245)。仅接受CBD治疗的组在假手术组和赋形剂治疗组的Y迷宫中表现中等(平均差异0.1745,p==0.2933)。这些结果表明,用IHL-216A治疗的动物在损伤后1天观察到的空间记忆缺陷得到了恢复。
40
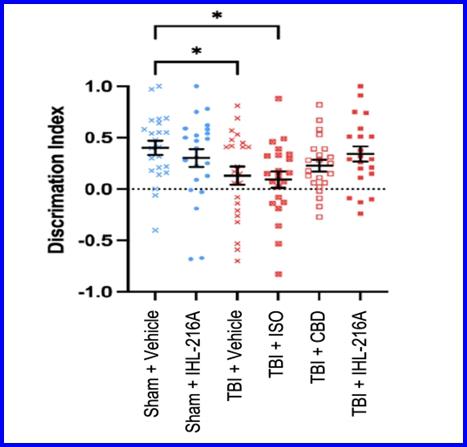
图10.IHL-216A恢复了颅脑损伤后24小时Y迷宫新/熟悉手臂分辨指数评估中的缺陷 。用Y迷宫检测大鼠脑损伤后2 4h的空间记忆。Sham+车辆处理组的动物表现出明显的对新手臂的偏好。在脑损伤+交通工具动物中,这一偏好被降低,这表明与脑损伤相关的新手臂辨别能力存在缺陷。每组由24只啮齿动物组成。
IHL-675A
我们正在开发IHL-675A, 这是一种专利的固定剂量组合产品,含有CBD和羟基氯喹硫酸盐(“HCQ”),用于治疗炎症情况。当身体的免疫系统攻击自身的组织和器官,导致炎症、疼痛、不适和对受影响的组织造成损害时,就会出现炎症情况。IHL-675A是一种多用途抗炎药物,针对类风湿性关节炎、炎症性肠病(结肠炎和克罗恩病)和肺部炎症(COPD、哮喘、支气管炎和ARDS)。IHL-675A由注册药物羟氯喹和CBD组成。HCQ是一种治疗疾病的抗风湿药物,它调节免疫系统的活动,在某些情况下,免疫系统可能会过度活跃。HCQ可以修改基础疾病的过程,而不是简单地治疗症状。我们利用已建立的炎症模型,在体外研究和4个不同的成功体内实验中,证明了IHL-675A组分CBD和HCQ协同作用抑制关键炎症细胞因子的产生。通过将CBD 和HCQ一起作用的预测结果与IHL-675A的实际结果进行比较,我们能够确定IHL-675A研究中是否存在协同效应。预测结果是通过独立分析研究中HCQ和CBD的结果确定的 ,然后根据这些结果预测这两种药物在联合基础上的表现如何;如果IHL-675A超过预测结果 ,我们可以得出结论,这两种药物相互增强疗效,存在协同效应。
我们已经评估了这些实验的结果,并认为IHL-675A是预防和治疗炎症性肺部疾病(ARDS、COPD、哮喘和支气管炎)、类风湿性关节炎和炎症性肠道疾病(结肠炎和克罗恩病)的多用途候选药物。潜在地, 这可能意味着对于某些炎症性疾病,IHL-675A是基于CBD或HCQ的产品的更好替代品,有待进一步检查 。
协同抗炎活性的假设在一系列临床前研究中得到证实,这些研究使用了人外周血单个核细胞和炎症性疾病的动物模型,包括关节炎、炎症性肠病和炎症性肺病。根据这些结果,我们开发了一种独特的固定剂量组合产品,用于临床试验的评估,目标是获得包括FDA和TGA在内的机构的监管批准。
41
我们已经与FDA完成了IND前的 会议,讨论在美国开发用于肺部炎症和类风湿性关节炎的IHL-675A的监管途径,并计划为这三种适应症中的每一种开设IND。FDA同意,IHL-675A的营销申请将 作为505(B)(2)应用程序,因为存在有关IHL-675A有效成分的某些安全性和有效性信息,这些信息来自我们有权在新药申请中使用的历史研究。在IHL-675A开发计划的背景下,这意味着我们不必执行批准新的化学实体所需的许多非临床毒理学研究,因为在先前存在的科学文献或各自参考上市药物的监管提交文件中都有足够的CBD和HCQ毒理学数据。然而,我们仍然需要通过一系列随机对照临床试验来证明IHL-675A在目标适应症中是安全有效的。
2021年7月,我们委托Procaps SA使用Procaps专利的Unigel技术开发和生产IHL-675A药物产品。Procaps 提供从开发到GMP商业规模生产的完整供应链解决方案。他们的制造设施已 通过包括FDA在内的多个全球监管机构的检查和批准。
2022年7月,我们获得了Bellberry HREC的批准,进行了一项第一阶段临床试验,调查IHL-675A的专利多用途。该试验测量了IHL-675A与参考上市药物Epidiolex(CBD)和Plaquil(HCQ)的安全性、耐受性和药代动力学特征。试验的关键终点是报告的不良事件和28天期间活性药物成分(原料药)、CBD和HCQ及其主要代谢物的血浆水平。由12名参与者组成的三个队列(n=36)接受了IHL-675A、CBD或HCQ,试验的三个分支的评估是相同的。患者招募于2022年8月开始,剂量 于2022年9月完成。参与者接受不良事件监测,直到2022年10月底,然后对血液样本进行CBD、HCQ和主要代谢物水平评估,以确定每种活性药物成分的药代动力学。 这项研究是在南澳大利亚的CMAX临床研究中心进行的,由Avance临床管理。
2022年10月,我们宣布第一阶段试验中的剂量已经完成,没有报告任何令人担忧的不良事件。此公告还包括:我们开始安排第二阶段临床试验,调查关节炎患者的安全性和有效性,并准备与FDA就使用IHL-675A治疗关节炎举行IND前会议。
2023年7月,我们从HREC获得了第二阶段临床试验的批准,预计将于2023年第四季度开始招募患者。第二阶段旨在提供有关IHL-675A治疗类风湿性关节炎的安全性和有效性的数据。这项试验将由Avance Clinic管理,他将在澳大利亚各地招募8-10个临床 试验点,总共招募128名患者。患者将根据以下四种药物中的一种进行随机分组:IHL-675A、单独服用CBD、单独服用HCQ或服用安慰剂。研究的主要终点是疼痛和功能相对于基线的减少 通过24周时RAPID3评估的分数确定。
2023年7月,在IND前会议之后,FDA确认IND应用不需要进一步的非临床研究,并就IHL-675A拟议的临床开发计划提供了指导。
肺部炎症(COPD、哮喘、ARDS和支气管炎)
慢性阻塞性肺疾病(COPD)是一种慢性炎症性肺部疾病,导致肺部气流阻塞。症状包括呼吸困难、咳嗽、粘液(痰)产生和喘息。它通常是由长期接触刺激性气体或颗粒物引起的,最常见的原因是香烟烟雾。患有慢性阻塞性肺病的人患心脏病、肺癌和其他各种疾病的风险更高。
哮喘是一种炎症导致呼吸道狭窄和肿胀,并可能导致患者产生额外粘液的情况。这会使呼吸困难,并引发咳嗽、呼吸时的口哨声(喘息)和呼吸急促。对一些人来说,哮喘是一个小麻烦。 对另一些人来说,它可能是一个大问题,干扰日常活动,并可能导致危及生命的哮喘发作。根据Acumen Research and Consulting的数据,2022年全球COPD和哮喘药物市场规模为367亿美元,2023年至2032年的复合年增长率为5.2%。
当位于肺部的气囊(肺泡)中积聚液体时,就会出现急性呼吸窘迫综合征(ARDS)。这种液体可以阻止氧气进入血液。这就剥夺了器官发挥功能所需的氧气。ARDS通常发生在已经身患重病或严重受伤的人群中。严重呼吸急促(ARDS的主要症状)通常在原发损伤或感染后几个小时至几天内出现。它是新冠肺炎导致的主要死亡原因之一,许多患上ARDS的人无法存活。死亡的风险随着年龄和疾病的严重程度而增加。在ARDS中幸存下来的人可能会对他们的肺部造成持久的损害。
支气管炎是一种肺部支气管壁的炎症。支气管炎可以是急性的,也可以是慢性的。虽然急性支气管炎很常见,但慢性支气管炎是一种更严重的疾病,它是对支气管壁的持续刺激或炎症。
42
类风湿关节炎
类风湿性关节炎是一种慢性炎症性疾病,可影响关节、皮肤、眼睛、肺、心脏和血管。作为一种自身免疫性疾病,类风湿性关节炎是由免疫系统对身体组织的攻击引起的。与骨关节炎造成的磨损损伤不同,类风湿性关节炎会引起疼痛的肿胀,最终会导致骨质侵蚀和关节畸形。2021年,治疗类风湿性关节炎药物的全球潜在市场总额估计为601亿美元,2022-2030年期间的复合年增长率为1.75%。
HCQ以硫酸羟氯喹的形式被批准用于治疗类风湿性关节炎,并以普莱奎尼和仿制药的形式上市。
炎症性肠病
炎症性肠病(“IBD”)是一个总括术语,用于描述涉及慢性消化道炎症的疾病。重要的IBD类型包括:
| ● | 溃疡性结肠炎。 这种情况涉及大肠表层的炎症和溃疡 (冒号)和直肠。 |
| ● | 克罗恩病。这种类型的IBD疾病的特点是消化道衬里发炎,通常会累及更深层次的消化道。 |
溃疡性结肠炎和克罗恩病通常以腹泻、直肠出血、腹痛、疲劳和体重减轻为特征。IBD可能会使人虚弱,有时还会导致危及生命的并发症。
炎症性肠病的确切原因仍不清楚。此前,人们怀疑饮食和压力。然而,目前医生承认,这些因素可能会加重IBD,但不是原因。一个可能的原因是免疫系统故障。当免疫系统试图击败入侵的病毒或细菌时,异常的免疫反应可能会导致免疫系统攻击 消化道中的细胞。2021年,IBD的全球潜在市场总额估计为210亿美元,预计从2022年到2031年,IBD全球市场将以5.1%的复合年增长率增长。
IHL-675A抗炎的临床前体外研究
2020年11月5日,我们公布了我们的第一项体外研究结果,以考察IHL-675A的协同抗炎活性。为测试IHL-675A的抗炎作用,用细菌脂多糖(LPS)刺激人外周血单个核细胞(PBMC)。将PBMC与一定浓度的CBD和HCQ共同孵育或单独孵育,然后用脂多糖刺激诱导炎症反应。24小时后通过测定培养上清液中细胞因子水平来评估炎症反应。药物治疗后细胞因子水平的降低是抗炎活性的标志。
细胞因子水平在来自两个供者的三个重复中平均,并归一化为最大值,以产生相对抑制值。 1的相对抑制是完全抑制细胞因子的释放,而值为0则不抑制细胞因子的释放。抗炎协同作用是使用标准的科学“过量幸福”(“EOB”)方法来确定的,其中预测的抑制作用,如使用公式E计算的 PRED A+B=(EA+EB)-(EAEB),从观察到的 抑制中减去,得到EOB分数。EOB得分大于零表示这一组合是协同的。以下数据 均未进行统计意义分析。
研究表明,黄连汤和盐酸黄连对供者外周血单核细胞产生炎性细胞因子IL-1β、IL-6、肿瘤坏死因子-α、IL-1αα和MIP-1α具有协同作用。平均EOB得分在0.32~0.57之间。在经IHL-675A处理的PBMC中,观察到的5种细胞因子水平(相对于赋形剂处理的PBMC)比单独用HCQ处理的PBMC降低了436%到1320%,比单独用CBD处理的PBMC降低了109%到767%,相对于CBD和HCQ的预测组合效应 增加了87%到767%。下面的图A、B、C、D和E中的结果显示了为每个细胞因子评估的最佳固定剂量IHL-675A组合。标为‘预测的CBD+HCQ’的条形图分别代表了我们基于每个药物的活性而得出的期望。根据每种药物单独对所分析的每种细胞因子的活性,观察到的CBD HCQ联合治疗对细胞因子释放的抑制比预测的要大。
43
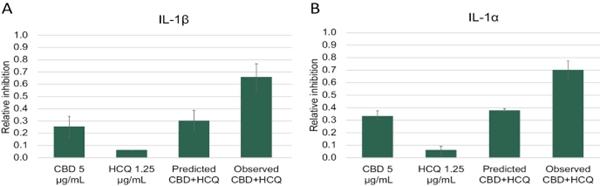
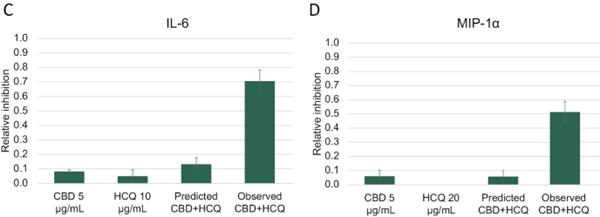
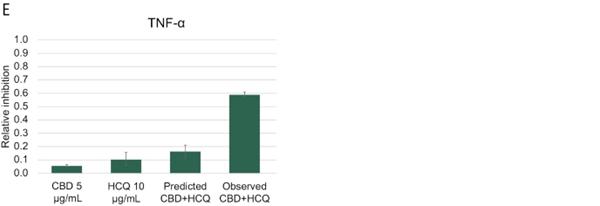
图11.CBD和HCQ抑制脂多糖诱导的人外周血单核细胞释放细胞因子。提供的数据是PBMC供体的平均相对抑制率。使用公式E计算CBD+HCQ的预测抑制PRED A+B=(EA+EB)-(EAEB)。 观察到的CBD+HCQ是实验中观察到的抑制水平。(A)IL-1b、(B)IL-1a、(C)IL-6、(D)MIP-1a和(E)TNF-a。误差 条是供体平均数的标准误差。
44
IHL-675A抗炎的临床前体内研究
2020年11月,我们宣布了一项在小鼠脓毒症模型中评估IHL-675A的体内研究结果。为了确定CBD和HCQ在体内是否有协同作用,从体重18-20g的11组10只小鼠中, 分别单独和联合注射CBD和HCQ。1小时后,小鼠注射脂多糖以诱导炎症反应。每组每只小鼠检测5种炎性细胞因子。注射脂多糖后2小时,心脏穿刺法采血。使用基于Luminex的分析方法处理和分析血清中的细胞因子水平。对于协同分析,使用假处理(不注射内毒素)细胞因子水平 减去基线数据,然后将各组中每个细胞因子的值相对于最大值进行归一化。使用归一化值来计算相对抑制值,其中值1表示完全抑制,值0表示没有抑制。使用EOB方法计算协同性,或使用公式E确定药物浓度组合之间的观察抑制和预测抑制之间的差异,其中预测抑制PRED A+B=(EA+EB)-(EAEB)。 EOB得分大于0表示协同效应。
体内研究的结果如图12所示,显示了在11组10只小鼠中评估的每种细胞因子的最佳固定剂量IHL-675A组合。 标记为‘预测的CBD+HCQ’的条形图代表了基于每种药物单独活性的IHL的预期。在所分析的炎性细胞因子中,观察到的 结果显著超出预期结果。在脂多糖诱导的脓毒症小鼠模型中,柴胡汤合用抑制炎性细胞因子IL-1β、IL-6、肿瘤坏死因子-α、IL-12(P70)和干扰素-γ的产生。平均EOB评分在0.15~0.30之间。与用赋形剂治疗的动物相比,用IHL-675A治疗的动物比只用CBD治疗的动物的5种炎性细胞因子水平降低的程度更大。与赋形剂治疗组相比,IHL-675A治疗组的细胞因子水平下降了26%至81%,而CBD HCQ组合在2小时后对五种分析的细胞因子的预测效果要高出26%至81%。
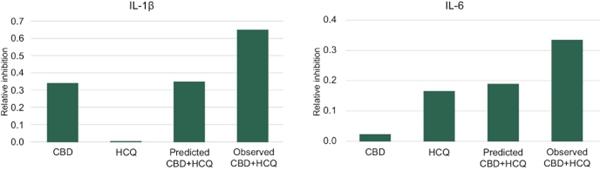
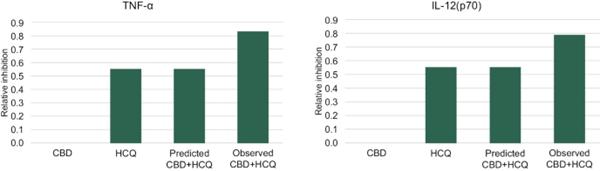
45
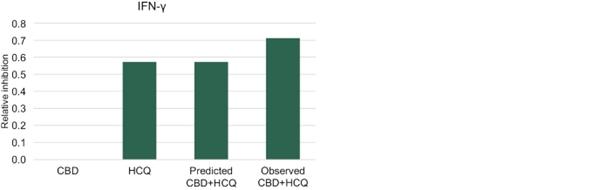
图12.CBD和HCQ在小鼠脓毒症模型中的协同抗炎活性。 CBD和HCQ的联合抗炎活性大于过量Bliss法预测的抗炎活性。补阳还五汤联合用药在抑制IL-1β、IL-6、肿瘤坏死因子-α、IL-12(P70)和干扰素-α释放方面具有协同作用。γ.
IHL-675A抗肺部炎症(ARDS、COPD、哮喘和支气管炎)的临床前体内研究
2021年2月,我们宣布了一项体内研究的结果,该研究评估了IHL-675A对慢性阻塞性肺疾病、哮喘、支气管炎和其他炎症性呼吸道疾病的抗炎能力。我们还评估了我们的专利IHL-675A配方 对肺中性粒细胞增多症的抗炎效果,这是COPD、哮喘、支气管炎和其他炎症性呼吸道疾病的主要潜在原因。 我们报告了令人鼓舞的结果,如下所述,这有助于大幅扩大IHL-675A的潜在用途,并代表着 新的患者治疗机会。
采用大鼠肺部炎症模型,评价IHL-675A的肺部抗炎作用。在这项研究中,10组小鼠,每组6只,在气管内注射细菌脂多糖之前,用CBD、HCQ或IHL-675A进行预处理,然后吸入细菌脂多糖,作为肺部的炎症刺激。不给小鼠注射脂多糖的假手术组也作为对照。24小时后用生理盐水冲洗肺组织,用Luminex法分析肺泡灌洗液中的细胞因子水平。细胞因子是介导炎症反应的蛋白质,细胞因子水平的降低表明炎症减轻。还对BALF进行了白细胞(WBC)计数。当肺部发生炎症时,WBC被招募为炎症反应的一部分。WBC计数的减少也表明炎症减轻。
将细胞因子水平归一化为在赋形剂处理的小鼠中检测到的水平,然后计算相对抑制。IHL-675A对所有已评估的炎性细胞因子IL-1β、IL-6、肿瘤坏死因子-α、CXCL和MCP-1的降低程度均大于单用CBD或HCQ。使用与细胞因子相同的方法将白细胞计数归一化,IHL-675A降低白细胞计数的程度比单独使用CBD或HCQ更大。这些结果表明,在小鼠肺部炎症模型中,IHL-675A具有比CBD和HCQ更好的抗炎活性。根据这些结果,将评估IHL-675A在治疗人类肺部炎症方面的疗效。这些结果还没有进行统计意义的分析。
46
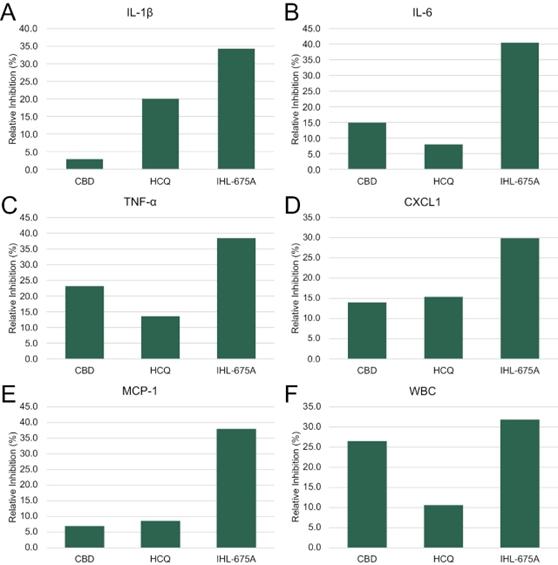
图13.在小鼠肺部炎症模型中,IHL-675A、CBD或HCQ治疗导致BALF中细胞因子水平和白细胞计数的减少。用CBD、HCQ或CBD+HCQ(IHL-675A)联合给药,然后气管内注射脂多糖。注射脂多糖后24小时,取支气管肺泡灌洗液(BALF),检测细胞因子水平和白细胞计数。IHL-675A对细胞因子水平的降低比单独使用任何一种药物都要大。(A)IL-1、(B)IL-6、(C)MCP1和(E)β的药物浓度分别为1毫克/公斤和25毫克/公斤。αCXCL-1和WBC(白细胞计数):10 mg/kg CBD和2.5 mg/kg HCQ。
47
IHL-675A在类风湿性关节炎模型中的临床前研究
2021年3月,我们宣布了一项评估IHL-675A在类风湿性关节炎模型中抗炎能力的体内研究结果。结果表明,与标准剂量的HCQ相比,小剂量的IHL-675A在降低疾病严重程度评分方面的有效性是仅标准剂量HCQ的1.06至3.52倍,这些评估包括临床评分、足爪体积、血管疙瘩评分、总组织学评分和血清细胞因子水平。HCQ 被批准并广泛用于治疗类风湿性关节炎,其形式为硫酸羟氯喹,市场名称为普莱奎尼。
在此类风湿性关节炎模型中,雌性Lewis大鼠于第1天以猪II型胶原和弗氏佐剂(0.2 mg/0.2毫升/只)尾底部皮下注射诱导关节炎。第7天注射0.1 mg/0.1毫升/只大鼠。第16天将大鼠分成6组。另设10组造模大鼠和1只假注射组。CBD、HCQ或IHL-675A(Br)从第17天至30天,每日1次,共14天。给药剂量分别为1和10 mg/kg CBD和2.5和25 mg/kg HCQ。选择10毫克/千克CBD和25毫克/千克HCQ剂量是因为它们代表了人体的标准剂量,基于FDA的人体表面积剂量当量估算为6/37。对于一个体重60公斤的人来说,10 mg/kg的CBD剂量相当于大鼠97 mg,25 mg/kg的HCQ剂量相当于243 mg。在Plaquil处方信息中推荐的类风湿性关节炎的维持量范围为每天200-400毫克。
在第1、7、10、14、16、18、20、22、24、26、28和30天用体积计测量后爪体积并使用定性严重性评分系统来评估疾病严重性。实验结束后第30天,所有大鼠采血,用商品化的酶联免疫吸附试验试剂盒检测炎性细胞因子β和IL-6的水平。之所以选择这两种细胞因子,是因为已知它们与类风湿关节炎的病理生理学有关。取双后爪,称重,福尔马林固定,做组织病理学检查。组织病理学评估包括评估滑膜关节组织中血管疙瘩形成(一层异常的纤维血管或颗粒状组织)和单个核细胞浸润对软骨和骨的破坏。还计算了总的组织学评分,这是血管疙瘩形成和单个核细胞浸润评分的总和。对于所有的评估,分数被假减去,然后计算相对于车辆组的减少 。
在关节炎大鼠模型中,IHL-675A治疗动物在第24天和第30天的临床评分和足爪体积、血管疙瘩形成、组织学总评分、IL-1β和IL-6的减少(相对于赋形剂治疗的动物)明显低于单纯用药组和复方丹参汤治疗组(在同等剂量下)。在同等剂量下,IHL-675A对疾病评估的减少是单独使用HCQ的1.07-8.72倍,这表明IHL-675A在关节炎大鼠模型中的益处大于单独使用HCQ,并表明IHL-675A具有潜在的治疗人类类风湿关节炎的潜力。
48
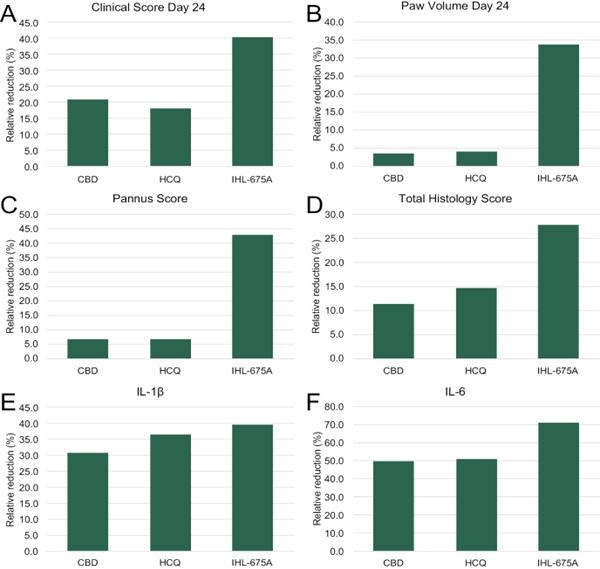
图14.IHL-675A与其成分药物CBD和HCQ在减少类风湿关节炎大鼠模型中的疾病评估方面的比较。 胶原性关节炎模型组大鼠给予等量的IHL-675A、CBD或HCQ(1 mg/kg CBD、2.5 mg/kg HCQ)治疗。在(A)第24天的临床评分、(B)第24天的足爪体积、(C)血管疙瘩形成、(D)组织学总评分、(E)血清IL-1b水平和(F)血清IL-6水平方面,IHL-675A治疗组大鼠关节炎疾病严重程度的降低幅度大于CBD或HCQ治疗组大鼠。
IHL-675A在炎症性肠病模型中的临床前研究
2021年2月,我们宣布了一项评估IHL-675A在炎症性肠病方面的抗炎能力的体内研究结果。IHL-675A 显示结肠炎指数下降46%,而仅CBD和HCQ治疗分别实现了25%和27%的下降, 表明IHL-675A与仅CBD和HCQ相比具有更好的抗炎活性,这表明IHL-675A具有 治疗人类炎症性肠病的潜力。
这项研究使用了11组6只小鼠。小鼠在给予TNBS/乙醇诱导溃疡性结肠炎后,用IHL-675A、CBD或HCQ连续治疗4天。研究包括赋形剂处理组和假手术组。在整个实验过程中监测大便的一致性。在第5天处死小鼠,采集血液进行细胞因子分析,并取出结肠进行分析。
49
终点测量包括: 大便一致性评分(衡量大便一致性的序号评分,数值越高,表明大便更疏松),结肠重量, 结肠宏观损伤评分(合并粘连、狭窄、溃疡/炎症和肠壁增厚的序号评分), 结肠炎指数(来自结肠切片的组织学检查的综合评分)和第5天结肠组织中髓过氧化物酶(一种在中性粒细胞中大量表达的酶,有助于IBD的炎性损伤)水平。这些终点的结果被假减去,并计算出相对减少量。没有对数据进行统计意义上的分析。
与单纯使用CBD或HCQ的动物相比,经IHL-675A 处理的动物在结肠炎指数、大便肉眼损伤评分、大便一致性评分、结肠与体重的比率和髓过氧化物酶(MPO)水平方面均有较大程度的降低(相对于赋形剂处理的动物)。这些结果表明,IHL-675A在溃疡性结肠炎小鼠模型中的益处大于CBD或HCQ单独使用,这表明IHL-675A 是一种潜在的治疗人类炎症性肠病的药物。
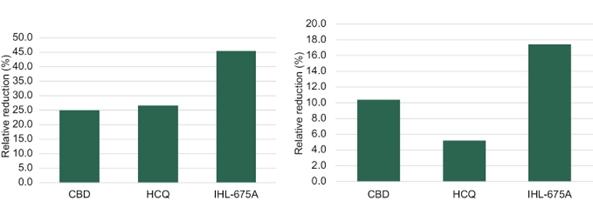
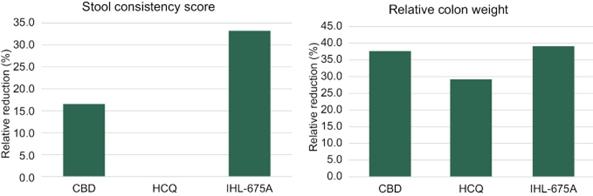
图15.CBD和HCQ(IHL-675A)在小鼠结肠炎模型中对结肠炎评分评估的减少. 用TNBS/乙醇结肠法建立小鼠结肠炎模型,分别用CBD、HCQ或CBD+HCQ(IHL-675A)治疗。4天后处死小鼠,取结肠进行大体及显微分析。在(A)结肠炎指数、(B)大体损伤评分、(C)相对结肠重量、(D)大便稠度和(E)MPO水平方面,接受IHL-675A治疗的小鼠的结肠炎严重程度的降低比单独使用CBD或HCQ的小鼠更大。所有评估的药物剂量分别为1 mg/kg CBD和2.5 mg/kg HCQ。
IHL-675A的1期临床试验
我们设计了一项在澳大利亚健康志愿者中进行的第一阶段临床试验,以评估IHL-675A在健康志愿者中的安全性和药代动力学,其结果将成为我们提交的涉及肺部炎症、类风湿性关节炎和炎症性肠病适应症的FDA IND报告的一部分。 本研究的目的是证明,与单独使用两种药物相比,CBD和HCQ没有或仅有最小的额外风险/副作用,并且这两种药物的吸收和代谢(药代动力学)不会相互干扰 。共有36名受试者参加了这项试验,平均分布在三个手臂上。12名受试者的三个手臂分别接受IHL-675A、Epidiolex(CBD)或Plaquil(HCQ)中的一种。三组患者的安全性和药代动力学评估是相同的。
50
当单独使用时,CBD和HCQ都曾被用作我们的目标适应症的治疗方法。然而,与任何药品一样,存在风险。IHL-675A设计的部分策略是,CBD和HCQ的结合允许减少HCQ, 这降低了与累积HCQ剂量相关的已知风险,而不会牺牲疗效。我们到目前为止进行的临床前研究的结果导致了这样的假设,即较低的HCQ累积剂量与CBD结合使用时,也将降低IHL-675A在人类中的目标适应症的疾病严重程度评分。尽管如此,两种药物总是有可能相互作用,并 加剧单独使用时存在的小问题或导致新的安全问题。证明含有CBD和HCQ的组合药物与成分药物具有类似的安全性,这是开发计划中的重要一步,也是监管机构设定的要求。此临床试验将在一期单元中进行,在需要管理不良事件的情况下进行全天候监测。安全性评估将包括通过心电和血液生物标记物进行心脏监测、血清肝酶水平、血细胞计数和生化、生命体征监测和精神健康问卷调查。由于大量证据表明HCQ和CBD之间需要协同作用才能在炎症标志物上产生更好的结果,因此HCQ和CBD的剂量可能显著低于单独用药治疗,这将在临床试验中进一步评估。
这项研究的另一个组成部分是监测IHL-675A的两种活性药物成分(“原料药”)CBD和HCQ的药代动力学,并将它们与各自的参考上市药物Epidiolex和Plaquil进行比较。研究参与者分别服用等量的IHL-675A、Epidiolex或Plaquil。在72小时内以预定的间隔采集血样,分析CBD和HCQ及其主要代谢物的水平。对于每个分子,最大浓度(“C”最大值“), 达到最大浓度的时间(”T最大值“)和总暴露剂量(”AUC“)将被确定。将比较IHL-675A、Epidolex和Plaquil的药代动力学参数,以确定IHL-675A中的原料药是否与上市的参考药物 生物等效。生物等效性是IHL针对IHL-675A的FDA 505(B)2批准途径的重要组成部分。
人类研究伦理委员会已于2022年7月批准进行第一阶段研究。参与者招募工作于2022年8月开始,给药工作已于2022年9月完成。参与者被监测到2022年10月底,在此之后,研究期间收集的血液样本被评估CBD、HCQ和主要代谢物的水平,以表征每种活性药物成分的药代动力学。
IHL-675A耐受性良好, 没有令人担忧的不良事件,也没有报告严重的不良事件,如下图16所示。IHL-675A与Epidiolex报告的与治疗相关的TEAE数量相同。与治疗相关的TEAE包括腹痛、头晕、疲劳、频繁排便、头痛和嗜睡。所有的TEAE都是轻微的,除了一例中度严重的腹部痉挛,在发病后不久就解决了。
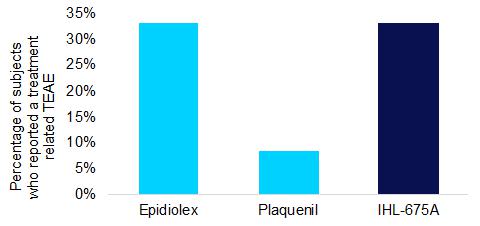
图16在IHL-675A第一阶段临床试验的每个治疗组中,报告与治疗相关的治疗紧急不良事件的受试者的百分比。
CBD药代动力学结果
比较服用IHL-675A的受试者和服用Epidiolex的受试者的CBD的平均药代动力学,发现CBD从IHL-675A吸收更快,并达到比Epidiolex更高的最大浓度,如下面的图17所示。平均最大浓度(C最大值IHL-675A的CBD是Epidiolex的1.57倍。达到最大浓度的时间 (T最大值)比Epidiolex快26%。在IHL-675A中给药的CBD也比Epidiolex更快被清除。1/2)比Epidiolex快13%。总暴露量(AUC信息)与IHL-675A和Epidiolex给药相似。这些模式是目前的趋势(p>0.05)。CBD代谢物7-COOH-CBD和7-OH-CBD也有类似的结果。
51
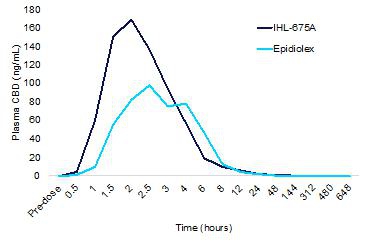
图17.在IHL-675A阶段1临床试验中,IHL-675A和Epidiolex治疗组的平均CBD血浆浓度随时间的变化。
下表列出了IHL-675A第一阶段研究的药代动力学参数,即CBD和代谢物PK参数:
| IHL-675A | 表雄酮 | |||||||||||||||||||||||||||||||||
| C最大值 | T最大值 | AUC信息 | T1/2 | C最大值 | T最大值 | AUC信息 | T1/2 | |||||||||||||||||||||||||||
| (纳克/毫升) | (人力资源) | (小时*ng/毫升) | (人力资源) | (纳克/毫升) | (人力资源) | (小时*ng/毫升) | (人力资源) | |||||||||||||||||||||||||||
| 中央商务区 | 平均 | 207.04 | 2.13 | 841.08 | 220.17 | 131.89 | 2.88 | 725.9 | 231.22 | |||||||||||||||||||||||||
| 标清 | 117.44 | 0.91 | 358.63 | 53.85 | 61.92 | 1.21 | 223.98 | 56.45 | ||||||||||||||||||||||||||
| 最小 | 72.6 | 1.02 | 391 | 113.84 | 45.6 | 1.5 | 355 | 144.41 | ||||||||||||||||||||||||||
| 最大值 | 472 | 4 | 1699 | 301.17 | 241 | 6 | 1121 | 305.88 | ||||||||||||||||||||||||||
| 7-羟基-CBD | 平均 | 55.24 | 2.17 | 389.18 | 40.54 | 21.06 | 3 | 262.27 | 21.15 | |||||||||||||||||||||||||
| 标清 | 34.58 | 0.94 | 214.49 | 52.79 | 9.15 | 1.22 | 103.95 | 10.05 | ||||||||||||||||||||||||||
| 最小 | 14.9 | 1.02 | 220 | 10.78 | 7.7 | 1.5 | 149 | 10.54 | ||||||||||||||||||||||||||
| 最大值 | 116 | 4 | 950 | 202.58 | 38.4 | 6 | 448 | 49.36 | ||||||||||||||||||||||||||
| 7-COOH-CBD | 平均 | 479.75 | 2.83 | 18753.9 | 167.87 | 362.17 | 4.97 | 16268 | 153.68 | |||||||||||||||||||||||||
| 标清 | 218.74 | 1.2 | 8979.02 | 95.47 | 299.63 | 1.3 | 11069.2 | 92.41 | ||||||||||||||||||||||||||
| 最小 | 209 | 1.5 | 11445 | 46.03 | 116 | 2.5 | 4475 | 18.47 | ||||||||||||||||||||||||||
| 最大值 | 921 | 6 | 43714 | 332.65 | 1180 | 6.05 | 42018 | 317.68 | ||||||||||||||||||||||||||
羟氯喹的药代动力学结果
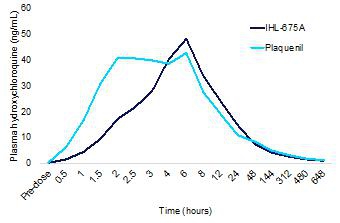
服用IHL-675A的受试者与服用普莱奎尼的受试者相比,羟氯喹的平均药代动力学比较显示,羟氯喹在IHL-675A中的吸收速度比普莱奎尼慢,但这两种药物的最大血药浓度相似,如下面的图18所示。达到最大浓度的时间(T最大值)HCQ作为IHL-675A给药的速度比普莱奎尼慢46%。两种药物的羟氯喹清除量和总接触量相似。这些模式是目前的趋势 (p>0.05)。羟氯喹代谢物去乙基氯喹、双脱乙基氯喹和去乙基氯喹的血浆浓度仅在较低水平(
52
图18.在IHL-675A第一阶段临床试验中,IHL-675A和普莱奎尼治疗组的平均血浆羟氯喹浓度随时间的变化。
下表列出了IHL-675A第一阶段研究的药代动力学参数,即羟氯喹和代谢物PK参数:
| IHL-675A | 普莱奎尔 | |||||||||||||||||||||||||||||||||
| C最大值 | T最大值 | AUC信息 | T1/2 | C最大值 | T最大值 | AUC信息 | T1/2 | |||||||||||||||||||||||||||
| (纳克/毫升) | (人力资源) | (小时*ng/毫升) | (人力资源) | (纳克/毫升) | (人力资源) | (小时*ng/毫升) | (人力资源) | |||||||||||||||||||||||||||
| HCQ | 平均 | 54.71 | 5.59 | 2986 | 182.62 | 55.52 | 3.46 | 3430.8 | 251.6 | |||||||||||||||||||||||||
| 标清 | 23.85 | 2.51 | 1244.46 | 93.7 | 24.81 | 1.94 | 1104.38 | 73.65 | ||||||||||||||||||||||||||
| 最小 | 22 | 2 | 800 | 35.68 | 26.1 | 1 | 2073 | 163.92 | ||||||||||||||||||||||||||
| 最大值 | 105 | 12.03 | 4217 | 311.57 | 124 | 6 | 5888 | 421.51 | ||||||||||||||||||||||||||
| 去乙基-羟基-氯喹 | 平均 | 1.38 | 81.08 | 北美 | * | 北美 | * | 1.29 | 17.46 | 北美 | * | 北美 | * | |||||||||||||||||||||
| 标清 | 1.24 | 183.01 | 北美 | * | 北美 | * | 1.04 | 35.04 | 北美 | * | 北美 | * | ||||||||||||||||||||||
| 最小 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||||||||||||||||||||||||||
| 最大值 | 4.4 | 673.83 | 0 | 0 | 3.3 | 123.93 | 0 | 0 | ||||||||||||||||||||||||||
| 去乙基氯喹 | 平均 | 0.8 | 7.77 | 北美 | * | 北美 | * | 0.42 | 5.59 | 北美 | * | NA* | ||||||||||||||||||||||
| 标清 | 0.72 | 13.03 | 北美 | * | 北美 | * | 0.84 | 13.58 | 北美 | * | NA* | |||||||||||||||||||||||
| 最小 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||||||||||||||||||||||||||
| 最大值 | 2 | 49.05 | 0 | 0 | 2.9 | 49.07 | 0 | 0 | ||||||||||||||||||||||||||
| 双脱乙基-羟基-氯喹 | 平均 | 0 | 0 | 北美 | * | 北美 | * | 0 | 0 | 北美 | * | 北美 | * | |||||||||||||||||||||
| 标清 | 0 | 0 | 北美 | * | 北美 | * | 0 | 0 | 北美 | * | 北美 | * | ||||||||||||||||||||||
| 最小 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||||||||||||||||||||||||||
| 最大值 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||||||||||||||||||||||||||
| * | NA:未检测到足以计算 PK参数的代谢物 |
对1期临床试验结果的解释
健康志愿者对IHL-675A耐受性良好。IHL-675A的不良反应与Epidiolex和Plaquil的观察结果一致,并已公开报道。两种活性药物成分CBD和HCQ都从IHL-675A中吸收。PK图谱的趋势表明,IHL-675A对CBD的吸收可能比Epidiolex更快,而Hcq在IHL-675A中的吸收可能比Plaquil慢。这可能对IHL-675A有利。CBD可以立即缓解炎症和疼痛,而HCQ是一种作用较慢的分子,可以延长缓解时间。
评估IHL-675A对类风湿关节炎患者疼痛和功能影响的第二阶段临床试验
2023年2月,我们宣布已开始第二阶段临床试验,以评估IHL-675A对类风湿性关节炎患者疼痛和功能的安全性和有效性。在这项试验中,类风湿关节炎患者将接受IHL-675A、CBD、HCQ或安慰剂中的一种,为期24周。治疗 将是双盲的,这意味着调查人员和患者都不知道个人正在接受哪种治疗。这项研究 将由澳大利亚和美国的CRO Avance Clinic管理,他们将确定并加入8-13个在类风湿性关节炎方面具有专业知识的临床试验地点,以进行患者招募和评估。Avance临床将管理试验站点和进行研究,确保数据具有必要的质量,并对所有试验站点收集的数据进行分析。
试验将包括128名符合资格标准的参与者。参与者将被随机分到4组中的一组:IHL-675A,单独CBD,单独HCQ 或安慰剂。研究的主要终点是相对于基线的疼痛和功能,通过24周时RAPID3评估的分数确定 。参与者还将使用电子患者报告结果设备(类似于在电子平板电脑上填写调查问卷),每天记录他们的疼痛和功能结果,填写关于疼痛、疲劳、关节僵硬和生活质量的问卷。参与者将每月访问临床试验现场,在那里进行血液测试和体检将监测额外的安全性和有效性结果,包括炎症生物标志物。该试验还将包括一项通过核磁共振检查关节损伤的子研究。受试者将根据他们在筛查时的类风湿性关节炎磁共振成像评分(“RAMRIS”)来评估他们是否符合MRI研究的条件。
53
这项研究的结果将确定IHL-675A治疗类风湿性关节炎的安全性和有效性,并将成为未来监管应用的关键组成部分,包括对FDA505(B)2 NDA档案中的联合规则评估做出贡献。
2023年7月,我们获得了HREC的批准,其牵头地点是弗吉尼亚州坎伯韦尔的荣休研究中心,用于进行第二阶段临床试验,调查IHL-675A对类风湿关节炎患者疼痛和功能减退的影响。选址、审批和HREC提交工作正在进行中,我们等待未来几个月收到剩余站点的批准。
裸盖菇素辅助心理治疗广泛性焦虑症(Psi-GAD)
广泛性焦虑障碍
广泛性焦虑症(GAD)的特征是弥漫的、过度的、无法控制的焦虑,这种焦虑经常发生,不限于任何特定的环境条件。症状是多种多样的,包括持续和过度担忧的感觉、紧张、不安、难以集中精力的疲劳、不规律的睡眠模式、肌肉紧张、易怒和恶心。
广泛性焦虑症是一种相对常见和严重的精神疾病,约有4%-6%的人在一生中受到影响。GAD会严重影响生活质量和职业生涯前景。这是一种高度并存的疾病,估计终生精神障碍的共患率高达90%。它最常与抑郁症并存,也常与其他焦虑症、其他情绪障碍以及非精神性疾病(如慢性疼痛和肠易激综合征)并存。据估计,澳大利亚和美国在任何时候都有800万人患有中度到重度的GAD,其中100万人居住在澳大利亚,700万人 居住在美国。
现有的治疗方法
GAD治疗的国际指南建议将选择性5-羟色胺再摄取抑制剂(“SSRIs”)、5-羟色胺和去甲肾上腺素再摄取抑制剂(“SNRI”)和普瑞巴林作为一线选择,而苯二氮卓类药物(如安定)作为二线选择。广泛性焦虑症也可以单独使用心理疗法或与药物疗法结合使用。然而,这些治疗显示出有限的疗效,只有不到一半的患者在这些治疗后获得缓解,并且有很大的治疗副作用和成本。特别是,与长期使用这些药物疗法相关的副作用包括情绪麻木、积极性降低、体重增加、性功能障碍和自杀念头。由于现有治疗的局限性,我们认为对新疗法的需求仍未得到满足,以改善被诊断为广泛性AD患者的生活质量。
裸盖菇素治疗广泛性焦虑症
迷幻辅助心理治疗在治疗与绝症相关的单相抑郁、抑郁和焦虑症状以及药物滥用方面可能提供快速、显著和持久的益处。裸盖菇素是一种精神活性分子,天然存在于几种蘑菇中,主要作用于5-羟色胺受体系统,可以调节意识、认知、知觉和情绪的状态。
当与特殊形式的心理治疗支持相结合时,裸盖菇素不会导致临床上显著的不良事件,并可以降低心理健康严重程度评估的分数。在20世纪50年代和60年代,数以万计的人参与了迷幻研究。虽然现代标准在方法上受到限制,但许多这些研究的结果显示,焦虑、抑郁和成瘾程度以及生活质量都有了实质性的改善。
在经历了几十年的社会政治障碍后,越来越多的临床迷幻药物试验正在世界各地备受尊敬的机构进行,包括伦敦帝国理工学院、约翰·霍普金斯大学、加州大学,以及现在的墨尔本莫纳什大学,与我们合作。
54
在过去的十年里,裸盖菇素在焦虑、抑郁和成瘾方面的治疗潜力已经在各种学术赞助的研究中得到了证明。在这些研究中,裸盖菇素辅助的心理疗法在服药当天迅速缓解了焦虑和抑郁症状 ,并在数月后的随访评估中基本保持了治疗效果。这些研究表明,裸盖菇素一般耐受性良好,毒性低,没有严重不良反应的报道。
我们认为以下四项研究支持裸盖菇素辅助治疗焦虑症,治疗剂量不超过30毫克/70千克:
| ● | 纽约大学,Ross等人2016年(n=29):裸盖菇素治疗危及生命的癌症患者的焦虑和抑郁后快速和持续的症状减轻:一项随机对照试验。裸盖菇素对焦虑和抑郁产生了立即、实质性和持续的改善,并减少了与癌症相关的士气低落和绝望,改善了精神健康,提高了生活质量。 |
| ● | 伦敦帝国理工学院,Carhart-Harris等人,2018年(n=20):裸盖菇素与心理支持治疗难治性抑郁症:6个月的随访。仅在裸盖菇素治疗两个疗程后,耐受性好、有效范围大、症状改善迅速,在治疗耐药队列中,治疗后六个月仍显著。 |
| ● | 加州大学洛杉矶分校,格罗布等人,2011年(n=12):裸盖菇素治疗晚期癌症患者焦虑的初步研究。状态-特质焦虑问卷特质焦虑分量表在治疗后1个月和3个月时焦虑显著降低。裸盖菇素没有临床上显著的不良反应。 |
| ● | 约翰霍普金斯大学,格里菲斯等2017年(n=51):裸盖菇素能显著并持续地减少危及生命的癌症患者的抑郁和焦虑:一项随机双盲试验。临床医生评估和自我评估的抑郁、焦虑或情绪障碍的指标大幅和显著下降,而生活质量、生命意义、死亡接受和乐观的指标增加。 |
两个针对抑郁症的裸盖菇素研究项目获得了FDA的突破性指定。全球正在进行少量其他裸盖菇素治疗开发项目 。如果这些研究项目中的任何一个的结果是积极的,裸盖菇素辅助的心理疗法可能会在未来五年内被批准作为处方药治疗。
我们的裸盖菇素治疗广泛性焦虑症的研究
我们的裸盖菇素疗法将裸盖菇素与心理疗法相结合,该疗法是由首席研究员保罗·利克纳伊茨基博士领导的多学科专家团队以及联合调查员苏雷什·桑德拉姆教授和木拉提·尤切尔教授专门为诊断为广泛性焦虑症的患者设计的。更广泛的研究团队包括迷幻辅助治疗、心理测量评估、定性研究、治疗师培训和风险管理方面的专家。作为我们临床开发计划的一部分,我们正在协调两项临床试验。2021年10月28日,我们与FDA就裸盖菇素辅助的GAD心理疗法计划举行了一次IND前会议,最终目的是为了FDA批准我们的裸盖菇素疗法用于GAD患者。
第二阶段探索性临床试验
我们的澳大利亚第二阶段探索性临床试验于2021年底获得人类研究伦理委员会(“HREC”)的批准,独立审查委员会的批准允许我们在澳大利亚招募试验参与者。参与者筛选和招募工作于2022年2月开始,试验的首批参与者于2022年3月开始接受治疗。
这项研究是一项2期随机、三盲、积极、安慰剂对照试验,旨在评估裸盖菇素辅助心理疗法治疗广泛性AD的安全性和有效性。参与者 在10周内经历两次裸盖菇素或活性安慰剂剂量治疗和最多11次非药物、专家心理治疗 。主要结果是安全性、有效性和耐受性,次要结果是生活质量、功能障碍和并发症。安全性是通过监测不良事件来评估的,包括但不限于肝功能测试和自杀倾向简明清单上的评分。通过比较安慰剂组和治疗组汉密尔顿焦虑量表从基线开始的变化来评估疗效。耐受性是通过比较安慰剂组和治疗组中完成两次给药疗程的参与者的比例来评估的。次要终点将通过监测残疾、合并症、生产力和生活质量,使用患者报告的结果衡量标准进行评估。
55
FDA发展计划和IND前会议
2021年10月,我们与FDA就裸盖菇素辅助GAD心理治疗计划举行了一次IND前会议。IND前会议包是在Camargo PharmPharmticals LLC的协助下准备的,Camargo PharmPharmticals LLC也与我们一起出席了会议。FDA在书面和电话会议上证实,裸盖菇素辅助治疗广泛性AD的治疗策略是适当的,并表达了对其开发的兴趣。FDA还就IncanneX提出的长期发展战略提供了指导,涉及成功的保密协议(FDA批准)和营销授权所需的条件。FDA对我们建议的临床试验设计的具体反馈将形成关键的2b期临床试验,这将是继第二阶段探索性试验的中期或全部结果之后的IND开放研究。
裸盖菇素治疗方案
我们的裸盖菇素疗法包括由经过我们的专业治疗师培训的精神健康专业人员 与心理疗法一起给药。治疗旨在优化GAD患者的安全性和治疗结果,并在服用裸盖菇素之前、期间和之后提供特定的支持。
每位受试者在每次服药前、服药期间和服药后都会接受两次治疗剂量的研究产品,其中包括特定剂量的裸盖菇素,并进行心理治疗。心理治疗包括四个不同的阶段:
| ● | 初步心理治疗:在筛选阶段进行,重点是临床配方、治疗联盟、迷幻治疗、心理教育和剂量的实际准备。 |
| ● | 准备心理治疗:在完全登记之后和第一次给药之前进行,重点是扩大初步心理治疗工作,并涵盖更有针对性和GAD特定的给药心理和实际准备。 |
| ● | 服药后支持:在准备会议后的一周内进行,重点是信任、适当的心态、有利的身体环境和参与者主导的支持。给药支持是心理治疗的环节。 |
| ● | 整合心理治疗:在服药后进行,包括每次服药后的第二天,重点是通过特定的专注于意识、情感和躯体的治疗、以意义为中心的支持,以及促进支持结果的背景变化来维持益处。 |
莫纳什大学
2020年12月,我们与澳大利亚莫纳什大学(“莫纳什”)签订了一项合作协议,进行裸盖菇素辅助心理疗法 治疗广泛性焦虑症。Monash赞助我们最初的第二阶段探索性临床试验,确保严格的科学独立性和道德和安全研究的最高标准。我们资助和支持这项由调查人员发起的试验,并保留试验产生的所有知识产权 。我们还在调查其他迷幻药物研究项目的启动情况,这些项目将提供一个机会,解决我们认为患有其他精神疾病的患者的未得到满足的需求。
莫纳什大学是澳大利亚的顶尖大学之一,一直位居世界前100名。我们探索性试验的迷幻治疗是在BrainPark内进行的,BrainPark是莫纳什特纳大脑与心理健康研究所和生物医学成像设施的一个最先进的研究平台,为研究环境中的迷幻治疗提供了一个非常有利的环境。特纳大脑和精神健康研究所的心理科学学院和临床科学学院的精神病学系都联合起来进行迷幻研究,团队成员包括精神病学、心理治疗和心理健康治疗开发相关领域的领先研究人员和临床医生。
虚拟现实(“VR”)暴露 反应疗法(“ERP”)和迷幻剂
2022年3月,我们与Monash签订了一项许可协议,开发一种结合了虚拟现实和迷幻药物的新型治疗方法。许可协议 为BrainPark开发的沉浸式治疗性虚拟现实环境提供了独家和永久许可。许可证 允许IncanneX调查虚拟现实治疗工具与迷幻药物的结合使用,以开发针对一种或多种严重形式的焦虑症的新疗法 。
56
相关研究和开发将由莫纳什大学的保罗·利克纳伊茨基博士领导,莫纳什大学是一所享有盛誉、全球公认的创新大学,在《2022年美国新闻和世界报告》中排名世界第40位。IncanneX和Monash正在就开发新治疗形式所需的临床试验的研究 协议进行深入讨论。最初的临床试验将评估该治疗方法的有效性、安全性、耐受性和最佳剂量。
临床试验研究人员
首席调查员是保罗·利克纳伊茨基博士,联合调查员包括木拉提·尤塞尔教授和苏雷什·桑德拉姆教授。
利克纳斯基博士是特纳研究所和莫纳什精神病学系临床迷幻研究实验室的负责人。他是莫纳什大学首席研究员和首席研究员,并在圣文森特医院、麦格理大学、迪肯大学和墨尔本大学担任兼职或荣誉职务。他在墨尔本大学获得了神经科学荣誉和心理学博士学位。他的工作主要是在情绪、焦虑和成瘾研究中检查精神疾病和治疗发展的机制。利克奈茨基是澳大利亚首个迷幻临床试验的研究人员。他被邀请就迷幻辅助心理治疗进行多次学术、专业和公开演讲,并接受了平面媒体、电台和播客的采访。LiKnaitzky领导着澳大利亚第一个临床迷幻实验室,协调澳大利亚第一个应用迷幻治疗师培训计划,并正在建立澳大利亚最大的迷幻试验(Psi-GAD)。他的工作 专注于在莫纳什大学制定一项严格的迷幻医学研究计划,寻求评估治疗效果、创新治疗设计、降低已知风险、探索潜在缺陷和了解治疗机制。
木拉提·尤切尔教授于2001年在拉特洛布大学获得了临床神经心理学博士学位,并接受了临床神经心理学方面的专业临床培训。然后他在墨尔本大学的多个心理健康研究中心工作,并于2012年被提升为教授。 他现在莫纳什心理科学学院工作,在那里他领导心理健康和成瘾研究项目。他 是BrainPark的董事,BrainPark是一家世界第一的神经科学研究诊所,旨在以一种可访问的方式将具有诊断或治疗益处的最新神经科学知识带给社区。
苏雷什·桑德拉姆教授是莫纳什大学临床科学学院精神病学系主任,莫纳什大学董事精神健康项目研究 健康。他一直在使用药理学、神经化学和神经病理学方法研究精神分裂症和相关精神障碍的分子病理学。这些相互关联的方法已被应用于分析疾病的组成部分,如治疗、耐药性和自杀,以更好地了解它们的神经生物学基础。他在墨尔本精神健康研究所进行博士和博士后研究,然后在那里建立他的实验室,随后在弗洛里研究所,并同时建立一个临床研究实验室,从事精神障碍的临床试验和生物标记物研究。然后,他转到莫纳什大学和莫纳什医学中心,并整合了他的研究项目。
PsiGAD
PsiGAD是一项概念验证性临床试验,调查裸盖菇素辅助心理疗法治疗GAD的安全性和有效性,由首席研究员保罗·利克纳伊茨基博士和莫纳什大学的临床科学家、医生和治疗师组成的扩大团队领导。这项试验将招募72名患者,涉及等量、三盲、裸盖菇素和安慰剂。每个患者将接受两次剂量治疗 以及若干次预备和整合心理治疗。这项试验的终点包括安全性、有效性和耐受性,而次要结果包括对生活质量、功能限制和合并症的评估。主要疗效 终点是第二次服药六周后汉密尔顿焦虑量表的变化。
2023年3月,对迄今为止的研究数据进行了中期分析。一个独立的数据安全监测委员会审查了数据,并建议不改变研究设计,也不担心PSI-GAD试验的安全性。IncanneX对由前29名参与者的主要终点数据组成的中期数据进行了审查,发现很有可能(大于85%的阿尔法误差0.05或95%的置信度) 整个研究将显示裸盖菇素治疗组比安慰剂治疗组在统计学上显著受益。此预测是通过假设在中期分析中观察到的29名参与者的效果大小代表其余43名参与者的效果大小而做出的。在这个模型中使用的终点是11周时汉密尔顿焦虑量表(HAM-A)得分相对于基线(第二次注射后6周)的降低,这是试验中的主要终点。此模型由公司内部完成,未经数据和安全监测委员会核实。
在整个报告所述期间,审判的征聘工作一直在继续,最终研究结果预计将在2023年底或2024年初公布。
57
2023年8月,我们宣布,在收到预计于2023年第四季度或2024年第一季度进行的研究的最终结果之前,我们的子公司PenenneX Pty Ptd已开始准备有关Psi-GAD的IND申请。
CGMP裸盖菇素药物产品的开发与生产
基于PsiGAD1中期分析的有希望的结果,我们于2023年3月聘请Catalent开发和cGMP生产我们自己的裸盖菇素药物产品。该药物产品将用于未来的临床试验和潜在的更广泛的商业用途。这个开发项目正在进行中。
知识产权战略
我们通过协调的知识产权战略从战略上保护我们的创新,将专利保护与监管和市场排他性相结合。我们正在为裸盖菇素治疗计划的各个方面寻求专利保护。我们将获得的专利不太可能单独涵盖裸盖菇素作为临床实体。然而,我们正在寻求关于使用裸盖菇素的治疗方法的专利地位,包括组合疗法(例如,配方、活性物质和心理治疗方式)和其他治疗方法(例如,特定剂量方案)。
大麻类口香糖和咀嚼片
含药口香糖和咀嚼片(“MCGT”)是一种越来越受到医学界青睐的药物输送系统,因为它是一种支持所含药物持续、持续释放的缓释剂型。MCGTs的作用很快,因为它们将活性成分输送到口腔粘膜中,减少了患者胃不耐受的可能性。这些特性使MCGTS 成为治疗持续性疼痛和成瘾障碍药物组合的极佳给药系统。患者对MCGTS的耐受性也很好,因为没有胶囊可以吞咽,也没有液体可以管理。咀嚼的好处,也被称为咀嚼, 有很好的记录,包括改善大脑循环,抗焦虑效果,改善记忆力,神经保护和止痛效果 。这些特性使MCGTS成为治疗持续性疼痛和成瘾障碍的药物组合的优秀递送系统 。
我们的子公司APIRx拥有多项基于大麻素的候选药物的专利,这些候选药物旨在治疗对不同药物类别的成瘾(包括大麻成瘾和阿片成瘾)以及持续疼痛(包括多发性硬化症的疼痛和痉挛)。
治疗化疗引起的恶心和呕吐的药物屈诺比诺
根据世界卫生组织的数据,癌症是主要的死亡原因之一,每年约有1000万癌症患者使用化疗,到2040年,这一统计数字预计将增长53%。恶心和呕吐是与癌症治疗相关的两种最可怕的副作用。Dronabinol是一种合成的四氢大麻酚(THC),是一种经批准的治疗化疗相关性恶心和呕吐以及与艾滋病毒/艾滋病相关的厌食症的药物。口服屈诺比诺的吸收很慢,需要1-2.5小时才能达到峰值血药浓度,而且还会经历首过代谢,这意味着只有10%-20%的剂量进入循环。
MedChew Dronabinol是一种可咀嚼的Dronabinol变体,已由APIRx开发并获得专利,用于绕过首次通过代谢。在MedChew Dronabinol的1a阶段研究中,THC在10分钟内出现循环,在大多数研究对象中观察到4至8小时的缓释曲线,因此该产品在需要的时间内更有用。该产品的下一步开发是进行生物利用度/生物等效性 临床研究,通过连接到有关Marinol的公开可用数据来支持批准申请。Marinol是通用Dronabinol的营销名称。 2021年,全球化疗引起的恶心和呕吐药物市场的经济规模估计为57亿美元, 预计在未来十年内以6%的复合年增长率增长。
MedChew Rx用于多发性硬化症(MS)的疼痛和痉挛(MS)
多达84%的多发性硬化症患者还会经历痉挛,这会导致不自主的肌肉僵硬和痉挛。疼痛也是多发性硬化症的常见症状,在全球研究中,多达三分之二的多发性硬化症患者报告疼痛。MedChew™Rx旨在通过口腔黏膜膜吸收,绕过肝脏,首先通过代谢。MedChewTM Rx含有与产品Sativex相同的CBD和THC成分配方,Sativex最初于2005年在加拿大获得批准,目前已在25个国家/地区上市,包括欧洲18个国家/地区、 和澳大利亚。然而,MedChew Rx促进了延长剂量并减少了重新给药的需要,对于Sativex来说,重新给药每天多达12次 。它不含酒精,而Sativex确实含有酒精,而且不会加剧经常与多发性硬化症药物治疗相关的口腔干燥。 MedChew Rx通过授予与含有大麻类物质的口香糖相关的专利而获得潜在的专利保护。APIRx工作人员已完成与Swiss-Medc(瑞士)和CBG-Meg(荷兰)的监管会议。随着生物等效性第1阶段研究与Sativex CBD/THC口腔喷雾剂的安全性和有效性数据相衔接,有可能快速获得欧洲的药物批准 。
58
治疗成瘾的药物口香糖和咀嚼片
切威尔治疗大麻依赖
CheWell是一种CBD咀嚼片,具有很高的生物利用度,可用于治疗大麻成瘾患者。大麻依赖预计将是药物依赖市场中增长最快的部分,APIRx观察到的初步数据表明,CBD可能对缓解大麻的渴求产生有益影响。一份病例报告显示,一名在大麻依赖戒断和复发阶段接受CBD治疗的患者取得了积极的结果。FDA正在为大麻依赖患者使用CheWell进行前IND准备工作。
我们有CheWell的数据,它是一种高生物利用度的产品。一期药代动力学(PK)研究表明,与标准的CBD口香糖输送机制相比,获得专利的CheWell配方导致CBD的生物利用度增加了10倍以上。正在进行国际监管分析,以确定在不同司法管辖区进行商业启动所需的条件。生物利用度的提高意味着即使在没有医生处方的情况下,MCGTS中的小剂量CBD也可以非常有效,从而满足非处方药产品的TGA要求。生物利用度的提高也降低了商品成本,从而提高了利润率。虽然第一个营销声明将是针对IBS的,但CheWell产品可以为CBD可能帮助患者的一系列适应症提供治疗益处。
为戒烟而戒烟
CanQuit是一种含药口香糖,将大麻素和尼古丁结合在一起,以减少对香烟或烟草蒸发用具的依赖。CanQuit旨在更好地帮助吸烟者戒烟,我们打算测试我们的产品对现有尼古丁口香糖的有效性。更有效和更具成本效益的大麻素/尼古丁组合药用口香糖可能会扰乱现有的全球尼古丁口香糖市场,2021年全球尼古丁口香糖市场价值为15亿美元,2022-2029年的年复合年增长率估计为4.8%。
CanQuit O治疗阿片成瘾
CanQuit O是一种含药口香糖,将大麻类药物与阿片激动剂和/或拮抗剂结合在一起,旨在抑制阿片成瘾者对阿片类药物的依赖。我们希望CanQuit O成为一种处方药,帮助对抗美国和其他地方持续存在的阿片成瘾危机。我们相信,CanQuit O有可能成为一种简单的解决方案,解决复杂的成瘾障碍和全国性的问题 ,影响深远。阿片类药物使用障碍的年目标市场规模估计在2022年为31亿美元,2023-2030年的年复合增长率为9.1%,许多人上瘾但未接受治疗。
CanChew Rx和SuppoCan治疗肠易激综合征和炎症性肠病
APIRx已经开发出一种名为CanChew Rx的含CBD的控释功能性口香糖和一种名为SuppoCan的含大麻类栓剂,可单独使用或联合使用来治疗肠道疾病。
肠易激综合征(IBS) 是一种影响全球高达11%人口的疾病。IBS的特征是腹痛、排便习惯改变,以及腹泻、便秘或两者兼而有之。来自36名患者的第二阶段概念验证试验的数据观察到,经CanChew 治疗的IBS患者腹痛减少了50%,支持了IBS的治疗效果。
全球有680万人 患有IBD。IBD的体征和症状包括克罗恩病和溃疡性结肠炎,包括腹泻、乏力、腹痛和痉挛、食欲减退和意外体重减轻。目前治疗IBD的主要药物是抗炎药物和止痛药。消炎药包括皮质类固醇类药物,用于诱导缓解,但具有免疫抑制作用。CBD已经在动物身上显示出治疗IBD的有效性,我们打算进行一期临床试验,以评估CanChew Rx和SuppoCan。
CannQuitN、CannQuitO和ReneCann™
我们于2022年11月宣布与Eurofins Science for开发和制造罐头尼古丁(“罐头”)、罐头阿片(“罐头”) 和ReneCann™配方签约。
坎奎特™产品 是具有相关授权专利和专利申请的组合药物资产,这些资产因收购APIRx制药公司(于2022年8月完成)而转移到IncanneX。Eurofins将负责CannQuit N和CannQuit O的配方开发和制造,这是一种结合尼古丁和大麻的咀嚼产品,以及大麻和阿片类拮抗剂,分别针对戒烟和阿片成瘾。
59
CannQuitN将尼古丁和CBD结合在一种控释、功能性、带药的口香糖中。CannQuitO将CBD和非专利处方阿片拮抗剂和/或部分激动剂-拮抗剂结合在一起。欧洲FINS公司生产的cGMP级产品将用于临床试验,旨在评估坎奎特™产品在戒烟和治疗阿片成瘾方面的安全性和有效性。
在欧洲FINS的两种候选药物的开发和生产过程中收集的有关坎奎特™抗成瘾产品的质量和稳定性的数据 将是未来监管包的关键组成部分。这些数据包包括IND申请和向FDA提交的NDA文件。
含药口香糖将其有效成分直接输送到口腔粘膜的循环中,确保成分的效果迅速输送,同时也以持续的方式减少了比其他输送方式更长时间的饥饿感。快速起效和持久起效都是治疗成瘾障碍的理想品质。此外,咀嚼的行为,也被称为咀嚼,也有一种多作用的抗焦虑效果,这已经在其他科学评估中得到了证明。
ReneCann局部CBD/CBG产品用于治疗皮肤病 。
ReneCann™是IncanneX的专利局部大麻制剂,用于治疗由免疫系统疾病引起的皮肤病,包括白癜风、牛皮癣和特应性皮炎,也称为湿疹。作为2022年8月敲定的™收购的一部分,ReneCann APIRX配方受到IncanneX获得的已授予和正在申请的专利的商业保护。
这种独特的配方结合了大麻酚(“CBG”)和CBD。CBG是一种非精神活性大麻素,具有强大的抗炎特性。在一项人体概念验证研究中使用了之前版本的ReneCann™,剂量超过6周。这项研究是在荷兰的莫里茨诊所进行的,由世界著名的皮肤科医生Marcus Meinardi博士领导。
在这项研究中,ReneCann™ 降低了每种目标皮肤病患者的疾病评分。白癜风、银屑病和特应性皮炎患者的症状改善率分别为10%、33%和22%。
特别是,研究参与者患有白癜风的结果非常令人鼓舞,部分原因是该疾病的发病率很高,占全球人口的0.5%-1.0%,而且对它的治疗有限。白癜风是当色素产生细胞(黑素细胞)停止产生黑色素,导致斑块中的皮肤颜色消失,变色区域通常随着时间的推移而变大时观察到的。ReneCann™与弥漫性再色素沉着(通常是滤泡周围或病变边缘)有关,在色素脱失复发之前,疗效最终持续数周。
由欧洲FINS合同开发和制造组织(“™”)生产的ReneCann™药物产品将用于临床试验,以证实ReneCann CDMO对白癜风、牛皮癣和特应性皮炎的安全性和疗效。作为欧洲FINS这一项目的一部分,有关ReneCann™质量和稳定性的数据将用于美国食品和药物管理局未来监管包的化学和制造控制模块 。ReneCann™还有可能在其他疾病中进行疗效评估,在这些疾病中,局部应用可能比传统的口服剂量大麻制剂有好处。
IncanneX已选择Quest 制药服务公司(“QPS”)作为其监管指导和临床试验管理的合作伙伴,以推进针对成瘾和免疫紊乱皮肤病而设计的坎昆™和人人网™产品系列。QPS成立于1995年,现已发展成为一家著名的合同研究机构,提供生物分析、药理学和临床研究方面的一系列服务。QPS正在为美国食品药品管理局和食品和药物管理局起草Cannquit™和Renecann™产品的IND前提交文件。监管批准后,QPS将在监督临床试验方面发挥主导作用,收集安全性和有效性的相关证据 。
Oraximax治疗牙周病和牙周炎
全世界高达50%的成年人 患有中到重度牙周炎和/或牙周炎。牙周病的治疗仅限于专业的牙齿清洁和全身抗生素的使用。我们正在开发含有CBD和大麻酚(CBG)的OraxiMax牙膏和漱口水,这两种物质可以预防牙菌斑的形成,从而预防牙龈炎和牙周炎。由于它们的专利配方,原料药的本地可获得性 被提高,而全身吸收保持在最低水平。
60
CBD在牙齿保护方面的好处包括:
| ● | 减少可导致牙周病的炎症 |
| ● | 减少与龋齿相关的细菌,降低龋齿风险。 |
| ● | 缓解牙齿和牙床过敏 |
| ● | 鼓励牙齿再矿化,以及 |
| ● | 恢复酸碱度平衡。 |
我们观察到OraxiMax产品令人鼓舞的 生物利用度数据,并打算进行第二阶段研究,以证明向FDA注册该产品的适当安全性和有效性。
治疗眼科疾病的大麻素
通过此次收购,我们获得了两项大麻类眼科制剂的专利授权。坊间证据支持大麻和大麻类药物产品在治疗青光眼和结膜炎方面的治疗益处。我们认为,这些眼部疾病的治疗效果来自于大麻素的神经保护、抗炎和抗微生物活性。我们打算进行1期安全性和概念验证临床试验,以促进用于眼科疾病的大麻类药物的开发。
克拉里昂诊所
2023年3月,我们宣布打算在澳大利亚和海外开设多家迷幻辅助心理治疗诊所。我们为迷幻诊所制定商业化计划已经有一段时间了,在TGA决定下调治疗难治性抑郁症的裸盖菇素(TRD)和创伤后应激障碍(PTSD)的MDMA之前就已经有一段时间了。TGA的声明导致了这些计划的扩展和宣布。
我们已经与澳大利亚领先的临床迷幻专业人员建立了合作关系,他们都在临床迷幻研究、治疗和培训方面拥有丰富的经验,包括以下个人:
| ● | 保罗·利克纳伊茨基博士:董事联合创始人、首席战略官兼首席科学官 |
Paul在澳大利亚建立临床迷幻领域中发挥了核心作用,并领导着该国最大的迷幻研究人员和临床医生团队。Paul 是迷幻试验项目的首席研究员,并在全国范围内参与了许多其他项目的合作。他领导了迷幻试验方案的开发、治疗设计、试验协调、治疗师选择和培训,并与该领域广泛的国际专家和组织网络建立了积极的合作关系。Paul的工作重点是开发创新的迷幻疗法、评估益处、探索潜在缺陷、预测治疗反应、降低风险、了解治疗机制以及将研究转化为实践。
| ● | Suresh Sundram教授:董事联合创始人、首席医疗官和精神病学负责人 |
苏雷什是澳大利亚皇家精神病学家和新西兰精神病学家学院的院士,也是精神病学家的顾问。他在学术和临床精神病学方面担任高级领导职务,发表了150多篇科学文章、书籍、书籍章节和会议摘要。他曾在国际和国内会议上作为全体会议发言和特邀演讲者,担任《亚洲精神病学杂志》副主编,并担任联合国以及国家和州政府的顾问。桑德拉姆教授领导了50多项精神疾病的临床试验和研究。他在心理治疗中使用迷幻剂方面拥有丰富的经验,并监督了该领域的多个研究项目。
61
| ● | 肖恩·奥卡罗尔:董事联合创始人兼心理治疗负责人 |
肖恩是一位综合性心理治疗师,擅长经验式、关系型和超个人化心理治疗。自2019年以来,他为多个临床迷幻研究团队开发并提供迷幻辅助心理治疗培训。他曾担任两个临床研究 试验的首席心理治疗师,继续监督其中一个团队,并在行业内担任迷幻辅助心理治疗顾问, 重点是心理治疗培训和方案制定。肖恩从2011年开始讲授超个人心理学,他有十多年的工作经验,研究他所说的“迷幻受害者”。通过Wild Mind Institute,他为心理健康从业者提供迷幻辅助心理治疗、“糟糕之旅”整合和生态心理治疗方面的培训。
2023年5月,我们宣布,我们签署了在维多利亚州墨尔本郊区阿伯茨福德开设第一家诊所的租约。该诊所被设计为商业规模的原型,可以扩大规模并复制到其他地点。据估计,它有能力在正常工作时间内每年治疗600多名患者,而在延长工作时间的手术中治疗的患者要多得多。该公司还宣布,已获得裸盖菇素和MDMA的初步供应,以促进临床手术的开始。
Clarion诊所咨询委员会由世界领先的临床迷幻专家组成,包括以下个人:
| ● | 比尔·理查兹博士是世界上最著名的迷幻研究人员和实践者之一。他在致幻研究、治疗和培训的前沿有几十年的职业生涯 ,是世界各地众多研究小组的导师和培训师。 他是约翰·霍普金斯大学迷幻研究小组的联合创始人,也是美国马里兰州阳光石疗法公司的董事治疗师。 |
| ● | Andrea Jungaberle博士是柏林Ovid诊所的首席医疗官,也是欧洲领先的迷幻研究和教育集团Mind Foundation的联合创始人。她曾为数百名患者进行和/或监督迷幻辅助心理治疗,并在德国最大的裸盖菇素临床试验和临床服务交付中工作。 |
| ● | 马修·约翰逊教授是世界上发表论文最多的迷幻科学家之一。他在约翰·霍普金斯迷幻与意识研究中心的建立和领导记录方面发挥了核心作用,他的工作为临床迷幻科学实践中的标准做出了贡献。作为该领域的知名科学家,他经常接受国内和国际媒体的采访。 |
2023年8月8日,Clarion诊所宣布,他们将接受迷幻治疗兴趣的注册,作为准备开业前筛查的一部分。
知识产权
我们在与我们的医疗顾问委员会合作开发我们的产品和疗法时,实施了专利申请战略。截至2023年6月30日,我们拥有与我们的大麻类药物候选药物相关的 项未决专利申请。下表列出了 的专利数量、专利类型和司法管辖区。一旦转换到完成/PCT阶段,临时专利也将适用于所有PCT签约国家 。国际检索机构的国际检索报告和书面意见已经确认,我们提交的专利合作条约申请中的关键权利要求是新颖和创造性的,本发明符合工业适用性的要求。 为PCT申请准备国际检索报告(ISR)和国际检索意见(ISO)是专利合作条约(PCT)国际阶段的主要程序步骤之一。在国际阶段进行检索的目的是确定相关的现有技术,并由国际检索当局就权利要求是否新颖、是否涉及创造性步骤以及是否可在工业上适用作出初步意见。虽然ISR和ISO不具约束力,但从国家专利局没有义务接受国际检索机构的任何裁决的意义上讲,这些报告往往是关于PCT申请中所要求的标的的可专利性的有用指南。
62
在涵盖候选大麻药物IHL-216A、IHL-675A和IHL-42X的PCT申请中,国际检索机构是澳大利亚专利局。因此,ISR/ISO中针对每一项PCT申请所表达的意见是基于澳大利亚专利审查员进行的检索 。
| 产品/技术 | 数量 应用程序 |
专利类型 保护 |
适用范围 司法管辖区 | |||
| IHL-42X/治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 8 | 标准/实用程序 | 澳大利亚、加州、CO、EP、IL、JP、新西兰、美国 | |||
| IHL-675A/治疗炎症性疾病的组合物和方法 | 8 | 标准/实用程序 | 澳大利亚、加州、CO、EP、IL、JP、新西兰、美国 | |||
| IHL-216A/治疗或预防创伤性脑损伤的组合物和方法 | 7 | 标准/实用程序 | 澳大利亚、加州、EP、IL、JP、新西兰、美国 |
大麻类药物候选药物IHL-675A是CBD和羟氯喹的组合,其具体定义由国际(PCT)申请号权利要求16定义。%/AU2021/050226。国际搜索局认为权利要求16既新颖又有创意。
大麻类药物候选药物IHL-42X是THC和乙酰唑胺的组合,用于治疗阻塞性睡眠呼吸暂停(OSA),其由国际(PCT)申请号:%/AU2021/050734。国际搜索局认为权利要求3既新颖又有创造性。
大麻类药物候选药物IHL-216A是CBD和异氟醚的组合,其具体定义由国际(PCT)申请号23的权利要求限定。PCT/Au2020/051056。 国际搜索机构认为权利要求23既新颖又有创造性。
除了为我们的所有资产寻求专利 保护外,我们还依赖非专利的商业秘密、技术诀窍和其他机密信息以及专有的 技术创新和专业知识,这些技术创新和专业知识在一定程度上受到与我们的员工、顾问和顾问签订的保密和发明转让协议的保护。
生物技术中的专利问题具有高度的不确定性,涉及复杂的法律和事实问题。生物技术 和药品专利中允许的权利要求的可用性和广度无法预测。可专利标的的法定差异可能会限制我们 可以对我们的部分或全部许可发明获得的保护范围,或者阻止我们获得专利保护,这可能会损害我们的业务、 财务状况和运营结果。由于专利申请从首次提交之日起至少18个月才会公布 ,而且科学文献中发现的发布往往滞后于实际发现,因此我们不能确定我们 或我们的任何许可人是未决专利申请所涵盖的发明的第一个创造者,或者我们或我们的许可人是 第一个为此类发明提交专利申请的人。此外,专利的授予和可执行性取决于许多因素,这些因素可能在不同的司法管辖区之间有所不同。这些因素可包括本发明的新颖性、要求本发明与现有技术相比不是显而易见的(包括本发明的先前使用或出版)、本发明的实用性以及专利清楚地描述了本发明的最佳工作方法的程度。简而言之,这意味着在不同地区批准的索赔可能会有所不同,从而影响商业结果。
虽然我们已经申请了 ,并将继续为我们的治疗产品和技术申请适当的保护,但我们不能确定我们未来提交或许可给我们的任何 专利申请是否会获得批准,或者我们是否会开发其他可申请专利的产品或方法 ,或者我们是否能够许可任何其他可申请专利的产品或方法。我们不能确定其他人不会 不独立开发类似的产品或流程、复制 公司开发或正在开发或授权给我们的任何产品或流程、或围绕我们拥有或许可的专利进行设计,也不确定我们拥有或许可的任何专利将为我们提供竞争优势。
此外,我们不能 确定第三方拥有的专利不会阻止采用由我们开发或授权给我们的技术的产品的商业化,或者第三方不会挑战或试图缩小、无效或规避我们拥有或许可的任何已发布、未决的 或未来专利。
63
我们的商业成功还将在一定程度上取决于我们避免侵犯他人专利的能力。如果法院判定我们侵犯了 任何第三方专利,我们可能会被要求支付损害赔偿金、更改我们的产品或流程、获取许可证或停止某些活动。 我们不能确定第三方持有的专利所需的许可证是否会以我们可以接受的条款提供 或根本不能接受。在我们无法获得此类许可的情况下,我们可能会被取消需要此类许可的产品的开发、出口、制造或商业化的权利,或者在我们尝试围绕 此类专利进行设计时遇到产品推出的延迟,而这些情况中的任何一种都可能对我们的业务、财务状况和 运营结果产生重大不利影响。我们可能不得不诉诸诉讼来强制执行向我们颁发或许可的任何专利,或确定第三方专有权的范围和有效性 。这样的诉讼可能会导致巨额费用和我们的工作分心。我们可能必须参与澳大利亚专利商标局或其他外国专利局的反对诉讼,或美国专利商标局宣布的干预诉讼,以确定竞争对手提交的专利申请的发明优先权。 无论结果如何,任何此类诉讼干预或反对诉讼都可能代价高昂且耗时,任何此类诉讼中的不利裁决都可能阻止我们开发、制造或商业化我们的产品,并可能对我们的业务、财务状况和运营结果产生实质性不利影响。
截至2023年6月30日,该公司还在澳大利亚和美国拥有商标注册
专利组合
下表介绍了我们由IncanneX提交的专利和专利申请组合,包括它们的状态(截至2023年6月30日)和所有权。如果保留专利,专利的有效期为自其生效申请之日起约20年。
下表介绍了我们由IncanneX提交的专利和专利申请组合,包括它们的状态(截至2023年6月30日)和所有权。
| 专利家族 | 标题 | 状态 | 过期 | |||
| AU 2019903734 | 可吸入组合物及其用途 | 继续作为PCT应用程序 | 北美 | |||
| %/澳元2020/051056 | 治疗或预防创伤性脑损伤的组合物 | 进入国家/地区阶段 | 北美 | |||
| AU 2020359294 | 治疗或预防创伤性脑损伤的组合物 | 授与 | 10/02/2040 | |||
| CA 3152806 | 治疗或预防创伤性脑损伤的组合物 | 待定 | 10/02/2040* | |||
| 第20870484.1集 | 治疗或预防创伤性脑损伤的组合物 | 待定 | 10/02/2040* | |||
| IL 291874 | 治疗或预防创伤性脑损伤的组合物 | 待定 | 10/02/2040* | |||
| JP2022-520850 | 治疗或预防创伤性脑损伤的组合物 | 待定 | 10/02/2040* | |||
| 新西兰786889 | 治疗或预防创伤性脑损伤的组合物 | 待定 | 10/02/2040* | |||
| 美国17/638264 | 治疗或预防创伤性脑损伤的组合物 | 待定 | 10/02/2040* | |||
| AU 2020901030 | 一种治疗方法 | 继续作为PCT应用程序 | 北美 | |||
| AU 2020902432 | 一种治疗方法 | 继续作为PCT应用程序 | 北美 | |||
| AU 2020903985 | 一种治疗方法 | 继续作为PCT应用程序 | 北美 | |||
| AU 2020904264 | 一种治疗方法 | 继续作为PCT应用程序 | 北美 | |||
| AU 2021900241 | 一种治疗方法 | 继续作为PCT应用程序 | 北美 | |||
| AU 2021900324 | 一种治疗方法 | 继续作为PCT应用程序 | 北美 | |||
| PCT/AU2021/050226 | 用于治疗或预防炎性病症的方法和组合物 | 进入国家/地区阶段 | 北美 | |||
| AU 2021250462 | 用于治疗或预防炎性病症的方法和组合物 | 待定 | 03/15/2041* | |||
| CA 3169702 | 用于治疗或预防炎性病症的方法和组合物 | 待定 | 03/15/2041* |
64
| CO NC2022/0015048 | 用于治疗或预防炎性病症的方法和组合物 | 待定 | 03/15/2041* | |||
| EP 21781628.9 | 用于治疗或预防炎性病症的方法和组合物 | 待定 | 03/15/2041* | |||
| IL 296943 | 用于治疗或预防炎性病症的方法和组合物 | 待定 | 03/15/2041* | |||
| JP 2022-559967 | 用于治疗或预防炎性病症的方法和组合物 | 待定 | 03/15/2041* | |||
| 新西兰793870 | 用于治疗或预防炎性病症的方法和组合物 | 待定 | 03/15/2041* | |||
| 美国17/907322 | 用于治疗或预防炎性病症的方法和组合物 | 待定 | 03/15/2041* | |||
| AU 2020902368 | 一种治疗方法 | 继续作为PCT应用程序 | 北美 | |||
| %/澳大利亚2021/050734 | 治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 进入国家/地区阶段 | 北美 | |||
| AU 2021306424 | 治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 待定 | 07/09/2041* | |||
| CA 3182528 | 治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 待定 | 07/09/2041* | |||
| CO NC2023/0000118 | 治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 待定 | 07/09/2041* | |||
| 第21837113.6集 | 治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 待定 | 07/09/2041* | |||
| IL 299212 | 治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 待定 | 07/09/2041* | |||
| JP2023-501090 | 治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 待定 | 07/09/2041* | |||
| 新西兰795230 | 治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 待定 | 07/09/2041* | |||
| 美国18/000,880 | 治疗阻塞性睡眠呼吸暂停(OSA)的组合物和方法 | 待定 | 07/09/2041* | |||
| 邮编:2021902170 | 组合物及其用途 | 继续作为PCT应用程序 | 北美 | |||
| PCT/AU2022/050731 | 在固定剂量组合胶囊中包含大麻二酚和羟氯喹的组合物 | 待定 | 07/13/2042^ | |||
| AU 2021903210 | 组合物及其用途 | 继续作为PCT应用程序 | 北美 | |||
| PCT/AU2022/051200 | 用于吸入给药的包含大麻二酚的水包油乳剂 | 待定 | 10/07/2042^ | |||
| AU 2022903614 | 一种治疗方法 | 待定 | 11/29/2043# |
| * | 有效期可能会受到任何专利期限延长或调整的影响。 |
| ^ | 假设将在关键管辖区进入国家/区域阶段 |
| # | 假设在2023年11月29日的完成截止日期完成PCT申请 |
对APIRx的收购为IncanneX的专利组合增加了19项已授予专利和23项未决专利申请。这些专利涵盖大麻类药物开发的方方面面,包括提取、配方和使用方法。
65
竞争
我们的目标是没有注册的、有限的或昂贵的药物解决方案的适应症。因此,我们正在评估的适应症的竞争对手药物要么不存在,要么疗效有限,要么对某些患者有令人不快的副作用。 下表概述了用于治疗我们目标药物治疗的疾病的现有药物和疗法及其对患者的相关 陷阱。
| 国际人道主义法:候选药物 | 指示 | 现有产品 | 现有产品陷阱 | |||
| IHL-42X | 阻塞性睡眠呼吸暂停 | −持续正压吸入器、牙科器械 |
睡眠时佩戴的−噪音机械装置; 由于不适,−患者的潜在依从性较差 。 | |||
| IHL-216A | 创伤性脑损伤/震荡 | 无 | 不适用 | |||
| IHL-675A | 肺部炎症 |
−皮质类固醇 −呼吸机 |
−皮质类固醇降低免疫系统活性 ; −呼吸机与高死亡率有关。 | |||
| IHL-675A | 类风湿关节炎 |
−皮质类固醇 −DMARDS −生物制剂 |
−费用高,副作用大 配置文件; −在某些患者队列中缺乏有效性或耐受性 。 | |||
| IHL-675A | 炎症性肠病 |
−皮质类固醇 −免疫系统抑制因子(ISSS) −生物制剂 |
−皮质类固醇可降低免疫系统的活性; −ISSS会损坏消化道衬里 ; | |||
| PSI-GAD | 广泛性焦虑障碍 | −抗抑郁药(SSRI/SNRI类) |
−无疗效,副作用较差; −有些患者对治疗产生了抗药性。 | |||
| ReneCann | 白癜风 | 外用皮质类固醇、钙调神经磷酸酶抑制剂、光疗、全身免疫抑制药 |
长期使用疗效差,副作用大。 需要多个应用程序,延迟后才能看到响应 | |||
| ReneCann | 特应性皮炎 | 外用皮质类固醇,钙调神经磷酸酶抑制剂,光疗,全身免疫抑制药,Crisborole,Dupilumab | 治疗依从性差、安全性问题、疗效有限 | |||
| ReneCann | 银屑病 | 外用皮质类固醇、钙调神经磷酸酶抑制剂、角蛋白水解剂、生物制品 | 需要注射治疗,疗效有限 | |||
| 坎奎特恩 | 戒烟 | 尼古丁替代疗法、安非他酮、伐伦尼克林 | 疗效有限 | |||
| CannQuito | 阿片类药物使用障碍 | 丁丙诺啡、美沙酮 | 有限的疗效、滥用的可能性、副作用 |
监管部门
我们候选药物的正在进行的研发、临床、监管、商业和生产活动受到众多政府机构的广泛监管,包括(I)在澳大利亚,主要是治疗药物管理局(TGA);(Ii)在美国,主要是食品和药物管理局(FDA),以及药品执行机构(DEA);以及(Iii)在欧洲,主要是欧洲药品管理局(EMA)和地方主管当局、伦理委员会(ECs)、机构研究委员会(IRBs)和 其他联邦、州或地方各级监管机构。我们与我们的第三方承包商一起,将被要求满足我们希望对候选药物进行研究或寻求批准或许可的国家/地区监管机构的各种临床前、临床和商业审批以及审批后要求。
66
美国
FDA流程
在美国,FDA根据《联邦食品、药物和化妆品法》或FDCA及其实施条例对药品进行监管。根据《联邦食品、药品和化妆品法》、《公共卫生服务法》及其实施条例对此类产品的药品质量、安全性、有效性、标签、储存、记录保存、广告和促销进行监管的法规。特别是,受管制物质,如合成大麻二酚、THC和裸盖菇素,受美国禁毒署(DEA)监管。
获得FDA和DEA批准以及实现和保持遵守适用的法律法规的过程需要花费大量的时间和财力。不遵守适用的FDA或其他要求可能会导致拒绝批准待定申请、 临床暂停、警告信、民事或刑事处罚、召回或扣押产品、部分或全部暂停生产 或将产品从市场上撤回。任何新药或生物药物,包括将之前批准的药物用于新适应症的新用途,都需要获得FDA的批准才能在美国上市。所有FDA批准的申请必须包含与安全性和有效性、药品质量、包装、标签和质量控制相关的信息。
政府对制药行业的监管通常分为审批前和审批后两类。今天市场上的大多数具有治疗意义的创新产品都是新药申请(NDA)或生物制品许可证申请(BLAS)的主题。预审批活动用于确保产品在上市前是安全有效的。
药品审批流程-FDA
在药物获得FDA批准之前,我们的候选药物 不得在美国上市。药物在美国上市前所需的步骤通常包括以下步骤:
| ● | 根据FDA的GLP和GMP规定,完成广泛的临床前实验室测试、动物研究和配方研究; |
| ● | 向FDA提交人体临床试验的研究新药或IND申请,该申请必须在人体临床试验开始之前生效; |
| ● | 在美国开始任何涉及使用附表I受控物质的临床试验之前,必须获得DEA的批准。 |
| ● | 根据GCP要求进行充分和良好控制的人体临床试验,以确定药物对每个拟议适应症的安全性和有效性; |
| ● | 在所有关键临床试验完成后向FDA提交NDA/BLA; |
| ● | 令人满意地完成FDA对生产和测试活性药物成分或原料药和成品的一个或多个生产设施的批准前检查,以评估是否符合当前的良好制造规范或cGMP;以及 |
| ● | FDA审查和批准NDA/BLA和DEA时间表(针对受控物质),然后在美国进行任何商业营销或销售该药物。 |
生产和质量以及临床前和临床试验和审批过程需要大量的时间、精力和财力,我们不能 保证我们的候选药物的批准将及时获得批准(如果有的话)。值得注意的是,FDA可能会在分析相同数据后得出与我们不同的结论,或者FDA审查小组成员之间可能会有不同的意见。
FDA可以对国内外开发设施、计划生产设施、临床试验场地和实验室设施进行检查和审计。在将新产品提交市场后,需要进行 审批前检查,对受监管设施进行常规检查,并对引起FDA注意的特定问题进行“原因”检查。产品获得批准并上市后,FDA 使用不同的机制来确保公司遵守申请中描述的批准条款和条件,并以一致和受控的方式生产产品。这是通过FDA的现场调查人员和分析师对生产和质量控制设施进行定期突击检查来完成的。
67
临床前试验包括实验室动物毒性评估和体外毒性评估(实验室测试)。临床前试验的结果与生产信息和分析数据一起作为IND申请的一部分提交给FDA。IND应用基于在动物身上进行的药理学和毒性初步测试的结果,该结果用于制定在人体上测试药物的计划。只有在临床前测试之后,FDA才会决定该药物是否应该在人体上进行测试。
此外,一个独立的机构审查委员会,或IRB,涵盖每个提议进行临床试验的医疗中心,必须在该中心开始任何临床试验之前审查和批准该计划,并必须监督研究直到完成。FDA、IRB或赞助商可随时以各种理由暂停临床试验,包括发现受试者或患者暴露在不可接受的健康风险中。临床试验还必须满足广泛的良好临床实践或GCP法规,其中包括要求 所有研究对象提供知情同意,以及所有临床研究必须在一名或多名合格的 研究人员的监督下进行。
临床试验(在IND下)涉及在合格研究人员的监督下对人类受试者进行研究用药。临床试验 是根据详细说明研究目标、用于监测安全性的参数和要评估的有效性标准的方案进行的。每个方案必须作为单独提交给IND的一部分提供给FDA。此外,建议进行临床试验的每个医学中心的机构审查委员会或IRB必须在该中心开始任何临床试验之前审查和批准研究方案,并通知研究对象的同意信息,并且IRB必须监测研究直到 完成。也有关于向公共注册机构报告正在进行的临床试验和临床试验结果的要求。 研究对象在参与临床试验之前必须签署知情同意书。
详细说明临床研究结果的进度报告必须至少每年提交给FDA,安全报告必须提交给FDA和调查人员,如果出现未公开的IND,则会出现严重和意外的不良反应。为了提交和批准保密协议或BLA,人体临床试验通常按以下顺序进行,这些阶段可能会重叠:
| ● | 第一阶段:试验最初在有限的健康人群中进行(在肿瘤学第一阶段试验中通常在患者身上进行)受试者或患者,以测试候选药物的安全性和剂量耐受性。这些研究旨在测试研究产品在人体内的安全性、剂量耐受性、吸收、新陈代谢和分布,以及与增加剂量相关的副作用,并在可能的情况下获得有效性的早期证据。 |
| ● | 第二阶段:研究产品用于特定疾病或状况的有限患者群体,以评估初步疗效、最佳剂量和剂量计划,并确定可能的不良副作用和安全风险。在开始更大规模和更昂贵的3期临床试验之前,可以进行多个2期临床试验以获得信息。 |
| ● | 第三阶段:研究产品在充分和良好控制的研究中应用于扩大的患者群体,以进一步评估剂量,提供临床疗效的统计显著证据,并进一步测试安全性,通常在多个地理分散的临床试验地点进行。这些临床试验旨在确定研究产品的总体风险/益处关系,并为产品批准提供充分的基础。 |
| ● | 第四阶段:在某些情况下,FDA可能会以赞助商同意进行额外的临床试验来进一步评估候选药物的安全性、纯度和有效性为条件来批准NDA或BLA。这种批准后的试验通常被称为第四阶段临床试验。 |
在临床研究的同时,赞助商通常会完成额外的动物研究,还必须开发有关产品的更多信息,并最终确定根据cGMP要求进行商业批量生产产品的工艺。制造过程必须能够 始终如一地生产高质量的候选药物批次,制造商必须开发和验证用于测试最终产品的特性、强度、质量和纯度的方法 。此外,必须选择和测试适当的包装,并进行稳定性研究,以确保产品的完整性,并证明候选药物在保质期内不会发生不可接受的变质。
68
产品开发、临床前研究和临床试验的结果以及上述制造信息将作为BLA/NDA的一部分提交给FDA。根据处方药使用费法案,FDA同意NDA/BLA审查时间的具体目标。测试和审批流程需要大量的时间、精力和财力。FDA将审查BLA/NDA,并可能认为它不足以支持批准,我们无法确保任何批准是否会及时获得批准(如果有的话)。FDA还可以将申请提交给适当的咨询委员会,通常是由临床医生组成的小组,以进行审查、评估,并就申请是否应被批准提出建议。FDA不受咨询委员会建议的约束,但它通常遵循此类建议。
如果不满足适用的监管标准,FDA可能会拒绝批准BLA/NDA,或者可能需要额外的临床数据或额外的关键第三阶段临床试验。即使提交了这样的数据,FDA也可能最终决定NDA/BLA不符合批准标准 。临床试验的数据并不总是决定性的,FDA可能会以不同于赞助商的方式解释数据。一旦 发布,如果未满足持续的监管要求或产品上市后出现安全问题,FDA可能会撤回产品批准。此外,FDA可能要求进行测试,包括第四阶段临床试验和监督计划,以监测已商业化的批准产品的效果,FDA有权根据这些上市后计划的结果阻止或限制产品的进一步销售 这些计划可能包括儿科评估,以及申请新适应症、新剂型、新给药方案、新给药途径或新有效成分所需的潜在研究。 产品只能针对批准的适应症并根据批准的标签的规定进行销售。此外,如果 药物有任何修改,包括适应症、标签或生产工艺或设施的变化,可能需要批准 新的或补充的BLA,这可能涉及进行额外的临床前研究和临床试验。
加快审批
FDA有各种计划,包括快速通道指定、优先审查、加速批准和突破性治疗指定,旨在加快或简化药物审查流程和/或根据替代终点提供批准。即使一种药物符合其中一个或多个计划的资格,FDA也可以在以后决定该药物不再符合资格条件,或者FDA审查或批准的时间段不会缩短。特别是,如果加速批准任何特定的候选药物,如果上市后临床试验结果不成功,FDA随后可以撤销该产品的上市授权。 通常情况下,符合这些计划条件的药物包括那些治疗严重或危及生命的疾病或疾病的药物,那些具有解决未满足的医疗需求的潜力的药物,以及那些提供比现有治疗更有意义的益处的药物。
美国其他监管要求
批准后,产品将受到FDA的持续监管,包括公司根据GMP生产产品的义务、 维护并向FDA提供最新的安全性和有效性信息、报告产品的不良体验、保留某些记录 并提交定期报告、获得FDA对某些生产或标签更改的批准以及遵守FDA的促销和广告 要求和限制。未能履行这些义务可能会导致各种不利后果,包括自愿的和FDA强加的,包括产品召回、撤回批准、限制营销,以及对BLA持有人施加民事罚款和刑事处罚 -所有这些都可能公之于众。此外,以后发现以前未知的安全性或有效性问题 可能会导致对产品、制造商或应用程序持有者的限制。
我们以及我们候选药物的任何制造商都必须遵守FDA的GMP法规中包含的适用的FDA生产要求。GMP法规要求质量控制和质量保证以及相应的记录和文档维护。我们候选药物的生产设施必须符合GMP要求。我们和任何第三方制造商 还将接受FDA和其他机构对设施的定期检查,包括测试和生产我们的候选药物时使用的程序和操作,以评估我们是否符合适用的法规。
69
关于产品上市后广告和促销,FDA对药品广告和促销实体实施了一系列复杂的法规,其中包括直接面向消费者广告的标准、促销产品的用途或在产品批准的标签中未说明的患者群体中(称为“非标签使用”)、行业赞助的科学和教育活动以及涉及互联网的促销活动。不遵守FDA的要求可能会产生负面后果, 包括负面宣传、FDA的强制执行函、强制更正广告或与医生和民事部门的沟通 或刑事处罚。尽管医生可能会开出合法的药品用于标签外用途,但制造商可能不会销售或推广此类标签外用途。
更改已批准申请中确定的某些条件,包括适应症、标签或生产工艺或设施的更改,需要 提交和FDA批准新的BLA或BLA补充剂才能实施。新适应症的BLA补充剂通常需要与原始申请中类似的临床数据,FDA在审查 BLA补充剂时使用的程序和操作与审查BLAS时相同。
FDA批准BLA后,需要提交不良事件报告和定期报告。FDA还可能要求上市后测试,即所谓的第四阶段测试、风险缓解策略和监控,以监控批准产品的影响,或对可能限制产品分销或使用的批准施加条件。
受管制物质
《受控物质法》(CSA)及其实施条例建立了受控物质分配的“封闭系统”。CSA在DEA的监督下规定了注册、安全、记录保存和报告、储存、制造、分销、标签、进口、出口、处置和其他要求。DEA是负责监管受控物质的联邦机构, 并要求生产、进口、出口、分销、研究或分发受控物质的个人或实体遵守监管要求,以防止受控物质转移到非法商业渠道。
研究、制造、分销、进口或出口任何受管制物质的设施必须每年向DEA登记。DEA登记针对特定地点、活动和使用的受控物质。例如,进口和制造活动需要单独注册,每一次注册都授权注册人可以处理受控物质的哪些时间表。但是,在没有获得单独的DEA注册的情况下,允许 某些重合活动,例如由生产这些活动的制造商分发受控物质 。
DEA将受管制的 物质归入五个附表之一-附表I、II、III、IV或V-,每个附表中列出 的资格各不相同。DEA的时间表决定取决于对一种物质或一种物质的特定配方的批准。 根据定义,时间表I物质具有很高的滥用潜力,目前在美国没有用于治疗的“可接受的医疗用途” ,并且在医疗监督下使用缺乏公认的安全性。它们只能用于联邦批准的研究项目,不得销售或销售给美国的患者。具有目前被接受的医疗用途的药品可被列为附表II、III、IV或V物质,其中附表II物质具有最高的滥用和身体或心理依赖的可能性,而附表V物质具有最低的滥用和依赖的相对可能性 。对附表II物质的监管要求比附表III-V物质更严格。 例如,所有附表II药物处方必须由医生签署,在大多数情况下必须亲自提交给药剂师, 并且不能续装。大麻和THC是CSA规定的附表I管制物质。在美国批准用于医疗用途的产品含有大麻、THC或大麻/THC提取物,必须列入附表II-V,因为FDA的批准满足 “可接受的医疗用途”要求。虽然大麻和THC是受管制物质,但2018年《农业改善法》修订了CSA,将符合大麻法定定义的大麻排除在大麻定义之外。因此,在干重基础上含有0.3%或更少Delta-9 THC的大麻不再被视为受控物质。此外,满足关于Delta-9 THC的相同限制的大麻二醇也被排除在CSA监管控制之外。 由于大麻的定义没有明确包括大麻或其衍生物的合成等价物,因此对药物制造的大麻二醇的CSA控制状态缺乏 清楚。如果没有禁毒署的相反指导,大麻和含有大麻但不符合大麻定义的产品仍保留在大麻法典委员会附表一中,用于开发和研究活动。
70
在签发受控物质注册之前,DEA检查所有制造设施,以审查安全、记录保存、报告和遵守其他DEA法规要求。具体的安全要求因业务活动的类型以及处理的受控物质的时间表和数量而异。最严格的要求适用于附表一和附表二物质的制造商。所需的安全措施通常包括对员工进行背景调查,并通过储存在经批准的保险库、保险箱和笼子中以及使用警报系统和监控摄像头对受控物质进行实物控制。作为附表I或II物质的批量制造商(不是剂型制造商或分装者/重新标签者)的生产注册申请必须在 《联邦登记册》上公布,并开放30天,以允许感兴趣的人提交意见、反对意见或听证请求。 DEA将向所有登记为该物质的大宗制造商或申请登记的人转发一份《联邦登记册》公布的通知副本。注册后,制造设施必须保存记录所有受控物质的制造、接收和分配的记录。制造商必须定期向DEA提交附表一和附表二受控物质、附表三麻醉物质和其他指定物质的分配情况报告。注册人还必须报告任何受控物质被盗或重大损失,并必须遵守某些要求来处置受控物质。与申请注册为散装制造商一样,申请进口商注册附表I或II物质 也必须在联邦登记册上公布,该登记册的开放时间为30天,征求意见。为商业目的进口表一和表二管制物质一般限于尚未从国内供应商处获得的物质或国内供应商之间没有充分竞争的物质。除进口商或出口商登记外,进出口商每次进口或出口附表一和表二、表三、表四和表五麻醉药品、特别指定的表三非麻醉品或表四或表五《精神药物公约》管制的表一或表二所管制的麻醉药品,都必须 取得许可证,并提交表三、表四和表五非麻醉品的进出口申报单。
对于在美国生产的药品,DEA根据DEA对满足合法医疗、科研和工业需求所需数量的估计,每年为附表I和附表II中可能在美国制造或生产的物质建立总量配额。DEA允许每年在美国生产的这一有限的大麻总量在各个公司之间分配,而这些公司又必须每年向DEA申请个人制造和采购配额。配额同样适用于活性药物成分的生产和剂型的生产。DEA可每年调整总生产配额数次,并在一年中不时调整个别制造或采购配额,尽管DEA在是否对个别公司进行此类调整方面拥有相当大的自由裁量权。
各州还保持单独的受控物质法律和法规,包括许可、记录保存、安全、分配和分配要求。州当局,包括药房委员会,在每个州管理受管制物质的使用。未能遵守适用的 要求,特别是受管制物质的损失或转移,可能会导致执法行动,这可能会对我们的业务、运营和财务状况产生重大不利影响。缉毒局可以寻求民事处罚,拒绝续期 必要的登记,或启动程序撤销这些登记。在某些情况下,违规行为可能导致刑事 起诉。
我们在美国进行临床试验和生产活动将需要得到美国药品监督管理局的批准。在美国参与IncanneX项目的所有缔约方,包括但不限于配方开发、制造、临床前和临床研究,涉及受控物质 ,都将获得DEA的适当许可证和许可。我们还可能决定在其他国家/地区开发、生产或商业化我们的候选药物。因此,我们将遵守澳大利亚TGA 、加拿大卫生部受控物质办公室、英国国家药物管制系统毒品和枪支股(Home Office)以及我们未来开发、制造或商业化每种药物资产的其他国家/地区的其他监管机构的受控物质法律和法规。
外国监管
除了美国的法规 外,我们还受制于管理我们候选药物的临床试验和商业销售和分销的各种外国法规 。无论我们的产品是否获得FDA的批准,我们都必须获得外国可比监管机构的批准,然后才能在这些国家开始临床试验或产品营销。审批流程 因国家/地区而异,时间可能比FDA审批所需的时间长或短。管理临床试验进行的要求因国家而异。
71
欧盟和联合王国
在欧洲经济区,即由欧盟成员国加上挪威、冰岛和列支敦士登组成的欧洲经济区,医药产品只有在获得欧洲药品管理局的营销授权或MA后才能 商业化。根据欧盟监管制度,我们必须在我们打算进行临床试验的每个成员国提交临床试验申请并获得授权。在欧盟进行临床试验时,我们必须遵守欧盟临床试验指令(指令2001/20/EC) 的规定以及实施这些指令的欧盟成员国的法律法规。这些规定要求,除其他事项外,在开始临床试验之前,必须事先获得道德委员会和成员国主管当局的授权。2014年4月,欧洲联盟通过了《临床试验条例》(条例536/2014),该条例将取代目前的《临床试验指令》。为确保临床试验规则在整个欧盟范围内保持一致,欧盟通过了《欧盟临床试验条例》 ,该条例可直接适用于所有欧盟成员国。在欧盟进行的所有临床试验都必须根据《临床试验指令》进行 ,直到《临床试验条例》生效。根据EMA目前的计划 ,《临床试验条例》有望适用。
在我们完成 临床试验后,我们必须获得营销授权才能将产品推向市场。我们可以通过集中程序提交营销授权申请 。集中化程序规定授予对所有欧盟成员国均有效的单一营销授权。
欧洲药品管理局(European Medicines Agency,简称EMA)是位于阿姆斯特丹的欧盟机构。EMA负责对制药公司开发的供欧盟使用的药品进行科学评估。EMA参与对集中程序范围内的药品进行科学评估。与FDA一样,监管机构之间存在协调,EMA可以检查和审计开发设施、计划生产设施、临床试验场地和实验室设施。此外,在产品 获得批准并上市后,EMA使用不同的机制来确保公司遵守申请中所述的批准条款和条件,并以一致和受控的方式生产产品。这是通过对生产和质量控制设施进行定期突击检查来实现的。
如果我们的任何候选药物在欧洲药品管理局获得上市批准,我们预计他们将受益于8年的数据保护和10年的市场保护。 这两个时期并行,因此有效地授予了8年的数据保护和2年的市场保护。这意味着,引用我们在EMA存档的安全性和有效性数据的生物相似申请直到8年的数据保护期 结束才能提交,而生物相似申请只有在又过了2年(8+2)之后才能投放市场。此外,我们还提供额外的1年市场保护(8+2+1),在最初的8年期间,我们获得了具有显著临床益处的第二个适应症的批准。
同样,自2010年《生物制品价格竞争与创新法案》(“BPCIA”)生效以来,美国为一种新的生物制品提供了4年的数据排他性 和12年的市场排他性。专营期是平行的,这意味着FDA将在4年内不接受生物相似药物的申请,并在未来8年(4+8)内不批准生物相似药物。
欧盟药品审批条例和程序
为了在美国境外销售任何产品,公司还必须遵守其他国家和司法管辖区关于质量、安全性和有效性的众多且各不相同的法规要求,以及对产品的临床试验、营销授权、商业销售和分销等方面的监管要求。无论是否获得FDA对产品的批准,申请人都需要获得相应外国监管机构的必要批准,才能在这些国家或司法管辖区启动该产品的临床试验或营销。具体地说,欧盟对医药产品的审批流程通常遵循与美国相同的 路线,尽管在美国批准一种医药产品并不能保证同样的产品在欧盟获得批准,无论是在美国批准的时间范围内还是在美国批准的时间范围内。它需要令人满意地完成药物开发、非临床研究以及充分和良好控制的临床试验,以确定 针对每个建议适应症的药品的安全性和有效性。它还要求将产品在欧盟或其成员国(以及冰岛、挪威和列支敦士登)营销和销售之前,向相关主管当局提交临床试验授权申请或MAA,并由这些 当局授予营销授权。 如果我们未能遵守适用的要求,我们可能会受到罚款、暂停临床试验、暂停 或撤回监管批准、产品召回、产品扣押、运营限制和刑事起诉等方面的处罚。
72
临床试验批准
根据目前适用的临床试验指令2001/20/EC和关于GCP的指令2005/28/EC,欧盟已通过成员国的国家立法实施了临床试验审批制度。根据这一制度,申请人必须获得进行临床试验的欧盟成员国的国家主管当局或NCA的批准,如果要在多个成员国进行临床试验,则必须在多个成员国获得批准。此外,申请人只有在独立伦理委员会(EC)对临床 试验发表了好评后,才能在特定的研究地点开始临床试验。临床试验申请必须附带有2001/20/EC号指令和2005/28/EC号指令以及成员国相应国家法律规定的支持信息的研究药品档案,并在适用的指南文件中进一步详细说明。根据现行制度,在临床试验期间发生的所有被怀疑的意外严重不良反应都必须向发生这些反应的成员国的NCA和ECS报告。
2014年4月,欧洲联盟通过了新的临床试验条例(EU)第536/2014号,该条例将取代目前的临床试验指令2001/20/EC。 它将彻底改革欧盟目前的临床试验审批制度。具体地说,新立法将 直接适用于所有欧盟成员国(意味着不需要在每个欧盟成员国 制定国家实施立法),旨在简化和简化欧盟临床试验的审批。例如,新的《临床试验条例》规定了通过单一入口点简化申请程序,并严格规定了临床试验申请评估的截止日期。新的临床试验条例于2022年1月31日生效.
营销授权
要获得产品在欧洲经济区(由欧盟成员国加上挪威、冰岛和列支敦士登组成)或EEA的上市许可 , 申请人必须根据EMA管理的集中程序或EEA成员国主管 当局管理的程序之一(分散程序、国家程序或相互承认程序)提交MAA。上市许可 仅可授予在EEA内成立的申请人。
集中程序 规定由欧盟委员会授予在整个欧洲经济区有效的单一上市许可。对于那些不强制使用集中程序的产品,如果 产品含有用于治疗强制性清单以外疾病的新活性物质,或者申请人 能够证明该产品构成重大治疗、科学或技术创新,或者集中处理 符合公共卫生利益的。
Under the centralized procedure, the Committee for Medicinal Products for Human use, or the CHMP, which is the EMA’s committee that is responsible for human medicines, established at the EMA is responsible for conducting the assessment of whether a medicine meets the required quality, safety and efficacy requirements, and whether it has a positive risk/benefit/risk profile. Under the centralized procedure, the maximum timeframe for the evaluation of a MAA is 210 days from the receipt of a valid MAA, excluding clock stops when additional information or written or oral explanation is to be provided by the applicant in response to questions of the CHMP. Clock stops may extend the timeframe of evaluation of a MAA considerably beyond 210 days. Where the CHMP gives a positive opinion, it provides the opinion together with supporting documentation to the European Commission, who make the final decision to grant a marketing authorization. Accelerated evaluation may be granted by the CHMP in exceptional cases, when a medicinal product is of major interest from the point of view of public health and, in particular, from the viewpoint of therapeutic innovation. If the CHMP accepts such a request, the timeframe of 210 days for assessment will be reduced to 150 days (excluding clock stops), but it is possible that the CHMP may revert to the standard time limit for the centralized procedure if it determines that the application is no longer appropriate to conduct an accelerated assessment.
PRIME方案
EMA现在提供了一个计划, 旨在加强与EMA的早期对话和EMA的监管支持,以刺激创新,优化开发 并加速优先药物或PRIME的评估。其旨在建立在EMA提供的科学建议方案和加速 评估程序的基础上。该计划是自愿的,必须符合资格标准的药物才有资格获得PRIME。
73
PRIME计划对 正在开发的药物开放,申请人打算通过 集中程序申请首次上市许可申请。合格产品必须针对医疗需求未得到满足的疾病(欧盟没有令人满意的诊断、预防或治疗方法 ,或者如果有,新药将带来重大的治疗优势) ,并且必须证明通过引入新方法或疗法或改进现有方法或疗法来解决未得到满足的医疗需求的潜力。申请人通常处于开发的探索性临床试验阶段,并将在患者中获得初步临床证据 ,以证明药物具有良好的活性及其在很大程度上解决未满足的医疗需求 的潜力。在特殊情况下,如果相关模型中令人信服的非临床数据提供了有希望的活性的早期证据, 并且首次人体研究表明预期药效和耐受性的充分暴露,则来自学术部门或SME(中小型企业)的申请人可以在开发的早期阶段提交资格申请。
如果为PRIME方案选择了药物, EMA:
| ● | 从CHMP或先进疗法委员会(CAT)任命一名特别报告员,以提供持续支持,并在提交上市许可申请之前积累药物知识; |
| ● | 发布对申请人整体发展计划和监管战略的指导意见; |
| ● | 与报告员和环境管理协会相关委员会和工作组的专家一起组织启动会议; |
| ● | 提供专职EMA联络人;以及 |
| ● | 在关键的发展里程碑上提供科学建议,必要时让更多的利益攸关方参与,如卫生技术评估机构和患者。 |
在申请上市 许可时,预计被选择 用于PRIME计划的药物也将受益于EMA的加速评估程序。在开发过程中,如果药物不再符合资格标准,PRIME计划下的支持可能会被撤销。
欧盟的监管数据保护
在欧洲药品管理局中,根据完整的独立数据包获得批准的创新药用 产品有资格获得八年的数据独占权,并根据修订后的(EC)第726/2004号法规和第2001/83/EC号指令获得额外两年的市场独家经营权。数据排他性防止仿制药和生物相似申请者在申请上市授权时参考参考产品档案中包含的创新者的临床前和临床试验数据,自参考产品首次在欧洲药品管理局获得授权之日起8年内。在额外的两年市场专营期内,可以提交仿制药或生物相似药的上市授权申请,并可以参考创新者的数据,但在市场专营期届满之前,不能销售任何仿制药或生物相似药品。如果在这10年的前8年中,营销授权持有人 获得了对一个或多个新治疗适应症的授权,并且在授权前的科学评估期间,该新的治疗适应症被认为与现有疗法相比能够带来显著的临床益处,则整个10年的期限将延长至最多11年。即使一种化合物被认为是创新的 医药产品,因此创新者获得了规定的数据独占期,如果另一家公司获得了基于MAA的营销授权,该公司可以销售该产品的另一个版本,该MAA具有完全独立的药物 测试、临床前测试和临床试验数据包。
授权期和续期
营销授权 原则上有效期为五年,可在五年后根据EMA或授权成员国的主管当局对风险收益余额进行重新评估而续签。为此,营销授权持有人必须在营销授权失效前至少九个月向EMA或主管当局提供关于质量、安全和疗效的文件的合并版本,包括自授予营销授权以来引入的所有变化。 一旦续签,营销授权的有效期为无限期,除非欧盟委员会或主管当局基于与药物警戒有关的正当理由决定继续进行一次额外的五年续展期。任何授权 未在授权失效后三年内将产品投放到欧洲经济区市场(在集中程序的情况下)或在授权成员国的市场上投放。
74
受管制药物分类
欧盟成员国的立场并不协调。成员国在本国立法中实施了相关的联合国公约(《1961年麻醉品单一公约》和《1971年精神药物公约》),这导致欧盟不同国家对受管制物质的管制方式有所不同。因此,重要的是在国家一级确定一种物质是否受到管制,并遵守适用的法律要求。
营销授权后的监管要求
批准后,上市许可证持有人 必须遵守适用于药品生产、上市、推广 和销售的一系列要求。
其中包括遵守 欧盟严格的药物警戒或安全性报告规则,根据这些规则,可以实施许可后研究和额外的 监测义务。上市许可持有人必须建立并维护药物警戒系统 ,并任命一名具有资质的药物警戒人员,负责监督该系统。主要义务包括 加速报告疑似严重不良反应和提交定期安全性更新报告(PSUR)。
此外,所有新的MAA 必须包括风险管理计划或RMP,描述公司将实施的风险管理系统,并记录 预防或最大限度降低产品相关风险的措施。监管机构也可以规定具体义务 作为上市许可的条件。此类风险最小化措施或许可后义务可能包括额外的 安全性监测、更频繁地提交PSUR或进行额外的临床试验或许可后安全性研究。 RMP和PSUR通常可供请求访问的第三方使用,但需进行有限的编辑。
此外,授权产品的生产 (必须获得单独的生产商许可证)也必须严格遵守 EMA的cGMP要求和欧盟其他监管机构的类似要求,这些要求要求对产品生产、加工和包装中使用的方法、 设施和控制进行强制性规定,以确保其安全性和同一性。
最后,授权产品的营销和 推广,包括行业赞助的继续医学教育和针对产品处方者 的广告,在欧盟受到经修订的第2001/83/EC号指令的严格监管。根据《2021年人用药品条例》,欧盟或英国不允许向公众发布处方药广告。虽然根据欧盟指令2001/83/EC(修订版)制定了药品广告和促销的 一般要求,但 细节受每个欧盟成员国(以及冰岛、挪威和列支敦士登)法规的管辖,并且可能因国家而异 。
英国
英国(UK)已 脱离欧盟,并将宣布其独立的临床研究和上市许可审批流程。由于英国涵盖药品质量、安全性和有效性、临床试验、上市许可、药品商业销售和分销的 监管框架源自欧盟指令和法规,英国脱欧可能会对 未来适用于产品的监管制度以及英国候选药物的批准产生重大影响,因为英国立法现在有可能 与欧盟立法不同。英国脱欧将如何影响英国候选药物和产品的长期监管要求还有待观察。MHRA已经发布了从2021年1月1日起行业和组织应遵循的详细指南, 将随着英国对药品的监管立场的不断发展而更新。如何在英国进行精确的临床研究以及如何组织药物审批,有待于持续的讨论。
集中式上市许可将不再涵盖 英国(根据《北爱尔兰协议》,集中式上市许可将继续 在北爱尔兰得到认可)。所有具有当前集中上市许可的药品将于2021年1月1日自动转换为英国上市许可。从2021年1月1日至2023年12月31日,MHRA可以依赖欧盟委员会 在集中程序中批准新上市许可的决定,以便更快地授予 新的英国上市许可。但仍需单独申请。自2024年1月1日起,将适用新的营销 认可框架。
75
澳大利亚
在澳大利亚,负责制药行业的相关 监管机构是治疗产品管理局(TGA)。与EMA和FDA 一样,监管机构之间也存在协调和协作。TGA要求在开始临床试验之前,通过 电子提交临床试验通知(CTN)来通知所有临床试验。
第三方付款人保险和报销
虽然我们的候选药物 尚未针对任何适应症进行商业化,但如果获批上市,我们候选药物的商业成功将 部分取决于联邦、州和私人层面的第三方付款人的承保和报销情况。
在美国和国际上, 我们未来销售的任何产品的销售额以及我们通过此类销售产生收入的能力,在很大程度上取决于 第三方付款人(如州和联邦政府、管理式医疗服务 提供者和私人保险计划)是否提供足够的保险和报销。
私营保险公司,如健康维护组织和管理式医疗保健提供者,已经实施了成本削减和报销计划,并且很可能在未来继续这样做。这些措施包括建立管理将提供的药物和生物制品的处方,以及成员患者对此类产品的自付义务。我们可能需要进行药物经济学研究,以证明我们的候选药物在处方覆盖和报销方面的成本效益。即使有了这样的研究,我们的候选药物也可能被认为比现有产品安全性更差、效果更差或成本效益更低,并且第三方付款人可能不会为我们的 候选药物提供全部或部分保险和报销。此外,特别是在美国,以及越来越多的其他国家,我们被要求 向州和联邦政府和机构提供折扣和支付回扣,以购买由此类实体报销的候选药物 。美国和其他司法管辖区未来的立法可能会影响我们正在开发的候选药物的报销率,并可能在未来发展,并可能进一步影响支付给联邦和州政府实体的折扣和返点水平 。任何影响这些领域的立法都可能对我们从候选药物销售中获得收入的能力产生重大影响,如果成功开发,我们将把这些药物推向市场。 政治、经济和监管影响正在使美国的医疗保健行业发生根本性变化。 已经有,我们预计将继续有立法和监管建议,以改变医疗体系的方式, 可能会显著影响我们未来的业务。
类似的政治、经济和监管发展正在欧盟发生,可能会影响制药公司将其产品进行盈利商业化的能力。除了价格和成本控制措施的持续压力外,欧盟或成员国一级的立法发展可能会导致重大的额外要求或障碍。在欧盟提供医疗保健,包括医疗服务的建立和运营以及药品的定价和报销,几乎完全是国家法律和政策的问题,而不是欧盟的法律和政策。在这方面,各国政府和保健服务提供者在提供保健以及产品定价和补偿方面有不同的优先事项和办法。然而,总的来说,大多数欧盟成员国的医疗保健预算限制导致相关医疗服务提供商对药品的定价和报销 进行限制。再加上欧盟和国家对那些希望开发和销售产品的公司不断增加的监管负担,这可能会限制或监管审批后的活动,并影响制药公司将其产品商业化的能力。在国际市场上,报销和医疗保健支付系统因国家而异,许多国家/地区 对特定产品和疗法设定了价格上限。未来,可能会继续有更多与美国和国际医疗体系改革有关的提案。未来的立法或监管行动 实施最近或未来的立法可能会对我们的业务产生重大影响。我们能否成功地将产品商业化 在一定程度上取决于我们的候选药物和相关治疗费用在多大程度上可以在美国和全球范围内从政府卫生行政部门、私人健康保险公司和其他组织获得报销。采用某些提案可能会限制我们能够向候选药物收取的价格、候选药物可获得的报销金额 ,并限制候选药物的接受度和可用性。因此,第三方付款人对新批准的保健品的报销状态存在很大的不确定性。
76
通货膨胀和季节性
管理层认为,通胀 没有对我们的运营或财务状况产生实质性影响。管理层进一步认为,由于我们目前缺乏市场上销售的产品,我们的运营目前不受季节性影响。此外,我们候选药物的目标不是季节性疾病。因此,一旦我们有了上市的产品,管理层就不会预计我们的业务会受到季节性的影响。
制造和原材料
我们没有制造能力 ,我们的候选药物的制造和制造流程开发依赖于第三方的经济高效的制造和制造流程。第三方制造商或生产过程中出现的问题可能会推迟或危及我们的候选药物的临床试验和商业化。
| C. | 组织结构 |
以下是我们重要的 子公司的列表,包括我们的所有权百分比、成立日期和管辖权。设立这些子公司是为了让我们能够在欧洲和美国开展商业和临床业务,并扩大我们在澳大利亚的业务。
| 子公司 | 所有权 | 成立日期/收购日期 | 管辖权 | |||||
| IncanneX私人有限公司 | 100 | % | 2018年11月30日 | 澳大利亚维多利亚州 | ||||
| 思琪耐克私人有限公司 | 100 | % | 2020年11月20日 | 澳大利亚维多利亚州 | ||||
| 美国APIRx制药公司 | 100 | % | 2022年8月5日 | 特拉华州 | ||||
| D. | 财产、厂房和设备 |
我们拥有计算机设备、办公家具和实验室设备,这些设备主要放置在我们自己的办公室和实验室。
| 办公地点 | 租约到期 日期 | |||
| 码头大道401号9楼9室,邮编:3008 | 2023年4月 | |||
| 澳大利亚新南威尔士州西北2153号8世纪电路楼105室 | 2026年7月 | |||
| 11542纽约州格伦科夫多索里斯巷221号 | - |
| 项目4a。 | 未解决的员工意见 |
没有。
| 第5项。 | 经营与财务回顾与展望 |
概述
我们是一家处于开发阶段的企业,处于候选药物开发的早期阶段。自成立以来,我们已出现净亏损,随着我们扩大研发活动(“R&D”) 并将我们的候选药物转移到后期开发阶段,预计在未来几年内将出现大量且不断增加的亏损。将我们的候选药物开发进行到较后的 开发阶段的过程可能需要大量额外的研发支出,包括临床前测试和临床 试验,以及获得监管部门的批准。到目前为止,我们主要通过出售股权证券、行使期权的收益、研发活动的税收补助和利息收入来为我们的运营提供资金。
77
我们从澳大利亚政府获得了研发活动的税收优惠。受某些例外情况的限制,澳大利亚政府的税收优惠为符合条件的研发活动提供 福利。这些实体有权(I)对年总营业额低于2000万澳元的符合条件的公司 享受43.5%的可退税抵免,或(Ii)对所有其他符合条件的 公司享受38.5%的不可退税抵税。我们的总营业额不到2000万澳元,并且不受一个或多个免税所得税实体的控制,因此我们 预计有权就年内与符合条件的研发活动相关的成本获得43.5%的可退税抵免。
| A. | 经营业绩 |
经营成果
下表列出了我们在截至2023年6月30日、2022年6月30日和2021年6月30日的年度以澳元计算的经营业绩。
| 截至六月三十日止年度, | ||||||||||||
| 2023 | 2022 | 2021 | ||||||||||
| A$ | A$ | A$ | ||||||||||
| 收入 | - | - | 1,897,596 | |||||||||
| 其他收入 | 1,376,645 | 788,654 | 75,748 | |||||||||
| 产品成本 | - | (6,338 | ) | (911,969 | ) | |||||||
| 行政管理费用 | (568,954 | ) | (280,969 | ) | (99,094 | ) | ||||||
| 广告和投资者关系 | (1,852,416 | ) | (2,746,226 | ) | (4,345,874 | ) | ||||||
| 坏账支出 | - | (134,626 | ) | - | ||||||||
| 研发成本 | (9,364,796 | ) | (5,371,821 | ) | (4,749,514 | ) | ||||||
| 合规、法律和监管 | (2,632,069 | ) | (3,559,511 | ) | (1,227,244 | ) | ||||||
| 基于股份的支付 | (3,191,640 | ) | (1,464,550 | ) | (600,043 | ) | ||||||
| 入住费 | (124,628 | ) | (112,341 | ) | (115,836 | ) | ||||||
| 折旧费用 | (130,946 | ) | - | - | ||||||||
| 工资和员工福利支出 | (3,490,754 | ) | (2,016,181 | ) | (1,296,569 | ) | ||||||
| 本年度净亏损 | (19,979,558 | ) | (14,903,909 | ) | (11,372,799 | ) | ||||||
截至2023年6月30日的财政年度与2022年6月30日的财政年度比较
其他收入
由于澳大利亚政府增加了研发活动的研发退税,其他收入从2022财年的788,654澳元增加到2023财年的1,376,645澳元,增长了75% 。
产品成本
由于停止销售大麻类石油产品,生产成本从2022财年的6,338澳元降至2023财年的零。
78
行政管理费用
管理费用 从2022财年的280,969澳元增加到2023财年的568,954澳元,增加了一倍多,原因是一般办公室和公司费用增加,以及 受外汇波动影响的国际支付费用增加。
广告和投资者关系
广告和投资者关系费用 从2022财年的2,746,226澳元下降到2023财年的1,852,416美元,降幅为33%,原因是支付给我们投资者关系顾问的费用减少了 。
坏账支出
坏账支出从2022财年的134,626澳元降至2023财年的零,原因是该财年没有记录坏账。
研发成本
研发成本 从2022财年的5,371,821澳元增加到2023财年的9,364,796澳元,这是由于与我们的临床试验相关的开发成本增加,特别是与Psi-GAD、IHL-675A和IHL-42X相关的开发成本。
合规、法律和监管
合规、法律和监管费用 从2022财年的3,559,511澳元下降到2023财年的2,632,069澳元,降幅为26%,这是因为我们在纳斯达克上市后支出减少了 。
基于股份的支付
基于股票的支付支出 从2022财年的1,464,550澳元增加到2023财年的3,191,640澳元,翻了一番多,原因是与该财年授予的基于股票的奖励数量增加相关的成本增加了 。
79
入住费
由于我们在悉尼的公司总部、墨尔本办事处和Clarion诊所现场签订了新的租赁协议,入住费从2022财年的112,341澳元增加到2023财年的124,628澳元,增幅为11%。
折旧费用
折旧费用从2022财年的零增加到2023财年的130,946澳元,这主要是由于我们设备的折旧。
工资和员工福利支出
工资和员工福利 支出从2022财年的2,016,181澳元增加到2023财年的3,490,754澳元,增幅为73%,这是因为一般管理部门(从1名员工增加到3名员工)和我们的研发部门(从3名员工增加到5名员工)的员工人数增加,以及我们的首席执行官 官员的工资增加。
本年度净亏损
本年度净亏损从2022财年的14,903,909澳元增加到2023财年的19,979,558澳元,增幅为34%,主要原因是法律和监管费用增加,我们的临床试验开发费用 以及工资和员工福利增加。
截至2022年6月30日的财政年度与2021年6月30日的财政年度比较
收入
收入从2021财年的1,897,596澳元下降到2022财年的零。我们2021财年的所有收入都与大麻类产品的销售有关。为了专注于我们候选药物的开发,我们在2021财年末终止了大麻类产品的分销协议,因此在2022财年没有任何此类销售。
其他收入
其他收入从2021财年的75,748澳元增加到2022财年的788,654澳元,原因是澳大利亚政府在2022财年增加了研发活动的研发退税 。
产品成本
生产成本从2021财年的911,969澳元降至2022财年的6,338澳元,这主要是由于2021财年末停止销售大麻类石油产品。
行政管理费用
管理费用从2021财年的99,094澳元增加到2022财年的280,969澳元,原因是一般办公费用和受外币波动影响的国际支付增加了 。
广告和投资者关系
广告和投资者关系费用 从2021财年的4,345,874澳元降至2022财年的2,746,226澳元,降幅为37%,原因是向我们的 顾问支付的股份减少。
坏账支出
坏账支出从2021财年的零增加到2022财年的134,626澳元,原因是第三方欠我们的金额在2021年12月31日被认为是无法收回的。
研发成本
研发成本 从2021财年的4,749,514澳元增加到2022财年的5,371,821澳元,这是由于与我们的临床试验相关的开发成本增加,特别是与IHL-675A、IHL-42X和IHL-216A相关的开发成本。
80
合规、法律和监管
合规、法律和监管费用 从2021财年的1,227,244澳元增加到2022财年的3,559,511澳元,几乎增加了两倍,这是因为上市导致的费用增加, 遵守纳斯达克上市要求的费用,而进行临床试验所需的监管成本和确保与我们的候选药物相关的知识产权地位的成本保持稳定。
基于股份的支付
基于股票的支付支出 从2021财年的600,043澳元增加到2022财年的1,464,550澳元,翻了一番多,原因是员工和董事的基于股票的奖励数量增加导致相关成本增加。
入住费
租住费用从2021财年的115,836澳元略降至2022财年的112,341澳元,原因是租赁费减少。
工资和员工福利支出
工资和员工福利 支出从2021财年的1,296,569澳元增加到2022财年的2,016,181澳元,增幅为56%,原因是一般行政部门的员工人数增加了 ,我们的首席执行官的工资也增加了。
本年度净亏损
本年度净亏损从2021财年的11,372,799澳元增加到2022财年的14,903,909澳元,增长了31%,主要原因是法律和监管费用增加,我们的临床试验开发费用 以及更高的工资和员工福利。
表外安排
在2023财年、 2022财年和2021财年,我们没有任何未整合的实体,如结构性融资或特殊目的实体,可用于 促进表外安排。
合同义务
不包括应付帐款, 截至2023年6月30日,我们没有任何未反映在资产负债表中的合同义务。办公场所的租赁义务反映在我们的资产负债表中。
或有负债
截至2023年6月30日,我们没有任何重大的或有负债。
资本承诺
截至2023年6月30日,我们没有任何重大的 资本支出承诺。
| B. | 流动性与资本资源 |
自我们成立以来,我们的业务 主要通过发行股权证券筹集资金。额外资金来自 定期存款的现金利息。
截至2023年6月30日,我们的现金为33,363,228澳元。我们预计,我们目前的现金将足以支持本财年,并为我们的运营提供资金,直至2024年10月底。然而,我们对我们的财务资源将在多长时间内足以支持我们的运营的预测是前瞻性陈述,涉及风险和不确定因素,实际结果可能与此大不相同。
81
由于我们专注于研究和开发活动,我们不能随时获得信贷安排,因此不受外部强加的资本 要求的约束。我们在资本风险管理方面的目标是平衡我们目前的营运资本状况与满足研发计划和公司管理费用的要求。
我们预计,我们将需要大量额外资金来实现我们的长期目标,并完成我们当前候选药物的研究和开发。在获得监管部门批准销售我们的候选药物并开始销售之前,我们预计不会产生可观的收入 。因此,我们预计在不久的将来将继续遭受重大损失。
我们未来的资本需求 很难预测,将取决于许多因素,包括:
| ● | 提交、起诉、辩护和执行任何专利权利要求和其他知识产权的费用; |
| ● | 临床前研究和临床试验的范围、结果和时间; |
| ● | 监管审批的成本和时间;以及 |
| ● | 建立销售、营销和分销能力的成本。 |
现金流
截至2023年6月30日的财政年度与2022年6月30日的现金流比较
下表汇总了我们在所示期间的现金流:
| 截至六月三十日止年度, | ||||||||||||
| 2023 | 2022 | 2021 | ||||||||||
| A$ | A$ | A$ | ||||||||||
| 用于经营活动的现金净额 | (15,942,825 | ) | (12,807,373 | ) | (6,909,780 | ) | ||||||
| 投资活动提供的现金净额 | (476,873 | ) | - | 29,277 | ||||||||
| 融资活动提供的现金净额 | 12,275,567 | 41,184,687 | 12,400,730 | |||||||||
经营活动
用于运营活动的净现金从2022财年的12,807,373澳元增加到2023财年的15,942,825澳元,增幅为24.4%,这主要是由于研究和开发活动的扩大。
投资活动
投资活动提供的净现金从2022财年的零增加到2023财年的476,873澳元,这是因为支付了增加房地产、厂房和设备的费用。
融资活动
融资活动提供的净现金减少了70%,从2022财年的41,184,687澳元降至2023财年的12,275,567澳元,原因是期权的行使减少了,与2023财年的2,207澳元相比,2022财年筹集的净现金相当于40,274,243澳元。
截至2022年6月30日的财政年度与2021年6月30日的现金流比较
*经营活动
用于运营活动的净现金从2021财年的6,909,780澳元增加到2022财年的12,807,373澳元,增幅为85%,这主要是由于我们扩大了临床 试验。
投资活动
投资活动提供的净现金从2021财年的29,277澳元减少到2022财年的零,原因是2022财年没有进行任何投资活动。
融资活动
融资活动提供的净现金增加了两倍多,从2021财年的12,400,730澳元增加到2022财年的41,184,687澳元,这是因为行使了期权,在2022财年筹集了相当于40,274,243澳元的净现金。
82
| C. | 研发、专利和许可证 |
有关我们的研究和开发计划及活动的说明,请参阅“第4项。关于公司的信息-B-。业务概述“。
截至2023年6月30日的年度内,我们每项临床试验的支出为:
| ● | PSI-GAD-*1,157,581澳元;*。 |
| ● | IHL-675A-SAARDS败血症相关急性呼吸窘迫综合征--2,028,926澳元; |
| ● | IHL-42X-OSA阻塞性睡眠呼吸暂停--3,481,125澳元; |
| ● | IHL-216A--创伤性脑损伤--472,670澳元; |
| ● | IHL-675A-类风湿性关节炎--703,478澳元; | |
| ● | CannQuitO,ReneCann,CannQuitN-516,256澳元 |
我们预计有权 从澳大利亚政府获得43.5%的可退税抵免,用于支付每个财年与符合条件的研发活动相关的费用。
| D. | 趋势信息 |
我们是一家临床阶段药物开发公司,我们无法准确预测我们的研究或商业化工作的结果 。
我们的主要支出包括 研发成本。研发支出的增加或减少可归因于临床试验活动的水平和这些试验的支出金额。
自我们收购APIRx以来, 我们通过贸易和我们持有的其他应付账款面临外币风险。我们需要以美元 和其他货币进行某些付款。他说:
| E. | 关键会计估计 |
不适用。
83
| 第6项。 | 董事、高级管理人员和员工 |
| A. | 董事和高级管理人员 |
下表列出了我们的董事和高级管理人员以及职位。我们董事会的任何成员和我们的高级管理层之间都没有家族关系。
| 名字 | 职位 | |
| 乔尔·莱瑟姆 | 董事首席执行官兼董事总经理 | |
| 特洛伊·瓦伦丁 | 主席 | |
| 彼得·威多斯 | 董事 | |
| 乔治·阿纳斯塔索夫博士 | 董事 | |
| 罗伯特·克拉克 | 董事 | |
| Lekhram Changoer | 首席技术官 | |
| 马杜卡尔·巴拉 | 首席财务官兼公司秘书 |
乔尔·莱瑟姆。乔尔·莱瑟姆 自2018年7月以来一直担任IncanneX的首席执行官兼董事董事总经理。莱瑟姆先生负责公司的商业运营、战略决策以及对IncanneX所有临床开发资产的监督。在被任命为首席执行官之前,Latham先生自2016年以来一直是我们高级领导团队的关键成员,担任总经理。在此期间,他在多个创收机会和合作伙伴的营销和采购方面发挥了重要作用,包括与太平洋微笑公司(ASX:PSQ)、1300微笑公司(ASX:ONT)、国家橄榄球联盟、澳大利亚足球联盟、One Fighting冠军、 Fit Technologies和Cannvalate的 。在该公司任职期间,莱瑟姆先生在开发和执行IncanneX的药物开发和监管战略方面发挥了关键作用。在2016年加入IncanneX之前,Latham先生在玛氏食品、Tabcorp和菲利普莫里斯国际等大型公司拥有超过14年的管理和商业运营经验。
特洛伊·瓦伦丁。特洛伊·瓦伦丁自2017年12月以来一直担任董事会主席。瓦伦丁先生是一名金融专业人士,拥有超过27年的管理和董事会经验。他于1994年在澳大利亚经纪公司Hartley Poynton(现在的Euroz Hartleys Limited) 开始他的职业生涯,然后于2000年转到百特森证券(现在的Canaccel Genuity),随后成为董事的助理。在帕特森任职期间,他负责管理零售和机构客户。瓦伦丁先生拥有丰富的企业和融资经验,尤其是在初创企业和中小型公司方面。他目前也是澳大利亚精品企业咨询公司Align Capital Pty Ltd.的董事成员,该公司是他于2014年共同创立的。
彼得·威多斯。彼得 自2018年以来一直是董事的一员。他是一名特许会计师,在各种业务职能方面拥有丰富的经验。他在澳大利亚和国际消费品市场拥有丰富的经验,曾在欧洲、美国和亚太地区等多个地区担任过高级管理人员。尤其是,Widdows先生于2008年至2010年担任亨氏公司大洋洲及大中华区首席执行官,于2002年至2008年在亨氏公司担任澳大利亚董事的首席执行官及管理,并于1998年至2000年在辛辛那提担任Starkist Foods Inc.的战略与规划部总经理。自2018年9月以来,Widdows先生一直担任澳大利亚最大的蛋壳鸡蛋和蛋粉生产商Sunny Queen Australia Ltd的董事长,也是澳大利亚综合保险公司友爱保险控股有限公司的非执行董事。
乔治·阿纳斯塔索夫博士。乔治·阿纳斯塔索夫博士自2022年6月以来一直是董事的一员。Anastassov博士在与FDA和EMA的联络和谈判方面积累了丰富的经验,这是因为他多年来向监管机构提交了大量的监管意见书,包括IND会议包和IND申请。阿纳斯塔索夫博士是世界上第一个含有大麻素的口香糖递送系统的开发者之一。在被任命为董事公司之前,阿纳斯塔索夫博士从2017年到2022年一直是APIRx PharmPharmticals LLC的创始管理董事。同时也是医疗和科学咨询团队的关键成员,协助开发组合化合物。在此之前,Anastassov博士曾担任Axim BioTechnologies的首席执行官和联合创始人,该公司在2014至2018年间实现了约12亿美元的历史最高市值。
84
罗伯特·克拉克。罗伯特·克拉克自2022年8月以来一直是董事用户。Clark先生是一位高级战略监管事务专家,拥有超过38年的美国和国际监管经验,包括在辉瑞公司工作超过20年,在诺和诺德公司工作超过10年。他 是FDA和EMA事务、美国药品广告实践以及与医疗保健专业人员和销售队伍活动有关的监管方面的专家,自2012年以来,他为FDA批准了12种重要新药做出了贡献。自2012年5月以来, 克拉克先生一直担任诺和诺德美国监管事务副主管总裁,在新药开发方面,他为一个由50多名监管人员和科学家组成的团队提供战略领导。在被任命为董事之前,克拉克先生从1992年到2021年在辉瑞担任全球监管战略和美国监管事务副总裁,领导一个由多达150名地区监管专业人员组成的团队,为药品开发和审批流程提供支持。
Lekhram Changoer。首席执行官 Changoer先生自2022年6月起担任IncanneX首席技术官。他负责药物治疗临床和商业生产的科学和技术战略的开发和实施。在加入IncanneX之前,Changoer先生是APIRx的董事 。在此之前,Changoer先生在2014至2018年间担任Axim BioTechnologies的首席技术官和联合创始人。
Madhukar Bhala.首席执行官Madhukar 自2021年6月以来一直担任IncanneX的首席财务官兼公司秘书。自2018年7月以来,他一直在澳大利亚证券交易所上市的澳大利亚公司Classic Minerals Limited担任公司 秘书和公司行政主管。2017年11月至2018年7月,巴拉先生担任澳大利亚榜样和领导者组织的公司治理和人力资源经理,并于2016年至2018年担任FairStar Resources Limited的公司秘书。
| B. | 补偿 |
薪酬原则
所有执行董事和非执行董事及高级职员的薪酬由董事会决定。
我们致力于以具有市场竞争力的方式向 高级管理人员和执行董事支付薪酬,并符合包括 股东利益在内的“最佳实践”。薪酬方案基于固定和可变的组成部分,由高管的职位、经验和业绩确定,并可通过现金或股权满足。
非执行董事的酬金从股东批准的总额中支付,并符合行业标准。非执行董事不会获得基于业绩的奖金,参与任何股权发行都需要事先获得股东的批准。如果适用,除法定养老金外,不再支付其他退休福利。
我们的薪酬政策不是直接基于我们的财务业绩,而是基于行业实践,因为我们在生物技术领域运营,我们的主要 重点是研究活动,长期目标是开发研发成果并将其商业化。
我们预计,在我们继续研发阶段的同时,我们在收益方面的表现将继续为负。
绩效奖金的目的是根据我们的目标奖励个人绩效。因此,基于绩效的薪酬支付给个人 如果个人的表现明显有助于成功的结果。这是根据关键绩效指标定期衡量的绩效 。
我们使用各种关键绩效 指标来确定绩效,具体取决于被评估高管的角色。这些措施包括:
| ● | 成功的合同谈判; |
| ● | 在预定时间和/或预算内完成研究项目里程碑;以及 |
| ● | 我们的股价在一段时间内在澳交所达到目标水平。 |
85
高管薪酬
下表列出了在2023财年担任董事和高管的每个人获得、赚取或支付的所有薪酬。
| 短期福利 | 岗位
就业 优势 | 长期的 (基于共享 付款) | 总计 | |||||||||||||||||||||
| 现金
工资 和费用 A$ | 现金
奖金 A$ | 其他
A$ | 超级- 年金 A$ | 性能 权利、股份 和选项 A$ | A$ | |||||||||||||||||||
| 董事 | ||||||||||||||||||||||||
| 乔尔·莱瑟姆 | 820,000 | 426,000 | — | 27,641 | 1,760,325 | 3,033,966 | ||||||||||||||||||
| 特洛伊 瓦伦丁 | 231,157 | — | 254,000 | 24,271 | 867,331 | 1,376,759 | ||||||||||||||||||
| Peter Widdows | 141,385 | — | 160,000 | 14,845 | — | 316,230 | ||||||||||||||||||
| 乔治·阿纳斯塔索夫博士 | 175,866 | — | — | — | — | 175,866 | ||||||||||||||||||
| 罗伯特·克拉克 | 88,588 | — | — | — | 87,500 | 176,088 | ||||||||||||||||||
| 其他 密钥管理人员 | ||||||||||||||||||||||||
| Madhukar(Br)巴拉 | 84,000 | — | — | — | — | 84,000 | ||||||||||||||||||
| Lekhram 昌戈尔 | 157,500 | — | — | — | — | 157,500 | ||||||||||||||||||
1,698,496 | 426,000 | 414,000 | 66,757 | 2,715,156 | 5,320,409 | |||||||||||||||||||
服务协议
截至2023年6月30日,以下关键人员成员的服务协议如下:
| 乔尔·莱瑟姆 | 管理董事和首席执行官 | |
| 协议开始生效: | 2020年7月1日 | |
| 细节 | 这份雇佣协议没有固定期限。每一方当事人 均可提前三个月通知自行终止合同。但是,如果终止是有原因的,则不需要通知。 | |
| 基本工资,包括养老金 | 每年77万澳元,外加养老金,外加每年20,000澳元的车辆津贴。此外,作为董事角色的费用为30,000澳元。 | |
| Lekhram Changoer | 首席技术官 | |
| 协议开始生效: | 2022年8月5日 | |
| 细节 | 本服务协议的有效期为1年,自2022年10月10日起生效。在该日期之后,除非任何一方终止,否则本协议继续有效。Changoer先生可以在21天内通知公司终止合同。双方均可因此原因终止合同。 | |
| 基本工资,包括养老金 | 作为首席技术干事的服务以及在完成里程碑活动时的业绩权利和选择权,每年21万澳元。 | |
| 马杜卡尔·巴拉 | 首席财务官兼公司秘书 | |
| 协议开始生效: | 2021年6月28日 | |
| 细节 | 本服务协议没有固定期限。本服务协议可由任何一方在发出1个月通知后随意终止。 | |
| 基本工资,包括养老金 | 担任首席财务官和公司秘书的服务每年8.4万澳元。 |
员工股票期权计划和绩效权利计划
公司目前没有 任何员工股票期权计划或绩效权利计划。如果董事认为此类计划是必要的,则公司将在使用任何此类计划之前征求股东的批准。
在过去三年中,公司向董事或管理层发放了期权或绩效权利,作为其薪酬的一部分或作为绩效激励的一部分。 2023财年没有向董事和高级管理人员授予绩效权利。所有这些发行都已在发行前获得股东的批准 。
86
普通股持有量
截至2023年6月30日,我们的董事和高级管理人员持有的股份数量如下。
| 开始时的余额 年份 | 接收日期 转换为 性能 上的权利 取得的成就 里程碑 | 已收到 在此期间 一年过去了 演练 选项 | 其他 变化 在.期间 年份 | 余额为 末尾 年份 | ||||||||||||||||
| 普通股 | ||||||||||||||||||||
| 乔尔·莱瑟姆 | 23,748,413 | — | — | — | 23,748,413 | |||||||||||||||
| 特洛伊·瓦伦丁 | 36,651,198 | — | — | — | 36,651,198 | |||||||||||||||
| 彼得·威多斯 | 16,573,685 | — | — | — | 16,573,685 | |||||||||||||||
| 乔治·阿纳斯塔索夫博士 | — | — | — | 66,972,077 | 66,972,077 | |||||||||||||||
| 罗伯特·克拉克(1) | — | — | — | — | — | |||||||||||||||
| Lekhram Changoer(2) | — | — | — | 63,954,841 | 63,954,841 | |||||||||||||||
| 马杜卡尔·巴拉 | — | — | — | — | — | |||||||||||||||
| 普通股合计 | 76,973,296 | — | — | 130,926,918 | 207,900,214 | |||||||||||||||
| (1) | 罗伯特·克拉克于2022年8月17日被任命。 |
| (2) | 普通股由昌戈尔先生控制的Prash BV公司持有。 |
期权持有量
截至2023年6月30日,我们董事和高级管理人员持有的期权数量如下。每个期权授予在IncanneX中获得一股全额支付的普通股的权利。
| 开始时的余额为
年 | 行权价格 过期日期 | 变化 在 年 | 余额为 年 | |||||||||||||||
| 选项 | ||||||||||||||||||
| 乔尔·莱瑟姆 | 750,000 | 0.05 | 2025年6月30日 | 750,000 | ||||||||||||||
| 乔尔·莱瑟姆 | 750,000 | 0.05 | 2026年6月30日 | 750,000 | ||||||||||||||
| 乔尔·莱瑟姆 | 750,000 | 0.05 | 2027年6月30日 | 750,000 | ||||||||||||||
| 乔尔·莱瑟姆 | 750,000 | 0.05 | 2025年6月30日 | 750,000 | ||||||||||||||
| 乔尔·莱瑟姆 | 750,000 | 0.05 | 2026年6月30日 | 750,000 | ||||||||||||||
| 乔尔·莱瑟姆 | 750,000 | 0.05 | 2027年6月30日 | 750,000 | ||||||||||||||
| 乔尔·莱瑟姆 | 933,333 | 0.26 | 2025年7月1日 | 933,333 | ||||||||||||||
| 乔尔·莱瑟姆 | 933,333 | 0.31 | 2026年7月1日 | 933,333 | ||||||||||||||
| 乔尔·莱瑟姆 | 933,334 | 0.35 | 2027年7月1日 | 933,334 | ||||||||||||||
| 乔尔·莱瑟姆 | 933,333 | 0.26 | 2026年7月1日 | 933,333 | ||||||||||||||
| 乔尔·莱瑟姆 | 933,333 | 0.31 | 2027年7月1日 | 933,333 | ||||||||||||||
| 乔尔·莱瑟姆 | 933,334 | 0.35 | 2028年7月1日 | 933,334 | ||||||||||||||
| 乔尔·莱瑟姆 | 0.25 | 2026年6月30日 | 661,285 | 661,285 | ||||||||||||||
| 乔尔·莱瑟姆 | 0.25 | 2026年6月30日 | 921,942 | 921,942 | ||||||||||||||
| 彼得·威多斯 | 0.25 | 2026年6月30日 | 1,104,913 | 1,104,913 | ||||||||||||||
| 特洛伊·瓦伦丁 | 0.25 | 2026年6月30日 | 2,443,413 | 2,443,413 | ||||||||||||||
| 特洛伊·瓦伦丁 | 466,666 | 0.26 | 2025年7月1日 | 466,666 | ||||||||||||||
| 特洛伊·瓦伦丁 | 466,666 | 0.31 | 2026年7月1日 | 466,666 | ||||||||||||||
| 特洛伊·瓦伦丁 | 466,668 | 0.35 | 2027年7月1日 | 466,668 | ||||||||||||||
| 特洛伊·瓦伦丁 | 466,666 | 0.26 | 2026年7月1日 | 466,666 | ||||||||||||||
| 特洛伊·瓦伦丁 | 466,666 | 0.31 | 2027年7月1日 | 466,666 | ||||||||||||||
| 特洛伊·瓦伦丁 | 466,668 | 0.35 | 2028年7月1日 | 466,668 | ||||||||||||||
| 罗伯特·克拉克 | - | 1.00 | 2024年5月31日 | 2,500,000 | 2,500,000 | |||||||||||||
| 罗伯特·克拉克 | - | 1.50 | 2024年5月31日 | 2,500,000 | 2,500,000 | |||||||||||||
| 选项总数 | 12,900,000 | 10,131,553 | 23,031,553 | |||||||||||||||
表演权
截至2023年6月30日,没有未偿还的演出权利 。每项表演权授予获得一股本公司缴足股款普通股的权利。
87
| C. | 董事会惯例 |
引言
我们的董事会由我们的股东选举产生并对其负责。它目前由五名董事组成,其中包括四名非执行董事,其中一名是我们董事会的非执行主席。我们的董事会主席负责董事会的管理和职能。
选举董事
董事在我们的年度股东大会上选举产生。根据我国宪法,董事非执行董事不得任职超过三年或在其被任命后的第三次年度股东大会(以较长的期间为准)之后,在没有 参加连任的情况下任职。本公司董事会有权委任任何人士为董事,以填补空缺 或作为额外的董事(只要董事总数不超过法律所允许的最高限额),而如此委任的任何董事 只能任职至其有资格当选的下一届股东周年大会(“股东周年大会”)。
各董事在2023年6月30日的任命和任期 如下:
| 名字 | 职位 | 首次任命的年份 | 当前 期限到期 | |||
| 乔尔·莱瑟姆 | 董事总裁兼首席执行官 | 2018 | —(1) | |||
| 特洛伊·瓦伦丁 | 主席 | 2017 | 2025(2) | |||
| 彼得·威多斯 | 董事 | 2018 | 2023(2) | |||
| 乔治·阿纳斯塔索夫博士(3) | 董事 | 2022 | 2025 | |||
| 罗伯特·克拉克(4) | 董事 | 2022 | 2026 |
| (1) | 根据我国宪法,董事经理的任期不受任期届满的限制。 |
| (2) | 任期于该年度的年度股东周年大会日期 届满。 |
公司治理
澳大利亚证券交易所公司治理原则
在澳大利亚,在澳大利亚证券交易所上市的公司没有必须遵守的明确的公司治理结构和做法,除了一定规模的实体必须有审计和薪酬委员会,在某些情况下,还要求关键管理人员的交易政策。 相反,澳大利亚证券交易所公司治理理事会发布了公司治理原则和建议(“建议”), 阐明了八项核心原则,旨在为公司的公司治理结构和做法提供参考。根据澳交所上市规则第4.10.3条,各公司须附上一份本公司的企业管治声明(已获董事会批准),并在其向股东提交的年报中提供一份声明,披露他们在报告期内已在多大程度上遵守该等建议,以及如没有遵守所有建议,则须确定 未获采纳的建议、未予遵守的原因及该公司在报告期内采用的替代管治措施 。并不是强制要遵循这些建议。由于遵守 建议会给我们带来过高的成本,而且考虑到我们目前的规模,我们不遵循建议,因为这样做的成本将超过收益。
非执行董事及独立董事
澳大利亚法律不要求公司任命一定数量的独立董事进入董事会或审计委员会。然而,根据公司治理原则和建议,澳大利亚证券交易所建议但不要求在澳大利亚证券交易所上市的公司在董事会中拥有多数独立董事。我们的董事会已经决定,根据澳大利亚证券交易所的要求,特洛伊·瓦伦丁、罗伯特·克拉克和彼得·威多斯 都有资格成为独立的董事。
88
我们的董事会没有定期安排只有独立董事出席的会议。董事会确实定期召开会议,预计独立董事将出席所有此类会议。
董事会各委员会
审计委员会成员。纳斯达克 市场规则要求我们建立一个至少由三名成员组成的审计委员会,每名成员都懂财务 ,符合美国证券交易委员会和纳斯达克各自的“独立性”要求,其中一人具有公司高层的会计或相关财务管理专业知识。
我们的审计委员会协助我们的董事会监督我们公司的会计和财务报告流程以及对我们财务报表的审计,包括我们财务报表的完整性、法律和法规要求的合规性、我们独立公共会计师的资格和独立性、独立公共会计师以及董事会可能指示的其他职责。 审计委员会还需要评估风险管理。
我们的审计委员会目前 由两名董事会成员Peter Widdows和Robert Clark组成。于2023年2月,吾等要求豁免遵守纳斯达克上市规则第5605(C)(2) 条有关须有三名独立董事为审核委员会成员的规定,原因是公司管治与本公司根据2001年澳洲公司法及澳大利亚证券交易所上市规则提出的其他要求不同 。从2023年4月至2023年9月,Peter Widdows为公司提供顾问服务,他的报酬为160,000澳元(104,000美元)。自2023年9月底起,Peter Widdow停止提供咨询服务。彼得·威多斯和罗伯特·克拉克目前均符合美国证券交易委员会和纳斯达克的相关规则下的“独立性”要求。
纳斯达克上市规则下的公司治理要求。
只要我们披露纳斯达克规则5600中我们不遵循的每一项要求,并描述我们 代替相关纳斯达克公司治理标准所遵循的母国实践,IncanneX就被允许遵循 澳大利亚“母国”公司治理实践,以替代其他适用的纳斯达克公司治理标准。我们遵循澳大利亚的公司治理实践,而不是 纳斯达克商城规则在以下方面的公司治理要求:
| ● | 纳斯达克根据规则5605(C)(2)(A)的要求 审计委员会至少由三名成员组成,并且每名成员必须是该规则所规定的“独立”的 。2023年2月,我们要求免除三名独立董事作为审计委员会成员的要求 ,因为我们过去是,现在仍然是一家专注于临床产品开发的小型生物技术公司,我们 不产生任何收入。在提交本文件之日,我们已有并预计将继续有一个审计委员会,该委员会由两名非执行董事组成,他们按照第5605(C)(2)(A)条的要求是“独立的”。 | |
| ● | 纳斯达克根据规则5605(D)成立薪酬委员会的要求-澳交所上市规则没有明确要求在澳交所上市的每一家 发行人都要成立薪酬委员会。我们依赖豁免根据纳斯达克上市规则成立薪酬委员会的要求,我们寻求申请这种豁免。 |
| ● | 纳斯达克根据规则5605(E)成立提名委员会的要求-澳交所上市规则没有明确要求在澳交所上市的每一家 发行人都必须成立提名委员会。我们依赖于豁免根据纳斯达克上市规则成立提名委员会的要求,我们寻求申请这种豁免。 |
| ● | 纳斯达克规则第5620(C)条要求法定人数由持有已发行普通股的331/3%的股东组成-澳交所上市规则并未明确要求在澳交所上市的每一家发行人必须达到任何特定数量的已发行普通股的法定人数,而是允许上市发行人建立自己的法定人数要求。我们的法定人数是有资格 投票的两人。我们相信这一法定人数要求与澳大利亚证券交易所的要求是一致的,并且是澳大利亚普遍接受的商业惯例的适当和典型。 |
| ● | 纳斯达克规则5605(B)(1)和(2)中关于董事独立性的要求,包括董事会的多数成员必须由独立董事组成,以及独立董事必须定期安排只有独立董事出席的会议-纳斯达克和澳交所对什么是独立董事的定义不相同,并且关于独立董事的角色和义务的 要求也不相同。与纳斯达克不同,澳交所允许发行人设立自己的重要性门槛,以确定董事与发行人之间的交易是否影响董事的独立地位,而且只要发行人公开披露这一事实,澳交所就不要求发行人董事会的多数成员是独立的。此外,澳大利亚证券交易所并不要求独立董事定期召开只有独立董事出席的会议。我们相信,我们的董事会组成符合澳大利亚证券交易所的要求 ,这是澳大利亚普遍接受的商业惯例的适当和典型。 |
89
| ● | 根据纳斯达克上市规则,我们的 独立董事必须定期在高管会议上开会。澳大利亚证券交易所上市规则和公司法并不要求澳大利亚公司的独立董事举行此类执行会议,我们要求豁免 纳斯达克规则。 |
| ● | 纳斯达克规则5605(D)项下的 要求发行人高管的薪酬必须由过半数独立董事或完全由独立董事组成的薪酬委员会确定或建议董事会确定,以及董事的被提名人必须由独立董事 过半数董事或完全由独立董事组成的提名委员会选出或推荐董事会遴选。纳斯达克薪酬委员会的要求与澳交所薪酬和提名委员会的要求不完全相同。根据适用的上市标准,建议在澳交所上市的发行人成立一个由多数独立董事和一名独立主席组成的薪酬委员会,或公开披露尚未这样做。我们没有薪酬委员会,因此申请豁免纳斯达克规则 。 |
| ● | 纳斯达克上市规则规定,在与某些收购、证券私募或设立或修订某些购股权、购买或其他补偿计划有关的证券发行之前,发行人必须获得股东批准的要求。 适用的澳大利亚法律和澳大利亚证券交易所上市规则与纳斯达克的要求不同,澳大利亚证券交易所上市规则一般规定,在许多情况下,必须事先获得股东批准。包括(I)于任何12个月期间发行超过本公司已发行股本15%(或在某些情况下超过25%)的股本证券(但在厘定15%上限时,根据规则例外或经股东批准发行的证券不计算在内),(Ii)向关联方发行股本证券(定义见澳交所上市规则)及(Iii)根据员工激励计划向董事或其联系人发行证券 。我们要求免除这一纳斯达克规则 |
纳斯达克规则下的董事会多元化矩阵
作为一家在澳交所上市的澳大利亚公司,我们在提交给澳交所的文件中披露了 我们是否遵循了澳交所公司治理委员会原则和建议(“建议”)的建议。 根据澳交所上市规则,这些建议不是强制性的。
鉴于我们公司的规模和我们的董事会,我们不遵循某些建议,包括关于董事会多样性的建议。我们尊重董事的隐私,并担心侵犯董事隐私的行为可能违反澳大利亚隐私法,特别是根据《1988年隐私法》(Cth)颁布的隐私原则6(使用或披露个人信息)和原则8(跨境披露个人信息)。
作为一家在纳斯达克上市的非美国公司,适用的上市规则 要求我们以规定的格式披露有关我们董事多样性的某些信息。下面的矩阵 在适用法律允许的范围内披露了纳斯达克上市规则第5606条所要求的信息。
截至2022年12月31日和2023年6月30日的董事会多样性矩阵
| 主要执行机构所在国家/地区 | 澳大利亚 | ||
| 外国私人发行商 | 是 | ||
| 母国法律禁止披露 | 是 | ||
| 董事总数 | 5 | ||
| 女性 | 男性 | ||
| 第一部分:性别认同 | |||
| 董事 | 0 | 5 | |
| 第二部分:人口统计背景 | |||
| 没有透露人口统计背景 | 5 |
董事及高级人员的弥偿
我们的宪法规定,我们可以在法律允许的最大范围内,赔偿现在或曾经是董事的人或我们公司的高级管理人员离开我们的财产,使其在辩护诉讼中作为董事或高级管理人员承担的任何责任,无论其结果如何。
此外,我们的宪法 规定,在法律允许的范围内,我们可以就一份合同支付或同意支付保费,该合同为 或曾经是董事的人或我们公司或我们的子公司的高管提供任何责任的保险:
| ● | 该人 以董事或我公司或其子公司高管的身份招致的费用,以及 |
| ● | 对于该人在辩护与该人以董事或IncanneX官员的身份行事有关的诉讼时所产生的费用和开支,无论是民事还是刑事诉讼,无论其结果如何。 |
我们有董事责任保险单和高级职员责任保险单。我们已经制定了一项政策,以赔偿我们的董事和高级管理人员作为董事或高级管理人员所产生的某些责任,包括成功为法律诉讼辩护所产生的费用和费用。
90
| D. | 员工 |
截至2023年6月30日,我们有10名员工。在这些员工中,6人受雇于研发部门,4人受雇于一般管理和行政部门。截至2023财年末,我们有10名员工。
我们的每位全职员工 都签订了一份无限制期限的协议。我们只能根据相关员工的雇佣合同 终止任何员工的雇佣。
我们的标准全职员工雇佣合同规定,我们可以在没有通知的情况下终止雇用严重不当行为的员工 ,或者在没有原因的情况下提前一到六个月通知(根据相关员工的雇佣合同中的规定)。
| E. | 股份所有权 |
有关涉及公司资本中的员工的安排的说明,包括涉及发行或授予公司的期权或股票或证券的任何安排,请参阅“第6项.董事、高级管理人员和员工-B.薪酬--员工 股票期权计划”和“绩效权利计划”。
高级管理人员和董事的所有权
下表列出了截至2023年9月30日我们每位董事和高级管理层以及全体董事和高级管理层对我们普通股的所有权的某些信息。显示的百分比基于截至2023年9月30日已发行和已发行的1,587,010,366股普通股。
| 名字 | 普通数量
个共享 拥有 | 百分比: 所有权 | ||||||
| 乔尔·莱瑟姆 | 23,748,413 | 1.50 | % | |||||
| 特洛伊·瓦伦丁(1) | 36,651,198 | 2.31 | % | |||||
| 彼得·威多斯 | 16,573,685 | 1.04 | % | |||||
| 乔治·阿纳斯塔索夫博士(2) | 66,972,077 | 4.22 | % | |||||
| 罗伯特·克拉克(3) | 5,000,000 | * | ||||||
| Lekhram Changoer(4) | 63,954,841 | 4.03 | % | |||||
| 马杜卡尔·巴拉 | — | — | ||||||
| 全体董事和执行干事(7人) | 288,203,307 | 18.17 | % | |||||
| * | 低于1% |
| (1) | 特洛伊·瓦伦丁是董事的一员,拥有Align Capital Pty Ltd.50%的股权,Align Capital Pty Ltd.拥有IncanneX 13,194,248股普通股。特洛伊·瓦伦丁是Tranaj Nominees Pty Ltd.的董事账户,该公司拥有IncanneX 10,216,950股普通股。特洛伊·瓦伦丁是Valplan Pty Ltd.的董事,后者拥有IncanneX 300万股普通股。特洛伊·瓦伦丁是董事的一员,也是Cityside Pty Ltd.的唯一股东,后者拥有IncanneX 4440,000股普通股。特洛伊·瓦伦丁是由Ekirtson作为受托人管理的GFCR投资信托基金的受益人,该信托基金拥有IncanneX 2,875,000股普通股。因此,特洛伊·瓦伦丁被视为实益拥有IncanneX的33,726,198股普通股。 |
| (2) | 乔治·阿纳斯塔索夫博士于2022年6月28日被任命。 |
| (3) | 罗伯特·克拉克于2022年8月17日被任命。于2023年9月30日,克拉克先生实益拥有5,000,000股普通股 可于2023年9月30日起60天内行使的期权。 |
| (4) | Lekhram Changoer被任命为 2022年10月10日普通股由Prash BV记录持有,该公司由Changoer先生控制。 |
行为规范
我们已采纳适用于所有董事、高级职员及雇员的 行为守则。我们的行为准则可在我们的网站上查阅, www.incannex.com.au. 我们在我们的网站上发布法律或纳斯达克上市标准要求的所有披露,这些披露涉及对《行为准则》任何条款的任何修订或豁免。对我们网站地址的提述并不构成以提述方式纳入我们网站所载或可透过我们网站获得的 资料,阁下亦不应将其视为本年报的一部分。
| F. | 披露注册人的 追回错误裁定赔偿的诉讼 |
截至2023年6月30日止财政年度或截至本年度 报告日期,我们没有任何需要收回错误赔偿的财务报表 重述。
91
| 第7项。 | 大股东和关联方交易 |
| A. | 大股东 |
下表呈列 根据于二零二三年九月三十日已发行的1,582,277,020股普通股,由我们所知为我们普通股5%以上实益拥有人的每名人士 对我们普通股的实益拥有权。
我们已根据美国证券交易委员会的规则和法规确定了受益所有权,该信息不一定表明受益所有权 用于任何其他目的。除以下脚注所述外,我们认为,根据我们获得的信息,下表中列出的个人和实体 对其实益拥有的所有股份拥有唯一投票权和唯一投资权。
在计算个人或实体实益拥有的 股数量以及该个人或实体的所有权百分比时,我们将该个人或实体目前可行使或在2023年9月30日 日起60天内可行使的所有 股视为尚未行使的受期权和认股权证约束的股票。然而,我们并不认为这些股票是为了计算任何其他人或实体的所有权百分比。
| 实益拥有的普通股 | ||||||||
| 股东 | 数 | 百分比 | ||||||
| HSBC托管代理人(澳大利亚)有限公司 | 82,707,741 | 5.23 | % | |||||
HSBC Custody Nominees(Australia)Limited于2023财年成为主要股东。汇丰作为代理人持有普通股,其所有权可以根据其持有股份的受益持有人的交易活动 增加或减少。汇丰的实益持有人均未持有至少5%的普通股。
Sud Agarwal在2023财年不再是 大股东。于二零二二年六月三十日,Sud Agarwal直接拥有75,303,093股普通股及透过Cannvalate Pty Ltd(“Cannvalate”)实益拥有32,000,000股普通股。从2022年8月23日到2023年9月20日,Sud Agarwal逐步出售了直接拥有的全部普通股。
截至2023年9月30日,我们的普通股共有12,340名登记持有人,其中4人的注册地址在美国。截至2023年9月30日,已发行的美国存托凭证共有1,024,005股,相当于25,600,125股普通股(或当时已发行普通股的1.62%)。截至2023年9月30日,没有注册的美国存托凭证持有人。这些数字并不代表本公司股份的实益持有人人数,亦不代表该等实益持有人的居住地,因为许多该等普通股是由经纪商或其他代名人登记持有的。
据我们所知,我们并非由另一家公司、任何外国政府或任何其他自然人或法人分别或共同直接或间接控制。目前尚无我们所知的协议,这些协议的实施可能会导致IncanneX的控制权发生变化。 所有股东都拥有相同的投票权。
| B. | 关联方交易 |
以下是自2020年7月1日以来我们的关联方交易的描述 ,我们注意到所有这些交易都是在保持一定距离的情况下进行谈判的。
在2023财年,向Cannvalate支付了247,122澳元的费用,Sud Agarwal博士(2022年6月28日辞职) 是Cannvalate的一个实体。与Cannvalate进行的患者研究活动有关的费用应在2022财年应计和支付。
在2023财年和2022财年,特洛伊·瓦伦丁分别获得了254,000澳元和240,000澳元的咨询费,这还不包括他的董事费用。Peter Widdow在2023财年还获得了16万澳元的咨询费,这还不包括他的董事费用。
在2022财年和2021财年,公司分别向Align Capital Pty Ltd(“Align”)支付了407,824澳元和97,976澳元的费用,Align Capital Pty Ltd(“Align”)是由我们的董事长特洛伊·瓦伦丁控制的实体,作为执行我们在澳交所上市的 期权计划的牵头经理所提供的服务的对价。
| C. | 专家和律师的利益 |
不适用。
92
| 第8项。 | 财务信息 |
| A. | 合并报表 及其他财务信息 |
我们截至2023年6月30日、2023年6月30日和2022年6月的财政年度的经审计的合并财务报表包括在本年度报告20-F表的第18项中,紧跟在本年度报告20-F表的正文之后。
PKF布里斯班审计(“PKF”)截至2023年6月30日及截至2022年6月30日的年度的审计报告包括在紧接财务报表之前的 。WithumSmith+Brown,PC(“Withum”)截至2021年6月30日和截至2021年6月30日的年度的审计报告包括在紧接财务报表之前。
法律诉讼
我们不参与任何可能对我们的财务状况或盈利能力产生重大不利影响的法律或仲裁程序。我们没有参与任何政府诉讼程序。
股利分配政策
我们从未向股东支付现金股息 。我们打算保留未来的收益用于我们的业务,在可预见的未来不会对我们的普通股 支付现金股息。未来的任何股息政策将由董事会决定,并将基于各种 因素,包括我们的经营业绩、财务状况、当前和预期的现金需求、未来前景、合同限制和董事会可能认为相关的其他因素。不能保证红利永远都会派发。见 “关于前瞻性陈述的特别说明”。
| B. | 重大变化 |
自年度财务报表日期 起未发生重大变化。
| 第9项。 | 报价和挂牌 |
| A. | 优惠和上市详情 |
自2016年11月以来,我们的普通股在澳大利亚证券交易所交易,代码为“IHL”。
自2022年2月起,我们的美国存托股份在纳斯达克股票市场 LLC交易,代码为“IXHL”。
有关我们ADS的 权利的描述,请参见“第12项。股本证券以外的证券说明-D。美国存托股份”。
| B. | 配送计划 |
不适用。
| C. | 市场 |
我们的普通股在 澳大利亚证券交易所上市交易,股票代码为“IHL”。
我们已在纳斯达克股票市场有限责任公司以“IXHL”代码上市了以ADS表示的普通 股,每股ADS代表25股普通股。 德意志银行美洲信托公司担任托管人。
| D. | 出售股东 |
不适用。
| E. | 稀释 |
不适用。
| F. | 发行债券的开支 |
不适用。
93
| 第10项。 | 附加信息 |
| A. | 股本 |
不适用。
| B. | 公司章程大纲和章程细则 |
一般信息
我们的宪法是一部宪法。《章程》受ASX有限公司上市规则和2001年《公司法》条款的约束。章程 可以修改或废除,并由股东特别决议取代,该决议已发出通知,并且 已获得有权对该决议投票的股东所投的至少75%的选票通过。
目的和目的
作为一家上市公司,我们拥有 自然人的所有权利、权力和特权。我们的宪法没有规定或规定任何具体的目标或 目的。
董事的权力
根据我们的 章程的规定,我们的董事可以行使我们公司的所有权力,但《公司法》或章程 赋予Incannex的任何权力除外。
感兴趣的董事
根据我们的章程, 如果董事根据《公司法》披露其信息,则该董事可以(i)以任何身份与 公司或公司的相关法人团体或公司拥有权益的法人团体就任何事项订立合同或作出安排,(ii)计入考虑合同或安排的董事会议的法定人数,(iii)就本公司是否 订立该合约或安排,以及就与该合约或安排有关的任何事宜进行表决,(iv)代表本公司签署任何与该合约或安排有关的文件,或 见证加盖本公司的法团印章,(v)保留该合约或安排项下的利益。
除非相关例外 适用,否则《公司法》要求我们的董事披露某些利益或利益冲突,并禁止 董事就其拥有重大个人利益的事项进行投票,以及在审议该事项时出席会议 。此外,《公司法》和《澳大利亚证券交易所上市规则》要求向我们的董事提供任何关联 方利益均需获得股东批准。
董事薪酬
我们的非执行董事 就其作为董事的服务获得薪酬,薪酬由股东大会决定。董事的固定报酬总额 将按照董事们自己同意的比例并按照我们的章程在董事之间分配。我们的执行董事就其作为董事提供的服务获得报酬,该报酬由 全体董事决定。
支付给我们的非执行 董事的费用必须是固定金额,而不是利润或营业收入的佣金或百分比。支付给我们执行董事的薪酬 也不得包括佣金或营业收入的百分比。
根据我们的章程, 任何执行董事会认为超出董事正常职责范围的服务的董事 可以获得额外报酬,这由我们的董事会决定。
除本公司章程规定的其他薪酬外,本公司所有董事均有权获得本公司支付的合理差旅费以及董事出席股东大会、董事会会议、委员会会议或与本公司业务相关的其他费用。
94
此外,根据我国宪法,董事可获得由我们董事会决定的退休福利,但须遵守《公司法》和《澳大利亚证券交易所上市规则》中规定的限制,这些限制广泛限制了我们向 本公司或我们的子公司的控制权发生变化,并规定须获得股东批准的要求 给我们的官员支付退休金
董事可行使的借款权力
根据我们的章程, 管理和控制我们的商业事务属于我们的董事会。因此,我们的董事会有权 筹集或借入资金,并抵押我们的任何财产或业务或任何未催缴资本,并可以发行债券或为我们或任何其他人的任何债务、负债或义务提供任何其他 担保,在每种情况下,以其认为合适的方式和条款。
董事的退休
根据我们的章程 及澳交所上市规则,每名董事(董事总经理除外)的任期不得超过三年或超过其获委任后的第三届股东周年大会(以较长时间为准)。此外,在每届股东周年大会上,至少须有一名董事轮值退任(董事为自上次当选以来任职时间最长的董事)。 轮值退任的董事有资格连任董事会成员,除非根据公司法或我们的宪法被取消担任董事的资格 。
附在我们普通股上的权利
授权股本的概念在澳大利亚已不复存在,因此,我们的授权股本是无限的。我们所有已发行的普通股 均为有效发行、缴足股款且不可评估。我们普通股附带的权利如下:
股息权。
董事可以根据股东的持股比例宣布向股东支付股息,并可以确定股息的数额、支付时间和支付方式。除根据不时修订的公司法规定外,不派发任何股息,且不会向本公司派息。
投票权。
普通股持有人 在提交股东表决的所有事项上,每持有一股普通股有一票投票权。此类投票权可能会受到以下情况的影响: 向未来可能获得授权的具有优先权利的某类股份的持有人授予任何特别投票权。
股东大会所需的法定人数为至少两名股东亲自出席,或由根据我们的章程指定的受委代表、代理人或代表出席。因法定人数不足而延期的会议一般会延期至下一周的同一天,在同一时间和地点举行。在重新召开的会议上,所需的法定人数包括任何两名成员亲自出席,或由代表、代理人或根据我国宪法任命的代表出席。如果在指定的会议时间后30分钟内未达到法定人数,会议即告解散。
普通决议案,如宣布股息的决议案,需要获得出席会议的多数投票权持有人的批准,可亲自、委托代表或以书面投票方式进行表决。根据我们的宪法、公司法和澳大利亚证券交易所上市规则,某些事项必须以特别决议的方式通过。特别决议案必须由有权就决议案投票并亲自出席会议的股东以至少75%的票数 通过。不需要通过特别决议的事项 需要通过普通决议。
95
我们利润中的权利。
我们的股东有权分享我们作为股息分配的利润和任何其他允许的分配。
清算时的权利。
如果发生我们的清算, 在清偿对债权人的债务后,我们的资产将按清算开始时的已缴资本或他们持有的股份应缴足的资本的比例分配给普通股持有人。这项 权利可能受授予享有优先 权利的某类股份持有人优先派息或分派权利的影响,例如优先于任何其他类别股份以现金支付当时已缴股款的清盘权利,以及有关该股份的任何股息欠款。
董事可发出通知
我们的章程规定,在股份发行条款的规限下,董事可要求股东支付其持有的股份中未支付的款项,但根据配股条件在固定时间应支付的款项除外。
更改股份所附权利
根据我们的章程,任何类别股份所附带的权利,除非该类别的条款另有规定,否则可经持有该类别已发行股份不少于75%的持有人的书面同意,或经该类别股份的另一次股东大会通过的特别决议案的批准而更改。
年会及特别会议
我们的董事必须每年至少召开一次年度股东大会。必须在会议日期前至少28天发出通知。 任何董事或股东均可根据《公司法》召开股东大会。
论我国公司证券所有权的限制
除对个人可持有本公司股份百分比的某些限制 外,我国宪法和澳大利亚联邦法律均不以任何方式限制本公司股份的所有权或投票权。
我们的首都的变化
根据上市规则,本公司董事可酌情决定向本公司非关联方人士发行证券,而无须 股东批准,前提是该项发行与本公司于过去12个月期间发行的证券合计不超过本公司于12个月期间开始时已发行资本的15%。其他证券配售需要股东的普通决议批准
| C. | 材料合同 |
IncanneX与APIRx制药美国有限责任公司卖方之间的股份买卖协议
2022年5月,我们签订了股份买卖协议,收购了APIRx的100%股权。作为对价,我们以每股0.225澳元的价格向APIRx的卖家发行了218,169,506股IncanneX普通股 。根据协议条款,我们收购了APIRx的所有资产和知识产权 。我们于2022年8月完成了收购。
96
与Alfred Health签订的临床试验研究协议,日期为2021年6月22日
2021年6月22日,我们与Alfred Health签订了临床试验研究协议。根据协议条款,Alfred Health将对治疗阻塞性睡眠呼吸暂停综合征的屈诺比诺和乙酰唑胺的联合检查进行和管理 开放标签扩展。开放标签扩展 将在最多12名研究参与者中进行。IncanneX将提供进行这项研究所需的所有信息, 将向Alfred Health支付市场标准费用,作为其角色的代价。本协议可由任何一方以协议中规定的原因终止,也可由IncanneX在终止日期前30天向Alfred Health发出书面通知后随意终止。
与Alfred Health签订的临床试验研究协议,日期为2020年9月24日
2020年9月24日,我们 与Alfred Health签订了临床试验研究协议。根据协议条款,Alfred Health将进行并管理一项剂量发现交叉试验,调查屈诺比诺联合乙酰唑胺对成人阻塞性睡眠呼吸暂停综合征患者呼吸暂停的影响。剂量发现交叉试验将在最多12名试验参与者中进行。IncanneX将提供进行这项研究所需的所有信息,并将向Alfred Health支付市场标准费用,作为其角色的代价。本协议可由任何一方基于协议中规定的原因终止,也可由IncanneX在终止日期前30天向Alfred Health发出书面通知后随意终止。
与西澳大利亚大学达成临床试验研究协议
2021年4月6日,我们与西澳大利亚大学签订了临床试验研究协议。根据协议条款,西澳大利亚大学将进行和管理一项剂量发现交叉试验,调查屈诺比诺与乙酰唑胺联合治疗对成人阻塞性睡眠呼吸暂停综合征患者呼吸暂停低密度脂蛋白的影响。剂量发现交叉试验将在最多12名试验参与者中进行。IncanneX将提供进行研究所需的所有信息,并将向西澳大利亚大学支付市场标准费用,作为其角色的考虑 。本协议可由任何一方以协议中规定的理由终止,并由IncanneX在终止日期前30天向西澳大利亚大学发出书面通知后终止。
与临床网络服务(CNS)签订总咨询协议 Pty Ltd.
2020年6月29日,我们与临床网络服务(CNS)Pty Ltd(“临床网络”)签订了一份总咨询协议。根据协议条款,临床网络公司将担任澳大利亚和新西兰的顾问,负责临床研究项目的产品开发和管理。IncanneX将向临床网络支付市场标准费用。任何一方均可基于协议中规定的原因终止协议。
与莫纳什大学签订的研究服务协议,日期为2020年11月27日
2020年11月27日,我们与莫纳什大学签订了研究服务协议。根据协议条款,莫纳什大学将进行有关PSI-GAD的研究和服务。研究活动将针对一项2A期随机、双盲、积极安慰剂对照的试验进行,以评估Psi-GAD的安全性和有效性。IncanneX将提供进行这项研究所需的所有信息,并将向莫纳什大学支付市场标准费用。基于协议中规定的原因,任何一方均可终止协议。
与莫纳什大学签订的研究服务协议,日期为2021年3月10日
2021年3月10日,我们与莫纳什大学签订了研究服务协议。根据协议条款,莫纳什大学将开展有关TBI的研究和服务。研究活动将针对CBD和异氟醚在轻度创伤性脑损伤啮齿动物模型中的神经保护作用进行。IncanneX将提供进行这项研究所需的所有信息,并将向莫纳什大学支付市场标准费用。出于协议中规定的原因,任何一方均可终止协议。
97
与Avance Clinic Pty Limited签订主服务协议
于2021年7月12日,我们与Avance Clinical Pty Limited(“Avance”)订立 主服务协议。根据协议条款,Avance将 根据Incannex的要求提供服务,以支持Incannex的临床试验和研究。该协议的初始期限为五年。任何一方均可在合同期满前三个月以书面形式通知终止本协议。
与Novotech签订的总咨询协议附录2 澳大利亚私人有限公司
2021年2月2日,我们与临床网络的附属公司Novotech Australia Pty Limited(“Novotech”)签订了总咨询协议的附录 第2号。根据协议条款,Novotech将对治疗阻塞性睡眠呼吸暂停的屈诺比诺和乙酰唑胺的组合进行开放标签延长审查。本协议的条款受与临床网络签订的主咨询协议的条款管辖。
| D. | 外汇管制 |
澳大利亚在很大程度上取消了对投资交易的外汇管制。澳元可以自由兑换成美元。此外,目前没有关于从澳大利亚出口属于外国投资者的利润、股息、资本或类似资金的具体规则或限制,但向非居民支付的某些款项必须向监督此类交易的澳大利亚现金交易报告机构报告,而且可能需要扣缴因潜在澳大利亚纳税义务而产生的金额,除非能证明适用相关税收条约。
1975年《外国收购和收购法案》
根据澳大利亚法律,在某些情况下,未经澳大利亚财政部长批准,外国人士不得收购澳大利亚公司超过一定比例的股份。这些限制规定在《澳大利亚人法案》中。1975年外国收购和收购法 (Cth)(“FATA”),相关立法和条例。除了这些限制之外,根据澳大利亚《公司法》的收购条款,任何人,无论是外国人还是其他人,都禁止收购上市公司超过20%的权益(在没有适用的例外情况下)。
如果一项投资需要接受外商投资审批,它可能会有强制性的事先通知要求,即“应通知的行动”或“应通知的国家安全行动”,或自愿的事先通知要求,即“重大行动”或“可审查的国家安全行动”。如果一项投资属于这一自愿申请类别,寻求批准将使澳大利亚财政部长未来必须审查和批准该投资的某些权利失效。在自愿通知条款适用的情况下,不申请批准并不违反FATA。
澳大利亚的外国投资制度适用于“外国政府投资者”和外国私人。广义而言,如(I)一名外国持有人(连同其联系人)持有该实体20%或以上的直接或间接权益,或(Ii)多名外国持有人持有合共至少40%的权益(直接或间接),则该实体被视为外国人士。如果(I)外国政府或外国政府所有的实体或来自同一国家的多个外国政府拥有的实体拥有20%的直接或间接权益,或(Ii)或来自任何国家的多个外国政府或外国政府拥有的实体拥有40%的直接或间接权益,则一个实体将成为“外国政府 投资者‘。
根据FATA,外国人士 必须在强制性的基础上通知外国投资审查委员会,并获得外国投资审查委员会的事先批准,以收购 一家澳大利亚实体的权益,包括:
| ● | 外国政府投资者收购澳大利亚实体的直接权益(通常为10%或以上),无论价值如何; |
| ● | 任何外国人取得: |
| – | 在澳大利亚实体中的“大量权益”(通常为20%或更多),其估值高于相关的货币门槛。这通常是2.89亿澳元(每年编制指数),对于美国投资者来说,如果投资是由美国投资者直接进行的,则为12.5亿澳元,每种情况下都是按澳大利亚实体的总资产价值和已发行证券的总价值中较高的一个计算;或 |
| – | 与经营国家安全业务或持有“国家安全土地”的“国家安全业务”或实体有直接利害关系,不论其价值为何;以及 |
| ● | 收购在敏感行业(如媒体、电信以及加密和安全技术)运营的澳大利亚实体、土地丰富的澳大利亚实体或农业综合企业澳大利亚实体的权益。 |
98
每名寻求 收购超过上述上限的股份的外国人士(包括其联系人)须填写申请表,列明有关建议及收购/持股的相关详情,并须缴付有关申请费用。然后,澳大利亚财务主管有30天的时间考虑申请并做出决定,另外还有10天的时间通知申请人。但是,澳大利亚财务主管 拥有广泛的权力来延长这一期限,包括通过发布临时命令将期限延长最多90天。 最常见的情况是,澳大利亚财务主管会要求申请人同意延期以避免发布临时命令, 由于临时命令是公开的,因此此类协议通常符合申请人的最佳利益,并且通过同意延期, 申请过程是保密的。否则,申请是严格保密的,不会向公众发布。
澳大利亚外国投资审查委员会是澳大利亚财政部的澳大利亚顾问委员会,该委员会提供了一份题为:澳大利亚的外国投资政策,其中提供了政策的大纲。至于与寻求批准相关的风险,该政策规定,除其他事项外,如果申请违反国家利益,财务主管将拒绝该申请。
如果向澳大利亚财政部长提出申请(无论是自愿的还是强制性的),澳大利亚财政部长可以发出无异议通知、有条件的无异议通知或拒绝通知。
如果未获得必要的批准 ,财务主管拥有一系列强制执行权力,包括有权下令要求收购人 在指定期限内处置其所收购的股份。一旦外国人(连同任何关联方)持有实体的直接权益 或重大权益,任何进一步的权益收购,包括在二级市场交易过程中, 将需要获得新的FIRB批准,除非适用豁免。
一旦获得批准,FIRB批准 的有效期为12个月,这意味着作为申请主题的拟议收购可以在 12个月期间的任何时间发生。
| E. | 税收 |
以下讨论 澳大利亚和美国的税务后果对我们的股东至关重要。如果讨论是基于未经司法或行政解释的税收立法 ,则讨论中表达的观点可能不被 有关税务机关或法院接受。本讨论不打算也不应被解释为法律或专业税务 建议,也不排除所有可能的税务考虑因素。
我们的ADS持有人应 就购买、拥有和处置 ADS的美国、澳大利亚或其他税务后果咨询其自己的税务顾问,尤其包括任何外国、州或地方税收的影响。
美国税收
The following is a summary of material U.S. federal income tax consequences that generally apply to U.S. Holders (as defined below) who hold ADSs as capital assets within the meaning of Section 1221 of the Internal Revenue Code of 1986, as amended (the “Code”). This summary is based on the Code, its legislative history, final, temporary and proposed United States Treasury regulations promulgated thereunder, published rulings and court decisions, and the bilateral income tax convention between Australia and the United States (the “Treaty”), all as in effect on the date hereof and all of which are subject to change, or changes in interpretation, either prospectively or retroactively. This discussion does not address all of the tax consequences relating to the purchase, ownership, and disposition of ADSs and does not take into account U.S. Holders who may be subject to special rules, including: financial institutions, insurance companies, , tax-exempt organizations, real estate investment trusts, regulated investment companies, grantor trusts, non-resident aliens of the United States or taxpayers whose functional currency is not the U.S. dollar, persons who hold the ADSs through partnerships or other pass-through entities, persons who acquired their ADSs through the exercise or cancellation of any employee share options or otherwise as compensation for their services, investors that actually or constructively own 10% or more of our shares, dealers or traders in securities or currencies, certain former citizens or long-term residents of the United States, dual resident corporations, persons that generally mark their securities to market for United States federal income tax purposes, persons who are residents of Australia for Australian income tax purposes, and investors holding ADSs as part of a straddle or appreciated financial position or as part of a hedging or conversion transaction. This summary does not address the Medicare tax imposed on certain investment income, any state, local and foreign tax considerations or any U.S. federal estate, gift or alternative minimum tax considerations relevant to the purchase, ownership and disposition of our ADSs. In addition, this discussion is based in part upon representations of the depositary and the assumption that each obligation in the deposit agreement and any related agreements will be performed according to its terms.
99
如果就美国联邦所得税而言被视为合伙企业的合伙企业或实体 或安排拥有ADS,则其合伙人的美国联邦所得税待遇 通常取决于合伙人的地位和合伙企业的活动。合伙企业应咨询其税务顾问 有关其及其合伙人购买、拥有和处置ADS的美国联邦所得税后果。
在本摘要中, 术语“美国持有人”指美国联邦所得税目的的ADS受益所有人: 美国公民或居民个人;在美国或其任何 政治分支机构法律下创建或组建的公司;一个遗产,其收入是受美国联邦所得税,无论其来源;或信托,如果(a)美国境内的法院能够对信托的管理行使主要监督,且一名或多名美国人士 有权控制信托的所有重大决策,或(b)根据适用的美国法律, 财政部规定将被视为美国人。
分配
出于美国联邦所得税的目的,美国存托凭证持有人将被视为拥有美国存托凭证的普通股。根据下文讨论的被动外国投资公司规则,美国股东收到的有关我们普通股或美国存托凭证的任何分派的总金额,包括由此扣缴的任何澳大利亚税额,将作为股息计入毛收入,前提是分派 从我们当前或累计的收益和利润(根据美国联邦所得税原则确定)中支付。超过我们收益和利润的分派 将首先在美国存托凭证中按美国持有人的 计税基准被视为资本的免税返还,此后将被视为出售或交换存托凭证的收益。我们没有也没有 计划为美国联邦所得税目的维护收入和利润的计算。因此,美国持有者可能需要将任何此类分配的全部金额包括在收入中作为股息。但是,对于从美国公司获得的股息,股息将不符合通常允许公司股东享受的“股息 扣减”。
在美国存托凭证上以澳元进行的任何分销的美元价值通常应参考美国持有人实际收到或建设性收到分销之日起生效的美元与澳元之间的现货汇率来计算 ,无论如此收到的澳元是否实际上已兑换成美元。美国持有者收到以 澳元支付的款项,并将这些澳元以不同于当日有效汇率的汇率兑换成美元,可能会有外币兑换收益或损失,这通常会被视为来自美国境内的普通收入或损失,用于美国外国税收抵免目的。
受复杂限制 和某些持有期要求的限制,美国持有者可以选择就其美国联邦所得税义务 在分配中预扣的澳大利亚税申请抵免。守则中规定的限制包括计算规则,根据这些规则,对特定收入类别允许的外国税收抵免 不能超过针对每个此类收入类别应缴纳的美国联邦所得税 。股息通常将被视为外国来源的被动类别收入,用于美国的外国税收抵免目的 ,或者在某些美国持有者的情况下,被视为外国来源的“一般类别”收入。不选择申请美国外国税收抵免的美国持有者可以申请扣除澳大利亚扣缴的税款。
受某些限制的限制,非公司美国持有人收到的股息 如果是“合格股息”,应按20%的最高减税税率缴税。在以下情况下,股息属于合格股息:(A)(I)发行人根据 条约有权获得利益,或(Ii)股票可随时在美国成熟的证券市场上交易,以及(B)满足其他某些 要求。我们相信,根据该条约,我们有权获得利益,而且美国存托凭证目前可以在美国成熟的证券市场上随时交易。然而,不能保证美国存托凭证仍然可以随时交易。 此外,如果我们是派息前一年或支付股息的年度的PFIC,降低的费率不适用于股息。
100
美国财政部 担心美国存托股份持有人和美国存托股份基础证券发行商之间的所有权链中的中介机构可能正在采取与为美国存托凭证持有人申请外国税收抵免不一致的行动。此类行动也将与上述适用于某些非公司持有人收到的股息的降低税率的主张不一致。因此,对澳大利亚税收可信度的分析以及某些非公司持有人 收到的股息的可得减税税率 均如上所述,可能会受到美国存托股份持有人和本公司之间所有权链中的中间人采取的行动的影响。
美国存托凭证的处置
如果您出售或以其他方式处置美国存托凭证,您将确认美国联邦所得税的收益或亏损,其金额等于出售或其他处置变现金额的美元价值与您在美国存托凭证中的调整计税基础之间的差额。根据下文讨论的被动型外国投资公司规则,此类收益或损失一般为资本收益或损失,如果您在出售或其他处置时持有美国存托凭证超过一年,则为长期资本收益 或亏损。一般来说,您在销售或以其他方式处置美国存托凭证时确认的任何收益都将是从美国来源获得的收益,适用于外国税收抵免限制;损失通常将 与美国来源收入进行分配。根据《守则》,资本损失的扣除受到某些限制。
如果以现金为基础的美国持有者因出售或以其他方式处置美国存托凭证而收到澳元,则变现金额将根据收到的澳元的美元价值计算,该美元价值是参照该兑换结算日生效的即期汇率确定的。美国持有者收到澳元付款并将澳元兑换成美元的汇率 不同于结算日的有效汇率,其外币汇兑损益将被视为来自美国境内来源的普通收入或损失,以用于美国外国税收抵免。
权责发生制美国持有人 可以在出售或处置美国存托凭证时选择与现金制纳税人相同的待遇,前提是该选择 每年都适用。未经美国国税局(“IRS”)同意,不得更改此类选择。 如果权责发生制美国持有者没有选择被视为现金制纳税人(根据适用于外币交易的财政部条例 ),则该美国持有者在美国联邦所得税方面可能有外币收益或损失 ,因为交易日和结算日收到的货币的美元价值存在差异。任何此类货币损益都将被视为来自美国境内来源的普通收入或损失,用于美国的外国税收抵免 。但是,如果外币在美国持有者收到之日兑换成美元,现金基础或选择权责发生制的美国持有者不应确认此类兑换的任何收益或损失。
被动型外国投资公司规则
出于美国联邦所得税的目的,我们可能会 成为PFIC。我们作为PFIC的待遇可能会导致美国ADS持有者的税后回报减少,并可能导致此类证券的价值下降。
对于美国联邦所得税 ,我们将被归类为以下任何纳税年度的PFIC:(I)我们总收入的75%或更多是被动收入,或 (Ii)该纳税年度我们所有资产平均价值的至少50%产生或持有用于产生被动收入 。为此,现金被认为是一种产生被动收入的资产。就这些目的而言,被动收入一般包括股息、利息、特许权使用费、租金、年金以及产生被动收入的资产处置所产生的盈亏差额。在作出PFIC决定时,我们将被视为拥有我们所占比例的资产,并在我们直接或间接拥有25%或更多(按价值计算)股本的任何其他公司的收入中赚取我们按比例的 份额。
101
根据我们资产和收入的构成,我们认为,就2023财年而言,IncanneX不是美国联邦所得税用途的PFIC。然而,确定PFC地位是一项事实决定,必须每年在每个纳税年度结束时作出,因此,在本纳税年度或任何未来纳税年度结束之前,我们在这方面的地位是不确定的。我们收入或资产性质的变化或我们美国存托凭证交易价格的下降可能会导致我们在本年度或随后的任何一年被视为PFIC 。如果我们在美国持有人持有我们的美国存托凭证期间的任何一年是PFIC,我们通常会在美国持有人持有美国存托凭证期间的随后每一年继续被视为PFIC。
根据默认的PFIC“超额 分配”制度,如果我们是美国持有人拥有ADS的任何课税年度的PFIC,则该美国持有人可能对以下事项承担额外的税收和利息费用:(I)我们的某些分配(通常是在一个纳税年度内支付的大于前三个纳税年度支付的平均年分配的125%的任何分配,或者,如果较短,则为美国持有人对ADS的持有期),以及(Ii)从出售、交换或其他处置中实现的任何收益,包括美国存托凭证的承诺,无论我们在处置当年是否继续是PFIC。在这些情况下,通常将通过按比例分配美国存托凭证持有人持有的美国存托凭证期间的此类分配或收益来确定税款。分配给本课税年度和我们是PFIC的第一个课税年度之前的任何年度的金额将作为本课税年度的普通收入(而不是资本利得)征税。分配给其他课税年度的税额将按该年度适用的最高边际税率征税,并将按适用于少缴税款的税率对分配给该其他课税年度的 税额征收利息费用。
间接股东可以对支付给PFIC的直接所有人的分配和对间接拥有的股份的处置征税。强烈建议间接股东 就这些规则的应用咨询他们的税务顾问。
如果我们是PFIC,并且随后 在未来一年不再是PFIC,美国持有人可以通过选择 被视为在我们是PFIC的最后一个课税年度的最后一天出售其美国存托凭证,从而避免继续适用上述税收待遇。任何收益通常都将被确认,并根据上述超额分配制度缴税。损失将不会被确认。美国持有者在其美国存托凭证中的基础将增加被视为出售时确认的收益金额(如果有的话)。美国持有者将被要求将其美国存托凭证的持有期视为从我们是PFIC的最后一个纳税年度的最后一天的次日开始。
如果美国存托凭证被认为是“适销股”,并且如果美国持有者及时选择“按市值计价”其美国存托凭证,则根据上述超额分配制度,该美国持有者将不需缴税。相反,美国持有者一般会在收入中计入美国存托凭证在每个课税年度结束时的公平市价超过美国存托凭证经调整的课税基础的任何盈余。 如果美国存托凭证的公平市价在该课税年度结束时折旧低于经调整的基础,美国持有者将有权 扣除该等经调整的美国存托凭证的市价超出其当时的公平市价。然而,此类扣除通常将 限于美国持有者在前几年就此类ADS计入收入中的按市值计价的净收益(如果有)。收入 按市值计价条款允许的确认和扣除,以及与作出按市值计价选择有关的美国存托凭证处置的任何收益或亏损被视为普通收入或亏损(除非亏损被视为资本损失,如果亏损超过美国持有者在前几年就该等普通股计入收益中的按市值计价净收益) )。然而,在我们不再是PFIC的那一年,处置ADS(就其进行了适当的按市值计价的选择)的收益或损失将是资本收益或损失。我们的普通股或美国存托凭证只要在国家证券交易所(如纳斯达克)或受市场所在国政府监管机构监管的外国证券交易所 保持定期交易,并满足某些要求,包括该交易所的规则有效地促进上市股票的活跃交易, 我们的普通股或美国存托凭证就是“可上市”的股票。如果这类股票在这样一个合格的交易所或其他市场交易,这类股票一般将在每个日历季度至少15天的任何日历年内“定期交易”,而不是以最低数量交易,但在这方面不能给予任何保证。我们的普通股 在澳大利亚证券交易所交易,该交易所可能有资格成为符合条件的外国证券交易所。由于我们不能按市值选择我们可能拥有的任何较低级别的PFIC,因此美国持有人可以继续遵守PFIC规则, 该持有人在我们持有的任何投资(出于美国联邦所得税目的而被视为PFIC的股权)中的间接权益,包括我们被视为PFIC的任何子公司的股票。
102
美国存托凭证持有人应 不能通过选择将我们视为合格的选举基金来避免上述税收后果。一般来说,对于美国人来说,如果美国人选择将其在公司普通收益和净资本收益中的比例份额计入美国年度收入中,则符合条件的选举基金是PFIC。仅当我们每年向美国持有人提供某些信息,并且我们不打算准备美国 持有人进行合格选举基金选举所需的信息时,才能就我们而言进行合格选举基金选举。
备份扣缴和信息报告
有关ADS的付款 可能需要向美国国税局报告信息并缴纳美国备用预扣税(根据现行法律,税率为24%)。但是,如果美国持有人(I)是公司,(Ii)满足适用的豁免,或(Iii)提供正确的纳税人身份证明,则备份预扣 将不适用。
备份预扣不是 附加税。根据备份预扣规则扣缴的金额可以记入美国持有人在美国的纳税义务中, 美国持有人可以通过向美国国税局提交适当的退款申请 来获得根据备份预扣规则扣缴的任何超额金额的退款。
澳大利亚税收
在本节中,我们讨论适用于非澳大利亚税务居民的有关美国存托凭证绝对实益所有权的收购、所有权和处置的重大澳大利亚税务考虑因素 美国存托凭证证明。本讨论基于截至本年度报告日期 的现行澳大利亚税法,该税法可能会发生更改,可能会追溯。本讨论不涉及澳大利亚所得税法的所有方面 ,这些方面根据特定投资者的个人投资情况可能很重要,例如受特殊税收规则约束的投资者(例如金融机构、保险公司或免税组织)持有的美国存托凭证或股票。此外,本摘要不讨论除印花税以外的任何外国或国家税收考虑因素。建议潜在投资者就购买美国存托凭证或股票的澳大利亚和外国收入及其他税务考虑事项、 美国存托凭证或股票的所有权和处置问题咨询其税务顾问。
澳大利亚税收用途的美国存托凭证的性质
出于澳大利亚所得税和资本利得税的目的,我们美国存托凭证的持有者应 被视为相关普通股的所有者。因此,就相关普通股支付的股息 将被视为直接支付给美国存托凭证所有者,而出售美国存托凭证将被视为出售相关普通股。在下面的 分析中,我们将讨论澳大利亚所得税和资本利得税规则对非澳大利亚居民的美国存托凭证持有者的适用情况。
股息的课税
澳大利亚实行股息分配制度,根据该制度,只要股息是从缴纳所得税的公司利润中支付的,股息就可以被申报为“印花税”。加盖全额印花税的股息不需要缴纳股息预扣税。未加盖印花税 或部分加盖印花税并支付给非澳大利亚居民股东的股息,在支付给非澳大利亚居民股东时,需缴纳预扣股息税。
未加盖印花税(或部分加盖印花税) 支付给非居民股东的股息将按30%的税率征收预扣税,除非该股东是澳大利亚与其有双重征税协议的国家的居民 。
根据澳大利亚和美国之间的双重征税公约的条款,美国居民有权受益的股息中任何未加盖印花税的部分的澳大利亚最高税率将降至15%,如果美国居民持有我公司不到10%的投票权,或5%,如果美国居民持有我公司10%或更多的投票权。特殊的 规则适用于持有股份并获得股息的受监管投资公司和房地产投资信托基金。澳大利亚和美国之间的双重征税公约不适用于限制美国存托凭证与美国存托凭证所有者在澳大利亚经营的常设机构或固定基地的股息税率,股东通过这些机构开展业务或提供独立的个人服务。
103
股票销售或其他处置税--资本利得税
非澳大利亚居民因出售不应纳税的澳大利亚财产的资本资产而获得的澳大利亚资本利得将不予考虑。非澳大利亚居民股东在出售我们的股票时获得的资本收益将不受澳大利亚资本利得税的影响,除非 他们与联营公司一起持有我们已发行资本的10%或更多,在出售时或在出售前24个月内的任何连续12- 个月期间进行测试,并且我们股票在出售时的价值主要归因于澳大利亚 房地产资产。
澳大利亚资本利得税 适用于按纳税人边际税率计算的净资本利得,但对于某些股东,如果 持有股票12个月或更长时间,并且股东在部分或全部所有权期间是澳大利亚居民,则可能适用资本利得折扣。对于 个人,此折扣为50%。净资本利得是在扣除资本损失(包括前一年的某些资本损失)后计算的,只有资本利得才能抵消。
一些非澳大利亚居民 股东可能会根据收入而不是资本账户持有股票,例如股票交易员。根据所得税法的普通收入条款,这些股东可能因出售或以其他方式处置包括在其应纳税所得额中的股票而获得收益 ,如果收益来自澳大利亚。
根据这些规定应就收入账户持有的股票收益进行评估的非澳大利亚居民股东将按适用于非澳大利亚居民的澳大利亚 税率进行评估,非澳大利亚居民个人的边际税率为32.5%。例如,根据美国和澳大利亚之间的双重征税公约,此类非澳大利亚居民股东可能会获得一些澳大利亚所得税减免 ,因为该股东在澳大利亚没有常设机构。
若非澳洲居民股东的应评税收入同时计入资本利得税条款及普通收入条款,则资本利得税金额一般会减少,因此股东不会因任何 部分收入收益或资本收益而被双重课税。
双重居住权
如果根据澳大利亚和美国的国内税法,股东同时是澳大利亚和美国的居民 ,则该股东可能作为澳大利亚居民 纳税。然而,如果就美国和澳大利亚之间的双重征税公约 而言,股东被确定为美国居民,则适用的澳大利亚税收将受到双重征税公约的限制。在这种情况下,股东 应咨询专家税务建议。
不征收澳大利亚遗产税(遗产税)
澳大利亚没有遗产税或遗产税。死者股份的继承不会产生资本利得税的负担。然而,受益人出售继承的股份可能会产生资本利得税债务。
| F. | 股息和支付代理人 |
不适用。
| G. | 专家发言 |
不适用。
104
| H. | 展出的文件 |
我们须遵守1934年修订的美国证券交易法或交易法中适用于“外国私人发行人”的报告要求 ,如交易法规则3b-4所定义。作为外国私人发行人,我们不受《交易所法》某些条款的约束。 因此,我们的委托书征集不受《交易所法》第14A条的披露和程序要求的约束 我们的高级管理人员和董事对我们的股权证券的交易不受报告和《交易所法》第16节所载的“短期”利润回收条款的约束。此外,根据《交易所法案》,我们不需要像其证券根据《交易所法案》注册的美国公司那样频繁或及时地提交定期报告和财务报表 。然而,我们向美国证券交易委员会提交了一份Form 20-F年度报告,其中包含已审查和报告的财务报表,以及独立注册会计师事务所发表的意见,我们以Form 6-K向美国证券交易委员会提交报告,其中包括每个财年前六个月的新闻稿和未经审计的财务 信息。我们在向美国证券交易委员会提交年度和半年报告后,会立即在我们的网站上发布这些报告。我们网站上包含的或通过我们网站获得的信息并未通过引用并入本Form 20-F年度报告中,也不应被视为本Form 20-F年度报告的一部分,本Form 20-F年度报告中对我们网站的提及仅为非正式文本参考。
本文件及其证物和我们根据《交易法》提交的任何其他文件可免费查阅,并按规定的费率在美国证券交易委员会公共资料室复印,地址为华盛顿特区20549号,邮编:20549,地址为美国证券交易委员会公共资料室。您可以 致电美国证券交易委员会,电话:1-800-美国证券交易委员会-0330,获取有关美国证券交易委员会在华盛顿特区公共资料室运作的信息。
美国证券交易委员会维护着一个网站,网址为Www.sec.gov其中包含使用EDGAR(电子数据收集、分析和检索)系统向美国证券交易委员会提交电子文件的注册人的报告、代理和信息声明以及其他信息。
本文档中提及的有关我们公司的文件也可在我们位于澳大利亚新南威尔士州西北2153 8世纪电路105室的办公室查阅。
| I. | 子公司信息 |
更多信息见项目4C“组织结构” 。
| J. | 给证券持有人的年度报告 |
不适用。
| 第11项。 | 关于市场风险的定量和定性披露 |
我们的现金全部由在澳大利亚银行的计息账户中持有的现金组成。因此,我们对市场风险的主要敞口是利息收入敏感度, 这会受到澳大利亚利率总体水平变化的影响。然而,市场利率的突然变化预计不会对我们的财务状况和/或经营业绩产生实质性影响。见财务报表附注“19.金融工具” ,以进一步讨论市场风险和敏感性分析。
105
| 第12项。 | 除股权证券外的其他证券说明 |
| A. | 债务证券 |
不适用。
| B. | 认股权证和权利 |
不适用。
| C. | 其他证券 |
不适用。
| D. | 美国存托股份 |
美国存托股份
德意志银行信托美洲公司作为托管人,将登记和交付美国存托凭证。每一张美国存托股份将代表25股普通股的所有权,这些普通股作为托管人存放在国家代理人有限公司 处。每个美国存托股份还将代表托管人可能持有的任何其他金融证券、现金或其他财产的所有权。托管美国存托凭证的公司信托办公室位于60 Wall Street,New York,NY 10005,USA。托管机构的主要执行办公室位于60 Wall Street, New York,NY 10005,USA。
直接登记系统是由存托信托公司(DTC)管理的系统,根据该系统,托管人可以登记未经证明的美国存托凭证的所有权,所有权应由托管人向有权 获得所有权的美国存托股份持有人定期发布的声明来证明。
我们不会将美国存托股份持有者 视为我们的股东,因此,作为美国存托股份持有者,您将没有股东权利。澳大利亚法律管辖股东权利。 您的美国存托凭证相关普通股的持有者将是托管人。作为美国存托凭证的持有者,您将拥有美国存托股份持有者权利。作为美国存托股份持有人的我们、托管银行和您以及美国存托凭证的实益所有人之间的存款协议将美国存托股份持有人的权利以及托管银行的权利和义务列为 。存款协议和美国存托凭证由纽约州法律管辖。见 “--管辖权和仲裁”。
费用及开支
作为美国存托股份持有者,您将被要求 向开户银行支付以下服务费以及某些税费和政府手续费(此外,您的任何美国存托凭证所代表的托管证券还需支付任何适用的费用、开支、税金和其他政府手续费):
| 服务 | 费用 | |
| 向获发美国存托凭证的任何人或根据股票股息或其他免费分发股票、红利分配、股票拆分或其他分配(转换为现金的除外)进行美国存托股份分配的任何人 | 每张美国存托股份最高可获0.05美元 | |
| 取消美国存托凭证,包括终止存款协议的情况 | 每个美国存托股份取消最高0.05美元 | |
| 现金股利的分配 | 持有的美国存托股份最高可获0.05美元 | |
| 分配现金应享权利(现金股息除外)和/或出售权利、证券和其他应享权利所得的现金收益 | 持有的美国存托股份最高可获0.05美元 | |
| 根据权利的行使分配美国存托凭证。 | 持有的美国存托股份最高可获0.05美元 | |
| 托管服务 | 在开户银行建立的适用记录日期(S)持有的美国存托股份,最高可达0.04美元 |
作为美国存托股份持有者,您 还将负责支付开户银行发生的某些费用和开支以及某些税费和政府收费(除了您的任何 美国存托凭证所代表的已存款证券的任何适用费用、费用、税费和其他政府收费外),例如:
| ● | 税收(包括适用的利息和罚款)和其他政府收费; |
| ● | 澳大利亚普通股的登记处和转让代理收取的普通股转让和登记费用(即普通股存入和提取时收取的费用)。 |
| ● | 将外币兑换成美元所发生的费用。 |
| ● | 电报、电传和传真以及交付证券的费用。 |
106
| ● | 证券转让的税项和关税,包括任何适用的印花税、任何股票转让费或预扣税(即普通股存入或提取时)。 |
| ● | 与交付或提供存款普通股服务有关的费用和开支。 |
| ● | 因遵守适用于普通股、存托证券、美国存托凭证和美国存托凭证的外汇管制法规和其他法规要求而产生的费用和支出。 |
| ● | 任何适用的费用和处罚。 |
在发行和注销美国存托凭证时应支付的存托费用 通常由从开户银行接收新发行的美国存托凭证的经纪人(代表其客户)支付给开户银行,并由将美国存托凭证交付给开户银行以供注销的经纪人(代表其客户) 支付给开户银行。经纪公司进而向其客户收取这些费用。与向美国存托股份持有人分发现金或证券有关的应付存托费用和存托服务费由开户银行自适用的美国存托股份备案日期起向美国存托凭证记录持有人收取 。
现金分配的应付存托费用 通常从分配的现金中扣除,或通过出售一部分可分配财产来支付费用 。如果是现金以外的分配(即股票股息、权利),开户银行在分配的同时向美国存托股份记录日期持有人收取适用的 费用。如果是在投资者名下登记的美国存托凭证(无论是否在直接登记中获得证明),托管银行会将发票发送给相应的记录日期美国存托股份持有人。 如果美国存托凭证是以经纪和托管账户(通过DTC)持有的,开户银行通常通过DTC提供的系统 向在其 DTC账户中持有美国存托凭证的经纪人和托管人(其代理人是在DTC持有的美国存托凭证的登记持有人)收取费用。将客户的美国存托凭证存入DTC账户的经纪人和托管人又向客户的账户收取支付给存款银行的费用。
如果拒绝支付托管费用,根据存款协议的条款,托管银行可以拒绝所请求的服务,直到收到付款为止,或者可以从向美国存托股份持有人的任何分配中扣除托管费用的金额。
托管银行可根据吾等和托管银行不时商定的条款和条件,通过提供因美国存托凭证计划而收取的美国存托股份费用的一部分或其他方式,向我方付款或偿还我方的某些成本和开支。
缴税
您将负责 您的美国存托凭证或您的任何美国存托凭证所代表的存款证券的任何应付或成为应付的税款或其他政府费用。托管人可能拒绝登记或转让您的美国存托凭证,或允许您提取您的美国存托凭证所代表的已存入证券,直到该等税款或其他费用付清为止。它可能使用欠您的款项或出售您的美国存托凭证所代表的存款证券来支付任何欠税,您仍将对任何不足承担责任。如果托管人出售已存放的证券,它将在适当的情况下减少美国存托凭证的数量,以反映出售情况,并向您支付任何净收益,或在其缴纳税款后将剩余的任何财产 发送给您。您同意赔偿我们、托管人、托管人及其各自的代理人、董事、 员工和关联公司因任何退税、源头扣缴率降低或为您获得的其他税收优惠而产生的任何税款索赔(包括适用的利息和罚款),并使他们各自不受损害。在美国存托凭证的任何转让、任何美国存托凭证的退还、存款证券的撤回或存款协议终止后,您在本款项下的义务将继续有效。
有关美国存托凭证的更多信息,请参见表2.3:“证券说明”。
107
第II部
| 第 项13. | 违约、拖欠股息和拖欠股息 |
不适用。
| 第 项14. | 对担保持有人权利和收益使用的实质性修改 |
不适用。
| 第 项15. | 控制和程序 |
信息披露控制和程序的评估
我们的管理层在首席执行官和首席财务官的参与下,根据交易所 法案下的规则13a-15(B)的要求,对截至2023年6月30日我们的披露控制和程序(如交易所法案下的规则13a-15(E)所定义)的有效性进行了评估。基于这一评估,我们的管理层得出结论,截至2023年6月30日,我们的披露控制和程序是有效的。
管理层年度财务内部控制报告
根据交易法规则13a-15(F)的定义,我们的管理层负责建立和维护对财务报告的充分内部控制。 在包括首席执行官和首席财务官在内的我们管理层的监督和参与下,我们根据特雷德韦委员会赞助组织委员会(COSO 2013)发布的《内部控制-综合框架》中规定的标准,对截至2023年6月30日的财务报告内部控制的有效性进行了评估。根据我们在《内部控制-综合框架》中规定的标准进行的评估,我们的管理层得出结论:我们对财务报告的内部控制自2023年6月30日起有效。
本年度报告不包括本公司注册会计师事务所的认证报告,因为我们是一家新兴的成长型公司。
控制措施有效性的固有限制
在设计和评估我们的披露控制和程序时,管理层认识到,任何控制和程序,无论设计和操作有多好,都只能为实现预期的控制目标提供合理的保证。此外,披露控制和程序的设计必须反映这样一个事实,即存在资源限制,要求管理层在评估可能的控制和程序相对于其成本的好处时作出判断。
财务报告内部控制的变化
在截至2023年6月30日的财政年度内,我们对财务报告的内部控制(如《交易法》第13a-15(F)条所定义)没有发生任何变化,这对我们的财务报告内部控制产生了重大影响,或有合理的可能性对其产生重大影响。
| 第 项16. | 已保留 |
不适用。
| 项目 16a。 | 审计委员会财务专家 |
Peter Widdows是我们董事会的成员,也是我们审计委员会的主席。我们的董事会已经确定Peter Widdows是审计委员会的财务专家,并且满足美国证券交易委员会、纳斯达克规则和澳交所规则的“独立性”要求。
| 项目 16b。 | 道德守则 |
我们采用了适用于我们公司的董事、首席执行官和所有高级财务官的行为准则,包括首席财务官、首席会计官或财务总监,或执行类似职能的人员。我们的行为准则可在我们的网站上获得 ,网址为www.incannex.com.au.
可根据要求提供书面副本 。如果我们对行为准则进行任何实质性修订或批准任何行为准则条款的豁免,包括任何隐含的豁免,我们将在我们的网站上披露此类修订或豁免的性质。
108
| 项目 16c。 | 首席会计师费用及服务 |
我们在2023财年和2022财年保留了PKF作为我们的独立注册会计师事务所。以下是2023财年和2022财年分别为所提供服务支付的费用摘要。
| 2023财年 | 2022财年 | |||||||
| A$ | A$ | |||||||
| 审计费 | 97,750 | 465,346 | (1) | |||||
| 审计相关费用 | — | — | ||||||
| 税费 | — | — | ||||||
| 所有其他费用 | — | — | ||||||
| 总薪酬 | 97,750 | 465,346 | ||||||
| (1) | 总薪酬包括就IncanneX在纳斯达克上市所产生的2021、2020和2019财年的审计费用向Withum支付的357,208澳元。IncanneX就其2022财年的审计向PKF支付了85,000澳元。薪酬总额不包括2022财年支付给HLB Mann Judd的23,138澳元,该金额与根据澳大利亚会计准则委员会的规则提供的审计服务有关。 |
审批前的政策和程序
我们的审计委员会已经通过了政策和程序,对我们独立的注册会计师事务所提供的审计和非审计服务进行预先批准。审计或非审计服务的预先批准可以作为一般预先批准,作为审计委员会批准我们独立注册会计师事务所聘用范围的一部分,或以个人为基础。任何超过一般预先批准水平的拟议服务也需要我们的审计委员会的具体预先批准。 该政策禁止保留独立注册会计师事务所执行萨班斯-奥克斯利法案第201节或美国证券交易委员会规则中定义的被禁止的非审计职能,并要求审计委员会 考虑拟议的服务是否与注册会计师事务所的独立性兼容。
| 第 项16d。 | 对审计委员会的上市标准的豁免 |
不适用。
| 项目 16e。 | 发行人及关联购买人购买股权证券 |
不适用。
| 项目 16 f. | 更改注册人的认证会计师 |
本公司宣布, 于2022年7月7日,我们解除Withum作为我们独立注册会计师事务所的职务。2022年7月7日,我们委任PKF为我们的独立注册会计师事务所。我们的独立注册会计师事务所的这一变更已于2022年7月7日获得董事会批准。
Withum关于 截至2021年6月30日止年度财务报表的报告不包含否定意见或拒绝发表意见,也没有 对不确定性、审计范围或审计原则提出保留或修改。
109
在Withum的 业务期间,(i)我们与Withum之间在会计原则或惯例、财务报表 披露或审计范围或程序方面没有任何分歧,这些分歧如果没有得到令Withum满意的解决,将导致其 在其报告中提及分歧的主题;及(ii)没有表格20-F第16 F(a)(1)(v)项所界定的“须予报告事件” 。公司已要求Withum向其提供一封致美国证券交易委员会的信,说明Withum是否同意上述声明。Withum于2022年10月28日致美国证券交易委员会的信函副本作为证据提交。
在截至2023年6月30日和2022年6月30日的最近两个 财政年度内,本公司或代表本公司的任何人均未就 (a)已完成或拟议的特定交易的会计原则应用咨询PKF;或 可能对公司合并财务报表出具的审计意见类型,既没有向公司提供书面报告,也没有提供PKF认为是公司在就会计、 审计或财务报告问题作出决定时考虑的重要因素的 口头建议;或(b)表格 20-F第16 F(a)(1)(iv)项所界定的任何争议事项及表格20-F第16 F项的相关指示,或表格20-F第16 F(a)(1)(v)项所述的任何须予报告事件。
| 项目 16克。 | 公司治理 |
根据纳斯达克规则第5615(a)(3)条, 外国私人发行人(如本公司)被允许遵循某些母国公司治理惯例,而不是纳斯达克规则的某些 规定。选择遵循本国惯例而非任何此类纳斯达克规则的外国私人发行人 必须提前向纳斯达克提交一份由该发行人本国的独立律师出具的书面声明,证明 发行人的惯例不受本国法律禁止。我们向纳斯达克提交了这样一份书面声明。参见 “第6项。董事、高级管理人员及企业家-C。董事会惯例-纳斯达克上市规则下的公司治理要求”,以总结此类差异。
| 项目 16小时 | 煤矿安全信息披露 |
不适用。
| 项目 16i. | 关于妨碍检查的外国司法管辖区的披露 |
不适用。
| 项目 16J。 | 内幕交易政策 |
我们采用了股票交易 政策(以下简称“政策”),该政策规定了管理证券购买、出售和处置的政策和程序,适用于董事、高级管理人员、员工、顾问、其配偶或子女,以及由他们中的任何人(以下简称“人员”)控制的任何信托、公司或投资工具。
该政策旨在限制 掌握“内幕消息”的人员交易我们的证券,并确保遵守所有适用的证券法律、规则和法规以及上市标准。
我们已将保单作为本年度报告的附件提交到表格 20-F中。
| 项目16K。 | 网络安全。 |
不适用。
110
第三部分
| 第 项17. | 财务报表 |
我们已选择提供财务报表 和第18项中规定的相关信息。
| 第 项18. | 财务报表: |
以下财务报表作为本年度报告的一部分以Form 20-F形式提交。
111
INCANNEX医疗保健有限公司
合并财务报表索引
| 页面 | ||
| 截至2023年、2023年和2022年6月30日止年度的综合财务报表 | ||
| 独立注册会计师事务所报告(PCAOB ID号 | F-2 | |
| 综合全面收益/(损益)表 | F-3 | |
| 合并财务状况表 | F-4 | |
| 合并权益变动表 | F-5 | |
| 合并现金流量表 | F-6 | |
| 合并财务报表附注 | F-7 |
| 页面 | ||
| 截至2022年和2021年6月30日止年度的综合财务报表 | ||
| 综合全面收益/(损益)表 | F-31 | |
| 合并财务状况表 | F-32 | |
| 合并权益变动表 | F-33 | |
| 合并现金流量表 | F-34 | |
| 合并财务报表附注 | F-35 |
| 页面 | ||
| 截至2021年和2020年6月30日止年度的综合财务报表 | ||
| 独立注册会计师事务所报告 | F-53 | |
| 综合全面收益/(损益)表 | F-54 | |
| 合并财务状况表 | F-55 | |
| 合并权益变动表 | F-56 | |
| 合并现金流量表 | F-57 | |
| 合并财务报表附注 | F-58 |
F-1
独立注册会计师事务所报告{br

PKF布里斯班审计
荷兰银行33 873 151 348
鹰街10号6楼
布里斯班,QLD 4000澳大利亚
+61 7 3839 9733
邮箱:brisbane@pkf.com.au pkf.com.au
致IncanneX Healthcare Limited董事会和股东
对财务报表的看法
本核数师已审核随附的IncanneX Healthcare Limited及其受控实体(“综合实体”)截至2023年6月30日及2022年6月30日的综合财务状况表 、截至2023年6月30日止两年内各年度的相关综合全面收益表、综合权益变动表及 综合现金流量表,以及相关附注(统称为“财务报表”)。吾等认为,该等财务报表在各重大方面均按照国际财务报告准则(“IFRS”) 及国际会计准则理事会发布的解释,公平地列报综合实体于2023年及2022年6月30日的财务状况,以及截至2023年6月30日止两年内各年度的经营业绩及现金流量。
意见基础
这些财务报表由合并实体的管理层负责。我们的责任是根据我们的审计对合并实体的财务报表 发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券 法律以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须独立于合并实体。
我们按照PCAOB的 标准进行审计。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是欺诈。合并实体不需要,也没有聘请我们对其财务报告的内部控制进行审计。作为我们审计的一部分,我们需要了解财务报告的内部控制,但不是为了对合并实体的财务报告内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的审计包括执行程序以评估财务报表重大错报的风险(无论是由于错误还是欺诈),以及执行应对这些风险的程序。这些程序包括在测试基础上审查与财务报表中的金额和披露有关的证据。 我们的审计还包括评估所使用的会计原则和管理层做出的重大估计,以及评估财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的基础。
/s/
自2022年7月以来,我们一直担任合并实体的 审计员。
2023年10月31日
PCAOB ID号6622
PKF布里斯班私人有限公司是PKF Global的成员之一,PKF Global是PKF International Limited的成员 公司网络,每个公司都是独立拥有的法人实体,不对任何个人成员或代理公司(S)的行为或不作为承担任何责任或责任。受专业标准法规批准的计划所限制的责任。
F-2
综合全面收益表
截至2023年6月30日止的年度
| 已整合 | ||||||||||
| 2023年6月30日 | 6月30日 2022 | |||||||||
| 备注 | $ | $ | ||||||||
| 其他收入 | 3 | |||||||||
| 其他收入合计 | ||||||||||
| 产品成本 | ( | ) | ||||||||
| 行政管理费用 | ( | ) | ( | ) | ||||||
| 广告和投资者关系 | ( | ) | ( | ) | ||||||
| 坏账支出 | ( | ) | ||||||||
| 研发成本 | ( | ) | ( | ) | ||||||
| 合规、法律和监管 | ( | ) | ( | ) | ||||||
| 基于股份的支付 | 17 | ( | ) | ( | ) | |||||
| 入住费 | ( | ) | ( | ) | ||||||
| 折旧费用 | ( | ) | ||||||||
| 工资和员工福利支出 | ( | ) | ( | ) | ||||||
| 总费用 | ( | ) | ( | ) | ||||||
| 税前亏损 | ( | ) | ( | ) | ||||||
| 所得税 | 5 | |||||||||
| 税后亏损 | ( | ) | ( | ) | ||||||
| 其他综合收益 | ||||||||||
| 本年度综合亏损总额 | ( | ) | ( | ) | ||||||
| 每股收益 | 6 | |||||||||
| 每股基本亏损(每股美分) | ( | ) | ( | ) | ||||||
| 每股摊薄亏损(每股美分) | ( | ) | ( | ) | ||||||
附注构成这些财务报表的一部分
F-3
综合财务状况表
截至2023年6月30日
| 已整合 | ||||||||||
| 2023年6月30日 | 6月30日 2022 | |||||||||
| 备注 | $ | $ | ||||||||
| 资产 | ||||||||||
| 流动资产 | ||||||||||
| 现金和现金等价物 | 8 | |||||||||
| 贸易和其他应收款 | 9 | |||||||||
| 其他资产 | 10 | |||||||||
| 流动资产总额 | ||||||||||
| 非流动资产 | ||||||||||
| 财产、厂房和设备 | 11 | |||||||||
| 使用权资产 | 12 | |||||||||
| 无形资产 | 13 | |||||||||
| 非流动资产总额 | ||||||||||
| 总资产 | ||||||||||
| 负债 | ||||||||||
| 流动负债 | ||||||||||
| 贸易和其他应付款 | 14 | |||||||||
| 租赁负债 | 12 | |||||||||
| 流动负债总额 | ||||||||||
| 非流动负债 | ||||||||||
| 租赁负债 | 12 | |||||||||
| 非流动负债总额 | ||||||||||
| 总负债 | ||||||||||
| 净资产 | ||||||||||
| 权益 | ||||||||||
| 已发行资本 | 15 | |||||||||
| 储量 | 16 | |||||||||
| 累计损失 | ( | ) | ( | ) | ||||||
| 净股本 | ||||||||||
附注构成这些财务报表的一部分
F-4
综合权益变动表
截至2023年6月30日止的年度
| 已整合 | 已发行资本 | 权益 储备 | 累计 损失 | 总计 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 2021年6月30日的结余 | ( | ) | ||||||||||||||
| 行使的期权 | ||||||||||||||||
| 基于股份的支付 | ||||||||||||||||
| 股票配售 | ||||||||||||||||
| 向顾问发行的股票 | ||||||||||||||||
| 股票发行成本 | ( | ) | ( | ) | ||||||||||||
| 本年度综合亏损 | ( | ) | ( | ) | ||||||||||||
| 2022年6月30日的结余 | ( | ) | ||||||||||||||
| 行使的期权 | ||||||||||||||||
| 发给顾问的期权 | ||||||||||||||||
| 期权配售 | ||||||||||||||||
| 基于股份的支付 | ||||||||||||||||
| 股票配售 | ||||||||||||||||
| 向顾问发行的股票 | ||||||||||||||||
| 已发行的资产收购股份 | ||||||||||||||||
| 股票发行成本 | ( | ) | ( | ) | ||||||||||||
| 本年度综合亏损 | ( | ) | ( | ) | ||||||||||||
| 2023年6月30日的结余 | ( | ) | ||||||||||||||
附注构成这些财务报表的一部分
F-5
合并现金流量表
截至2023年6月30日止的年度
| 已整合 | ||||||||||
| 2023 | 2022 | |||||||||
| 备注 | $ | $ | ||||||||
| 经营活动的现金流 | ||||||||||
| 来自客户的收据 | ||||||||||
| 来自其他收入的收入 | ||||||||||
| 向供应商和员工付款 | ( | ) | ( | ) | ||||||
| 收到的利息和其他收入 | ||||||||||
| 经营活动中使用的现金净额 | 8 | ( | ) | ( | ) | |||||
| 投资活动产生的现金流 | ||||||||||
| 增加财产、厂房和设备的付款 | ( | ) | ||||||||
| 投资活动的现金净额 | ( | ) | ||||||||
| 融资活动产生的现金流 | ||||||||||
| 发行股份所得收益(扣除成本) | ||||||||||
| 偿还租赁债务 | ( | ) | ||||||||
| 融资活动的现金净额 | ||||||||||
| 现金和现金等价物净减少 | ( | ) | ||||||||
| 年初现金及现金等价物 | ||||||||||
| 汇率波动对现金持有的影响 | ||||||||||
| 年终现金及现金等价物 | 8 | |||||||||
附注构成这些财务报表的一部分
F-6
财务报表附注
截至2023年6月30日止的年度
1. 重要会计政策
在编制综合财务报表时采用的主要会计政策如下。除非另有说明,这些政策一直适用于提交的所有年度 。
运营的性质
IncanneX Healthcare Limited(“本公司”) 及其合并附属公司(统称“本集团”)是一家临床阶段药物开发公司, 正在开发独特的医用大麻药物产品和迷幻药物疗法。公司的普通股在澳大利亚证券交易所(“澳大利亚证券交易所”)交易。该公司的注册办事处位于澳大利亚维多利亚州墨尔本3000号柯林斯街525号南塔里亚托23层。
截至2023年6月30日止财政年度,集团除所得税后的综合亏损总额为$
采用新的或修订的会计准则和解释
本集团已采纳国际会计准则委员会(“IASB”)颁布的所有新的或经修订的会计准则及诠释,该等准则及诠释于本报告期内属强制性的 。
尚未强制执行的任何新的或修订的会计准则或解释 尚未及早采用。
历史成本惯例
综合财务报表乃根据历史成本惯例编制,但(如适用)通过损益按公允价值重估金融资产及负债、通过其他全面收益及衍生金融工具按公允价值重估金融资产除外。
关键会计估计
编制合并财务报表需要使用某些关键会计估计数。它还要求管理层在应用本集团会计政策的过程中作出判断。涉及较高程度的判断或复杂性的领域,或假设和估计对合并财务报表具有重大意义的领域,在附注2中披露。
比较句
如有必要,已对比较信息进行了重新分类和重新定位,以与本年度的披露保持一致。
合规声明
该等综合财务报表于2023年10月获董事会批准 发布。
综合财务报表符合 澳大利亚会计准则,其中包括澳大利亚与国际财务报告准则(“AIFRS”)的等价物, 。遵守AIFRS确保财务报告也符合国际财务报告准则(“IFRS”)。
F-7
1. 重要会计政策(续)
父实体信息
根据AASB 10(国际财务报告准则10)合并财务报表 ,该等综合财务报表仅载列本集团的业绩。关于父实体的补充信息在附注24中披露。
合并原则
综合财务报表包括 本公司所有附属公司于2023年及2022年6月30日的资产及负债,以及截至该等年度的所有附属公司的业绩。IncanneX Healthcare Limited及其附属公司在本综合财务报表中统称为“本集团”。所有受控实体的详情载于附注22。
子公司是指集团拥有控制权的所有实体。当本集团因参与某实体而面临或有权获得可变回报时,本集团控制该实体,并有能力通过其指导该实体活动的权力影响该等回报。子公司自控制权移交给本集团之日起 全面合并。它们从控制权停止之日起解除合并。
集团中实体之间的公司间交易将被取消。附属公司的会计政策已于有需要时作出更改,以确保与本集团采纳的政策保持一致。
如本集团失去对附属公司的控制权,则终止确认附属公司的资产,包括商誉、负债及非控股权益,以及在权益中确认的任何累计折算差额。本集团确认所收取代价的公允价值及保留的任何投资的公允价值,连同任何损益。
运营细分市场
营运分部按“管理方法”于附注4列示,所载资料与向行政总裁提交的内部报告相同。首席执行官负责为各业务部门分配资源,并评估其业绩。
外币折算
合并财务报表以澳元列报,澳元是公司的职能货币和列报货币。
外币交易
外币交易使用交易日期的现行汇率折算为 澳元。结算该等交易所产生的汇兑损益,以及按财政年终汇率折算以外币计价的货币资产和负债所产生的汇兑损益,在损益中确认。
收入确认。
本公司确认收入,以描述将商品和服务转让给客户的金额,该金额反映了本公司预期有权通过以下步骤换取这些商品和服务的对价:
| ● | 确定与客户的合同; |
| ● | 确定合同中的履约义务; |
| ● | 确定交易价格; |
| ● | 将交易价格分配给履约义务;以及 |
| ● | 在公司履行业绩义务时确认收入。 |
F-8
1. 重要会计政策(续)
收入可以随着履行义务的履行而获得 ,也可以在实体获得支付权、客户拥有资产以及相关的重大所有权风险和回报,以及客户已接受资产的时间点获得。
公司与客户的安排 可包括多项履约义务。当合同涉及各种履约义务时,本公司评估是否每一项履约义务都是不同的,是否应根据美国会计准则第15号(国际财务报告准则第15号)、与客户的合同收入作为单独的会计单位进行会计处理。
本公司根据其整体定价目标和市场情况确定独立销售价格。考虑的重要定价实践包括: 折扣实践、我们交易的规模和数量、我们的营销策略、历史销售额和合同价格。独立销售价格的确定 是通过与管理层协商并经管理层批准,并考虑到我们的入市战略 。随着公司进入市场战略的发展,公司未来可能会修改其定价做法,这可能会导致相对独立销售价格的变化。
本公司根据最能反映收入和现金流的性质、金额、时间和不确定性受经济因素影响的类别,对与客户签订的合同收入进行分类 。于截至2023年及2022年6月30日止年度内,本公司只确认一个此类类别的收入,即大麻油销售。
公司在正常的28天商业条款内开具发票后收到客户的付款 。如果客户被明确确定为信用风险,则停止确认收入 ,但已收取的费用除外。
其他收入
其他收入在收到时确认 或在确定收受权利时确认。其他收入主要包括赠款收入和利息收入。
利息收入
利息收入采用有效利息法确认为利息应计项目。这是一种计算金融资产摊销成本并使用实际利率分配相关期间利息收入的方法,实际利率是通过金融资产的预期寿命将估计未来现金收入 准确贴现至金融资产的账面净值的比率。
所得税
该期间的所得税支出或利益是指根据每个司法管辖区适用的所得税税率对该期间的应纳税所得额支付的税款,并按可归因于暂时性差异、未使用的税项损失和以前报告年度已确认的调整的递延税项资产和负债变动进行调整(如适用)。
递延税项资产和负债按资产收回或负债清偿时预计适用的税率确认 暂时性差异,根据已颁布或实质颁布的税率确认,但以下情况除外:
| ● | 在非企业合并的交易中,因初始确认商誉或资产或负债而产生的递延所得税资产或负债,并且在交易时不影响会计和应税利润; |
| ● | 当应课税暂时性差异与附属公司、联营公司或合资企业的权益相关,且转回的时间可以控制,且暂时性差异很可能在可预见的将来不会转回。 |
F-9
1. 重要会计政策(续)
递延税项资产只有在未来可能有应课税额可用于利用该等暂时性差额和亏损的情况下,才会确认为可扣除的暂时性差额和未用税项损失。
已确认和未确认的递延税项资产的账面金额在每个报告日期进行审核。已确认的递延税项资产减值至不再有未来应课税溢利可供收回账面金额的程度。以前未确认的递延税项资产 在可能有未来可供收回资产的应课税利润的范围内予以确认。
递延税项资产和负债只有在法律上有权将当期税项资产与当期税项负债和递延税项资产与递延税项负债相抵销的情况下才被抵销 ;并且它们涉及同一应纳税主体或打算同时结算的不同应纳税主体 。
政府拨款
只有当公司合理地保证赠款将会收到,并且赠款的条件得到遵守时,才会确认来自政府赠款的收入。来自政府拨款的收入 在本公司确认为支出的期间内系统地确认,而拨款旨在补偿的相关成本 。政府拨款涉及澳大利亚联邦政府的新冠肺炎支持计划 ,旨在为符合条件的组织提供“现金流提升”,支持中小型组织。
当期和非当期分类
资产和负债按流动和非流动分类在财务状况表 中列示。
在下列情况下,资产被归类为流动资产:在本集团正常经营周期内预期变现或拟出售或消耗的资产;主要为交易目的而持有;预期于报告期后12个月内变现;或资产为现金或现金等价物 ,除非受限制不得在报告期后至少12个月内交换或用于清偿负债。所有其他 资产均归类为非流动资产。
当负债 预期于本集团正常经营周期内结算;主要为买卖目的而持有;于报告期后12个月内到期结算;或并无无条件权利将负债结算延迟至报告期后最少12个月 时,则分类为流动负债。所有其他负债分类为非流动负债。
递延税项资产及负债分类为非流动。
现金
现金和存放在金融机构的活期存款,其他短期、高流动性投资,原到期日不超过三个月,可随时转换为已知数额的现金,价值变动风险很小。
贸易和其他应收款
应收贸易账款初步按 公平值确认,其后采用实际利率法按摊销成本减任何预期信贷亏损拨备计量。 应收贸易账款须于30日内到期结算。
本集团已应用简化方法 计量预期信贷亏损,其使用全期预期亏损拨备。为计量预期信贷亏损,应收贸易账款已按逾期天数分组。
其他应收款项按摊销 成本减任何预期信贷亏损拨备确认。
F-10
1. 重要会计政策(续)
其他金融资产
其他金融资产初始按公允价值计量。除按公平值计入损益之金融资产外,交易成本计入初步计量。该等资产其后视乎其分类按摊销成本或公平值计量。分类 乃根据持有该等资产的业务模式及 金融资产的合约现金流量特征厘定,除非可避免会计错配。
当收取现金流量的权利 已届满或已转让,而本集团已将拥有权的绝大部分风险及回报转让时,则终止确认金融资产。 当无法合理预期收回部分或全部金融资产时,其账面价值被撇销。
财产、厂房和设备
所有物业、厂房及设备均按历史成本减折旧确认。折旧乃按估计可使用年期或(倘为租赁物业装修及若干租赁厂房及 设备)较短期间以直线法分配其成本或重估金额( 扣除其剩余价值)计算如下:
| ● | 建筑物 |
| ● | 机械设备 |
| ● | 车辆 |
| ● | 家具、配件和设备 |
家具、配件和设备包括办公室装修形式的资产 。该等资产及 其他租赁改进按其公平值确认,并按其使用年限或租赁期较短的 计提折旧,除非该实体预期在租赁期后使用该等资产。
无形资产
专利和商标
单独获得的专利和商标以历史成本显示。商标的使用寿命是无限的。专利已被评估为具有
使用寿命不确定的无形资产 或尚未使用的无形资产每年进行减值测试,如果事件或环境变化表明它们可能减值,则更频繁地进行减值测试。
研发
研究成本在发生研究成本的期间计入费用。当考虑到项目在商业上及技术上的可行性而有可能取得成功;本集团能够使用或出售资产;本集团有足够资源及意向完成开发;
且其成本可可靠计量时,则将开发成本资本化。资本化开发成本在其预期收益期间按直线摊销,即其有限寿命
使用权租赁资产
使用权资产于租赁开始日期 确认。使用权资产按成本计量,该成本包括租赁负债的初始金额(按适用情况调整)、在开始日期或之前支付的任何租赁付款(扣除收到的任何租赁奖励)、产生的任何初始直接成本 以及拆除和移除标的资产以及修复场地或 资产预计产生的成本。
使用权资产按租约未到期期间或资产的估计使用年限(以较短者为准)按直线折旧 。使用权资产 须进行减值或根据租赁负债的任何重新计量进行调整。
F-11
1. 重要会计政策(续)
本公司已选择不确认租期为12个月或以下的短期租约及低价值资产租约的使用权资产及相应的租赁负债。这些资产的租赁付款 在发生时计入损益。
租赁负债
租赁负债于租赁开始之日 确认。租赁负债初步按租赁期间支付的租赁付款现值确认,按租赁中隐含的利率或(如该利率不能轻易确定)本集团的递增借款利率贴现。租赁付款包括固定付款减去任何应收租赁奖励、取决于指数或利率的可变租赁付款、根据剩余价值担保预期支付的金额、购买期权在合理确定将发生行使时的行使价以及任何预期的终止罚款。不依赖于指数或费率的可变租赁付款在发生期间支出。
租赁负债按实际利息法按摊销成本计量。如果下列方面发生变化,则重新计量账面金额:因指数变化或使用的利率而产生的未来租赁付款 ;剩余担保;租赁期限;购买选择权的确定性和终止罚金。 当重新计量租赁负债时,对相应的使用权资产进行调整,或在完全减记使用权资产的账面金额的情况下对损益进行调整。
贸易和其他应付款
该等金额为在财政年度结束前向本集团提供的货物及服务的负债,但尚未支付。由于它们属于短期性质, 它们是按摊余成本计量的,不会贴现。这些金额是无担保的,通常在确认后30天内支付。
条文
拨备确认当本集团因过往事件而具有 现时(法律或推定)义务时,本集团很可能会被要求清偿该义务, 并可可靠地估计该义务的金额。确认为拨备的数额是在报告日期清偿当前债务所需的对价的最佳估计数,同时考虑到债务的风险和不确定性。如果货币的时间价值是重大的,则使用特定于负债的现行税前税率对拨备进行贴现。 由于时间流逝而导致的拨备增加被确认为财务成本。
员工福利
短期雇员福利
工资和薪金负债,包括预计在报告日期后12个月内全部结清的非货币福利、年假和长期服务假,按负债结清时预计支付的金额计量。
其他长期雇员福利
年假和长期服务假的负债预计不会在报告日期后12个月内结清,按截至报告日期员工提供的服务的预期未来付款的现值 使用预计单位信用法计量。 考虑预期的未来工资和薪金水平、员工离职经历和服务年限。预期未来付款 使用报告日期的公司债券市场收益率进行贴现,债券的到期日期限和币种与估计的未来现金流出尽可能接近 。
退休福利义务
根据澳大利亚法律,本集团所有员工均有权获得养老金 供款。员工指定的养老金计划的缴费将在发生缴费的 期间支出。
F-12
1. 重要会计政策(续)
基于股份的支付
向员工提供股权结算的补偿福利。
股权结算交易是提供给员工以换取提供服务的股票的奖励, 股票的表演权或期权。
股权结算交易的成本于授出日按公允价值计量。公允价值采用Black-Scholes期权定价模型独立厘定,该模型考虑了 行使价、期权期限、摊薄的影响、授出日的股价及相关股份的预期价格波动、期权期限内的预期股息率及无风险利率,以及非归属条件(即 不决定本集团是否接受使雇员有权收取付款的服务)。用于计算公允价值的Black-Scholes期权定价模型的投入被归类为AASB 13(IFRS 13)公允价值层次结构下的第三级投入。不考虑任何其他归属条件。
股权结算交易的成本确认为支出,并于归属期间相应增加股本。累计损益费用是根据授予日的公允价值、可能授予的奖励数量的最佳估计以及归属期限的过期部分计算的。当期在损益中确认的金额是在每个报告日期计算的累计金额减去以前期间已确认的金额。
在厘定公允价值时,会考虑市场情况。因此,无论是否满足市场条件,只要满足所有其他条件,任何受市场条件制约的奖励都将被视为授予。
如果修改了股权结算奖励,则至少应确认一笔费用,就好像未进行修改一样。于剩余归属期间内,如有任何修订增加以股份为本的补偿利益于修订日期的总公允价值,则会确认额外开支。
如果非归属条件在集团或员工的控制范围内,则未能满足该条件将被视为取消。如果条件不在本集团或员工的控制范围内,且在归属期间未得到满足,则奖励的任何剩余费用将在剩余的 归属期间确认,除非奖励被没收。
如果股权结算奖励被取消, 将被视为在取消之日已归属,任何剩余费用将立即确认。如果新的替代裁决 取代了已取消的裁决,则被取消的新裁决将被视为修改。
公允价值计量
当一项资产、负债或权益工具(金融或非金融)为确认或披露目的而按公允价值计量时,公允价值是基于在计量日期在市场参与者之间的有序交易中出售资产或权益工具或支付以转移负债而收到的价格 ;并假设交易将在以下其中之一发生:在主要市场;或在没有主要市场的情况下,在最有利的市场进行。
F-13
1. 重要会计政策(续)
公允价值是根据市场参与者在为资产、负债或权益工具定价时使用的假设来计量的,假设他们的行为符合他们的经济最佳利益。 对于非金融资产,公允价值计量基于其最高和最佳使用。采用适用于 情况且有足够数据以计量公允价值的估值技术,以最大限度地利用相关可观察到的投入,并最大限度地减少使用不可观察到的投入。
按公允价值计量的资产、负债和权益工具按公允价值划分为三个等级,公允价值等级反映了计量中使用的投入的重要性。对于初始确认后按公允价值计量的资产和负债,在每个报告日期审查分类,并根据对对公允价值计量有重要意义的最低投入等级的重新评估确定等级之间的转移。 公允价值等级的三个等级如下:
| ● | 第1级- 对相同的资产或负债在活跃市场上报价(未调整)市场价格; |
| ● | 第2级-直接或间接可观察到对公允价值计量意义重大的最低水平投入的 估值技术;以及 |
| ● | 第3级- 估值技术,对公允价值计量有重要意义的最低水平投入无法观察到。 |
对于经常性和非经常性公允价值计量,当无法获得内部专业知识或估值被视为重要时,可使用外部估值师。外部评估师是根据市场知识和声誉选择的。如果一项资产或负债的公允价值从一个时期到另一个时期有重大变化,则进行分析,包括核实在最新估值中应用的主要投入 并在适用的情况下与外部数据来源进行比较。
已发行资本
普通股被归类为股权。
直接可归因于发行新股或购股权的增量成本在权益中显示为从收益中扣除税款后的净额。
F-14
1. 重要会计政策(续)
分红
股息在 财政年度宣布时确认。
每股亏损
每股基本亏损
每股基本亏损的计算方法为: IncanneX Healthcare Limited所有者应占利润(不包括普通股以外的任何股本服务成本)除以财政年度内已发行普通股的加权平均数(经财政年度内发行的普通股的红利因素调整后)。这些值在附注6中列出。
稀释每股亏损
每股摊薄亏损调整在厘定每股基本盈利时所使用的数字 ,以计及与摊薄潜在普通股相关的利息及其他融资成本的税后影响 ,以及假设已免费发行的股份数量与摊薄潜在普通股有关的加权平均数 。这些值在附注6中列出。
商品和服务税('GST') 和其他类似税收
收入、支出和资产在扣除相关GST后确认,除非所产生的GST无法从税务机关收回。在这种情况下,它被确认为资产购置成本的一部分或费用的一部分。
应收及应付款项包括 应收或应付的GST金额。可从税务机关收回的商品及服务税净额计入财务状况表的其他应收款项。
现金流量按总额基准呈列。投资或融资活动产生的可从税务机关收回或应向税务机关支付的现金流的 商品及服务税部分 作为经营现金流列示。
披露的承诺和或有事项不包括可从税务机关收回或应付的GST 金额。
采用新的和修订的标准
合并实体已采纳澳大利亚会计准则委员会(“AASB”)发布的所有 新的或修订的会计准则和解释,该等准则和解释对本报告期具有强制性 。
尚未强制执行的任何新的或修订的会计准则或解释 尚未及早采用。
已颁布但尚未生效的会计准则和解释
最近颁布或修订但尚未生效且本集团尚未于截至2023年6月30日止年度报告期间 采纳且对该等账目的披露并不重大的澳大利亚会计准则及诠释 。
F-15
2.关键会计判断、估计和假设
编制综合财务报表需要管理层作出影响综合财务报表所呈报金额之判断、估计及假设。管理层持续评估其有关资产、负债、或然负债、 收入及开支的判断及估计。管理层根据过往经验及其他各种因素作出判断、估计及假设, 包括管理层相信在有关情况下属合理的对未来事件的预期。由此产生的会计判断 和估计很少与相关的实际结果相同。具有 重大风险导致下一个财政年度资产及负债账面值须作出重大调整之判断、估计及假设讨论如下。
收购APIRx Pharmaceuticals
本集团已确定,于二零二二年八月收购APIRx Pharameticals(“APIRx”)不被视为业务合并,因为所收购的APIRx的一系列活动及资产不符合AASB第3号业务合并项下业务的定义。因此,该交易已 作为资产购置入账。
在资产收购中,所收购的资产 根据交易成本及其相对公允价值分配账面价值。交易成本乃 根据发行作为代价之股份之公平值厘定(根据下文以分享为基础之付款交易会计政策 )。根据AASB 112所得税的初始确认豁免 ,不会产生与所收购资产和所承担负债相关的递延税项。
此外,收购时并无产生商誉,而收购的交易成本计入资产的资本化成本。在确定交易何时是资产 收购而不是业务时,需要作出重大判断,以评估所收购的资产是否构成符合AASB 3的业务。根据AASB第3号,业务是一组能够为提供回报而进行或管理的综合活动和资产,包括投入和过程,当应用于这些投入时,有能力创造产出。
基于股份的支付交易
本集团参考权益工具于授出日期之公平值计量与雇员及第三方进行之权益结算 交易之成本。 公平值乃采用三项式或柏力克-舒尔斯模式厘定,并计及 工具授出之条款及条件。有关以权益结算以股份为基础之付款之会计估计及假设将不会对下一个年度报告期间之资产及负债账面值产生影响 ,但可能影响损益及权益。
使用寿命不确定或尚未可供使用的无形资产
本集团根据附注1所述之会计政策,每年(或倘 有事件或情况变动显示出现减值,则更频密地)测试具有无限可使用年期之无形资产或尚未可供使用之无形资产 是否出现任何减值。可收回 金额已使用特许权使用费减免法确定。这些计算需要使用假设,包括估计 贴现率、特许权使用费率和估计未来现金流的增长率。更多信息见附注12。
3.其他收入
| 已整合 | ||||||||
| 2023 | 2022 | |||||||
| 其他收入(时间点) | $ | $ | ||||||
| 利息 | ||||||||
| 可退还的研发税收抵免 | ||||||||
F-16
4.细分市场信息
确定可报告的运营区段
AASB 8(IFRS 8)经营分部要求根据首席执行官定期审查的有关集团组成部分的内部报告确定经营 分部,以便向分部分配资源并评估其绩效。
本集团之经营分部乃 参考首席执行官就本集团 经营及营运资金分配作出决定时所使用之每月管理账目而厘定。鉴于本集团的规模及性质,董事会整体上已被确定为 首席执行官。
根据
AASB 8(IFRS 8)中包含的量化阈值,截至2023年6月30日止财政年度,本集团组织为
| 1. | 研究和开发使用迷幻药和治疗精神健康障碍的疗法。这项活动于 年内开始。于本年度,业务完全包括研究及开发活动,包括临床试验。 |
| 2. | 研究 和开发药用大麻素产品的用途。年内,本集团继续研究及开发其产品及 系列产品,包括进一步的临床试验。 |
| 3. | 公司运营,包括组织管理、资本管理和资源管理。收入包括财务 收入和其他收入。 |
该集团仅有
本集团该等分部之整体收入及业绩
载于综合全面收益表,而本集团之整体资产及负债则载于综合财务状况表。
| 2023年6月30日 | 迷幻产品 | 大麻素产品 | 公司 | 已整合 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 来自外部客户的收入 | ||||||||||||||||
| 利息收入 | ( | ) | ||||||||||||||
| 其他收入 | ||||||||||||||||
| 其他费用 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 所得税后分部亏损 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 细分资产 | ||||||||||||||||
| 分部负债 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 2022年6月30日 | 迷幻产品 | 大麻类产品 | 公司 | 已整合 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 来自外部客户的收入 | ||||||||||||||||
| 利息收入 | ||||||||||||||||
| 其他收入 | ||||||||||||||||
| 其他费用 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 所得税后分部亏损 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 细分资产 | ||||||||||||||||
| 分部负债 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
F-17
5.所得税
| 已整合 | ||||||||
| 2023 | 2022 | |||||||
| $ | $ | |||||||
| 税前会计亏损 | ( | ) | ( | ) | ||||
| 所得税优惠,适用税率为 | ||||||||
| 不可扣除的费用 | ( | ) | ( | ) | ||||
| 免税收入 | ||||||||
| 未确认的递延税项资产 | ( | ) | ( | ) | ||||
| 所得税优惠 | ||||||||
| 未确认的递延税金资产 | ||||||||
| 未在财务报表中确认的递延税项资产: | ||||||||
| 未用税损 | ||||||||
| 未确认税收优惠净额为 | ||||||||
该潜在递延税项利益并未在财务报表中确认为资产,因为在美国会计准则第112号所得税(国际会计准则第12号)的背景下,收回该资产的可能性不大。
只有在以下情况下才能实现好处:
| a) | 公司获得的未来应评税收入的性质和数额足以使收益得以实现。 |
| b) | 公司符合法律规定的抵扣条件;以及 |
| c) | 税务法规的变更不会对本公司实现这一利益产生不利影响。 |
6.每股亏损
| 已整合 | ||||||||
| 2023 | 2022 | |||||||
| $ | $ | |||||||
| 每股基本亏损--每股亏损 | ( | ) | ( | ) | ||||
| 每股基本亏损 | ||||||||
| 计算每股基本亏损时使用的普通股亏损和加权平均数如下: | ||||||||
| 本年度综合亏损总额 | ( | ) | ( | ) | ||||
| --普通股加权平均数(个) | ||||||||
该公司指出,稀释后每股亏损与基本每股亏损相同。
F-18
7.派发股息
本公司尚未宣布截至2023年6月30日的年度的股息(2022年:$).
8.现金及现金等价物
| 已整合 | ||||||||
| 2023 | 2022 | |||||||
| $ | $ | |||||||
| 银行现金和手头现金 | ||||||||
| 银行现金以每日银行存款利率为基础,以浮动利率赚取利息。 | ||||||||
| 本年度亏损与经营活动现金流量净额的对账: | ||||||||
| 所得税后亏损 | ( | ) | ( | ) | ||||
| 将净收入与业务活动中使用的现金净额进行调整: | ||||||||
| 基于股份的支付 | ||||||||
| 折旧及摊销 | ||||||||
| 外汇收益 | ( | ) | ( | ) | ||||
| 净资产和净负债变动情况: | ||||||||
| 应收账款(增加)/减少 | ( | ) | ||||||
| (增加)/减少其他流动资产 | ( | ) | ||||||
| 贸易应付款和应计费用增加/(减少) | ||||||||
| 其他负债增加/(减少) | ||||||||
| 运营中使用的现金流 | ( | ) | ( | ) | ||||
9.贸易和其他应收款(当期)
| 当前 | 已整合 | |||||||
| 2023 | 2022 | |||||||
| $ | $ | |||||||
| 可收回的商品及服务税 | ||||||||
预期信贷损失
本集团采用美国会计准则第9号(国际财务报告准则第9号)简化模型,以确认所有应收贸易账款的终身预期信贷损失,因为该等项目并无重大融资成分。 在计量预期信贷亏损时,由于应收贸易账款具有共同信贷风险特征,因此已按集体评估。它们已根据过期天数和客户的地理位置进行了分组。
10.其他资产(流动)
| 提前还款1 | ||||||||
| 办公室租赁债券 | ||||||||
| 1 |
F-19
11.财产、厂房和设备(非现货)
| 家具、配件和 设备 | 总计 | |||||||
| $ | $ | |||||||
| 截至2023年6月30日止年度 | ||||||||
| 期初净账面金额 | ||||||||
| 加法 | ||||||||
| 折旧费 | ( | ) | ( | ) | ||||
| 期末账面净额 | ||||||||
| 2023年6月30日 | ||||||||
| 成本 | ||||||||
| 累计折旧和减值 | ( | ) | ( | ) | ||||
| 账面净额 | ||||||||
12.无形资产
| 专利 | 商标 | 其他 无形资产3 | 总公允价值 | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 截至2023年6月30日止年度 | ||||||||||||||||
| 期初净账面金额 | ||||||||||||||||
| 收购资产1 | ||||||||||||||||
| 摊销费用2 | ||||||||||||||||
| 期末账面净额 | ||||||||||||||||
| 2023年6月30日 | ||||||||||||||||
| 成本 | ||||||||||||||||
| 累计摊销和减值2 | ||||||||||||||||
| 账面净额 | ||||||||||||||||
| 1 | |
| 2 | |
| 3 |
F-20
12.无形资产(续)
对寿命不确定或尚未使用的无形资产进行减值测试
会计准则规定,对于专利和商标等无限期无形资产,必须 每年进行减值测试。此外,公司还必须在每个报告日期进行评估 是否有任何迹象表明资产可能减值,如果有,则进行减值测试。
可收回金额采用特许权使用费宽免(‘RFR’)估值方法厘定。公允价值在很大程度上使用第2级和第3级投入AASB 13公允价值计量。 主要假设概述如下。
这些计算反映了13年的收入预测,并需要使用假设,包括估计的特许权使用费费率、税率、估计的贴现率和预期的使用寿命。
十三年收入预测是基于集团对目前处于临床前和活跃临床阶段的已收购候选药物的十三年预测,这些候选药物是Medchew、Chewell、CannQuit O、CannQuit N和Renecann,并已提交给
审计委员会。13年的预测是基于20项已授权专利的每一项的到期日期,已授权专利的平均使用寿命约为
| 专利 | 商标 | |||||||
| 版税税率1 | % | % | ||||||
| 终端增长率2 | % | |||||||
| 税后贴现率3 | % | % | ||||||
| 贴现率溢价4 | % | % | ||||||
| 税率5 | % | % | ||||||
| 复合年收入增长率6 | % | % | ||||||
| 1 |
| 2 |
| 3 |
| 4 |
| 5 |
| 6 |
于结算日并无减值迹象。
F-21
13.租契
| 已整合 | ||||||||
| 2023 | 2022 | |||||||
| $ | $ | |||||||
| 在财务状况表中确认的金额 | ||||||||
| 使用权资产 | ||||||||
| 使用权资产 1 | ||||||||
| 折旧 | ( | ) | ||||||
| - | ||||||||
| 1 |
租赁负债
| 当前 | ||||||||
| 非当前 | ||||||||
于全面收益表确认之金额
| 使用权资产折旧费用 | ||||||||
| 财务费用净额 | ||||||||
14.贸易及其他应付款项(流动)
| 已整合 | ||||||||
| 2023 | 2022 | |||||||
| $ | $ | |||||||
| 贸易应付款 | ||||||||
| 应计费用 | ||||||||
| 员工休假权利 | ||||||||
F-22
15.已发行股本
| 已整合 | ||||||||
| 2023 | 2022 | |||||||
| $ | $ | |||||||
已整合 | ||||||||||||||||
| 2023 | 2023 | 2022 | 2022 | |||||||||||||
| $ | 不是的。的股份 | $ | 不是的。的股份 | |||||||||||||
| (A)普通股--年度内的变动情况 | ||||||||||||||||
| 在年初 | ||||||||||||||||
| 新股发行-配售1 | ||||||||||||||||
| 发行新股-收购2 | ||||||||||||||||
| 发行新股-雇员及董事 | ||||||||||||||||
| 期权的行使 | ||||||||||||||||
| 以股份代替顾问费3 | ||||||||||||||||
| 股票发行成本4 | ( | ) | ( | ) | ||||||||||||
| 在年底 | ||||||||||||||||
| 1 | |
| 2 | |
| 3 | |
| 4 |
16.储备
| 基于权益的保费准备金 | 已整合 | |||||||
| 2023 | 2022 | |||||||
| $ | $ | |||||||
| 2022年7月1日的结余 | ||||||||
| 发给顾问的期权1 | ||||||||
| 新期权的问题--配售2 | ||||||||
| 发行给管理层和董事的股权工具3 | ||||||||
| 2023年6月30日 | ||||||||
| 1 | |
| 2 | |
| 3 | |
股权溢价准备金用于记录为筹集资本而发行的股权的价值,以及用于以股份为基础的付款。
F-23
17.基于股份的支付方式
公司可能会不时向其员工、董事或顾问发行股票 证券(即股票、期权或绩效权利),以使绩效奖励 与公司增长和战略目标的实现更紧密地结合起来。如果收款人是本公司的董事,则在向任何董事发行任何股权证券之前,必须根据澳交所上市规则寻求股东的批准。
已发行股份的公允价值
向雇员发行股份的公允价值是根据股份于授出日的收市价厘定,并于归属期间列支。本年度向雇员及董事发行的股份公允价值合共为$
选项
截至2023年6月30日至2022年6月30日,未偿还期权的行权价在1美元至1美元之间。
截至2023年6月30日,
授予日的公允价值是使用三项式定价或Black-Scholes期权模型独立确定的,该模型考虑了要行使的任何价格、期权或权利的期限、授予日的股价、标的股份的价格波动性以及期权或权利的 期限的无风险利率。下表中的已摊销公允价值为已分配给当期的公允价值总额的比例,余额将在未来期间摊销。
选项 | 数 | 授予日期 | 期满 日期 | 锻炼 价格 | 总计 公允价值 | |||||||||||
| 授予董事的期权 | ||||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 授予第三方的期权 | ||||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | |||||||||||||||
| 选项总数 | $ | |||||||||||||||
F-24
17.以股份为基础的付款(续)
在截至2022年6月30日的年度内,向员工和顾问发放了以下股票期权,作为以股票为基础的付款:
选项 | 数 | 授予日期 | 期满 日期 | 锻炼 价格 | 总计 公允价值 | |||||||||||
| 授予董事的期权 | ||||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 授予员工的期权 | ||||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 选项总数 | $ | |||||||||||||||
授予日的公允价值是使用三项式定价或Black-Scholes期权模型独立确定的,该模型考虑了要行使的任何价格、期权或权利的期限、授予日的股价、标的股份的价格波动性以及期权或权利的 期限的无风险利率。根据美国会计准则第13号(IFRS 13)的公允价值等级,用于计算公允价值的三项式和Black-Scholes期权定价模型的投入被归类为第三级投入。
| $1.00 选项 | $1.50 选项 | $0.612 选项 | $0.69 选项 | $0.765 选项 | ||||||||||||||||
| 5月31日至24日 | 5月31日至24日 | 4-8月25日 | 4-8月25日 | 4-8月25日 | ||||||||||||||||
| 数 | ||||||||||||||||||||
| 预期波动率下降(%) | % | % | % | % | % | |||||||||||||||
| 无风险利率(%) | % | % | % | % | % | |||||||||||||||
| 期权的预期寿命(年) | ||||||||||||||||||||
| 行权价格(分) | ||||||||||||||||||||
| 授予日期股价(美分) | ||||||||||||||||||||
| 归属日期 | ||||||||||||||||||||
F-25
17.以股份为基础的付款(续)
*授予的股权结算股份 期权的公允价值是在授予日使用Black-Scholes期权模型估计的,同时考虑到授予期权的条款和条件 截至2022年6月30日的年度如下:
| $0.26选项 | $0.31 选项 | $0.35 选项 | $0.26 选项 | $0.31 选项 | $0.35 选项 | $0.26 选项 | $0.31 选项 | $0.35 选项 | ||||||||||||||||||||||||||||
| 01-7-25 | 1-7-26 | 7月1日至27日 | 1-7-26 | 7月1日至27日 | 01-7-28 | 01-7-25 | 1-7-26 | 7月1日至27日 | ||||||||||||||||||||||||||||
| 数 | ||||||||||||||||||||||||||||||||||||
| 预期波动率下降(%) | % | % | % | % | % | % | % | % | % | |||||||||||||||||||||||||||
| 无风险利率(%) | % | % | % | % | % | % | % | % | % | |||||||||||||||||||||||||||
| 期权的预期寿命(年) | ||||||||||||||||||||||||||||||||||||
| 行权价格(分) | ||||||||||||||||||||||||||||||||||||
| 授予日期股价(美分) | ||||||||||||||||||||||||||||||||||||
| 归属日期 | ||||||||||||||||||||||||||||||||||||
期权的预期寿命基于历史数据,并不一定指示可能发生的锻炼模式。预期波动率反映了这样一种假设,即历史波动率是未来趋势的指示性指标,这也可能不一定是实际结果。
普通股
有几个
表演权
截至2023年6月30日及2022年6月30日止年度并无业绩股份及业绩权利。
F-26
18.核数师的薪酬
| 已整合 | 已整合 | |||||||
| 2023 | 2022 | |||||||
| $ | $ | |||||||
| 审计或审查公司的财务报告 | ||||||||
| 核数师收到和应收的金额: | ||||||||
| 审计服务-PKF布里斯班审计 | ||||||||
| 审计服务--HLB Mann Judd | ||||||||
| 审计服务-Withum Smith&Brown(美国审计师) | ||||||||
Withum Smith&Brown,PC被任命为美国审计师 ,为公司证券在美国上市做准备。
19.金融工具
本集团的主要金融工具包括现金及短期存款。
这些金融工具的主要目的是为本集团的业务筹集资金。本集团有多项其他财务负债,例如贸易应付账款,而这些负债 直接来自其业务。本集团的政策是,并于年内一直在检讨中,即不得进行任何金融工具交易。本集团金融工具产生的主要风险包括现金流利率风险、流动性风险和信用风险。董事会审查并同意管理每一项风险的政策,这些政策概述如下 。
(A)利率风险
本集团面对市场利率变动的风险 主要与本集团的浮息短期存款有关。
本集团对金融资产及金融负债的利率风险,详见本附注的敏感度分析部分。
(B)敏感性分析
于2023年期间,若利率较实际利率高或低50个基点 个基点,而所有其他变数保持不变,则本年度的税后业绩将会有非实质性的变化。对股本的影响应该是一样的。
(C)公允价值净值
现金及现金等价物 及无息货币金融资产及负债的公允净值与其账面价值大致相同。
(D)商品价格风险
本集团对价格风险的风险敞口微乎其微。
F-27
19.金融工具(续)
(E)信贷风险
本集团并无重大信贷风险集中 。
至于本集团其他金融资产(包括现金及现金等价物、可供出售金融资产及若干衍生工具)所产生的信贷风险, 本集团因交易对手违约而产生的信贷风险,最高风险敞口等于该等工具的账面金额 。
由于本集团只与公认的第三方进行交易,因此不需要抵押品。
(F)流动性风险
本集团的目标是透过发行股份及发行可换股票据,在持续融资与灵活性之间维持平衡 。
| 描述 | 不到 个月 | 1至3 个月 | 3个月 到1年 | 1至5 年份 | 总计 | |||||||||||||||
| 已整合 | $ | $ | $ | $ | $ | |||||||||||||||
| 应付款和应计项目 | ||||||||||||||||||||
| 描述 | 不到 个月 | 1至3 个月 | 3个月 到1年 | 1至5 年份 | 总计 | |||||||||||||||
| 已整合 | $ | $ | $ | $ | $ | |||||||||||||||
| 应付款和应计项目 | ||||||||||||||||||||
(G)资本管理
本集团管理资本的目标 是保障其持续经营的能力,以便继续为股东提供回报,并为其他利益相关者提供利益。由于本集团过往活动的性质为矿产勘探,故无法随时获得信贷安排,因此不受任何外部资本规定的规限,而本集团资金的主要来源 为股权融资及无抵押可换股票据。因此,本集团资本风险管理的目标是平衡目前的营运资金状况与满足勘探计划和企业管理费用的要求。这是通过保持适当的流动资金以满足预期的运营要求来实现的,以期根据需要启动融资。
20.承付款和意外开支
于二零二三年六月三十日,本集团并无承担或或然负债。
F-28
21.关键管理人员薪酬及关联方披露
Incannex Healthcare Limited于年内之主要管理人员为:
特洛伊·瓦伦丁
彼得·维德斯
乔尔·莱瑟姆
乔治·阿纳斯塔索夫
罗伯特·克拉克(于二零二二年八月十七日获委任)
| 2023 | 2022 | |||||||
| $ | $ | |||||||
| 短期雇员福利 | ||||||||
| 离职后福利 | ||||||||
| 基于股份的支付 | ||||||||
| KMP薪酬总额 | ||||||||
与相关实体的交易
关联方之间的交易按商业 条款及条件进行,除非另有说明,否则该等条款及条件并不比其他方可获得的条款及条件优惠。
年内, (2022: $
年内,$
年内,华伦丁先生的薪酬为
22.受控实体的详细信息
综合财务报表包括IncanneX Healthcare Limited(“IHL”)及其全资附属公司IncanneX Pty Ltd(“IXPL”)、APIRx PharmPharmticals、
LLC(“APIRx”)及PenecenneX Pty Ltd(“PXPL”)的财务报表。IXPL在澳大利亚注册成立,IHL拥有
23.报告日期之后的事件
自本财政年度结束以来,未发生更多重大事件。
F-29
24.母实体披露
| 财务状况表 | 2023 | 2022 | ||||||
| 财务状况 | $ | $ | ||||||
| 流动资产 | ||||||||
| 非流动资产 | ||||||||
| 总资产 | ||||||||
| 流动负债 | ( | ) | ( | ) | ||||
| 非流动负债 | ( | ) | ||||||
| 总负债 | ( | ) | ( | ) | ||||
| 净资产 | ||||||||
| 已发行资本 | ||||||||
| 储量 | ||||||||
| 累计损失 | ( | ) | ( | ) | ||||
| 股东权益 | ||||||||
母实体的或有事项
确实有
对母公司的担保
确实有
F-30
综合全面收益表
截至2022年6月30日止的年度
| 已整合 | ||||||||||
| 2022年6月30日 | 6月30日 2021 | |||||||||
| 备注 | $ | $ | ||||||||
| 收入 | 3(a) | |||||||||
| 其他收入 | 3(b) | |||||||||
| 总收入和其他收入 | ||||||||||
| 产品成本 | ( | ) | ( | ) | ||||||
| 行政管理费用 | ( | ) | ( | ) | ||||||
| 广告和投资者关系 | ( | ) | ( | ) | ||||||
| 坏账支出 | ( | ) | ||||||||
| 研发成本 | ( | ) | ( | ) | ||||||
| 合规、法律和监管 | ( | ) | ( | ) | ||||||
| 基于股份的支付 | 14 | ( | ) | ( | ) | |||||
| 入住费 | ( | ) | ( | ) | ||||||
| 工资和员工福利支出 | ( | ) | ( | ) | ||||||
| 总费用 | ( | ) | ( | ) | ||||||
| 税前亏损 | ( | ) | ( | ) | ||||||
| 所得税优惠 | 5 | |||||||||
| 税后亏损 | ( | ) | ( | ) | ||||||
| 其他综合收益 | ||||||||||
| 本年度综合亏损总额 | ( | ) | ( | ) | ||||||
| 每股收益 | 6 | |||||||||
| 每股基本亏损(每股美分) | ( | ) | ( | ) | ||||||
| 每股摊薄亏损(每股美分) | ( | ) | ( | ) | ||||||
附注构成这些财务报表的一部分
F-31
综合财务状况表
截至2022年6月30日
| 已整合 | ||||||||||
| 2022年6月30日 | 6月30日 2021 | |||||||||
| 备注 | $ | $ | ||||||||
| 资产 | ||||||||||
| 流动资产 | ||||||||||
| 现金和现金等价物 | 8 | |||||||||
| 贸易和其他应收款 | 9 | |||||||||
| 其他资产 | 10 | |||||||||
| 流动资产总额 | ||||||||||
| 总资产 | ||||||||||
| 负债 | ||||||||||
| 流动负债 | ||||||||||
| 贸易和其他应付款 | 11 | |||||||||
| 流动负债总额 | ||||||||||
| 总负债 | ||||||||||
| 净资产 | ||||||||||
| 权益 | ||||||||||
| 已发行资本 | 12 | |||||||||
| 储量 | 13 | |||||||||
| 累计损失 | ( | ) | ( | ) | ||||||
| 净股本 | ||||||||||
附注构成这些财务报表的一部分
F-32
综合权益变动表
截至2022年6月30日止的年度
| 已整合 | 已发行 资本 | 权益 储备 | 累计 损失 | 总计 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 2020年6月30日的结余 | ( | ) | ||||||||||||||
| 行使的期权 | ||||||||||||||||
| 发给顾问的期权 | ||||||||||||||||
| 基于股份的支付 | ||||||||||||||||
| 股票发行成本 | ( | ) | ( | ) | ||||||||||||
| 本年度综合亏损 | ( | ) | ( | ) | ||||||||||||
| 2021年6月30日的结余 | ( | ) | ||||||||||||||
| 行使的期权 | ||||||||||||||||
| 基于股份的支付 | ||||||||||||||||
| 股票配售 | ||||||||||||||||
| 向顾问发行的股票 | ||||||||||||||||
| 股票发行成本 | ( | ) | ( | ) | ||||||||||||
| 本年度综合亏损 | ( | ) | ( | ) | ||||||||||||
| 2022年6月30日的结余 | ( | ) | ||||||||||||||
附注构成这些财务报表的一部分
F-33
合并现金流量表
截至2022年6月30日止的年度
| 已整合 | ||||||||||
| 2022 | 2021 | |||||||||
| 备注 | $ | $ | ||||||||
| 经营活动的现金流 | ||||||||||
| 来自客户的收据 | ||||||||||
| 来自其他收入的收入 | ||||||||||
| 向供应商和员工付款 | ( | ) | ( | ) | ||||||
| 收到的利息和其他收入 | ||||||||||
| 经营活动中使用的现金净额 | 8 | ( | ) | ( | ) | |||||
| 投资活动产生的现金流 | ||||||||||
| 出售附属公司所得款项 | ||||||||||
| 处置财产、厂房和设备所得收益 | ||||||||||
| 投资活动的现金净额 | ||||||||||
| 融资活动产生的现金流 | ||||||||||
| 发行股份所得收益(扣除成本) | ||||||||||
| 融资活动的现金净额 | ||||||||||
| 现金及现金等价物净增加情况 | ||||||||||
| 年初现金及现金等价物 | ||||||||||
| 汇率波动对现金持有的影响 | ||||||||||
| 年终现金及现金等价物 | 8 | |||||||||
附注构成这些财务报表的一部分
F-34
财务报表附注
截至2022年6月30日止的年度
1.重大会计政策
在编制综合财务报表时采用的主要会计政策如下。除非另有说明,这些政策一直适用于提交的所有年度 。
运营的性质
IncanneX Healthcare Limited(“本公司”) 及其合并附属公司(统称“本集团”)是一家临床阶段药物开发公司, 正在开发独特的医用大麻药物产品和迷幻药物疗法。公司的普通股在澳大利亚证券交易所(“澳大利亚证券交易所”)交易。该公司的注册办事处位于澳大利亚维多利亚州Docklands3008号Dockland Drive,401号12层Suite 15。
截至2022年6月30日止财政年度,集团除所得税后的综合亏损总额为$
采用新的或修订的会计准则和解释
本集团已采纳国际会计准则委员会(“IASB”)颁布的所有新的或经修订的会计准则及诠释,该等准则及诠释于本报告期内属强制性的 。
尚未强制执行的任何新的或修订的会计准则或解释 尚未及早采用。
历史成本惯例
综合财务报表乃根据历史成本惯例编制,但(如适用)通过损益按公允价值重估金融资产及负债、通过其他全面收益及衍生金融工具按公允价值重估金融资产除外。
关键会计估计
编制合并财务报表需要使用某些关键会计估计数。它还要求管理层在应用本集团会计政策的过程中作出判断。涉及较高程度的判断或复杂性的领域,或假设和估计对合并财务报表具有重大意义的领域,在附注2中披露。
比较句
如有必要,已对比较信息进行了重新分类和重新定位,以与本年度的披露保持一致。
合规声明
董事会已于2022年10月批准 发布这些综合财务报表。
合并财务报表符合国际会计准则理事会(IASB)发布的《国际财务报告准则》(IFRS)。
F-35
1. 重要会计政策(续)
父实体信息
根据国际财务报告准则第10号合并财务 报表,该等综合财务报表仅载列本集团的业绩。关于上级实体的补充信息在附注21中披露。
合并原则
综合财务报表包括 本公司所有附属公司于2022年及2021年6月30日的资产及负债,以及截至该等年度的所有附属公司的业绩。IncanneX Healthcare Limited及其附属公司在本综合财务报表中统称为“本集团”。所有受控实体的详情载于附注19。
子公司是指集团拥有控制权的所有实体。当本集团因参与某实体而面临或有权获得可变回报时,本集团控制该实体,并有能力通过其指导该实体活动的权力影响该等回报。子公司自控制权移交给本集团之日起 全面合并。它们从控制权停止之日起解除合并。
集团中实体之间的公司间交易将被取消。附属公司的会计政策已于有需要时作出更改,以确保与本集团采纳的政策保持一致。
如本集团失去对附属公司的控制权,则终止确认附属公司的资产,包括商誉、负债及非控股权益,以及在权益中确认的任何累计折算差额。本集团确认所收取代价的公允价值及保留的任何投资的公允价值,连同任何损益。
运营细分市场
营运分部按“管理方法”于附注4列示,所载资料与向行政总裁提交的内部报告相同。首席执行官负责为各业务部门分配资源,并评估其业绩。
外币折算
合并财务报表以澳元列报,澳元是公司的职能货币和列报货币。
外币交易
外币交易使用交易日期的现行汇率折算为 澳元。结算该等交易所产生的汇兑损益,以及按财政年终汇率折算以外币计价的货币资产和负债所产生的汇兑损益,在损益中确认。
收入确认。
本公司确认收入,以描述将商品和服务转让给客户的金额,该金额反映了本公司预期有权通过以下步骤换取这些商品和服务的对价:
| ● | 确定 与客户的合同; |
| ● | 确定 合同中的履行义务; |
| ● | 确定 成交价; |
| ● | 将 交易价格分配给履约义务;以及 |
| ● | 在公司履行履约义务时确认 收入。 |
收入可以随着履行义务的履行而获得 ,也可以在实体获得支付权、客户拥有资产以及相关的重大所有权风险和回报,以及客户已接受资产的时间点获得。
公司与客户的安排 可能包括多项履约义务。当合约涉及多项履约责任时,本公司评估每项 履约责任是否独立,并应根据国际财务报告准则第15号“客户合约收入” 作为独立会计单位入账。
F-36
1. 重要会计政策(续)
本公司根据其整体定价目标和市场情况确定独立销售价格。考虑的重要定价实践包括: 折扣实践、我们交易的规模和数量、我们的营销策略、历史销售额和合同价格。独立销售价格的确定 是通过与管理层协商并经管理层批准,并考虑到我们的入市战略 。随着公司进入市场战略的发展,公司未来可能会修改其定价做法,这可能会导致相对独立销售价格的变化。
本公司根据最能描述收入和现金流 的性质、金额、时间和不确定性如何受经济因素影响的类别, 对来自客户合同的收入进行分解。截至2022年6月30日及2021年6月30日止年度,本公司仅确认来自大麻素油销售的收入。
公司在正常的28天商业条款内开具发票后收到客户的付款 。如果客户被明确确定为信用风险,则停止确认收入 ,但已收取的费用除外。
其他收入
其他收入在收到时确认 或在确定收受权利时确认。其他收入主要包括赠款收入和利息收入。
利息收入
利息收入采用有效利息法确认为利息应计项目。这是一种计算金融资产摊销成本并使用实际利率分配相关期间利息收入的方法,实际利率是通过金融资产的预期寿命将估计未来现金收入 准确贴现至金融资产的账面净值的比率。
所得税
该期间的所得税支出或利益是指根据每个司法管辖区适用的所得税税率对该期间的应纳税所得额支付的税款,并按可归因于暂时性差异、未使用的税项损失和以前报告年度已确认的调整的递延税项资产和负债变动进行调整(如适用)。
递延税项资产和负债按资产收回或负债清偿时预计适用的税率确认 暂时性差异,根据已颁布或实质颁布的税率确认,但以下情况除外:
| ● | 在非企业合并的交易中,因初始确认商誉或资产或负债而产生的递延所得税资产或负债,并且在交易时不影响会计和应税利润; |
| ● | 当应课税暂时性差异与附属公司、联营公司或合资企业的权益相关,且转回的时间可以控制,且暂时性差异很可能在可预见的将来不会转回。 |
F-37
1. 重要会计政策(续)
递延税项资产只有在未来可能有应课税额可用于利用该等暂时性差额和亏损的情况下,才会确认为可扣除的暂时性差额和未用税项损失。
已确认和未确认的递延税项资产的账面金额在每个报告日期进行审核。已确认的递延税项资产减值至不再有未来应课税溢利可供收回账面金额的程度。以前未确认的递延税项资产 在可能有未来可供收回资产的应课税利润的范围内予以确认。
递延税项资产和负债只有在法律上有权将当期税项资产与当期税项负债和递延税项资产与递延税项负债相抵销的情况下才被抵销 ;并且它们涉及同一应纳税主体或打算同时结算的不同应纳税主体 。
政府拨款
只有当公司合理地保证赠款将会收到,并且赠款的条件得到遵守时,才会确认来自政府赠款的收入。来自政府拨款的收入 在本公司确认为支出的期间内系统地确认,而拨款旨在补偿的相关成本 。政府拨款涉及澳大利亚联邦政府的新冠肺炎支持计划 ,旨在为符合条件的组织提供“现金流提升”,支持中小型组织。
当期和非当期分类
资产和负债按流动和非流动分类在财务状况表 中列示。
在下列情况下,资产被归类为流动资产:在本集团正常经营周期内预期变现或拟出售或消耗的资产;主要为交易目的而持有;预期于报告期后12个月内变现;或资产为现金或现金等价物 ,除非受限制不得在报告期后至少12个月内交换或用于清偿负债。所有其他 资产均归类为非流动资产。
当负债 预期于本集团正常经营周期内结算;主要为买卖目的而持有;于报告期后12个月内到期结算;或并无无条件权利将负债结算延迟至报告期后最少12个月 时,则分类为流动负债。所有其他负债分类为非流动负债。
递延税项资产及负债分类为非流动。
现金
现金和存放在金融机构的活期存款,其他短期、高流动性投资,原到期日不超过三个月,可随时转换为已知数额的现金,价值变动风险很小。
贸易和其他应收款
应收贸易账款初步按 公平值确认,其后采用实际利率法按摊销成本减任何预期信贷亏损拨备计量。 应收贸易账款须于30日内到期结算。
本集团已应用简化方法 计量预期信贷亏损,其使用全期预期亏损拨备。为计量预期信贷亏损,应收贸易账款已按逾期天数分组。
其他应收款项按摊销 成本减任何预期信贷亏损拨备确认。
F-38
1. 重要会计政策(续)
其他金融资产
其他金融资产初始按公允价值计量。除按公平值计入损益之金融资产外,交易成本计入初步计量。该等资产其后视乎其分类按摊销成本或公平值计量。分类 乃根据持有该等资产的业务模式及 金融资产的合约现金流量特征厘定,除非可避免会计错配。
当收取现金流量的权利 已届满或已转让,而本集团已将拥有权的绝大部分风险及回报转让时,则终止确认金融资产。 当无法合理预期收回部分或全部金融资产时,其账面价值被撇销。
无形资产
研发
研究成本在发生研究成本的期间计入费用。当考虑到项目在商业上及技术上的可行性而有可能取得成功;本集团能够使用或出售资产;本集团有足够资源及意向完成开发;
且其成本可可靠计量时,则将开发成本资本化。资本化开发成本在其预期收益期间按直线摊销,即其有限寿命
贸易和其他应付款
该等金额为在财政年度结束前向本集团提供的货物及服务的负债,但尚未支付。由于它们属于短期性质, 它们是按摊余成本计量的,不会贴现。这些金额是无担保的,通常在确认后30天内支付。
条文
拨备确认当本集团因过往事件而具有 现时(法律或推定)义务时,本集团很可能会被要求清偿该义务, 并可可靠地估计该义务的金额。确认为拨备的数额是在报告日期清偿当前债务所需的对价的最佳估计数,同时考虑到债务的风险和不确定性。如果货币的时间价值是重大的,则使用特定于负债的现行税前税率对拨备进行贴现。 由于时间流逝而导致的拨备增加被确认为财务成本。
员工福利
短期雇员福利
工资和薪金负债,包括预计在报告日期后12个月内全部结清的非货币福利、年假和长期服务假,按负债结清时预计支付的金额计量。
其他长期雇员福利
年假和长期服务假的负债预计不会在报告日期后12个月内结清,按截至报告日期员工提供的服务的预期未来付款的现值 使用预计单位信用法计量。 考虑预期的未来工资和薪金水平、员工离职经历和服务年限。预期未来付款 使用报告日期的公司债券市场收益率进行贴现,债券的到期日期限和币种与估计的未来现金流出尽可能接近 。
退休福利义务
根据澳大利亚法律,本集团所有员工均有权获得养老金 供款。员工指定的养老金计划的缴费将在发生缴费的 期间支出。
F-39
1. 重要会计政策(续)
基于股份的支付
向员工提供股权结算的补偿福利。
股权结算交易是提供给员工以换取提供服务的股票的奖励, 股票的表演权或期权。
股权结算交易之成本于授出日期按公平值计量。公平值乃使用柏力克-舒尔斯期权定价模式独立厘定,当中考虑 行使价、期权年期、摊薄影响、相关 股份于授出日期之股价及预期价格波幅、预期股息收益率及期权年期之无风险利率,连同 并不决定本集团是否收取服务而使雇员有权收取付款的非归属条件。用于计算公平值的柏力克-舒尔斯期权定价模式的输入数据分类为国际财务报告准则第13号公平值层级下的第三级输入数据。没有 考虑任何其他归属条件。
在厘定公允价值时,会考虑市场情况。因此,无论是否满足市场条件,只要满足所有其他条件,任何受市场条件制约的奖励都将被视为授予。
如果修改了股权结算奖励,则至少应确认一笔费用,就好像未进行修改一样。于剩余归属期间内,如有任何修订增加以股份为本的补偿利益于修订日期的总公允价值,则会确认额外开支。
如果非归属条件在集团或员工的控制范围内,则未能满足该条件将被视为取消。如果条件不在本集团或员工的控制范围内,且在归属期间未得到满足,则奖励的任何剩余费用将在剩余的 归属期间确认,除非奖励被没收。
如果股权结算奖励被取消, 将被视为在取消之日已归属,任何剩余费用将立即确认。如果新的替代裁决 取代了已取消的裁决,则被取消的新裁决将被视为修改。
公允价值计量
当一项资产、负债或权益工具(金融或非金融)为确认或披露目的而按公允价值计量时,公允价值是基于在计量日期在市场参与者之间的有序交易中出售资产或权益工具或支付以转移负债而收到的价格 ;并假设交易将在以下其中之一发生:在主要市场;或在没有主要市场的情况下,在最有利的市场进行。
公允价值是根据市场参与者在为资产、负债或权益工具定价时使用的假设来计量的,假设他们的行为符合他们的经济最佳利益。 对于非金融资产,公允价值计量基于其最高和最佳使用。采用适用于 情况且有足够数据以计量公允价值的估值技术,以最大限度地利用相关可观察到的投入,并最大限度地减少使用不可观察到的投入。
F-40
1. 重要会计政策(续)
按公允价值计量的资产、负债和权益工具分为三个级别,采用反映进行计量的投入重要性的公允价值层次结构。对于初始确认后按公允价值计量的资产和负债,在每个报告日期对分类进行审查,并根据对公允价值计量重要的最低投入水平的重新评估来确定不同级别之间的转移。公允价值层次的三个层次如下所述:
| ● | 第1级--相同资产或负债的活跃市场报价(未经调整)市场价格; |
| ● | 第2级-直接或间接可观察到对公允价值计量有重要意义的最低水平投入的估值技术;以及 |
| ● | 第3级-无法观察到对公允价值计量有重要意义的最低水平投入的估值技术。 |
对于经常性和非经常性公允价值计量,当无法获得内部专业知识或估值被视为重要时,可使用外部估值师。外部评估师是根据市场知识和声誉选择的。如果一项资产或负债的公允价值从一个时期到另一个时期有重大变化,则进行分析,包括核实在最新估值中应用的主要投入 并在适用的情况下与外部数据来源进行比较。
已发行资本
普通股被归类为股权。
直接可归因于发行新股或购股权的增量成本在权益中显示为从收益中扣除税款后的净额。
分红
股息在 财政年度宣布时确认。
每股亏损
每股基本亏损
每股基本亏损的计算方法为: IncanneX Healthcare Limited所有者应占利润(不包括普通股以外的任何股本服务成本)除以财政年度内已发行普通股的加权平均数(经财政年度内发行的普通股的红利因素调整后)。这些值在附注6中列出。
稀释每股亏损
每股摊薄亏损调整在厘定每股基本盈利时所使用的数字 ,以计及与摊薄潜在普通股相关的利息及其他融资成本的税后影响 ,以及假设已免费发行的股份数量与摊薄潜在普通股有关的加权平均数 。这些值在附注6中列出。
商品和服务税('GST') 和其他类似税收
收入、支出和资产在扣除相关GST后确认,除非所产生的GST无法从税务机关收回。在这种情况下,它被确认为资产购置成本的一部分或费用的一部分。
应收及应付款项包括 应收或应付的GST金额。可从税务机关收回的商品及服务税净额计入财务状况表的其他应收款项。
现金流量按总额基准呈列。投资或融资活动产生的可从税务机关收回或应向税务机关支付的现金流的 商品及服务税部分 作为经营现金流列示。
承付款及或有事项按可向税务机关收回或须向税务机关支付的商品及服务税金额净额 披露。
F-41
1. 重要会计政策(续)
尚未采用的新会计准则
本集团于截至2022年及2021年6月30日止的 年度报告期内,并未提早采纳最近颁布或修订但尚未强制执行的国际财务报告准则及解释。
2.关键会计判断、估计和假设
编制综合财务报表需要管理层作出影响综合财务报表所呈报金额之判断、估计及假设。管理层持续评估其有关资产、负债、或然负债、 收入及开支的判断及估计。管理层根据过往经验及其他各种因素作出判断、估计及假设, 包括管理层相信在有关情况下属合理的对未来事件的预期。由此产生的会计判断 和估计很少与相关的实际结果相同。具有 重大风险导致下一个财政年度资产及负债账面值须作出重大调整之判断、估计及假设讨论如下。
冠状病毒(新冠肺炎)大流行
根据已知信息,在考虑冠状病毒(新冠肺炎)大流行已经或可能对本集团造成的影响时,已作出判断。考虑范围包括所提供的产品和服务的性质、客户、供应链、人员配备和集团所在的地理区域。 目前似乎既没有对综合财务报表产生任何重大影响,也没有任何重大不确定性 可能会在报告日期或随后因新冠肺炎(CoronaVirus)大流行对本集团造成不利影响的事件或情况。
基于股份的支付交易
本集团参考权益工具于授出日期之公平值计量与雇员及第三方进行之权益结算 交易之成本。 公平值乃采用三项式或柏力克-舒尔斯模式厘定,并计及 工具授出之条款及条件。有关以权益结算以股份为基础之付款之会计估计及假设将不会对下一个年度报告期间之资产及负债账面值产生影响 ,但可能影响损益及权益。
3.收入
| 已整合 | ||||||||
| 2022 | 2021 | |||||||
| (A)收入(时间点) | $ | $ | ||||||
| 大麻油销售 | ||||||||
| (B)其他收入 | ||||||||
| 来自其他安排的收入 | ||||||||
| 政府拨款 | ||||||||
| 利息 | ||||||||
| 可退还的研发税收抵免 | ||||||||
F-42
4.细分市场信息
确定可报告的运营区段
国际财务报告准则第8号营运分部要求根据行政总裁定期审阅的有关集团组成部分的内部报告来确定营运分部 ,以便向该分部分配资源及评估其表现。
本集团之经营分部乃 参考首席执行官就本集团 经营及营运资金分配作出决定时所使用之每月管理账目而厘定。鉴于本集团的规模及性质,董事会整体上已被确定为 首席执行官。
根据《国际财务报告准则》第8号所载截至2022年6月30日的财政年度的量化门槛,本集团被组织为
| 1. | 研究和开发使用迷幻药物和疗法治疗精神健康障碍。这项活动是在年内开始的。在本年度内,业务完全包括研究和开发活动,包括临床试验。 |
| 2. | 研究开发医用大麻素产品的用途。年内,本集团继续研究及发展其产品及一系列产品,包括进一步的临床试验。 |
| 3. | 公司运营,包括组织管理、资本管理和资源管理。收入由财务收入和其他收入组成。 |
该集团仅有
本集团该等分部之整体收入及业绩
载于综合全面收益表,而本集团之整体资产及负债则载于综合财务状况表。
| 2022年6月30日 | 迷幻产品 | 大麻素 产品 | 公司 | 已整合 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 来自外部客户的收入 | ||||||||||||||||
| 利息收入 | ||||||||||||||||
| 其他收入 | ||||||||||||||||
| 其他费用 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 所得税后分部亏损 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 细分资产 | ||||||||||||||||
| 分部负债 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 2021年6月30日 | 迷幻 产品 | 大麻素 产品 | 公司 | 已整合 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 来自外部客户的收入 | 1 | |||||||||||||||
| 利息收入 | ||||||||||||||||
| 其他收入 | ||||||||||||||||
| 其他费用 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 所得税后分部亏损 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 细分资产 | ||||||||||||||||
| 分部负债 | ( | ) | ( | ) | ( | ) | ||||||||||
| 1 |
F-43
5.所得税
| 已整合 | ||||||||
| 2022 | 2021 | |||||||
| $ | $ | |||||||
| 税前会计亏损 | ( | ) | ( | ) | ||||
| 所得税优惠,适用税率为 | ||||||||
| 不可扣除的费用 | ( | ) | ( | ) | ||||
| 免税收入 | ||||||||
| 未确认的递延税项资产 | ( | ) | ( | ) | ||||
| 所得税优惠 | ||||||||
| 未确认的递延税金资产 | ||||||||
| 未在财务报表中确认的递延税项资产: | ||||||||
| 未用税损 | ||||||||
| 未确认税收优惠净额为 | ||||||||
该潜在递延税项利益并未在财务报表中确认为资产,因为在美国会计准则第112号所得税(国际会计准则第12号)的背景下,收回该资产的可能性不大。
只有在以下情况下才能实现好处:
| a) | 本公司所得的未来应评税收入的性质及数额足以令该等利益得以实现。 |
| b) | 公司遵守法律规定的扣减条件;以及 |
| c) | 税务法规的改变不会对本公司实现利益造成不利影响。 |
6.每股亏损
| 已整合 | ||||||||
| 2022 | 2021 | |||||||
| $ | $ | |||||||
| 每股基本亏损--每股亏损 | ( | ) | ( | ) | ||||
| 每股基本亏损 | ||||||||
| 计算每股基本亏损时使用的普通股亏损和加权平均数如下: | ||||||||
| 本年度综合亏损总额 | ( | ) | ( | ) | ||||
| --普通股加权平均数(个) | ||||||||
该公司指出,稀释后每股亏损与基本每股亏损相同。
F-44
7.派发股息
本公司尚未宣布截至2022年6月30日的年度派息(2021年:零美元)。
8.现金及现金等价物
| 已整合 | ||||||||
| 2022 | 2021 | |||||||
| $ | $ | |||||||
| 银行现金和手头现金 | ||||||||
| 银行现金以每日银行存款利率为基础,以浮动利率赚取利息。 | ||||||||
| 本年度亏损与经营活动现金流量净额的对账: | ||||||||
| 所得税后亏损 | ( | ) | ( | ) | ||||
| 非现金费用: | ||||||||
| 基于股份的支付 | ||||||||
| 折旧及摊销 | ||||||||
| 投资者关系服务的非现金费用 | ||||||||
| 释放Gameday销售退款准备金 | ( | ) | ||||||
| 其他非现金费用 | ( | ) | ||||||
| 净资产和净负债变动情况: | ||||||||
| 应收账款(增加)/减少 | ( | ) | ||||||
| 库存(增加)/减少 | ||||||||
| 其他流动资产减少 | ||||||||
| 贸易应付款和应计费用增加/(减少) | ( | ) | ||||||
| 其他负债增加/(减少) | ( | ) | ||||||
| 运营中使用的现金流 | ( | ) | ( | ) | ||||
9.贸易和其他应收款(当期)
| 当前 | 已整合 | |||||||
| 2022 | 2021 | |||||||
| $ | $ | |||||||
| 其他应收账款 | ||||||||
| 可收回的商品及服务税 | ||||||||
预期信贷损失
本集团采用美国会计准则第9号(国际财务报告准则第9号)简化模型,以确认所有应收贸易账款的终身预期信贷损失,因为该等项目并无重大融资成分。 在计量预期信贷亏损时,由于应收贸易账款具有共同信贷风险特征,因此已按集体评估。它们已根据过期天数和客户的地理位置进行了分组。
F-45
10.其他资产(流动)
| 提前还款 | ||||||||
| 办公室租赁债券 | ||||||||
| 预付临床试验保险 | ||||||||
11.贸易和其他应付款(当前)
| 贸易应付款 | ||||||||
| 应计费用 | ||||||||
| 员工休假权利 | ||||||||
12.已发行资本
| 已整合 | ||||||||
| 2022 | 2021 | |||||||
| $ | $ | |||||||
| 已整合 | ||||||||
| 2022 | 2022 | |||||||
| $ | 不是的。的股份 | |||||||
| (A)普通股--年度内的变动情况 | ||||||||
| 在年初 | ||||||||
| 新股发行-配售 | ||||||||
| 发行新股-股份支付1 | ||||||||
| 期权的行使 | ||||||||
| 以股份代替顾问费 | ||||||||
| 股票发行成本 | ( | ) | ||||||
| 在年底 | ||||||||
| 1 |
13.储备
| 已整合 | ||||||||
| 2022 | 2021 | |||||||
| $ | $ | |||||||
| 2021年7月1日的结余 | ||||||||
| 发给顾问的期权1 | ||||||||
| 发行给管理层和董事的股权工具 | ||||||||
| 2022年6月30日 | ||||||||
| 1 |
股权溢价准备金 用于记录为筹集资本而发行的股权的价值,以及用于以股份为基础的付款。
F-46
14.基于股份的支付
公司可能会不时向其员工、董事或顾问发行股票 证券(即股票、期权或绩效权利),以使绩效奖励 与公司增长和战略目标的实现更紧密地结合起来。如果收款人是本公司的董事,则在向任何董事发行任何股权证券之前,必须根据澳交所上市规则寻求股东的批准。
已发行股份的公允价值
向雇员发行股份的公允价值是根据股份于授出日的收市价厘定,并于归属期间列支。本年度向雇员及董事发行的股份公允价值合共为$
选项
截至2022年6月30日至2021年6月30日,未偿还期权的行权价在1美元至1美元之间。
截至2022年6月30日,
授予日的公允价值是使用三项式定价或Black-Scholes期权模型独立确定的,该模型考虑了要行使的任何价格、期权或权利的期限、授予日的股价、标的股份的价格波动性以及期权或权利的 期限的无风险利率。下表中的已摊销公允价值为已分配给当期的公允价值总额的比例,余额将在未来期间摊销。
选项 | 数 | 格兰特 日期2 | 到期日 | 锻炼 价格 | 总计 公允价值 | |||||||||||
| 授予董事的期权 | ||||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 授予员工的期权 | ||||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 选项总数 | $ | |||||||||||||||
F-47
14.以股份为基础的付款(续)
在截至2021年6月30日的年度内,向员工和顾问发放了以下股票期权,作为以股票为基础的付款:
选项 | 数 | 格兰特 日期2 | 到期日 | 锻炼 价格 | 总计 公允价值 | |||||||||||
| 授予第三方的期权 | ||||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 未列出的期权 | $ | $ | ||||||||||||||
| 选项总数 | $ | |||||||||||||||
授予日的公允价值是使用三项式定价或Black-Scholes期权模型独立确定的,该模型考虑了要行使的任何价格、期权或权利的期限、授予日的股价、标的股份的价格波动性以及期权或权利的 期限的无风险利率。根据美国会计准则第13号(IFRS 13)的公允价值等级,用于计算公允价值的三项式和Black-Scholes期权定价模型的投入被归类为第三级投入。
| $0.26选项 | $0.31选项 | 0.35美元选项 | $0.26选项 | $0.31选项 | 0.35美元选项 | $0.26选项 | $0.31选项 | 0.35美元选项 | ||||||||||||||||||||||||||||||||
| 01-7-25 | 1-7-26 | 7月1日至27日 | 1-7-26 | 7月1日至27日 | 01-7-28 | 01-7-25 | 1-7-26 | 7月1日至27日 | ||||||||||||||||||||||||||||||||
| 数 | ||||||||||||||||||||||||||||||||||||||||
| 预期波动率下降(%) | % | % | % | % | % | % | % | % | % | |||||||||||||||||||||||||||||||
| 无风险利率(%) | % | % | % | % | % | % | % | % | % | |||||||||||||||||||||||||||||||
| 期权的预期寿命(年) | ||||||||||||||||||||||||||||||||||||||||
| 行权价格(分) | ||||||||||||||||||||||||||||||||||||||||
| 授予日期股价(美分) | ||||||||||||||||||||||||||||||||||||||||
| 归属日期 | | | | | | | | |||||||||||||||||||||||||||||||||
授予的股权结算股票期权 的公允价值是在授予日使用Black-Scholes期权模型估计的,同时考虑到授予期权的条款和条件,截至2021年6月30日的年度如下:
| $0.08 选项 | $0.15 选项 | $0.25 选项 | $0.20 选项 | $0.25 选项 | ||||||||||||||||
| 9月30日至21日 | 11月20日至23日 | 11月20日至23日 | 11月20日至23日 | 11月20日至23日 | ||||||||||||||||
| 数 | ||||||||||||||||||||
| 预期波动率(%) | % | % | % | % | % | |||||||||||||||
| 无风险利率(%) | % | % | % | % | % | |||||||||||||||
| 期权的预期寿命(年) | ||||||||||||||||||||
| 行权价格(分) | ||||||||||||||||||||
| 授予日期股价(美分) | ||||||||||||||||||||
| 归属日期 | ||||||||||||||||||||
期权的预期寿命基于历史数据,并不一定指示可能发生的锻炼模式。预期波动率反映了这样一种假设,即历史波动率是未来趋势的指示性指标,这也可能不一定是实际结果。
F-48
14.以股份为基础的付款(续)
表演权
| 安全说明 | $0..$0.08选项 | 年初余额 | 由本公司授予 | 已转换或过期 | 年终余额 | |||||||||||||
| 2022年6月30日 | ||||||||||||||||||
| 2021年6月30日 | ( | ) | ||||||||||||||||
| (1) |
15.核数师的薪酬
| 已整合 | 已整合 | |||||||
| 2022 | 2021 | |||||||
| $ | $ | |||||||
| 审计或审查公司的财务报告 | ||||||||
| 核数师收到和应收的金额: | ||||||||
| 审计服务-PKF布里斯班审计 | ||||||||
| 审计服务--HLB Mann Judd | ||||||||
| 审计服务-Withum Smith&Brown(美国审计师) | ||||||||
| 其他服务-Withum Smith&Brown(美国审计师) | ||||||||
Withum Smith&Brown,PC被任命为美国审计师 ,为公司证券在美国上市做准备。在这一年中,开展的工作涉及对财务报表进行PCAOB(Br)合规审计。
16.金融工具
本集团的主要金融工具包括现金及短期存款。
这些金融工具的主要目的是为本集团的业务筹集资金。本集团有多项其他财务负债,例如贸易应付账款,而这些负债 直接来自其业务。本集团的政策是,并于年内一直在检讨中,即不得进行任何金融工具交易。本集团金融工具产生的主要风险包括现金流利率风险、流动性风险和信用风险。董事会审查并同意管理每一项风险的政策,这些政策概述如下 。
(A)利率风险
本集团面对市场利率变动的风险 主要与本集团的浮息短期存款有关。
本集团对金融资产及金融负债的利率风险,详见本附注的敏感度分析部分。
F-49
16.金融工具(续)
(B)敏感性分析
于2022年期间,若利率较实际利率高或低50个基点 个基点,而所有其他变数保持不变,则本年度的税后业绩将会有非实质性的变化。对股本的影响应该是一样的。
(C)公允价值净值
现金及现金等价物 及无息货币金融资产及负债的公允净值与其账面价值大致相同。
(D)商品价格风险
本集团对价格风险的风险敞口微乎其微。
(E)信贷风险
本集团并无重大信贷风险集中 。
至于本集团其他金融资产(包括现金及现金等价物、可供出售金融资产及若干衍生工具)所产生的信贷风险, 本集团因交易对手违约而产生的信贷风险,最高风险敞口等于该等工具的账面金额 。
由于本集团只与公认的第三方进行交易,因此不需要抵押品。
(F)流动性风险
本集团的目标是透过发行股份及发行可换股票据,在持续融资与灵活性之间维持平衡 。
本集团于2022年6月30日的合同负债如下:
| 描述 | 少于1个月 | 1至3 个月 | 3个月至 1年 | 1至5 年份 | 总计 | |||||||||||||||
| 已整合 | $ | $ | $ | $ | $ | |||||||||||||||
| 应付款和应计项目 | ||||||||||||||||||||
本集团于2021年6月30日的合同负债如下:
| 描述 | 少于1个月 | 1至3 个月 | 3个月至 1年 | 1至5 年份 | 总计 | |||||||||||||||
| 已整合 | $ | $ | $ | $ | $ | |||||||||||||||
| 应付款和应计项目 | ||||||||||||||||||||
(G)资本管理
本集团管理资本的目标 是保障其持续经营的能力,以便继续为股东提供回报,并为其他利益相关者提供利益。由于本集团过往活动的性质为矿产勘探,故无法随时获得信贷安排,因此不受任何外部资本规定的规限,而本集团资金的主要来源 为股权融资及无抵押可换股票据。因此,本集团资本风险管理的目标是平衡目前的营运资金状况与满足勘探计划和企业管理费用的要求。这是通过保持适当的流动资金以满足预期的运营要求来实现的,以期根据需要启动融资。
F-50
17.承付款和或有事项
租赁承诺额
本集团持有位于墨尔本、悉尼和澳大利亚珀斯的办公场所的三份商业租约。所有这些租约的租期均为自租约开始之日起计12个月。因此,租赁付款是在租赁期限内以直线方式确认的。
其他承诺
本集团于二零二零年十一月二十三日与蒙纳士大学(“蒙纳士”)订立一项安排,据此,蒙纳士将于三年内提供有关Psi-GAD-1的研究试验。该协议载列将进行的试验的范围及本集团的成本,其中
18.关键管理人员薪酬及关联方披露
Incannex Healthcare Limited于年内之主要管理人员为:
特洛伊·瓦伦丁
彼得·维德斯
乔尔·莱瑟姆
于二零二二年六月二十八日辞任。
George Anastassov(于二零二二年六月二十八日获委任)
| 2022 | 2021 | |||||||
| $ | $ | |||||||
| 短期雇员福利 | ||||||||
| 离职后福利 | ||||||||
| 基于股份的支付 | ||||||||
| KMP薪酬总额 | ||||||||
与相关实体的交易
关联方之间的交易按商业 条款及条件进行,除非另有说明,否则该等条款及条件并不比其他方可获得的条款及条件优惠。
年内,$
19.受控实体的详细情况
综合财务报表包括
Incannex Healthcare Limited(“IHL”)及其全资附属公司Incannex Pty Ltd(“IXPL”)
和Psychennex Pty Ltd(“PXPL”)的财务报表。IXPL在澳大利亚注册成立,IHL拥有
F-51
20.报告日期之后的事件
2022年8月17日,该公司任命罗伯特·布鲁斯·克拉克为董事会非执行董事。
于2022年8月5日,本公司完成对APIRx PharmPharmticals的收购
自本财政年度结束以来,未发生更多重大事件。
21.母实体披露
| 财务状况表 | 2022 | 2021 | ||||||
| 财务状况 | $ | $ | ||||||
| 流动资产 | ||||||||
| 非流动资产 | ||||||||
| 总资产 | ||||||||
| 流动负债 | ( | ) | ( | ) | ||||
| 非流动负债 | ||||||||
| 总负债 | ( | ) | ( | ) | ||||
| 净资产 | ||||||||
| 已发行资本 | ||||||||
| 储量 | ||||||||
| 累计损失 | ( | ) | ( | ) | ||||
| 股东权益 | ||||||||
母实体的或有事项
确实有涉及母公司的或有负债 (2021年: ).
对母公司的担保
确实有涉及 母实体的担保(2021年: )
F-52
独立注册会计师事务所报告
致董事会
关于Incannex Healthcare Limited
对合并财务报表的几点看法
我们已审计随附的英康医疗有限公司(“贵公司”)于二零二一年及二零二零年六月三十日的 综合财务状况表、 相关综合全面收益╱(亏损)表、权益变动表及现金流量表以及相关附注(统称 “综合财务报表”)。我们认为,合并财务报表 在所有重大方面按照国际会计准则理事会 颁布的国际财务报告准则 公允列报了贵公司于2021年及2020年6月30日的合并财务状况以及截至该日止年度的合并经营成果和现金流量。
意见基础
这些合并财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的 合并财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会(SEC)和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们根据PCAOB的标准 进行审核。这些准则要求我们计划和执行审计,以获得关于合并财务报表是否没有重大错报的合理保证 ,无论是由于错误还是欺诈。本公司不需要对其财务报告的内部控制进行审计,我们也没有受聘进行审计。作为我们审计的一部分,我们 需要了解财务报告的内部控制,但不是为了对公司财务报告内部控制的有效性发表意见 。因此,我们不表达这样的意见。
我们的审计包括执行 评估合并财务报表重大错报风险的程序,无论是由于错误还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试基础上审查关于合并财务报表中的金额和披露的证据 。我们的审计还包括评估管理层使用的会计原则和作出的重大估计,以及评估合并财务报表的整体列报。我们相信,我们的审计 为我们的观点提供了合理的基础。
/s/WithumSmith+Brown,PC
纽约,纽约 2021年11月3日
F-53
综合全面收益/(亏损)表
截至2021年和2020年6月30日止年度
| 备注 | 截至六月三十日止年度 2021 | 截至的年度 6月30日 2020 | |||||||||
| 收入 | 3 | $ | 1,897,596 | $ | 604,884 | ||||||
| 其他收入 | 3 | 75,748 | 217,170 | ||||||||
| 总收入和其他收入 | 1,973,344 | 822,054 | |||||||||
| 产品成本 | 1 | (911,969 | ) | (450,345 | ) | ||||||
| 行政管理费用 | 1 | (99,094 | ) | (457,673 | ) | ||||||
| 广告和促销 | 1 | (4,345,874 | ) | (406,225 | ) | ||||||
| 研发成本 | 1 | (4,749,514 | ) | (2,110,639 | ) | ||||||
| 合规、法律和监管 | 1 | (1,227,244 | ) | (235,163 | ) | ||||||
| 基于股份的支付 | 12 | (600,043 | ) | (565,448 | ) | ||||||
| 入住费 | 1 | (115,836 | ) | (2,085 | ) | ||||||
| 工资和员工福利支出 | 1 | (1,296,569 | ) | (523,760 | ) | ||||||
| 总费用 | (13,346,143 | ) | (4,751,338 | ) | |||||||
| 持续经营的税前亏损 | (11,372,799 | ) | (3,929,284 | ) | |||||||
| 所得税优惠 | 5 | — | — | ||||||||
| 持续经营的税后亏损 | (11,372,799 | ) | (3,929,284 | ) | |||||||
| 非持续经营亏损,税后净额 | 6 | — | (768,352 | ) | |||||||
| 全面损失总额 | $ | (11,372,799 | ) | $ | (4,697,636 | ) | |||||
| 持续运营和非持续运营的每股基本亏损(每股美分) | 7 | (1.16 | ) | (0.69 | ) | ||||||
| 持续经营的每股基本亏损(每股美分) | 7 | (1.16 | ) | (0.57 | ) | ||||||
附注是这些合并财务报表的组成部分
F-54
合并财务状况表
截至2021年和2020年6月30日
| 备注 | 2021年6月30日 | 6月30日 2020 | |||||||||
| 资产 | |||||||||||
| 流动资产 | |||||||||||
| 现金 | 9 | $ | 9,123,617 | $ | 3,603,390 | ||||||
| 贸易和其他应收款 | 10 | 169,088 | 413,268 | ||||||||
| 其他资产 | 11 | 36,090 | 36,262 | ||||||||
| 库存 | 13 | — | 183,159 | ||||||||
| 流动资产总额 | 9,328,795 | 4,236,079 | |||||||||
| 总资产 | 9,328,795 | 4,236,079 | |||||||||
| 负债 | |||||||||||
| 流动负债 | |||||||||||
| 贸易和其他应付款 | 14 | 755,049 | 955,006 | ||||||||
| 其他负债 | 15 | — | 116,645 | ||||||||
| 流动负债总额 | 755,049 | 1,071,651 | |||||||||
| 总负债 | 755,049 | 1,071,651 | |||||||||
| 净资产 | $ | 8,573,746 | $ | 3,164,428 | |||||||
| 母公司所有者应占权益 | |||||||||||
| 股本 | 16 | $ | 45,852,107 | $ | 34,192,043 | ||||||
| 储量 | 17 | 6,612,641 | 1,490,588 | ||||||||
| 赤字 | (43,891,002 | ) | (32,518,203 | ) | |||||||
| 净股本 | $ | 8,573,746 | $ | 3,164,428 | |||||||
附注是这些合并财务报表的组成部分
F-55
合并权益变动表
截至2021年和2020年6月30日止年度
| 股本 | |||||||||||||||||||||||
| 备注 | 股票 | 金额 | 储量 | 赤字 | 总计 | ||||||||||||||||||
| 2019年7月1日的余额 | 581,897,040 | $ | 26,951,744 | $ | 451,643 | $ | (27,820,567 | ) | $ | (417,180 | ) | ||||||||||||
| 行使的期权 | 12 | 34,427,321 | 1,077,093 | — | — | 1,077,093 | |||||||||||||||||
| 发给顾问的期权 | 12,17 | — | — | 449,093 | — | 449,093 | |||||||||||||||||
| 基于股份的支付 | 12,17 | — | — | 589,852 | — | 589,852 | |||||||||||||||||
| 已发行股份 | 16 | 132,330,128 | 7,105,354 | — | — | 7,105,354 | |||||||||||||||||
| 股票发行成本 | — | (942,148 | ) | — | — | (942,148 | ) | ||||||||||||||||
| 本年度综合亏损 | — | — | — | (4,697,636 | ) | (4,697,636 | ) | ||||||||||||||||
| 2020年6月30日余额 | 748,654,489 | $ | 34,192,043 | $ | 1,490,588 | $ | (32,518,203 | ) | $ | 3,164,428 | |||||||||||||
| 2020年6月30日余额 | 748,654,489 | $ | 34,192,043 | $ | 1,490,588 | $ | (32,518,203 | ) | $ | 3,164,428 | |||||||||||||
| 行使的期权 | 12 | 286,500,523 | 12,498,706 | — | — | 12,498,706 | |||||||||||||||||
| 发给顾问的期权 | 12,17 | — | — | 3,781,344 | — | 3,781,344 | |||||||||||||||||
| 基于股份的支付 | 12,17 | — | — | 600,043 | — | 600,043 | |||||||||||||||||
| 已发行股份 | 16 | 33,256,212 | — | — | — | — | |||||||||||||||||
| 股票发行成本 | — | (838,642 | ) | 740,666 | — | (97,976 | ) | ||||||||||||||||
| 本年度综合亏损 | — | — | — | (11,372,799 | ) | (11,372,799 | ) | ||||||||||||||||
| 2021年6月30日的余额 | 1,068,411,224 | $ | 45,852,107 | $ | 6,612,641 | $ | (43,891,002 | ) | $ | 8,573,746 | |||||||||||||
附注是这些合并财务报表的组成部分
F-56
合并现金流量表
截至2021年和2020年6月30日止年度
| 备注 | 截至的年度 6月30日 2021 |
截至的年度 6月30日 2020 |
||||||||
| 经营活动的现金流 | ||||||||||
| 来自客户的收据 | $ | 1,974,010 | $ | 1,172,084 | ||||||
| 来自其他收入的收入 | 82,807 | 217,170 | ||||||||
| 向供应商和员工付款 | (8,969,276 | ) | (5,299,667 | ) | ||||||
| 收到的利息 | 2,679 | 3,079 | ||||||||
| 用于经营活动的现金净额 | 9(i) | (6,909,780 | ) | (3,907,334 | ) | |||||
| 投资活动产生的现金流 | ||||||||||
| 出售Gameday子公司的收益 | 29,277 | — | ||||||||
| 处置财产、厂房和设备所得收益 | — | 13,000 | ||||||||
| 投资活动提供的现金净额 | 29,277 | 13,000 | ||||||||
| 融资活动产生的现金流 | ||||||||||
| 发行股份所得收益(扣除成本) | 12,400,730 | 7,469,392 | ||||||||
| 已偿还的债务 | — | (65,000 | ) | |||||||
| 融资活动提供的现金净额 | 12,400,730 | 7,404,392 | ||||||||
| 现金净增 | $ | 5,520,227 | $ | 3,510,058 | ||||||
| 年初现金 | 3,603,390 | 93,332 | ||||||||
| 年终现金 | 9 | $ | 9,123,617 | $ | 3,603,390 | |||||
合并现金流量表超过 PRESEnts公司现金流总额,包括非持续经营。 截至2021年6月30日和2020年6月30日止三个年度的非持续经营现金流如下:
| ● | 经营活动中使用的现金流量:2021年为零,2020年为636,857美元; |
| ● | 投资活动中的现金流:2021年为零,2020年为13,000美元; |
| ● | 融资活动中使用的现金流:2021年为零,2020年为零 |
额外的 补充现金流信息(附注9)
附注是这些合并财务报表的组成部分
F-57
1.重大会计政策
在编制综合财务报表时采用的主要会计政策如下。除非另有说明,这些政策一直适用于提交的所有年度 。
运营的性质
IncanneX Healthcare Limited(“本公司”) 及其合并附属公司(统称“本集团”)是一家临床阶段药物开发公司, 正在开发独特的医用大麻药物产品和迷幻药物疗法。公司的普通股在澳大利亚证券交易所(“澳大利亚证券交易所”)交易。该公司的注册办事处位于澳大利亚新南威尔士州NorWest 2153,8世纪电路105室。
截至2021年6月30日止财政年度,集团除所得税后的全面亏损总额为1,140万美元,营运现金净流出为690万美元。 截至2021年6月30日,集团持有的现金总额为910万美元。
采用新的或修订的会计准则和解释
本集团已采纳国际会计准则委员会(“IASB”)颁布的所有新的或经修订的会计准则及诠释,该等准则及诠释于本报告期内属强制性的 。
尚未强制执行的任何新的或修订的会计准则或解释 尚未及早采用。
历史成本惯例
综合财务报表乃根据历史成本惯例编制,但(如适用)通过损益按公允价值重估金融资产及负债、通过其他全面收益及衍生金融工具按公允价值重估金融资产除外。
关键会计估计
编制合并财务报表需要使用某些关键会计估计数。它还要求管理层在应用本集团会计政策的过程中作出判断。涉及较高程度的判断或复杂性的领域,或假设和估计对合并财务报表具有重大意义的领域,在附注2中披露。
比较句
如有必要,已对比较信息进行了重新分类和重新定位,以与本年度的披露保持一致。
合规声明
这些合并财务报表已获董事会批准于2021年10月发布。
合并财务报表符合国际会计准则理事会(IASB)发布的《国际财务报告准则》(IFRS)。
父实体信息
根据国际财务报告准则第10号合并财务 报表,该等综合财务报表仅载列本集团的业绩。关于上级实体的补充信息在附注24中披露。
F-58
合并原则
综合财务报表包括 本公司所有附属公司于2021年及2020年6月30日的资产及负债,以及截至该等年度的所有附属公司的业绩。IncanneX Healthcare Limited及其附属公司在本综合财务报表中统称为“本集团”。所有受控实体的详情载于附注22。
子公司是指集团拥有控制权的所有实体。当本集团因参与某实体而面临或有权获得可变回报时,本集团控制该实体,并有能力通过其指导该实体活动的权力影响该等回报。子公司自控制权移交给本集团之日起 全面合并。它们从控制权停止之日起解除合并。
集团中实体之间的公司间交易将被取消。附属公司的会计政策已于有需要时作出更改,以确保与本集团采纳的政策保持一致。
如本集团失去对附属公司的控制权,则终止确认附属公司的资产,包括商誉、负债及非控股权益,以及在权益中确认的任何累计折算差额。本集团确认所收取代价的公允价值及保留的任何投资的公允价值,连同任何损益。
运营细分市场
经营分部采用“管理层方法”呈列,其中呈列资料与向首席执行官提供的内部报告的基准相同。 首席执行官负责将资源分配给运营部门并评估其绩效。
外币折算
合并财务报表以澳元列报,澳元是公司的职能货币和列报货币。
外币交易
外币交易使用交易日期的现行汇率折算为 澳元。结算该等交易所产生的汇兑损益,以及按财政年终汇率折算以外币计价的货币资产和负债所产生的汇兑损益,在损益中确认。
收入确认
该公司的收入来自 通过澳大利亚的特殊准入计划销售药用大麻产品。收入包括已收或应收代价的公平值 ,并于扣除税项及折扣后列示。本公司亦透过电子商务网站销售牙医产品赚取收入,然而,本公司已于二零二零年六月三十日终止此分部。
该公司还根据2019年3月与Cannvalate签订并于2021年6月终止的分销协议(“分销协议”)通过Cannvalate Pty Ltd销售大麻素油产品赚取收入。本公司根据国际财务报告准则第15号以总额为基础记录该合同的收入。IFRS 15-B35 B指出:当(或作为)作为委托人的实体履行履约义务时, 该实体以其预期有权换取所转让的指定 商品或服务的对价总额确认收入。”
F-59
公司确认收入To 描述向客户转让商品和服务的金额,该金额反映了本公司预期 有权通过以下步骤交换这些商品和服务的对价:
| ● | 识别 与客户签订的合同; |
| ● | 确定 合同中的履行义务; |
| ● | 确定 成交价; |
| ● | 分配 履约义务的交易价格;以及 |
| ● | 识别 当或当公司履行履约义务时,收入。 |
收入 可以随着履约义务的履行或实体获得 付款权利、客户拥有资产以及相关的重大风险和所有权回报,并且客户 已接受资产的时间点。
公司与客户的安排 可能包括多项履约义务。当合约涉及多项履约责任时,本公司评估每项 履约责任是否独立,并应根据国际财务报告准则第15号“客户合约收入” 作为独立会计单位入账。
本公司根据其整体定价目标和市场情况确定独立销售价格。考虑的重要定价实践包括: 折扣实践、我们交易的规模和数量、我们的营销策略、历史销售额和合同价格。独立销售价格的确定 是通过与管理层协商并经管理层批准,并考虑到我们的入市战略 。随着公司进入市场战略的发展,公司未来可能会修改其定价做法,这可能会导致相对独立销售价格的变化。
本公司根据最能描述收入和现金流 的性质、金额、时间和不确定性如何受经济因素影响的类别, 对来自客户合同的收入进行分解。截至2021年和2020年6月30日止年度,公司仅确认了一个此类类别的收入,即大麻素油销售。如这些合并财务报表附注4所述,本公司先前 确认了来自口腔和牙科器械的收入,尽管这些业务已经停止。所有销售均在澳大利亚境内 进行,公司未根据地理位置对收入进行分类。
公司在正常的28天商业条款内开具发票后收到客户的付款 。如果客户被明确确定为信用风险,则停止确认收入 ,但已收取的费用除外。
其他收入
其他收入在收到时确认 或在确定收受权利时确认。其他收入主要包括赠款收入和利息收入。
所得税
该期间的所得税支出或利益是指根据每个司法管辖区适用的所得税税率对该期间的应纳税所得额支付的税款,并按可归因于暂时性差异、未使用的税项损失和以前报告年度已确认的调整的递延税项资产和负债变动进行调整(如适用)。
递延税项资产资产和负债的暂时性差异按收回资产或清偿负债时预期适用的税率确认,并以已颁布或实质上已颁布的税率为基础,但下列情况除外:
| ● | 何时 递延所得税资产或负债产生于交易中商誉或资产或负债的初始确认 不属于企业合并,且在交易时既不影响会计利润,也不影响应税利润; 或 |
| ● | 何时 应纳税暂时性差异与子公司、联营公司或合营企业的权益有关, 拨回是可以控制的,且暂时性差异在可预见的未来很可能不会拨回。 |
F-60
递延税项资产只有在未来可能有应课税额可用于利用该等暂时性差额和亏损的情况下,才会确认为可扣除的暂时性差额和未用税项损失。
已确认和未确认的递延税项资产的账面金额在每个报告日期进行审核。已确认的递延税项资产减值至不再有未来应课税溢利可供收回账面金额的程度。以前未确认的递延税项资产 在可能有未来可供收回资产的应课税利润的范围内予以确认。
递延税项资产和负债只有在法律上有权将当期税项资产与当期税项负债和递延税项资产与递延税项负债相抵销的情况下才被抵销 ;并且它们涉及同一应纳税主体或打算同时结算的不同应纳税主体 。
停产经营
已终止经营业务指 本集团已出售或分类为持作出售之组成部分,并代表一项独立之主要业务或经营地区 ,或为出售该业务或经营地区之单一协调计划之一部分,或为专为转售而收购之附属公司 。已终止经营业务之业绩于全面收益表 内单独呈列。
政府拨款
只有当公司合理地保证赠款将会收到,并且赠款的条件得到遵守时,才会确认来自政府赠款的收入。来自政府拨款的收入 在本公司确认为支出的期间内系统地确认,而拨款旨在补偿的相关成本 。政府拨款涉及澳大利亚联邦政府的新冠肺炎支持计划 ,旨在为符合条件的组织提供“现金流提升”,支持中小型组织。
当期和非当期分类
资产和负债按流动和非流动分类在财务状况表 中列示。
在下列情况下,资产被归类为流动资产:在本集团正常经营周期内预期变现或拟出售或消耗的资产;主要为交易目的而持有;预期于报告期后12个月内变现;或资产为现金或现金等价物 ,除非受限制不得在报告期后至少12个月内交换或用于清偿负债。所有其他 资产均归类为非流动资产。
当负债 预期于本集团正常经营周期内结算;主要为买卖目的而持有;于报告期后12个月内到期结算;或并无无条件权利将负债结算延迟至报告期后最少12个月 时,则分类为流动负债。所有其他负债分类为非流动负债。
递延税项资产及负债分类为非流动。
现金
现金和存放在金融机构的活期存款,其他短期、高流动性投资,原到期日不超过三个月,可随时转换为已知数额的现金,价值变动风险很小。
贸易和其他应收款
应收贸易账款初步按 公平值确认,其后采用实际利率法按摊销成本减任何预期信贷亏损拨备计量。 应收贸易账款须于30日内到期结算。
F-61
本集团已应用简化方法 计量预期信贷亏损,其使用全期预期亏损拨备。为计量预期信贷亏损,应收贸易账款已按逾期天数分组。
其他应收款项按摊销 成本减任何预期信贷亏损拨备确认。
库存
存货原材料、在制品及 制成品按“先进先出”基准按成本及可变现净值两者中之较低者列账。成本包括 直接材料及运送成本、直接劳工、进口关税及其他税项,以及基于正常营运能力的适当比例的可变及固定间接费用 开支。采购存货的成本在扣除已收或应收的回扣和折扣后确定。
在途存货按成本 与可变现净值两者中的较低者列账。成本包括采购及交付成本,扣除已收或应收回扣及折扣。
可变现净值为日常业务过程中的估计售价 减估计完成成本及进行销售所需的估计成本。
其他金融资产
其他金融资产初始按公允价值计量。除按公平值计入损益之金融资产外,交易成本计入初步计量。该等资产其后视乎其分类按摊销成本或公平值计量。分类 乃根据持有该等资产的业务模式及 金融资产的合约现金流量特征厘定,除非可避免会计错配。
当收取现金流量的权利 已届满或已转让,而本集团已将拥有权的绝大部分风险及回报转让时,则终止确认金融资产。 当无法合理预期收回部分或全部金融资产时,其账面价值被撇销。
金融资产减值准备
本集团就按摊销成本或按公平值计入其他全面收益计量的金融资产的预期 信贷亏损确认亏损拨备。亏损拨备的计量 取决于本集团于各报告期末根据可得的合理及可支持的资料, 评估金融工具的 信贷风险自初始确认以来是否显著增加,而无需付出不必要的成本或努力。
倘自初始确认以来信贷风险并无显著增加,则估计12个月预期信贷亏损拨备。这代表资产整个存续期预期信用损失的一部分 ,可归因于未来12个月内可能发生的违约事件。 如果金融资产已发生信用减值或确定信用风险已显著增加,则损失备抵 基于资产的整个存续期预期信用损失。确认的预期信用损失金额按 工具存续期内预期现金短缺的概率加权现值按原实际 利率折现计量。
非金融资产减值准备
非金融资产于发生事件或情况变动显示其账面值可能无法收回时进行减值测试。如果非金融资产的账面价值 超过其可收回金额(即使用价值与公允价值减处置成本两者中的较高者),则 资产被撇减,并相应确认减值费用。
F-62
若无法估计个别资产的可收回金额,减值测试将于该资产的现金产生单位(即该资产所属的产生现金流入的最小资产组别 )进行,而该现金流入在很大程度上独立于其他资产的现金流入。
分配给一项资产的减值损失只有在自上次确认减值损失以来用于确定该资产的可收回金额的估计发生变化的情况下才会 转回。
如上所述,减值损失的冲销 限于资产的账面金额(扣除折旧或摊销后的净额)的较低者,如果资产在前几年没有确认减值损失和资产的可收回金额,则应确定的资产的账面金额较低。在确认非金融资产减值后,本公司于每个报告日期审查是否有迹象表明过去确认的减值已不复存在或应减值。资产减值损失的冲销在损益中确认。
财产、厂房和设备
物业、厂房及设备按历史成本减去累计折旧及减值列账。历史成本包括直接可归因于收购项目的支出 。就终止业务(附注6)而言,本公司于截至2020年6月30日止财政年度的物业、厂房及设备未来价值被视为微不足道,并就账面值计入减值开支。 因此,于2021年及2020年6月30日止物业、厂房及设备的价值为零。
折旧按直线 计算,以注销每项财产、厂房和设备(不包括土地)在其预期使用年限内的净成本,如下所示:
| 建筑物 | 40年 | |
| 租赁权改进 | 3年到10年 | |
| 厂房和设备 | 3岁-7岁 |
在每个报告日期对剩余价值、使用年限和折旧方法进行审查,并在适当时进行调整。
租赁改进按租约未到期期间或资产的估计使用年限(以较短者为准)计提折旧。
物业、厂房及设备于出售时或在对本集团没有未来经济利益时终止确认 。账面金额和出售之间的损益 收益计入利润或亏损。
无形资产
就终止业务 (附注6)而言,本公司的无形资产未来价值被视为微不足道,并于截至2020年6月30日止财政年度就账面值计入减值开支。因此,截至2021年和2020年6月30日,无形资产价值为零。
研发
研究费用在发生研究费用的 期间计入。当考虑到项目的商业及技术可行性而有可能取得成功、本集团有能力使用或出售资产、本集团有足够的资源及意向完成 开发,且其成本可可靠地计量时,则将开发成本资本化。资本化开发成本按其预期收益的期间(即其10年的有限寿命)按直线摊销。本公司尚未将截至2021年6月30日及2020年6月30日的年度 的任何开发成本资本化。
F-63
贸易和其他应付款
该等金额为在财政年度结束前向本集团提供的货物及服务的负债,但尚未支付。由于它们属于短期性质, 它们是按摊余成本计量的,不会贴现。这些金额是无担保的,通常在确认后30天内支付。
租赁负债
租赁负债在租赁开始之日确认。租赁负债初步按租赁期间支付的租赁付款现值确认,按租赁隐含利率贴现,或如该利率不能轻易确定,则按本集团递增的 借款利率贴现。租赁付款包括固定付款减去任何应收租赁奖励、取决于指数或利率的可变租赁付款、根据剩余价值担保预期支付的金额、购买期权在合理确定将发生行使时的行使价以及任何预期的终止罚款。不依赖于指数或费率的可变租赁付款在发生期间支出。
租赁负债按实际利息法按摊销成本计量。如果下列方面发生变化,则重新计量账面金额:因指数变化或使用的利率而产生的未来租赁付款 ;剩余担保;租赁期限;购买选择权的确定性和终止罚金。 当重新计量租赁负债时,对相应的使用权资产进行调整,或在完全减记使用权资产的账面金额的情况下对损益进行调整。
于开始日期租期为12个月或以下的租赁,以及标的价值被视为低价值的租赁,概不确认租赁负债。任何该等租赁的成本均记入已发生的费用内。
融资成本
应占合资格资产的融资成本 作为资产的一部分进行资本化。所有其他财务成本均在发生期间支出。
条文
拨备确认当本集团因过去事件而负有目前(法律或推定)义务时,本集团很可能会被要求清偿该义务, 并可对该义务的金额作出可靠估计。确认为拨备的数额是在报告日期清偿当前债务所需的对价的最佳估计数,同时考虑到债务的风险和不确定性。如果货币的时间价值是重大的,则使用特定于负债的现行税前税率对拨备进行贴现。 由于时间流逝而导致的拨备增加被确认为财务成本。
员工福利
短期雇员福利
工资和薪金负债,包括预计在报告日期起12个月内全部结清的非金钱福利、年假和长期服务假 ,按结清负债时预计支付的金额计量。
其他长期雇员福利
年假和长期服务假的负债预计不会在报告日期后12个月内结清,按截至报告日期员工提供的服务的预期未来付款的现值 使用预计单位信用法计量。 考虑预期的未来工资和薪金水平、员工离职经历和服务年限。预期未来付款 使用报告日期的公司债券市场收益率进行贴现,债券的到期日期限和币种与估计的未来现金流出尽可能接近 。
F-64
基于股份的支付
向员工提供股权结算的补偿福利。
股权结算交易是提供给员工以换取提供服务的股票的奖励, 股票的表演权或期权。
股权结算交易的成本于授出日按公允价值计量。公允价值是使用三项式或Black-Scholes期权定价模型 独立确定的,该模型考虑了行权价格、期权期限、稀释的影响、授予日的股价和标的股份的预期价格波动、期权期限的预期股息收益率和无风险利率。加上不能决定本集团是否接受使雇员有权收取款项的服务的非归属条件。 用于计算公允价值的三项式期权定价模型的投入被归类为国际财务报告准则13的公允价值层次下的第三级投入。不考虑任何其他归属条件。
股权结算交易的成本确认为支出,并于归属期间相应增加股本。累计损益费用是根据授予日的公允价值、可能授予的奖励数量的最佳估计以及归属期限的到期部分来计算的。当期在损益中确认的金额是在每个报告日期计算的累计金额减去以前期间已确认的金额。
在确定公允价值时会考虑市场条件 。因此,任何受市场条件规限的奖励均被视为归属,而不论该 市场条件是否已获达成,惟所有其他条件须获达成。
如果修改了股权结算奖励,则至少应确认一笔费用,就好像未进行修改一样。于剩余归属期间内,如有任何修订增加以股份为本的补偿利益于修订日期的总公允价值,则会确认额外开支。
如果非归属条件在集团或员工的控制范围内,则未能满足该条件将被视为取消。如果条件不在本集团或员工的控制范围内,且在归属期间未得到满足,则奖励的任何剩余费用将在剩余的 归属期间确认,除非奖励被没收。
如果股权结算奖励被取消, 将被视为在取消之日已归属,任何剩余费用将立即确认。如果新的替代裁决 取代了已取消的裁决,则被取消的新裁决将被视为修改。
公允价值计量
当一项资产、负债或权益工具(金融或非金融)为确认或披露目的而按公允价值计量时,公允价值是基于在计量日期在市场参与者之间的有序交易中出售资产或权益工具或支付以转移负债而收到的价格 ;并假设交易将在以下其中之一发生:在主要市场;或在没有主要市场的情况下,在最有利的市场进行。
公允价值计量采用假设市场参与者在为资产、负债或权益工具定价时将使用的假设,假设他们的行为符合其经济最佳利益。 对于非金融资产,公允价值计量基于其最高和最佳使用。采用在有关情况下适用且有足够数据以计量公允价值的估值技术,从而最大限度地利用相关可观察到的投入,并最大限度地减少使用不可观察到的投入。
F-65
按公允价值计量的资产、负债和权益工具分为三个级别,采用反映进行计量的投入重要性的公允价值层次结构。对于初始确认后按公允价值计量的资产和负债,在每个报告日期对分类进行审查,并根据对公允价值计量重要的最低投入水平的重新评估来确定不同级别之间的转移。公允价值层次的三个层次如下所述:
| ● | 第1级--相同资产或负债的活跃市场报价(未经调整)市场价格; |
| ● | 2级--对公允价值计量具有重大意义的最低水平投入可直接或间接观察到的估值技术;以及 |
| ● | 级别 3-无法观察到对公允价值计量有重要意义的最低级别输入的估值技术。 |
对于经常性和非经常性公允价值计量,当无法获得内部专业知识或估值被视为重要时,可使用外部估值师。外部评估师是根据市场知识和声誉选择的。如果一项资产或负债的公允价值从一个时期到另一个时期有重大变化,则进行分析,包括核实在最新估值中应用的主要投入 并在适用的情况下与外部数据来源进行比较。
已发行资本
普通股被归类为股权。
直接可归因于发行新股或购股权的增量成本在权益中显示为从收益中扣除税款后的净额。
分红
股息在 财政年度宣布时确认。
每股亏损
每股基本亏损
每股基本亏损的计算方法为: IncanneX Healthcare Limited所有者应占利润(不包括普通股以外的任何股本服务成本)除以财政年度内已发行普通股的加权平均数(经财政年度内发行的普通股的红利因素调整后)。附注7中列出了这些值。
稀释每股亏损
每股摊薄亏损调整在厘定每股基本盈利时所使用的数字 ,以计及与摊薄潜在普通股相关的利息及其他融资成本的税后影响 ,以及假设已免费发行的股份数量与摊薄潜在普通股有关的加权平均数 。附注7中列出了这些值。
商品和服务税('GST') 和其他类似税收
收入、费用和资产应在扣除相关商品及服务税后确认,除非发生的商品及服务税不能从税务机关收回。在这种情况下,它被确认为资产购置成本的一部分或费用的一部分。
应收及应付款项包括 应收或应付的GST金额。可从税务机关收回的商品及服务税净额计入财务状况表的其他应收款项。
现金流量按总额基准呈列。投资或融资活动产生的可从税务机关收回或应向税务机关支付的现金流的 商品及服务税部分 作为经营现金流列示。
承付款及或有事项按可向税务机关收回或须向税务机关支付的商品及服务税金额净额 披露。
F-66
尚未采用的新会计准则
近期已颁布或修订但尚未强制执行的国际财务报告准则及解释,尚未为本集团于截至2021年及2020年6月30日止 年度报告期提早采纳。本集团对该等与本集团最为相关的新会计准则及经修订会计准则及诠释的影响评估如下。
对《国际会计准则1》的修正:将负债分类为流动负债或非流动负债
修正案澄清了与确定负债应在财务状况表中作为流动还是非流动列报有关的要求。根据新的要求,对一项负债是按当期还是非当期列报的评估是根据报告日期的合同安排进行的,不影响确认的金额或时间。该修正案追溯适用于自2022年1月1日或之后开始的年度报告期 。本公司目前正在评估这些修订对本公司合并财务报表的潜在影响。
国际会计准则第37号修正案:繁重的合同和履行合同的成本
修正案规定,“履行合同的成本” 包括“与合同直接相关的成本”。与合同直接相关的成本可以是履行合同的增量成本,也可以是与履行合同直接相关的其他成本的分摊。修正案 从2022年1月1日或之后开始的年度期间有效,允许提前申请。本公司目前正在评估这些修订对本公司综合财务报表的潜在影响。
国际财务报告准则第17号保险合同
IFRS第17号保险合同已经发布, 但尚未强制要求公司采用。公司将被要求在截至2024年6月30日的财政年度采用国际财务报告准则第17号。董事预期采纳国际财务报告准则第17号不会对本公司的财务状况或业绩产生重大影响。
2.关键会计判断、估计 和假设
编制综合财务报表需要管理层作出影响综合财务报表所呈报金额之判断、估计及假设。管理层持续评估其有关资产、负债、或然负债、 收入及开支的判断及估计。管理层根据过往经验及其他各种因素作出判断、估计及假设, 包括管理层相信在有关情况下属合理的对未来事件的预期。由此产生的会计判断 和估计很少与相关的实际结果相同。具有 重大风险导致下一个财政年度资产及负债账面值须作出重大调整之判断、估计及假设讨论如下。
冠状病毒(新冠肺炎)大流行
根据已知信息,在考虑冠状病毒(新冠肺炎)大流行已经或可能对本集团造成的影响时,已作出判断。考虑范围包括所提供的产品和服务的性质、客户、供应链、人员配备和集团所在的地理区域。 目前似乎既没有对综合财务报表产生任何重大影响,也没有任何重大不确定性 可能会在报告日期或随后因新冠肺炎(CoronaVirus)大流行对本集团造成不利影响的事件或情况。
F-67
基于股份的支付交易
本集团与雇员及第三方进行权益结算交易的成本,乃参考权益工具于授予之日的公允价值计量。公允价值是通过使用三项式或Black-Scholes模型确定的,同时考虑到授予工具的条款和条件 。与股权结算股份支付相关的会计估计和假设不会对下一个年度报告期内资产和负债的账面价值产生影响,但可能影响损益 和权益。有关详细信息,请参阅附注12和17。
3.收入和支出
| 已整合 | ||||||||
| 6月30日终了年度 2021 | 截至的年度 6月30日 2020 | |||||||
| (a)收入(时间点) | ||||||||
| 大麻油销售 | $ | 1,897,596 | $ | 604,884 | ||||
| $ | 1,897,596 | $ | 604,884 | |||||
| (b)其他收入 | ||||||||
| 来自其他安排的收入(1) | $ | 35,569 | $ | 123,125 | ||||
| 政府拨款(2) | 37,500 | 89,500 | ||||||
| 利息 | 2,679 | 4,545 | ||||||
| $ | 75,748 | $ | 217,170 | |||||
| (C)其他开支 | ||||||||
| 执行董事酬金 | $ | 600,043 | $ | 539,923 | ||||
| (1) | 收入 其他安排 |
截至2021年6月30日止财政年度的其他安排收入与销售Gameday护齿有关,该等收入乃就本公司出售 Gameday分部前的销售所履行的订单(附注6)。此外,本公司还于2020年12月确认了用于结算销售退款的其他收入。 管理层认为该等金额并不重大,因此并无计入截至二零二一年六月三十日止财政年度的已终止经营业务。
截至2020年6月30日止财政年度的其他安排收入乃由于与AXIM Biotechnologies订立的一项交易所致,考虑到全面理解的条款,已发行6,800,000股国际控股股份,以全面考虑拟定交易。
AXIM未能履行 交易中他们的部分,合同被终止。公司没有退还股票,而是收到了现金。由于这一收入不是从任何正常的贸易交易中获得的,因此在账目中作为单独的项目进行核算。该等股份的退回及 其后收入为国际控股的一次性收入项目,并无导致综合财务状况表 所示的权益变动。
| (2) | 政府须知 赠款 |
来自政府补助的其他收入与澳大利亚政府就COVID-19疫情提供的援助有关。本公司可合理保证其已 遵守该等授出的附带条件。于二零二一年及二零二零年六月三十日,该等 补助并无附带未达成条件或其他或然事项。
F-68
4.细分市场信息
确定可报告的运营区段
IFRS 8营运分部要求根据有关集团组成部分的内部报告确定营运分部,行政总裁会定期审阅该内部报告,以便为该分部分配资源及评估其表现。
本集团之经营分部乃 参考首席执行官就本集团 经营及营运资金分配作出决定时所使用之每月管理账目而厘定。鉴于本集团的规模及性质,董事会整体上已被确定为 首席执行官。
根据《国际财务报告准则》第8号所载的量化门槛,在截至2020年6月30日的财政年度内,该集团根据所提供的产品和服务(1)医用大麻和(2)口腔和牙科器械的不同而分为两个经营部门。于2020年6月30日,本公司出售口腔及牙科器械业务(见附注6),以完全专注于医用大麻产品的销售及开发。本集团于截至2021年6月30日止财政年度主要分为一个营运分部,包括医用大麻,而口腔及牙科器材则在各自的营运分部记录截至2021年6月30日止财政年度的其他相关开支。
本集团只有一个地理区块,即澳大利亚。
本集团整体该等分部的收入及业绩列载于简明全面收益表,而本集团整体资产及负债则列载于简明财务状况表。各分部当期收入和支出以及会计年度结束时的资产和负债汇总表如下。
细分结果
| 口腔和牙科 设备 (已停产) | 迷幻 | 药用 大麻 | 未分配 | 已整合 | ||||||||||||||||
| 截至2021年6月30日止年度 | ||||||||||||||||||||
| 来自外部客户的收入 | $ | — | $ | — | $ | 1,897,596 | (1) | $ | — | $ | 1,897,596 | |||||||||
| 利息收入 | — | — | 6 | 2,673 | 2,679 | |||||||||||||||
| 其他收入 | — | — | — | 73,069 | 73,069 | |||||||||||||||
| 折旧 | — | — | — | — | — | |||||||||||||||
| 摊销 | — | — | — | — | — | |||||||||||||||
| 其他费用 | — | (768,316 | ) | (5,202,371 | ) | (7,375,456 | ) | (13,346,143 | ) | |||||||||||
| 所得税后分部亏损 | $ | — | $ | (768,316 | ) | $ | (3,304,769 | ) | $ | (7,299,714 | ) | $ | (11,372,799 | ) | ||||||
| 细分资产 | $ | — | $ | 2,000 | $ | 104,267 | $ | 9,222,528 | $ | 9,328,795 | ||||||||||
| 分部负债 | $ | — | $ | (86,522 | ) | $ | (668,527 | ) | $ | (755,049 | ) | |||||||||
| 截至2020年6月30日止年度 | ||||||||||||||||||||
| 来自外部客户的收入 | $ | 718,656 | $ | — | $ | 604,884 | (1) | $ | — | $ | 1,323,540 | |||||||||
| 利息收入 | 8 | — | 2 | 4,543 | 4,553 | |||||||||||||||
| 其他收入 | 140,816 | — | 212,625 | — | 353,441 | |||||||||||||||
| 折旧 | (14,854 | ) | — | — | — | (14,854 | ) | |||||||||||||
| 摊销 | (21,688 | ) | — | — | — | (21,688 | ) | |||||||||||||
| 其他费用 | (1,591,290 | ) | — | (2,899,761 | ) | (1,851,577 | ) | (6,342,628 | ) | |||||||||||
| 所得税后分部亏损 | $ | (768,352 | ) | $ | — | $ | (2,082,250 | ) | $ | (1,847,034 | ) | $ | (4,697,636 | ) | ||||||
| 细分资产 | $ | — | $ | — | $ | 662,414 | $ | 3,573,665 | $ | 4,236,079 | ||||||||||
| 分部负债 | $ | — | $ | — | $ | (567,423 | ) | $ | (504,228 | ) | $ | (1,071,651 | ) | |||||||
| (1) | 在截至2021年6月30日和2020年6月30日的财年中,医用大麻的总收入中,100%来自Cannvalate Pty Ltd的分销网络。 |
F-69
5.所得税
综合财务报表中税前会计(亏损)/营业利润的表面所得税(费用)/收益 与所得税收益的对账如下:
| 已整合 | ||||||||
| 截至六月三十日止年度 2021 | 截至的年度 6月30日 2020 | |||||||
| 税前会计亏损 | $ | (11,372,799 | ) | $ | (4,697,636 | ) | ||
| 按适用税率26%计算的所得税福利(二零二零年: (27.5%) | $ | 2,956,928 | $ | 1,291,850 | ||||
| 适用税率为26%的不可抵扣费用 (2020(占27.5%) | (1,192,112 | ) | (155,498 | ) | ||||
| 未确认的递延税项资产 | (1,764,816 | ) | (1,136,352 | ) | ||||
| 所得税优惠 | $ | — | $ | — | ||||
| 的可抵扣暂时性差异 未确认递延所得税资产的 | ||||||||
| 未使用税项亏损为26%(二零二零年: (27.5%) | $ | 5,425,637 | $ | 3,872,022 | ||||
| 未确认的税收利益净额 | $ | 5,425,637 | $ | 3,872,022 | ||||
未确认的税收优惠净额未 在合并财务报表中确认为资产,因为在《国际会计准则》第12号《所得税》的背景下,认为收回资产的可能性不大。
只有在以下情况下才能实现好处:
| a) | 该 公司获得的未来应课税收入的性质和金额足以使 要实现的利益。 |
| b) | 该 公司遵守法律规定的扣除条件;以及 |
| c) | 否 税法的变化对公司实现利益产生不利影响。 |
6.终止经营业务
描述
于2020年6月30日,本集团出售其100% 附属公司- Gameday International Pty Ltd(“Gameday”),代价为29,277元,即其资产于当日的账面值,因此并无产生出售亏损。Gameday生产和销售本集团的牙科器械, 自2016年以来一直亏损。由于COVID-19大流行,社区体育活动关闭,直接影响其主要产品(运动护齿套)的销售,令其进一步受到影响。出售Gameday将使本集团得以专注于其药用大麻业务。
F-70
财务执行情况资料
| 已整合 | ||||||||
| 6月30日终了年度 2021 | 截至的年度 6月30日 2020 | |||||||
| 来自外部客户的收入 | $ | — | $ | 718,656 | ||||
| 利息收入 | — | 8 | ||||||
| 其他收入 | — | 140,816 | ||||||
| 产品成本 | — | (589,570 | ) | |||||
| 行政管理费用 | — | (38,985 | ) | |||||
| 广告和促销 | — | (218,865 | ) | |||||
| 折旧 | — | (14,854 | ) | |||||
| 摊销 | — | (21,688 | ) | |||||
| 处置财产、厂房和设备的损失 | — | (13,654 | ) | |||||
| 减值成本 | — | (82,989 | ) | |||||
| 入住费 | — | (81,493 | ) | |||||
| 工资和员工福利支出 | — | (565,734 | ) | |||||
| 所得税前亏损 | — | (768,352 | ) | |||||
| 所得税优惠 | — | — | ||||||
| 已终止经营所得税后亏损 操作 | $ | — | $ | (768,352 | ) | |||
| 处置资产和负债的账面金额 | ||||||||
| 现金 | $ | — | $ | 17,970 | ||||
| 盘存 | — | 6,000 | ||||||
| 其他流动资产 | — | 6,100 | ||||||
| 贸易和其他应付款 | — | (793 | ) | |||||
| 销售总收益 | $ | — | $ | 29,277 | ||||
减值成本
在出售Gameday的过程中,对收购方不想要的Gameday的各种资产进行了评估,以确定其未来价值或出售能力。具体地说, 这些资产包括专门或定制的厂房和设备、资本化的无形资产以及应收账款的回收。
对于这些资产中的每一项,确定其未来价值可以忽略不计,在截至2020年6月30日的财政年度内,每项资产对总减值成本的贡献如下:
(I)厂房及设备
| 原始成本 | 累计 折旧 | 账面价值 在此之前 减值 | ||||||||||
| $ | 76,136 | $ | (32,221 | ) | $ | 43,915 | (A) | |||||
(二)无形资产
| 原始成本 | 累计 摊销 | 账面价值 在此之前 减值 | ||||||||||
| $ | 116,731 | $ | (89,042 | ) | $ | 27,689 | (B) | |||||
F-71
(三)应收账款
| 原始账面价值 | 可回收 金额 | 账面价值 在.之前 损伤 | ||||||||||
| $ | 11,635 | $ | (250 | ) | $ | 11,385 | (C) | |||||
| 减值成本(A+B+C) | $ | 82,989 | ||||||||||
7.每股亏损
| 年
结束 6月30日 2021 | 年
结束 6月30日 2020 | |||||||
| 每股基本亏损-持续和非持续运营-每股10美分 | $ | (1.16 | ) | $ | (0.69 | ) | ||
| 每股基本亏损-持续运营-每股10美分 | $ | (1.16 | ) | $ | (0.57 | ) | ||
| 每股基本亏损 | ||||||||
| 计算每股基本亏损时使用的普通股亏损和加权平均数如下: | ||||||||
| -持续业务和非持续业务的亏损(美元) | $ | (11,372,799 | ) | $ | (4,697,636 | ) | ||
| -持续经营亏损(美元) | $ | (11,372,799 | ) | $ | (3,929,284 | ) | ||
| --普通股加权平均数(个) | 976,931,338 | 684,035,399 | ||||||
8.派发股息
在截至2020年6月30日或2021年6月30日的两个年度内,该公司尚未宣布派息。
9.现金
| 已整合 | ||||||||
| 2021年6月30日 | 6月30日 2020 | |||||||
| 银行现金和手头现金 | $ | 9,123,617 | $ | 3,603,390 | ||||
| $ | 9,123,617 | $ | 3,603,390 | |||||
银行现金以银行每日存款利率为基础按浮动利率赚取利息。
I.将各年度的亏损与经营活动的现金流量净额进行对账:
| 年
结束 6月30日 2021 | 年
结束 6月30日 2020 | |||||||
| 所得税后亏损 | $ | (11,372,799 | ) | $ | (4,697,636 | ) | ||
| 非现金支出(收入): | ||||||||
| 基于股份的支付 | 600,043 | 565,448 | ||||||
| 折旧及摊销 | — | 36,542 | ||||||
| 投资者关系服务的非现金费用 | 3,781,344 | — | ||||||
| 释放Gameday销售退款准备金 | (15,484 | ) | — | |||||
| 年假非现金支出 | 91,354 | 97,221 | ||||||
| 净资产和净负债变动情况: | ||||||||
| 应收账款的减少/(增加) | 214,903 | (315,484 | ) | |||||
| 库存减少/(增加) | 183,159 | (30,355 | ) | |||||
| 其他流动资产减少 | 172 | 2,928 | ||||||
| 贸易及其他应付款(增加)/减少 | (291,311 | ) | 464,223 | |||||
| 其他负债减少 | (101,161 | ) | (30,221 | ) | ||||
| 运营中使用的现金流 | $ | (6,909,780 | ) | $ | (3,907,334 | ) | ||
F-72
二.非现金筹资活动
本公司已记录以股份为基础付款形式之非现金交易 ,如该等综合财务报表附注12所披露。截至2021年止年度,以股份为基础的 付款总额为600,043元(2020年:565,448元)。
本公司于截至2021年6月30日止年度录得740,666元非现金交易,于2020年10月2日发行30,164,690份非上市期权,作为与行使2. 62亿份IHLOB期权系列有关的经纪人支持的代价。该数额记作印发费用。于截至二零二一年六月三十日止年度后,该等购股权已获行使(附注23)。
截至2019年6月30日,公司记录了与等待股东批准的期权发行有关的其他流动负债 244,403美元。于截至二零二零年六月三十日止年度, 此负债已透过发行购股权结算,届时负债结余244,403元已转拨至权益。
10.贸易及其他应收款项(流动)
| 已整合 | ||||||||
| 2021年6月30日 | 6月30日 2020 | |||||||
| 当前 | ||||||||
| 应收贸易账款 | $ | — | $ | 225,125 | ||||
| 其他应收账款 | 53,447 | 51,026 | ||||||
| 可收回的商品及服务税 | 115,641 | 137,117 | ||||||
| $ | 169,088 | $ | 413,268 | |||||
与 客户期初应收账款、合同资产和合同负债:
于截至2021年及2020年6月30日止年度内,并无确认来自前几年已履行(或部分已履行)履约责任的收入。
预期信贷损失
本集团采用国际财务报告准则第9号简化模式 确认所有应收贸易账款的终身预期信贷损失,因为该等项目并无重大融资成分。
在衡量预期信贷损失时,由于贸易应收账款具有共同的信用风险特征,因此已按集体进行评估。它们已根据过期天数和客户的地理位置进行了 分组。
11.其他资产(流动)
| 已整合 | ||||||||
| 6月30日 2021 | 6月30日 2020 | |||||||
| 提前还款 | $ | 29,784 | $ | 11,083 | ||||
| 办公室租赁债券 | — | 25,179 | ||||||
| 预付临床试验保险 | $ | 6,306 | $ | — | ||||
| $ | 36,090 | $ | 36,262 | |||||
12.基于股份的支付
公司可能会不时向其员工、董事或顾问发行股票 证券(即股票、期权或绩效权利),以使绩效奖励 与公司增长和战略目标的实现更紧密地结合起来。如果收款人是本公司的董事,则在向任何董事发行任何股权证券之前,必须根据澳交所上市规则寻求股东的批准。
F-73
已发行股份的公允价值
作为补偿而发行的股份的公允价值 是根据股份于授出日的收市价厘定,并于归属期间列支。
选项
下表汇总了本公司截至2021年和2020年6月30日止三个年度的股票期权活动:
| 第
个 选项 | 加权 平均值 锻炼 价格 | 加权 平均值 剩余 合同 生命 (年) | ||||||||||
| 截至2019年6月30日的未偿还款项 | 262,960,728 | $ | 0.040 | 1.255 | ||||||||
| 授与 | 412,169,705 | $ | 0.139 | |||||||||
| 已锻炼 | (34,427,321 | ) | $ | 0.031 | ||||||||
| 截至2020年6月30日 | 640,703,112 | $ | 0.104 | 0.748 | ||||||||
| 授与 | 72,414,690 | $ | 0.152 | |||||||||
| 已锻炼 | (286,500,523 | ) | $ | 0.044 | ||||||||
| 过期或被没收 | (88,000,000 | ) | $ | 0.104 | ||||||||
| 截至2021年6月30日的未偿还款项 | 338,617,279 | $ | 0.166 | 0.568 | ||||||||
| 自2021年6月30日起可行使 | 337,117,279 | $ | 0.167 | |||||||||
截至2021年6月30日和2020年6月30日,未偿还期权的行权价在0.05美元至0.25美元之间。截至二零二一年六月三十日止年度,已授出购股权之加权平均授出日公平价值分别为0.10美元及0.22美元。
截至2021年6月30日,与未归属股票期权相关的未确认补偿成本总额为116,680美元,预计将在约一年的加权平均期间内确认。
在截至2021年6月30日的年度内,向员工和顾问发放了以下股票期权,作为基于股票的付款:
| 数 | 授予日期 | 期满 日期 | 锻炼 价格 | 总计 公允价值 | ||||||||||||
| 授予第三方的期权 | ||||||||||||||||
| 未列出的期权 | 10,000,000 | 2020年11月20日 | 2023年11月20日 | $ | 0.15 | $ | 647,348 | |||||||||
| 未列出的期权 | 10,000,000 | 2020年11月20日 | 2023年11月20日 | $ | 0.25 | $ | 527,766 | |||||||||
| 未列出的期权 | 10,000,000 | 25-2月-2021年 | 2023年11月20日 | $ | 0.20 | $ | 1,352,588 | |||||||||
| 未列出的期权 | 10,000,000 | 25-2月-2021年 | 2023年11月20日 | $ | 0.25 | $ | 1,253,140 | |||||||||
| 未列出的期权 | 30,164,690 | 2020年10月2日 | 2021年9月30日 | $ | 0.08 | $ | 740,665 | |||||||||
| 授予第三方的期权总额 | 70,164,690 | $ | 4,521,507 | |||||||||||||
| 授予员工的期权 | ||||||||||||||||
| 未列出的期权 | 750,000 | 2020年7月1日 | 2025年6月30日 | $ | 0.05 | $ | 25,432 | |||||||||
| 未列出的期权 | 750,000 | 2020年7月1日 | 2026年6月30日 | $ | 0.05 | $ | 27,450 | |||||||||
| 未列出的期权 | 750,000 | 2020年7月1日 | 2027年6月30日 | $ | 0.05 | $ | 29,040 | |||||||||
| 授予员工的期权合计 | 2,250,000 | $ | 81,922 | |||||||||||||
| 选项总数 | 72,414,690 | $ | 4,603,429 | |||||||||||||
F-74
在截至2020年6月30日的年度内,向员工和顾问发放了以下股票期权,作为以股票为基础的付款:
| 数 | 授予日期 | 期满 日期 | 锻炼 价格 | 总计 公允价值 | ||||||||||||
| 授予第三方的期权 | ||||||||||||||||
| 未列出的期权 | 10,000,000 | 2019年8月8日 | 2020年1月1日 | $ | 0.02 | $ | 85,251 | |||||||||
| 未列出的期权 | 10,000,000 | 2019年8月8日 | 2020年5月1日 | $ | 0.03 | $ | 51,531 | |||||||||
| 未列出的期权 | 12,000,000 | 2019年8月8日 | 2020年5月1日 | $ | 0.04 | $ | 34,966 | |||||||||
| 未列出的期权 | 14,000,000 | 2019年8月19日 | 2020年12月1日 | $ | 0.06 | $ | 30,297 | |||||||||
| 未列出的期权 | 16,000,000 | 2019年8月19日 | 2020年12月1日 | $ | 0.08 | $ | 18,248 | |||||||||
| 未列出的期权 | 18,000,000 | 2019年8月19日 | 2020年12月1日 | $ | 0.10 | $ | 11,606 | |||||||||
| 未列出的期权 | 20,000,000 | 2019年8月19日 | 2020年12月1日 | $ | 0.12 | $ | 7,700 | |||||||||
| 未列出的期权 | 20,000,000 | 2019年8月19日 | 2020年12月1日 | $ | 0.14 | $ | 4,804 | |||||||||
| 未列出的期权 | 89,919,705 | 五花八门(1) | 2021年9月30日 | $ | 0.08 | $ | 449,067 | |||||||||
| 授予第三方的期权总额 | 209,919,705 | $ | 693,470 | |||||||||||||
| 授予员工的期权 | ||||||||||||||||
| 未列出的期权 | 750,000 | 26-6-2020 | 2025年6月30日 | $ | 0.05 | $ | 24,817 | |||||||||
| 未列出的期权 | 750,000 | 26-6-2020 | 2026年6月30日 | $ | 0.05 | $ | 26,424 | |||||||||
| 未列出的期权 | 750,000 | 26-6-2020 | 2027年6月30日 | $ | 0.05 | $ | 27,754 | |||||||||
| 未列出的期权 | 200,000,000 | 26-6-2020 | 2021年9月30日 | $ | 0.20 | $ | 306,299 | |||||||||
| 授予员工的期权合计 | 202,250,000 | $ | 385,294 | |||||||||||||
| 选项总数 | 412,169,705 | $ | 1,078,764 | |||||||||||||
| (1) | 向2019年7月至2019年7月股权融资的参与者发行了22,368,422份期权,并向根据该等融资认购的股份附加了 份期权,向支持该等股权融资的经纪商发行了33,000,000份期权。此外,还向2019年10月底融资的 参与者发行了34,551,283份期权,并附上了根据此次融资认购的股份。 |
授予日的公允价值是使用三项式定价或Black-Scholes期权模型独立确定的,该模型考虑了要行使的任何价格、期权或权利的期限、授予日的股价、标的股份的价格波动性以及期权或权利的 期限的无风险利率。用于计算公允价值的三项式和布莱克-斯科尔斯期权定价模型的投入被归类为国际财务报告准则第13号公允价值等级下的第三级投入。
F-75
授予的股权结算股票期权 的公允价值是在授予日使用Black-Scholes期权模型估计的,同时考虑到授予期权的条款和条件,截至2021年6月30日的年度如下:
| $0.08
选项 2021年9月30日 | $0.15
选项 2023年11月20日 | $0.25
选项 2023年11月20日 | $0.20
选项 2023年11月20日 | $0.25
选项 2023年11月20日 | ||||||||||||||||
| 数 | 30,164,690 | 10,000,000 | 10,000,000 | 10,000,000 | 10,000,000 | |||||||||||||||
| 股息率(%) | — | % | — | % | — | % | — | % | — | % | ||||||||||
| 预期波动率(%) | 86 | % | 100 | % | 100 | % | 101 | % | 101 | % | ||||||||||
| 无风险利率(%) | 0.17 | % | 0.11 | % | 0.11 | % | 0.12 | % | 0.12 | % | ||||||||||
| 期权的预期寿命(年) | 1 | 3 | 3 | 2.7 | 2.7 | |||||||||||||||
| 行权价格(分) | 8 | 15 | 25 | 20 | 25 | |||||||||||||||
| 授予日期股价(美分) | 7.7 | 11.5 | 11.5 | 22 | 22 | |||||||||||||||
| 归属日期 | 2020年10月2日 | 2020年11月20日 | 2020年11月20日 | 25-2月-2021年 | 25-2月-2021年 | |||||||||||||||
授予的股权结算股票期权的公允价值在授予日使用Black-Scholes期权模型(对于所有0.05美元期权)和三项期权模型(对于 0.20美元期权)进行估计,同时考虑到授予期权的条款和条件,截至2020年6月30日的年度如下:
| $0.05 选项 2025年6月30日 | $0.05 选项 2026年6月30日 | $0.05 选项 2027年6月30日 | $0.20
选项 2021年9月30日 | |||||||||||||
| 数 | 750,000 | 750,000 | 750,000 | 2,000,000 | ||||||||||||
| 股息率(%) | — | % | — | % | — | % | — | % | ||||||||
| 预期波动率(%) | 92 | % | 92 | % | 92 | % | 93 | % | ||||||||
| 无风险利率(%) | 0.39 | % | 0.48 | % | 0.58 | % | 0.25 | % | ||||||||
| 期权的预期寿命(年) | 5 | 6 | 7 | 1.25 | ||||||||||||
| 行权价格(分) | 5.0 | 5.0 | 5 | 20 | ||||||||||||
| 授予日期股价(美分) | 4.8 | 4.8 | 4.8 | 4.8 | ||||||||||||
| 归属日期 | 2020年6月30日 | 2021年6月30日 | 2022年6月30日 | 请参阅下文第(A)项。 | ||||||||||||
期权的预期寿命基于 历史数据,并不一定指示可能发生的运动模式。预期波动率反映了这样一种假设,即历史波动率预示着未来趋势,这也可能不一定是实际结果。
| (a) | 自授出期权之日起至期权到期日(2021年9月30日至2021年9月30日)为止的任何时间,任何5个交易日内收盘价为每股20美分或以上的股份即可获得期权。 |
表演权
截至以下年度的绩效股票和绩效权利数量的变动:
2021年6月30日
| 安全说明 | 余额为
年初 | 授权者:
《公司》 | 转换为
或 过期 | 余额为
年终 | ||||||||||||
| 表演权(1) | 41,553,593 | — | (41,553,593 | ) | — | |||||||||||
| (1) | 30,303,593股表演权在达到指定业绩关口时转换为普通股 表演权到期11,250,000股。 |
F-76
2020年6月30日
| 安全说明 | 余额为 年初 |
授权者 公司 |
已转换或 已过期 |
余额为 年终 |
||||||||||||
| 表演权(1) | 24,166,668 | 32,303,593 | (14,916,668 | ) | 41,553,593 | |||||||||||
| 业绩股(2) | 20,000,002 | — | (20,000,002 | ) | — | |||||||||||
| (1) | 经股东批准,公司于2020年6月26日发行了32,303,593项绩效权利,作为公司首席医疗官 (Sud Agarwal博士)的薪酬。11,916,668股履约权利 在达到指定业绩关口时转换为普通股的权利 和3,000,000股履约权利到期。 |
| (2) | 业绩 本公司于2016年11月重新上市时,向持有人发行了股票。这些股票的业绩 与现已停产的设备业务中的销售目标相关 。这些目标没有实现,业绩份额于2020年6月30日失效。 |
基于价值的绩效权利具有以市场为基础的里程碑 。在计算这些权利的公允价值时,已使用三项期权模型估计了实现这些里程碑(与不同市值水平相关)的可能性,2020年6月30日的主要投入为授出日期股价。0.048美元;无风险利率0.25%;波动率95%,总价值469,324美元。于截至2021年及2020年6月30日止年度内,表演权支出分别为280,253美元及189,071美元。
考虑到管理层S对达到里程碑的可能性的估计,里程碑表演权的估值为授出日的股价(0.048美元)。
13.库存
| 已整合 | ||||||||
| 6月30日 2021 | 6月30日 2020 | |||||||
| 当前 | ||||||||
| 过境药用大麻产品 | $ | — | $ | 183,159 | ||||
| 总库存 | $ | — | $ | 183,159 | ||||
14.贸易及其他应付款项(流动)
| 已整合 | ||||||||
| 6月30日 2021 | 6月30日 2020 | |||||||
| 贸易应付款 | $ | 233,117 | $ | 590,099 | ||||
| 应计费用 | 381,717 | 316,046 | ||||||
| 员工休假权利 | 140,215 | 48,861 | ||||||
| $ | 755,049 | $ | 955,006 | |||||
F-77
员工休假权益对账:
| 年
结束 6月30日 2021 | ||||
| 截至2020年7月1日的账面价值 | $ | 48,861 | ||
| 雇员在年内累积的假期 | 91,354 | |||
| 2021年6月30日的余额 | $ | 140,215 | ||
| 年
结束 6月30日 2020 | ||||
| 截至2019年7月1日的账面价值 | $ | 36,899 | ||
| 雇员在年内累积的假期 | 11,962 | |||
| 2020年6月30日余额 | $ | 48,861 | ||
15.其他流动负债
| 已整合 | ||||||||
| 6月30日 2021 | 6月30日 2020 | |||||||
| 销售准备金 退款(1) | $ | — | $ | 116,645 | ||||
| $ | — | $ | 116,645 | |||||
| (1) | 根据出售设备业务的销售协议条款(参见附注6) 本公司有责任向买方支付与2020年6月30日之后退款的设备相关的任何退款。 本公司于2020年6月30日记录及估计金额。 在截至2021年6月30日的财政年度,本公司达成和解,鉴于与退货有关的历史滞后,本公司将不再负责退款。之后, 公司将剩余余额记为其他收入。 |
销售退款对账拨备:
| 年
结束 6月30日 2021 | ||||
| 截至2020年7月1日的账面价值 | $ | 116,645 | ||
| 已偿还的款项 | (101,161 | ) | ||
| 清偿记入其他收入的负债 | (15,484 | ) | ||
| 2021年6月30日的余额 | $ | — | ||
16.已发行资本
(A)已发行资本
| 已整合 | ||||||||
| 6月30日 2021 | 6月30日 2020 | |||||||
| 普通股 | $ | 45,852,107 | $ | 34,192,043 | ||||
F-78
(B)普通股在过去几年中的波动
| 年
结束 6月30日 2021 (没有。的 份) | 年
结束 6月30日 2020 (没有。的 份) | |||||||
| 在年初 | 748,654,489 | 581,897,040 | ||||||
| 新股发行-配售 | — | 114,663,460 | ||||||
| 发行新股-股份支付 | 2,952,619 | 5,750,000 | ||||||
| 表演权的转换 | 30,303,593 | 11,916,668 | ||||||
| 期权的行使 | 286,500,523 | 34,427,321 | ||||||
| 在年底 | 1,068,411,224 | 748,654,489 | ||||||
普通股使持有人有权按所持股份数目按比例参与股息和本公司清盘所得款项。举手表决时,出席会议的每位股东 有权投一票,投票表决时,每股股份有权投一票。普通股没有面值,本公司没有有限的法定资本。
17.储备
基于权益的保费准备金
| 已整合 | ||||||||
| 年
结束 6月30日 2021 | 年
结束 6月30日 2020 | |||||||
| 年初余额 | $ | 1,490,588 | $ | 451,643 | ||||
| 发给顾问的期权(1) | 4,522,010 | 449,093 | ||||||
| 向Cannvalate Pty Ltd.发行的期权(2) | — | 244,403 | ||||||
| 发行给管理层和董事的股权工具 | 600,043 | 345,449 | ||||||
| 年终余额 | $ | 6,612,641 | $ | 1,490,588 | ||||
| (1) | 于截至2021年6月30日止年度内,向投资者关系服务顾问发行了40,000,000份可按0.15美元、0.20美元及0.25美元行使的期权。此外,发行了30,164,690份可按0.08美元行使的期权 ,作为经纪商支持行使 2.62亿英镑上市的IHLOB期权系列的代价(见附注12)。于截至2020年6月30日止年度内,向支持2019年7月至2019年7月融资的经纪商发行了33,000,000份可按0.08美元行使并于2021年9月30日到期的期权。这些期权已使用Black-Scholes期权模型进行了估值,其输入为授予日期为0.04美元的股价、0.24%的无风险利率和92%的波动率。 |
| (2) | 2019年8月9日,在股东大会上,批准向Cannvalate Pty Ltd发放120,000,000份期权 ,作为Cannvalate管理公司临床计划的报酬。这笔款项最初于2019年6月30日记为应付款项,并于2020年6月30日终了年度转入储备金。这些期权是使用Black-Scholes期权模型进行估值的,投入是授予日期股价0.02美元,无风险利率1.07%,波动率59%。 |
股权溢价准备金用于记录为筹集资本而发行的股权的价值,以及用于以股份为基础的付款。
F-79
18.核数师的薪酬
| 已整合 | ||||||||
| 年
结束 6月30日 2021 | 年
结束 6月30日 2020 | |||||||
| 审计或审查公司的财务报告 | ||||||||
| 审计师应收和应收的金额: | ||||||||
| 审计服务--HLB Mann Judd | $ | 37,785 | $ | 37,000 | ||||
| 审计服务-Withum Smith&Brown(美国审计师) | 287,975 | — | ||||||
| 总计 | $ | 325,760 | $ | 37,000 | ||||
Withum Smith,Brown,PC获委任为美国(“美国”)核数师,为本公司证券在美国上市作准备。于截至2021年6月30日止年度内,所进行的工作涉及审计符合国际会计准则理事会的财务报表所发布的PCAOB准则及国际财务报告准则。
审计师的上述报酬已在综合全面损失表中计入合规、法律和监管费用。
19.金融工具
本集团的主要金融工具 包括现金和短期存款及可转换票据。
这些金融工具的主要目的是为本集团的业务筹集资金。本集团有多项其他财务负债,例如贸易应付账款,而这些负债 直接来自其业务。本集团现时及过去数年的政策是不得进行金融工具的交易 。本集团金融工具产生的主要风险为现金流利率风险、流动性风险及信用风险。董事会审阅并同意管理上述每项风险的政策,现概述如下。
有关各类金融资产、金融负债及权益工具的主要会计政策及采用的方法的详情,包括确认准则、计量基准及确认收入及支出的基准,已于综合财务报表附注1中披露。
(A)降低利率风险
本集团面对市场利率变动的风险 主要与本集团的浮息短期存款有关。
本集团对金融资产及金融负债的利率风险,详见本附注的敏感度分析部分。
(B)敏感性分析
在截至2021年6月30日及2020年6月30日止年度内,若利率较实际利率高或低50个基点,而所有其他变数保持不变,则本年度的税后业绩将会有实质变化。对股本的影响应该是一样的。
(C)净公允价值
现金及不计息金融资产及负债的公允价值净值与其账面价值相若。
(D)商品价格风险
本集团对价格风险的风险敞口微乎其微。
(E)降低信用风险
本集团并无重大信贷风险集中 。
F-80
至于因本集团其他金融资产(包括现金、可供出售金融资产及若干衍生工具)而产生的信贷风险, 本集团因交易对手违约而产生的信贷风险,最高风险敞口等于该等工具的账面金额 。
由于本集团只与公认的第三方进行交易,因此不需要抵押品。
(F)降低流动性风险
本集团的目标是透过发行股份及发行可换股票据,在融资的连续性与灵活性之间维持平衡。
本集团于2021年6月30日的合同负债 如下:
| 描述 | 少于
1个月 | 1至3个月 | 3个月
到 1年 | 1至5年 | 总计 | |||||||||||||||
| 已整合 | ||||||||||||||||||||
| 会计和应计项目 | $ | 614,834 | $ | — | $ | — | $ | — | $ | 614,834 | ||||||||||
| $ | 614,834 | $ | — | $ | — | $ | — | $ | 614,834 | |||||||||||
本集团于二零二零年六月三十日之合约负债如下:
| 描述 | 少于
1个月 | 1至3个月 | 3个月
到 1年 | 1至5年 | 总计 | |||||||||||||||
| 已整合 | ||||||||||||||||||||
| 会计和应计项目 | $ | 906,145 | $ | — | $ | — | $ | — | $ | 906,145 | ||||||||||
| $ | 906,145 | $ | — | $ | — | $ | — | $ | 906,145 | |||||||||||
(G)资本管理公司
本集团管理资本的目标 是保障其持续经营的能力,以便继续为股东提供回报,并为其他利益相关者提供利益。由于本集团过往活动的性质,作为一项药物开发业务,本集团并不具备获得信贷安排的渠道,因此不受任何外部资本规定的规限,本集团的主要资金来源为股权融资及无抵押可换股票据。因此,本集团资本风险管理的目标是平衡目前的营运资金状况与需求和企业管理费用。这是通过保持适当的流动资金以满足预期的运营要求来实现的,以期根据需要启动融资。
20.承付款和意外开支
租赁承诺额
本集团持有其位于墨尔本和澳大利亚悉尼的写字楼的两份商业租约。这两份租约的租期均为12个月,自租约开始之日起计。截至6月30日,这些合同规定的未来最低付款如下:
| 已整合 | ||||||||
| 6月30日 2021 | 6月30日 2020 | |||||||
| 一年内 | $ | 56,496 | $ | 9,697 | ||||
| 一到三年 | 37,916 | — | ||||||
| 合同最低付款总额 | $ | 94,412 | $ | 9,697 | ||||
在过渡到IFRS 16时,这些租赁 未资本化。
F-81
21.关键管理人员薪酬 及关联方披露
IncanneX Healthcare Limited在过去几年的主要管理人员包括:
特洛伊·瓦伦丁
彼得·威多斯
乔尔·莱瑟姆
苏德·阿加瓦尔
关键管理人员薪酬
| 已整合 | ||||||||
| 年
结束 6月30日 2021 | 年
结束 6月30日 2020 | |||||||
| 短期雇员福利 | $ | 761,231 | $ | 638,201 | ||||
| 基于股份的支付(1) | 672,699 | 565,448 | ||||||
| 离职后福利 | 38,877 | 29,985 | ||||||
| KMP薪酬总额 | $ | 1,472,807 | $ | 1,233,634 | ||||
| (1) | 本公司注意到该金额与截至2021年6月30日止年度的综合权益变动表 不符。本公司注意到,由于期权被没收,向Cannvalate Pty Ltd发行的88,000,000份股票期权的72,656美元的费用在 发生了冲销。这些期权是在截至2020年6月30日的财政年度内发行的。 |
与相关实体的交易
关联方之间的交易按商业 条款及条件进行,除非另有说明,否则该等条款及条件并不比其他方可获得的条款及条件优惠。
于截至二零二一年六月三十日止年度,华伦丁先生为董事的实体Align Capital Pty Ltd(“Align”)获支付97,976美元(二零二零年:145,200美元)费用。 Align受聘为本公司于年内进行的各项融资活动的牵头经办人。
Cannvalate Pty Ltd(Cannvalate)是一个实体,Sud Agarwal博士是该实体的大股东、首席执行官和董事成员。2019年3月,本公司与Cannvalate签订经销协议。如附注4所述,在截至2020年6月30日的财政年度中,药用大麻的总收入中,100%是通过Cannvalate的分销网络。该协议不再有效,于2021年6月终止。
如附注19所述,于2019年8月9日, 在股东大会上,批准向Cannvalate发行120,000,000份期权,作为Cannvalate管理层对本公司临床计划的薪酬 。这笔款项最初于2019年6月30日记为应付款项,并于截至2020年6月30日止年度转账至储备金。
截至2021年6月30日,应向相关方支付的款项为229,889美元,包括在综合财务状况表上的贸易和其他应付款中。
F-82
22.受控实体的详细信息
综合财务报表包括 IncanneX Healthcare Limited(“IHL”)及其全资附属公司IncanneX Pty Ltd(“IXPL”)的财务报表。 IXPL于澳洲注册成立,IHL拥有IXPL已发行普通股的100%(2020年:100%)。
于二零二零年六月三十日,本集团全数出售其100%附属公司赛马天国际私人有限公司(“赛马日”)。
23.后续事件
于2021年7月21日,本公司发行了239,103股普通股,原因是期权持有人以每股0.08美元的行权价行使了非上市期权,获得了19,128美元的收益。
于2021年8月16日,本公司因行使“IHLAH”购股权而额外发行2,739,662股普通股,行使价为每股0.08美元 ,所得款项为219,173美元。
于2021年8月25日,本公司因行使“IHLAH”购股权而发行普通股9,201,186股,行使价为每股0.08美元,所得款项 为736,095美元。
2021年9月7日,由于行使“IHLAH”股票期权,公司发行了 普通股,总收益4,587,667美元:
-7,345,833股普通股,行权价为每股0.08美元
-发行20,000,000股普通股,行权价为每股0.2美元
本公司于2021年9月21日因行使“IHLAH”购股权而发行61,311,557股普通股,行使价为每股0.08美元,所得款项为4,904,925美元。
2021年10月4日,由于行使“IHLAH”股票期权,公司发行了 普通股,总收益5,114,109美元:
-以每股0.08美元的行权价购买11,427,616股普通股
-购买20,999,500股普通股,行权价为每股0.2美元
于2021年10月7日,本公司因行使“IHLAH”购股权而发行6,852,322股普通股,行使价为每股0.08美元,所得款项为548,186美元。
自本财年结束以来,未发生更多重大事件。
24.母实体披露
IncanneX Healthcare Limited(ACN 096 635 246) 是在澳大利亚注册和注册的母公司。
母公司的注册地址为:澳大利亚新南威尔士州NorWest 2153,8世纪电路,105套房。
F-83
母公司 实体的个别财务报表显示以下合计金额。所提供的资料是按照附注1所述的会计政策编制的。
| 6月30日 2021 | 6月30日 2020 | |||||||
| 截至2021年和2020年6月30日的财务状况 | ||||||||
| 流动资产 | $ | 9,222,528 | $ | 3,573,665 | ||||
| 非流动资产(i) | — | — | ||||||
| 总资产 | 9,222,528 | 3,573,665 | ||||||
| 流动负债 | (668,527 | ) | (504,228 | ) | ||||
| 非流动负债 | — | — | ||||||
| 总负债 | (668,527 | ) | (504,228 | ) | ||||
| 净资产 | $ | 8,554,001 | $ | 3,069,437 | ||||
| 股本 | $ | 45,852,107 | $ | 34,192,043 | ||||
| 储量 | 6,612,641 | 1,490,588 | ||||||
| 赤字 | (43,910,747 | ) | (32,613,194 | ) | ||||
| 股东权益 | $ | 8,554,001 | $ | 3,069,437 | ||||
| (i) | 于截至2020年6月30日止年度,给予附属公司的贷款已完全减值。 |
母实体的或有事项
截至2021年和2020年6月30日,没有涉及母实体的或有负债。
对母公司的担保
截至2021年和2020年6月30日,没有涉及母公司实体的担保。
F-84
项目19.展品
以下证据作为本年度报告20-F表的一部分提交:
展品索引
| 展品 | 描述 | |
| 1.1 | IncanneX Healthcare Limited的章程(通过参考公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件1.1注册成立)。 | |
| 2.1 | IncanneX Healthcare Limited与德意志银行美洲信托公司作为托管公司之间的存款协议表格(通过参考公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件2.1而合并) | |
| 2.2 | 美国存托凭证格式(附于附件2.1) | |
| 2.3 | 证券说明(参照公司于2022年10月28日向美国证券交易委员会提交的20-F表格年报附件2.3) | |
| 4.1 | IncanneX Healthcare Limited与Joel Latham的雇佣协议,日期为2020年7月1日(通过参考公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件4.1纳入) | |
| 4.2 | IncanneX Healthcare Limited与Madhukar Bhala之间的服务协议,日期为2021年6月28日(通过参考公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件4.3并入) | |
| 4.3✓ | Alfred Health和IncanneX Healthcare Limited之间的临床试验研究协议,日期为2021年6月22日(通过引用公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件4.4纳入) | |
| 4.4✓ | Alfred Health和IncanneX Healthcare Limited于2020年9月24日签订的临床试验研究协议(通过引用公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件4.5而并入) | |
| 4.5✓ | 西澳大利亚大学与IncanneX Healthcare Limited于2021年4月6日签订的临床试验研究协议(通过参考公司于2022年1月25日向美国证券交易委员会提交的20-F表格注册说明书附件4.6而合并) | |
| 4.6✓ | 临床网络服务(CNS)有限公司(现为澳大利亚新科科技有限公司)与IncanneX Healthcare Limited之间的总顾问协议,日期为2020年6月29日(通过参考公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件4.7而合并) | |
| 4.7✓ | 莫纳什大学和IncanneX医疗有限公司之间的研究服务协议,日期为2020年11月27日(通过引用公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件4.8纳入) | |
| 4.8✓ | 莫纳什大学和IncanneX医疗有限公司之间的研究服务协议,日期为2021年3月10日(通过参考公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件4.9而合并) | |
| 4.9✓ | Avance Clinic Pty Limited和IncanneX Healthcare Limited之间的主服务协议,日期为2021年7月12日(通过参考2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件4.10合并) | |
| 4.10✓ | Novotech Australia Pty Limited和IncanneX Healthcare Limited于2021年2月2日签订的总顾问协议附录2(通过参考公司于2022年1月25日提交给美国证券交易委员会的20-F表格注册声明的附件4.11而并入) | |
| 4.11 | IncanneX Healthcare Limited与APIRx Pharmtics USA LLC卖方之间的股份买卖协议,日期为2022年5月12日。(参照本公司2022年10月28日提交给美国证券交易委员会的20-F表格年报的附件4.11并入) | |
| 4.12# | IncanneX Healthcare Limited与Lekhram Changoer之间的服务协议,日期为2022年8月5日 | |
| 8.1 | 注册人子公司名单(参照公司2022年10月28日提交给美国证券交易委员会的20-F表格年报附件8.1并入) | |
| 11.1# | IncanneX Healthcare Limited的股票交易政策 | |
| 12.1# | 根据依照2002年《萨班斯-奥克斯利法案》第302节通过的1934年《证券交易法》第13a-14(A)和15d-14(A)条颁发首席执行官证书。 | |
| 12.2# | 根据依照2002年《萨班斯-奥克斯利法案》第302节通过的1934年《证券交易法》第13a-14(A)和15d-14(A)条对首席财务官进行认证。 | |
| 13.1# | 根据2002年《萨班斯-奥克斯利法案》第906条通过的《美国法典》第18编第1350条对首席执行官的证明 | |
| 13.2# | 根据2002年《萨班斯-奥克斯利法案》第906条通过的《美国法典》第18编第1350条对首席财务官的证明 | |
| 15.1 | Withum Smith+Brown,PC,日期为2022年10月28日致证券交易委员会的信(通过引用公司于2022年10月28日提交给美国证券交易委员会的20-F表格年度报告的附件15.1而并入) | |
| 15.2# | PKF布里斯班审计机构同意 | |
| 15.3# | 经Smith+Brown同意,PC | |
| 101.INS# | 内联XBRL实例文档。 | |
| 101.SCH编号 | 内联XBRL分类扩展架构文档。 | |
| 101.Cal# | 内联XBRL分类扩展计算链接库文档。 | |
| 101.定义编号 | 内联XBRL分类扩展定义Linkbase文档。 | |
| 101.实验编号 | 内联XBRL分类扩展标签Linkbase文档。 | |
| 101.之前的# | 内联XBRL分类扩展演示文稿Linkbase文档。 | |
| 104# | 封面交互数据文件(格式为内联XBRL,包含在附件101中)。 |
| # | 现提交本局。 |
| ✓ | 本展品中的某些机密信息通过用括号标记此类信息而被遗漏(“[***]“)因为所确定的保密信息不是实质性的,而是登记人视为私人或机密的类型。 |
112
签名
注册人特此证明 它符合提交20-F表格的所有要求,并已正式促使并授权以下签署人代表其签署本 年度报告。
| IncanneX Healthcare Limited | ||
| 撰稿S/乔尔·莱瑟姆 | ||
| 发信人: | 乔尔·莱瑟姆 | |
| 标题: | 董事首席执行官兼董事总经理 | |
日期:2023年10月31日
113