| 中期报告 2023 年 1 月至 9 月 第三季度 |
| 2 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 284 130% 787 2023 年 7 月至 9 月(与 2022 年 7 月至 9 月相比) 2023 年 1 月至 9 月(与 2022 年 1 月至 9 月相比) “我们期待 TARPEYO 可能获得全面批准,用于 治疗我们的 IgA 肾病 PDUFA 的日期为 2023 年 12 月 20 日。” 2023 年 7 月 — 9 月 MSEK TARPEYO 净销售额 Renee Aguiar-Lucander /首席执行官 TARPEYO 净销售额 增长(与 2022 年第三季度相比) msek 2023 年 9 月 30 日中期报告 2023 年 1 月至 9 月 • 净销售额为2.946 亿瑞典克朗,其中 TARPEYO® 净销售额截至2023年9月30日的三个月中,金额为2.836亿瑞典克朗, 。 截至2022年9月30日的三个月中, 的净销售额 为2.601亿瑞典克朗,其中TARPEYO 的净销售额为1.234亿瑞典克朗。 • 截至2023年9月30日和2022年9月30日的三个月,营业亏损分别为1.596亿瑞典克朗和3620万瑞典克朗。 • 截至2023年9月30日和2022年9月30日的三个月,摊薄前后的每股亏损分别为3.14瑞典克朗和0.17瑞典克朗。 • 截至2023年9月30日和2022年9月30日,现金总额分别为7.869亿瑞典克朗和7.362亿瑞典克朗。 • 8月,美国食品药品管理局批准了全面批准用于 治疗IgA肾病的TARPEYO (布地奈德)延迟释放胶囊的 申请的优先审查。 • 8月,Nefecon®(TARPEYO® /Kinpeygo®)的3期NefiGard 研究的完整数据发表在《柳叶刀》上。 • 9月,STADA和Calliditas宣布 已提交Kinpeygo在欧盟的全面上市许可申请 。 • PDUFA 的日期定为 2023 年 12 月 20 日:TARPEYO 有可能在针对 iGaN 患者的完整研究 人群中获得全面批准。 • 中国关于Nefecon的市场 授权的监管决定。 • 欧盟关于Kinpeygo的完全 上市许可的监管决定。 • setanixib 治疗头颈癌的 2 期概念验证研究 的完整数据,预计于 2024 年上半年发布。 • 截至2023年9月30日的九个月中, 的净销售额为7.553亿瑞典克朗,其中 TARPEYO的净销售额为7.285亿瑞典克朗。在截至2022年9月30日的九个月 个月中,净销售额为 3.738亿瑞典克朗,其中TARPEYO的净销售额为 至2.05亿瑞典克朗。 • 截至2023年9月30日和2022年9月30日的九个月中,营业亏损分别为4.148亿瑞典克朗和4.544亿瑞典克朗。 • 截至2023年9月30日和2022年9月30日的九个月中,摊薄前后的每股亏损分别为8.34瑞典克朗和7.72瑞典克朗。 即将到来 6 个月的预期关键事件 |
| 3 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 Calliditas — 开创性的 罕见 疾病新疗法 我们的价值观 Calliditas Therapeutics 利用科学专业知识和特定疾病见解来改善患者的生活。我们是一家商业阶段的生物制药公司,致力于研究、开发和 商业化新疗法,以解决罕见病中未得到满足的 需求。我们致力于扩大治疗 的选择,为 罕见病患者制定新的护理标准,这体现在我们针对未得到满足的医疗需求的创新药物 产品线上。 我们的主要产品提供了一种治疗方案,我们 认为这种治疗方案可以缓解IgA肾病 (iGaN)(也称为 )的疾病。伯杰氏病是一种进行性自身免疫性肾脏疾病 ,对许多患者来说,会导致终末期肾脏 病 (ESRD),需要透析或器官移植。这款 药物产品以 Nefecon® 的名义开发,于 2021 年获得 FDA 的 加速批准,如今以 TARPEYO® 品牌在美国上市 。 它还获得了欧洲 委员会以Kinpeygo® 品牌在欧洲 经济区(EEA)和英国的有条件上市许可。TARPEYO和Kinpeygo 目前正在接受美国食品药品管理局和欧洲药品管理局的审查以获得全面批准, 美国PDUFA的日期定为2023年12月20日。 Nefecon也已在澳门获得批准,正在接受中国、新加坡和韩国监管机构的审查 ,Calliditas 最近建立了合作关系,在日本开发Nefecon并将其商业化。 AGILITY 我们非常灵活,能够快速调整和适应 不断变化的情况和要求。 EXPERTIENCE 我们利用强大的内部经验和能力,同时通过 需要的知识共享和外部合作来补充我们的优势。 INTEGRITY 我们对自己的行为负责,并要求自己 遵守最高的道德标准,在我们的道德 原则的指导下,做出正确的决定。 PIONEER 我们探索新方法,互相赋能 以合规、创新 和务实的方式寻找新的运营方式。 IgA 肾病是肾小球肾炎 疾病中最大的疾病,因此 Nefecon 的市场潜力巨大, 的对外许可协议就证明了这一点,潜在付款 超过3亿美元,包括预付款和 预定义的里程碑以及持续的特许权使用费义务。 我们的后期产品线基于同类首创的氮氧化物抑制剂平台 。我们的主要化合物setanaxib可抑制参与炎症和纤维化途径的 酶 ,是该类别中第一个进入临床阶段的药物。 Setanaxib 目前正在进行针对以炎症和纤维化为特征的罕见 疾病的临床试验,包括 IPF 和 PBC,Calliditas还计划启动一项用于 setanaxib 治疗阿尔波特综合征的试验。此外,基于令人鼓舞的 临床前发现,我们正在对 头颈癌进行概念验证试验,以进一步支持 类药物的作用模式。 虽然我们的总部设在瑞典的斯德哥尔摩,但我们在美国仍占有重要地位,在纽约 和新泽西设有办事处。我们还在法国和瑞士设有办事处, 是我们的发现团队所在地。Calliditas Therapeutics普通股于2018年在纳斯达克斯德哥尔摩上市(CALTX) ,随后,代表我们 普通股的美国存托股份于2020年在美国纳斯达克全球精选市场 上市(CALT)。 |
| 4 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月关键数据 投资亮点 2023 年 7 月至 9 月 1 月至 9 月 1 月至 12 月 (以千瑞典克朗计,每股金额除外或另有说明)2023 2023 2022 2022 净销售额 294,592 755,327 373,837 802,879 其中 TARPEYO 产品销售额 283,591 123,400 728,879 522 204,989 372,247 营业利润/(亏损)(159,573)(36,227)(414,819)(454,438)(421,943) 该期间的所得税前利润/(亏损)(164,082)(15,958)(419,483)(409,417) 收益之前的每股亏损/(亏损)和摊薄后(瑞典克朗)(3.14)(0.17)(8.34)(7.72)(7.78) 用于经营活动的现金流(62,529)(124,725)(457,500)(541,383)(311,354) 截至 (千瑞典克朗,每股金额或其他说明除外)30.09.2023 30.09 9.2022 31.12.2022 期末包括卡利达斯持有的股份在内的注册股份总数 59,580,087 59,157,587 59,580,087 期末归属于母公司股东的权益 352,435 725,936 766,264 期末权益比率为% 22% 48% 39% 在此期间 786,883 736,161 1,249,094 近期和预期的价值驱动因素 NEFECON setanaxib 正面读数 头部和颈部 poc 试验的生物标志物数据 在 启动试验} Alport syndrome 头部和 颈癌 Ph2 试验的最终数据读出 Ph2 IPF 试验的数据读出 ph2b PBC 试验 申请全面批准 在美国 iGaN 和 欧洲 DUFA 日期 12 月 20 日: 可能获得美国 iGaN 的全面批准 TARPEYO 在 的商业坡道 Nefecon 在中国的商业坡道 由 Everest Medicines H1 2023 H2 2024 H2 2024 STADA Kinpeygo 的商业坡道 } 在欧盟 iGaN 获得批准 |
| 5 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月首席执行官声明 8 月,我们很高兴看到我们发表在《柳叶刀》上的全球 随机、安慰剂对照、双盲三期临床 试验NefiGard的完整数据集。如先前报道的那样, 该试验成功达到了其主要终点,提供了证据 表明,在原发性IgA肾病(iGaN)成人患者中,使用Nefecon 16 mg/天的治疗9个月后, (衡量肾脏 功能的指标)的下降幅度在2年内显著降低。此外,在整个期间, 观察到蛋白尿 持续降低,Nefecon 对egFR的积极作用与基线蛋白尿无关,导致 与安慰剂相比 ,在2年内,eGFR的降幅降低了约50%。我们认为,这些结果 支持这样的论点,即该药物有可能延迟 次的透析或移植需求,具有临床意义。我们期待 TARPEYO 有可能在 2023 年 12 月 20 日的 PDUFA 日期获得全面批准。 9月,我们有机会参加了每年两次的iiGann会议,该会议于今年在日本东京举行。 在峰会上,我们展示了5张海报,包括确认性的 生物标志物分析,显示Gd-Iga1显著减少,以及支持该药物 疾病调节机制的循环免疫复合物(Iga-iC)。我们还做了两次口服 陈述,其中一次研究种族差异,一次 表明,使用Nefecon进行治疗可使无微血尿的 患者数量从34%增加到60%,而安慰剂中 的患者数量从32%增加到39%,这具有统计学意义(p=0.0001)。 正如预期的那样,第三季度受到夏季的影响,销售团队也出现了一些人员流动,导致 尽管新处方者持续增长,但新注册人数略有下降。但是,从第四季度早期的趋势来看, 入学率的显著增长令我们感到非常鼓舞。第三季度总收入为2.95亿瑞典克朗,其中 来自TARPEYO的净收入为2.84亿瑞典克朗( 2630万美元)。本季度的营业亏损为1.6亿瑞典克朗 ,其中包括5.2亿瑞典克朗的一次性研发成本 ,主要源于TRANSFORM试验的变化以及 研究项目的停止。本季度 的现金净减少7300万瑞典克朗,我们的现金状况仍然强劲 ,资产负债表上有7.87亿瑞典克朗,根据对TARPEYO的收入预测,我们认为这足以使我们实现现金流收支平衡。我们还开始看到 市场准入统计数据有所改善,新患者开始平均需要 15-20 天才能填补,这反映了我们为持续 改善患者获得渠道所做的努力。 继多次美国顾问委员会会议以及在最近的会议上与肾脏科医生的数十次 面对面互动获得积极反馈后, 《柳叶刀》发布了 完整的第三阶段数据集 ,我们决定启动一项有针对性的美国重点投资 计划,以适当支持和巩固我们的 类别领导地位。这将涉及在相关商业职能部门增加资源 ,以便充分利用 在 2023 年底获得全面批准的可能性。我们相信, 这将最大限度地提高我们在2024年推动收入显著增长的能力 ,而在2023年对成本的影响有限。在接下来的几个月中,我们计划有选择地用 补充现有团队,目标是继续加强我们的医学教育、患者 支持和市场准入活动,以促进患者准入 ,并继续基于 NefiGard 试验数据集建立领先的特许经营权。这种增长是有针对性的、渐进的, 预计不会在2024年大幅增加商业成本基础。 在本季度我还有机会拜访了我们在中国的合作伙伴 Everest Medicines,详细了解他们在 之前的商业活动和准备工作,有望在今年晚些时候获批 ,以及在 4月启动的非常成功的抢先体验患者(EAP)计划。数百名患者报名参加该项目, 使其成为 在中国启动的最成功的EAP项目之一。我们希望Nefecon在今年 年晚些时候在中国获得批准。在中国,肾小球肾炎 的高患病率导致许多年轻人最终接受透析,因此 对患者进行有效治疗的需求至关重要。 季度后的活动包括在费城举行的美国肾脏病学会肾脏周会议,这为我们提供了 许多与全国各地的肾脏科医生 会面和互动的机会。总体情绪以及 与肾脏科医生的多次会面都非常积极, 进一步巩固了我们的信念,即我们 3期试验的强劲长期数据加上已发布的注册数据,例如Radar出版物 ,已在 肾病学界开始了一场关于需要尽早干预和治疗IgAn的重要对话。更多信息请见我的第四季度报告。 我们保持2023年的指导方针,期待TARPEYO有可能在第四季度获得全面批准,并期待2024年激动人心。 *慢性肾脏病临床试验中基于斜率的终点的线性样条混合效应模型。Renée Aguiar-Lucander,首席执行官 |
| 6 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月业务概述 我们的产品线 激动人心的未来旅程 Calliditas 的主要产品以 Nefecon 的名义开发,已在美国和 欧洲获得批准,正在等待中国的批准。我们的产品线包括基于 一流氮氧化物抑制剂平台的开发项目。先导化合物setanaxib是第一种进入临床阶段的氮氧化物抑制剂,是一种选择性氮氧化物1和氮氧化物4抑制剂。Calliditas目前正在试用setanaxib治疗原发性胆管炎(PBC)和头部和 颈部鳞状细胞癌(SCCHN)。还有一项由研究者主导的特发性肺纤维化(IPF) 的试验正在进行中,我们正计划启动一项针对Alport综合征的2期试验。 2023 年 12 月 20 日 PDUFA 日期;美国食品药品管理局决定全面批准 TAPREYO 用于 有进展风险患者 原发性 IgA 肾病 中国的监管决定 Kinpeygo 可能于 2024 年上半年在欧盟获得全面批准 23:靶向启动 Alport 综合征临床试验 H 24:来自头颈部 癌症 2 期研究的完整数据 NEFECON* Setanaxib 临床前阶段 1 期 2 期上市权商业区即将到来的里程碑 * 在美国加速获得批准tradename TARPEYO® 可减少原发性 IgAn 有疾病快速进展风险的成年人的蛋白尿,通常尿蛋白与肌酐比 (UPCR) ≥ 1.5 g/g,并以商品名 Kinpeygo® 在欧洲经济区和英国获得有条件上市许可,用于治疗有尿蛋白与肌酐比率快速疾病进展风险的成年人中的原发性 IgAn (UPCR) ≥1.5 g/g。 商业正在进行的试验计划中的试验研究员主导的试验 iGaN 日本 ROW 前合作伙伴 PDUFA 可能获得全面批准的日期:2023 年 12 月 20 日 iGaN 中国、香港、澳门、 台湾、新加坡、 韩国 接受保密协议,中国收到 FTD 。 预计将在2023年第四季度做出决定,等待EMA审查 的全面营销 授权申请。iGan KINPEYGO 4 mg 改性释放硬胶囊 布地奈德 欧洲、英国、瑞士 全球 SCCHN Global IPF Global Alport Global PBC |
| 7 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月业务概述 我们的商业产品 Calliditas 的主导产品是 有史以来第一种 批准的药物,是 批准的药物,是 有史以来第一种 批准的药物,是唯一专为靶向自身免疫性肾病 起源 IgA 肾病 (IgAn) 而设计的 治疗药物,可改善疾病。 iGaN 是一种严重的进行性疾病,其中,多达 50% 的 患者最终面临在十到二十年内患上终末期肾脏疾病 (ESRD) 的风险。该产品 以 Nefecon® 的名义开发,在美国获准使用 品牌名称 TARPEYO®,在欧洲获准使用 品牌名称 Kinpeygo®。 疾病背景 尽管 iGaN 出现在肾脏中,但有证据表明 它是一种起源于肠道远端的疾病, 具体地说是回肠。Peyer 斑块集中在回肠的肠道相关淋巴组织中, 已被确定为粘膜型 IgA 抗体的主要来源。IgA 肾病患者 粘膜型 IgA 水平升高,与血液中的大多数 IgA 相比,粘膜型 IgA 主要是二聚体或聚合物, 缺乏半乳糖。在iGaN患者中, 遗传易感性与环境、细菌和饮食 因素相结合会导致这些 缺乏 半乳糖的IgA抗体的产量增加。产量的增加, 可能与肠道通透性增加相结合, 会导致这些分泌抗体出现在血液中。 来自完整的3期试验读数的强大数据 NefiGard 是第一项专为 IgA 肾病设计的 3 期试验,以 egFR 测量,显示出具有统计学意义且与临床相关的肾脏保护作用。Calliditas向FDA提交的 补充新药申请是基于 该试验的数据,而Calliditas在强劲的eGFR数据读取的基础上以 申请全面批准。 完整的3期NefiGard试验共包括364名患者,其中包括来自中期分析的200名患者, 在此基础上,Calliditas成功地分别向FDA和EMA申请了加速 和有条件的批准。 完整试验包括所有研究参与者的9个月治疗和15个月的 治疗后观察期 ,以确认长期的肾脏保护。完整的 3期试验的终点评估了接受治疗的 患者与安慰剂患者之间的肾功能差异(以eGFR测量),自每位患者开始给药之日起,在 两年内。 的数据读取于2023年3月进行,并于2023年8月发表在《柳叶刀》上。 3期试验的主要终点是两年内每个时间点观察到的eGFR的时间加权 平均值。 成功满足了主端点,其高度统计的 p 值为 |
| 8 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 IgA 肾病 ——巨大的市场机会 我们的商业合作伙伴关系 • iGaN 是一种罕见的疾病,但它是最常见的 原发性肾小球肾炎。据估计, 在美国的患病率在13万至15万名患者之间, 在欧洲约为20万名患者,在中国高达500万名患者。 • 在美国,我们估计大约有 12,000 名肾脏科医生,其中多达三分之二使用 iGaN 治疗 患者。大约 4,000 到 5,000 名专科医生 为大多数患者看病。大约 40% 的患者在学术环境中接受治疗 ,其余患者在社区接受治疗。1 业务概述 欧盟 Nefecon® 于 2022 年 7 月获得 欧盟委员会的有条件上市许可 (CMA), 随后于 2 月获得英国药品和 保健产品监管局 (MHRA)} 2023,品牌名称为 Kinpeygo® ,用于治疗有快速疾病进展风险的成年人 iGaN,尿液 蛋白质与肌酐比 (UPCR) ≥1.5 g/ 克,成为欧盟第一个也是唯一一个获准的 IgAn 治疗药物。如果获得该司法管辖区的批准, Kinpeygo 将在欧洲 经济区 (EEA)、英国和 瑞士上市,仅由STADA Arzneimittel AG 上市。Calliditas于2021年7月与该公司签订了 许可协议,在欧洲注册 并将Kinpeygo商业化。 STADA 于 2022 年 9 月 在德国推出了Kinpeygo,随后还将推出更多欧洲国家。在德国, 据估计,每年每10万人中有3.1人患上iGaN。 继从完整的NefiGard试验中读出积极数据并向美国食品药品管理局提交了 snDa之后,Calliditas正在与STADA合作评级,寻求欧盟委员会对 Kinpeygo的全面批准,并在整个研究人群中寻求对MHRA的全面批准。 大中华区 Calliditas于 与 Everest Medicines(香港交易所 1952.HK)签订了许可协议 ,在大中华区和新加坡为 iGaN 开发和商业化Nefecon。2022 年 3 月,该协议 扩大到包括韩国。 珠穆朗玛对Nefecon的新药申请(NDA) 于2022年11月被中国 监管机构国家药品监督管理局(NMPA)接受,12月,NMPA 的 药物评估中心(CDE)建议优先审评。监管部门 预计将在2023年第四季度做出决定。 2023 年 4 月,珠穆朗玛峰在中国 海南博鳌试验区推出了 Nefecon,作为首创的 IgA 肾病缓解疗法。该计划允许创新 • 根据KDIGO指南的定义,美国面临疾病进展风险的iGaN患者群体 约为45,000至60,000名患者。2 • 如今,这些患者中的大多数主要接受支持性治疗,例如用于控制血压的仿制ACE和/或 抗逆转录病毒药物,以及其他 广泛使用的有氧和肾脏保护药物。 • 随着特别适用和批准用于iGaN的获批药物 的供应量和知名度的增加 ,以及医生考虑采取更积极的干预措施来保护肾脏功能,我们估计全球iGaN 市场规模将达到50亿至80亿美元。 在 获得国家药品监督管理局监管批准之前, 已在其他地区 获准在海南省实际临床环境中销售和使用的海外药品和医疗器械。数百名患者报名参加这个 抢先体验计划,使其成为 中国推出的 最成功的 EAP 项目之一。 2023 年 10 月,珠穆朗玛峰获得澳门 特别行政区药品管理局的批准 将 Nefecon 用于处于 疾病进展风险的 iGaN 患者, 成为珠穆朗玛峰地区首个 获得 Nefecon 批准的地区。 日本 2022年底,Calliditas与Viatris Inc.(纳斯达克股票代码:VTRS)的子公司Viatris Pharmicals日本公司 建立了合作伙伴关系,在日本 实现Nefecon的商业化。 Viatris 是一家全球医疗保健公司, 总部位于美国, 业务遍及超过 165 个国家和 个地区,还经营大约 40 个制造工厂。 1Veeva OpenData 2023 年,包括所有主要专长为肾脏病的活跃 HCP 2Spherix RealWorld Dynamix |
| 9 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 Nefecon 有潜力 在 iGaN 中建立新的护理标准 业务概述 专为局部靶向疾病 起源而设计的靶向免疫调节剂 与 优化的 rasI 疗法结合使用;可选择间歇治疗,而不是 耐用 eGaN iGaN 有益 有益处 有持续的促茶尿病改良作用 活性成分和 安全概况 作用机制患者关注疗效安全 Nefecon® 是美国食品药品管理局和欧盟委员会批准的第一款用于 iGaN 的药物,也是唯一一种专为靶向 IgA 肾病 (iGaN) 起源而设计的能够改善疾病的治疗药物。 • 需要遗传易感性 但还不够;大多数患者 在20多岁和30多岁时被诊断出来 • 超过 50% 的患者有 在10-20年内发生ESRD的风险,从而导致肾脏移植 • 治疗目标是保持 — 肾功能 • 蛋白尿水平 > 1g/24h 表示存在患病风险进展 和更糟糕的前景 iGaN 患者: |
| 10 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 TARPEYO 销售额持续增长 业务概述 在 2023 年第三季度,Calliditas 的商业团队继续在上一季度取得的成就的基础上再接再厉,进一步巩固了 TARPEYO 作为 IgA 肾病 (iGaN) 变革性治疗选择的地位。值得注意的是,本季度 FDA 批准了对我们的补充新药申请的优先审查,以全面批准 TARPEYO,PDUFA 的日期定为2023年12月20日。该团队正在为新的 适应症的发布做准备,预计美国食品药品管理局将批准在NefiGard试验中研究的全部iGaN患者 人群中使用TARPEYO。 Actinest Journey Ahead 接受了 7 份摘要,用于 ASN 的 演讲。 有机会在 2023 年 11 月 1-4 日在费城 ASN 上交流 P2P 教育和科学数据 。 2023 年 12 月 20 日 PDUFA 日期 有可能获得 的全面批准。 新适应症促销活动 发布——基于肾功能减缓的证据 减缓*,为全部 NefiGard 3 期试验人群发布了新标签。 2023 年第三季度注册的新患者年初至今注册患者:2023 年第三季度有 1,198 名新处方者 LTD 处方者:1,338 *不包括仍在等待最终保险决定的患者 *尚待美国食品药品管理局审查和批准 TARPEYO Touchpoints 的患者获得 Tarpeyo* YTD 在 nefiGard Pahse 3 试验 人群中审查 TARPEYO 的全面批准 — PDUFA 2023 年 12 月 20 日。 来自 《柳叶刀》上发表的 NefiGard 3 期试验的完整结果。 在 igA Nephropathy 基金会主办的 SPARK 2023 研讨会上与 iGaN 社区互动 >200 名患者参加。 在 iiGann 会议上发表了 7 次演讲, 报告了 NeflGard 3 期试验的结果 和生物标志物数据。 季度亮点 第三季度关键指标 367 197 86% 2630 万美元 |
| 11 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月业务概述 Calliditas 的产品线包括基于同类首创氮氧化物抑制剂平台的开发 项目。Calliditas目前正在头部鳞状细胞癌和 颈部鳞状细胞癌(SCCHN)以及原发性胆汁性胆管炎 (PBC)中使用先导化合物setanaxib 进行临床试验,该试验于7月公布了中期数据。我们还计划在2023年第四季度启动一项针对 Alport 综合征的临床试验。 氮氧化酶抑制剂 NOX 酶抑制剂是一组具有前景的新型实验性药物 ,属于新的治疗类别,自 2019 年批准 “naxib” 作为新药干以来,世卫组织就开始认可。烟酰胺 腺嘌呤二核苷酸磷酸盐 (NADPH) 氧化酶,也称为 酶,是唯一已知的 专门用于产生活性氧 (ROS) 的酶,因为其主要功能是 。它们是跨膜酶, 将细胞质中 NADPH 中的电子转移到细胞 膜上,从而形成 ROS。 在适当的浓度下,活性氧在细胞信号传导过程中具有基本功能 ,但是氧化还原 动态平衡的破坏与多种疾病途径有关。 当细胞受伤时,会触发过多的氮氧化物活性, 氧化还原动态平衡变得不平衡,导致 促纤维化通路的激活。 肿瘤微环境中的癌症相关成纤维细胞也表达氮氧化物酶,这可能 导致肿瘤免疫活性低下,对免疫肿瘤药物(例如 检查点抑制剂)的作用具有相对抗性。 Setanaxib 是第一种进入临床 阶段的氮氧化物抑制剂,可抑制 NOX1 和 NOX4,这两种酶与 纤维化和炎症途径有关,是潜在的治疗靶标。 Alport Syndrome Alport 综合征是一种遗传性疾病,源于编码 4 型胶原蛋白的基因 的突变。4 型胶原蛋白 α链主要位于肾脏、眼睛和 耳蜗中,因此该病的特征是肾脏 疾病、听力丧失和眼部异常。最终, 患者出现蛋白尿、高血压、进行性肾功能丧失 (GFR 逐渐下降)和终末期肾脏 病(ESRD)。 管道:氮氧化物抑制剂平台 据估计,美国有3万至6万人患有这种疾病,它是慢性 肾脏病 (CKD) 的重要病因,导致青少年和年轻 成年人出现ESRD,占欧盟和美国接受肾脏 替代疗法的儿童的 1.5% 至 3.0%。1 基于临床前显著的支持性体内支持工作中,Callid-itas计划在Alport综合征中启动一项随机、安慰剂对照的临床试验 ,涉及约20名患者,同时评估 的总体安全性作为对蛋白尿的影响。我们预计这项研究 将在2023年第四季度启动,并根据所读的数据, 决定在阿尔波特制定一项全面的监管计划。2023年9月,Calliditas被美国食品药品管理局授予 孤儿药称号,用于使用setanaxib治疗Alport 综合征,2023年10月,EMA孤儿药品委员会(COMP) 对该公司在欧盟申请阿尔波特综合征中setanaxib的孤儿 药物认定发表了积极的看法。 原发性胆汁性胆管炎 PBC 是一种进行性慢性肝脏自身免疫性疾病 ,可导致胆道上皮细胞循环免疫损伤, 导致胆汁淤积和纤维化。它是一种孤儿病, 根据其已知的患病率,我们估计 在美国大约有 140,000 名患者,其中 的年发病率介于 0.3 至 5.8 例之间。Calliditas 于 2021 年 8 月 在 PBC 中获得了 setanaxib 的 FDA 快速通道称号。 熊去氧胆酸(一种仿制药物,也称为熊二醇 或UDCA)和奥贝胆酸(称为奥卡利瓦)是美国食品药品管理局和欧洲 委员会批准的唯一 治疗PBC的方法。但是,尽管有这些治疗选择,但PBC患者的医疗需求仍未得到满足,尤其是在重要的生活质量结果方面, 。 在PBC中对111名患者进行setanaxib试验的2期数据 表明,对于估计肝纤维化阶段为F3或更高的患者,setanaxib对 肝纤维化和 ALP 减少(碱性磷酸酶,一种广泛确立的PBC预后独立预测指标)的影响更为明显。 肝硬度升高的患者患病的风险更大。 Calliditas正在对肝硬度升高的PBC患者进行一项随机、安慰剂对照、双盲2b期试验。 我们已经向FDA提交了协议修正案,以调整 该试验的设计,并预计将在2024年中期 公布数据。 1。Watson S、Padala SA、Hashmi MF 等阿尔波特综合症。 [2023 年 8 月 14 日更新]。在:StatPearls [因特网]。金银岛(佛罗里达州):StatPearls 出版社;2023 年 1 月- 可从以下地址获得:https://www.ncbi.nlm.nih.gov/books/NBK470419/ |
| 12 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月业务概述 第 2 阶段概念验证研究:中期数据 Readout 2023 年 7 月,Calliditas 宣读了该试验的中期数据, 反映了鼓励早期临床无进展存活率 的结果,也支持了 setanaxib 假定的抗纤维化模式。分析的基础包括20名复发或转移性SCCHN患者的数据 ,其中 16名患者的肿瘤大小和全氟辛烷磺酸相关结果是可评估的。 十二名患者在治疗前后接受了肿瘤活检 ,这些活检在生物标志物分析中是可评估的,该分析包括 转录组学分析,并评估了 SMA、Foxp3 调节性 T 细胞和 PDL-1 CPS 等 等病理标志物。 转录组分析显示,受治疗影响的两种主要途径 是纤维化相关信号通路 (特发性肺纤维化信号通路和肝 纤维化/肝星状细胞激活途径),为 活化癌 Setanaxib 在鳞状细胞癌中的假定作用模式提供支持 Head 和 Neck Calliditas 正在评估 setanaxib 在头颈癌中的作用,并在 的有前景的体内临床前数据基础上建立 ,这些数据表明 setanaxib 可以显著增强免疫肿瘤疗法的作用。我们正在进行一项双盲、随机、安慰剂对照、概念验证的2期研究,该研究正在研究 setanaxib 800mg 与 pembrolizumab 200mg 静脉注射对至少 50名复发或转移性SCCHN患者以及 中度或高水平癌症肿瘤的作用相关成纤维细胞。 管道:氮氧化物抑制剂平台 28 天 无治疗 筛查治疗随访 ~50 名患者 ≤ 28 天 可接受肿瘤 组织活检 阳性 CAF 水平 (定义为肿瘤中的 CafS 水平 不进行治疗 所有入组患者 br} 肿瘤活检 9 周 (±1 周) Pembrolizumab 200 mg 静脉注射,每 3 周一次 Setanaxib 800mg PO,每日两次 CAF = 静脉注射 A 肿瘤活检 会的在随机分组之前服用,大约 9 周后再次服用 。根据 肿瘤学试验的标准惯例,治疗将继续 直到出现不可接受的毒性或疾病进展。Calliditas于2023年7月宣读了该研究的临时数据 ,并预计将在2024年上半年读出最终的试验数据 。 这项研究的更多细节可以在www.clinicaltrials.gov上找到,参考文献是 NCT05323656。 头颈癌中存在相关成纤维细胞,以及Calliditas其他正在进行的临床项目中潜在的抗纤维化作用。 病理学分析显示,初步证据表明,使用 setanaxib 治疗的患者肿瘤内的免疫活性增加,Foxp3 和 PDL-1 CPS 发生了有利的变化。由于两组之间 基线时的SMA水平不平衡, 和肿瘤活检样本通常很少, 无法就setanaxib对减少SMA 的影响得出任何结论。 在PFS方面,16例可评估的患者中有7例无进展,病情稳定或部分反应,其中 6例属于setanaxib组,1例在安慰剂组。 在读出数据 时,7名患者中有6名仍在服用该研究药物,报告的最长服药时间为21周,与患者有关在 setanaxib 手臂里。 |
| 13 Calliditas Therapeutics | 第三季度中期报告:2023年1月至9月采访首席营销官理查德·菲利普森 Calliditas 首席医学官 理查德·菲利普森 头颈癌 研究的中期读数意味着我们现在已经看到了Calliditas生成的第一批关于setanaxib的数据。在这些数据中,你 最突出的是什么? 来自 肿瘤组织的转录组数据确实让我们感到鼓舞,这些数据显示有证据表明 setanaxib 正在调节 纤维化途径,这与该药物 的作用机制非常吻合。我们还发现无进展存活率存在有趣的数字差异 ,有利于接受seta-naxib(在pembrolizumab之上)治疗的患者,并指出在这次中期数据综述中,我们没有进行任何 正式的统计测试。 这些数据为2024年上半年数据 的最终分析奠定了良好的基础,我们希望 看到,与 pembrolizumab 一起使用时,setanaxib 会减缓 肿瘤的生长并提高无进展存活率,而 与单独使用pembrolizumab 相比,setanaxib 会减缓 的生长并提高无进展存活率。 NefiGard 的完整数据最近发布在 《柳叶刀》上。你认为这对驾驶 iGaN 领域的 肾脏科医生有多重要? NefiGard研究最终分析的发布对Nefecon来说是一个里程碑,更笼统地说,对于igA 肾病领域来说,也是一个里程碑。我们知道肾脏科医生非常希望看到 高质量的科学和临床数据支持 Nefecon 的使用;《柳叶刀》上的这篇文章通过 快速审查程序获得认可,对这项为期两年的肾功能结果进行了清晰而全面的描述。 在研究结果时,给我留下特别深刻印象的是 Nefecon 对肾脏功能(估计的肾小球滤过率)具有明显的有益作用 [eGFR]) 在 9 个月的治疗中达到, 在随后的治疗后的 15 个月中一直保持不变。伴随着蛋白尿的持续和持久改善,这种改善在非治疗期间也得以维持。 Nefecon 的开放标签延期研究目前正在进行中 ,预计将在2024年中期公布结果。你将在这个数据集中寻找什么 ? 这是一项非常有趣且重要的研究,它将帮助我们 了解使用Nefecon进行再治疗的影响。在 开放标签延伸研究(OLE)中,所有入组患者都将接受为期 9个月的Nefecon治疗。在主要的NefiGard研究中,其中一些患者 已经接受了 Nefecon 的9个月疗程(随后是15个月 的非治疗观察),而其余患者 将首次接受Nefecon(因为他们在主要研究中接受了 安慰剂)。我们将能够观察 第二疗程如何影响蛋白尿和 eGFR,因此 可以更好地了解使用 Nefecon 进行再治疗的潜在益处。我们希望在研究的最终分析完成后不久 公布这些结果。 你在 2020 年中期加入了 Calliditas。自从你加入公司以来, 医疗方面最令人兴奋的事态发展是什么 ? 在我加入公司以来的三年中,Calliditas 取得了长足的发展,与我在2020年7月加入的 相比,这是一家截然不同的公司。在医学方面,我们在临床运营、生物统计学、科学 传播和药物警戒方面积累了 内部专业知识,尤其令我兴奋的是,我们能够在头颈癌和Alport 综合征等疾病中获得令人信服的临床前数据,并将这些数据转化为临床研究,使 我们能够评估setanaxib的安全性和临床效果这些 种疾病。我们绝对致力于开发能为罕见病患者带来改变的药物 , 为我们在肾脏病学、肝病和头颈部 癌症领域建立的与专家 的良好关系网络感到非常自豪。 |
| 14 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 Calliditas 开展可持续发展工作 ,其目标是CSRD报告 14 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 Calliditas 致力于关注 可持续发展,并期待 在可持续性问题上变得越来越透明。在欧盟,企业 可持续发展报告指令 (CSRD) 将 引入新的报告要求, 为我们的可持续发展工作提供方向和方法 。 重要性评估是第一步 作为Calliditas加强可持续发展目标的第一步, 我们已经开始了双重重要性评估 。该评估将有助于定义与Calliditas最相关的可持续发展 问题。根据CSRD, 这些问题是基于两个角度定义的。影响 视角基于Calliditas运营如何影响人和环境,而财务视角 基于外部 因素对Calliditas的财务影响。 然后,定义的重大主题将构成Calliditas 可持续发展战略、目标和运营的基础。它们也将 构成Calliditas未来符合CSRD标准的可持续性报告的基础 。 可持续发展 我们将目光投向了 2025 年年度和可持续发展报告 Calliditas 将从 2025 财年 年度起受到 CSRD 的约束,该报告将于 2026 年发布。为了确保 及时开展Calliditas的实际可持续发展工作 “我们在 可持续发展方面的工作取得了长足的进步。对于Calliditas来说,重要的是要以社会和环境 合乎道德和负责任的方式开展工作, 遵守新的CSRD指令。” åsa Hillsten 投资者关系与可持续发展主管 说实话,在 Calliditas的可持续发展工作中实施CSRD的工作已经开始。作为第一步, 董事会和管理团队接受了有关该主题的 培训。本次培训概述了 新的规章制度,描述了 将如何影响Calliditas,并强调了 董事会和管理团队的责任越来越大。 对于Callid-itas来说,可持续发展问题一直非常重要。通过我们的商业模式,我们为改善 医疗需求未得到满足的罕见病患者 的生活做出了贡献。考虑到Calliditas经营的行业, 道德和负责任的商业行为至关重要。在Calliditas,为我们的 员工提供一个安全、健康和充满活力的工作场所也是当务之急。这 包括非歧视和为所有人提供 平等机会的工作场所文化。Calliditas在其价值链中还承担着重要的上游 和下游责任,因此 的目标是减少公司的环境影响 和资源使用。 CSRD 对可持续发展报告的 质量和数量提出了更严格的要求 CSRD 是欧盟促进 公平透明的可持续发展报告的一揽子措施的一部分。这是欧盟雄心壮志的一部分,即确保融资和资本 覆盖面企业拥有可持续的投资和业务 模式,从而使欧盟符合《巴黎 协议》的要求和17个可持续发展目标。 CSRD 中的要求比 先前的可持续发展报告要求更为全面,涵盖了 大量与环境、社会和治理 (ESG) 问题相关的披露。其他披露涉及总体可持续发展治理报告 以及 年度可持续发展报告的制定。Calliditas期待着开展必要的工作以满足CSRD的要求, 在成为一家更具可持续性的企业方面取得长足的进步。 |
| 15 Calliditas Therapeutics | 中期报告第三季度:2023年1月至9月2023年1月至9月财务概览 截至2023年9月30日和2022年9月30日的三个月,净销售额分别为2.946亿瑞典克朗和2.601亿瑞典克朗 , 。截至2023年9月30日的九个月中, 和2022年9月30日的净销售额分别为7.553亿瑞典克朗和3.738亿瑞典克朗。该期间的净销售额主要来自TARPEYO® 在美国的净销售额,在截至2023年9月30日和2022年9月30日的三个月 中,净销售额分别为 2.836亿瑞典克朗和1.234亿瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月 个月中, TARPEYO的净销售额分别为7.285亿瑞典克朗和2.05亿瑞典克朗, 。就2022年的 比较期而言,我们在欧洲合作的特许权使用费收入在2023年第三季度为960万瑞典克朗, 2023年前九个月为2,280万瑞典克朗,未确认特许权使用费收入。 在截至2023年9月30日的三个月和九个月中, 没有发现任何里程碑。在截至2022年9月30日 的三个月中,净销售额为1.35亿瑞典克朗 ,其中包括 Kinpeygo® 在欧洲商业化产生的里程碑费用。此外,在截至2022年9月30日 的九个月中,里程碑费用为1.638亿瑞典克朗,其中包括有关Everst Medicines的里程碑费用。 有关更多信息,请参阅注释 4。 销售成本 截至2023年9月30日和2022年9月30日的三个月,销售成本分别为1,490万瑞典克朗和430万瑞典克朗 , 。在截至2023年9月30日和 2022年9月30日的九个月中,销售成本分别为3,820万瑞典克朗和730万瑞典克朗。2023 年期间的增长 与产品销售量的增加有关。 总运营费用 截至2023年9月30日和2022年9月30日的三个月,总运营支出分别为4.392亿瑞典克朗和2.920亿瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月中,总运营支出分别为11.320亿瑞典克朗和8.210亿瑞典克朗。 研发费用 截至2023年9月30日和2022年9月30日的三个月,研发费用分别为1.799亿瑞典克朗和1.029亿瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月中, 的研发费用分别为3.955亿瑞典克朗和3.125亿瑞典克朗, 。在截至2023年9月30日的三个月中, 增加了7700万瑞典克朗,在截至2023年9月30日的九个月中增加了8,300万瑞典克朗, ,这主要是由于nox平台的临床活动增加, 包括正在进行的setanaxib试验,以及Budenofalk减值3,210万瑞典克朗产生的一次性影响, 与上一年 的相应期相比,于2019年确立的许可。 营销和销售费用 截至2023年9月30日和2022年9月30日的三个月,营销和销售费用分别为1.705亿瑞典克朗 和1.161亿瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月中, 的营销和销售费用 分别为5.292亿瑞典克朗和3.233亿瑞典克朗。 截至2023年9月30日的三个月中增加了5,440万瑞典克朗,在截至2023年9月30日的九个月中, 增加了2.059亿瑞典克朗,这主要与TARPEYO在美国的销售和营销成本 有关,与去年同期相比,美国的营销 活动得到加强,销售队伍也增加了 。 管理费用 在截至2023年9月30日和 2022年9月30日的三个月中,管理费用分别为8,860万瑞典克朗和7,100万瑞典克朗。在截至2023年9月30日的九个月中, 和2022年9月30日,管理费用分别为2.384亿瑞典克朗和1.784亿瑞典克朗。截至2023年9月30日的三个月, 1760万瑞典克朗的增长, 在截至2023年9月30日的九个月中增加5,990万瑞典克朗, 主要与组织规模扩大和 监管要求提高所导致的增长有关。 截至2023年9月30日和2022年9月30日的三个月中, 其他营业收入/支出,净额 其他营业收入/(支出),分别为(20万瑞典克朗)和(190万瑞典克朗)。在截至2023年9月30日和2022年9月30日的九个月中, 其他营业收入/ (支出),净额分别为3,110万瑞典克朗和(670万瑞典克朗), 。这两个时期的增长主要归因于 与经营应收账款 和负债相关的汇率变动。 截至2023年9月30日和2022年9月30日的三个月,净财务收入/(支出)分别为(450万瑞典克朗) 和2,030万瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月中, 净财务收入/ (支出)分别为(2,790万瑞典克朗)和3,500万瑞典克朗, 。在截至2023年9月30日的三个月中, 减少了2480万瑞典克朗, 在截至2023年9月30日的九个月中减少了6,290万瑞典克朗,这主要源于 与借款相关的利息支出和 货币影响。 |
| 16 Calliditas Therapeutics | 第三季度中期报告:2023年1月至9月财务概览 税收 截至2023年9月30日和2022年9月30日的三个月,总税收收入/(支出)分别为(430万瑞典克朗)和 690万瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月中,总税收收入/(支出)分别为 至(510万瑞典克朗)和1,090万瑞典克朗。 这两个时期的税收支出增加的主要原因是 美国子公司的应纳税利润。集团结转的税收损失 未被确认为递延所得税资产, 除非此类税收损失可用于抵消 临时差额。 期内业绩 在截至2023年9月30日和2022年9月30日的三个月中, 的亏损分别为1.684亿瑞典克朗和910万瑞典克朗, 摊薄前后的相应每股亏损分别为3.14瑞典克朗和0.17瑞典克朗。 截至2023年9月30日和2022年9月30日的九个月中,亏损 为4.478亿瑞典克朗和4.086亿瑞典克朗, 摊薄前后的相应每股亏损分别为8.34瑞典克朗和7.72瑞典克朗。 现金流和现金状况 截至2023年9月30日和2022年9月30日的三个月,用于经营活动的现金流分别为6,250万瑞典克朗和1.247亿瑞典克朗,与上年相比的改善是由于 营运资金增加所解释的。在截至2023年9月30日和2022年9月30日的九个月中,用于经营活动的现金流分别为 4.575亿瑞典克朗和5.414亿瑞典克朗, 的改善主要是由美国TARPEYO® 销售增长推动的经营 业绩增长所致,而 强劲的营运资金产生了积极影响。 截至2023年9月30日和2022年9月30日的三个月,用于投资活动的现金流分别为740万瑞典克朗和90万瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月 个月中, 用于投资活动的现金流分别为1140万瑞典克朗和370万瑞典克朗。 这两个时期的增长主要是由购置设备来解释的。 截至2023年9月30日和2022年9月30日的三个月,用于融资活动的现金流分别为290万瑞典克朗和260万瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月 个月中,来自 融资活动的现金流分别为(890万瑞典克朗)和2.934亿瑞典克朗。同期的下降主要是 归因于前几年使用了2.365亿瑞典克朗的外部贷款 工具。 截至2023年9月30日和2022年9月30日的三个月, 现金净减少分别为7,280万瑞典克朗和 1.282亿瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月中,现金净减少分别为4.778亿瑞典克朗和2.517亿瑞典克朗。截至2023年9月30日和2022年9月30日,现金 分别为7.869亿瑞典克朗和7.362亿瑞典克朗。 人员 在截至2023年9月30日和2022年9月30日的 三个月中,平均员工人数分别为179人和92人,在截至2023年9月30日和2022年9月30日的九个月中,平均员工人数分别为174和81人。 截至2023年9月30日和2022年9月30日,股东 权益和股票数量的变化 归属于母公司股东的权益 分别为3.524亿瑞典克朗和7.259亿瑞典克朗。截至2023年9月30日和2022年9月30日的 , 的注册股票数量分别为59,580,087股和59,157,587股。 国库股 截至2023年9月30日,Calliditas拥有母公司作为库存股持有的5,908,018股普通 股。在2023年的 年度股东大会上, Calliditas获得授权,可以转让(出售)这些普通股,用于 收购业务、获得 资本来资助项目开发、偿还 贷款或将Calliditas的产品商业化。有关 的更多信息,请参见注释 7。 激励计划 在截至2023年9月30日的三个月中,已为2023年ESOP计划分配了96.5万份期权。有关 有关激励计划的更多信息,请参阅注释 9。 2023年展望 Calliditas预计2023年美国的收入将增长,其中: 截至2023年12月31日的财年,TARPEYO的净销售额估计为1亿至1.2亿美元(按瑞典克朗/美元的平均汇率10.47瑞典克朗/美元汇率计算, 约为10.47亿瑞典克朗)。 母公司 截至2023年9月30日和2022年9月30日的三个月,母公司Calliditas Therapeutics AB的净销售额分别为1.944亿瑞典克朗和2.196亿瑞典克朗 , 。在截至2023年9月30日和2022年9月30日的九个月中,净销售额分别为4.684亿瑞典克朗和2.518亿瑞典克朗。截至2023年9月30日的三个月 与去年同期相比, 的下降是指Kinpeygo在欧洲商业化 产生的里程碑费用,总额为1.35亿瑞典克朗。 此外,在截至2022年9月30日的九个月中, 里程碑费用为1.638亿瑞典克朗。 截至2023年9月 30日的九个月中,净销售额的增长主要来自于TARPEYO与去年同期相比 的销售额。截至2023年9月30日和2022年9月30日的三个 个月中,营业亏损 分别为1.041亿瑞典克朗和4,740万瑞典克朗。 截至2023年9月30日和2022年9月30日的九个月营业亏损分别为2.689亿瑞典克朗和3.021亿瑞典克朗, 。 |
| 17 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月重大事件 财务评论 2023 年 7 月 1 日至 9 月 30 日期间的重大事件 • 7 月 13 日,Calliditas 公布了 使用先导氮氧化物抑制剂 候选体 setanaxib 的 头颈癌试验的支持性中期数据。 • 8月15日,Calliditas公布了发表在《柳叶刀》上的NefiGard 3期试验的完整结果。 • 8月18日,美国食品药品管理局批准对用于治疗IgA肾病的 TARPEYO® 进行优先审查。 • 9月27日,Calliditas授予美国食品药品管理局 颁发的孤儿药称号,用于使用setanaxib治疗阿尔波特综合症。 • 9月28日,STADA和Calliditas宣布申请Kinpeygo® 在欧盟的 全面上市许可。 • 9月29日,Calliditas在2023年东京第17届IgA 肾病国际研讨会(iiGann)上公布了来自NefiGard 3期试验的数据。 期后的重大事件 • 10月3日,Calliditas宣布向英国卫生和健康管理局申请治疗IgA肾病的 Kinpeygo。 • 10月5日,欧洲药品管理局孤儿药品委员会 对 Calliditas在阿尔波特综合征中申请setanaxib给予了积极评价。 • 10月23日,卡利迪塔斯宣布任命2024年股东周年大会提名委员会 。提名委员会 由Stiftelsen Industri-Fonden任命的帕特里克·索博基、由Linc AB任命的卡尔·托比森、由BVF任命的 任命的斯派克·洛伊和埃尔玛·施内(董事会主席)组成。 • 10月27日 Calliditas宣布,其商业合作伙伴 Everest Medicines 已获得中国澳门特别行政区 地区药品 管理局的批准。 执行管理层 Calliditas Therapeutics AB的执行管理层包括:首席执行官蕾妮·阿吉亚尔-卢坎德、首席财务官弗雷德里克 约翰逊、首席营销官理查德·菲利普森、集团总法律顾问 乔纳森·舒尔、北美总裁安德鲁·乌德尔、监管事务副总裁弗兰克·布林斯特鲁普和 人力资源主管桑德拉·弗里西奥夫。 股息 未来的任何股息及其规模将根据Calliditas的长期增长、收益趋势和资本要求确定 。在公司产生长期 可持续利润和正现金流之前,董事会不打算 提议任何股息。 在2022财年没有支付股息。 |
| 18 Calliditas Therapeutics | 第三季度中期报告:2023 年 1 月至 9 月财务评论 评论 这份中期报告未经该 公司审计师的审查。 斯德哥尔摩 2023 年 11 月 7 日 Renée Aguiar-Lucander 截至 2023 年 9 月,十大股东% BVF Partners LP 10.51 Linc Ab 10.01 Stiftelsen Industrifonden 5.28 Avanza Pension 3.81 Handelsbanken Fonder 3.19 Unionen 3.02 Polar Capital 2.94 Sofinnova Partners 2.36 Invus Group 1.79 Sub-十大股东共计 46.38 股国库股 9.92 其他股东 43.70 合计 100.00 年年度股东大会 2024 年年度股东大会 2024 年年度股东大会将于 2024 年 5 月在瑞典斯德哥尔摩 举行。前几届股东周年大会 的所有文件均发布在公司网站上,网址为 https://www.callid-itas.se/en/governance/general-meeting/general-meetings/ Nomination 委员会2024年股东大会任命 2023年10月,Calliditas宣布,该公司的 主要所有者已任命了2024年 年度股东大会的提名委员会。提名委员会根据 2017 年 股东特别大会通过的原则在 任命,包括:Stiftelsen Industrifonden 任命的 Patrick Sobocki、Linc AB 任命的卡尔·托比森、BVF 任命的 Spike Loy 和埃尔玛·施内(董事会主席 )。希望向2024年年度股东大会 提名委员会提交 提案的股东可以通过发送电子邮件至 finance@calliditas.com 提交。 提案应在2024年3月15日之前提交给提名委员会 。 The Share 截至2023年9月30日,普通股数量为 59,580,087股,其中5,908,018股作为 库存股由母公司持有。截至2023年9月29日, ,Calliditas Therapeutics股票 CALTX的收盘价为97.5瑞典克朗。截至2023年9月30日 ,股东总数约为15,000人。 股东结构 |
| 19 Calliditas Therapeutics | 中期报告第三季度:2023年1月至9月向投资者、分析师和媒体介绍情况 欲了解更多信息 请联系 即将举行的活动 • Calliditas邀请投资者、分析师和媒体于11月7日下午14点30分参加 2023年季度报告的发布会。该报告将在当天上午 7:00 发布。 • Calliditas首席执行官蕾妮·阿吉亚尔-卢坎德将与首席财务官弗雷德里克·约翰逊、首席营销官理查德·菲利普森和北美总裁 安德鲁·乌德尔一起提交报告。演讲将以 英语进行。 • 时间:美国中部时间11月7日星期二下午 14:30。 • 网络直播链接 https://financialhearings.com/event/46414 • 要通过此链接通过电话会议注册参与会议: https://conference.financialhearings.com/teleconference/?id=2001082 注册后,您将收到一个电话号码和一个用于登录电话会议的会议 ID。通过电话会议, 有机会提出口头问题。 2024 年 2 月 22 日年终报告,2023 年第四季度 2023 年 1 月至 12 月 2023 年年度报告将于 2024 年 4 月以数字形式发布 2024 年 5 月 16 日中期报告,2024 年 1 月至 3 月 Renée Aguiar-Lucander /首席执行官 +46 (0) 764 03 35 43 asa.hillsten@calliditas.com 补充信息 本中期报告未经公司审计师审查或审计。renee.lucander@calliditas.com 根据 《欧盟市场滥用条例》,临时报告中的信息是Calliditas有义务公开的信息。该信息已于欧洲中部时间 2023 年 11 月 7 日上午 7:00 通过上述 联系人机构发送以供发布。 注册办公室 Calliditas Therapeutics AB Kungsbron 1 SE 111 22 瑞典斯德哥尔摩 calliditas.com/ ir@calliditas.com 前瞻性陈述 本中期报告包含经修订的1995年《私人证券诉讼改革法》所指的前瞻性陈述,包括但不限于有关Calliditas战略、业务计划、收入和其他财务预测的陈述,以及焦点。“可能”、 “将”、“可能”、“将”、“应该”、“期望”、“计划”、“预期”、“打算”、“相信”、“估计”、“预测”、“项目”、“潜力”、“继续”、“目标” 等词语旨在识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别性词语。 本中期报告中的任何前瞻性陈述均基于管理层当前的预期和信念,受许多风险、 不确定性和重要因素的影响,这些因素可能导致实际事件或结果与本中期报告中包含的任何前瞻性 陈述所表达或暗示的存在重大差异,包括但不限于与Calliditas的业务、运营、TARPEYO 和Kinpeygo临床商业化有关的任何前瞻性陈述,试验、供应链、战略、目标和预期时间表开发和潜在批准、来自其他 家生物制药公司的竞争、收入和产品销售预测或预测,包括TARPEYO指南和现金跑道的2023年净销售额,以及 Calliditas向美国证券交易委员会提交的报告中标题为 “风险因素” 的部分中确定的其他风险。 Calliditas提醒您不要过分依赖任何前瞻性陈述,这些陈述仅代表其发表之日。Calliditas声明, 没有义务公开更新或修改任何此类陈述,以反映 任何此类陈述所依据的预期或事件、条件或情况的任何变化,或者可能影响实际结果与前瞻性陈述中列出的结果不同的可能性的任何变化。 本中期报告中包含的任何前瞻性陈述仅代表Calliditas截至本文件发布之日的观点,不应将其视为 代表其在随后任何日期的观点。 本中期报告以瑞典语原件编写,并已翻译成英文。如果两者之间存在差异,则应适用瑞典语 版本。 |
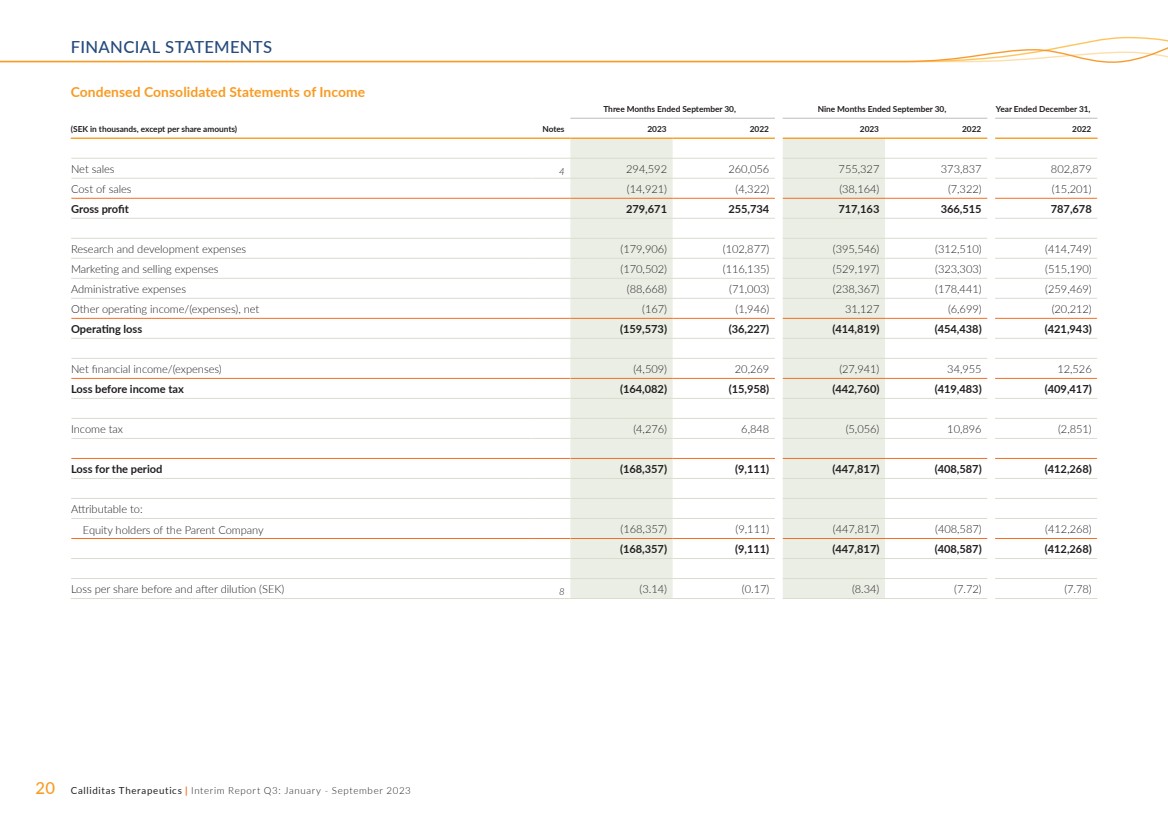
| 20 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月财务报表 截至9月30日的三个月,截至9月30日的九个月, (以千瑞典克朗计,每股金额除外)票据 2023 2023 2022 2022 年净销售额 4 294,592 260,056 755,327 373,837 802,879 销售成本 (142,879 921) (4,322) (38,164) (7,322) (15,201) 毛利 279,671 255,734 717,163 366,515 787,678 研发费用 (179,906) (102,877) (395,546) (312,510) (414,749) 营销和销售费用 (170,502) (116,135) (529,197) (323,303) (515,190) 管理费用 (88,668) (71,003) (238,367) (178,441) (259,469) 其他营业收入/(支出),净额(167)(1,946)31,127 (6,699) (20,212) 营业亏损 (159,573) (36,227) (414,819) (454,438) (421,943) 净财务收入/(支出)(4,509) 20,269 (27,941) 34,955 12,526 所得税前亏损 (164,082) (15,958) (442,958) (442,958) 760) (419,483) (409,417) 所得税 (4,276) 6,848 (5,056) 10,896 (2,851) 该期间的亏损 (168,357) (9,111) (447,817) (408,587) (412,268) 归属于: 母公司股权持有人(168,357)(9,111)(447,817)(408,587)(412,268) (168,357)(9,111)(447,817)(408,587)(412,268) 摊薄前后的每股亏损(瑞典克朗)8(3.14) (0.17) (8.34) (7.72) (7.78) |
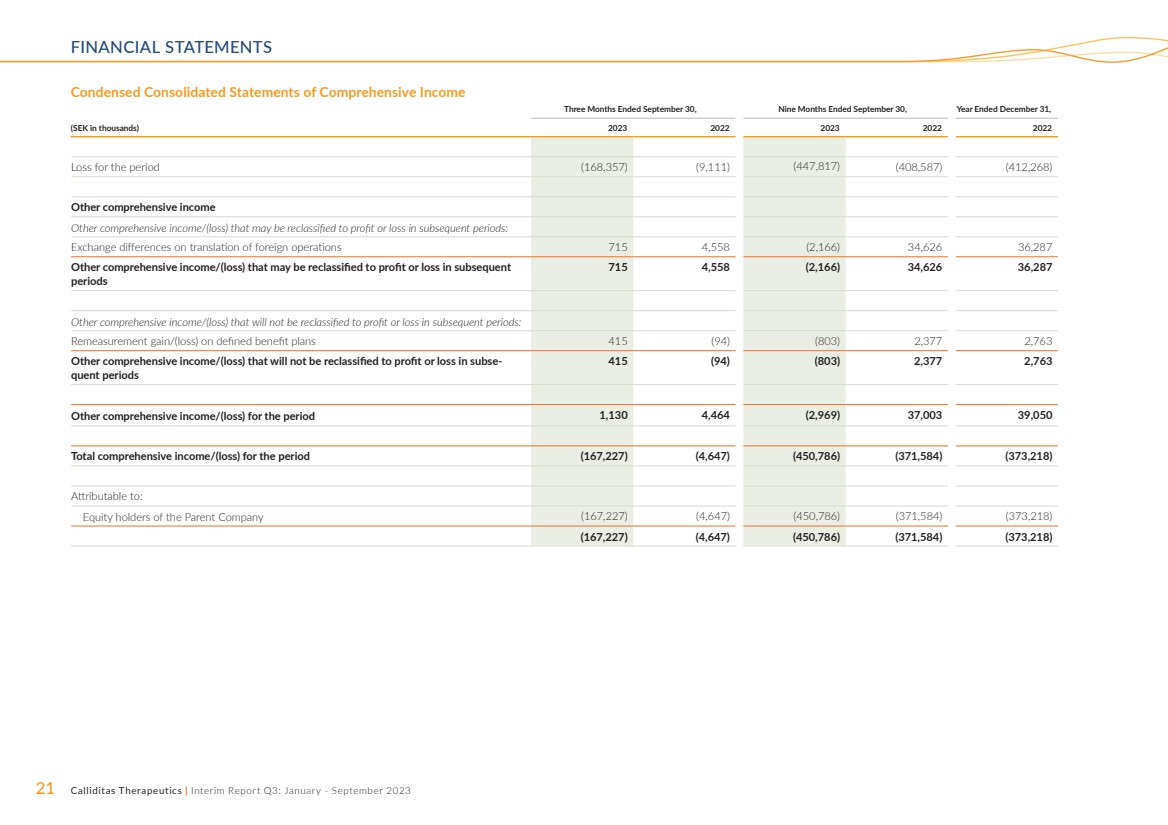
| 21 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月财务报表 截至9月30日的三个月,截至9月30日的九个月, (千瑞典克朗)2023 2023 2022 年期间亏损(168,357)(9,111)(447,817)(408,587)(412,268) 其他综合收益 其他可能在后续时期重新归类为损益的综合收益/(亏损): 国外业务折算汇兑差额 715 4,558 (2,166) 34,626 36,287 可能在随后 期内重新归类为损益的其他综合收益/(亏损) 715 4,558(2,166)34,626 36,287 其他不会在后续时期重新归类为损益的综合收益/(亏损): 重新计量固定福利计划的收益/(亏损)415 (94) (803) 2,377 2,763 在后续时期内不会重新归类为损益的其他综合收益/(亏损) 415 (94) (803) 2,377 2,763 期间其他综合收益/(亏损)1,130 4,464(2,969)37,003 39,050 合计该期间的综合收益/(亏损)(167,227)(4,647)(450,786)(371,584)(373,218) 归属于于: 母公司股权持有人(167,227)(4,647)(450,786)(371,584) (167,227)(4,647)(45047)786) (371,584) (373,218) |
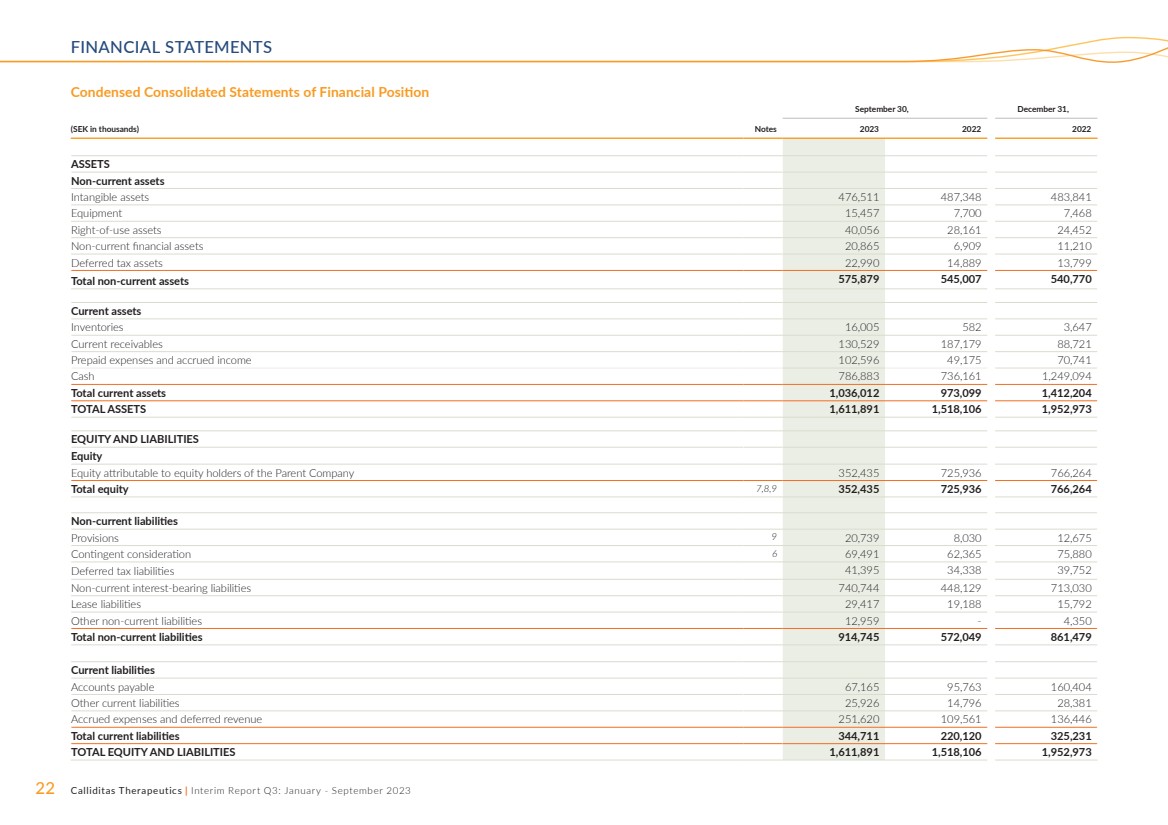
| 22 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月财务报表 ,12 月 31 日, (以千瑞典克朗计)票据 2023 2022 年资产 非流动资产 无形资产 47,511 483,841 设备 15,457 7,700 7,468 使用权资产 40,056 28,161 24,852 非流动金融资产 20,8452 65 6,909 11,210 递延所得税资产 22,990 14,889 13,799 非流动资产总额 575,879 545,007 540,770 流动资产 库存 16,005 582 3,647 当前应收账款 130,529 187,179 88,721 预付费用和应计费用收入 102,596 49,175 70,741 现金 786,883 736,161 1,249,094 流动资产总额 1,036,012 973,099 1,412,204 总资产 1,611,891 1,518,106 1,952,973 权益和负债 权益 归属于母公司股东的权益 352,435 725,936 766,264 总权益 7,8,9 352,435 725,936 766,264 非流动负债 准备金 9 20,739 8,030 12,675 或有对价 6 69,491 62,365 75,880 递延所得税负债 41,395 34,338 39,752 非流动计息负债 740,744 448,030 租赁负债 29,417 19,188 15,792 其他非流动负债 12,959-4,350 非流动负债总额 914,745 572,049 861,479 流动负债 应付账款 67,165 95,763 160,404 其他流动负债 25,926 14,796 28,381 应计费用和递延收入 251,620 109,561 136,446 流动负债总额 344,711 220,120 325,231 总权益和负债 1,611,891 1,518,106 1,952,973 简明合并财务状况表 |
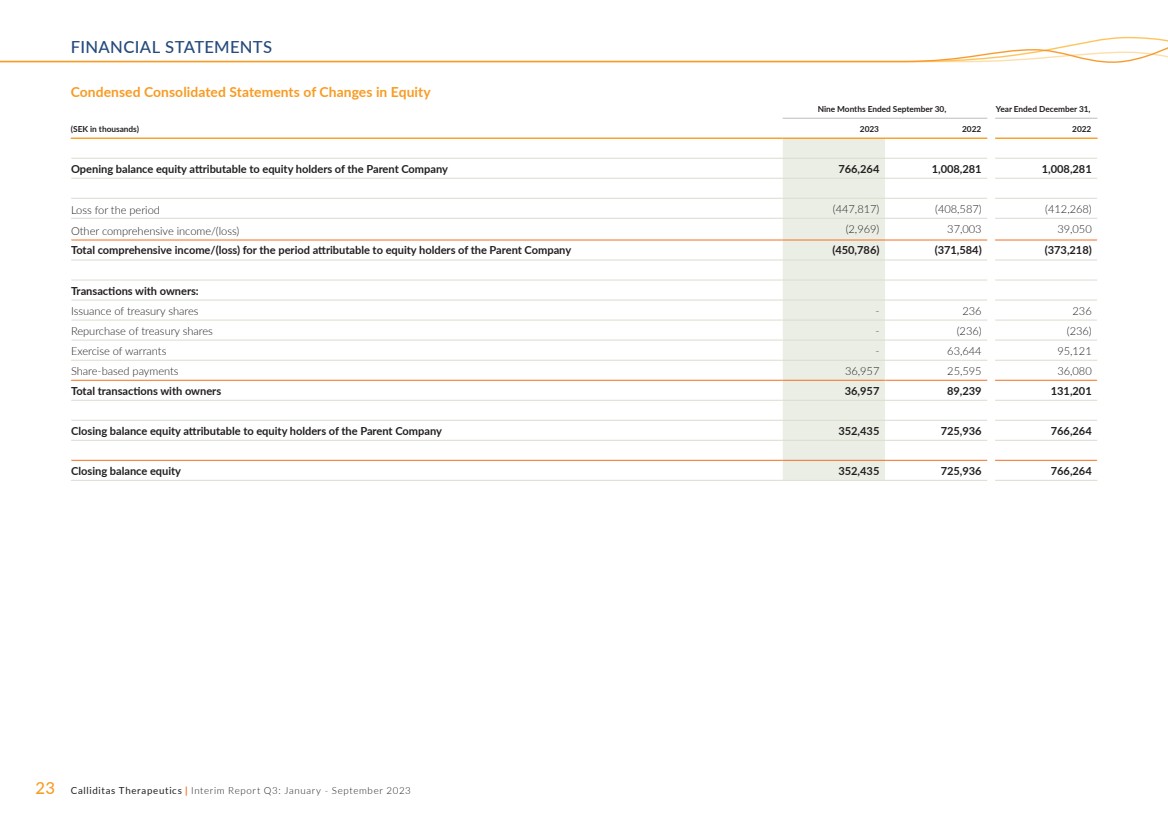
| 23 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月财务报表 简明合并权益变动表 截至9月30日的九个月, (千瑞典克朗)2022 年期初余额归属于母公司股东的权益 766,264 1,008,281 1,008,281 期内亏损(447,817)(408,587)(412,268) 其他综合收益/(亏损)(2,969)37,003 39,050 本期归属于母公司股东的综合收益/(亏损)总额(450,786) (371,584) (373,218) 与所有者的交易: 发行库存股-236 236 回购库存股-(236) (236) 行使认股权证-63,644 95,121 基于股份的支付 36,957 25,595 36,080 与所有者的交易总额 36,957 89,239 131,201 期末余额权益归属于权益母公司持有人 352,435 725,936 766,264 期末余额权益 352,435 725,936 766,264 |
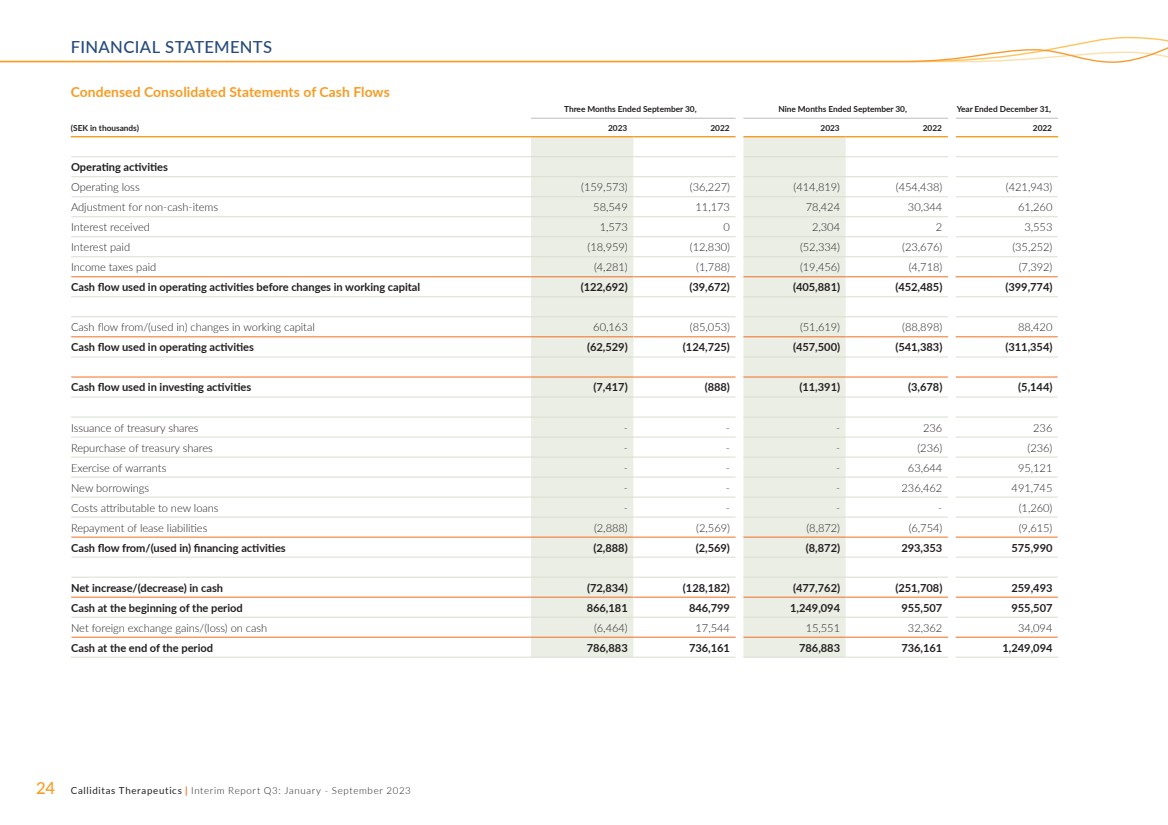
| 24 Calliditas Therapeutics | 中期报告第三季度:2023年1月至9月财务报表 截至9月30日的三个月,截至9月30日的九个月, (千瑞典克朗)2023 2023 2022 2022 年经营活动 营业亏损 (159,573) (36,227) (414,819) (454,438) (421,943) 非现金调整 h-items 58,549 11,173 78,424 30,344 61,260 已收利息 1,573 0 2,304 2 3,553 已付利息 (18,959) (12,830) (52,334) (23,676) (35,252) 已缴所得税 (4,281) (1,788) (19,456) (4,718) (7,392) 现金流用于营运资金变动前的经营活动 (122,692) (39,672) (405,881) (452,485) (399,774) 来自/(用于)营运资金变动的现金流 60,163(85,053)(51,619)(88,898)88,420 用于经营活动的现金流(62,529)(124,725)(457,500) (541,383) (311,354) 用于投资活动的现金流 (7,417) (888) (11,391) (3,678) (5,144) 发行库存股---236 236 回购库存股---(236) (236) 行使认股权证---63,644 95,121 新借款--236,462 491,745 可归于新借款的成本贷款----(1,260) 偿还租赁负债(2,888)(2,569)(8,872)(6,754)(9,615) 来自/(用于)融资活动的现金流(2,888)(2,569)(8,872)293,353 575,990 现金净增加/(减少)(72,834)(128,1834)(128,1834)(128,1834)82) (477,762) (251,708) 259,493 期初现金 866,181 846,799 1,249,094 955,507 955,507 现金净外汇收益/(亏损)(6,464)17,544 15,551 32,362 34,094 期末现金 786,883 736,161 786,886,888 3 736,161 1,249,094 简明合并现金流量表 |
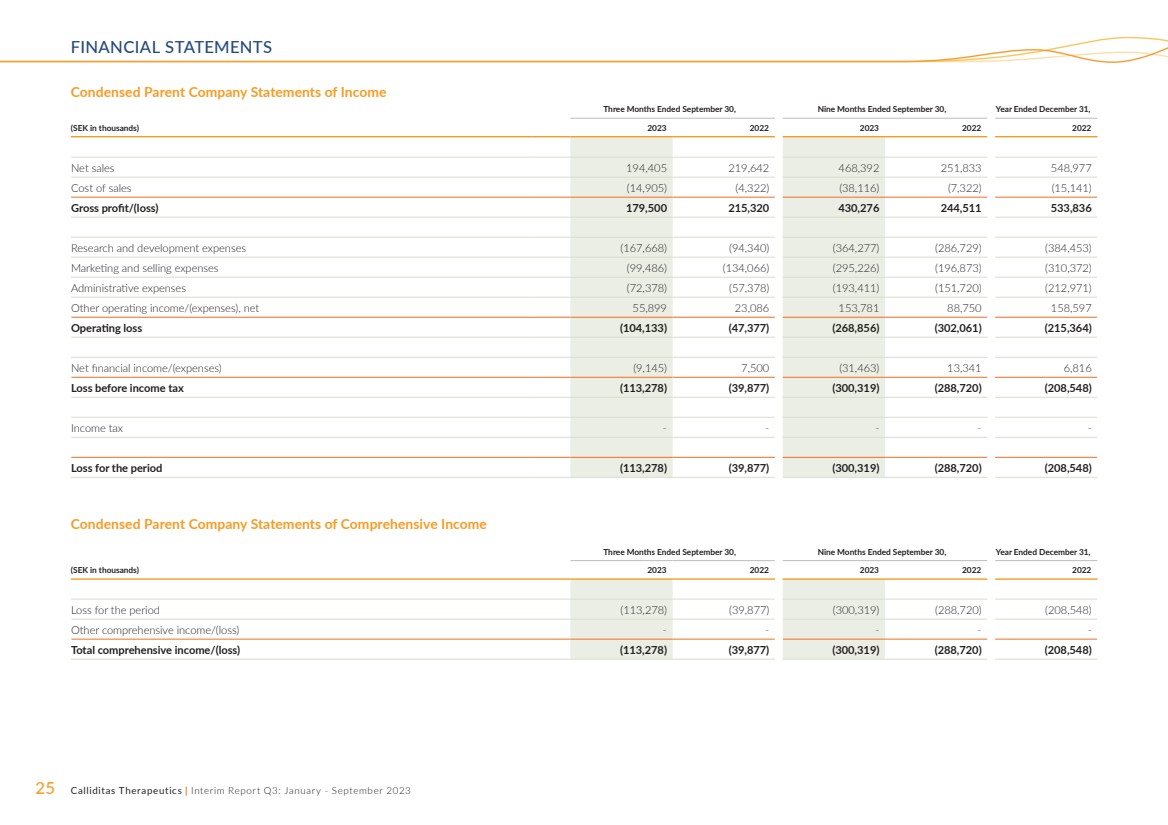
| 25 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月简明母公司损益表 截至9月30日的三个月,截至9月30日的九个月, (千瑞典克朗)2023 2023 2022 年净销售额 194,405 219,642 468,392 251,833 548,977 销售成本 (14,905) (4,905) (4,905) 322) (38,116) (7,322) (15,141) 毛利润/(亏损)179,500 215,320 430,276 244,511 533,836 研发费用(167,668)(94,340)(364,277)(286,729)(384,453) 营销和销售费用 (99,486) (134,066) (295,226) (196,873) (310,372) 管理费用 (72,378) (57,378) (193,411) (151,720) (212,971) 其他营业收入/(支出),净额 55,899 23,086 153,781 88,597 营业亏损 (104,133) (47,377) (268,856) (302,061) (215,364) 净财务收入/(支出)(9,145) 7,500 (31,463) 13,341 6,816 所得税前亏损 (113,278) (39,877) (300,319) (288,720) (208,720) (20 8,548) 所得税---- 该期间的亏损 (113,278) (39,877) (300,319) (288,720) (208,548) 截至9月30日的三个月,截至9月的九个月30,截至12月31日的财年, (千瑞典克朗)2023 年 2022 年 2022 年 2022 年期间亏损(113,278)(39,877)(300,319)(288,720)(208,548) 其他综合收益/(亏损)---- 总综合收益/(亏损)(113,278)(39,877)(300,319) (288,720) (208,548) 简明母公司综合收益表 |
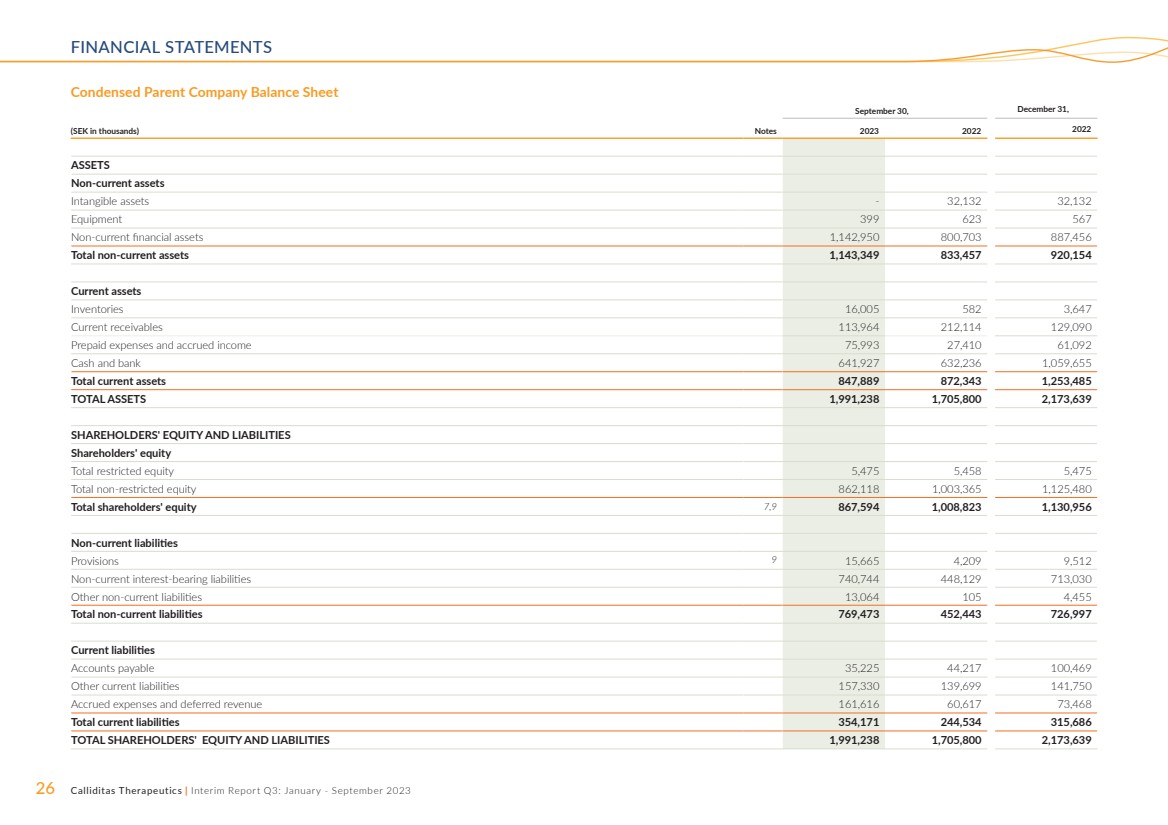
| 26 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月财务报表 简明母公司资产负债表 ,12 月 31 日, (千瑞典克朗)票据 2023 2022 年资产 非流动资产 无形资产-32,132 32,132 设备 399 623 567 非流动金融资产 1,142,950 800,703 887,456 非流动资产总额 1,143,349 833,457 920,154 流动资产 库存 16,005 582 3,647 当前应收账款 113,964 212,114 129,090 预付费用和应计收入 75,993 27,410 61,092 现金和银行 64,927 632,236 1,059,655 流动资产总额 847,889 872,343 1,253,485 总资产 1,991,238 1,705,800 2,173,639 股东权益和负债 限制性权益总额 5,475 5,458 5,475 非限制性权益总额 862,118 1,003,365 1,125,480 股东权益总额 7,480 9 867,594 1,008,823 1,130,956 非流动负债 准备金 9 15,665 4,209 9,512 非流动计息负债 740,744 448,029 713,030 其他非流动负债 13,064 105 4,455 非流动负债总额 769,473 452,443 726,997 当前负债 应付账款 35,225 44,217 100,469 其他流动负债 157,330 139,699 141,750 应计费用和递延收入 161,616 60,617 73,468 流动负债总额 354,173,4639 244,534 315,686 股东权益和负债总额 1,991,238 1,705,639 |
| 27 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 NOTES 注释1-业务描述 Calliditas Therapeutics AB(publ)(“Calliditas” 或 “母公司”),公司注册号 556659-9766,及其子公司(统称 “集团”)在药品领域开展商业和 开发活动。这些中期简明合并财务报表涵盖了截至2023年9月30日和2022年9月30日的九 个月的集团及其子公司,总部设在瑞典斯德哥尔摩。 Calliditas 是一家瑞典公共有限公司,注册于 斯德哥尔摩,注册办事处位于 。公司总部的注册地址为瑞典斯德哥尔摩 Kungsbron 1, D5。Calliditas在美国纳斯达克的中型股板块上市,股票代码为 “CALTX”, 以ADS的形式在美国纳斯达克全球精选市场上市,股票代码为 “CALT”。 这些中期简明合并财务报表已经 董事会(“董事会”)批准,将于2023年11月7日发布。 该报告可能包含前瞻性陈述。实际结果可能与 所说的有所不同。研究项目的成功管理和知识产权 等内部因素可能会影响未来的结果。还有一些外部条件(例如经济 气候、政治变化和竞争性研究项目)可能会影响集团的业绩。 附注2-会计政策 这些中期简明合并财务报表根据 《国际会计准则》第34号(IAS 34)“中期财务报告” 编制。母公司 公司对法人实体适用瑞典财务报告委员会建议RFR2(会计 )。在编制中期简明财务报表时采用的会计政策与编制2022年 年度报告时遵循的会计政策一致。自 2023 年 1 月 1 日起生效的新准则或经修订的准则和解释均未对集团的财务报告产生重大影响。 重要的会计原则可以在2022年年度报告的第49-54页上找到。 适用ESMA(欧洲证券和市场管理局)关于替代关键绩效比率的指导方针,这意味着对于 未按照《国际财务报告准则》定义的财务指标的披露要求。有关国际财务报告准则未定义的关键比率,请参阅第31页的定义 和替代绩效衡量标准的对账。 注3-集团和母公司的风险和不确定性 运营风险 获批注册之前的研发和药物开发面临相当大的风险, 是一个资本密集型过程。由于技术风险,例如未能证明有效性或有利的风险/ 收益状况或制造问题,所有已启动的项目中的大多数将永远无法进入市场注册。竞争药品可以占据市场份额 或更快地进入市场,或者如果竞争研究项目获得更好的产品概况,则产品组合的 未来价值可能低于预期。这些运营也可能受到监管决策的负面影响,例如缺乏批准和价格变动。 Calliditas拥有一款商业化产品,该产品已在美国 获得加速批准,品牌名为TARPEYO,并已在欧盟和英国以Kinpeygo品牌获得有条件的上市许可 。存在的风险是,商业化 无法按计划进行,或者处方医生的吸收率会比计划差,或者 该药物不会产生足够的效果或出现不良副作用,这可能会对 的销售产生负面影响。 “研发费用” 部分的 “财务概览” 中描述了对财务报表的影响。 Financial Risks Calliditas 管理金融风险管理的财务政策由 董事会设计,代表了指导方针和规则框架,形式为风险 的规定和金融活动限制。集团主要受到外汇 风险的影响,因为Nefecon和setanaxib的开发成本主要以美元和欧元支付。 此外,集团持有以美元计的应收账款以及以美元和欧元为单位的现金,以支付未来 与TARPEYO在美国的商业化以及 临床开发项目相关的预期成本(以美元和欧元计)。关于集团和母公司的财务风险 管理,与2022年年度 报告中的描述相比,风险基本保持不变。 有关运营和财务风险的更多信息和全面披露,请参阅 于 2023 年 4 月向美国证券交易委员会 提交的 2022 年年度报告和 20-F 表年度报告。 简明合并财务报表附注 |
| 28 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 NOTES 附注 4-与客户签订合同的收入 9 月 30 日止三个月, 截止九个月 12 月 31 日, (以千瑞典克朗计)2023 2023 2022 年商品或服务类型 产品销售额 284,992 125,045 2,563 206,634 375,515 产品外许可-135,011-163,816 421,689 特许权使用费收入 9,600-22,764-2,287 某些监管 服务的业绩 --3,387 3,387 共计 294,592 260,056 755,327 373,837 802,879地理市场 美国 283,591 123,400 728,522 204,989 372,247 欧洲 11,001 136,656 26,805 140,044 143,955 亚洲--28,804 286,677 总计 294,592 260,056 755,327 373,837 802,879 该期间的净销售额主要来自塔佩约的净销售额在美国,截至2023年9月30日和 2022年9月30日的三个月中,金额分别为2.836亿瑞典克朗和1.234亿瑞典克朗。在截至2023年9月30日和2022年9月30日的九个月中, TARPEYO的净销售额分别为7.285亿瑞典克朗和2.05亿瑞典克朗。 我们在欧洲合作的特许权使用费收入在2023年第三季度为960万瑞典克朗(-)万瑞典克朗,2023年前九个月为2,280万瑞典克朗。在截至2023年9月30日的三个月和九个月中,没有发现任何里程碑。在截至2022年9月30日 的三个月中,净销售额为1.35亿瑞典克朗,其中包括Kinpeygo在欧洲商业化产生的里程碑费用 。此外,在截至2022年9月 30日的九个月中,里程碑费用为1.638亿瑞典克朗,其中包括有关 Everst Medicines 的里程碑费。 截至2023年9月30日和2022年9月30日,预期回报和回扣的总负债分别为4,410万瑞典克朗和1,720万瑞典克朗,在其他当前 负债以及应计费用和递延收入中确认。 注5-关联方交易 在本报告所述期间,没有发生任何重大的关联方交易。 有关激励计划的信息,请参阅注释 9。 附注6——金融工具 集团的金融资产包括非流动金融资产、流动应收账款和现金, 按摊余成本确认。集团的金融负债包括或有 对价、非流动计息负债、其他非流动负债、租赁负债、 应付账款、其他流动负债和应计费用,除或有 对价外,均按摊余成本确认。账面金额是 公允价值的近似值。 或有对价按公允价值确认,按国际财务报告准则价值层次结构的第三级衡量。或有对价是根据现值 方法计算的,并考虑了各种里程碑是否以及何时发生 的概率。计算基于 12.0% 的折扣率。影响或有对价估值的最重要输入 是集团对实现里程碑概率 的估计。在截至2023年9月30日和2022年9月30日的三个月中, 的利润/(亏损)分别为(180万瑞典克朗)和(140万瑞典克朗), 在截至2023年9月30日和2022年9月30日的九个月中, 的影响利润/(亏损)分别为880万瑞典克朗和(410万瑞典克朗),计入其他 营业收入/(费用),净额。这归因于setanaxib平台内PBC 项目的研究设计发生了变化。欲了解更多信息,请参阅 2022 年年度报告。 注7——国库股 截至2023年9月30日,母公司 持有5,908,018股普通股作为库存股。在2023年年度股东大会上,授权Calliditas 可以转让(出售)这些普通股,用于为收购业务提供资金, 筹集资金以资助项目开发、偿还贷款或将 Calliditas的产品商业化。截至2023年9月30日,尚未发生库存股的转让(出售)。 截至2023年9月30日的已发行股票总数列于附注8。 |
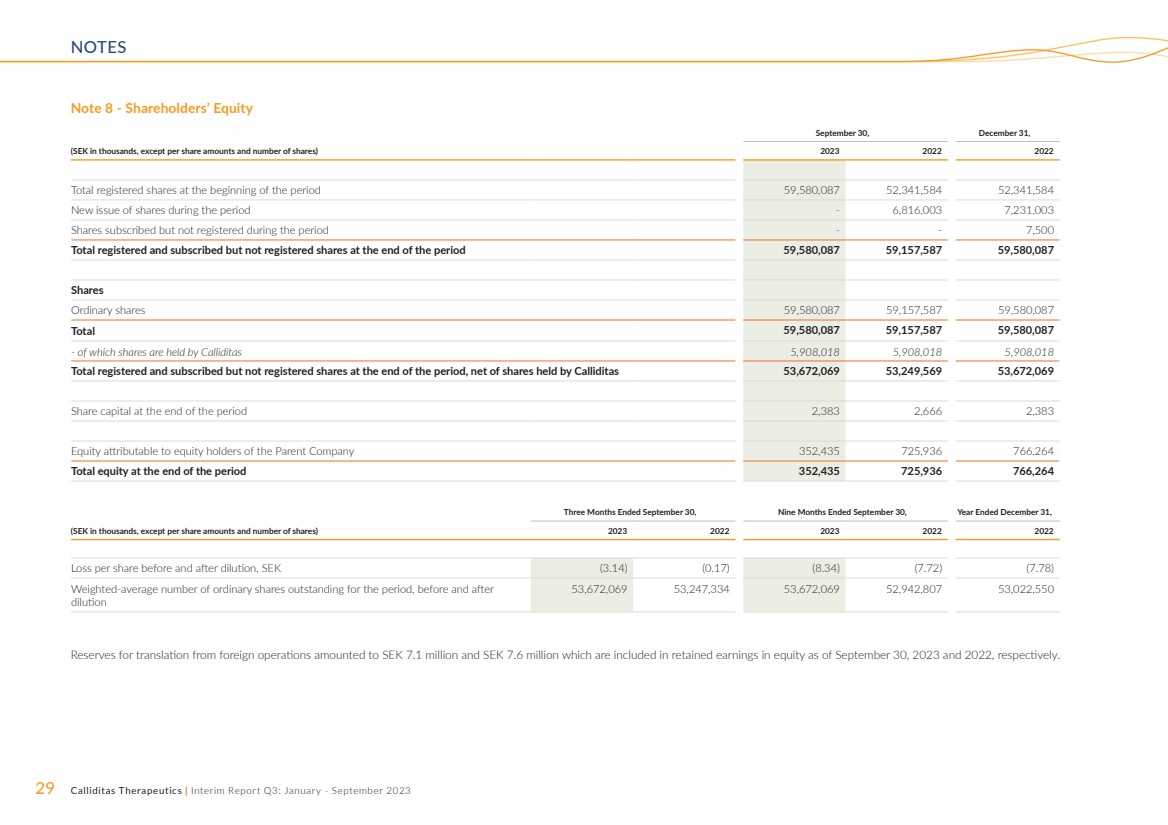
| 29 Calliditas Therapeutics | 中期报告第三季度:2023 年 1 月至 9 月 NOTES 注 8 — 股东权益 9 月 30 日,12 月 31 日, (以千瑞典克朗计,每股金额和股票数量除外)2023 2022 年期初注册股票总数 59,580,087 52,341,584 股本期内新发行的股票——6,816161 在此期间已认购但未注册的7,231,003股股票--7,500 股本期末已注册和认购但未注册的股票总数 59,580,087 59,157,587 59,580,087 股 普通股 59,580,087 59,157,587 59,580,087 共计 59,580,087 59,157,587 59,580,087-其中股份由卡利迪塔斯持有 5,908,018 5,908,018 期末已注册和认购但未注册的股份总数,扣除卡利迪塔斯持有的股份 53,67,67,087 2,069 53,249,569 53,672,069 期末股本 2,383 2,666 2,383 归属于母公司股东的权益 352,435 725,936 766,264 期末的总权益 352,435 725,936 766,264 截至9月30日的三个月,截至九个月9月30日,截至12月31日的财年, (以千瑞典克朗计,每股金额和股票数量除外)2023 2023 2022 2022 摊薄前后的每股亏损,瑞典克朗(3.14)(0.17)(8.34)(7.72)(7.78) 稀释前后该期间已发行普通股的加权平均数 53,672,069 53,2469 7,334 53,672,069 52,942,807 53,022,550 来自国外业务的折算储备金为710万瑞典克朗和760万瑞典克朗,分别包含在截至2023年9月30日和2022年9月30日的权益留存收益中。 |
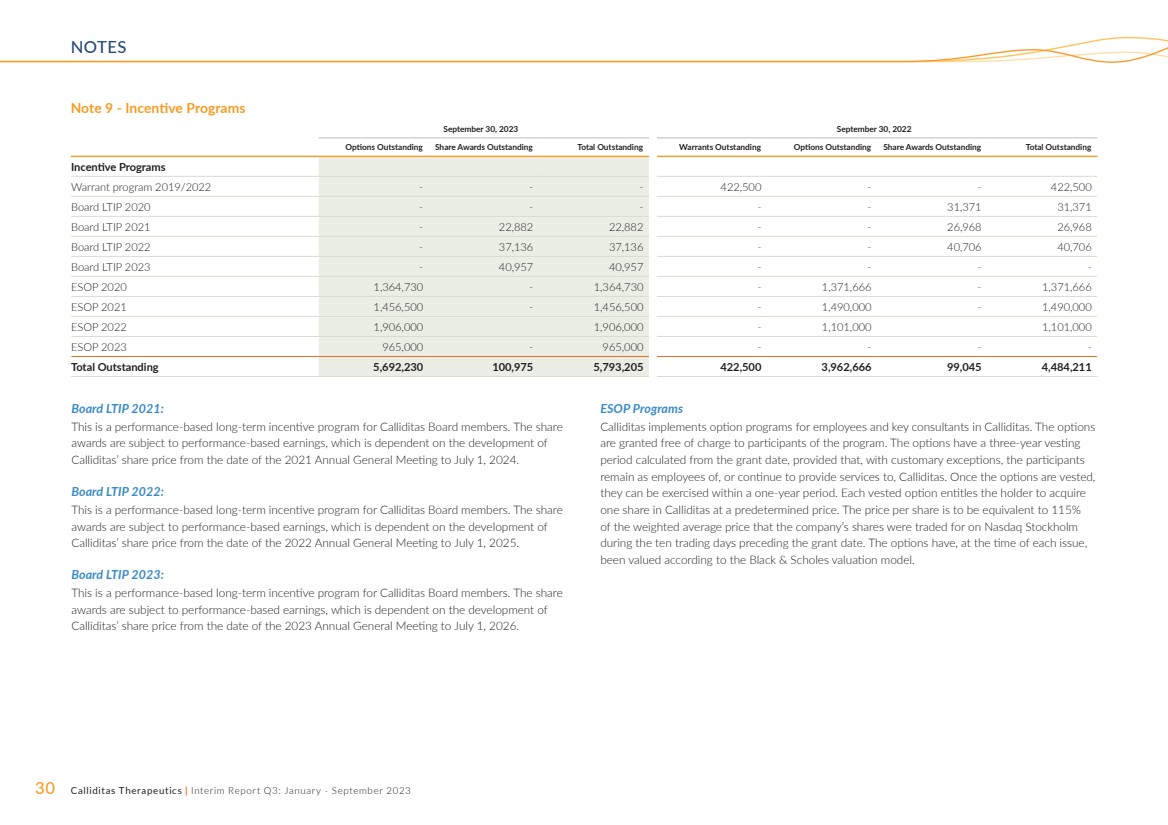
| 30 Calliditas Therapeutics | Interim Report Q3: January - September 2023 NOTES Note 9 - Incentive Programs Board LTIP 2021: This is a performance-based long-term incentive program for Calliditas Board members. The share awards are subject to performance-based earnings, which is dependent on the development of Calliditas’ share price from the date of the 2021 Annual General Meeting to July 1, 2024. Board LTIP 2022: This is a performance-based long-term incentive program for Calliditas Board members. The share awards are subject to performance-based earnings, which is dependent on the development of Calliditas’ share price from the date of the 2022 Annual General Meeting to July 1, 2025. Board LTIP 2023: This is a performance-based long-term incentive program for Calliditas Board members. The share awards are subject to performance-based earnings, which is dependent on the development of Calliditas’ share price from the date of the 2023 Annual General Meeting to July 1, 2026. ESOP Programs Calliditas implements option programs for employees and key consultants in Calliditas. The options are granted free of charge to participants of the program. The options have a three-year vesting period calculated from the grant date, provided that, with customary exceptions, the participants remain as employees of, or continue to provide services to, Calliditas. Once the options are vested, they can be exercised within a one-year period. Each vested option entitles the holder to acquire one share in Calliditas at a predetermined price. The price per share is to be equivalent to 115% of the weighted average price that the company’s shares were traded for on Nasdaq Stockholm during the ten trading days preceding the grant date. The options have, at the time of each issue, been valued according to the Black & Scholes valuation model. September 30, 2023 September 30, 2022 Options Outstanding Share Awards Outstanding Total Outstanding Warrants Outstanding Options Outstanding Share Awards Outstanding Total Outstanding Incentive Programs Warrant program 2019/2022 - - - 422,500 - - 422,500 Board LTIP 2020 - - - - - 31,371 31,371 Board LTIP 2021 - 22,882 22,882 - - 26,968 26,968 Board LTIP 2022 - 37,136 37,136 - - 40,706 40,706 Board LTIP 2023 - 40,957 40,957 - - - - ESOP 2020 1,364,730 - 1,364,730 - 1,371,666 - 1,371,666 ESOP 2021 1,456,500 - 1,456,500 - 1,490,000 - 1,490,000 ESOP 2022 1,906,000 1,906,000 - 1,101,000 1,101,000 ESOP 2023 965,000 - 965,000 - - - - Total Outstanding 5,692,230 100,975 5,793,205 422,500 3,962,666 99,045 4,484,211 |
| 31 Calliditas Therapeutics | Interim Report Q3: January - September 2023 NOTES Definitions and Reconciliations of Alternative Performance Measures Definitions of Alternative Performance Measures Alternative Key Performance Indicator Definitions Reason for Inclusion Equity ratio at the end of the period in % The ratio at the end of respective period is calculated by dividing total shareholders’ equity by total assets. The equity ratio measures the proportion of the total assets that are financed by shareholders. Reconciliations of Alternative Performance Measures September 30, December 31, (SEK in thousands or otherwise indicated) 2023 2022 2022 Equity ratio at the end of the period in % Total shareholders' equity at the end of the period 352,435 725,936 766,264 Total assets at the end of the period 1,611,891 1,518,106 1,952,973 Equity ratio at the end of the period in % 22% 48% 39% |