sgmo-202311022023年11月2日0001001233假的00010012332023-11-022023-11-02 美国
证券交易委员会
华盛顿特区 20549
表单 8-K
当前报告
根据第 13 条或第 15 (d) 条
1934 年《证券交易法》
报告日期(最早报告事件的日期): 2023年11月2日
SANGAMO 治疗公司
(注册人的确切姓名如其章程所示)
| | | | | | | | | | | | | | |
| | | | |
| 特拉华 | | 000-30171 | | 68-0359556 |
(州或其他司法管辖区
公司) | | (委员会
文件号) | | (国税局雇主
证件号码) |
7000 Marina Blvd。, 布里斯班, 加利福尼亚94005
(主要行政办公室地址)(邮政编码)
(510) 970-6000
(注册人的电话号码,包括区号)
不适用
(如果自上次报告以来发生了变化,则为以前的姓名或以前的地址)
如果提交8-K表格是为了同时履行注册人根据以下任何条款承担的申报义务,请勾选下面的相应方框:
| | | | | |
| ☐ | 根据《证券法》(17 CFR 230.425)第425条提交的书面通信 |
| | | | | |
| ☐ | 根据《交易法》(17 CFR 240.14a-12)第14a-12条征集材料 |
| | | | | |
| ☐ | 根据《交易法》(17 CFR 240.14d-2 (b))第14d-2(b)条进行的启动前通信 |
| | | | | |
| ☐ | 根据《交易法》(17 CFR 240.13e-4 (c))第13e-4(c)条进行的启动前通信 |
根据该法第12(b)条注册的证券: | | | | | | | | | | | | | | |
| | | | |
| 每个班级的标题 | | 交易品种 | | 注册的每个交易所的名称 |
| 普通股,每股面值0.01美元 | | SGMO | | 纳斯达克全球精选市场 |
用复选标记表明注册人是1933年《证券法》第405条(本章第230.405节)还是1934年《证券交易法》第12b-2条(本章第240.12b-2节)所定义的新兴成长型公司。
新兴成长型公司☐
如果是新兴成长型公司,请用复选标记表明注册人是否选择不使用延长的过渡期来遵守根据《交易法》第13(a)条规定的任何新的或修订后的财务会计准则。☐
项目 8.01 其他活动。
Giroctocogene fitelparvovec,也称为 SB-525,是治疗中度至重度 A 型血友病的候选基因疗法产品,也是我们的 1/2 期 Alta 研究和注册的 3 期 AFFINE 临床试验的主题。我们正在与我们的合作者辉瑞公司(Pfizer Inc.)一起开发giroctogene fitelparvovec。我们和辉瑞计划在65的平台演示中提供来自Alta第1/2期研究的最新数据,其中已接受摘要的摘要摘要见下文第四美国血液学会年会和博览会将于2023年12月11日举行。辉瑞预计,评估giroctogene fitelparvovec的3期AFFINE试验将在2024年中期获得关键结果。
Giroctocogene Fitelparvovec 的 1/2 期 Alta 研究的最新初步结果摘要
•Alta 是一项 1/2 期单剂量多中心剂量范围研究,旨在评估 giroctogene fitelparvovec 在成人重度 A 型血友病中的安全性和耐受性。
•在4个队列中,向年龄≥18岁的成年人注射了四种递增剂量的giroctogene fitelparvovec(9e11、2e12、1e13和3e13 vg/kg)。高剂量(3e13vg/kg)队列扩大到5名参与者。
•关键终点包括安全性、循环因子VIII或FVIII、活性、FVIII 替代疗法的使用以及出血事件的频率。
•共有11名男性参与者参与了这项研究,其中5名参与者属于3e13-vg/kg最高剂量队列。截至2023年5月19日的截止日期,所有参与者都已被跟踪了153至290周。第156周后,两名参与者离开了研究。在其余的参与者中,有1名参与者尚未完成4年(208周)。在高剂量队列(n=5)中报告的最常见的治疗相关不良事件(AE)是肝酶升高和输液相关反应:丙氨酸氨基转移酶(ALT;n=3)升高 [60.0%]),增加天冬氨酸氨基转移酶(AST;n=2 [40.0%])、发热 (n=3 [60.0%]) 和心动过速 (n=2 [40.0%]).
•在最高剂量队列中,有一名受试者报告了与治疗相关的严重不良事件,该参与者在giroctocogene fitelparvovec输注大约六小时后出现低血压和发热;这些事件在治疗后完全消退,第二天输液后出院时间没有延迟。
•在高剂量队列的5名参与者中,有4名观察到需要服用皮质类固醇≥7天的ALT增加的不良事件。ALT 升高是通过逐渐缩小皮质类固醇疗程(中位持续时间:56 天;范围:7—135 天),同时维持有效的 FVIII 活性水平来控制的。高剂量队列的参与者自第65周以来没有服用过类固醇,ALT值在正常范围内(随访:156—208周),肝脏磁共振成像检查结果正常(随访:104—208周)。
•截至2023年5月19日截止日期,没有出现经证实的FVIII抑制剂开发,也没有报告血栓形成事件或肝肿块。
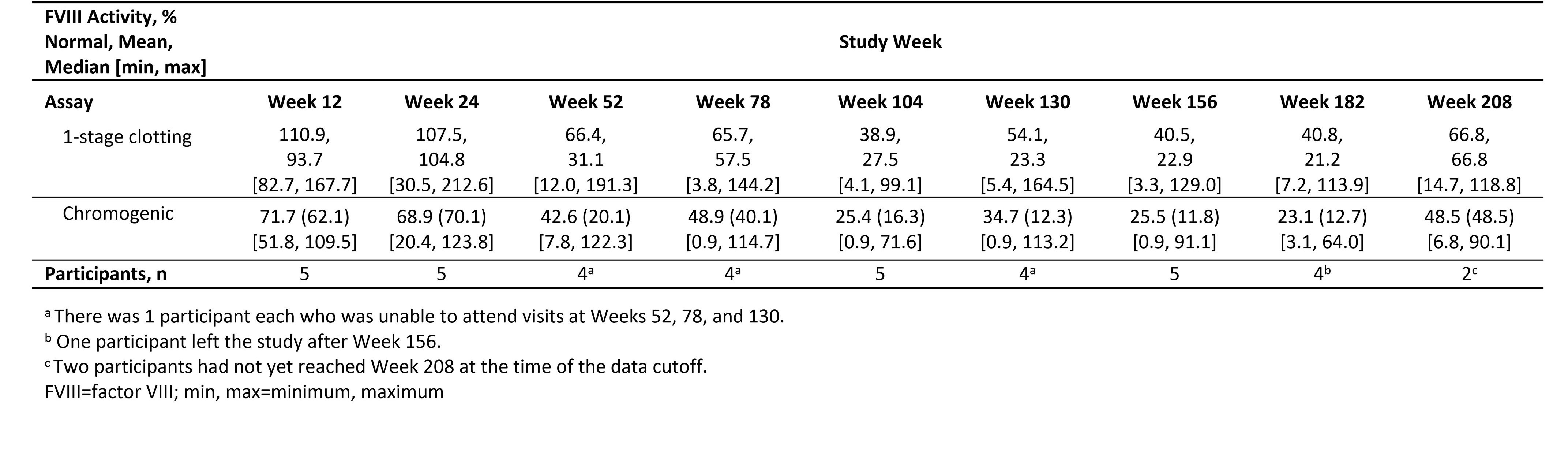
•在高剂量队列的5名参与者中,有2人获得了截至第208周的数据,FVIII活性保持在轻度至正常范围内(见下表1),与第156周的结果一致。在没有第208周数据的人中,有2人有截至第182周的数据。一名参与者的FVIII活性维持在温和的范围内(分别为正常水平的14.1%和24.1%,通过显色和1阶段分析测量);另一名参与者的FVIII活性为3.1%和7.2%。其余参与者在第156周后离开了研究,FVIII活性维持在温和区间(11.8%和22.9%)。
•在高剂量队列中,平均年化总出血率 [(研究药物输注 3 周后开始的所有出血发作次数)/(观察期(以年为单位)]输液后的第一年为0,在整个随访时间内为1.2(SD 2.58)。在该队列中,FVIII 活动水平最低的参与者共经历了 22 次出血,其中 21 次需要治疗(8 次创伤;7 次自发;6 次未知)。其他 4 名参与者没有出血或极少出血,包括 1 名目标关节出血的受试者。截至截止日期,高剂量队列中没有参与者恢复预防。
•对患有严重血友病 A 的参与者进行单次输注 giroctogene fitelparvovec 基因疗法在输注后近 4 年内通常仍能保持良好的耐受性,FVIII 水平相应升高在中度至正常范围内,没有持续的AE,自第 59 周以来没有与肝功能检查增加相关的不良反应。
表 1:Giroctogene Fitelparvovec 3e13-vg/kg 队列的 1 阶段和显色测定法得出的因子 VIII 活性水平
签名
根据1934年《证券交易法》的要求,注册人已正式促使经正式授权的下列签署人代表其签署本报告。
| | | | | | | | | | | | | | | | | | | | |
| | | | | | |
| | | | SANGAMO 治疗公司 |
| | | |
| 日期:2023 年 11 月 3 日 | | | | 来自: | | /SCOTT B. WILLOUGHBY |
| | | | 姓名: | | 斯科特·B·威洛比 |
| | | | 标题: | | 高级副总裁、总法律顾问兼公司秘书 |