

附录 99.2 癌症疫苗:下一个免疫疗法 Frontier IO Biotech 突破界限。点燃变革。纳斯达克:IOBT 2023 年夏季企业概览 © 2023 IO Biotech, Inc. 机密 O Co v n efr id vie en w tial 概述 1

免责声明和前瞻性陈述本演示文稿 仅供参考,旨在帮助有关各方对IO Biotech, Inc.( “公司”)的证券(“私募配售”)的潜在私募进行自己的评估。本演示文稿中或与本演示文稿不作任何明示或暗示的陈述或保证。本演示文稿中的信息不包含或意图包含可能与投资者参与私募的决定相关的所有信息。每个投资者都有责任对公司和私募进行自己的评估,并提出其他问题并获得该投资者认为必要的 其他信息。根据经修订的1933年《证券法》(“证券法”)或任何其他 司法管辖区的证券法,私募中发行的证券将不予登记。公司打算根据《证券法》和其他适用法律的注册要求豁免来提供此类证券。此类证券的任何要约或出售只能向证券法第501 (a) 条所指的 机构 “合格投资者” 或《证券法》第144A条所指的 “合格机构买家” 的人提出。这些证券不会得到任何联邦、州或外国证券管理机构的批准或推荐,也不会透露私募的优点。本陈述不构成出售要约或招揽购买这些证券的要约 ,在任何州或司法管辖区根据任何此类州或 司法管辖区的证券法进行注册或获得资格之前,此类要约、招标或出售均为非法的州或司法管辖区也不得出售这些证券。本演示文稿及其中包含的信息(“机密信息”)构成机密信息。收到机密信息即表示您同意保持 机密信息的机密性,并且此类机密信息受您或您的关联公司对公司、其业务或私募的任何保密义务的约束。未经公司事先书面同意,禁止复制或分发 机密信息。本演示文稿中包含的所有与历史事实无关的陈述均应被视为前瞻性陈述,包括与我们开发 IO102-IO103、IO112 和任何其他候选产品、我们的临床前或临床试验数据的承诺和潜在影响以及任何临床试验或读出的时机和结果有关的 陈述。这些 前瞻性陈述基于管理层当前的预期。在某些情况下,前瞻性陈述可以用 “可能”、“应该”、“将”、“期望”、 “计划”、“预期”、“可以”、“打算”、“目标”、“项目”、“考虑”、“相信”、“估计”、“预测”、 “潜力” 或 “继续” 或这些术语的负面或其他术语来识别旨在识别有关未来的陈述的可比术语。本演示文稿中包含的前瞻性陈述包括但不限于 有关我们未来的财务或业务业绩、状况、计划、前景、趋势或战略以及其他财务和商业问题的陈述;我们对 IO102-IO103、 IO112 和任何其他候选产品的临床试验的时机、进展和成功,包括关于研究或试验启动和完成时间以及相关准备工作的陈述,试验结果将公布的时期可用和我们的 研发计划;我们按照我们预期的速度招收患者参与临床试验的能力;监管部门对我们的候选产品或竞争对手的产品和候选产品的批准和行动; 我们的临床前研究结果;我们任何候选产品或临床开发计划的开发成本;对我们现有资本资源在多长时间内足以资助我们的 运营支出和资本的预期支出;潜在属性以及使用 IO102-IO103、IO112 或任何其他候选产品(如果获得批准)的临床益处;如果获得批准,我们能够成功将 IO102-IO103、IO112 或任何其他 候选产品商业化;我们成功建立或维持候选产品的合作或战略关系的能力;IO102-IO103、IO112 或我们可能确定和追求的任何 其他候选产品的市场接受率和程度;我们获得孤儿药称号的能力,突破性疗法称号,我们可能确定的任何候选产品的加速批准或其他批准;我们对 政府和第三方付款人承保范围和报销的期望;我们根据美国食品药品监督管理局的要求和其他适用监管机构的要求制造 IO102-IO103、IO112 或任何其他候选产品的能力,包括通过合同制造组织;我们成功建立销售队伍和商业基础设施的能力;我们与目前公司竞争的能力生产或参与 治疗我们所追求的疾病适应症和我们开发的治疗模式的临床开发;我们依赖第三方进行临床试验;我们依赖第三方为我们制造和提供 候选产品;我们留住和招募关键人员的能力;我们获得和维持 IO102-IO103、IO112 或我们可能确定和追求的任何其他候选产品的知识产权保护的能力;我们对我们的 的估计开支, 持续亏损, 未来收入,资本要求以及我们对获得额外融资的需求或能力;以及与我们的竞争对手或我们的行业有关的发展和预测。 可能会不时出现新的风险和不确定性,不可能预测所有的风险和不确定性。除非法律要求,否则我们没有义务公开更新这些前瞻性陈述,也没有义务更新实际业绩可能与 前瞻性陈述中预期的结果存在重大差异的原因,即使将来有新的信息可用。有关这些风险和不确定性以及其他重要因素的讨论,其中任何一个都可能导致我们的实际业绩与前瞻性陈述中包含的业绩有所不同,请参阅我们向美国证券交易委员会(“SEC”)提交的最新10-K表年度报告中标题为 “风险因素” 的部分,以及 我们随后向美国证券交易委员会(“SEC”)提交的其他文件中对潜在风险、不确定性和其他重要因素的讨论美国证券交易委员会。提醒收件人不要过分依赖这些前瞻性陈述,这些陈述仅代表此类陈述发表之日,不应被解释为事实陈述。本演示文稿包括我们从行业出版物和第三方进行的研究、调查和研究中获得的统计数据和其他行业和市场数据 以及我们自己对潜在市场机会的估计。本演示文稿中使用的所有市场数据都涉及许多假设和局限性,请注意不要过分重视这些数据。行业出版物和 第三方研究、调查和研究通常表明,他们的信息是从被认为可靠的来源获得的,尽管它们不能保证此类信息的准确性或完整性。我们对候选产品 潜在市场机会的估计包括基于我们的行业知识、行业出版物、第三方研究和其他调查的几个关键假设,这些假设可能基于较小的样本量,可能无法准确反映市场机会。尽管我们认为我们的内部假设是合理的,管理层应对此类假设和数据的准确性负责,但没有独立来源证实这些假设。机密 概述 2

“癌症疫苗:下一个免疫疗法前沿” 疫苗 基于靶向免疫抑制蛋白(例如IDO1、PDL1)的T细胞的开创性发现。IO Biotech的t-win疫苗平台:率先对免疫调节疫苗定向抑制细胞(IDO1和PDL1)进行免疫直接杀死, 包括TME表达细胞中的肿瘤对细胞(Tregs和TAM)和TME中的基因稳定的免疫抑制细胞,蛋白质(目前在Ph3中)在Ph1/2将TME调节到更促炎、抗肿瘤的环境中得到证实通过消除 IDO 和 PD-L1 阳性 Treg 和 TAM t-win® IO102-IO103 疫苗有可能显著改善当前的治疗模式 1。Lin 等人Nature Cancer 3,911-926 (2022) 机密概述 3 2.Runwal P.《国家地理》,2022 年 12 月 22 日出版

增长轨迹得益于重要的临床里程碑势头 行业先驱改变黑色素瘤治疗范式在2025年进入美国市场的潜力。其他实体瘤的多个上行机会有望增长 5 机密概述
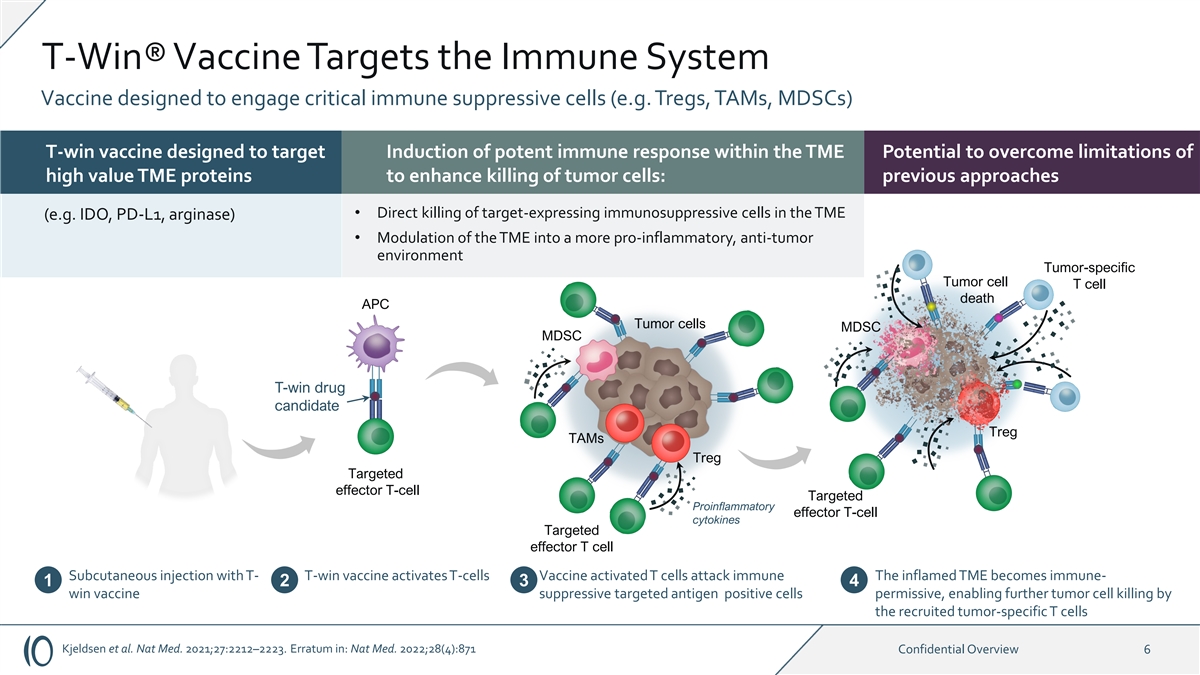
T-Win® 疫苗靶向免疫系统疫苗,旨在接触 关键免疫抑制细胞(例如 Treg、TAM、mdsc)t-win 疫苗,旨在靶向 TME 内诱导强效免疫反应克服高价值 TME 蛋白的局限性以增强对肿瘤细胞的杀死:以前的 方法 • 直接杀死 TME 中表达靶向的免疫抑制细胞(例如 IDO、PD-L1、精氨酸酶)• 将 TME 调制成更具促炎性、抗肿瘤的环境肿瘤特异性肿瘤细胞 T 细胞死亡 APC Tumo 细胞MDSC MDSC t-win 候选药物 Treg tams Treg 靶向效应剂 T 细胞靶向促炎效应剂 T 细胞因子靶向效应剂 T 细胞皮下注射 T 细胞激活 T 细胞疫苗活化 T 细胞攻击 免疫发炎的 TME 变得免疫——1 2 3 4 赢疫苗抑制靶向抗原阳性细胞是允许的,通过招募的肿瘤特异性进一步杀死肿瘤细胞 T 细胞 Kjeldsen 等人Nat Med. 2021;27:2212 —2223。Erratum in: Nat Med. 2022;28 (4): 871 机密概述 6

将我们的科学转化为患者的临床结果保密 概述 7

当前管道 — 所有项目都在追踪治疗/项目 临床前 1 阶段 2 阶段 3 阶段里程碑指示 ü 225 名患者 2023 年 6 月入学 First Line Advanced • 完成入组:按年份划分-(1) 2023 年底 • 中期分析:2024 年中期 ü 来自九名 可评估的非小细胞肺癌患者 (2) IO102-IO103 • 肺 (NSCLC) 2023 年 1 月公布的令人鼓舞的数据 (1) (2) • Head & Neck (SCCHN) 一线实体瘤目标:• 继续报名第 2 期 (2) • 膀胱 (UBC) IDO,PD-L1 “篮子” 试验 • 2023 年的其他数据 • 黑色素瘤新佐剂/ (2)• 启动 2 期 “篮子” 试验 • Head & Neck (SCCHN) (1) 辅助实体瘤 2023 年 2 小时 • 适应症待定 IO112 适应症待定实体瘤 • IND 就绪目标:IO112 精氨酸酶 1 1.与 pembrolizumab 2 联合使用。NSCLC = 非小细胞肺癌,SCCHN = 头颈部鳞状细胞癌,UBC = 尿路上皮膀胱癌机密 概述 8
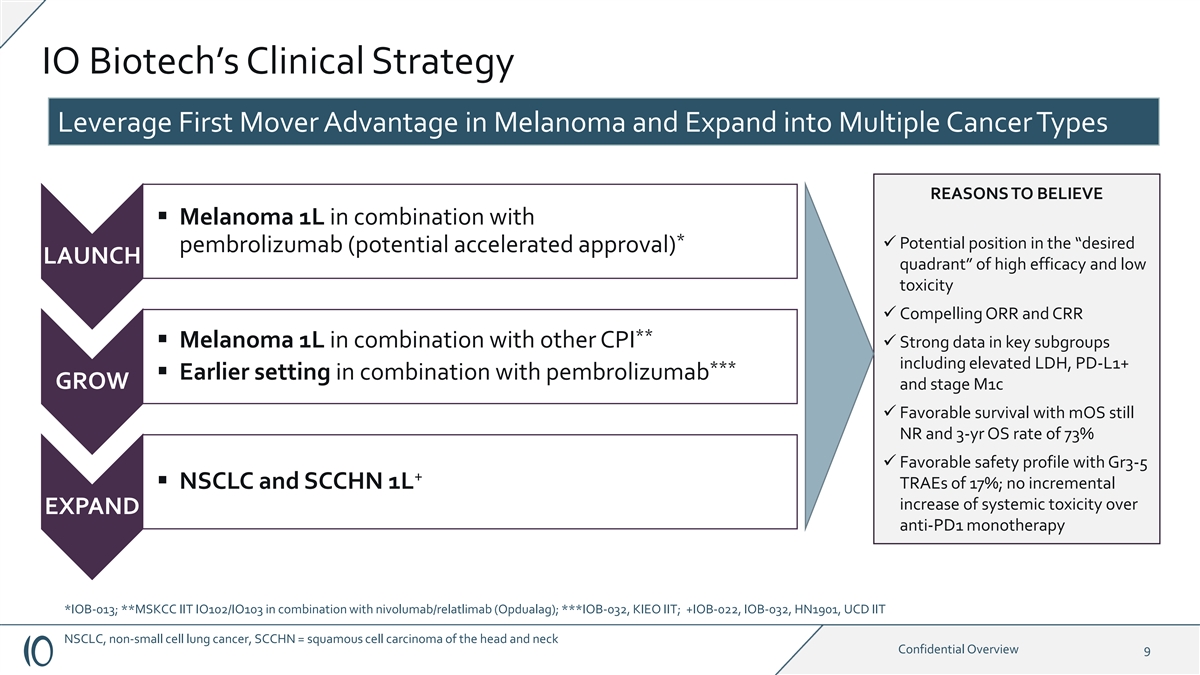
IO Biotech 的临床策略利用 黑色素瘤的先发优势,扩展到多种癌症类型值得相信的理由 § 黑色素瘤 1L,再加上 * ü 在 “期望的 pembrolizumab(潜在加速批准)启动象限” 中的潜在位置,具有高疗效和低 毒性 ü 令人信服的 ORR 和 CRR ** § melanoma 1L 与包括 LDH 升高在内的其他 cpiü 关键亚组的强大数据,PD-L1+ *** § 较早的设置与 pembrolizumab GROW 和 stage m1c ü 配合使用 moS 还是 NR 和 3 年操作系统,生存效果良好比率为 73% ü Gr3-5 + § NSCLC 和 SCCHN 1L TRAE 为 17%;与 EXPAND 抗 PD1 单一疗法相比,全身毒性没有递增增加 *IOB-013;**MSKCC IIT IO102/IOB-103 与 nivolumab/relatlimab (Opdualag) 联合使用;***IOB-032,KIEO IT;+IOB-022,IOB-032、HN1901、UCD IT NSCLC、非小细胞肺癌、SCCHN = 头颈部鳞状细胞癌机密概述 9
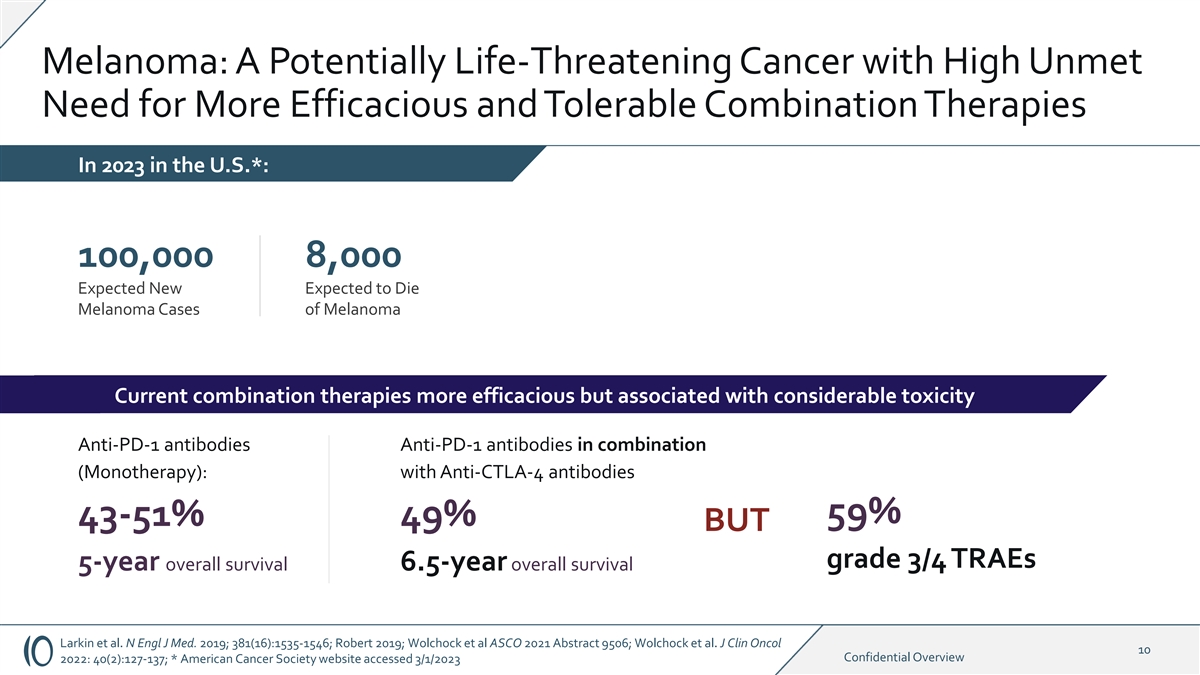
黑色素瘤:一种可能危及生命的癌症,2023 年美国对 更有效和更可耐受的联合疗法的需求未得到满足*:100,000 预计会有新的死亡黑色素瘤病例当前的组合疗法更有效但毒性相当强的抗 PD-1 抗体组合抗PD-1 抗体(单一疗法):含抗 CTLA-4 抗体 59% 43-51% 49% 但总存活率为 3/4 traes 5 年总存活率 6.5 年 Larkin 等人N Engl J Med. 2019;381 (16): 1535-1546;Robert 2019;Wolchock 等人 ASCO 2021 摘要 9506;Wolchock 等人J Clin Oncol 2022 年机密概述:40 (2): 127-137;* 美国癌症协会网站已于 2023 年 3 月 1 日访问
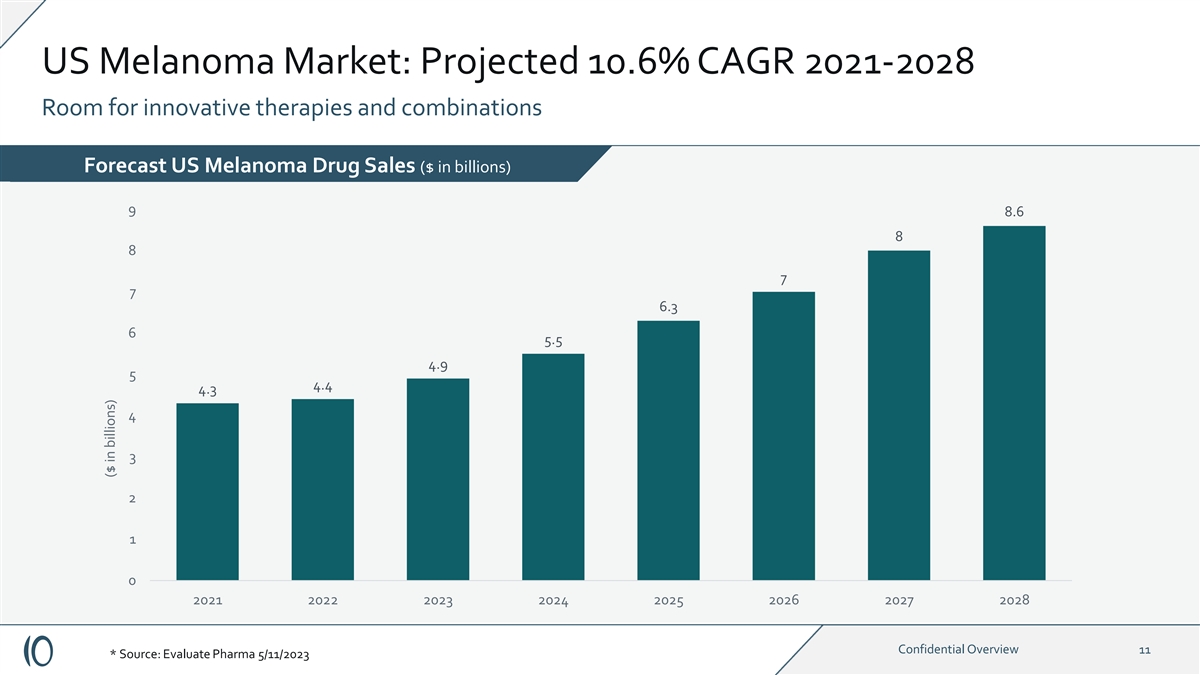
美国黑色素瘤市场:预计2021-2028年复合年增长率为10.6% 创新疗法和组合还有空间 fore 10 演员阵容美国黑色素瘤药物销售额(十亿美元)9 8.6 8 7 6 6.3 6 5.5 4.4 4 4 4 3 1 0 2021 2023 2024 2026 2027 2028 机密概述 11 * 来源:评估药业 2023 年 11 月 5 日(以十亿美元计)

1/2 期试验令人信服的 1/2 期黑色素瘤数据发表在 Nature Medicine 成功结果推动持续临床开发 2021 年 12 月 9 日 2023 年 1 月 2023 年 1 月 2 日数据剪辑* 发布于 JITC,2023 年 5 月 25.5 49.8 个月 mpf 月中位随访 moS 尚未达到* 80% 50% ORR(正如之前在 Nature 上报道的那样;RECIST1.1= 73.3% ORR)1 月 23 日更新:一名患者接受了重新评估但没有 “真正的进度” 但改为伪进度机密概述 12 Lorentzen 等人J Immunother Cancer 2023;11 (5): e006755
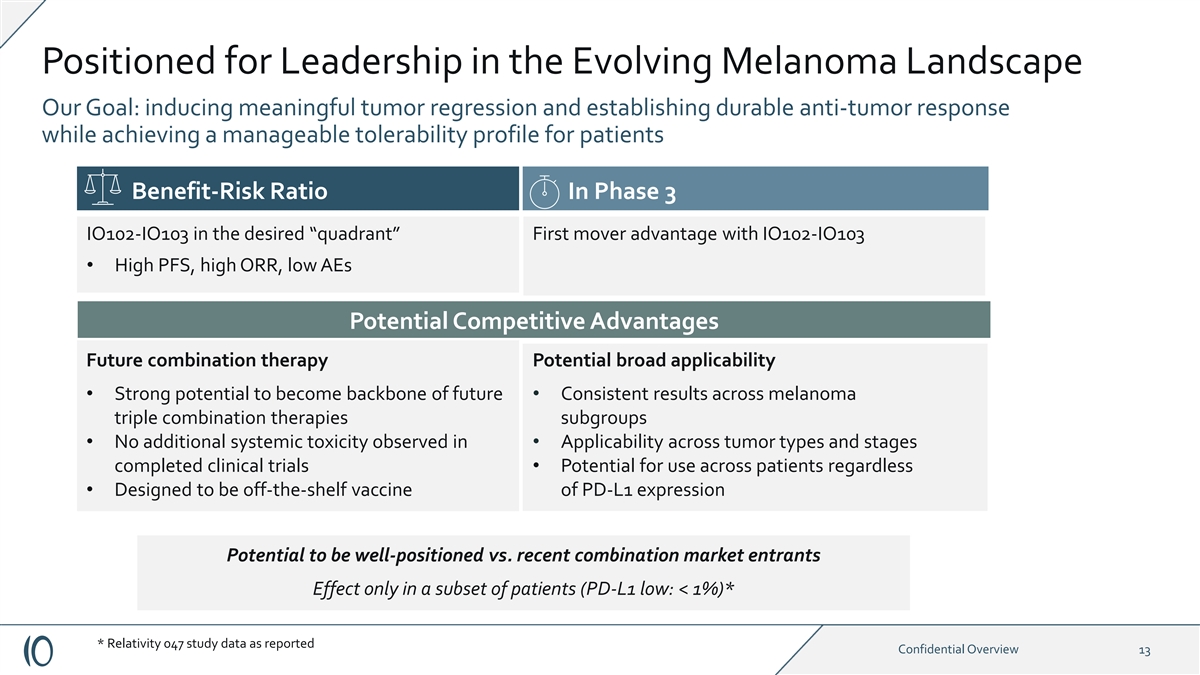
有望在不断演变的黑色素瘤格局中处于领先地位我们的目标: 诱导有意义的肿瘤消退并建立持久的抗肿瘤反应,同时实现患者可控的耐受性在第三阶段 IO102-IO103 在所需的 “象限” 中先发优势 • 高 PFS、高 ORR、低 AE 潜在竞争优势未来联合疗法潜在的广泛适用性 • 黑色素瘤三重获得一致的结果} 组合疗法 IO102-IO103亚组 • 未观察到额外的全身毒性 • 在肿瘤类型和阶段的适用性已完成临床试验 • 无论如何都有可能在患者中使用 • 设计为 表达的现成疫苗 与最近的组合市场进入者相比,可能处于有利地位,仅对一部分患者有效(PD-L1 low: PD-L1

IO102-IO103 免疫调节癌症疫苗:正在进行的临床试验 机密概述 14
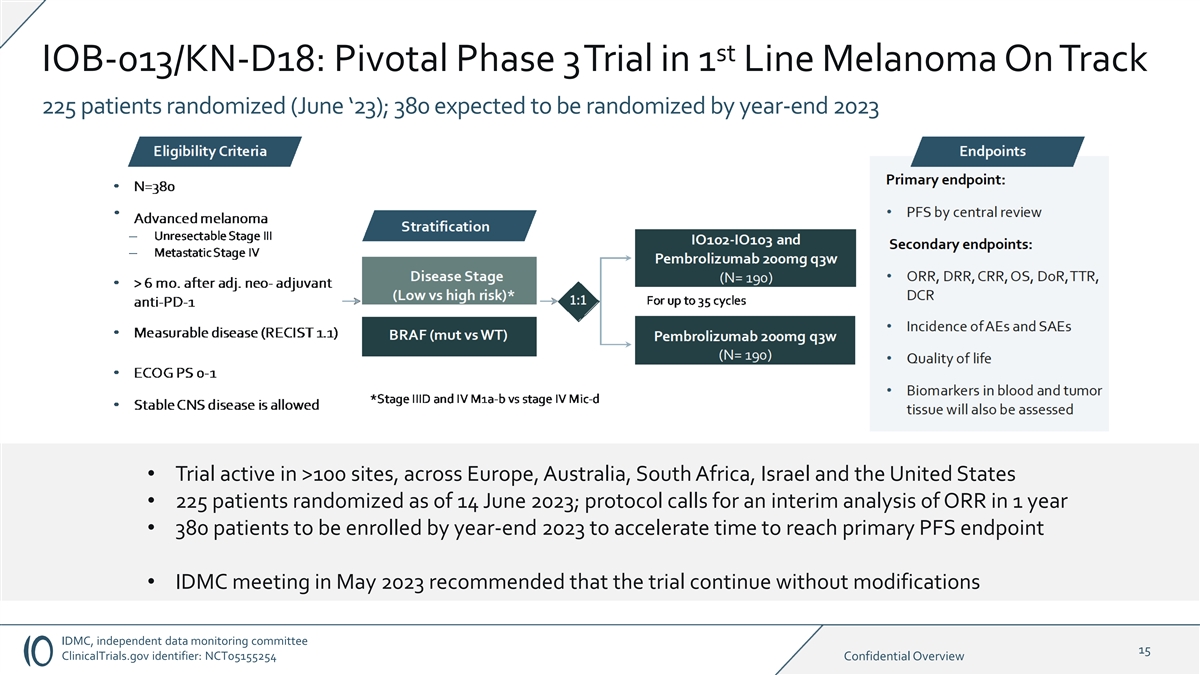
st IOB-013/KN-D18:Pivotal Phase 3 试验 1 线黑色素瘤 On Track 225 名患者随机分组(23 年 6 月);预计到 2023 年底将有 380 名患者随机分组 • 截至 2023 年 6 月 14 日,有 225 名患者随机分组; 协议要求在 1 年内对 ORR 进行中期分析 • 年底前 380 名患者入组 2023 年将加快到达 PFS 主端点的时间 • 2023 年 5 月的 IDMC 会议建议在不修改的情况下继续试验 IDMC,独立数据监测委员会 15 ClinicalTrials.gov 标识符:NCT05155254 机密概述
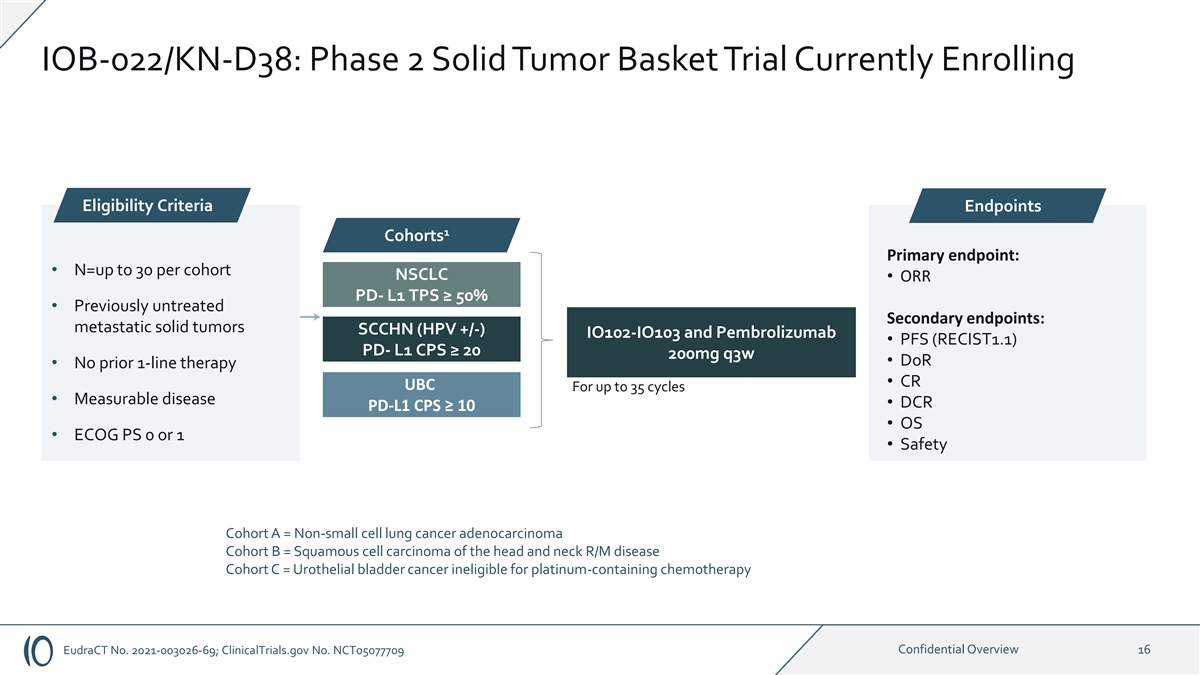
IOB-022/KN-D38:2 期实体瘤篮子试验目前正在报名 资格标准终点 1 个队列主要终点:• n=每个队列最多 30 个 NSCLC • ORR PD-L1 TPS ≥ 50% • 以前未经治疗的 1:1 次要终点:转移性实体瘤 SCCHN (HPV +/-) IO102-IO103 和 pembrolizumab • PFS (RECIST1.1) pd-L1 CPS ≥ 20 200mg q3w • doR • 之前没有单线疗法 • CR UBC 长达 35 个周期 • 可测量的疾病 • DCR PD-L1 CPS ≥ 10 • OS • ECOG PS 0 或 1 • 安全队列 A = 非小细胞肺癌腺癌群组 B = 鳞状细胞癌头颈部 R/M 疾病群组 C = 尿路上皮膀胱癌没有资格接受含铂化疗 eudRact 编号 2021-003026-69; clinicalTrials.gov No.NCT05077709 机密概述 16
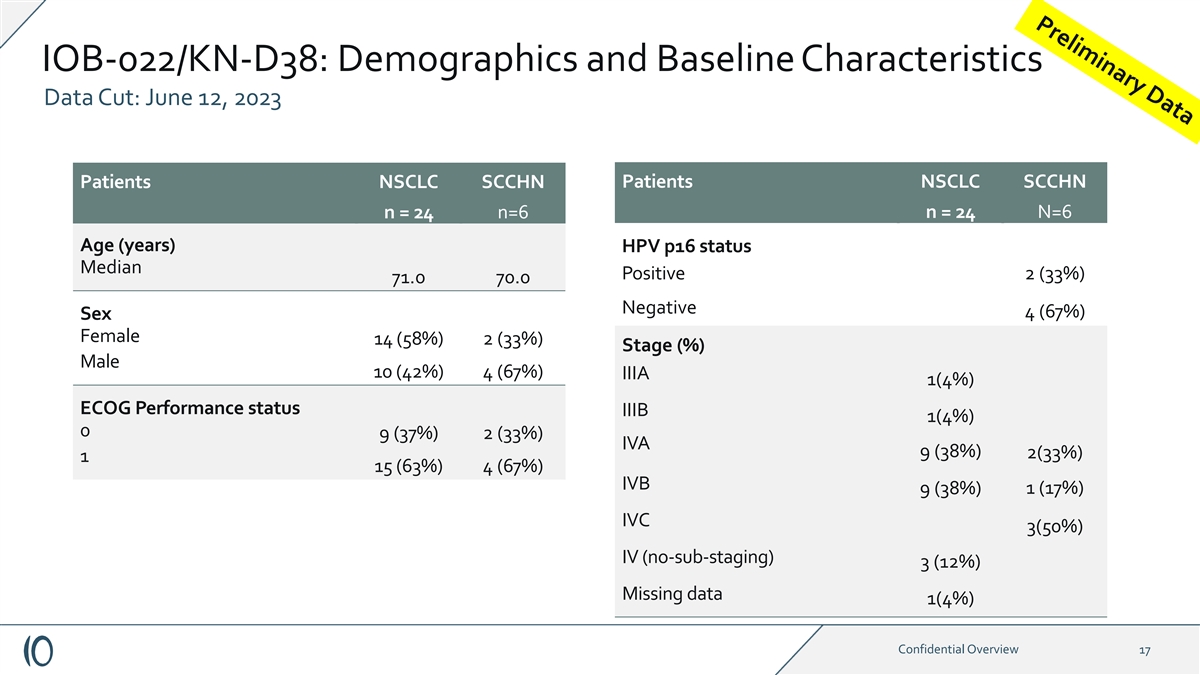
IOB-022/KN-D38:人口统计学和基线特征数据剪辑: 2023 年 6 月 12 日患者 NSCLC SCCHN 患者 NSCLC SCCHN n = 24 n=6 n = 24 N=6 年龄(岁)HPV p16 状态中位数阳性 2 (33%) 71.0 70.0 阴性 4 (67%) 性别女性 14 (58%) 2 (33%) 男性 10 (%) 42%) 4 (67%) IIIA 1 (4%) ECOG 性能 status IIIB 1 (4%) 0 9 (37%) 2 (33%) IVA 9 (38%) 2 (33%) 1 15 (63%) 4 (67%) IVB 1 (17%) 9 (38%) IVC 3 (50%) IV (no-substaging) 3 (12%) 缺失数据 1 (4%) 机密概述 17
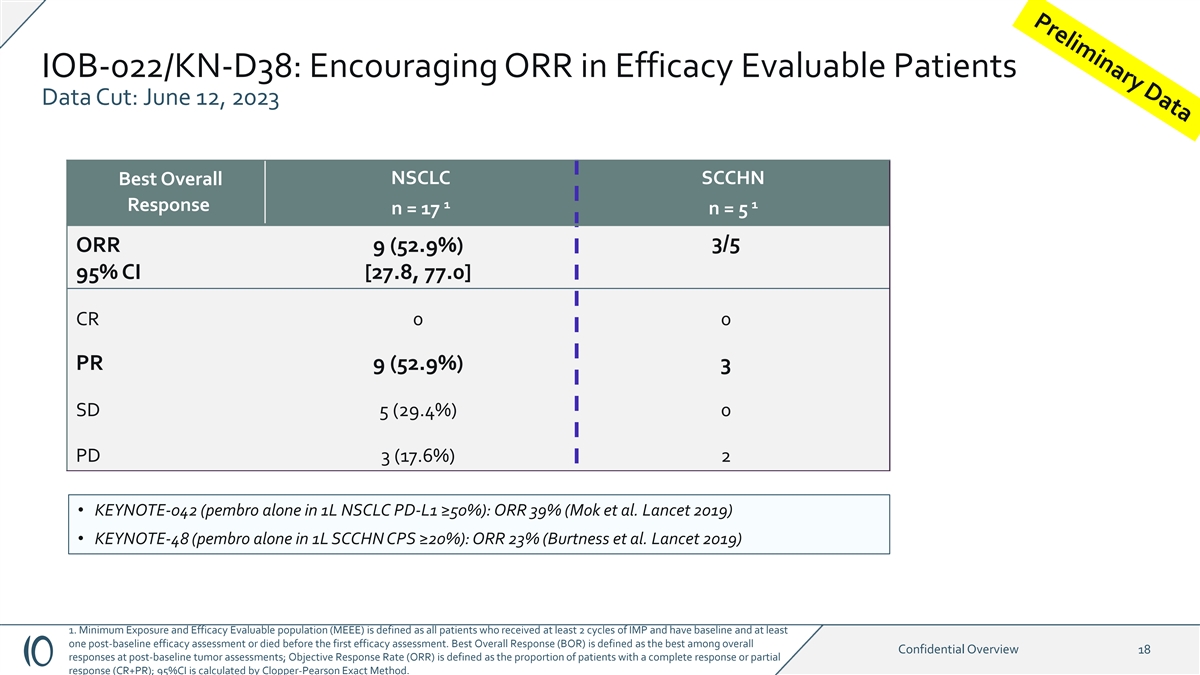
IOB-022/KN-D38:在疗效中鼓励 ORR 可评估患者数据 剪辑:2023 年 6 月 12 日 NSCLC SCCHN 最佳总体反应 n = 17 n = 5 3/5 ORR 9 (52.9%) 95% 置信区间 [27.8, 77.0]CR 0 0 PR 9 (52.9%) 3 SD 5 (29.4%) 0 PD 3 (17.6%) 2 • KEYNOTE-042(在 1L NSCLC PD-L1 中单独使用 pembro ≥ 50%):ORR 39%(Mok 等人 Lancet 2019)• KEYNOTE-48(在 1L SCCHN CPS 中单独使用 pembro ≥ 20%):ORR 23%(Burtness 等人《柳叶刀》2019) 1.最低暴露量和疗效可评估人群 (MEEE) 定义为所有接受了至少 2 个周期的 IMP 且有 基线和至少一次基线后疗效评估或在第一次疗效评估之前死亡的患者。最佳总体反应(BOR)被定义为基线后肿瘤评估中总体机密概述18个反应中最好的; 客观反应率(ORR)定义为完全缓解或部分缓解(CR+PR)的患者比例;95% 置信区间由Clopper-Pearson Exact Method 计算。
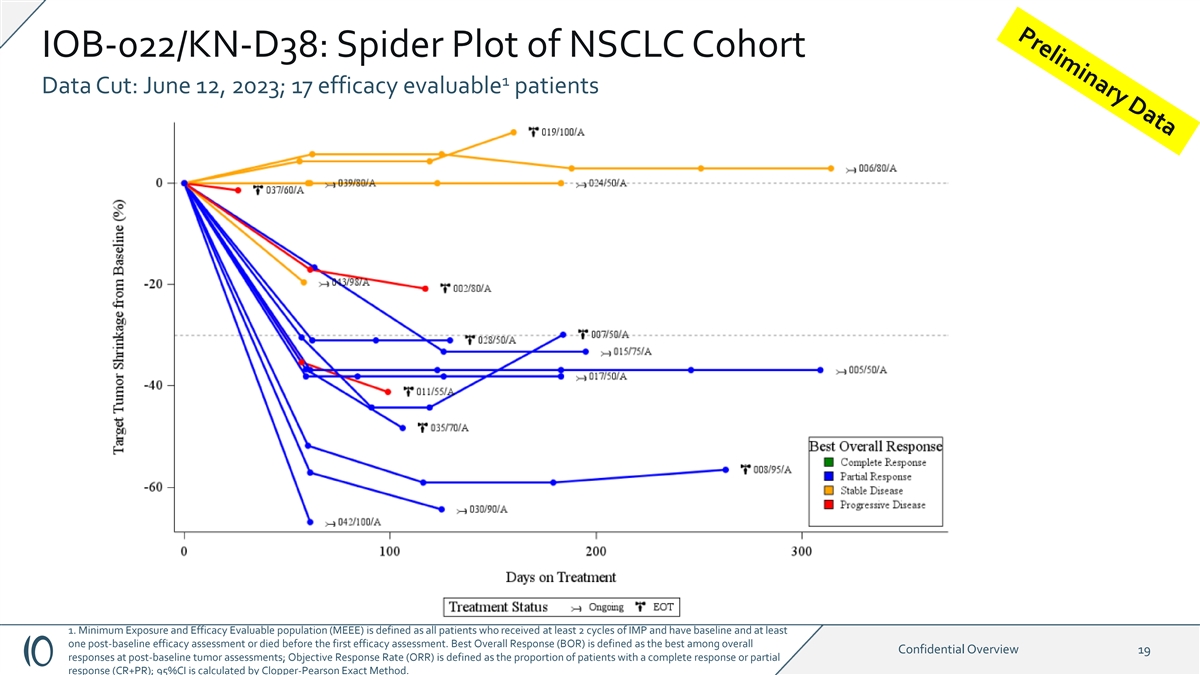
IOB-022/KN-D38:NSCLC 队列 1 数据剪辑的蜘蛛图:2023 年 6 月 12 日; 17 名疗效可评估患者 1.最低暴露量和疗效可评估人群 (MEEE) 的定义是所有接受了至少 2 个周期的 IMP 并且接受了基线和至少一次基线后疗效评估或在 首次疗效评估之前死亡的患者。最佳总体反应(BOR)被定义为基线后肿瘤评估中总体机密概述19个反应中最好的;客观反应率(ORR)定义为完全缓解或部分反应(CR+PR)的患者比例;95% 置信区间由Clopper-Pearson 精确方法计算。
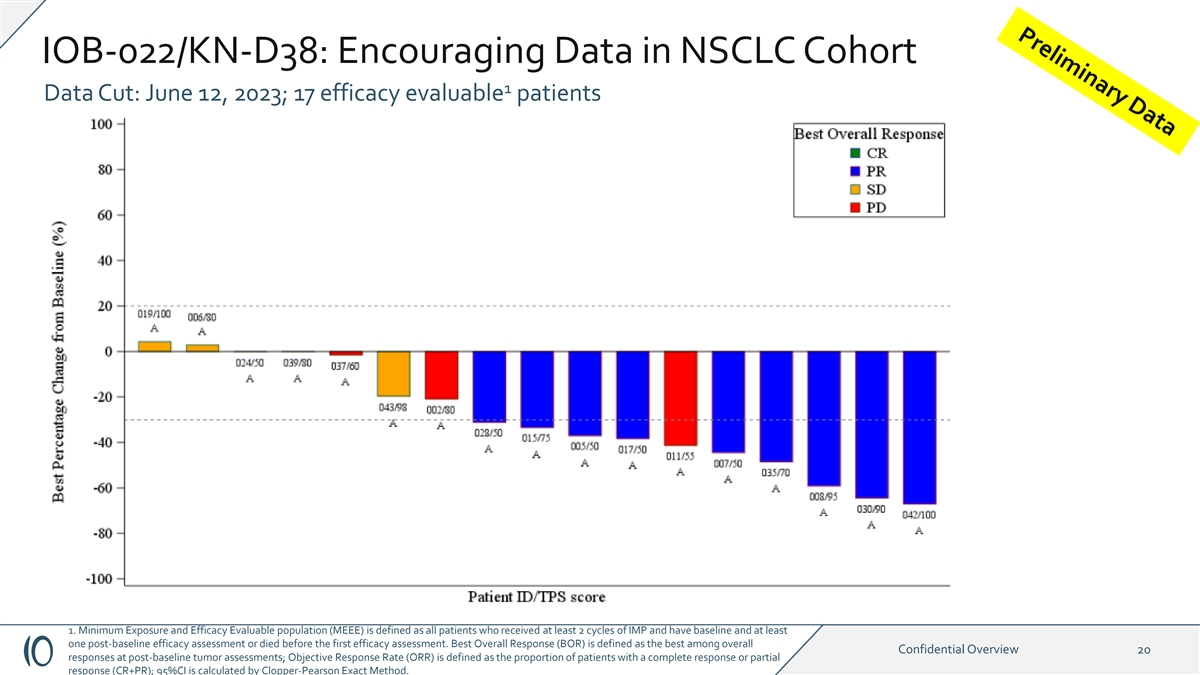
IOB-022/KN-D38:NSCLC 队列 1 中令人鼓舞的数据:2023 年 6 月 12 日 ;17 名可评估疗效的患者 1.最低暴露量和疗效可评估人群 (MEEE) 定义为所有接受了至少 2 个周期的 IMP 且接受了基线和至少一次基线后疗效评估或在 第一次疗效评估之前死亡的患者。最佳总体反应(BOR)被定义为基线后肿瘤评估中总体机密概述20个反应中最好的;客观反应率(ORR)定义为 完全缓解或部分反应(CR+PR)的患者比例;95% 置信区间由 Clopper-Pearson 精确方法计算。
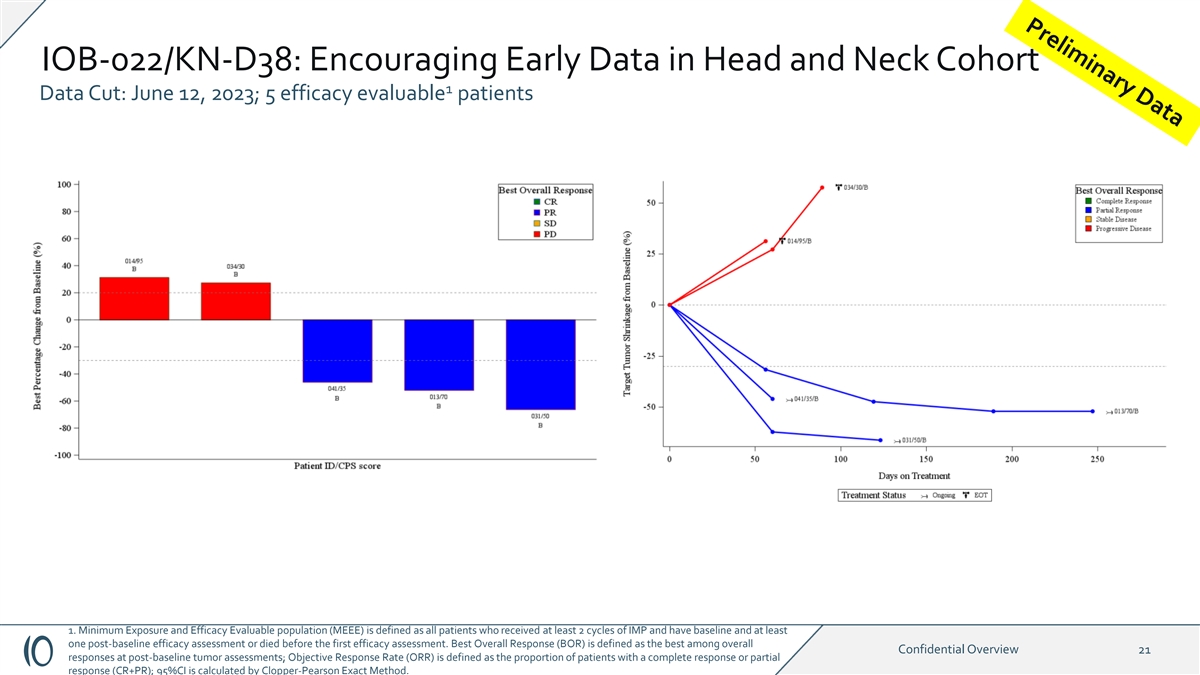
IOB-022/KN-D38:令人鼓舞的 Head and Neck 队列 1 数据 Cut:2023 年 6 月 12 日;5 名疗效可评估的患者 1.最低暴露量和疗效可评估人群 (MEEE) 定义为所有接受了至少 2 个周期的 IMP 且有基线和至少一次基线后疗效评估或 在第一次疗效评估之前死亡的患者。最佳总体反应(BOR)被定义为基线后肿瘤评估中总体机密概述21个反应中最好的;客观反应率(ORR)定义为完全缓解或部分反应(CR+PR)的患者的比例;95% 置信区间由Clopper-Pearson Exact Method 计算。

IO102-IO103: 黑色素瘤 (MM1636) 的全部临床数据非常令人鼓舞 ph1/2;NSCLC 和 H&N 初步疗效 1/2 期 MM1636 黑色素瘤数据 80% ORR*、50% CR、23% PR 令人鼓舞的来自 IOB-022/KN-D38 的初步数据;未观察到新的安全信号 NSLCC — 17 名疗效可评估患者 H&N — 5 名疗效可评估患者 • 最佳总体反应 (ORR):9 (52.9%) • 最佳总体反应 (ORR):3/5 *24 名有反应的患者中有两名在随后的放射学确认之前进展顺利(如之前在《自然》杂志上报道的《机密》 概述 22Medicine RECIST1.1= 73.3% ORR)

向前迈进机密概述 23
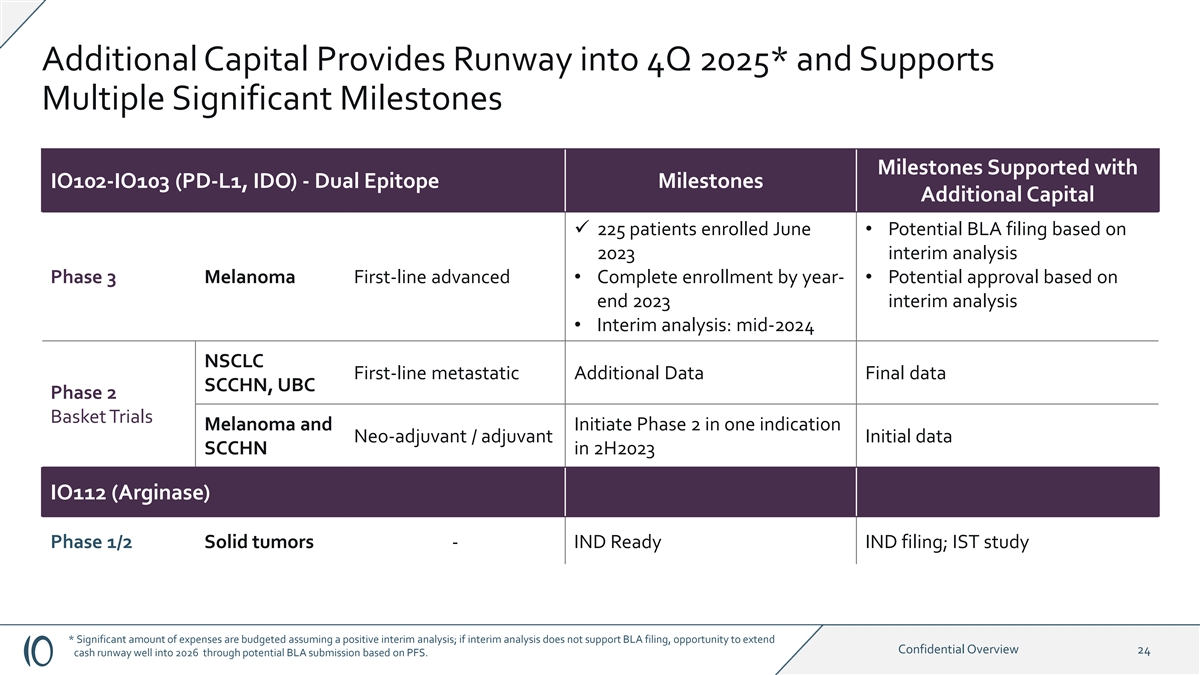
额外资本为 2025 年第 4 季度提供跑道* 并支持 IO102-IO103(PD-L1、IDO)支持的多个 重要里程碑——双表位里程碑额外资本 ü 225 名患者 6 月入学 • 基于 2023 年中期分析 3 期黑色素瘤一线高级 • 按年度完成入组-• 基于 2023 年底中期分析的潜在批准 • 中期分析:2024 年中期 NSCLC 一线转移性额外数据 SCLC 最终数据 CHN、UBC Phase 2 Basket Trials 黑色素瘤和启动期 2 合一适应症2H2023 IO112(精氨酸酶)1/2 期实体瘤中的新辅助/辅助性初始数据 SCCHN — IND Ready IND 申请;IST 研究 * 假设中期分析呈阳性,则有机会将大量支出编入预算;如果中期 分析不支持 BLA 申报,则有机会通过可能根据 PFS 提交的 BLA 将机密概述 24 现金跑道延长到 2026 年。

谢谢联系人:info@iobiotech.com © 2023 IO Biotech, Inc. Confidential O Co v n efr id vie en w tial 概述 25

附录:t-win® IO102-IO103 免疫调节癌症疫苗 1/2 期临床试验与癌症免疫疗法中心合作 26 机密概述 26
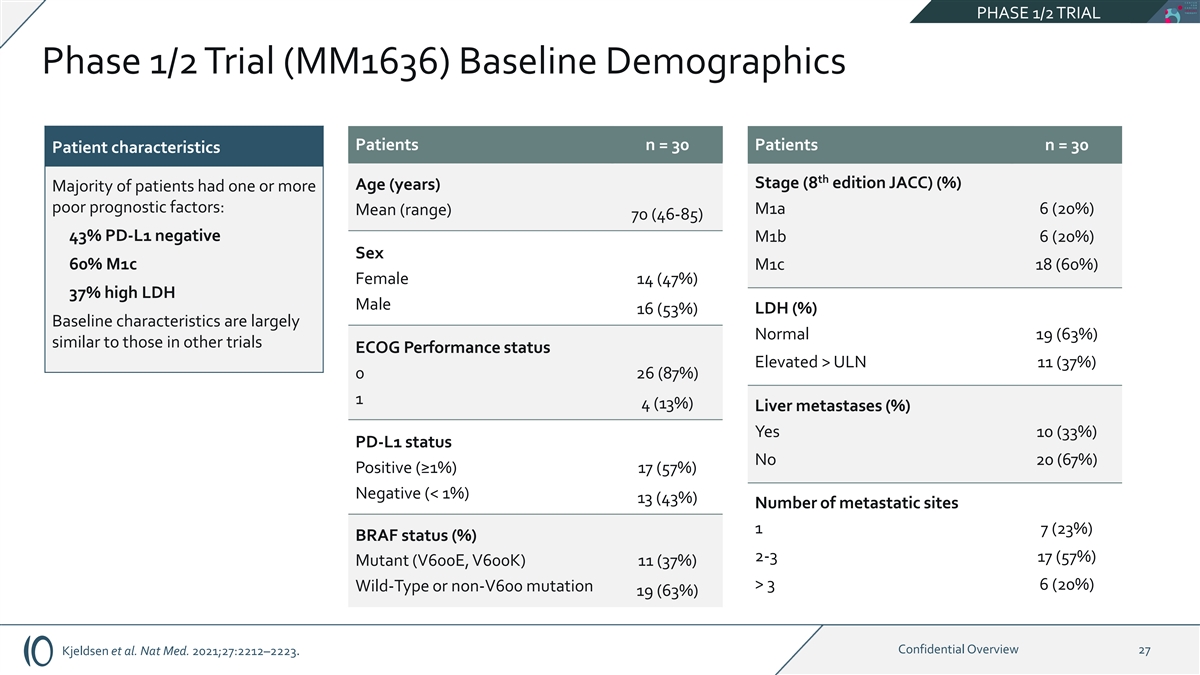
第 1/2 期试验 1/2 期试验 (MM1636) 基线人口统计学患者 n = 30 名患者 n = 30 患者特征第 th 阶段(8 版 JACC)(%)年龄(岁)大多数患者有一个或多个预后不佳因素:m1a 6 (20%) 平均值(范围)70 (46-85) 43% PD-L1 阴性 m1b 6 (20%) 性别 60% m1c m1c 18 (60%) 女性 14 (47%) 37% 高 LDH 男性 16 (53%) LDH (%) 基线特征基本正常 19 (63%) 与其他试验相似 ECOG 性能状态提升 > ULN 11 (37%) 0 26 (87%) 1 4 (13%) 肝转移 (%) 是 10 (33%) PD-L1status 否 20 (67%) 阳性 (≥ 1%) 17 (57%) 阴性 (3 6 (20%) Wild-Type 或非 v600 突变 19 (63%) 机密概述 27 Kjeldsen 等人Nat Med. 2021;27:2212 —2223。

第 1/2TRIAL 令人信服的 ORR 和 CRR 数据外部证实 Nature Med 2021 JITC 2023 最佳总体回应 2021 年 2 月 1 日数据削减 2023 年 1 月 2 日数据削减 ORR 和 CRR 外部得到响应者确认 — ORR* 24 80% 后续盲目审查最佳总体回复率 (RECIST 1.1**) 22 73.3% 完成回复率 14 46.7% 15 50% 部分回应率 8 26.7% 7 23.3% 稳定疾病 0 0% 0 0% 进行性疾病 6 20% 6 20% 总计 30 100% 30 100% 最佳 ORR(已确认)— PD-L1 阴性 (n = 13) 7 54% 7 54% • Ipi/Nivo ORR:58% 和 CRR:22%(Larkin 2019)• Nivolumab 或 pembrolizumab ORR 45%-46%(Larkin 2019 和 Robert 2019)* 24 名回应患者中有两名在随后的放射学确认之前进展顺利;** 随后的 成像机密概述 28 1.Kjeldsen 等人Nat Med. 2021;27:2212 —2223。2.Lorentzen 等人。J Immunother Cancer 2023;11 (5): e006755
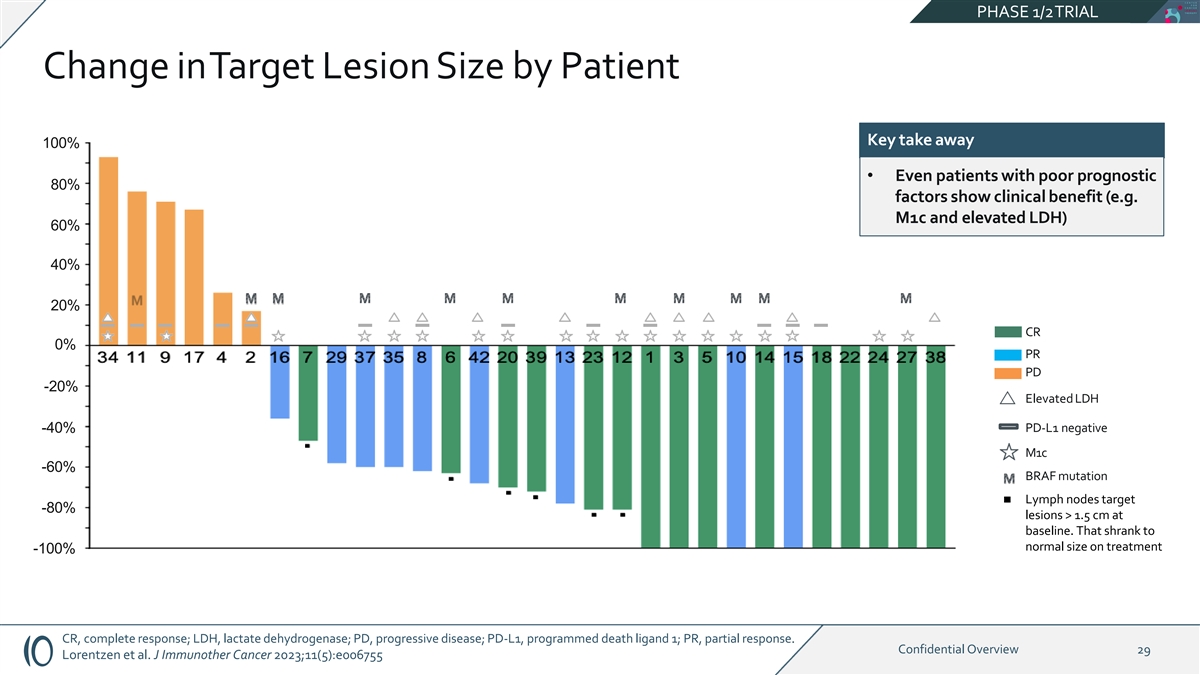
PHASE 1/2TRIAL 根据患者关键改变目标病变大小 100% • 即使是预后不佳 80% 因子的患者也显示出临床益处(例如 m1c 和 LDH 升高)60% 40% 20% CR 0% PR PD -20% LDH 升高 -40% PD-L1 阴性 m1c -60% BRAF 突变淋巴结靶向 基线处 -80% 病变 > 1.5 cm。治疗后缩小到正常大小 -100% CR,完全反应;LDH,乳酸脱氢酶;PD,进行性疾病;PD-L1,程序性死亡配体 1;PR,部分反应。机密概述 29 Lorentzen 等J Immunother Cancer 2023;11 (5): e006755
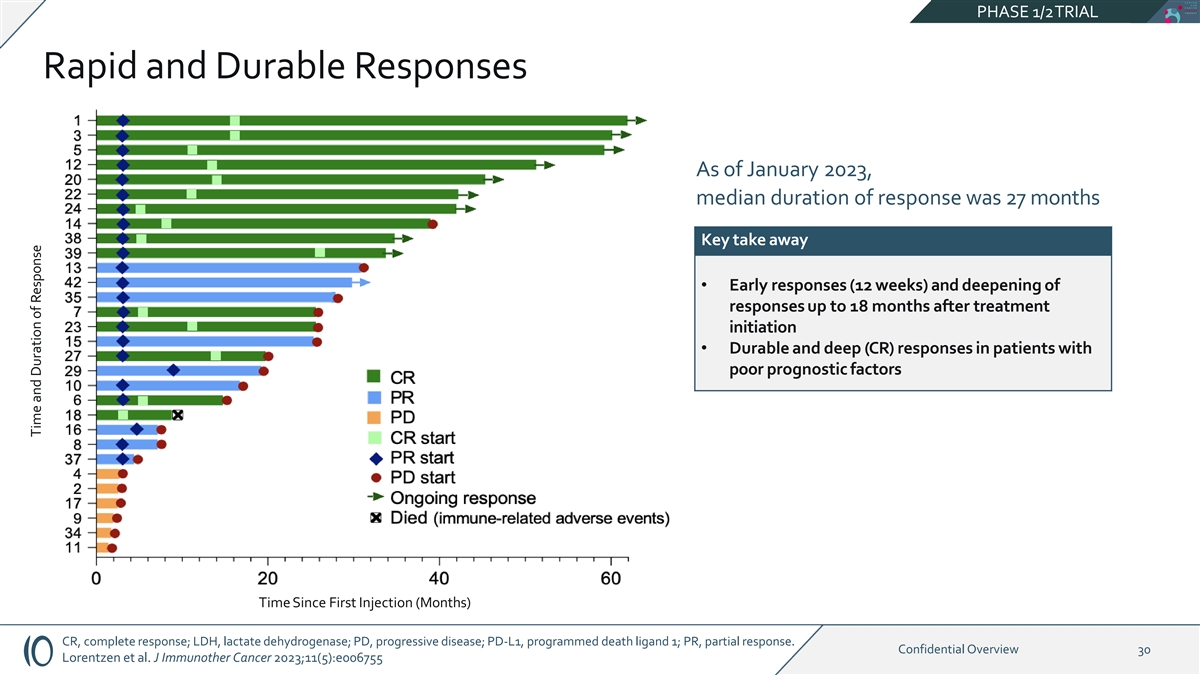
PHASE 1/2TRIAL 快速持久反应截至 2023 年 1 月,中位缓解持续时间为 27 个月关键收获 • 早期反应(12 周),反应加深 • 预后因素不佳患者的持久而深入(CR)反应自 首次注射(月)CR,完全反应;LDH,乳酸脱氢酶;PD,进行性疾病;PD-L1,程序性死亡配体 1; PR,部分回应。机密概述 30 Lorentzen 等J Immunother Cancer 2023;11 (5): e006755 时间和 反应持续时间

PHASE 1/2TRIAL 快速、深度和持久的反应完全反应 (CR) 部分反应 (PR) 进行性疾病 (PD) 18 机密概述 Lorentzen 等人J Immunother Cancer 2023;11 (5): e006755
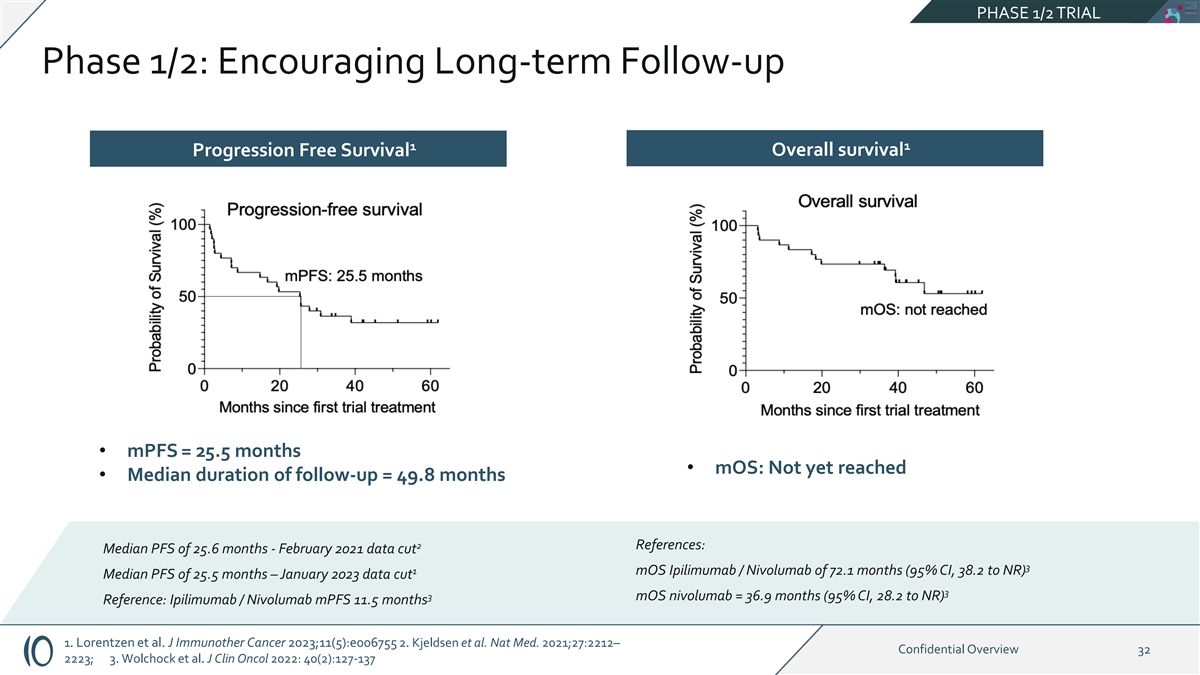
第 1/2 阶段试验第 1/2 阶段:鼓励长期随访 1 1 无进展存活总存活率 • mpF = 25.5 个月 • moS:尚未达到 • 随访时间中位数 = 49.8 个月 2 参考文献:PFS 中位数 25.6 个月——2021 年 2 月数据削减 3 1 moS Ipilimumab /Nivolumab 为 72.1 个月(95% 置信区间,38.2 至 NR)PFS 中位数为 25.5 个月 — 2023 年 1 月 data cut 3 3 moS nivolumab = 36.9 个月(95% 置信区间,28.2 到 NR)参考:Ipilimumab /Nivolumab mpfs 11.5 个月 1。Lorentzen 等人。J Immunother Cancer 2023;11 (5): e006755 2.Kjeldsen 等人Nat Med. 2021;27:2212 — 机密概述 32 2223;3.Wolchock 等人。J Clin Oncol 2022:40 (2): 127-137
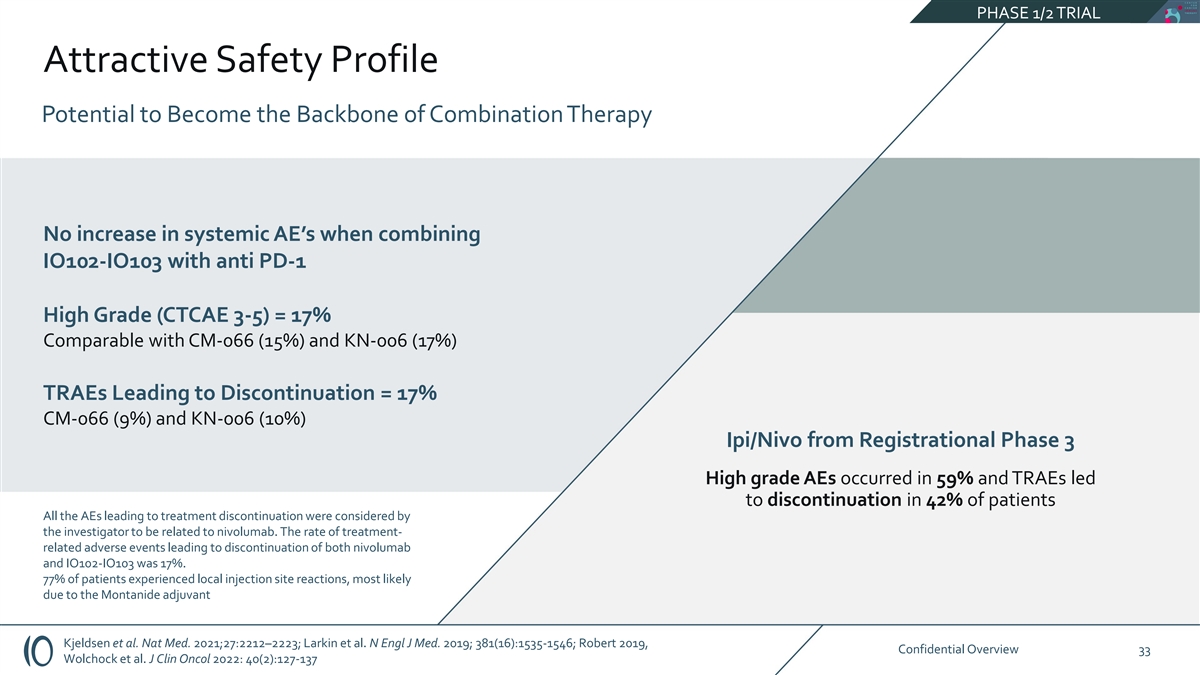
第 1/2 阶段试验有吸引力的安全概况有可能成为联合疗法的支柱 IO102-IO103 与抗 PD-1 High Grade (CTCAE 3-5) 联合使用时,系统性 AE 没有增加 = 17% 与 CM-066 (15%) 和 KN-006 (17%) TRAE 相当,导致停药 = 17% 的注册阶段 CM-066 (9%) 和 KN-006 (10%) Ipi/Nivo 出现在 59% 的高级 AE 中,TRAE 导致停药患者研究人员认为,所有导致停药的 AE 都与 nivolumab 有关。导致停用 nivolumab 和 IO102-IO103 的治疗相关不良事件发生率 为 17%。77% 的患者出现局部注射部位反应,很可能是由于 Montanide 辅助剂 Kjeldsen 等人造成的。Nat Med。 2021;27:2212 —2223;Larkin 等人N Engl J Med. 2019;381 (16): 1535-1546;Robert 2019,《机密概述》33 Wolchock 等人J Clin Oncol 2022:40 (2): 127-137

附录:肺部数据发表的研究机密概述 34
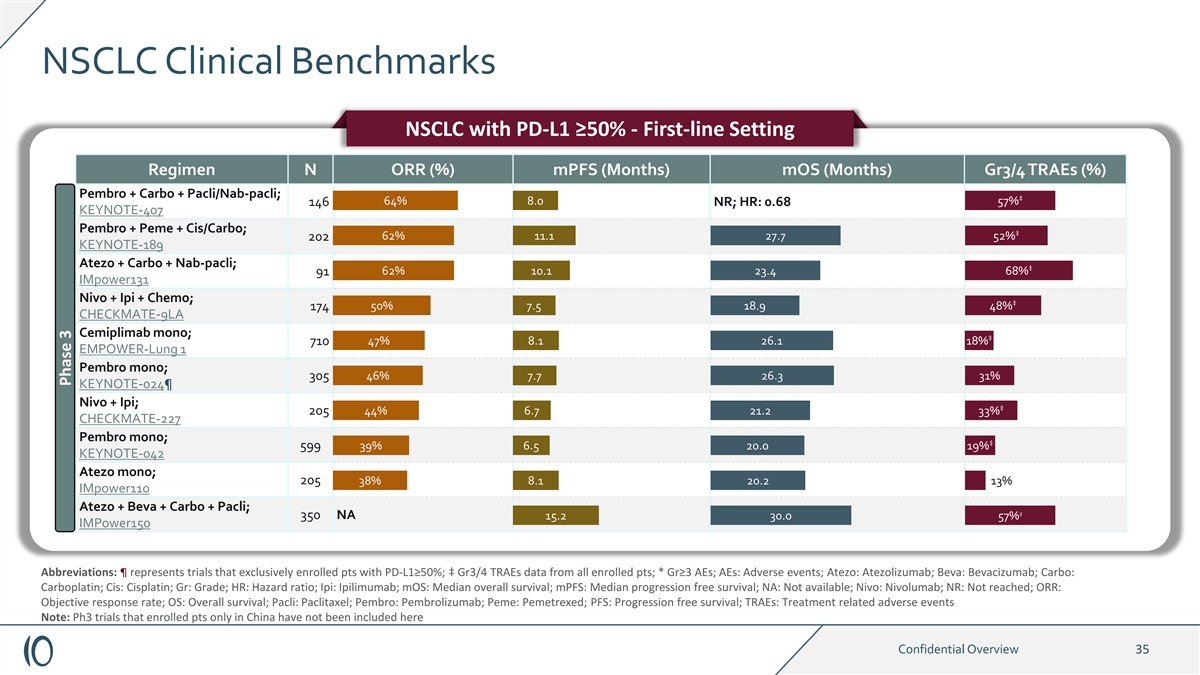
NSCLC 临床基准 PD-L1 ≥ 50% 的非小细胞肺癌——一线 设定方案 N ORR (%) mpf(月)moS(月)Gr3/4 traes (%) Pembro + Carbo + pacli/nab-pacli;‡ 64% 8.0 57% 146 NR;HR:0.68 KEYNOTE-407 Pembro + Peme + cis/Carbo;‡ 62% 11.1 27.7 52% 202 KEYNOTE-189 Atezo + Carbo + nab-pacli; ‡ 62% 10.1 23.4 68% 91 impower131 Nivo + Ipi + Chemo;‡ 174 50% 7.5 18.9 48% CHECKMATE-9LA cemiplimab mono;‡ 710 47% 8.1 pembro mono;305 46% 7.7 26.3 31% KEYNOTE-024¶ 4% 6.7 21.2 33% CHECKMATE-227 Pembro mono;‡ 599 39% 6.5 20.0 19% KEYNOTE-042 Atezo mono;205 38% 8.1 20.2 13% impower110 Atezo + Beva + Carbo + Pacli;‡ 350 NA 15.2 30.0 57% impower150 缩写:¶ 代表只有 注册 pts 的试验,来自所有注册的 pts;* Grizu3 AE;AE:不良事件;Atezo:Atezol150 Beva;Beva:Bevacizumab;Carbo:Carboplatin;Cis:顺铂;Gr:等级;HR:危险比;Ipi:Ipilimumab;moS:中位无进展存活率;NA:不可用;Nivo:Nivolumab;NR:未达到;ORR:客观反应率;OS: 总体存活率;Pacli:紫杉醇;Pembro:Pembrolizumab;Peme:pemetrexex;PFS:Progressives 自由存活率;TRAE:治疗相关不良事件注意:此处未包括仅在中国招生 pts 的 Ph3 试验机密概述 35 阶段 3