
附录 99.2 C B P-2 0 1-WW001 G l o b a l p h a s e 2 b t r i a l i n a t o c d e r m a t i t i i t i s t t t i s t t t t t t t t t o p l i n e r e r e r e s u l t t 是 T 细胞驱动的炎症性疾病的下一代疗法电话会议——2022 年 1 月 5 日

2 2 前瞻性陈述 • 这份关于 Connect Biopharma Holdings Limited(Connect、我们、我们或我们的)的演示文稿仅供参考。• 本演示文稿中包含的某些信息涉及或基于从第三方来源获得的研究、出版物、调查和其他数据 以及Connect自己的内部估计、研究和分析。尽管截至本演示文稿发布之日,我们认为这些第三方来源是可靠的,但我们尚未对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性进行独立验证,也没有 陈述。此外,本演示文稿中包含的所有数据都涉及许多假设和局限性, 无法保证此类假设的准确性或可靠性。最后,尽管我们认为我们自己的内部研究或分析是可靠的,但此类研究或分析尚未得到任何独立来源的证实。• 本演示文稿 包含涉及重大风险和不确定性的前瞻性陈述。除本演示文稿中包含的历史事实陈述外,所有陈述均为前瞻性陈述,包括关于美国海关和边境保护局-201 有可能实现 差异化、竞争或有利的福利或形象的陈述,包括关于安全性、有效性和/或便利性的陈述,以及公司启动第三阶段试验计划以进一步评估 CBP-201 的计划。前瞻性 陈述可以用诸如 “预期”、“相信”、“考虑”、“继续”、“可以”、“估计”、“预期”、“打算”、“可能”、“计划”、“潜力”、“预测”、“应该”、“目标”、“将” 或这些术语或其他类似术语的负面词语来识别 表达式。本演示文稿中的前瞻性陈述只是预测。这些前瞻性陈述主要基于我们当前对未来事件和趋势的预期和预测,我们认为这些事件和趋势可能会影响我们 的财务状况、运营业绩、业务战略和财务需求。这些前瞻性陈述本质上受许多风险、不确定性和假设的影响,其中一些无法预测或量化,其中一些 是我们无法控制的,其中包括:我们的临床试验能够证明候选产品的安全性和有效性,以及其他积极的结果;我们获得和维持 候选产品的监管批准的能力;美国、中国、欧洲和欧洲的现行法规和监管发展其他司法管辖区;不确定性关于中国法律、规章和法规的解释和执行;与 COVID-19 疫情相关的风险,这场疫情已经并将继续对我们的业务、临床前研究和临床试验产生重大和不利影响;我们获得、维护、保护和执行我们的知识产权和 专有技术的计划和能力,包括现有专利条款的延长;我们继续依赖第三方对我们的候选产品进行额外的临床试验,以及制造 临床前研究和临床试验的候选产品;以及医生、患者、医疗保健支付方和医学界其他人对我们候选产品的市场接受程度。这些风险并不详尽。• Connect 不应将包含 前瞻性陈述视为表示其任何预期、预测或计划都将实现。由于Connect向美国证券交易委员会提交的文件中描述的Connect业务固有的风险和 不确定性以及其他风险,实际业绩可能与这些预期、预测或计划有所不同。• 新的风险因素不时出现,我们的管理层无法预测所有风险因素,也无法评估所有因素对我们业务的影响,也无法评估任何因素或因素组合可能导致实际业绩差异的程度实质上来自任何前瞻性陈述中包含或暗示的内容。您不应依赖 前瞻性陈述作为对未来事件的预测。尽管我们认为前瞻性陈述中反映的预期是合理的,但我们无法保证未来的业绩、活动水平、业绩或 成就。除非法律要求,否则在本演示文稿发布之日之后,我们没有义务出于任何原因公开更新任何前瞻性陈述。• 此外,“我们相信” 的陈述和类似 陈述反映了我们对相关主题的信念和看法。这些陈述基于截至本演示文稿发布之日我们所掌握的信息,尽管我们认为此类信息构成了此类陈述的合理依据,但 此类信息可能有限或不完整,我们的陈述不应被理解为表明我们已经对所有可能可用的相关信息进行了详尽的调查或审查。这些陈述本质上是不确定的,提醒投资者不要过分依赖这些陈述。• 我们还没有对 CBP-201 与 dupilumab 进行正面交锋研究。CBP-201 与本文包含的 dupilumab 的比较是基于对 个别研究数据的分析。由于研究方案、条件和患者群体的差异,此类数据可能无法直接比较。因此,交叉试验比较可能无法可靠地预测 CBP-201 与 dupilumab 相比的相对疗效或安全性。CBP-201 的潜在好处并不意味着监管部门批准的期望完全在 FDA(或适用的外国监管机构)的权限范围内。
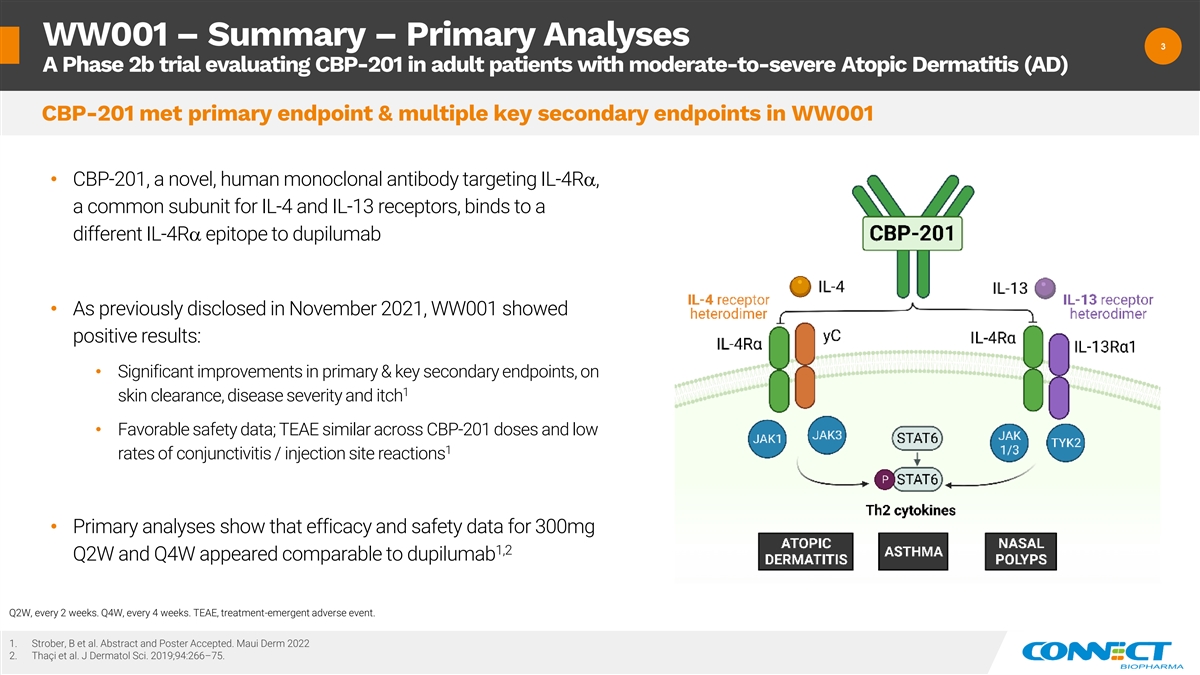
WW001 — 摘要 — 初步分析 3 3 A 2b 期试验 评估中度至重度特应性皮炎 (AD) 的成年患者中的 CBP-201,CBP-201 在靶向 IL-4RA 和 IL-13 受体的常见 亚单位 IL-4ra 中的主要终点和多个关键次要终点 • 和以前一样 2021 年 11 月披露,WW001 显示出积极的结果:• 在 1 皮肤清除率、疾病严重程度和瘙痒方面,主要和关键次要终点显著改善 • WW001 CBP-201良好的安全数据;TEAE 在 CBP-201 剂量中相似,结膜炎/注射部位反应发生率低 1 • 初步分析表明,300mg 1,2 Q2W 和 Q4W 的疗效和安全性数据似乎与 dupilumab Q2W 相当,每 2 周一次。第四季度,每 4 周一次。TEAE,治疗紧急不良事件。1.Strober、B 等人摘要和海报已接受。Maui Derm 2022 2.Thaci 等人J Dermatol Sci. 2019;94:266 —75。

4 4 WW001 — 摘要 — 其他分析 CBP-201 300mg Q2W 和 Q4W 300mg 似乎至少与分化潜力相当。不是正面交锋的试验。试验设计和受试者特征之间存在差异,在比较不同试验的数据时应谨慎行事 • WW001 和 SOLO 1,2 试验招收了不同的患者群体,因此很难进行直接的交叉试验比较 1,2,3 1。WW001 招募了不那么严重的人群 1,2,3 2.WW001 的辍学率和停药率更高 • 另外对 WW001 试验人群的先验和 事后分析显示 1,2,3 • 随着基线疾病严重程度的增加,CBP-201 疗效反应进一步改善 • 基线严重程度与 SOLO1,2 更接近, CBP-201 300mg Q2W 和 Q4W 1,2,3 的并排比较似乎至少相当,有些终点在数字上比 dupilumab 好 300 Q2W • CBP-201 300mg 有可能借助 Q4W 给药带来差异化的疗效和安全性 • 规划全球第三阶段AD项目正在进行中,预计首例患者入组时间为2022年下半年 1.Strober、B 等人摘要和海报已接受。Maui Derm 2022 2.Silverberg,J 等人摘要和海报已接受。Maui Derm 2022 3.Thaci 等人J Dermatol Sci. 2019;94:266 —75。

5 5 WW001-全球 2b 期 AD 试验设计 1 项试验专为 剂量范围、最大疗效和可能更长的给药间隔而设计 (NCT04444752) 一项随机、双盲、安慰剂对照的多中心试验,内容涉及 中度至重度特应性皮炎的成年受试者中 CBP-201 的疗效、安全性、药代动力学和药效学 CBP-201,600 mg LD D1 + 300 mg Q2W,nsc,nn =57 随访随机分组 CBP-201,600 mg LD D1 + 150 mg Q2W,SC,n=57 随访 1:1:1 n=226 CBP-201,600 mg LD D1 + 300 mg Q4W,SC,n=56 后续安慰剂,n=56 随访筛查/45 天 16 周/治疗 8 周关键纳入标准:伴随疗法:主要终点 • 中度至重度 AD 未得到充分控制 • TCS、TCI 和处方保湿剂冲掉 ≥1 • 基线前一周使用局部皮质类固醇和钙调神经素抑制剂的 EASI 变化百分比关键次要疗效终点:• 特应性皮炎持续 ≥ 1 年 • OTO C 润肤剂在基线前使用了 ≥ 1 周的出价 • 第 16 周达到 IGA 0,1 的患者比例 • EASI ≥ 16 且持续时间为研究 • 第 16 周达到 EASI-75 的患者比例 • IGA 分数 ≥ 3(5 分量表) [0-4]) • 已知会影响 AD 的药物仅用于救援 • 第 16 周达到 EASI-90 的患者比例 • ≥ 10% BSA 受累疗法 • PP-NRS 从基线到第 16 周的变化研究 在美国 (N=38)、中国 (N=9)、澳大利亚 (N=8) 和新西兰 (N=4) 的 59 个中心进行 1。Strober、B 等人摘要和海报已接受。Maui Derm 2022
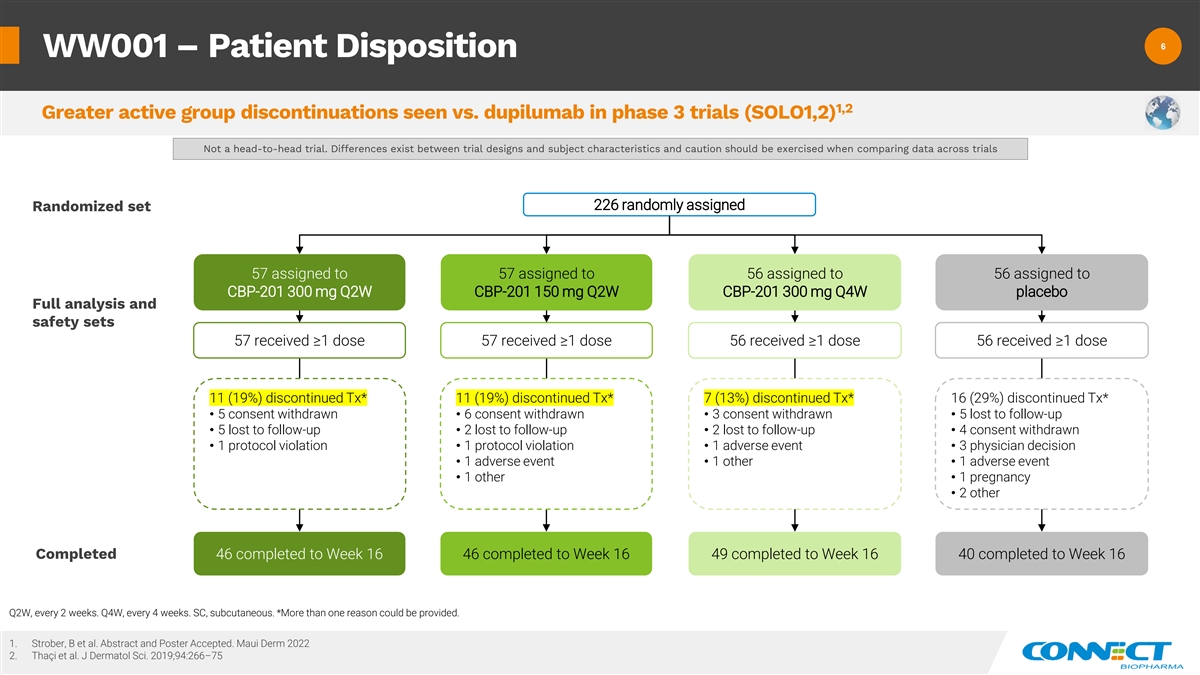
6 6 WW001 — 患者处置 1,2 在 3 期试验(SOLO1,2)中,与 dupilumab 相比,停药的活跃组 更大。试验设计和受试者特征之间存在差异,在比较各项试验的数据时应谨慎行事 226 随机分配 随机分配给 57 分配给 56 分配给 CBP-201 300 mg q2W CBP-201 150 mg Q2W CBP-201 300 mg Q4W 安慰剂完整分析和安全套装 57 接受 ≥ 1 剂量 56 接受 ≥ 1 剂 56 接受 ≥1 剂量 11 (19%) 停药 Tx* 11 (19%) 已终止 Tx* 7 (13%) 已停产 Tx* 16 (29%) 已停止 Tx* • 5 同意撤回 • 6 同意撤回 • 3 同意撤回• 5 在随访中输掉了• 5 个输给了后续• 2 在后续行动中输掉了• 2 个在后续行动中输掉了• 4 个撤回同意 • 1 个违反协议• 1 个不良事件• 3 个医生决定 • 1 个不良事件 • 1 个其他• 1 个怀孕 • 2 其他已完成 46 到第 16 周 46 完成到第 16 周 49 到第 16 周 40 已完成到第 16 周 Q2W,每 2 周一次。第四季度,每 4 周一次。SC,皮下。*可以提供多个 个理由。1.Strober、B 等人摘要和海报已接受。Maui Derm 2022 2.Thaci 等人J Dermatol Sci. 2019;94:266 —75
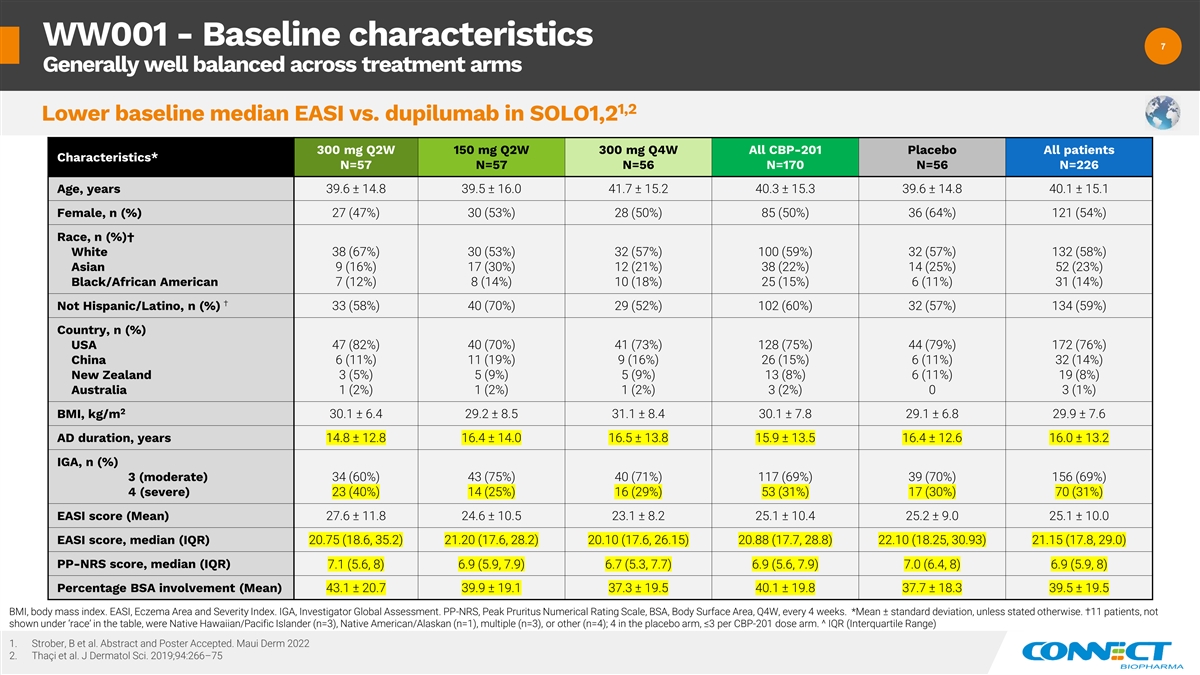
WW001-基线特征 7 7 治疗组总体平衡良好 1,2 SOLO1,2 300 mg Q2W 150 mg Q2W 150 mg Q2W 300 mg Q4W 所有 CBP-201 安慰剂所有患者的特征* N=57 N=56 N=56 N=56 N=226 N=226 年龄,39.6 ± 14.8 39.5 ± 15.2 40.3 ± 15.3 39.6 ± 14.8 40.1 ± 15.1 女性,n (%) 27 (47%) 30 (53%) 28 (50%) 85 (50%) 36 (64%) 121 (54%) Race,n (%) † White 38 (67%) 30 (53%) 32 (57%) 132 (58%) Asian 9 (16%) 17 (30%)) 12 (21%) 38 (22%) 14 (25%) 52 (23%) 黑人/非裔美国人 7 (12%) 8 (14%) 10 (18%) 25 (15%) 6 (11%) 31 (14%) † 不是西班牙裔/拉丁裔,n (%) 33 (58%) 40 (70%) 29 (52%) 102 (60%) 32 (57%) 134 (59%) 国家,n (%) 美国 47 (82%) 40 (70%) 41 (73%) 128 (79%) 172 (79%) 6%) 中国 6 (11%) 11 (19%) 9 (16%) 26 (15%) 6 (11%) 32 (14%) 新西兰 3 (5%) 5 (9%) 13 (8%) 6 (11%) 19 (8%) 澳大利亚 1 (2%) 1 (2%) 3 (1%) 2 体重指数,kg/m 30.1 ± 6.4 ± 8.4 31.1 0.1 ± 7.8 29.1 ± 6.8 29.9 ± 7.6 广告持续时间,年 14.8 ± 12.8 16.4 ± 14.0 16.5 ± 13.8 15.9 ± 13.5 16.4 ± 12.6 ± 13.2 IGA,n (%) 3(中等)34 (60%)43 (75%) 40 (71%) 117 (69%) 39 (70%) 156 (69%) 4 (严重) 23 (40%) 14 (25%) 16 (29%) 53 (31%) 70 (31%) EASI 分数 (平均值) 27.6 ± 11.8 24.6 ± 10.5 23.1 ± 10.4 25.1 ± 10.0 EASI 分数,中位数 (IQR) 20.75 (18.6、35.2) 21.20 (17.6、28.2) 20.10 (17.6、26.15) 20.88 (17.7、28.8) 22.10 (18.25、30.93) 21.15 (17.8、29.0) PP-NRS 分数,中位数 (IQR) 7.1 (5.6、8) 6.9 (5.9、7.9) 6.7 (5.3、7.7) 6.7 (5.3、7.7) 9 (5.6, 7.9) 7.0 (6.4, 8) 6.9 (5.9, 8) BSA 参与百分比 (平均值) 43.1 ± 20.7 39.9 ± 19.1 37.3 ± 19.5 40.1 ± 19.8 37.7 ± 18.3 39.5 ± 19.5BMI,体重指数。EASI、湿疹区域和严重程度指数。IGA,研究者全球评估。PP-NRS,Peak Pruritus 数值评级量表,BSA,身体表面积,Q4W,每 4 周一次。*除非另有说明,否则均值 ± 标准差。†11 名患者是夏威夷原住民/太平洋岛民(n=3)、美洲原住民/阿拉斯加人(n=1)、多人(n=3)或其他(n=4);安慰剂 手臂中有 4 人,每 CBP-201 剂量臂 ≤3。^ IQR(Interquartile Range)1.Strober、B 等人摘要和海报已接受。Maui Derm 2022 2.Thaci 等人J Dermatol Sci. 2019;94:266 —75
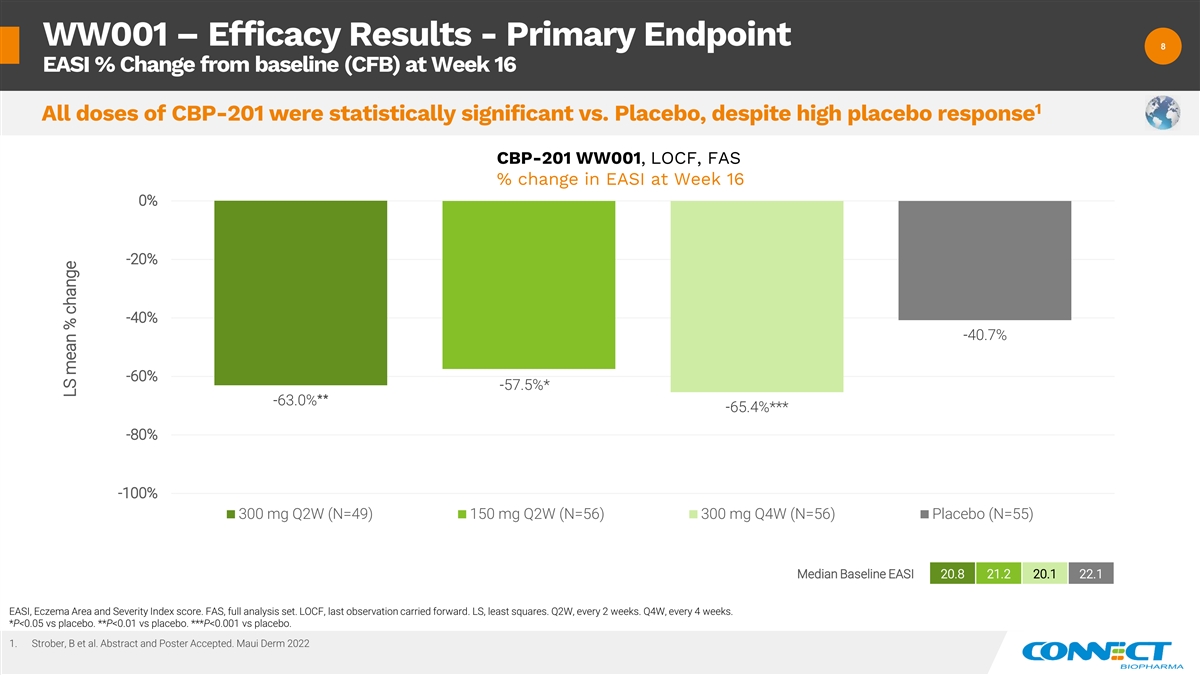
WW001 — 疗效结果——主要终点 8 8 EASI% 与第 16 周的 基线 (CFB) 相比变化百分比 1 尽管安慰剂反应很高 CBP-201 WW001、LOCF、FAS 在第 16 周 EASI 的变化百分比 0% -20% -40.7% -60% -57.5% * -65.4% ** -80% -100% 300 mg Q2W (N=49) 150 mg Q2W (N=56) 300 mg Q4W (N=56) 安慰剂 (N=55) 基线中位数 20.8 21.2 20.1 22.1 EASI、湿疹区域和严重程度指数分数。CBP-201FAS,全套分析集。LOCF,最后一次观察延续了下去。LS,最小二乘法。第二季度,每 2 周一次。 Q4W,每 4 周一次。*P
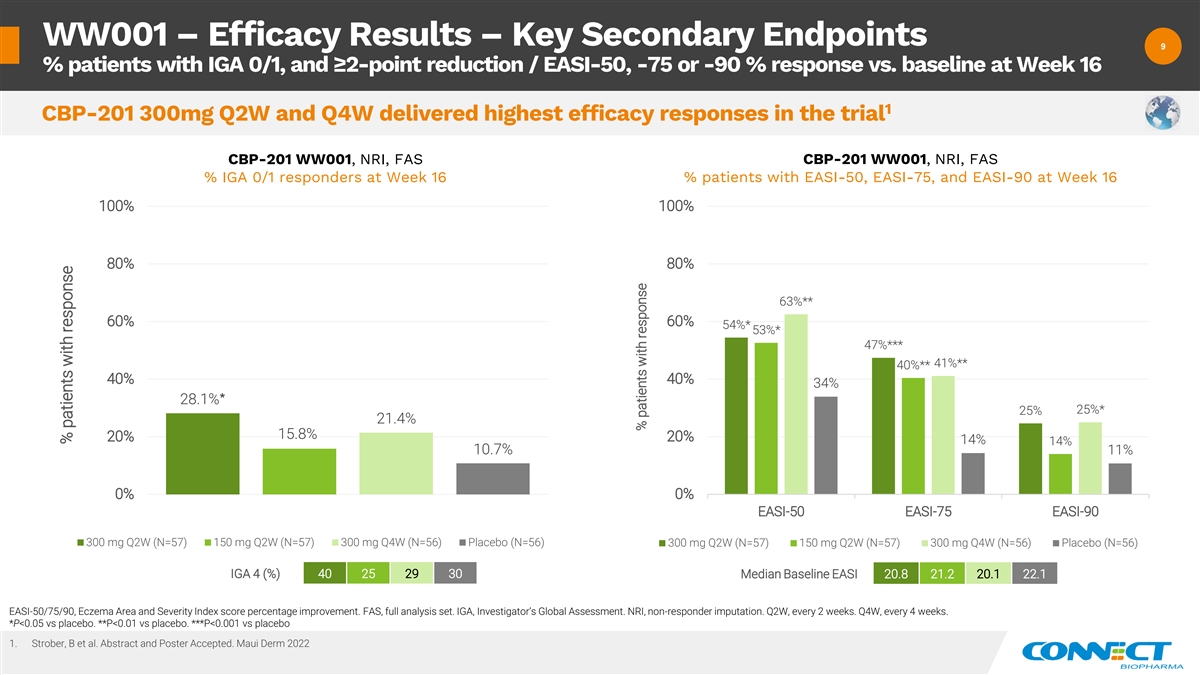
WW001 — 疗效结果 — 关键次要终点 9 9% 患有 IGA 0/1、降低 ≥ 2 点/EASI-50、-75 或 -90% 的患者在第 16 周 CBP-201 300mg Q2W 和 Q4W 的疗效反应最高 CBP-201 WW001、NRI、FAS% IGA 0/1 反应者在第 16 周有 the、the 第 16 周 100% 100% 80% 80% 63% ** 60% 54% * 53% * 47% *** 41% ** 40% ** 40% 40% 34% 28.1% * 25% 21.4% 20% 15.8% 20% 14% 10.7% 11% 0% br 300 mg Q2W (N=57) 150 mg Q2W (N= CBP-201 WW001 EASI-50 EASI-75 EASI-90 EASI-50 EASI-75 EASI-9057) 300 mg Q4W (N=56) 安慰剂 (N=56) 300 mg Q2W (N=57) 150 mg Q2W (N=57) 300 mg Q4W (N=56) 安慰剂 (N=56) 40 25 29 30 基线中位数 20.8 20.1 22.1 EASI-50/75/90,湿疹区域和严重程度指数 百分比改善。FAS,全套分析集。IGA,研究者的全球评估。NRI,无回应者指责。第二季度,每 2 周一次。第四季度,每 4 周一次。*P
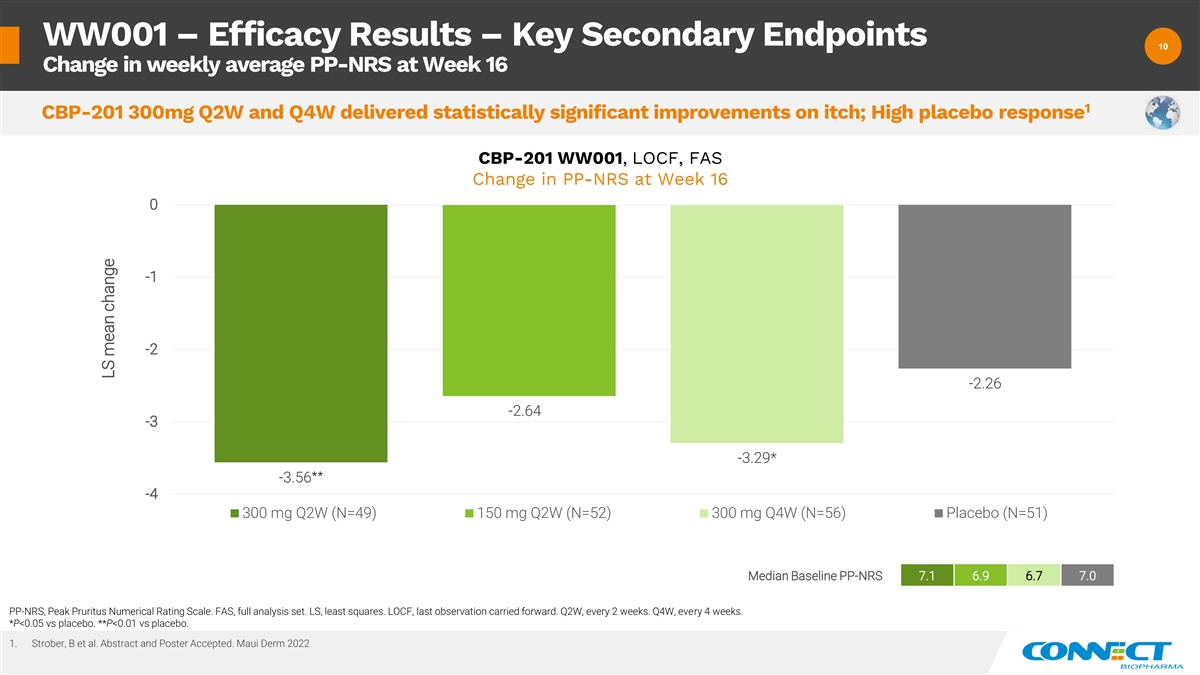
WW001 — 疗效结果 — 关键次要终点 10 10 第 16 周平均值 PP-NRS 的变化 1 CBP-201 300mg Q2W 和 Q4W 对瘙痒产生了统计学上的显著改善;安慰剂反应高 CBP-201 WW001、LOCF、FAS 第 16 周 PP-NRS 的变化 0 -1 -2 -2.26 -2.64 -3.29* -3 -3.56** -300 mg Q2W (N=49) 150 mg W (N=52) 300 mg Q4W (N=56) 安慰剂 (N=51) 基线中位数 PP-NRS 7.1 6.9 6.7 7.0 PP-NRS,Peak Pruritus 数值评级量表。FAS,全套分析集。LS,最小二乘法。LOCF,最后一次观察延续了下去。第二季度,每 2 周一次。第四季度,每 4 周一次。*P
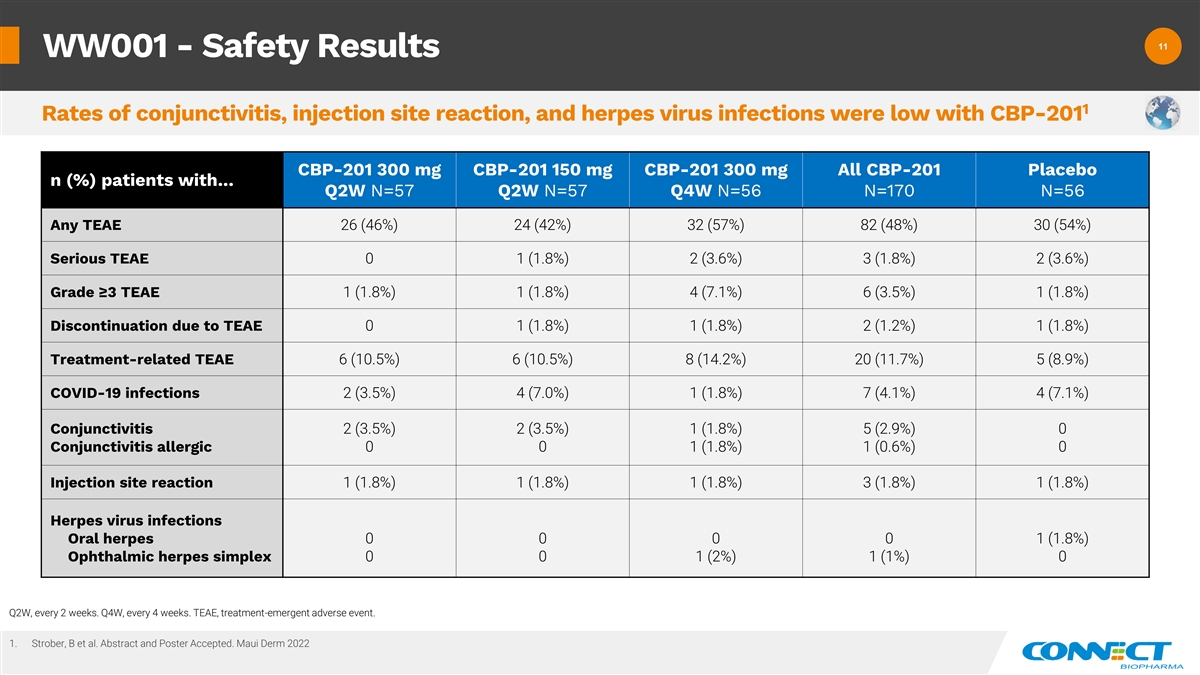
11 11 WW001-安全结果 1 结膜炎、注射部位 反应和疱疹病毒感染率很低 CBP-201 CBP-201 300 mg CBP-201 150 mg CBP-201 300 mg All CBP-201 安慰剂 n (%) 患者... Q2W N=57 Q2W N=56 N=56 N=56 任何 TEAE 26 (46%) 24 (42%) 82 (48%)) 30 (54%) Serious TEAE 0 1 (1.8%) 2 (3.6%) 3 (1.8%) 2 (3.6%) 等级 ≥3 TEAE 1 (1.8%) 1 (1.8%) 4 (7.1%) 6 (3.5%) 1 (1.8%) 因治疗相关的 TEAE 而停产 6 (10.5%) 6 (10.5%) 8 (14.2%) 20 (11.7%) 5 (8.9%) COVID-19 感染 2 (3.5%) 4 (7.0%) 1 (1.8%) 7 (4.1%) 4 (7.1%) 结膜炎 2 (3.5%) 2 (3.5%) 1 (1.8%) 5 (2.9%) 0 结膜炎过敏 0 0 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1 (1.8%) 1.8%) 疱疹 病毒感染口腔疱疹 0 0 0 0 1 (1.8%) 眼科单纯疱疹 0 0 1 (2%) 1 (1%) 0 Q2W,每 2 周一次。第四季度,每 4 周一次。TEAE,治疗紧急不良事件。1.Strober、B 等人摘要和海报已接受。Maui Derm 2022

12 12 WW001 — 了解招募的试验人群 1,2 WW001 和 SOLO 1,2 招募了不同的患者,是在不同的情况下进行的 1-4 • WW001 招募的试验人群与 SOLO 1,2 试验 3 1 中看到的不同。由于以下原因,疾病不那么严重 • COVID-19 疫情可能导致行动限制期间疾病爆发的机会降低(例如减少接触环境过敏原和刺激疾病爆发)• 随着时间的推移,在临床试验中 最严重的符合条件的患者人数的竞争加剧 • 从学术中心选择的临床试验地点减少和不同的地理组合进行试验地点 → 可能有助于安慰剂疗效反应/ 群组 3 2.由于 COVID-19 疫情的行动限制可能会影响试验的进行,预定就诊的患者辍学率/患者门诊就诊率 → 可能促成了疗效反应,尤其是积极治疗组 1.Strober、B 等人摘要和海报已接受。Maui Derm 2022. 2.Silverberg,J 等人摘要和海报已接受。Maui Derm 2022. 3.Thaci 等人J Dermatol Sci. 2019;94:266 —75 4.Silverberg,J 等人关于影响中度至重度特应性皮炎随机临床试验解释的关键参数的专家观点。美国 临床皮肤病学杂志。https://doi.org/10.1007/s40257-021-00639-y [已于 2021 年 11 月 3 日访问]

13 13 WW001 — 其他分析 1,2,3 对疾病严重程度与 SOLO 更接近的 WW001 人群的分析 1,2 • 鉴于招募的试验人群存在差异,在 WW001 中进行了多项分析,以确定基线疾病严重程度对治疗幅度的影响 效应(参见 SOLO 1,2)该分析试图解决的先验和事后分析表示疾病严重程度高于全球人群,接近 SOLO 1,2(Higher China Subgroup (nn) =32) 基线 EASI /基线 TARC)。减少了停产造成的 影响。中位数结果 (n=226) 考虑了反映低疾病严重程度的基线 EASI 的非正态分布 EASI 基线 (n=216) 展示按基线 EASI 分数(疾病严重程度)分层的疗效反应 展示按TARC基线(n=212)疾病活动的炎症生物标志物基线水平分层的疗效反应 • 主要发现 1.随着基线疾病严重程度的增加, 所有剂量的 CBP-201 疗效结果进一步提高。安慰剂反应呈下降趋势。2.Connect 认为,CBP-201 300mg 有可能通过 Q4W 给药的便利性实现差异化的疗效和安全性 3。这强化了临床试验设计和 行为对疗效结果的影响,并为我们的3期AD项目计划TARC、胸腺和激活调节的趋化因子(一种在 Th2 淋巴细胞上独特表达的趋化因子 1)提供了依据。Strober、B 等人摘要和海报已接受。Maui Derm 2022 2. Silverberg,J 等人摘要和海报已接受。Maui Derm 2022 3.Thaci 等人J Dermatol Sci. 2019;94:266 —75
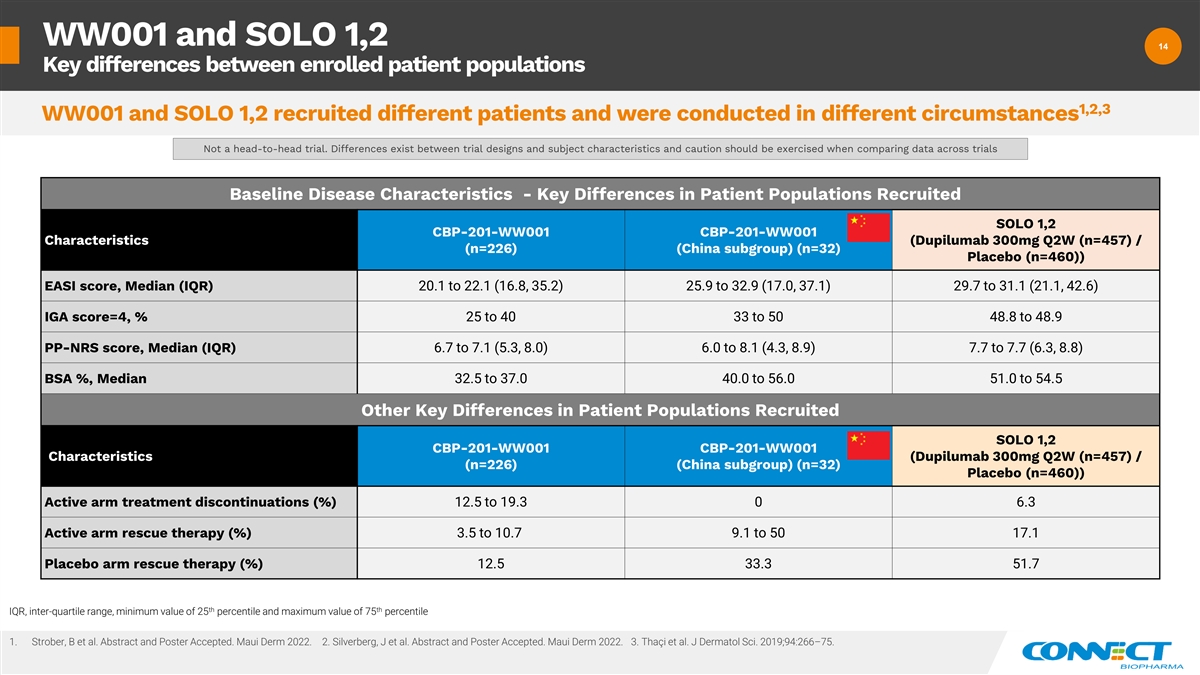
WW001 和 SOLO 1,2 14 14 入组患者 人群之间的主要区别 1,2,3 WW001 和 SOLO 1,2 招募了不同的患者,是在不同的情况下进行的。不是正面交锋的试验。试验设计和受试者特征之间存在差异, 比较各项试验的数据时应谨慎行事。基线疾病特征——招募的患者群体的关键差异 SOLO 1,2 CBP-201-WW001 CBP-201-WW001 特征(dupilumab 300mg Q2W (n=457)/(n=226)(中国亚组)(n=32)安慰剂(n=460)) EASI 分数,中位数 (IQR) 20.1 到 22.1 (16.8、35.2) 25.9 到 32.9 (17.0、37.1) 29.7 到 31.1 (21.1、42.6) IGA 分数 =4,% 25 比 40 33 比 50 48.8 到 48.9 PP-NRS 分数,中位数 (IQR) 6.7 到 7.1 (5.3、8.0) 6.0 到 8.1 (4.3,8.9) 7.7 到 7.7 (6.3, 8.8) BSA%, 中位数 32.5 到 37.0 40.0 到 56.0 51.0 到 54.5 招募的患者群体中的其他关键差异 SOLO 1,2 CBP-201-WW001 CBP-201-WW001 特征(dupilumab 300mg Q2W (n=457)/(n=226)(中国亚组)(n=32)安慰剂(n=460))Active arm 治疗停止 (%) 12.5 到 19.3 0 6.3 主动手臂救援疗法 (%) 3.5 到 10.7 9.1 9.1 到 50 17.1 安慰剂手臂救援疗法 (%) 12.5 33.3 第 51.7 个 IQR,四分位数间范围,最小值为 25 个百分位数,最大值为 75 个百分位数 1。Strober、B 等人摘要和海报已接受。Maui Derm 2022. 2.Silverberg,J 等人摘要和海报已接受。Maui Derm 2022. 3.Thaci 等人J Dermatol Sci. 2019;94:266 —75。
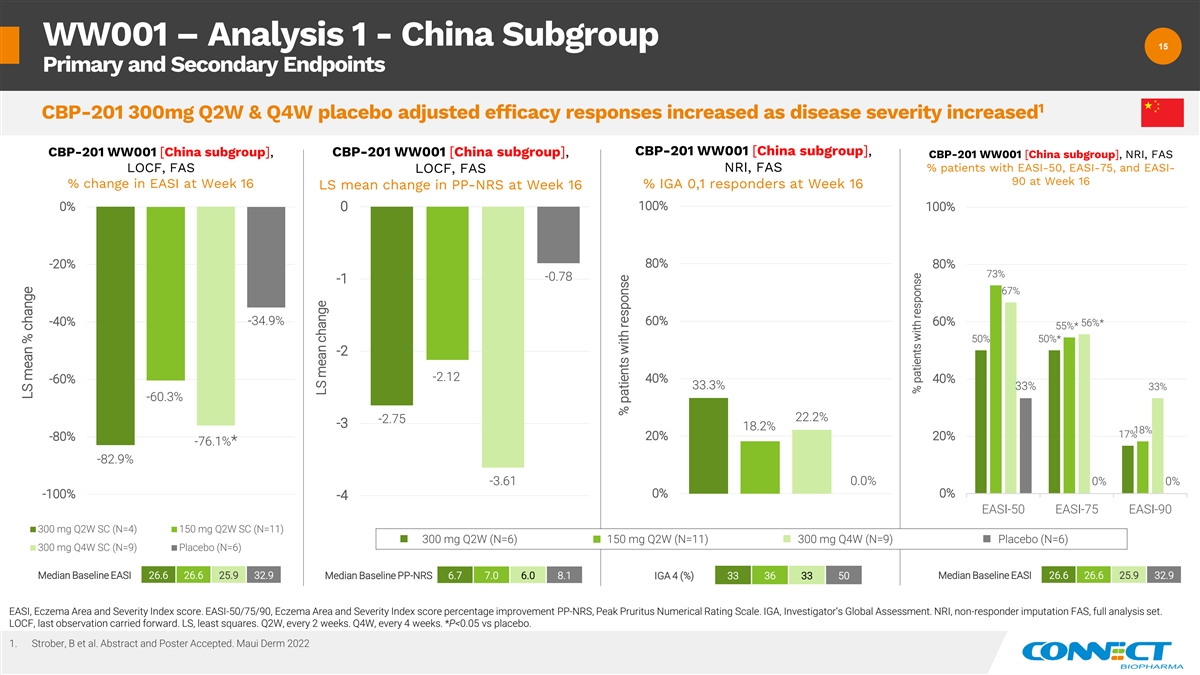
WW001 — 分析 1-中国亚组 15 15 主要和次要 终点 1 CBP-201 300mg Q2W 和 Q4W 安慰剂调整后的疗效反应随着疾病严重程度的增加而增加 CBP-201 WW001 [中国分组],CBP-201 WW001 [中国分组],CBP-201 WW001 [中国分组],CBP-201 WW001 [中国分组],NRI, FAS% EASI-50、EASI-75 和 EASI-LOCF、FAS LOCF、FAS NRI、FAS 90 患者在第 16 周 EASI 的变化%% 第 16 周 IGA 0,1 受访者 LS 第 16 周 PP-NRS 的平均变化 100% 0% 0 80% -20% 73% -0.78 -67% -34.9% -40% {br 60%} 56% * 55% * 50% 50% *-2 -2.12 40% 40% -60% 33.3% 33% 33% -60.3% 22.2% -2.75 -3 18.2% 18% 20% -80% -76.1% * -82.9% -3.61 0.0% 0% 0% -100% -4 EASI-50 EASI-75 EASI-90 300 mg Q2W SC (N=11) 300 mg Q2W SC (N=11) 300 mg Q2W (N=11) 300 mg =6) 150 mg Q2W (N=11) 300 mg Q4W (N=9) 安慰剂 (N=6) 300 mg Q4W SC (N=9)安慰剂 (N=6) 基线中位数 EASI 26.6 26.6 25.9 32.9 基线中位数 PP-NRS 6.7 7.0 6.0 8.1 基线中位数 26.6 26.6 25.9 32.9 IGA 4 (%) 33 36 33 50 EASI、湿疹面积和严重程度 指数分数。EASI-50/75/90,湿疹面积和严重程度指数分数改善百分比 PP-NRS,Peak Pruritus 数值评分量表。IGA,研究者的全球评估。NRI,无响应者归因 FAS,完整分析集。LOCF,最后一个 观测结果向前延伸。LS,最小二乘法。第二季度,每 2 周一次。第四季度,每 4 周一次。*P
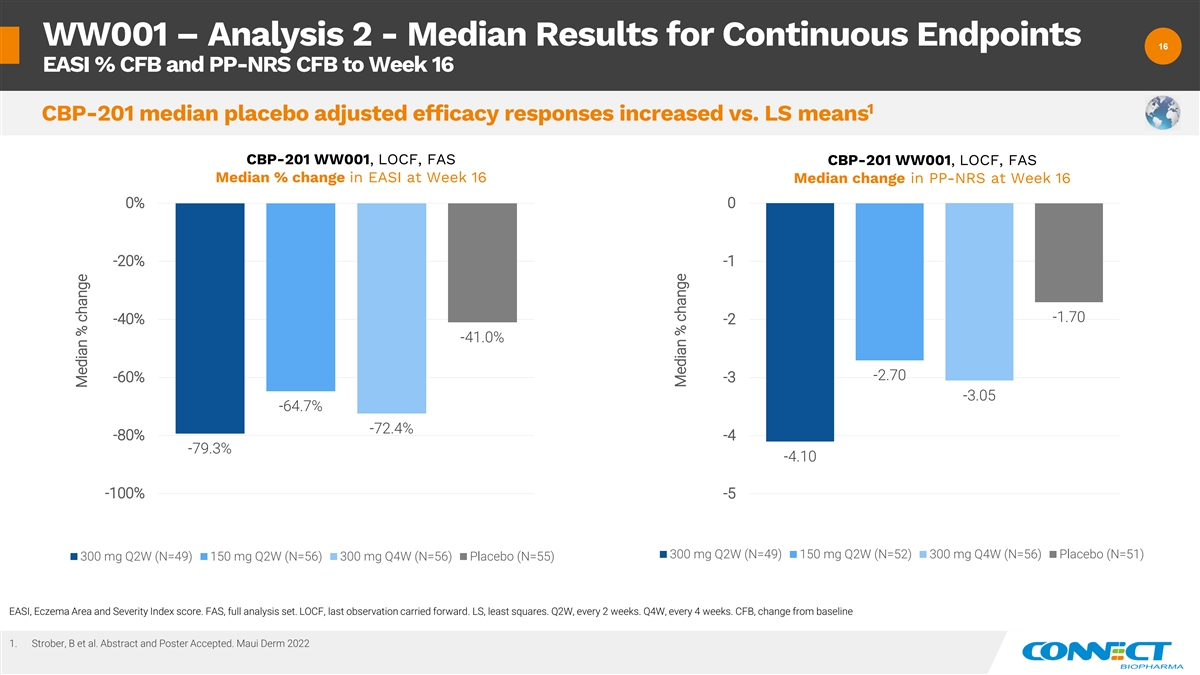
WW001 — 分析 2-连续终点的结果中位数 16 16 EASI% CFB 和 PP-NRS CFB 至第 16 周 1 CBP-201 安慰剂调整后的疗效反应中位数与 LS 平均值相比 CBP-201 WW001、LOCF、FAS CBP-201 WW001、LOCF、FAS 第 16 周 PP-NRS 变化中位数 0% 0 -20% -1 -1.70 -40% -2.70% -60% -3 -3.05 -64.7% -72.4% -80% -4 -79.3% -4.10 -100% -5 300 mg Q2W (N=49) 150 mg Q2W (N=52) 300 mg Q4W (N=56) 300 mg Q2W (N=56) 300 mg Q4W (N=56) 安慰剂 (N=56) =55) EASI、湿疹区域和 严重程度指数分数。FAS,全套分析集。LOCF,最后一次观察延续了下去。LS,最小二乘法。第二季度,每 2 周一次。第四季度,每 4 周一次。CFB,与基准线相比的变化 1。Strober、B 等人摘要和海报已接受。Maui Derm 2022 中位数% 变化中位数百分比变化
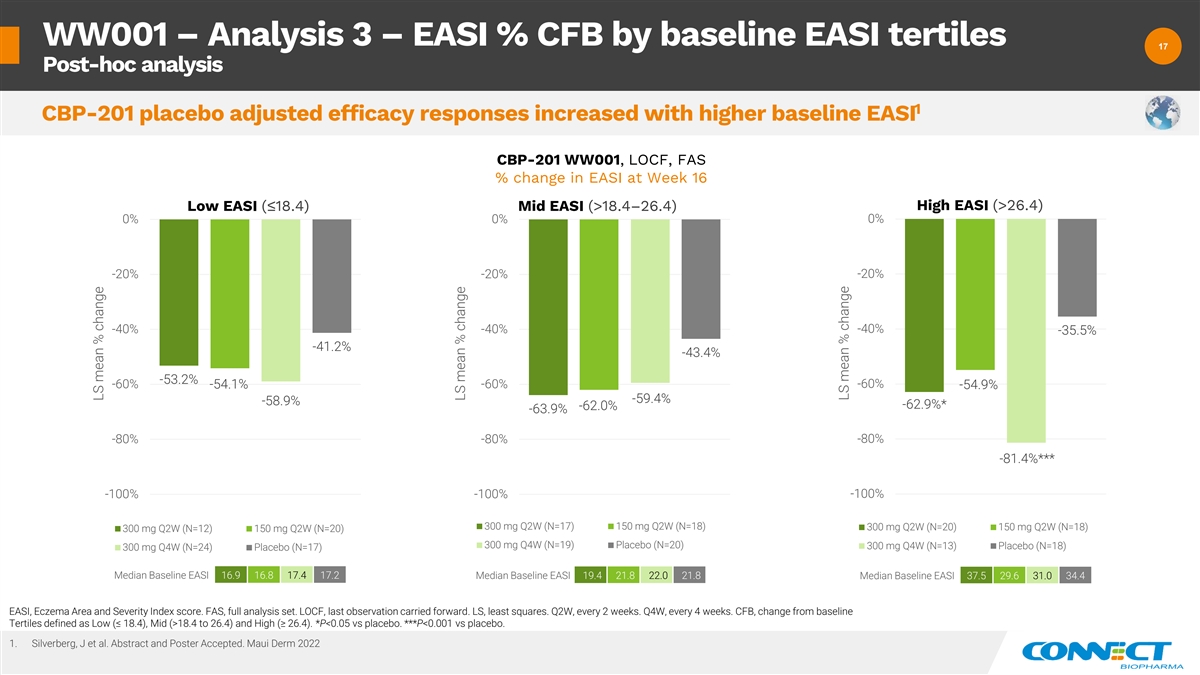
WW001 — 分析 3 — 按基线计算 EASI% CFB 17 17 事后分析 1 CBP-201 安慰剂调整后的疗效反应随着基线升高 EASI CBP-201 WW001、LOCF、FAS 第 16 周高 EASI (>26.4) 低 EASI (>18.4—26.4) 0% 0% 0% -20% -20% -40% 40% -40% -35.5% -41.2% -43.4% -60% -60% -54.1% -60% -54.9% -59.9% -58.9% -62.9% -62.9% -62.9% -80% -80% -81.4% *** -100% -100% -100% 300 mg Q2W (N=18) 300 mg Q2W (N=18) 300 mg W (N=20) 150 mg Q2W (N=18) 300 mg Q2W (N=12) 150 mg Q2W (N=20) 300mg Q4W (N=19) 安慰剂 (N=20) 300 mg Q4W (N=13) 安慰剂 (N=18) 300 mg Q4W (N=24) 安慰剂 (N=17) 中位基线 EASI 16.9 16.8 17.2 中位基线 EASI 19.4 21.8 中位基线 37.5 29.6 31.4 EASI、湿疹面积和严重程度指数分数。FAS,全套分析集。LOCF,最后一次观察延续了下去。LS,最小二乘法。第二季度,每 2 周一次。第四季度,每 4 周一次。CFB,从定义为低 (≤ 18.4)、中等 (>18.4 到 26.4) 和高 (≥ 26.4) 的基线 Tertiles 发生变化。*P
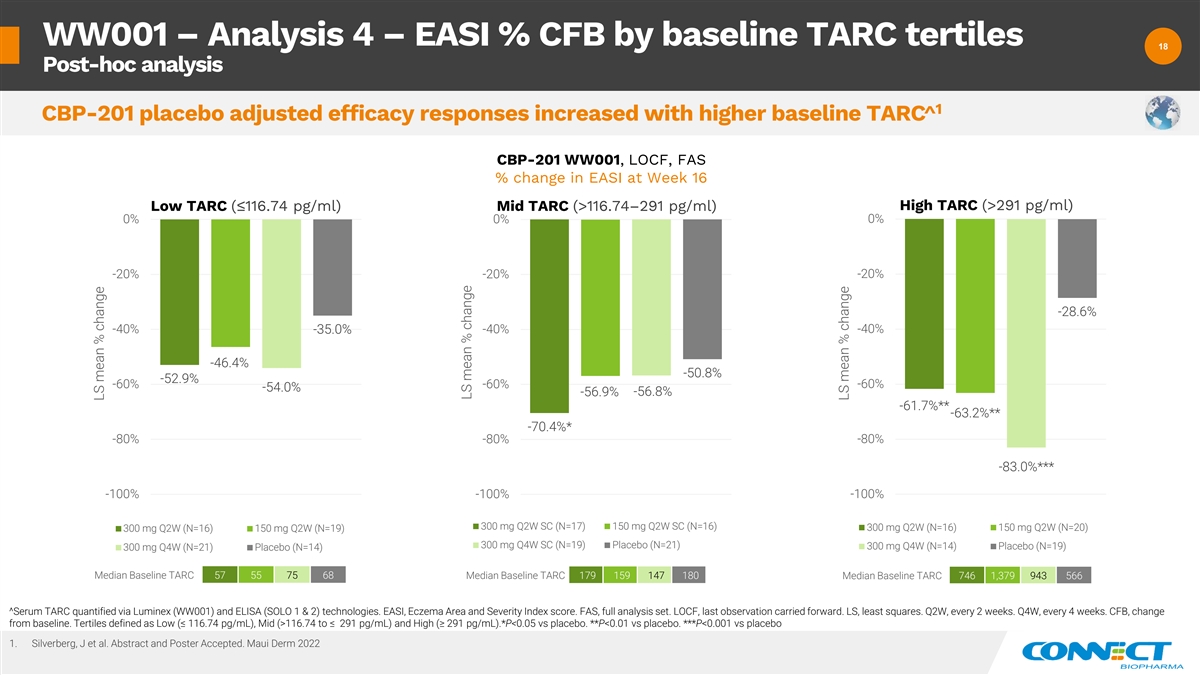
WW001 — 分析 4 — EASI% CFB 按基线 TARC tertiles 18 18 事后分析 1 CBP-201 安慰剂调整后的疗效反应随着基线升高而增加 TARC ^ CBP-201 WW001、LOCF、FAS 第 16 周高 TARC (>291 pg/ml) 低 TARC (>116.74—291 pg/ml) 0% 0% -20% -20% -20% -28.6% -40% -40% -40% -46.4% -50.8% -52.9% -60% -60% -54.0% -56.9% -56.8% -61.7% ** -63.2% * -80% -80% -83.0% *** -100% -100% -100% -100% 300 mg Q2W SC (N=17) 150 mg 2W SC (N=16) 300 mg Q2W (N=16) 150 mg Q2W (N=20) 300 mg Q2W (N=16) 150 mg Q2W (N=19) 300 mg Q4W SC (N=19) 安慰剂 (N=21) 300 mg Q4W (N=14) 安慰剂 (N=19) 300 mg Q4W (N=21) 安慰剂 (N=14) 中位基线 TARC 57 55 75 68 中位基线 TARC 179 159 180 基线中位数 TARC 746 1,379 966 ^Serum TARC 通过 Luminex (WW001) 和 ELISA (SOLO 1 和 2) 技术进行量化。EASI、湿疹区域和严重程度指数分数。FAS,全套分析集。LOCF,最后一次观察延续了下去。LS,最小二乘法。第二季度,每 2 周一次。Q4W, 每 4 周一次。CFB,与基线相比有所变化。Tertiles 定义为低(≤ 116.74 pg/mL)、中等(>116.74 至 ≤ 291 pg/mL)和高(≥ 291 pg/mL)。*P
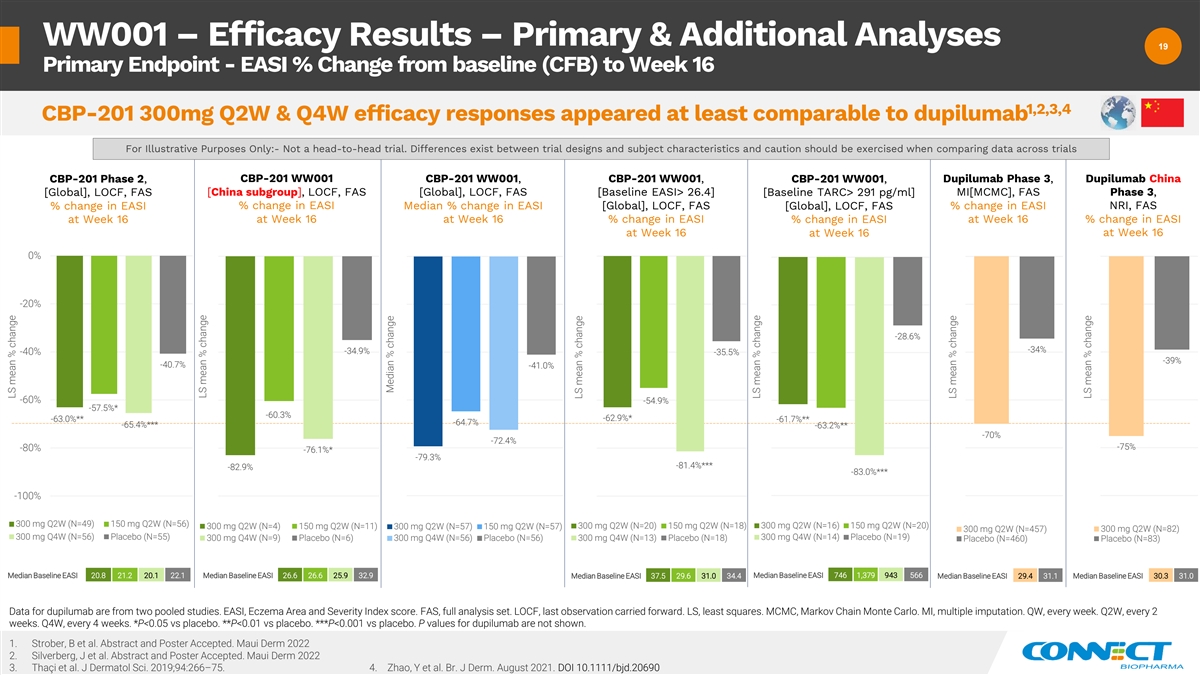
WW001 — 疗效结果 — 主要和附加 分析 19 19 主要终点——从基线 (CFB) 到第 16 周的 EASI 百分比变化 1,2,3,4 CBP-201 300mg Q2W 和 Q4W 疗效反应似乎至少与 dupilumab 相当,仅用于说明目的:-不是正面交锋试验。试验设计和受试者特征之间存在差异 ,比较不同试验的数据时应谨慎行事 CBP-201 第 2 期、CBP-201 WW001 CBP-201 WW001、CBP-201 WW001 CBP-201 WW001、dupilumab 3 期、dupilumab China [全球]、LOCF、 FAS [中国分组]、LOCF、FAS [全球]、LOCF、FAS [基线 EASI> 26.4][基线 TARC> 291 pg/ml]MI[MCMC],FAS 第 3 阶段,EASI 的变化百分比 EASI 的变化百分比 EASI 的变化中位数百分比 [全球]、LOCF、FAS [全球],LOCF,FAS EASI NRI 的百分比变化, FAS 在第 16 周第 16 周 EASI 的变化% 第 16 周 EASI 的变化% 第 16 周 EASI 的变化 0% -20% -28.6% -34% -40% -35.5% -39% -40% -41.0% -54.9% -57.5% * -60.3% -62.9% * -63.0% ** -61.7% ** -64.7% -65.4% *** -63.2% ** -70% -72.4% -80% -76.1% * -79.3% -83.0% *** -100% 300 mg Q2W (N=56) 300 mg Q2W (N=56) 300 mg 2W (N=4) 150 mg Q2W (N=11) 300 mg Q2W (N=20) 150 mg Q2W (N=18) 300 mg Q2W (N=16) 150 mg Q2W (N=20) 300 mg Q2W (N=57) 300 mg Q2W (N=457) 300 mg Q2W (N=82) 300 mg Q4W (N=56) 安慰剂 (N=55) 300 mg Q4W (N=14) 安慰剂 (N=19) 300 mg Q4W (N=9) 安慰剂 (N=6) 300 mg Q4W (N=13) 安慰剂 (N=18) 安慰剂 (N=460) 安慰剂 (N=83) 中位基线 EASI 746 1,379 943 566 基线中位数 20.8 21.2 20.1 22.1 中位基线 EASI 26.6 25.9 32.9 中位基线 EASI 29.4 31.0 dupiluge 数据 mab 是 来自两项汇总研究。EASI、湿疹区域和严重程度指数分数。FAS,全套分析集。LOCF,最后一次观察继续进行。LS,最小二乘法。MCMC,马尔可夫连锁蒙特卡罗。MI,多重归因。QW,每周一次。第二季度,每 2 周一次。Q4W, 每 4 周一次。*P

WW001 — 疗效结果——主要和额外分析 20 20 个次要终点——第 16 周 IGA 0,1% 的响应者和 EASI-50、-75、-90% 的响应者 1,2,3 CBP-201 300mg Q2W 和 Q4W 疗效反应似乎至少与 dupilumab 相当,仅供说明起见:-不是正面交锋试验。 试验设计和受试者特征之间存在差异,比较不同试验的数据时应谨慎行事 CBP-201 WW001 [中国分组],CBP-201 第 2 阶段,NRI,FAS dupilumab 第 3 阶段,NRI,FAS dupilumab 中国第 3 阶段,NRI, FAS% IGA 0,1 受访者在第 16 周 NRI,FAS% IGA 0,1 受访者 16周 100% 100% 100% IGA 4 (%) 40 29 30 IGA 4 (%) 33 36 33 50 IGA 4 (%) 48.8 48.9 IGA 4 (%) 57 56 80% 80% 80% 60% 60% 60% 60% 37% 40% 40% 40% 33.3% 28.1% * 27% 22.2% 18.8% 20% 20% 10.7% 9% 0.0% 0% 300 mg Q2W (N=6) 150 mg Q2W (N=6) 150 mg =11) 300 mg Q2W (N=57) 150 mg Q2W (N=57) 300 mg Q2W (N=457) 安慰剂 (N=460) 300 mg Q2W (N=82) 安慰剂 (N=83) 300 mg Q4W (N=56) 安慰剂 (N=56) 300 mg Q4W (N=9) 安慰剂 (N=6) dupilumab 的数据来自两项汇总研究。IGA,研究者的全球评估。FAS,全套分析集。LOCF,最后一次观察延续了下去。LS, 最小二乘法。QW,每周一次。第二季度,每 2 周一次。第四季度,每 4 周一次。**P
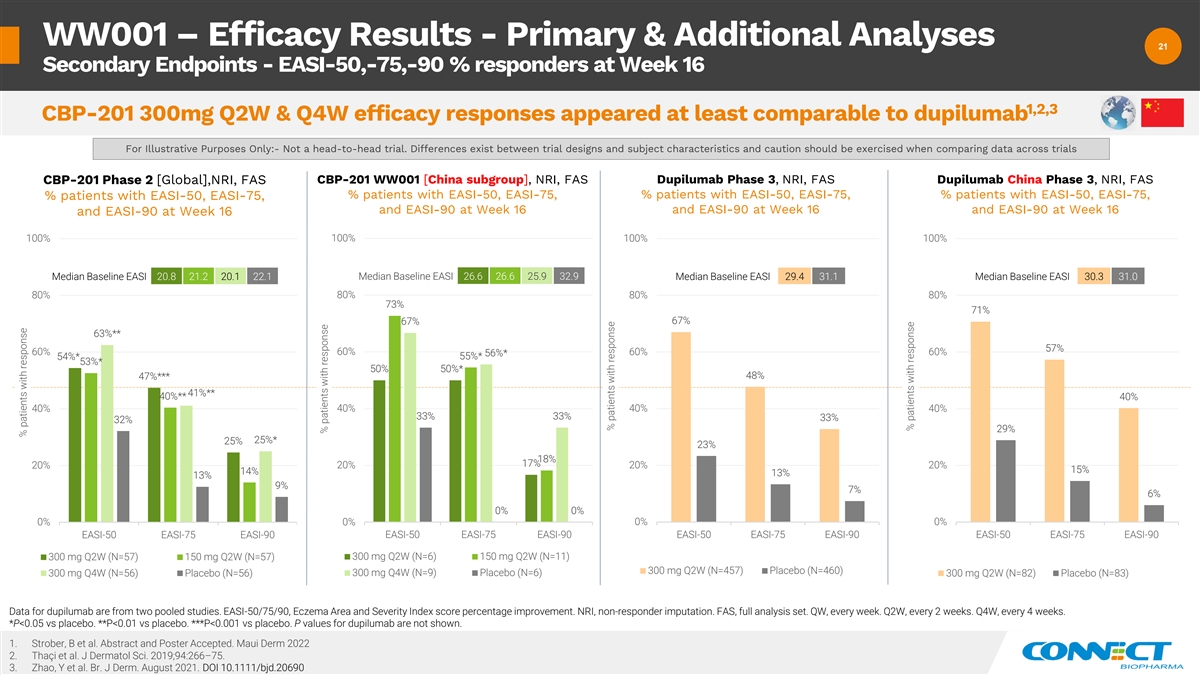
WW001 — 疗效结果——主要分析和其他分析 21 21 个次要终点——第 16 周 EASI-50、-75、-90% 的反应者 1,2,3 CBP-201 300mg Q2W 和 Q4W 疗效反应似乎至少与 dupilumab 相提并论:-不是正面交锋试验。 试验设计和受试者特征之间存在差异,比较不同试验的数据时应谨慎行事 CBP-201 Phase 2 [全球],NRI,FAS CBP-201 WW001 [中国分组]、NRI、FAS dupilumab 3 期、NRI、FAS dupilumab China 3 期、NRI、FAS% EASI-50、EASI-75 患者、EASI-50 患者百分比、EASI-50、EASI-75、% 的患者在第 16 周和第 16 周有 culder 100% 100% 中位基线 EASI 20.8 21.2 20.1 22.1 基线中位数 EASI 26.6 26.6 25.9 32.9 中位基线 EASI 29.4 31.1 基线中位数 30.3 31.0 80% 80% 80% 73% 71% 67% 63% ** 57% 60% 60% * 56% * 53% * 50% * 48% *48% *** 47% *** EASI-75 EASI-50 EASI-75 EASI-90 EASI-90 EASI-90 EASI-9041% ** 40% ** 40% 40% 40% 40% 33% 33% 33% 32% 29% 25% * 25% 18% 17% 20% 20% 20% 15% 13% 9% 6% 0% 0% 0% 0% EASI-50 EASI-75 EASI-90 EASI-50 EASI-75 EASI-90 EASI-50 EASI-75 EASI-90 EASI-50 EASI-75 300 mg Q2W (N=57) 300 mg Q2W (N=6) 300 mg Q2W (N=6) 150 mg Q2W (N=6) 150 mg Q2W (N=6) 150 mg Q2W (N=6) 150 mg Q2W (N=6) 150 mg Q2W (N=6) 150 mg Q2W (N=6) 150 mg Q2W (N=6 W (N=11) 300 mg Q2W (N=457) 安慰剂 (N=460) 300 mg Q4W (N=56) 安慰剂 (N=56) 300 mg Q4W (N=9) 安慰剂 (N=6) 300 mg Q2W (N=82) dupilumab 的数据来自两项汇总研究。EASI-90EASI-50/75/90,湿疹 面积和严重程度指数分数百分比提高。NRI,无回应者指责。FAS,全套分析集。QW,每周一次。第二季度,每 2 周一次。第四季度,每 4 周一次。*P
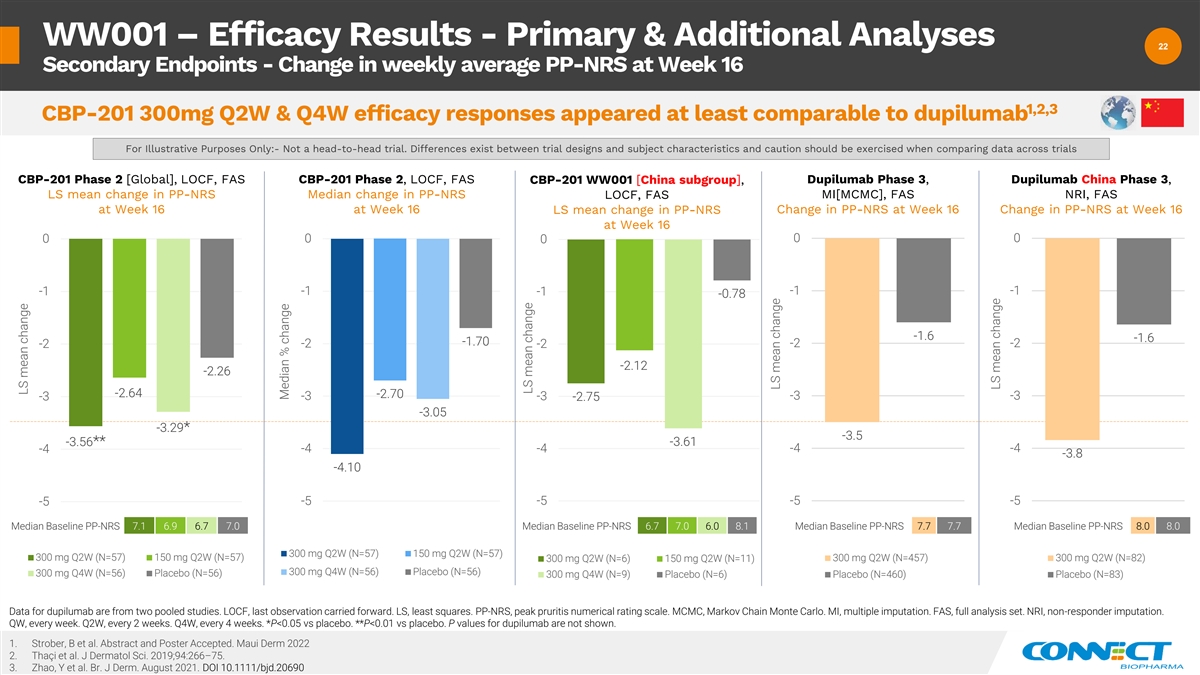
WW001 — 疗效结果——主要分析和其他分析 22 22 个次要终点——第 16 周每周平均 PP-NRS 的变化 1,2,3 CBP-201 300mg Q2W 和 Q4W 疗效反应似乎至少与 dupilumab 相当,仅用于说明目的:-不是正面交锋试验。 试验设计和受试者特征之间存在差异,比较不同试验的数据时应谨慎行事 CBP-201 Phase 2 [全球]、LOCF、FAS CBP-201 第 2 阶段、LOCF、FAS CBP-201 WW001 [中国分组]、dupilumab 第 3 期、dupilumab 中国第 3 期、LS PP-NRS 的平均变化 PP-NRS LOCF、FAS MI[MCMC],FAS NRI,第 16 周的 FAS 第 16 周 LS 第 16 周 PP-NRS 的平均变化第 16 周 PP-NRS 的变化第 16 周 PP-NRS 的变化 0 0 0 0 -1 -1 -1 -1 -1.6 -1.6 -1.70 -2 -2.12 -2.64 -2.64 -2.70 -3 -3.29* -3.5 -3.56** -3.61 -4 -4 -4 -3.8 -4.10 -5 -5 -5 -5 -5 基线中位数 7.1 6.9 6.7 7.0 基线中位数 PP-NRS 6.7 7.7 中位基线 PP-NRS 8.0 8.0 300 mg Q2W (N=57) 300 mg Q2W (N=57) 300 mg Q2W (N=57) 300 mg Q2W (N=57) 300 mg N=57) 150 mg Q2W (N=57) 300 mg Q2W (N=457) 300 mg Q2W (N=82) 300 mg Q2W (N=6) 150 mg Q2W (N=11) 300 mg Q4W (N=56) 安慰剂 (N=56) 300 mg Q4W (N=56) 安慰剂 (N=56) 300 mg Q4W (N=9) 安慰剂 (N=6) 安慰剂 (N=83) dupilumab 的数据来自两个池研究报告。LOCF,最后一次观察延续了下去。LS,最小二乘法。PP-NRS,peak puritis 数字评级量表。MCMC,马尔可夫连锁蒙特卡罗。MI,多重归因。 FAS,完整分析集。NRI,无回应者指责。QW,每周一次。第二季度,每 2 周一次。第四季度,每 4 周一次。*P

23 23 WW001-结论 WW001 符合主要终点和关键 次要终点;预计于 2022 年 2 年下半年开始的 3 期首次患者入组不是正面交锋试验。试验设计和受试者特征之间存在差异,比较不同试验的数据时应谨慎行事 • CBP-201 显示 1,2 中度至重度 AD 的成年患者的皮肤清除率、疾病严重程度和瘙痒显著改善 • 很难与 SOLO 1,2 进行交叉试验比较,因为招募的 AD 人群不那么严重 ,而且由于 COVID-19 疫情对 WW001 中试验的影响,患者停药人数增加 • 其他先验和 WW001 试验人群的临时分析显示 1,2,3 • 随着基线疾病严重程度的增加, CBP-201 疗效反应进一步改善 • 基线严重程度与 SOLO1,2 更接近,CBP-201 300mg Q2W 和 Q4W 1,2,3 的并排比较似乎至少具有可比性,有些终点在数字上优于 dupilumab 300mg Q2W • CBP-201 300mg 具有差异化的疗效和安全性 4W 剂量 • 全球第 3 期 AD 计划的规划正在进行中,预计将于 2022 年下半年首次入组患者 1.Strober、B 等人摘要和海报已接受。Maui Derm 2022 2.Silverberg,J 等人摘要和海报已接受。Maui Derm 2022 3.Thaci 等人J Dermatol Sci. 2019;94:266 —75。