
Azenosertib 临床更新剂量选择、单一疗法和化疗组合疗效和安全性以及持续发展 2023 年 6 月纳斯达克:ZNTL

2 前瞻性声明和免责声明 Zentalis Pharmicals, Inc.(“我们”,“我们的”,“Zentalis” 或 “公司”)警告说,本演讲(包括本演示附带的口头评论)包含1995年《美国私人证券诉讼改革法》所指的前瞻性陈述。本演示文稿中包含的所有与历史事实无关的陈述均应被视为前瞻性陈述,包括但不限于关于我们的候选产品有可能成为同类首创和/或同类最佳产品的陈述;有可能加快批准途径;我们的候选产品有可能作为单一疗法和联合疗法开发;azenosertib(zn-c3)有可能解决一系列癌症未得到满足的巨大需求;间歇给药对我们的潜在好处候选产品;我们的azenosertib 的开发方法;提供 azenosertib 项目时间表和潜在注册途径的最新时机;临床前和临床项目更新的时机;特定适应症和/或患者群体中潜在未得到满足的需求;包括我们的候选产品在内的潜在组合可能性及其潜在益处;我们的候选产品及其作用机制,包括作为单一疗法和/或联合疗法;我们相信我们有加强了我们的临床能力开发计划,包括 azenosertib 的开发计划;NDA 或最终数据读取的时机;潜在可针对的患者群体的规模;我们的候选产品的临床和监管进展,包括注册、启动临床试验和数据公布;我们候选产品的市场机会和市场潜力;启动 azenosertib 与化疗联合治疗 Cyclin E1+ 铂敏感性卵巢癌的 3 期试验的时机;以及声明其中包括 “设计”、“估计”、“可能” 等字样机会”、“计划”、“潜力”、“预测”、“有希望”、“战略”、“将” 以及具有未来或前瞻性质的类似陈述。这些陈述既不是承诺也不是担保,而是涉及已知和未知的风险、不确定性和其他重要因素,这些因素可能导致我们的实际业绩、业绩或成就与前瞻性陈述所表达或暗示的任何未来业绩、业绩或成就存在重大差异,包括但不限于以下内容:我们的运营历史有限,这可能使我们难以评估当前业务和预测未来的成功和生存能力;我们已经并且预计将继续承担重大差异损失;我们需要额外的资金,但可能无法获得;我们开发任何诊断工具的计划,包括其成本;临床前测试和早期试验的结果可能无法预测后期临床试验的成功;未能确定其他候选产品并开发或商业化可销售的产品;临床试验期间潜在的不可预见事件可能导致延误或其他不利后果;与监管批准程序或持续监管义务相关的风险;未能获得美国或国际市场批准;我们的候选产品可能造成严重的不良副作用;无法维持我们的合作或合作失败;我们对第三方的依赖;重大竞争的影响;系统故障或安全漏洞的可能性;与知识产权相关的风险;我们吸引、留住和激励合格人员的能力以及与管理过渡相关的风险;以及作为上市公司运营所产生的巨额成本。其他风险和不确定性包括我们最近提交的10-K和10-Q表定期报告中标题为 “风险因素” 的风险和不确定性以及未来向美国证券交易委员会提交的文件中列出的风险和不确定性。可能导致实际结果与本演示文稿中前瞻性陈述所显示的结果存在重大差异。任何此类前瞻性陈述均代表管理层截至本演示之日的估计。新的风险和不确定性可能会不时出现,而且不可能预测所有的风险和不确定性。尽管我们可能会选择在未来的某个时候更新这些前瞻性陈述,但除非适用法律要求,否则我们没有义务更新或修改任何前瞻性陈述。尽管我们认为此类前瞻性陈述中反映的预期是合理的,但我们无法保证这种预期会被证明是正确的。因此,提醒读者不要过分依赖这些前瞻性陈述。对任何此类前瞻性陈述的准确性均不作任何陈述或保证(明示或暗示)。本演示文稿还包含独立各方和我们做出的与市场规模有关的估计和其他统计数据以及有关我们行业的其他数据。这些数据涉及许多假设和模仿,提醒您不要对此类数据和估计值给予过分的重视。此外,对我们未来业绩以及我们运营所在市场的未来表现的预测、假设和估计必然受到高度的不确定性和风险的影响。我们和我们的关联公司、顾问或代表均不对该数据的准确性或完整性作出任何陈述,也不承诺在本演示之日之后更新此类数据。ZENTALIS® 及其相关徽标是 Zentalis 和/或其关联公司的商标。本演示文稿中出现的所有其他商标、商品名称和服务标记均为其各自所有者的财产。本演示文稿中提供的所有网站地址仅供参考,无意用作活跃链接或将任何网站信息纳入本文档。Zentalis的候选产品是研究药物,尚未获得美国食品药品监督管理局或任何其他监管机构的批准。

3 今日议程 1 Azenosertib 单一疗法试验结果回顾:宣布新的 Azenosertib 单一疗法 2 剂量目前正在进行卵巢癌试验,以及南加州大学对耐铂卵巢癌的 Azenosertib + 化疗综述(昨天发表:ASCO 摘要 5513)3 拟议的 3 期化疗组合试验4 Q&A5

今天加入电话会议 4 金伯利·布莱克威尔,医学博士 Zentalis Pharmicals 首席执行官 Carrie Brownstein,医学博士 Zentalis Pharmicals Funda Meric-Bernstam,医学博士,德克萨斯大学医学博士安德森癌症中心第一阶段项目;Zentalis Scientific 成员。顾问委员会

5 Zentalis的临床转型取得了重大进展 • 针对已知癌症靶点开发出同类首屈一指和同类最佳的疗法目标有望执行和交付 • 具有深厚肿瘤经验的管理团队 • 与辉瑞、葛兰素史克建立合作伙伴关系 • 血液系统恶性肿瘤领域的多种机会 • 迄今为止已有 100 多名患者给药前景看好的项目:bcl-2i 和 Degrader • 在难以治疗的靶点中具有很大的潜力、经过验证的靶点肿瘤 • WEE1 抑制剂旨在具有优越性选择性和药理特性 • 单一疗法活性和良好的安全性 • 迄今为止服用 Azenosertib 的 400 多名患者符合所有标准 People

6 Today's Call——两个大型的1期数据集:在抗铂/难治性卵巢癌中,与单独使用化疗相比,Azenosertib联合单药化疗可以提高反应率和耐久性:• 50% ORR、5.6 个月 DOR 和 7.4 个月紫杉醇的 MPF • 36% ORR、11.4 个月 DOR 和 10.4 个月 MPF 在卵巢癌和 USB 中的卡铂综合持续开发战略 C: • 南加州大学的 2 期单一疗法(所有患者)• 耐铂卵巢癌的 2 期单一疗法 • 1/2 期单一疗法或联合/交替使用耐尼拉帕尼 PARPI 的 PROC • 拟议的 Cyclin E1+ 铂敏感性卵巢癌的 3 期研究 • 化疗 + azenosertib 然后是 azenosertib 单一疗法维持与双重化疗后安慰剂单药剂量优化相比已成功:• 已确认接受过大量预治疗的耐铂卵巢癌和 USC 的 ORR 为 36.8% • 耐受性比其他药物有所提高 WEE-1 抑制剂,与抗体药物偶联物 USC 子宫浆液性癌高度相似;ORR,已确认客观反应率;DOR,反应持续时间;MPF,无进展存活率中位数。

AZENOSERTIB 新的间歇性单一疗法剂量

8 Azenosertib 间歇性单一疗法剂量显著提高了抗肿瘤活性和耐受性与之前的给药方案(连续 300 mg)相比,间歇给药导致:• 暴露量翻了一倍以上 • USC 和 HGSOC 的反应几乎翻了一番 • 患者群体中确认的 ORR 为 36.8% * • 维持或提高了安全性和耐受性 *反应可评估:至少有 RECIST 1.1 可测量的基线疾病一次基线后扫描,并接受了至少一剂药物;缩略语:5:2,治疗5天,然后是 2-休假治疗;南加州大学,子宫浆液性癌;HGSOC,高级别浆液性卵巢癌;ORR,客观反应率单一疗法剂量选择:400 mg 间歇性(持续 5 天,每周休息 2 天;5:2)
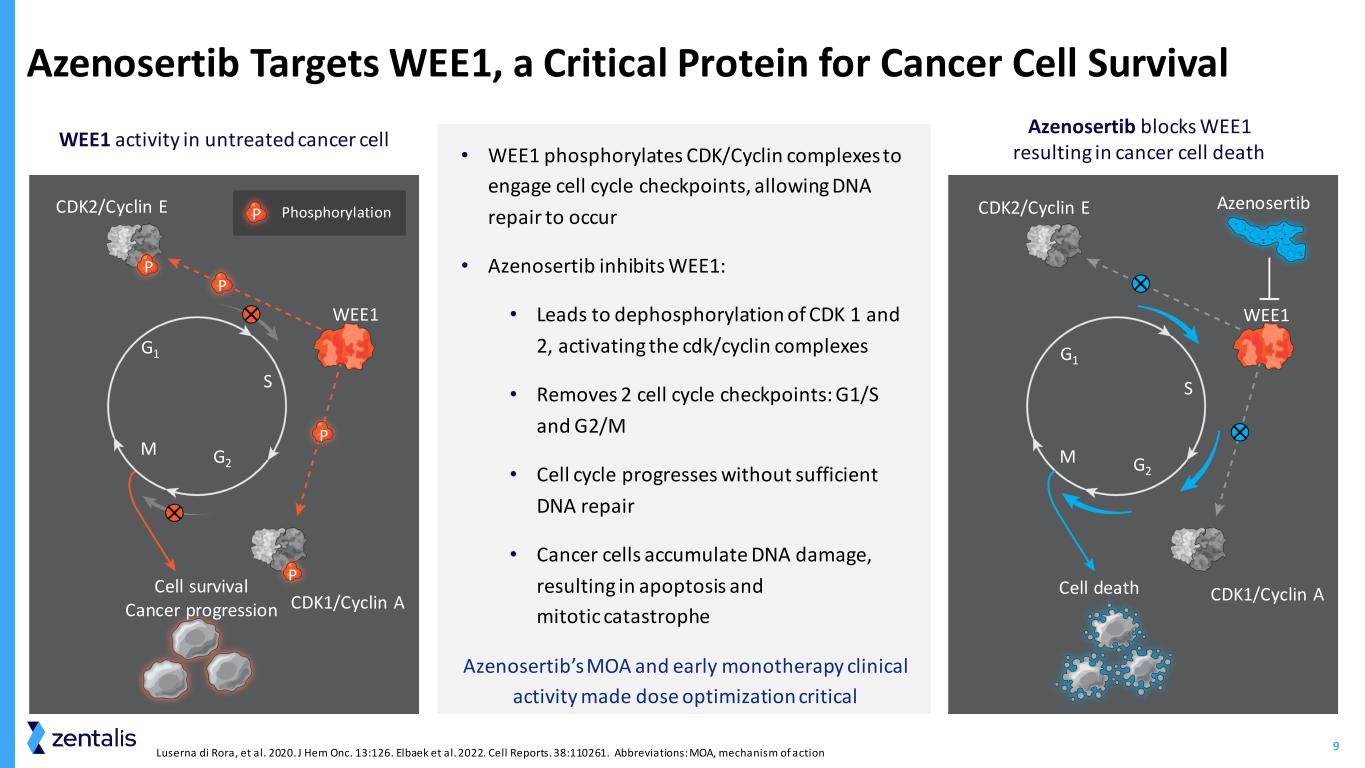
9 • WEE1 磷酸化 CDK/细胞周期蛋白复合物以接触细胞周期检查点,从而进行 DNA 修复 • Azenosertib 抑制 WEE1:• 导致 CDK 1 和 2 的脱磷酸化,激活 cdk/cyclin 复合物 • 移除 2 个细胞周期检查点:G1/S 和 G2/M • 细胞周期在没有充分 DNA 修复的情况下进行 • 癌细胞积累 DNA 损伤,导致细胞凋亡和有丝分裂灾难 Azenosertib的moa和早期的单一疗法临床活性使剂量优化成为未经治疗的癌细胞中的关键 WEE1 活性 Azenosertib 阻断了 WEE1在癌细胞死亡中 Azenosertib 靶向 WEE1,这是癌细胞存活的关键蛋白 cdk2/Cyclin E phostoriylationP P P P P P P S G2 M G1 细胞存活癌症进展 P cdk1/Cyclin A cdk1/Cyclin A cdk1/Cyclin 等人。2020J Hem Onc. 13:126。Elbaek 等人。2022。细胞报告。38:110261。缩写:MOA,作用机制

10 稳定状态下暴露量的增加保持或提高耐受性发现 Azenosertib a m o u n t f d ru g 的最佳剂量 B lo o d ru g in b lo o d 300 mg 显示出良好的安全性和抗肿瘤活性,但临床前模型和临床数据表明,间歇给药将允许:治疗指数
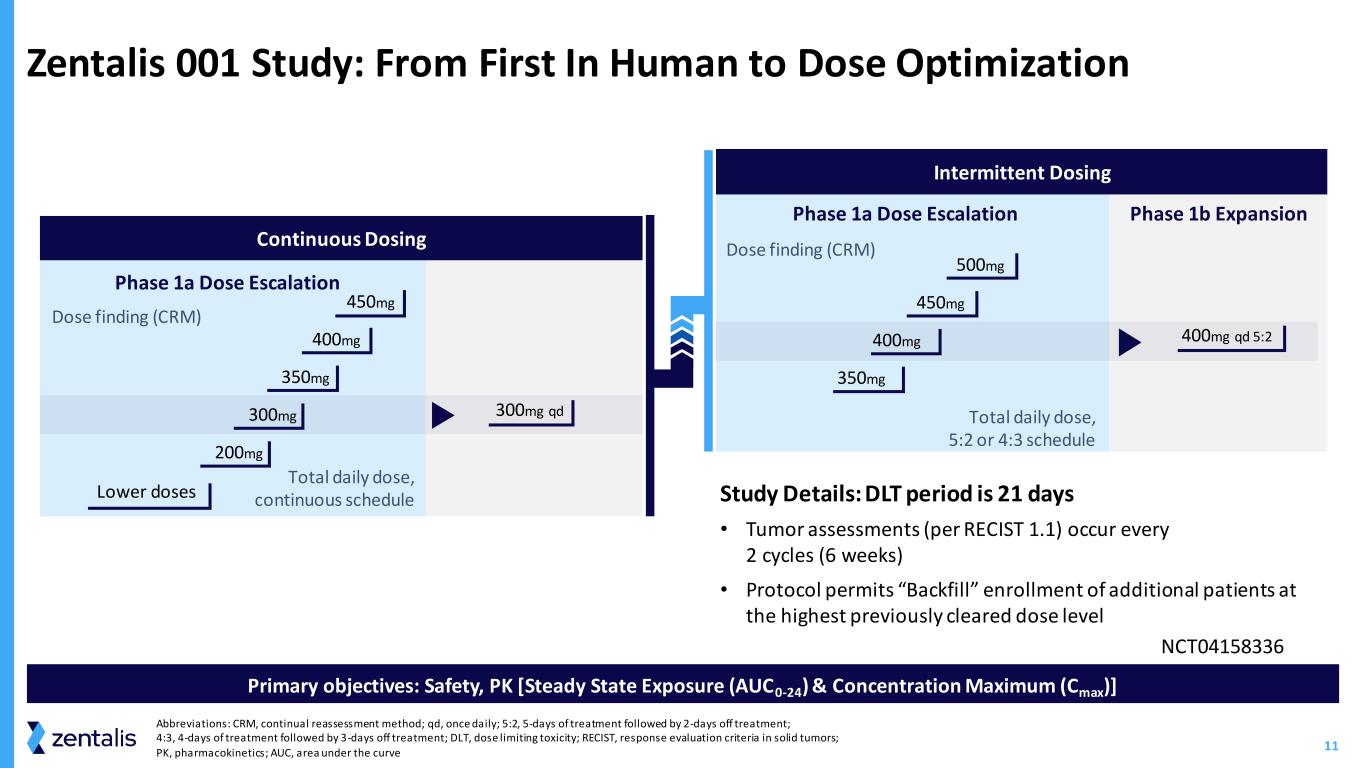
11 Zentalis 001 研究:从首次进入人体到剂量优化主要目标:安全、PK [稳态曝光 (AUC0-24) 和最大浓度 (Cmax)]1b 阶段扩展间歇给药剂量发现 (CRM) 每日总剂量,5:2 或 4:3 时间表 1a 阶段剂量升级 1b 阶段扩展 500mg 450mg 400mg 400mg qd 5:2 持续给药阶段 1a 剂量增加 450mg 200mg 剂量发现 (CRM) 每日总剂量,连续计划 400mg 350mg 300mg qd 较低剂量研究详情:DLT 期为 21 天 • 肿瘤评估(根据 RECI)ST 1.1) 每 2 个周期(6 周)发生一次 • 协议允许以先前批准的最高剂量水平 “回填” 注册更多患者缩写:CRM,持续重新评估方法;qd,每天一次;5:2,治疗 5 天,然后休息 2 天治疗;4:3,4 天治疗,然后休息 3 天治疗;DLT,剂量限制毒性;RECIST,实体瘤反应评估标准;PK,药代动力学;AUC,曲线下方区域 NCT04158336
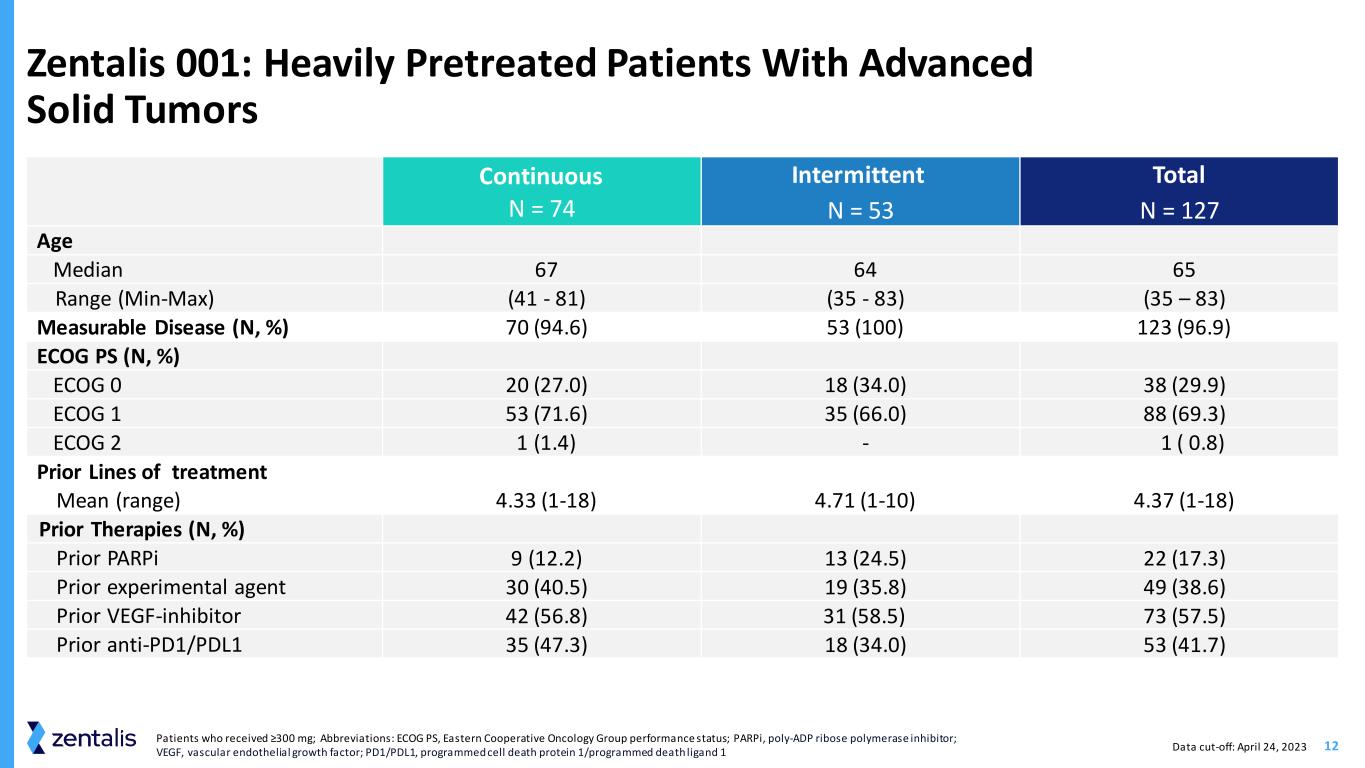
12 Zentalis 001:经过大量预先治疗的晚期实体瘤患者持续 N = 74 间歇性 N = 53 总计 N = 127 年龄中位数 67 64 65 范围(最小-最大)(41-81) (35-83) (35 — 83) (35 — 83) 70 (94.6) 53 (100) 123 (96.9) ECOG PS (N,%) ECOG 0 20 (27.0) 18 (34.0) 38 (29.9) ECOG 1 53 (71.6) 35 (66.0) 88 (69.3) ECOG 2 1 (1.4)-1 (0.8) 先前的治疗线平均值(范围)4.33 (1-18) 4.71 (1-10) 4.37 (1-18) 先前的疗法 (N,%) ParPi 9 (12.2) 13 (24.5) 22 (17.3) 先前的实验药物 30 (40.5) 19 (35.8) 49 (38.6) 之前的 VEGF-抑制剂 42 (56.8) 31 (58.5) 73 (57.5) Prior anti-PD1/PDL1 35 (47.3) 18 (34.0) 53 (41.7) 数据截止日期:2023 年 4 月 24 日接受 ≥300 mg 的患者;缩写:ECOG PS,东方合作肿瘤小组的表现状况;parPi,聚-ADP 核糖聚合酶抑制剂;VEGF,血管内皮生长因子;PD1/PD1/PDP L1,程序性细胞死亡蛋白 1/程序性死亡配体 1
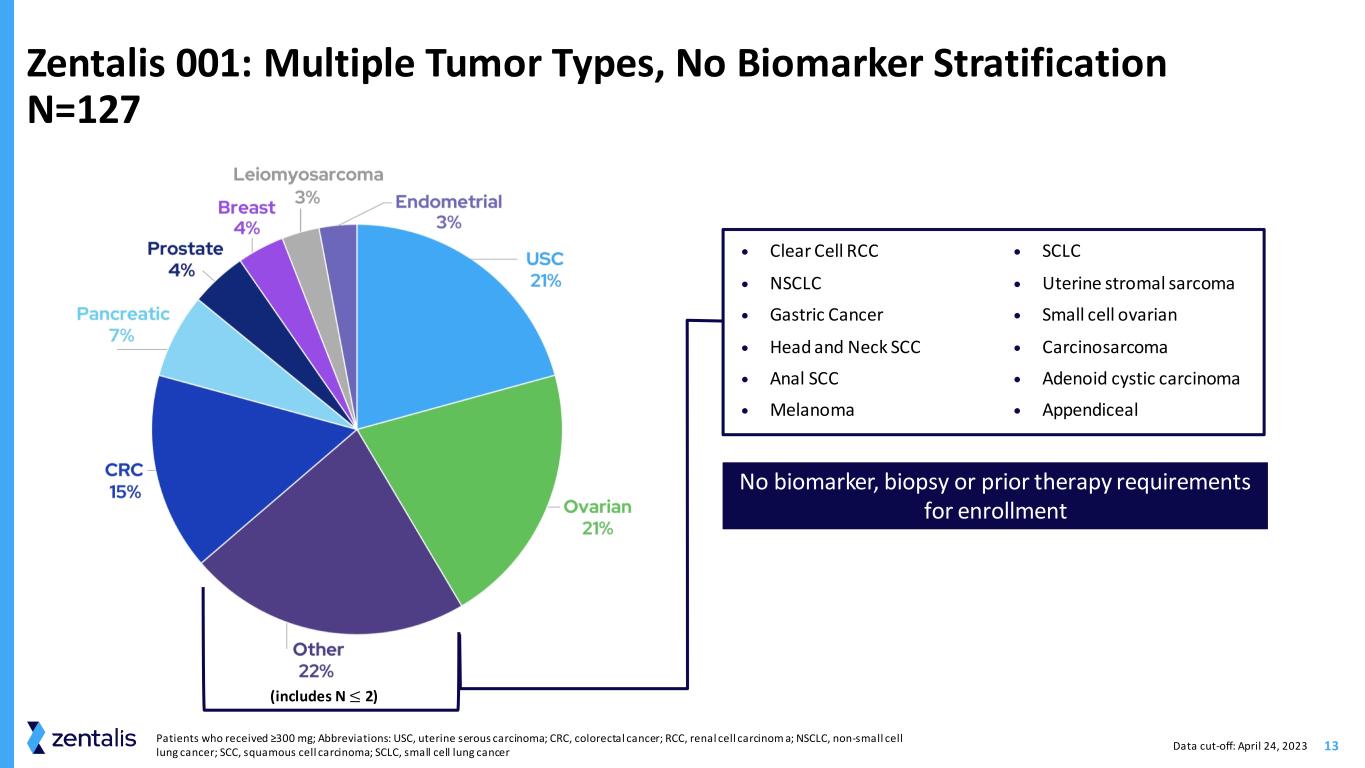
13 Zentalis 001:多种肿瘤类型,无生物标志物分层 N=127 • Clear Cell RCC • NSCLC • 胃癌 • 头颈 SCC • 肛门 SCC • 黑色素瘤 • SCLC • 子宫间质肉瘤 • 小细胞卵巢 • 癌肉瘤 • 腺样囊性癌 • 附录(包括 N ≤ 2)患者没有生物标志物、活检或先前的治疗要求谁接受了≥300 mg;缩写:USC,子宫浆液性癌;CRC,结直肠癌;RCC,肾细胞癌 a;NSCLC,非小细胞肺癌;SCC,鳞状细胞癌;SCLC,小细胞肺癌症数据截止日期:2023 年 4 月 24 日
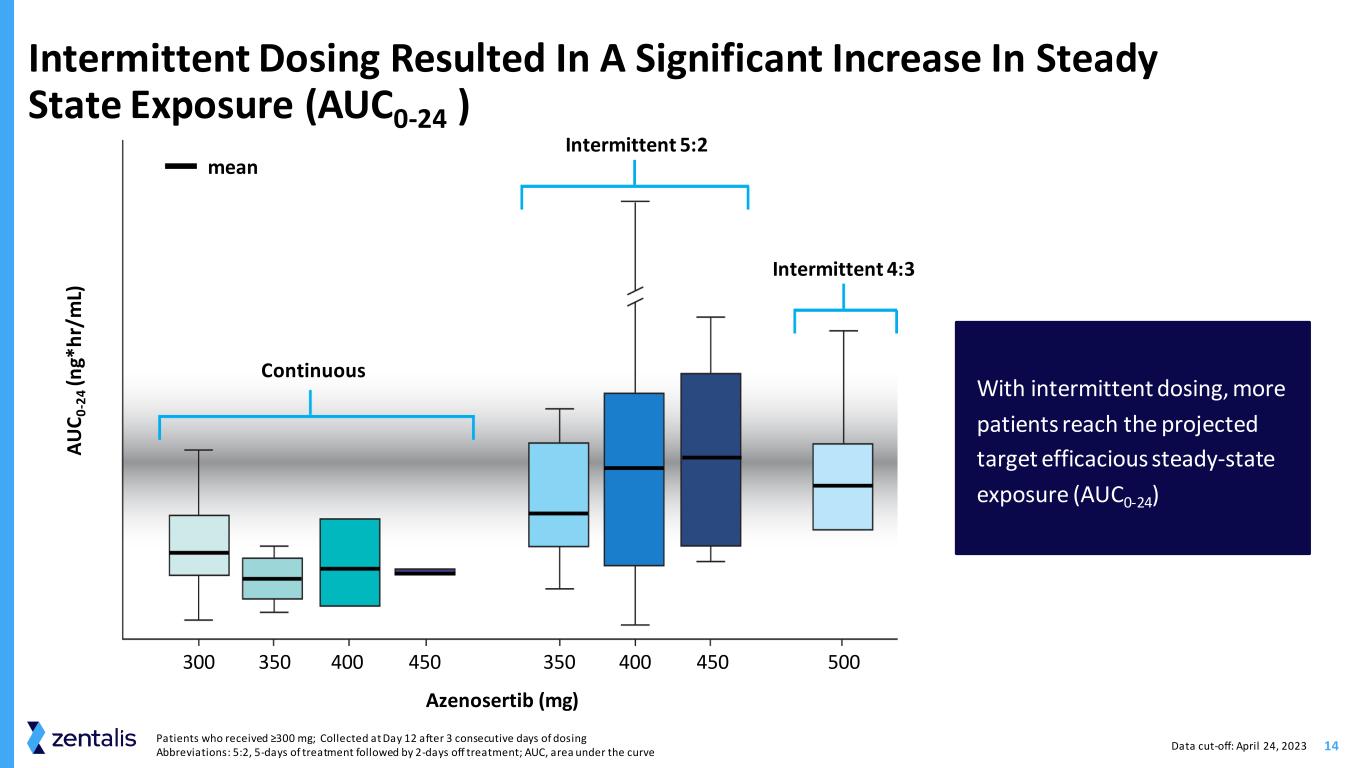
14 位接受 ≥300 mg 的患者;在连续 3 天给药 3 天后在第 12 天采集缩写:5:2 治疗 5 天后休息治疗 2 天;AUC,曲线下方的区域间歇给药导致稳态暴露显著增加 (AUC0-24) 通过间歇给药,更多的患者达到预期的目标有效稳态暴露 (AUC0-24) Azenosertib (mg) 300 350 450 350 400 450 500 连续间歇性给药 5:2 A U C 0 -2 4 (n g* h r/ m L) 意思是间歇性 4:3 数据截止时间:2023 年 4 月 24 日
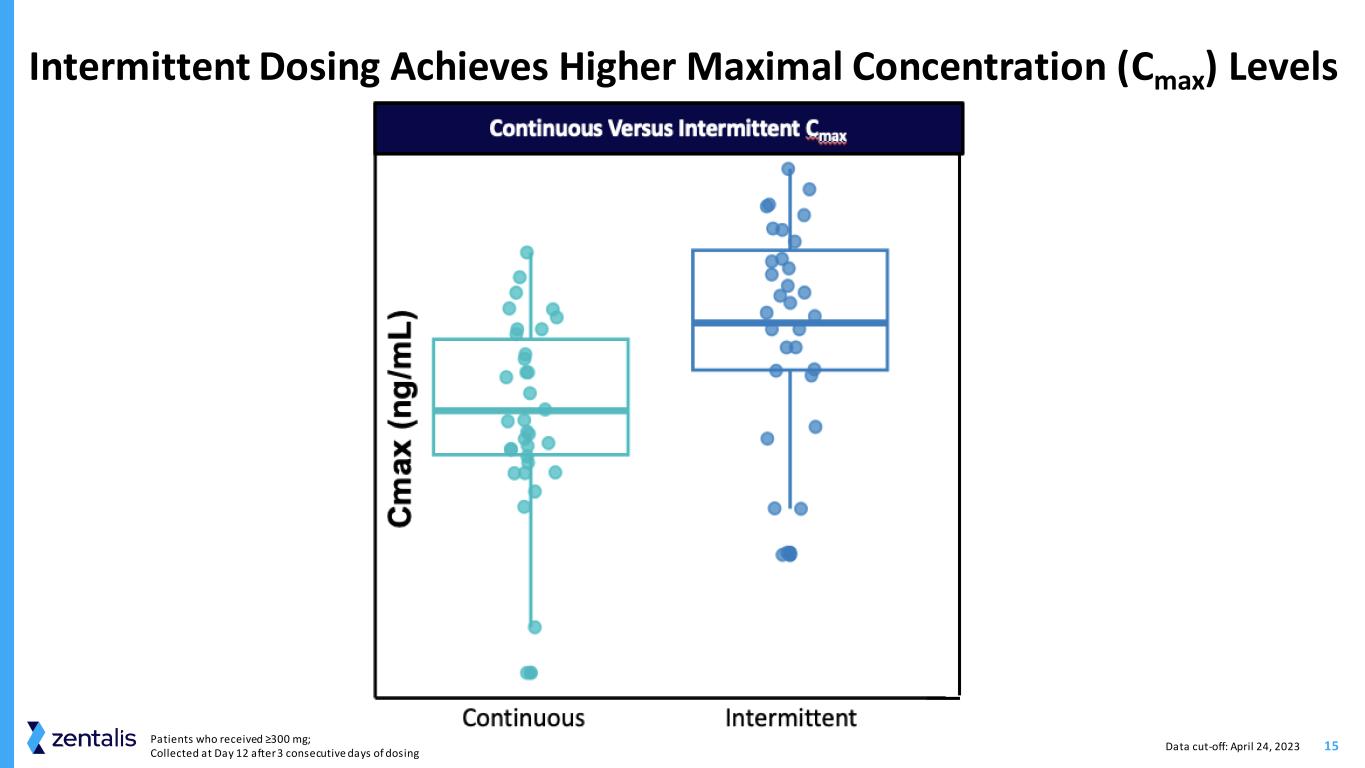
15数据截止时间:2023 年 4 月 24 日接受 ≥300 mg 的患者;在连续 3 天给药后第 12 天采集的患者达到更高的最大浓度 (Cmax) 水平

AZENOSERTIB 单一疗法对卵巢和子宫浆液性癌的疗效
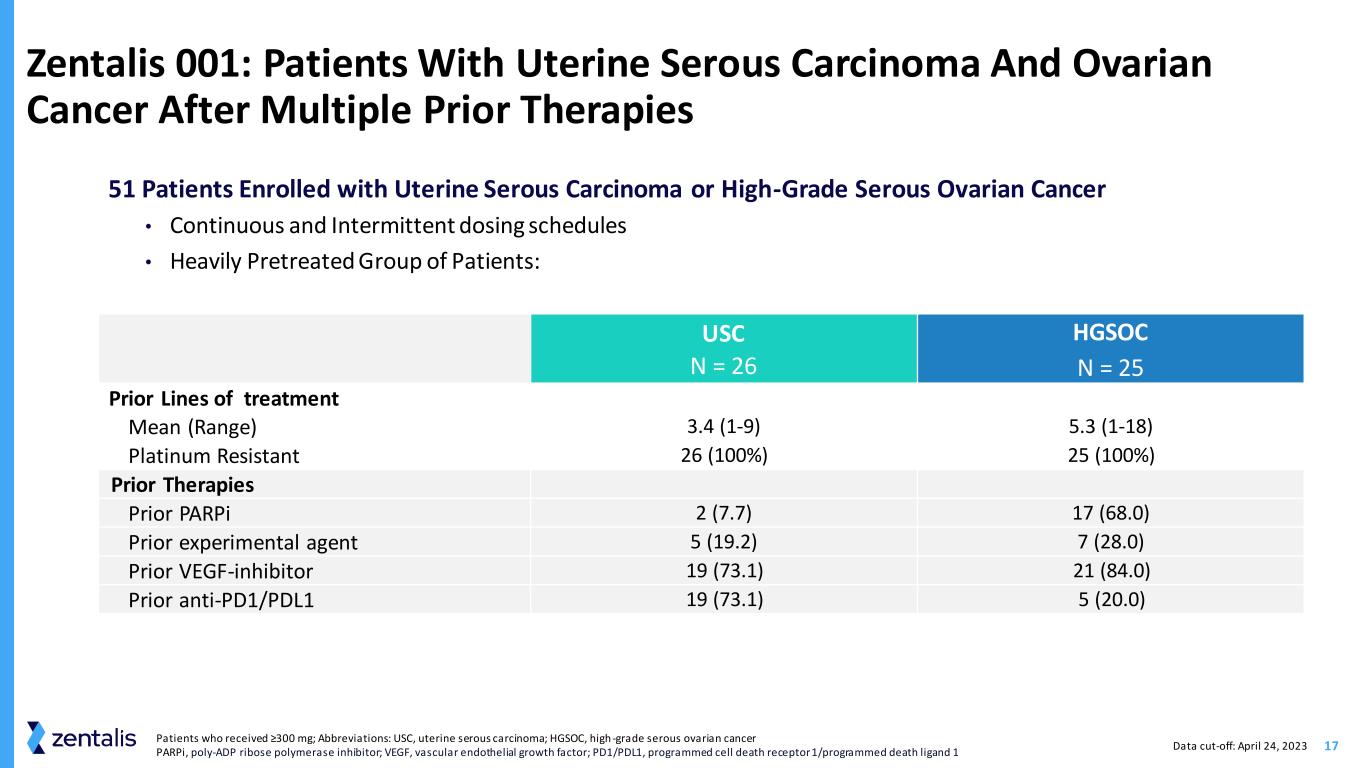
17 Zentalis 001:先前接受过多次治疗的子宫浆液癌和卵巢癌患者 51 名子宫浆液性癌或高级别浆液性卵巢癌入组患者 • 连续和间歇性给药时间表 • 大量预先治疗的患者组:USC N = 26 HGSOC N = 25 条先前治疗线平均值(范围)3.4 (1-9) 5.3 (1-18) 铂耐药性 26 (100%) 25 (100%) 先前疗法 parPi 2 (7.7) 17 (68.0) 先验实验剂 5 (19.2) 7 (28.0) Prior VEGF 抑制剂 19 (73.1) 21 (84.0) Prior anti-pd1/PDL1 19 (73.1) 5 (20.0)接受 ≥300 mg 的患者;缩写:USC,子宫浆液性癌;HGSOC,高级别浆液性卵巢癌 parPI,聚-ADP 核糖聚合酶抑制剂;VEGF,血管内皮生长因子;PD1/PDL1,程序性细胞死亡受体 1/程序性死亡配体 1 数据截止:2023 年 4 月 24 日
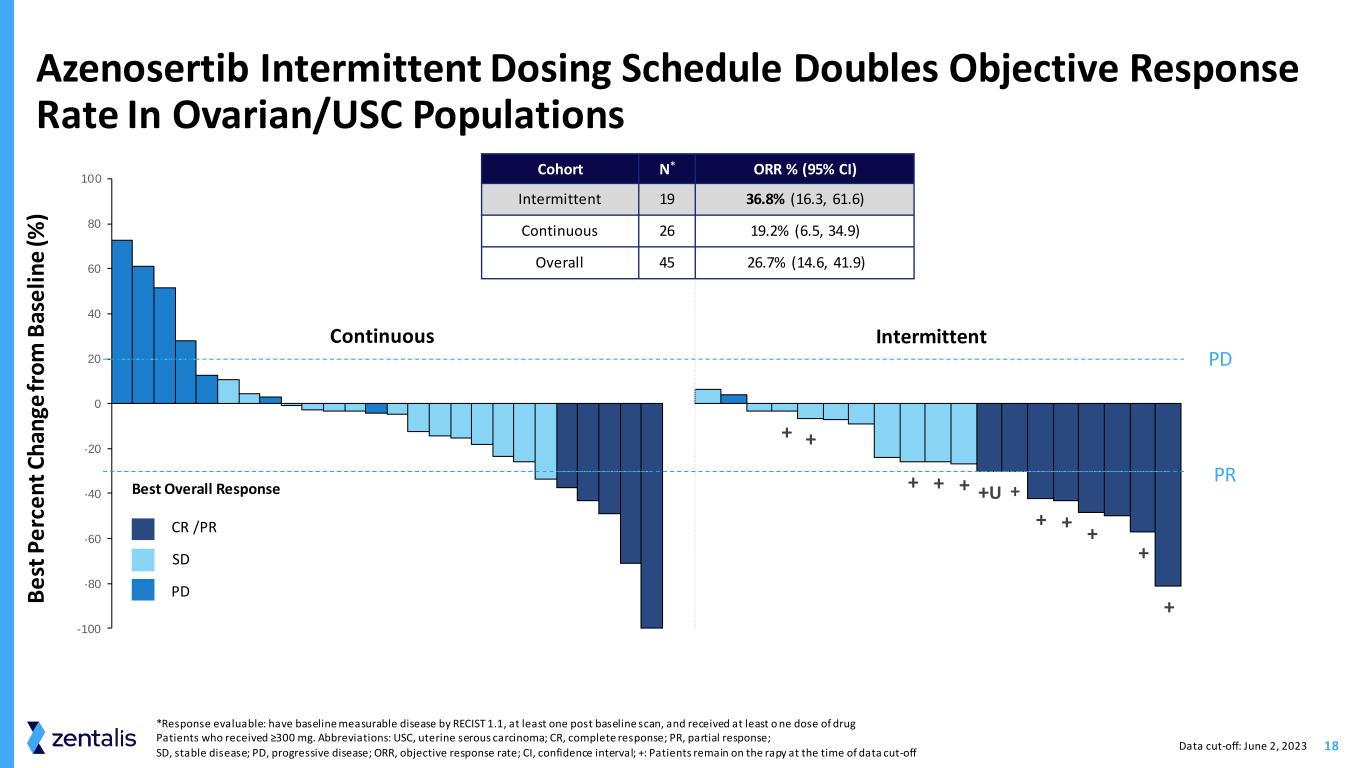
18 Azenosertib 间歇性给药时间表使卵巢/南加州大学人群的客观反应率翻倍数据截止日期:2023 年 6 月 2 日 *反应可评估:使用 RECIST 1.1 进行基线可测量的疾病,至少进行一次基线后扫描,并接受至少一剂药物治疗 ≥300 mg 的患者。缩写:USC,子宫浆液性癌;CR,完全缓解;PR,部分反应;SD,稳定性疾病;PD,进展性疾病;ORR,客观反应率;CI,置信区间;+:数据截止时患者仍处于困境 0 20 40 60 80 -100 -80 -60 -20 40 60 80 100 300 300 450 300 300 300 300 300 300 300 300 300 300 300 350 350 + + + + + + U + + + + + 0 40 60 80 120 160 180 500 500 500 500 400 400 400 400 400 450 450 450 350 350 450 350 450e st p e rc e n t C h an ge o m B as e li n e (%) PR PD 连续间歇性 CR/PR SD PD 最佳整体反应队列 N* ORR% (95% 置信区间) 间歇性 19 36.8% (16.3, 61.6) 连续 26 19.2% (6.5, 34.9) 总体 45 26.7% (14.6, 41.9) +

19 Azenosertib 单一疗法间歇性给药:89% 的卵巢和南加州大学患者在基线扫描中目标病变减少 + + + + + + + + + 基线周 6 周 12 周 18 周 30 周 36 PD PR -100 -90 -80 -60 -50 -40 -10 0 20 20 20 40 50 60 70 80 0 p e rc e t p e rc e tC h an ge Fr o m B as el in e (%) 访问肿瘤类型卵巢南加州大学间歇剂量队列 N* ORR% (95% CI) 卵巢 13 30.8% (9.09-61.4) 子宫浆液癌 6 50% (11.8-88.2) *反应可评估:至少有 RECIST 1.1 可测量的基线疾病一次基线后扫描,并接受了至少一剂药物;接受了≥300 mg的患者。缩写:USC,子宫浆液性癌;HGSOC,高级别浆液性卵巢癌 SD,疾病稳定;PR,部分缓解;ORR,已确认的客观反应率;mPF,无进展存活率中位数;完全缓解;NR,未达到,+:数据切断时患者仍在接受治疗 • 12/19(63%)患者仍在接受治疗 • 随访中位数 4.4 个月 • MPF 为 5.68 个月(2.79,NR) • 10/13(77%)的卵巢癌患者之前曾接受过 PARP 抑制剂数据截止日期:2023 年 6 月 2 日
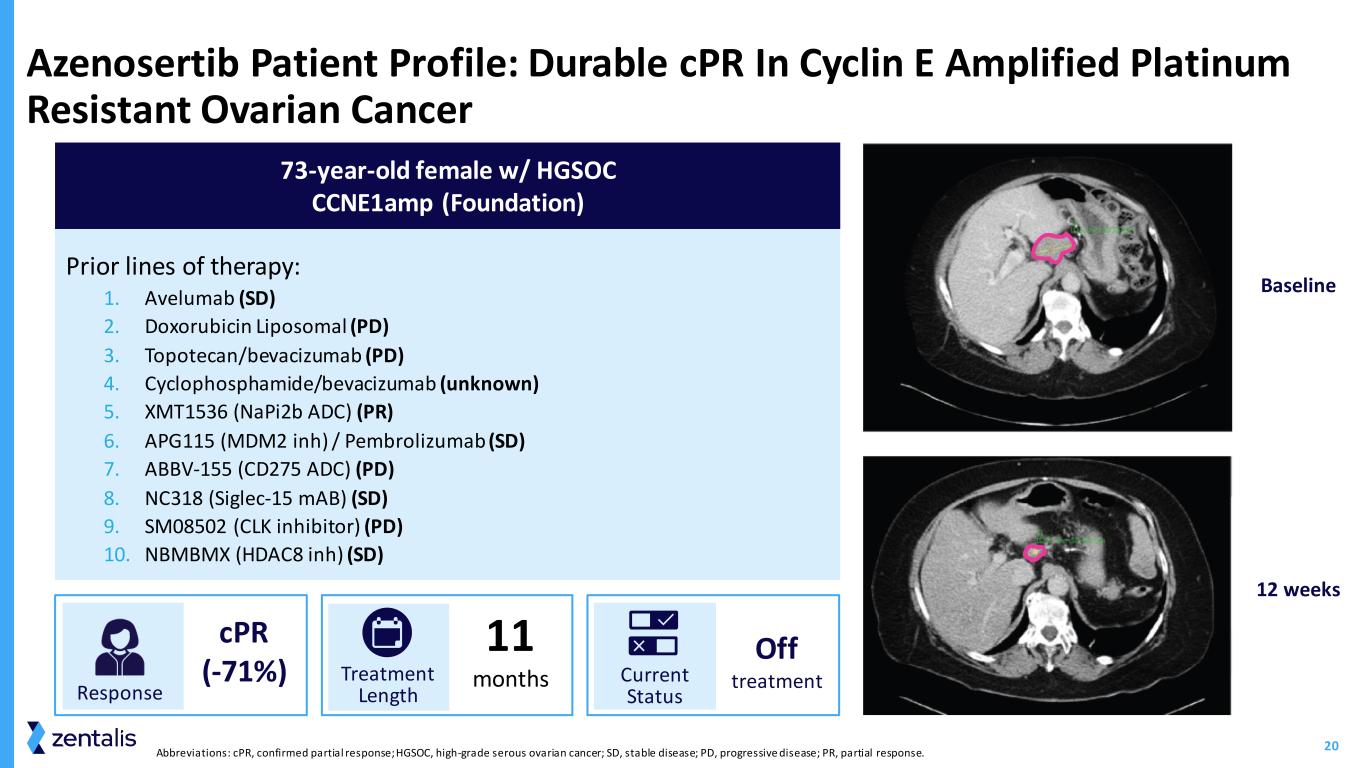
20 缩写:CPR,已确认部分缓解;HGSOC,高级别浆液性卵巢癌;SD,稳定性疾病;PD,进行性疾病;PR,部分缓解。Azenosertib 患者简介:Cyclin E 扩增铂耐药性卵巢癌筛查 Timepoint 2 先前的治疗线索中的持久心肺复苏:1.Avelumab (SD) 2.多柔比星脂质体 (PD) 3.topotecan/bevacizumab (PD) 4.环磷酰胺/贝伐珠单抗(未知)5.XMT1536 (napi2b ADC) (PR) 6.APG115 (mdm2 inh) /pembrolizumab (SD) 7.ABBV-155 (CD275 ADC) (PD) 8.NC318 (Siglec-15 mAb) (SD) 9.SM08502(CLK 抑制剂)(PD) 10.NBMBMX (HDAC8 inh) (SD) TL1:基线 TL1:Timepoint6 73 岁女性患有 HGSOC ccne1amp(基金会)Response cpR(-71%)治疗时长 11 个月当前状态关闭治疗基线 12 周
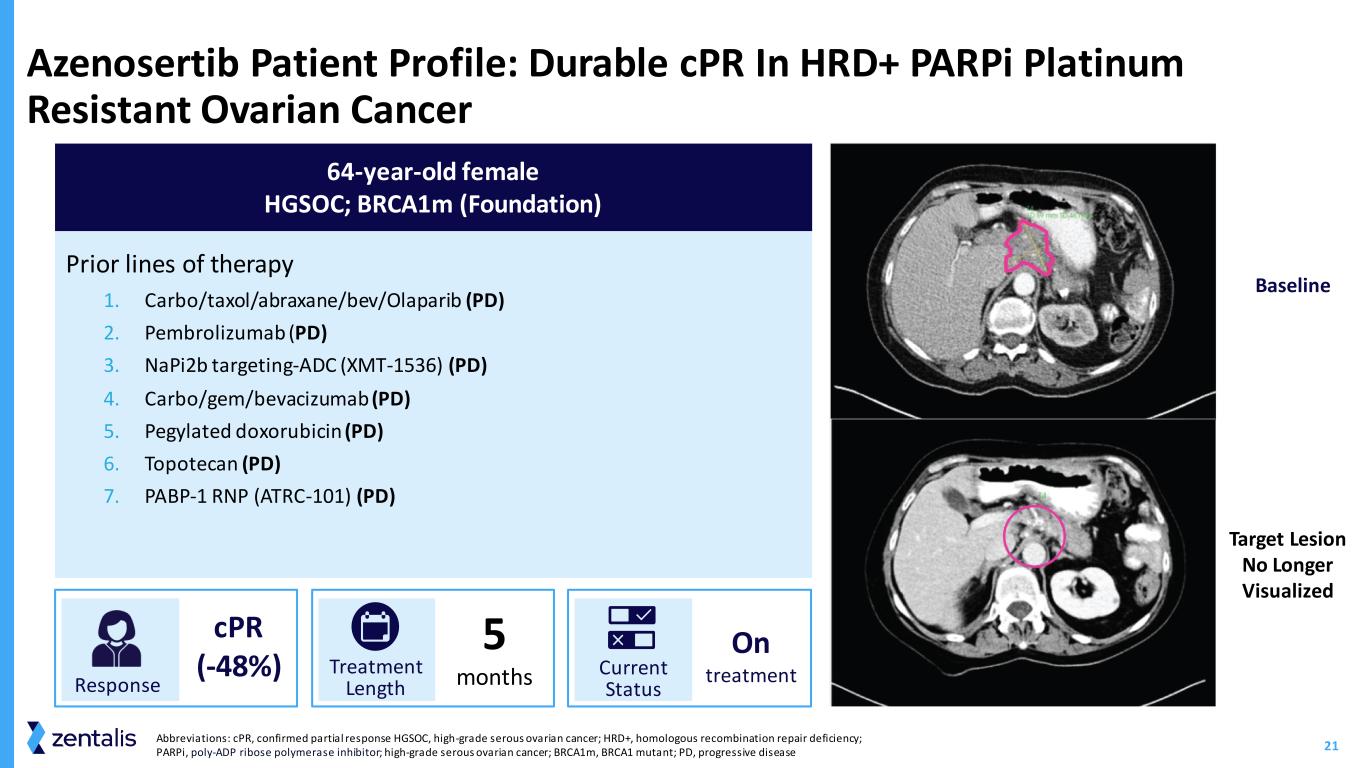
21 Azenosertib 患者简介:HRD+ 中的持久心肺复苏 parPi 铂耐药性卵巢癌筛查 Timepoint 2 目标病变不再可视化先前的治疗线路 1.carbo/taxol/abraxane/bev/Olaparib (PD) 2.pembrolizumab (PD) 3.napi2b Targeting-ADC (XMT-1536) (PD) 4.carbo/gem/bevacizumab (PD) 5.聚乙二醇化多柔比星 (PD) 6.Topotecan (PD) 7.PABP-1 RNP (ATRC-101) (PD) 64 岁女性 HGSOC;brca1M(基金会)反应性心肺复苏(-48%)治疗时长 5 个月治疗现状缩写:CPR,已确认部分缓解 HGSOC,高级别浆液性卵巢癌;HRD+,同源重组修复缺陷;parPi,多重组聚糖聚合酶抑制剂;高级别浆液性卵巢癌;brca1M,BRCA1 突变体;PAD,进展性疾病基线

ZENOTALIS 001 患者 AZENOSERTIB 单一疗法的安全性
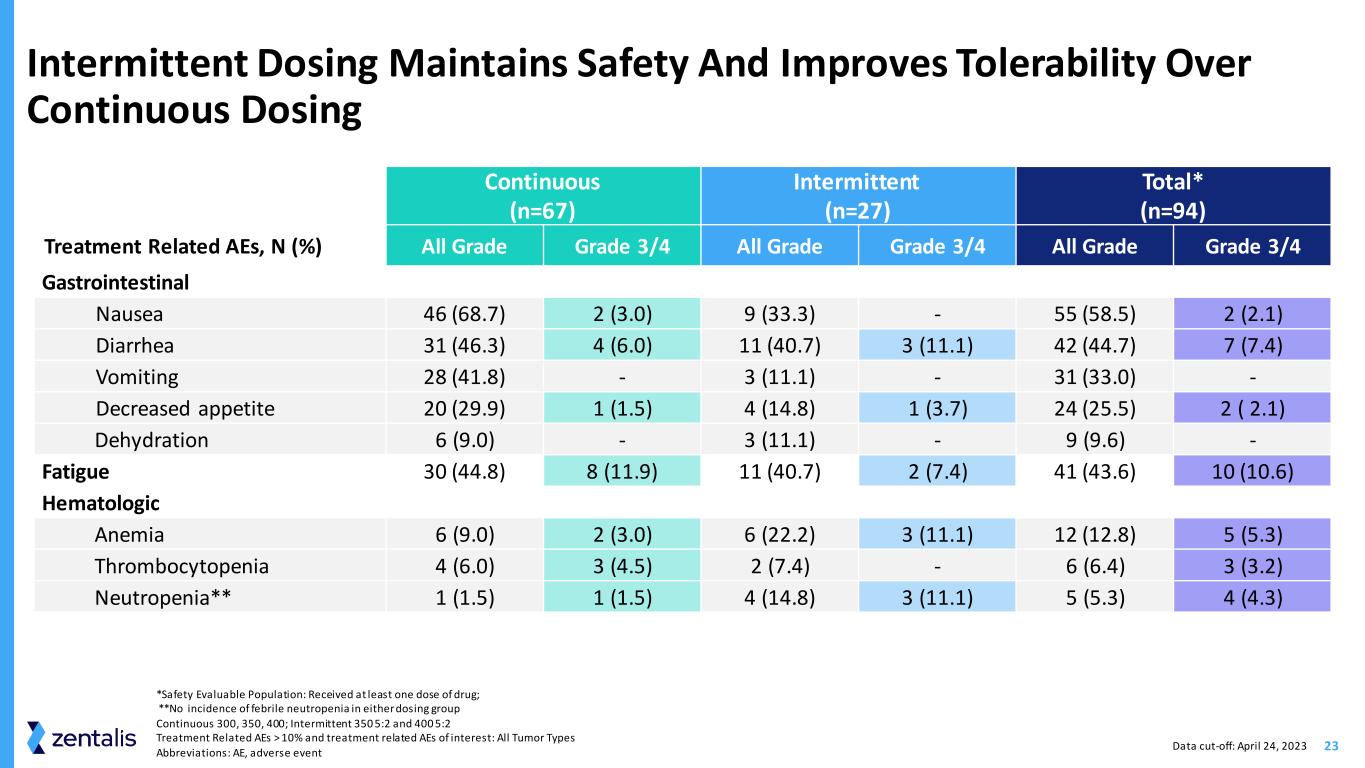
23 间歇给药可保持安全性并提高耐受性连续给药 (n=67) 间歇性给药 (n=27) 总数* (n=94) 治疗相关的 AE,N (%) 所有等级 3/4 所有等级 3/4 所有等级 3/4 胃肠道恶心 46 (68.7) 2 (3.0) 9 (33.3)-55 (58.5) 2 (58.5) 2 (2.1) 腹泻 31 (46.3) 4 (6.0) 11 (40.7) 3 (11.1) 42 (44.7) 7 (7.4) 呕吐 28 (41.8)-3 (11.1)-31 (33.0)-食欲下降 20 (29.9) 1 (1.5) 4 (14.8) 1 (3.7) 24 (25.5) 2 (2.1) 脱水 6 (9.0)-3 (11.1)-9 (9.6)-疲劳 30 (44.8) 8 (11.9)) 11 (40.7) 2 (7.4)41 (43.6) 10 (10.6) 血液学贫血 6 (9.0) 2 (3.0) 6 (22.2) 3 (11.1) 12 (12.8) 5 (5.3) 血小板减少症 4 (6.0) 3 (4.5) 2 (7.4) 3 (3.2) 中性粒细胞减少** 1 (1.5) 1 (1.5) 4 (14.8) 3 (11.1) 5 (5.3)) 4 (4.3) *安全性可评估人群:已接受至少一剂药物;**任一给药组均未出现发热性中性粒细胞减少症连续 300、350、400;间歇性 350 5:2 和 400 5:2 治疗相关 AE > 10% 和治疗相关不良反应:所有肿瘤类型缩写:AE,不良事件数据截止日期:2023 年 4 月 24 日
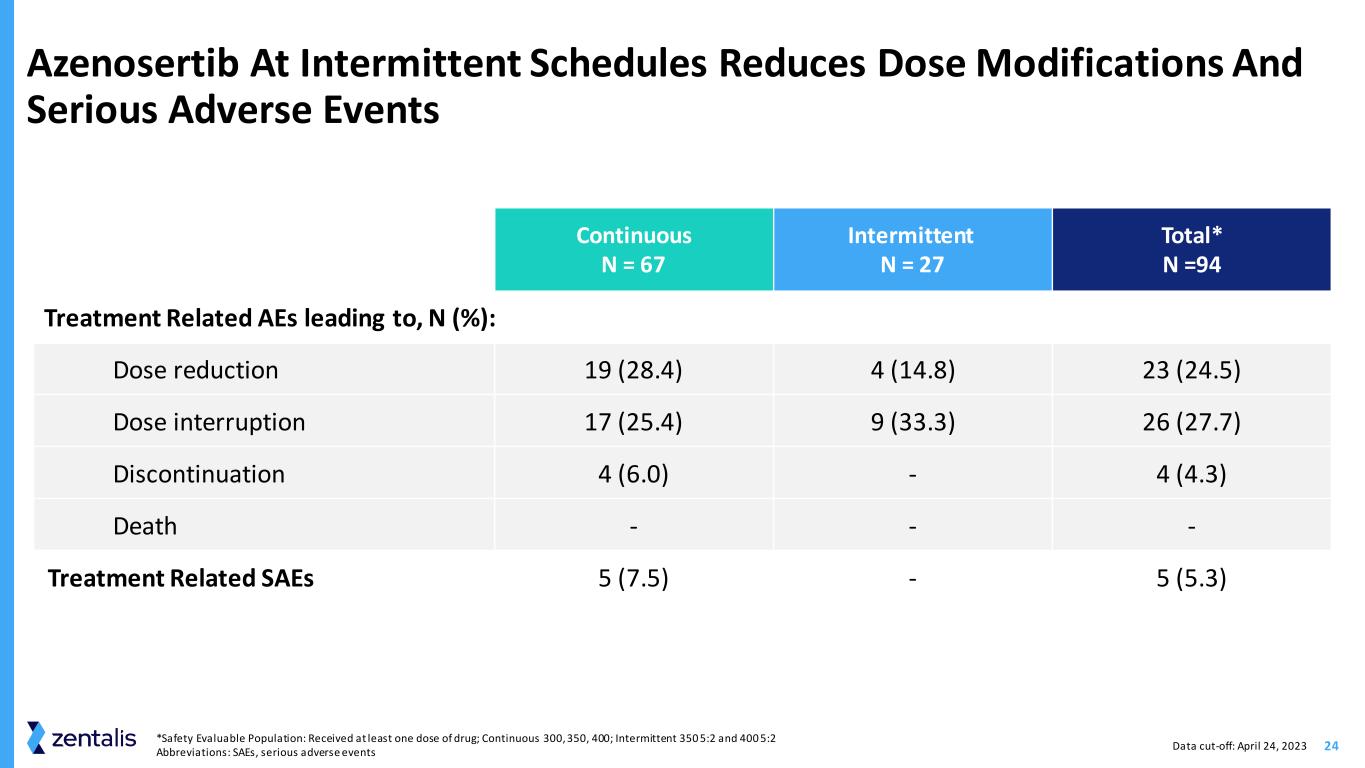
24 *安全性可评估人群:接种了至少一剂药物;连续 300、350、400;间歇性 350 5:2 和 400 5:2 缩写:SAE,间歇性计划下的严重不良事件 Azenosertib 减少剂量调整和严重不良事件持续 N = 67 间歇性 N = 27 总数* N =94 治疗相关不良事件,N (%):剂量减少 19 (28.4) 4 (14.8) 23 (24.5) 剂量中断 17 (25.4) 9 (33.3) 26 (27.7) 停药 4 (6.0)-4 (4.3) 死亡--与治疗相关 SAE 5 (7.5)-5 (5.3) 数据截止日期:2023 年 4 月 24 日
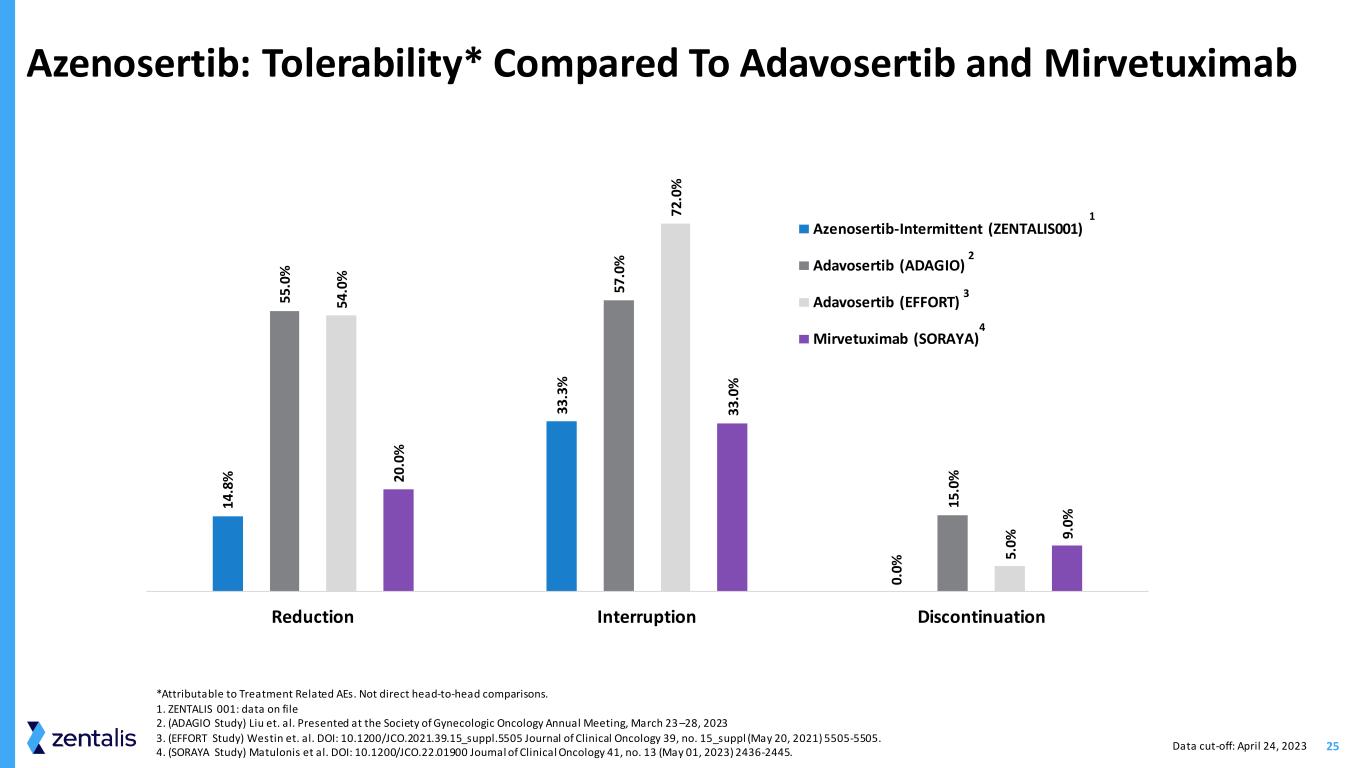
25 Azenosertib:耐受性* 与 Adavosertib 和 mirvetuximab 相比 14 .8% 33 .3% 0. 0% 55 .0% 57 .0% 15 .0% 5 .0% 72 .0% 2 0 .0% 3 3 .0% 9. 0% 减少中断停用 Azenosertib-Inspiratib (ZENTALIS001) Adavosertib (ADAGIO)) Adavosertib(EFFT)Mirvetuximab(SORAYA)1 2 4 3 数据截止日期:2023 年 4 月 24 日 *归因于与治疗相关的 AE。不是直接的正面比较。1.ZENTALIS 001:文件 2 中的数据。(ADAGIO 研究)刘等人在 2023 年 3 月 23 日至 28 日妇科肿瘤学会年会上发表 3.(努力研究)威斯汀等人DOI:10.1200/jco.2021.39.15_Suppl.5505《临床肿瘤学杂志》39,第 15_suppl(2021 年 5 月 20 日)5505-5505。4.(SORAYA Study)Matulonis 等人。DOI:10.1200/JCO.22.01900《临床肿瘤学杂志》41,第 13 期(2023 年 5 月 1 日)2436-2445。

AZENOSERTIB 单一疗法正在进行的南加州大学和卵巢癌研究

27 单一疗法剂量和生物标志物富集是我们临床策略的基础 Cyclin E1 0 0.1 0.3 1 μM Azenosertib p-chk1 Cleaved Caspase-3 γH2ax p-h3 Azenosertib 诱导 DNA 损伤、复制应激和细胞凋亡的标志物* *OVCAR3 Cyclin E1 阳性细胞,16 小时治疗高度基因组不稳定性可能由细胞周期蛋白引起 E1+ 肿瘤 • Cyclin E1+ 通过与 CDK2 的合作推动加速进入 S 期 • 复制机制超负荷,导致基因组不稳定同源重组修复缺陷 (HRD+) 肿瘤 •由于肿瘤无法修复双链 DNA 断裂,导致基因组不稳定。基因组不稳定性高的肿瘤对 Azenosertib 敏感
28 Zentalis 004(TETON):Azenosertib 单一疗法对晚期子宫浆液性癌的女性进行终点 NCT04814108 患者(N=130)Azenosertib 400 mg QD 5:2 关键资格:复发性或持续性 USC;先前有 HER-2 针对已知 HER-2+ 的定向治疗;先前的抗PDL-1;可测量的疾病;ECOG PS 0-1;先前没有 WEE1 抑制剂;之前没有细胞周期检查点抑制剂。DOR 安全性和耐受性 ORR 目前正在累积——美国食品药品管理局快速通道名称缩写:2L,两行;USC,子宫浆液癌;ECOG PS,东部合作肿瘤学小组绩效得分;QD,每天一次;5:2,治疗 5 天后休息;ORR,客观反应率;DOR,反应持续时间
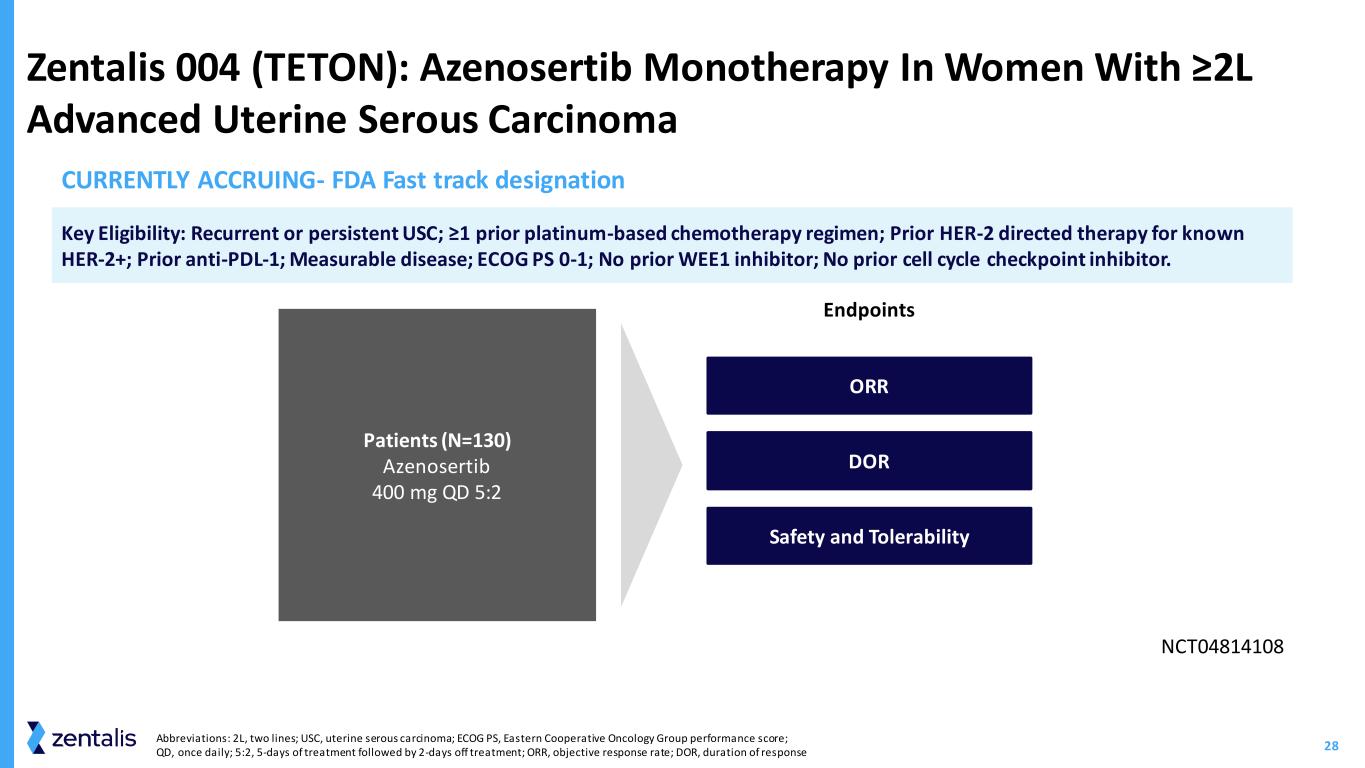
29 Zentalis 005 (DENALI):评估 CCNE1 扩增和细胞周期蛋白 E1+ 对耐铂高级浆液性卵巢癌终点 (ICR) 队列 2B (N=80) CCNE1 非扩增和细胞周期蛋白 E1+ 队列 2C (N=40) CCNE1 非扩增和细胞周期蛋白 E1-队列 2A (N=60) CCNE1 扩增和细胞周期蛋白 E1+ 队列 1 (N=30) 扩增和/或 Cyclin E1+ Azenosertib 400 mg QD 5:2 关键资格:高级别浆液性卵巢癌;ECOG PS 0-1;铂耐药(不包括铂难治性);先前有 1-3 条化疗线路;RECIST v 1.1 中可测量的疾病;Cyclin E1 NCT05128825 CCNE1IHC+ 和/或 CCNE1 已放大。目前正在累积 ORR DOR DOR ORR DOR DOR DOR 缩写:ECOG PS,东方合作肿瘤小组表现得分;RECIST,实体 t 肿瘤的反应评估标准;QD,每天一次;5:2,治疗 5 天,休息 2 天;ORR,客观反应率;DOR,反应持续时间;ICR,独立中央评论
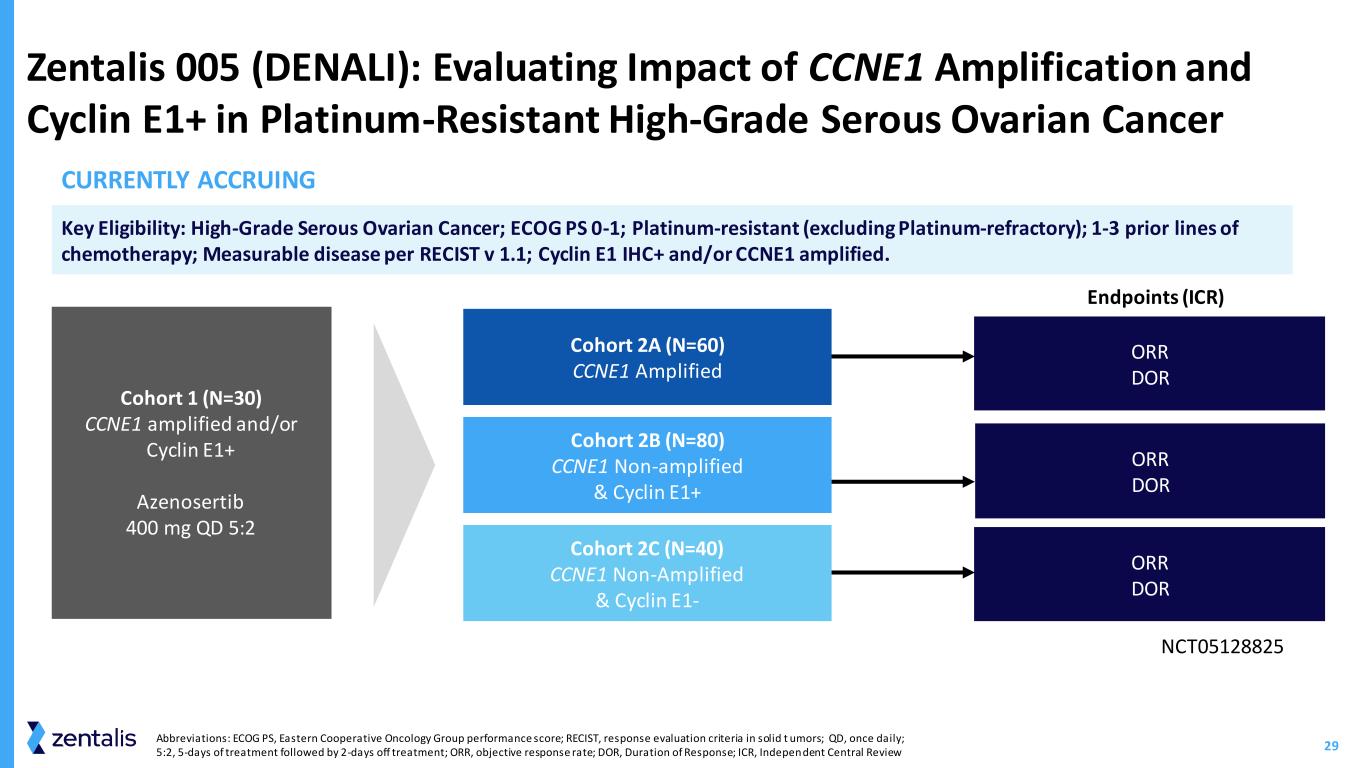
30 个缩写:parPI,Poly-ADP 核糖聚合酶抑制剂;QD,每天一次;5:2 治疗 5 天,然后休息 2 天;PFS,无进展存活率;ORR,客观反应率 Zentalis 006(MAMOTH):azenosertib 与尼拉帕尼联合使用或作为单一疗法治疗parP患者的修订版 1/2 期研究耐药性卵巢癌终点 Azenosertib + niraparib 交替方案 Azenosertib 单一疗法 400 mg QD 5:2 Azenosertib + niraparib 同时给药 NCT05198804 Rollant* (N=138) *根据空位可用性关键资格进行入组:复发性高度上皮性卵巢癌、原发性腹膜癌或输卵管癌(浆液性、透明细胞癌或子宫内膜样癌);1 — 5 条先前患有晚期/转移性疾病;铂疗法(铂耐药)后 6 个月内复发,在服用至少 3 个月的 parPi 作为维持治疗后进展。ORR 安全性和耐受性 PFS、DOR 目前正在累积

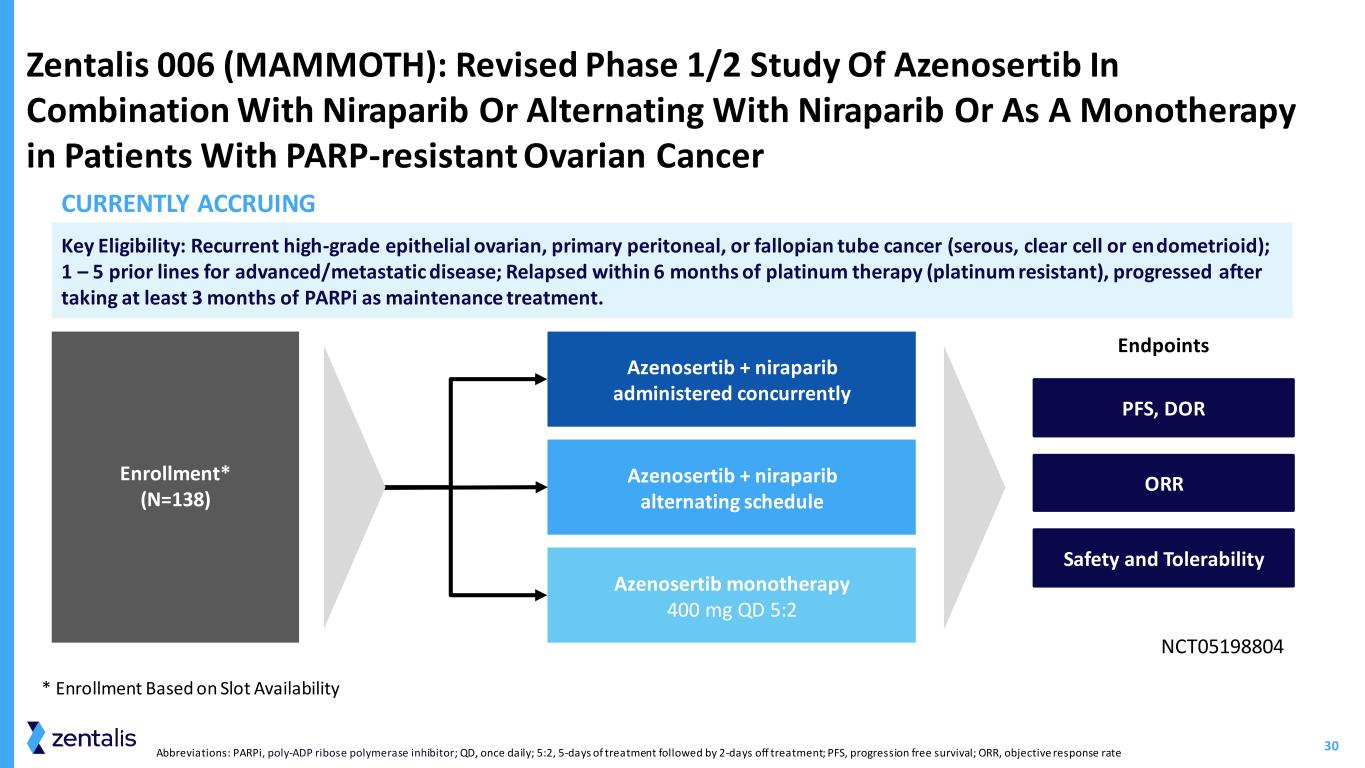
31 • 根据临床安全性和有效性选择按照 5:2 时间表选择的 2 期推荐剂量为 400 mg • 2H23 中单药疗效数据和临床试验时间表间歇给药的卵巢和子宫浆液癌的确诊反应率为 36.8% * 大多数患者仍在接受间歇治疗 Azenosertib 是卵巢癌和南加州大学的高活性药物,具有良好的安全性 *反应可评估患者(已接受至少一次)scan) 南加州大学,子宫浆液癌

AZENOSERTIB 化疗组合

33 在 WEE1 抑制剂 Azenosertib (zn-c3) 联合化疗 (CT) 治疗铂耐药或难治性卵巢癌、腹膜癌或输卵管癌 (EOC) 患者 (pts) 的 1b 期剂量递增研究中 Cyclin E1 表达与临床结局的相关性 Joyce Liu1、Siqing Fu2、Gary Richardson2 3、Zivko Vranjes4、Tarek Meniawy5、Catherine Shannon6、Erika P. Hamilton7、Stephanie Blank8、Cara Mathews9、Jasmina Alidzanovic10、Rossitza Krasteva11、Qing Shi13、Olivier Harismendy13、Mieke Ptaszynski14、Shannon N. Westin22Funda Meric-Bernstam2,Premal H.Thaker15 1Dana Farber 癌症研究所,马萨诸塞州波士顿 2德克萨斯大学医学博士安德森癌症中心;澳大利亚马尔文3卡布里尼医院;4波斯尼亚和黑塞哥维那塞族共和国大学临床中心;5线性癌症研究,澳大利亚珀斯西澳大利亚大学;6Mater 医院,澳大利亚布里斯班;7田纳西肿瘤学,莎拉·坎农研究所,田纳西州纳什维尔;8位于纽约州纽约市西奈山的伊坎医学院;9罗得岛州普罗维登斯市罗德岛妇幼医院;10波斯尼亚和黑塞哥维那图兹拉大学临床中心;保加利亚帕纳久里什特 11Uni 医院;纽约州纽约 13Zentalis Pharmicals;纽约州纽约市 14formerLyzentalis Pharmicals;密苏里州圣路易斯华盛顿大学 15Siteman 癌症中心摘要 #5513 Poster Bd #208

34 *吉西他滨 + Azenosertib 具有令人兴奋和持久的活性——MTD 尚未确定,更多剂量队列正在进行中。缩写:RP2D,推荐第 2 期剂量;PLD 聚乙二醇化脂质体多柔比星;QD,每日一次;5:2 治疗 5 天,然后休息 2 天;D,day;AUC,曲线下方区域;mg/ml*min 主要要点 • 跨化疗主干的强效信号——corR 为 34%;cdoR 为 8.3 个月;mpF 为 9.0 个月(反应可评估=94) • Cyclin E1 状态预测了在化疗中加入 azenosertib 的益处 • 表明 azenosertib 可恢复经过大量预先治疗的耐铂卵巢癌 RP2D 的化疗敏感性Azenosertib 化疗紫杉醇 300 mg QD 5:2 80 mg/m2 在 D1、D8、D15(28 天周期)Carboplatin 200 mg QD 5:2 AUC=5 在 D1(21 天周期)吉西他滨 TBD* TBD* PLD 400 mg QD 5:2 40 mg/m2 D1(28 天周期)数据截止日期:2023 年 4 月 10 日为 pacaxlitaxel 制定 RP2D Azenosertib 与化疗联合使用 Azenosertib 具有活性,具有良好的耐受性
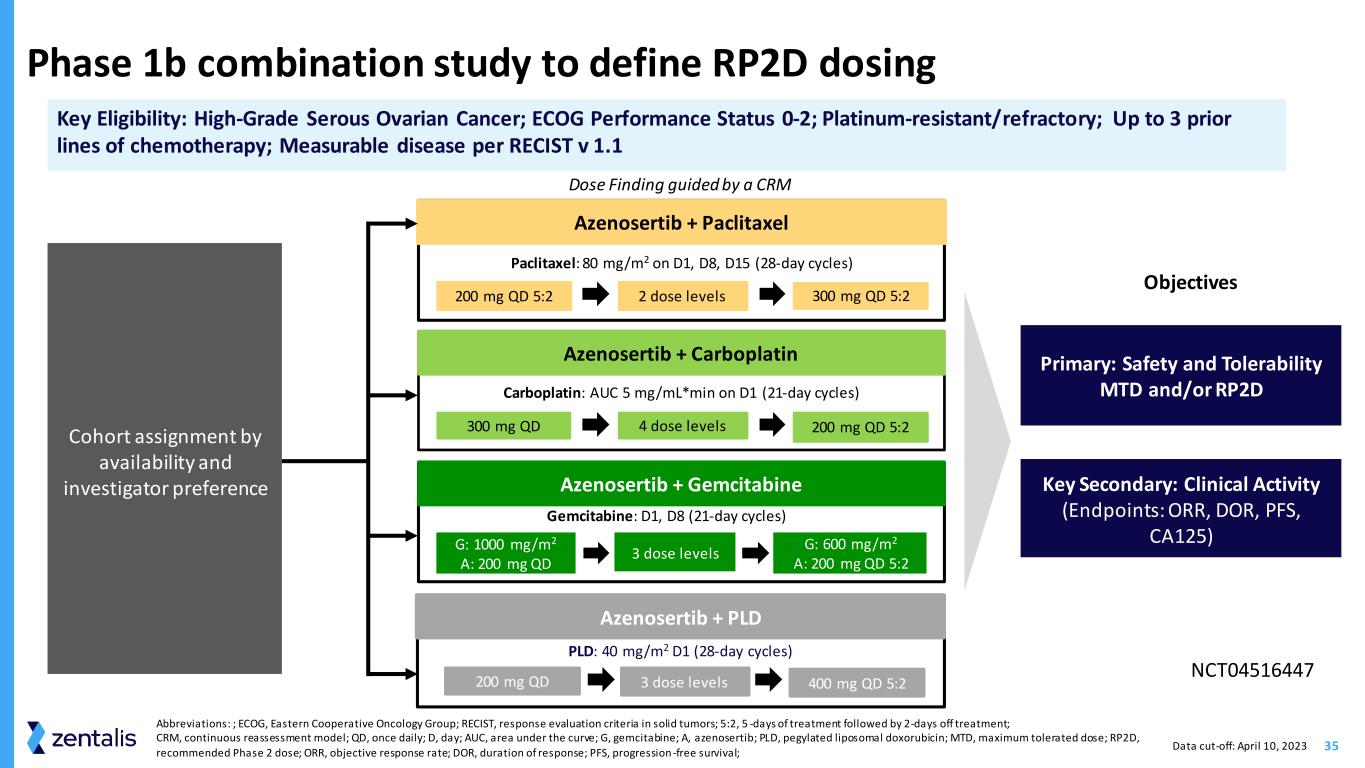
35 定义 RP2D 剂量 Azenosertib + Paclitaxel 200 mg QD 5:2 2 剂量水平 300 mg QD 5:2 Azenosertib + 吉西他滨 Azenosertib + PLD 200 mg QD 3 剂量水平按可用性和研究者偏好划分队列分配紫杉醇:D1、D8、D15(28 天周期)目标 Azenosertib tib + Carboplatin 300 mg QD 吉西他滨:D1、D8(21 天周期)4 剂量等级 200 mg QD 5:2 卡铂:AUC 5 mg/ml*min 在 D1(21 天周期)G:1000 mg/m2 A:200 mg QD 5:2 PLD:40 mg/m2 D1(28 天周期)-day cycles) 以 CRM 关键资格为指导的剂量发现:高级别浆液性卵巢癌;ECOG 表现状态 0-2;铂耐药/难治性;最多 3 条之前的化疗线路;RECIST v 1.1 主要:安全性和耐受性 MTD 和/或 RP2D 关键次要:临床活动(终点:ORR、DOR、PFS、CA125)NCT04516447 缩写:;ECOG,东方合作肿瘤小组;RECIST,反应评估标准在实体瘤中;5:2,治疗5天后休息2天;CRM,持续重新评估模型;QD,一次每日;D,天;AUC,曲线下方区域;G,吉西他滨;A,azenosertib;PLD,聚乙二醇化脂质体多柔比星;MTD,最大耐受剂量;rp2D,推荐第 2 阶段剂量;ORR,客观反应率;DOR,反应持续时间;PFS,无进展存活率;数据截止时间:2023 年 4 月 10 日
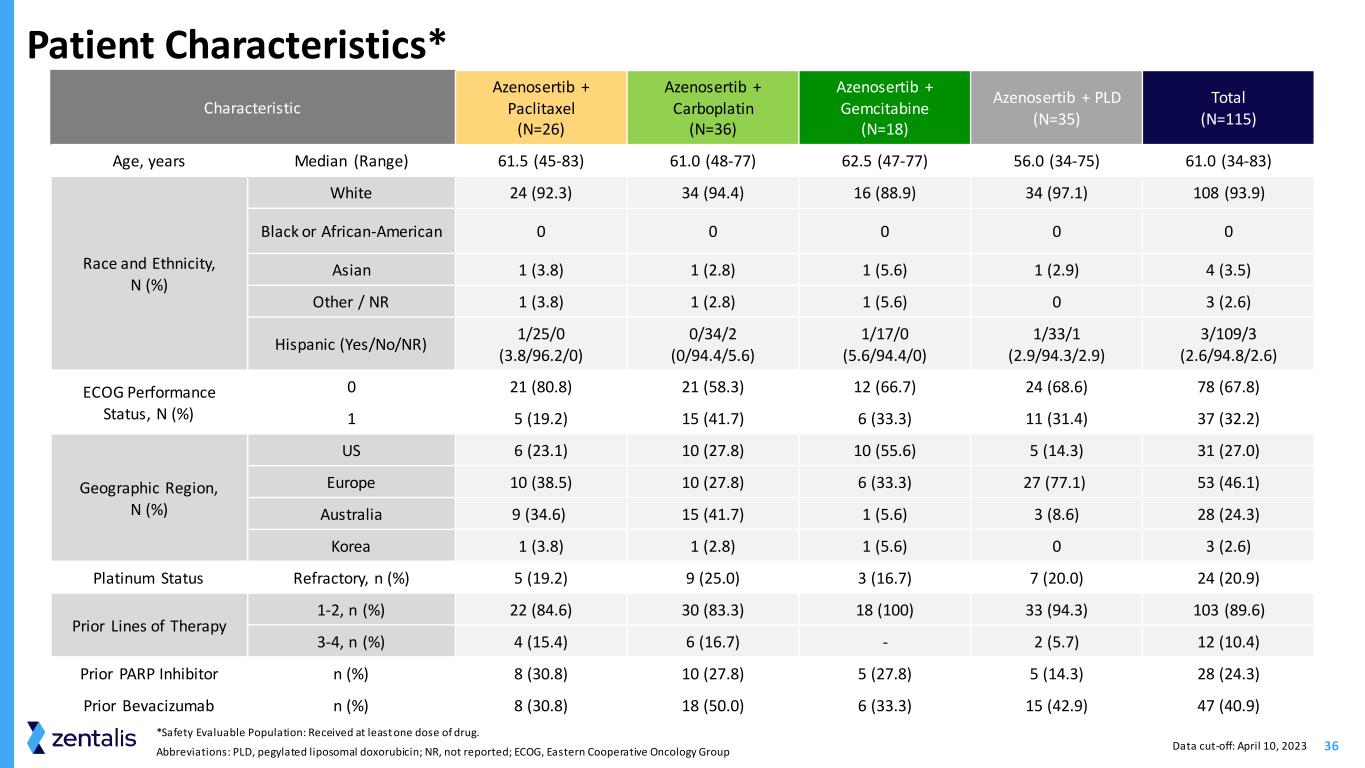
36 *安全性可评估人群:已接受至少一剂药物。缩写:PLD,聚乙二醇化脂质体多柔比星;NR,未报道;ECOG,东方合作肿瘤学小组患者特征* 特征 Azenosertib + 紫杉醇 (N=26) Azenosertib + Carboplatin (N=36) Azenosertib + PLD (N=35) Total (N=35) =115) 年龄、年份中位数(范围)61.5 (45-83) 61.0 (48-77) 62.5 (47-77) 56.0 (34-75) 61.0 (34-83) 种族和民族,N (%) 白人 24 (92.3) 34 (88.9) 34 (98.9) 34 (97.1) 108 (93.9) 0 0 0 亚洲人 1 (3.8) 1 (2.8) 1 (5.6) 1 (2.9) 4 (3.5) 其他/NR 1 (3.8) 1 (2.8)) 1 (5.6) 0 3 (2.6) 西班牙裔(是/no/nR)1/25/0 (3.8/96.2/0) 0/34/2 (0/94.4/5.6) 1/17/0 (5.6/94.4/0) 1/33/1 (2.9/94.3/2.9) 3/109/3 (2.6/94.8/2.6) ECOG 绩效状态,N (%) 0 21 (80.8) 21 (58.3) 12 (66.7) 24 (68.6) 78 (67.8) 1 5 (19.2) 15 (41.7) 6 (33.3) 11 (31.4) 37 (32.2) 地理区域,N (%) 美国 6 (23.1) 10 (27.8) 10 (55.6) 5 (14.3) 31 (27.0) 欧洲 10 (38.5) 10 (27.8) 6 (33.3) 27 (77.1) 53 (46.1) 澳大利亚 9 (34.6) 15 (41.7) 1 (5.6) 3 (8.6) 28 (24.3) 韩国 1 (3.8) 1 (2.8) 1 (5.6) 0 3 (2.6) 铂金身份耐火材料,n (%) 5 (19.2) 9 (25.0) 3 (16.7) 7 (20.0) 24 (20.9) 先验疗法 1-2、n (%) 22 (84.6) 30 (83.3) 18 (100) 33 (94.3) 103 (89.6) 3-4、n (%) 4 (15.4) 6 (16.7)-2 (5.7) 12 (10.4) PARP 抑制剂 n (%) 8 (30.8) 10 (27.8) 5 (27.8) 5 (27.8) (5) 14.3) 28 (24.3) Prior Bevacizumab n (%) 8 (30.8) 18 (50.0) 6 (33.3) 15 (42.9) 47 (40.9) 数据截止日期:2023 年 4 月 10 日
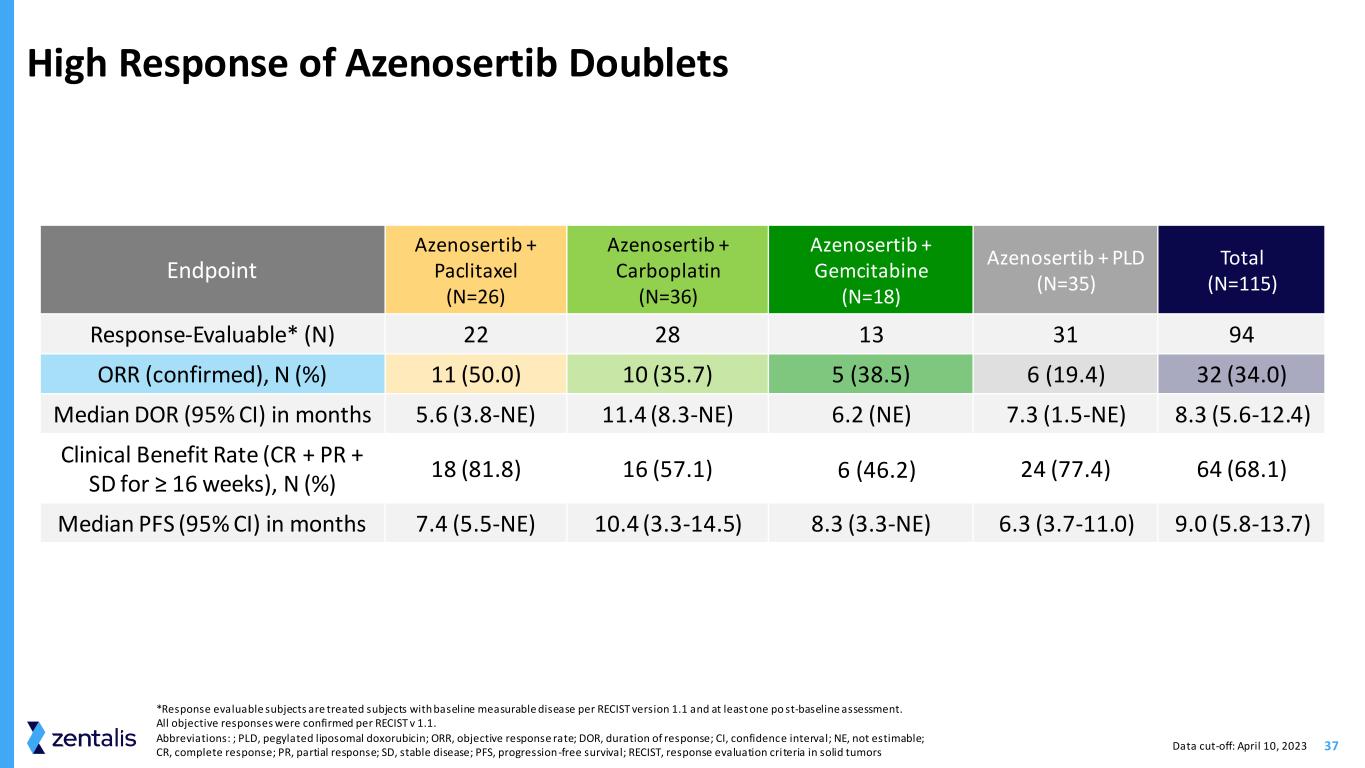
37 Azenosertib Doublets 的高响应 Endpoint Azenosertib + paclitaxel (N=26) Azenosertib + Carboplatin (N=36) Azenosertib + PLD (N=35) Total (N=115) Responsertib + PLD (N) 22 28 13 31 94 ORR(已确认),N (%) 11 (50.0) 10 (35.7) 5 (38.5) 6 (19.4) 32 (34.0) 5.6 (3.8-NE) 11.4 (8.3-NE) 6.2 (NE) 7.3 (1.5-NE) 8.3 (5.6-12.4) 临床受益率 (CR + PR + SD ≥ 16 周),N (%) 18 (81.8) 16 (57.1) (67.1) (6) 46.2) 24 (77.4) 64 (68.1) 7.4 (5.5-NE) 7.4 (5.5-NE) 10.4 (3.3-14.5) 8.3 (3.3-NE) 中位数 PFS (95% 置信区间)6.3 (3.7-11.0) 9.0 (5.8-13.7) *根据RECIST 版本 1.1 和至少一次后基线评估,可评估反应的受试者是接受过基线可测量疾病的受试者。根据 RECIST v 1.1,所有客观回应均得到证实。缩写:;PLD,聚乙二醇化脂质体多柔比星;ORR,客观反应率;DOR,反应持续时间;CI,置信区间;NE,不可估计;CR,完全反应;SD,稳定性疾病;PFS,无进展存活率;RECIST,实体瘤反应评估标准数据截止日期:2023 年 4 月 10 日

38 缩写:PLD,聚乙二醇化脂质体多柔比星;PFS,无进展存活率;m,月。Kaplan-Meier 无进展存活率曲线:持久反应 0 0.0 0.2 0.4 0.6 0.8 1.0 5 10 15 20 20 P ro gr si o n-F re e rv al lo b ili ty Median PFS(月)Azenosertib 与 Time(月)有风险的患者 35 36 26 18 18 8 11 4 7 4 1 1 0 0 0 1 paclitaxel PLD Carboplatin Gemital PFS(月)Azenosertib 与 Time(月)联合使用 Azenosertib 与 Time(月)处于危险的患者 35 36 26 18 8 11 4 7 4 1 1 0 0 6.28 m PLD (N=35) 紫杉醇 (N=26) 7.36 m 吉西他滨 (N=18) 8.31 m Carboplatin (N=36) 10.35 m 数据截止日期:2023 年 4 月 10 日
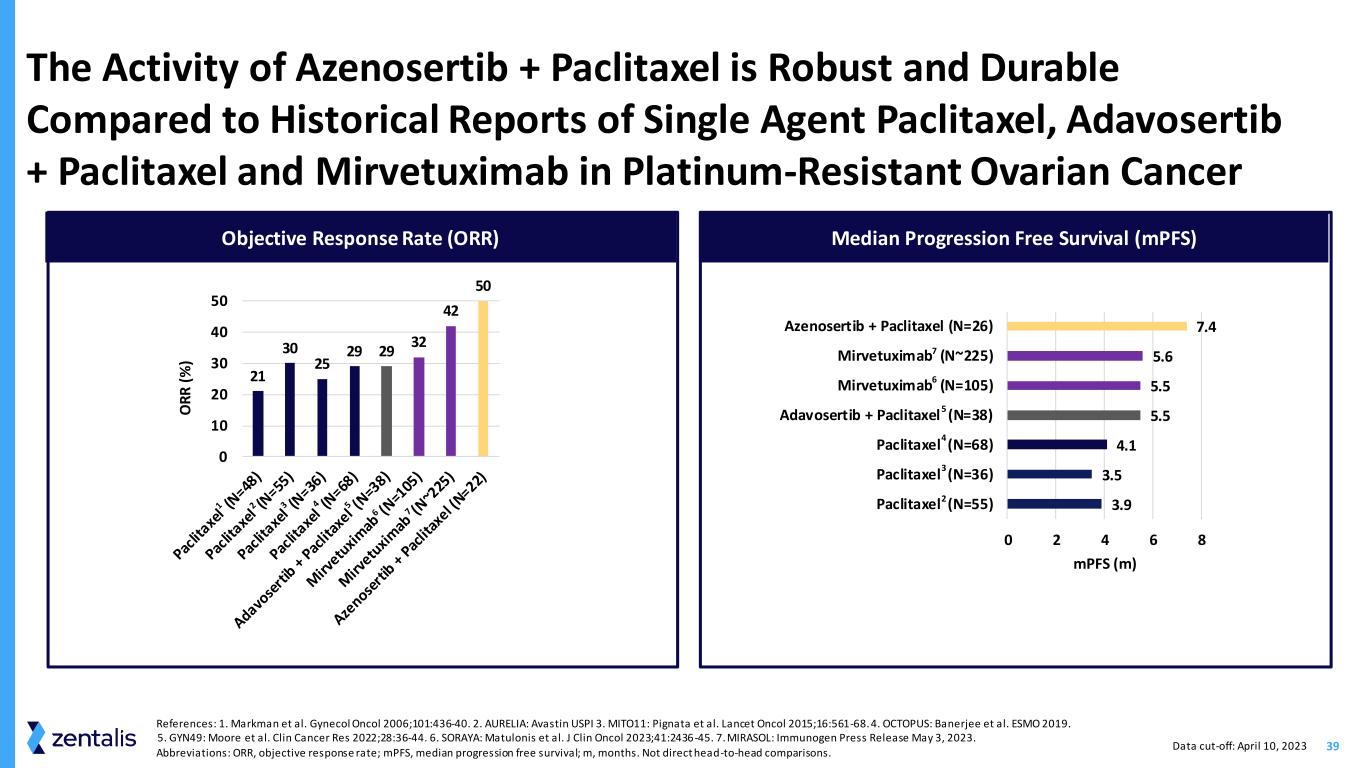
39 21 30 25 29 32 42 50 0 10 20 30 40 50 O R R (%) 与单药紫杉醇、Adavosertib + 紫杉醇和米尔韦妥昔单抗在耐铂卵巢癌中的历史报道相比,Azenosertib + 紫杉醇的活性既强劲又耐用 3.9 3.5 4.1 5.5 5.5 5.6 7.4 0 2 4 6 8 紫杉醇(N=55)紫杉醇 (N=36) 紫杉醇 (N=68) Adavosertib + 紫杉醇 (N=38) Mirvetuximab (N=105) Mirvetuximab (N~225) Azenosertib + Paclitaxel (N=26) mpF (m) 客观反应率 (ORR) 中位无进展存活率 (MPF) 参考文献:1.马克曼等Gynol Oncol 2006;101:436-40。2.AURELIA:Avastin USPI 3。MITO11:Pignata 等人。Lancet Oncol 2015;16:561-68。4.章鱼:Banerjee 等人。ESMO 2019。5.GYN49:Moore 等人。2022 年 Clin Cancer Ress;28:36-44。6.SORAYA:Matulonis 等人。J Clin Oncol 2023;41:2436-45. 7.MIRASOL:免疫原新闻稿 2023 年 5 月 3 日。缩写:ORR,客观反应率;mPF,无进展存活率中位数;m,月。不是直接的正面比较。数据截止日期:2023 年 4 月 10 日 7 6 5 4 3 2
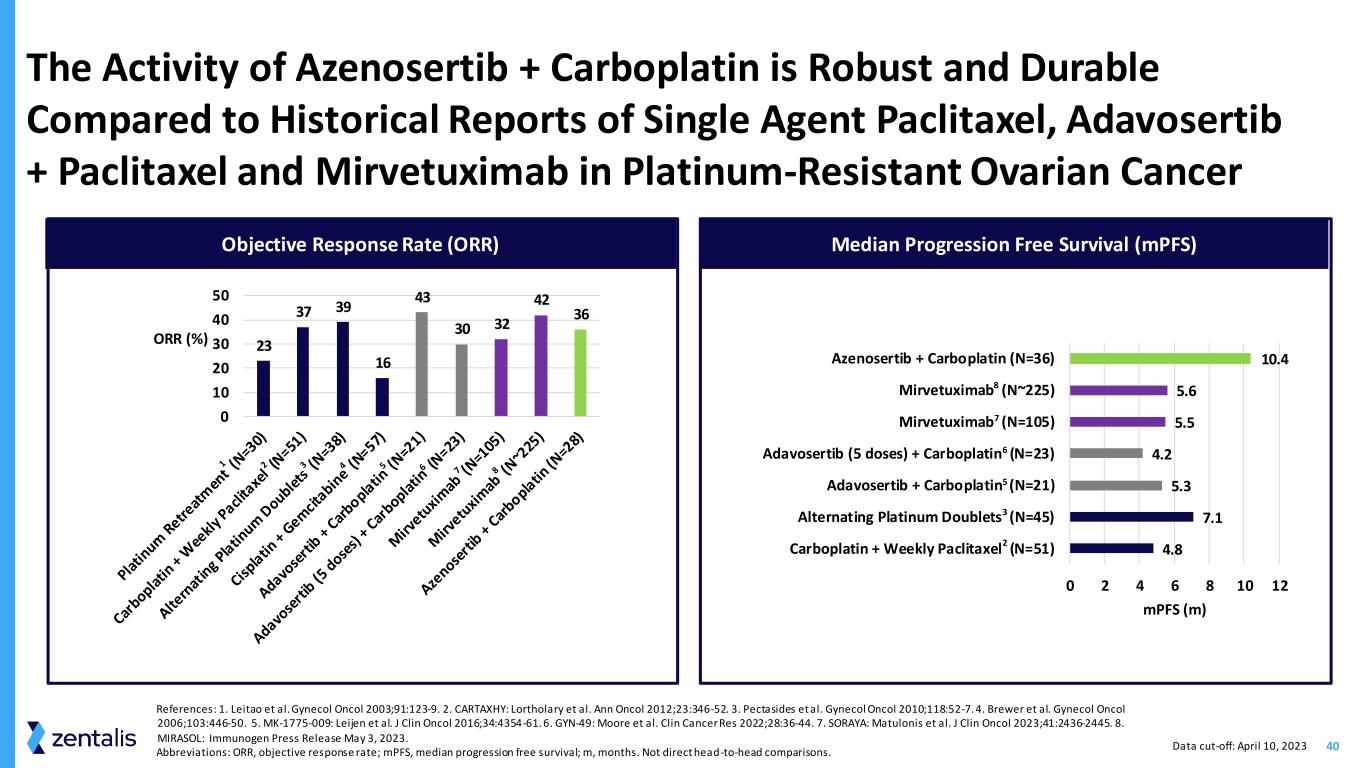
40 参考文献:1.Leitao 等人。Gynol Oncol 2003;91:123-9。2.CARTAXHY:Lortholary 等人。Ann Oncol 2012;23:346-52。3.Pectasides 等人。Gynol Oncol 2010;118:52-7。4.布鲁尔等。Gynol Oncol 2006;103:446-50。5.MK-1775-009:Leijen 等人。J Clin Oncol 2016;34:4354-61。6.GYN-49:摩尔等人2022 年 Clin Cancer Ress;28:36-44。7.SORAYA:Matulonis 等人。J Clin Oncol 2023;41:2436-2445。8.MIRASOL:免疫原新闻稿 2023 年 5 月 3 日。缩写:ORR,客观反应率;mPF,无进展存活率中位数;m,月。不是直接的正面比较。与单药紫杉醇、Adavosertib + paclitaxel 和 mirvetuximab 在耐铂卵巢癌中的历史报道相比,Azenosertib + Carboplatin 的活性既强劲又耐用 23 37 39 16 30 42 42 43 30 42 40 50 ORR (%) 4.8 7.1 5.2 5.6 0 2 4 4 4 6 6 12 Carboplatin + Weeklitaxel + Weeklitaxel (N=51) 交替铂双联剂 (N=45) Adavosertib + Carboplatin (N=21) Adavosertib (5 剂) + Carboplatin (N=23) Mirvetuximab (N=105) mirvetuxib (N=105) Azenosertib + Carboplatin (N=36) mpF (m) 客观反应率 (ORR)无进展存活率中位数 (MPF) 数据截止日期:2023 年 4 月 10 日 8 7 6 5 3 2
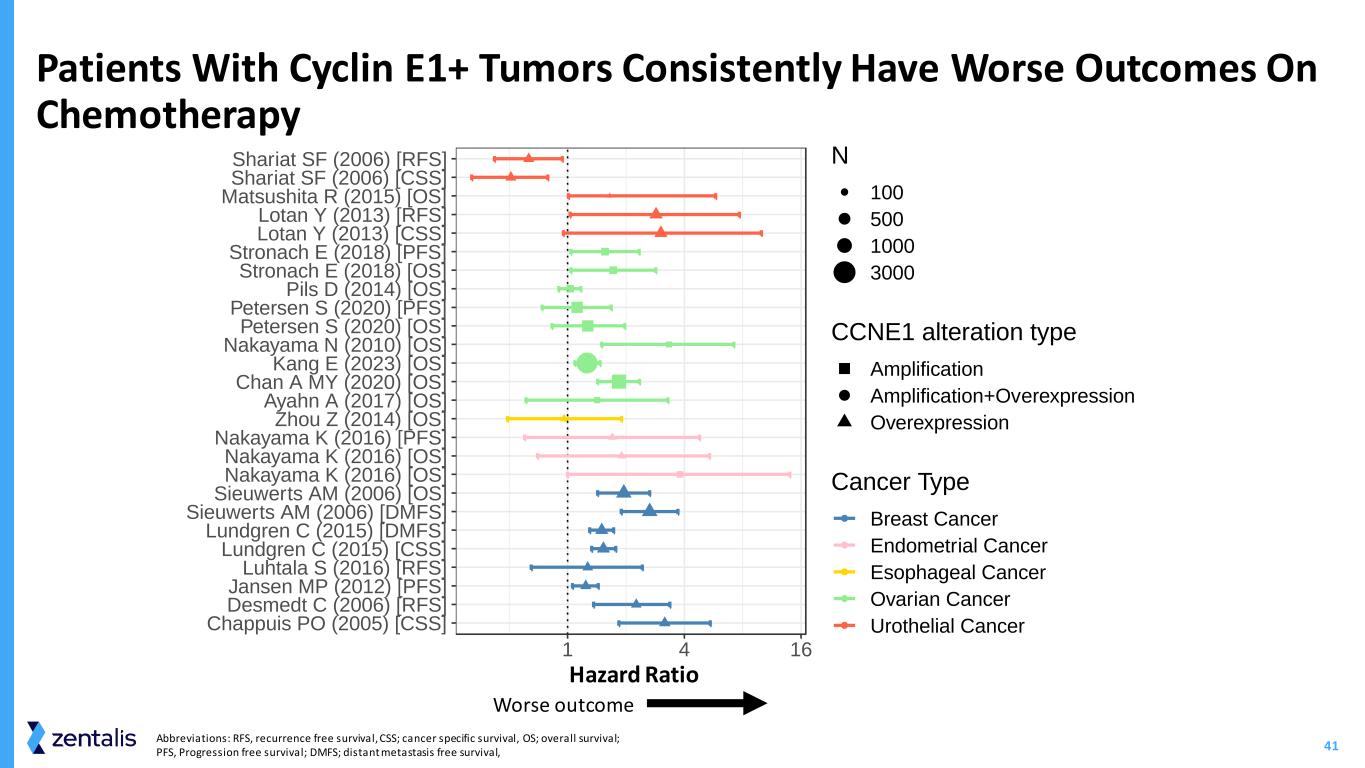
41 缩写:RFS,无复发存活率,CSS;癌症特异性存活率,OS;总存活率;PFS,无进展存活率;DMFS;远处无转移存活率,Cyclin E1+ 肿瘤患者的化疗危险比预后持续较差 Chappuis PO(2005) [CSS]Desmedt C (2006) [RFS]詹森议员 (2012) [PFS]Luhtala S (2016) [RFS]Lundgren C (2015) [CSS]Lundgren C (2015) [DMFS]Sieuwerts AM (2006) [DMFS]Sieuwerts AM (2006) [操作系统]Nakayama K (2016) [操作系统]Nakayama K (2016) [操作系统]Nakayama K (2016) [PFS]Zhou Z (2014) [操作系统]Ayahn A (2017) [操作系统]Chan A MY (2020) [操作系统]Kang E (2023) [操作系统]Nakayaman (2010) [操作系统]彼得森 S (2020) [操作系统]彼得森 S (2020) [PFS]Pils D (2014) [操作系统]Stronach E (2018) [操作系统]Stronach E (2018) [PFS]Lotan Y (2013) [CSS]Lotan Y (2013) [RFS]松下 R (2015) [操作系统]Shariat SF (2006) [CSS]Shariat SF (2006) [RFS]1 4 16 Haz ti N 100 500 1000 3000 CCNE1 改变型扩增+过度表达过度表达癌症类型乳腺癌子宫内膜癌食管癌卵巢癌尿路上皮癌
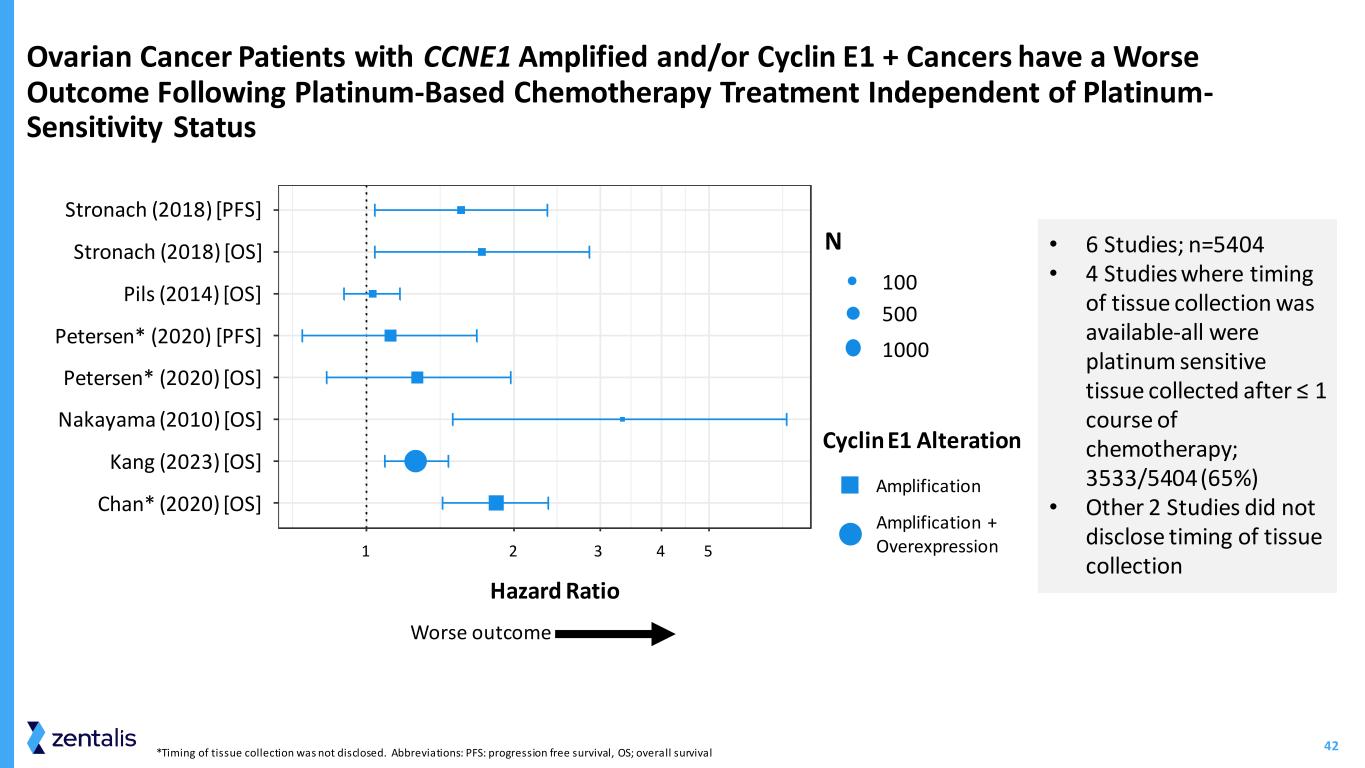
42 *组织采集的时间未透露。缩写:PFS:无进展存活率,OS;总存活率 CCNE1 扩增和/或 Cyclin E1 + 癌症患者接受铂类化疗后预后更差——与铂敏感性状态危险比 Cyclin E1 改变结果较差 • 6 项研究;n=5404 • 4 项有组织采集时机的研究——全部是在 ≤ 1 个疗程化疗后采集的铂敏感组织;3533/5404 (65%) • 其他 2 项研究没有透露组织采集的时间 1 2 4 53 Chan* (2020) [操作系统]中山 (2010) [操作系统]彼得森* (2020) [操作系统]彼得森* (2020) [PFS]Pils (2014) [操作系统]Stronach (2018) [操作系统]Stronach (2018) [PFS]N 500 100 1000 扩增扩增 + 过度表达 Kang (2023) [操作系统]han []Kan []Nakaya []etersen []t 或 en () ]皮尔斯 []斯特罗纳克 []斯特罗纳赫 () ]1 2 3 4 5 危险比率 N 100 500 1000 Cyclin E1 改变扩增扩增+ 过度表达
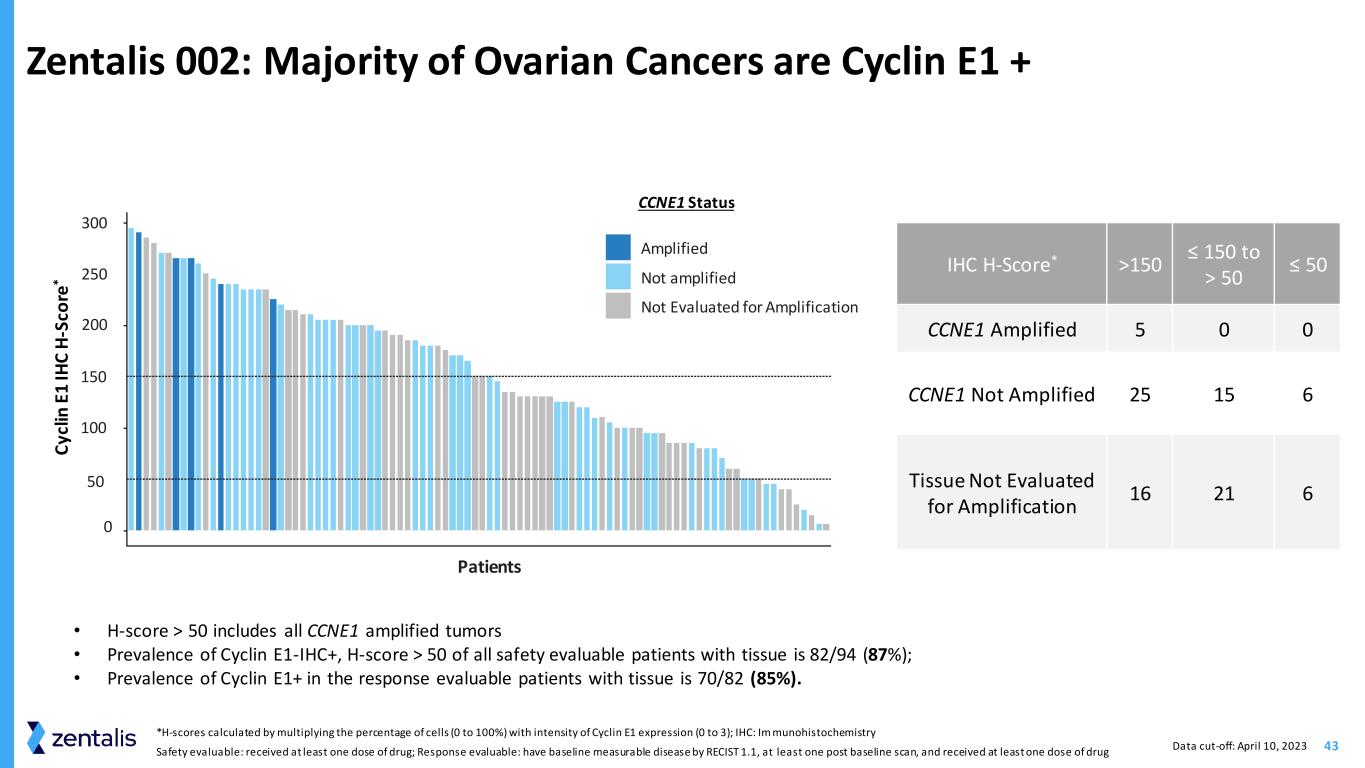
43 Zentalis 002:大多数卵巢癌是 Cyclin E1 + IHC H-Score* >150 ≤ 150 到 > 50 ≤ 50 CCNE1 扩增后 5 0 CCNE1 未扩增 25 15 6 组织未进行扩增评估 16 21 6 • H-score > 50 包括所有 CCNE1 扩增后的肿瘤 • 细胞周期蛋白 E1-IHC+ 的患病率在所有可安全评估的组织患者中有 50% 为 82/94 (87%); • 可评估反应的组织患者中 Cyclin E1+ 的患病率为 70/82 (85%)。C yc lin E 1 IH C H-S co re * CCNE1 状态放大未进行扩增评估 0 患者 100 200 300 50 150 *H 分数通过将细胞百分比(0 到 100%)乘以 Cyclin E1 表达强度(0 到 100%)计算得出;IHC:Im munohistochemics 安全性可评估:已接受至少一剂药物;反应可评估:使用 RECIST 1.1 测定基线疾病,基线后至少进行过一次扫描,并接受了至少一剂药物数据截止日期:2023 年 4 月 10 日 250
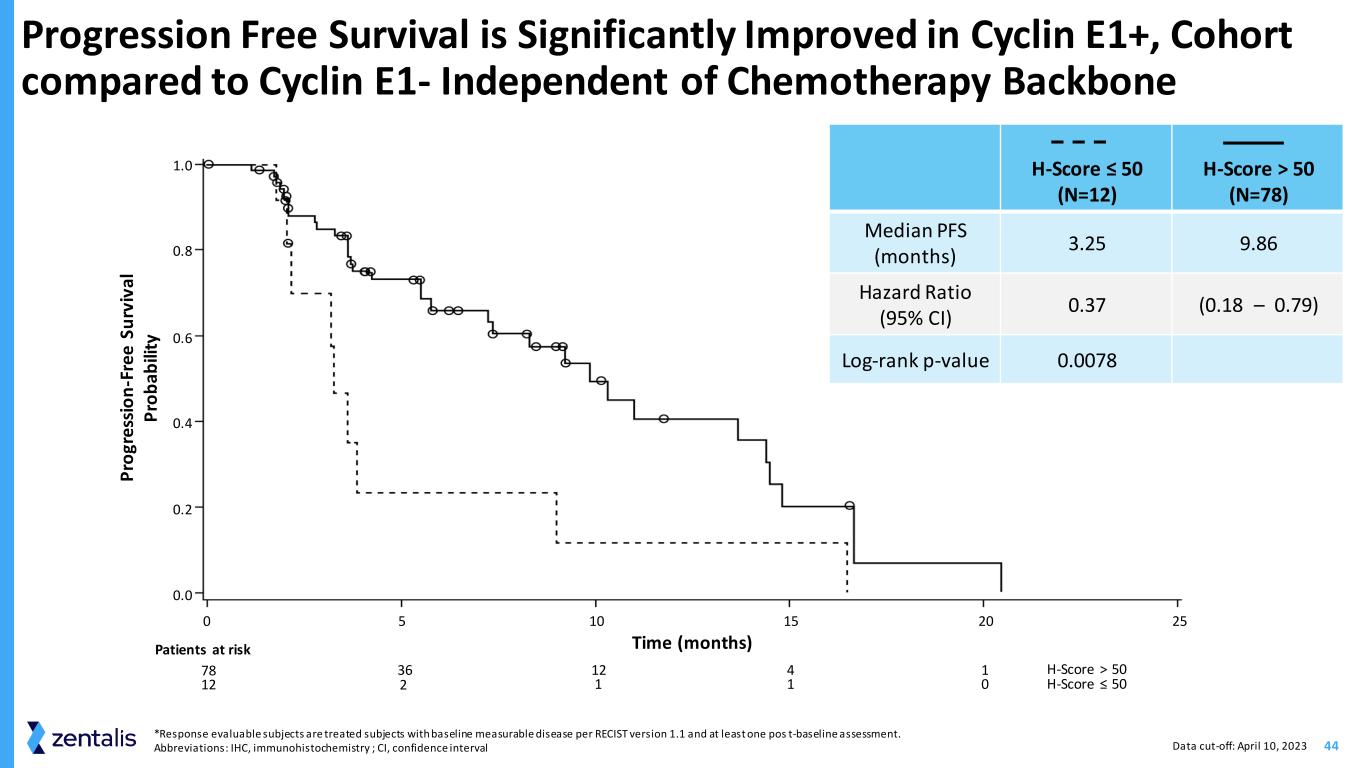
44 与Cyclin E1+相比,Cyclin E1+的无进展存活率显著提高——与化疗骨干无关 *根据RECIST 版本 1.1 和至少一次 pos t 基线评估,可评估反应的受试者是接受过基线可测量疾病的受试者。缩写:IHC,免疫组织化学;CI,置信区间 H 分数 ≤ 50(N=12)H-Score > 50(N=78)PFS(月)中位数 3.25 9.86 危险比(95% 置信区间)0.37 (0.18 — 0.79) log-rank p 值 0.0078 0 0.2 0.4 0.8 1.0 5 10 10 15 20 25 有风险的患者 78 12 2 12 12 1 0 P ro g re ss io n-F re s u rv iv a l p ro b ab ili ty Time(月)H-Score > 50 H-Score ≤ 50 数据截止日期:2023 年 4 月 10 日
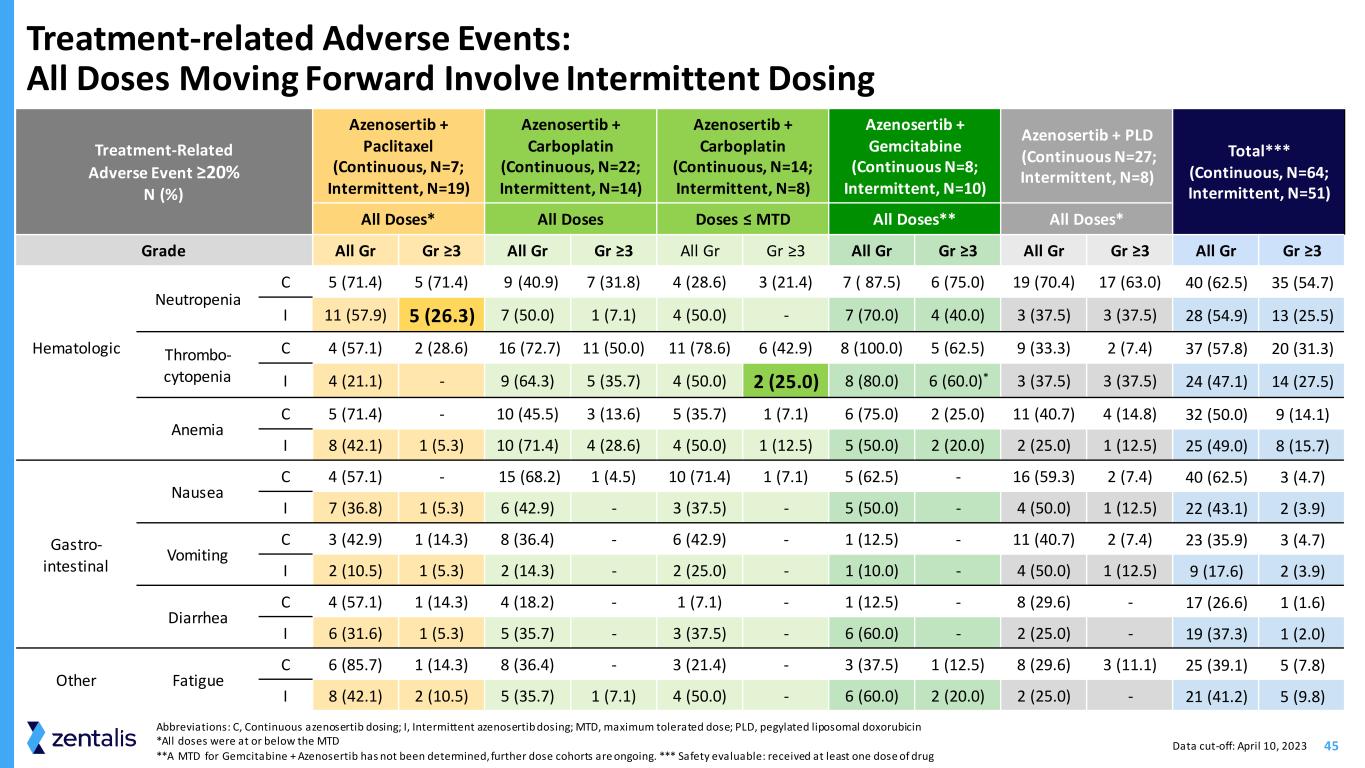
45 缩写:C,持续给药 azenosertib;I,间歇性阿泽诺塞替布给药;MTD,最大耐受剂量;PLD,聚乙二醇化脂质体多柔比星 *所有剂量均等于或低于 MTD **吉西他滨 + Azenosertib 的 A MTD 尚未确定,更多剂量队列正在进行中。*** 安全性可评估:已收到至少一个药物治疗相关不良事件剂量:未来所有剂量均涉及间歇性给药治疗相关不良事件 ≥ 20% N (%) Azenosertib + Paclitaxel(连续,N=7;间歇性,N=19)Azenosertib + Carboplatin (连续,N=22;间歇性,N=14)Azenosertib + Carboplatin(连续,N=14;间歇性,N=8)Azenosertib + Gemcitabine(连续 N=8;间歇性,N=10)Azenosertib + PLD(连续 N=27;间断,N=8)总剂量* 全部剂量 ≤ MTD 所有剂量** 所有剂量* 等级 All Gr ≥3 All Gr gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 血液学中性粒细胞减少症 C 5 (71.4) 5 (71.4) 9 (40.9) 7 (31.8) 4 (28.6) 3 (21.4) 7 (87.5) 6 (75.0) 19 (75.0) 19 (75.0) 0.4) 17 (63.0) 40 (62.5) 35 (54.7) I 11 (57.9) 5 (26.3) 7(50.0) 1 (7.1) 4 (50.0)-7 (70.0) 4 (40.0) 3 (37.5) 3 (37.5) 28 (54.9) 13 (25.5) Thrombo-cytopenia C 4 (57.1) 2 (28.6) 16 (72.7) 11 (78.6) 6 (42.9) 8 (100.0) 5 (62.5) 9 (33.3)) 2 (7.4) 37 (57.8) 20 (31.3) I 4 (21.1)-9 (64.3) 5 (35.7) 4 (50.0) 2 (25.0) 8 (80.0) 6 (60.0) * 3 (37.5) 24 (47.1) 14 (27.5) 贫血 C 5 (71.4)-10 (45.5) 3 (13.6) 5 (35.7)) 1 (7.1) 6 (75.0) 2 (25.0) 11 (40.0) 4 (14.8) 32 (50.0) 9 (14.1) I 8 (42.1) 1 (5.3) 10 (71.4) 4 (28.6) 4 (50.0) 1 (12.5) 5 (50.0) 2 (20.0) 2 (25.0) 1 (12.5) 25 (49.0) 8 (15.7)) 胃肠恶心C 4 (57.1)-15 (68.2) 1 (4.5) 10 (71.4) 1 (7.1) 5 (62.5)-16 (59.3) 2 (7.4) 40 (62.5) 3 (4.7) I 7 (36.8) 1 (5.3) 6 (42.9)-3 (37.5)-5 (50.0)-4 (50.0) 1 (12.5) 22 (43.1) 2 (3.9)) 呕吐 C 3 (42.9) 1 (14.3) 8 (36.4)-6 (42.9)-1 (12.5)-11 (40.7) 2 (7.4) 23 (35.9) 3 (4.7) I 2 (10.5) 1 (25.0)-1 (10.0)-4 (50.0) 1 (12.5) 9 (17.6) 2 (3.9)) 腹泻 C 4 (57.1) 1 (14.3) 4 (18.2)-1 (7.1)-1 (12.5)-8 (29.6)-17 (26.6) 1 (1.6) I 6 (31.6) 1 (5.3) 5 (35.7)-3 (37.5)-6 (60.0)-2 (25.0)-19 (37.3) 1 (2.0) 其他疲劳 C 6 (85.7)) 1 (14).3) 8 (36.4)-3 (21.4)-3 (37.5) 1 (12.5) 8 (29.6) 3 (11.1) 25 (39.1) 5 (7.8) I 8 (42.1) 2 (10.5) 5 (35.7) 1 (7.1) 4 (50.0)-6 (60.0) 2 (25.0)-21 (41.2) 5 (9.8) 数据截止日期:2023 年 4 月 10 日
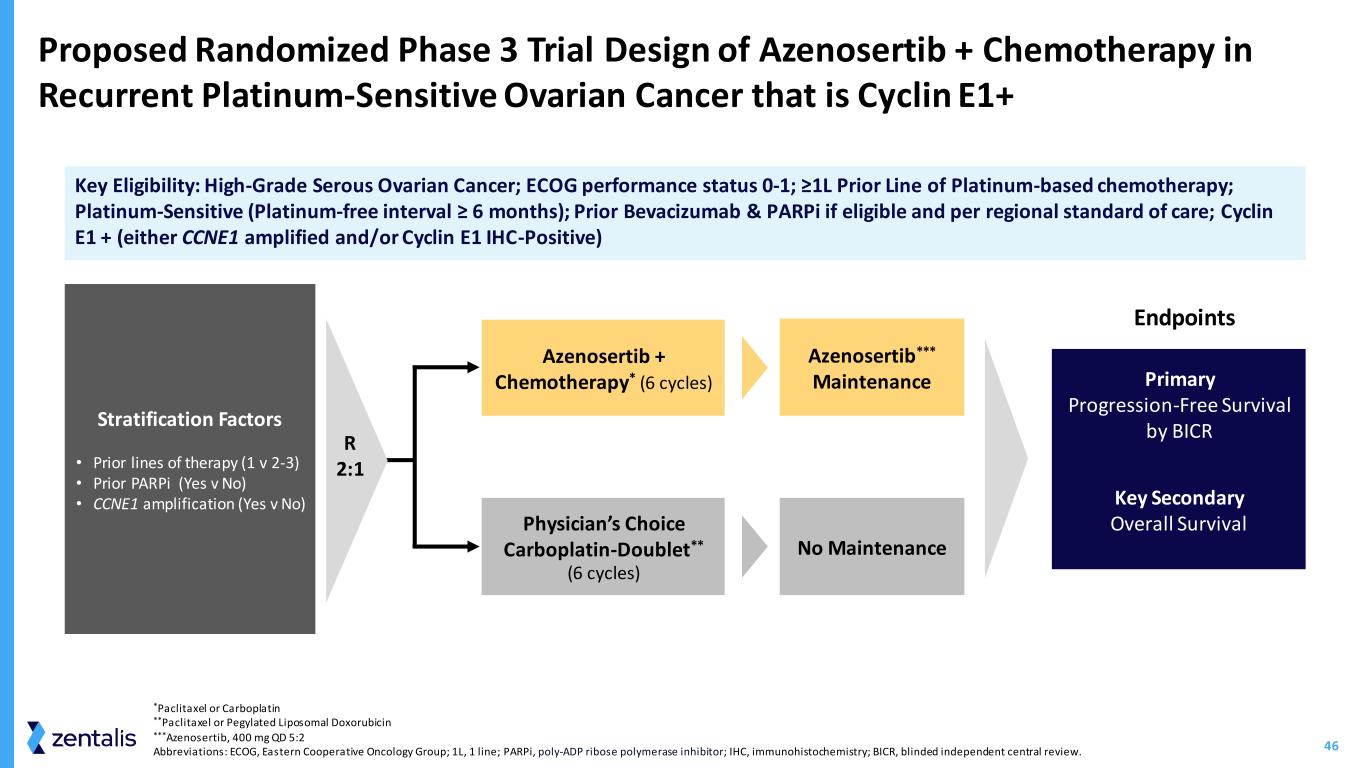
46 Azenosertib + 治疗复发性铂敏感性卵巢癌的拟议随机 3 期试验设计主要资格:高级别浆液性卵巢癌;ECOG 表现状态 0-1;≥1L 先行铂基化疗;铂敏感型(无铂间隔 ≥ 6 个月);如果符合条件且符合地区治疗标准,则先行使用贝伐珠单抗和 parPi;Cyclin E1 +(CCNE1 扩增和/或 Cyclin E1 IHC 阳性)医师之选 Carboplatin-Doublet**(6 个周期)终结初级无进展存活率 by BICR 否维持分层因子 • 先前的治疗线路 (1 v 2-3) • 先前 parPI(是 v 否)• CCNE1 扩增(是 v 否)Azenosertib + 化疗*(6 个周期)azenosertib*** 维持关键次要总存活率 R 2:1 *紫杉醇或卡铂**紫杉醇或聚乙二醇化脂质体多柔比星***azenosertib**a b,400 mg QD 5:2 缩写:ECOG,东方合作肿瘤学小组;1L,1 系;parPI,Pory-ADP 核糖聚合酶抑制剂;IHC,免疫组织化学;BICR,盲人独立中心综述。

47 *吉西他滨 + Azenosertib 具有令人兴奋和持久的活性——MTD 尚未确定,更多剂量队列正在进行中。缩写:RP2D,推荐第 2 期剂量;PLD 聚乙二醇化脂质体多柔比星;QD,每天一次;5:2 治疗 5 天,然后休息 2 天;D,day;AUC,曲线下方区域;mg/ml*min 结论:数据支持剂量和进步 Azenosertib-化疗组合在铂敏感性卵巢癌中的主要收获 • 在信号中具有强而持久的疗效化疗主干 • Cyclin E1 状态预测了在化疗之外加用 azenosertib 的益处 • 表明 azenosertib 可以恢复经过大量预先治疗的化疗敏感性铂耐药性卵巢癌 • 计划启动 azenosertib 与化疗联合治疗 Cyclin E1+ 铂敏感性卵巢癌 RP2D Azenosertib 化疗紫杉醇 300 mg QD 5:2 80 mg/m2 在 D1、D8、D15(28 天周期)Carboplatin 200 mg QD 5:2 AUC=5(21 天周期)吉西他滨待定* TBD* PLD 400 mg QD 5:2 40 mg/m2 D1(28 天周期)数据截止日期:2023 年 4 月 10 日为紫杉醇、卡铂和 PLD 组合制定 RP2D
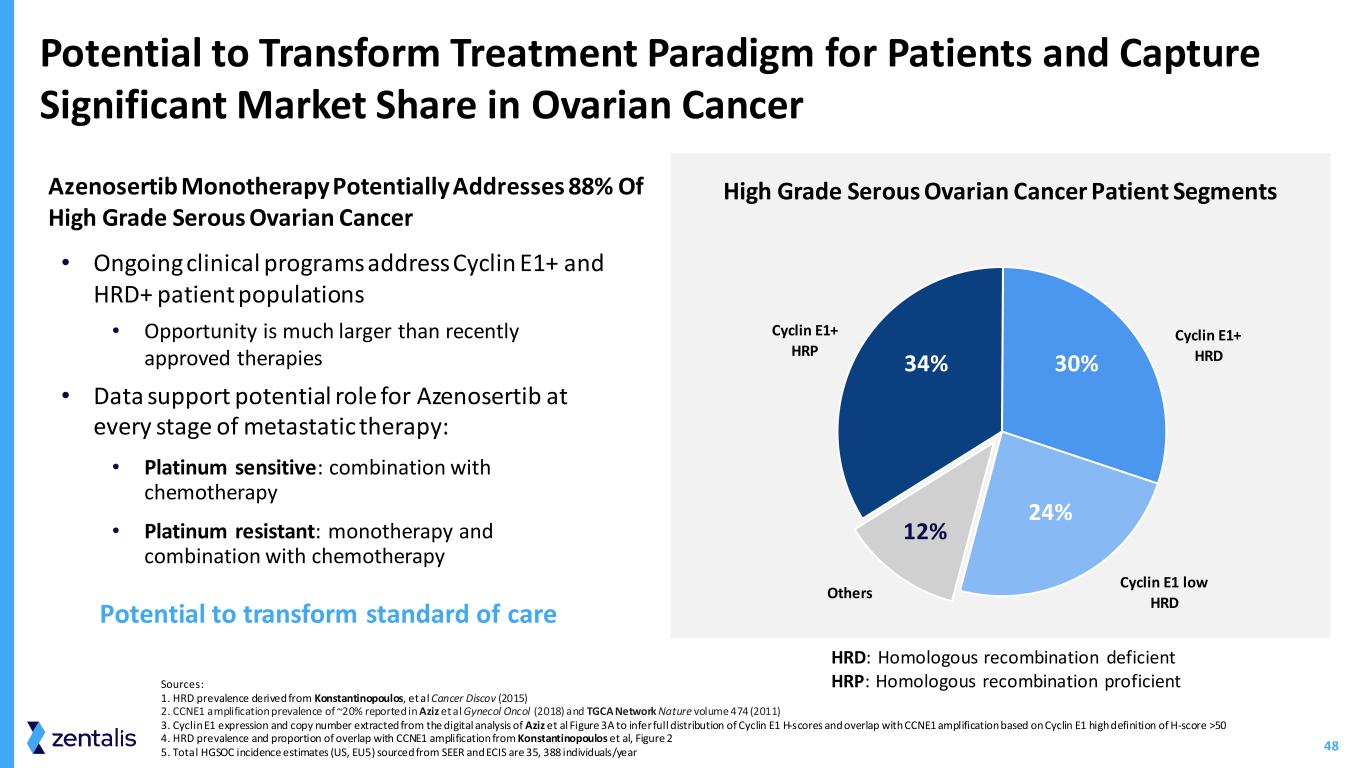
48 有可能改变患者治疗模式,在卵巢癌 Cyclin E1+ HRP Cyclin E1+ HRD Cyclin E1 低 HRD 其他细分市场 30% 24% 12% 34% 高等级浆液性卵巢癌患者群体 • 正在进行的临床项目涉及 Cyclin E1+ 和 HRD+ 患者群体 • 机会比最近批准的疗法大得多 • 数据支持 Azenosertib 在转移治疗的每个阶段的潜在作用:• 铂敏感:与化疗联合使用 • 铂耐药:单一疗法和联合化疗化疗有可能改变治疗标准 Azenosertib 单一疗法有可能解决 88% 的高度浆液性卵巢癌来源:1.HRD 患病率源自 Konstantinopoulos 等人 Cancer Discov(2015)2。Aziz 等人 Gynocol Oncol(2018)和 TGCA Network Nature 第 474 卷(2011)3 中报告的 CCNE1 扩增患病率约为 20%。从 Aziz 等人的数字分析中提取的 Cyclin E1 表达和拷贝数图 3A,用于推断 Cyclin E1 H 分数的完整分布,并与基于 Cyclin E1 的 H 分数 >50 4 的高清晰度的 CCNE1 扩增重叠。HRD 患病率和与 Konstantinopoulos 等人的 CCNE1 扩增重叠比例,图 2 5。来自 SEER 和 ECIS 的 HGSOC 总发病率估计值(美国、欧盟5)为 35 388 人/年 HRD:同源重组缺陷 HRP:同源重组缺乏 HRP:同源重组精通
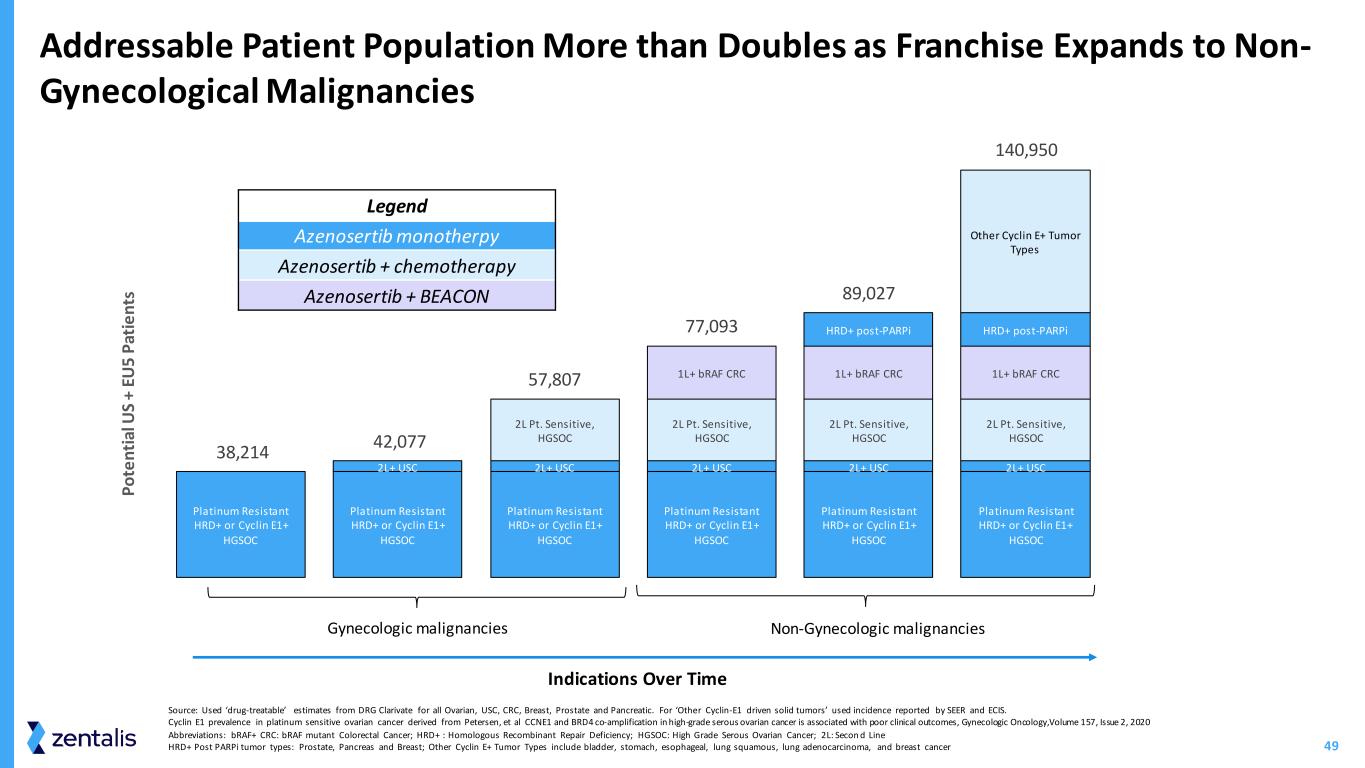
49 耐铂金 HRD+ 或 Cyclin E1+ HGSOC 铂金抗性 HRD+ 或 Cyclin E1+ HGSOC Platinum Dastist HRD+ 或 Cyclin E1+ Platinum Dasisting HRD+ 或 Cyclin E1+ Platinum Dasisting HRD+ L+ USC 2L+ USC 2L Pt.敏感,HGSOC 2L Pt.敏感,HGSOC 2L Pt.敏感,HGSOC 2L Pt.敏感、HGSOC 1L+ braF CRC 1L+ braF CRC 1L+ braF CRC HRD+ postParpi HRD+ post-Parpi 其他细胞周期蛋白 E+ 肿瘤类型 38,214 42,807 77,027 8950 P o te n ti al U S + eu 5 p ie n ts 妇科恶性肿瘤 Legend azenosertib monotherib azenosertib + 化疗 Azenosertib + BEACON 随着特许经营范围扩展到非妇科恶性肿瘤,随着时间的推移 Azenosertib + 化疗 Azenosertib + BEACON 适应症可寻址的患者人数增加了一倍以上来源:使用了 DRG Clarivate 对所有卵巢、南加州大学、结直肠癌、乳腺癌、前列腺和乳腺癌的 “可药物治疗” 估计胰腺。对于 “其他Cyclin-E1驱动的实体肿瘤”,使用了SEER和ECIS报告的发病率。源自 Petersen 等人的铂敏感性卵巢癌的 cyclin E1 患病率,CCNE1 和 BRD4 联合扩增与临床结果不佳有关,《妇科肿瘤学》,第 157 卷,2020 年第 2 期缩写:braF+ CRC:braF 突变体结直肠癌;HRD+:同源重组修复缺陷;HGSOC:高级浆液性卵巢癌;2L:Secon d Line HRD+ Post parPi 肿瘤类型:前列腺、胰腺和乳腺;其他 Cyclin E+ 肿瘤类型包括膀胱、胃、食管、肺鳞癌、肺腺癌、和乳腺癌
50 今日结论:在推动 Azenosertib 转变癌症治疗潜力方面取得了重大进展多种化疗组合可获得扎实疗效 • 与单独化疗或化疗相比,ORR 和 mpF 有显著改善 + adavosertib • 有机会使用 Cyclin E+ 作为生物标志物来识别除化疗中可受益的患者缩写:RP2D,推荐的 2 期剂量;ORR,已确认的客观反应率;HGSOC,高级浆液性卵巢癌;南加州大学,子宫浆液性子宫内膜癌;2H23,下半部分2023;mPF,无中质进展存活综合临床策略 • 卵巢癌的所有疗法,包括单一疗法和化疗联合疗法 • 南加州大学的 pembro(≥2 L)后 • 临床试验时间表将在 2H23 中更新 Azenosertib 单一疗法 RP2D 剂量:400 mg 间歇性(持续 5 天,每周 2 天;5:2)• 间歇给药后暴露量增加导致卵巢癌和南加州大学的ORR为36.8% • 安全性强:没有与治疗相关的停药 • 大多数患者仍在接受治疗;23年下半年更新

51 我们对所有患者、护理人员、家属和研究人员表示感谢和最深切的感谢 KBC Bezanijska kosa 您可以信赖的医院。

问答环节 52 金伯利·布莱克威尔,医学博士 Zentalis Pharmicals 首席执行官 Carrie Brownstein,医学博士 Zentalis Pharmicals Funda Meric-Bernstam,医学博士,德克萨斯大学医学博士安德森癌症中心第一阶段项目;Zentalis Scientific 成员。顾问委员会
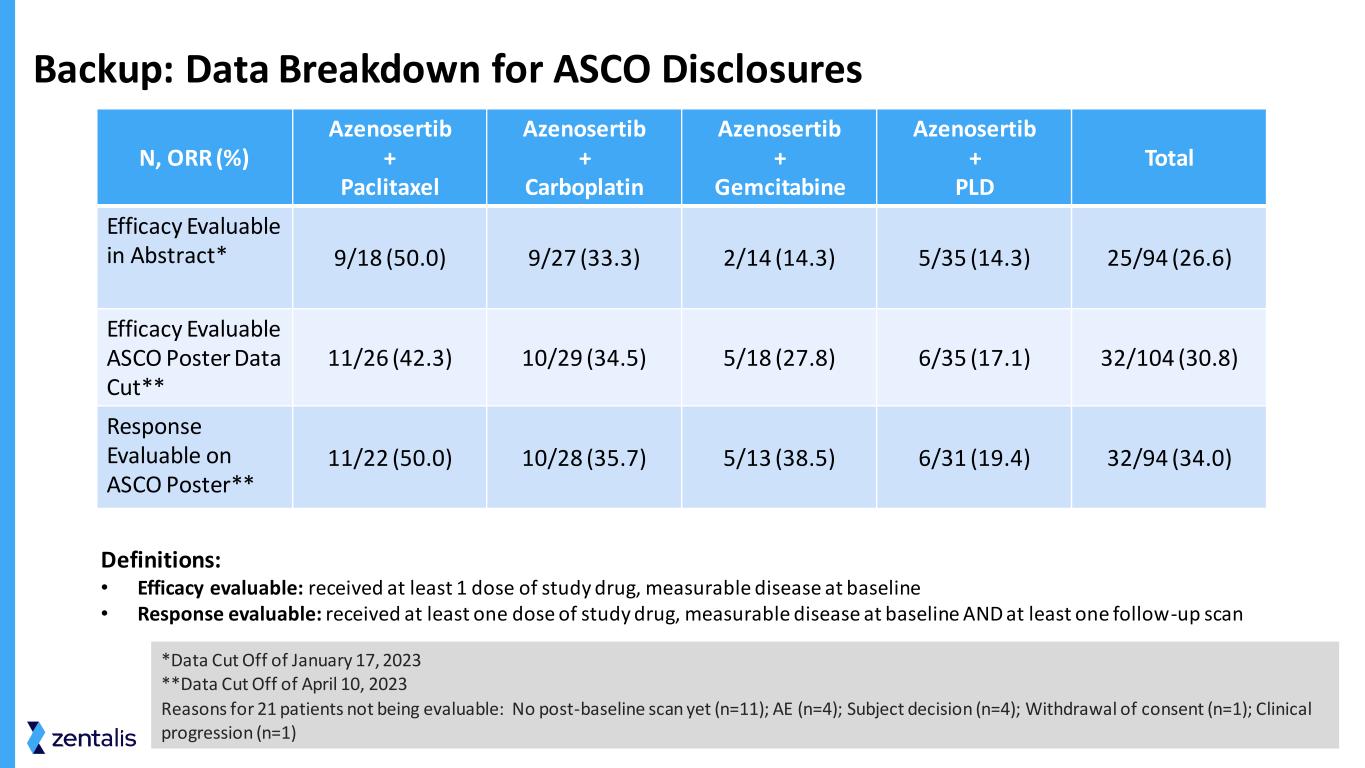
备份:ASCO 披露的数据明细 N、ORR (%) Azenosertib + paclitaxel azenosertib + Carboplatin azenosertib + Gemcitabine Azenosertib + PLD 总疗效可抽象评估* 9/18 (50.0) 9/27 (33.3) 2/14 (14.3) 5/35 (14.3) 25/94 (26.6) 功效可评估 ASCO Data Cut** 11/26 (42.3) 10/29 (34.5) 5/18 (27.8) 6/35 (17.1) 32/104 (30.8) 回复可在 ASCO Poster上评估** 11/22 (50.0) 10/28 (35.7) 5/13 (38.5) 6/31 (19.4) 32/94 (34.0) 定义:• 疗效可评估:已服用至少 1 剂研究药物,基线时可测量疾病 • 回应可评估:接受了至少一剂研究药物、基线时可测量的疾病和至少一次随访扫描 *2023 年 1 月 17 日数据截止**2023 年 4 月 10 日数据截止日期 21 名患者无法评估的原因:尚未进行基线后扫描(n=11);AE(n=4);受试者决定(n=4);撤回同意(n=1);临床进展(n=1)