

2023 年 6 月公司简报 | 纳斯达克:CNTB 为 T 细胞驱动的炎症性疾病开发下一代疗法

前瞻性陈述本关于Connect Biopharma Holdings Limited(“Connect”、“我们” 或 “我们的”)的演示仅供参考。本演示文稿中包含的某些信息涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及 Connect 自己的内部估计和研究。尽管我们认为截至本演示之日,这些第三方来源是可靠的,但我们尚未独立核实从第三方来源获得的任何信息的充分性、公平性、准确性或完整性,也不作任何陈述。此外,本演示文稿中包含的所有市场数据都涉及许多假设和限制,无法保证此类假设的准确性或可靠性。最后,尽管我们认为自己的内部研究是可靠的,但此类研究尚未得到任何独立来源的证实。本演示文稿包含涉及重大风险和不确定性的前瞻性陈述。除本演示文稿中包含的历史事实陈述以外的所有陈述,包括有关我们未来财务状况、经营业绩、业务战略和计划、潜在产品及其潜在收益、产品批准、预期里程碑、预期数据读取和注册、研发计划和成本、潜在的未来合作伙伴关系、成功的时机和可能性、未来运营的管理目标、预期产品开发工作的未来结果以及充足性的陈述为运营和资本支出需求提供资金的现有现金和潜在的合伙资金以及有关行业趋势的陈述均为前瞻性陈述。前瞻性陈述可以通过以下词语来识别:“预期”、“相信”、“考虑”、“继续”、“可以”、“估计”、“期望”、“打算”、“可能”、“计划”、“潜在”、“预测”、“项目”、“应该”、“目标”、“将” 或这些术语或其他类似表达方式的否定词。本演示文稿中的前瞻性陈述仅是预测。我们的这些前瞻性陈述主要基于我们当前对未来事件和趋势的预期和预测,我们认为这些事件和趋势可能会影响我们的财务状况、经营业绩、业务战略和财务需求。这些前瞻性陈述本质上受许多风险、不确定性和假设的影响,其中一些无法预测或量化,有些是我们无法控制的,其中包括:我们的临床试验证明候选产品的安全性和有效性的能力以及其他积极结果;我们是否需要扩大或增加试验才能获得监管部门对候选产品的批准;我们获得和维持现有候选产品的监管部门批准的能力;美国、中国、欧洲和其他司法管辖区的法规和监管动态;我们当前的现金和投资状况支持计划运营的能力;中国法律、规章制度的解释和执行方面的不确定性;与 COVID-19 疫情相关的风险,该疫情已经并可能继续对我们的业务、临床前研究和临床试验产生重大和不利影响;我们获取、维护、保护和执行我们的知识产权和专有权的计划和能力技术,包括延长现有专利条款(如果有);我们继续依赖第三方对我们的候选产品进行更多临床试验,以及为临床前研究和临床试验生产候选产品;以及医生、患者、医疗保健支付方和医学界其他人对我们的候选产品的市场接受程度。这些风险并非详尽无遗。Connect不应将包含前瞻性陈述视为其任何预期、预测或计划将得到实现的陈述。由于Connect业务固有的风险和不确定性以及Connect向美国证券交易委员会提交的文件中描述的其他风险,实际业绩可能与这些预期、预测或计划有所不同。有关这些风险和其他风险的更多信息包含在Connect向美国证券交易委员会提交的定期报告中 “风险因素” 标题下,包括Connect于2022年3月31日向美国证券交易委员会提交的20-F表年度报告,以及其他报告,这些报告可在美国证券交易委员会网站(www.sec.gov)和Connect的网站(www.bioconnectharm.com)上的 “投资者” 标题下查阅。新的风险因素不时出现,我们的管理层无法预测所有风险因素,也无法评估所有因素对我们业务的影响,也无法评估任何因素或因素组合在多大程度上可能导致实际业绩与任何前瞻性陈述中包含或暗示的结果存在重大差异。您不应依赖前瞻性陈述来预测未来事件。尽管我们认为前瞻性陈述中反映的预期是合理的,但我们无法保证未来的业绩、活动水平、业绩或成就。除非法律要求,否则在本演示文稿发布之日之后,我们没有义务以任何理由公开更新任何前瞻性陈述。此外,“我们相信” 的陈述和类似陈述反映了我们对相关主题的信念和观点。这些陈述基于截至本演示之日我们获得的信息,尽管我们认为此类信息构成了此类陈述的合理依据,但此类信息可能有限或不完整,不应将我们的声明理解为表明我们已经对所有可能可用的相关信息进行了详尽的调查或审查。这些陈述本质上是不确定的,提醒投资者不要过分依赖这些陈述。我们没有对 CBP-201 与 dupilumab 进行过正面交锋研究,也没有对 icanbelimod(前身为 CBP-307)与 Etrasimod 或 Ozanimod 进行过正面交锋研究。本文所载 CBP-201 与 dupilumab 的比较以及 CBP3-7 与 Etrasimod 和 Ozanimod 的比较基于对单独研究数据的分析。由于研究方案、条件和患者群体的差异,此类数据可能无法直接比较。因此,交叉试验比较可能无法可靠地预测 CBP-201 与 dupilumab 的相对疗效或安全性,也不能可靠地预测 icanbelimod 与 Etrasimod 或 Ozanimod 相比的相对疗效或安全性。CBP-201 或 icanbelimod 的潜在益处并不意味着期望获得监管部门的批准,这完全在 FDA(或适用的外国监管机构)的权限范围内。

公司亮点 ad=过敏性皮炎;CD=克罗恩氏病;h3r=组胺3受体;il-4rα =白介素-4受体 alpha;sip1=鞘氨醇 1-磷酸受体 1;uc=溃疡性结肠炎。截至2023年3月31日,未经审计的现金、现金等价物和投资。靶向需求未得到满足的炎症性疾病为治疗领域带来数十亿美元的全球市场机遇美国总部在中国运营和临床开发美国、欧盟、澳大利亚和中国纳斯达克 CNTB Cash 1.457 亿美元 USDA CBP-201 Icanbelimod (CBP-307) CBP-174 IL-4rα 阻滞剂 AD 和 asthma2H 2023:AD 关键中国 52 周数据、哮喘 pH2 头条数据 UC 和 CDQQ1 调节剂 2'2023:UC Ph2 维持期数据 H3R 拮抗剂治疗瘙痒症与 AD 相关的高通量功能方法用于快速强效T细胞调节剂的鉴定为5种适应症提供了领先的临床阶段资产:

强大的潜在差异化疗法产品线 Connect Biopharma 拥有所有候选产品的全球开发和商业化权 a该公司在中国针对 AD 患者的 CBP-201 临床试验包括在内,因为该公司打算根据该试验的结果以及中国国家药品监督管理局药物评估中心 (CDE) 的预先反馈在中国提交新药申请 (NDA)。由于新冠肺炎,bPhase 2 CD 试验提前结束相关的入学挑战。ind=在研新药。

CBP-201:正在开发用于 2 型炎症性疾病的下一代抗白介素-4 受体 α (IL-4Rα) 抗体

CBP-201:下一代 IL-4Rα 阻滞剂显示出降低给药频率、提高持续疗效和加快发作速度的潜力 CBP-201 是一种新型的人类单克隆 IGG4 抗体,IL-4rα 是 IL-4 和 IL-13 受体的常见亚单位。阻断与 IL-4Rα 结合的 IL-4 和 IL-13 会抑制 IL-4 和 IL-13 信号传导。双重抑制 IL-4 和 IL-13 是一种行之有效的治疗策略,可治疗许多 TH2 介导的疾病,例如特应性皮炎、哮喘、crsWNP、慢性阻塞性肺病、eOE 等。copd=慢性阻塞性肺病;crswnp=伴有鼻息肉的慢性鼻窦炎;eoe=嗜酸性食管炎;ic50=半最大抑制浓度;iL=白介素;jak=janus 激酶;stat=信号转导和转录激活因子;tarc=胸腺和激活调节的趋化因子。基于头对头对头的趋化因子与 dupilumab 的体外比较。Yang 等人,《皮肤病学调查学会》,波特兰,2022 年,海报 LB945。观察结果是根据我们的内部临床前实验得出的,包括与dupilumab的所有比较。Kamal MA 等人,Clin Transl Sci. 2022 (10): 2342-2354。CBP-201 特征(对比 dupilumab)使用与更高的 il-4rα1 结合亲和力相关的不同表位作用更长靶介导的消除时间更长的 IC50 在:降低 JAK-STAT 信号1、细胞增殖1、TARC 释放1、潜在的临床相关性更强的临床反应更快的起效频率减少不良事件
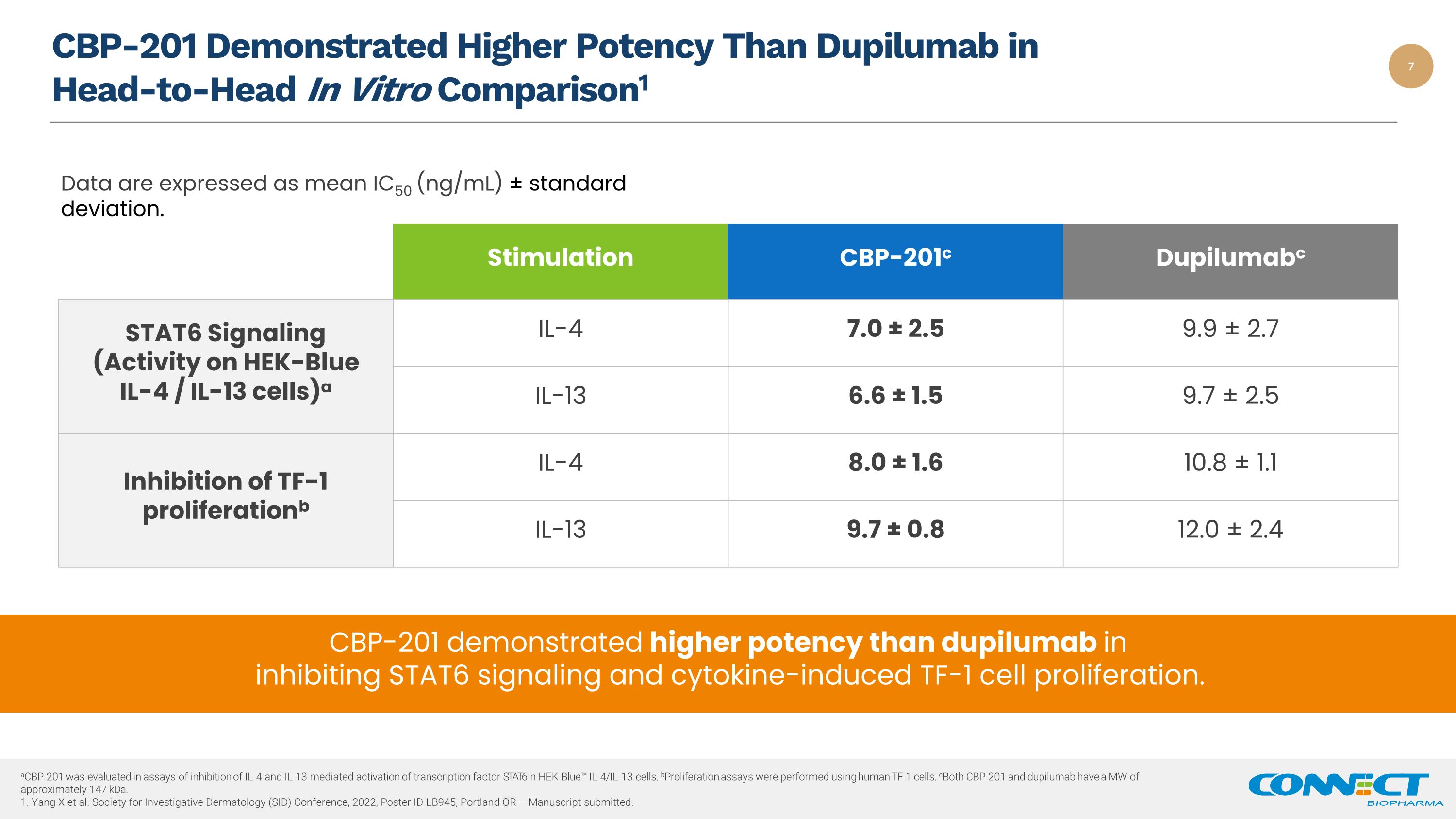
CBP-201 在头对头体外比较中显示出比 dupilumab 更高的效力1 CBP-201 在抑制 STAT6 信号传导和细胞因子诱导的 TF-1 细胞增殖方面表现出比 dupilumab 更高的效力。刺激 cbp-201c Dupilumabc STAT6 信号(Hek-blue IL-4/ IL-13 细胞活性)a IL-4 7.0 ± 2.5 9.9 ± 2.7 IL-13 6.6 ± 1.5 9.7 ± 2.5 TF-1 增殖的抑制 b IL-4 8.0 1.6 10.8 ± 1.1 IL-13 9.7 ± 0.8 12.0 ± 2.4 acbp-201 在抑制 IL-4 和 IL-13 介导的转录因子激活的实验中评估了在 HEK-blue IL-4/IL-13 细胞中。b增殖测定是使用人类 TF-1 细胞进行的。CBP-201 和 dupilumab 的 mW 约为 147 kDa.1。STAT6Yang X 等2022 年皮肤病学调查学会 (SID) 会议,海报编号 LB945,俄勒冈州波特兰 — 手稿已提交。数据以平均值 IC50 (ng/mL) ± 标准差表示。
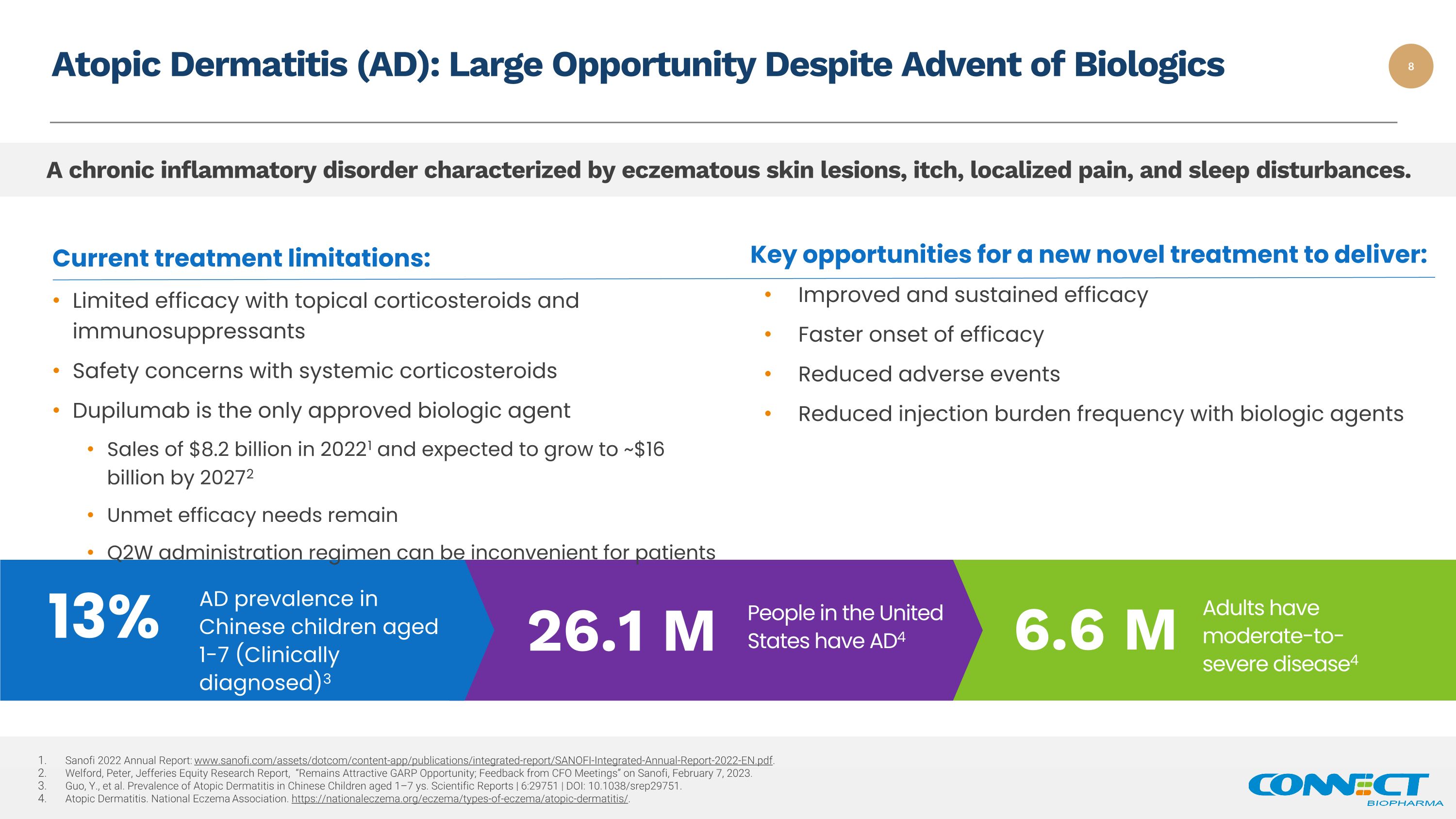
特应性皮炎(AD):尽管生物制剂问世,但机会仍然很大。一种以湿疹性皮损、瘙痒、局部疼痛和睡眠障碍为特征的慢性炎症性疾病。成年人患有中度至重度疾病4 660万美国1至7岁中国儿童(临床诊断)的AD患病率为2610万人 3 13% 赛诺菲2022年年度报告:www.sanofi.com/assets/dotcom/content-app/publications/Integrations/Integrations/Integrations/integrations/integrations/integrations/integrations/integrationWelford,Peter,《杰富瑞股票研究报告》,“仍然有吸引力的GARP机会;来自首席财务官会议的反馈”,赛诺菲,2023年2月7日。Guo, Y. 等中国1—7岁儿童特应性皮炎的患病率科学报告 | 6:29751 | DOI:10.1038/srep29751。过敏性皮炎。全国湿疹协会。https://nationaleczema.org/eczema/types-of-eczema/atopic-dermatitis/。当前的治疗局限性:局部使用皮质类固醇和免疫抑制剂的疗效有限全身性皮质类固醇的安全问题 Dupilumab 是唯一获得批准的生物制剂 2021 年销售额为 82 亿美元,预计到 2027 年将增长到约 160 亿美元疗效需求仍未得到满足 Q2W 给药方案可能给患者带来不便新疗法实现的关键机会:改善和持续疗效更快的疗效起效减少不良事件生物制剂的注射负荷频率
CBP-201:全球 2b 期试验(AD)
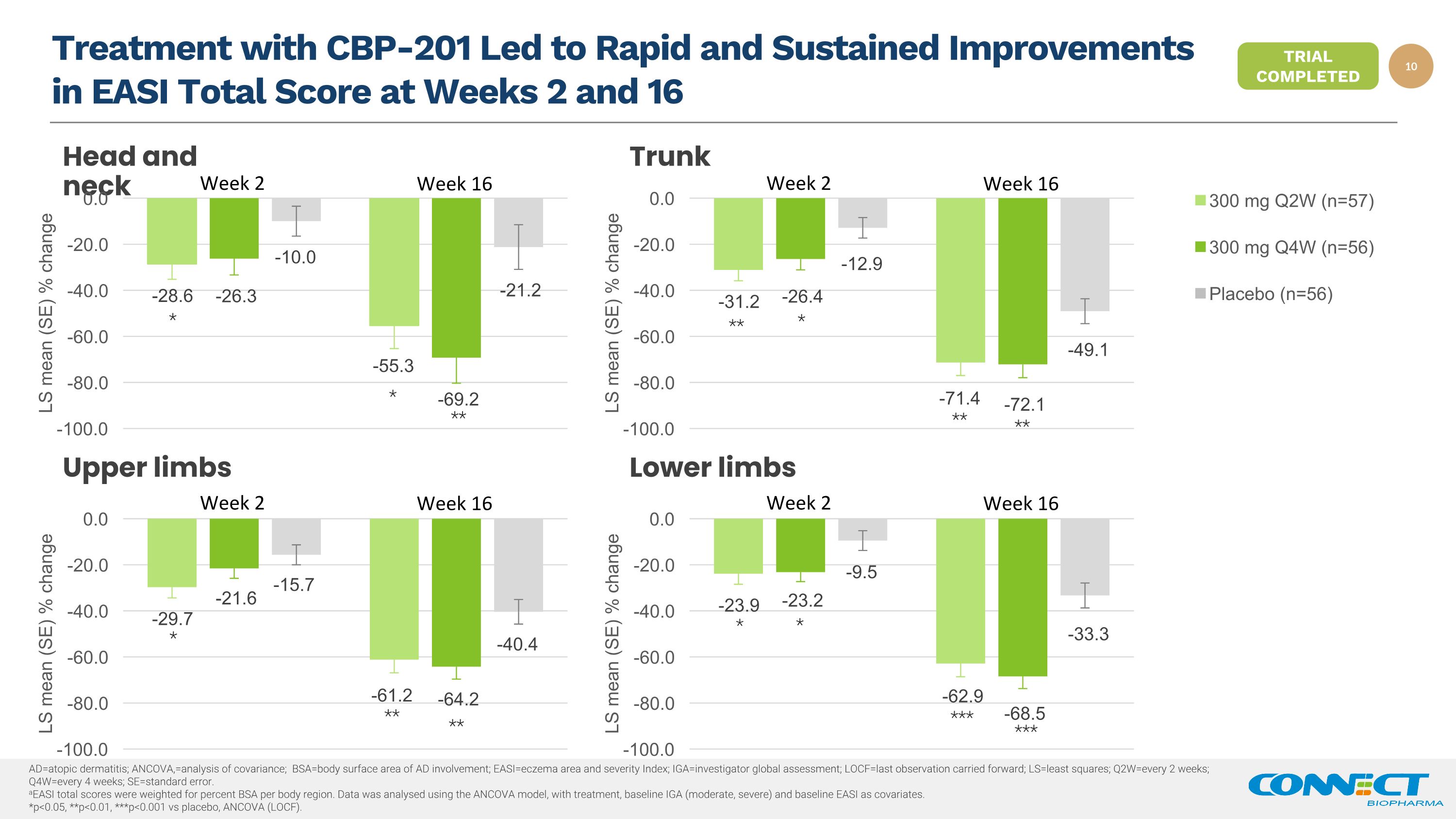
CBP-201 治疗使第 2 周和第 16 周的 EASI 总分快速持续改善头部和颈部上肢下肢第 2 周第 16 周第 16 周第 16 周第 2 周 * * *** * * *** * *** ad=过敏性皮炎;ANCOVA,=协方差分析;bsa=AD 受累的身体表面积;easi=湿疹面积和严重程度指数;iga=湿疹面积和严重程度指数;iga=研究者全球评估;locf=延续的最后一次观测结果;ls=最小二乘法;q2w=每 2 周;q4w=每 4 周;se=标准误差。aeasi 总分是根据每个身体 BSA 百分比进行加权的地区。使用ANCOVA模型对数据进行了分析,将治疗、基线 IGA(中度、重度)和基线 EASI 作为协变量。*p
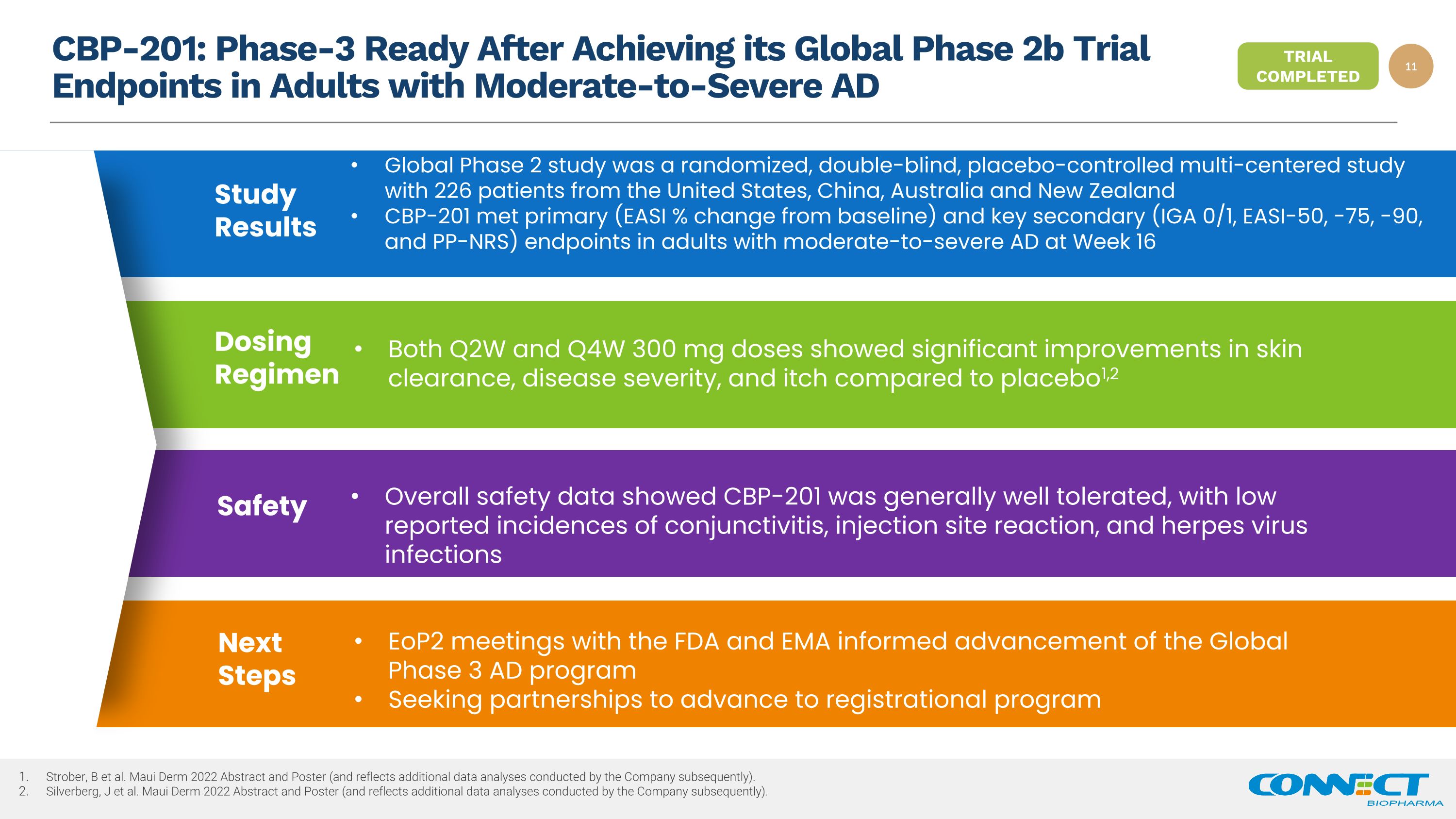
CBP-201:在中度至重度 AD Strober 成人中度至重度 AD Strober 的全球第 2b 期试验终点后,第 3 阶段准备就绪,B 等人。Maui Derm 2022 摘要和海报(反映了公司随后进行的其他数据分析)。Silverberg,J 等。Maui Derm 2022 摘要和海报(反映了公司随后进行的其他数据分析)。全球 2 期研究是一项随机、双盲、安慰剂对照的多中心研究,来自美国、中国、澳大利亚和新西兰的 226 名患者在第 16 周患有中度至重度 AD 的成年人中,CBP-201 达到初级(EASI 与基线相比的变化百分比)和关键继发性(IGA 0/1、EASI-50、-75、-90 和 PP-NRS)终点研究结果 Q2W 和 Q4W 300 mg 剂量均显示出显著改善与安慰剂1,2 给药方案相比,皮肤清除率、疾病严重程度和瘙痒总体安全性数据显示 CBP-201 的耐受性总体良好,较低报告的结膜炎、注射部位反应和疱疹病毒感染发病率 Safety eoP2 与 FDA 和 EMA 的会议为全球三期广告计划的进展情况寻求伙伴关系以推进注册计划下一步试验已完成

CBP-201:中国在AD领域的关键试验
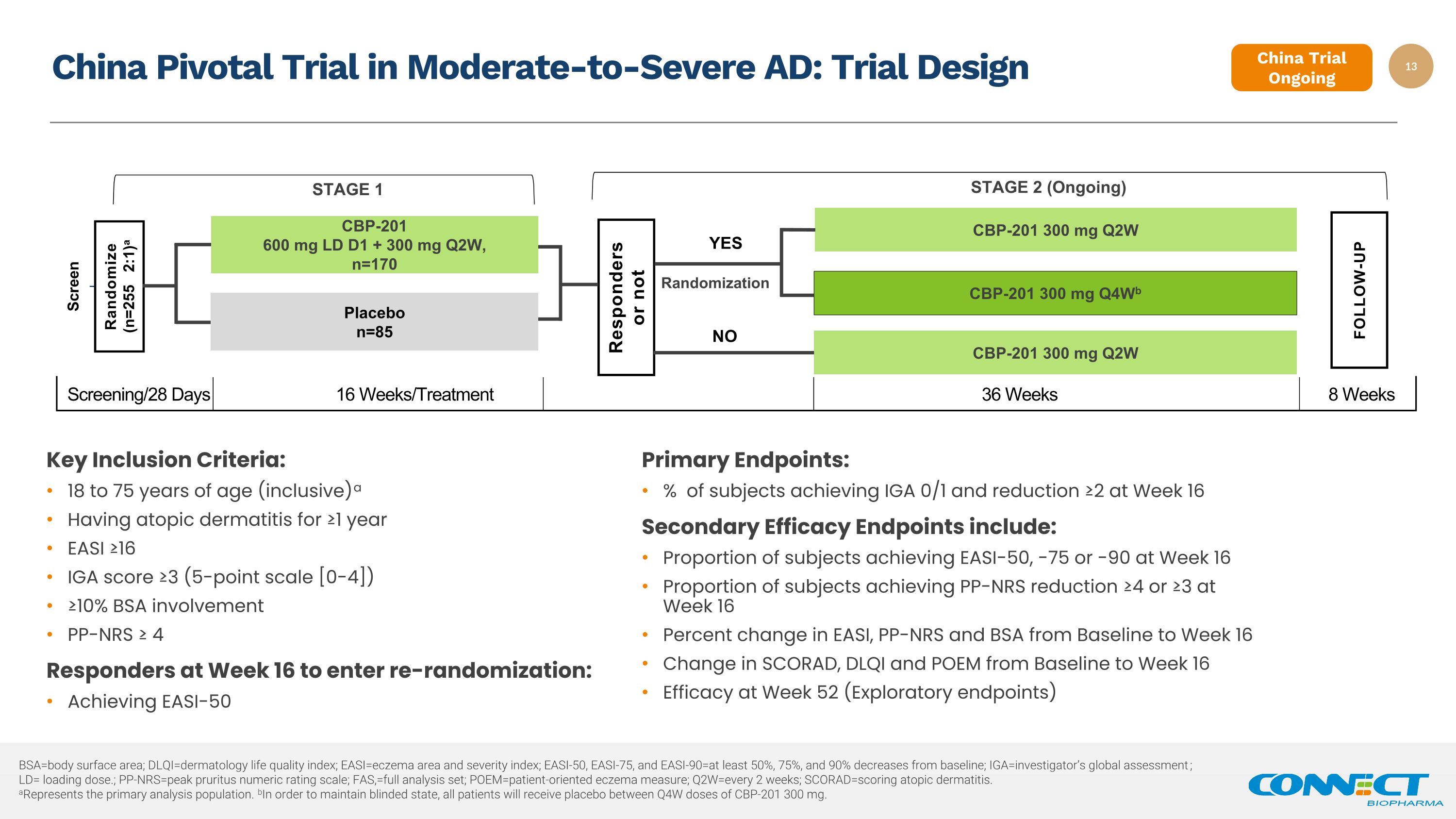
中度至重度 AD 随机化中国关键试验:试验设计反应者与否第 1 阶段安慰剂 n=85 屏幕随机化(n=255 2:1)a CBP-201 600 mg LD D1 + 300 mg Q2W,n=170 第 2 阶段(正在进行中)CBP-201 300 mg Q2W CBP-201 300 mg Q2W 关键纳入标准:18 至 75 岁(含)a 患有过敏反应 ≥1 年 EASI ≥16 IGA 分数 ≥3(5 分制)CBP-201 [0-4]) ≥ 10% BSA 参与 PP-NRS ≥ 4 名应答者在第 16 周进入重新随机分组:达到 EASI-50 主要终点:在第 16 周达到 IGA 0/1 且降低 ≥2 的受试者百分比次要疗效终点包括:第 16 周达到 EASI-50、-75 或 -90 的受试者比例第 16 周达到 PP-NRS 降低 ≥4 或 ≥3 的受试者比例 EASI、PP-NRS 和 BSA 从基线到 BSA 的变化百分比第 16 周 SCORAD、DLQI 和 POEM 在第 52 周(探索性终点)筛查/28 天 16 周/治疗 36 周后从基线到第 16 周疗效的变化UP 是否 8 周 bsa=身体表面积;dlqi=皮肤科生活质量指数;easi=湿疹面积和严重程度指数;EASI-50、EASI-75 和 easi-90=比基线至少下降50%、75%和90%;Iga=Investor的全球评估;LD= 负荷剂量。;pp-nrs=皮肤瘙痒症峰值分级量表;FAS,=全套分析集;poem=以患者为导向的湿疹测量;q2w=每 2 周一次;scorad=评分过敏性皮炎。a代表主要分析人群。为了维持失明状态,所有患者都将接受介于 Q4W 剂量 CBP-201 300 mg 之间的安慰剂。中国审判正在进行中

中国AD关键试验:基线人口统计学和疾病特征* CBP-201 N=170 安慰剂 N=85 总年龄(岁)平均值(SD)中位数(最小,最大)39.3 (16.1) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) 39.7 (16.5) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) 36.0 (18, 74) (39%) 90 (35%) 体重指数 (kg/m2),平均值 (SD) 中位数(最小,最大)23.9 (4.1) 23.6 (14.8, 47.1) 25.0 (4.7) 24.6 (18.1, 46.9) 24.3 (14.8, 47.1) IGA,n (%) 3(中度)4(严重)78(45.9%)92(54.1%)38 (44.7%) 47 (55.3%) 116 (45.5%) 139 (54.5%) EASI 分数,平均值 (SD) 中位数(最小,最大)29.6 (11.9) 27.3 (16.0, 72.0) 29.3 (12.0) 26.3 (16.0, 66.9) 29.5 (11.9) 26.9 (16.0, 72.0) BSA 参与百分比平均值 (SD) 中位数 (最小, 最大) 48.7 (20.8) 44.3 (13.5, 100.0) 48.4 (21.4) 45.0 (18.0, 100.0) 48.6 (20.9) 44.5 (13.5, 100.0) PP-NRS 平均值 (SD) 中位数(最小,最大)7.2 (1.8) 7.0 (2, 10) 7.0 (2, 10) 7.0 (2, 10) 7.0 (2, 10) DLQI 平均值 (SD) 中位数(最小,最大)15.9 (7.3) 16.0 (1, 30) 15.6 (6.0) 14.0 (5, 30) 15.8 (5, 30) 15.8 (5, 30) 15.8 (5, 30) 15.8 (6.9) 15.0 (1, 30) ad=过敏性皮炎;bsa=身体表面积;BMI,=体重指数。easi=湿疹区域和严重程度指数;iga=研究者的全球评估;pp-nrs=peak pruritus 数字评级 dlqi=Dermatology 生活质量指数;sd=标准差。a代表主要分析人群。人口统计数据代表中度至重度 AD 患者,符合预期的基线值。中国试验正在进行中
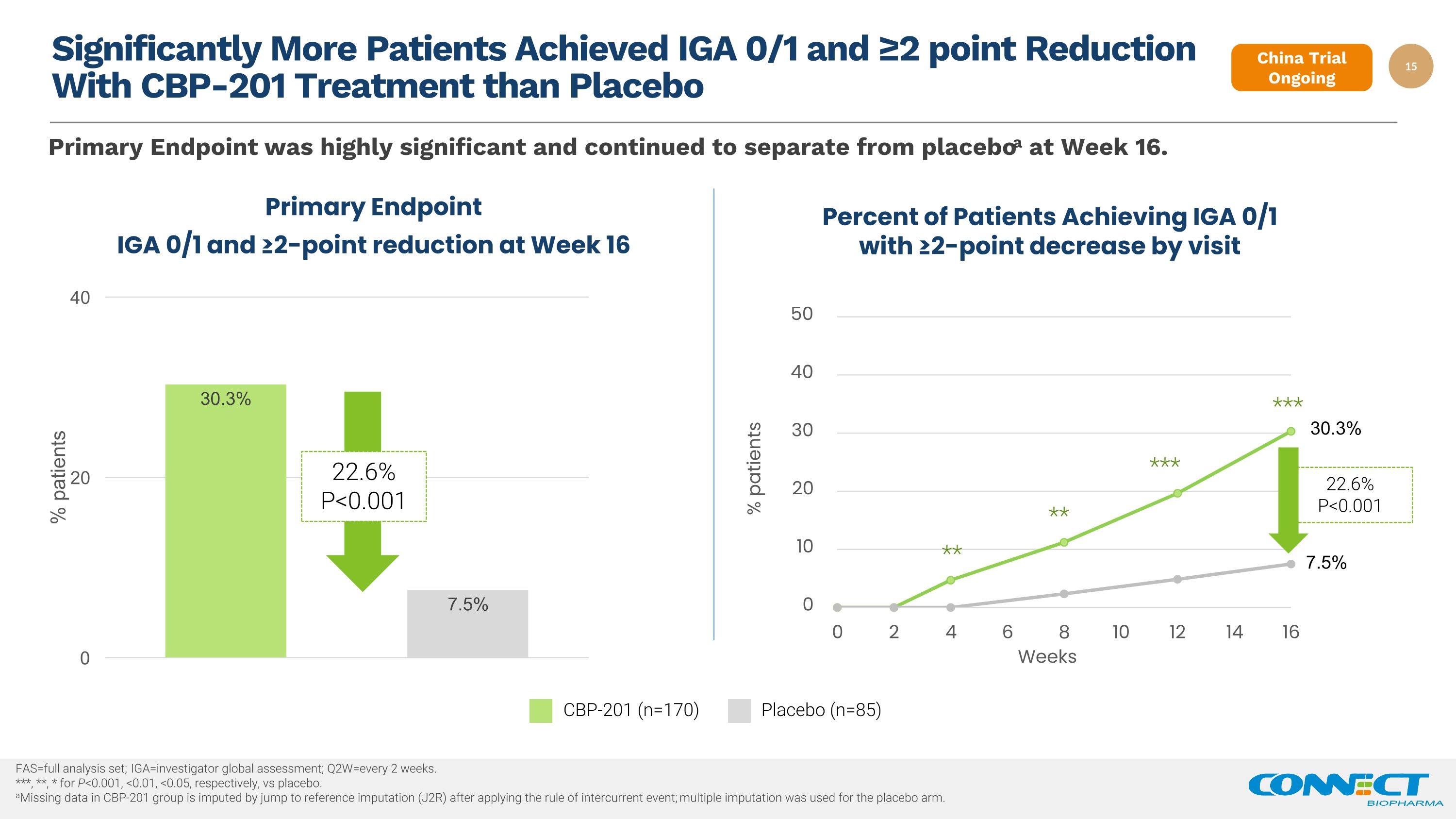
通过 CBP-201 治疗实现 IGA 0/1 和 ≥2 分降低的患者明显多于安慰剂 fas=完整分析集;Iga=Investor 全球评估;q2w=每 2 周一次。***、**、* for
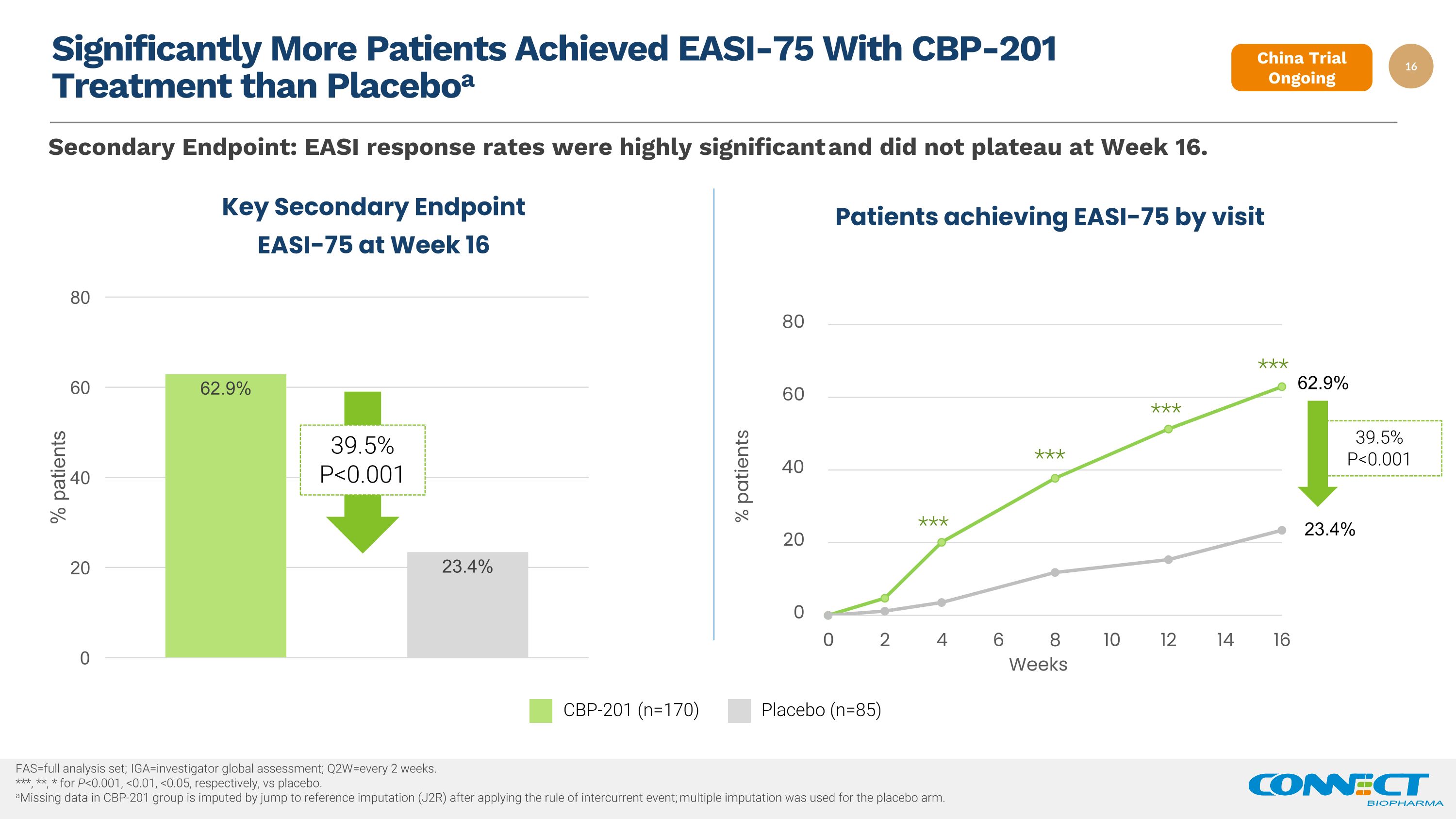
通过 CBP-201 治疗获得 EASI-75 的患者明显多于 Placeboa fas=完整分析集;iga=Invesitor 全球评估;q2w=每 2 周一次。***、**、* for p
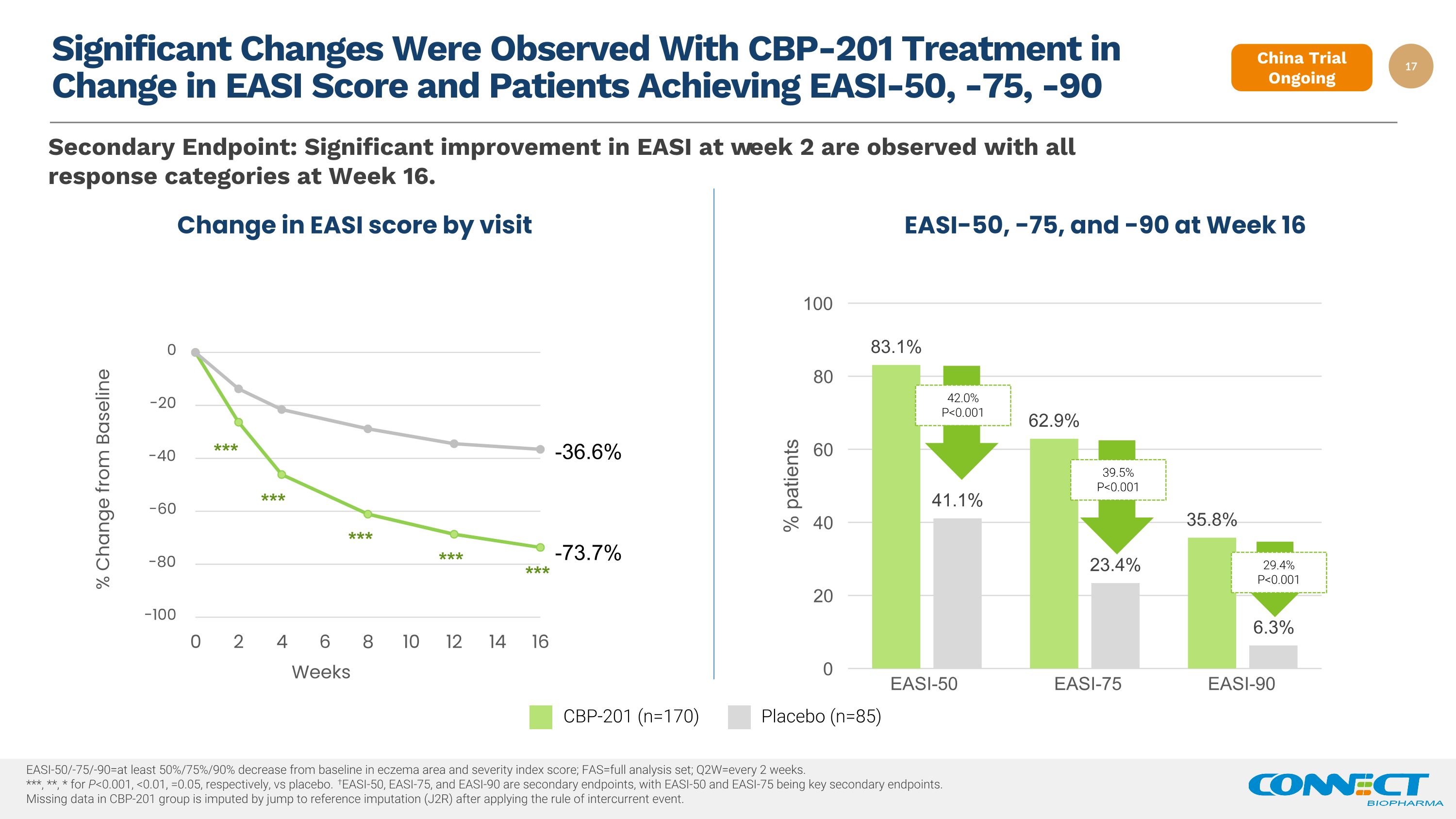
观察到 CBP-201 治疗的EASI分数发生了显著变化,患者在第 16 周达到 EASI-50、-75、-90 EASI-50、-75 和 -90 第二终点:观察到第 2 周的 EASI 都有显著改善,所有反应类别在第 16 周均有显著改善。easi-50/-75/-90=湿疹区域和严重程度指数分数比基线下降至少 50%/75%/90%;fas=完整分析集;q2w=每 2 周一次。***、**、* for

CBP-201 治疗观察到 pruritus/Itch 的显著持续改善 pp-nrs=peak pruritus 数值评级量表;fas=完整分析集;q2w=每 2 周一次。***、**、* for p

第 1 阶段 CBP-201 的安全性结果总体耐受性良好,没有新的安全信号。主要分析人群。麻烦疱疹 TEAE 是:“单纯疱疹”(每个治疗组 n=1);“单纯疱疹再激活” 和 “口腔疱疹”(在 CBP-201 组中均为 n=1);“带状疱疹”(安慰剂组 n=1)。c过敏反应患者仍在研究中接受了研究药物。治疗紧急不良事件 (TEAE) 概述一项中国试验正在进行中 n (%) 患者 CBP-201 N=170 placebon=85 任何 TEAE 125 (73.5%) 62 (72.9%) 与研究药物 54 (31.8%) 20 (23.5%) 重度 TEAE(3 级)4(2.4%)5 5.9%) TEAE 导致研究药物停用 1 (0.6%) 0 疱疹病毒感染* 1 (0.6%) 1 (1.2%) n (%) 患者 CBP-201 N=170 placebon=85 结膜炎 8 (4.7%) 3 (3.5%) 角膜炎 2 (1.2%) 0 过敏反应(轻度,与研究药物无关)1 (0.6%) 0 注射部位持续时间超过 24 小时的反应(均为轻度)11(6.5%)0 注射部位反应:主要包括红斑、硬结和水肿,均未导致停药未观察到以下任何具有特殊意义的 TEAE:“AST/ALT 升高 >5×ULN”、“寄生虫感染和机会性感染”、“妊娠”、“症状性服药过量” 严重 TEAE:半月板损伤、骨性关节炎接受 CBP-201 治疗的患者出现关节病变和肌腱炎;3 名接受安慰剂 Special Interesta 预先指定 TEAE 的患者的撕脱性骨折、肱骨骨骨折、胃溃疡
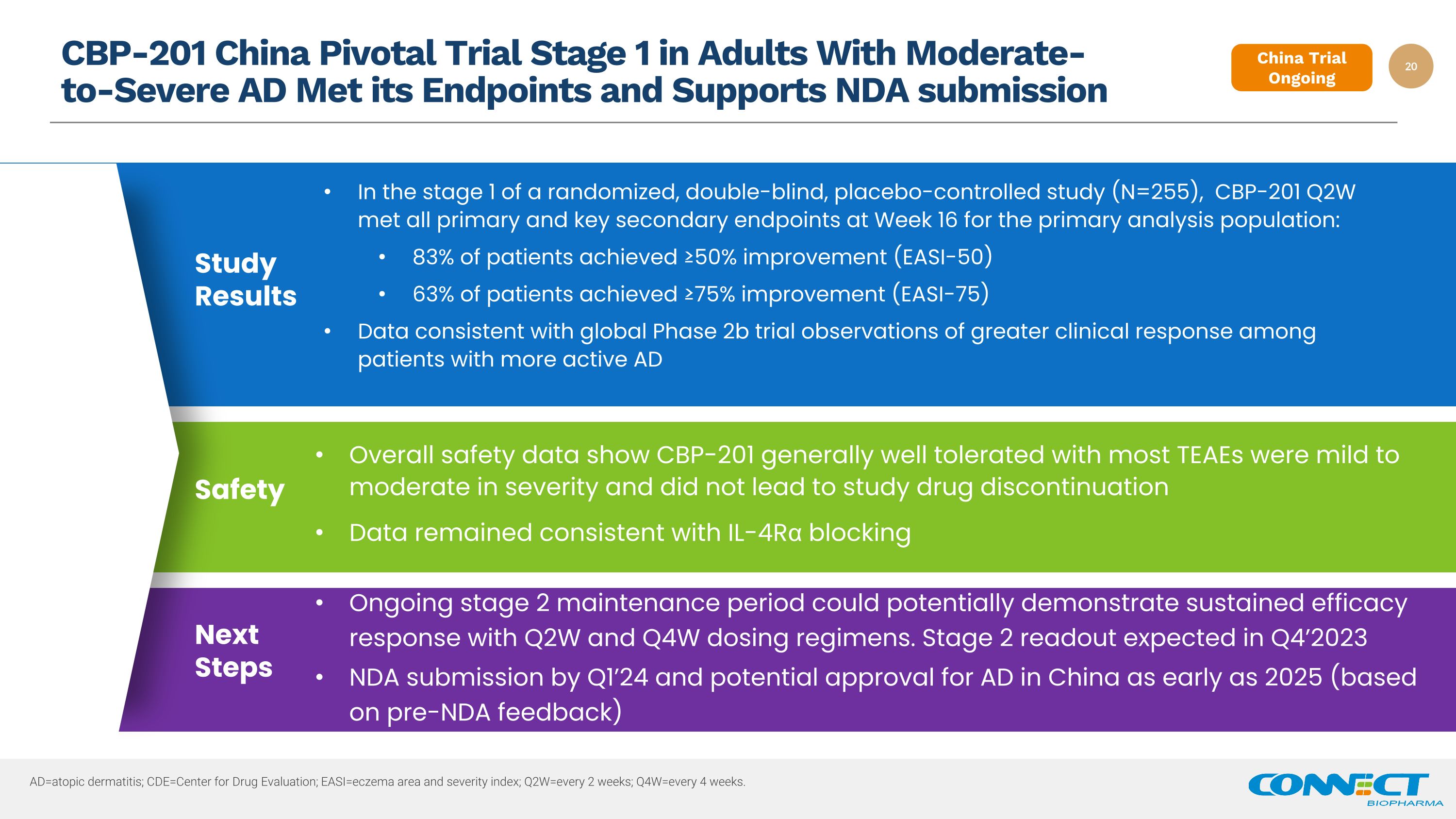
CBP-201 中国针对中度至重度 AD 成人的 Pivotal 试验第 1 阶段已达到终点并支持提交新药申请 ad=Atopic 皮炎;CDE=药物评估中心;easi=eachema 区域和严重程度指数;q2w=每 2 周一次;q4w=每 4 周一次。持续的第 2 阶段维持期可能显示出 Q2W 和 Q4W 给药方案具有持续的疗效反应。预计在 2023 年第 4 季度提交的 NDA 中将公布第 2 阶段读数,最早可能在 2025 年中国获批 AD(基于新药上市前反馈)下一步安全性数据显示,大多数 TEAE 的 CBP-201 总体耐受性良好,严重程度为轻度至中度,未导致研究药物停用数据与 IL-4Rα 阻断研究结果在随机、双盲、安慰剂对照研究的第 1 阶段(N=255),CBP-201 Q2W 在第 16 周达到了主要分析人群的所有主要和关键次要终点:83%患者实现了 ≥ 50% 的改善 (EASI-50) 63% 的患者实现了 ≥ 75% 的改善 (EASI-75) 数据与全球 2b 期试验的观察结果一致,即 AD 活跃患者临床反应更强的观察结果中国试验正在进行中

CBP-201:哮喘全球2b期

关键纳入标准中度至重度不受控制的哮喘在筛查前 1 个月使用中到高剂量吸入性皮质类固醇与第二种缓解剂/对照剂(例如 LABA、LTRA、LAMA 或 theophyline)联合使用中至高剂量吸入性皮质类固醇的现有治疗持续至少 3 个月,且在筛查前 1 个月就诊 pre-bronchodilator FEV1,为随机分期筛查血液中嗜酸性粒细胞的预测正常值的 40 至 85% 随机分组前 1 次和第 2 次就诊时计数 ≥ 300 个细胞/μLA ACQ-6 分数 ≥1.5 在前 12 个月内至少记录了 1 例哮喘发作截至知情同意之日第 12 周 FEV1 主要终点与基线相比的变化次要疗效终点其他时间点肺功能与基线的变化哮喘 pRO(ACQ-6,症状日记)PD 标志物(FENO、嗜酸性粒细胞、ECP、骨膜素、TARC)救援药物使用 CBP-201 全球阶段 2b 在哮喘中的使用:试验设计 acq-6=哮喘控制问卷 6 问题版本;feno=分量呼出硝酸氧化物;fev1=1 秒时强制呼气量。a代表当前包含标准。专为剂量范围设计(NCT04773678)的试验;预计将在2023年下半年公布顶点读数。CBP-201、600 mg LD D1 + 150 mg Q2W、n=102 筛查/28 天内运行 CBP-201、600 mg LD D1 + 300 mg Q2W、n=102 安慰剂、n=102 随访 24 周/治疗 8 周随机化 1:1:1 n=306 一项多中心、随机、双盲、平行组、安慰剂对照 CBP-201 对中度至重度持续性哮喘患者的疗效和安全性研究 2 型炎症试验正在进行中

CBP-201:治疗AD和哮喘的晚期、分化型IL-4Rα抑制剂在临床疗效和安全性数据的支持下在第16周对超过475名中度至重度AD患者的全球2b期和中国关键/1期试验均取得主要和关键次要结果 300mg Q2W 和 300mg Q4W 剂量均显示出皮肤清除率、疾病严重程度和瘙痒方面的显著改善 2b 期试验的安慰剂总体安全数据显示,CBP-201 的耐受性总体上良好,与阻断 IL-4Rα 信号一致固有特征(结合位置、亲和力、效力)和现有证据(体外数据、PK 数据)表明,与其他生物制剂相比,CBP-201 可能具有更具竞争力的 PK/PD 特征。具有快速、高水平和持久反应的差异化给药方案的潜力 2023 年第四季度:2024 年第 2 季度中国关键试验第 2 阶段读数:NDA 提交并可能获批 AD(基于新药上市前反馈):2023 年第四季度:2024 年第 2 季度的 NDA 提交和潜在批准:2023 年哮喘第 2 阶段的头条数据
Icanbelimod (CBP-307):正在开发的用于炎症性肠病 (IBD) 的下一代选择性鞘氨醇受体 1 (S1P1) 调节剂
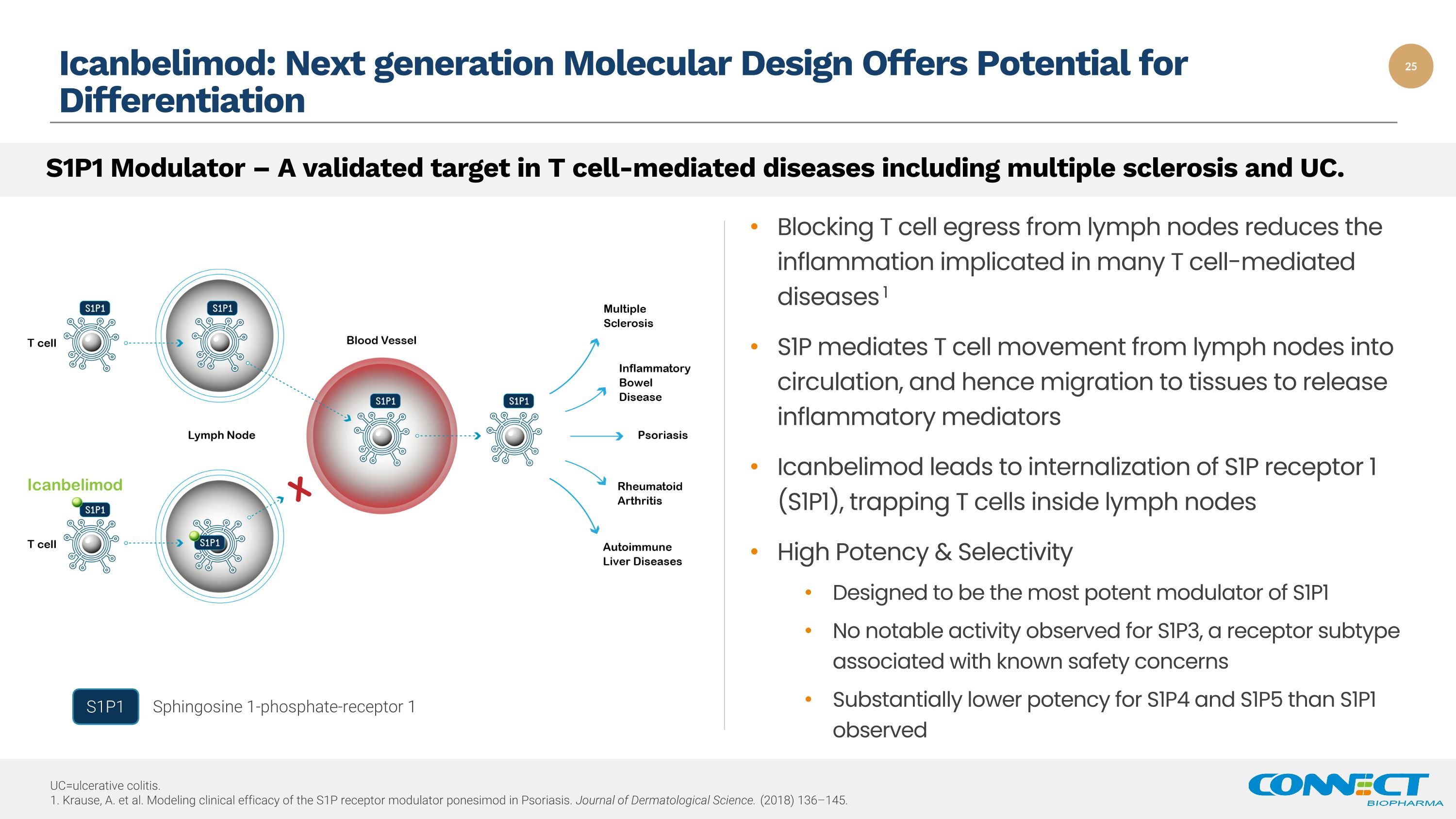
Icanbelimod:下一代分子设计为分化提供潜力阻止 T 细胞从淋巴结流出可减少与许多 T 细胞介导的疾病相关的炎症 1 S1P 介导 T 细胞从淋巴结进入血液循环,从而迁移到组织释放炎症介质 Icanbelimod 导致 S1P 受体 1 (S1P1) 的内化,将 T 细胞捕获在淋巴结内部 High potency & Selepticy & Seleancy 活性旨在成为 S1P1 最有效的调节剂 S1P3(一种相关的受体亚型)未观察到明显的活性存在已知的安全问题,S1P4和S1P5的效力明显低于S1P1观察到的S1P1调节剂——这是包括多发性硬化症和UC在内的T细胞介导疾病的有效靶标。S1P1 鞘氨醇 1-磷酸盐受体 1 uc=溃疡性结肠炎。1.Krause,A. 等人。模拟牛皮癣中S1P受体调节剂ponesimod的临床疗效。《皮肤病学杂志》。(2018) 136—145。

溃疡性结肠炎(UC):差异化同类最佳S1P1调节剂的巨大市场机会一种导致结肠和直肠内膜(大肠)发炎和溃疡的自身免疫性疾病。到20282年,UC S1P WW市场>25亿美元 UC WW 市场复合年增长率 2021-20282 年 +9.3% UC WW 市场复合年增长率 +9.3%(高于 2021 年的59亿美元)2 > 110亿美元溃疡性结肠炎。自然评论。疾病引物。2020. 6:74。https://doi.org/10.1038/s41572-020-0205-x 评估来自2023年5月的制药市场数据。当前的治疗局限性:疗效不到一半的患者实现长期缓解,许多药物会失去初始疗效反应1 最大临床缓解可能需要长达一年的治疗安全隐患多种治疗选择的安全问题生物制剂给药方案的不便性 S1P1 发挥作用的关键机会:提高疗效更快的疗效起效增强的风险收益特征新的口服疗法
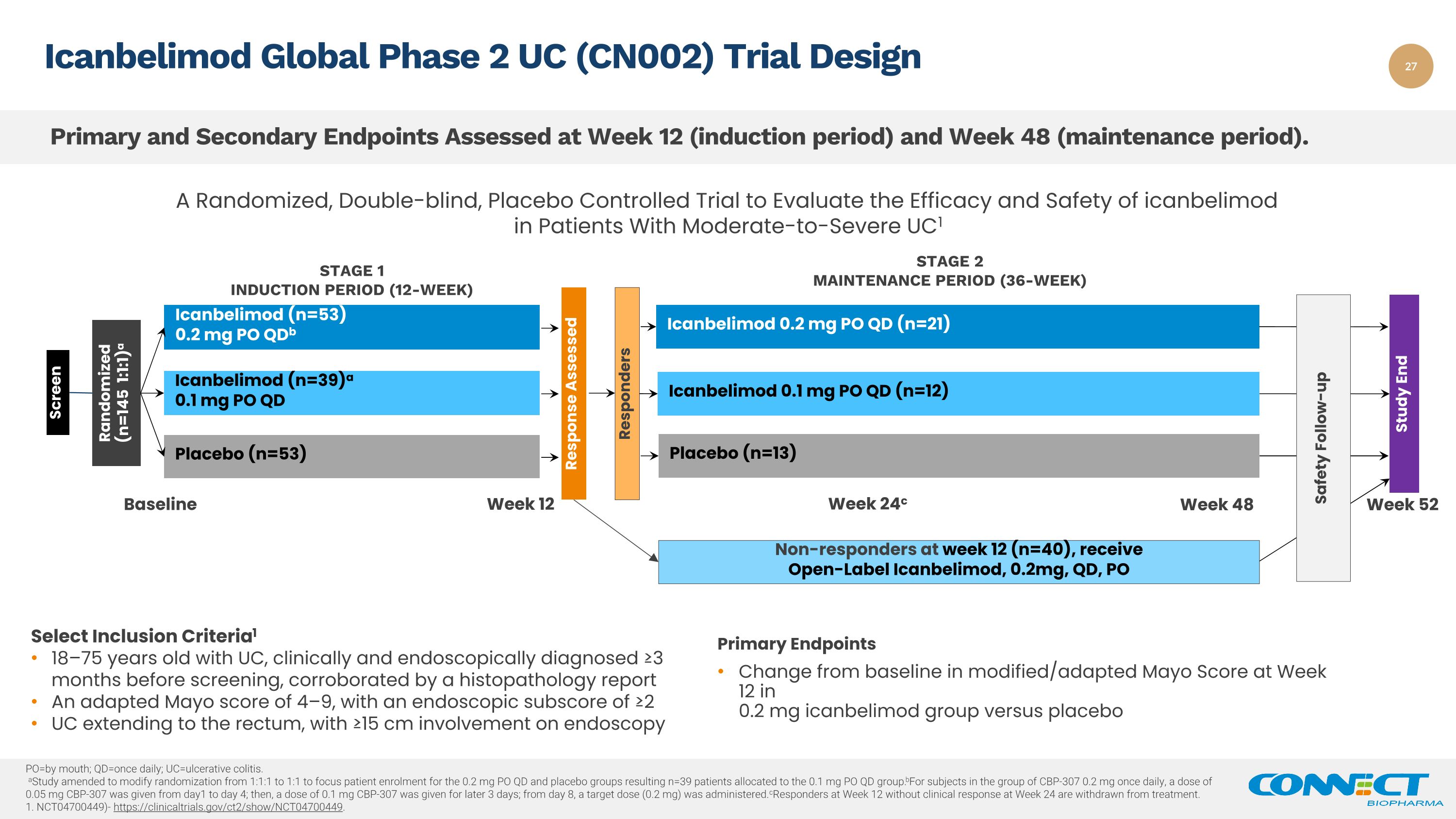
在第 12 周(入职期)和第 48 周(维护期)评估主要和次要终端。Icanbelimod Global 2 期 UC (CN002) 试验设计反应评估第 1 阶段诱导期(12 周)安慰剂(n=53)筛查随机(n=145 1:1:1)a icanbelimod(n=53)a 0.1 mg PO QD 一项评估伊坎贝利莫德在患者中的疗效和安全性的随机、双盲、安慰剂对照试验对于中度至重度 UC1 反应者第 2 阶段维持期(36 周)Icanbelimod 0.1 mg PO QD (n=12) 安慰剂 (n=13) Icanbelimod 0.2 mg PO QD (n=21) 非反应者,在第 12 周(n=40)接受开放标签 Icanbelimod、0.2mg、QD、PO研究结束基线第 12 周 48 周 52 周 24c 安全随访 po=by by by;qd=每天一次;uc=溃疡性结肠炎。一项研究经过修正,将随机分组从 1:1:1 修改为 1:1,将患者入组的重点放在 0.2 mg PO QD 组,结果为 n=39 名患者分配给 0.1 mg PO QD 组。b对于 CBP-307 组的受试者,每天一次 0.2 mg,剂量为 0.05 从第 1 天到第 4 天服用 mg CBP-307;然后,在随后 3 天服用 0.1 mg CBP-307 的剂量;从第 8 天开始,服用目标剂量(0.2 mg)。第 12 周的 cresponders 没有临床用药第 24 周的反应已停止治疗。1.NCT04700449)-https://clinicaltrials.gov/ct2/show/NCT04700449。选择纳入标准1 18—75 岁患有 UC 的患者,在筛查前 ≥3 个月经临床和内窥镜诊断出患有 UC,组织病理学报告证实了适应性的 Mayo 评分为 4—9,内窥镜亚分数为 ≥2 UC 延伸至直肠,参与内窥镜检查 ≥15 cm 主要终点与 0.2 mg icanbelimod 组中修改/适应的 Mayo 评分与基线的变化 bo
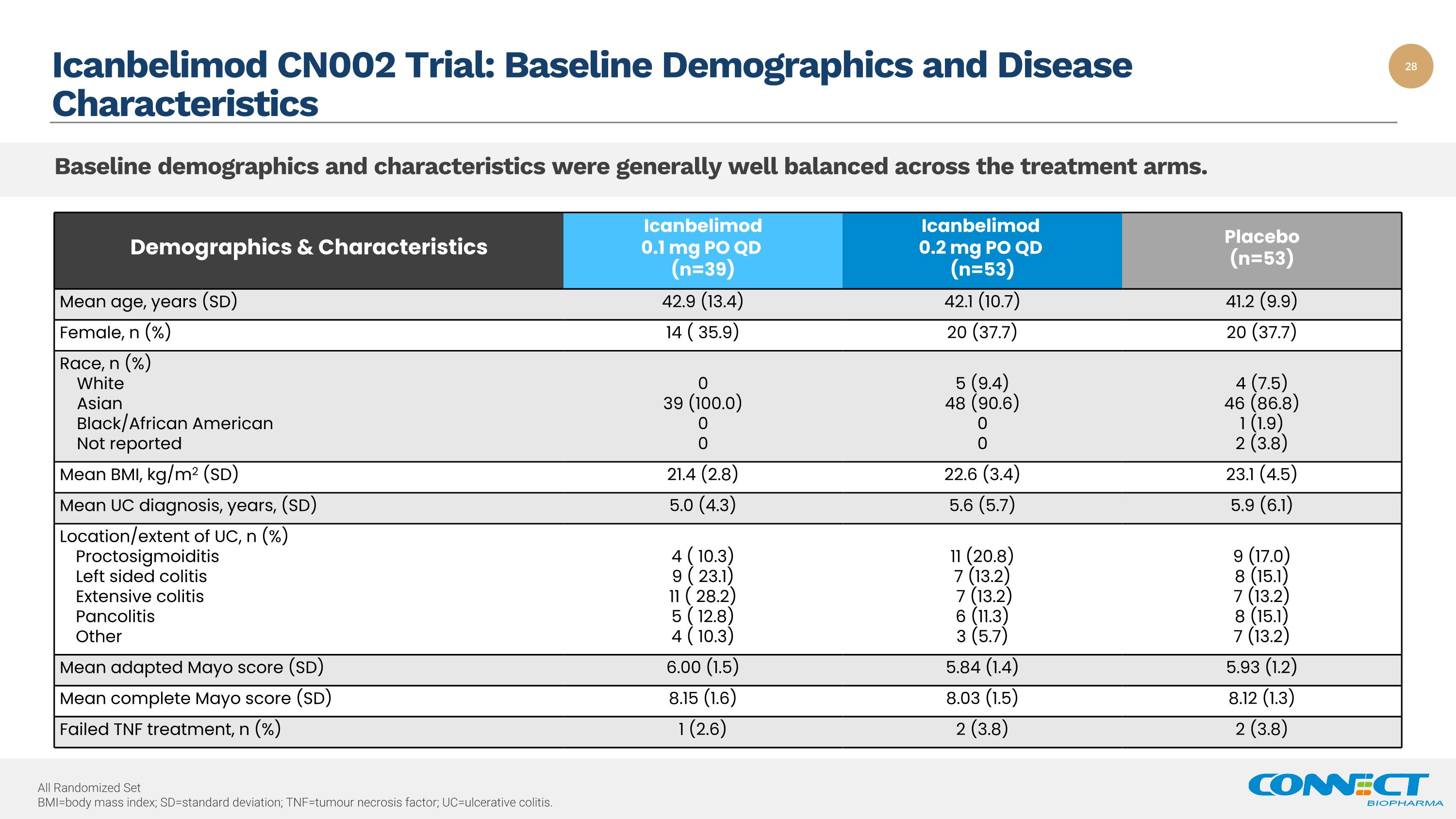
人口统计与特征 Icanbelimod 0.1 mg PO QD (n=39) Icanbelimod 0.2 mg PO QD (n=53) 安慰剂 (n=53) 平均年龄,岁 (SD) 42.9 (13.4) 42.1 (10.7) 41.2 (9.9) 女性,n (%) 14 (35.9) 20 (37.7) 种族,n (%) 亚裔白人黑人/非裔美国人未报告 0 39 (100.0) 0 5 (9.4) 48 (90.6) 0 0 4 (7.5) 46 (86.8) 1 (1.9) 2 (3.8) 平均体重指数,kg/m2 (SD) 21.4 (2.8) 22.6 (3.4) 23.1 (4.5) UC 的平均诊断,年份,(SD) 5.0 (4.3) 5.6 (5.7) 5.9 (6.1) UC 的位置/范围,n (%) Propo 乙状结肠炎左侧结肠炎广泛性结肠炎泛结肠炎其他 4 (10.3)9 (23.1) 11 (28.2) 5 (12.8) 4 (10.3) 11 (20.8) 7 (13.2) 7 (13.2) 6 (11.3) 3 (5.7) 9 (17.0) 8 (15.1) 7 (13.2) 梅奥平均分数 (SD) 6.00 (1.5) 5.93 (1.2) Mean complete o 分数 (SD) 8.15 (1.6) 8.03 (1.5) 8.12 (1.3) 肿瘤坏死因子治疗失败,n (%) 1 (2.6) 2 (3.8) 2 (3.8) Icanbelimod CN002 试验:基线人口统计和疾病特征各治疗组的基线人口统计和特征总体上保持了良好的平衡。全部随机集 bmi=体重指数;sd=标准差;tnf=肿瘤坏死因子;uc=溃疡性结肠炎。
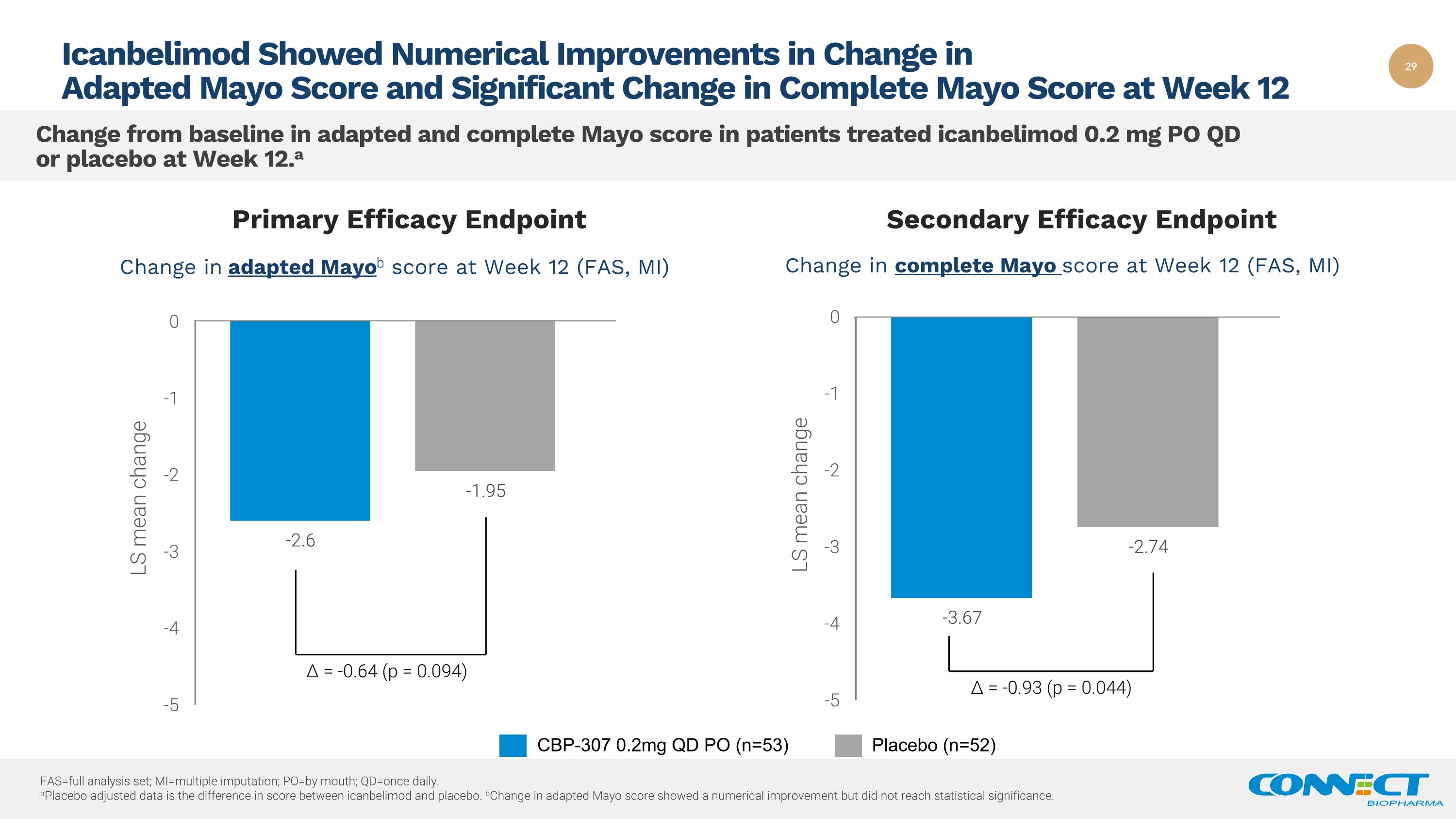
fas=完整分析集;mi=多重插补;po=by mouth;qd=每日一次。安慰剂调整后的数据是icanbelimod和安慰剂之间的分数差异。适应性梅奥评分的b变化显示出数值改善,但未达到统计学意义。Icanbelimod 显示,第 12 周接受过艾康贝利莫德治疗的患者的适应性梅奥评分变化在数字上有所改善,完全梅奥分数与基线相比发生了变化 12 周(FAS、MI)第 12 周(FAS、MI)完全梅奥分数的变化 Δ= -0.93(p = 0.044) Δ= -0.64 (p = 0.094) 主要功效终点次要疗效终点 CBP-307 0.2mg QD PO (n=53) 安慰剂 (n=52)

在第12周接受艾康贝利莫德 0.2 mg PO QD 或安慰剂治疗的患者中,获得临床缓解、临床反应和内窥镜改善的患者比例。接受伊坎贝利莫德治疗的患者在第 12 周表现出临床反应并实现临床缓解明显增加 Δ= 20.1% (p = 0.039) Δ= 18.7% (p = 0.016) 临床缓解第 12 周 (FAS、NRI) a 临床反应第 12 周 (FAS、NRI) a 内窥镜改善第 12 周 (FAS、NRI) CBP-307 0.2mg QD PO (n=53) 安慰剂 (n=52)) Δ= 9.0% (p = 0.295) 临床缓解:直肠出血 (RB) = 0;大便频率 (SF) ≤1;内窥镜检查 ≤1。临床反应:梅奥降低 ≥2 个百分点和 ≥ 30%,RB 或绝对的 RB 降低 ≥1。内窥镜改善:内窥镜分数 ≤1。基于调整后的 Mayo 分数。

接受艾康贝利莫德0.2 mg治疗的患者在第48周维持或实现临床缓解、临床反应和内窥镜改善的比例。在诱导期结束时表现出临床反应的患者中,伊坎贝利莫德持续临床缓解至第 48 周临床缓解:直肠出血 (RB) = 0;大便频率 (SF) ≤1;内窥镜检查 ≤1。临床反应:梅奥降低 ≥2 个百分点和 ≥ 30%,RB 或绝对的 RB 降低 ≥1。内窥镜改善:内窥镜分数 ≤1。临床反应内窥镜改善第 48 周(FAS、NRI)第 48 周临床反应持续、临床缓解或内窥镜改善的患者的临床缓解百分比(FAS、NRI)第 48 周出现临床反应的患者的疗效反应 n = 13/21 12/21 n = 13/21 8/10 9/11
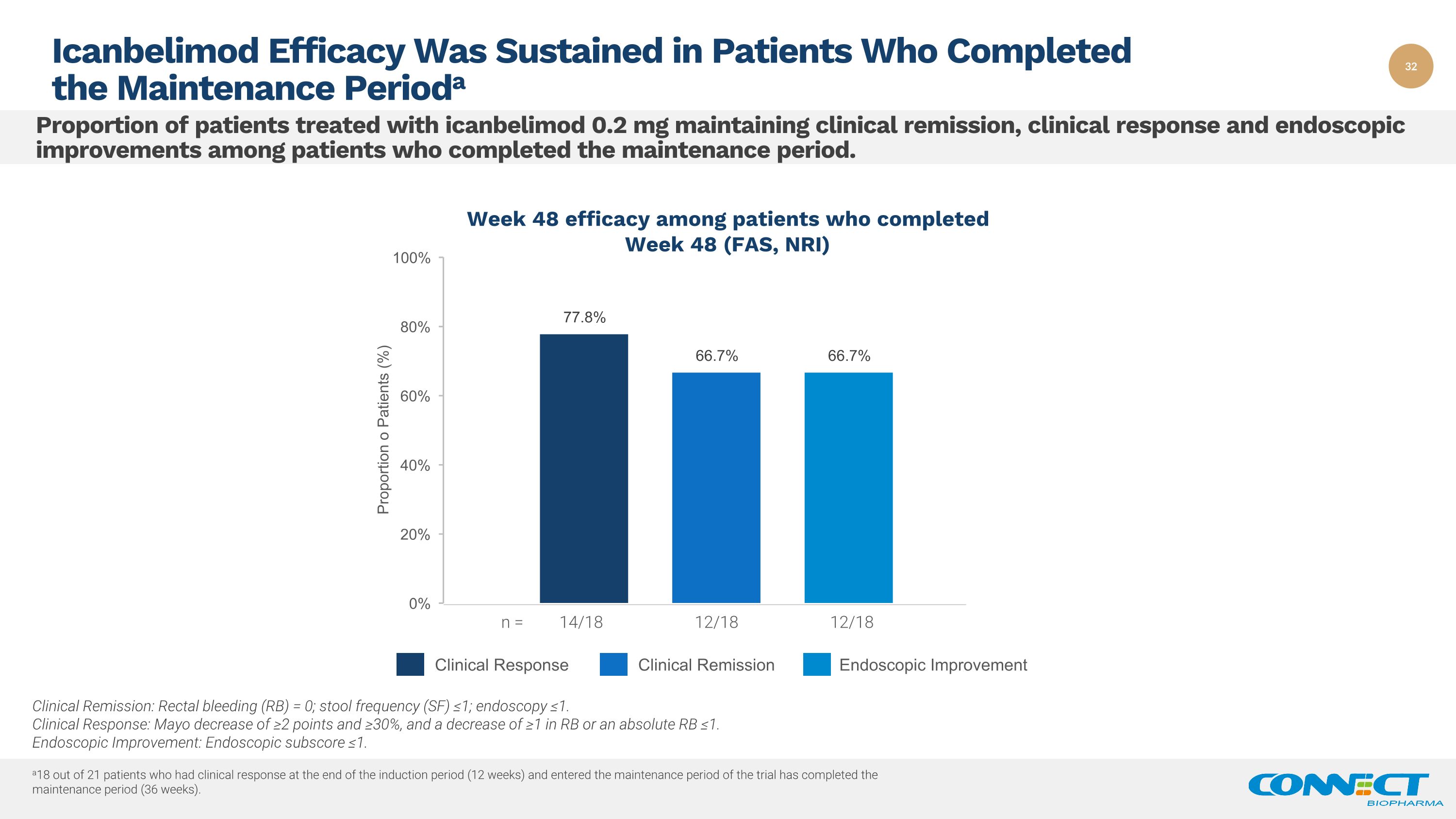
在完成维持期的患者中,接受艾康贝利莫德0.2 mg治疗的患者中维持临床缓解、临床反应和内窥镜改善的比例。Icanbelimod 对完成维持期临床缓解的患者疗效持续:直肠出血 (RB) = 0;大便频率 (SF) ≤1;内窥镜检查 ≤1。临床反应:梅奥降低 ≥2 个百分点和 ≥ 30%,RB 或绝对的 RB 降低 ≥1。内窥镜改善:内窥镜分数 ≤1。临床反应内窥镜改善临床缓解第48周的患者在第48周(FAS,NRI)n = 14/18 12/18 12/18 12/18 a21名在诱导期结束(12周)时出现临床反应并进入试验维持期的患者中,有18名已完成维持期(36周)。

安全参数受试者,n (%) Icanbelimod 0.1 mg PO QD (n=39) Icanbelimod 0.2 mg PO QD (n=53) 安慰剂 (n=52) 任何 TEAE 37 (94.9%) 47 (88.7%) 40 (76.9%) 3 级或以上 TEAE 10 (25.6%) 4 (7.7%) 4 (7.7%) 药物相关 TEAE 23 (59.0%) 34 (64.2%) 20 (38.5%) 药物相关等级 3 或更高 TEAE 5 (12.8%) 3 (5.7%) 0 Serious TEAE 6 (15.4%) 2 (3.4%) 2 (3.4%) 3 (5.8%) 3 (5.8%) 3 (5.8%) 0 TEAE 导致死亡 0 0 TEAE of Special 利息 6 (15.4%) 3 (5.7%) 0 Icanbelimod CN002 试用:安全12 周诱导期(第 1 阶段)的结果 1 阶段的总体安全结果 qd=每日一次;sae=严重不良事件;teae=Treatment-Emergent 不良事件。总体而言,Icanbelimod 组,包括与药物相关的 TEAE 和具有特殊意义的 TEAE,更为常见。大多数 TEAE 的严重程度为轻度和中度 Icanbelimod 0.2 mg QD 显示出与安慰剂相似的 SAE 和 TEAE 的频率与安慰剂相似。没有报告进行性多灶性白质脑病病病例,也没有死亡报告
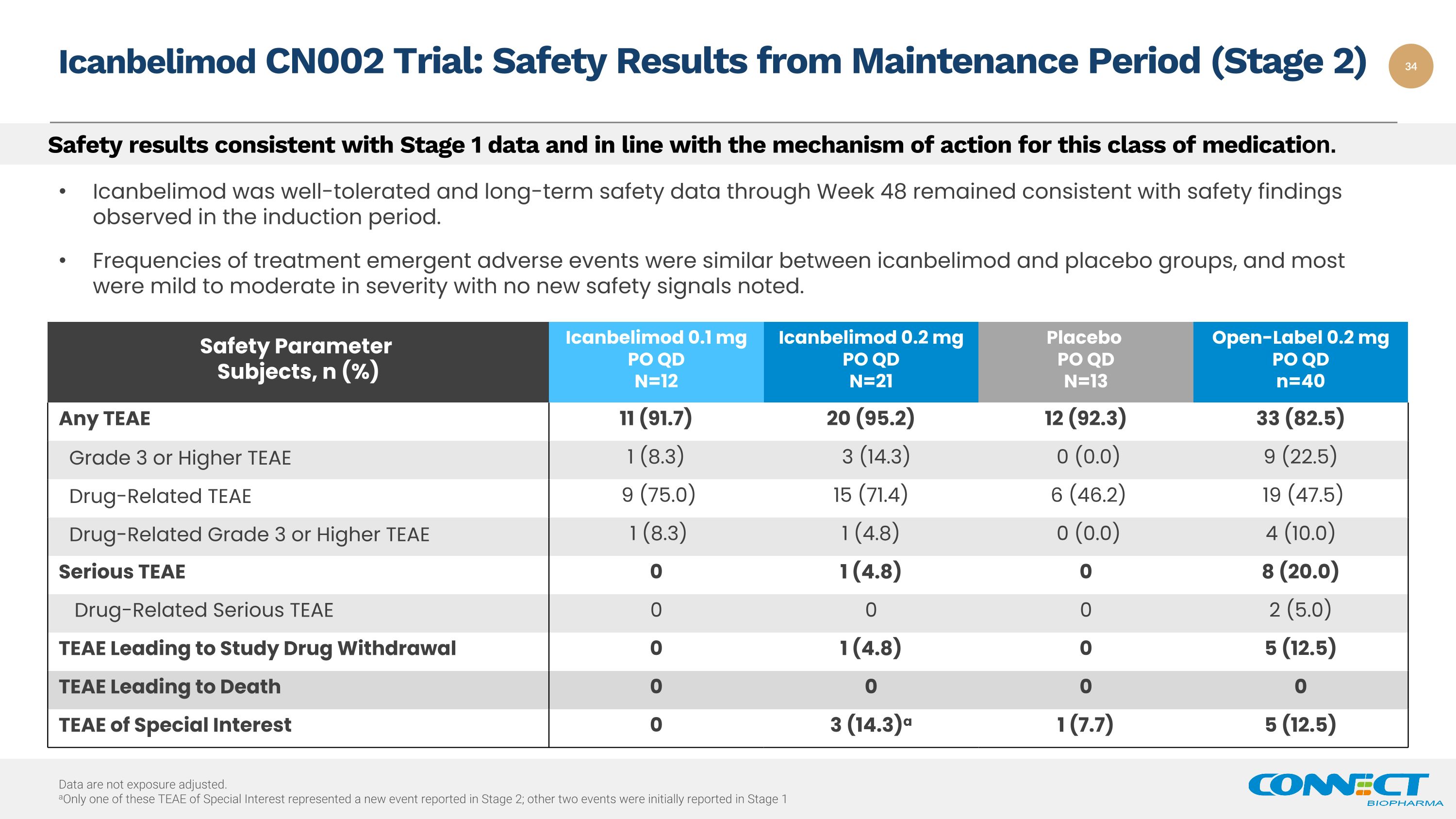
安全结果与第一阶段的数据一致,也符合此类药物的作用机制。安全参数受试者,n (%) Icanbelimod 0.1 mg PO QD N=12 Icanbelimod 0.2 mg PO QD N=21 安慰剂 PO QD N=13 开放标签 0.2 mg PO QD n=40 任何 TEAE 11 (91.7) 20 (95.2) 12 (92.3) 33 (82.5) 0 (8.3) 3 (14.3) 0 (0.0) 9 (2AE) 2.5) 毒品相关 TEAE 9 (75.0) 15 (71.4) 6 (46.2) 19 (47.5) 毒品相关等级 3 或更高 TEAE 1 (8.3) 1 (4.8) 0 (0.0) 4 (10.0) Serious TEAE 0 1 (4.8) 0 1 (4.8) 0 8 (20.0) 毒品相关严重 TEAE 0 0 0 0 2 (5.0) TEAE 导致研究戒毒 0 1 (4.8) 0 5 (12.5) TEAE Leading to Death 0 0 0 TEAE of Special Interest 0 3 (14.3)a 1 (7.7) 5 (12.5) 数据未经过暴露调整。a这些特别感兴趣的TEAE中只有一个代表了第二阶段报告的新事件;另外两个事件最初是在第 1 阶段 Icanbelimod CN002 试验中报告的:维护期(第 2 阶段)的安全结果 Icanbelimod 耐受性良好,截至第 48 周的长期安全数据与诱导期观察到的安全发现保持一致。icanbelimod和安慰剂组的治疗突发不良事件发生频率相似,大多数的严重程度为轻度至中度,没有发现新的安全信号。

Icanbelimod CN002 试验 — 药效学 endpointAbsolute 淋巴细胞计数 (ALC) 和第 12 周 (FAS) 的百分比变化代表主要分析人群。Icanbelimod 在 12 周内减少了外周淋巴细胞计数。a 绝对淋巴细胞计数 (ALC) 的平均值和变化百分比 1.0 0.8 0.5 0.2 Icanbelimod 0.2mg QD PO (N=53) 安慰剂 (N=52) Icanbelimod 0.1mg QD PO (N=39)

伊坎贝利莫德治疗溃疡性结肠炎:3期准备就绪,具有同类最佳潜力,在包括第48周在内的临床疗效和安全性数据的支持下,有机会增加剂量以增强疗效下一步寻求合作伙伴关系,推动icanbelimod进入未来的UC和克罗恩病(CD)试验,以利用同类最佳潜力在诱导期,icanbelimod mod:根据调整后的 Mayo Score,12 周后显示疾病严重程度有所降低的治疗,尽管这一变化没有达到统计学意义在临床缓解方面取得了统计学意义,临床缓解是美国食品药品管理局推荐的主要终点,用于批准先前批准的治疗UC的药物,以及其他次要终点在维持期内,icanbelimod:在诱导期结束时获得临床缓解的患者中,有80%的患者在第48周表现出持续的临床缓解良好的长期安全数据,没有死亡或PML病例

行政领导郑伟、博士(Bill)Pan、博士、工商管理硕士 Chin Lee、医学博士、MPH Steve Chan、CPA Jiang Bian、京东联合创始人、首席执行官兼董事会主席首席医学官首席财务官首席法律顾问兼首席合规官 > 25 年运营、管理和筹款经验 > 20 年临床研究和药物开发经验 > 25 年企业财务、运营、国际管理、商业和筹款经验 > 在许可、知识产权和公司法领域为医疗保健和生物技术公司提供外部和内部法律咨询10年

Raul Collazo,博士 Malinda Longphre,孙雷博士,王庆健博士,博士副总裁,全球医学事务主管副总裁,临床运营主管(美国)副总裁兼生物制剂和 CMC 执行董事,临床前/非临床 > 20 年的医学/科学事务、合规、运营、企业战略和咨询经验 > 20 年哮喘和领域的研究和临床运营经验特应性皮炎 > 20 年生物制剂开发专注于工艺开发、CMC 和制造 > 30 年各种药物研发能力的临床前经验高级管理团队

投资亮点2023年第二季度:UC Ph2维持阶段完整数据 2023年下半年:过敏性皮炎关键中国52周数据哮喘Ph2头条数据广告数据将在世界皮肤病学大会上公布。专家和经验丰富的领导团队在开发生物制剂和小分子方面将在美国、欧盟、澳大利亚和中国开展全球运营和临床开发活动。一个稳健的后期产品线,在多个适应症中有积极的临床数据。CBP-201 已达到:在中国 AD 正在进行的关键性试验在第 16 周(第 1 阶段)在第 16 周,主要和关键次要终点在 AD Icanbelimod (CBP-307) 的一项全球 pH2b 试验的第 16 周的主要和关键次要终点:在加州大学的第 48 周显示出全球 pH2 的持续临床缓解利用高通量功能方法识别专有的高效和安全 T 细胞模块演员们。巨大的市场机会后期管道的短期催化剂:经验丰富的领导团队
纳斯达克:CNTB