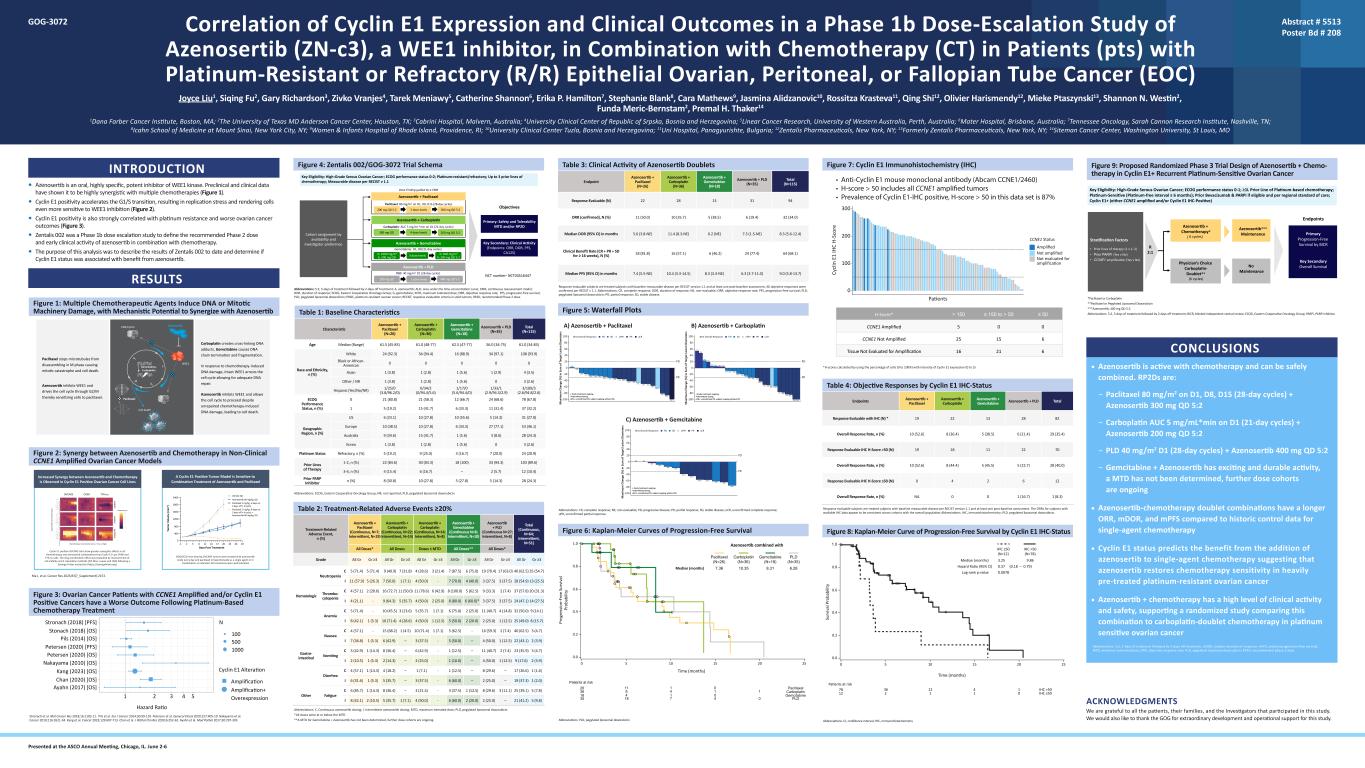
WEE1 抑制剂 Azenosertib (zn-c3) 联合化疗 (CT) 治疗铂耐药或难治性卵巢癌、腹膜癌或输卵管癌 (EOC) 患者 (pts) 的 1b 期剂量递增研究中 Cyclin E1 表达与临床结局的相关性 Joyce Liu1、Siqing Fu2、Gary Richardson2 3、Zivko Vranjes4、Tarek Meniawy5、Catherine Shannon6、Erika P. Hamilton7、Stephanie Blank8、Cara Mathews9、Jasmina Alidzanovic10、Rossitza Krasteva11、Qing Shi12、Olivier Harismendy12、Mieke Ptaszynski13、Shannon N. Westin2、FundaMeric-Bernstam2,Premal H. Thaker14 1Dana Farber 癌症研究所,马萨诸塞州波士顿;2德克萨斯州休斯敦德克萨斯大学安德森癌症中心;3澳大利亚马尔文卡布里尼医院;4波斯尼亚和黑塞哥维那塞族共和国大学临床中心;5线性癌症研究,澳大利亚珀斯西大学;6Mater 医院,澳大利亚布里斯班;7田纳西肿瘤学,莎拉·坎农研究所,田纳西州纳什维尔;8纽约州纽约市西奈山伊坎医学院;9罗德岛州普罗维登斯市罗德岛妇幼医院;10波斯尼亚和黑塞哥维那图兹拉大学临床中心;保加利亚帕纳久里什特 11Uni 医院;12Zentalis Pharmicals,纽约州纽约;13前身为纽约州纽约市 Zentalis Pharmicals;密苏里州圣路易斯华盛顿大学 14Siteman 癌症中心简介 • Azenosertib 是一种口服、高特异性、强效的 WEE1 激酶抑制剂。临床前和临床数据表明,它与多种化疗具有高度的协同作用(图 1)。• 细胞周期蛋白 E1 阳性可加速 G1/S 过渡,导致复制应激,使细胞对 WEE1 抑制更加敏感(图 2)。• Cyclin E1 阳性还与铂耐药和更差的卵巢癌预后密切相关(图 3)。• Zentalis 002 是 1b 期递增剂量旨在定义 azenosertib 与化疗联合使用的 2 期推荐剂量和早期临床活性的研究。•该分析的目的是描述Zentalis 002迄今为止的结果,并确定Cyclin E1状态是否与azenosertib的益处有关。结果图 1:多种化疗药物诱发 DNA 或有丝分裂机制损伤,具有与 Azenosertib 协同作用的机制潜力图 2:在非临床 CCNE1 扩增的卵巢癌模型中 Azenosertib 与化疗之间的协同作用 Ma J 等人Cancer Res 2023;83(7_Supplement): 2153。图 3:患有 CCNE1 扩增和/或细胞周期蛋白 E1 阳性癌症的卵巢癌患者在接受铂类化疗后的预后较差 Stronach 等人。2018 年 Mol Cancer Res;16:1103-11。皮尔斯等人2014 年 Eur J Cancer;50:99-110。彼得森等。Gynol Oncol 2020;157:405-10。中山等2010 年癌症;116:2621-34。Kang 等人。癌症 2023;129:697-713。陈等2020 年 J Pathol Clin Ress;6:252-62。Ayahn 等Mod Pathol 2017;30:297-303 Carboplatin 会产生交联 DNA 加合物,吉西他滨导致 DNA 链终止和片段。为了应对化疗引起的 DNA 损伤,完整的 WEE1 会阻断细胞周期,从而进行充分的 DNA 修复。Azenosertib 抑制 WEE1 并允许细胞周期继续进行,尽管化疗未修复引起的 DNA 损伤,但会导致细胞死亡。紫杉醇阻止微管在 M 期分解,导致有丝分裂灾难和细胞死亡。Azenosertib 抑制 WEE1 并推动细胞周期通过 G2/M,从而使细胞对紫杉醇过敏。吉西他滨、卡铂紫杉醇 WE1 CDK/Cyclin 细胞死亡 S G2 M G1 西他滨、arboplatin clitaxel E1 K/Cyclin el death Azenosertib Cyclin E1 阳性 OVCAR3 细胞在所有化疗和 azenosertib 组合中的协同作用比 Cyclin E1 Low OV90 和 tyk-NU 细胞更大。根据Synergy Finder的指令(https://synergyfinder.org),通过测量细胞活力和4种计算方法(ZIP、Bliss、Loewe和HSA)对药物组合效果进行了评估。患有 OVCAR3 肿瘤的 NOD/SCID 小鼠每天口服 azenosertib 治疗,腹腔注射紫杉醇作为单一药物或联合治疗,如指示所示。所有治疗的耐受性良好。68% TGI 74% TGI 回归 OVCAR3 OV90 TYK-NU A Cyclin E1 阳性肿瘤模型对 azenosertib 和紫杉醇的联合治疗敏感在 cyclin E1 阳性卵巢癌细胞系中观察到 Azenosertib 与化疗之间的协同作用增强 1 2 4 53 Ayahn (2017) [操作系统]Cyclin E1 Alvated Chan (2020) [操作系统]Kang (2023) [操作系统]中山 (2010) [操作系统]彼得森 (2020) [操作系统]彼得森 (2020) [PFS]Pils (2014) [操作系统]Stonach (2018) [操作系统]Stronach (2018) [PFS]N Hazard Ratio 500 100 1000 扩增+ 过度表达在伊利诺伊州芝加哥的 ASCO 年会上发表。6 月 2 日至 6 日摘要 # 5513 Poster Bd # 208 GOG-3072 结论 • Azenosertib 对化疗具有活性,可以安全地联合使用。rp2D 是:— D1、D8、D15 上的紫杉醇 80 mg/m2(28 天周期)+ Azenosertib 300 mg QD 5:2 — Carbolatin AUC 5 mg/ml*Min 在 D1(21 天周期)+ Azenosertib 200 mg QD 5:2 — 吉西他滨 + Azenosertib 具有令人兴奋和持久的活性,MTD 尚未确定,更多剂量队列正在进行中 • 与单药化疗的历史对照数据相比,azenoSertib-Chermarib复方联合疗法的 ORR、mdoR 和 mpF 更长 • Cyclin E1 状态预测了添加的益处azenosertib 转单药化疗表明 azenosertib 可恢复经过大量预先治疗的耐铂卵巢癌的化疗敏感性 • Azenosertib + 化疗具有很高的临床活性和安全性,支持一项随机研究将该组合与铂双联化疗在铂敏感性卵巢癌中进行比较缩写:5:2 治疗 5 天后休假;mdoR,中位反应持续时间;MPF,无进展存活率;MTD,最大耐受剂量;ORR,客观反应比率;PLD,聚乙二醇化脂质体多柔比星;RP2D,推荐的 2 期剂量。图 4:Zentalis 002/GOG-3072 试验架构缩写:5:2,治疗 5 天,休息 2 天;A,azenosertib;AUC,时间集中曲线下的区域;CRM,持续重新评估模型;DOR,反应持续时间;ECOG,东方合作肿瘤小组;G,吉西他滨;MTD,最大耐受剂量;ORR,目标反应率;PFS,无进展存活;PLD,聚乙二醇化脂质体多柔比星;PROC,耐铂卵巢癌;RECIST,实体瘤反应评估标准;RP2D,推荐的第二阶段剂量。 表 1:基线特征 Azenosertib + Paclitaxel (N=26) Azenosertib + Carboplatin (N=36) Azenosertib + Gemcitabine (N=18) Azenosertib + PLD (N=35) 总计 (N=115) 年龄中位数(范围)61.5 (45-83) 61.0 (48-77) 62.5 (47-77) 56。0 (34-75) 61.0 (34-83) 种族和民族,n (%) 白人 24 (92.3) 34 (94.4) 16 (88.9) 34 (97.1) 108 (93.9) 黑人或非裔美国人 0 0 0 0 0 0 亚洲人 1 (3.8) 1 (2.8) 1 (5.6) 1 (2.9) 4 (3.5) 其他/NR 1 (3.8) 1 (2.8) 1 (5.6) 0 3 (2.6) 西班牙裔 (是/no/nR) 1/25/0 (3.8/96.2/0) 0/34/2 (0/94.4/5.6) 1/17/0 (5.6/94.4/0) 1/33/1 (2.9/94.3/2。9) 3/109/3 (2.6/94.8/2.6) ECOG 绩效状态,n (%) 0 21 (80.8) 21 (58.3) 12 (66.7) 24 (68.6) 78 (67.8) 1 5 (19.2) 15 (41.7) 6 (33.3) 11 (31.4) 37 (32.2) 地理区域,n (%) 美国 6 (23.1) 10 (27.8) 10 (55.6) 5 (14.3) 31 (27.0) 欧洲 10 (38.5) 10 (27.8) 6 (33.3) 27 (77.1) 53 (46.1) 澳大利亚 9 (34.6) 15 (41.7) 1 (5.6) 3 (8.6) 28 (24.3) 韩国 1 (3.8) 1 (2.8) 1 (5.6) 0 3 (2.6) Platinum Status 耐火材料,n (%) 5 (19.2) 9 (25.0) 3 (16.7) 7 (20.0) 24 (20.9) 先前的治疗线路 1-2,n (%) 22 (84.6) 30 (83.3) 18 (100) 33 (94.3) 103 (89.6) 3-4,n (%) 4 (15.4) 6 (16.7) — 2 (5.7) 12 (10.4) PARP 抑制剂 n (%) 8 (30.8) 10 (27.8) 5 (14.8) 5 (14.8) 5 (14.8) 3) 28 (24.3) 缩写:ECOG,东方合作肿瘤学小组;NR,未报告;PLD,聚乙二醇化脂质体多柔比星。表 2:治疗相关不良事件 ≥ 20% 治疗相关不良事件,n (%) Azenosertib + 紫杉醇(持续,N=7;间歇性,N=19)Azenosertib + Carboplatin(连续,N=22;间歇性,N=14)azenosertib + Carboplatin(连续,N=14)abine(连续 N=8;间歇性,N=10)Azenosertib + PLD(连续 N=27;间歇性,N=8)总计(连续,N=64;间歇性,N=51)所有剂量* 所有剂量 ≤ MTD 所有剂量** 所有剂量* 等级 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3 All Gr ≥3All Gr ≥3 血液学中性粒细胞减少症 C 5 (71.4) 5 (71.4) 9 (40.9) 7 (31.8) 4 (28.6) 3 (21.4) 7 (87.5) 6 (75.0) 19 (70.4) 17 (63.0) 40 (62.5) 35 (54.7) I 11 (57.9) 5 (26.3) 7 (50.0) 1 (7.1) 4 (50.0)-7 (70.0) 4 (40.0) 3 (37.5) 3 (37.5) 28 (54.9) 13 (25.5) Thrombo-cytopenia C 4 (57.1) 2 (28.6) 16 (72.7) 11 (78.6) 6 (42.9) 8 (100.0) 5 (62.5) 9 (33.3) 2 (7.4) 37 (57.8)) 20 (31.3) I 4 (21.1)-9 (64.3) 5 (35.7) 4 (50.0) 2 (25.0) 8 (80.0) 6 (60.0) * 3 (37.5) 24 (47.1) 14 (27.5) 贫血 C 5 (71.4)-10 (45.5) 3 (13.6) 5 (35.7) 1 (7.1) 6 (75.0)) 2 (25.0)11 (40.7) 4 (14.8) 32 (50.0) 9 (14.1) I 8 (42.1) 1 (5.3) 10 (71.4) 4 (28.6) 4 (50.0) 1 (12.5) 5 (50.0) 2 (25.0) 1 (12.5) 25 (49.0) 8 (15.7) 胃肠恶心 C 4 (57.1)-15 (57.1) 68.2) 1 (4.5) 10 (71.4) 1 (7.1) 5 (62.5)-16 (59.3) 2 (7.4) 40 (62.5) 3 (4.7) I 7 (36.8) 1 (5.3) 6 (42.9) — 3 (37.5) — 4 (50.0) 1 (12.5) 22 (43.1) 2 (3.9) 呕吐 C 3 (42.9) 1 (14.3) 8 (36.4) — 6 (42.9)-1 (12.5) — 11 (40.7) 2 (7.4) 23 (35.9) 3 (4.7) I 2 (10.5) 1 (5.3) — 2 (25.0) — 1 (10.0) — 4 (50.0) 1 (12.5) 9 (17.6) 2 (3.9) 腹泻 C 4 (57.1) 1 (14)。3) 4 (18.2) — 1 (7.1)-1 (12.5) — 8 (29.6) — 17 (26.6) 1 (1.6) I 6 (31.6) 1 (5.3) 5 (35.7) — 3 (37.5)-6 (60.0) — 2 (25.0) — 19 (37.3) 1 (2.0) 其他疲劳 C 6 (85.7) 1 (14.3) 8 (36.4) — 3 (21.4)-3 (37.5) 1 (12.5) 8 (29.6) 3 (11.1) 25 (39.1) 5 (7.8) I 8 (42.1) 2 (10.5) 5 (35.7) 1 (7.1) 4 (50.0)-6 (60.0) 2 (25.0) — 21 (41.2) 5 (9.8) 缩写:C,连续 aza enosertib 剂量;I,间歇性 azenosertib 给药;MTD,最大耐受剂量;PLD,聚乙二醇化脂质体多柔比星。*所有剂量均等于或低于最大剂量**吉西他滨+ Azenosertib的MTD尚未确定,进一步的剂量队列正在进行中。表 3:Azenosertib Doublets 的临床活性终点 Azenosertib + paclitaxel (N=26) Azenosertib + Carboplatin (N=36) Azenosertib + Gemcitabine (N=18) Azenosertib + PLD (N=35) Total (N=115) Responsertib + PLD (N =35) Responsertib (N) 22 28 13 31 94 ORR(已确认),N (%) 11 (50.0) 10 (35.7) 5 (38.5) 6 (19.4) 32 (34.0) 5.6 (3.8-NE) 11.4 (8.3-NE) 6.2 (NE) 7.3 (1.5-NE) 8.3 (5.6-12.4) 临床受益率 (CR + PR + SD ≥ 16 周),N (%) 18 (81.8) 16 (57.1) 6 (46.2) 24 (77.4) 64 (68.1) 7.4 (5.5-NE) 第 7.4 个月 PFS 中位数(95% 置信区间)10.4 (3.3-14.5) 8.3(3.3-NE) 6.3 (3.7-11.0) 9.0 (5.8-13.7) 根据RECIST版本1.1和至少一次基线后评估,可评估反应的受试者是接受过基线可测量疾病的受试者。根据 RECIST v 1.1,所有客观回应均得到证实。缩写:CR,完全反应;DOR,反应持续时间;NE,不可评估;ORR,客观反应率;PFS,无进展存活率;PLD,聚乙二醇化脂质体多柔比星;PR,部分缓解;SD,稳定性疾病。图 5:瀑布图缩写:CR,完全反应;NE,不可评估;PD,进行性疾病;PR,部分缓解;SD,稳定性疾病;uCR,未经证实的完全反应;uPR,未经证实的部分反应。图 6:无进展存活率的 Kaplan-Meier 曲线缩写:PLD,聚乙二醇化脂质体多柔比星 0 0.0 0.2 0.4 0.6 0.8 1.0 10 15 20 25 时间(月)处境危险的患者 Pr og re ss io n-Fr ee S ur vi l pr ob ilt 35 36 26 18 8 11 4 4 1 1 4 1 4 4 1 4 0 0 1 中位数(月)tib 与紫杉醇联合使用 PLD 卡博拉汀吉西他滨 6.28 PLD (N=35) 紫杉醇 (N=26) 7.36 吉西他滨 (N=18) 8.31 Carboplatin (N=36) 10.35 图 7:Cyclin E1 免疫组织化学 (IHC) *H 分数通过使用细胞百分比(0 至 100%)计算得出细胞周期蛋白 E1 表达强度(0 至 3)表 4:细胞周期蛋白 E1 IHC 状态终点的客观反应 Azenosertib + paclitaxel Azenosertib + Carboplatin Azenosertib + Gemcitabine azenosertib + PLD 可用 IHC 进行评估的总反应* 19 22 13 28 82 总体反应率,n (%) 10 (52.6) 8 (33) 6.4) 5 (38.5) 6 (21.4) 29 (35.4) 响应可评估 IHC H-Score >50 (N) 19 18 11 22 70 总体回复率,n (%) 10 (52.6) 8 (44.4) 5 (45.5) 5 (22.7) 28 (40.0) 响应可评估 IHC H-Score ≤50 (N) 0 4 2 6 12 总体响应率,n (%) NA 0 1 (16.7) 1 (8.3)根据RECIST版本1.1和至少一次基线后评估,可评估反应的受试者是接受过治疗的受试者,其患有基线可测量的疾病。拥有可用 IHC 数据的受试者的 ORR 似乎在各队列中与整个人群一致。缩写:IHC,免疫组织化学;PLD,聚乙二醇化脂质体多柔比星。图 8:Cyclin E1 无进展存活率 Kaplan-Meier 曲线 IHC 状态缩写:CI,置信区间;IHC,免疫组织化学 0 0.2 0.4 0.6 0.8 5 10 15 25 25 1.0 时间(月)有风险的患者 Su rv iv al P ro bi lit y 78 12 36 12 1 4 1 0 中位数(月)3.25 IHC ≤50(N=12)IHC >C >50 IHC ≤50 IHC >50 (N=78) 9.86 危险比 (95% 置信区间) 0.37 (0.18 — 0.79) log-rank p 值 0.0078 图 9:Azenosertib + 化疗在周期蛋白 E1+ 复发性铂敏感性卵巢癌中的拟议随机化 3 期试验设计 *紫杉醇或卡铂**紫杉醇或聚乙二醇化脂质体多柔比星***Azenosertib,400 mg QD 5:2 缩写:5:2 治疗 5 天,然后休息 2 天;BICR,盲人独立中心审查;ECOG,东方合作肿瘤小组;parPi,PARP 抑制剂。Azenosertib + Paclitaxel 200 mg QD 5:2 2 剂量水平 300 mg QD 5:2 Azenosertib + 吉西他滨 Azenosertib + PLD 200 mg QD 3 剂量水平按可用性和研究者偏好划分紫杉醇:D1、D8、D15 上的 80 mg/m2(28 天周期)目标 Azenosertib + Carboplatin 300 mg QD Gemcitaxel D1、D8(21 天周期)4 剂量等级 200 mg QD 5:2 卡铂:AUC 5 mg/mlin 在 D1(21 天周期)G:1000 mg/m2 A:200 mg QD 3 剂量水平 G:600 mg/m2 A:200 mg QD 5:2 pld:40 mg/m2 D1(28 天周期)在 CRM Key 的指导下进行剂量查找资格:高级别浆液性卵巢癌;ECOG 表现状态 0-2;铂耐药/难治性;最多 3 条之前的化疗线路;RECIST v 1.1 中可测量的疾病:安全性和耐受性 MTD 和/或 RP2D 关键次要性:临床活动(终点:ORR、DOR、PFS、CA125)NCT 编号——NCT04516447 致谢我们感谢参与这项研究的所有患者、他们的家属和研究人员。我们还要感谢GOG为这项研究提供的非凡发展和运营支持。-100 -80 -60 -40 -20 0 200^ 200 200 250^ + 研究治疗正在进行中。^间歇性给药。upR+:未经证实的 PR,受试者正在进行没有 PD。+ 研究治疗正在进行中。^间歇性给药。upr+:未经证实的 PR,受试者正在没有 PD。200^ 300^,+ 300^,+ 200 200 200 300^,+ 300^,+ 250^ 200 200 200 200 200 200 250^,+300 300 200 200 200 200 200 200 250,+ 250^,+ 250 250,+ 250^,+ 200250,+ 250^,+ 300^ PR PD PR PD 200 40 60 m ax im um c ha ng e (%) i n Su m m o f t t l es io n di am et s m m c ha e (%) i n su m o f t ar ge t t l es io n di am et s a n di am et s ar s ar s s s s s s s s paclitaxel B (Azenosertib + paclitaxel B) enosertib + Carboplatin -100 -80 -60 -40 -20 20 20 40 60 8080100 -100 -80 -60 -40 -20 0 + 研究治疗正在进行中。^间歇性给药。upR+:未经证实的 PR,受试者正在进行没有 PD。PR PD20 40 60 M ax im um C ha ng e (%) i n su m o f t t t t t l es io n di am et er s 100 80 C) azenosertib + Gemcitabine 200 200 200 200,+ 200,+ 200^,+ 200 200 ^ pd upr+ PR ucrBest 整体响应 PD upr+ PR ucrBest 整体响应 SD upr+ PR ucrBest 总体反应 ≤ 50≤ 150 至 > 50> 150H-Score* 005 61525CCNE1 未扩增 62116组织未进行扩增评估 • 抗细胞周期蛋白 E1 小鼠单克隆抗体 (Abcam cCNE1/2460) • H 分数 > 50 包括所有 CCNE1 扩增肿瘤 • 细胞周期蛋白 E1-IHC 阳性、H-该数据集中的分数 ≥ 50 为 94% CCNE1 扩增 0 名患者扩增 CCNE1 状态未进行扩增评估 100 200 Cy cl in E 1 IH C H-Sc 或 e 300 • 抗细胞周期蛋白 E1 小鼠单克隆抗体 (Abcam cCNE1/2460) • H 分数 > 50 包括所有 CCNE1 扩增肿瘤 • 该数据集中 cyclin E1-IHC 阳性、H 分数 > 50 的患病率为 87% 关键资格:高级别浆液性卵巢癌;ECOG 表现状态 0-1;≥1L 先验铂类化疗;铂敏感型(无铂间隔 ≥ 6 个月);先行贝伐珠单抗和 parPi 如果符合条件且符合地区护理标准;Cyclin E1+(CCNE1 扩增和/或 Cyclin E1 IHC 阳性)医师精选卡博铂-双重**(6 个周期)通过 BICR 终止初级无进展存活率 • 先前的治疗线路(1 v 2-3)• 先前 parPi(是 v 否)• CCNE1 扩增(是 v 否)Azenosertib + y*(6 个周期)Azenosertib*** 维护密钥次要总体生存 R 2:1