
2022年第四季度和全年财务业绩2023年2月23日

本演示文稿包含涉及重大风险和不确定性的前瞻性陈述。《1995年私人证券诉讼改革法》中对前瞻性陈述的定义是,前瞻性陈述不是历史事实,涉及许多风险和不确定因素。这里的词语,例如“可能”、“将会”、“应该”、“可能”、“将会”、“期望”、“计划”、“预期”、“相信”、“估计”、“计划”、“预测”、“打算”、“潜在”、“继续”和类似的表达(以及引用未来事件的其他词语或表达
,条件或情况)可能会识别前瞻性陈述。本演示文稿中的前瞻性陈述基于公司目前的预期和信念,涉及已知和未知的风险、不确定性和其他因素,可能会导致公司的实际结果、业绩和成就以及某些事件的时间与任何前瞻性陈述中预测、预期或表明的结果、业绩、成就或时间大不相同。此类风险、不确定性和其他因素包括但不限于以下因素:美国、欧洲或日本以外的Arikayce或公司在美国、欧洲、日本或其他市场的候选产品未能获得或延迟获得监管批准,包括每个市场和每种用途对Lamira®雾化器系统的单独监管批准;公司唯一批准的产品Arikayce未能在美国、欧洲或日本成功商业化(分别为阿米卡星脂质体吸入混悬剂、脂质体590 mg雾化分散剂和阿米卡星吸入药物产品), 或维持美国、欧洲或日本对Arikayce的批准;因灾难或其他事件(包括自然灾害或公共卫生危机)造成的业务或经济中断;新冠肺炎大流行的影响及其减少其对公司业务、员工(包括关键人员、患者、合作伙伴和供应商)传播的努力;Brensocatib或TPIP在正在进行的和未来的临床研究中被证明对患者无效或不安全的风险,包括,对于Brensocatib,Aspen研究;医生、患者、第三方付款人和医疗界其他人对Arikayce的市场接受程度的不确定性;公司无法获得美国食品和药物管理局对Arikayce的完全批准,包括公司无法成功或及时完成验证患者报告结果工具的研究以及完全批准Arikayce所需的确认性上市后临床试验的风险;公司、Pari或公司的其他第三方制造商无法遵守与Arikayce或Lamira®雾化器系统相关的法规要求;公司无法从政府或第三方付款人那里获得足够的Arikayce或Arikayce可接受价格的补偿;与Arikayce、Brensocatib、TPIP或本公司其他候选产品相关的意外安全或疗效问题;
公司对Arikayce、Brensocatib、TPIP或本公司其他候选产品的潜在市场规模的估计不准确,或公司用来确定医生身份的数据、预期的患者接受率、预期的治疗持续时间不准确, 或预期的患者遵从率或中止率;与由Pharmakon顾问公司管理的某些基金的公司担保优先贷款相关的风险和不确定性,以及公司与OrbiMed Royalty&Credit Opportunities IV,LP管理的公司特许权使用费融资的预期收益,包括我们保持遵守优先担保贷款和特许权使用费融资协议中的契诺的能力,以及
根据这些协议对公司运营的限制所感知的影响;本公司无法创建有效的直销和营销基础设施,也无法与提供此类基础设施的第三方合作以分销Arikayce或公司未来批准的任何候选产品;未能获得监管部门的批准,无法将Arikayce的适应症扩大到更广泛的患者群体;公司的竞争对手
可能获得与公司为特定适应症开发的产品本质上相同的产品的孤立药物独家专利权;未能成功预测新型基因治疗产品的开发、监管批准和商业化的时间和成本;由于公司在进行监管批准所需的临床前开发活动和临床试验方面的经验有限,以及可能无法招募或留住足够的患者来进行和完成试验或生成监管批准所需的数据,未能成功进行Arikayce、Brensocatib、TPIP和公司其他候选产品的未来临床试验,
除其他事项外,公司的临床研究将被推迟或在药物开发过程中发现严重副作用的风险;公司依赖的第三方未能生产足够数量的Arikayce或公司用于商业或临床需求的候选产品,未能进行公司的临床试验,或未能遵守影响公司业务的公司协议或法律法规或与公司的
协议;公司无法吸引和留住关键人员或有效管理公司的增长;公司无法成功地整合其最近收购的公司,并适当管理管理层投入整合活动的时间和注意力;公司收购的技术、产品和候选产品在商业上不成功的风险;公司无法适应其竞争激烈和不断变化的环境;公司无法维持其重要客户的风险;政府医疗改革大幅增加公司成本并损害其财务状况的风险;美国、欧洲、日本和全球总体经济状况恶化,包括长期通货膨胀的影响,影响到公司及其供应商, 第三方服务提供商和潜在合作伙伴;公司无法
充分保护其知识产权或阻止披露其商业秘密和其他专有信息,以及与此类事项相关的诉讼或其他诉讼相关费用;与Arikayce或公司候选产品相关的协议对公司施加的限制或其他
义务,包括与Pari和阿斯利康AB的许可协议,以及公司未能遵守此类协议规定的义务;公司作为或可能成为当事人的诉讼造成的成本和潜在的声誉损害,包括产品责任索赔;公司的运营在发生网络安全攻击或问题时受到重大干扰的风险;与公司企业资源规划系统升级相关的业务中断或费用;公司在国际经营方面的有限经验;适用于公司业务的法律法规的变化,包括任何价格改革,以及未能遵守此类法律法规;公司的运营亏损历史, 公司可能永远无法实现或维持盈利能力;商誉减值费用影响公司的经营业绩和财务状况;无力偿还公司现有的债务以及与公司获得未来资本的能力有关的不确定性;以及延迟执行经适当监管机构批准的额外第三方制造设施的计划,以及与这些计划相关的意外费用。公司可能无法实际实现公司前瞻性陈述所表明的结果、计划、意图或预期,因为前瞻性陈述本质上涉及风险和不确定因素,因为它们与事件有关,并取决于未来可能发生或不可能发生的情况。有关可能影响公司业务的风险和不确定因素的更多信息,请参阅公司截至2022年12月31日的年度10-K表格
报告以及公司随后提交给美国证券交易委员会(美国证券交易委员会)的任何文件中“风险因素”第1A项“风险因素”中讨论的因素。本公司告诫读者不要过度依赖任何此类前瞻性陈述,
这些陈述仅在本演示文稿发表之日发表。除法律和美国证券交易委员会规则特别要求外,公司不承担任何义务公开更新或修改任何此类陈述,以反映预期或事件、条件或环境的任何变化,或可能影响实际结果与前瞻性陈述中陈述的那些变化。前瞻性陈述

2023年上半年Aspen登记完成(1Q)肌肉骨骼临床前数据(2Q)CNS临床前数据(2Q)第一肌肉骨骼IND(2Q)2H 2023 CRSsNP第二阶段试验启动(2023年年中)产生TOLINE结果(3Q)TPIP临时剂量滴定安全性和耐受性水平登记完成(YE)1H
2024 PH-ILD TOPLINE结果肌肉骨骼临床数据Aspen TOPLINE结果(2Q)Insmed正在从我们的四个支柱中的每一个获得变革性的临床数据读数,意在代表一流或一流的治疗
Arikayce Brensocatib TPIP早期研究

成人患者筛查已完成未来里程碑预期登记完成
Toplines结果将于24年第2季度完成

保存日期国际研究日日期:2023年5月8日地点:纽约市和
虚拟时间:东部时间上午8点

推出世界领先的能力,支持我们的下一个增长篇章

所有提交的8篇摘要均接受提交,包括:Arikayce不良事件缓解:真实世界背景下的Brensocatib Willow研究:按疾病严重程度分组分析,5月19日至24日

Brensocatib:启动无鼻息肉潜力的CRS的第二阶段研究
首发疾病治疗~全球400K1,2,3,4可寻址患者(重症人群)约7000万美国CRSsNP1患者,但许多人对皮质类固醇和/或内窥镜鼻窦手术(ESS)最初针对最严重的复发和潜在手术患者没有反应。慢性鼻窦炎无鼻息肉J变态反应性Clin免疫实践。2016;4(4):575-582。DOI:10.1016/j.jaip.2016.04.015;2 Benjamin et.Al,无鼻息肉的慢性鼻窦炎患者的临床特征在学术环境下,J过敏CLIN免疫实践卷7,第3期,2019年3月;3仅限美国患者级别声明数据分析(Komodo Health),患者病史中无Dx代码的积极治疗CRS患者的比例;外推至欧洲5和日本;4患者级别声明数据分析仅US(Komodo Health),主动治疗的CRSNP患者患有ESS的比例;外推至欧洲5和日本Brensocatib 40 mg qd安慰剂qd筛查基线EOT(初步分析)Brensocatib 10 mg qd 4周疗程24周EOS R停药后随访每日鼻窦主要终点总积分(STSS)约270名患者1:1:1-2023年年中
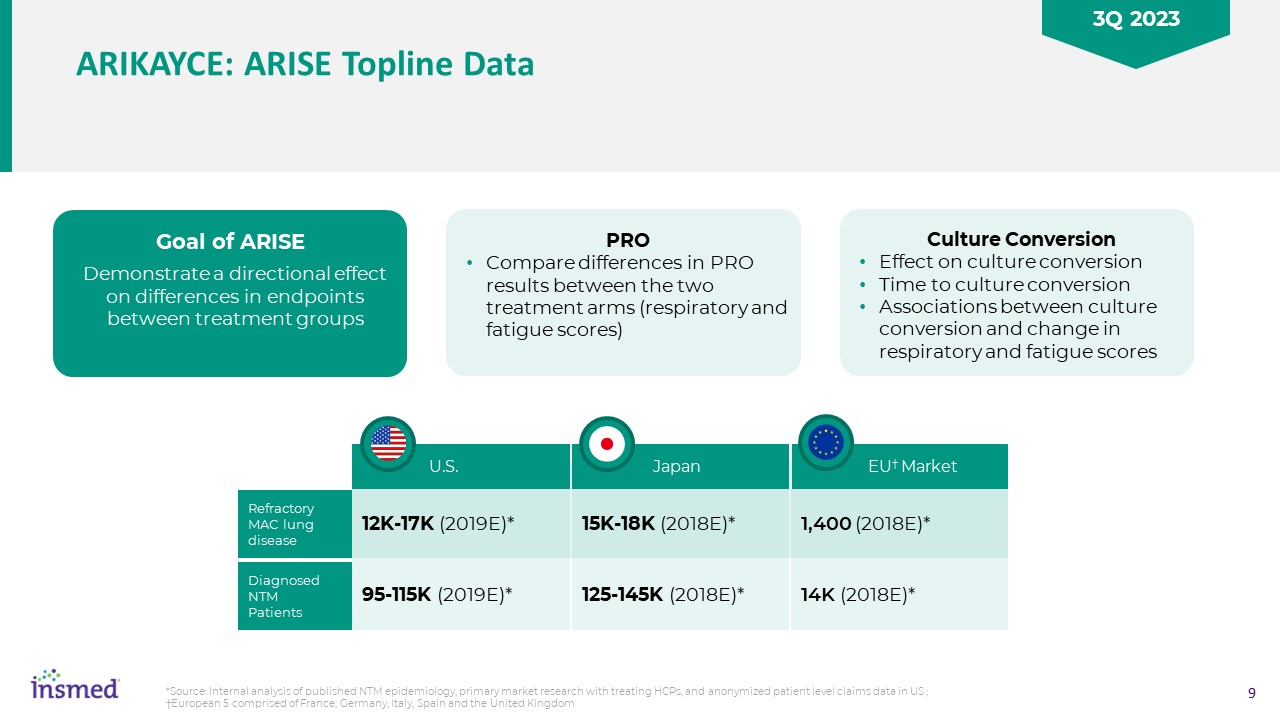
Arikayce:Rise Topline数据PRO比较了两个治疗组之间PRO结果的差异(呼吸和疲劳评分)的目标显示了对治疗组之间终点差异的定向影响培养转换对培养转换时间的影响
培养转换与呼吸和疲劳评分变化之间的转换关联*来源:对已发表的NTM流行病学的内部分析,治疗HCP的初级市场研究,以及匿名的美国患者水平索赔数据;†欧洲5由法国、德国、意大利、西班牙和英国组成12K-17K(2019E)*95-115K(2019E)*美国难治性MAC肺部疾病诊断NTMP患者15K-18K(2018E)*125-145K(2018E)*日本1,400(2018E)*14K
(2018E)*欧盟†市场2023年第三季度
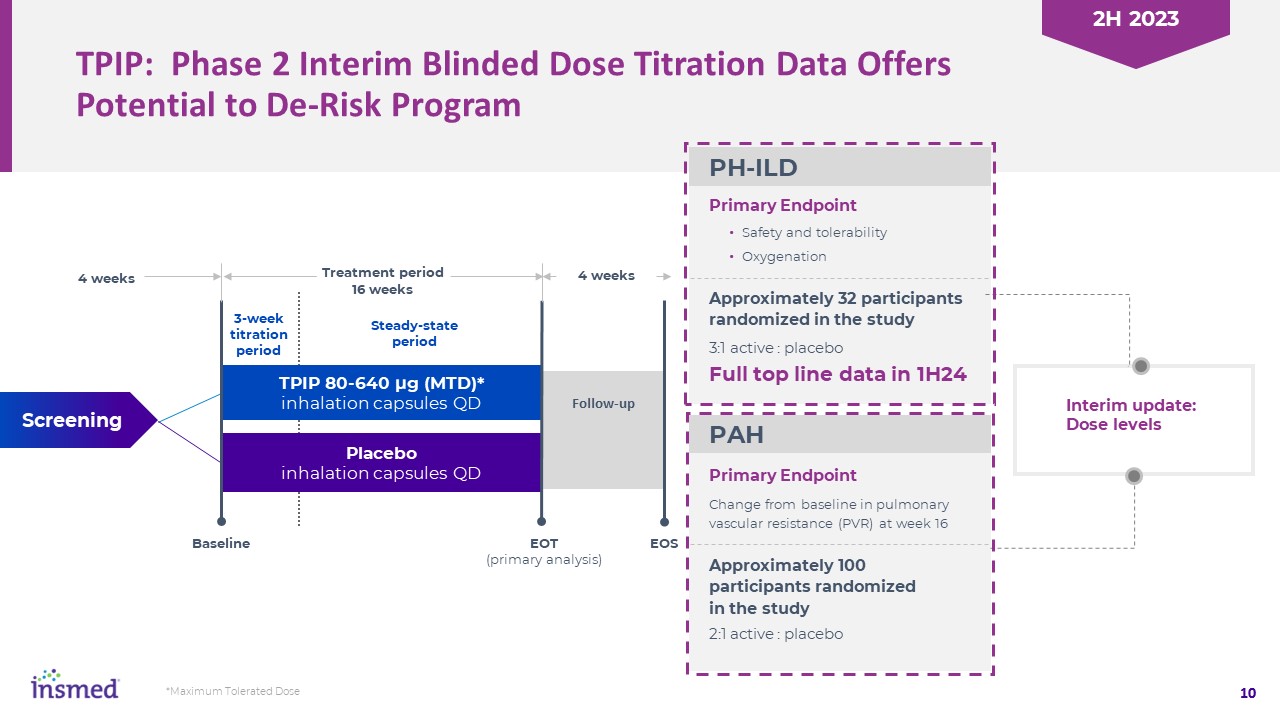
TPIP:第二阶段临时盲法剂量滴定数据提供了降低风险的可能性
计划主要终点10 3:1有效:安慰剂安全性和耐受性氧合在研究中随机选择大约32名参与者在研究第16周时肺血管阻力(PVR)的变化主要
终点大约100名参与者在研究中随机2:1积极:安慰剂1周内完整的顶线数据TPIP 80-640微克(MTD)*吸入胶囊QD安慰剂吸入胶囊QD筛选治疗期16周基线EOT(初步分析)EOS 4周随访稳态期3周滴定期中期更新:剂量水平PH-ILD PAH*最大耐受剂量2023
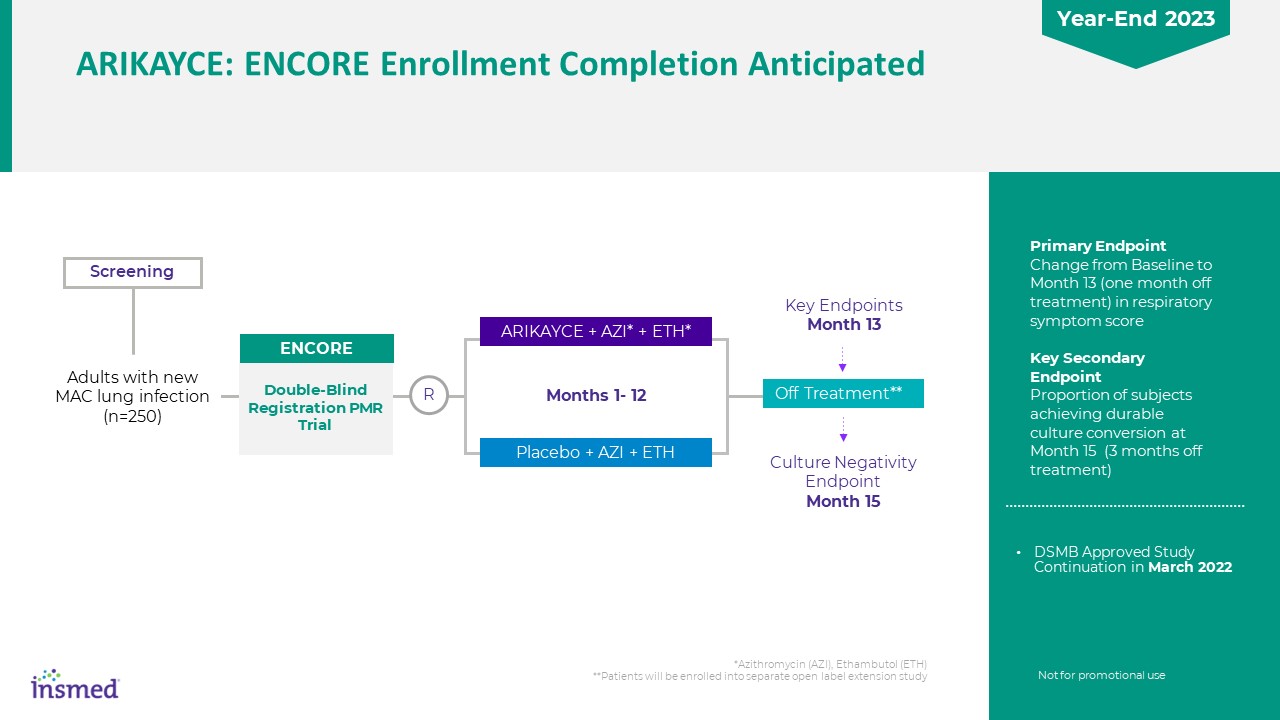
*阿奇霉素(Azi),乙胺丁醇(ETH)**患者将被纳入单独的
开放标签扩展研究主要终点从基线到第13个月(停止治疗一个月)关键次级终点在第15个月(停止治疗3个月)实现持久培养转换的受试者比例在第15个月筛查关键终点第13个月培养阴性终点15 Arikayce+Azi*+ETH*安慰剂+Azi+ETH 1-12个月患有新的MAC肺部感染的成人(n=250)停止治疗**双盲人注册PMR
试验Encore R非用于促销用途DSMB批准在2022年3月继续研究Arikayce:Encore注册预计在2023年年底完成
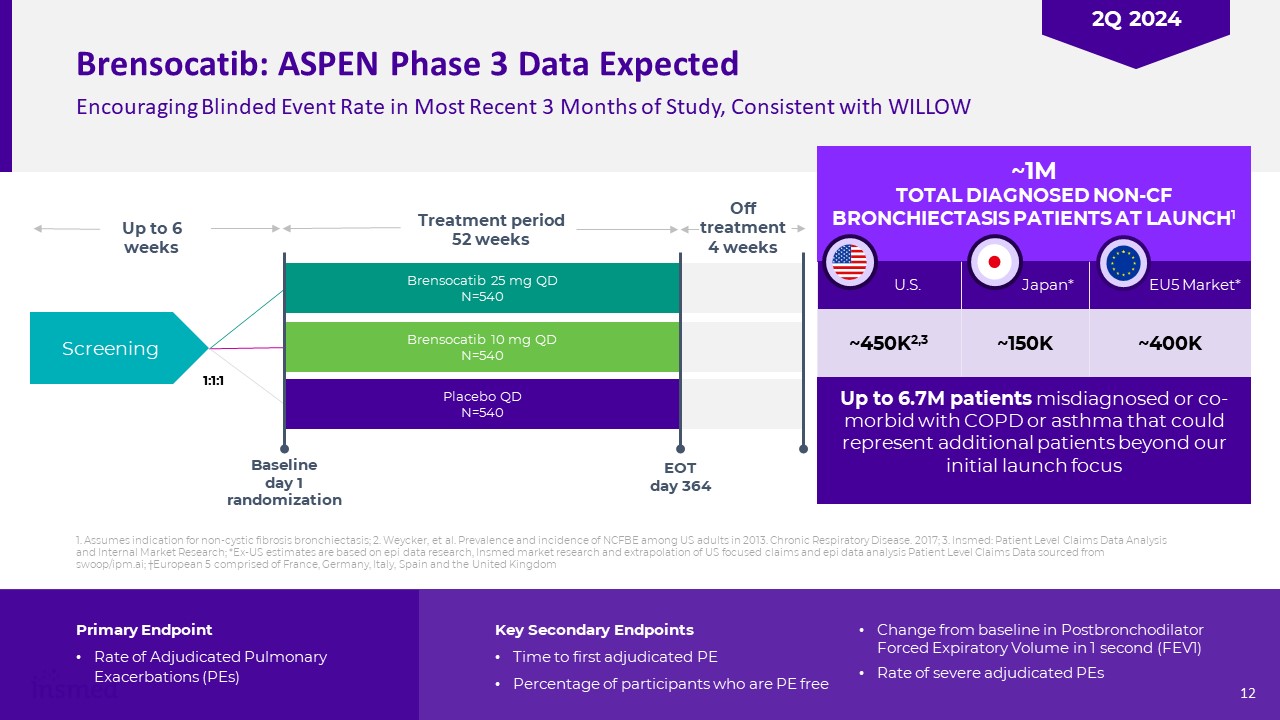
Brensocatib:在最近3个月的研究中,Aspen阶段3数据预计会鼓舞人心的失明事件发生率,在LAUNCH1~450K2,3美国~150K日本*~400K EU5市场*多达670万名误诊或合并COPD或哮喘的患者
代表我们最初推出的焦点Brensocatib 25 mg qd N=540 Brensocatib 10 mg qd N=540筛选治疗期52周基线第1天随机EOT 364至6周1:1:1停止治疗4周后,新增患者。关键次要终点首次判定PE的时间在支气管扩张剂后1秒用力呼气容量(FEV1)较基线有PE自由变化的参与者的百分比(FEV1)严重判定PE的比率1。假定为非囊性纤维性支气管扩张症的适应症;2.Weycker等人。2013年美国成年人中NCFBE的患病率和发病率。慢性呼吸系统疾病。2017年;3.Insmed:患者级别索赔数据分析和内部市场研究;*美国以外的估计基于EPI数据研究、Insmed市场研究以及对美国重点索赔和EPI数据分析的外推
患者级别索赔数据来自swoop/ipm.ai;†欧洲5由法国、德国、意大利、西班牙和英国†12 2Q2024组成
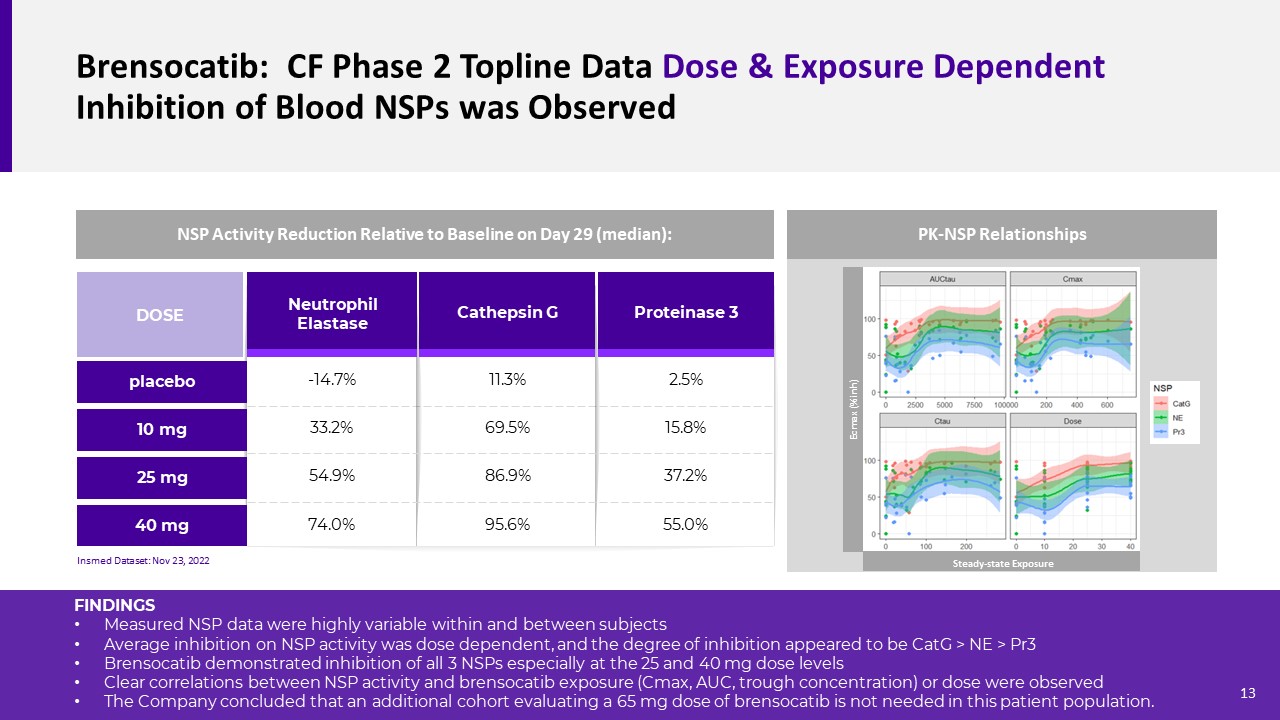
Brensocatib:CF阶段2 TOPLINE数据观察到组织蛋白酶G蛋白3中性粒细胞弹性蛋白酶10 mg 25 mg剂量40 mg安慰剂-14.7%33.2%54.9%74.0%11.3%69.5%86.9%95.6%2.5%15.8%37.2%55.0%NSP活性在29天与基线相比下降
29天(中位数):Insmed数据集:11月23日2022年PK-NSP关系结果测量的NSP数据在受试者内和受试者之间高度可变,对NSP活性的平均抑制呈剂量依赖性,抑制程度似乎为:CATG>NE>PR3。Brensocatib显示对所有3种NSP的抑制,特别是在25和40 mg剂量水平上。观察到NSP活性与Brensocatib暴露(Cmax、AUC、谷浓度)或剂量之间存在明显的相关性。
公司得出结论,在该患者群体中不需要额外评估65 mg剂量的Brensocatib。Ecmax(%inh)稳态暴露13
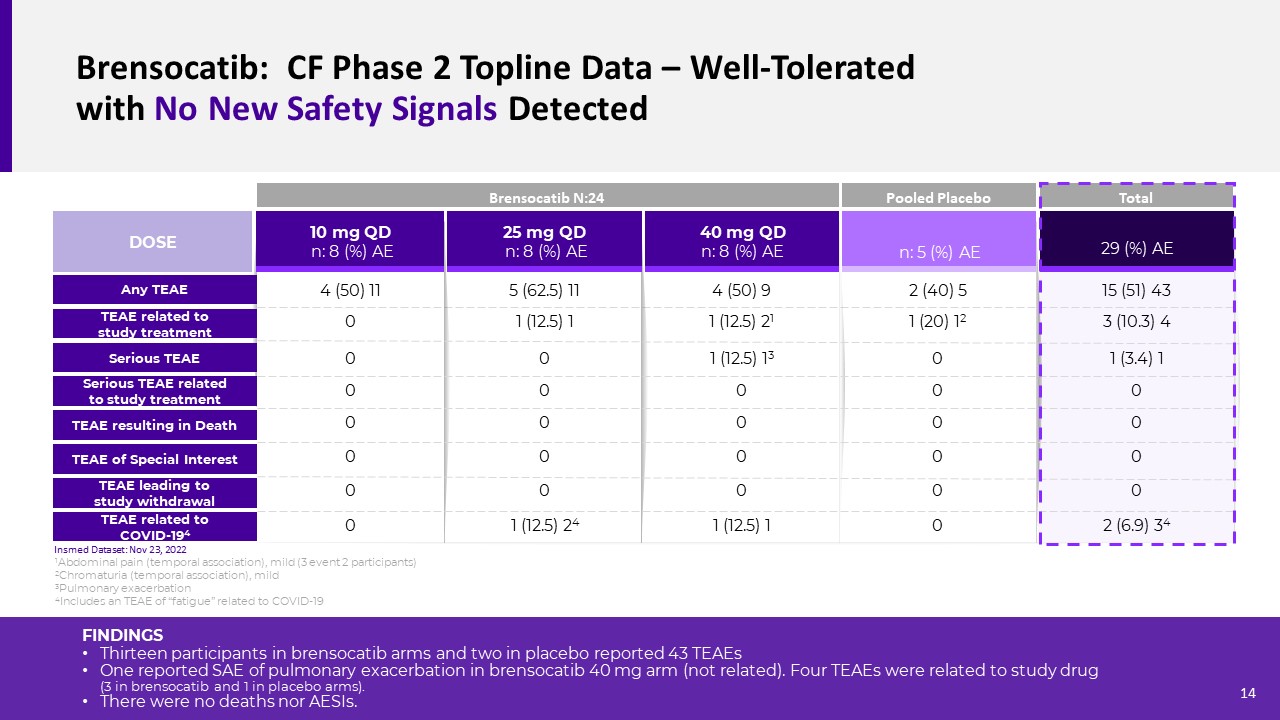
Brensocatib:cf第2阶段拓扑线数据-没有新的安全信号的良好耐受性
检测结果13名Brensocatib组和2名安慰剂组的参与者报告了43个TEAE,其中一个报告了Brensocatib 40 mg组的肺加重SAE(无关)。有4例TEAEs与研究药物有关(3例服用布伦西汀,1例服用安慰剂)。没有死亡病例,也没有AESIs病例。25 mg QD n:8(%)AE 40 mg QD n:8(%)AE 10 mg QD n:8(%)AE TEAE与研究治疗相关严重TEAE剂量严重TEAE与研究治疗相关任何TEAE n:5(%)
AE 29(%)AE4(50)9 1(12.5)21 1(12.5)13 0 Brensocatib N:24与COVID-194 TEAE相关的混合安慰剂总TEAE与COVID-194 TEAE相关死亡0 0 1(12.5)1TEAE导致研究停用5(62.5)11 1(12.5)1 00 00 01(12.5)24 4(50)11 00 00 00 02(40)51(20)12 00 00 00 15(51)43 3(10.3)4 1(3.4)1 00 00 02(6.9)34 1腹痛(暂时性联想),轻度(3个事件2参与者)2色尿(暂时性关联),轻度3肺加重4包括与新冠肺炎相关的TEAE“疲劳”14 Insmed数据集:2022年11月23日
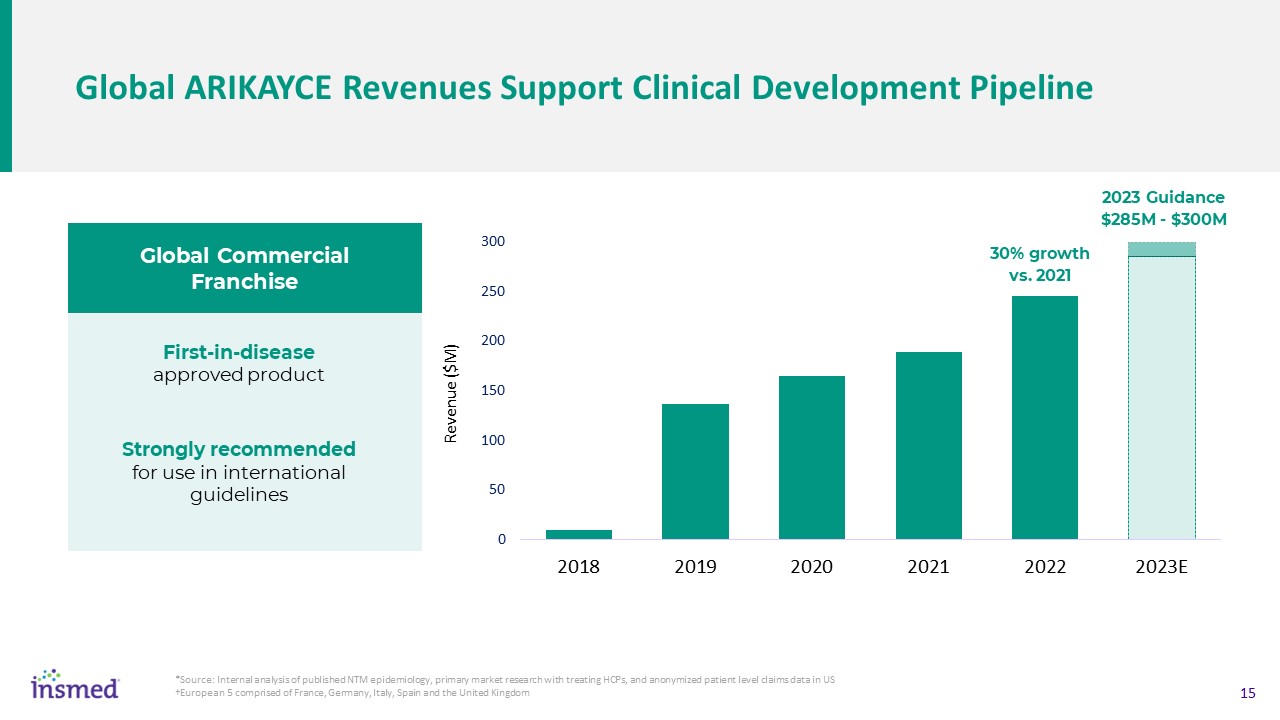
全球Arikayce收入支持临床开发渠道*来源:对已发表的非传染性支气管炎流行病学分析、治疗HCP的初级市场研究和匿名患者水平索赔数据的内部
美国†欧洲5由法国、德国、意大利、西班牙和英国首发批准的产品
强烈建议用于国际指南2023年全球商业特许经营指南与2021年相比增长2.85亿-3亿美元30%

到2025年建立可持续增长商业1 2 3 4 Arikayce Brensocatib TPIP*早期研究难治性MAC肺病前线MAClung疾病下一代制造额外技术阶段3支出的80%无鼻息肉(CRSsNP)囊性纤维性化脓性鼻炎(HS)美国、日本、欧盟†市场†欧洲5包括法国、德国、意大利、西班牙和英国*Treprostinil Palmil吸入粉16

Arikayce商业特许经营权的可靠收入来源截至2012年12月31日的现金状况支持未来18个月的所有拐点2022年收入比2021财年增长30%全球收入-2.454亿美元-1.86亿美元JP-5650万欧盟+ROW-290万美元2023年资本分配>中后期管道和商业项目预期支出的80%

根据我们的战略重点执行,利用我们可靠的收入流
同时谨慎部署资本生产TOPLINE临床数据读数近期和长期推进商业准备活动,以服务于显著更多的严重和罕见疾病控制支出的患者,审慎部署
资本以支持最佳回报产生机会优先事项2023年收入预期为2.85亿美元至3亿美元>80%的支出集中于中后期计划指导临床里程碑未来18个月1H 2023 Aspen
登记完成(1Q)肌肉骨骼临床前数据(2Q)CNS临床前数据(2Q)第一肌肉骨骼IND 2H 2023 CRSNP阶段2试验启动(2023年年中)产生背线结果(3Q)TPIP中期剂量滴定安全性和耐受性水平注册完成(YE)第一次CNS IND(2023年末/2024年初)2024年上半年PH-ILD TOPLINE结果肌肉骨骼临床数据Aspen TOPLINE结果(2Q)