| 图99.2 2023年2月22日1 GLAUKOS Corporation(NYSE:GKOS) 2022年第四季度和全年回顾 重要信息 本文档旨在供投资者在定期安排的季度电话会议之前阅读,旨在回顾Glaukos Corporation最近的财务和运营 业绩以及总体业务前景。 请参阅本文档附加信息部分中的《前瞻性声明》和《关于使用非GAAP财务 措施的声明》。 电话会议信息 日期:2月22日2023年时间:下午4:30美国东部时间下午1:30Pt 拨入号码:1-888-210-2212(美国),1-646-960-0390(国际) 确认ID:7935742现场网络直播:Glaukos投资者关系网站上的活动页面 http://investors.glaukos.com或单击此链接。 网络直播重播:电话会议结束后,网络直播的重播将在Glaukos投资者关系网站上存档。 我们将首先进行 创新是我们所做一切的核心。在Glaukos,我们 推动科学技术的极限,以解决慢性眼病中未得到满足的需求 。 |
| 2023年2月22日22022年第四季度和全年财务业绩摘要 业务描述 眼科医疗技术和制药公司专注于开发和商业化 新型无滴平台疗法,旨在打破传统护理标准,改善慢性眼病患者的预后 疾病类别 青光眼 角膜健康 视网膜疾病 收入(增长) 2022美元7120万美元 (-3%vs.2021;固定货币对2021财年第四季度) 2022财年$2.829亿 (与2021财年相比-4%;-2%不变 货币vs.2021财年) 毛利率(非GAAP) 2022财年第四季度83.6% (2021年第四季度为84.6%) 2022财年83.5% (2021财年为85.0%) 现金和现金等价物、短期投资、 和受限现金 截至2022年12月31日为3.598亿美元(截至 9月30日为3.707亿美元)2022) 2023财年销售额 指导2023财年全球综合收入预期为2.9亿-2.95亿美元 请参阅本文档其他信息部分中包含的《关于使用非GAAP财务指标的声明》和非GAAP对账 。提供了货币收入恒定增长、非GAAP毛利率、非GAAP运营支出和非GAAP每股收益与最直接可比的GAAP财务指标的对账。 |
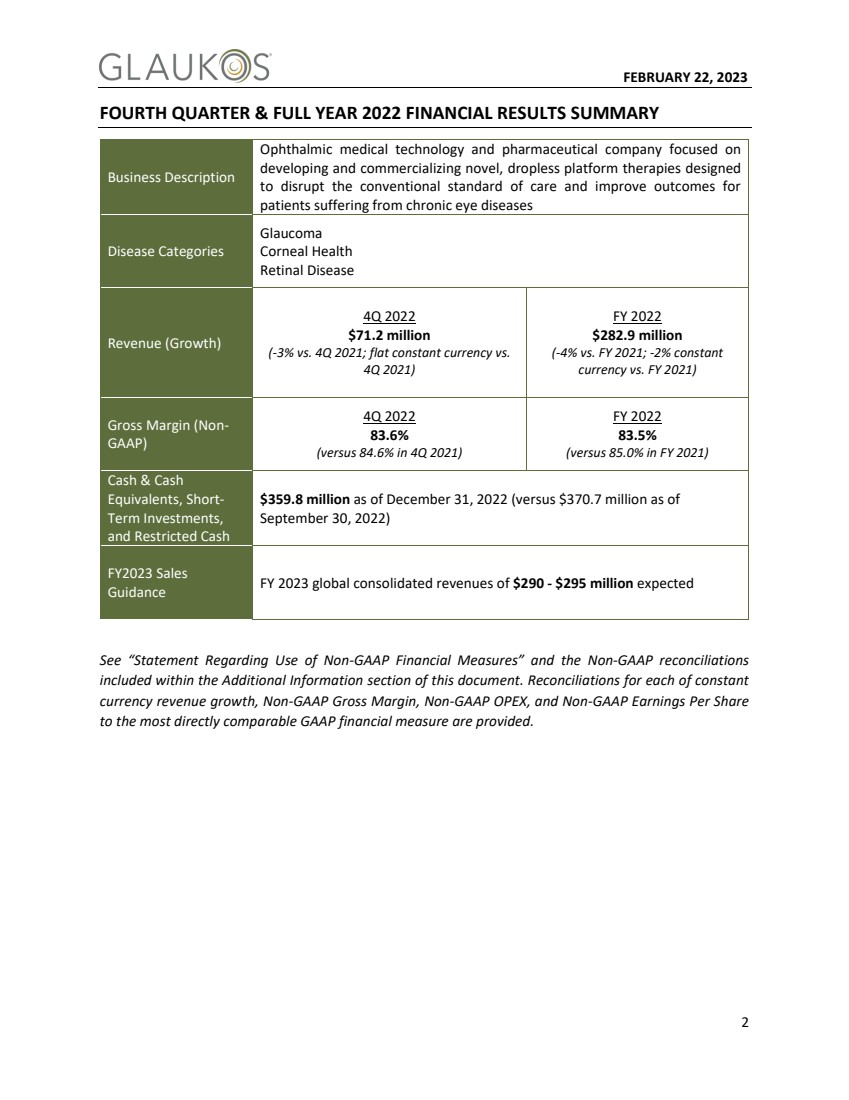
| 2023年2月22日3收入业绩和商业概述 全球综合收入业绩 Glaukos报告第四季度净收入为7120万美元,按报告基础下降2.7%,按不变货币计算与2021年第四季度持平。我们第四季度的业绩反映了我们在全球青光眼和角膜健康特许经营中的持续执行 在与2022年医疗保险中心和医疗补助服务(CMS)医生费用削减相关的美国混合性白内障青光眼逆风、国际外汇逆风以及全球COVID和员工动态的影响下。 2022财年,净收入约为2.83亿美元,在报告的基础上下降了4%,或在不变货币的基础上下降了2%,而2021财年的净收入约为2.94亿美元。 |
| 2023年2月22日4特许经营收入业绩 美国青光眼 我们第四季度美国青光眼净收入为3540万美元,同比下降14% 2021年第四季度。2022财年,美国青光眼净收入约为1.45亿美元,与2021财年约1.71亿美元的净收入相比,下降了15%。我们第四季度和全年的美国青光眼净收入反映了宏观经济因素和2022年CMS最终 医生费用报销削减的组合。 提醒一下,CMS关于2022年医疗保险医生费用支付费率的最终规则(最终规则)于2022年1月1日生效。与2021年生效的报销率相比,最终规则包含了与植入小梁旁路支架相关的明显更低的医生费用,例如我们的iStent®系列产品 ,并结合白内障手术。医生费用的降低对2022年白内障手术中程序性iStent系列产品的数量产生了影响。这些费率在CMS关于2023年医生费率的最终规则中没有明显修改。尽管受到这些 动态的影响,但我们对我们商业战略的执行以及我们的联合白内障iStent特许经营在2022年面临这些报销逆风时的弹性感到非常高兴。 我们仍然专注于创新和扩大外科医生可用的视力保护工具,以改善对眼科患者的整体护理,在2022年期间,我们通过引入几项新的眼科 技术,成功地扩展了我们全面的、同类最佳的产品组合,包括(1)iAccess™,一种新型器械,具有允许客户执行开腹手术的功能, (2)iStent™,一种创新的粘弹性输送设备,以及(3)最近推出的iStent Infined®,这是我们的新型三支架可注射系统,旨在为无法通过先前的内科和手术治疗控制的青光眼患者提供基础的全天候眼内压控制。 虽然iStent无限发布仍处于起步阶段,但它是Glaukos和MiGs市场的一个重要里程碑,成为有史以来第一个被指示用作独立青光眼治疗的微侵入性植入性设备。我们相信iStent无限将引领我们的长期使命,创建一个新的介入性青光眼市场,寻求一种替代治疗模式来推进患者护理并阻止这种慢性视力威胁疾病的发展。我们看好iStent INFINE的长期前景,但在考虑近期贡献时,请谨慎行事,因为我们 在今年上半年完成了从各个Mac获得保险和付款的正常过程。 |
| 2023年2月22日5国际青光眼 我们第四季度国际青光眼净收入约为1,750万美元,与2021年第四季度相比,同比增长11%,按不变货币计算增长24%。 第四季度的国际增长是广泛的,但在一定程度上被重大的不利外汇逆风所抵消。PRESERFLO®MicroShort®在澳大利亚和加拿大的早期推出活动继续进展顺利,我们在关键市场的整体表现突出了 强劲的季度。 2022财年,国际青光眼净收入约为6960万美元,较2021年报告的同比增长14%,按不变货币计算增长23%。我们仍处于国际机遇的早期渗透阶段,并继续在全球现有市场的商业销售和市场准入方面进行重大投资,同时选择性地机会性地进行地理扩张。 Corneal Health 我们创纪录的第四季度Corneal Health净收入约为1,830万美元,较2021年第四季度同比增长13%。第四季度业绩的推动因素是美国Photrexa®季度销售额达到创纪录的1,530万美元,与2021年第四季度相比增长了13%。 美国Photrexa新客户持续健康增长的趋势。我们对我们为解决2022年遇到的零星报销问题而进行的投资后出现的持续改善迹象感到高兴。 2022财年,Corneal Health的净收入约为6860万美元,较2021年报告的同比增长11%。2022年美国Photrexa的销售额为5630万美元, 与2021年相比增长了12%。我们将继续致力于为患有这种罕见疾病的圆锥角膜患者扩大治疗渠道。 |
| 2023年2月22日6 2023年收入指引 Glaukos预计2023年全年全球合并净销售额为2.9亿-2.95亿美元。本指南试图考虑: ·与专业费用相关的对美国青光眼数量的持续估计影响 复合性白内障小梁旁路手术与其他更具侵入性的替代手术相比的报销 ·复合性白内障MiGs全球竞争 ·截至2023年2月22日第四季度财报电话会议的最新外币现货汇率·iAccess、iPRIME、和iStent无限(更倾向于 下半年) ·在国内为我们的Corneal Health特许经营中的患者提供增量自付援助 ·客户账户人员配备限制 ·新冠肺炎的逆风基于当前的事实和情况 |
| 2月22日,2023 7研发/流水线概述 流水线概述 我们旨在打破传统治疗模式并产生未来创新的下跌的五个关键无滴技术治疗平台如下: 1.iStent®微型外科设备 2.iDose®缓释药品 3.iLution™透皮制药 4.iLink™生物活化药品 5.视网膜XR™生物可降解缓释药品 Glaukos流水线概述平台产品指示美国现状 IPRIME在眼科手术期间交付粘弹性材料FDA批准在眼科手术期间手动切割TM FDA批准接受iStent/iStent注射/iStent注射W轻中度原发性开角型青光眼合并白内障手术FDA批准 iStent无限青光眼(先前内科和手术治疗失败)FDA批准接受FDA批准 iStent无限青光眼(标签扩展)IDE计划 PRESERFLO微分流晚期-难治性青光眼 美国IDE计划 iDose Or高血压-青光眼3期试验完成 IDose TREX眼压-青光眼临床前 iDose Rock眼压-青光眼临床前 GLK-311眼压-青光眼IND开放 GLK-301干眼病第二阶段GLK-302老花眼第二阶段GLK-302老花眼临床前 Photrexa(Epi-off)Keratoconus FDA批准的Epioxa(Epi-On)Keratoconus第一阶段3试验已完成 第二代角膜圆锥角膜第二阶段1 GLK-401(IVT多激活酶抑制剂)AMD,二甲醚, 视网膜病变临床前视网膜 GLK-411(静脉注射曲安奈德)二甲醚临床前视网膜XR bio-erodible sustained-release pharmaceutical iLution transdermal sustained-release pharmaceutical角膜 iStent 显微手术设备GLAUCOMA iDose sustained-release pharmaceutical iLink bioactivated pharmaceutical 1 2 4 5 3 1 2 3 4 5 |
| 2023年2月22日8关键研发和流水线更新 我们正在继续成功地投资并推进我们丰厚的核心创新平台流水线, 仅自2018年以来,我们的研发项目就获得了超过4亿美元的自筹资金支持。 我们最近正在进行的更新包括: ✓宣布了iDose tr交换试验的结果,其中包括第二次注射iDose tr 和移除原始iDose tr植入物,随着第二个iDose tr在12个月的评估期(2023年1月)显示出良好的安全性,iDose tr与美国食品和药物管理局(FDA)的提交前会议现已结束;新药申请提交目标 2023年2月✓宣布了治疗GLK-301(iLution-干眼病)的2a期人类首个临床试验(2023年1月) o基于这些令人鼓舞的观察,我们计划将GLK-301推进到2b期临床试验,目标是于2023年开始 ✓开始招募受试者参加Epioxa™的第二阶段3验证性关键试验(Epi-on™),以支持Epioxa未来的NDA提交(2023年1月) ✓完成了GLK-302(iLution-老年性老花眼)的第二阶段临床试验;评估数据的同时,我们还 继续密切关注与现有老花眼疗法相关的不断发展的市场状况 预计在2023年进行初步数据分析✓第三代iLink疗法的第二阶段角膜健康临床计划继续取得进展 ✓PRESERFLO MicroShort o美国调查设备豁免申请计划 o正在拉丁美洲寻求批准的监管活动 ✓调查新药(IND)现已向iLution Travoprost开放(2023年1月) |
| 2023年2月22日9其他财务业绩概述 作为提醒,我们在非GAAP或形式基础上讨论我们的财务业绩,并总结我们的GAAP业绩 。我们鼓励投资者审查我们的公认会计准则到非公认会计准则的对账,可在我们的 收益新闻稿、此处包含的其他信息部分以及我们网站的投资者关系部分 中找到。 2022年第四季度财务业绩摘要: 4Q2022:84% 2021:85% YoY∆:-100bps ·请注意,我们对销售 商品成本的非公认会计准则调整包括与 埃维德罗收购会计相关的大量金额 ·同比减少反映了地域组合,2022年第四季度外汇和通胀:5110万美元 2021年第四季度:4670万美元 同比∆:+10% ·10%环比增长与2022年第三季度4640万美元·同比和季度增长反映全球商业和G&A投资和新产品发布活动 2022年第四季度:3580万美元 2021年第四季度:2650万美元 同比∆:+35% ·24%环比增长与2022年第三季度2890万美元相比,同比和季度增长反映了对 和新产品发布活动的持续投资推动研发项目(主要是iDose NDA准备)和临床试验活动(主要是环氧乙烷) 2021年第四季度:870万美元 2021年第四季度:7330万美元 2022年第三季度同比∆:+19% ·16%与7520万美元相比2022年第三季度运营亏损(非公认会计准则) 2022年第四季度:(2740万美元) 第四季度2021季度:(1130万美元) 净亏损(非公认会计准则) 42022:(2510万美元) 2021年第四季度:(1530万美元) 稀释每股收益(非GAAP) 2022年第四季度:(0.53美元) 2021年第四季度:(0.33美元) *从2022年第二季度开始, 我们不再排除与协作和许可安排相关的某些预付款和或有里程碑付款,以及用于非GAAP报告和披露目的的某些正在进行的研发费用。上一年期间 已进行相应调整,以考虑到此方法变化。 2022年第四季度:820万美元 2021年第四季度:930万美元 同比∆:(90万美元) ·与历史水平相比,资本支出保持较高水平,这一趋势预计将持续下去,然后在2023年期间放缓至更符合历史 正常水平的水平·第四季度同比下降,主要是由于加利福尼亚州阿利索·维埃霍的新设施大量完工,部分被我们在加利福尼亚州圣克莱门特和伯灵顿的投资所抵消Ma facilities Gross Margin (Non-GAAP) SG&A (Non-GAAP) R&D (Non-GAAP) SG&A+ 研发 (非公认会计准则) 收益* 资本支出 |
| 2022年2月22日10年第四季度:约3.6亿美元 2022年第三季度:约3.71亿美元 季度∆:(1,100万美元) ·运营费用和资本投资增加 2022年全年,全球合并净销售额为2.83亿美元,非公认会计准则毛利率约为83.5%,非公认会计准则运营费用为3.228亿美元,非公认会计准则运营亏损为 (8,670万美元),非公认会计准则净亏损为(103.6美元)。非GAAP每股净亏损为(2.18美元)。 包括在2022年非GAAP运营费用、非GAAP运营亏损、非GAAP净亏损和非GAAP每股收益中的IPR&D费用为1,000万美元,与与执行许可安排相关的预付款相关,这导致2022年非GAAP稀释后每股亏损有 额外亏损(0.21美元)。 现金 |
| 2023年2月22日11年度补充资料年度补充资料 每年与第四季度收益电话会议一起提供 |
| 2023年2月22日122022年评审 新的研发计划 2022: 强有力的 执行力, Performance 和milestone achievement despite headwinds •完成了iLution DED和老花眼 2a期试验 ·先进的几个临床前研发计划 ·新总部,Cornea创新中心和 新型混合制药制造设施 ·扩展的基础设施和系统 核心特许经营近期流水线 ·全球MiGs的领先地位和执行 ·iLink商业业绩和市场开发 ·国际增长和规模 ·推出iAccess、iPRIME和iStent 无限 ·积极的iDose tr阶段3 TOPLINE数据; 2023年初提交的保密协议全球业务 2022年是我们公司强劲的执行力、业绩和里程碑式的成就的一年,尽管 与我们的美国复合性白内障青光眼特许经营权相关的报销逆风和具有挑战性的宏观经济环境 。我们为我们的团队能够推进我们的关键战略计划感到自豪。 首先,我们通过推动变革性的MIG和iLink解决方案在全球范围内获得新的采用率和更深的渗透率,在我们目前的核心特许经营中成功地执行了任务。 第二,我们推进了近期的渠道,推出了三项新技术,包括iAccess、iPRIME和iStent INFINFER。我们还在2022年9月发布了积极的第三阶段topline数据,推进了iDose tr 的第三阶段临床计划。 第三,我们推进了早期流水线计划,完成了两项干眼病和老花眼的第二阶段临床试验,同时鼓励了临床前计划的研发进展,如iDose TREX和iDose Rock。 第四,我们扩大了全球业务,在加利福尼亚州Aliso Viejo建立了新的总部设施,这是波士顿的一个新的角膜创新中心, 以及位于加利福尼亚州圣克莱门特的一家新的一流混合制药制造厂,以支持iDose tr的制造计划。与此同时,我们还继续 扩展我们的整体基础设施和优化系统,以支持我们的长期增长计划。 |
| 2023年2月22日13展望2023年2023年: 继续 推进我们的 战略 核心特许经营 新的研发计划 近期流水线 ·开发独立的MiGs市场 ·复合性白内障执行 ·国际青光眼,iLink市场建设倡议成立 扩大核心产品和潜在的新医药计划在甲板上 ·2023年初iDose NDA提交;Ye 2023批准目标 ·iLution DED 2b期临床试验 ·Epioxa 3期确证临床试验 ·计划提交多个IND/IDE文件 (青光眼和其他计划) ·开始iLution tr(Ph2a)试验, iStent INFINE(标签扩展)和 Retina XR(人类第一) 全球运营 下一代创新进入临床,为未来增长做准备 ·制药实验室建设,目标是2024年iDose tr商业化 ·全球人才和专业知识 我们在2022年取得的成就让我们对我们的前景感到兴奋,并为我们的创业之旅的下一阶段做好了充分的准备 2023年,我们计划: ✓通过我们专注的干预性青光眼策略开发独立的MIGS市场, 通过新产品在联合白内障MIGS专营权内执行,并继续 扩大我们的国际青光眼和角膜健康专营权; ✓提供我们的近期流水线,在 2023年第一季度为IDOSE tr提交有针对性的保密协议,并在今年年底做出有针对性的FDA批准决定,开始iLution DED 2b期临床试验,并推进Epioxa第二阶段确认性临床试验; ✓推进了我们的早期研发计划,iLution Travoprost (Ph2a)、iStent无限(标签扩展)和Retina XR(人类首例)开始试验, 以及几个针对我们下一代疗法的计划中的IND和IDE应用程序;以及 ✓继续发展我们的全球组织和基础设施,以支持未来的增长。 |
| 2023年2月22日14提供长期增长和价值创造的投资组合 在我们进行商业执行的同时,我们继续成功地投资并推进我们强大的小说管道 , 前景看好的平台技术,我们相信这些技术可以显著扩大我们的潜在市场 并利用我们的商业平台随着时间的推移从根本上改变我们的公司。 我们的核心战略 1.伟大的想法 2.重大的临床需求 3.专业的研发团队 4.经验丰富的销售组织 5.久经考验的市场建设者 6.旨在推动长期增长和价值创造的高效全球运营 我们的使命是颠覆传统治疗模式,以提高现有的护理标准和丰富为全世界患有威胁视力的慢性眼病患者提供生命和治疗选择。我们相信,我们的平台和候选产品有能力在未来几年产生强劲的新产品推出节奏,从而产生未来的层层增长。 利润率 我们目前的 产品组合 用 解决了重要的 需要的 14个公开的流水线 项目 青光眼患者 iStent/iStent注射/iStent注射W轻中度青光眼合并白内障 IStent无限青光眼独立治疗(之前治疗失败) 角膜 Photrexa(Epi-off)圆锥角膜 其他手术 iAccess精密青光眼切开术 iPRIME ViscoDelivery 产品患者 青光眼 iStent/iStent注射/iStent注射W轻中度青光眼合并白内障 iStent无限青光眼独立治疗(先前治疗失败) iStent无限青光眼独立治疗(标签扩展) iStent无限青光眼-晚期难治性青光眼独立治疗 iDose OHT-独立青光眼 iDose TREX OHT-独立青光眼 iDose Rock OHT-青光眼独立 iLution Travoprost OHT-青光眼 iLution Travoprost OHT-青光眼 iLution Blepharitis(Epi-Off)圆锥角膜 iLink第三代圆锥角膜iLink第三代圆锥角膜(Br)iLution干眼干眼 iLution老花眼 iLution老花眼 iLution Blepharitis Demodex Blepharitis 视网膜 IVT多酶抑制因子AMD, DME、RVO IVT曲安奈德DME 其他外科手术 iAccess精密性腺切开术 iPRIME ViscoDelivery 我们未来的 产品组合 颠覆了治疗 范式, 解决了重要的 需求 推进了现有和 目前未披露的平台和计划 |
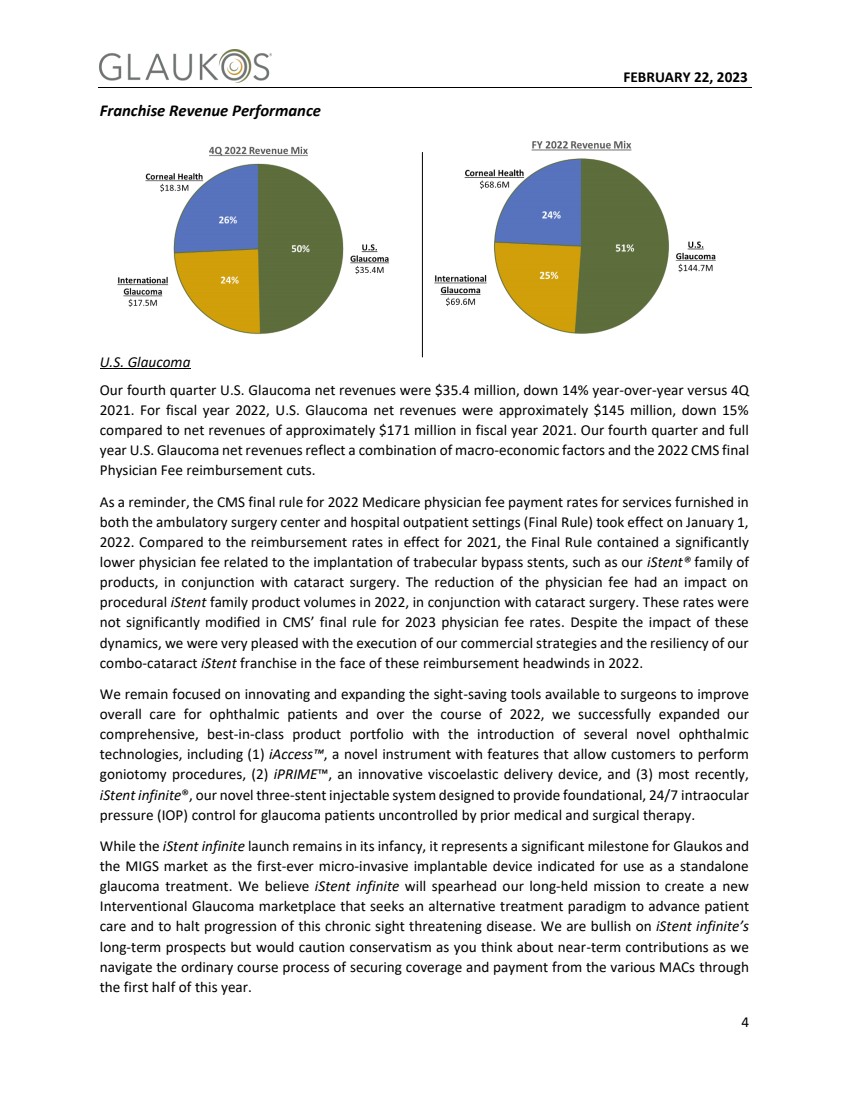
| 2023年2月22日15我们期待着未来潜在的新产品机会,我们计划利用我们成熟的 一流的商业组织和全球直销基础设施来扩大规模和提高销售代表的生产力,我们认为这是一个非常具有杠杆作用的全球眼科销售渠道。 高效、 scalable global platform supports growth 2015 2023 65 275+ 全球商业人员 拥有直销业务的国家/地区 2014年2 2023 17个国家/地区 分销商和 另外35个国家/地区的混合动力车型 新的最先进的混合动力制药制造设施 此外,我们相信我们已经建立的雄厚的财务状况和资本状况提供了坚实的基础 ,这使我们能够在成功投资未来时保持攻势,为我们的开创性旅程的下一阶段做好准备,因为我们的目标是临床、监管、和 今年的商业里程碑和年度ahead. Attractive financial profile provides solid foundation NET销售额 2015 2022$72$283利润率 75%%83% 2014年毛利率1 2022$360 2015$104 2022现金和等值(百万) 20%+ 7年复合年增长率 销售组合 2014财年公认会计准则和非公认会计准则毛利率(75%);2022年GAAP毛利率为76%,用于某些Avedro合并相关会计和其他调整-有关详细信息,请参阅附录 2015年6月30日,2022年截至12月31日51% 25% 24% 2022 95% 5% 3q 2015年美国青光眼 角膜健康 国际青光眼 |
| 2023年2月22日16个关键技术平台/产品/候选产品 概述 我们的平台包含了雄心勃勃的宏大构想,旨在解决长期得不到充分服务的大型眼科疾病 青光眼、角膜疾病和视网膜疾病。多年来,已披露的与这些平台相关的流水线项目数量已大幅扩大至14个,进入2023年。自2018年以来, 在研发方面投入了5个不同的平台 产生颠覆性、 3个专营权的无滴创新 4亿美元 14披露了2023年的流水线项目 与2015年的4个项目自2018年以来,我们的大创意 开发了新的 无滴 疗法,以 颠覆传统的 局部滴眼液 被猖獗的患者困扰的 疗法 不坚持 |
| 2023年2月22日17iStent微型手术设备 我们的基础iStent微型手术设备平台主要包括 插入微型设备,旨在通过为青光眼患者恢复 自然房水流出通道来降低眼压。我们相信,我们的iStent产品组合是业界最全面的微创、节省组织的青光眼解决方案,支持我们的目标,即提供全方位的选项,以适应外科医生的个人青光眼治疗算法,在疾病 进展的每个阶段、从高眼压到难治性疾病以及在联合白内障和独立手术中提供最佳的 短期和长期风险效益比计算。 我们为成为企业先驱和全球市场领导者而自豪。自我们成立以来,我们的iStent技术系列得到了250多份同行评议出版物的支持,20多年的临床和商业经验,以及全球植入的100多万台iStent设备。 组合式白内障今天,在美国市场,我们提供的iStent和iStent Inject®W是美国食品和药物管理局批准的用于治疗轻度到中度原发性开角型青光眼合并白内障手术的产品。 ➢iStent美国FDA批准(2012) ➢iStent Inject美国FDA批准(2018) ➢iStent Inject W美国FDA批准(2020) 这些产品还获得批准并在各种国际市场销售 。IStent注射剂W代表了国际市场的大部分收入,但我们仍继续销售iStent注射剂 |
| 2023年2月22日18个市场尚未推出iStent Injection W,第一代iStent已在部分市场上市。 2022年8月,我们宣布FDA 510(K)批准了iStent INFINE,这是我们的新型三支架可注射系统,旨在为先前内科和外科治疗无法控制的青光眼患者提供基础的全天候眼压控制。 iStent INFINE是一种三支架设备,旨在通过独立的 程序来降低青光眼患者的高眼压。它包括三个预装在自动注射系统中的肝素涂层钛支架,该系统允许外科医生在施莱姆管(眼睛的主要引流通道)周围大约六个小时的时间内注射支架。支架安装到位后,可通过恢复房水自然、生理性的流出来降低眼压。强大的关键数据支持,突出了 良好的安全性和有效性,我们相信iStent INFINE可能会为眼科外科医生提供一种极具吸引力的新治疗选择,为那些之前的内科和外科治疗无法控制的开角型青光眼患者 进行独立的治疗。 之前手术治疗失败的开角型青光眼患者 o 510(K)美国食品和药物管理局批准(2022年8月) o正在与联邦医疗保险行政承包商(MACS) 合作,为CPT代码0671T(独立MIG/iStent INFINITE)制定积极的覆盖决定和相关付款 水平。 患有早期单纯性青光眼的➢患者 o IDE计划 而iStent无限发布仍处于起步阶段, 这对我们公司和MiGs市场来说是一个重要的里程碑,因为它是有史以来第一个被指定用于独立治疗青光眼的微创植入式设备。我们相信iStent无限将引领我们的长期使命,创建一个新的介入性青光眼市场,寻求一种替代治疗模式来推进患者护理并阻止这种慢性视力威胁疾病的发展。我们看好iStent INFINE的长期前景,但在考虑近期贡献时,请谨慎行事,因为我们 在今年上半年完成了从各个Mac获得保险和付款的正常过程。 |
| 2023年2月22日19 iDose缓释药物 我们的iDose缓释药物平台由靶向、微创、可注射植入物组成,旨在从眼睛内提供更长时间的治疗水平的药物。旨在通过提供全天候、长期、强劲的疗效和最小的副作用来解决普遍存在的患者不依从性和与局部药物相关的慢性副作用。iDose tr由著名的前列腺素类似物曲伏前列素组成,是我们利用iDose平台技术推进的第一个研究候选者。 ➢美国FDA针对高眼压或开角型青光眼患者的NDA研究 o阳性背线3期结果达到了主要疗效终点 并显示出良好的耐受性和安全性 (2022年9月) o宣布(2023年1月) 即将提交NDA申请(2023年1月) o目标是在2022年9月7日之前潜在的NDA批准,我们宣布了iDose tr的两个第三阶段关键试验的主要数据,即在两个第三阶段试验中, 在3个月内成功实现了预先指定的主要疗效终点 ,并在12个月内证明了良好的耐受性和安全性。基于两个第三阶段关键试验的综合疗效和安全性结果,我们正在准备即将向美国FDA提交缓释iDose tr模型的NDA ,预计FDA将在2023年底完成审查和决定 。 |
| 2023年2月22日在两个关键的审判中,IDose tr 快释和缓释剂量 达到了与美国FDA商定的预先指定的 主要疗效终点 (在3个月内不逊于局部用药 硫吗心安) 积极的3期试验结果 预计将支持 即将提交的nda申请 缓释iDose tr 眼压较基线(毫米汞)下降8.5 6.6 7.7 6.5 6.7 6.8 6.8 7.2慢发布iDose tr Timolol 0.5%Bid 前3个月1·1期间观察到的眼压较基线下降 ,150名受试者在两个3期试验中随机 ·每个研究的平均基线眼压为~24 mm Hg ·~81%的缓释片受试者患有开角型青光眼;19%的眼部高血压 ·67%的缓释iDose tr 受试者在筛查时至少服用了1种降眼压药物,其中23%的受试者在3期或2期以上的数据中达到了主要疗效终点 1 mm Hg范围代表在美国FDA预先指定的6个时间点,即第10天、第6周和第3个月的上午8点和10点的眼压下降;IDose tr未获FDA批准 除了第三阶段关键数据外,我们很高兴最近宣布了iDose tr交换试验的结果,其中包括第二次注射iDose tr和移除原始iDose tr植入物,第二次iDose tr在12个月的评估期内显示出良好的安全性 。另外, 在平均超过五年的延长评估期内,Exchange试验中没有一名受试者表现出超过30%的内皮细胞丢失。我们很高兴这些数据 在临床上支持iDose患者随时间推移重新治疗的安全性和耐受性,并进一步增加了我们市场领先的临床证据体系,支持我们的微创技术相对于竞争对手的替代方案具有同类最佳的效益风险计算。 我们期待着将此数据集包括在我们即将提交给FDA的 即将发布的NDA中,它将扩大强大的第三阶段数据集。除了我们的临床和监管 ·前瞻性多中心试验,以评估交换程序的安全性 ·研究纳入了33名之前植入iDose tr阶段2b研究的受试者 ·受试者的眼睛接受了手术 使用缓释iDose tr 模型进行了手术 交换,随访期为12个月 ·平均总体扩展评估时间为5年以上 Exchange研究的阳性 数据集将包括在 NDA中以实现重复 剂量;目标是在2023年第一季度提交FDA 角膜内皮细胞计数在5年以上没有临床意义的变化 Exchange研究中没有患者在延长的评估期内出现内皮细胞丢失(≥30%丢失)的不良事件 Exchange试验显示再次给药iDose tr 0 500 1000 1500 2000 2500 3000 Ph2b基线Ph2b 3年重新给药 基线(4.2年) 第二剂1年 (5.2年) 角膜内皮细胞密度 (细胞/mm2) |
| 2023年2月22日21团队孜孜不倦的保密协议准备工作,我们已经在我们的商业和市场准入组织中与一个由跨职能部门的 领导者组成的团队顺利地推进了iDose tr商业发布的准备和规划 目标是在2024年推出iDose tr。 鉴于我们在iDose tr方面的开发迄今取得的成功,我们将继续投入资源来扩展我们的 药物开发能力并开发未来的iDose解决方案。 下一代iDose延期释放植入物,其尺寸和外形与原始iDose tr相似,旨在提供近两倍的药物容量,以延长疗效持续时间。 o临床前 我们还在评估其他药物类别,如岩石抑制剂 ,我们已经看到令人鼓舞的兔子模型数据,并正在为候选药物建立 原型植入。 o临床前 |
| 2023年2月22日22我们的另一项新型免费外科眼科技术由Glaukos与眼科医生合作开发,iAccess是一种 精密刀片,旨在切割小梁组织,从而使 水直接流入Schlemm管。带iAccess的生殖器切开术旨在为外科医生提供多才多艺的外科技术,使外科医生能够确定哪种手术最适合患者,无论是跨越几个小时的多个小切口,保存多达95%的解剖结构,还是广泛的施莱姆管开口。➢于2022年第一季度开始在美国开展iAccess的商业发布活动。iPRIME是一种新颖的产品,真正微创的粘弹性输送系统,通过在眼科手术期间提供粘弹性输送, 进一步支持医生和患者的需求。这项技术进一步扩展了Glaukos广泛的创新眼科解决方案产品组合,与我们对微创疗法价值的长期立场是一致的。我们相信iPRIME将成为支持医生和患者需求的另一种重要工具。 ➢于2022年第二季度末在美国开始了iPRIME的初步商业推出活动 PRESERFLO MicroShort是一种不需要外置的外科青光眼植入物 旨在降低原发性开角型青光眼患者的眼压 在使用最大耐受性青光眼药物或青光眼进展需要手术时眼压无法控制的患者。由一种名为SIBS poly(styrene-block-isobutylene-block-styrene),的专有生物兼容材料制成的PRESERFLO微分流器是一种灵活的, 带有平面翅片的8.5毫米长的管子 有助于通过微切口将设备固定在组织中,防止泄漏和迁移。 ➢OUS获得批准并在澳大利亚和加拿大推出 ➢监管活动正在寻求拉丁美洲的批准 ➢美国IDE计划于2023年 |
| 2023年2月22日23 iLink生物激活药物 我们的iLink生物激活药物平台由新的一次性 药物配方组成,这些药物由我们的专利系统通过将紫外线传递到角膜来生物激活 ,从而引发名为角膜交联的生化反应,旨在加强、稳定和重塑角膜。 尽管圆锥角膜是一种严重威胁视力的疾病,也是美国全层角膜移植的主要原因,但我们认为它仍然严重得不到治疗。这种治疗不足主要是由于诊断不足和历史上缺乏有效的解决方案。 为了最大限度地提高这种重要的Photrexa疗法对患者的可用性,我们 进行了大量投资,并执行了一系列旨在扩大我们的商业 组织、降低实践采用门槛、提高验光和眼科社区对圆锥角膜的认识、简化转诊模式以及培训角膜健康专业人员的iLink程序。 Photrexa(Epi-Off™)我们的第一代iLink疗法,ILink Epi-off使用一种名为Photrexa的新药配方来治疗圆锥角膜,圆锥角膜是一种威胁视力的退行性疾病,在这种疾病中,角膜逐渐变薄,变弱,导致视力丧失。FDA批准的仅是被证明可以减缓或阻止圆锥角膜进展的疗法 o在没有有效治疗的情况下,每5名进展性圆锥角膜患者中就有1人可能需要进行角膜移植1 200+同行评审出版物 o出色的疗效和安全性。广泛的临床证据和长期(10年)的随访 o产品特定的J-Code;为97%以上的商业活动提供优惠补偿 1 Pramanik S,Musch DC,Sutphin JE, 法尔霍AA。穿透性角膜移植治疗圆锥角膜的长期疗效。眼科。2006年;113(9):1633-1638;马哈拉纳PK,阿加瓦尔K,Jhanji V,Vajpayee RB。深前板层角膜移植治疗圆锥角膜的研究进展眼神隐形眼镜。2014;40(6):382-389 |
| 展望未来,我们正在推进我们的下一代iLink疗法,也就是Epi-on,它使用了一种名为Epioxa的专利新药配方, 更强的UVA照射方案,以及提供更高水平的补充氧气的能力。 o第一阶段第三阶段临床试验阳性结果满足预定义终点 (2021年2月) o开始第二阶段第三阶段确认临床试验(2023年1月) o目标是在2023年1月之前完成第二阶段第三阶段确认试验,旨在减少治疗时间和复杂性,改善患者 舒适度和恢复时间 ,根据我们在NDA前会议期间从FDA收到的反馈,我们开始了我们治疗圆锥角膜的下一代角膜交联剂Epioxa(Epi-On)的第二阶段3验证性关键试验的受试者登记。我们计划在这项试验中随机抽取大约290名受试者,目标是在2023年底完成登记。 提醒一下,FDA已经确认,我们的Epioxa第一阶段3关键试验满足预先指定的主要疗效终点,将足以支持提交和审查最终的NDA, 与第二次试验一起进行。随着我们继续推进Epioxa的临床计划,我们仍然处于有利地位,可以为圆锥角膜患者提供我们的第一代角膜交联剂,即Epi-off,它仍然是FDA批准的唯一可以减缓和阻止圆锥角膜进展的疗法。 正如我们对所有平台所做的那样,我们继续推动后续几代未来的创新, 和 正在进行第三代iLink疗法的第二阶段临床计划。 iLink第三代第三代iLink疗法正在进行第二阶段临床计划 o旨在定制治疗能力和简化患者体验 o由两个独立的多中心、随机、对照试验 组成,旨在评估针对患者的安全性和有效性, 定制与非定制的角膜治疗模式 交联和新的基于激光的生物激活系统,于2022年第二季度,吾等与iVeena Delivery Systems,Inc.订立独家许可协议,据此,iVeena授予Glaukos使用iVeena专有技术的全球独家许可,包括治疗圆锥角膜的某些化学成分。 |
| 2023年2月22日25 o IVMED-80是iVeena的主要研究候选者,这是一种专有的非手术、非侵入性、疾病修改干预措施,具有FDA孤儿 称号,可上调赖氨酰氧化酶(LOX)并在药理上诱导角膜 交联性 o这是一个非常早期的计划(第一阶段),是我们iLink平台的补充 本许可协议表明了我们对这一类别以及为圆锥角膜患者提供治疗和护理的持续承诺 |
| 2023年2月22日26 iLution透皮药物 我们的iLution透皮 药物平台由基于专利的乳膏 药物配方组成,应用于 眼皮外表面,用于 治疗眼部疾病的 药物活性化合物 无滴入皮给药。 我们认为iLution在眼皮上的差异化给药方法 与传统的局部给药方式相比具有显著的优势,包括更容易给药,起效更快,副作用更少,例如减少防腐剂引起的角膜和结膜后遗症,所有这些都有助于更好的依从性和改善患者的预后。 GLK-301:干眼GLK-301是一种适用于眼皮的无菌眼科局部霜,用于 治疗干眼症的症状和体征。乳膏 配方充当了一个仓库,允许匹罗卡品通过眼睑真皮输送到眼睛。 o利用我们的iLution平台 o API:匹罗卡品 o 2a期首次人体试验结果显示有望进展到计划于2023年1月进行的 2b期试验,我们宣布了针对我们的iLution干眼病计划 GLK-301的2a期临床试验的初步结果。GLK-301的TOPLINE 2a阶段结果显示,泪膜质量有所改善,视觉质量也相应改善。基于这些令人鼓舞的观察,我们计划在今年晚些时候开始GLK-301的2b阶段试验。 |
| 2月22日,2023年27-8.5-8.2试验显示良好的安全性和耐受性 ·98%的患者完成试验 ·未发生眼部不良事件,发生率为5%或更高 泪膜质量改善(泪膜破裂时间征),视力质量相应改善(视力模糊症状减轻) 观察到背线试验结果为早期读出iLution无滴眼疗法治疗干眼的潜在差异化疗效提供了良好的早期 读数疾病 iLution干眼(GLK-301)2a期试验:对218名干眼症患者进行了为期28天的研究,并对3种剂量的GLK-301与安慰剂进行了为期28天的安全随访 ~55名患者/组 GLK-301 2a期首次人体试验结果显示,承诺进入2023期2b试验 GLK-301a安慰剂 43% 22% 泪液破裂时间百分比 28天GLK-301a安慰剂较基线变化 VAS视力改善模糊 较28天27 19©2023 Glaukos Corporation 26 GLK-302基线变化:老花眼 GLK-302是一种无菌眼科外用乳膏,适用于眼皮,用于治疗老花眼。该霜配方充当了一个仓库,使匹罗卡品可以通过眼睑真皮输送到眼睛。 o利用我们的iLution平台 o第二个研究候选药物:匹罗卡品 o 2a期完成;评估2a期数据,同时我们继续 密切关注与可用的老花疗法相关的不断发展的市场状况 GLK-311:Travoprost GLK-311是我们的临床前计划,研究专为治疗眼前节疾病而设计的药物化合物 , 例如 青光眼。 o IND现已开放;计划于2023年开始试验。o api:Travoprost Blepharitis Ilution Blepharitis是我们的临床前计划,研究旨在根除蠕形螨的药物 化合物, 蠕形螨炎是眼皮炎的根本原因,经常与眉毛腺功能障碍和相关眼病有关。 o临床前 |
| 蠕形螨是人体皮肤上发现的最常见的体外寄生虫 蠕形螨是眼皮炎的根本原因,通常与眉肌腺功能障碍有关,是干眼病和其他几种相关眼病的主要原因。 |
| 2023年2月22日29视网膜XR生物可侵蚀缓释药物 我们的生物可侵蚀缓释药物平台Retina XR旨在治疗视网膜疾病,目前视网膜是眼科最大的市场 估计全球销售额为130亿美元,预计到2023年将以每年近10%的速度增长。在美国,视网膜疾病影响着大约2800万人;AMD和糖尿病眼病约占患者总数的89%(根据市场范围)。 GLK-401: IVT多激酶抑制剂 GLK-401是一种生物可腐蚀缓释植入物,针对老年性黄斑变性(AMD)、糖尿病黄斑水肿(DME)、和视网膜静脉阻塞。 o临床前开发 o api:MultiKinase Inhibitor GLK-411: Triamcinolone GLK-411是一种针对二甲基醚的生物可腐蚀缓释植入物。 o临床前开发 o api:曲安奈德 这些临床前计划的目标是为视网膜专家和他们的患者提供新的 持续药物治疗方案,这些方案提供比目前占主导地位的护理标准更长的有效持续时间通过短期生物注射,由于所需治疗的频率很高,这往往会给患者带来巨大的治疗负担。我们的目标是在未来12个月内将其中至少一个项目推进到首个人类临床试验中。 |
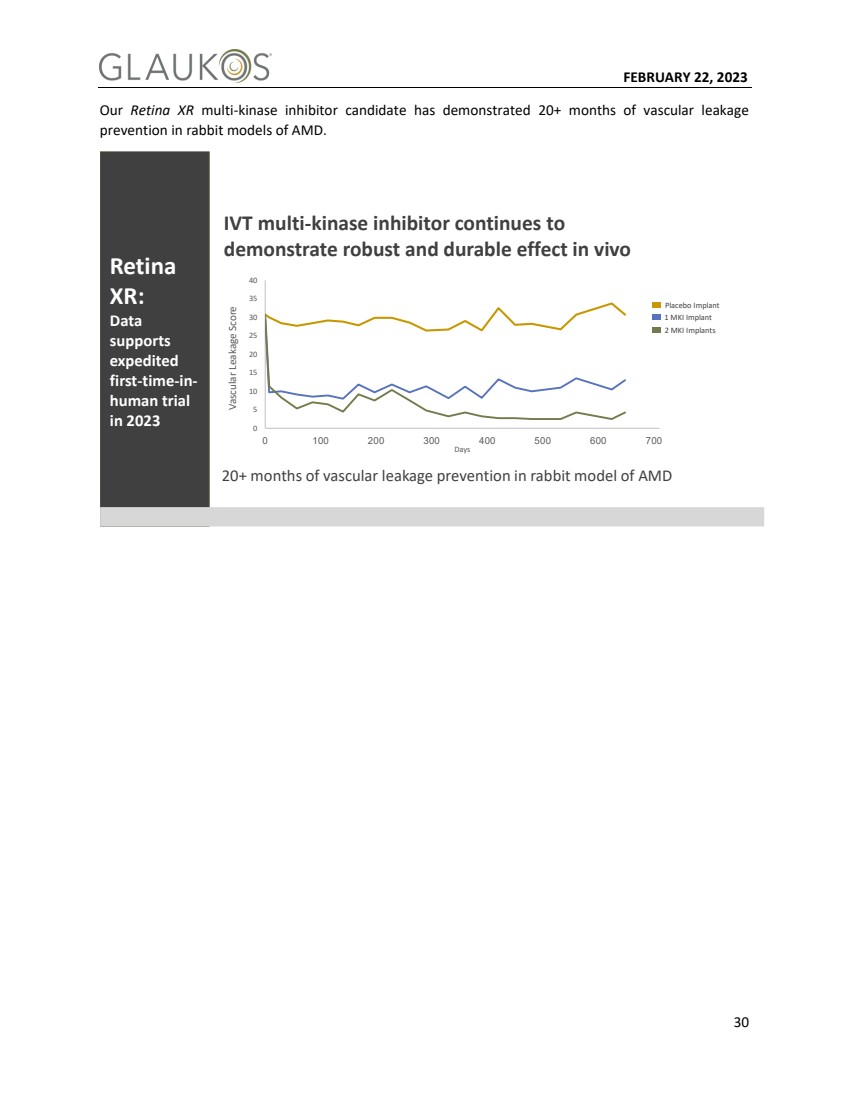
| 2月22日,2023年30我们的Retina XR多激酶抑制剂候选药物已经在AMD兔模型中证明了20+个月的预防血管渗漏 在2023年进行的Retina XR: Data supports expedited first-time-in-human试验 -8.5-8.2IVT试验 在AMD兔模型中20+个月的预防血管渗漏 IVT多激酶抑制剂继续 在体内显示出强大而持久的效果 0 10 15 20 25 30 35 40 0 100 200 300 400500 600 700血管渗漏评分 天 安慰剂植入物 2个MKI植入物 1个MKI植入物 |
| 2023年2月22日31年度补充资料 |
| 2023年2月22日32前瞻性陈述 本新闻稿包含联邦证券法定义的“前瞻性陈述”。 本演示文稿中包含的涉及我们预期、相信或预期未来将发生或可能发生的活动、事件或发展的除历史事实陈述外的所有陈述均为前瞻性陈述。这些陈述基于管理层目前的预期、假设、估计和信念。尽管我们相信本文中包含的前瞻性陈述有合理的基础,但我们提醒您,这些前瞻性陈述是基于对影响我们的未来事件的当前预期,会受到与我们的运营和业务环境有关的风险、不确定性和因素的影响,所有这些都很难预测,其中许多是我们无法控制的, 可能会导致我们的实际结果与本演示文稿中的前瞻性 陈述所表达或暗示的结果大不相同。这些可能导致实际结果与前瞻性陈述中描述的结果大不相同的潜在风险和不确定性包括但不限于: 新冠肺炎大流行或其他公共卫生危机对我们业务的影响的不确定性;包括外汇波动在内的总体宏观经济状况的影响;CMS最终确定的2022年和2023年使用该公司iStent系列产品的手术的医生费用和ASC设施费用报销率及其对我们美国组合性白内障青光眼收入的影响;我们有能力继续创造商业化产品的销量,并开发和商业化其他产品;我们对有限数量的第三方供应商的依赖, 其中一些是单一来源, 对于我们产品的组件;我们的主要设施发生严重事故、自然灾害或其他中断,这可能会对我们的制造能力和运营造成实质性影响 ;确保或保持第三方为使用iStent、iStent注射器、iStent注射器W、iAccess、iPRIME、iStent Infinition的程序提供足够的保险或报销 , 我们的角膜交联剂产品或其他正在开发的产品;我们在使用我们的产品时进行适当培训的能力,以及 获得眼科医生的接受和信任;我们在医疗器械行业以及与当前和未来技术(包括MIG 技术)有效竞争的能力;我们遵守联邦、州和外国法律法规对我们产品和制造流程的批准和销售及营销;我们的临床试验过程漫长且昂贵,以及任何特定临床试验或监管批准过程的时间和结果的不确定性;我们的产品召回或严重安全问题的风险以及患者结果的不确定性;我们的保护能力,以及保护我们的知识产权不受第三方和竞争对手影响的费用和耗时的性质,以及因侵犯或挪用第三方知识产权和任何相关诉讼而对我们提出的任何索赔的影响;以及 我们偿还债务的能力。我们在提交给美国证券交易委员会(美国证券交易委员会)的文件中,包括截至2022年9月30日的10-Q表格季度报告,以及我们于2022年11月4日提交给美国证券交易委员会的10-Q表格季度报告,详细描述了这些和其他已知的风险、不确定因素和因素。, 并将包括在截至2022年12月31日的年度Form 10-K年度报告中,预计将于2023年3月1日或之前提交。我们向美国证券交易委员会提交的文件可在我们网站的投资者栏目中查阅,网址为:www.glaukos.com或www.sec.gov。此外,我们的网站www.glaukos.com上还提供了有关我们产品的风险和收益的信息。本新闻稿中包含的所有前瞻性陈述均明确符合前述警告性声明的全部内容。告诫您不要过度依赖本新闻稿中的前瞻性陈述, 这些陈述仅在本新闻稿发布之日起发表。我们不承担任何更新、修改或澄清这些内容的义务 |
| 2023年2月22日33前瞻性陈述,无论是由于新信息、未来事件还是其他原因,适用的证券法可能要求的除外。 关于使用非GAAP财务指标的声明 为补充根据公认会计原则(“GAAP”)编制的综合财务结果,公司使用某些非GAAP历史财务指标。 管理层对GAAP计量进行调整,涉及(A)未反映公司核心经营活动的项目(费用和收益),(B)通常在本公司所属行业内作出调整,以加强本公司财务业绩与其同业 集团财务业绩的可比性,或(C)不同期间的金额或频率不一致(尽管该等项目受到监察 及与核心业务同等尽责地控制)。本公司使用“非公认会计原则” 一词,是指不包括实施业务合并所发生的与外部收购相关的成本;在业务合并、资产购买交易或其他合同关系中取得的无形资产的摊销;商誉和无形资产的减值;某些正在进行的研发费用;因业务合并而产生的或有对价负债和收购前或有事项的公允价值调整;与业务合并有关的整合和过渡成本;在业务合并或资产购买交易中取得的存货的公允市场价值调整。 与退出或大幅缩减企业规模相关的重组费用、重复运营费用或资产冲销(或冲销);出售企业的损益;按市值计价调整、减值的损益, 长期投资或出售;对对冲未来期间收入或支出风险的衍生工具的按市值计价调整 ;重大法律诉讼费用和/或和解费用,或与政府或内部调查有关的重大法律费用和其他相关费用;与交易有关的重大离散收入和 其他税务调整,以及与企业合并相关的估计收购日期税务影响的变化,以及实施税法变化和 和解的影响。有关提交给可比GAAP财务指标的每个非GAAP衡量标准的对账,请参阅“主要GAAP对非GAAP调整”。 此外,为了消除外币汇率波动的影响,公司 还在不变货币基础上提供某些净销售额信息,这代表了如果本期汇率与可比时期有效的平均汇率 相同将导致的结果 。有关按已报告、GAAP和不变货币基础上的某些净销售额信息的 演示,请参阅“其他GAAP对非GAAP调整”。 |
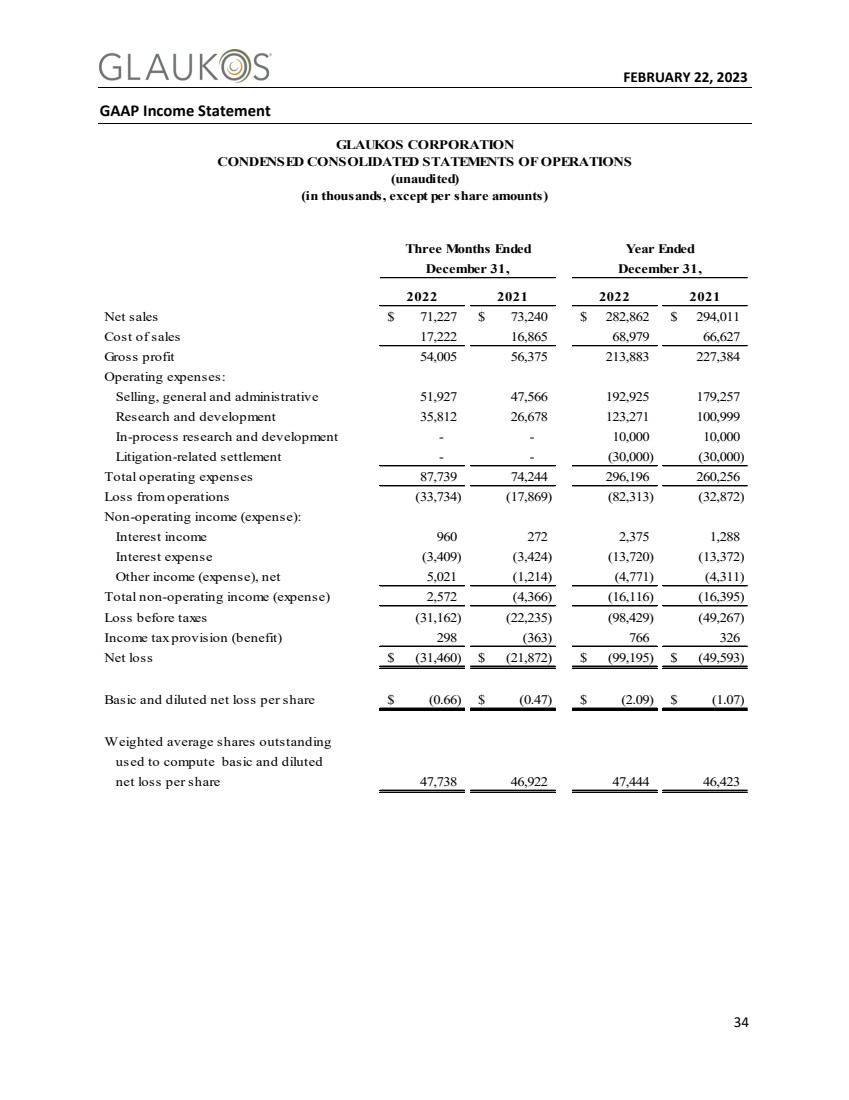
| 2023年2月22日34 GAAP损益表 截至2022年12月31日的三个月 2021年12月31日净销售额$71,227$73,240$282,862$294,011销售成本17,222 16,865 68,979 66,627毛利润54,005 56,375 213,883 227,384运营费用: 销售,一般和行政51,927 47,566 192,925 179,257研究和开发35,812 26,678 123,271 100,999正在进行的研究和开发--10,000与诉讼相关的和解--(30,000)(30,000) 总运营费用87,739 74,244 296,196 260,256运营亏损(33,734)(17,869)(82,313)(32,872) 非运营收入(支出): 利息收入960 272,375 1,288利息支出(3,409)(3,424)(13,720)(13,372) 净5,021(1,214)(4,771)(4,311) 营业外收入(费用)合计2,572(4,366)(16,116)(16,395) 税前亏损(31,162)(22,235)(98,429)(49,267) 所得税准备(福利)298(363)766 326净亏损$(31,460)$(21,872)$(99,195)$(49,593) 每股基本和稀释后净亏损$(0.66)$(0.47)$(2.09)$1.07) 加权平均流通股 用于计算基本和稀释后每股净亏损47,738 46,922 47,444 46,423 GLAUKOS Corporation 精简合并经营报表 (千,每股金额除外) (未经审计) |
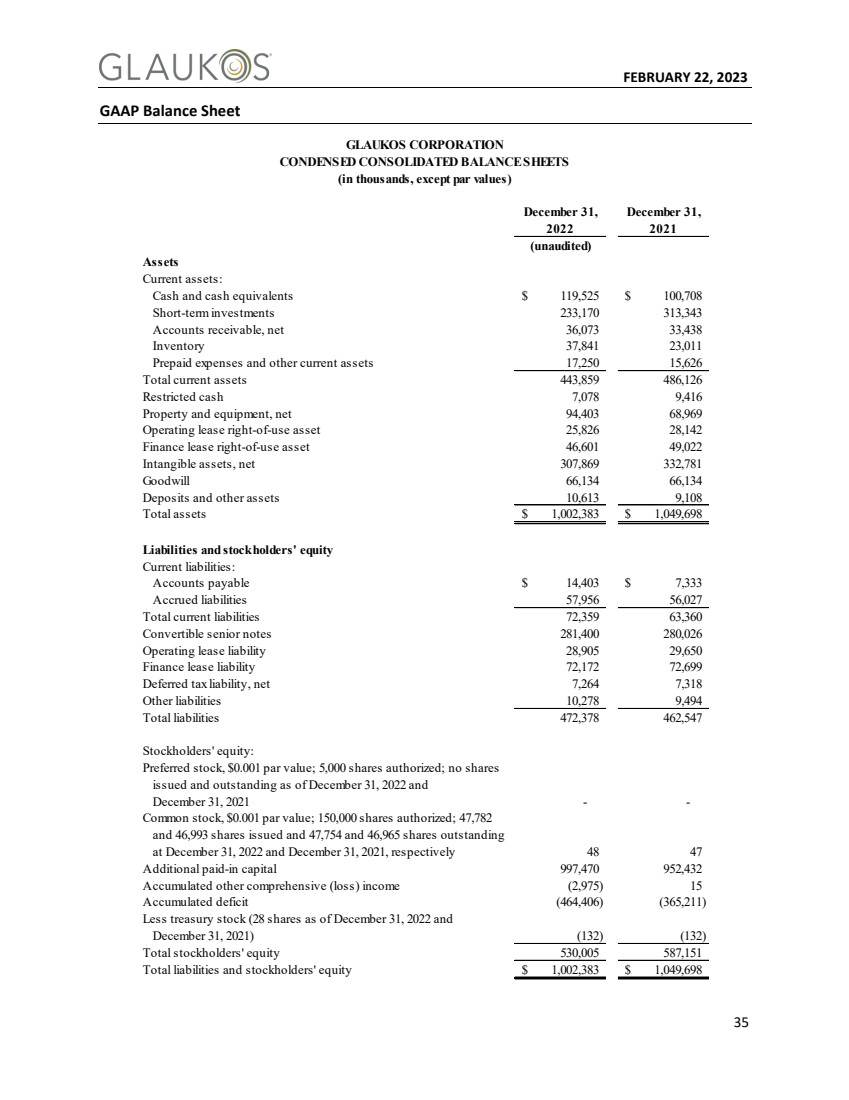
| 2023年2月22日35 GAAP资产负债表 GLAUKOS Corporation 压缩合并资产负债表 (千元,面值除外) 2022年12月31日 2021年12月31日(未经审计) 资产 流动资产: 现金及现金等价物$119,525$100,708短期投资233,170 313,343应收账款,净额36,073 33,438存货37,841 23,011预付费用和其他流动资产17,250 15,626总流动资产443,859 486,126受限现金资产443,859 486,126受限现金使用权资产25,826 28,142融资租赁资产使用权46,170 313,343应收账款,净额36,073 33,438存货37,841 23,011预付费用和其他流动资产17,250 15,626流动资产443,859 486,126受限现金资产49,416净额940,368,969净307,869 332,781商誉66,134 66,134存款和其他资产10,613 9,108总资产$1,002,383$1,049,698负债和股东权益 流动负债: 应付账款$14,403$7,333应计负债57,956 56,027流动负债总额72,359 63,360可转换优先票据281,400 280,026经营租赁负债28,905 29,650融资租赁负债72,172 72,699净额7,264 7,318其他负债10,278 9,494总负债472,378 462,547股东权益: 优先股,面值0.001美元;授权5,000股;截至2022年12月31日和2021年12月31日未发行和发行任何股份-- 普通股,面值0.001美元;授权150,000股;在2022年12月31日和2021年12月31日分别发行47,782股和46,993股以及47,754股和46,965股 分别48 47额外实收资本997,470 952,432累计其他综合(亏损)收入(2,975)15累计亏损(464,406)(365,211) 减去库存股(截至2022年12月31日为28股)(132) 股东权益总额530,005 587,151负债和股东权益总额$1,002,383$1,049,698 |
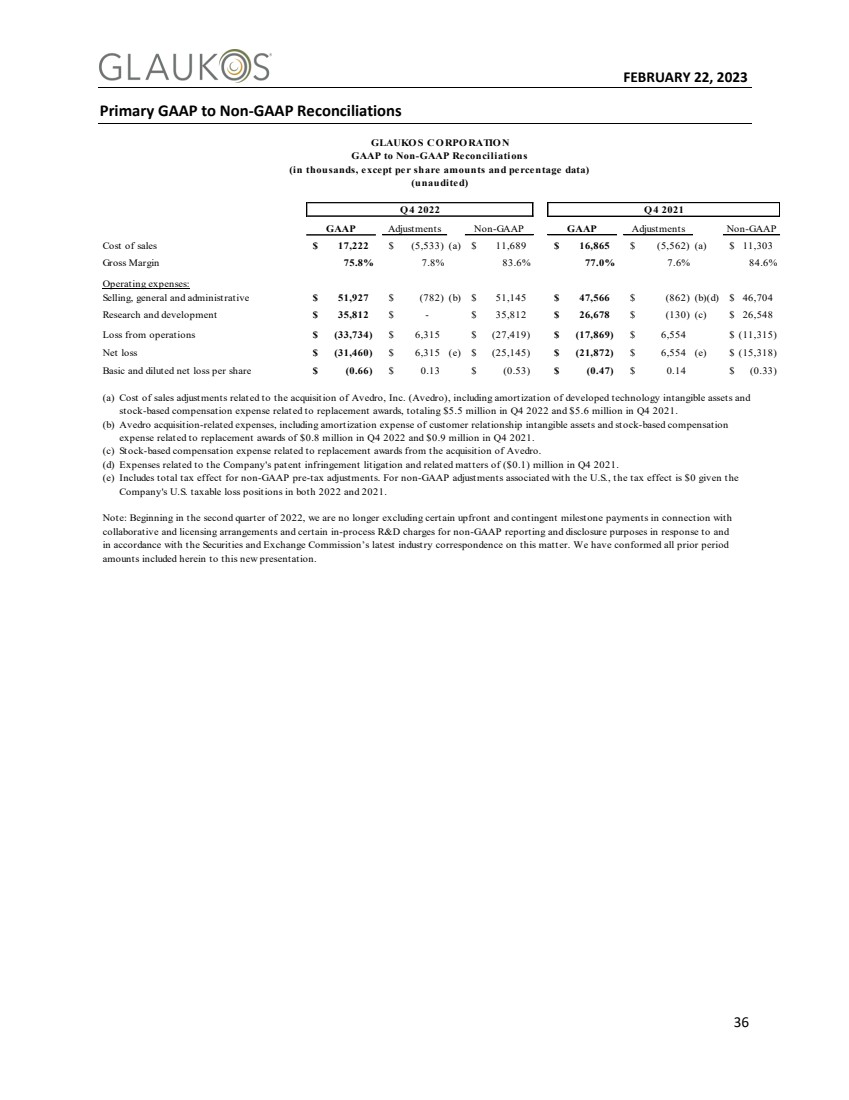
| 2023年2月22日36主要GAAP至非GAAP调整 GLAUKO S CO RPO比率N GAAP至非GAAP调整 (单位:千,每股金额和百分比数据除外) (未经审计) Q 4 2022 Q 4 2021 GAAP调整非GAAP GAAP调整非GAAP 销售成本$17,222$(5,533)(A)$11,689$16,865$(5,562)(A)$11,689$16,865$(5,562)(A)$11,303毛利率75.8%7.8%83.6%77.0%7.6%84.6% 运营费用:销售、一般和管理费用$51,927$(782)(B)$51,145$47,566$(862)(B)(D)$46,704研发$35,812$-$35,812$26,678$(130)(C)$26,548运营亏损$(33,734)$6,315$(27,419)$(17,869)$6,554$(11,315) 净亏损$(31,460)$6,315(E)$(25,145)$(21,872)$6,554(E)$(15,318) 每股基本和稀释后净亏损$(0.66)$0.13$(0.53)$(0.47)$0.14$(0.33) (A)与收购Avedro,Inc.(Avedro)有关的销售调整成本,包括已开发技术无形资产的摊销和与重置奖励有关的基于股票的薪酬支出,2022年第四季度总计550万美元,2021年第四季度560万美元。 (B)埃维德罗收购相关支出,包括客户关系无形资产摊销费用和股票补偿 与2022年第四季度的80万美元和2021年第四季度的90万美元的替换奖励相关的股票补偿支出。 (C)与收购Avedro的替换奖励相关的股票补偿支出。 (D)2021年第四季度与公司专利侵权诉讼和相关事项相关的支出(10万美元)。 (E)包括非公认会计原则税前调整的总税收影响。对于与美国相关的非GAAP调整,考虑到公司在2022年和2021年在美国的应税亏损头寸,税收影响为0美元。 注:从2022年第二季度开始, 根据美国证券交易委员会关于此事的最新行业函件,我们不再排除与协作和许可安排相关的某些预付和或有里程碑付款,以及针对非GAAP报告和披露目的的某些正在进行的研发费用。我们已将本文中包含的所有前期 金额与此新演示文稿一致。 |
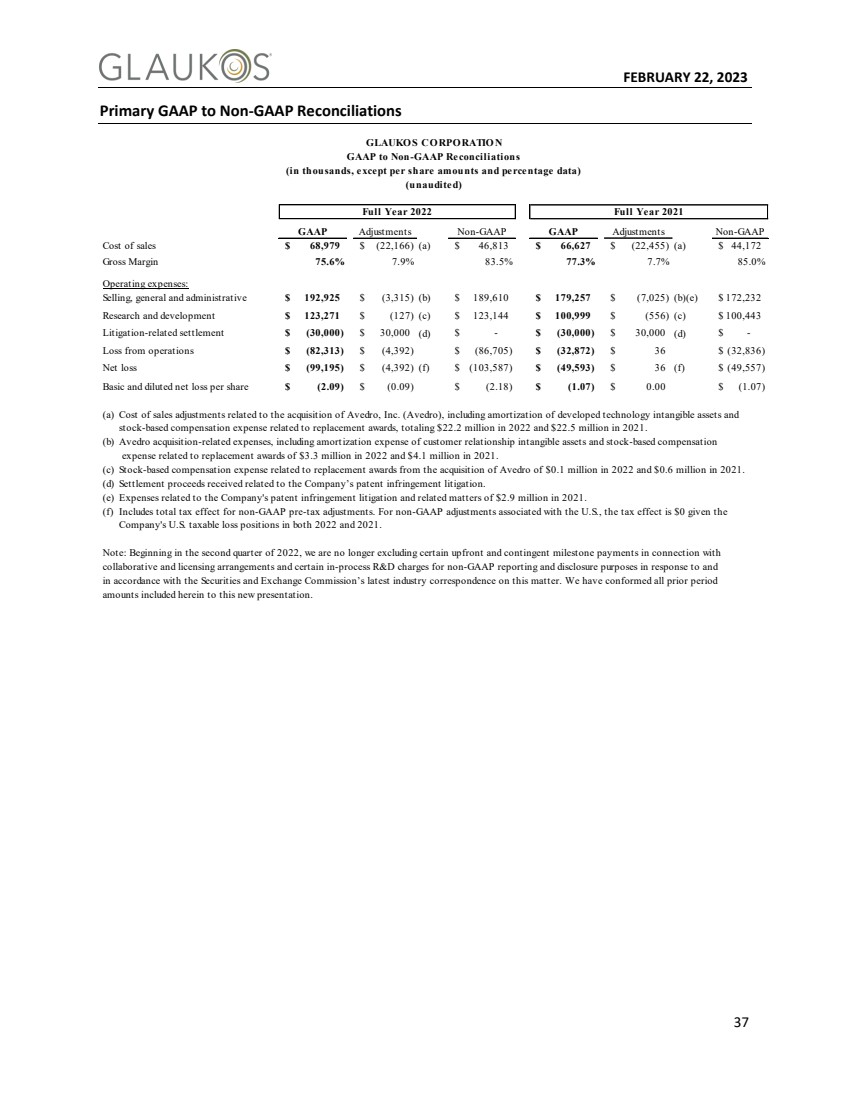
| FEBRUARY 22, 2023 37 Primary GAAP to Non-GAAP Reconciliations GLAUKO S CO RPO RATIO N GAAP to Non-GAAP Reconciliations (in thousands, except per share amounts and percentage data) (unaudited) Full Year 2022 Full Year 2021 GAAP Adjustments Non-GAAP GAAP Adjustments Non-GAAP Cost of sales $ 68,979 $ (22,166) (a) $ 46,813 $ 66,627 $ (22,455) (a) $ 44,172 Gross Margin 75.6% 7.9% 83.5% 77.3% 7.7% 85.0% Operating expenses: Selling, general and administrative $ 192,925 $ (3,315) (b) $ 189,610 $ 179,257 $ (7,025) (b)(e) $ 172,232 Research and development $ 123,271 $ (127) (c) $ 123,144 $ 100,999 $ (556) (c) $ 100,443 Litigation-related settlement $ (30,000) $ 30,000 (d) $ - $ (30,000) $ 30,000 (d) $ - Loss from operations $ (82,313) $ (4,392) $ (86,705) $ (32,872) $ 3 6 $ (32,836) Net loss $ (99,195) $ (4,392) (f) $ (103,587) $ (49,593) $ 3 6 (f) $ (49,557) Basic and diluted net loss per share $ (2.09) $ (0.09) $ (2.18) $ (1.07) $ 0.00 $ (1.07) (a) Cost of sales adjustments related to the acquisition of Avedro, Inc. (Avedro), including amortization of developed technology intangible assets and stock-based compensation expense related to replacement awards, totaling $22.2 million in 2022 and $22.5 million in 2021. (b) Avedro acquisition-related expenses, including amortization expense of customer relationship intangible assets and stock-based compensation expense related to replacement awards of $3.3 million in 2022 and $4.1 million in 2021. (c) Stock-based compensation expense related to replacement awards from the acquisition of Avedro of $0.1 million in 2022 and $0.6 million in 2021. (d) Settlement proceeds received related to the Company’s patent infringement litigation. (e) Expenses related to the Company's patent infringement litigation and related matters of $2.9 million in 2021. (f) Includes total tax effect for non-GAAP pre-tax adjustments. For non-GAAP adjustments associated with the U.S., the tax effect is $0 given the Company's U.S. taxable loss positions in both 2022 and 2021. Note: Beginning in the second quarter of 2022, we are no longer excluding certain upfront and contingent milestone payments in connection with collaborative and licensing arrangements and certain in-process R&D charges for non-GAAP reporting and disclosure purposes in response to and in accordance with the Securities and Exchange Commission’s latest industry correspondence on this matter. We have conformed all prior period amounts included herein to this new presentation. |
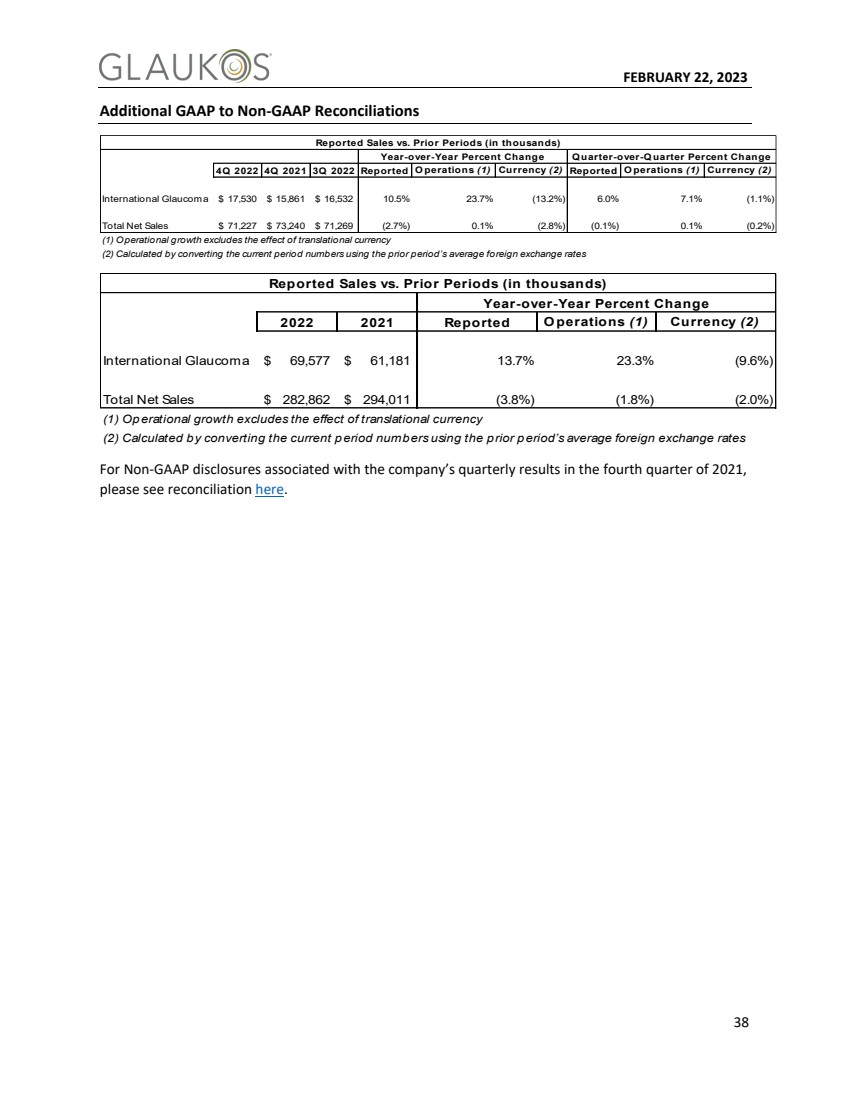
| FEBRUARY 22, 2023 38 Additional GAAP to Non-GAAP Reconciliations 4Q 2022 4Q 2021 3Q 2022 Reported O perations (1) Currency (2) Reported O perations (1) Currency (2) International Glaucoma $ 17,530 $ 15,861 $ 16,532 10.5% 23.7% (13.2%) 6.0% 7.1% (1.1%) Total Net Sales $ 71,227 $ 73,240 $ 71,269 (2.7%) 0.1% (2.8%) (0.1%) 0.1% (0.2%) (1) Operational growth excludes the effect of translational currency (2) Calculated by converting the current period numbers using the prior period’s average foreign exchange rates Year-over-Year Percent Change Q uarter-over-Q uarter Percent Change Reported Sales vs. Prior Periods (in thousands) 2022 2021 Reported O perations (1) Currency (2) International Glaucoma $ 69,577 $ 61,181 13.7% 23.3% (9.6%) Total Net Sales $ 282,862 $ 294,011 (3.8%) (1.8%) (2.0%) (1) Operational growth excludes the effect of translational currency (2) Calculated by converting the current period numbers using the prior period’s average foreign exchange rates Reported Sales vs. Prior Periods (in thousands) Year-over-Year Percent Change For Non-GAAP disclosures associated with the company’s quarterly results in the fourth quarter of 2021, please see reconciliation here. |