附件99.1
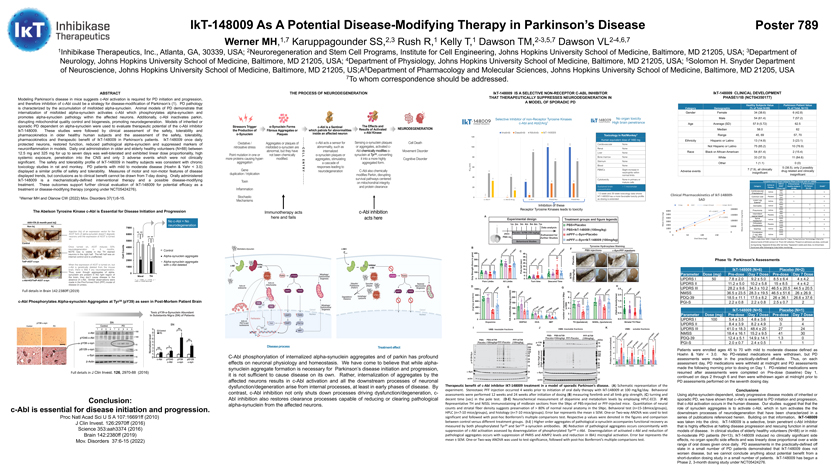
789 Werner MH,1,7 Karuppagounder SS,2,3 Rush R,1 Kelly T,1 Dawson TM,2-3,5,7 Dawson VL2-4,6,71 1抑制酶治疗公司,亚特兰大,GA,30339,美国;2神经再生和干细胞计划,约翰霍普金斯大学医学院细胞工程研究所,巴尔的摩,MD 21205,美国;3美国,约翰霍普金斯大学医学院神经病学系,巴尔的摩,MD 21205;4约翰霍普金斯大学医学院生理系,美国马里兰州巴尔的摩21205;5所罗门·H·斯奈德神经科学系,约翰霍普金斯大学医学院,美国巴尔的摩,马里兰州21205;A6约翰霍普金斯大学医学院药理学和分子科学系,巴尔的摩,MD 21205,美国7函件收件人。摘要帕金森病小鼠模型提示c-Abl的激活是帕金森病发生和发展所必需的,因此抑制c-Abl可能成为帕金森病的疾病修饰策略(1)。帕金森病的病理特征是错误折叠的α-突触核蛋白积聚。帕金森病的动物模型表明,错误折叠的α-突触核蛋白内化激活了c-Abl,c-Abl使α-突触核蛋白磷酸化,促进了受影响神经元内的α-突触核蛋白病理。此外,c-Abl还使Parkin失活,扰乱了线粒体的质量控制和生物发生,促进了神经退化。使用依赖α-突触核蛋白的遗传性或散发性帕金森病模型来评估c-Abl抑制剂IKT-148009的治疗潜力。在这些研究之后,对老年健康受试者的安全性、耐受性和药代动力学进行临床评估,并对安全性、耐受性进行评估。, IKT-148009在帕金森病患者中的药代动力学和疗效。IKT-148009每天一次,在模型中保护神经元,恢复功能,减少病理性α-突触核蛋白,并抑制神经炎症标志物。老年和老年健康志愿者(N=88)每天口服12.5 mg到325 mg之间的药物,最多7天耐受性良好,表现出线性剂量比例,高全身暴露,向中枢系统渗透,只有3个不良事件没有临床意义。IKT-148009在健康受试者中的安全性和耐受性与大鼠和猴子的慢性毒理学研究一致。轻、中度PD患者(Hoehn&Yahr1微摩尔,14浓度,113周和39周的毒理学数据显示。6 0 1Ikt-148009具有更有利的毒性曲线0 c-abl1 c-abl/arg c-Kit PDGFRA PDGFRb随着剂量的延长 抑制这些受体酪氨酸激酶导致毒性6000(Ng)5000 Cmax 4000 3000平均值2000 1000 0 c-Abl抑制剂Ikt-148009在散发性帕金森病模型中治疗的疗效。(A)实验示意图。在伊卡托-148009每日100 mg/kg口服治疗开始前4周开始进行立体定向全氟化铁注射。分别在给药后12周和24周进行行为学评估(B)测定前肢 和所有肢体握力,(C)转身和下降时间(美国证券交易委员会)。(D-E)用高效液相色谱-电子捕获检测器测定多巴胺和代谢水平的神经化学。(F-H)注射PBS或PFF小鼠中脑SNPC切片的代表性TH和Nissl免疫染色。神经计数和纹状体纤维密度的定量表明SNPC保留了>80%的正常神经解剖。行为学测试(n=15-18只/组), 高效液相色谱法(n=7-10只小鼠/组)和组织学(n=7-10只小鼠/组)。误差条代表平均值±扫描电子显微镜。采用单因素方差分析或双因素方差分析进行显着性检验,然后采用Bonferroni后的多重比较检验。图中分别表示了各自的p值以及对照组与不同处理组之间的比较。(i-J))根据磷酸化的Tyr39和Ser129a-突触核蛋白抗体的测定,病理性a-突触核蛋白的高阶聚集伴随着功能恢复。(K)病理性聚集的减少伴随着c-Abl活性的抑制,通过下调磷酸化的Tyr245c-Abl来评估。随着PARIS和AIMP2水平的抑制以及IBA1小胶质细胞激活的减少,活化的c-Abl下调和病理性聚集物减少。误差条代表平均值±扫描电子显微镜。采用单因素方差分析或双因素方差分析进行显著性检验,然后进行后Bonferroni‘s多重比较检验。Ikt-148009临床发展阶段1/1B(NCT04350177)健康受试者评估帕金森患者价值类别人口学(占总数的百分比N=88)(占总数的百分比,N=13)性别女性34(38.6)6(42.8)男性54(61.4)7(57.2)平均年龄(SD)57.9(5.72)62.5中位数58.0 62范围45,69 57,70种族西班牙裔或拉丁裔13(14.8)3(23.1)非西班牙裔或拉丁裔75(85.2)10(76.9)黑人或非裔美国人54(61.4)2(15.4)白人33(37.5)11(84.6)其他1(1.1)0(0)7(7.9),临床均为5(38.5), 在使用IKT-148009活性或SAD的1/1b期试验中,只有2个可能与药物相关且临床意义不大的完整不良事件列表或#个发生事件类别MAD(1)健康受试者PD患者等级(2) 安慰剂(剂量mg)(N=88)(N=14)心血管SAD活性1 1(心悸)(6)(75)MAD普通感冒安慰剂1 0(25)小腿MAD 1 1水肿症(5)(25)MAD 1皮炎活性1(50)MAD 1肺炎活性1(50)间歇性SAD安慰剂11阴道出血(4)(175)脊髓MAD 1活动0头痛(3)(50)直立性MAD 1安慰剂1低血压(100)SAD腹泻活动(325)21便秘MAD 1(活动后1天(100)1天7剂量)(1)SAD=单剂,MAD=每日单剂,连服7天;(2)使用不良事件通用术语标准(CTCAE)5.0版;(3)来自脑脊液收集;(4)在入院时出现在服药前,在服药过程中继续;(5)出现在最后一次服药后28天;(6)出现在服药后2周, 即使经过3天的动态心电图监测,也没有发现临床依据。帕金森病1b期评估IKT-148009(N=6)安慰剂(N=2)参数剂量(Mg)剂量前第7天剂量前第7天剂量UPDRS I 50 7.8±2.0 9.2±5.0 8.5±6.4 4±4.2 UPDRS II 11.2±5.0 10.2±5.8 15±8.5 4±4.2 UPDRS III 28.2±9.6 34.3±10.2 46.5±20.5 44.5±20.5 NMSS36.5±23.5 28.3±19.5 46.5±51.6 26±26.9 PDQ-39 18.5±11.1 17.5±8.2 26±36.1 26.6±37.6 PGI-S 2.2±0.8 2.2±0.8 2.5±0.7 2IKT-148009(N=5)安慰剂(N=1)参数剂量(Mg)剂量前7天剂量前7剂剂量前7剂UPDR I 100 5.4±3.54.8±3.6 109 UPDRS II 8.4±3.9 8.2±4.9 3 4 UPDRS III 41.0±18.3 48.4±20 27 24 NMS 18.4±16.1 15.2±9.5 41 30 PDQ-39 12.4±5.1 14.9±14.1 1.3 0 PGI-S 2.0±0.7±2.4±0.5 1例年龄在45岁至70岁之间的患者,定义为Hoehn&Yahr