
2022年第二季度财务结果和公司更新2022年8月8日附件99.2

本演示文稿包含经修订的1995年《私人证券诉讼改革法案》所定义的前瞻性陈述,包括但不限于以下陈述:我们与新冠肺炎疫苗销售相关的预期收入和净利润,在获得完全或有条件营销授权的情况下,被批准在我们合作伙伴控制的地区使用,特别是那些根据我们合作伙伴提供的初步估计得出的数字;我们在向各国政府首次销售新冠肺炎疫苗后,与政府当局、私人健康保险公司和其他第三方付款人进行的定价和承保范围谈判;未来对新冠肺炎疫苗初始剂量或增强剂量的商业需求和医疗需求;来自其他新冠肺炎疫苗的竞争或与我们其他候选产品有关的竞争,包括那些具有不同作用机制和不同制造和分销限制的产品,其基础是疗效、成本、储存和分销的便利性、批准的用途范围、副作用概况和免疫反应的持久性;我们的新冠肺炎疫苗以及如果获得批准的研究药物被市场接受的速度和程度;我们研究和开发计划的启动、时间、进度、结果和成本,包括与新冠肺炎疫苗的其他配方有关的计划,以及我们当前和未来的临床前研究和临床试验,包括关于研究或试验和相关准备工作开始和完成时间的声明, 试验结果公布的期间以及我们的研发计划;我们获得和维持对我们的候选产品进行监管批准的时间和能力;BNT162b2预防由新出现的病毒变异引起的新冠肺炎的能力;我们和我们的交易对手管理和采购必要的能源资源的能力;我们发现研究机会和发现和开发研究药物的能力;我们的第三方合作者继续进行与我们的开发候选药物和研究药物相关的研发活动的能力和意愿;新冠肺炎大流行对我们的发展计划、供应链、合作者和财务业绩的影响;由于使用我们的新冠肺炎疫苗和其他由我们开发或制造的产品和候选产品而导致的不可预见的安全问题和索赔;我们推进疟疾、结核病和艾滋病毒计划的能力,包括为这些计划选择临床候选人的时间和临床试验的开始时间,以及任何数据读数;世界卫生组织、欧盟委员会和其他组织支持的性质和持续时间,以及建立基础设施的情况;在非洲大陆(包括我们的BioNTainers)开发可持续的疫苗生产和供应解决方案的情况,以及这些解决方案的性质和可行性;我们对研发收入、商业收入、销售成本、研发费用、销售和营销费用、一般和行政费用、资本支出、所得税、流通股的估计;如果获得批准,我们和我们的合作伙伴将我们的候选产品商业化和营销的能力, 包括我们的新冠肺炎疫苗;我们管理我们开发和扩张的能力;美国和外国的监管发展;我们有效地扩大我们的生产能力和生产产品的能力,包括我们的新冠肺炎疫苗的目标生产水平和候选产品;以及其他我们目前未知的因素。在某些情况下,前瞻性表述可以通过“将”、“可能”、“应该”、“预期”、“打算”、“计划”、“目标”、“预期”、“相信”、“估计”、“预测”、“潜在”、“继续”或这些术语的否定或其他类似术语来识别,尽管并不是所有的前瞻性表述都包含这些词语。本演示文稿中的前瞻性陈述既不是承诺,也不是保证,您不应过度依赖这些前瞻性陈述,因为它们涉及已知和未知的风险、不确定性和其他因素,其中许多因素不在BioNTech的控制范围之内,可能导致实际结果与这些前瞻性陈述中明示或暗示的结果大不相同。你应该在我们截至2022年6月30日的三个月的季度报告中以及在生物技术公司提交给美国证券交易委员会的后续文件中(这些文件可在美国证券交易委员会的网站https://www.sec.gov/.上获得)中审查在“风险因素”标题下描述的风险和不确定因素除法律另有规定外,在出现新信息、未来发展或其他情况时,BioNTech对更新或修改本演示文稿中包含的任何前瞻性陈述不承担任何意图或责任。这些前瞻性陈述是基于BioNTech目前的预期,仅代表截至本文发布之日的情况。本幻灯片演示文稿包括前瞻性陈述2

COMIRATY®▼(辉瑞-生物科技新冠肺炎疫苗)已获得欧盟委员会的有条件营销授权,可以预防5岁以下人群的冠状病毒病2019年(新冠肺炎)。该疫苗以两剂为一系列,间隔3周接种。此外,CMA已扩大到包括18岁及以上个人在第二次接种后至少6个月的加强剂量(第三次接种)。对于免疫功能低下的人,第三次接种可能在第二次接种后至少28天给予。欧洲药品管理局的人类药物委员会已经完成了对COMIRATY®的严格评估,一致认为关于疫苗质量、安全性和有效性的足够有力的数据现在已经可用。重要安全信息:·已报告过敏反应事件。在接种疫苗后出现过敏反应的情况下,应随时提供适当的治疗和监督。·在接种Comirnaty疫苗后观察到非常罕见的心肌炎和心包炎病例。这些病例主要发生在接种疫苗后14天内,更多发生在第二次接种之后,更多发生在年轻男子身上。现有数据表明,接种疫苗后的心肌炎和心包炎的病程与一般的心肌炎或心包炎没有什么不同。·与焦虑有关的反应,包括血管迷走神经反应(晕厥)、过度换气或与压力有关的反应(如头晕、心悸、心率加快、血压改变, 刺痛感和出汗)可能与接种过程本身有关。与压力相关的反应是暂时的,并自行解决。应建议个人将症状提请疫苗接种提供者进行评估。重要的是要采取预防措施,避免因晕倒而受伤。·疫苗的有效性、安全性和免疫原性尚未在包括接受免疫抑制治疗在内的免疫功能受损的个人身上进行评估。在免疫抑制的个体中,COMIRATY®的疗效可能较低。·与任何疫苗一样,使用COMIRATY®接种疫苗可能不会保护所有疫苗接受者。个人可能要在第二次接种疫苗后7天才能获得完全保护。·在临床研究中,16岁及以上参与者的不良反应为注射部位疼痛(>80%)、疲劳(>60%)、头痛(>50%)、肌肉疼痛和寒战(>30%)、关节痛(>20%)、发热和注射部位肿胀(>10%),通常是轻度或中度,并在接种疫苗后几天内消失。较低的反应性事件发生频率与较大的年龄相关。·COMIRATY®在5至15岁参与者中的总体安全概况与16岁及以上参与者中看到的相似。·5至11岁儿童最常见的不良反应是注射部位疼痛(>80%)、疲劳(>50%)、头痛(>30%)、注射部位红肿(>20%)、肌肉疼痛和寒战(>10%)。·12至15岁的临床试验参与者最常见的不良反应是注射部位疼痛(>90%)、疲劳和头痛(>70%)、肌肉痛和寒战(>40%), 关节痛、发热(>20%)。·在孕妇中使用COMIRATY®的经验有限。只有在对母亲和胎儿的潜在益处超过任何潜在风险的情况下,才应考虑在怀孕期间使用COMIRNatY®。·尚不清楚COMIRATY®是否会从母乳中排泄出来。·尚未研究与其他医药产品的相互作用或与其他疫苗同时使用COMIRATY®的情况。·有关COMIRATY®安全性的完整信息,请始终参考EMA网站上以欧盟所有语言提供的经批准的产品特性摘要和包装传单。黑色等边三角形▼表示需要额外监测以捕获任何不良反应。这将允许快速识别新的安全信息。个人可以通过报告他们可能获得的任何副作用来提供帮助。副作用可以报告给EudraVigilance,或通过电子邮件Medinfo@biontech.de、电话+49 6131 9084 0或通过网站www.biontech.de安全信息3直接向BioNTech报告。

安全信息授权在美国使用·新冠肺炎疫苗是美国食品和药物管理局批准的新冠肺炎疫苗,用于主动免疫,以预防由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的12岁及12岁以上个人患上2019年冠状病毒病(新冠肺炎)。根据欧盟法案,它还被授权向6个月至4岁的个人提供3剂初级系列,向5岁及5岁以上的个人提供2剂初级系列,向已被确定患有某种免疫损害的5岁及5岁以上的个人提供第三次初级系列剂量,向5岁至11岁及以上已完成辉瑞-生物科技新冠肺炎疫苗或COMIRNAY®初级系列接种的个人提供单剂加强剂,向12岁及12岁以上的具有某些免疫损害的个人提供第三次初级系列剂量。为12岁及以上完成辉瑞-生物科技新冠肺炎疫苗或COMIRATY®初级系列接种的个人提供第一剂加强疫苗,为18岁及以上使用不同授权新冠肺炎疫苗完成初步接种的个人提供第一剂加强剂, 第二次加强接种对象为50岁及以上已接种任何授权新冠肺炎疫苗第一剂加强接种的个人;第二次加强接种对象为12岁及以上已确定患有某些免疫损害并已接种第一剂授权新冠肺炎疫苗的个人。加强剂时间表基于用于初级系列的疫苗的标签信息。重要安全信息个人不应接种以下情况:·在前一剂疫苗后出现严重过敏反应·对该疫苗的任何成分有严重过敏反应个人应将其所有医疗状况告知疫苗接种提供者,包括如果他们:·有任何过敏·有心肌炎(心肌炎症)或心包炎(心脏外膜炎症)·发烧·有出血障碍或正在服用血液稀释剂·免疫功能受损或正在服用影响免疫系统的药物·怀孕,计划怀孕,或者正在哺乳·接种了另一种新冠肺炎疫苗·曾因注射而晕倒疫苗可能并不能保护所有人。据报道,疫苗的副作用包括:·疫苗引起严重过敏反应的可能性很小,严重过敏反应通常在接种疫苗后几分钟至1小时内发生。因此,疫苗接种提供者可能会要求个人在接种疫苗后留在接种疫苗的地方进行监测。严重过敏反应的迹象可能包括呼吸困难、面部和喉咙肿胀、心跳加快、全身出现严重皮疹、头晕和虚弱。, 他们应该拨打911或去最近的医院4

·一些接种疫苗的人发生心肌炎(心肌炎)和心包炎(心脏外衬里的炎症),40岁以下的男性比女性和老年男性更常见。在这些人中,大多数人在接种第二剂疫苗后几天内开始出现症状。发生这种情况的可能性非常低。个别人士在接种疫苗后如有下列任何病征,应立即求医:o胸痛o呼吸急促o感觉心跳急促、扑腾, O严重的过敏反应;非严重的过敏反应,如注射部位疼痛;疲倦;头痛;肌肉疼痛;寒战;关节疼痛;发烧;注射部位肿胀;注射部位发红;恶心;感觉不适;淋巴结肿大(淋巴结病);食欲减退;腹泻;呕吐;手臂疼痛;以及与注射疫苗相关的晕厥·这些可能不是疫苗接种的全部副作用。可能会出现严重的、意想不到的副作用。疫苗可能的副作用仍在临床试验中研究。致电疫苗接种提供商或医疗保健提供商,了解令人烦恼的副作用或副作用不会消失,因为其他疫苗尚未提交给FDA,因此有关接种该疫苗的数据尚未提交给FDA。考虑与其他疫苗一起接种这种疫苗的个人应该与他们的医疗保健提供者讨论他们的选择。患者应该总是向他们的医疗保健提供者寻求关于不良事件的医疗建议。鼓励个人向美国食品和药物管理局(FDA)和疾病控制和预防中心(CDC)报告疫苗的负面副作用。请访问https://www.vaers.hhs.gov或致电1-800-822-7967。此外,副作用可报告给辉瑞公司,网址为www.pfizerSafetyreport。或致电1-800-438-1985。5安全资讯

公司展望Ryan Richardson,首席战略官Jens Holstein财务业绩,CFO管道更新Özlem Türeci,CMO 2022年第二季度亮点Ugur Sahin,CEO 6
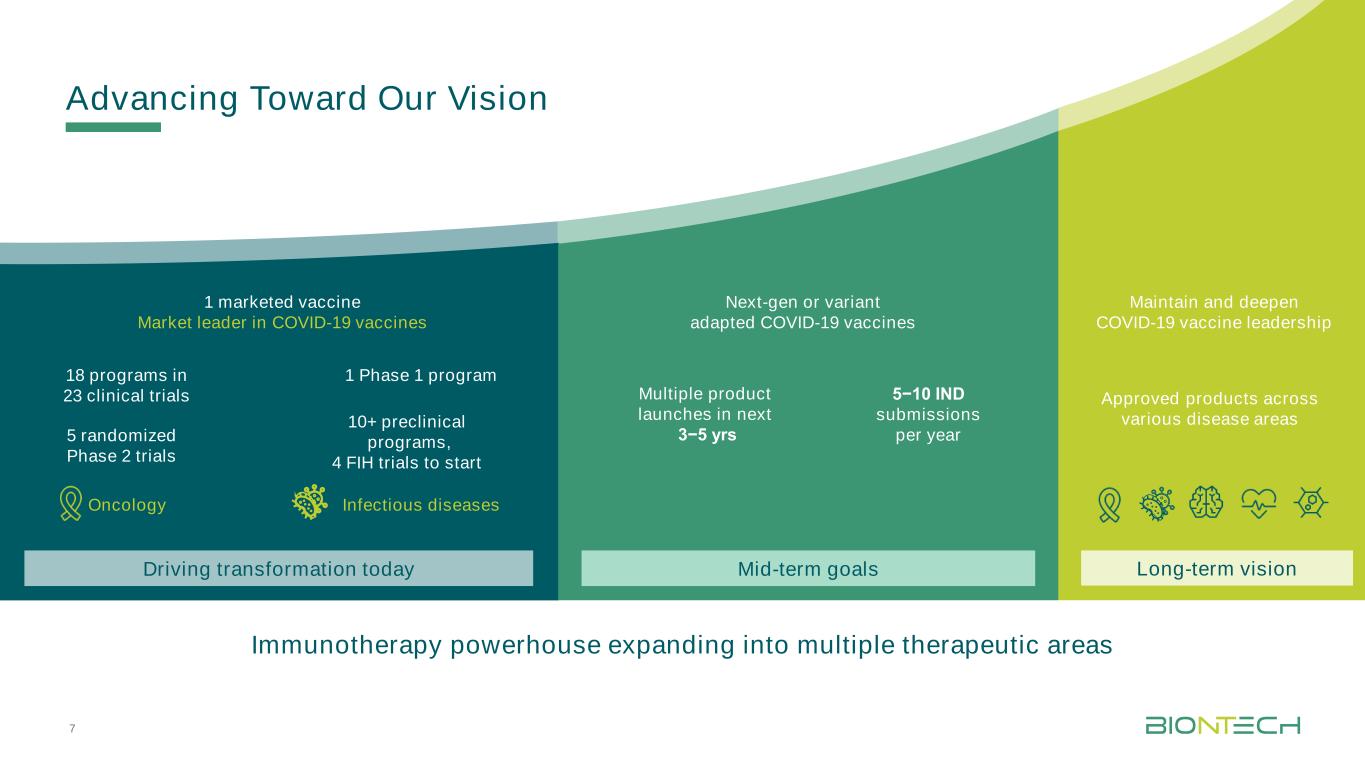
迈向我们的愿景肿瘤学传染病5随机第二阶段试验1上市疫苗市场领先者新冠肺炎疫苗10+临床前计划,4项FIH试验将启动1阶段1计划23项临床试验中的18项计划保持并深化新冠肺炎疫苗的领先地位未来3−5年中期目标推动转型今天推动转型长期愿景5−每年10次提交新一代或变种新冠肺炎疫苗批准的产品跨不同疾病领域免疫治疗强者扩展到多个治疗领域7

第二季度的亮点:企业和肿瘤学流水线·报告的第二季度总收入为3.2BN1欧元,今年迄今的收入为9.6BN1欧元·开始在非洲建设第一个BioNTainer mRNA疫苗制造设施·与Genmab签署新的等额成本/利润合作协议,共同开发针对CD27的抗体·BNT122(INeST):胰腺癌切除患者的第一阶段试验的阳性数据显示良好的安全性和令人鼓舞的临床活动迹象2·BNT116(FixVac):晚期NSCLC的FPD处于第一阶段试验·BNT142(Ribomab):FPD处于第一阶段试验在CLDN6阳性实体肿瘤·BNT211(CLDN6 CAR-T细胞疗法):用于第三或更晚一线治疗睾丸癌的EMA优先药物(PRIME)公司更新肿瘤学:Produced Advantage 1 BioNTech的利润份额是根据辉瑞公司和BioNTech公司共享的初步数据估计的,在截至12月31日的Form 20-F年度报告中进一步描述,2021年以及截至2022年6月30日的三个月和六个月的季度报告,作为BioNTech于2022年8月8日提交的当前Form 6-K报告的证物。协作合作伙伴毛利润的估计份额的任何变化都将被前瞻性地确认。2调查员发起的试验8

第二季度亮点:新冠肺炎疫苗/COMIRNAY·FDA批准EUA用于6个月至4岁儿童的初级系列,并用于5至11岁儿童的加强剂量,儿科标签现在包括1:·6个月。至
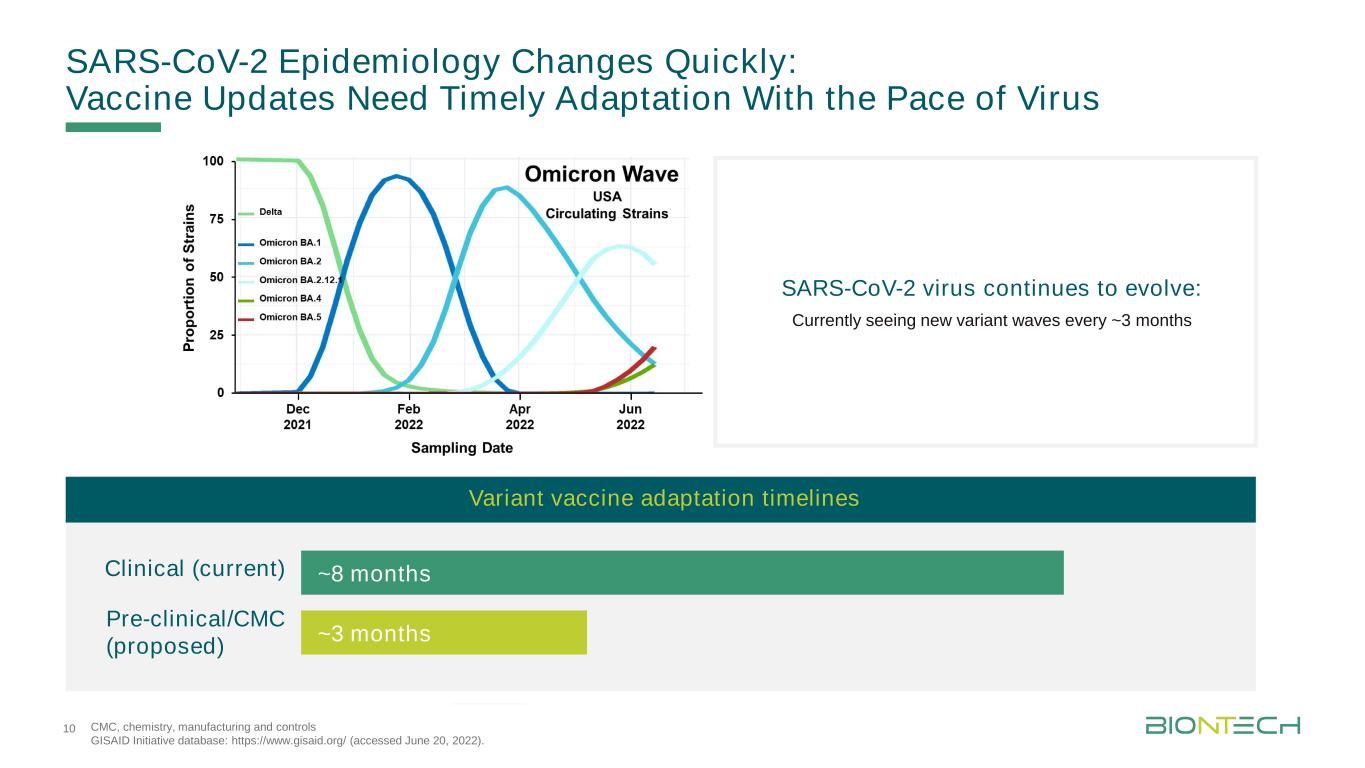
SARS-CoV-2流行病学变化迅速:疫苗更新需要及时适应病毒CMC、化学、制造和控制的步伐。GISAID倡议数据库:https://www.gisaid.org/(2022年6月20日访问)。~8个月~3个月临床(当前)临床前/CMC(建议)变异疫苗适应时间表SARS-CoV-2病毒继续演变:目前每~3个月出现新的变异浪潮10

FDA、EMA和其他监管机构建议在全球范围内为BA.1和BA.4/5适应二价疫苗提交正在进行的奥密克戎适应二价疫苗提交·FDA:为编码奥密克戎BA.4/5刺突蛋白的二价疫苗提供指导·EMA:奥密克戎BA.1适应二价疫苗提交最终完成;准备提交奥密克戎BA.4/5二价疫苗的临床前和CMC数据包为2022年10月初推出奥密克戎二价疫苗做准备CMC、化学、制造和控制第一批发货量预计最早将于10月获得监管部门的批准计划启动·奥密克戎BA.4/5二价疫苗的临床试验预计将于8月启动·BA.1-和BA.4/5-二价疫苗生产已启动·计划在秋季助推活动之前及时供应这两种疫苗监管参与临床开发生产规模扩大11

公司展望首席战略官Ryan Richardson 04 03财务业绩Jens Holstein,CFO管道更新Özlem Türeci,CMO 01 2022年第二季度亮点Ugur Sahin,CEO 12
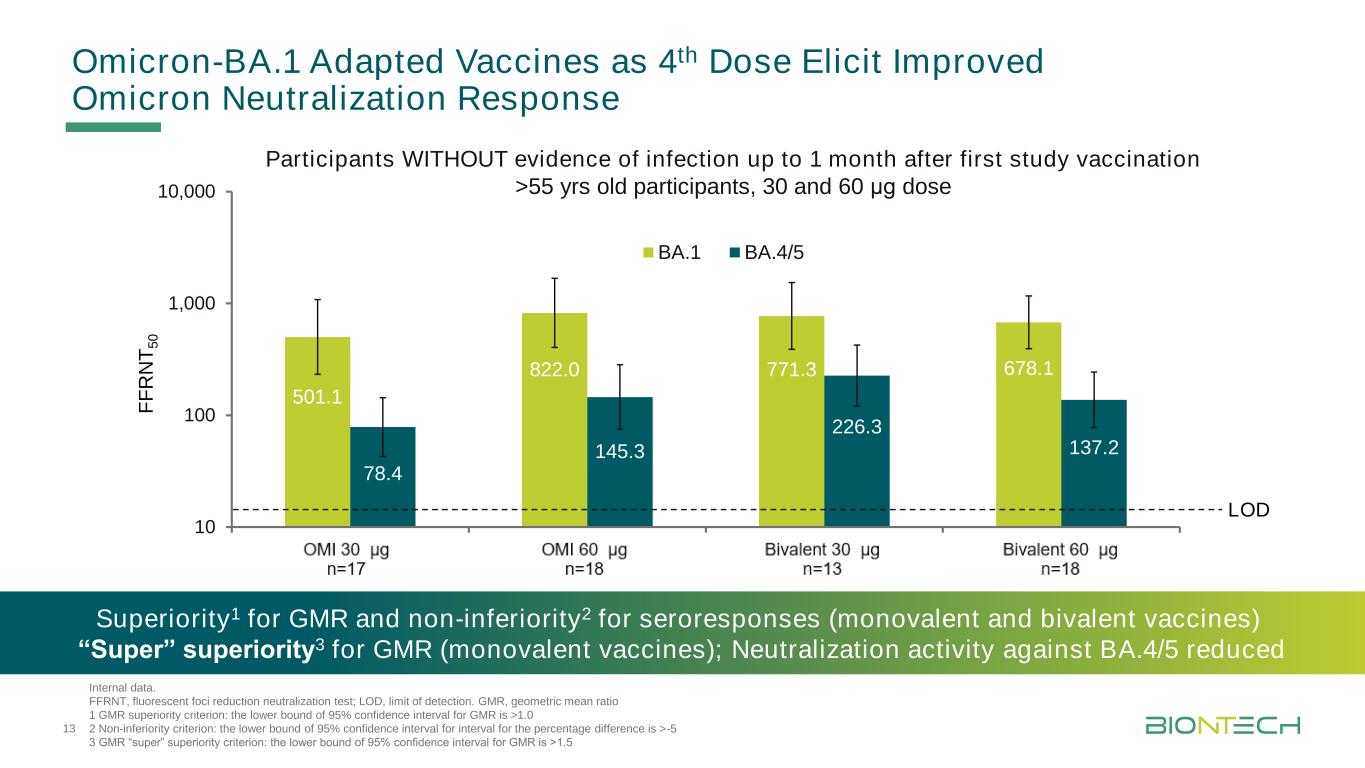
F F R N T 5 0 501.1 822.0 771.3 678.1 78.4 145.3 226.3 137.2 10 100 1,000,000 OMI 30μg…Omi 60μg…二价30μg…二价60μg…BA.1 BA.4/5 LOD奥密克戎-BA.1适应疫苗第4剂诱导改善奥密克戎中和反应内部数据。FRNT,荧光减灶中和试验;LOD,检出限。GMR,几何平均比率1 GMR优势标准:GMR的95%可信区间下限>1.0 2非劣势标准:百分比差异区间的95%可信区间下限>-5 3 GMR“超级”优势标准:首次研究接种后1个月内无感染证据的GMR的95%可信区间下限>1.5>55岁的参与者,30和60μg剂量13优势1,血清应答(单价和双价疫苗)“超”优势2 GMR(单价和双价疫苗)“超级”优势3
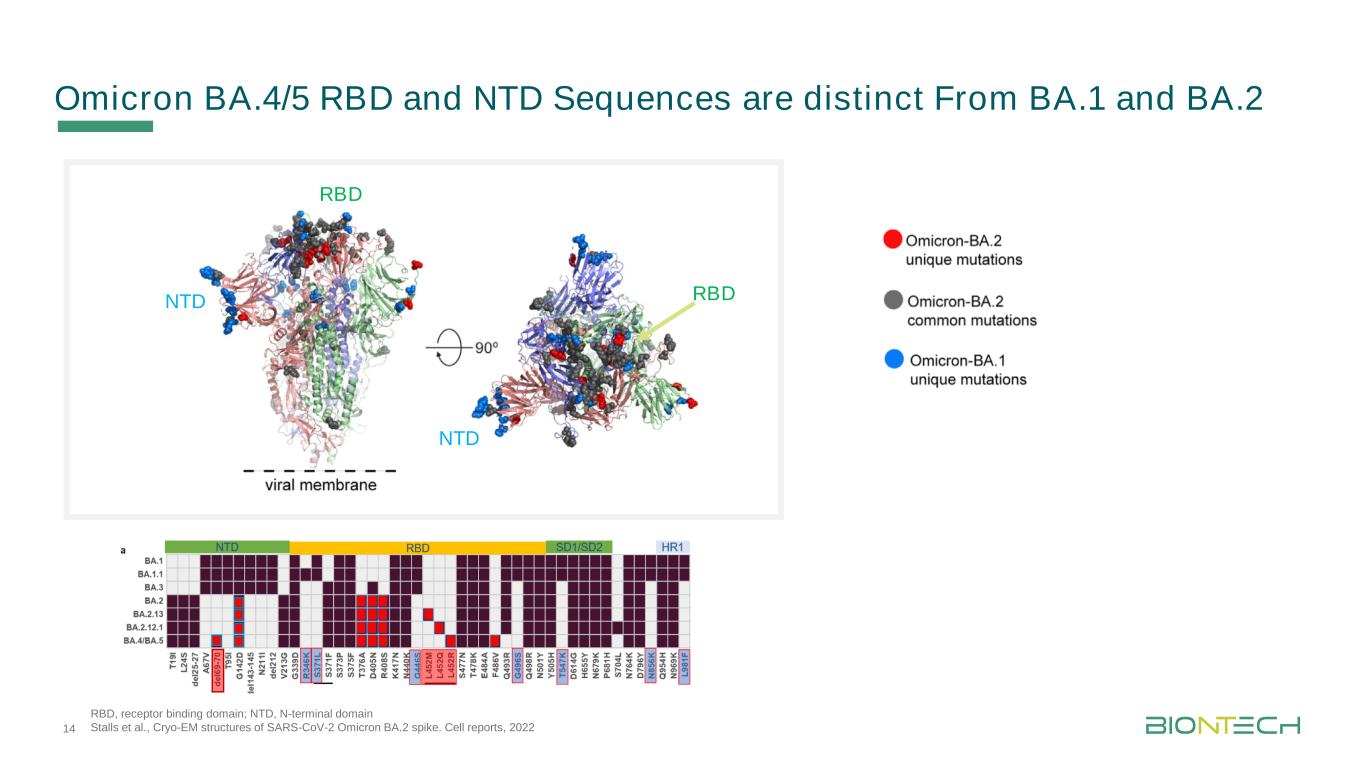
NTD RBDNTD RBD奥密克戎BA.4/5 RBD和NTD序列不同于BA.1和BA.2的14个RBD受体结合域,NTD,N-末端结构域STALS等,以及SARS-CoV-2奥密克戎BA.2棘突的冷冻-EM结构。《2022年细胞报告》
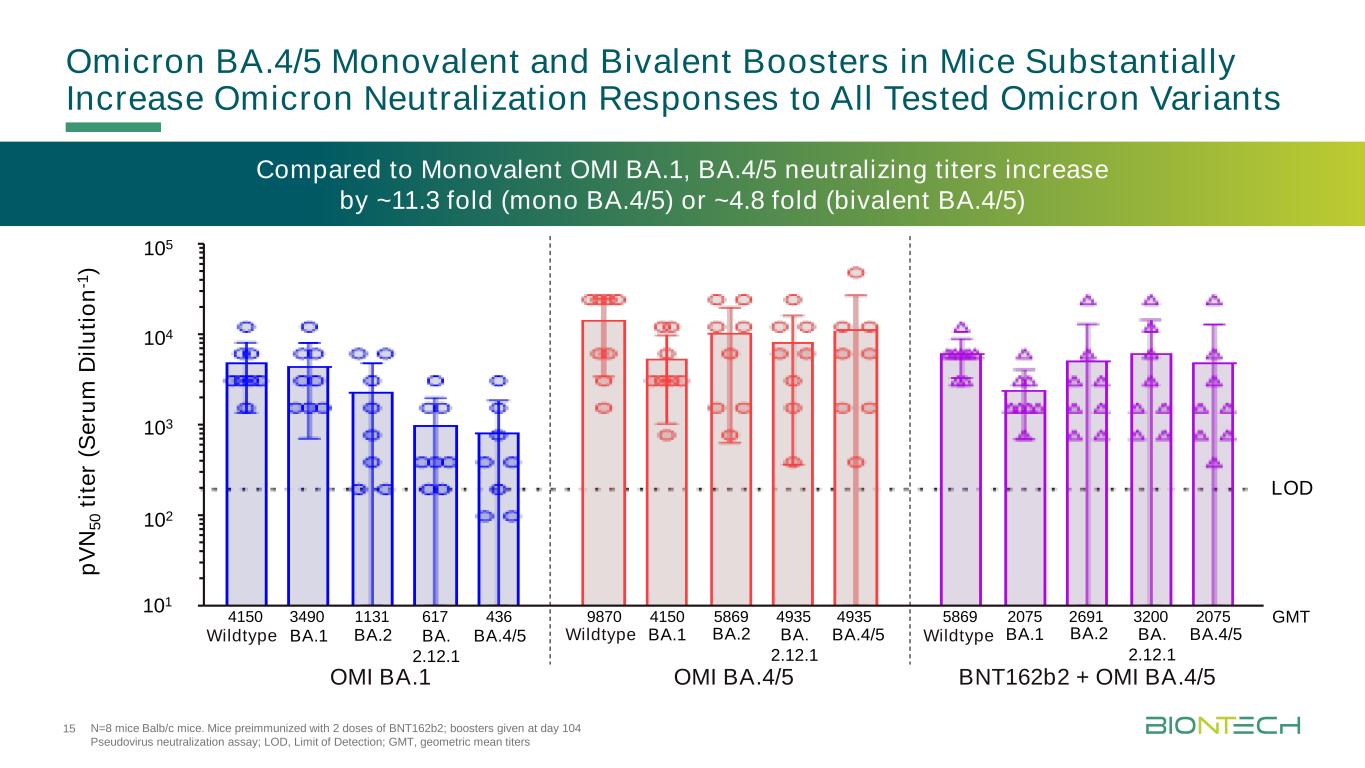
与单价OMI BA.1相比,BA.4/5中和效价增加了~11.3倍(单价BA.4/5)或~4.8倍(二价BA.4/5)OMI BA.1 OMI BA.1 OMI BA.4/5 BNT162b2+OMI BA.4/5 101 102 103 105 p V N 5 0 te r(S e ru m D il u ti o n-1)武汉BA.1 BA.2 BA。2.12.1BA.4/5 LOD 4150 436 9870 4935 5869 2075GMT3490 4150 20751131 617 5869 4935 2691 3200 N=8只Balb/c小鼠。用2剂BNT162b2预免疫小鼠;第104天给予加强免疫;假病毒中和试验;LOD,检测限;GMT,武汉BA.1 BA2 BA几何平均滴度。2.12.1 BA.4/5武汉BA.1 BA.2 BA2.12.1BA.4/5野生型野生型15

寻求多种新的新冠肺炎疫苗方法,提供持久和高水平的保护,对抗不断演变的变种T细胞增强型疫苗候选设计,旨在刺激和增强T细胞免疫泛SARS-CoV-2疫苗候选潜力更大,更持久的保护以管理未来令人担忧的变异临床试验开始预计2022年下半年:下一代疫苗接近为优化免疫原性而设计的下一代SARS-CoV-2尖峰抗原·提高预输血稳定性·暴露更多中和敏感表位BNT162b5:二价疫苗候选增强的SARS-CoV-2祖先株和奥密克戎BA2亚型第二阶段:7月份的FPD长期战略包括多管齐下设计和测试多种结构,目的是接触免疫系统的不同部分,包括抗体和T细胞-概念验证试验预计2H 2022年16

SMIM,小分子免疫调节剂。1名研究人员发起的第1阶段试验;2名与Genentech合作;3名与赛诺菲合作;4名与Genmab合作。肿瘤方面的重大进展和扩展2022药物类别平台候选产品适应症(目标)临床前1期2期3期里程碑mRNA修复Vac BNT111晚期和R/R黑色素瘤BNT112前列腺癌BNT113 HPV16+头颈癌BNT1151卵巢癌BNT116 NSCLC FPD 2022年7月iNeST Autogene cevumeran(BNT122)2 1L黑色素瘤数据更新:1H 2023辅助直肠癌实体瘤辅助胰腺导管腺癌1(BNT131)3实体瘤(IL-12sc,IL15-sushi,GM-CSF,GM-CSF)2022年1月的FPD BNT142多实体肿瘤(CD3×CLDN6)2022年7月的FPD核细胞因子BNT151多实体肿瘤(优化的IL-2)BNT152,BNT153多实体肿瘤(IL-7,IL-2)细胞治疗CAR T细胞+CARVac BNT211多实体肿瘤(CLDN6)数据更新:2H 2022 BNT212胰腺,α其他肿瘤(CLDN18.2)基于新抗原的T细胞BNT221(NEO-PTC-01)多实体肿瘤TCR工程T细胞将被选为所有肿瘤抗体下一代免疫检查点调节剂GEN1046(BNT311)4转移性非小细胞肺癌(PD-L1×4-1BB)多实体肿瘤(PD-L1×4-1BB)GEN1042(BNT312)4多实体肿瘤(CD40×4-1BB)GEN1053(BNT313)4恶性实体肿瘤(CD27)启动阶段:2H 2022靶向肿瘤抗体BNT321(MVT-5873)胰腺癌(SLEA)SMTL样受体结合BNT411实体瘤(TLR7)✓✓17✓
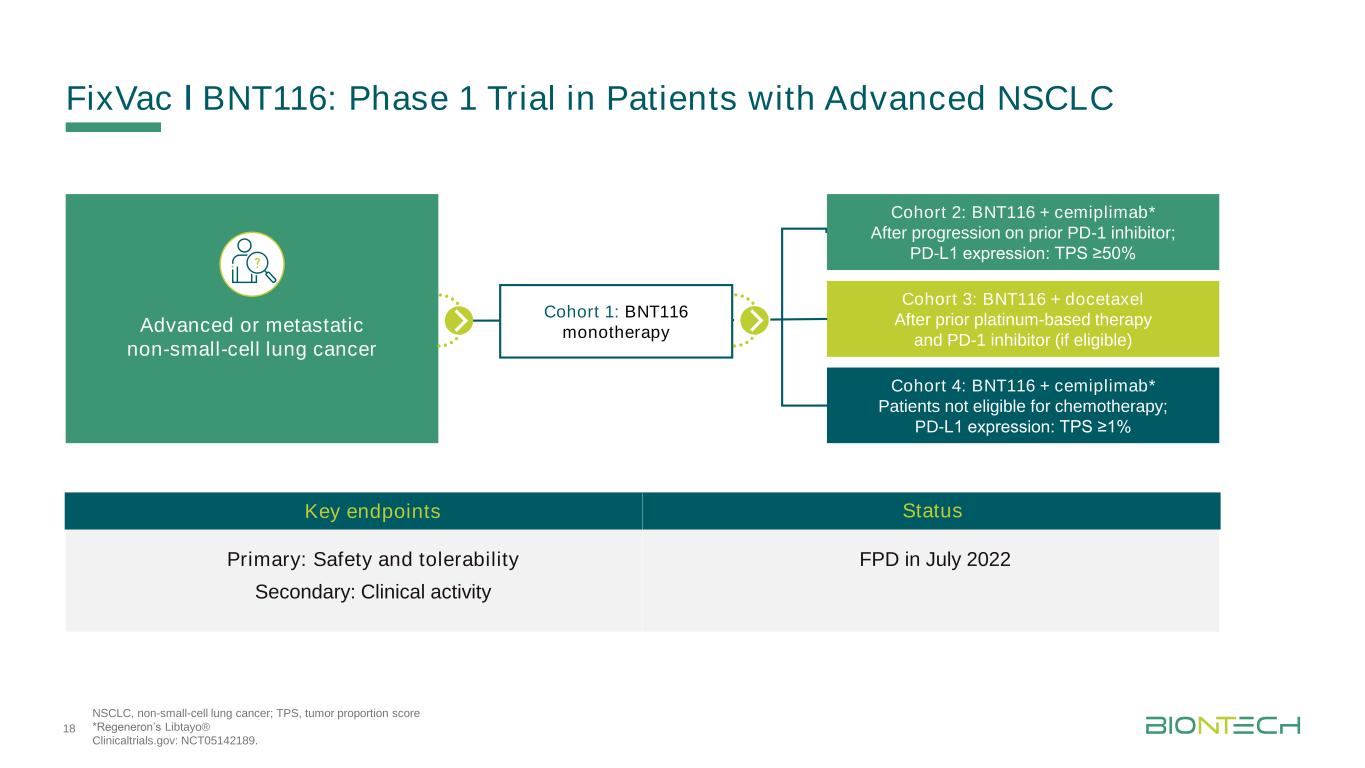
修复Vac非小细胞肺癌BNT116:晚期非小细胞肺癌患者的1期试验;TPS,肿瘤比例评分*Regeneron的Libtayo®ǀ临床试验。2022年7月晚期或转移性非小细胞肺癌:安全性和耐受性继发:临床活动队列2:BNT116+西米普利单抗*在使用PD-1抑制剂后进展;PD-L1表达:Tps≥50%队列4:BNT116+西米普单抗*不符合化疗条件的患者;PD-L1表达:Tps≥1%队列1:BNT116单一治疗队列3:BNT116+多西紫杉醇在之前基于铂的治疗和PD-1抑制剂(如果符合条件)后
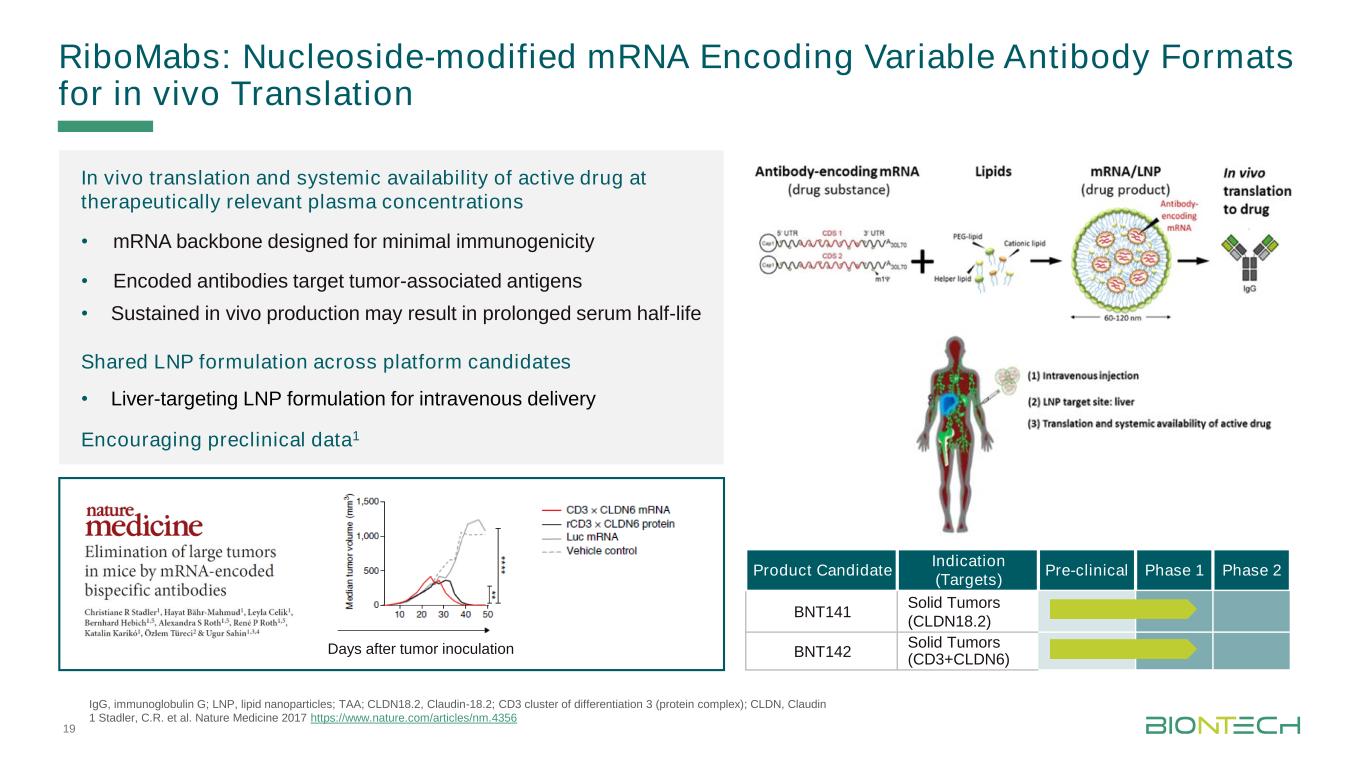
Ticelmaster Format Durch Klken BearbeitenRiboMabs:核苷修饰的mRNA编码可变抗体格式在体内翻译和有效药物在治疗相关血浆浓度的系统可利用性·为最低免疫原性设计的mRNA主干·编码的抗体针对肿瘤相关抗原·体内持续生产可能导致延长血清半衰期共享跨平台候选LNP配方·肝脏靶向LNP配方用于静脉注射鼓励临床前数据1免疫球蛋白G;LNP,脂质纳米颗粒;TAA;CLDN18.2,Claudin-18.2;CD3分化簇3(蛋白质复合体);CLDN,Claudin 1 Stadler,C.R.等人。自然医学2017年https://www.nature.com/articles/nm.4356产品候选适应症(目标)临床前1期2 BNT141实体瘤(CLDN18.2)BNT142实体瘤(CD3+CLDN6)肿瘤接种后19天
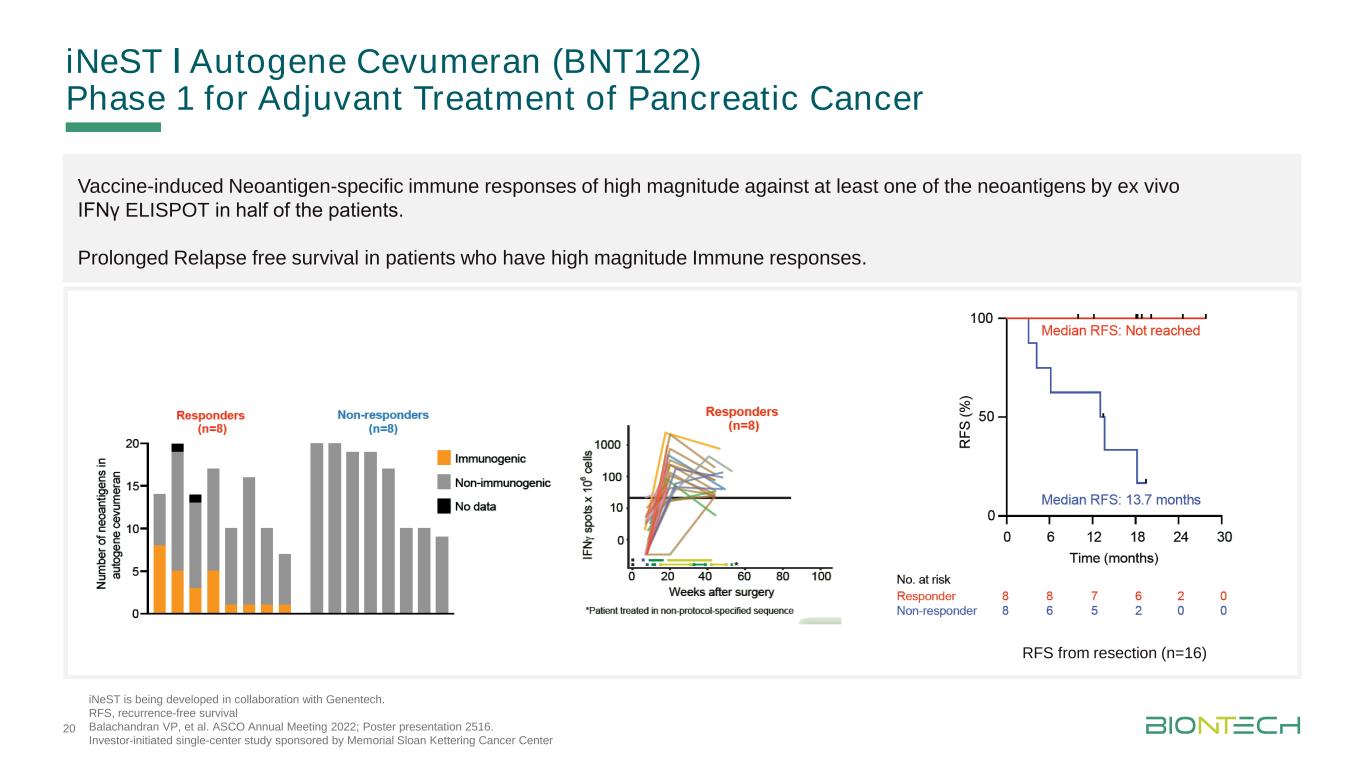
INeSTǀ自体基因Cevumeran(BNT122)用于胰腺癌辅助治疗的第一阶段正在与基因技术公司合作开发。RFS,无复发生存期,Balachandran VP,等。2022年ASCO年会;海报展示2516。投资者发起的单中心研究,由纪念斯隆-凯特琳癌症中心切除(n=16)疫苗通过体外干扰素γELISPOT在半数患者体内诱导针对至少一种新抗原的高强度的新抗原特异性免疫反应。免疫反应强度高的患者的无复发生存期延长。20个
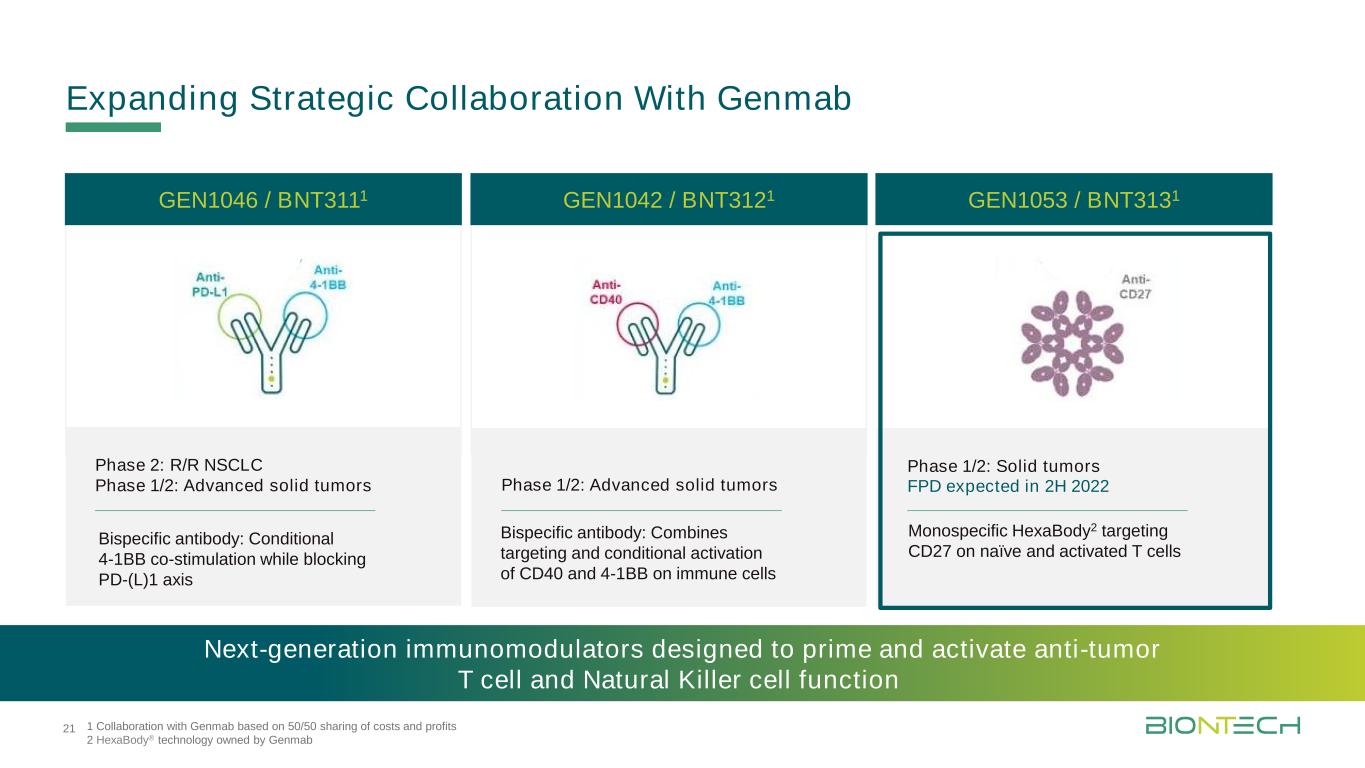
扩大与Genmab的战略合作1在成本和利润各占一半的基础上与Genmab合作2由Genmab下一代免疫调节剂拥有的HexaBody®技术旨在启动和激活抗肿瘤T细胞和自然杀伤细胞功能1/2阶段:晚期实体肿瘤GEN1042/BNT3121阶段2:R/R非小细胞肺癌阶段1/2:晚期实体肿瘤GEN1046/BNT3111阶段1/2:实体肿瘤FPD预计在2022年下半年GEN1053/BNT3131双特异性抗体:有条件的4-1BB共刺激同时阻断PD-(L)1双特异性抗体:结合靶向和有条件激活CD40和4-双特异性抗体针对幼稚和活化T细胞21上的CD27的免疫细胞上的单特异性HexaBody2

公司展望首席战略官Ryan Richardson 04财务业绩Jens Holstein,CFO 02管道更新Özlem Türeci,CMO 01 2022年第二季度亮点Ugur Sahin,CEO 22
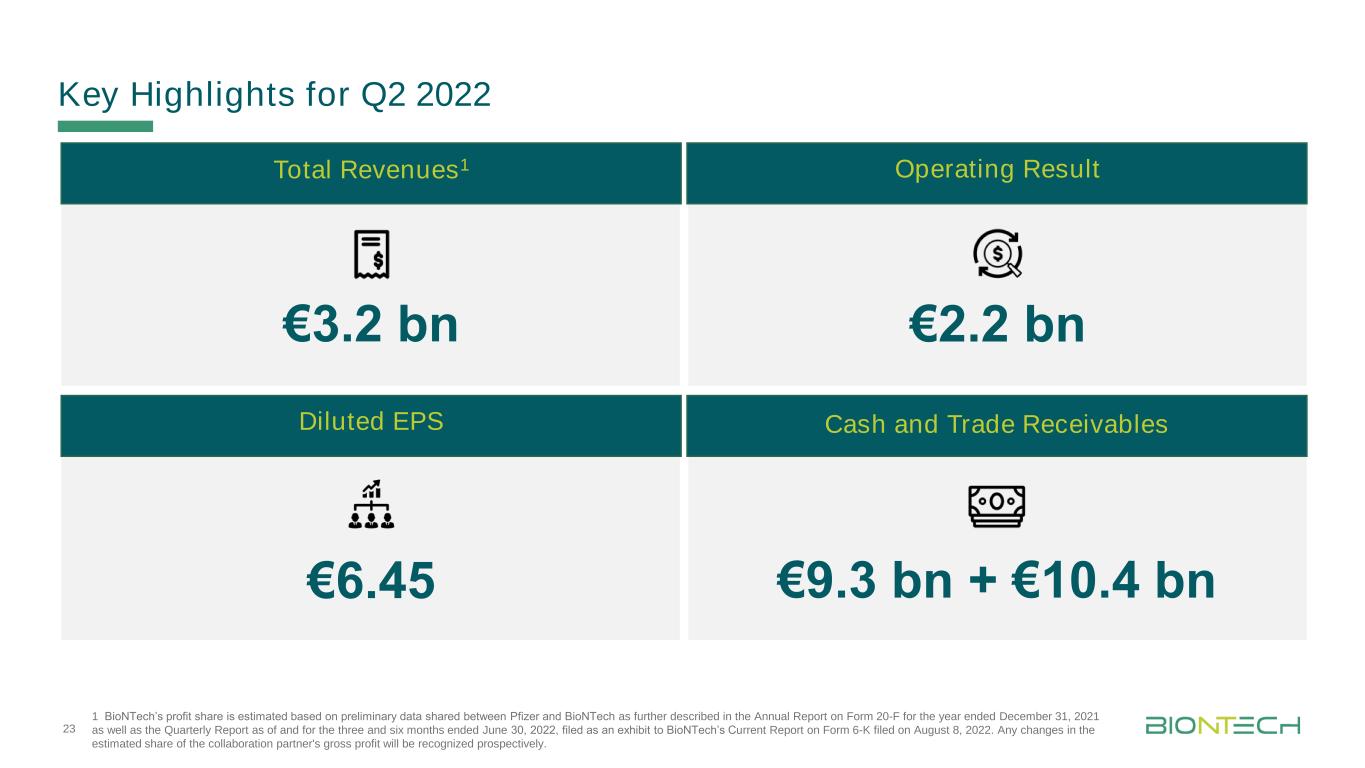
欧元32亿欧元22亿欧元93亿欧元+104亿欧元1 BioNTech的利润份额是根据辉瑞和BioNTech共享的初步数据估计的,具体描述见截至2021年12月31日的Form 20-F年度报告以及截至2022年6月30日的三个月和六个月的季度报告,这些报告作为BioNTech于2022年8月8日提交的当前Form 6-K报告的证物。协作合作伙伴毛利润的估计份额的任何变化都将被前瞻性地确认。2022年第二季度总收入1营业业绩摊薄每股现金和应收贸易账款6.45欧元23
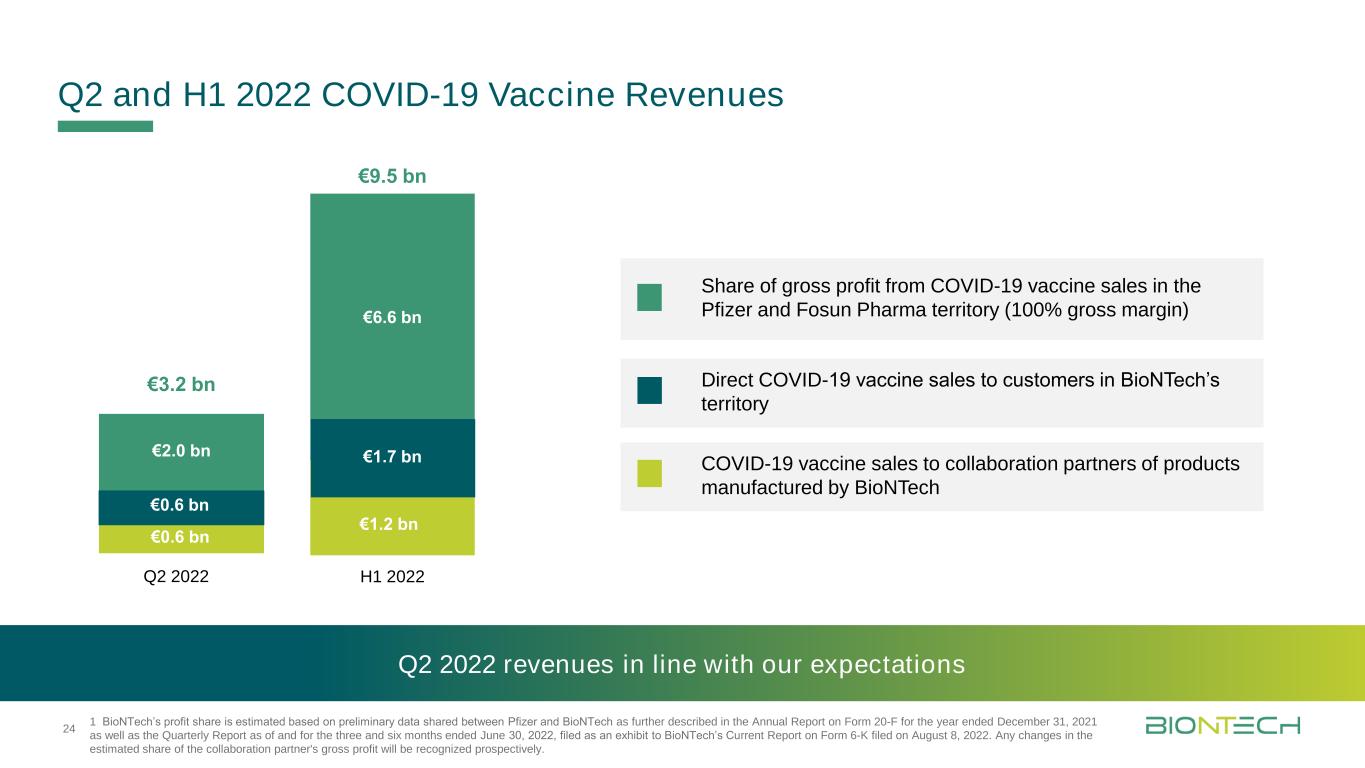
2022年第二季度和上半年新冠肺炎疫苗收入1 BioNTech的利润份额是根据辉瑞与BioNTech共享的初步数据估计的,具体描述见截至2021年12月31日的Form 20-F年度报告以及截至2022年6月30日的三个月和六个月的季度报告,这些报告作为BioNTech于2022年8月8日提交的当前Form 6-K报告的证物。协作合作伙伴毛利润的估计份额的任何变化都将被前瞻性地确认。2022年第2季度收入符合我们的预期2022年第2季度收入32亿欧元6亿欧元95亿欧元2022年上半年66亿欧元66亿欧元17亿欧元12亿24新冠肺炎直接销售疫苗在辉瑞和复星国际制药地区的毛利润份额新冠肺炎疫苗销售给合作伙伴生物科技公司生产的产品
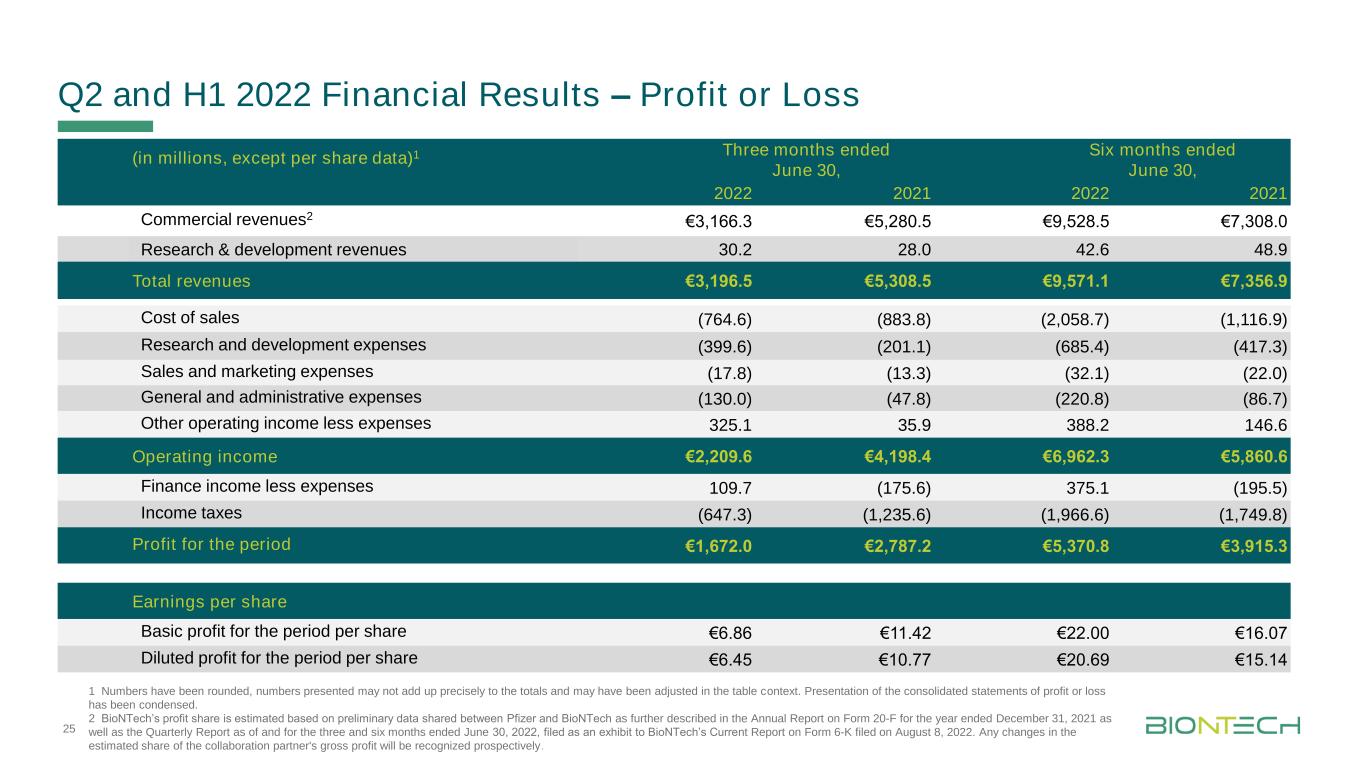
2022年第二季度和上半年财务业绩-利润或亏损(百万美元,每股数据除外)1截至6月30日的三个月,截至6月30日的六个月,商业收入2欧元3,166.3欧元5,280.5欧元9,528.5欧元7,308.0研发收入30.2 28.0 42.6 48.9总收入3,196.5欧元5,308.5欧元9,571.1欧元7,356.9销售成本(764.6)(883.8)(2,058.7)(1,116.9)研发费用(399.6)(201.1)(685.4)(417.3)销售和营销费用(17.8)其他营业收入减去支出325.1 35.9 388.2 146.6营业收入欧元2,209.6欧元4 198.4欧元6,962.3欧元5,860.6财务收入减去支出109.7(175.6)375.1(195.5)所得税(647.3)(1,235.6)(1,966.6)(1,749.8)该期间的利润欧元1,672.0欧元2,787.2欧元5,370.8欧元3,915.3该期间的基本每股利润欧元6.86欧元11.42欧元22.00欧元16.07稀释后的每股利润欧元6.45欧元10.77欧元20.69欧元15.14 1数字已四舍五入,所列数字的总和可能与总数不符,可能已在表格中进行了调整。综合损益表的列报已精简。2 BioNTech的利润份额是根据辉瑞和BioNTech共享的初步数据估计的,在截至2021年12月31日的Form 20-F年度报告以及截至2022年6月30日的三个月和六个月的季度报告中有进一步描述,该季度报告作为BioNTech于2022年8月8日提交的当前Form 6-K报告的证物。协作合作伙伴毛利润的估计份额的任何变化都将被前瞻性地确认。25个

2022财年指导重申1范围反映了当前的基本情况预测,不包括额外合作或潜在并购交易造成或推动的潜在影响。2 BioNTech Group估计,由于平均贸易税率下降,年有效所得税税率从2021财年的31.6%降至2022财年的约28%。新冠肺炎疫苗收入20221财年预计生物科技新冠肺炎疫苗收入130亿至170亿欧元2022年计划支出和Capex1研发支出1400至15亿欧元SG&A支出4.5亿至5.5亿欧元资本支出4.5亿至5.5亿欧元2022财年估计税收假设生物科技集团估计年度有效所得税税率~28%2 26

公司展望Ryan Richardson,首席战略官03财务业绩Jens Holstein,CFO 02管道更新Özlem Türeci,CMO 01第二季度2022年第二季度亮点Ugur Sahin,CEO 27

截至2022年7月初全球新冠肺炎疫苗特许经营1的强劲地位和前景2辉瑞和BioNTech运营的市场上2022年1月1日至2022年7月20日疫苗的累计份额,报告的市场份额数据3包括。发达市场(4)和新兴市场(阿根廷、智利、厄瓜多尔、香港、尼泊尔、秘鲁、南非、乌拉圭)的所有市场4包括美国、欧盟/欧洲经济区、其他国际发达市场(日本、韩国、瑞士、乌克兰)5从1月1日开始,此数据集的2022年数据来自2022年第一季度收益报告5等待监管部门批准与辉瑞公司合作分销新冠病毒-10疫苗自产品推出以来已运往180个国家或地区超过36亿剂1自20222年1月以来市场份额增加3:从52%增加到63%·发达市场4:从59%增加到68%2022年订单:约25亿剂·美国政府额外订购1.05亿剂,价值32亿美元·再订购1.95亿剂·EC订单6.5亿剂,2022年交付·修改了重新交付的合同2022年第4季度28随着奥密克戎变异疫苗计划在秋季晚些时候推出,出货量预计将增加5

履行提供公平获得药品的承诺·端到端信使核糖核酸生产单位,能力高达5000万剂/年·第一个制造设施成为分散和强大的非洲端到端制造网络的节点·在卢旺达破土动工后正在建设设施·2020年12月至2022年7月17日期间通过双边和捐赠协议为塞内加尔和南非增加潜在地点1通过双边和捐赠协议BioNTainer于2022年6月在非洲塞内加尔、卢旺达和南非启动>15亿剂新冠肺炎疫苗运往中低收入国家承诺20亿剂在非洲1个潜在的制造地点29

标题母版格式持续Klken Bearbeiten精选2022年流水线里程碑预期计时新冠肺炎疫苗:后续和下一代疫苗奥密克戎BA 4/5改编的二价疫苗试验开始2022年8月BNT162b5:下一代双价疫苗,编码祖先和BA2的增强型SARS-CoV-2刺突抗原第二阶段:FPD 2022年7月T细胞增强疫苗试验开始2022年下半年额外的下一代疫苗试验开始,包括泛SARS-CoV-2疫苗2H 2022多数据更新2022 4传染病首例人类试验开始带状疱疹疫苗1 2H 2022 BNT163 HSV2疫苗2H 2022 BNT164结核病疫苗2 2H 2022/2023 BNT165疟疾疫苗2H 2022/2023年初4肿瘤学首例人类试验于2022年1月开始BNT141实体肿瘤核单抗(CLDN18.2)FPD实体肿瘤BNT142核单抗(CD3×CLDN6)FPD 2022 BNT116 Vac与Cplimab联合用于NSCLC FNT313(GEN1053)2022年7月BNT313(GEN1053)INeST联合pbro治疗一线黑色素瘤目前处于2023年上半年BNT211期1/2CAR-T/CLDN6+多发性实体瘤2H 2022✓✓✓HSV2,单纯疱疹病毒2型;FPD,首例给药患者;CLDN,克劳丁;非小细胞肺癌,非小细胞肺癌1与辉瑞合作;2与辉瑞合作;3与Genmab合作4与基因泰克✓30合作
展望2022年及以后新冠肺炎疫苗的进一步开发加快晚期肿瘤学计划推进传染病投资组合寻求互补性收购改造和扩大全球组织一代人一次的机会改变医学为患者、股东和社会带来长期价值31

谢谢你32