
创新系列2022年6月29日P o to:F u si o n m e e d ic a l a n im a ti on,un spla sh

本演示文稿包含经修订的1995年《私人证券诉讼改革法》定义的前瞻性陈述,包括但不限于以下陈述:新冠肺炎疫苗初始或加强剂量的未来商业需求和医疗需求;与其他新冠肺炎疫苗的竞争或与我们其他候选产品的竞争,包括那些具有不同作用机制和不同制造和分销限制的产品,其基础是疗效、成本、储存和分销的便利性、批准的使用范围、副作用概况和免疫反应的持久性;我们的新冠肺炎疫苗以及我们的研究药物(如果获得批准)被市场接受的速度和程度;我们的研究和开发计划以及我们当前和未来的临床前研究和临床试验的启动、时间、进展和结果,包括有关研究或试验及相关准备工作的开始和完成的时间、试验结果的期限和我们的研发计划;我们获得并保持对我们的候选产品的监管批准的时间和能力;我们与辉瑞公司合作开发和销售新冠肺炎疫苗(包括BNT162b2的潜在增强剂量和/或具有修改的mrna序列的BNT162b2变体的潜在增强剂量);BNT162b2预防由新出现的病毒变异引起的新冠肺炎的能力;我们发现研究机会和发现和开发研究药物的能力;我们的第三方合作者继续进行与我们的开发候选药物和研究药物相关的研发活动的能力和意愿;新冠肺炎大流行对我们开发计划的影响, 这些风险包括:我们的供应链、合作伙伴和财务业绩;不可预见的安全问题和因使用我们开发或制造的其他产品和候选产品而导致的人身伤害或死亡的索赔;我们推进疟疾、结核病和艾滋病毒计划的能力,包括为这些计划选择临床候选人的时间和临床试验的开始,以及任何数据的读出;世界卫生组织、欧盟委员会和其他组织支持基础设施建设的性质和持续时间;在非洲大陆开发可持续的疫苗生产和供应解决方案,以及这些解决方案的性质和可行性;我们对研发收入、商业收入、销售成本、研发费用、销售和营销费用、一般和行政费用、资本支出、所得税、流通股的估计;我们和我们的合作伙伴将我们的候选产品(包括我们的新冠肺炎疫苗)商业化和营销的能力;我们管理开发和扩张的能力;美国和外国的法规发展;我们有效地扩大我们的生产能力和制造我们的产品,包括我们的新冠肺炎疫苗的目标生产水平和候选产品的能力;以及目前我们不知道的其他因素。在某些情况下,前瞻性陈述可以通过诸如“将”、“可能”、“应该”、“预期”、“打算”、“计划”、“目标”、“预期”、“相信”、“估计”、“预测”、“潜在”、“继续”或这些术语的否定或其他类似术语来识别。, 尽管并不是所有前瞻性声明都包含这些词语。本演示文稿中的前瞻性陈述既不是承诺,也不是保证,您不应过度依赖这些前瞻性陈述,因为它们涉及已知和未知的风险、不确定性和其他因素,其中许多因素不在BioNTech的控制范围之内,可能导致实际结果与这些前瞻性陈述中明示或暗示的结果大不相同。你应该审查本演示文稿中“风险因素”标题下描述的截至2022年3月31日的三个月的风险和不确定因素,以及生物技术公司提交给美国证券交易委员会的后续文件中的风险和不确定因素,这些文件可在美国证券交易委员会的网站上查阅:https://www.sec.gov/.除法律另有规定外,在出现新信息、未来发展或其他情况时,BioNTech对更新或修改本演示文稿中包含的任何前瞻性陈述不承担任何意图或责任。这些前瞻性陈述是基于BioNTech目前的预期,仅代表截至本文发布之日的情况。本幻灯片演示文稿包括前瞻性陈述2

COMIRATY®▼(辉瑞-生物科技新冠肺炎疫苗)已获得欧盟委员会的有条件营销授权,可从5岁起预防2019年人类冠状病毒病(新冠肺炎)。该疫苗以两剂为一系列,间隔3周接种。此外,CMA已扩大到包括18岁及以上个人在第二次接种后至少6个月的加强剂量(第三次接种)。对于免疫功能低下的人,第三次接种可能在第二次接种后至少28天给予。欧洲药品管理局的人类药物委员会已经完成了对COMIRATY®的严格评估,一致认为关于疫苗质量、安全性和有效性的足够有力的数据现在已经可用。重要安全信息:·已报告过敏反应事件。在接种疫苗后出现过敏反应的情况下,应随时提供适当的治疗和监督。·在接种Comirnaty疫苗后观察到非常罕见的心肌炎和心包炎病例。这些病例主要发生在接种疫苗后14天内,更多发生在第二次接种之后,更多发生在年轻男子身上。现有数据表明,接种疫苗后的心肌炎和心包炎的病程与一般的心肌炎或心包炎没有什么不同。·与焦虑有关的反应,包括血管迷走神经反应(晕厥)、过度换气或与压力有关的反应(如头晕、心悸、心率加快、血压改变, 刺痛感和出汗)可能与接种过程本身有关。与压力相关的反应是暂时的,并自行解决。应建议个人将症状提请疫苗接种提供者进行评估。重要的是要采取预防措施,避免因晕倒而受伤。·疫苗的有效性、安全性和免疫原性尚未在包括接受免疫抑制治疗在内的免疫功能受损的个人身上进行评估。在免疫抑制的个体中,COMIRATY®的疗效可能较低。·与任何疫苗一样,使用COMIRATY®接种疫苗可能不会保护所有疫苗接受者。个人可能要在第二次接种疫苗后7天才能获得完全保护。·在临床研究中,16岁及以上参与者的不良反应为注射部位疼痛(>80%)、疲劳(>60%)、头痛(>50%)、肌肉疼痛和寒战(>30%)、关节痛(>20%)、发热和注射部位肿胀(>10%),通常为轻度或中度,并在接种疫苗后几天内消失。较低的反应性事件发生频率与较大的年龄相关。·COMIRATY®在5至15岁参与者中的总体安全概况与16岁及以上参与者中看到的相似。·5至11岁儿童最常见的不良反应是注射部位疼痛(>80%)、疲劳(>50%)、头痛(>30%)、注射部位红肿(>20%)、肌肉疼痛和寒战(>10%)。·12至15岁的临床试验参与者最常见的不良反应是注射部位疼痛(>90%)、疲劳和头痛(>70%)、肌肉痛和寒战(>40%), 关节痛、发热(>20%)。·在孕妇中使用COMIRATY®的经验有限。只有当对母亲和胎儿的潜在益处超过任何潜在风险时,才应考虑在怀孕期间使用COMIRNAY®。·目前尚不清楚COMIRNatY®是否会从母乳中排泄出来。·尚未研究与其他医药产品的相互作用或与其他疫苗同时使用COMIRATY®的情况。·有关COMIRATY®安全性的完整信息,请始终参考EMA网站上以欧盟所有语言提供的经批准的产品特性摘要和包装传单。黑色等边三角形▼表示需要额外监测以捕获任何不良反应。这将允许快速识别新的安全信息。个人可以通过报告他们可能获得的任何副作用来提供帮助。副作用可报告给EudraVigilance,或通过电子邮件Medinfo@biontech.de、电话+49 6131 9084 0或通过网站www.biontech.de安全信息3直接向BioNTech报告。

安全信息授权在美国使用·新冠肺炎疫苗是美国食品和药物管理局批准的新冠肺炎疫苗,用于主动免疫,以预防由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的16岁及以上个人患上2019年冠状病毒病(新冠肺炎)。根据欧盟法案,它还被授权向6个月至4岁的个人提供3剂初级系列疫苗,向5岁及5岁以上的个人提供2剂初级系列疫苗,向已被确定有某些免疫损害的5岁及5岁以上个人提供第三剂初级系列疫苗,向已完成辉瑞-生物技术新冠肺炎疫苗或COMIRNAY®初级系列疫苗的12岁及以上个人提供单剂加强剂,向已完成不同授权新冠肺炎疫苗初级接种的18岁及以上个人提供单剂加强剂。对已接种任何授权新冠肺炎疫苗的第一剂加强剂的50岁及以上个人进行第二剂加强接种;对12岁及12岁以上被确定患有某种免疫折衷并接受了任何授权新冠肺炎疫苗的第一剂加强接种的个人进行第二次加强接种。加强剂时间表基于用于初级系列的疫苗的标签信息。重要安全信息个人不应接种疫苗,条件是:·在上一剂疫苗后出现严重过敏反应·对该疫苗的任何成分有严重过敏反应个人应将其所有医疗状况告知疫苗接种提供者, 包括以下情况:·有任何过敏·患有心肌炎(心肌炎)或心包炎(心脏外衬里的炎症)·发烧·有出血性疾病或正在服用血液稀释剂·免疫功能受损或正在服用影响免疫系统的药物·怀孕、计划怀孕或正在哺乳·接受了另一种新冠肺炎疫苗·曾因注射疫苗而晕倒·疫苗可能无法保护所有人。据报道,疫苗的副作用包括:·疫苗引起严重过敏反应的可能性很小,严重过敏反应通常在接种疫苗后几分钟至1小时内发生。出于这个原因,疫苗接种提供者可能会要求个人在接种疫苗后留在接种疫苗的地方进行监测o严重过敏反应的迹象可能包括呼吸困难、面部和喉咙肿胀、心跳加快、全身严重皮疹、头晕和虚弱o如果个人经历严重过敏反应,他们应该拨打9-1-1或去最近的医院·一些接种疫苗的人发生了心肌炎(心肌炎症)和心包炎(心脏外衬里的炎症),在40岁以下的男性中比女性和年长的男性更常见。在这些人中,大多数人在接种第二剂疫苗后几天内开始出现症状。发生这种情况的可能性非常低。个别人士在接种疫苗后如有下列任何病征,应立即求医:o胸痛o呼吸急促o感觉心跳急促、扑腾, ·严重的过敏反应;非严重的过敏反应,如注射部位疼痛;疲倦;头痛;肌肉疼痛;寒战;关节疼痛;发烧;注射部位肿胀;注射部位发红;恶心;感觉不适;淋巴结肿大(淋巴结病);食欲减退;腹泻;呕吐;手臂疼痛;以及与注射疫苗相关的晕厥·这些可能不是疫苗可能的副作用。可能会出现严重的、意想不到的副作用。疫苗可能的副作用仍在临床试验中研究。致电疫苗接种提供商或医疗保健提供商,了解令人烦恼的副作用或副作用不会消失,因为其他疫苗尚未提交给FDA,因此有关接种该疫苗的数据尚未提交给FDA。考虑与其他疫苗一起接种这种疫苗的个人应该与他们的医疗保健提供者讨论他们的选择。患者应该总是向他们的医疗保健提供者寻求关于不良事件的医疗建议。鼓励个人向美国食品和药物管理局(FDA)和疾病控制和预防中心(CDC)报告疫苗的负面副作用。请访问https://www.vaers.hhs.gov或致电1-800-822-7967。此外,副作用可报告给辉瑞公司,网址为www.pfizerSafetyreport。或致电1-800-438-1985。4.

Ugur议程欢迎生物技术创新方法-目标发现和表征-多平台创新引擎-数字和AI/ML-制造和自动化传染病的新前沿Q&A咖啡介绍肿瘤学流水线信使核糖核酸癌症疫苗蛋白质疗法将细胞疗法扩展到实体肿瘤细胞因子闭幕词问与答会议闭幕词:F u si o o n m e e d ic a l a n im a ti on,un n spla sh

维吾尔族的欢迎
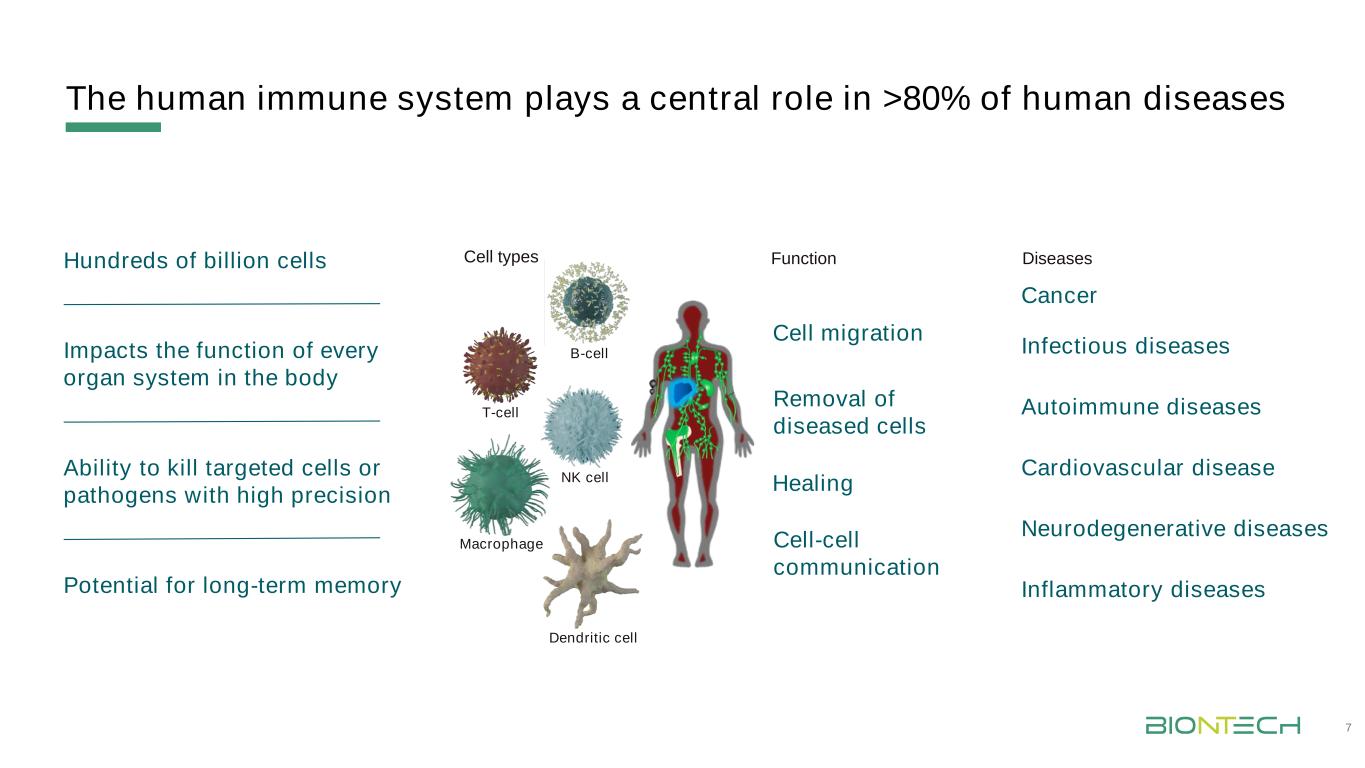
人类免疫系统在超过80%的人类疾病中发挥核心作用7.高精度杀伤靶细胞或病原体的能力千亿细胞影响人体每个器官系统的功能长期记忆的潜能癌症自身免疫性疾病神经退行性疾病感染性疾病B细胞-巨噬细胞-NK细胞-T细胞类型炎症疾病树突状细胞迁移疾病细胞-细胞通讯疾病
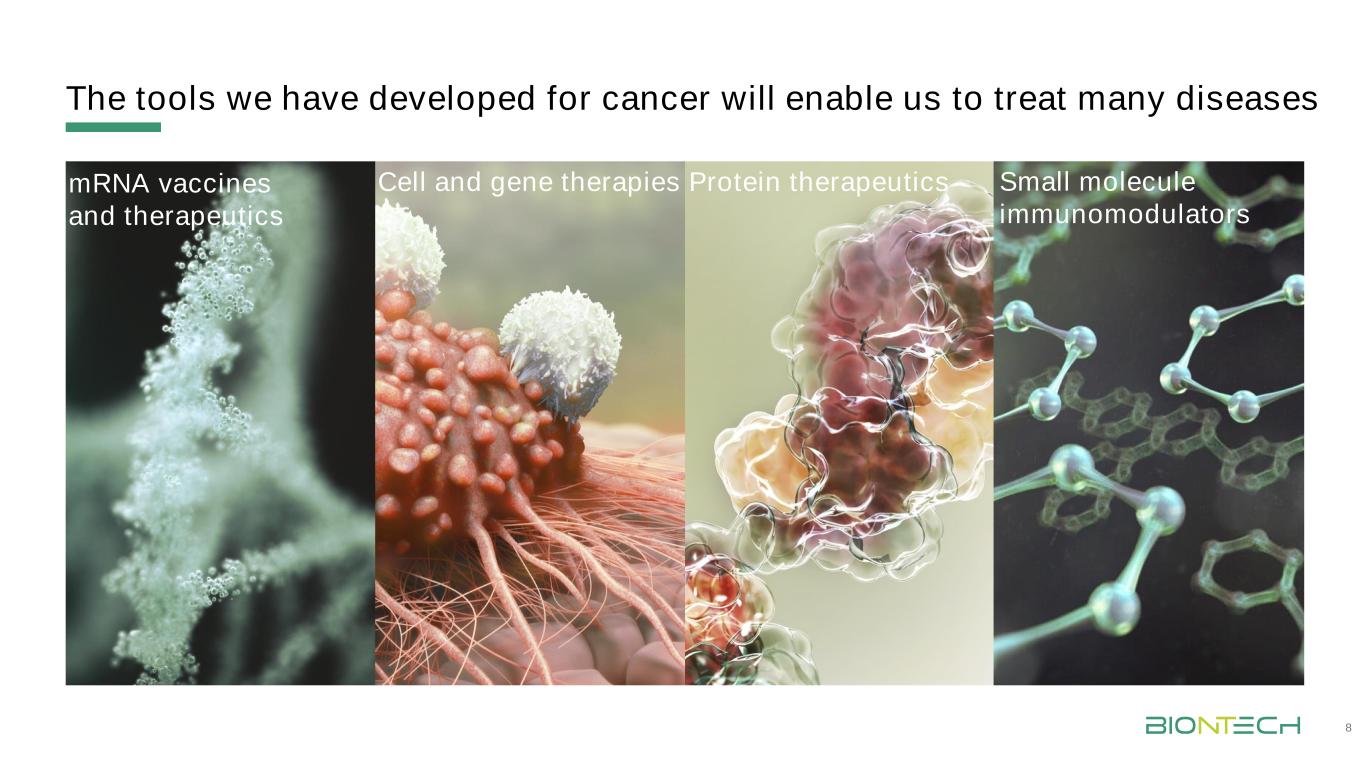
我们开发的癌症治疗工具将使我们能够治疗多种疾病8mrna疫苗和疗法细胞和基因疗法蛋白质疗法小分子免疫调节剂

将基因从VISION转化为现实1,在全球100多个国家和地区授权或批准用于紧急用途或临时使用,或获得营销授权,2022年4月;2截至2022年4月底;3至2022年底;4 Eric C.Schneider等人,美国新冠肺炎疫苗接种计划一年:避免了多少死亡和住院?(英联邦基金,2021年12月)。欧洲疾病预防和控制中心;5.https://www.statista.com/topics/6139/covid-19-impact-on-the-global-economy/9 BNT162b2数百万例严重疾病或死亡病例可能避免了4万亿美元的全球经济影响5~34亿剂2有史以来第一次获得批准的信使核糖核酸疗法1超过10亿人接种2>175个国家/地区达到约20亿至中低收入国家3最快的制药产品开发和推出

CARVac临床前概念验证发表在《科学》杂志上的强大势头建立在20年的创新基础上由创始人10阶段开始的mRNA疫苗研究20世纪90年代中期2008 BioNTech由Ugur Sahin,Özlem Türeci和Christoph Huber在美因茨创立,2017年发表在《自然》杂志上的德国现成的信使核糖核酸疫苗2019年首次公开发售纳斯达克计划光速启动的新冠肺炎疫苗获得美国食品和药物管理局的全面批准2个体化的信使核糖核酸疫苗降低黑色素瘤患者的转移性复发率发表在《自然》杂志2017年细胞疗法首例人体试验2021年双特异性免疫调节剂首例人体试验3 2020年核单抗首次人体试验2022年核单抗BNT211 17临床方案7个临床方案改进新冠肺炎疫苗配方推出核细胞因子首例人体试验变异适应新冠肺炎疫苗提交2005年首例信使核糖核酸2006年发表于血液中的个体化信使核糖核酸癌症疫苗首例人体试验2014年纳米粒信使核糖核酸疫苗首例人类试验2016年发表于《自然》杂志2015上的辅助性胰腺数据在ASCO年会上发表的MS疫苗临床前概念验证发表在《科学》IVAC试验中,延长了RNA-Lipoplex治疗2016 MS的无复发生存临床前概念验证,多发性硬化症。1项与基因泰克的iNeST合作;2项与辉瑞的全球联合开发联合商业协议;3项与Genmab的GEN1046合作。
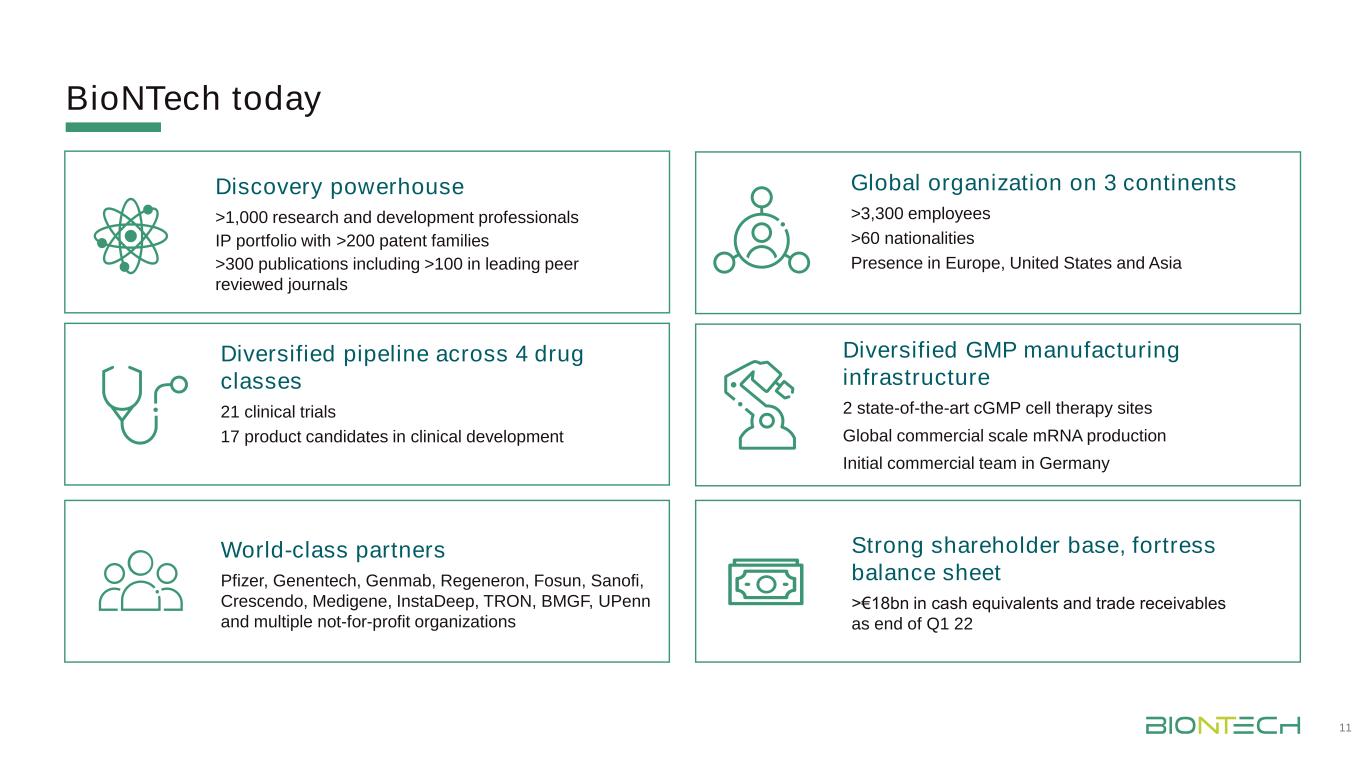
BioNTech今天拥有超过1,000名研究和开发专业人员的IP投资组合,拥有超过200个专利家族>300篇出版物,包括超过100种领先的同行评审期刊21项临床试验多元化流水线跨4个药物类别21项临床试验17个临床开发候选产品多元化GMP制造基础设施2个最先进的cGMP细胞治疗网站全球商业规模基因生产最初的商业团队在德国拥有世界级合作伙伴辉瑞、基因泰克、Genmab、Regeneron、复星国际、赛诺菲、Cresendo、Medigene、InstaDeep、Tron、BMGF、UPenn和多个非营利组织强大的股东基础,堡垒资产负债表>截至第一季度末的180亿欧元现金等价物和应收账款22全球组织在3大洲>3,300名员工>60个国家在欧洲、美国和亚洲的业务
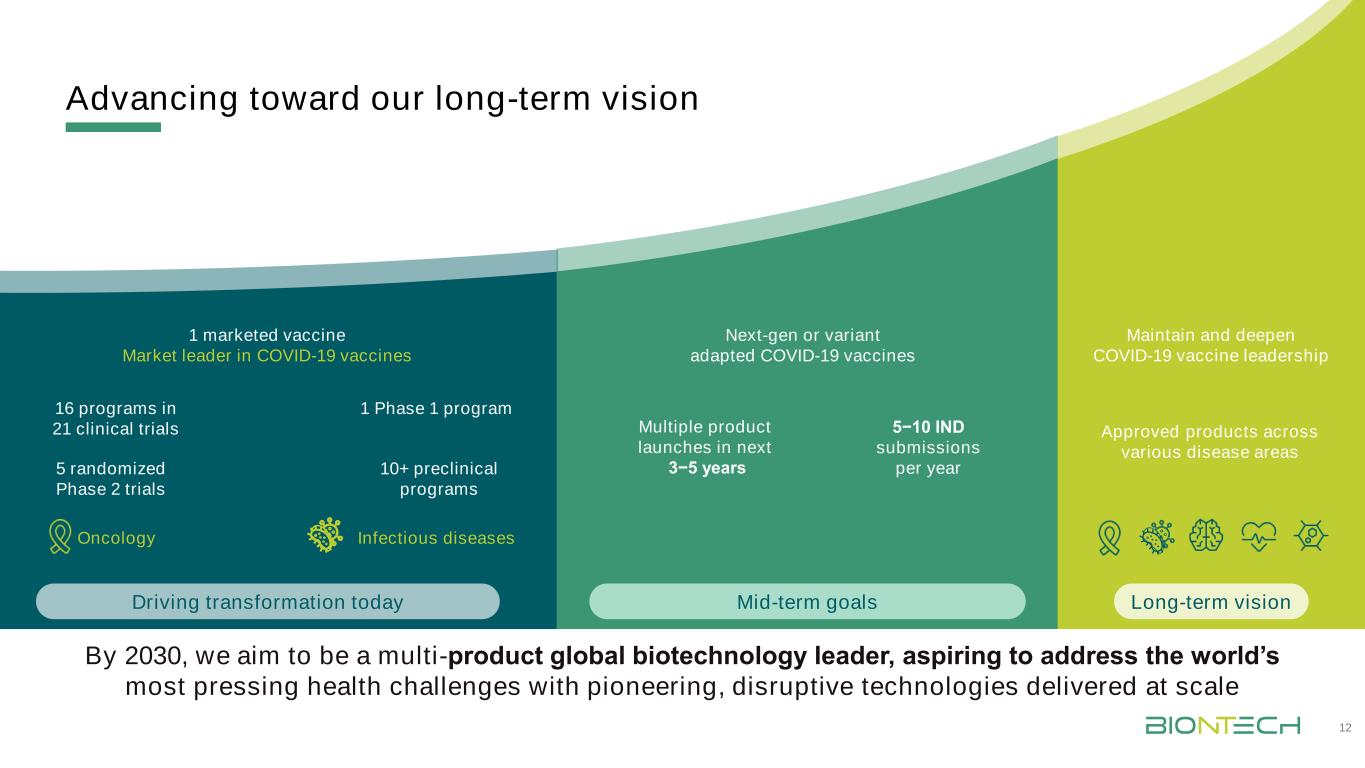
迈向我们的长期愿景12肿瘤学感染性疾病5随机第二阶段试验1上市疫苗市场新冠肺炎疫苗10+临床前计划1阶段1计划21项临床试验中的16项计划保持并深化新冠肺炎疫苗的领导地位未来3−5年到2030年,我们的目标是成为多产品全球生物技术的领先者,渴望通过大规模交付开创性、颠覆性技术来应对世界上最紧迫的健康挑战中期目标推动转型今天长期愿景5−10指数每年提交新一代或变种改装新冠肺炎疫苗批准的跨不同疾病领域的产品

创新的生物技术方法{P o o to:V 2 o s k,u n s p la s h
聚焦五大创新支柱深入理解免疫系统多平台创新引擎制造与自动化目标发现与表征数字化与AI/ML 14

蛋白质翻译基因转录mRNA--本质上参与所有生物过程免疫系统--全身控制生理和病理机制免疫系统15

T细胞肿瘤细胞Treg 4-1BB PD-1 PD-L1 TCRMHC促炎细胞因子幼稚T细胞APC CD40了解和利用免疫学机制16 mRNA编码的癌症疫苗2共享抗原个性化抗原CAR、TCR和非工程细胞疗法3 44 2下一代免疫调节剂4 mRNA编码的传染病疫苗1 B细胞1mRNA编码的效应分子5免疫系统抗体细胞因子共享抗原个性化双激动剂CPI+激动剂抗体55 32健康细胞病原体
聚焦五大创新支柱深入理解免疫系统多平台创新引擎制造与自动化目标发现与表征数字化&AI/ML 17目标发现
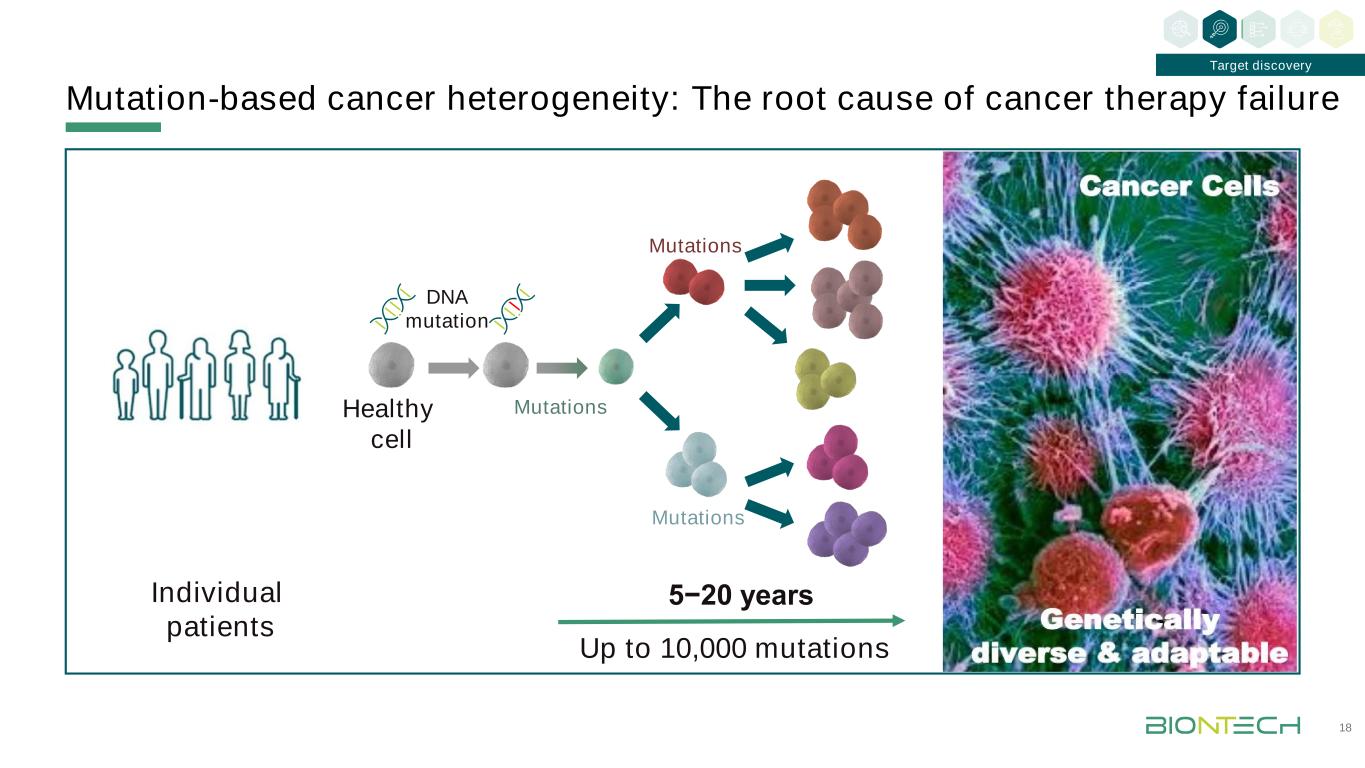
基于突变的癌症异质性:癌症治疗失败的根本原因18目标发现多达10,000个突变5−20年个别患者健康细胞dna突变
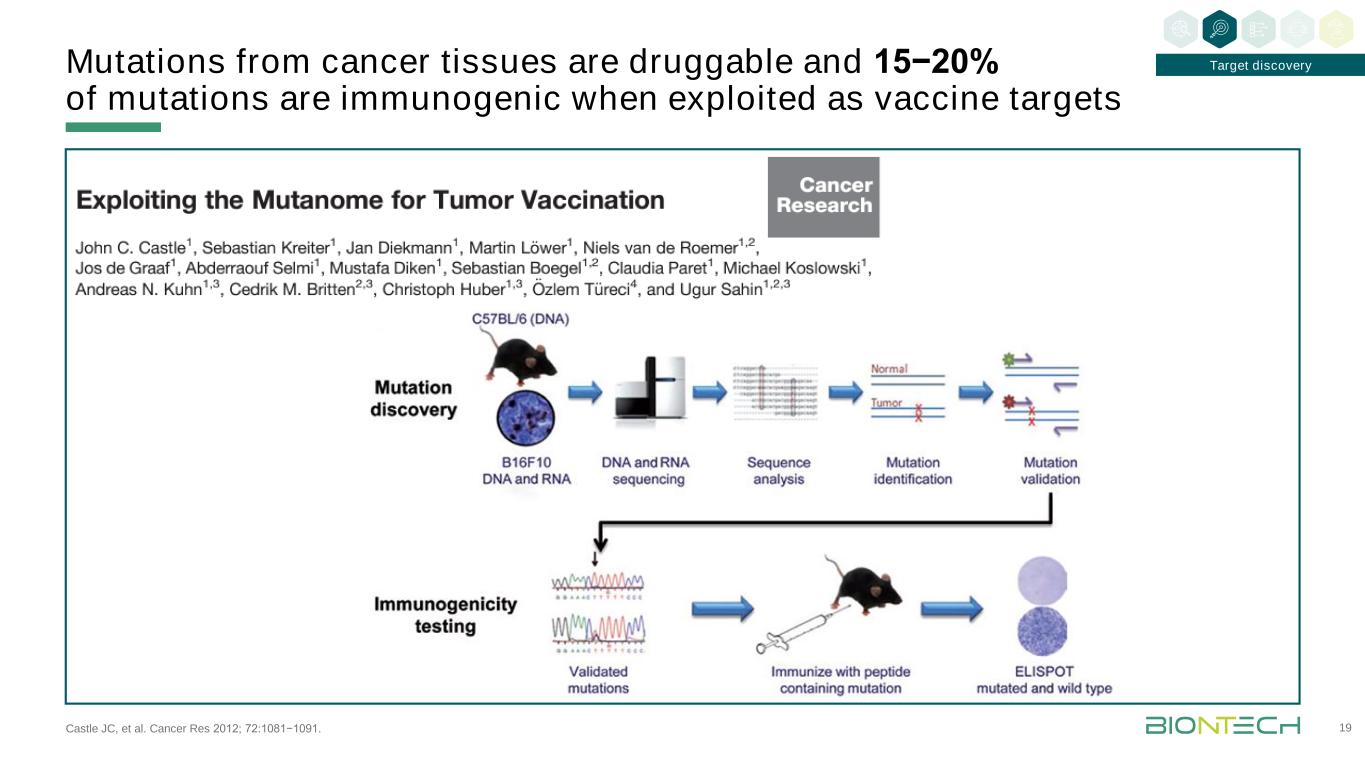
Castle JC等人。癌症资源2012;72:1081−1091。来自癌症组织的突变是可用药的,15−20%的突变被用作疫苗靶点时是免疫原性的19靶点发现
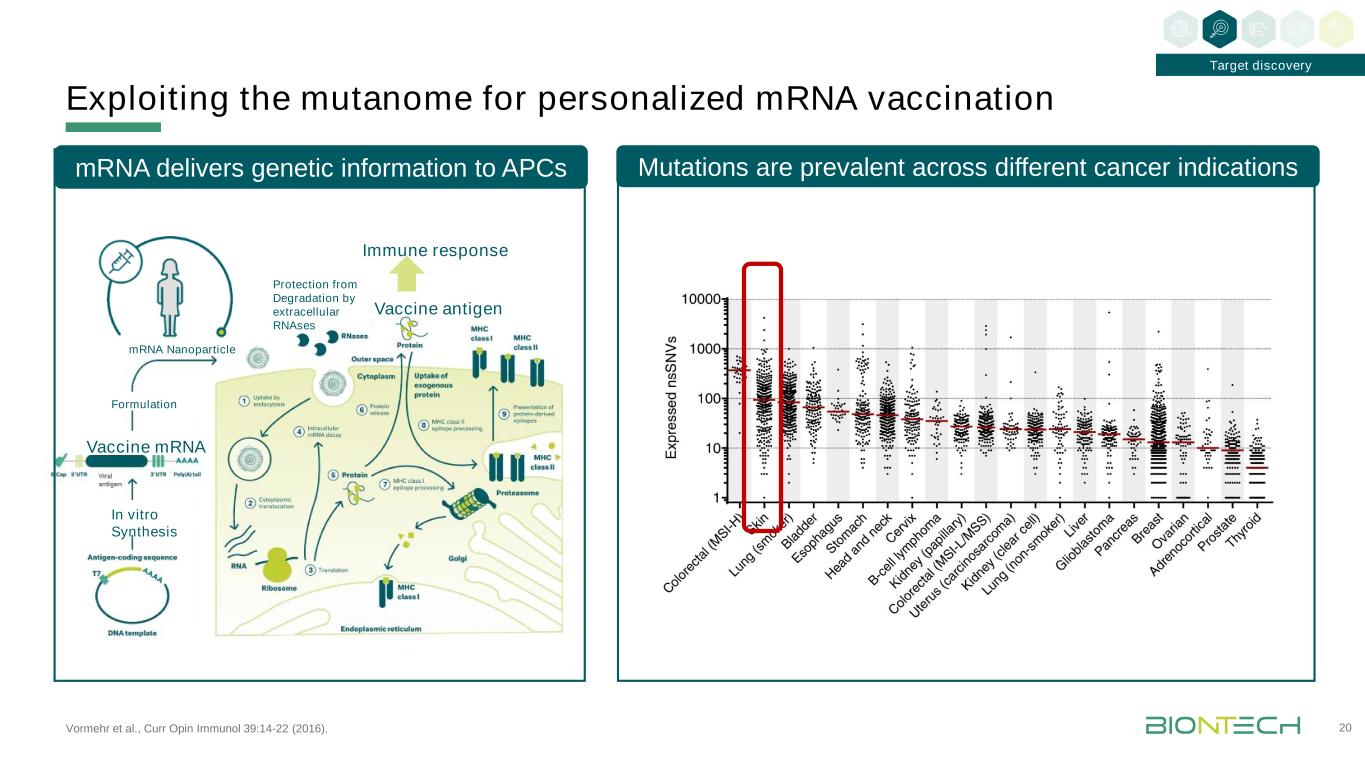
Vormehr等人,Curr Opin免疫学39:14-22(2016)。利用突变组进行个性化信使核糖核酸疫苗20靶点发现疫苗抗原疫苗体外合成免疫反应制剂信使核糖核酸酶降解信使核糖核酸酶信使基因信息传递给APC突变在不同的癌症适应症中普遍存在

获取患者组织和血液样本21个靶点的发现
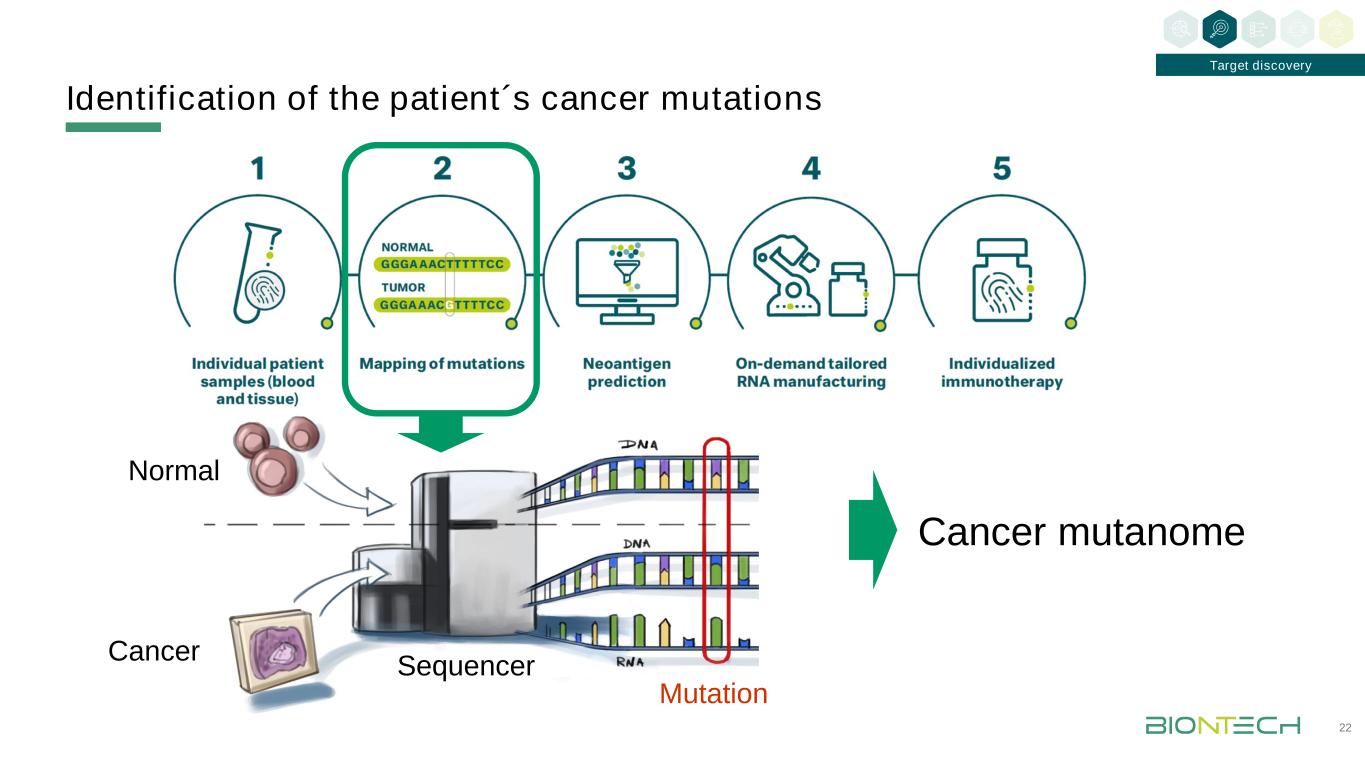
患者癌基因突变的鉴定22靶点发现癌突变组正常癌基因序列突变

KREITER et.艾尔自然2015年计算机预测突变23目标发现计算机预测突变列表由专家评审关键基因Mut Chrom Score#001 PIK3CA R115L 3 0,2#002 IMPA2 R202P 18 0,3#003 KRAS G12D 12 0,45#...…验证………#267 KIF21B P188 S 1 3,45
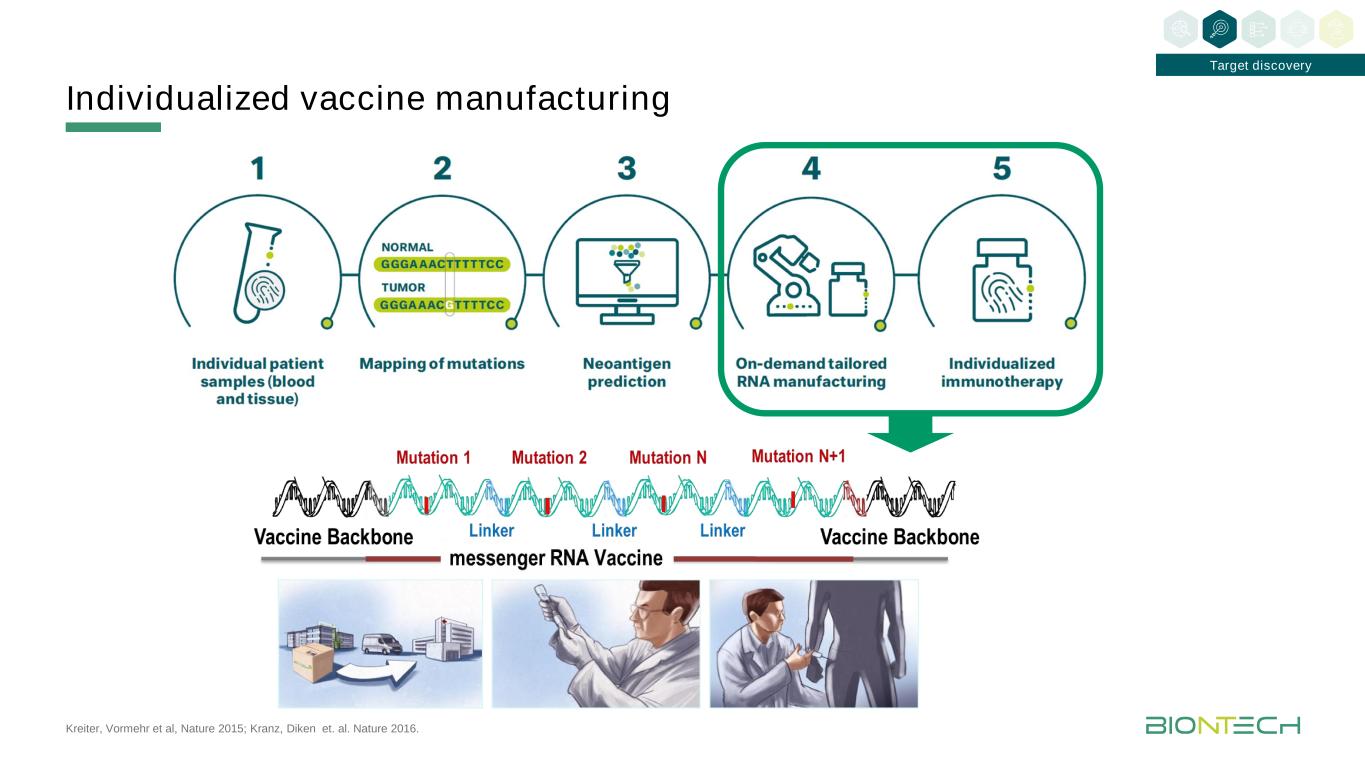
KREITER,Vormehr等人,《自然》2015;Kranz,Diken等人。艾尔《自然》2016。个性化疫苗生产目标的发现
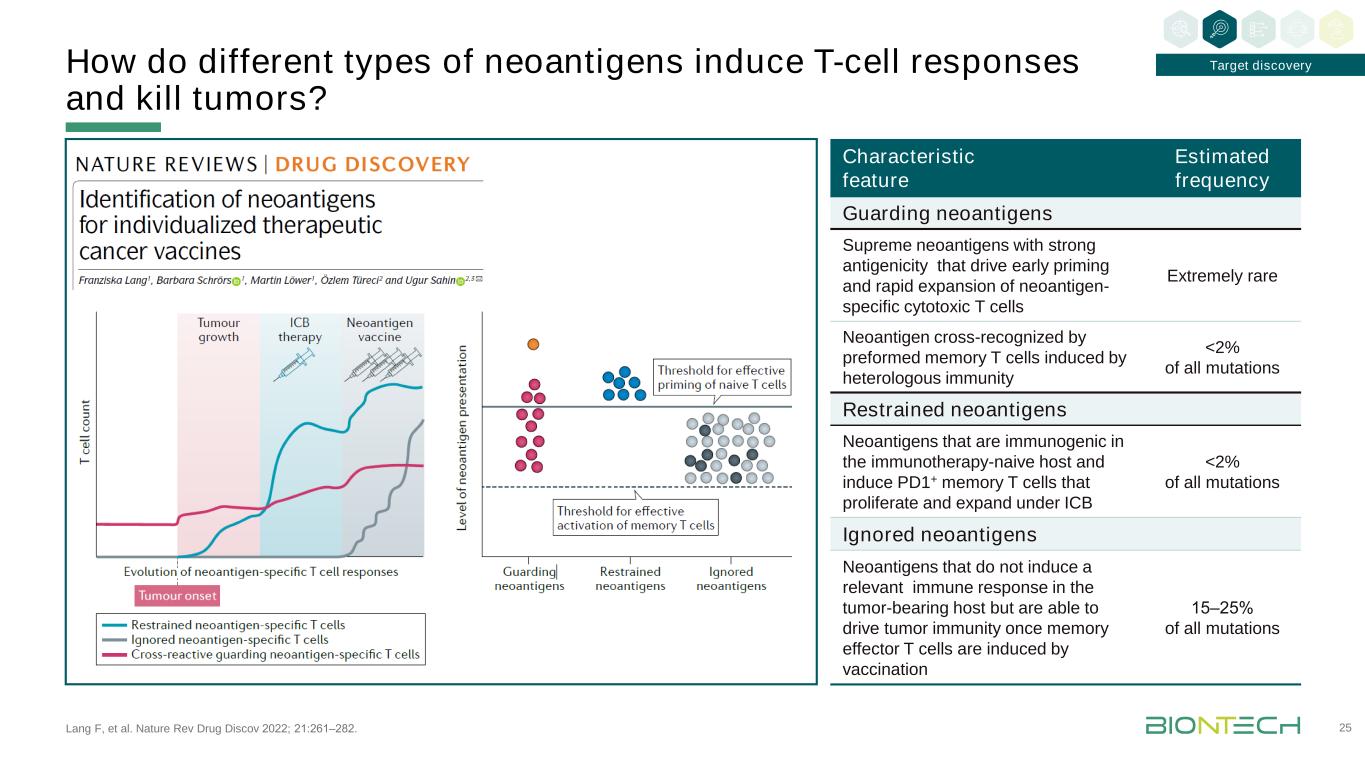
Lang F等人的研究成果。《自然回顾药物发现》2022;21:261-282。不同类型的新抗原如何诱导T细胞反应和杀伤肿瘤?25个特征特征守卫新抗原的频率最高的新抗原具有很强的抗原性,促使新抗原特异性细胞毒T细胞的早期启动和快速扩增异种免疫诱导的预形成记忆T细胞交叉识别的极其罕见的新抗原
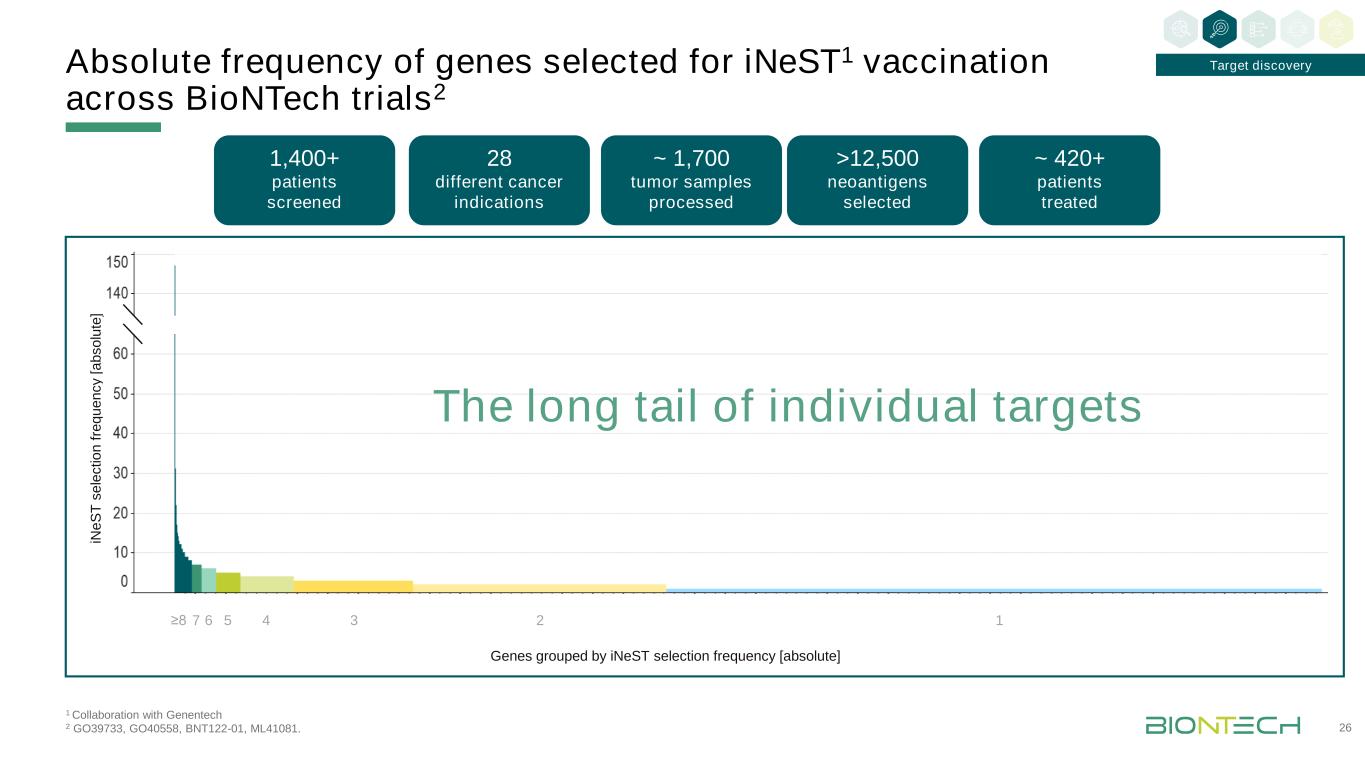
在E S T s e le c ti o n Fr e Q u e n c y中[一个b s o lu te]≥8 7 6 5 4 3 2 1 1与基因泰克2 GO39733、GO40558、BNT122-01、ML41081协作。在BioNTech试验中选择用于iNeST1疫苗接种的基因的绝对频率2 26目标发现1,400+患者筛选~420+接受治疗的患者约1,700个肿瘤样本处理>12,500个新抗原选择28个不同的癌症适应症基因按iNeST选择频率分组[绝对的]个别目标的长尾
聚焦五大创新支柱深入理解免疫系统多平台创新引擎制造与自动化目标发现与表征数字化AI/ML 27多平台引擎
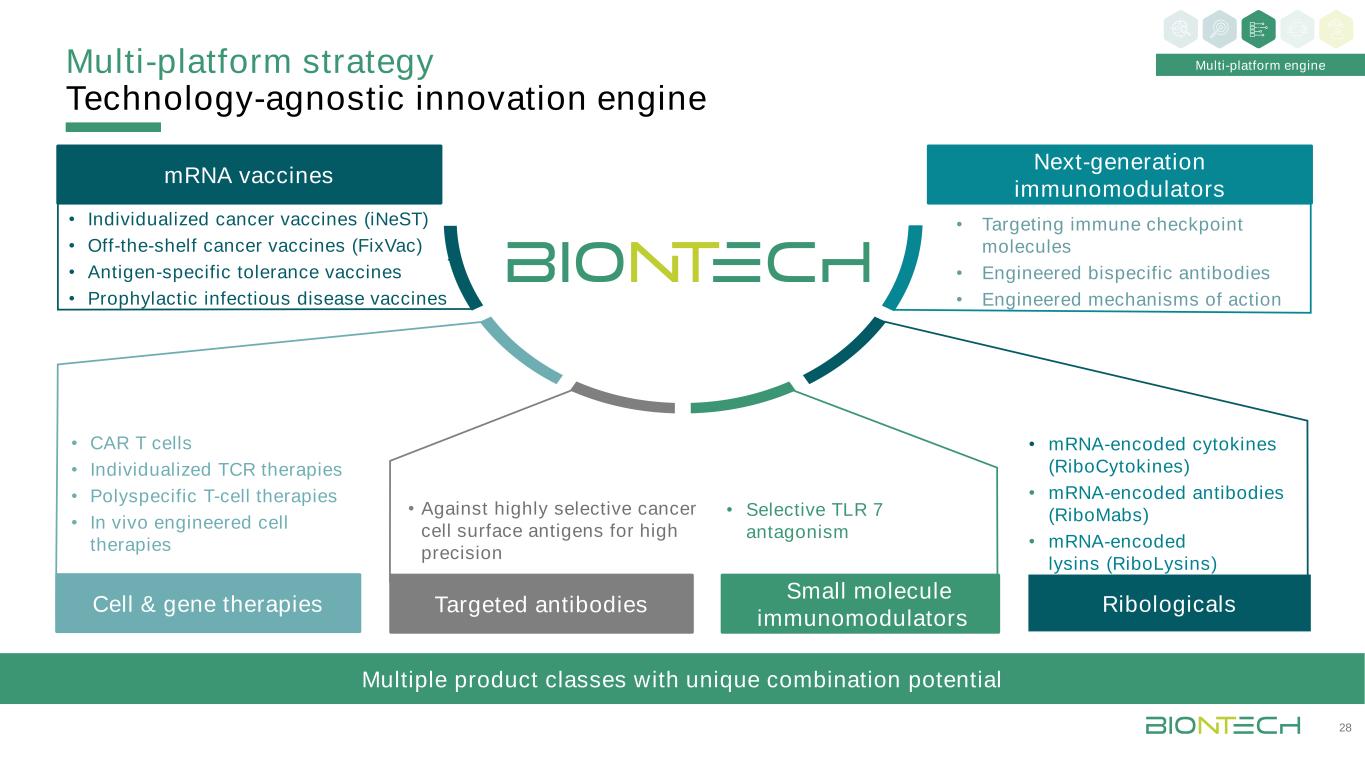
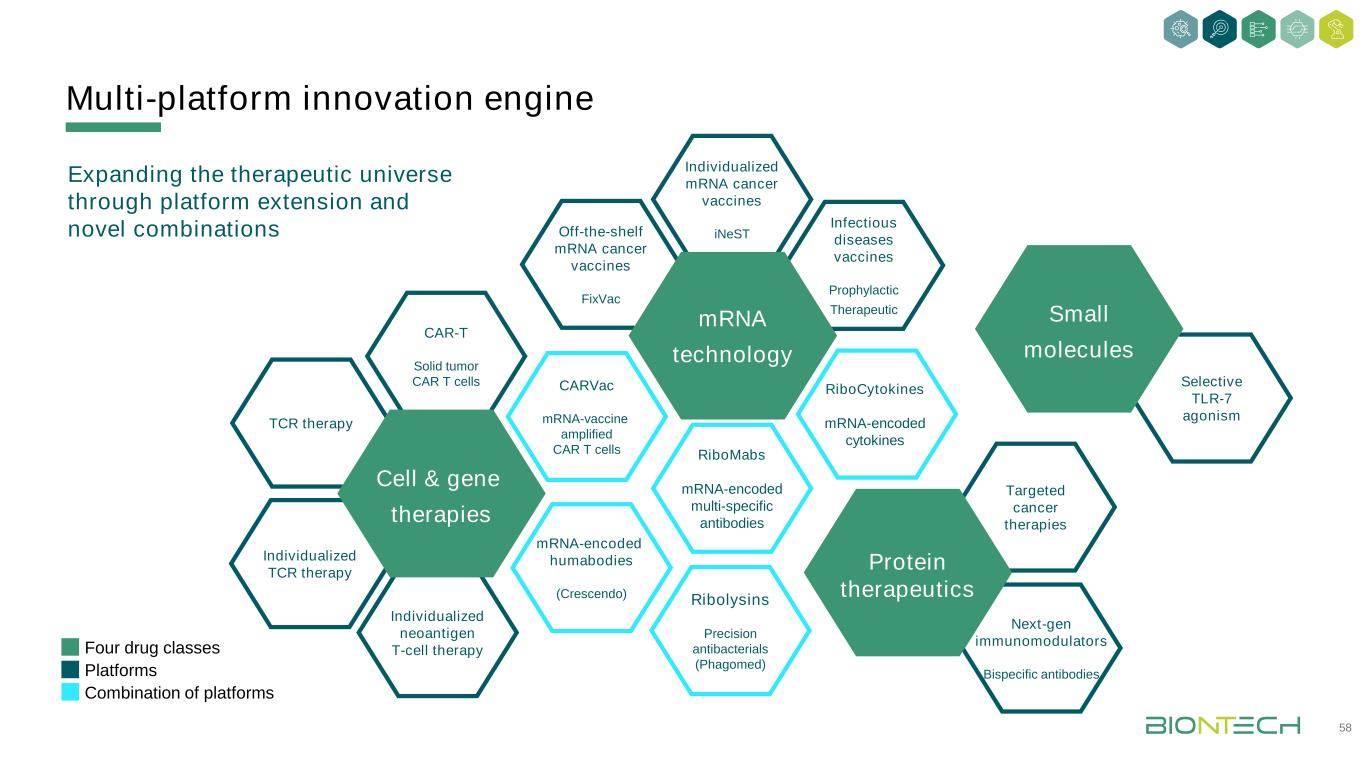
多平台战略技术-不可知创新引擎多平台引擎28 mRNA疫苗靶向抗体小分子免疫调节剂·靶向免疫检查点分子·工程双特异性抗体·作用机制细胞和基因疗法下一代免疫调节剂Ribologics·针对高选择性癌细胞表面抗原的高精确度·选择性TLR7拮抗剂·CAR T细胞·个体化TCR疗法·多特异性T细胞疗法·体内工程细胞疗法·个体化癌症疫苗(INeST)·现成癌症疫苗(FixVac)·抗原特异性耐受性疫苗·预防性传染病疫苗·mRNA编码的细胞因子(核细胞因子·信使核糖核酸编码抗体(RiboMabs)·信使核糖核酸编码赖氨酸(RiboLysins)具有独特结合潜力的多种产品类别

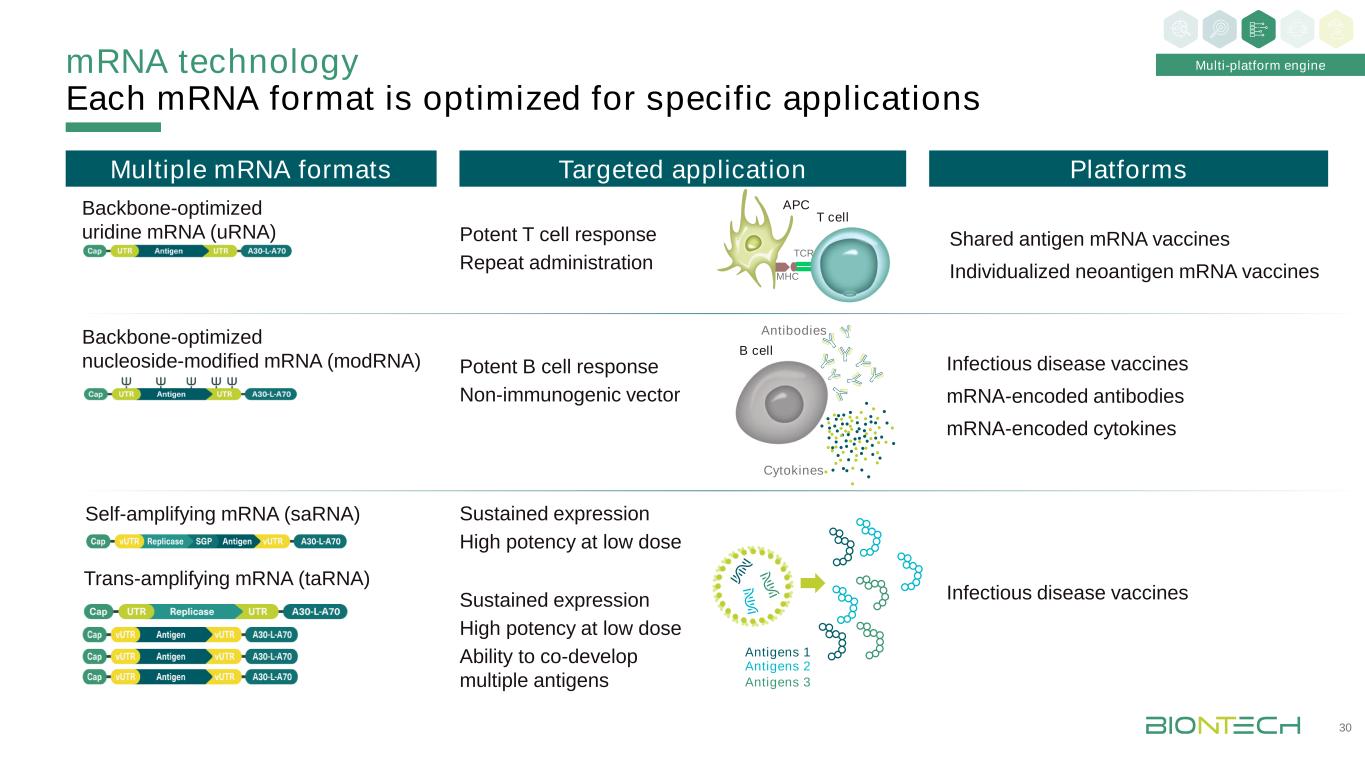
信使核糖核酸技术基于深厚的免疫学专业知识构建的广泛信使信使核糖核酸工具包29多种信使核糖核酸递送配方灵活的递送途径局部、肿瘤内、组织特异性或全身脂复合物(LPX)脂质纳米粒(LNP)多复合体骨架优化的尿苷信使信使核糖核酸(URNA)+十多年的信使核糖核酸研究使效价提高>10,000倍并改善持久性骨架优化的核苷修饰信使核糖核酸(ModRNA)自扩增信使核糖核酸(SARNA)多平台引擎反式放大信使信使(TARNA)
T细胞TCR MHC APC信使核糖核酸技术每种信使信使针对特定应用而优化多种信使信使骨架优化尿苷信使核糖核酸骨架优化核苷修饰信使核糖核酸靶向应用有效T细胞应答重复给药共享抗原信使核糖核酸疫苗个性化新抗原信使核糖核酸疫苗平台有效B细胞应答非免疫原性载体持续表达低剂量高效持续表达高效协同开发多种抗原B细胞因子抗体感染性疾病疫苗抗原1抗原2抗原3多平台引擎传染病疫苗信使核糖核酸编码抗体信使核糖核酸反式扩增信使核糖核酸自扩增信使核糖核酸30
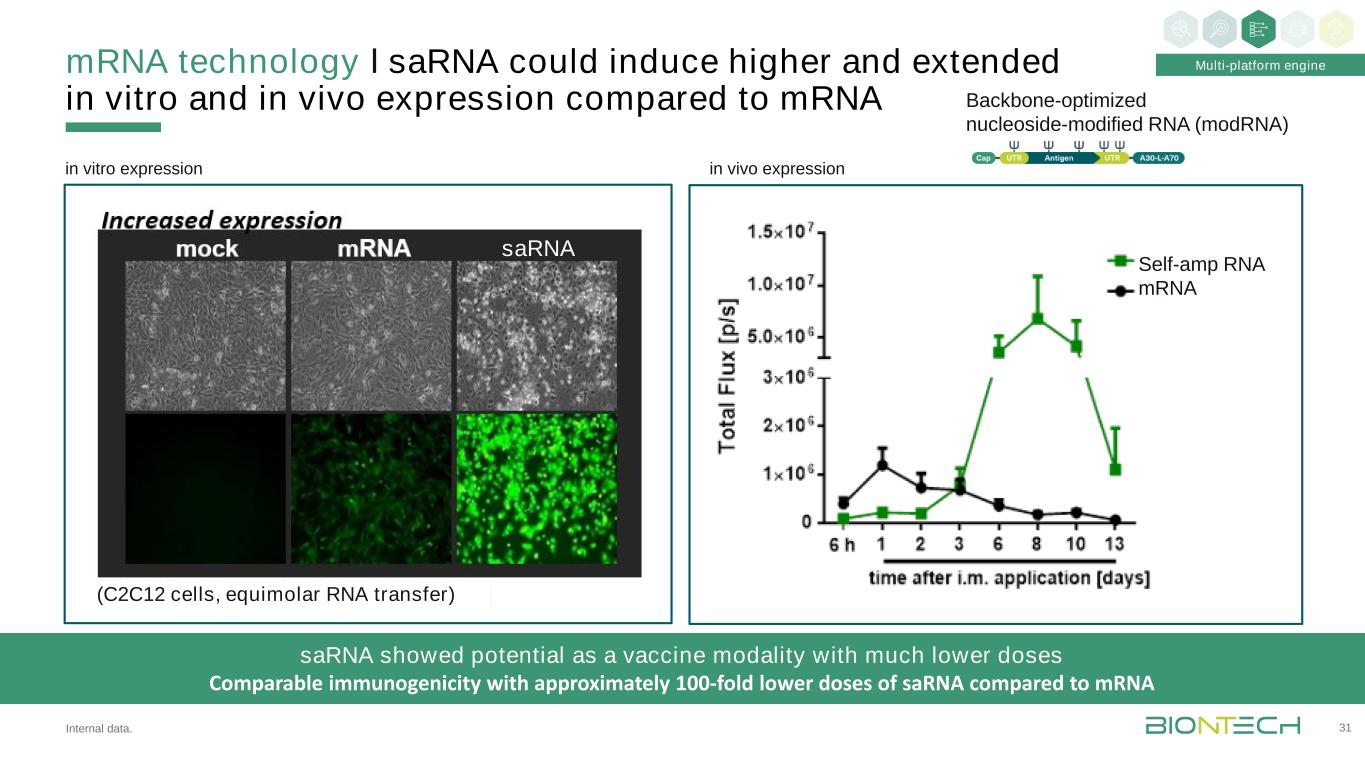
与І内部数据相比,信使核糖核酸技术可以在体外和体内诱导更高和更长时间的表达。31体外表达骨架优化的核苷修饰RNA(ModRNA)多平台引擎Sarna显示出作为疫苗的潜力,其剂量与免疫原性相当,与信使核糖核酸(C2C12细胞,等摩尔RNA转移)相比,其免疫原性约低100倍
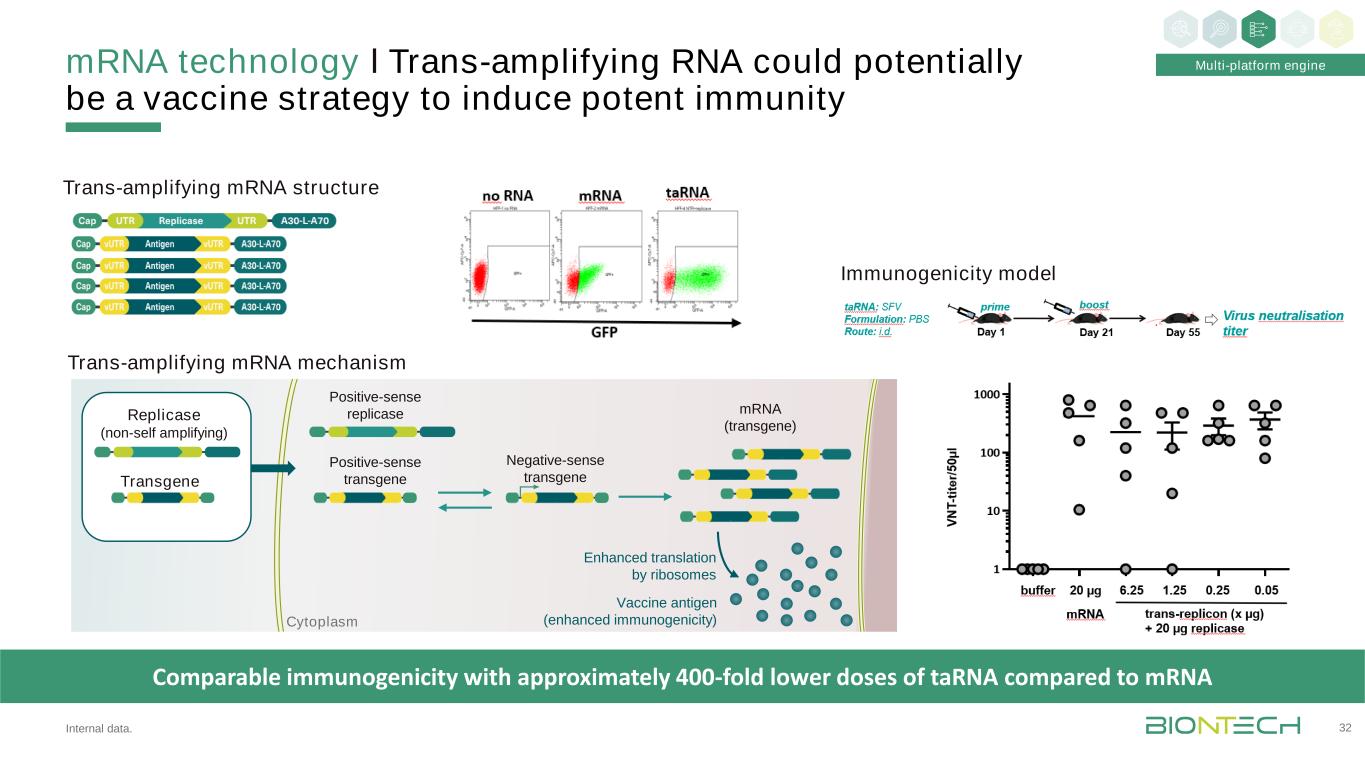
核糖核酸技术І反式扩增核糖核酸可能是一种潜在的疫苗策略,以诱导强大的免疫力32多平台引擎内部数据。转基因复制酶(非自扩增)正义复制酶正义转基因反义转基因(转基因)疫苗抗原(增强免疫原性)增强核糖体的翻译胞浆免疫原性与TARNA的剂量相比低约400倍反式扩增的结构免疫原性模型反式扩增的机制
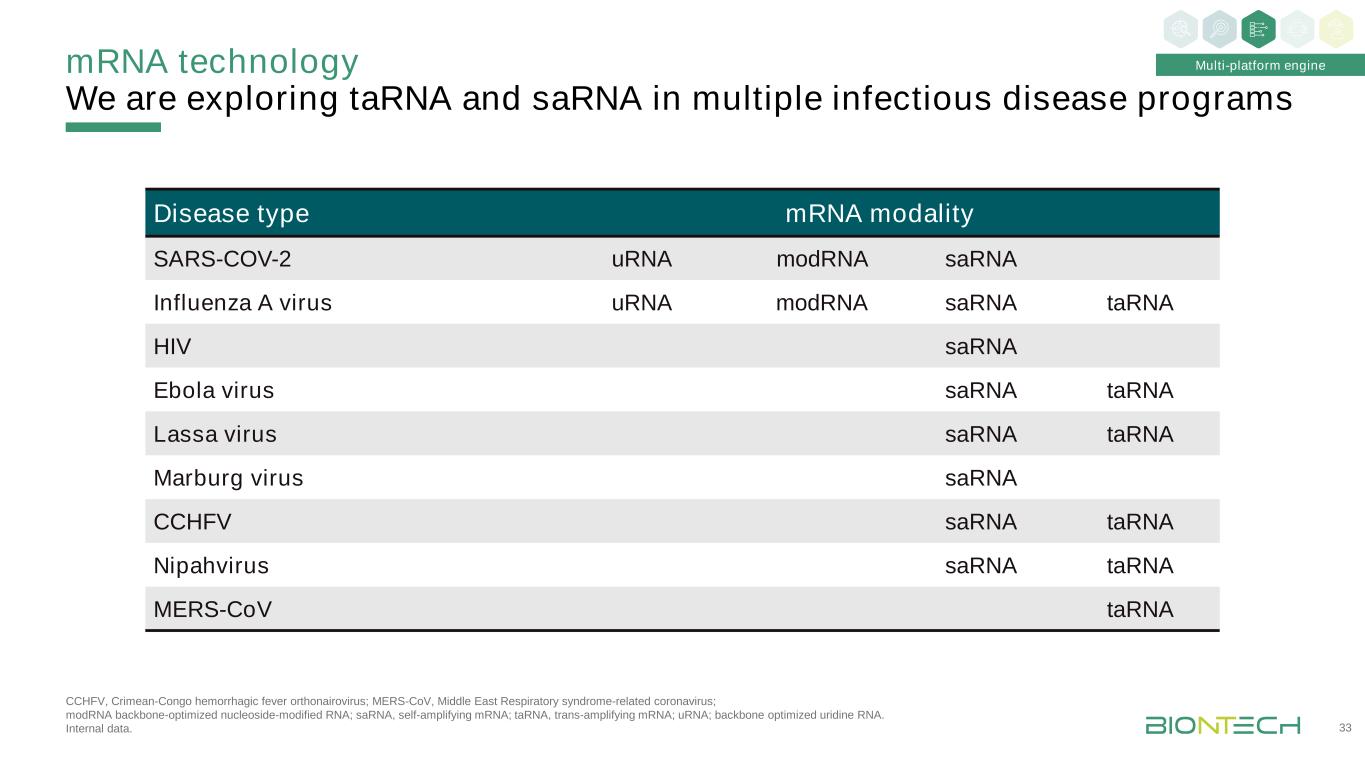
我们正在探索TARNA和SARNA在多种传染病项目中的应用:CCHFV,克里米亚-刚果出血热原核病毒;MERS-CoV,中东呼吸综合征相关冠状病毒;modRNA骨架优化的核苷修饰的RNA;SARNA,自我扩增的RNA;TARNA,反式放大的RNA;URNA;骨架优化的尿苷RNA。内部数据。33疾病类型mRNA模式SARS-COV-2 urna modRNA Sarna流感A病毒urna modRNA Sarna Tarna HIV Sarna埃博拉病毒Sarna Tarna Lassa病毒Sarna Tarna Marburg病毒Sarna CCHFV Sarna Tarna NipahVirus Sarna Tarna MERS-CoV Tarna多平台引擎
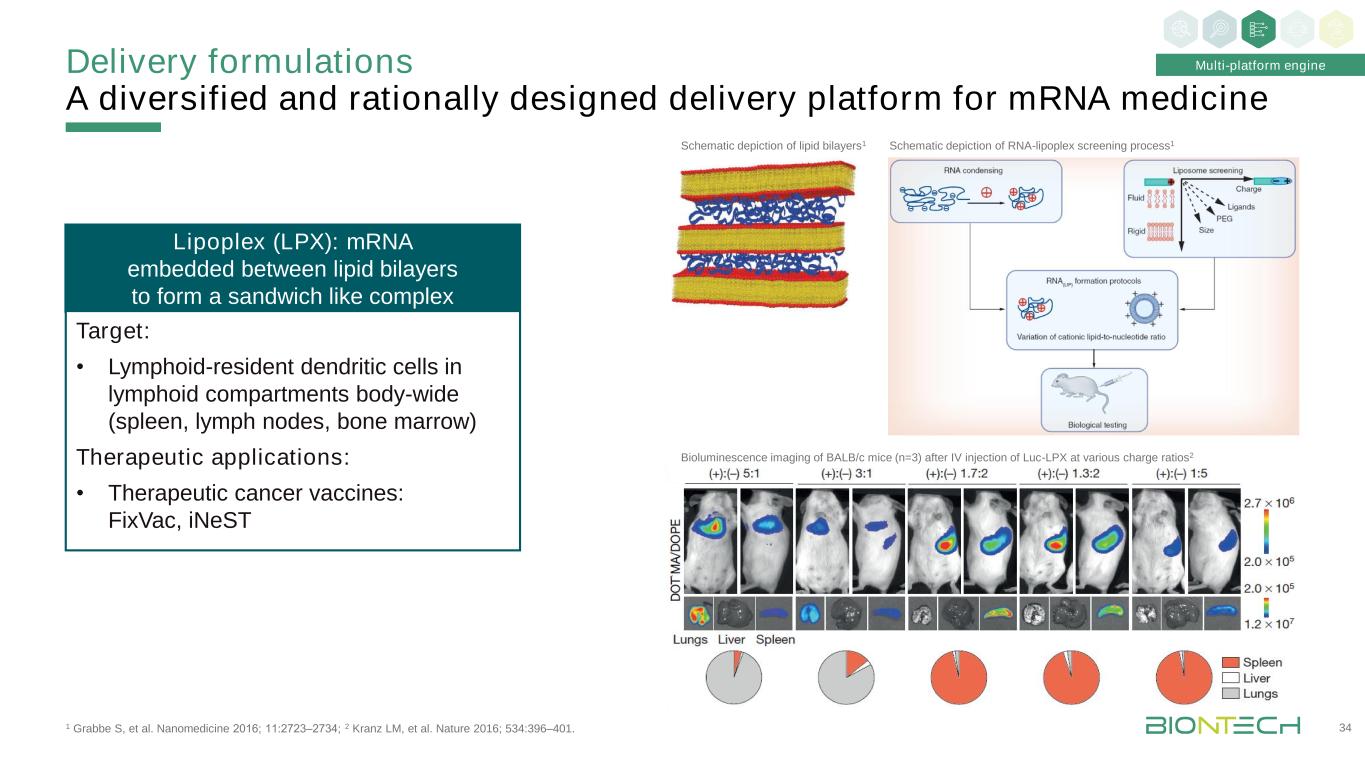
1 Grabbe S等人。Nanomedicine 2016;11:2723-2734;2 Kranz LM,等人。《自然》2016;534:396-401。给药配方多样化且设计合理的信使核糖核酸药物递送平台34多平台引擎核糖核酸-脂复合体筛选过程示意图1不同充电比静脉注射Luc-LPX后BALB/c小鼠的生物发光成像(n=3)2脂双层(LPX)示意图:嵌入在脂双层之间以形成夹心状复合体的信使核糖核酸靶点:·淋巴滞留于全身淋巴间隔(脾、淋巴结、骨髓)的树突状细胞治疗应用:治疗癌症疫苗:FixVac,iNeST
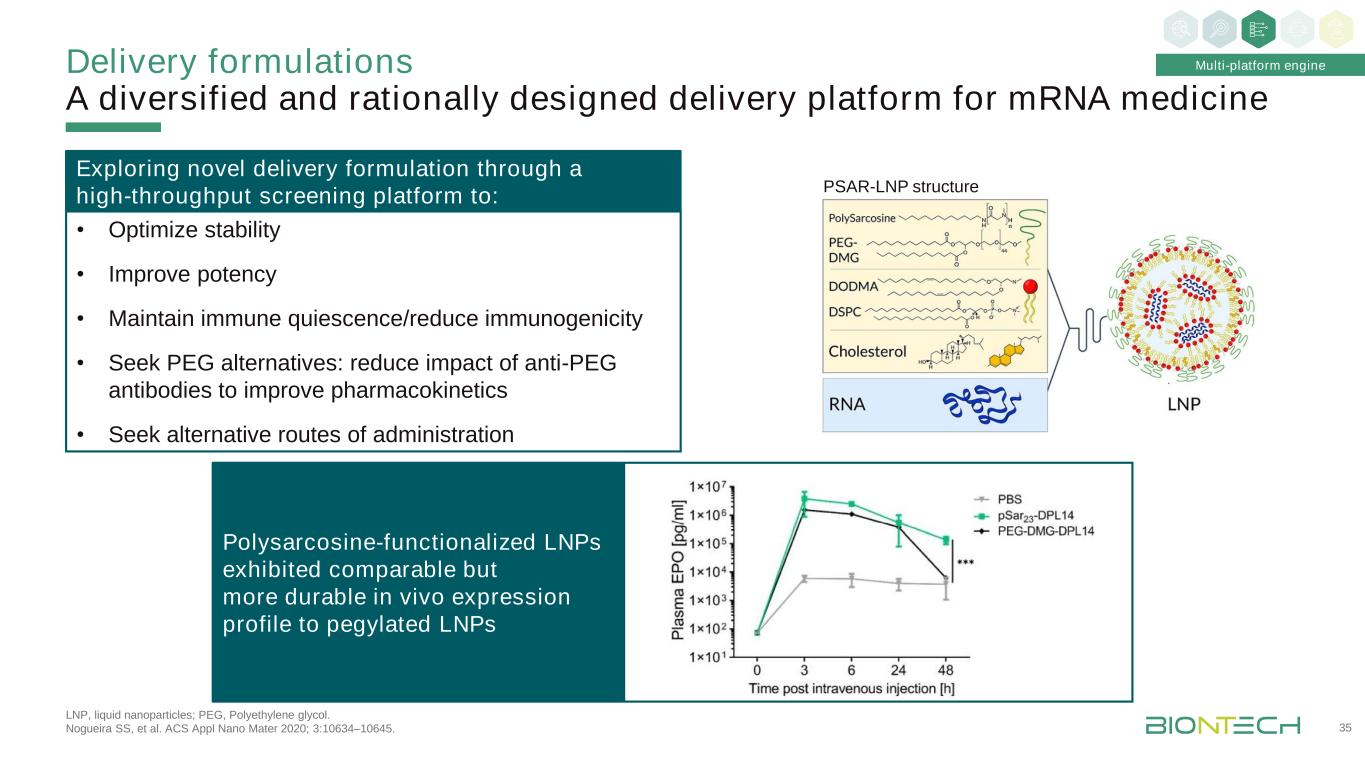
·优化稳定性·提高效力·保持免疫静止/降低免疫原性·寻求聚乙二醇类替代品:减少抗聚乙二醇类抗体的影响以改善药代动力学·寻求替代给药途径:LNP,液体纳米粒;聚乙二醇类。Nogueira SS等人。美国应用纳米材料2020年;3:10634-10645。递送配方用于信使核糖核酸药物的多样化和合理设计的递送平台35多平台引擎通过高通量筛选平台探索新的递送配方以:Psar-LNP结构多肌氨酸功能化的LNPs显示出与聚乙二醇化的LNPs相似但更持久的体内表达谱
聚焦五大创新支柱深入理解免疫系统多平台创新引擎制造与自动化目标发现与表征Digital&AI/ML 36 Digital&AI/ML

BioNTech的AI&ML应用37新抗原预测新冠肺炎变异监测和预测数字化&AI/ML 1 2
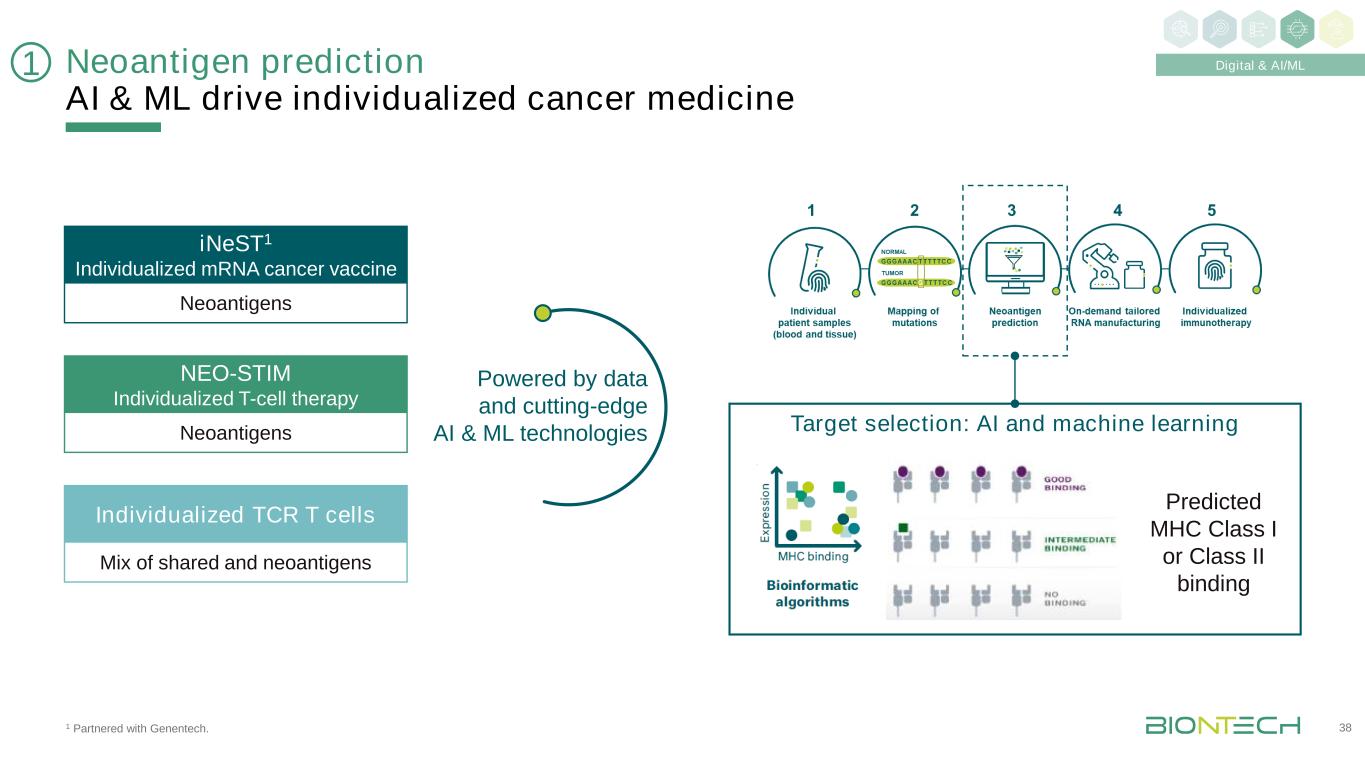
1与基因泰克合作。新抗原预测AI&ML驱动个体化癌症药物38 1新抗原iNeST1个体化信使核糖核酸癌症疫苗新抗原NEO-STIM个体化T细胞疗法共享和新抗原的混合个体化TCR T细胞由数据和尖端AI&ML技术驱动目标选择:AI和机器学习预测MHC I类或II类结合数字和AI/ML

1 TüreciÖ,et al.NAT Bimed Eng 2018;2:566-569;2 Sahin U.AACR 2022年会;口头陈述;3 McGranahan N等人。Science 2016;351:1463-1469;4 Gejman RS等人。ELife 2018;7:e41090;5段F等人。J Exp Med 2014;211:2231-2248;6 Balachandran副总裁等人。《自然》2017;551:512-516;7亚达夫·M等人。《自然》2014;515:572-576;8 Kreiter S等人。《自然》2015;520:692-696;9 Abelin JG等人。豁免权2017;46:315-326。新抗原预测我们如何识别、预测和表征新抗原?39细胞毒性T细胞对癌症相关突变的识别1参考?与免疫原性相关的生物学与肿瘤细胞识别相关的生物学·突变的类型(SNV、Indel、Fusion.)2·突变的克隆性(克隆、亚克隆)3、4·突变位置(锚定、非锚定、TCR可及性)5-7·突变的转录本表达水平8、9·与外来抗原的相似性/缺乏自相似性2·多肽/人类白细胞抗原结合强度(亲和力、失重率)2数字和AI/ML1
Yadav M等人。《自然》2014;515:572-576。新抗原预测个体化靶点:并非所有新抗原都是等同的40个外显子变异外显子编码变异转录本编码变异预测新表位光谱鉴定新表位预测免疫原性新表位验证免疫原性新表位T细胞会识别突变的多肽吗?突变是否在肿瘤中表达,而在正常组织中不表达?突变的多肽会出现在抗原提呈细胞表面吗?突变是克隆的吗?目标排名#1目标排名#2…靶点排名#20独特的患者肿瘤胚系WES体细胞突变ID在恶性组织上的表达表位预测人类白细胞抗原分型量化突变表位特征排名免疫原性新抗原选择过程排名候选肿瘤新抗原1数字和AI/ML
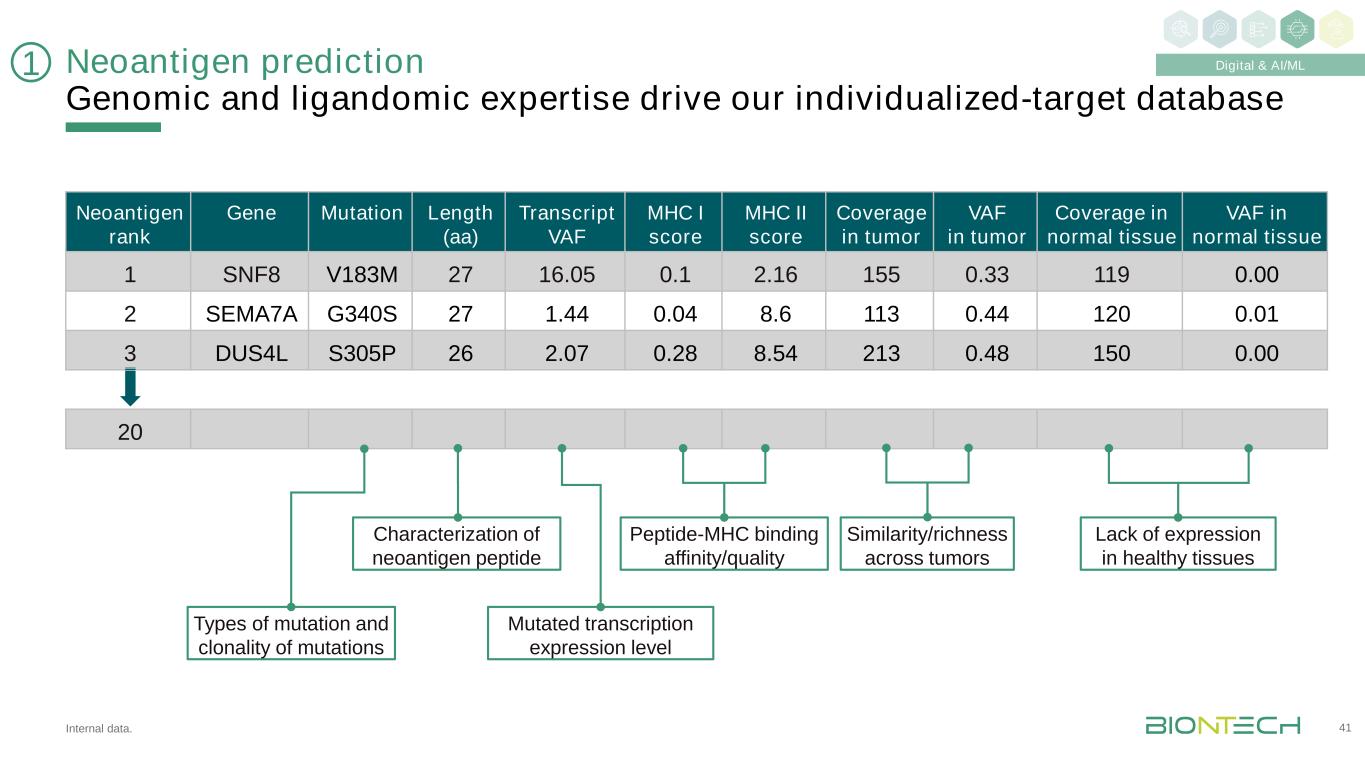
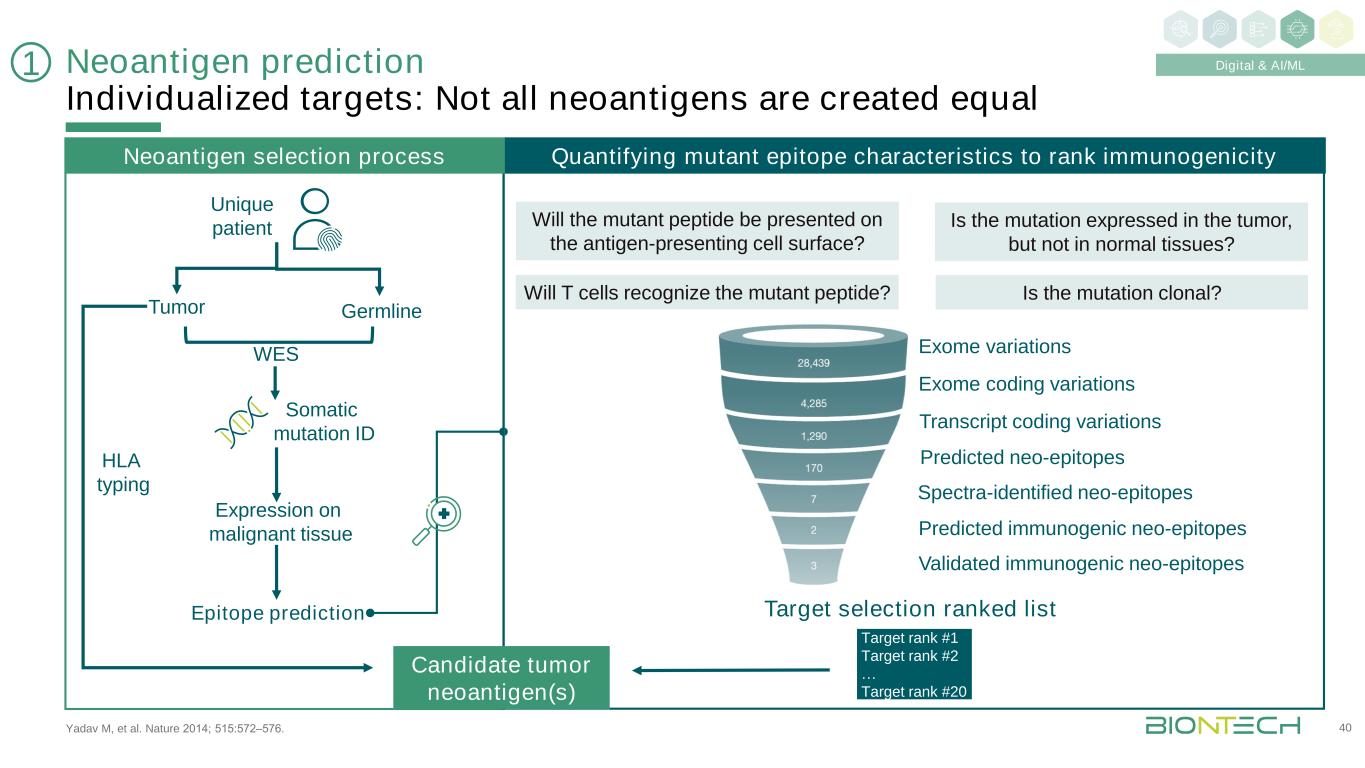
内部数据。新抗原预测基因组和配子学专业知识推动我们的个性化靶标数据库41新抗原等级基因突变长度(AA)转录本VAF MHC I评分MHC II评分肿瘤VAF覆盖正常组织1 SNF8 V183M 27 16.05 0.1 2.16 155 0.33 119 0.00 2 SEMA7A G340S 27 1.0.04 8.6 113 0.44 120 0.01 3 DUS4L S305P 26 2.07 0.28 8.54 213 0.48 150 0.00 20种突变和克隆性突变转录表达水平表征新抗原肽-MHC的结合亲和力/质量相似性/丰富度跨肿瘤缺乏在健康组织中表达1数字和AI/ML
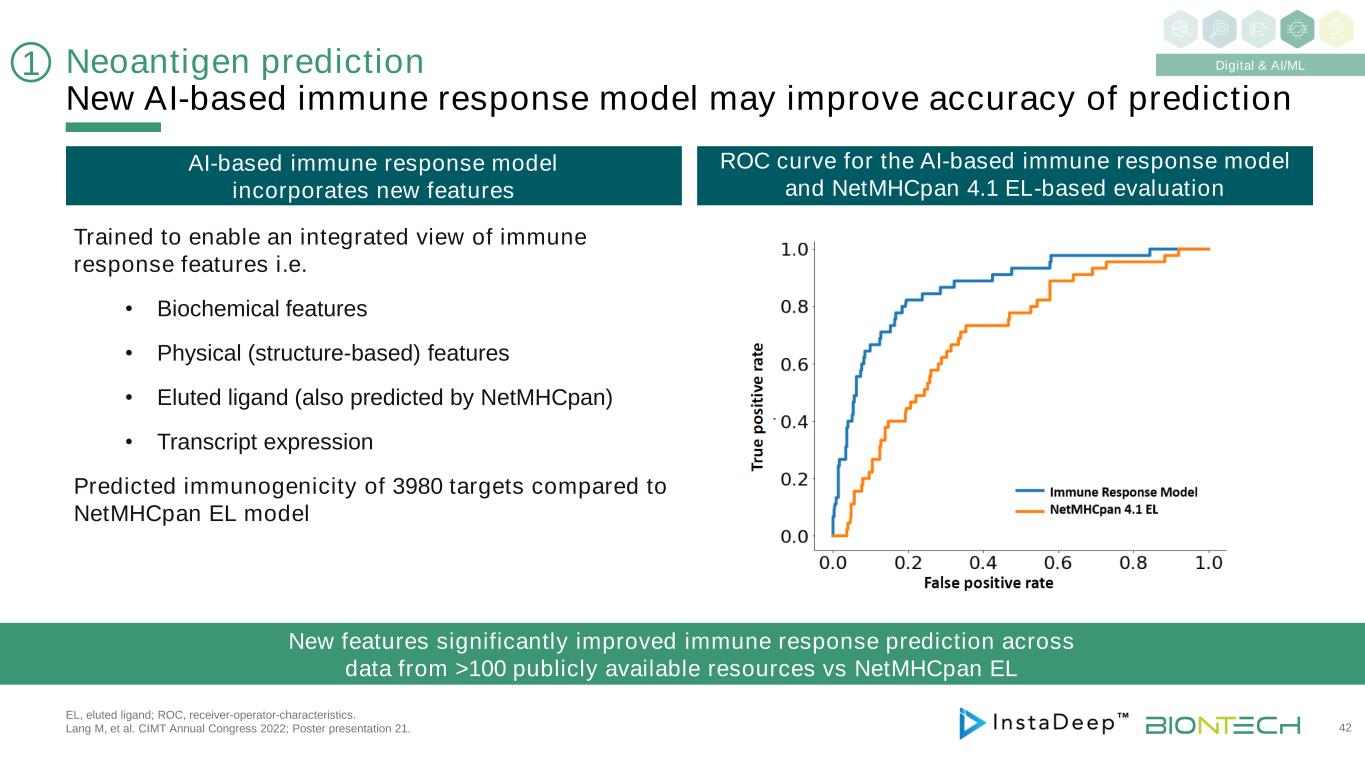
新抗原预测新的基于AI的免疫反应模型可能提高预测EL的准确性;洗脱的配体;ROC,接受者-操作者-特性。Lang M等人的研究成果。CIMT 2022年年会;海报展示21。42 1经过数字和AI/ML培训,以实现免疫反应特征的集成视图,即·生化特征·物理(基于结构)特征·洗脱配体(也由NetMHCpanEL预测)·与NetMHCpanEL模型相比,转录表达预测3980个目标的免疫原性新功能显著改进了对来自100多个公开资源的数据的免疫反应预测VS NetMHCpanEL基于AI的免疫反应模型纳入了新功能ROC曲线用于基于AI的免疫反应模型和NetMHCpan4.1基于EL的评估

新冠肺炎变异的监测和预测在检测到新变异的时间上减少了~2个月1人工智能合作的BioNTech和InstaDeep。紧急警报系统。Bguir K,et al.BioRxiv 2021年;DOI:10.1101/2021.12.24.474095。43高危SARS-CoV-2变种的早期计算检测1支持新冠肺炎疫苗的快速适应以对抗新的威胁,在响应时间上节省数月2表位改变分数通过抗体检测和中和ACE2结合蛋白免疫逃逸分数感染性分数感染性分数Pareto分数嵌入空间语义变化距离野生型对数语言模型增长速度元数据(序列+实验数据)预测概率的似然和(序列+实验数据)结构建模机器学习建模EWS分数Spike Protein ACE2SARS-CoV-2病毒按世界卫生组织名称标记随时间变化的变异案例累计(以对数标度表示)数字AI/ML
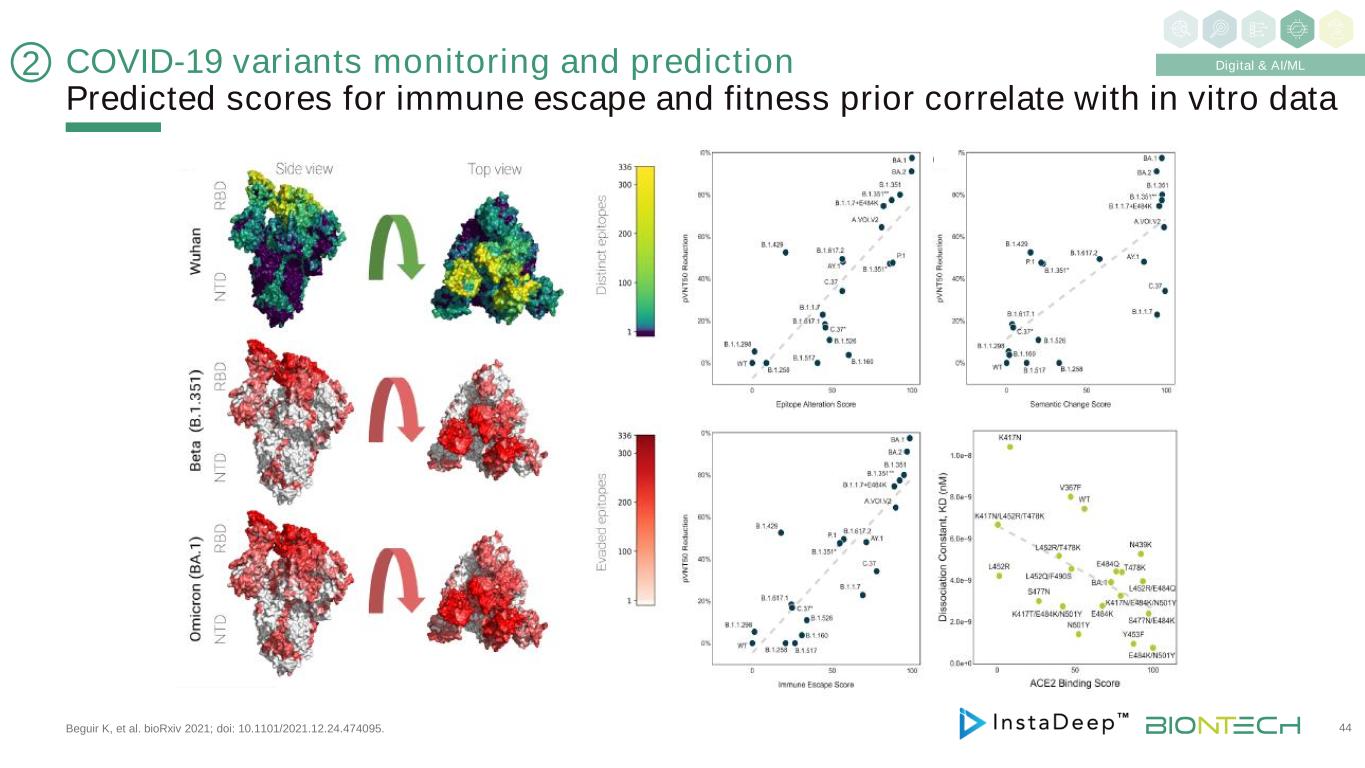
新冠肺炎变异监测和预测的免疫逃逸和健康先验预测分数与体外数据相关,Bguir K等人。BioRxiv 2021年;DOI:10.1101/2021.12.24.474095。44 2数字和AI/ML
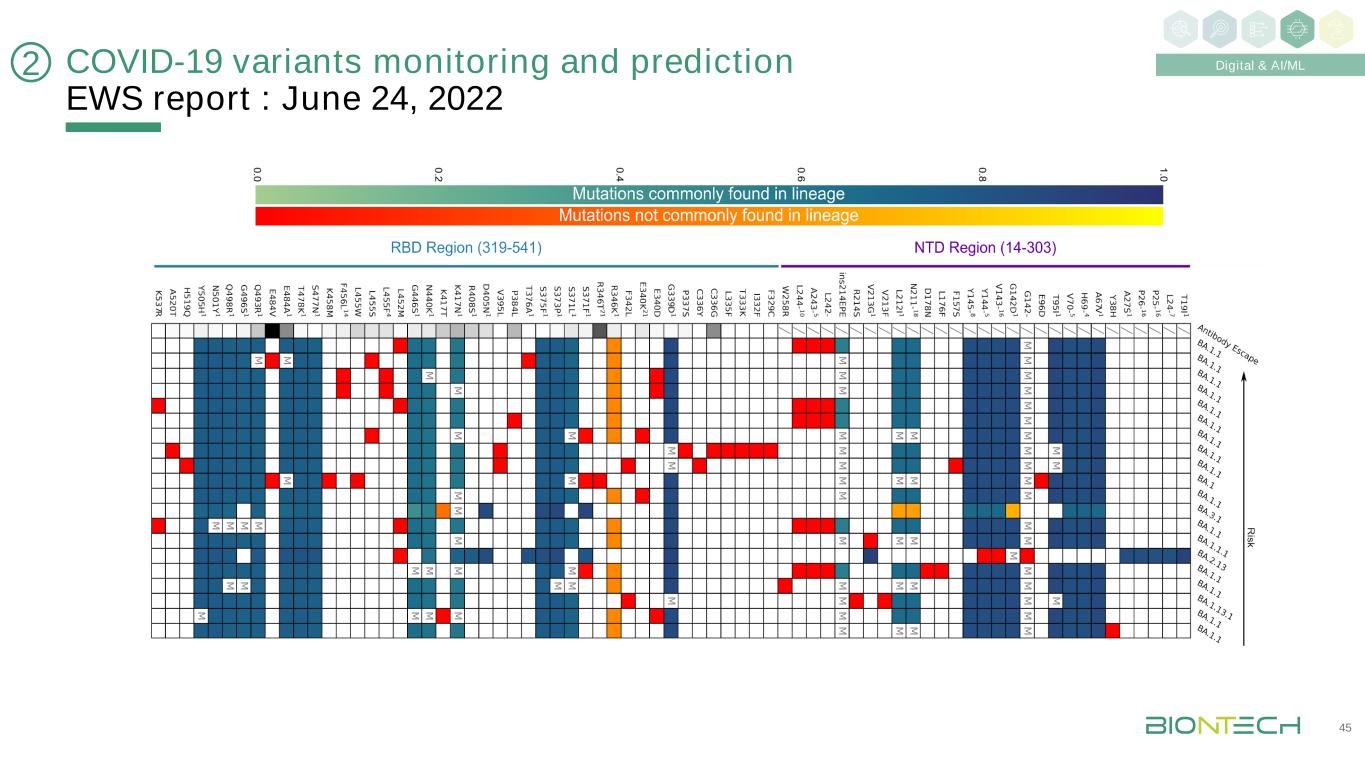
新冠肺炎变异监测和预测预警报告:2022年6月24日45数字化&人工智能/ML2
聚焦五大创新支柱深入理解免疫系统多平台创新引擎制造与自动化目标发现与表征数字化与AI/ML 46制造与自动化

制造业和自动化
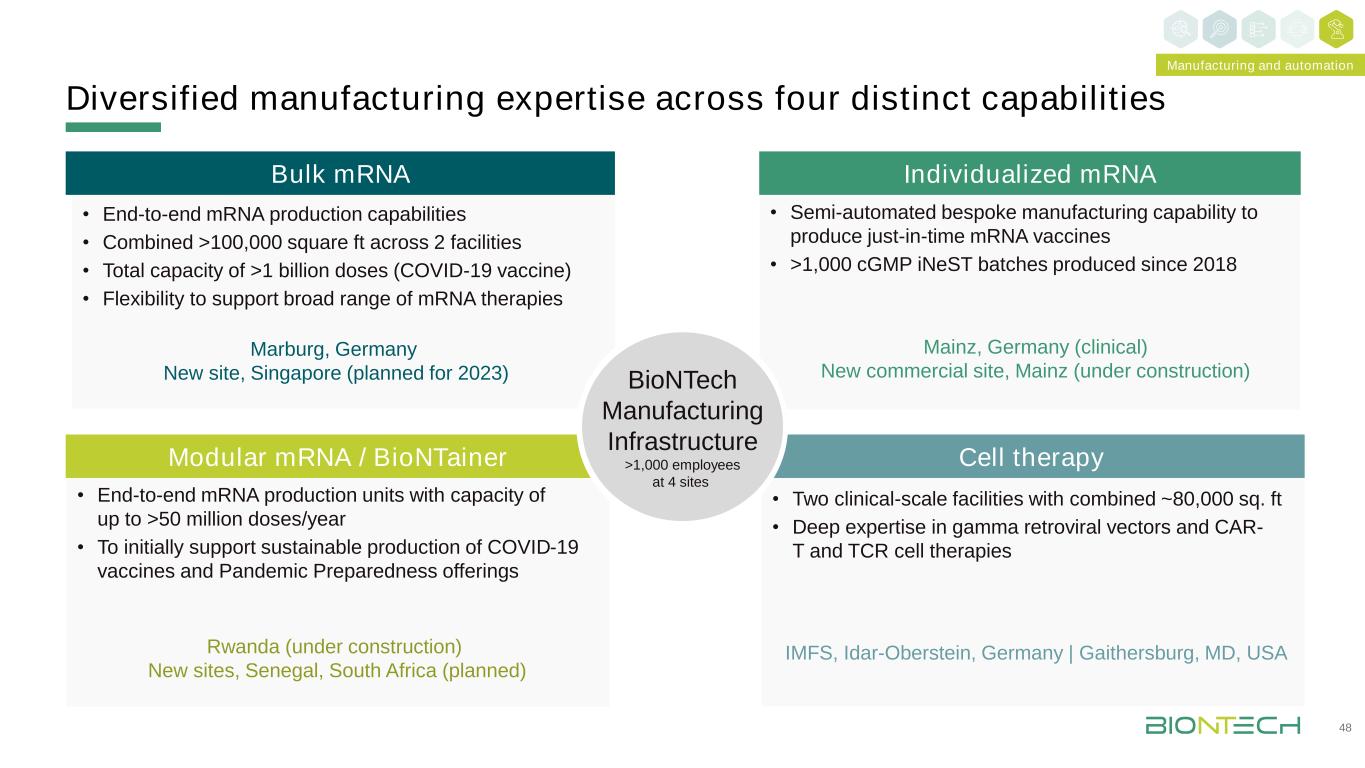
四个不同能力的多样化制造专业技能48·端到端信使核糖核酸生产能力·2个设施合计超过100,000平方英尺·总产能>10亿剂(新冠肺炎疫苗)·灵活地支持各种信使核糖核酸疗法大宗信使信使能·半自动定制制造能力,以生产即时信使核糖核酸疫苗·>1,000 cGMP iNeST自2018年以来生产的批次个体化信使核糖核酸·端到端信使核糖核酸生产能力高达>5,000万剂/年·最初支持新冠肺炎疫苗和大流行防范产品的可持续生产模块化信使核糖核酸/BioNTainer·两个临床规模的设施,合并约80,000平方英尺。《金融时报》·伽玛逆转录病毒载体和CAR-T及TCR细胞疗法的深厚专业知识德国马尔堡细胞疗法,新加坡(计划2023年)德国美因茨(临床)新商业网站,美因茨(在建)卢旺达(在建)新网站,塞内加尔,南非(计划)IMF,德国|盖瑟斯堡,马里兰州,美国制造和自动化BioNTech制造基础设施在4个网站超过1,000名员工
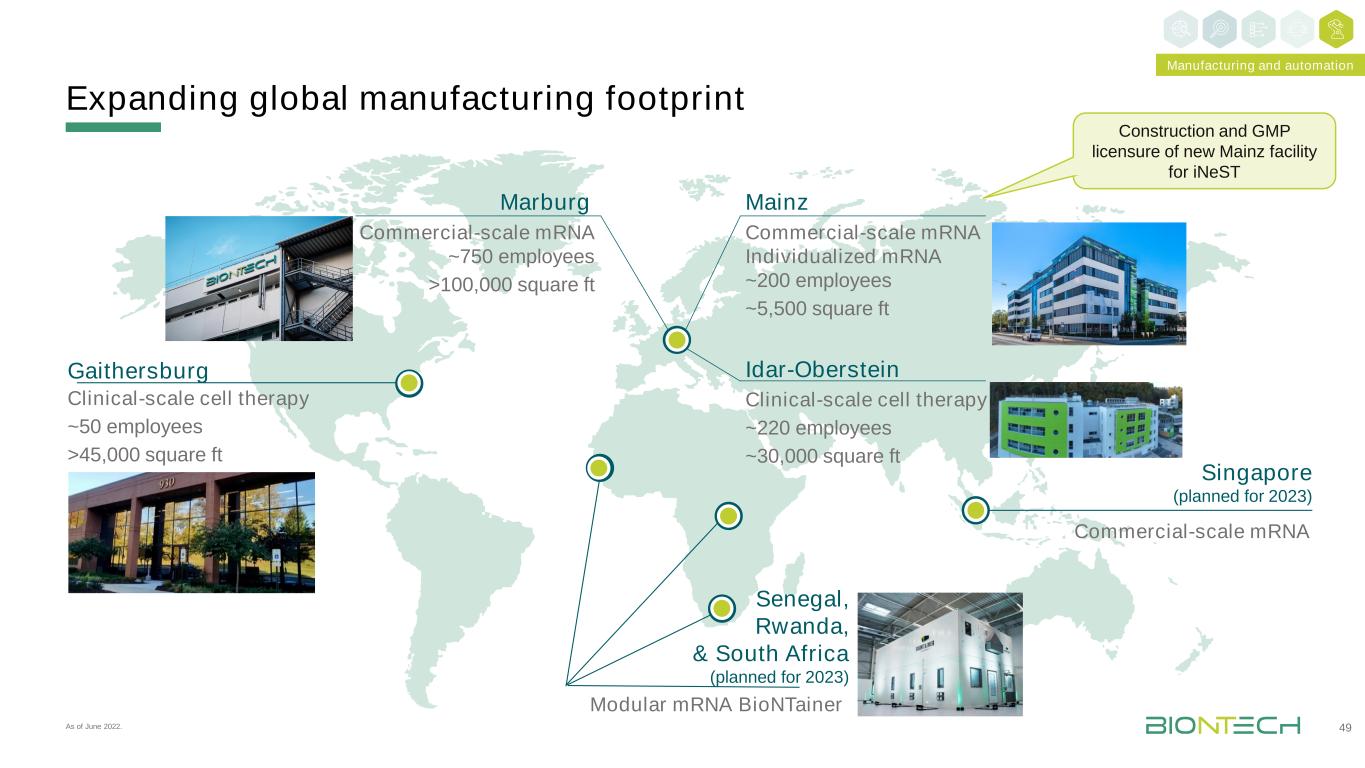
扩大全球制造规模49盖瑟斯堡临床规模细胞疗法~50名员工>45,000平方英尺模块化mRNA生物信息网塞内加尔、卢旺达和南非(计划于2023年)新加坡(计划2023年)商业规模mRNA Idar-Oberstein MainzMarburg商业规模mRNA个性化mRNA~200名员工~5,500平方英尺临床规模细胞疗法~220名员工~30,000平方英尺商业规模mRNA~750名员工>100,000平方英尺建造和GMP许可证截至2022年6月,为iNeST制造和自动化提供新的Mainz工厂

扩大信使核糖核酸生产通过数字化和自动化实现50批次的规模和能力扩展2022年年度临床患者批次能力1,000>10,000计划能力2020年末马尔堡大宗信使核糖核酸批次规模350克1.4公斤2020年初制造和自动化1克2011年10

扩大基因批次:Marburg 51 BioNTainer开发中心于2020年以不到1亿欧元的价格从诺华公司收购>2021年第二季度以来生产的15亿剂新冠肺炎疫苗>100,000平方英尺和8套改装生产套件,在收购、制造和自动化后6个月内生产基因疫苗
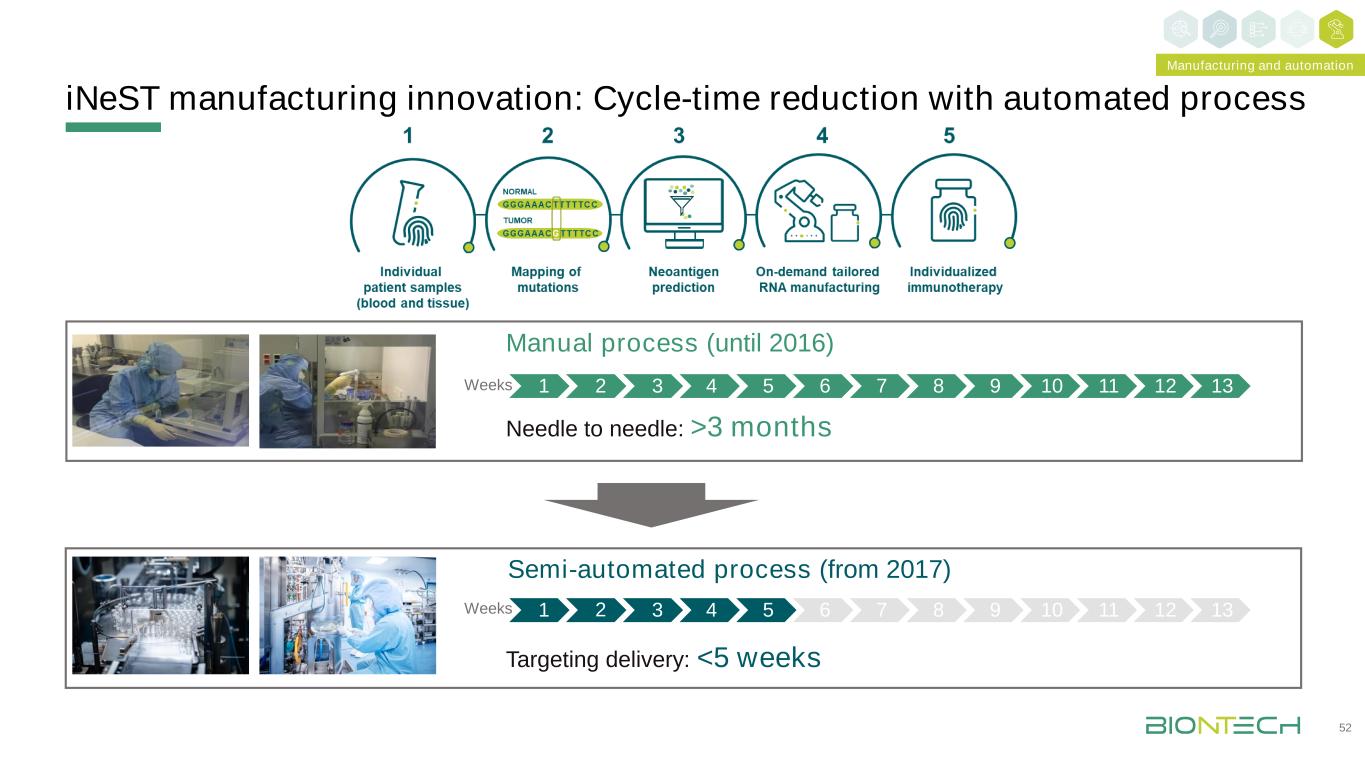
1 2 3 4 5 6 7 8 9 10 11 12 13目标交付:3个月手动流程(至2016年)半自动流程(自2017年起)周制造和自动化

我们正在投资全球cGMP细胞治疗基础设施53个IMF,德国伊达尔-奥伯斯坦(全资拥有)全天候运营模式减少步骤和时间复杂性提高效率自动化方法的优势制造过程的重复性释放产能更快的周转时间每个患者先进的计划算法需要网站BioNTech,盖瑟斯堡,马里兰州,美国(长期租赁)制造和自动化的新图片

BIONTainer:本地化和可持续的信使核糖核酸生产的平台54挑战建立信使核糖核酸的GMP生产的解决方案是复杂的,需要克服多个层面的挑战交钥匙方案,包括模块化生产单元、符合GMP的设置和人员培训制造和自动化

BioNTainers:2022年的下一步是什么55在卢旺达的第一个BioNTainer制造工厂破土动工55第一个BioNTainer预计将发货(YE 2022)监管框架符合国际和当地标准评估全球BioNTainer的其他用例和产品最终确定非洲联盟制造和自动化新设施的规划和初始资产
聚焦五大创新支柱使合成医学进入新时代对免疫系统的深刻理解多平台创新引擎制造和自动化目标发现和表征数字化&AI/ML 56
聚焦五大创新支柱推动合成医学进入新时代对免疫系统的深入理解多平台创新引擎制造和自动化目标发现和表征数字化&AI/ML 57
多平台创新引擎58 TCR治疗CAR-T实体瘤CAR-T细胞感染性疾病疫苗预防治疗现成的信使核糖核酸癌症疫苗FixVac RiboMabs信使核糖核酸编码的多特异性抗体癌症疫苗iNeST核细胞因子信使核糖核酸编码的细胞因子CARVac信使核糖核酸疫苗扩增的CAR-T细胞核糖核酸精确抗菌药物(已合成)四种药物平台结合平台个体化新抗原T细胞疗法信使核糖核酸编码的体液(新药)个体化的TCR细胞和基因疗法下一代免疫调节剂双特异性抗体靶向癌症治疗TLR-7选择性激动剂小分子通过扩展平台和新组合扩大治疗宇宙

传染病的新前沿传染病的新前沿

在新冠肺炎疫苗领导地位的基础上应对全球挑战60推进信使核糖核酸疫苗、核糖核酸疫苗、核糖核酸疫苗和核糖核酸疫苗的广泛工具包下一代新冠肺炎疫苗的多样化流水线提供针对高需求传染病的突破有能力精确地解决多样化和难以靶向的病原体新疫苗的推出和临床试验预计将于2022年下半年开始
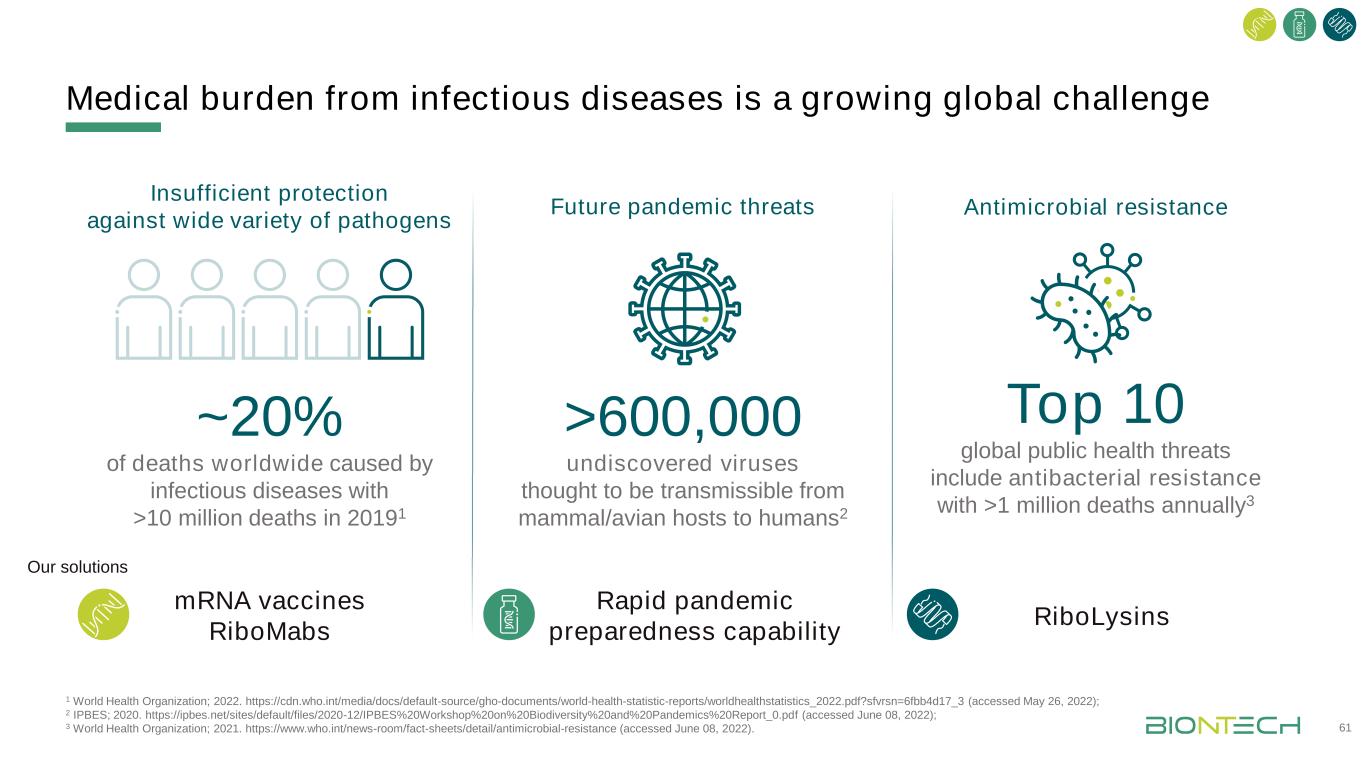
传染病造成的医疗负担是一个日益严重的全球性挑战,1世界卫生组织,2022年。Https://cdn.who.int/media/docs/default-source/gho-documents/world-health-statistic-reports/worldhealthstatistics_2022.pdf?sfvrsn=6fbb4d17_3(2022年5月26日访问);2个IPBES;2020年。Https://ipbes.net/sites/default/files/2020-12/IPBES%20Workshop%20on%20Biodiversity%20and%20Pandemics%20Report_0.pdf(2022年6月8日访问);3世界卫生组织;2021年。Https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance(2022年6月8日访问)。全球61%~20%的人死于传染病20191全球10大公共卫生威胁包括抗菌素抗药性每年有100多万人死亡3未来大流行威胁对多种病原体的保护不足抗菌素抗药性>600,000种被认为可从哺乳动物/禽类宿主传染给人类的未发现病毒2核糖核酸疫苗RiboMabs快速大流行预防能力RiboLysins我们的解决方案

新冠肺炎疫苗验证了我们的信使核糖核酸技术,并为未来信使信使核糖核酸产品62信使核糖核酸的ID 10个月开发时间剂量截至202234亿10亿接种者安全数据库铺平了道路

BioNTech和辉瑞在传染病领域的全球mRNA合作计划FIH,这是人类首例。63新冠肺炎公司:计划于2022年下半年推出全球领先的特许经营变异适应疫苗计划2022年下半年推出单剂四价mna疫苗第一阶段数据更新预计2022年带状疱疹疫苗潜在的一流基于信使核糖核酸的带状疱疹疫苗具有重磅炸弹潜力FIH第一阶段试验2H 2022mRNAfor ID建立在传染病疫苗快速临床开发和成功全球商业化的记录+

截至2022年3月,1被批准为预防新冠肺炎的2剂系列疫苗,适用于16岁及以上的个人;2 2剂系列的紧急使用许可,适用于5-15岁的个人;3剂系列的紧急使用许可,适用于6个月至4岁的儿童;2该疫苗被指定为主动免疫,以预防5岁及以上的个人预防SARS-CoV-2病毒引起的新冠肺炎。为下一阶段新冠肺炎大流行做好准备64个关键驱动者大流行准备。FDA批准用于儿科的EUA(6个月至175个国家和地区
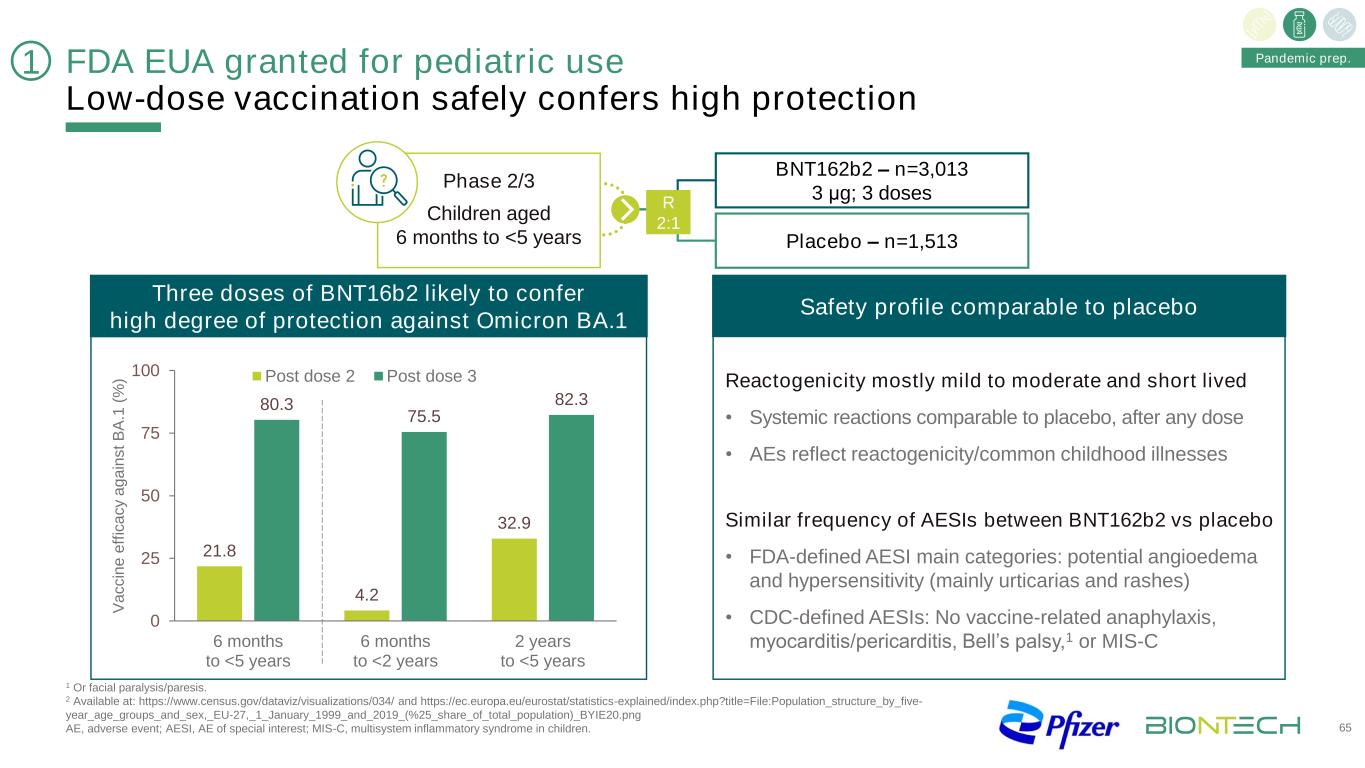
FDA批准用于儿童的EUA低剂量疫苗安全地提供高保护65三剂BNT16b2可能对奥密克戎BA.1 21.8 4.2 32.9 80.3 75.5 82.3 0 25 50 75 100 6个月提供高度保护
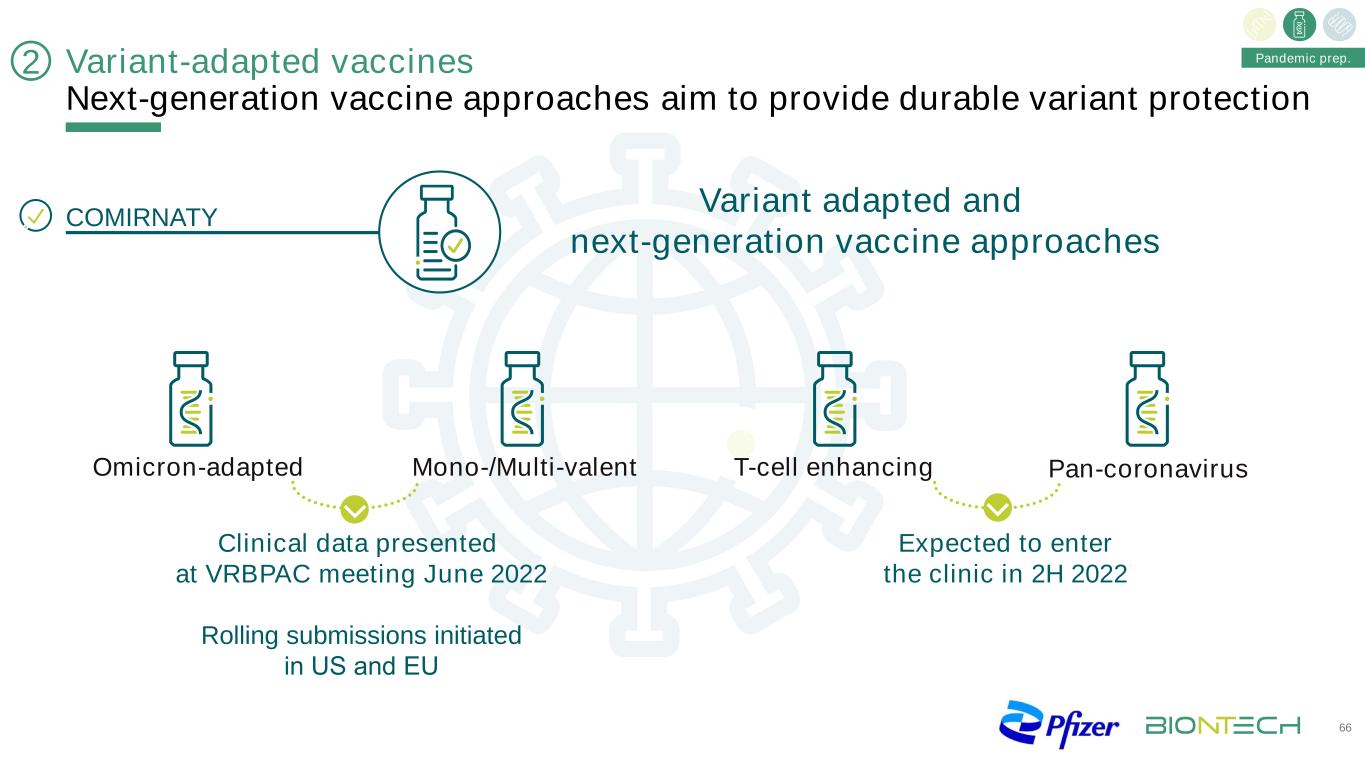
变异适应疫苗下一代疫苗方法旨在提供持久的变异保护66奥密克戎适应的单价/多价T细胞增强型泛冠状病毒变异适应和下一代疫苗方法在VRBPAC会议上提交的临床数据2022年6月在美国和欧盟发起的滚动提交预计将在2022年下半年大流行准备进入临床2
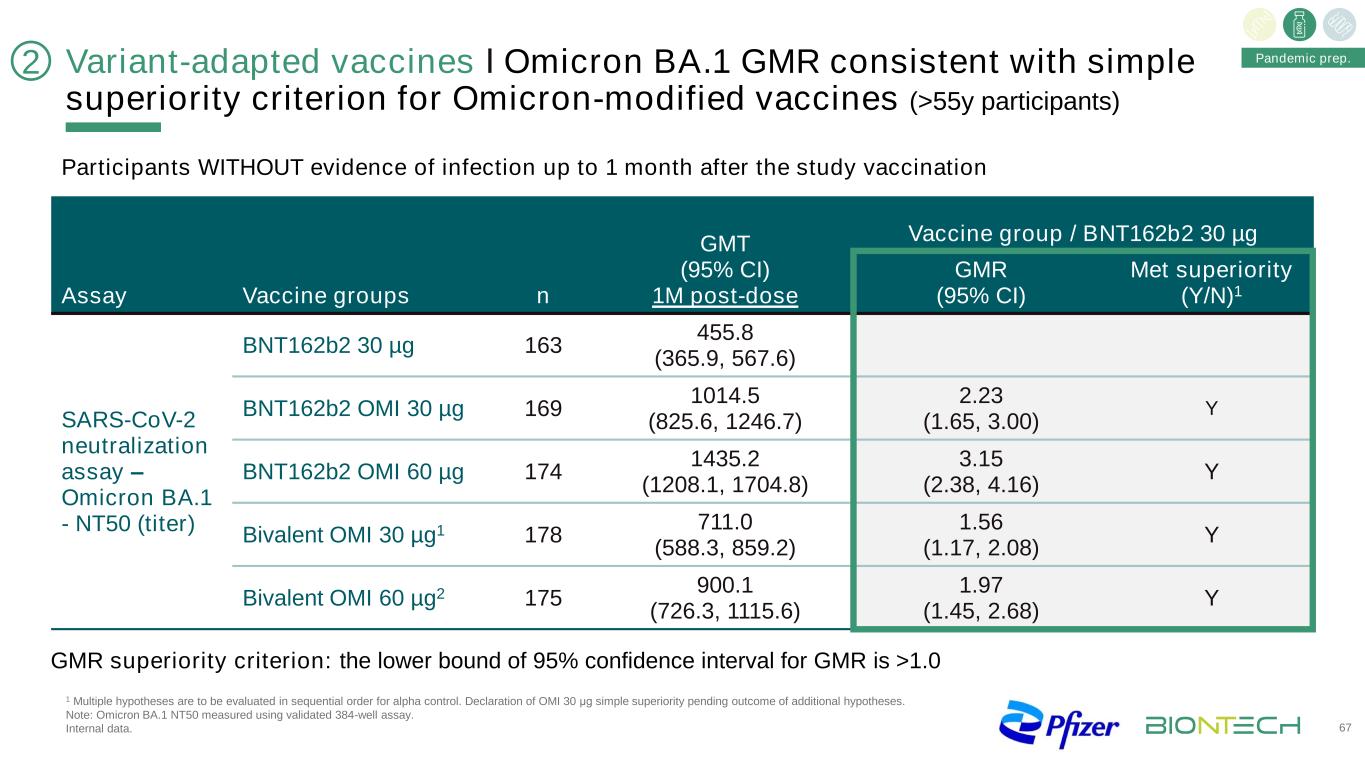
GMR优势标准:GMR的95%可信区间下限为>1.0变异适应疫苗І奥密克戎BA.1 GMR与奥密克戎修饰疫苗(>55y参与者)67大流行准备的简单优势标准一致。在研究接种后1个月内无感染证据的参与者GMT(95%CI)1M剂量后疫苗组/BNT162b2 30微克检测疫苗组n GMR(95%CI)蛋氨酸优势(Y/N)1 SARS-CoV-2中和试验-奥密克戎BA1-NT50(效价)BNT162b2 30微克163 455.8(365.9,567.6)BNT162b2 OMI 30微克169 1014.5(825.6,1246.7)2.23(1.65,3.00)Y BNT162b2 OMI 60微克174 1435.2(1208.1,1704.8)3.15(2.38,4.16)Y双价OMI 30微米G1178 711.0(588.3,859.2)1.56(1.17,2.08)Y双价OMI 60微米G2 175 900.1(726.3,1115.6)1.97(1.45,2.68)Y21多重假设将按顺序进行阿尔法对照评估。宣布OMI 30μg简单优势有待额外假设的结果。注:奥密克戎BA.1 NT50采用验证的384孔试纸条测定。内部数据。
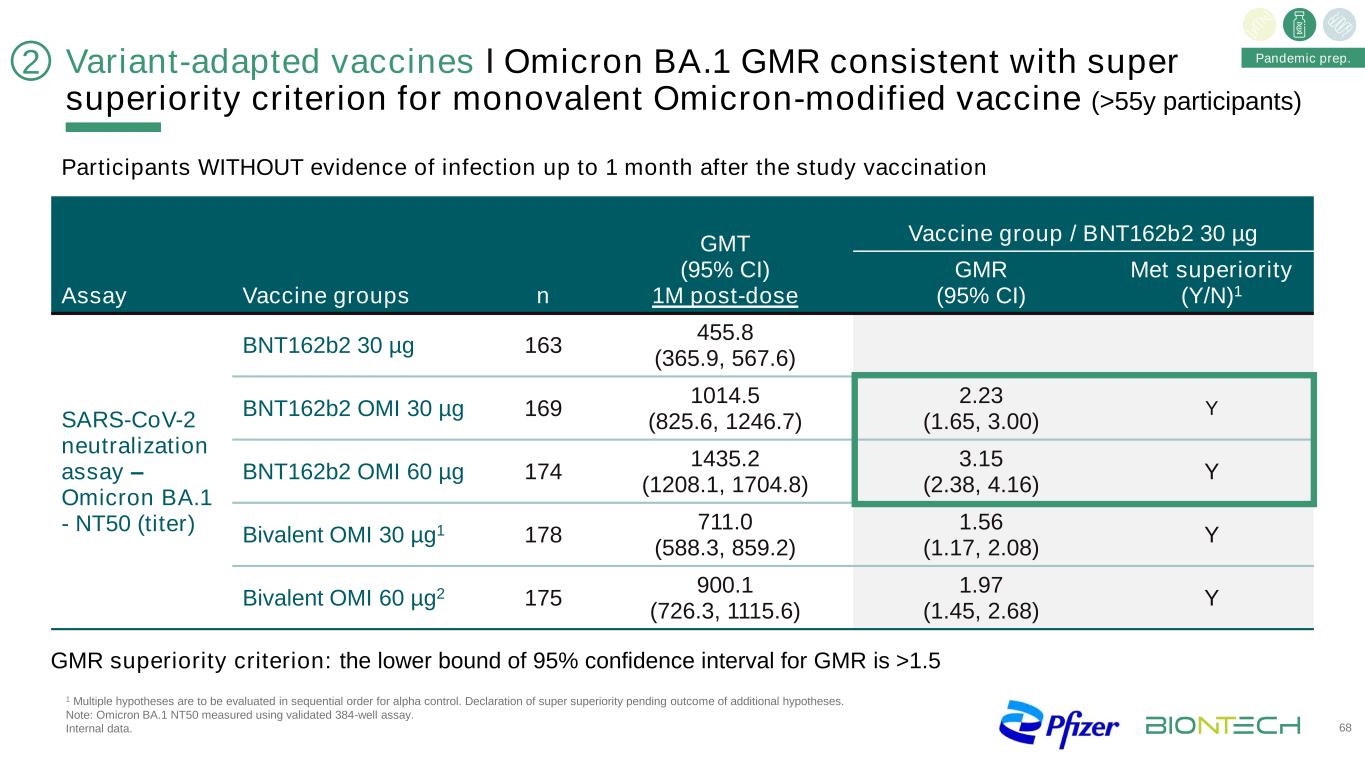
变种适应疫苗І奥密克戎BA.1 GMR符合单价奥密克戎修饰疫苗的超级优势标准(>55y参与者)68大流行准备。在研究接种后1个月内无感染证据的参与者GMT(95%CI)1M剂量后疫苗组/BNT162b2 30微克检测疫苗组n GMR(95%CI)蛋氨酸优势(Y/N)1 SARS-CoV-2中和试验-奥密克戎BA1-NT50(效价)BNT162b2 30微克163 455.8(365.9,567.6)BNT162b2 OMI 30微克169 1014.5(825.6,1246.7)2.23(1.65,3.00)Y BNT162b2 OMI 60微克174 1435.2(1208.1,1704.8)3.15(2.38,4.16)Y二价OMI30µG1178 711.0(588.3,859.2)1.56(1.17,2.08)Y二价OMI60µG2175 900.1(726.3,1115.6)1.97(1.45,2.68)Y巨磁电阻优势标准:巨磁电阻的95%可信区间下限>1.521阿尔法对照的多重假设将按顺序进行评估。宣布超级优势,等待额外假设的结果。注:奥密克戎BA.1 NT50采用验证的384孔试纸条测定。内部数据。
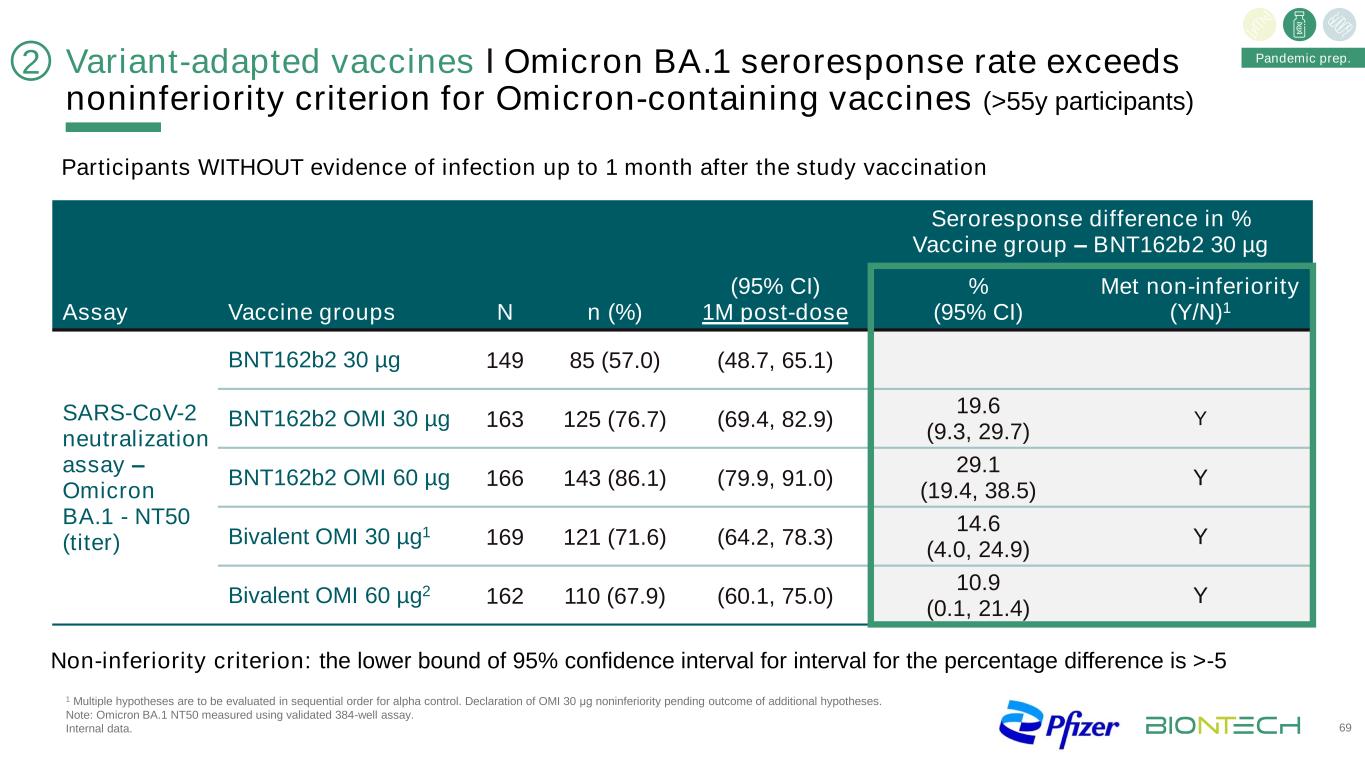
变种适应疫苗І奥密克戎BA1血清响应率超过含奥密克戎疫苗(>55岁参与者)的非劣质标准69大流行准备。研究接种后1个月内无感染证据的参与者%疫苗组1M剂量后血清反应差异-BNT162b2 30微克%(95%CI)满足非劣势(Y/N)1检测疫苗组N SARS-CoV-2中和试验-奥密克戎BA1-NT50(滴度)BNT162b2 30微克149 85(57.0)(48.7,65.1)BNT162b2 OMI 30微克163 125(76.7)(69.4,82.9)19.6(9.3,29.7)Y BNT162b2 OMI 60微克166 143(86.1)(79.9,91.0)29.1(19.4,38.5)Y二价OMI 30微米G1 169 121(71.6)(64.2,78.3)14.6(4.0,24.9)Y二价OMI 60微米G2 110(67.9)(60.1,75.0)10.9(0.1,21.4)Y非劣性标准:百分比差异区间的95%可信区间下限>-5 2 1多个假设应按顺序进行阿尔法对照评估。宣布OMI 30μg非劣势,等待额外假设的结果。注:奥密克戎BA.1 NT50采用验证的384孔试纸条测定。内部数据。
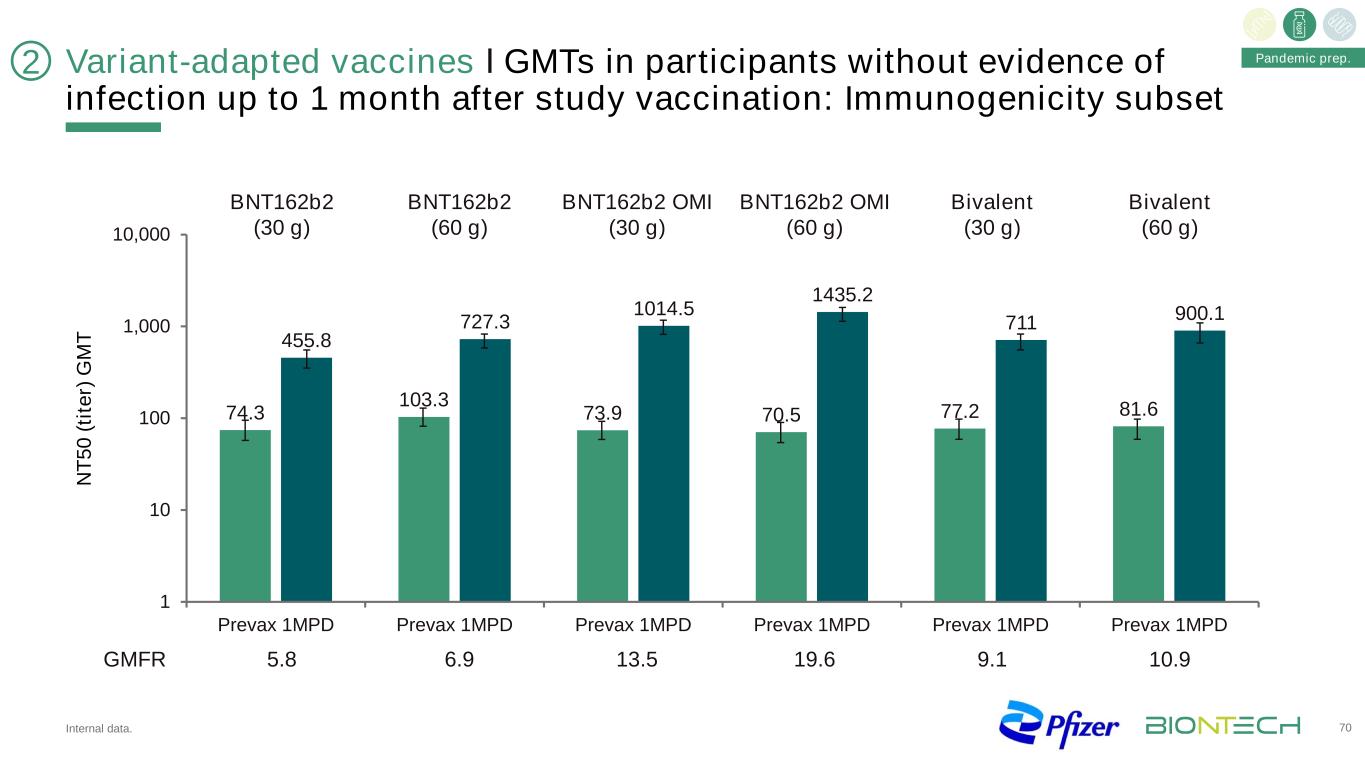
变种适应疫苗在研究接种后1个月内无感染证据的参与者中的ІGMT:免疫原性亚集N T 50(Tite R)G M T大流行准备。BNT162b2(30克)BNT162b2(60克)BNT162b2 OMI(30克)BNT162b2 OMI(60克)二价(30克)二价(60克)149 163 163 169 163 169 166 169 178 162 175 5.8 6.9 13.6 9.1 10.9GMFR 74.3 103.3 73.9 70.5 77.2 81.6 727.3 1014.5 1435.2 711 900.1 1 10 10 100 1,000 Prevax 1MPD 70 2内部数据。

变种适应疫苗І变种疫苗的反应性概况总体上类似于原型BNT162b2疫苗大流行准备。年龄18−55岁的参与者·单价奥密克戎修饰疫苗(30微克)显示出与原型疫苗(30微克)相似的局部反应和全身事件特征·年龄>55岁的参与者(30微克)显示出与原型疫苗相似的局部反应和全身事件特征·60微克剂量水平:与30微克71 2内部数据相比,轻度至中度注射部位疼痛、疲劳和肌肉疼痛更常见。

变种适应疫苗奥密克戎含修饰变种疫苗摘要72大流行准备。奥密克戎疫苗的中和反应符合监管标准:·GMR简单优势,血清反应非劣势(单价和双价疫苗)·GMR(单价疫苗)“超级”优势变异疫苗的反应性图谱与原型BNT162b2疫苗内部数据总体相似。2.
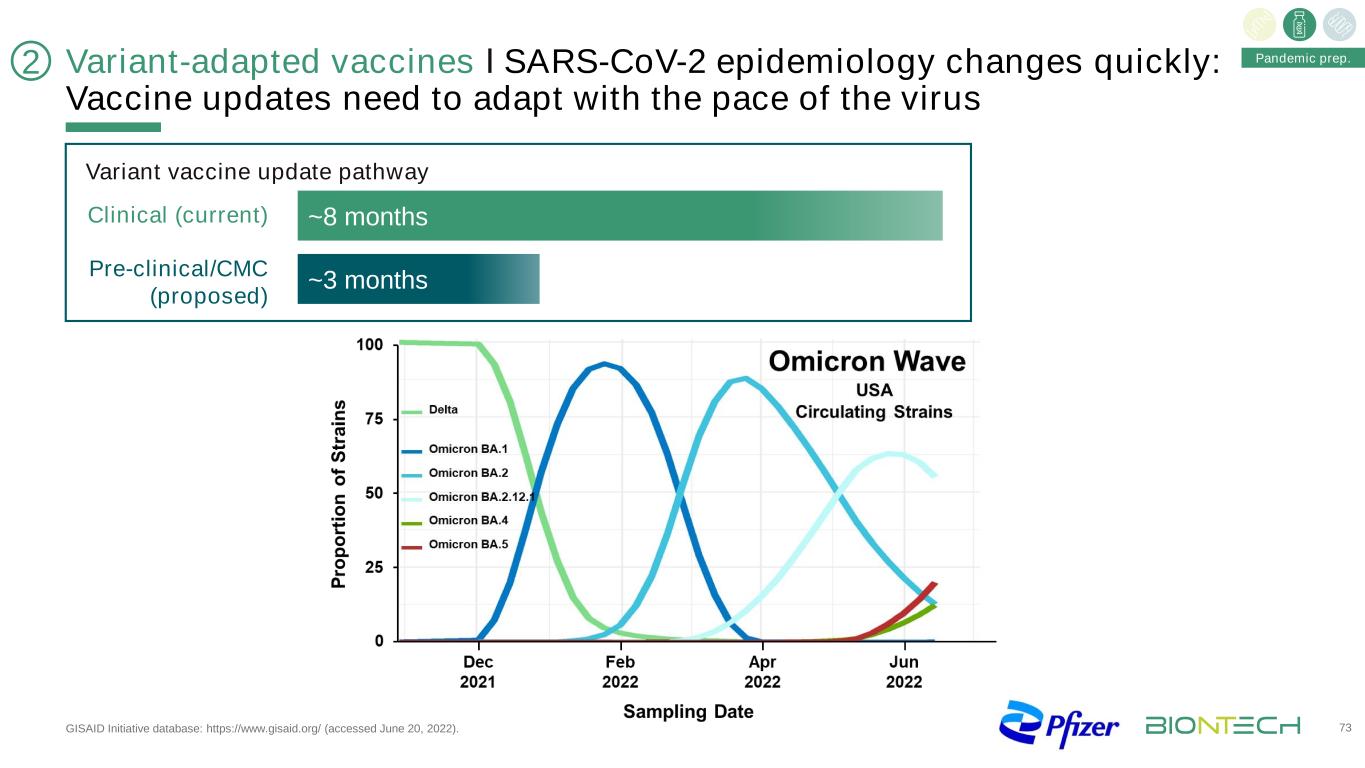
变种适应疫苗ІSARS-CoV-2流行病学变化迅速:疫苗更新需要适应病毒大流行准备的步伐。GISAID倡议数据库:https://www.gisaid.org/(2022年6月20日访问)。~8个月~3个月临床前(当前)临床前/CMC(建议)变异疫苗更新途径73 2
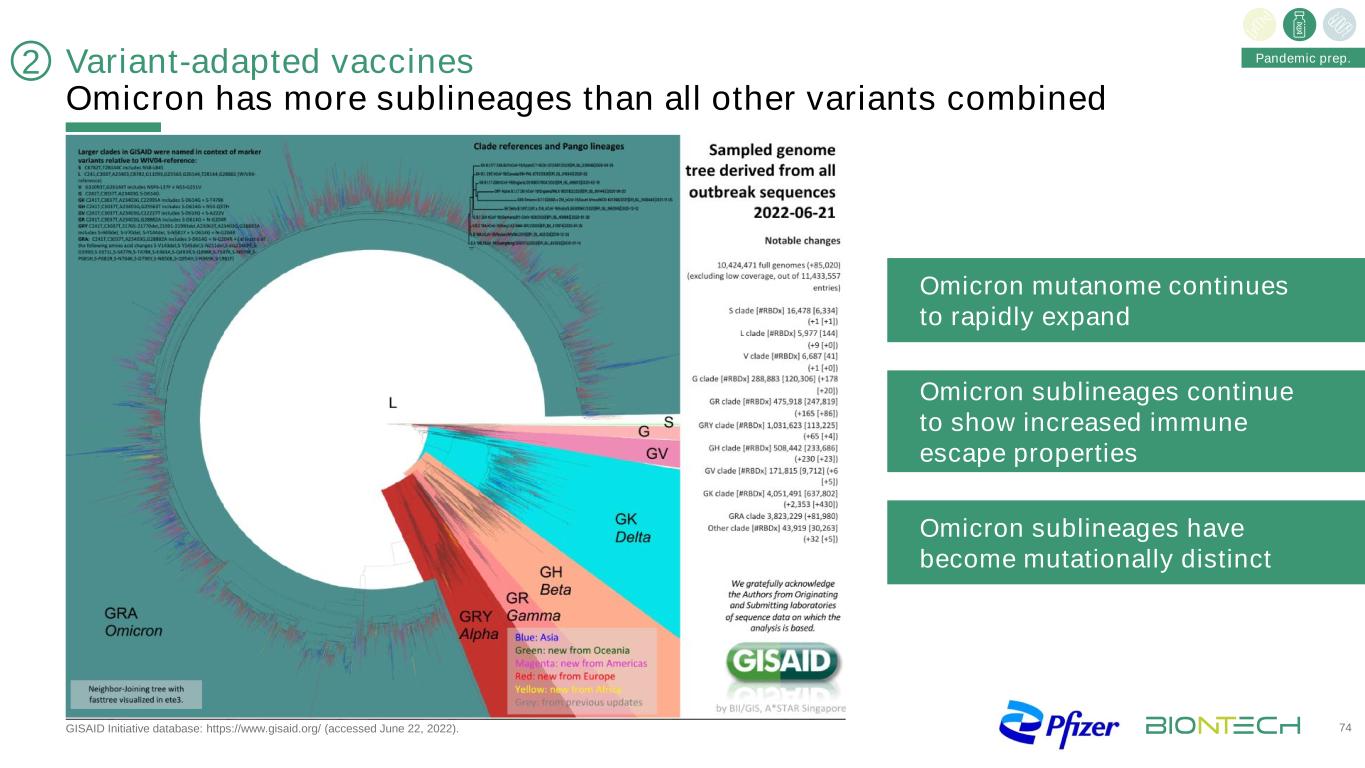
变种适应疫苗奥密克戎的亚系比所有其他变种的总和更多,GISAID倡议数据库:https://www.gisaid.org/(2022年6月22日访问)。74奥密克戎突变组继续迅速扩大奥密克戎亚系继续表现出增强的免疫逃逸特性奥密克戎亚系已成为突变明显的大流行准备2
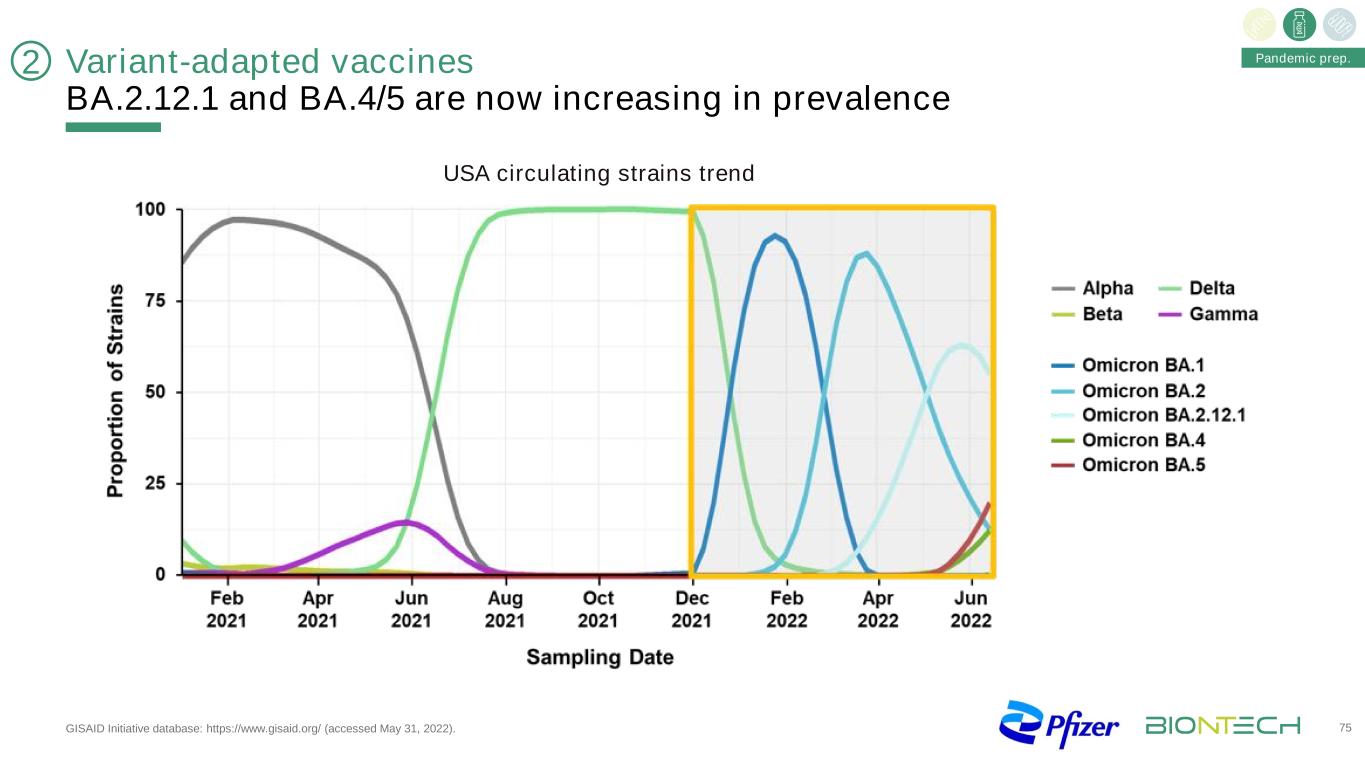
变种适应疫苗BA.2.12.1和BA.4/5现在在GISAID倡议数据库中的流行率正在增加:https://www.gisaid.org/(2022年5月31日访问)。75大流行准备2美国流行毒株趋势
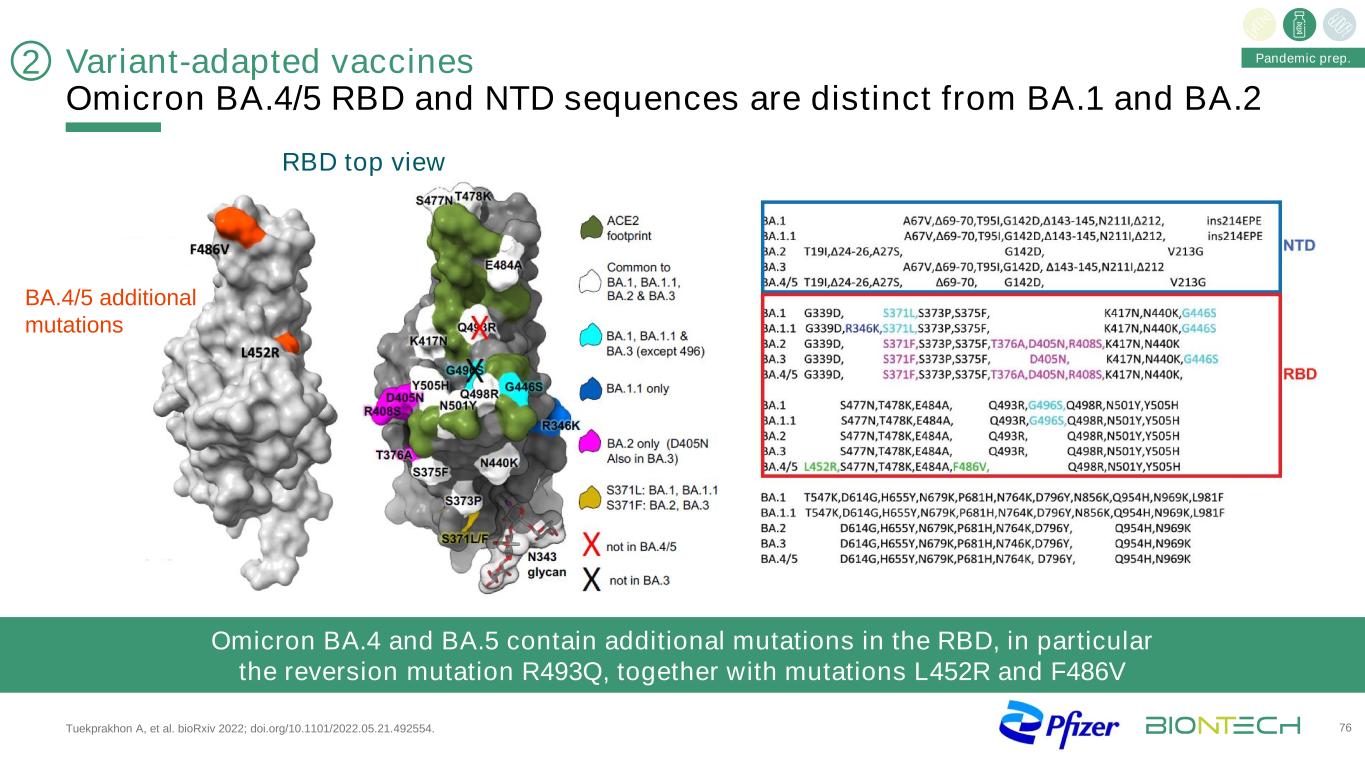
变种适应疫苗奥密克戎BA.4/5RBD和NTD序列不同于BA.1和BA2,TuekPrakhon A等人。BioRxiv 2022;doi.org/10.1101/2022.05.21.492554。76奥密克戎BA.4和BA.5含有额外的RBD突变,特别是回复突变R493Q,以及不属于BA.4/5大流行的突变L452R和F486V。2 BA.4/5其他突变RBD顶视图
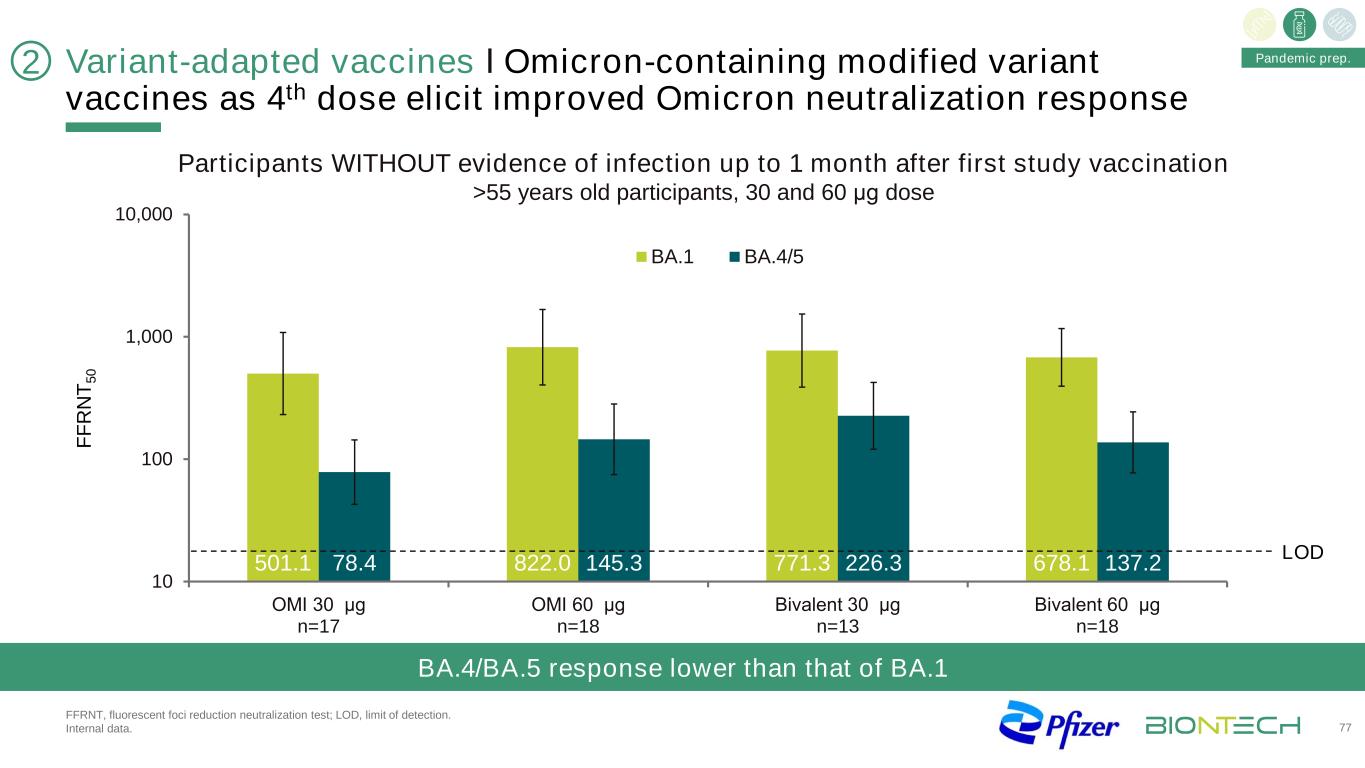
F F R N T 5 0 501.1 822.0 771.3 678.178.4 145.3 226.3 137.2 10 100 1,000 10,000 OMI 30μg n=17 OMI 60μg n=18二价30μg n=13二价60μg n=18 BA 1.1 BA.4/5 LOD变异疫苗І奥密克戎第4剂含修饰变异疫苗可诱导增强的奥密克戎中和反应,荧光灶减少中和试验;检出限。内部数据。BA.4/BA.5的反应低于BA.1大流行准备。首次研究后1个月内无感染证据的参与者>55岁的参与者,30和60μg剂量77 2
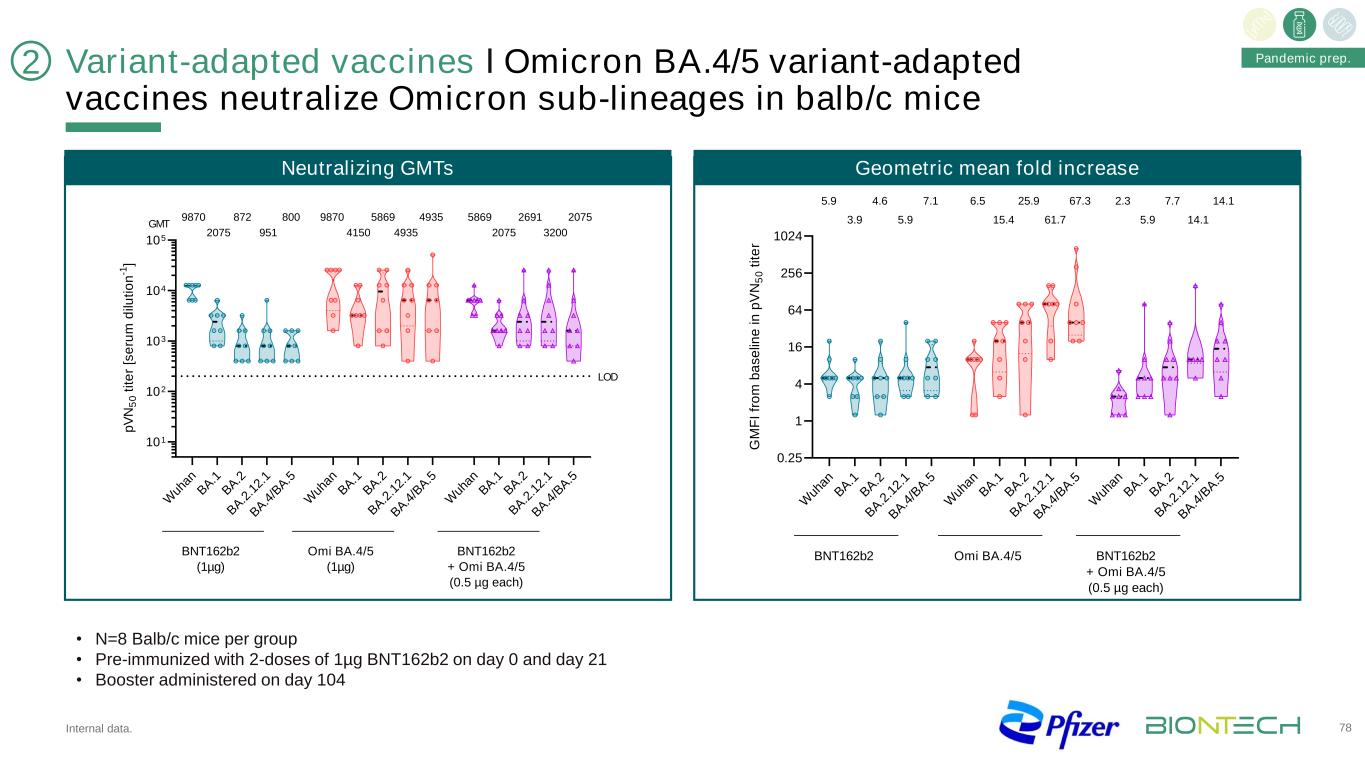
变种适应疫苗І奥密克戎BA.4/5变种适应疫苗中和BALB/c小鼠奥密克戎亚系内部数据。78·N=每组8只Balb/c小鼠·第0天和第21天用1微克BNT162b2预免疫·第104天接种BA.1 BA.2 BA.2 2.1 BA4/BA.5WUANBA.1 BA.2 BA.2 1.2 1BA4/BA.5WUAAN BA.1 BA.2 2.1BA.1 BA.2 BA.2 2.1BA.4/BA.50.25 1 4 16 64 256 1024 G M F i fr o m b a s e lin e i n p V N 5 0 t it e r 5.9 3.9 4.6 5.9 7.1 6.5 15.4 25.9 61.7 67.3 2.3 5.9 7.7 14.1 14.1 BNT162b2 Omi BA.4/5 BNT162b2+Omi BA.4/5(各0.5微克)W Uh an B A.1 B A.2 B A.2 2.1 BA.4/B A.5 W an B A.1 B A.2 B A.2 1 B A.1 B A.4/B A.5 W an B A.1 B A.2 B A.2 2.1 B A.4/B A.5 101 102 103 104 p V N 5 0 t it e r[S e ru m d ilu ti on n-1] BNT162b2 (1µg) Omi BA.4/5 (1µg) BNT162b2 + Omi BA.4/5 (0.5 µg each) 9870 2075 872 951 800 9870 4150 5869 4935 4935 5869 2075 2691 3200 2075 GMT LOD Neutralizing GMTs Geometric mean fold increase 2 Pandemic prep.
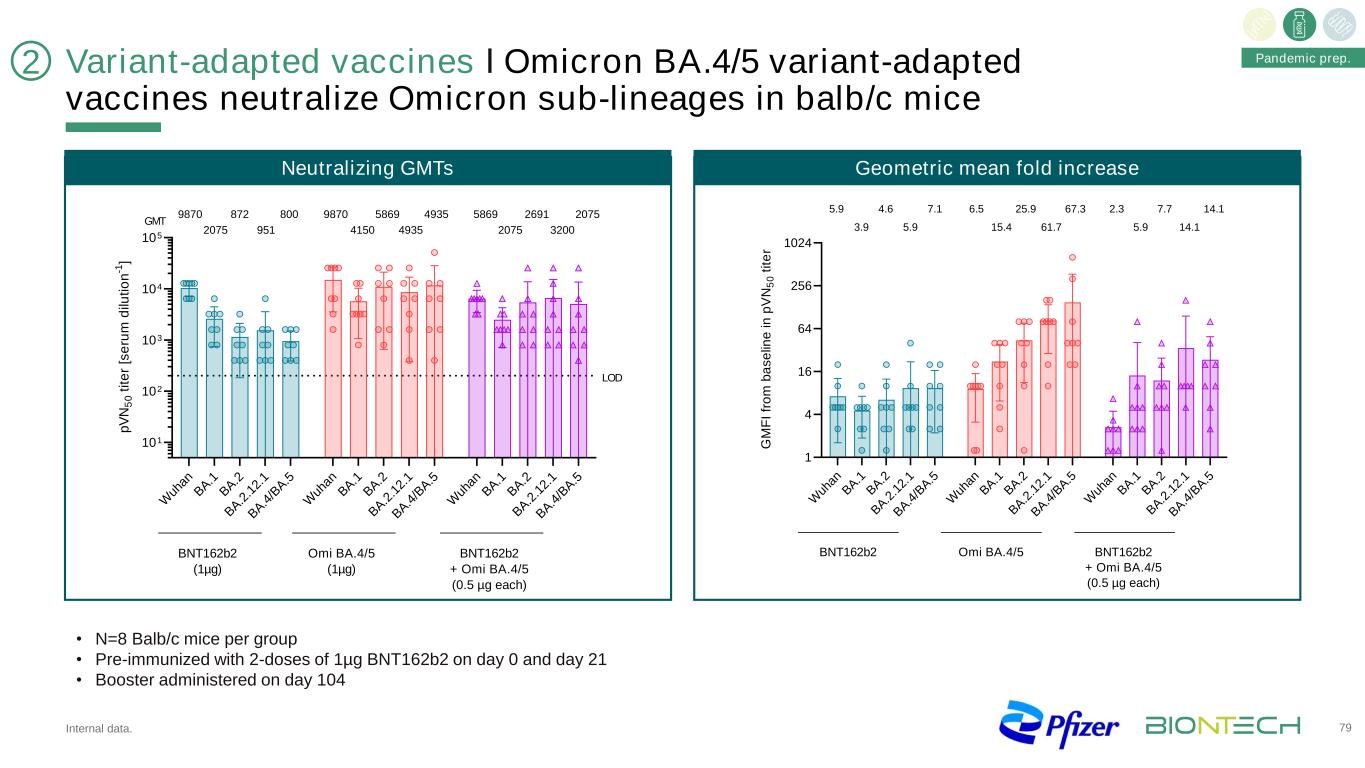
变种适应疫苗І奥密克戎BA.4/5变种适应疫苗中和BALB/c小鼠奥密克戎亚系内部数据。79·N=每组8只Balb/c小鼠·第0天和第21天两剂1微克BNT162b2预先免疫·第104天免疫,中和GMT几何平均倍数增加W Un An B A.1 B A.2 B A.2 2.1 B A.4/B A.5W Un An B A.1 B A.2 B A.2 2.1 B A.4/B A.5 W Uh An B A.1 B A.2 B A.2 2.1 B A 4/B A.5 101 102 103 104 105 p V N 50 t it e r[S e ru m d ilu ti on n-1] BNT162b2 (1µg) Omi BA.4/5 (1µg) BNT162b2 + Omi BA.4/5 (0.5 µg each) 9870 2075 872 951 800 9870 4150 5869 4935 4935 5869 2075 2691 3200 2075 GMT LOD W uh an B A .1 B A .2 B A .2 .1 2. 1 B A .4 /B A .5 W uh an B A .1 B A .2 B A .2 .1 2. 1 B A .4 /B A .5 W uh an B A .1 B A .2 B A .2 .1 2. 1 B A .4 /B A .5 1 4 16 64 256 1024 G M F I fr o m b a s e lin e i n p V N 5 0 t it e r 5.9 3.9 4.6 5.9 7.1 6.5 15.4 25.9 61.7 67.3 2.3 5.9 7.7 14.1 14.1 BNT162b2 Omi BA.4/5 BNT162b2 + Omi BA.4/5 (0.5 µg each) 2 Pandemic prep.

变异适应疫苗І奥密克戎BA 4/5变异适应疫苗增加奥密克戎亚系/武汉参考Balb/c小鼠内部数据中pVN50滴度比率。80 W Un B A.1 B A.2 B A.2 2.1 B A.4/B A.5 0.1 1 R a ti o o f v a ri a n t/W u h a n r e F.p V N 50 t it e r BNT162b2 Omi BA.4/5几何平均比率O m I B A.1 O m I B A.2 O m I B A 2.1 2.1 O m I B A.4/B A.5 0.21 0.090.10 0.08 0.42 0.59 0.50 0.35 0.46 0.55 0.35b2+Omi BA.4/5交叉中和分析·N=每组8只Balb/c小鼠·在第0天和第21天用2剂1微克BNT162b2预先免疫·在第104天大流行准备时加强免疫。

变种适应疫苗科学驱动的准备战略81大流行准备2正在与监管机构讨论,以确定最合适的途径,以利用当前的经验,并确保未来可以提供变种适应疫苗,以及时应对新出现的变种/亚系·多个其他变种适应疫苗的丰富临床经验-一致的安全性和免疫原性特征·稳健的制造过程-只需最少的改变即可为新的变种/亚系引入更新的抗原序列·截至目前,COMIRNAY的安全性特征良好-广泛的上市后暴露和密切的监测-在儿科人群中没有发现新的重要安全问题以及加强计划

大流行防备未来大流行防备的综合、多方面模型82应对准备现场测试实验室测试风险预测(人工智能驱动)用于部署大流行准备的制造规划。我们的目标:实现我们疫苗在全球范围内的端到端制造和交付,同时确保未来五年的生产质量3:储备和保持制造能力,每年生产至少8000万剂基于mRNA的疫苗,以应对2022年4月与德国联邦卫生部签订的大流行预防合同

疟疾、结核病和艾滋病毒仍然是流行的艾滋病毒,人类免疫缺陷病毒;世卫组织,世界卫生组织。世界卫生组织概况介绍。Https://www.who.int/news-room/fact-sheets(2022年6月9日访问)。2020年世界卫生组织非洲区域83~2.29亿例病例2020年世界卫生组织非洲区域60.1万例死亡(80%为儿童
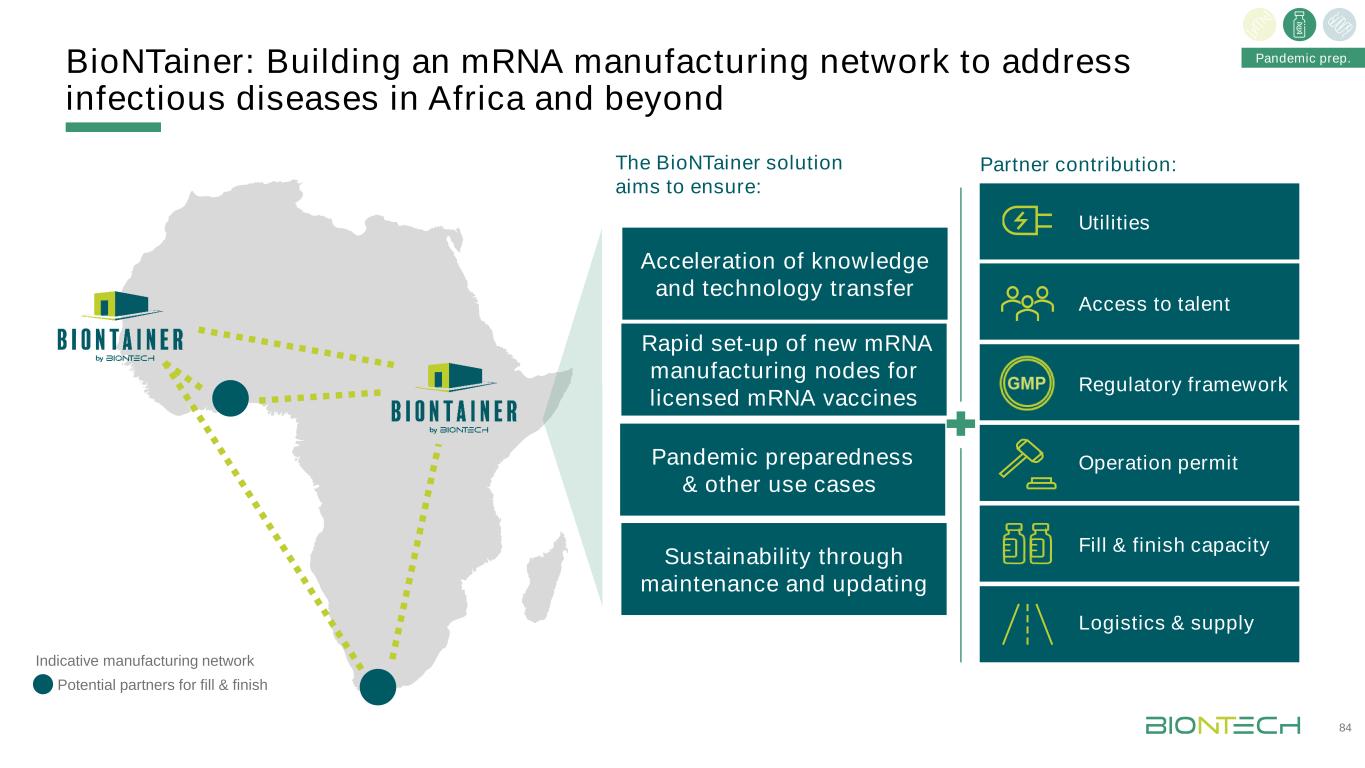
BioNTainer:建立一个信使核糖核酸制造网络,以应对非洲及84年以后的传染病。BioNTainer解决方案旨在确保:合作伙伴贡献:指示性的制造网络潜在的合作伙伴填补和完成大流行预防和其他使用案例的可持续性通过维护和更新,加速知识和技术转让快速建立新的信使制造节点,以获得许可的信使核糖核酸疫苗运作许可物流和供应公用事业获得人才填补和完成能力监管框架大流行准备。

迫切需要下一代精密抗菌剂1抗菌素耐药性协作者。《柳叶刀》2022;399:629-655;2 O‘Neill J.Wellcome Collection。2014年归属;可在:https://wellcomecollection.org/works/rdpck35v(2022年6月6日访问)上查阅。85抗菌药可防止多达1,000万人死于抗菌素耐药性20501通过有效的抗菌剂保护现代医学1,2改善1.5亿慢性和严重细菌感染患者的护理标准1
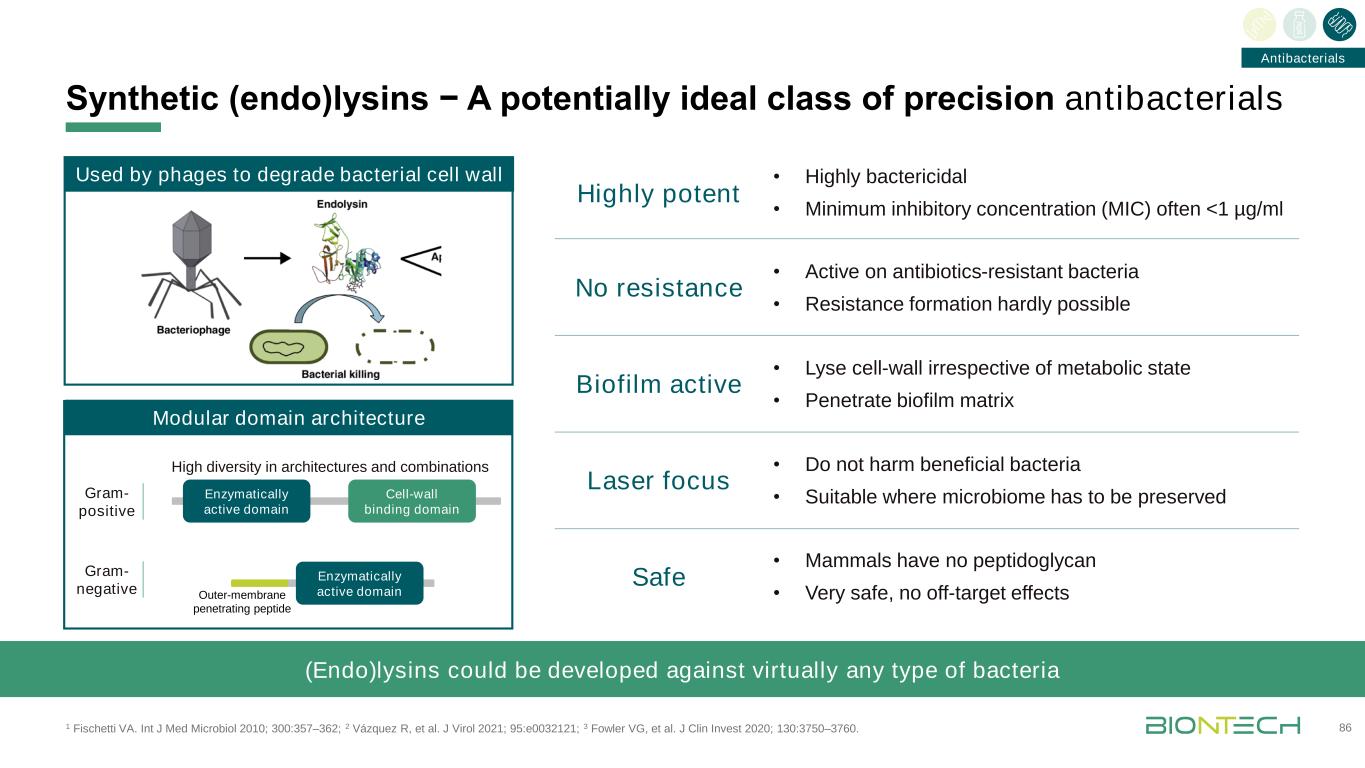
合成(内切)赖氨酸−一类潜在的理想的精密抗菌药1费舍蒂VA。INT J Med Microbiol 2010;300:357-362;2 Vázquez R,等人。J Virol 2021;95:e0032121;3 Fowler VG,et al.J Clin Invest 2020;130:3750-3760。86模块结构域结构酶活性结构域细胞壁结合结构域酶活性结构域噬菌体用于降解细菌细胞壁(Endo)的外膜穿透肽结构和组合的高度多样性可针对几乎任何类型的细菌开发生物膜活性激光焦点无耐药性安全·对抗生素耐药细菌有活性·几乎不可能形成耐药性·不受代谢状态影响的细胞壁·穿透生物膜基质·不损害有益细菌·适用于微生物组必须保存的地方·哺乳动物无肽多糖·非常安全,无脱靶效应高度有效·高度杀菌·最低抑菌浓度(MIC)经常
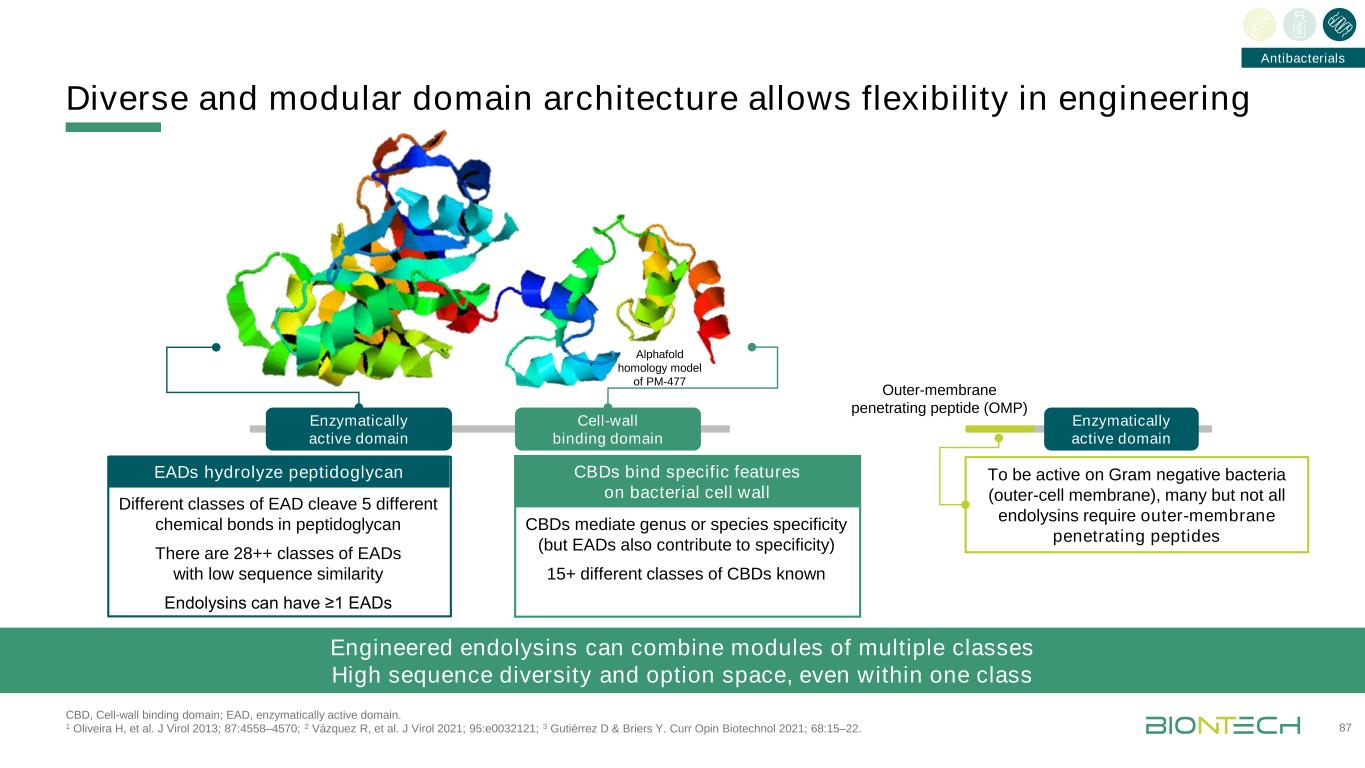
CBD介导属或种的特异性(但EADS也有助于特异性)15+不同类别的CBD已知的多样化和模块化的结构域结构允许灵活地设计87个酶活性区域细胞壁结合区域酶活性区域外膜穿透肽(OMP)对革兰氏阴性细菌(外细胞膜),许多但不是所有的内毒素需要外膜穿透肽的Alphaold同源模型的PM-477 CBD,细胞壁结合区域;EAD,酶活性区域。1 Oliveira H,et al.J Virol 2013;87:4558-4570;2 Vázquez R,et al.J Virol 2021;95:e0032121;3 Gutiérrez D&Briers Y.Curr Opin Biotechnol 2021;68:15-22。抗菌工程内毒素可以结合多种类型的模块,具有高度的序列多样性和选择空间,即使在同一类EAD中,不同类型的EAD也能切割5个不同的化学键。有28++类的EAD具有低序列相似性的EAD,内毒素可以具有≥1 EADS CBD结合细菌细胞壁的特异性
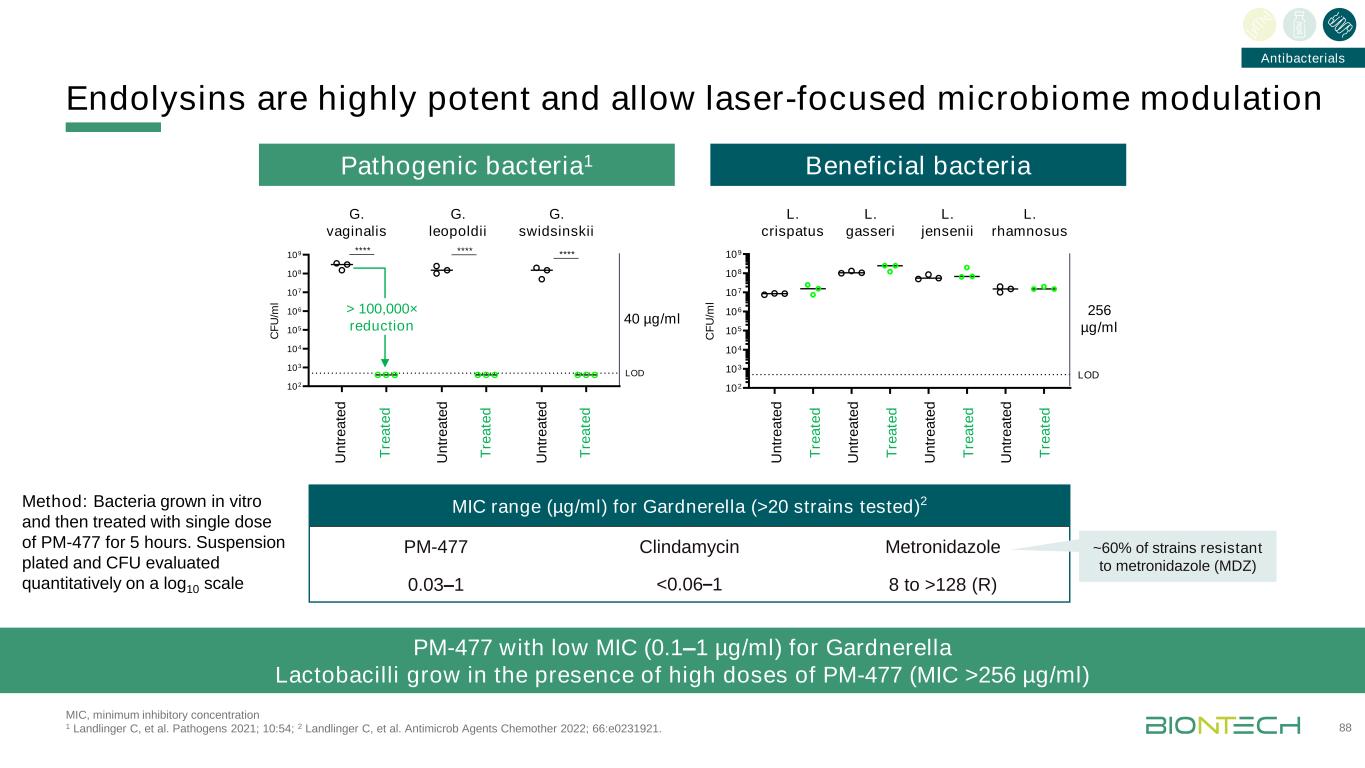
内毒素是高效的,允许激光聚焦微生物群调节对加德纳氏菌(>20株测试)的MIC范围(>20株)2 PM-477克林霉素甲硝唑0.03-1 128(R)方法:细菌在体外生长,然后用单剂量PM-477处理5小时。悬液平板和CFU对60%的甲硝唑(MDZ)耐药菌株进行了对数10分的定量检测。致病菌102 103 104 105 106 107 108 109 C F U/m l LOD>100,000×还原MIC>100,000×还原MIC,最低抑菌浓度1 Landlinger C等。病原体2021;10:54;2 Landlinger C等人。抗菌剂化学试剂2022;66:E0231921。对加德纳乳杆菌具有低MIC(0.1-1微克/毫升)的抗菌剂PM-477在高剂量PM-477(最低抑菌浓度>256微克/毫升)下生长

扩大传染病领域的机会:4项首例人类信使核糖核酸疫苗试验预计于2022年启动1项全球联合开发联合商业协议;2项授权辉瑞公司的全球权利;3项与宾夕法尼亚大学的合作;4项与比尔和梅林达·盖茨基金会的合作。BioNTech拥有全球发行权,但BMGF拥有发行权的发展中国家除外。89平台产品候选(目标)下一个里程碑基因疫苗BNT162b21新冠肺炎2022年数据更新Omicron1新冠肺炎2022年数据更新BNT16122022年新冠肺炎数据更新BNT1612 2022年流感数据更新2带状疱疹首例人体试验将于2022年下半年开始BNT163(预防性)3单纯疱疹病毒2首例人体试验将于2022年下半年开始3单纯疱疹病毒2例人类首例人体试验将于2022年下半年开始3单纯疱疹病毒2BNT1644结核病首例人体试验将于2022年下半年开始BNT165疟疾首个人体试验将于2022年下半年开始

90 Q & A

休息时间到了!

肿瘤学管道
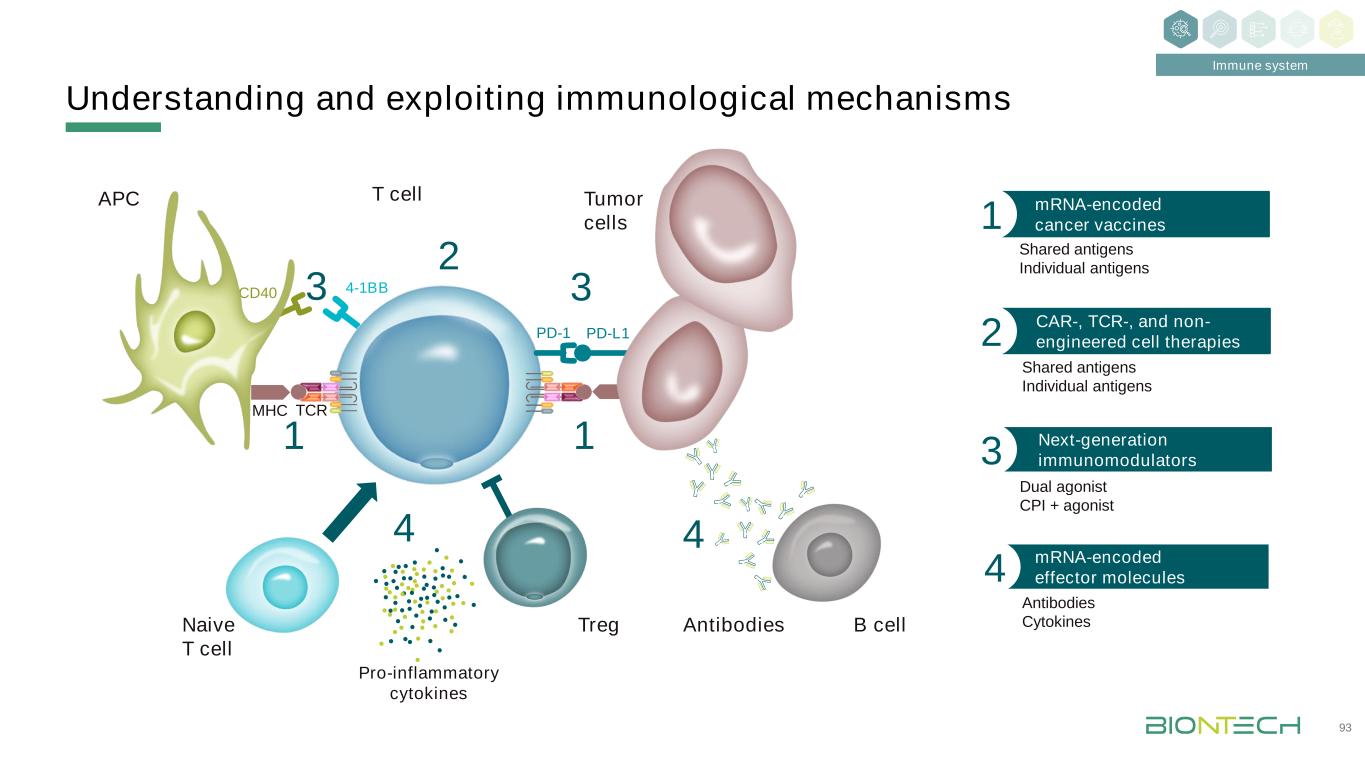
了解和探索免疫机制免疫系统93 T细胞肿瘤细胞Treg 4-1BB PD-1 PD-L1 TCRMHC促炎细胞因子幼稚T细胞APC CD40 mRNA编码的癌症疫苗1共享抗原单个抗原CAR、TCR和非工程细胞疗法2 33 1下一代免疫调节剂3B细胞mRNA编码的效应分子4抗体细胞因子共享抗原双重激动剂CPI+激动剂抗体44 21

SMIM,小分子免疫调节剂。1名研究人员发起的第1阶段试验;2名与Genentech合作;3名与赛诺菲合作;4名与Genmab合作。肿瘤学流水线:2022年重大进展和扩展94药物类别平台候选产品适应症(目标)临床前1期2期3期里程碑mRNA修复Vac BNT111晚期和R/R黑色素瘤FPD 2021年6月BNT112前列腺癌BNT113 HPV16+头颈癌FPD,2021年7月BNT1151卵巢癌BNT116 NSCLC开始1/2期iNeST Autogene cevumeran(BNT122)2 1L黑色素瘤数据H2 2022辅助直肠癌FPD,2021年12月实体瘤辅助胰腺导管腺癌1后续试验腔内免疫治疗SAR441000(BNT131)3实体肿瘤(IL-12c,IL15-sushi,GM-CSF,GM-CSF)干扰素α)RiboMabs BNT141多实体肿瘤(CLDN18.2)FPD 1月2022年1月BNT142多实体肿瘤(CD3×CLDN6)启动1/2期核细胞因子BNT151多实体肿瘤(优化的IL-2)BNT152,BNT153多实体肿瘤(IL-7,IL-2)细胞治疗CAR T细胞+CARVac BNT211多实体肿瘤(CLDN6)Ph 2计划2023年BNT212胰腺、其他肿瘤(CLDN18.2)基于新抗原的T细胞BNT221(neo-PTC-01)多实体肿瘤TCR工程化T细胞将被选为所有抗体下一个检查点免疫调节器(BNT311肿瘤)4转移非小细胞肺癌(PD-L1×4-1BB)FPD,FPD2021年12月多实体瘤(PD-L1×4-1BB)GEN1042(BNT312)4多实体瘤(CD40×4-1BB)靶向肿瘤抗体BNT321(MVT-5873)胰腺癌(Slea)SMIM Toll样受体结合BNT411实体瘤(TLR7)
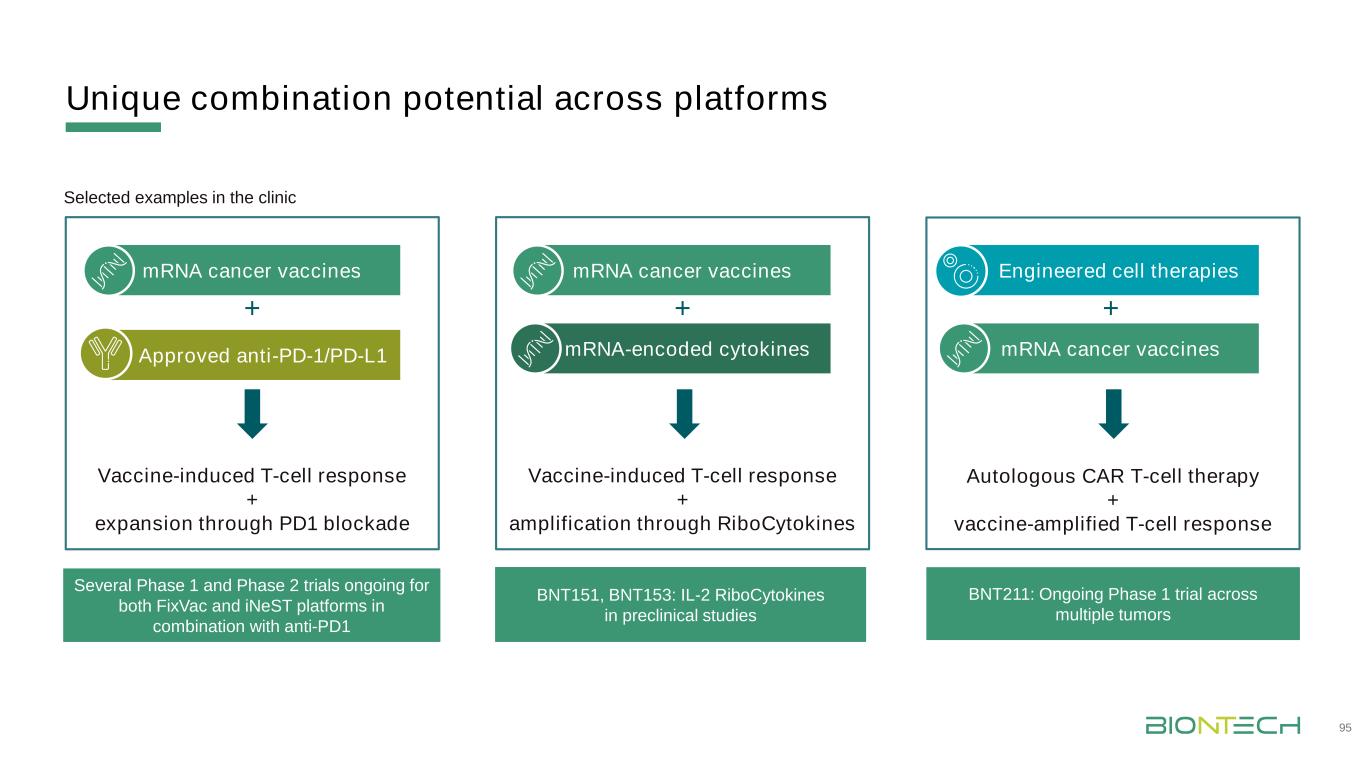
跨平台的独特组合潜力95疫苗诱导T细胞反应+通过PD1阻断自体T细胞疗法+疫苗放大的T细胞反应疫苗诱导T细胞反应+通过核细胞因子扩增批准的抗PD-1/PD-L1 mRNA癌症疫苗+mRNA编码的细胞因子+工程细胞疗法mRNA癌症疫苗+临床上正在进行的FixVac和iNeST平台与抗PD1 BNT151、BNT153:IL-2核细胞因子联合临床前研究的几个第一阶段和第二阶段试验精选实例

核糖核酸肿瘤疫苗
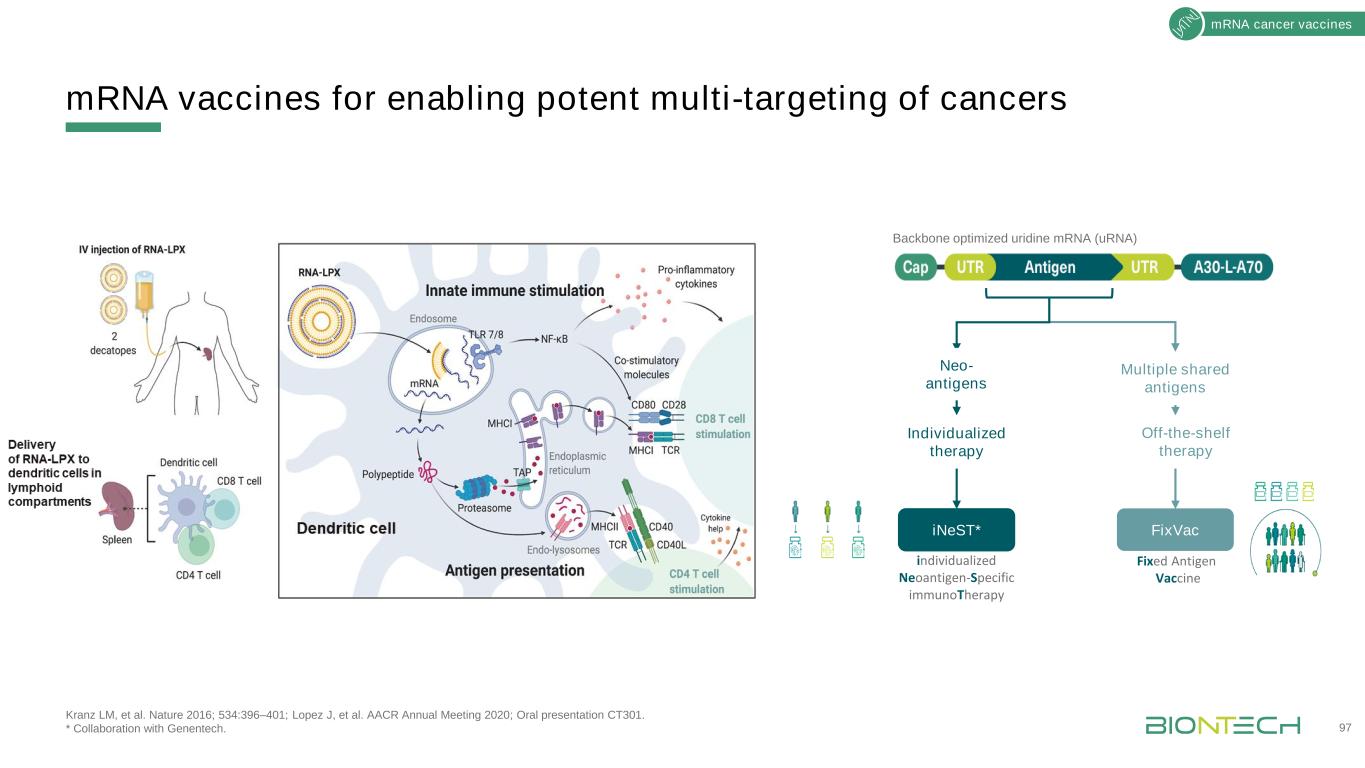
实现癌症有效多靶向的信使RNA疫苗97信使RNA癌症疫苗多种共享抗原个体化治疗现成治疗iNeST*FixVac固定抗原疫苗个体化新抗原特异性免疫治疗主干优化尿苷信使核糖核酸新抗原Kranz LM等。《自然》2016;534:396-401;洛佩兹等人。AACR 2020年年会;口头报告CT301。*与基因泰克合作。
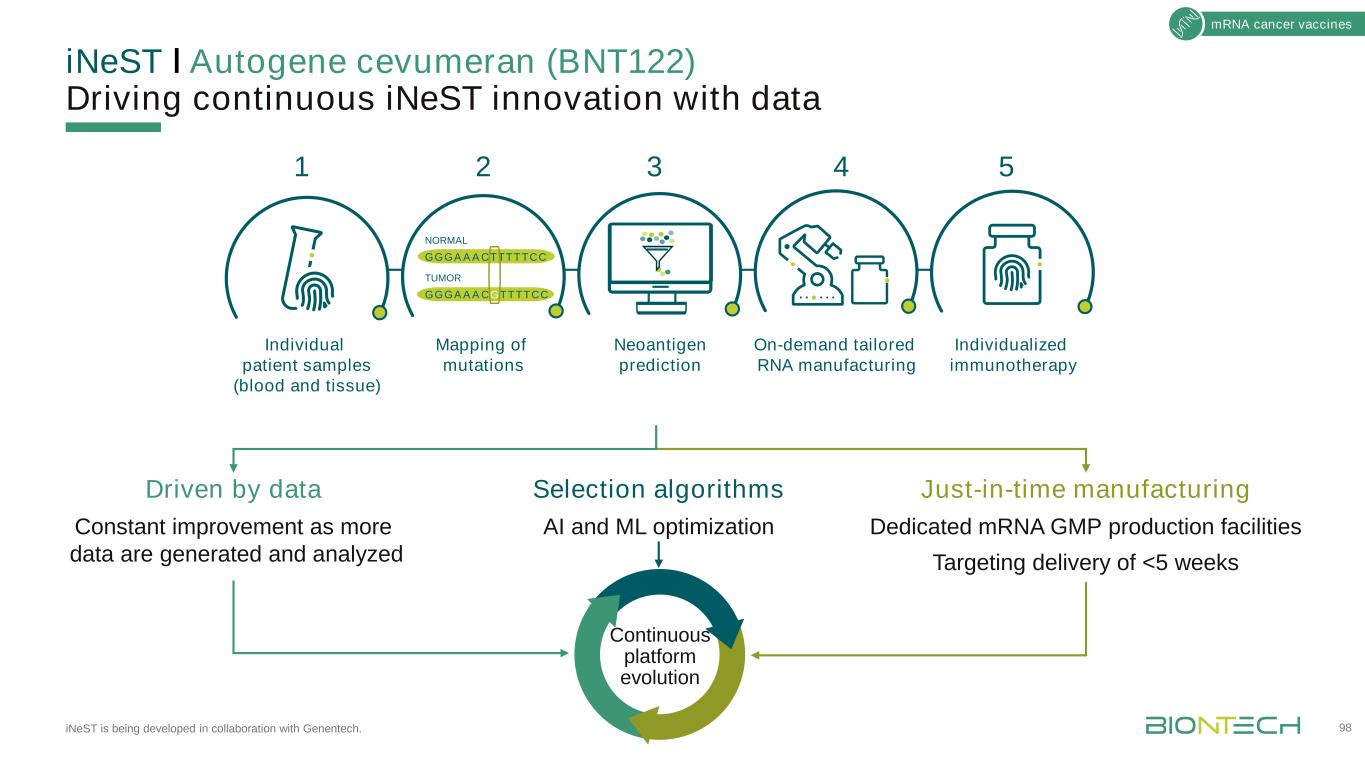
InestǀAutogene cevumeran(BNT122)正在与基因泰克合作开发,以数据驱动inest的持续创新。98种信使核糖核酸癌症疫苗及时生产专用信使核糖核酸生产设施,目标是交付

INeSTǀAutogene Cevumeran(BNT122)1期作为单一疗法,与检查点抑制剂阿替唑单抗CPI联合治疗;PR,部分缓解;PD,进展性疾病;SD,稳定期疾病。1.Sahin U,et al.自然2017;547:222-226;BNT121是BNT122的前身,也是iNeST与基因泰克合作的前身。2.洛佩兹·J等人。AACR 2020年年会;口头报告CT301;3.Braiteh F等人。AACR 2020年年会;海报演示CT169;4.与基因泰克合作。MRNA型癌症疫苗·在经过大量预治疗、PD-L1低的患者中进行的一期试验的数据涉及多种肿瘤类型·证明了作为单一疗法和联合疗法(多个患者每个新表位T细胞反应率>5%),能够诱导显著的效应和记忆表型T细胞反应·与治疗相关的不良事件主要是短暂的全身反应,表现为低级别CRS,IRR或流感样症状·临床活动的初始信号作为单一药物观察,联合Atezo BNT122在CPI敏感和CPI不敏感的肿瘤类型中诱导CD8+T细胞BNT122在肿瘤中诱导CD8+T细胞浸润BNT122在>10个适应症99中使用/不使用Tecentriq的安全性和可行性评价
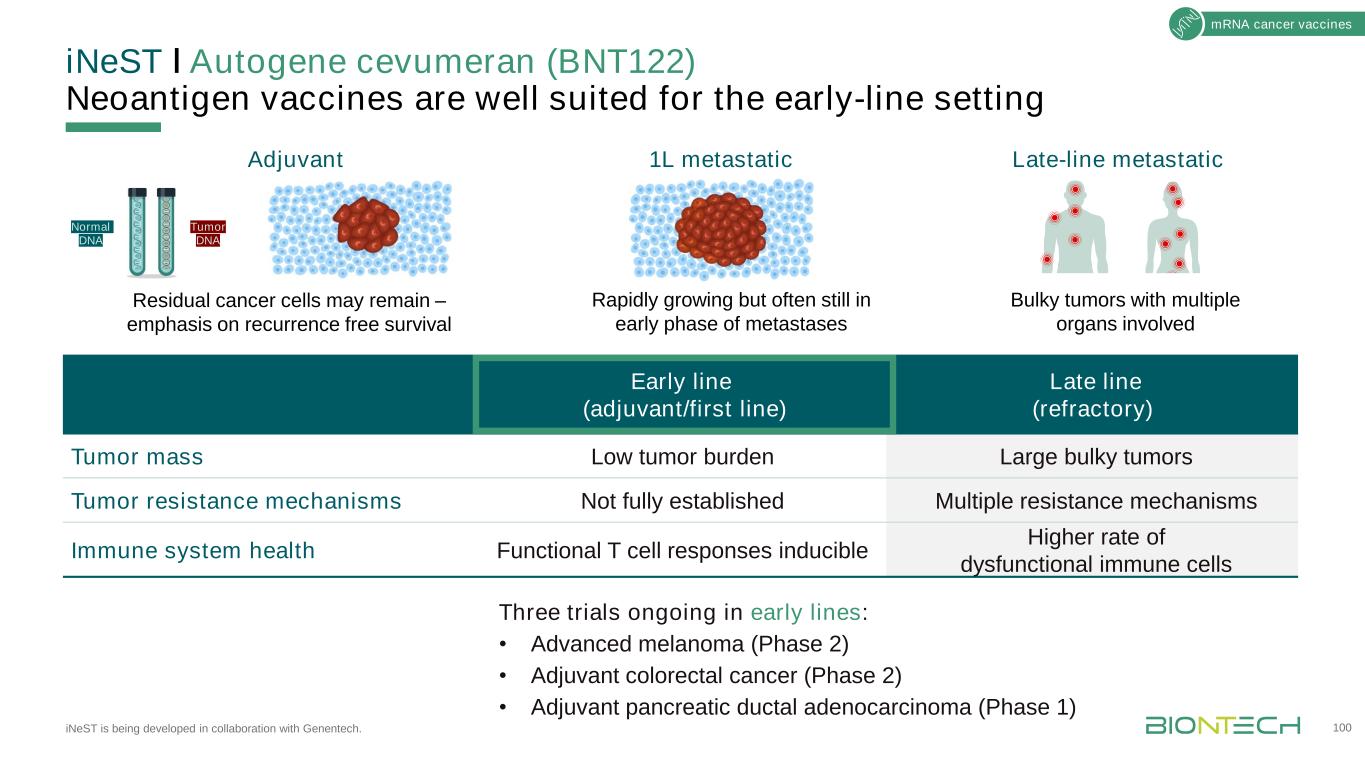
INeSTǀAutogene Cevumeran(BNT122)新抗原疫苗非常适合与基因泰克合作开发的早期产品线。100mRNA肿瘤疫苗早期(佐剂/一线)晚期(难治)肿瘤质量低肿瘤负担大体积肿瘤耐药机制未完全建立多重耐药机制免疫系统健康功能T细胞反应诱导更高的免疫细胞功能障碍免疫细胞比率早期正在进行的三项试验:·晚期黑色素瘤(2期)·佐剂性结直肠癌(2期)·佐剂胰腺导管腺癌(1期)晚期转移1L转移佐剂正常DNA肿瘤DNA残留癌细胞可能保持--强调无复发生存迅速增长,但往往仍处于转移的早期阶段多器官受累的大肿瘤
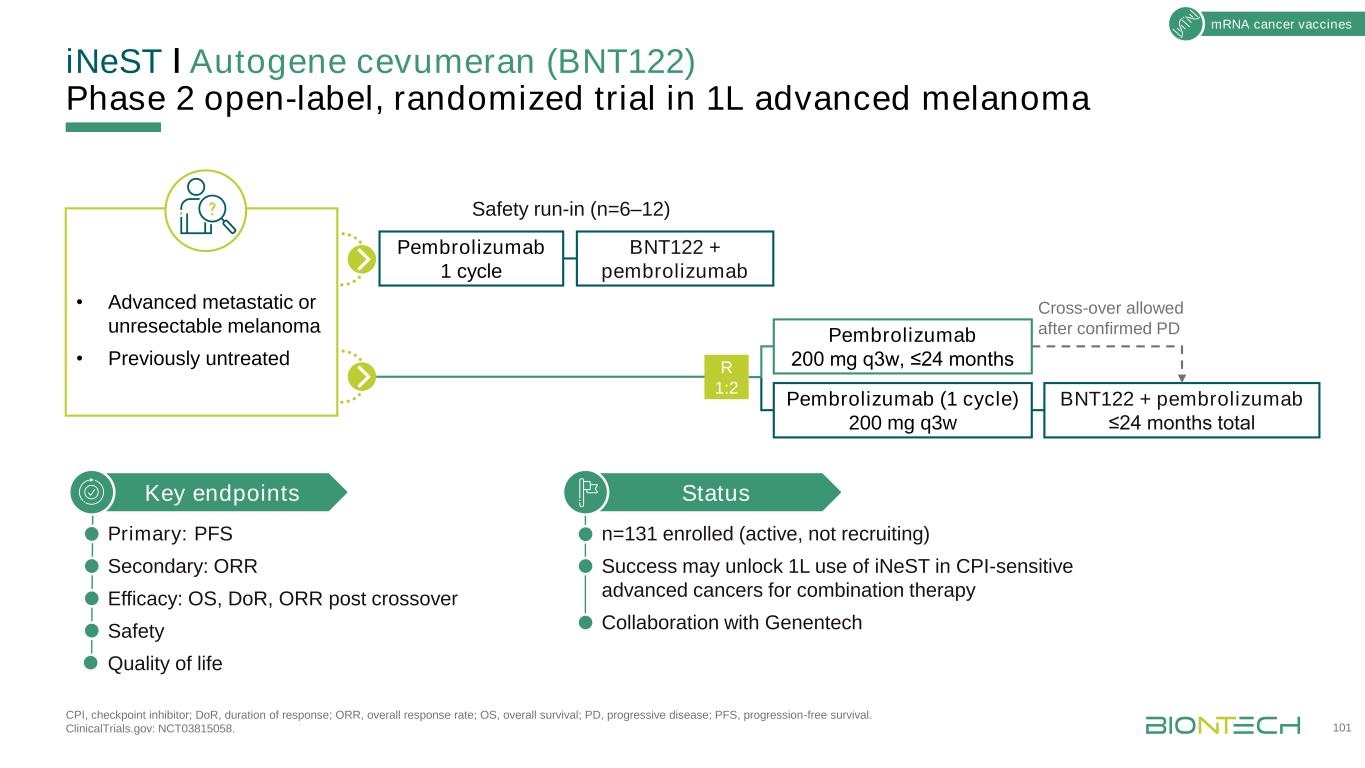
INeSTǀAutogene Cevumeran(BNT122)2期开放随机试验治疗1L晚期黑色素瘤CPI,检查点抑制剂;DOR,反应持续时间;ORR,总应答率;OS,总存活率;PD,进展性疾病;PFS,无进展存活率。临床试验网站:NCT03815058。101mRNA癌症疫苗·晚期转移性或无法切除的黑色素瘤·以前未治疗的状态n=131入选(正在进行,未招募)成功可能开启inest在CPI敏感的晚期癌症中的1L使用,用于与基因泰克关键终点的联合治疗合作主要:PFS次级:或R疗效:OS,DOR,ORR交叉后安全生活质量BNT122+Pembrolizumab≤24个月总计Pembrolizumab 200 mg q3w,≤24个月在确认PD BNT122+Pembrolizumab 1安全周期磨合后允许交叉使用
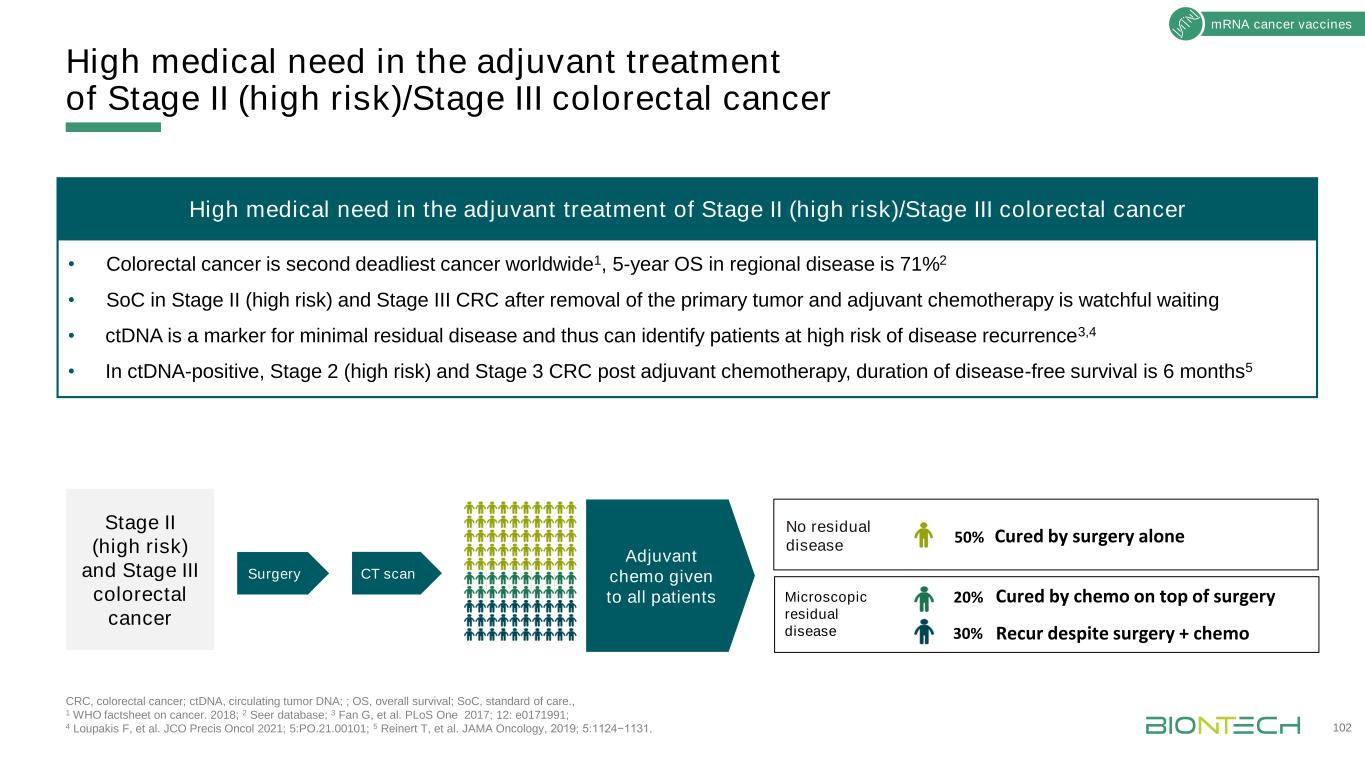
二期(高危)/三期结直肠癌信使核糖核酸疫苗辅助治疗的高度医疗需求结直肠癌;ctDNA,循环肿瘤DNA;OS,总存活率;SOC,护理标准,1世卫组织癌症情况说明书。2018年;2个SEER数据库;3个Fan G等人。PLOS One 2017;12:E0171991;4 Loupakis F,等人。JCO Precis Oncol2021;5:PO.21.00101;5 Reinert T,et al.《美国医学会肿瘤学》,2019;5:1124−1131。102二期(高危)和三期结直肠癌接受辅助化疗所有患者手术50%手术治愈CT扫描无残留病变在手术基础上化疗20%手术+化疗残留病30%手术+化疗残留病50%仅手术治愈·结直肠癌是世界上第二致命的癌症1,5年OS在区域疾病中为71%2.原发肿瘤切除后的SOC在II期(高危)和III期CRC在原发肿瘤切除和辅助化疗后仍需密切关注等待·ctDNA是微小残留病的标志,因此可以识别疾病复发的高风险患者3,42期(高危)和3期结直肠癌辅助化疗后,无病生存期为6个月5对II期(高危)/III期结直肠癌的辅助治疗有很高的医疗需求

INeSTǀAutogene Cevumeran(BNT122)2期随机试验与观察等待治疗在辅助结直肠癌、结直肠癌;ctDNA,循环肿瘤dna;OS,总存活率;Q1/2/6周,每1/2/6周;R,随机化;RFS,无复发生存期;SOC,护理标准;ttf,治疗失败时间;ttr,反应时间。临床试验网站:NCT04486378。103 mRNA癌症疫苗状态第一名患者接种(随机队列):2021年12月与基因泰克关键终点合作主要:无病生存(DFS)疗效:RFS、TTR、TTF、OS在ctDNA状态BNT122 15剂:6×q1w、2×q2w、7×q6w观察观察等待接受手术切除的II期(高危)或III期CRC筛查1 ctDNA状态(手术后)筛查3最终合格(ctDNA阳性)筛查2新抗原选择用于疫苗生产12-24周iNeST制造≤20新表位R1:1探索性:BNT122筛查复发疾病3(n≤20)n=166生物标志物:BNT122与ctDNA状态无关(n=15)
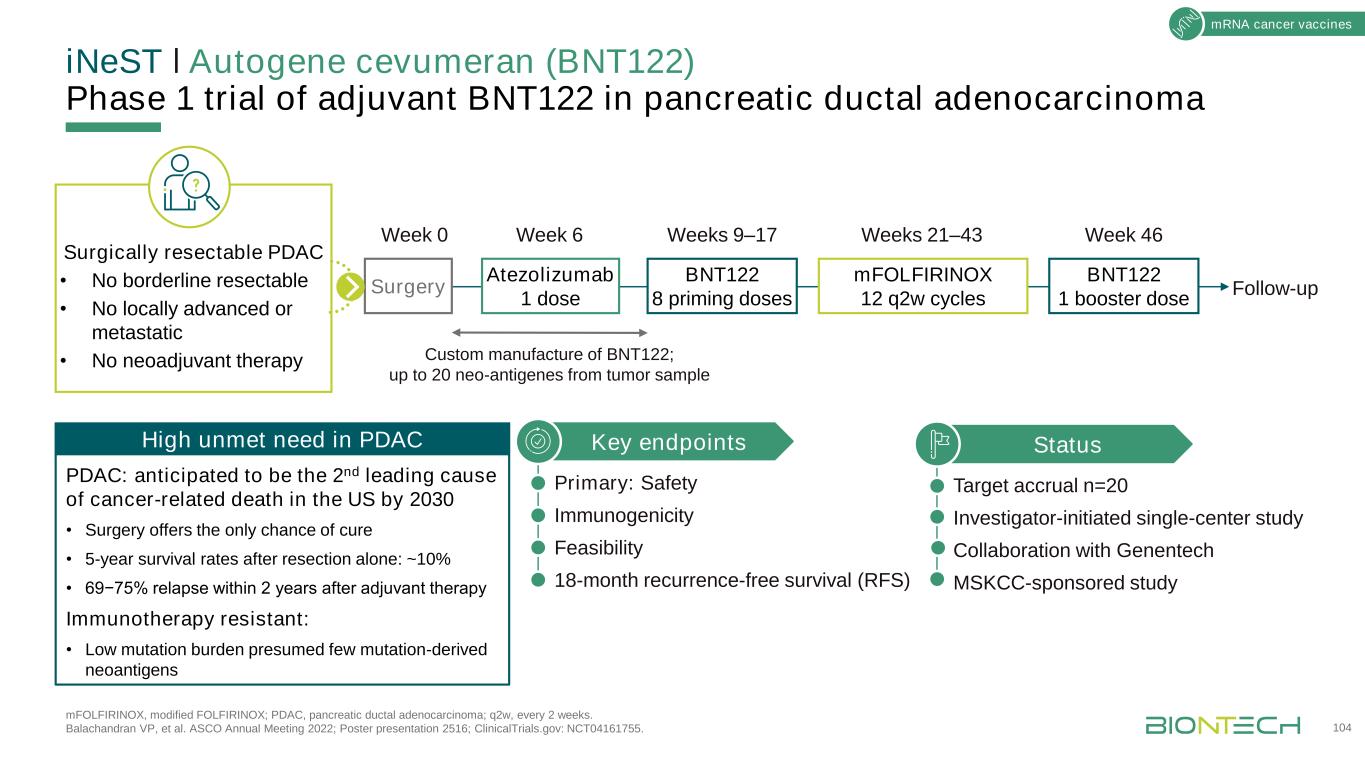
INeSTǀ自身基因Cevumeran(BNT122)佐剂治疗胰腺导管腺癌的1期试验:改良FOLFIRINOX;PDAC,胰腺导管腺癌;Q2W,每2周一次。Balachandran副总裁等人。ASCO 2022年会;海报展示2516;ClinicalTrials.gov:NCT04161755。104状态目标应计n=20研究人员发起的单中心研究与基因技术公司MSKCC赞助的研究关键终点主要:安全免疫原性可行性18个月无复发生存期pDAC:预计到2030年将成为美国癌症相关死亡的第二大原因·手术提供治愈的唯一机会·单独切除后5年存活率:~10%·69−75%在辅助治疗后2年内复发免疫治疗耐药:·低突变负担假定很少突变衍生的肿瘤抗原在可手术切除的pDAC中高度未满足的需求·无手术切除·无局部切除·无局部切除晚期或转移性·无新辅助治疗BNT122 8预充剂Atezolizumab 1剂BNT122 1加强剂mFOLFIRINOX 12个Q2W周期手术周0周6周9~17周21~43周46次随访定制BNT122;从肿瘤样本中提取多达20个新的抗癌基因
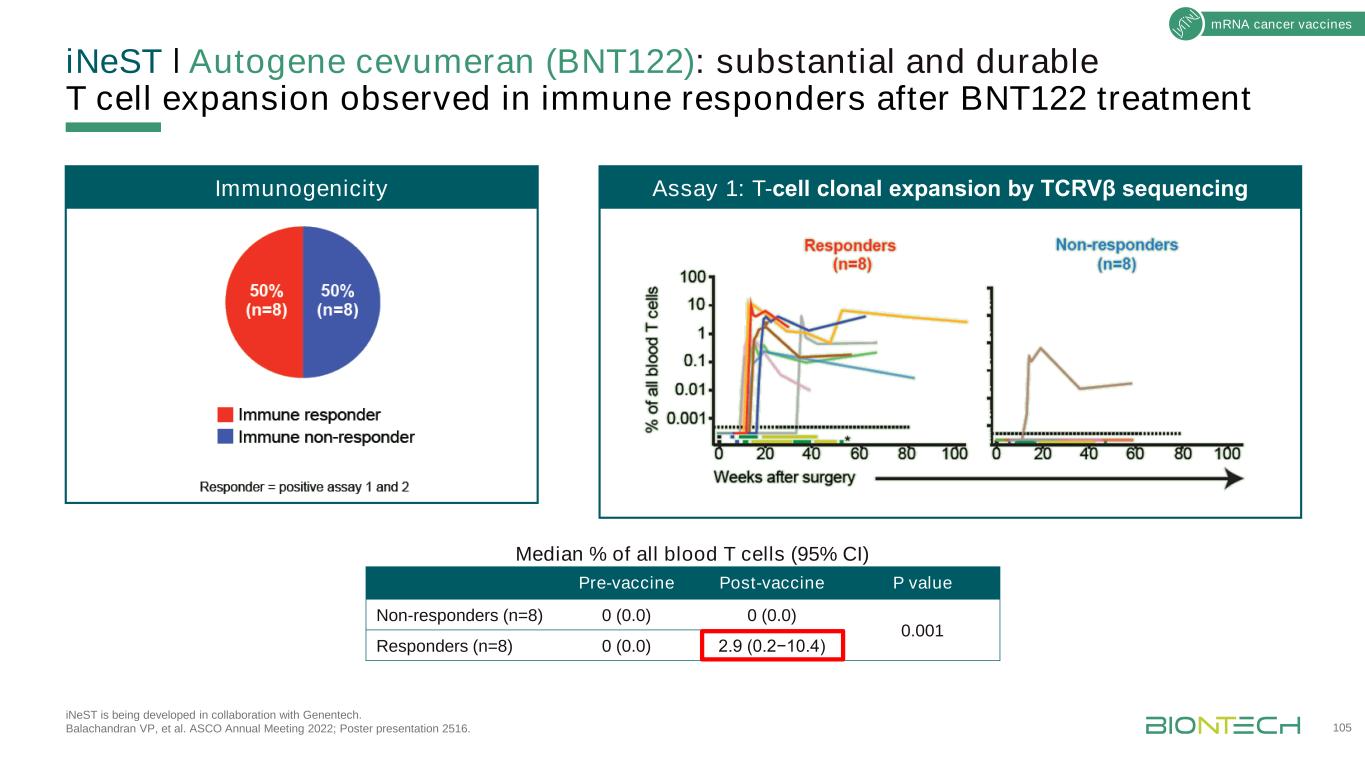
INeSTǀ自体基因Cevumeran(BNT122):在BNT122治疗后免疫应答者中观察到大量和持久的T细胞增殖iNeST正在与基因技术公司合作开发。Balachandran副总裁等人。2022年ASCO年会;海报展示2516。免疫原性检测1:T细胞克隆性扩增疫苗接种前P值无应答者(n=8)0(0)0(0)0.001应答者(n=8)0(0)2.9(0.2−10.4)T细胞占全血T细胞的中位数%(95%CI)

由ELISPOT在免疫应答器中证实的inestǀ自体基因cevumeran(BNT122)功能T细胞正在与基因技术公司合作开发。Balachandran副总裁等人。2022年ASCO年会;海报展示2516。用干扰素γELISPOT检测106mRNAs肿瘤疫苗对自身基因Cevumeran新抗原的2:T细胞特异性
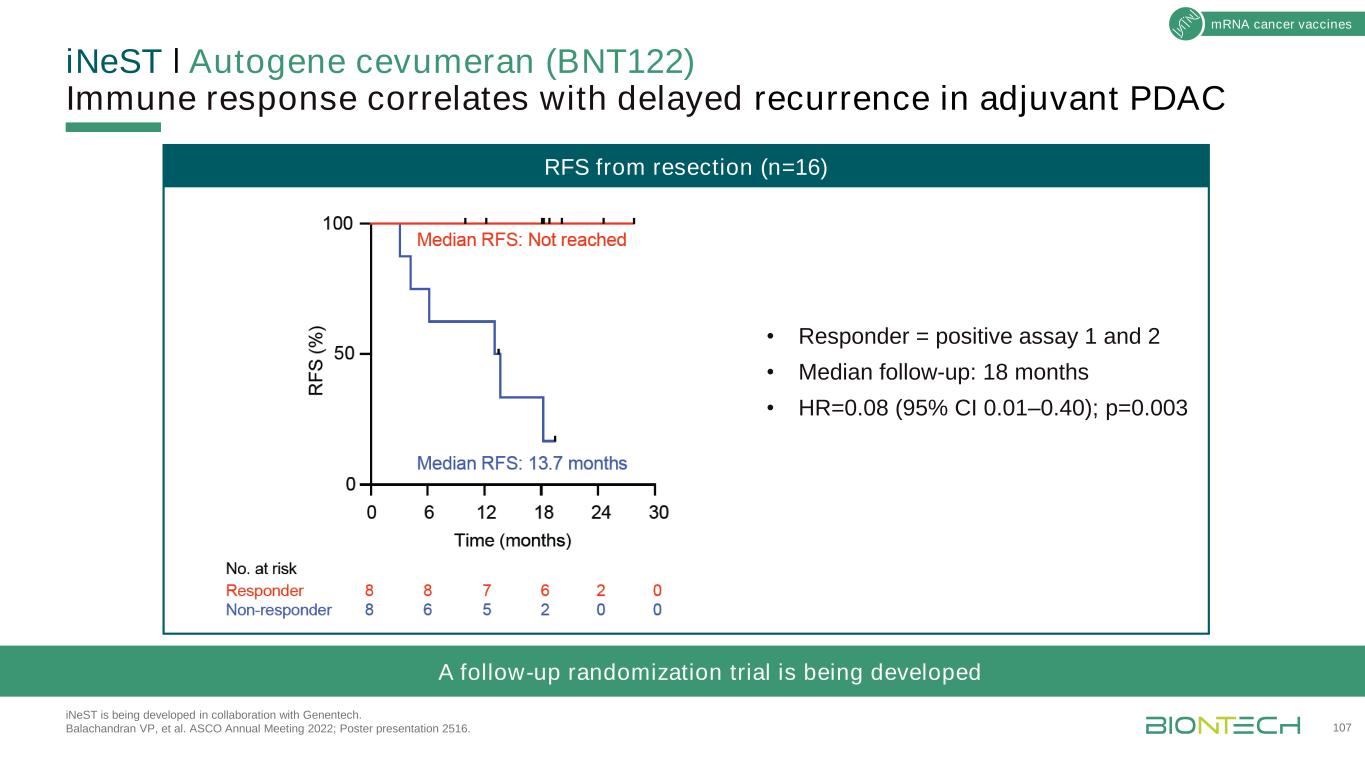
ǀ自身基因Cevumeran(BNT122)免疫反应与佐剂PDAC延迟复发相关iNeST正在与基因泰克合作开发。Balachandran副总裁等人。2022年ASCO年会;海报展示2516。107mR NA肿瘤疫苗切除后RFS(n=16)·应答者=阳性试验1和2·中位随访期:18个月·HR=0.08(95%可信区间0.01-0.40);p=0.003正在进行随机化随访试验

FixVac利用共享的肿瘤相关抗原治疗癌症:HNSCC,头颈部鳞状细胞癌;HPV,人乳头瘤病毒;NSCLC,非小细胞肺癌。108信使核糖核酸疫苗共有抗原的疫苗骨架Lipoplex=针对共有肿瘤相关抗原的固定疫苗组合RNA-LPX配方(IV)固定Vac骨架优化的尿苷mRNA(URNA)针对每个适应症量身定做的多抗原方法+AAAA Poly(A)尾部抗原CASSETTE5‘BNT111编码4个肿瘤相关抗原,覆盖90%以上的皮肤黑色素瘤患者HPV16+HNSCC HPV-E6 HPV-E7 BNT113编码2个癌蛋白,仅在前列腺癌前和恶性组织中表达BNT112编码5个前列腺癌相关抗原NSCLC BNT116编码6个不同的NSCLC肿瘤相关抗原

解决晚期黑色素瘤CPI失效所需的治疗选择CPI,检查点抑制剂;DOR,反应持续时间;MPFS,中位无进展生存期;ORR,总应答率;R/R,难治/耐药;世卫组织,世界卫生组织。1可在:https://www.melanomauk.org.uk/2020-melanoma-skin-cancer-report;2全球癌症观测站-2018年《今日癌症》的数据;3全球癌症观测站-《明天的癌症》预测的2025年数据;4拉金等人。N Engl J Med 2019;381:1535−1546;5可从https://seer.cancer.gov/statfacts/html/melan.html获得(2021年8月6日访问。109信使核糖核酸癌症疫苗改善护理标准的重要机会每年病例增加近50%,超过287,0001,2世卫组织预测,到2025年,死亡人数将增加20%3 20%50%的发病率死亡患者对CPI治疗无效或复发,使他们的治疗选择有限4CPI R/R患者~55%黑色素瘤仍然是最致命的皮肤癌1,2·5年转移性黑色素瘤的生存率仍然只有29.8%5·CPI的一线免疫治疗最大限度地诱导持久的反应。45CPI50%的患者−时间相对较短·CPI抵抗/难治性患者对CPI无反应或CPI后复发的患者预后特别差,根据危险因素,生存期短至6个月·晚期CPI R/R黑色素瘤是高医疗需求人群,预后极差
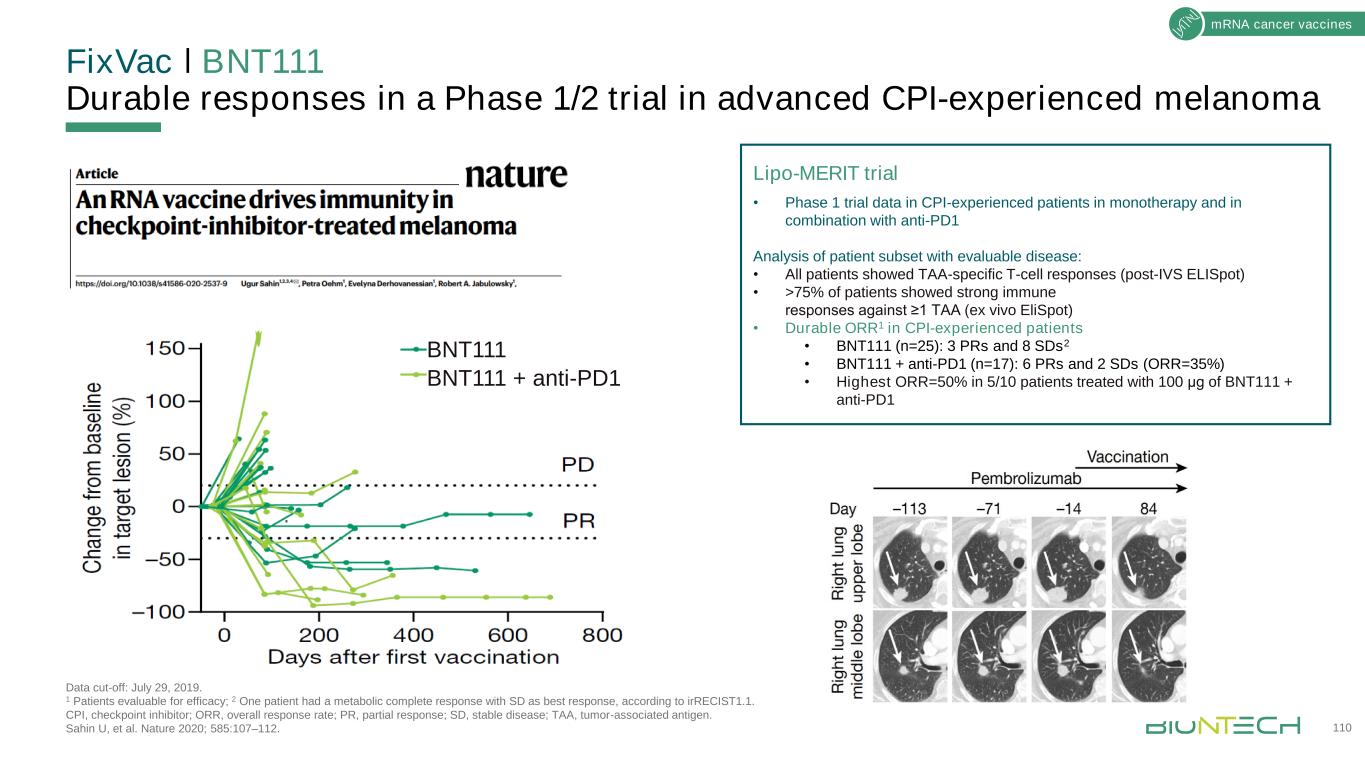
修复VacǀBNT111在晚期消费物价指数经历的黑色素瘤数据截断的1/2阶段试验中的持久反应:2019年7月29日。1例可评价疗效;2根据irRECIST1.1标准,1例患者代谢完全缓解,SD为最佳反应。CPI,检查点抑制物;ORR,总缓解率;PR,部分缓解率;SD,病情稳定;TAA,肿瘤相关抗原。Sahin U,et al.《自然》2020;585:107-112。110mRNA型癌症疫苗BNT111 BNT111+抗-PD1Lipo优点试验·在有CPI经验的患者中进行单药治疗和联合抗PD1分析的第一阶段试验数据:·所有患者都显示出TAA特异性T细胞应答(体外ELISPOT后)·>75%的患者对≥1 TAA(体外ELISPOT)有强烈的免疫应答·有CPI经验的患者的持久ORR1·BNT111(n=25):3个PR和8个SD 2·BNT111+抗-PD1(n=17):6个PR和2个SD(ORR=35%)·100μg BNT111+抗PD1治疗的5/10患者ORR=50%
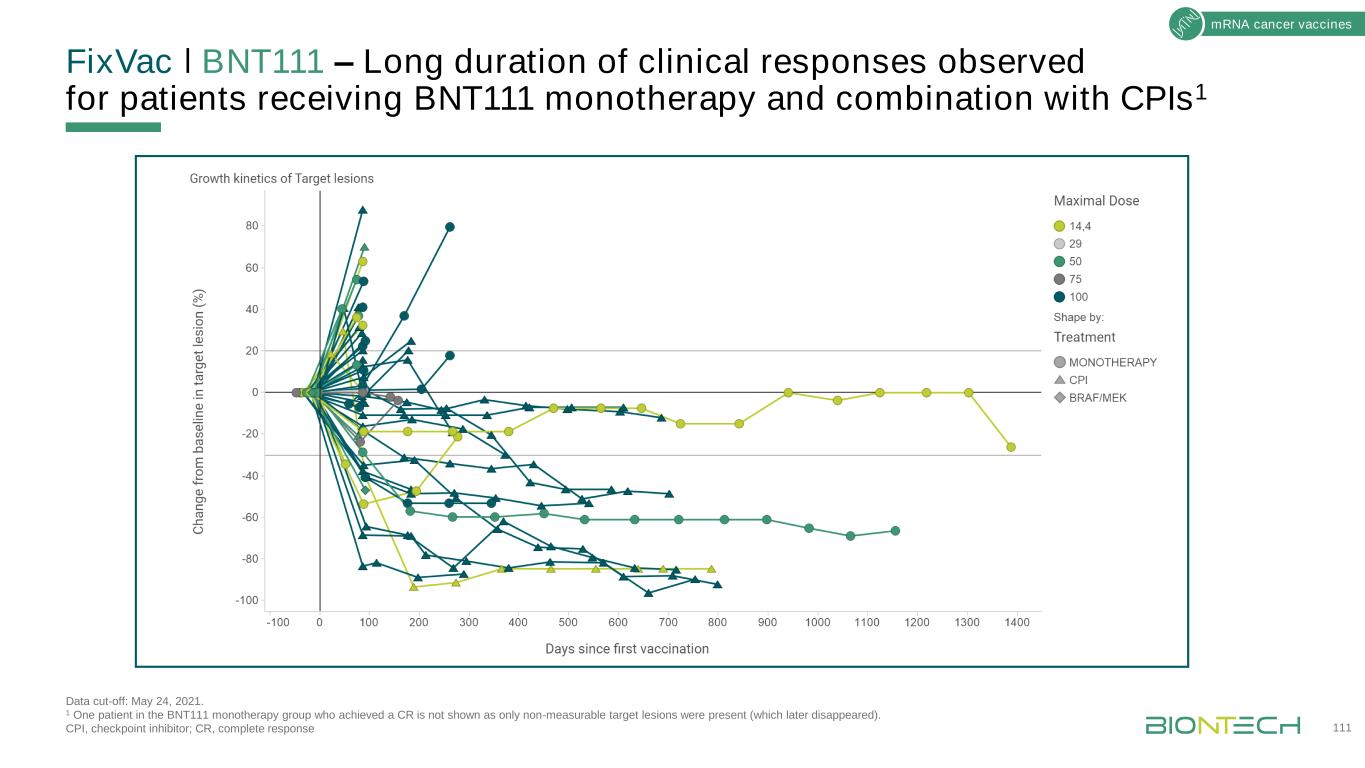
修复VacǀBNT111-接受BNT111单一治疗和联合CPIS1数据截止的患者观察到的长时间临床反应:2021年5月24日。1在BNT111单一治疗组中,有1例患者达到CR,但未显示为仅存在不可测量的靶区(后来消失)。CPI,检查点抑制因子;CR,完全应答111mRNA癌症疫苗

修复VacǀBNT111-接受BNT111单一治疗或与PD-1抑制剂1,2联合治疗的患者观察到肿瘤缩小1,2数据截止日期:2021年5月24日。1 1例患者靶区病变较基线减少83.2%,但出现新的靶区病变,总体疗效最佳。患者B4-31有几个新的病变,尽管目标病变减少;2在BNT111单一治疗组中有一名患者实现了CR,但没有显示,因为只有不可测量的目标病变存在(后来消失)。CPI,检查点抑制物;irRECIST,实体瘤免疫相关反应评估标准;SD,稳定期疾病。112种信使核糖核酸肿瘤疫苗最佳总体应答*PR°SD/IRSD

修复VacǀBNT111强大的免疫原性和有望的临床活性在第一阶段Lipo-优点数据截止日期:2021年5月24日。ED,疾病证据;IVS,体外刺激;NED,无疾病证据;NR,未达到;TAA;肿瘤相关抗原。Loquai C等人。SITC 2021年年会;海报展示549。113个mRNA癌症疫苗在ED和NED患者之间显示出类似的CD4+和CD8+T细胞反应,在试验纳入体外ELISpot(ED,n=22;NED,n=28)后,在没有疾病证据的患者中初步无病生存(ED,n=9;NED,n=6)体外反应ED:64%(n=14)NED:68%(n=19)T细胞对≥-1TAA的反应在所有患者中观察到·在NED患者中:34.8月中位DFS(95%CI:7.0NR),中位随访期40.7个月(95%CI:35.3-42.7)
FixVacǀBNT111第2期随机试验±cymplimab在患有抗PD1-R/R黑色素瘤DCR的患者中,疾病控制率;DOR,反应持续时间;ORR,总应答率;OS,总生存期;PFS,无进展生存期;R/R,复发/难治;Ttr,反应时间。临床试验网站:NCT04526899。114种信使核糖核酸癌症疫苗·无法切除的III或IV期黑色素瘤·复发/对抗PD1状态难治性首例患者用药:2021年6月n=180个全球试验(澳大利亚、德国、意大利、波兰、西班牙、英国、美国)与Regeneron关键终点合作主要:联合ARM:ORR疗效:ORR、DOR、DCR、TTR、PFS、OS安全性,包括免疫相关的AEs生活质量BNT111长达24个月-n=45 Cymplimab长达24个月-n=90 R2:1:1疾病进展后BNT111+cymplimab成功措施ORR=30%美国快速通道指定和Orphan药物指定
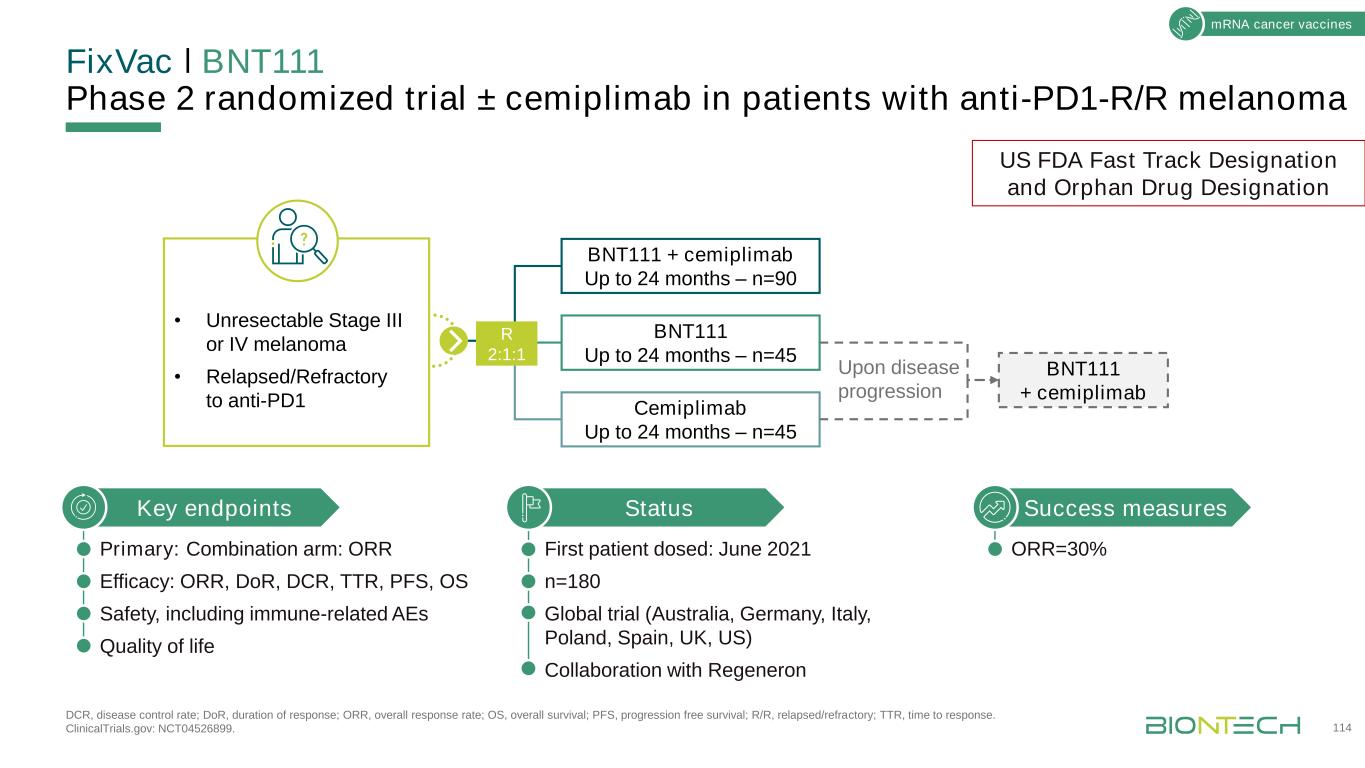
FPD,首例用药;HNSCC,头颈部鳞状细胞癌;NSCLC,非小细胞肺癌;PDAC,胰腺导管腺癌;R/R,复发/难治。1 BNT122,与基因技术公司合作;2研究人员发起的研究。近期里程碑115mRNA癌症疫苗平台产品候选适应症(靶点)下一个里程碑iNeST新抗原mRNA疫苗Autogene cevumeran(BNT122)+培溴利珠单抗1L黑色素瘤2期完全招募;数据更新H2 2022自体基因cevumeran(BNT122)1佐剂结直肠癌2期正在进行(FPD,2021年12月)自体基因cevumeran(BNT122)±阿替唑珠单抗实体瘤1期完全招募自体基因cevumeran(BNT122)±阿替唑蓝1,2佐剂PDAC后续随机试验正在开发中FixVac固定组合信使核糖核酸疫苗BNT111±抗PD1晚期黑色素瘤1期正在进行BNT111±cymplimab R/R黑色素瘤2期正在进行(FPD,2021年6月)-美国FDA快速跟踪指定和孤儿药物指定BNT112±cplimab正在进行的第二部分BNT113+pembrozumab PVH16+头颈部癌症和具有登记潜力的头颈部癌症2期(FPD,2021年7月)BNT111±cempplimab R/R黑色素瘤2期正在进行(FPD,2021年6月)-美国FDA快速跟踪指定和孤儿药物指定BNT112正在进行的cplimab前列腺癌登记第二部分BNT113+pembrozumab PVH16+颈部癌症2期正在进行(FPD,2021年7月)

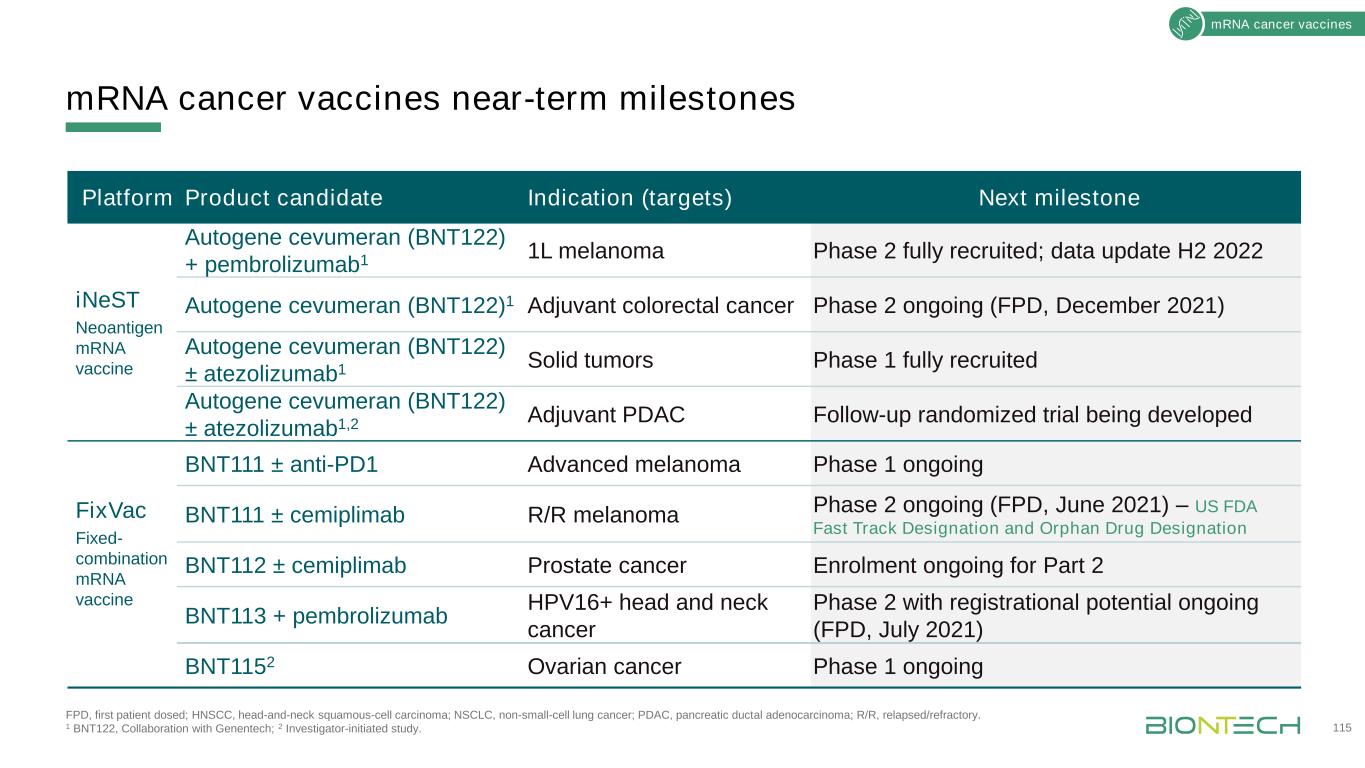
蛋白质疗法
BNT311结合了检查点封锁和条件T细胞共刺激*BNT311(Gen1046)是与Genmab基于50/50分享成本和利润的合作伙伴关系。1 Muik A等人。癌症Discov 2022;12:1248−1345。117蛋白质疗法以PD-L1结合为条件的双靶向4-1BB共刺激条件增强T细胞和NK细胞功能的新机制(BNT311)·针对两个临床前验证靶点的条件性双特异性分子:·PD-L1:表达在肿瘤细胞上的受体-配体,以抑制PD1阳性细胞的增殖,并参与免疫逃避·4-1BB:表达在T细胞和NK细胞上的共刺激肿瘤坏死因子。激活4-1BB途径可促进T细胞增殖、增强T细胞效应功能并阻止T细胞死亡BNT311结合亲和力:KD PD-L1:0.16nmol/L,4-1BB:0.15nmol/L
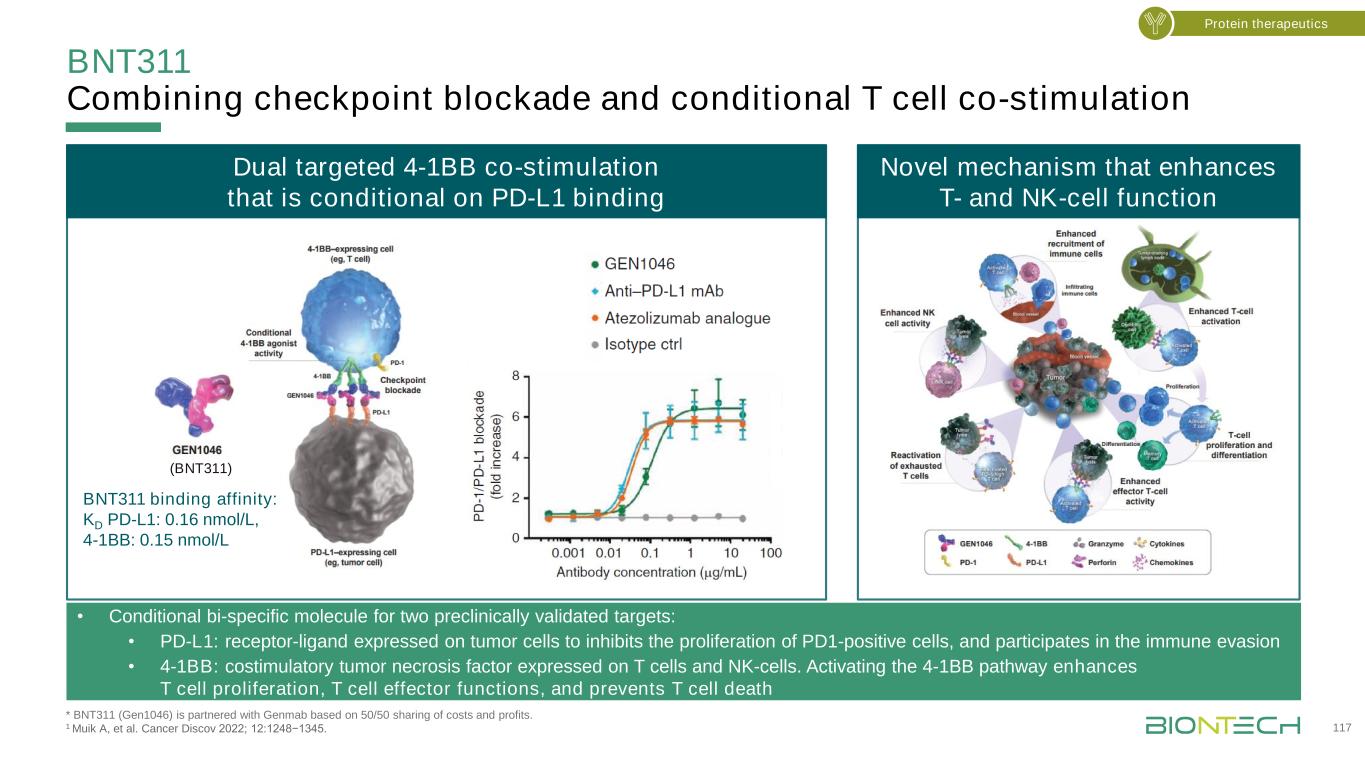
BNT311是人类首个经过严格预处理的晚期实体肿瘤的1/2期试验*BNT311(Gen1046)与Genmab基于50/50分享成本和利润的基础上进行合作。CC,宫颈癌;EC,子宫内膜癌;HNSCC,头颈部鳞状细胞癌;MTD,最大耐受剂量;NSCLC,非小细胞肺癌,PD,进展性疾病;RP2D,推荐2期剂量;TNBC,三阴性乳腺癌;UC,尿路上皮癌。NCT03917381。与Genmab关键终点合作招募11个扩展队列主要:MTD、RP2D安全性、药代动力学、免疫原性药效学和潜在预测生物标记物抗肿瘤活性(RECIST v1.1)蛋白质治疗剂量递增(N=61)BNT311/GEN1046*IV直至PD或不可接受毒性·转移性或无法切除的实体肿瘤·不适合标准治疗剂量扩展的患者(≤40/队列)·PD-(L)1-抑制剂预治疗队列·CervicalC·EndometrialC·HNSCC扩展剂量100 mg Q3W 1期2a·NSCLC·TNBC·Urethelic
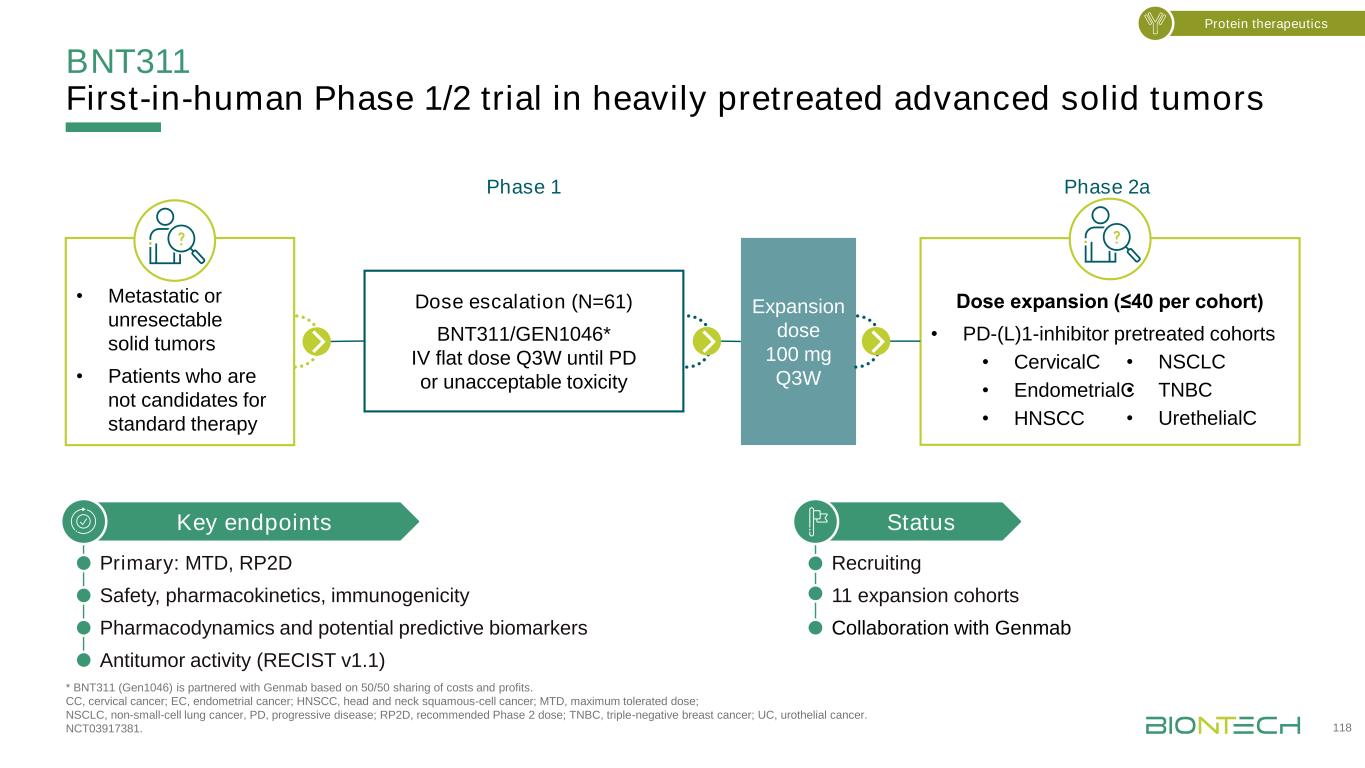
BNT311:剂量升级的初步结果显示,大多数AE的安全状况可控,数据截止日期为1级或2级:2020年8月31日。DLT,剂量限制毒性;MTD,最大耐受量;TEAE,治疗紧急不良事件;TRAE,治疗相关不良事件。Garralda E,et al.SITC 2020年年会;海报展示412。蛋白疗法·治疗相关转氨酶升高26.2%(≥3级:9.8%),用糖皮质激素治疗后降低·无治疗相关胆红素升高或4级转氨酶升高·6例DLT:4级发热中性粒细胞减少2例,3级肾炎1例,3级ALT升高1例,3级AST/ALT升高1例,3级转氨酶升高1例·6例患者均痊愈无后遗症·≥未达TEAE,剂量递增队列中10%的患者发生≥。N(%)≥3级,n(%)任何TRAE 43(70.5)17(2 7.9)TRAE在≥患者中占10%,由于优先项ALT升高,谷草转氨酶升高增加甲减疲劳14(2 3.0)13(2 1.3)11(18.0)8(13.1)5(8.2)2(3.3)1(1.6)1(1.6)
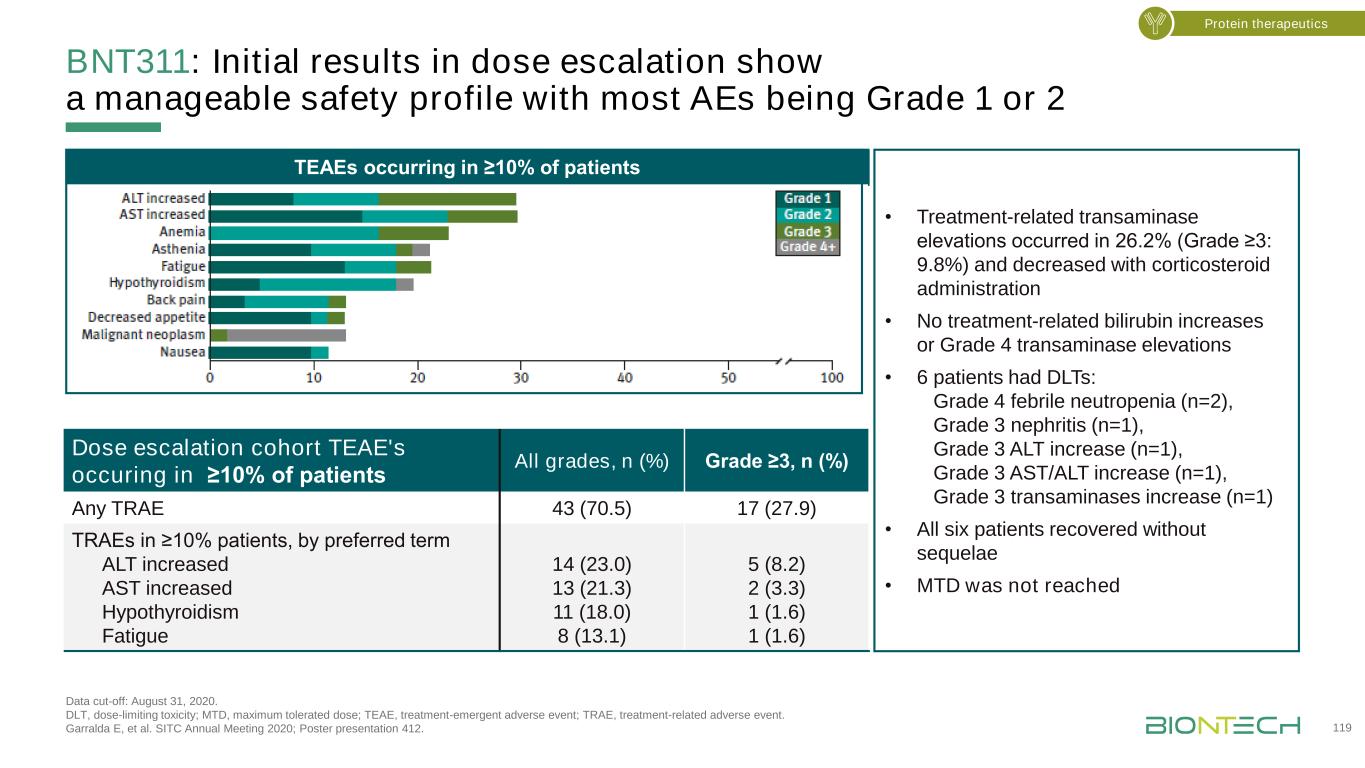
BNT311抗肿瘤活性(第一阶段剂量升级部分)数据截止日期:2020年9月29日。没有对5名患者进行基线后扫描。未达到每个RECIST v1.1的最短响应持续时间(5周)。B-PR在随后的扫描中没有得到确认。NE,不可评估;NSCLC,非小细胞肺癌;PD,进展性疾病;PD-(L)1,程序性死亡(配体)1;PR,部分反应;SD,稳定疾病;SOD,直径总和;UPR,未证实部分反应。65.6%(40/61)的患者在3个月的中位随访期内实现了▪病的控制,▪4早期部分反应在TNBC(1例),卵巢癌(1例),和CPI治疗前NSCLC(2)肿瘤大小变化最好的患者结直肠癌NSCLC卵巢癌胰腺癌其他癌症之前PD-(L)1 75 50 25-25-50-75剂量水平PD SD NEA SD PD SD PD SD NEA PR uPRbuPRSD 1 4 0 m g 4 0 m g 1 2 0 m g 5 0 m g2 5 m g 2 5 m g 8 0 m g 1 4 0 m g 2 0 0 m g 2 0 0 m g 8 0 m g 2 0 0 m g 1 4 0 m g 4 0 m g 4 0 m g 1 4 0 m g 1 4 0 m g 8 0 m g 1 4 0 m g 8 0 m g 8 0 0 m g 2 0 0 m g 8 0 m g 4 0 0 m g 5 0 m g 4 0 0 m g 8 0 m g 2 5 m g 1 4 0 m g 1 0 0 m g 1 0 m g 2 0 m gG 1 2 0 0 m g 8 0 0 m g 1 0 0 m g 1 2 0 m g 8 0 m g 1 2 0 m g 4 0 0 m g 4 0 0 m g 8 0 m g 5 0 m g 5 0 m g 8 0 m g 2 0 0 m g 4 0 0 m g 8 0 0 m g 5 0 m g 5 0 m g 4 0 0 m g 8 0 0 m g 8 0 0 m g 2 0 m g 8 0 m g 2 0 m g 1 0 0 m g
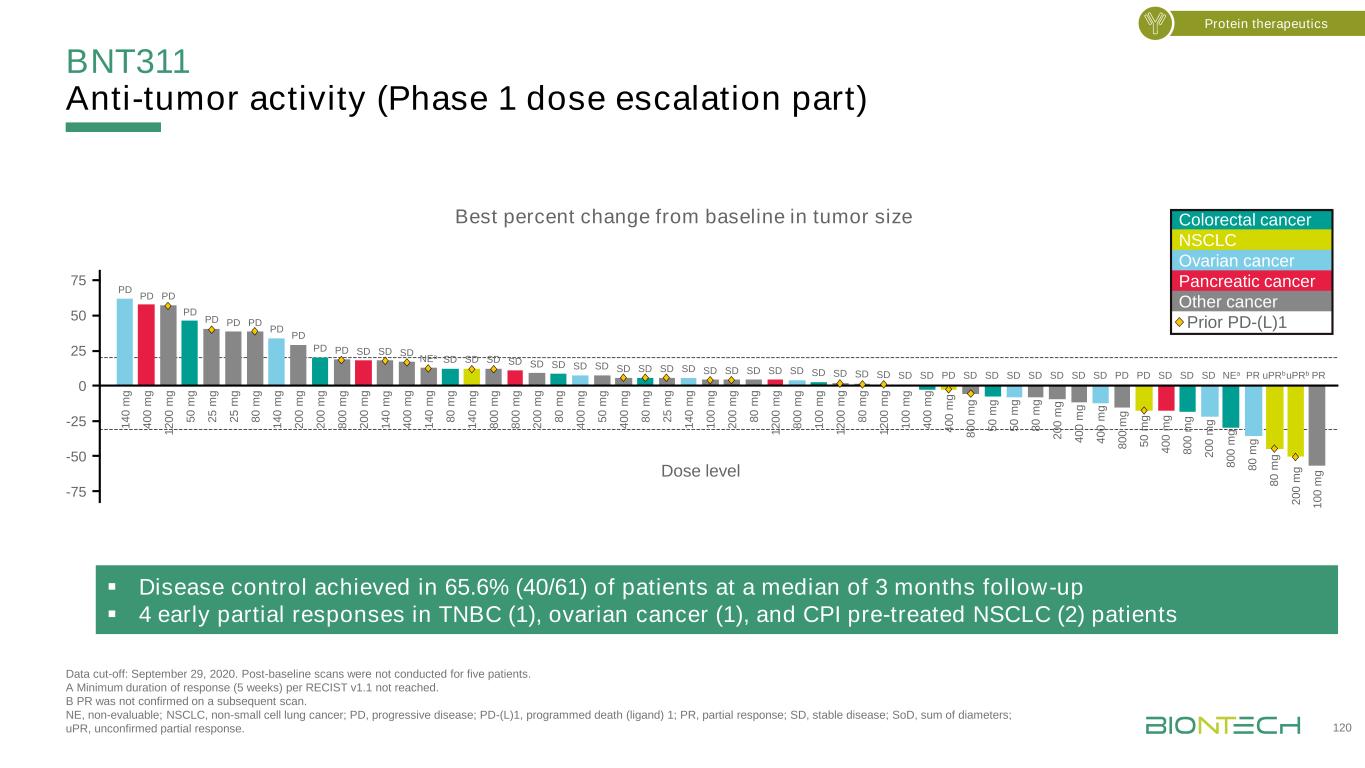
BNT311 CPI患者的临床活动-复发/难治性NSCLC数据截止日期:2020年10月12日。*PR未经随后的扫描确认。所有患者都接受了≥-1基线后肿瘤评估(每6周进行一次),因此可以进行临床受益评估;12名患者中有6名仍在接受治疗。NA,不可用,NE,不可评估;PD,进展性疾病;PR,部分反应;SD,稳定期;SOD,直径总和;UPR,未证实的部分反应。Garralda E,et al.SITC 2020年年会;海报展示412。121例蛋白质疗法·NSCLC扩展队列中的12名可评估患者,其中2名经历PR;1名UPR;4名SD靶病变较基线有PD(L)-1(n=12)的NSCLC患者(n=12)*有PD(L)-1(n=12)的NSCLC患者肿瘤大小较基线有最佳变化
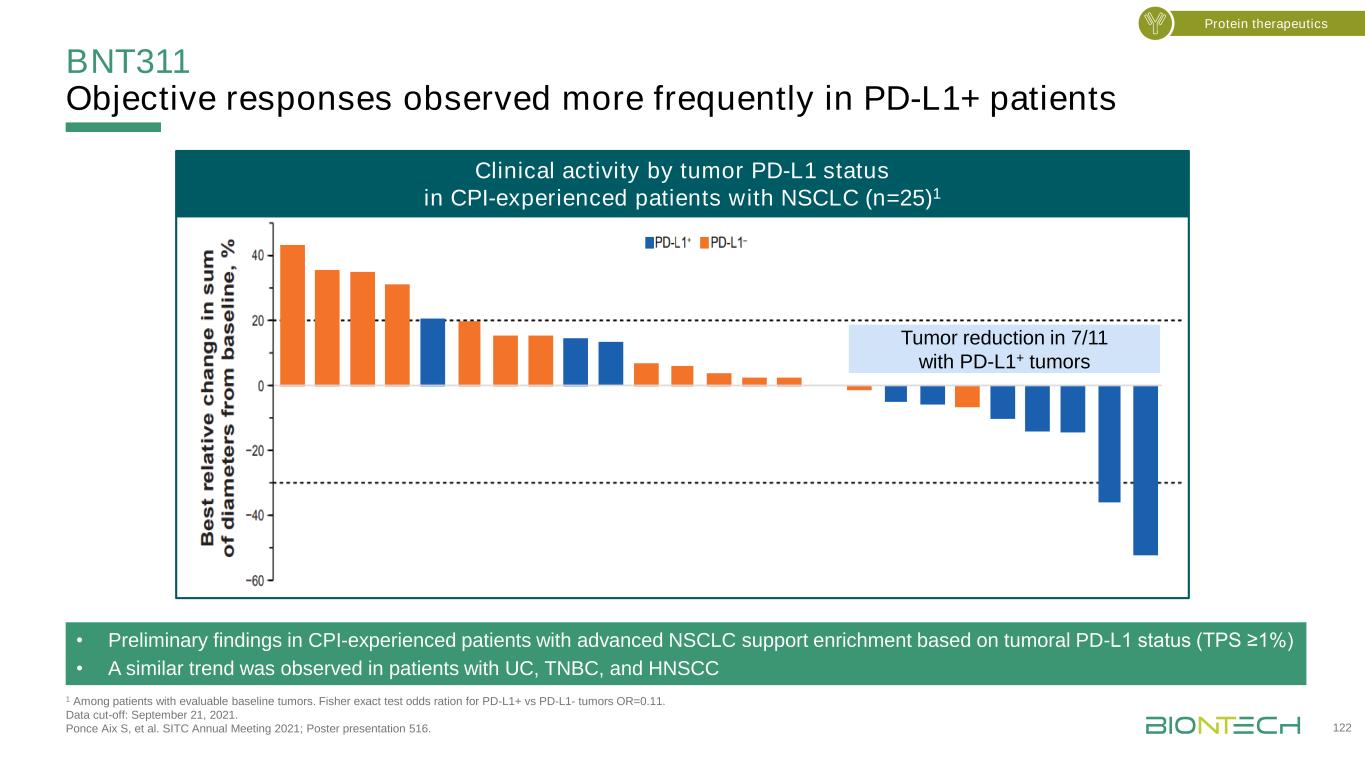
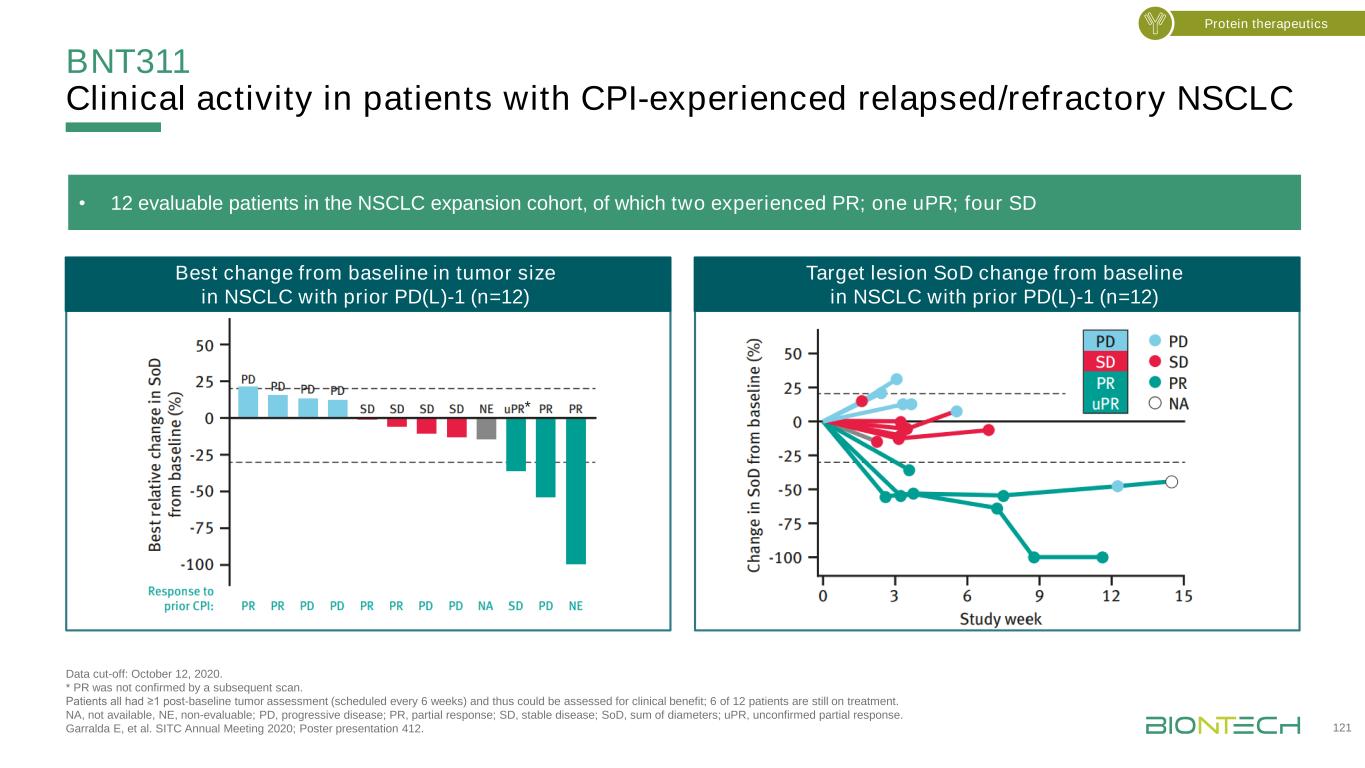
BNT311在PD-L1+患者中观察到更频繁的客观反应1在可评估的基线肿瘤患者中。Pd-L1+与Pd-L1-肿瘤的Fisher确切检验优势比OR=0.11。数据截止日:2021年9月21日。庞塞·艾克斯·S等人SITC 2021年年会;海报展示516。有CPI经历的非小细胞肺癌患者中肿瘤PD-L1状态的临床活性(n=25)1·有CPI经历的非小细胞肺癌患者中基于肿瘤PD-L1状态的晚期非小细胞肺癌支持增加的初步结果(Tps≥1%)·在UC、TNBC和HNSCC患者中观察到类似的趋势,7/11例PD-L1+肿瘤患者肿瘤减少

PD-L1×4-1BB双特异性与PD-1拮抗剂联合应用可提高临床前模型的活性1当
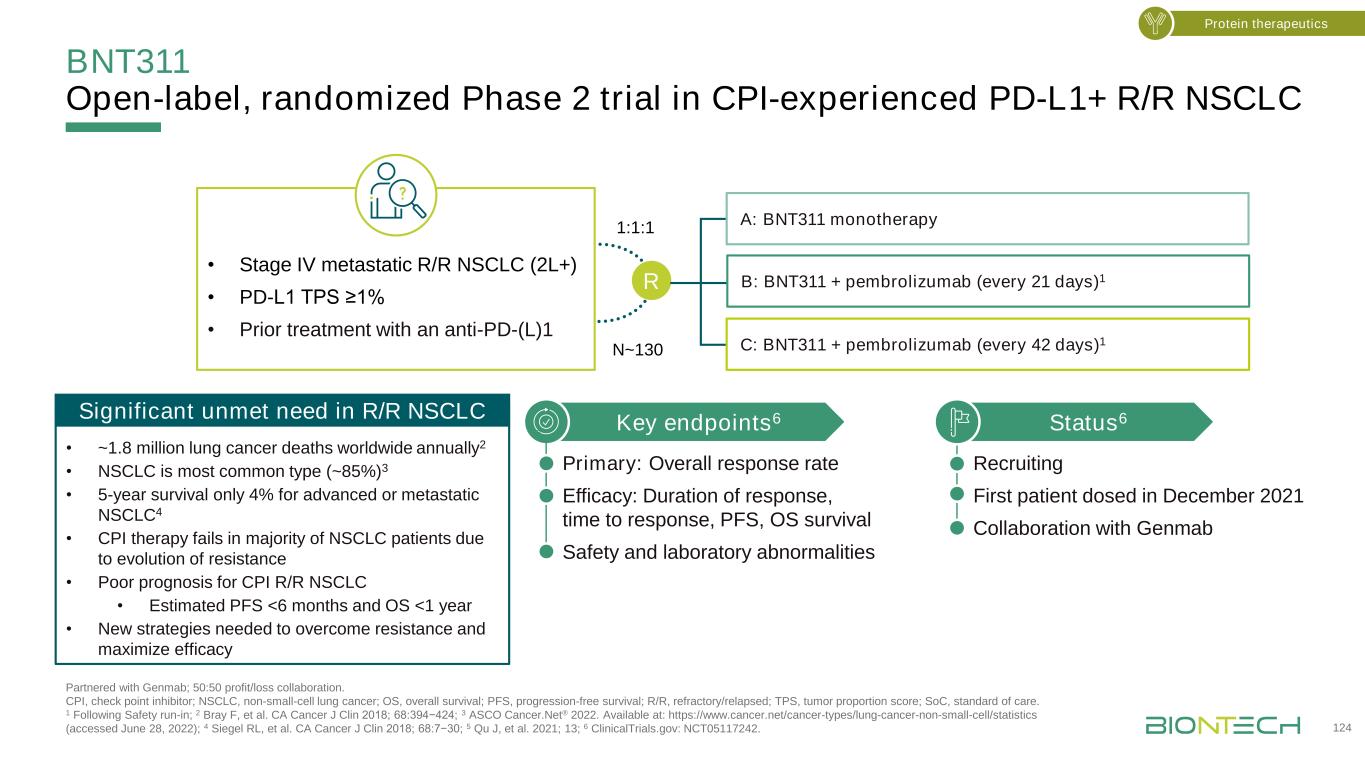
BNT311在CPI经验丰富的PD-L1+R/R非小细胞肺癌与Genmab合作的开放标签随机第二阶段试验;50:50盈亏协作。CPI,检查点抑制物;NSCLC,非小细胞肺癌;OS,总生存期;PFS,无进展生存期;R/R,难治/复发;TPS,肿瘤比例评分;SOC,护理标准。1遵循安全磨合;2 Bray F等人。《美国癌症杂志》2018年;68:394ASCO424;3ASCO Cancer.net−2022年。可从以下网站获得:https://www.cancer.net/cancer-types/lung-cancer-non-small-cell/statistics(2022年6月28日访问);4Siegel RL等人。《加州癌症杂志》2018年;68:7−30;5 QUJ等人。2021;13;6 ClinicalTrials.gov:NCT05117242。蛋白质疗法·IV期转移性R/R非小细胞肺癌(2L+)·PD-L1 TPS≥1%·接受抗PD-(L)1状态治疗6招募2021年12月给药的第一名患者与Genmab关键终点合作6主要:总应答率疗效:反应持续时间、反应时间、PFS、OS生存安全性和实验室异常N~130 R 1:1:1 A:BNT311单一疗法B:BNT311+培溴珠单抗(每21天)1 C:BNT311+培溴珠单抗(每42天)全球每年1~180万肺癌死亡2·非小细胞肺癌是最常见的类型(~85%)3·5年生存率晚期或转移性非小细胞肺癌仅4%·CPI治疗在大多数非小细胞肺癌患者中由于耐药性的演变而失败·CPI R/R非小细胞肺癌预后不良·估计PFS

BNT312双特异性抗体旨在增强T细胞和APC突触BNT312(Gen1042)与Genmab基于50/50分享成本和利润的合作;1 Muik A等。J免疫其他癌症2022;0:e004322。DOI:10.1136/JITC2021-004322。125蛋白质治疗药物惰性FC、双条件、双CD40×4-1BB激动剂有条件CD40-刺激APC和有条件4-1BB介导的T细胞刺激·两个临床前验证靶点的“双条件”“双激动剂”分子:·CD40:主要表达于APC的刺激受体。CD40的参与导致APC·4-1BB的激活和成熟:表达在T细胞和NK细胞上的共刺激肿瘤坏死因子。激活4-1BB途径可促进T细胞增殖、增强T细胞效应功能并防止T细胞死亡·惰性Fc可避免不需要的免疫细胞交联(BNT312)BNT311结合亲和力:KD CD40 1.0nmol/L,4-1BB:0.17nmol/L
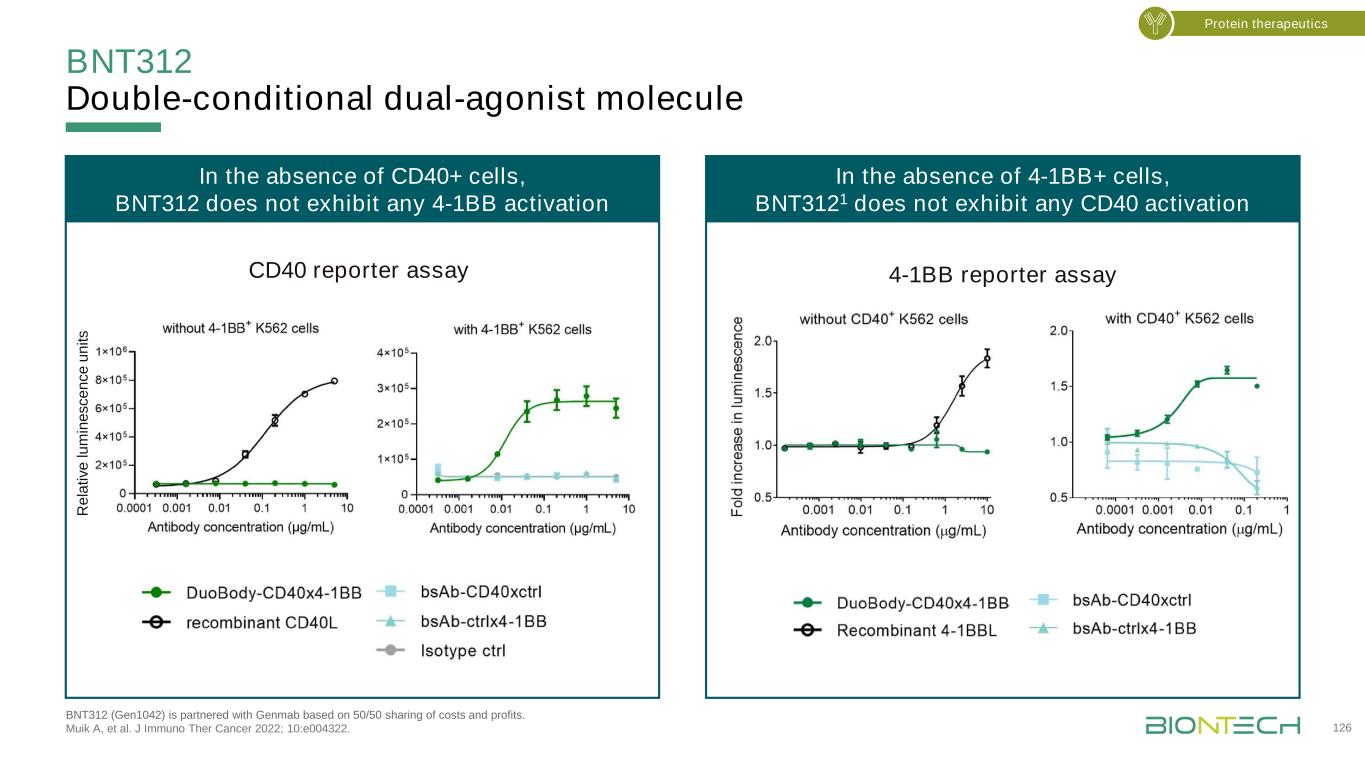
BNT312双条件双激动剂分子BNT312(Gen1042)与Genmab合作,成本和利润各占一半。Muik A等人的研究成果。J免疫治疗癌症2022;10:e004322。126蛋白质疗法在没有CD40+细胞的情况下,BNT312在没有4-1BB+细胞的情况下不表现出任何4-1BB激活,BNT3121不表现出任何CD40激活CD40报告实验4-1BB报告实验
BNT312增强了IDC的T细胞和APC 127单Z平面之间的交联,在Alexa Fluor 647-偶联的DuoBody-CD40.4-1BB(洋红)和LFA-1(绿色)抗体的存在下,IDC与预激活的CD8+T细胞共培养,在x和y轴上,同一图像的z堆叠与相对放大。在DuoBody-CD40.4-1BB或对照抗体存在的情况下,用Hoechst(蓝色)共培养的代表性荧光图像对细胞核进行反染。白虚线=DC和T细胞之间的界面加强的交联蛋白疗法BNT312(Gen1042)与Genmab基于50/50的成本和利润分担而建立合作伙伴关系。Muik A等人的研究成果。J免疫治疗癌症2022;10:e004322。
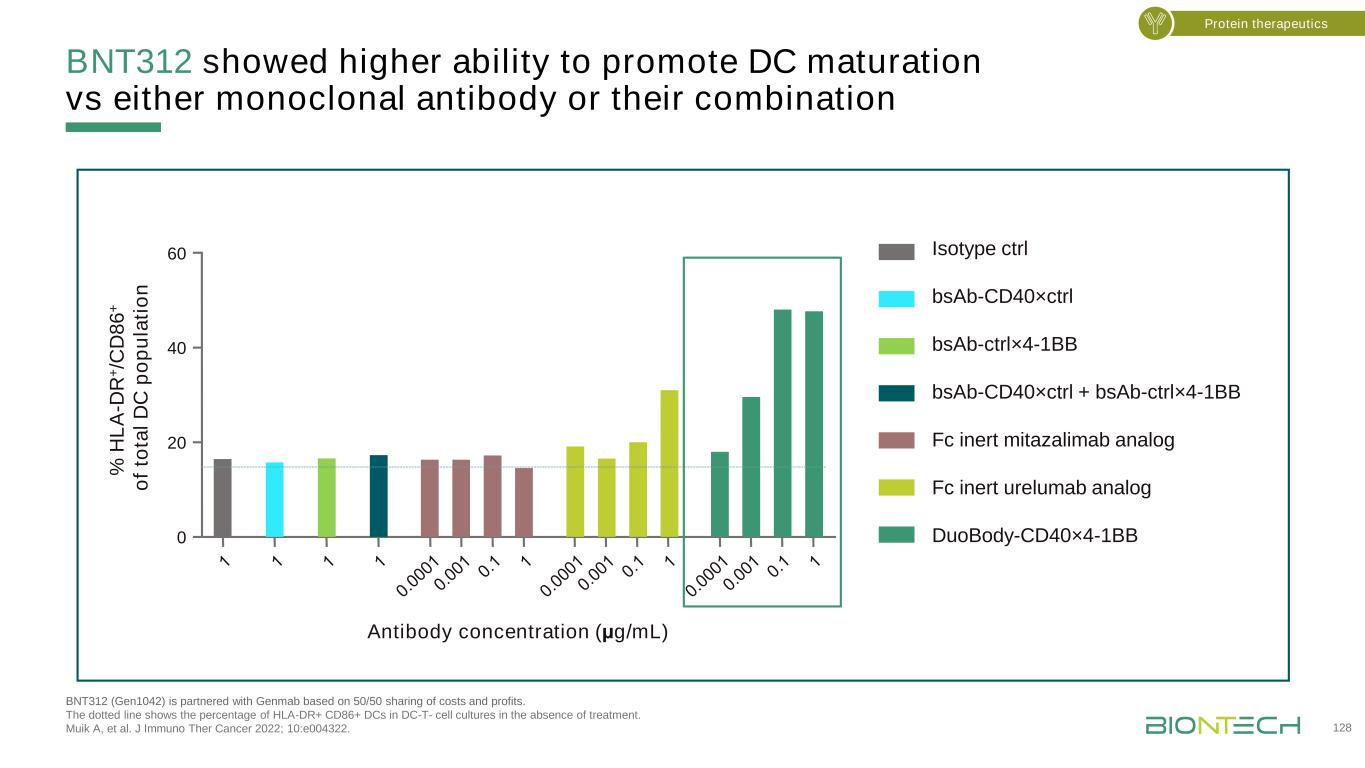
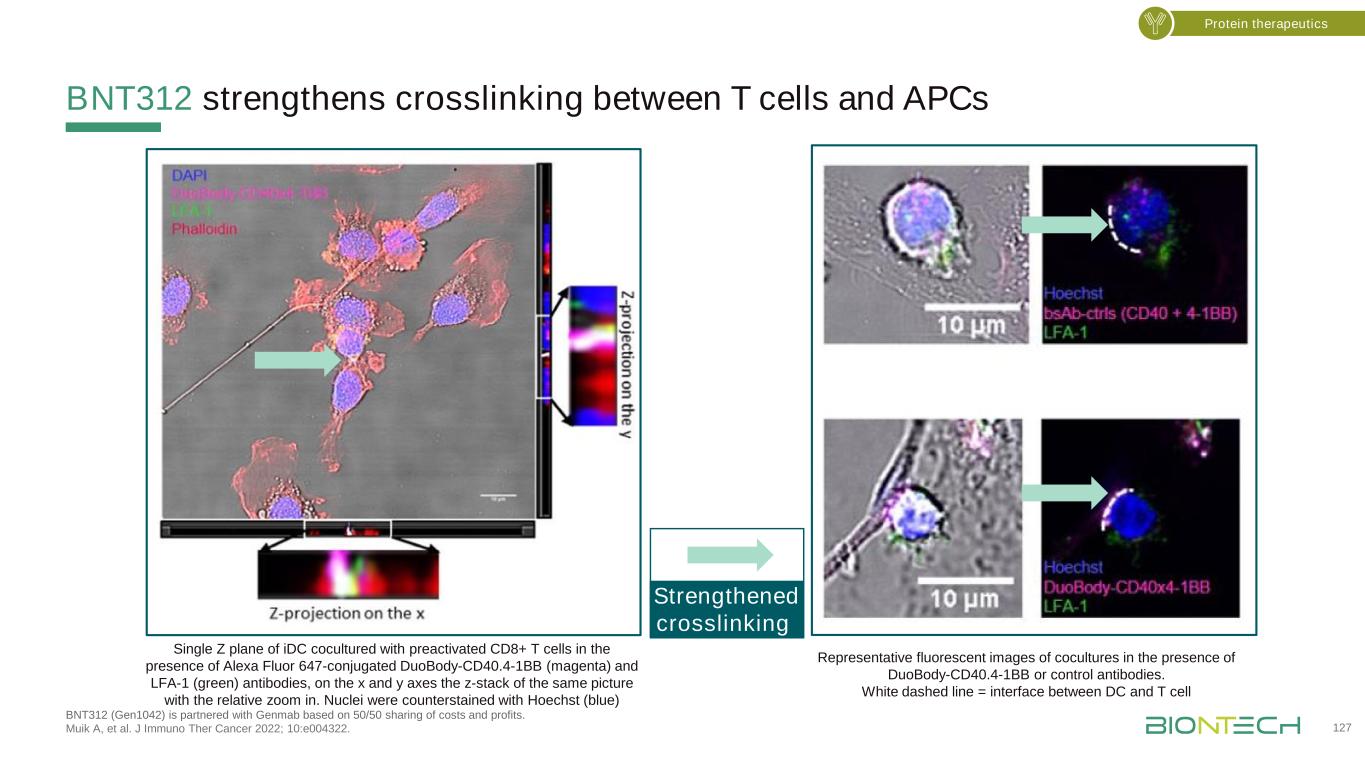
BNT312具有更强的促进DC成熟的能力,BNT312(Gen1042)与Genmab的结合体BNT312(Gen1042)与Genmab按50/50的成本和利润分摊。虚线显示未经治疗的DC-T细胞培养中人类白细胞抗原DR+CD86+DC的百分比。Muik A等人的研究成果。J免疫治疗癌症2022;10:e004322。12 8 0 20 40 60抗体浓度(μg/m L)%H LA-D R+/CD D 8 6+抗Ta l D C p o p u la ti n同型ctrl bsAb-CD40×ctrl bsAb-ctrl×4-1BB bsAb-CD40×ctrl+bsAb-ctrl×4-1BB Fc惰性米他那利单抗类似物Fc惰性urelumab类似物双抗体-CD40×4-1BB蛋白治疗
BNT312:在广泛的剂量范围内具有良好的安全性;选择100毫克作为剂量扩展阶段数据截止日期:2021年8月27日。与Genmab合作;50:50盈亏协作。CRS,细胞因子释放综合征;DLT,剂量限制性毒性;MTD,最大耐受量。Johnson M,et al.SITC 2021年年会;口头陈述493。蛋白质疗法·MTD未达到·1DLT(4级转氨酶升高200毫克)可用皮质类固醇解决·没有药物相关的≥3级血小板减少症或CRS·没有治疗相关的死亡-≥10%的紧急不良事件(N=50)
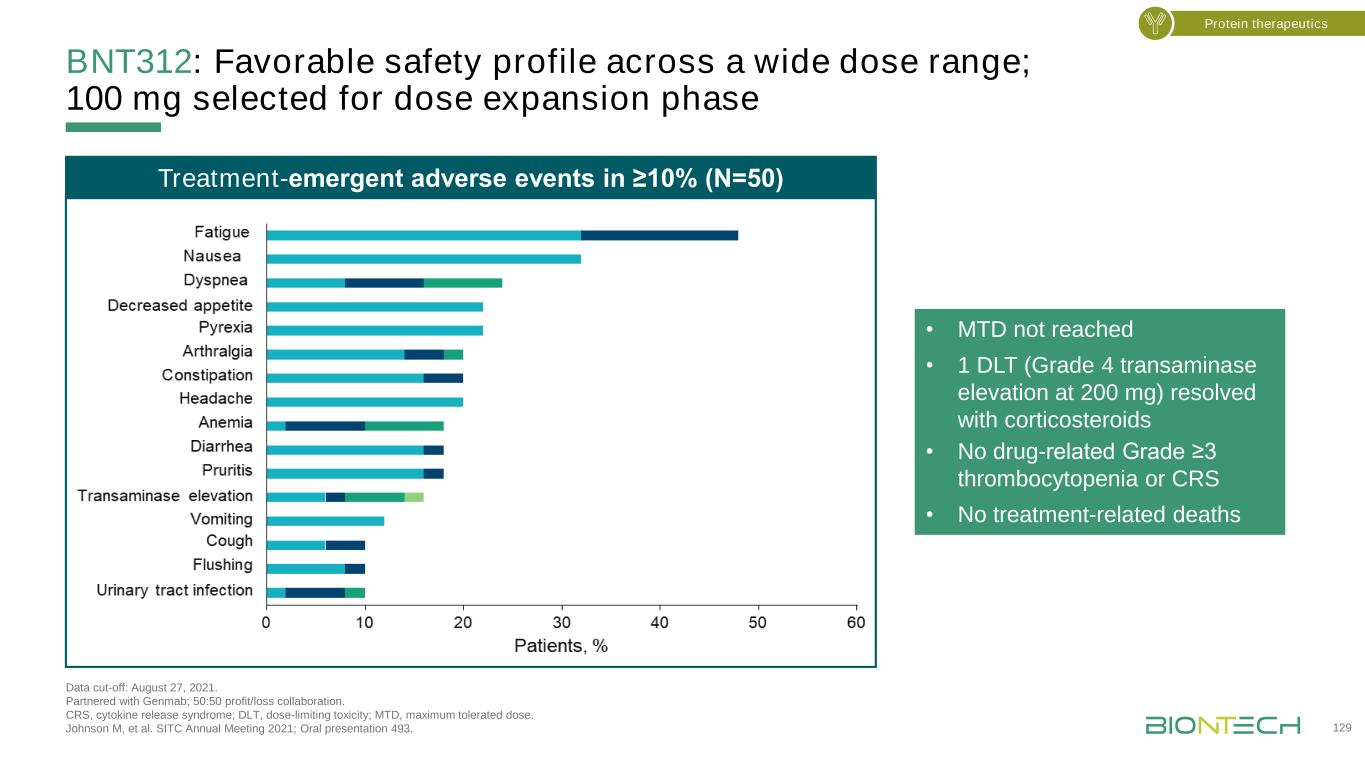
BNT312:外周生物标记物的临床调节支持其在广泛实体肿瘤中的功能数据截止日期:2021年8月27日。与Genmab合作;50:50盈亏协作。在第一个周期中,高剂量和低剂量队列的细胞因子浓度和CD8+T细胞百分比±平均标准差(SEM)的平均倍数变化。显示在任何给定点具有可用数据(N)的最小和最大患者数。APC,抗原提呈细胞;DC,树突状细胞;TARC,胸腺和激活调节的趋化因子。Johnson M,et al.SITC 2021年年会;口头陈述493。1 3 0蛋白质疗法12 0 0 80 6 0 40 2 0 0 Min=2 5;Max=2 8C1D1,Pr e C1D1,2 h C1D1,6h C1D2C1D3C1D8C1D15C2D1,Pr e Fo ld ch an g e 60 5 0 40 30 2 0 10 0 C1D1,Pr e C1D2 C1D3C1D8C1D15C2D1,Pr鄂敏=2 4;MAX=2 7 0 5 10 15 2 0 C1D 1,Pr e C 1D 1,2 h C 1 D 1,6 h C 1D 2 C 1D 3 C 1D 8 C 1D 15 C 2 D 1,Pr鄂敏=2 1,M ax=2 4 F o d c h a n g e 0 5 10 15 Min=2 4;MAX=27C1D1C1D3C1D8C1D15C2D1,Pre%KI67+CD8+Tcell s剂量≥30 mg可有效诱导促炎细胞因子的释放·高剂量更有效地诱导干扰素-≥和γ,分别表明T细胞激活和DC/APC激活(Pre%KI6 7+CD8+T cEll s剂量vs.
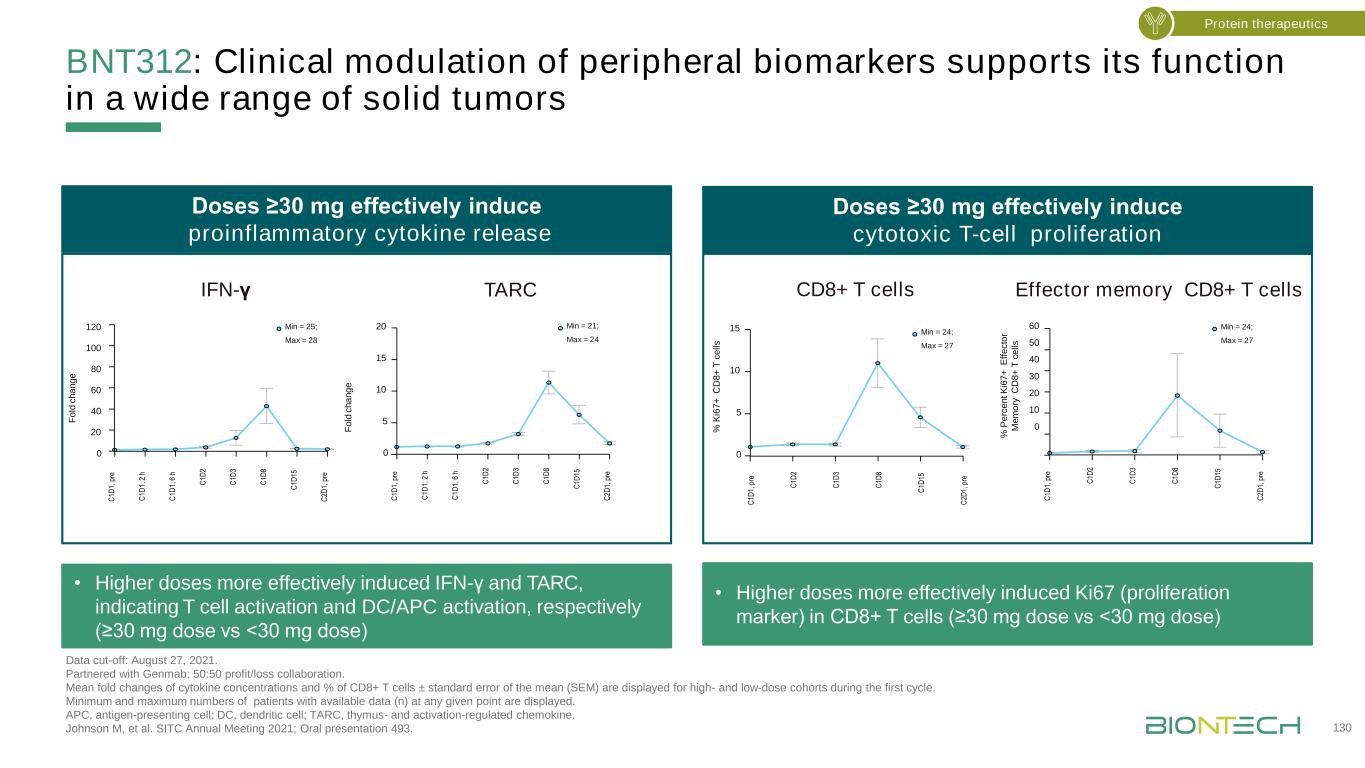
FPD,首次给药;非小细胞肺癌,非小细胞肺癌;R/R,复发/难治。1(GEN1046和GEN10542),与Genmab合作;50:50盈亏协作。蛋白质疗法近期里程碑131蛋白质疗法平台候选产品适应症下一个里程碑下一代免疫调节剂BNT311(PD-L1×4-1BB)1多种晚期实体瘤1/2期试验:8个扩展队列已完成2个队列招募正在进行,1个队列招募将开始BNT311±Pembrolizumab1 PD1+R/R NSCLC第2期正在进行(FPD,2021年12月)BNT312(CD40×4-1BB)1±抗PD1±化疗多个晚期实体肿瘤2b期联合试验扩展队列正在招募
将细胞治疗扩展到实体瘤

开发3个自体细胞治疗平台并解决新靶点,Reinhard K等人。科学2020;367:446-453133新嵌合抗原受体(CAR)1 T细胞受体(TCR)CARVac·针对细胞外靶点的自体工程细胞疗法+rna-LPX疫苗·针对新抗原的个性化体外T细胞疗法·针对细胞内外靶点的工程细胞疗法·正在开发的个性化TCR-T领先计划:BNT211针对CLDN6的CARVac计划:BNT221跨多实体肿瘤计划:KRAS,PRAME TCRs细胞治疗αCLDN6 scFCD8铰链4-1BB CD3ζαβεδεγ

·针对癌症特异性癌-胚胎抗原CLDN6的第二代CAR·CLDN6在具有高医疗需求的多种实体癌症中表达·CAR T BNT211的体内扩展、持久性和有效性:评估针对CLDN6、CLADIN 6的下一代CAR T与CARVac在实体瘤CLDN6、CLADIN 6中的1/2试验;E15,胚胎第15天;E1,细胞外环;P0,出生时。莱因哈德·K等人。科学2020;367:446-453。134CAR-T细胞治疗+CARVac RNA疫苗体内扩增CAR T细胞αCLDN6scFvCD8铰链4-1BB CD3ζ在tr a c e ll u la r E x tr a c e ll u la r E x tr a c e ll u la r r细胞治疗多种癌症中未见表达的Claudin-6在多种癌症中表达的第二阶段试验计划于2023年在睾丸癌卵巢癌中命名为EMA Prime
BNT211 16名接受大量预治疗的患者在试验数据截止日期:2022年3月10日。CLDN6,Claudin 6;Dl,剂量水平。Haanen J,et al.AACR 2022年年会;口头报告CT002。135名患者特征单一治疗DL1(n=3)联合DL1(n=3)单一治疗DL2(n=6)联合DL2(n=4)总计(n=16)中位年龄、年龄(范围)33(25-68)41(27-56)56(35-66)44(23-61)46(23-68)性别(男/女)癌症类型n/n 2/1 3/03/3 2/2 10/6N睾丸卵巢子宫内膜输卵管肉瘤胃1 1 0 0 1 0 3 0 0 0 2 1 1 1 0 1 2 2 0 0 0 8 4 1 11 1中位CLDN6 II/III+细胞百分比(范围)60(60-80)90(90-95)82.5(50-90)95(75-100)85(50-100)治疗前中位数(范围)4(3-5)4(3-4)5(2-7)5(3-7)4(2-7)
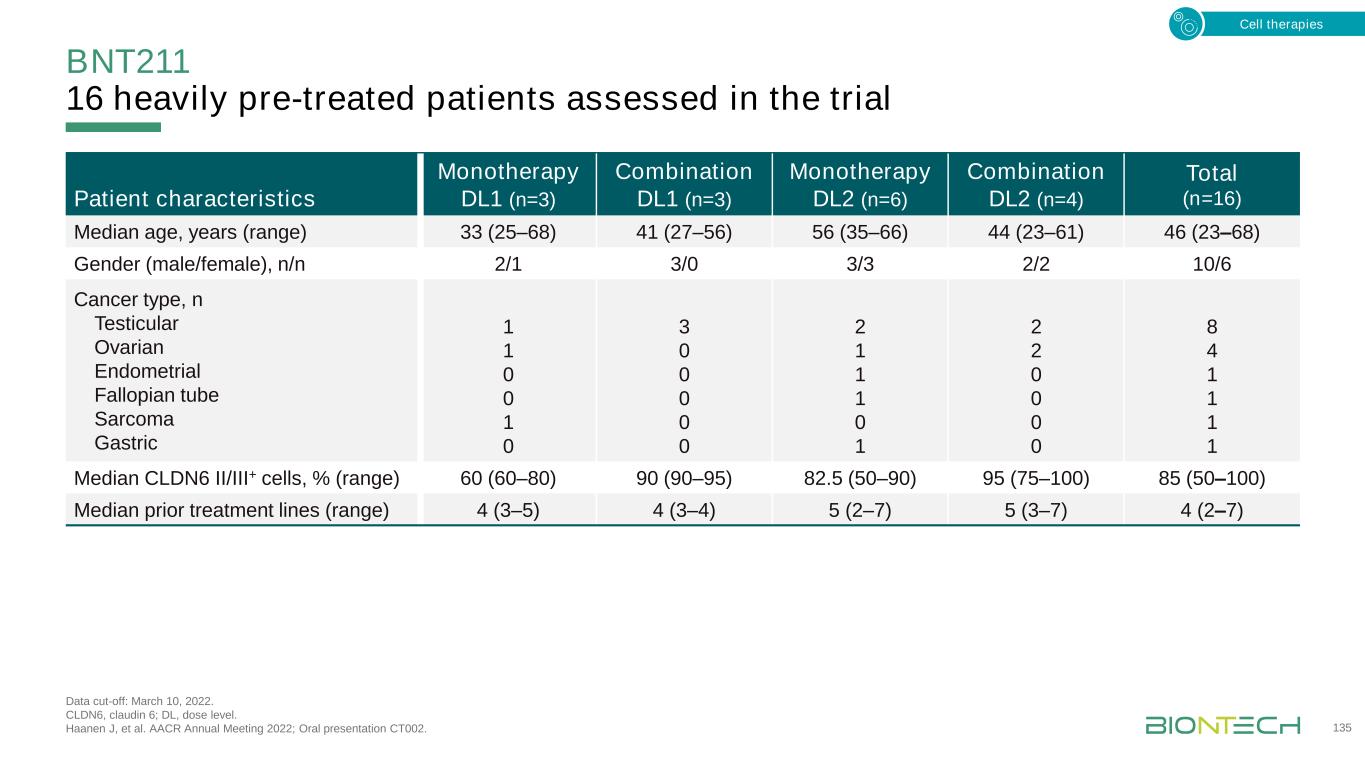
BNT211在评估数据截止的剂量水平上耐受性良好:2022年3月10日。不良事件;CAR,嵌合抗原受体;CARVac,CAR T细胞放大RNA疫苗;CRS,细胞因子释放综合征;DL,剂量水平;DLT,剂量限制性毒性;HLH,噬血细胞淋巴组织细胞增多症;ICANS,免疫效应细胞相关神经毒性综合征;SAE,严重AE。Haanen J,et al.AACR 2022年年会;口头报告CT002。136次单一治疗DL1(n=3)联合DL1(n=3)单一治疗DL2(n=6)联合DL2(n=4)总(n=16)随访天数(范围)284(111-348)38(29-156)157(99-241)93(52-127)127(2-348)次CARVac注射中位数,n(范围)N/A 2(1-6)N/A 4(3-5)N/A安全性,N单一治疗DL1(n=3)联合DL1(n=3)单一治疗DL2(n=6)联合DL2(n=4)总计(n=16)DLTS 0 0 1 12 2例≥3 AE3 3 3 5 4 15 AEs 3怀疑与BNT211 4 8 11 2 2 45例CRS 0 1 4 3 8例ICAN 0 1 0 1死亡疾病进展SAE 1 0 2 0 2 0 0 0 5 0·2 DLT观察:淋巴清除后全血细胞减少延长(单一治疗DL2)和HLH(联合DL2,开始CARVAC前)·所有CRS均为1或2级;据报道,70%的DL2患者可通过使用tocilizumab(如果需要)细胞疗法进行治疗
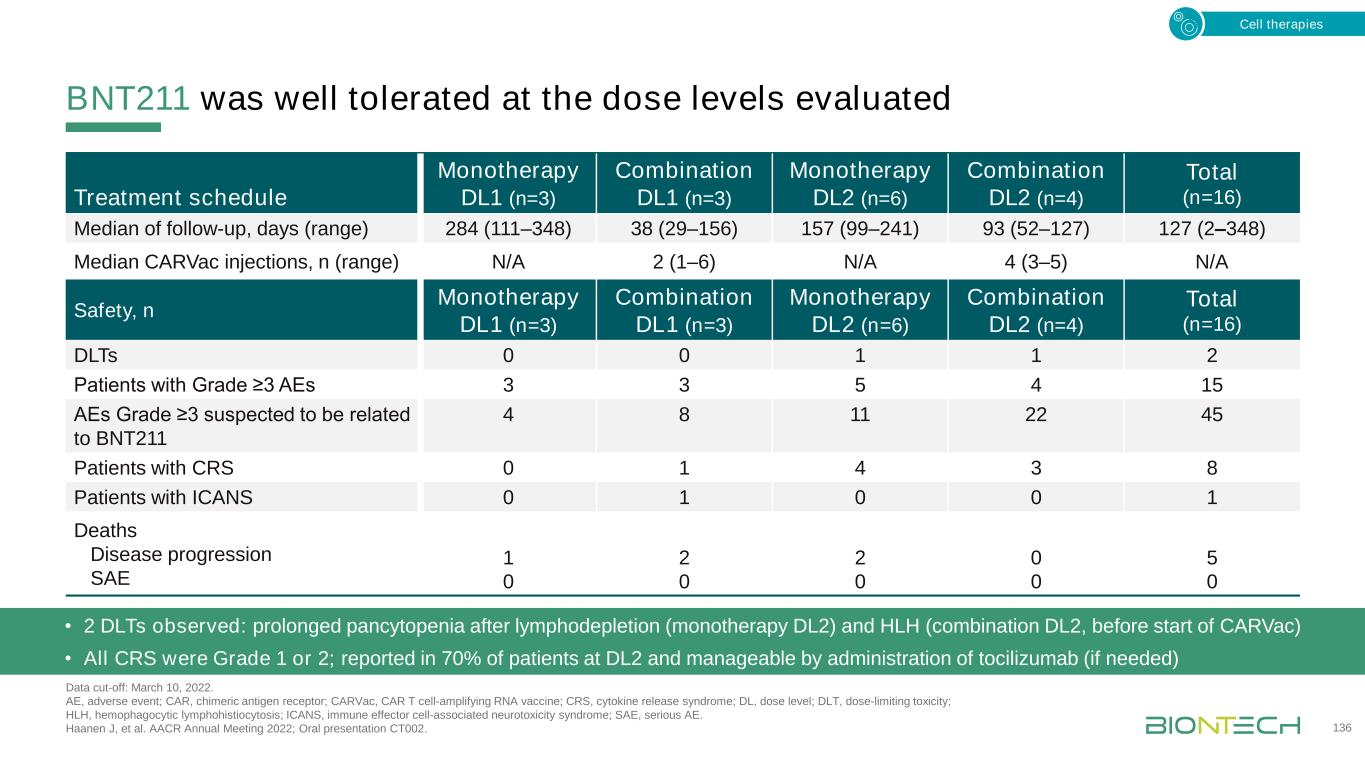
BNT211,ORR 43%,DCR 86%(PR 6例,SD+5例,SD 1例),截止时间:2022年3月10日;首次评估,输注后6周。ACT,过继细胞转移;CR,完全缓解;DCR,疾病控制率;EoT,试验结束(由于PD);PD,进展性疾病;PR,部分反应;SD(+),稳定疾病(目标皮损缩小)。Haanen J,et al.AACR 2022年年会;口头报告CT002。137ACT 6周12周18周24周PR SD+PD CR PAT#1 PAT#2 PAT#3 30周36周PAT#1 Mono DL1 Combo DL1 Mono DL2 42周48周EoT Mono→组合PAT#1 PAT#2 PAT#3 PAT#4 PAT#5 PAT#2 Combo DL2 SD PAT#6 PAT#5 PAT#6修复PAT#3 PAT#4其他不包括不可评估的PAT#1(50%淋巴清除)在DL2睾丸癌(n=5,包括减少LD):最佳总体应答率̶80%,DCR100%(1个CR,3个PR,1个SD+)细胞疗法
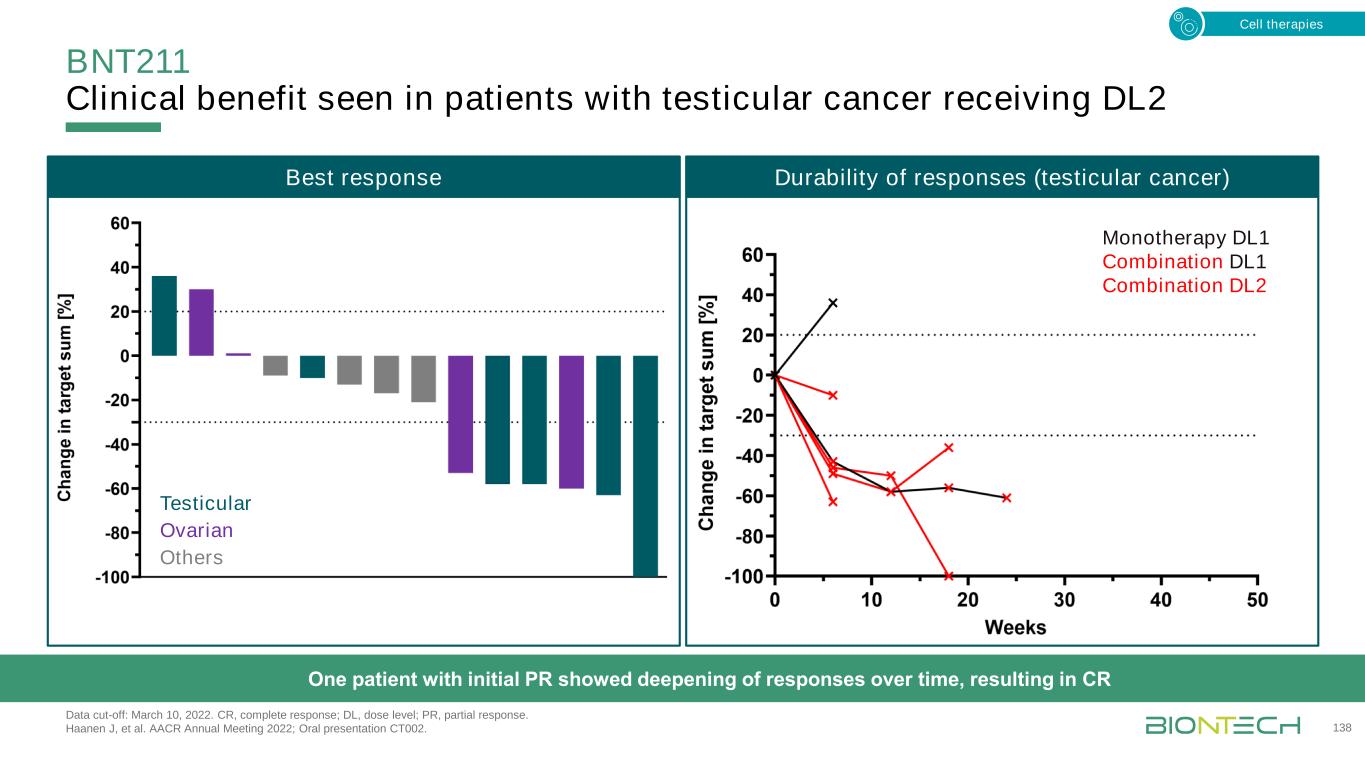
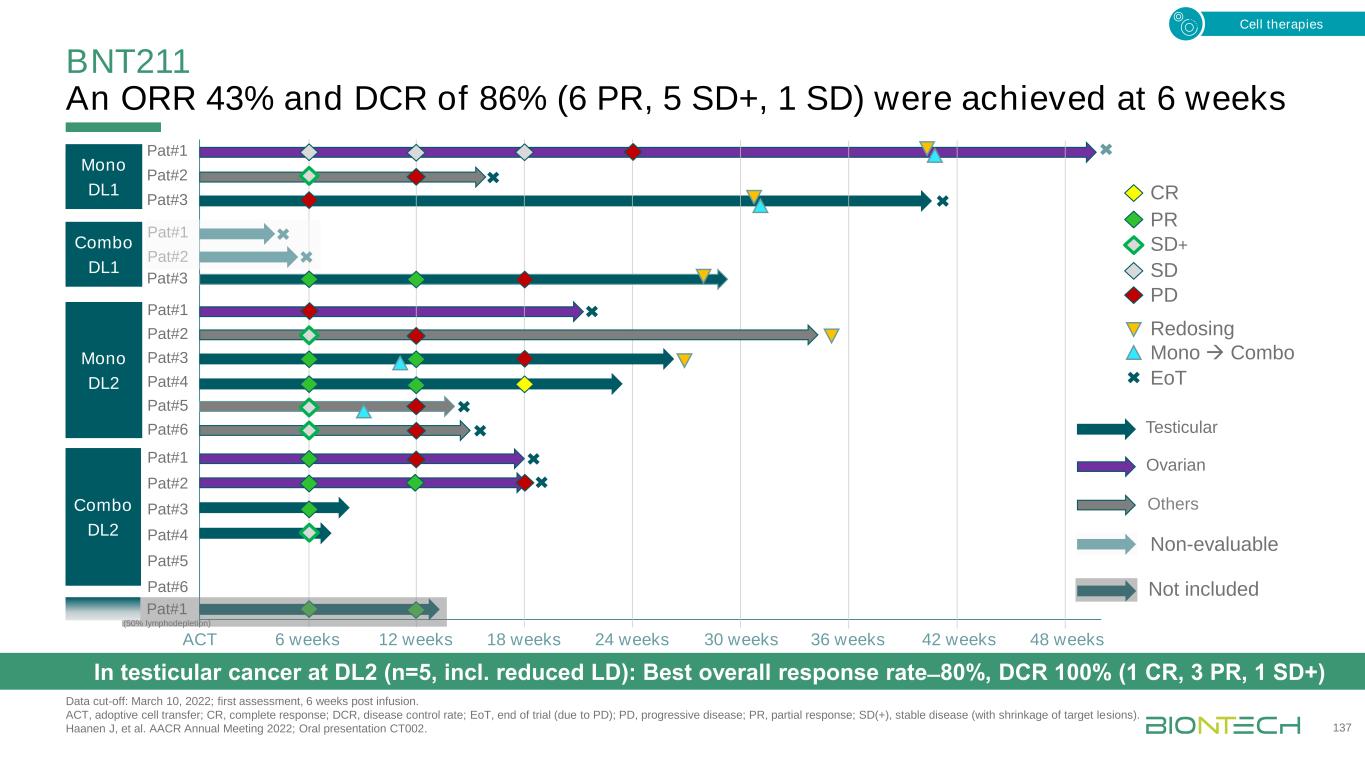
接受DL2数据截止的睾丸癌患者的BNT211临床益处:2022年3月10日。CR,完全反应;DL,剂量水平;PR,部分反应。Haanen J,et al.AACR 2022年年会;口头报告CT002。138个睾丸卵巢其他一个初次PR的患者随着时间的推移表现出反应的加深,导致CR单一疗法DL1联合DL1联合DL2细胞治疗反应的最佳反应持久性(睾丸癌)

两名睾丸癌患者的BNT211反应数据截止日期:2022年3月10日。甲胎蛋白;CAR,嵌合抗原受体;CARVac,CAR T细胞扩增RNA疫苗;CLDN6,claudin 6;CR,完全应答;d,天;DL,剂量水平。Haanen J,et al.AACR 2022年年会;口头报告CT002。139 12周后扫描患者1 61岁男性确诊2008(DL2:1×108)患者2 56岁男性确诊2020(DL1:1×107+CARVac)输注后6周基线12周后·未发现新病变·肿瘤标志物(AFP)处于正常水平·正在进行CR·在初步应答后,发现新病变·治疗中活检显示CLDN6阳性·再次接受d197细胞治疗
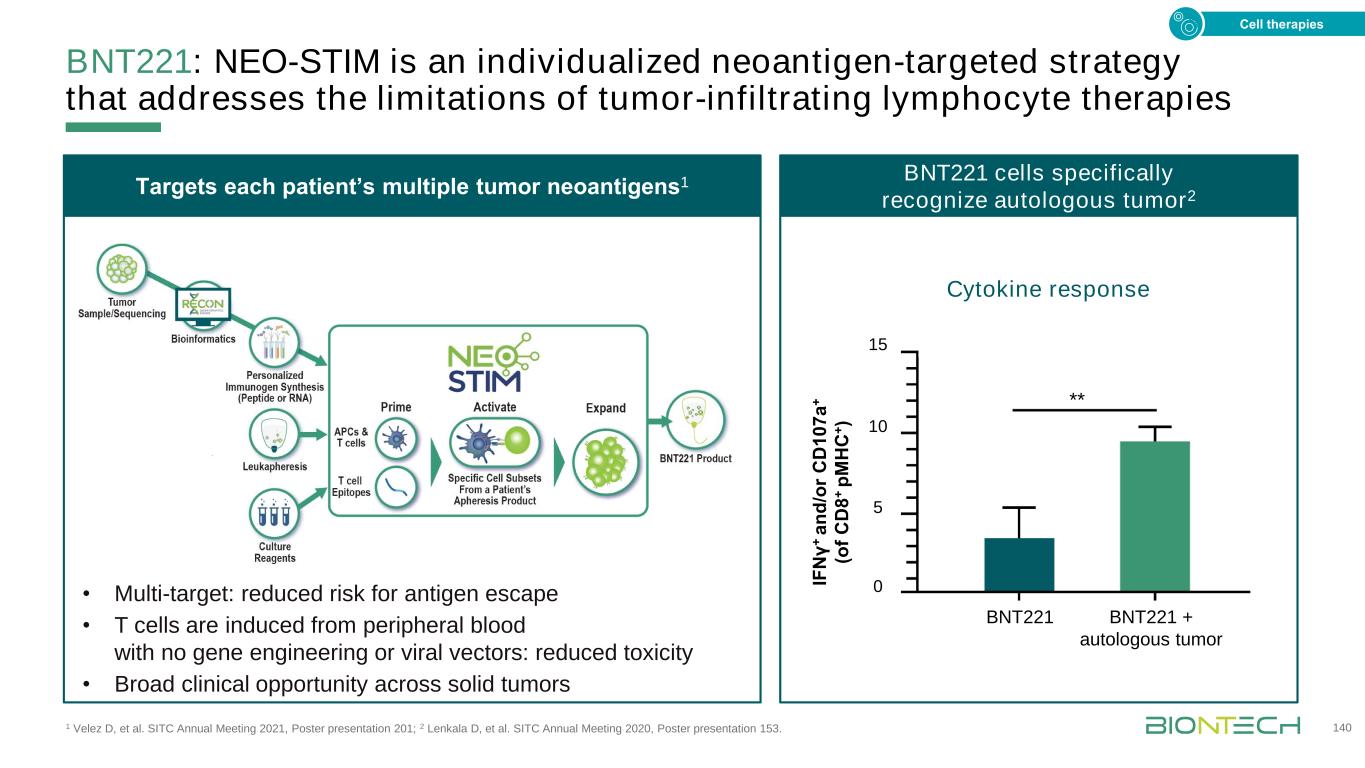
BNT221:NEO-STIM是一种个体化的新抗原靶向策略,解决了肿瘤浸润性淋巴细胞疗法的局限性1,Velez D等人。SITC 2021年年会,海报展示201;2 Lenkala D,等人。SITC 2020年年会,海报展示153。140针对每个患者的多种肿瘤新药1 BNT221 BNT221+自体肿瘤**如果Nγ+d/或r C D 1 0 7a+(o f C D 8+p M H C+)15 10 5 0细胞因子反应·多靶点:降低抗原逃逸的风险·T细胞从外周血中诱导而不使用基因工程或病毒载体:降低毒性·跨实体肿瘤广泛的临床机会BNT221细胞专门识别自体肿瘤2细胞疗法
BNT221在PD-1难治性转移性黑色素瘤患者中的1期试验,Velez D等人。SITC 2021年年会,海报展示201;ClinicalTrials.gov:NCT04625205。141 A组剂量递增(3×3)·无法切除或转移性黑色素瘤·抗PD-1进展·接受抗CTLA-4状态招募多达20名患者将在剂量扩展B组关键临床活动(ORR,反应持久性)免疫监测细胞存活·不可切除或转移性黑色素瘤·稳定或无症状进展抗PD-1±抗CTLA-4队列B剂量扩展选定剂量细胞疗法
TCR发现平台,用于肿瘤和患者特定的治疗TCR,T细胞受体。142种细胞疗法·技术迭代·与其他资产(例如核细胞因子)的结合·收购:PRAME-TCR和PD1-41BB Switch(Medigene,2022年2月)·TCR仓库:多个TCR,针对一个或多个抗原·类库方法,增加新的靶点和HL A等位基因·与Medigene研发合作·按需识别新表位,及时制造定制的T细胞·收购:新抗原TCR平台(Kite,2021年7月)在实体瘤广泛覆盖患者的个性化治疗中建立TCR平台

核细胞因子
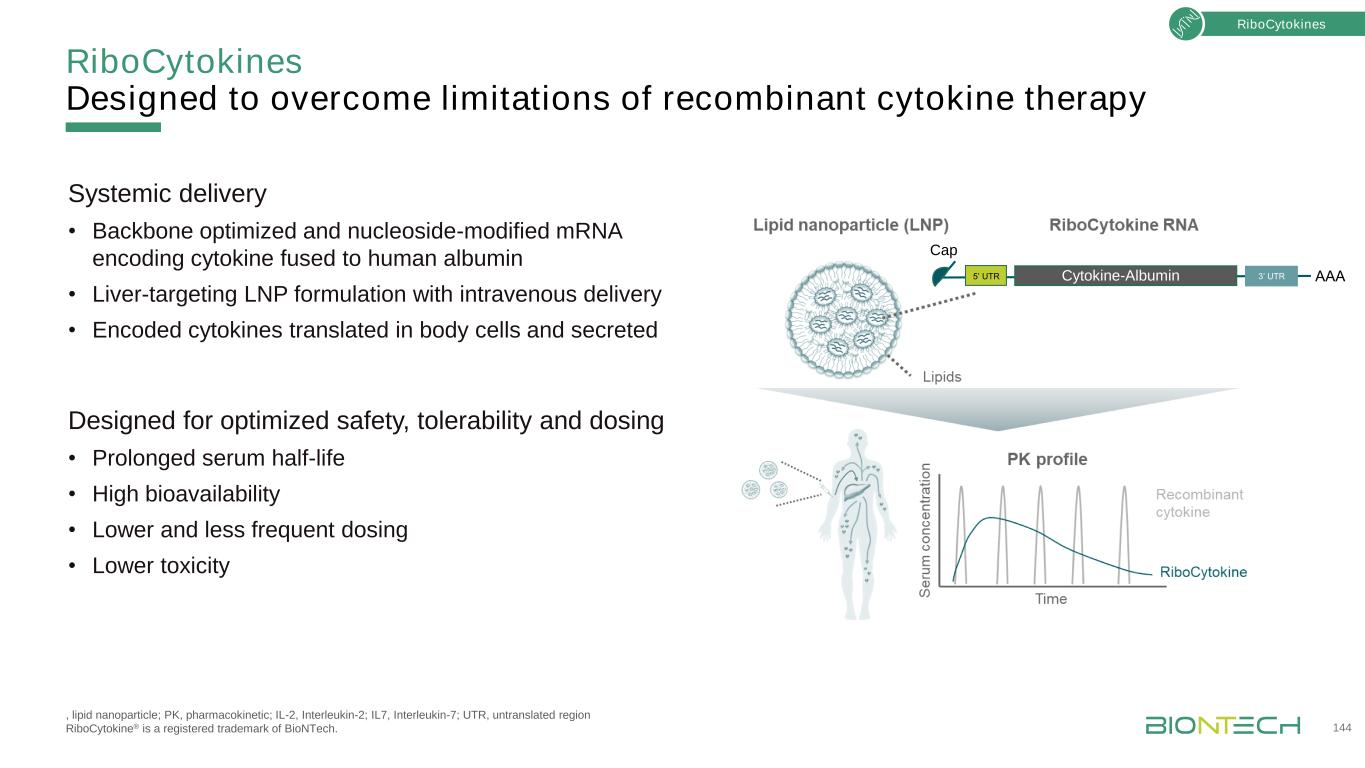
为克服重组细胞因子治疗的局限性而设计的核细胞因子,脂质纳米粒;PK,药代动力学;IL-2,白介素2;白介素7;非翻译区核细胞因子®是BioNtech的注册商标。144种核细胞因子系统递送·骨架优化和核苷修饰的编码细胞因子的mRNA与人白蛋白融合·肝靶向静脉递送LNP制剂·编码的细胞因子在体内细胞中转译并分泌,以优化安全性、耐受性和剂量·延长血清半衰期·高生物利用度·更低和更少的给药频率·较低的毒性5‘UTR3’UTRAAA帽细胞因子-白蛋白

BNT151刺激CD8+和NK细胞,而不广泛触发Treg细胞Vormehr M等人。SITC 2019年年会;海报展示626。·与IL-2Rα的结合减弱·旨在刺激低表达或不表达IL-2Rα的幼稚和效应性T细胞(CD25low/neg),而不广泛触发免疫抑制调节性T细胞·增加与IL-2Rβ核细胞因子IL-2RαIL-2RβIL-2Rγ的结合
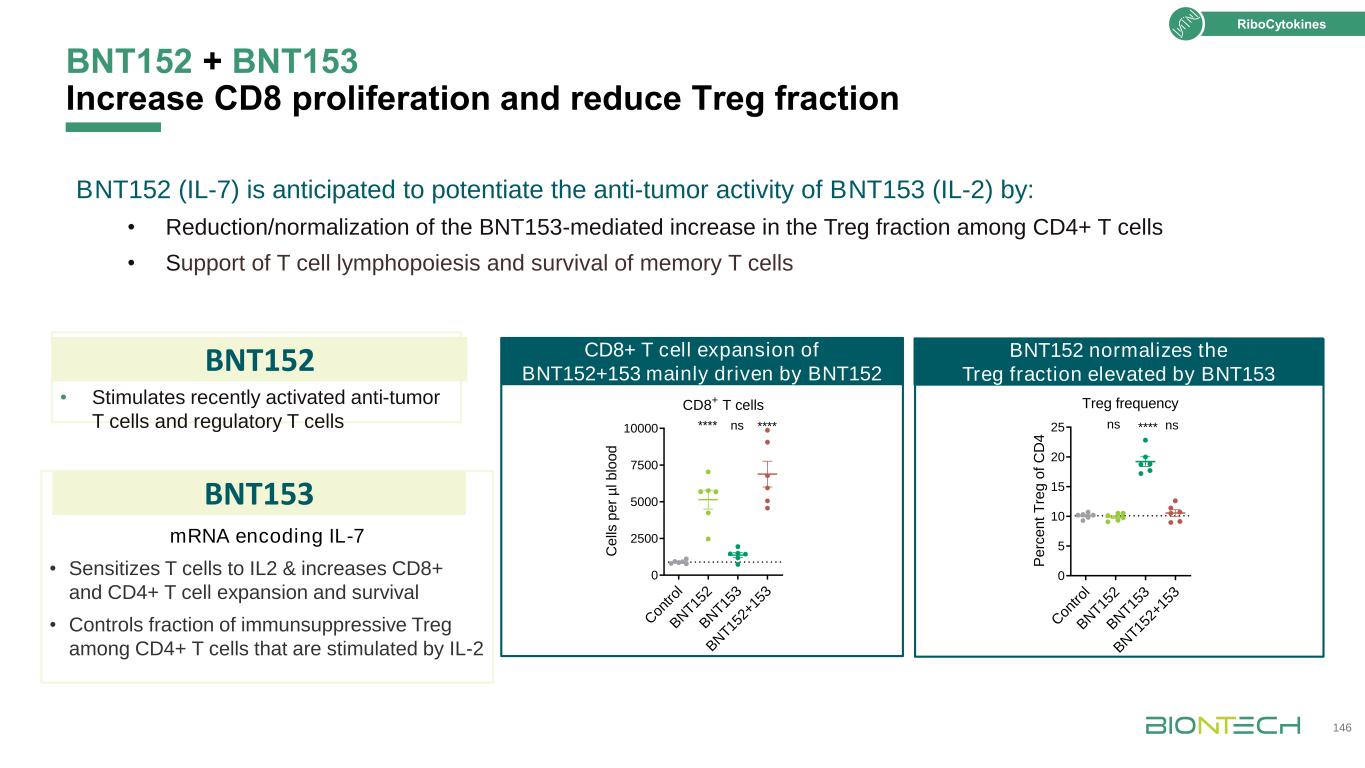
·刺激最近激活的抗肿瘤T细胞和编码IL-7的调节性T细胞mRNA·增强T细胞对IL-2的敏感性,增加CD8+和CD4+T细胞的扩增和存活·控制IL-2刺激的CD4+T细胞中免疫抑制Treg的部分BNT152+BNT153促进CD8增殖和减少Treg部分146 BNT152 BNT153(IL-7)有望通过以下方式增强BNT153(IL-2)的抗肿瘤活性:·降低/正常化BNT153介导的CD4+T细胞中Treg比例的增加·支持T细胞的生成和记忆T细胞的存活在tro l B N T15 2 B N T15 2+15 3 B N T15 2 B N T15 3 B N T15 2+15 3 B N T15 2+15 3 0 5 10 15 20 20 25*nsCD8+T细胞C在tro l B N T15 2 B N T15 2 B N T15 3 B N T15 2+15 3 0 2 500 5000 7500 10000 ns上

BNT152+BNT153结合基因疫苗Kranz LM等人。SITC 2019年年会;海报展示620。147 BNT152联合RNA疫苗在CT26模型中增强BNT153的治疗抗肿瘤活性BNT152+BNT153在第二次治疗后7天优先扩增疫苗诱导的CD8+T细胞1 10 10 100 1,000 10,000 10,000 CD8+T细胞,Cd 8+T细胞非E7特异性E7特异性*vac:BNT153:mIL7:IRR++E7+-E7-+E7+核细胞因子
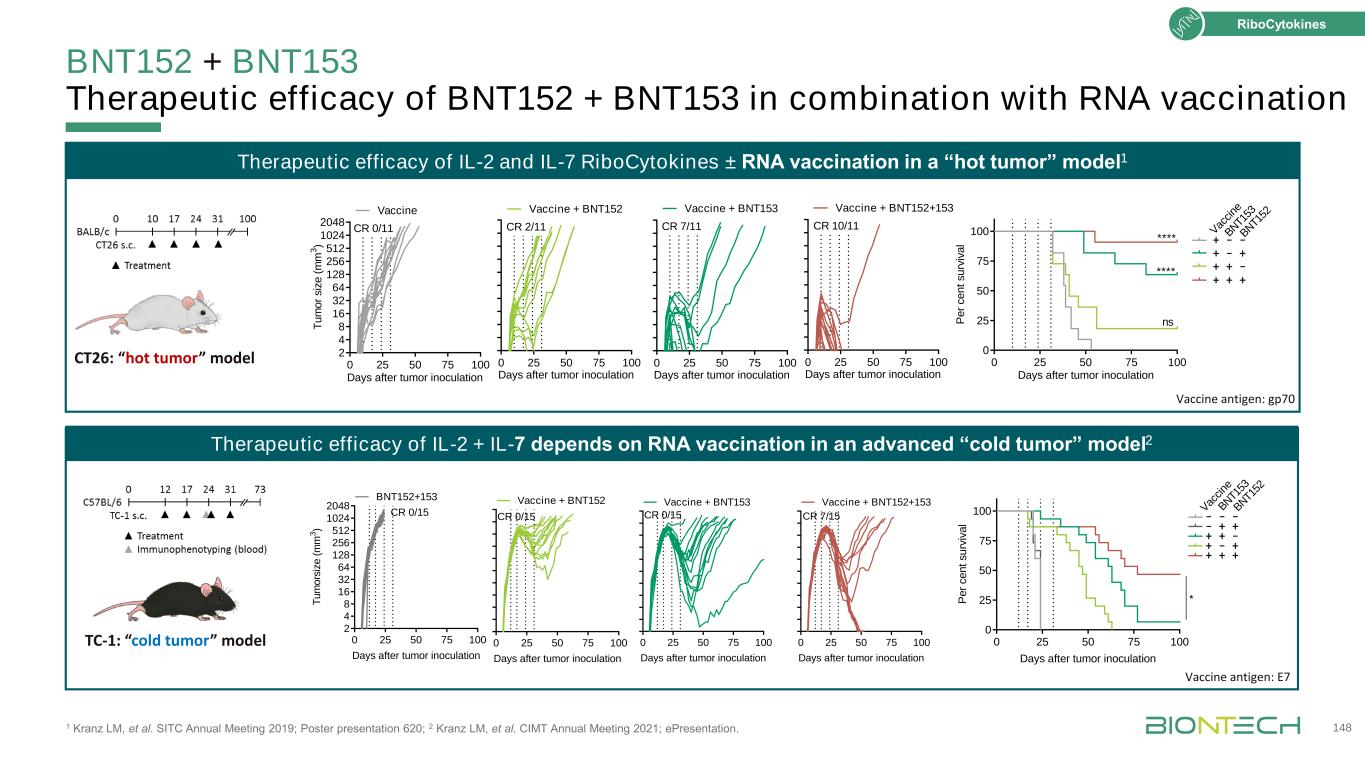
BNT152+BNT153联合RNA疫苗1 Kranz LM等的治疗效果SITC 2019年年会;海报展示620;2 Kranz LM,等人。CIMT 2021年年会;电子演示。肿瘤接种后148 0 25 50 75 75 100 0 25 50 75 U RV iv a l V ac ne---+++-+++*BN T1 53 BN T1 52 0 25 50 75 100 2 4 8 16 32 64 128 256 512 1024 2048肿瘤接种后CR0/11 0 25 50 75 75 100天肿瘤接种CR 7/11疫苗+BNT153 0 25 50 75 75 100天接种疫苗+BNT152接种疫苗+BNT152接种疫苗100天+BNT152+153 CR 10/11 TC-1:冷瘤模型0 25 50 75 100 2 4 8 16 32 64 128 256 512 1024 2048天(立方米)CR0/15 BNT152+153 0 25 50 75 100天CR0/15疫苗+BNT152 0 25 50 75 100天+BNT152 0 25 50 75 100天CR 7/15疫苗+BNT152+153肿瘤接种后0 25 50 75 100 0 25 50 75 rv iv a l*ns*Vac ci ne BN T1 53 BN T1 52+-+++CT26:“热肿瘤”模型疫苗抗原:gp70疫苗抗原:E7 IL-2+IL-7的疗效取决于晚期“冷肿瘤”模型中的RNA接种2 IL-2和IL-7核细胞因子±RNA疫苗在“热肿瘤”模型1中的治疗效果
BNT151联合T细胞疫苗的治疗活性1 Kranz LM等。SITC 2019年年会;海报展示620;2 Kranz LM,等人。CIMT 2021年年会;电子演示。肿瘤接种后149天,核细胞因子TRP1疫苗+hIL2 TRP1疫苗+对照+hIL2对照+BNT151 0 25 50 75 0 250 500 750 1000 1250 1500 1750天。*对照TRP1疫苗+BNT151 0 10 20 30 40 TRP1特异性CD8+T细胞接种天数:hIL2:BNT151:+---+++-++*nsB16F10 S.C.肿瘤疫苗靶点:肿瘤疫苗靶点:TRP1(含CD8 T细胞表位的分化抗原)C57BL/6 0 10 20 30 40 CD8+与Treg的比值CD8+与T细胞的比例疫苗:hIL2:BNT151:+---+++-+-+*ns0 20 40 60 80 2 4 8 16 32 64 128 256 512 1024 2048天后T(M 3)gp70疫苗0/11 CR 0 20 40肿瘤接种后60 80天7/11 CR gp70疫苗+hIL 2 0 20 40 60 80天gp70疫苗+BNT151 11/11 CR 0 20 40 60 80 2 4 8 16 32 64 128 256 512 1024 2048(立方米)gp70疫苗0/11 CR 0 20 40 6 6 8天7/11 CR gp70疫苗+hIL 2 0 20 40 60 60 80天gp70疫苗+BNT151 11/11 CR 0 20 40 60 2 4 8 32 64 128 256 512Gp70疫苗接种后1024 2048d或s(M M 3)gp70疫苗接种后0/11 CR 0 20 40 60 8 d 7/11 CR gp70疫苗+hIL 2 0 20 40 60 80 d周期gp70疫苗+BNT151 11/11 CR疫苗单独疫苗+hIL-2疫苗+BNT151 Vormehr M,等人的研究。SITC 2019年年会;海报展示626。BNT151对RNA-LPX疫苗治疗效果的实质性提高
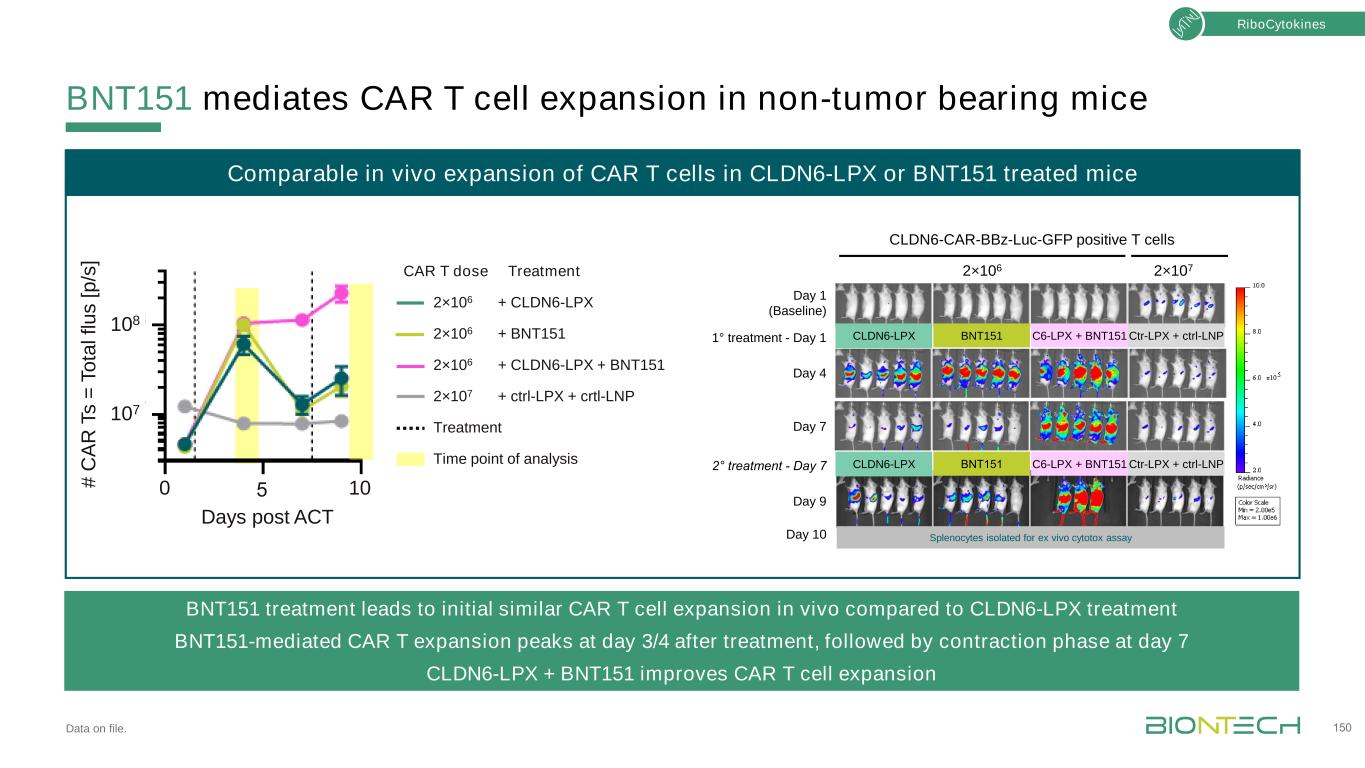
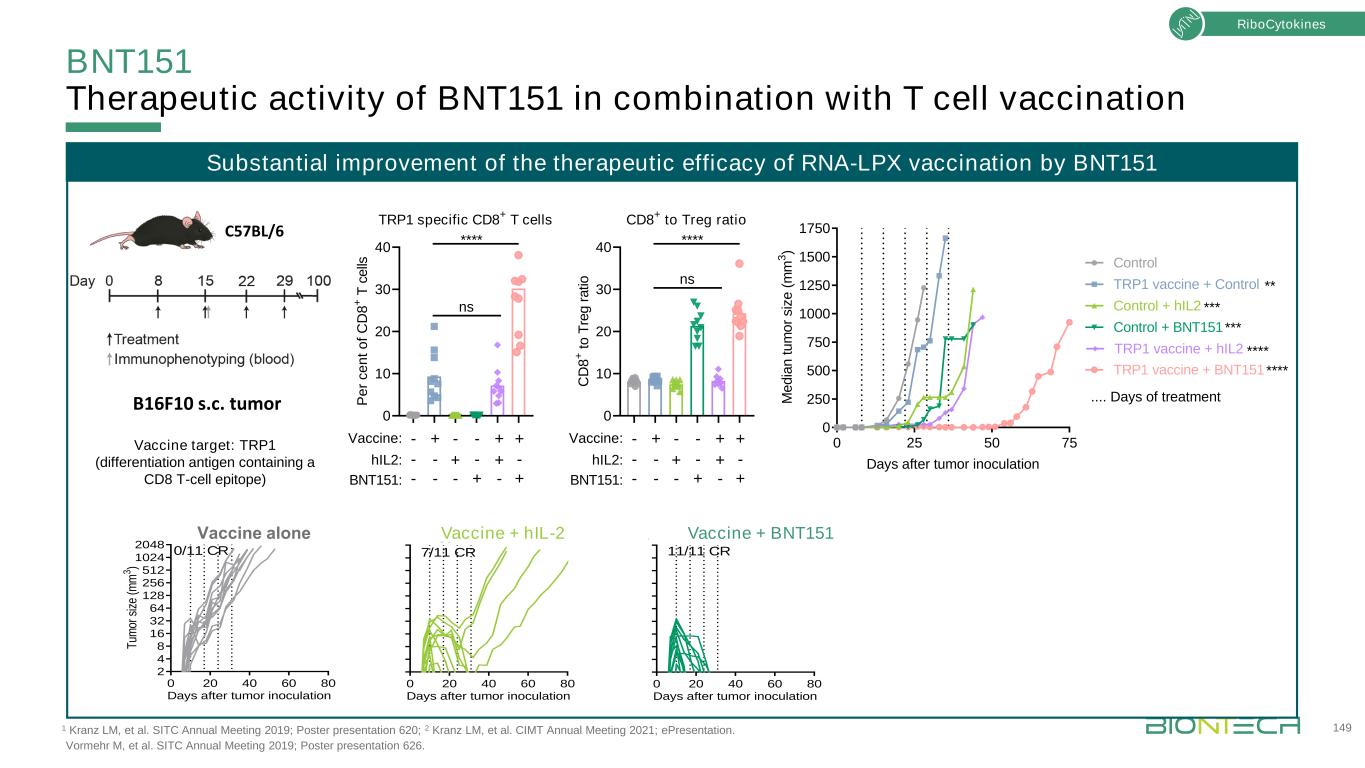
与CLDN6-LPX治疗组相比,BNT151治疗组的CAR T细胞在体内的初始扩增作用与CLDN6-LPX治疗组相似。CLDN6-LPX+BNT151治疗组在治疗后第3/4天达到CAR T细胞扩增高峰,随后在第7天进入收缩阶段。BNT151介导非肿瘤小鼠CAR T细胞的体内扩增CLDN6-CAR-LPX或BNT151处理的CLDN6-CAR-BBZ-LUC-GFP阳性T细胞CLDN6-CLDN6-LPX BNT151 C6-LPX+BNT151 Ctr-LPX+Ctrl-LNP CLDN6-LPX BNT151 C6-LPX+BNT151 Ctr-LPX+ctrl-LNP第1天(基线)1°治疗-第1天第4天第9天2°治疗-第7天2×106 2×107分离的脾细胞用于体外细胞毒性分析108 10 0 5天后#C R T=o T ta l fl s s第1天(基线)1°治疗-第1天第4天第9天2°治疗-第7天2×106 2×107分离的脾细胞用于体外细胞毒性分析[ p /s ]Car T剂量治疗2×106+CLDN6-LPX 2×106+BNT151 2×106+CLDN6-LPX+BNT151 2×107+ctrl-LPX+crt1-LNP治疗时间点分析核细胞因子
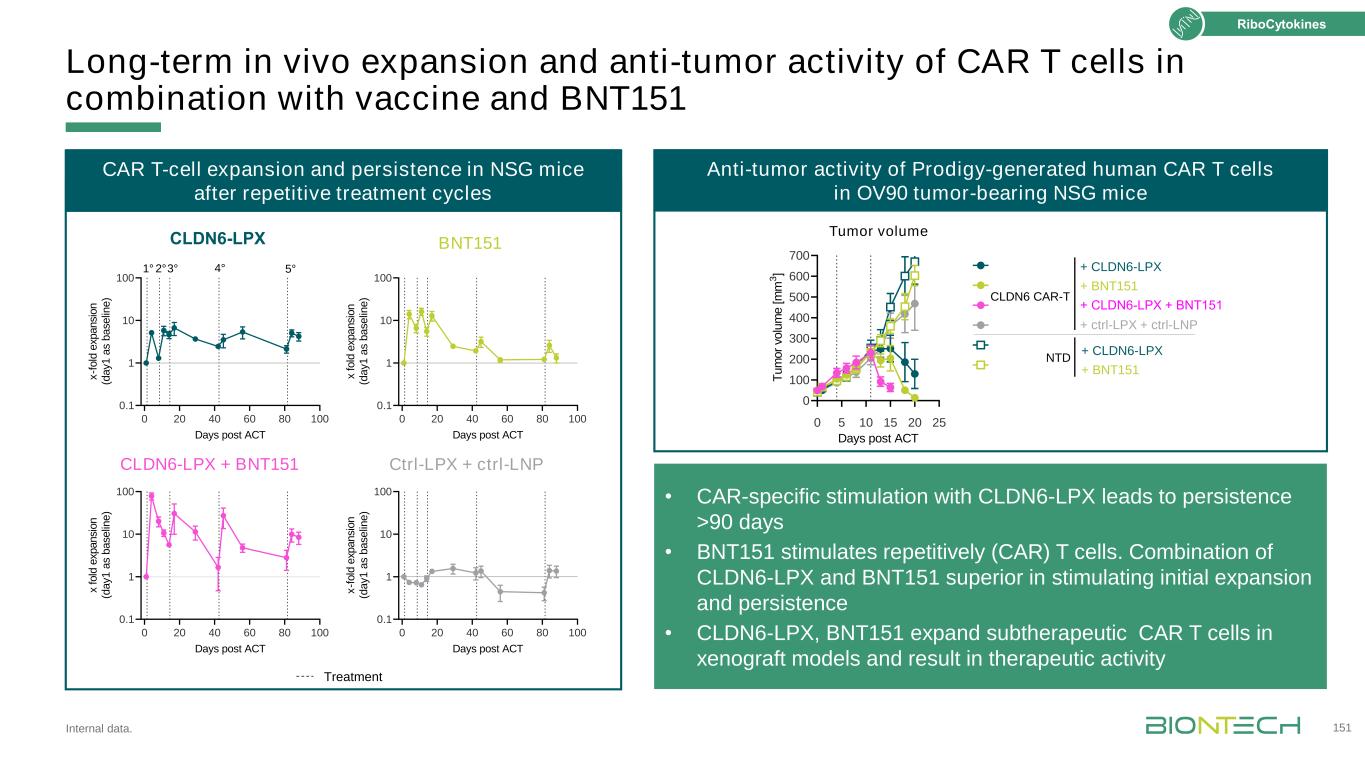
结合疫苗和BNT151的体内长期扩增和抗肿瘤活性的CAR T细胞。151次重复治疗1°2°3°治疗4°5°0 20 40 60 80 80 100 0.1 10 100天后NSG小鼠体内核细胞因子CAR T细胞的扩增和存留CLDN6-LPX BNT151 CLDN6-LPX+BNT151 Ctrl-LPX+Ctrl-LNP在OV90荷瘤NSG小鼠体内的体外抗肿瘤活性[ m m 3 ]CLDN6 Car-T+CLDN6-LPX CLDN6 Car-T+BNT151 CLDN6 Car-T+CLDN6-LPX+BNT151 CLDN6 Car-T+ctrl-LPX+ctrl-LNP NTD-T+CLDN6-LPX NTD-T+BNT151 Car-T-LPX 151 6-LPX+BNT151 Trl-LNP NTD+CLDN6-LPX+BNT151·Car特异性刺激持续时间>90天·BNT151重复刺激(CAR)T细胞。CLDN6-LPX联合BNT151在刺激初始扩增和持久性方面具有优势·CLDN6-LPX、BNT151在异种移植模型中扩增亚治疗性CAR T细胞并产生治疗活性
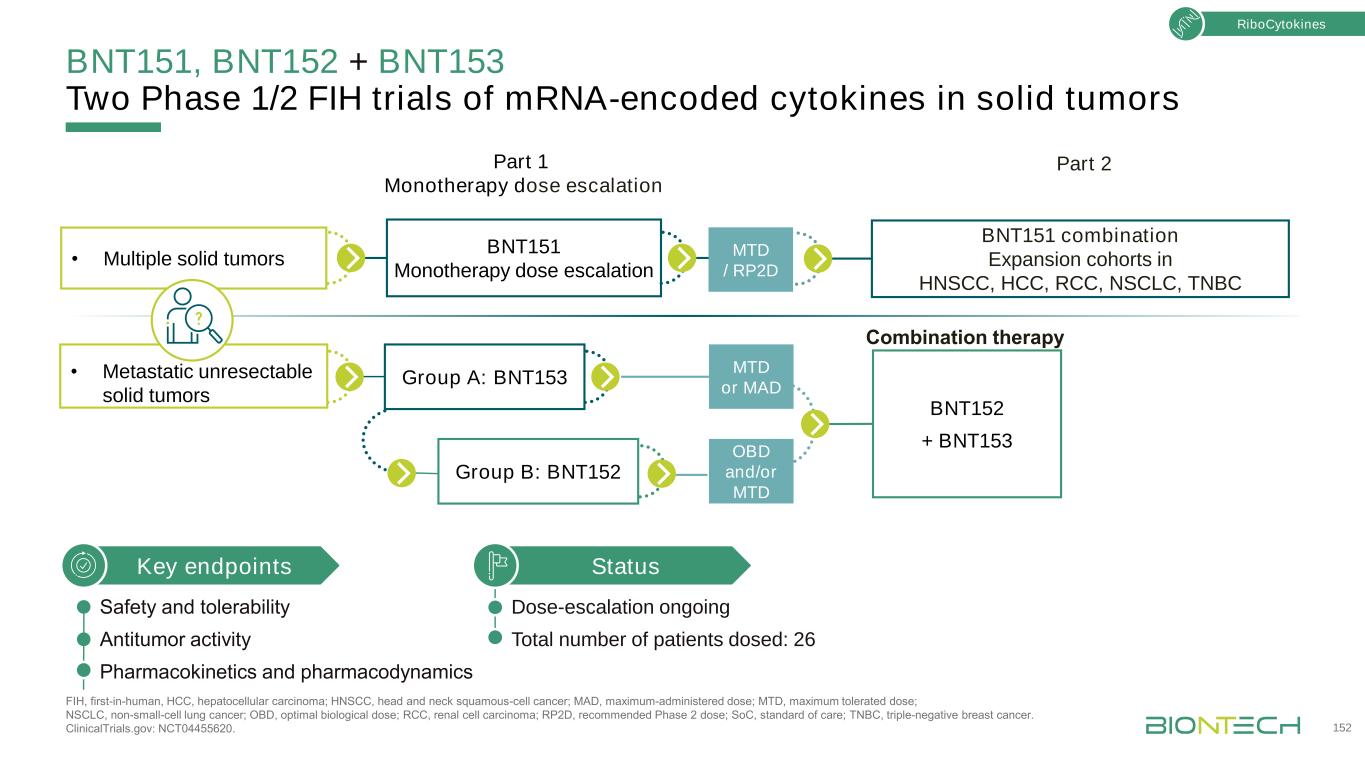
BNT152+BNT153 BNT151、BNT152+BNT153两期1/2期FIH试验:信使核糖核酸编码的细胞因子在实体瘤FIH、人类首例、肝细胞癌、HNSCC、头颈部鳞状细胞癌;MAD,最大给药剂量;MTD,最大耐受剂量;NSCLC,非小细胞肺癌;OBD,最佳生物剂量;RCC,肾细胞癌;RP2D,推荐2期剂量;SOC,护理标准;TNBC,三阴性乳腺癌。临床试验.gov:NCT04455620。152 BNT151单一治疗剂量递增·多发性实体肿瘤第2部分状态剂量递增正在进行的患者总数:26个关键终点安全性和耐受性抗肿瘤活性BNT151联合治疗HNSCC、肝癌、肾癌、非小细胞肺癌、TNBC核细胞因子MTD或MAD OBD和/或MTD·转移性不可切除实体肿瘤A组:BNT153组:BNT152联合治疗第1部分MTD/RP2D单药剂量递增

结束语
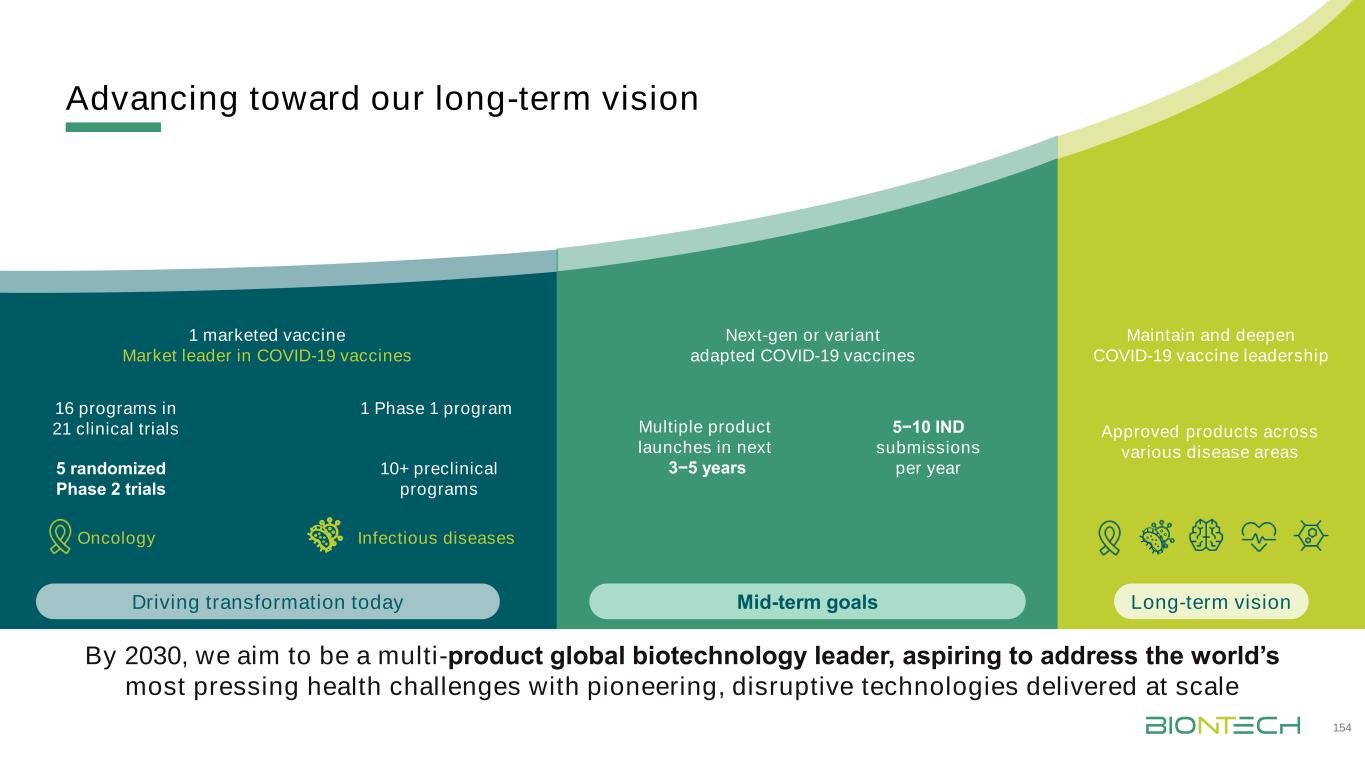
迈向我们的长期愿景15肿瘤学感染性疾病5随机第二阶段试验1上市疫苗市场新冠肺炎疫苗10+临床前计划1阶段1计划21项临床试验中的16项计划保持并深化新冠肺炎疫苗的领导地位未来3−5年到2030年,我们的目标是成为多产品全球生物技术的领先者,渴望通过大规模交付开创性、颠覆性技术来应对世界上最紧迫的健康挑战中期目标推动转型今天长期愿景5−10每年提交的新一代或变种改装新冠肺炎疫苗批准的跨不同疾病领域的产品

15 5 Q & A

