
勇于创新2022年5月纳斯达克:OCGN

前瞻性陈述2本陈述包含1995年《私人证券诉讼改革法》所指的前瞻性陈述,这些陈述会受到风险和不确定性的影响。在某些情况下,我们可能会使用“预测”、“相信”、“潜在”、“建议”、“继续”、“估计”、“预期”、“预期”、“计划”、“打算”、“可能”、“将”、“应该”或其他表达未来事件或结果不确定性的词语来识别这些前瞻性陈述。此类前瞻性陈述包括对现有数据的定性评估、潜在益处、对临床试验的预期以及临床试验读数和监管提交的预期时间。这些信息涉及风险和不确定因素,可能导致实际结果与此类陈述所表达或暗示的结果大相径庭。风险和不确定性包括但不限于研发中固有的不确定性,包括满足预期临床终点的能力、临床试验的开始和/或完成日期、监管提交日期、监管批准日期和/或启动日期,包括由于持续的新冠肺炎大流行的影响而无法满足这些日期的风险,以及与初步和中期数据相关的风险,包括不利的新临床试验数据和对现有临床试验数据的进一步分析;体外研究结果不会在人体临床试验中重复的风险;在科学界,临床试验数据受到不同解释和评估的风险,包括在同行审查/发表过程中, 是否以及何时将来自Bharat Biotech的临床试验的数据发表在科学期刊出版物上,如果是,何时以及进行何种修改;由印度Bharat Biotech进行的COVAXIN™的临床前和临床研究的数据和结果是否将被美国食品和药物管理局(“FDA”)接受,或者是否足以支持我们的研究性新药申请(“IND”)或计划的生物制品许可证申请(“BLA”)(视情况而定);我们是否以及何时能够解决我们的COVAXIN™的2/3期免疫桥联和拓宽临床试验的临床搁置;我们可能需要进行的任何其他试验或研究的规模、范围、时间和结果,以支持COVAXIN™的临床试验,包括我们的2/3期免疫桥接和拓宽临床试验和计划的安全桥接临床试验;我们可能被要求提交的任何额外的化学、制造和对照信息;COVAXIN™的BLA是否以及何时将提交给FDA;美国食品和药物管理局是否以及何时批准新药提交申请,加拿大卫生部是否批准新药提交申请,以及我们向加拿大卫生部提供的额外信息是否足以支持加拿大卫生部批准COVAXIN™及其相关的任何延迟;根据我们与巴拉特生物技术公司的协议,我们是否有能力在墨西哥为18岁以上的成年人成功地将COVAXIN™商业化;我们是否以及何时将获得用于2至18岁儿童的COVAXIN™在墨西哥的紧急使用授权批准;授权或批准将取决于多种因素, 包括确定候选疫苗的益处是否大于其已知风险,以及候选疫苗的效力以及如果获得批准或获得批准是否会在商业上成功;与新冠肺炎大流行有关的事态发展是否会影响美国、加拿大、墨西哥或其他司法管辖区可用于疫苗的监管途径;制造能力、生产能力和供应限制,包括是否能在我们预计的时间段内生产或供应足够剂量的科瓦欣™;美国、加拿大或墨西哥对科瓦欣™的市场需求;美国食品和药物管理局、加拿大卫生部或联邦卫生防护委员会在墨西哥针对影响标签、制造工艺、安全性和/或其他可能影响™在美国、加拿大或墨西哥的供应或商业潜力的事项的卫生风险作出的决定,包括其他公司的产品或疗法的开发。这些以及其他风险和不确定性在我们提交给美国证券交易委员会(“美国证券交易委员会”)的定期报告中有更全面的描述,包括我们在提交给美国证券交易委员会的季度和年度报告中题为“风险因素”的章节中描述的风险因素。我们在本演示文稿中所作的任何前瞻性陈述仅限于本演示文稿发布之日。除法律另有规定外,我们没有义务在本陈述之日之后,因新信息、未来事件或其他原因而更新陈述中包含的前瞻性陈述。。

我们来到这里是为了通过欧库根的勇敢创新3使命产生影响,我们正在为医疗挑战开发新的解决方案,有目的和灵活地进行医疗创新,为面临疾病的人提供新的选择。愿景我们正在培育一个没有人在疾病面前感到绝望的未来。从遗传疾病到新的疾病,我们的专业知识和坚韧正在为人们和全球社区创造选择。首创针对几种遗传形式视力障碍的突破性修饰基因疗法创新一种新的生物疗法用于治疗可能导致数百万人失明的眼病共同开发一种新冠肺炎疫苗

4管道概述资产/项目指示状态疫苗COVAXIN™(BBV152)墨西哥成人用全病毒灭活疫苗新冠肺炎·EUA;正在审查的2-18岁儿童EUA*·美国2/3期临床试验*(暂停剂量/临床搁置)·加拿大卫生部正在审查的NDS*修饰基因治疗平台OCU400*AAV-hNR2E3基因突变与视网膜变性相关**NR2E3突变1/2 Rho突变1/2 CEP290突变将提交PDE6B突变将提交OCU410 AAV-hRORA干性年龄相关性黄斑变性(干性AMD)**临床前新生物OCU200转铁蛋白-肿瘤糖尿病黄斑水肿临床前糖尿病视网膜黄斑变性(Wet AMD)临床前*基于印度巴拉特生物技术赞助的临床试验**在美国没有批准的疗法https://www.aao.org/eye-health/diseases/retinitis-pigmentosa-treatment|https://www.aao.org/eye-health/diseases/amd-treatment*孤儿药物指定;欧共体指定广泛的孤儿药品用于治疗视网膜色素变性(RP)和Leber先天性黑色素(LCA)

5柯萨欣™(BBV152)是巴拉特生物技术公司批准用于美国和加拿大市场的全病毒灭活新冠肺炎候选疫苗

产品简介6 COVAXIN™(BBV152):全病毒灭活SARS-CoV-2抗原和佐剂:6ug/shd+阿尔盖尔-™(TLR7/8激动剂)剂量水平和方案为每0.5毫升混悬液6 ug;2剂:第0天和第28天每瓶10剂预计货架寿命2℃-8℃储存条件下稳定6个月两年建议适应症预防由SARS-CoV-2引起的新冠肺炎目标人群:2-18岁及以上儿童

7为什么选择科瓦欣™?旨在增强我们在北美的新冠肺炎疫苗库·成人和儿童阶段2/3数据表明,针对多种病毒蛋白产生体液和细胞反应·数据支持疫苗诱导Th1反应(细胞免疫),这对持久保护至关重要·数据表明,成人和儿童人群中有很强的安全性·用于生产脊髓灰质炎的技术平台,流感和狂犬病疫苗使用VERO细胞平台已知的安全性·第三阶段数据建议可预防新冠肺炎引起的住院·增强剂量提供针对奥密克戎和Delta变种的强大中和抗体反应,专为广谱免疫反应设计结果显示可预防严重新冠肺炎病·10剂瓶装,可在2°-8°C下储存和运输,保质期2年,室温下6个月稳定性运输和储存轻松图片仅供说明用途

8为什么选择™(BBV152)?第三阶段临床试验亮点77.8%93.4%65.2%总体疗效与重症疗效对比B.1.617.2(Delta)严重不良事件安慰剂ARM不良事件COVAXIN™ARM 12.4%

柯萨欣™发展的9条途径国家技术研究:05258669免疫桥联和拓宽(OCU-002)助推器和安全性*建议的中期分析BLA提交窗口*拟提交的协议OCU-002A阶段2/3,观察者盲法,免疫桥接,和拓宽完整的严重急性呼吸综合征冠状病毒灭活疫苗(BBV152)在健康成人中的研究类型干预(临床试验)估计登记400参与者分配随机分配干预模型平行分配干预模型描述1:1随机比主要目的预防模型描述

10修饰剂基因治疗平台突破性技术旨在应对许多罕见疾病以及影响数百万人的复杂疾病

11我们的焦点:核激素受体基因(NHR)*参考:https://pubmed.ncbi.nlm.nih.gov/28556246/|https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5409218/https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4339951/|https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0183526 NHR是视网膜发育和功能的调节器,作为视网膜分子重置关键转录因子和相关基因网络的“主基因”--视网膜稳态基因修饰物的概念,包括它对临床表型的影响,在其他疾病领域是众所周知的,如囊性纤维化和脊肌萎缩症

12我们的愿景:修饰性基因治疗与传统基因增强正常基因X基因增强:将非功能基因的功能版本转移到靶细胞中。修饰基因治疗:旨在引入一种功能基因来改变许多基因、基因网络的表达,并调节视网膜的基本生物学过程。一次针对一种单个基因突变的传统方法调控途径专注于一种疾病的特定产品更长时间来收回开发成本针对核激素基因(NHR)的新方法,传统基因疗法OCU400 NR2E3突变相关视网膜疾病视紫红质突变相关视网膜疾病CEP290突变相关视网膜疾病PDE6B突变相关视网膜疾病广谱治疗RP One疾病基因X基因X基因X细胞基因M细胞功能正常的基因以外的其他基因修饰基因X基因M细胞功能正常的细胞我们计划使用相同的基因修饰物产品来治疗多种疾病。单元格

13我们的原则证明:Neena Haider博士的实验室研究在《自然》杂志上发表了在哈佛医学院开发的5种独特的RP技术小鼠模型上显示的基因治疗有效性结果,表明修饰性基因治疗在疾病早期和晚期获得广谱治疗益处的效力表明,有证据表明在疾病的早期和晚期进行视力挽救https://www.nature.com/articles/s41434-020-0134-z是治疗发展的重要里程碑;证明了在由不同突变引起的变性动物模型中引发的原理保护的证据可能代表第一种广谱治疗并在疾病开始后提供救援
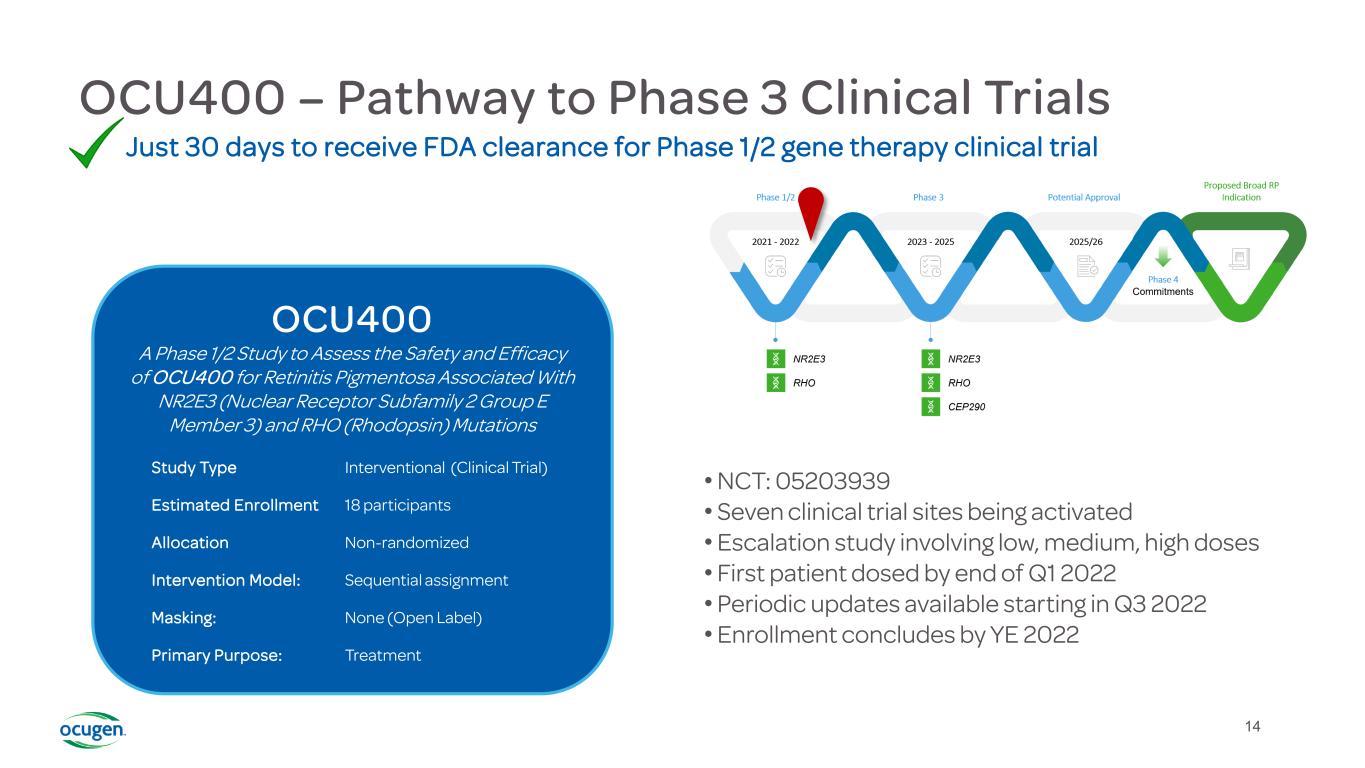
14 OCU400-3期临床试验之路仅30天即可获得FDA批准进行1/2期基因治疗临床试验·NCT:05203939·7个临床试验站点正在激活·涉及低、中、高剂量·第一个患者在2022年第一季度末给药·2022年第三季度开始定期更新·2022年第三季度结束登记OCU400评估OCU400治疗与NR2E3(核受体亚家族2组E成员3)和Rho(视紫红质)突变相关的视网膜色素变性的安全性和有效性的1/2阶段研究类型介入(临床试验)估计登记18参与者分配非随机干预模型:序贯分配掩蔽:无(开放标签)主要目的:治疗

在研究OCU400用于治疗由NR2E3和Rho基因突变引起的视网膜色素变性的1/2期临床试验中,15名第一和第二名患者在CanSinoBio成功完成了商业规模(200L)的生产,以支持临床研究扩大与CanSinoBio的制造协议,包括支持OCU410 Ocugen计划2022年在墨西哥商业化™的活动摘要,随着Ocugen领域的扩大,现已覆盖整个北美,该公司正在与美国食品和药物管理局合作,解决世界卫生组织对BBIL制造设施的检查所产生的问题,以便继续进行OCU-002临床试验加拿大卫生部继续进行COVAXIN™(BBV152)OCU400/410

16经验丰富的领导力Shankar Musunuri,博士,MBA董事长、首席执行官兼联合创始人Zara Gaudioso,SHRM-CP AVP,人力资源,办公厅主任Nirdosh Jagota,法规事务,合规和安全高级副总裁Jessica Creso,注册会计师首席会计官&高级副总裁,财务Bruce Forrest,MD代理首席医疗官J.P.Gabriel SVP,技术运营Huma Qamar,MD,公共卫生硕士,CMI AVP,临床开发Mike Shine高级副总裁,商业Arun Upadhyay,博士高级副总裁,研发

2022年5月纳斯达克:OCGN谢谢!