
附录 99.1

1 © 2022 NOVAVAX。版权所有。NOVAVAX 研究 N AnoFLU 疫苗和 COVID-19 的最新情况——流感联合疫苗开发 2022 年 4 月 20 日 | NOVAVAX

安全港声明 2 © 2022 NOVAVAX。版权所有。某些信息,特别是与Novavax的未来、其运营计划和前景、合作伙伴关系、NVX-CoV 2373的持续发展有关的信息,包括Novavax计划在2022年第二季度启动儿科研究,NanoFlu,其COVID-季节性流感研究候选疫苗,COVID-nanoFlu组合疫苗,包括Novavax启动COVID-nanoFlu组合疫苗的2期临床试验的计划,Omicron-特异性疫苗和其他 Novavax 候选疫苗产品,得出结果的时间来自临床试验,Novavax和NVX-CoV 2373在解决疫苗获取、控制疫情和保护人群方面的潜在影响,包括加强剂量的NVX-CoV 2373以提供针对COVID-19(包括变体)的保护,以及NVX-CoV 2373的有效性、安全性和预期用途,包括Novavax' 计划用监管部门同意的儿科数据和儿科调查计划来补充全球监管文件当局、NVX-CoV 2373的全球市场机遇、我们的全球供应链准备就绪以及NVX-CoV 2373在全球范围内的未来上市,以及NVX-CoV 2373的商业化和预期交付以及即将到来的关键里程碑构成了前瞻性声明。前瞻性陈述通常可能包含诸如 “相信”、“可能”、“将”、“可能”、“可能”、“估计”、“继续”、“正在进行”、“考虑”、“预期”、“打算”、“寻求”、“表明”、“计划”、“项目”、“期望”、“应该”、“将”、“目标” 或 “假设” 或 “假设” 或此类单词或其他具有相似含义的单词的变体。Novavax警告说,这些前瞻性陈述受许多假设、风险和不确定性的影响,这些假设、风险和不确定性会随着时间的推移而发生变化,并可能导致实际业绩与前瞻性陈述中讨论的结果存在重大差异。这些风险和不确定性包括但不限于单独或与合作伙伴一起满足各种安全性、有效性和产品特性要求,包括满足相关监管机构所需的与工艺认证和检测验证相关的要求;难以获得稀缺的原材料和供应;资源限制,包括制造能力,包括人力资本和制造能力,影响Novavax走上计划监管途径的能力;应对挑战与多个商业、政府和其他实体达成的协议下的合同要求;以及向美国证券交易委员会提交的截至2021年12月31日的Novavax截至2021年12月31日年度报告的 “风险因素” 和 “管理层对财务状况和经营业绩的讨论和分析” 部分确定的其他风险因素,可在www.sec.gov和www.novavax.com上查阅。前瞻性陈述基于当前的预期和假设以及当前可用的数据,既不是对未来事件或业绩的预测,也不是对未来事件或业绩的保证。当前的结果可能无法预测未来的结果。你不应过分依赖前瞻性陈述,这些陈述仅代表截至本文发布之日。除非适用法律要求,否则公司不承诺在任何前瞻性陈述发表后对其进行更新或修改,无论是由于新信息、未来事件还是其他原因。Novavax TM(及所有相关徽标)是 Novavax, Inc. 的商标。Matrix-M TM 是 Novavax AB 的商标。

概述 nanoFLU (qNiV) 疫苗项目开发 COVID-流感组合 (CIC) 疫苗开发 3 © 2022 NOVAVAX。版权所有。

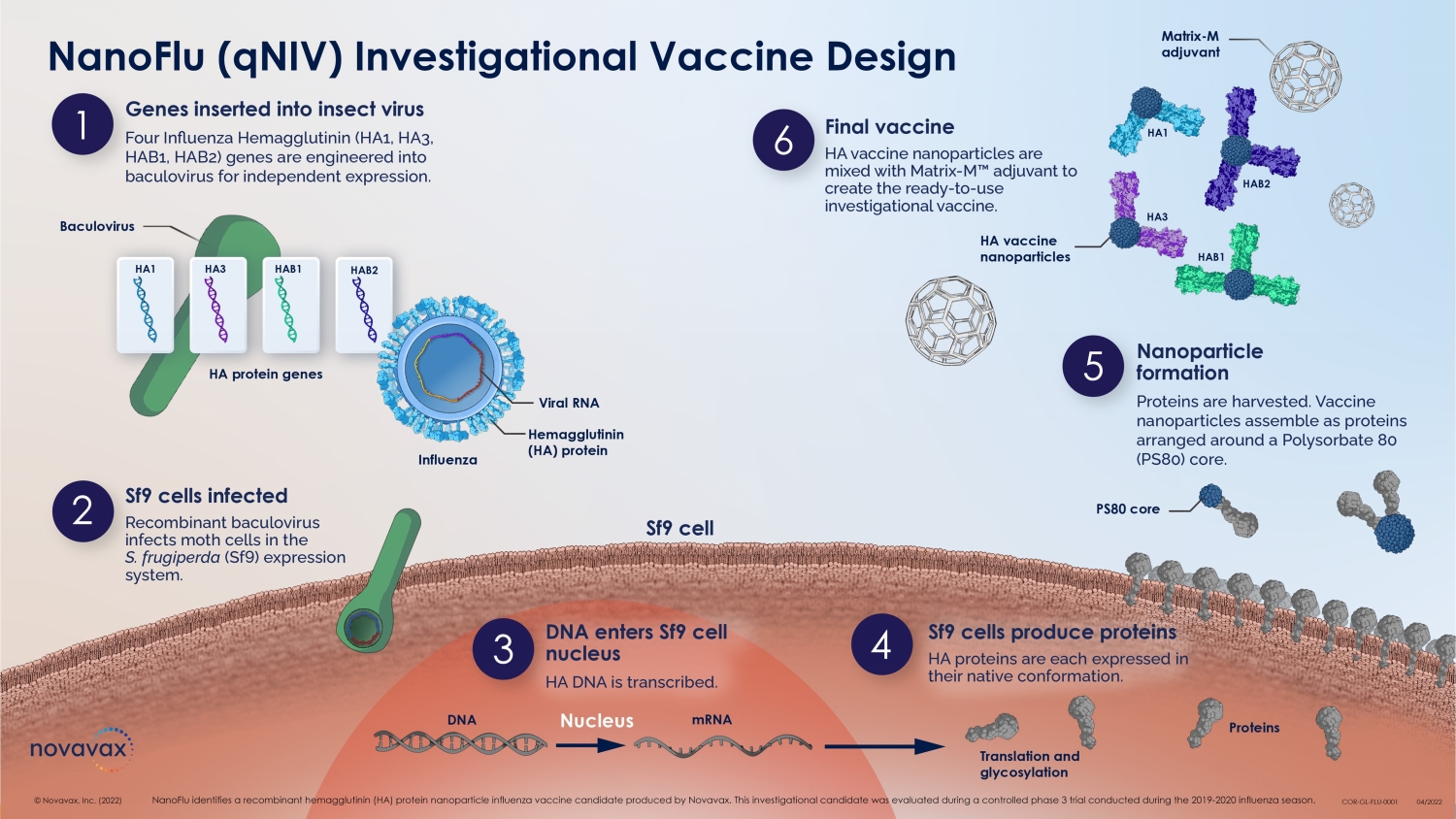
N anoFLU * (q NIV) 疫苗开发 4 © 2022 NOVAVAX。版权所有。* nanoFLU 鉴定了 Novavax 生产的重组血凝素 (HA) 蛋白纳米颗粒候选流感疫苗。该候选研究对象是在2019-2020年流感季节进行的一项对照3期试验中评估的。

特征针对疫苗类型卵子——适应性变化抗原漂移免疫衰老抗体 T-细胞标准灭活 1,2,3,4,5 高剂量灭活 1,3,4,5 x MF-59 辅助型 4,5,6,7 x x?细胞-衍生的失活 5,8?重组 2,3,4 x x x nanoFlu (qniV) 9,10 [重组 + 佐剂]x x x x 目前获得许可的流感疫苗的特征 5 © 2022 NOVAVAX。版权所有。1.Diaz-Granados 2015;2.Dunkle,2017;3.Zost,2017;4.2019 年 Cowling;5.2019 年 Izurieta;6.Frey 2014;7.Mannino 2012;8.Gouma 2020;9.Shinde 2018;10.Shinde 2020 nanoFLU(qNiV)已被证明可以诱导广泛的交叉反应性抗体和强效的多功能 CD4+ T 细胞反应,并避免卵子适应性抗原变化。这些只是产品特性,尚未进行头对头研究,并不意味着临床疗效。
6 © 2022 NOVAVAX。版权所有。
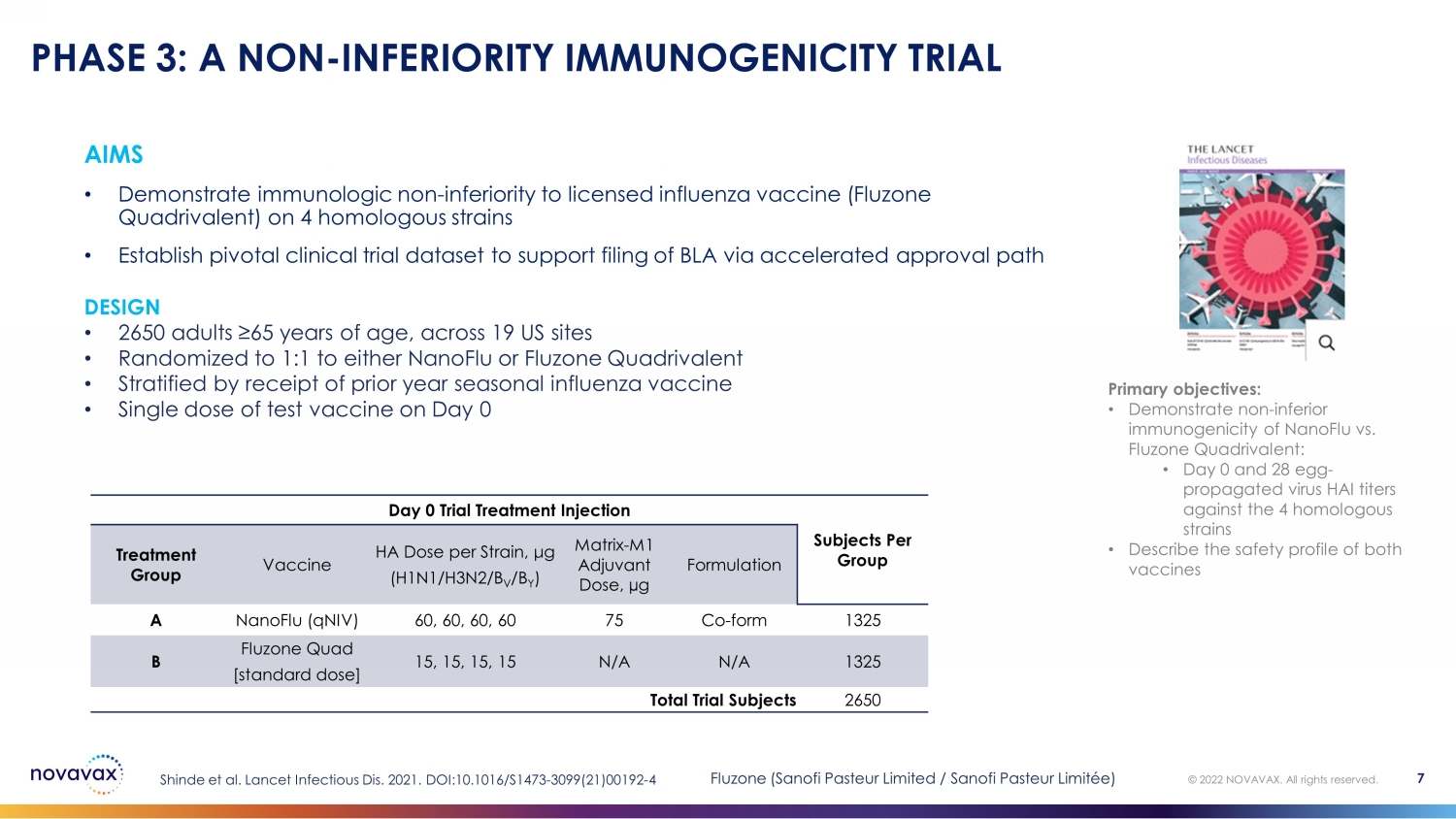
目标 • 在 4 种同源菌株上证明免疫学上不逊于获得许可的流感疫苗(Fluzone Quadrivalent)• 建立关键临床试验数据集以支持通过加速批准途径申报 BLA 第 3 阶段:非劣质免疫原性试验主要目标:• 证明 nanoFlu 与 Fluzone 四价疫苗的免疫原性不差:• 第 0 天和第 28 天——卵子传播的病毒 HAI 滴度对比 4 同源菌株 • 描述两种疫苗的安全性(第 0 天试验治疗每组治疗的注射受试者)每种菌株的分组疫苗 HA 剂量,μg (H1N1/H3N2/B V /B Y) 矩阵-M1 辅助剂量,µg 配方 A nanoFlu (qniV) 60、60、60、60 75 Co-form 1325 B Fluzone Quad [标准剂量]15、15、15、15 N/A N/A 1325 总试验受试者 2650 Shinde 等人2021 年《柳叶刀》传染病。DOI: 10.1016/S1473-3099 (21) 00192-4 © 2022 NOVAVAX。版权所有。7 DESIGN • 美国 19 个地点的 2650 名年龄在 65 岁以上的成年人 • NanoFlu 或 Fluzone Quadrivalent 随机分配至 1:1 • 按去年接种的季节性流感疫苗进行分层 • 第 0 天 Fluzone 的单剂测试疫苗(赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司)

• 所有使用卵子适应性 HAI 抗体反应评估的同源菌株均达到主要免疫原性终点 • 非自卑性符合 GMT 比率和血清转化差异成功标准 • nanoFlu:与 4 种同源菌株的 Fluzone 四价抗体相比 Fluzone 四价抗体反应高 24 — 66% • nanoFlu:野生型 HAI 抗体反应高出 34 — 46% 2 漂移菌株 • 野生型微中和抗体反应已证实野生型 HAI 抗体反应第 3 阶段摘要:已达到主要终点Shinde 等人。2021 年《柳叶刀》编号。DOI:10.1016/S1473-3099 (21) 00192-4 © 2022 NOVAVAX。版权所有。8
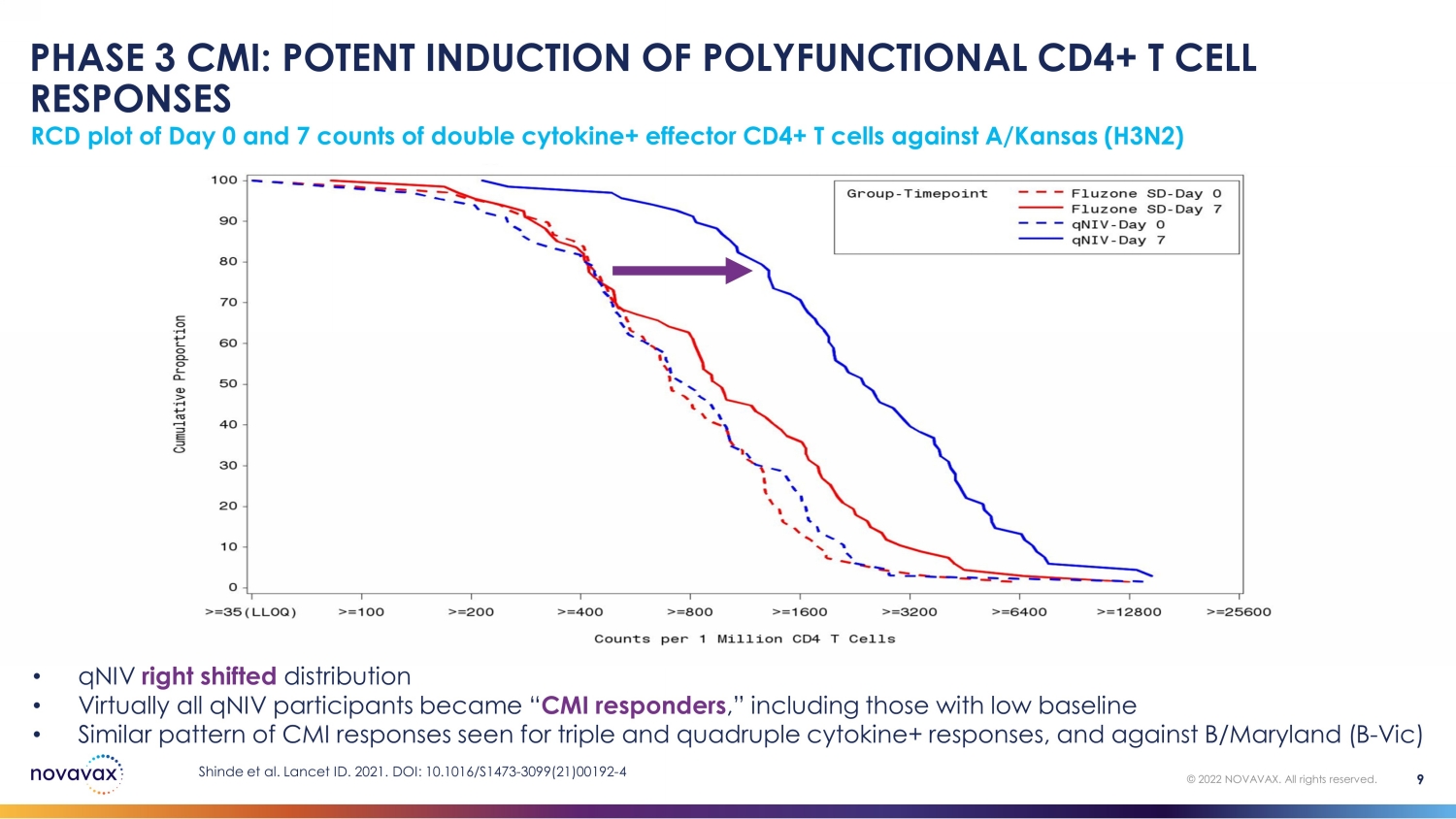
第 3 阶段 CMI:强效诱导多功能 CD4+ T 细胞反应 0 天 RCD 曲线图和 7 个针对 A/Kansas (H3N2) 的双cytokine+ 效应 CD4+ T 细胞计数 9 © 2022 NOVAVAX。版权所有。• qniV 右移分布 • 几乎所有 qniV 参与者都成了 “CMI 反应者”,包括基线较低的参与者 • 三重和四倍细胞因子+反应以及针对 B/Maryland (B-Vic) Shinde 等人的 CMI 反应模式类似。2021 年《柳叶刀》编号。DOI:10.1016/S1473-3099 (21) 00192-4
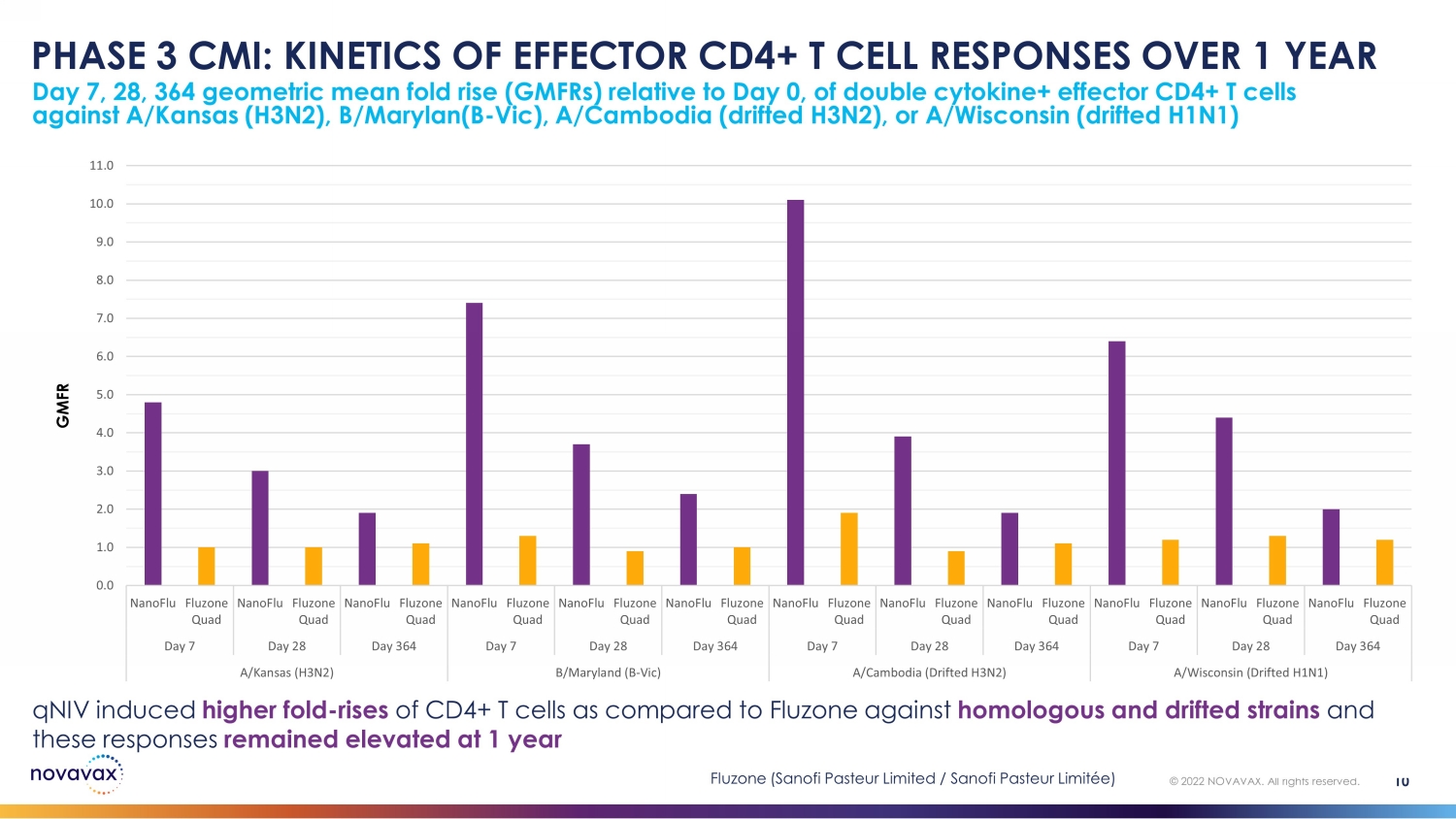
相对于第0天,双细胞因子+效应CD4+ T细胞对抗A/Kansas(H3N2)、B/ Marylan(B-Vic)、A/Cambodia(漂移的H3N2)或/威斯康星(漂移的H3N1)的第7、28、364天的几何平均倍数上升(gmFRs)10 © 2022 NOVAVAX。版权所有。PHASE 3 CMI:1 年内效应 CD4+ T 细胞反应的动力学 GMFR 0.0 1.0 2.0 3.0 4.0 6.0 7.0 8.0 9.0 10.0 nanoFlu Fluzone Quad nanoFLU Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone QuaFluzone Quad nanoFLU Fluzone Quad nanoFlu Quad Day 7 Day 28 Day 364 Day 28 Day 28 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 Day 364折叠——与Fluzone相比,CD4+ T细胞在同源和漂移菌株上升,这些反应在1年 Fluzone(赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司)

第 3 阶段:总结和结论已达到主要终点:• 已证明免疫学上不逊于 Fluzone Quad(卵适应性 HAI 抗体反应)与 Fluzone Quadrivalent 相比,野生型 HAI 抗体反应更高:• 第 28 天 gmT 对同源菌株的反应提高了 24 — 66% • 第 28 天 gmT 对抗多种漂移 A/H3N2 菌株的野生型 HAI 抗体反应得到证实野生型 HAI 抗体反应,包括对漂移菌株的反应,多功能 CD4+ T 细胞的强效诱导反应,一年后仍然存在 • 几乎所有 nanoFLU 受试者都成了 “CMI 反应者”,值得注意的是,包括基线低的 CMI 11 © 2022 NOVAVAX 的受试者。版权所有。Fluzone(赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司)

COVID-流感组合(CIC)疫苗开发 12 © 2022 NOVAVAX。版权所有。

接种 COVID-CoV-2 疫苗的理由未来可能需要反复接种 SARS-COV-2 疫苗的复发增强剂持续出现逃避自然/疫苗免疫的变异体持续的SARS-CoV-2传播,可能呈季节性反复发作模式在疫苗接种或感染后的4至12个月内中和抗体反应减弱尽管在2020年和2021年COV-19疫情期间流感传播很少,但仍需要每年接种季节性流感疫苗,流感可能传播随着社会的重新开放,将在2022年及以后反弹。公共卫生部门迫切需要开发更有效的季节性流感疫苗 © 2022 NOVAVAX。版权所有。13 用一种潜在的疫苗解决方案解决两个主要的公共卫生问题联合疫苗的开发预计未来需要在冬季传播季节之前每年同时接种SARS-CoV-2和流感病毒
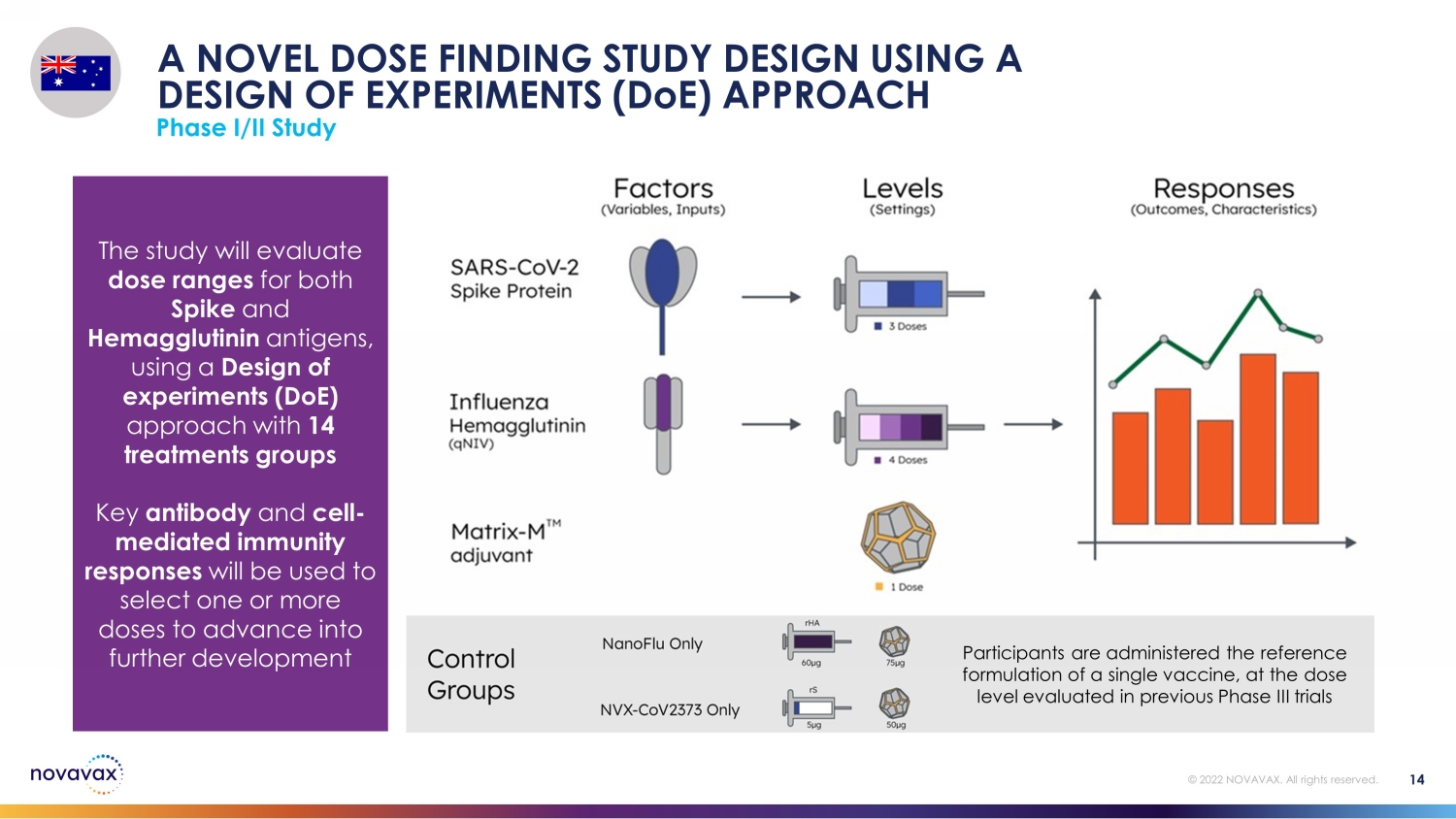
该研究将采用实验设计(DoE)方法,评估Spike和Hemagglutinin抗原的剂量范围,包括14个治疗组。关键抗体和细胞介导的免疫反应将用于选择一个或多个剂量进行进一步开发。参与者接受单一疫苗的参考配方,其剂量水平与先前III期试验中评估的剂量水平相同。使用实验设计(DoE)方法进行I/II期研究 © 2022 NOVAVAX。版权所有。14
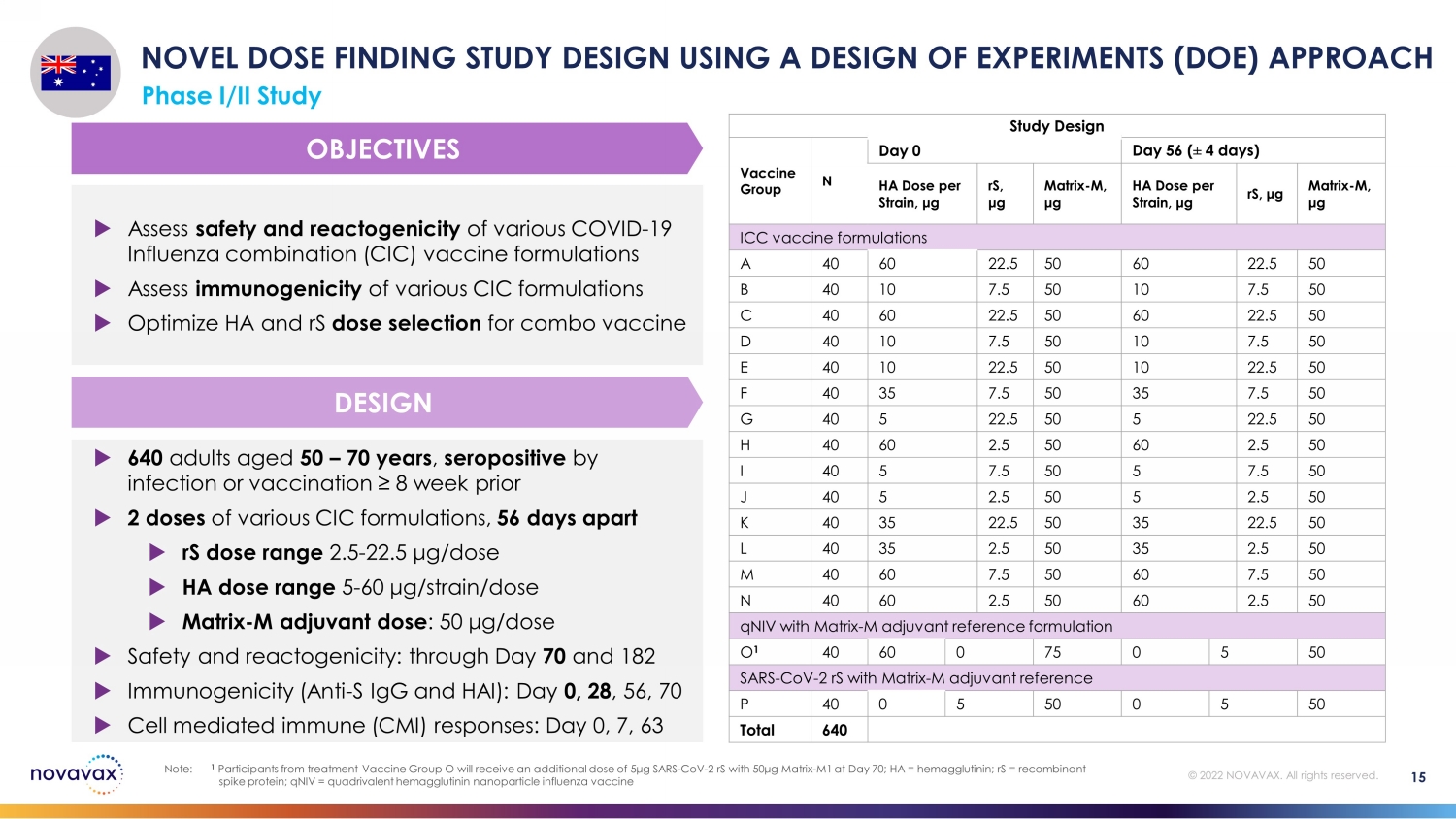
640 名 50 — 70 岁的成年人,感染或疫苗接种呈血清阳性 ≥ 8 周前 2 剂各种 CIC 制剂,相隔 56 天 rS 剂量范围 2.5-22.5 μg /剂量 HA 剂量范围 5-60 μg /张力/剂量 matrix-M 辅助剂量:50 μg/剂量安全性和反应原性:直到第 70 天和 182 天免疫原性(抗 S IgG 和 HAI):第 0 天、28 天 56、70 细胞介导免疫 (CMI) 反应:第 0、7、63 天评估各种 COVID-19 流感组合 (CIC) 疫苗制剂的安全性和反应原性评估各种 CIC 配方的免疫原性优化组合疫苗的 HA 和 rS 剂量选择使用实验设计 (DOE) 方法进行新剂量寻找研究设计使用实验设计 I/II 期研究设计疫苗组 N 天 0 天 56(4 天)HA 每株剂量,μ g rS,μg matrix-M,μg matrix-M,μg ICC 疫苗配方 A 40 60 22.5 50 B 40 7.5 50 50 50 C 40 60 22.5 50 60 22.5 50 D 40 10 7.5 50 10 7.5 50 E 40 22.5 50 10 22.5 50 F 40 35 7.5 50 G 40 5 22.5 50 50 5 22.5 50 H 40 2.5 50 60 2.5 50 I 40 7.5 50 5 7.5 50 J 40 5 2.5 50 50 J 40 5 2.5 50 K 40 5 2.535 22.5 50 35 22.5 50 L 40 2.5 50 2.5 50 50 50 50 60 7.5 50 7.5 50 N 40 60 2.5 50 60 2.5 50 qNiV 带有 Matrix-M 辅助参考配方 O 1 40 60 0 75 5 50 sars-CoV-2 rs with matrix-M 辅助参考制剂 P 40 0 5 5 50 total 640 设计目标 15 注意:1 来自治疗疫苗组 O 的参与者将获得额外剂量 5μg SARS-CoV-2 rs with 50μg Matrix-70 天 M1;HA = 血凝素;rS = 重组刺突蛋白;qniV = 四价血凝素纳米颗粒流感疫苗 © 2022 NOVAVAX。版权所有。

16 个 CIC 疫苗第 1/2 期试验的初步结果 © 2022 NOVAVAX。版权所有。

基线特征、反应原性和安全性结果 17 © 2022 NOVAVAX。版权所有。治疗组在基线水平上相当 • 中位年龄 59 岁 • 62% 男性/38% 女性 • 100% 曾接种过原发系列 EUA COV-19 疫苗;中位数在 0 天前 10.7 周 • 约 0.2% 以前曾感染过严重急性呼吸道综合征——CoV-2 CIC 制剂耐受性良好:• 反应原性与独立参比 rS(NVX-CoV2373)和 HA(qniV)相当 • 最常见的征集局部 AE 为疼痛和压痛 • 最常见的全身 AE 为疲劳、头痛、全身乏力、肌肉疼痛;发烧很少见 • 通常为 0、1 级或者 2。3 级稀有。不是 4 级。• 征集的局部和全身 AE 在 rS 剂量水平上没有显著差异 • 通过增加 HA 剂量水平略高征集的局部 AE • 剂量 1 和剂量 2 之间的反应原性相当 70 天之前的安全性:• CIC 制剂显示未经请求的 AE 与独立的参考 rS 和 HA 制剂的发生率相当 • 严重的 AE(SAE)很少见;没有一个被评估为相关性接种疫苗 • 没有关于特别关注的不良事件(AESI)的报告
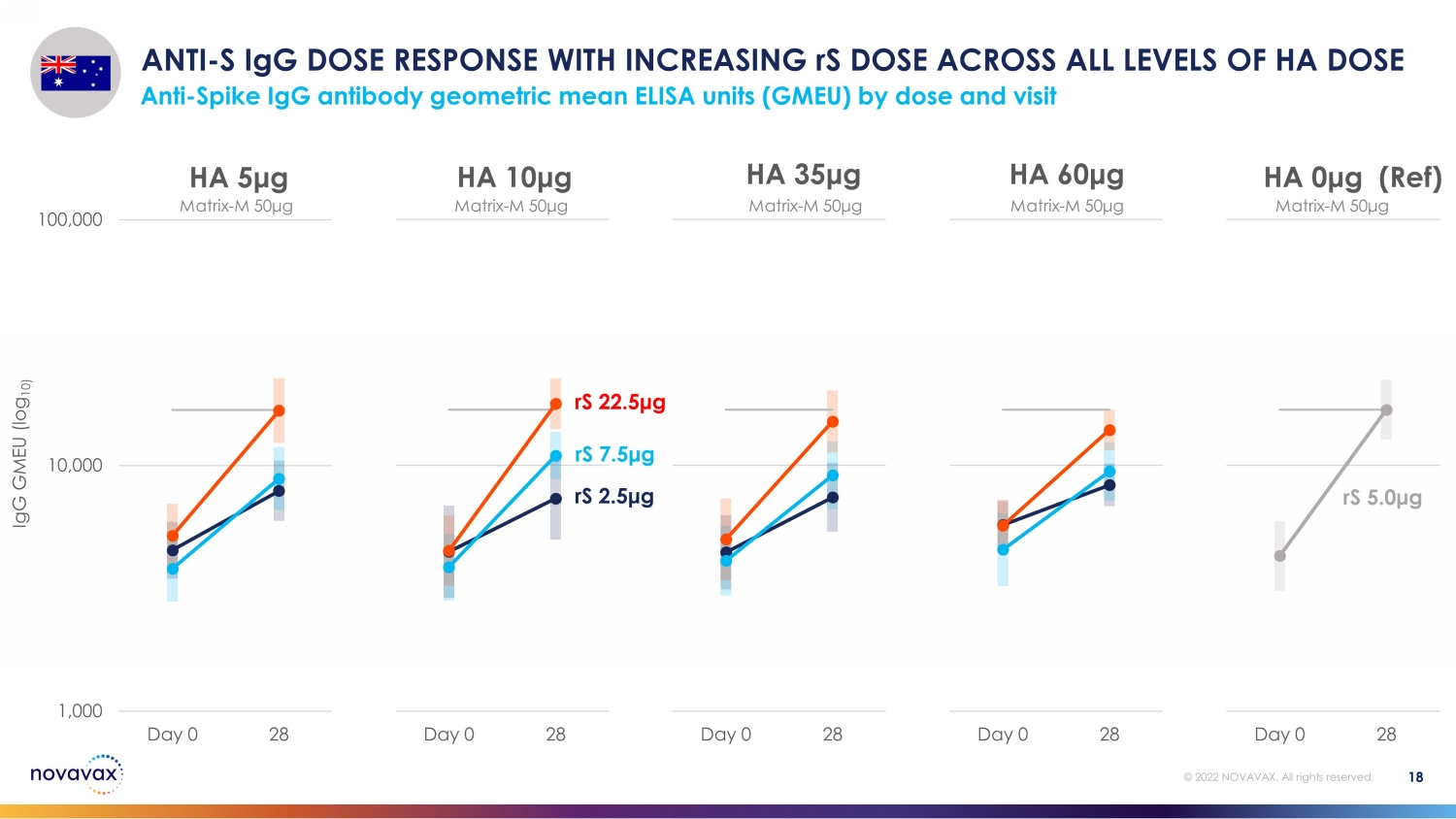
18 © 2022 NOVAVAX。版权所有。1,000 10,000 100,000 天 0 28 HA 0 μg(参考)1,000 10,000 10,000 天 0 28 HA 60 μg 100,000 Day 0 28 HA 10 μg 100,000 Day 0 28 HA 5 μg rS 2.5 μg rS 7.5 μg rS 5.0 g anti-S igG day 0 28 HA 10 μg rS 5.0 g anti-S igG day 0 28 HA 10 μg rS 5.0 g anti-S igG day 0 28 HA 10 μg rS 7.5 μg rS 5.0 g anti-S igG 剂量响应随着 rS 增加所有等级 HA 剂量 anti-Sp按剂量和访问量划分的 g 抗体几何平均值 ELISA 单位 (GMEU) matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg igG GMEU (log 10)
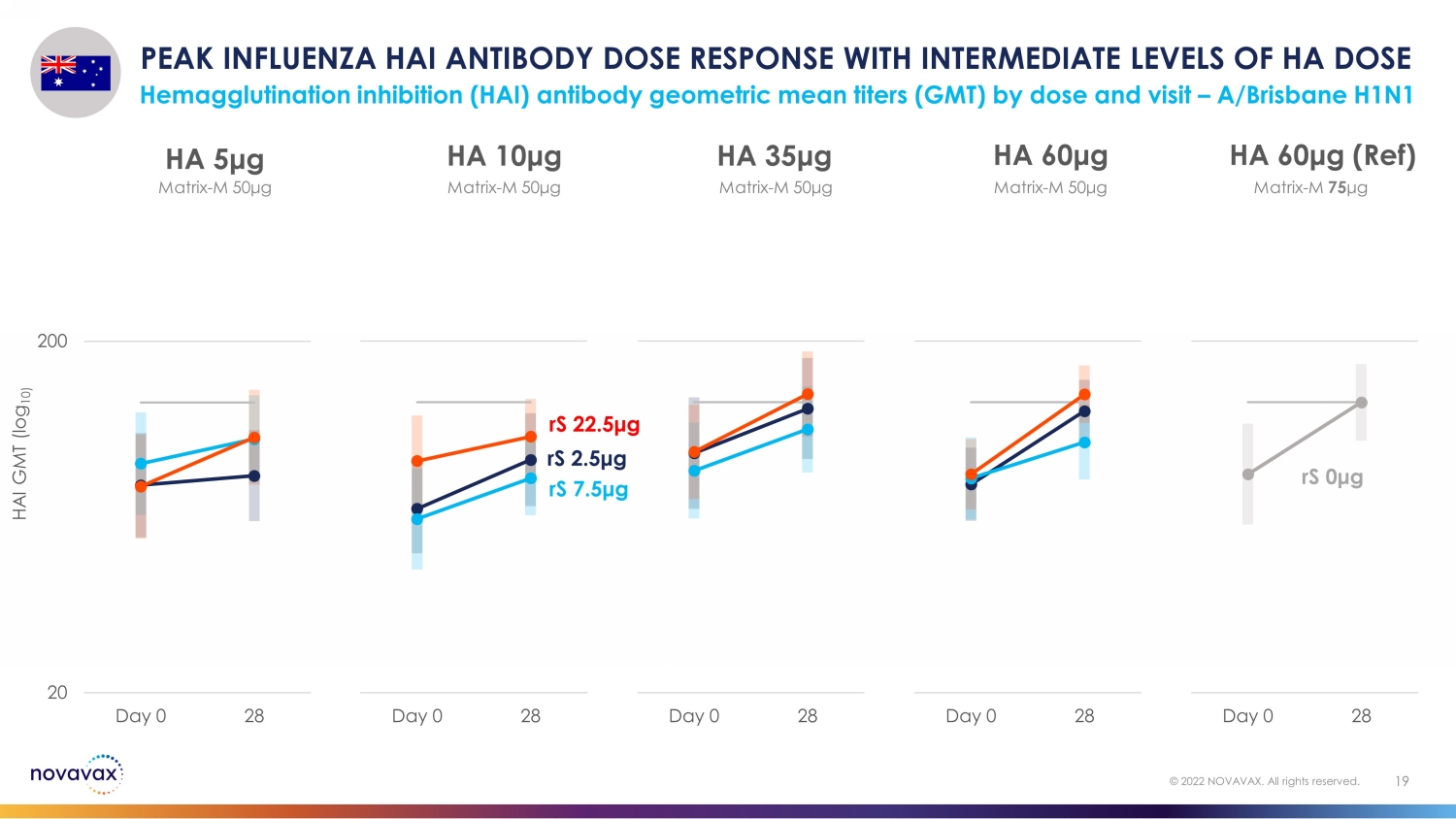
按剂量和访问量划分,HA 剂量血凝抑制 (HAI) 抗体几何平均滴度 (GMT) 处于中等水平,HA 剂量血凝抑制 (HAI) 的峰值 HAI 抗体剂量反应 — A/Brisbane H1N1 19 © 2022 NOVAVAX。版权所有。20 200 Day 0 28 HA 60 μg(参考资料)20 200 天 0 28 HA 60 μg 20 Day 0 28 HA 35 μg 20 200 天 0 28 HA 10 μg 20 200 天 0 HA 5 μg rS 2.5 μg rS 7.5 μg rS rS 0 μg 矩阵-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg M 75 μg HAI GMT (log 10)
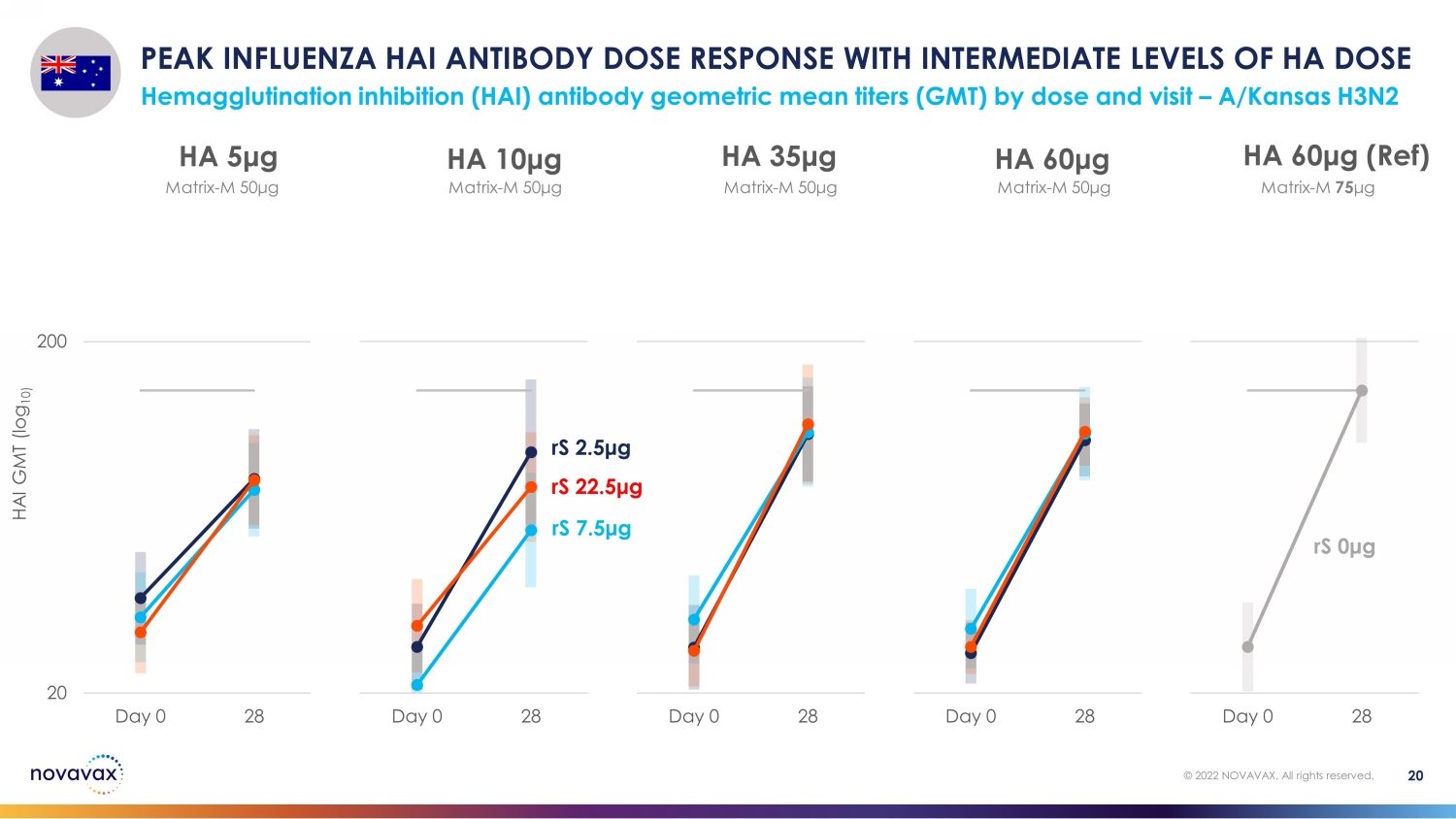
按剂量和访问量划分,HA 剂量血凝抑制 (HAI) 抗体几何平均滴度 (GMT) 处于中等水平,HA 剂量血凝抑制 (HAI) 的峰值 HAI 抗体剂量反应 — A/Kansas H3N2 20 © 2022 NOVAVAX。版权所有。20 200 Day 0 28 HA 60 μg(参考资料)20 200 天 0 28 HA 60 μg 20 Day 0 28 HA 35 μg 20 200 天 0 28 HA 10 μg 20 200 天 0 HA 5 μg rS 2.5 μg rS 7.5 μg rS rS 0 μg 矩阵-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg M 75 μg HAI GMT (log 10)
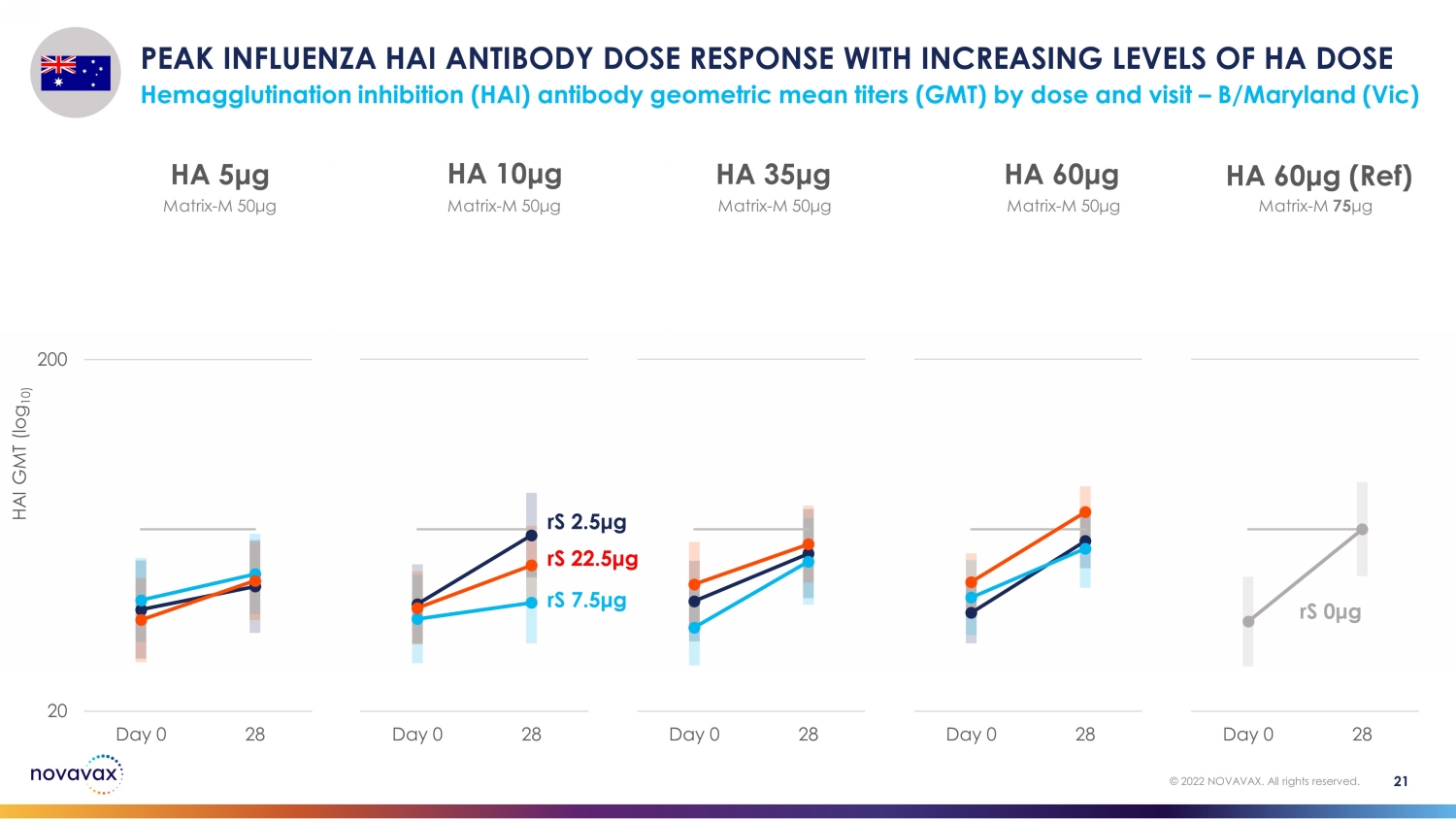
随着 HA 剂量血凝抑制 (HAI) 抗体几何平均滴度 (GMT) 的剂量和访问量增加,HA 抗体剂量反应达到峰值 — B/Maryland (Vic) 21 © 2022 NOVAVAX。版权所有。20 200 Day 0 28 HA 60 μg(参考资料)20 200 天 0 28 HA 60 μg 20 Day 0 28 HA 35 μg 20 200 天 0 28 HA 10 μg 20 200 天 0 HA 5 μg rS 2.5 μg rS 7.5 μg rS rS 0 μg 矩阵-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg M 75 μg HAI GMT (log 10)

按剂量和访问量划分,HA 剂量血凝抑制 (HAI) 抗体几何平均滴度 (GMT) 处于中等水平,HA 剂量血凝抑制 (HAI) 达到峰值 HAI 抗体剂量反应 — b/Phukei (Yam) 22 © 2022 NOVAVAX。版权所有。20 200 Day 0 28 HA 60 μg(参考资料)20 200 天 0 28 HA 60 μg 20 Day 0 28 HA 35 μg 20 200 天 0 28 HA 10 μg 20 200 天 0 HA 5 μg rS 2.5 μg rS 7.5 μg rS rS 0 μg 矩阵-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg M 75 μg HAI GMT (log 10)
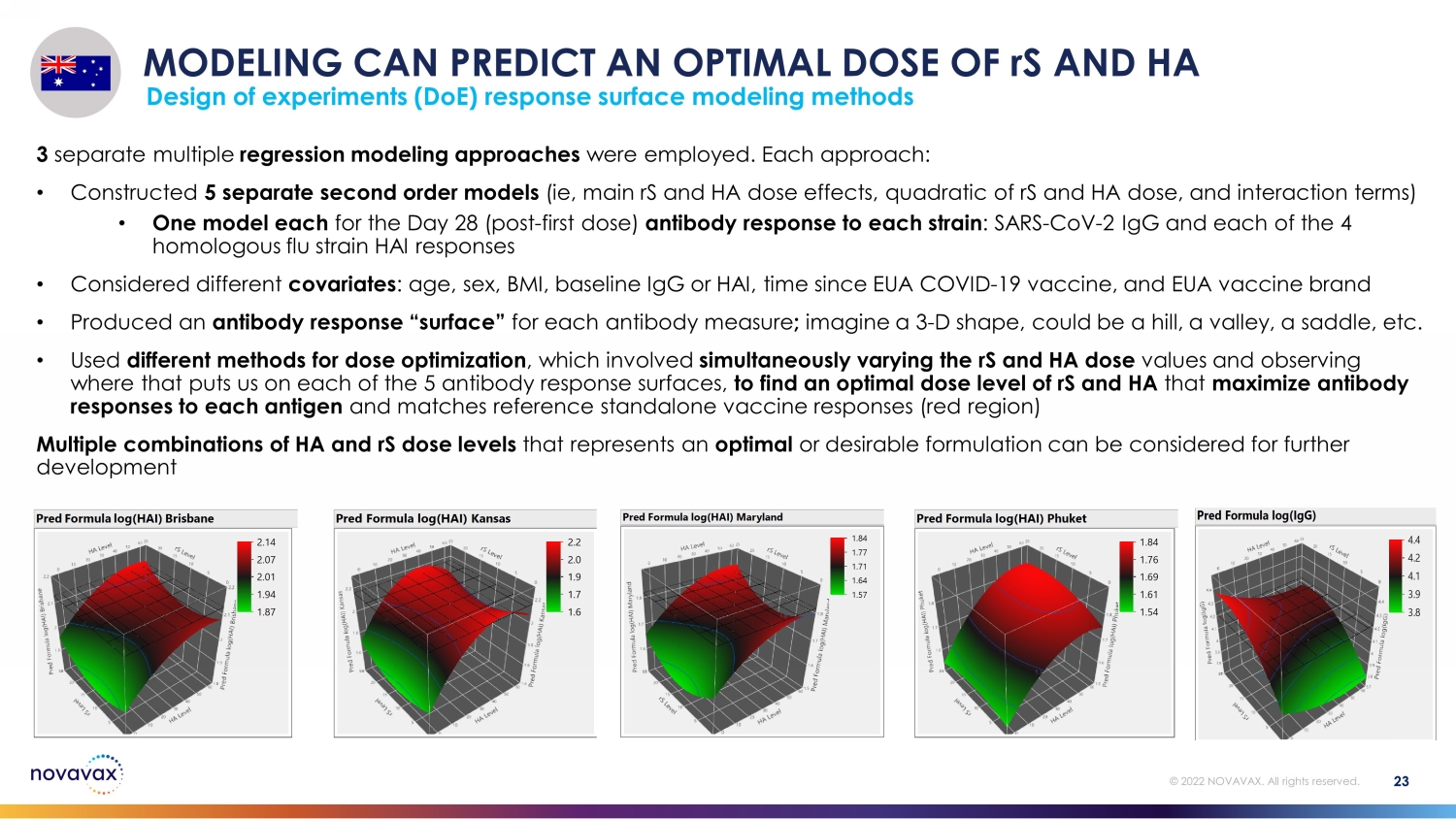
建模可以预测 rS 和 HA 的最佳剂量实验设计 (DoE) 响应表面建模方法 23 © 2022 NOVAVAX。版权所有。采用了 3 种不同的多元回归建模方法。每种方法:• 构建 5 个独立的二阶模型(即主要 rS 和 HA 剂量效应、rS 和 HA 剂量的二次方以及相互作用项)• 每种菌株的第 28 天(第一剂后)抗体反应各一个模型:SARS-CoV-2 IgG 和 4 种同源流感菌株 HAI 反应 • 考虑了不同的协变量:年龄、性别、体重指数、基线 IgG 或 HAI,此后的时间 EUA COVID-19 疫苗和 EUA 疫苗品牌 • 为每项抗体测量生成了抗体反应 “表面”;想象一个 3-D 形状,可能是山丘、山谷、鞍座,等等 • 使用不同的方法进行剂量优化,包括同时改变 rS 和 HA 剂量值,观察这会使我们在 5 个抗体反应表面上的位置,以找出最佳 rS 和 HA 剂量水平,以最大限度地提高对每种抗原的抗体反应并匹配参考独立疫苗反应(红色区域)可以考虑将代表最佳或理想配方的 HA 和 rS 剂量水平的多种组合用于进一步开发 Pred Formula log (HAI) Brisbane 1.87 94 2.01 2.07 2.14 Response Grid 滑块2.12678 Pred Formula log (HAI) 堪萨斯州 1.6 1.7 1.9 2.0 2.2 Response Grid Slider 2.16167 Pred Formula log (HAI) 马里兰 1.57 1.64 Pred Formula log (HAI)
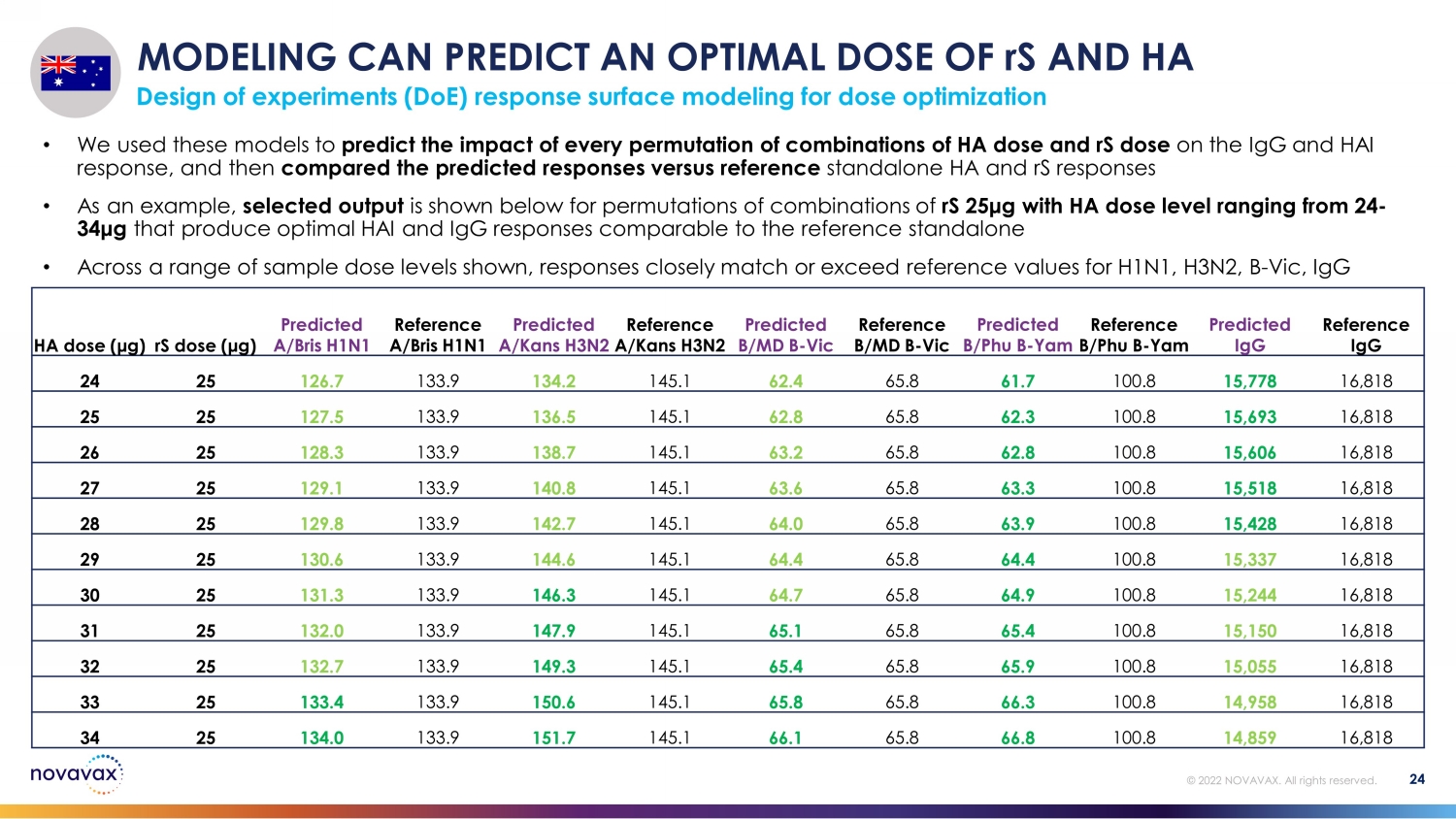
建模可以预测 rS 和 HA 的最佳剂量用于剂量优化的实验设计 (DoE) 响应表面建模 24 © 2022 NOVAVAX。版权所有。• 我们使用这些模型预测 HA 剂量和 rS 剂量组合的每一次排列对 IgG 和 HAI 反应的影响,然后将预测的反应与参考独立的 HA 和 rS 反应进行比较 • 举例来说,下面显示了 rS 25 μg 和 HA 剂量水平在 24-34 μg 之间的组合排列的选定输出,可产生与参考独立剂量相当的最佳 HAI 和 IgG 反应 • 在一系列范围内显示样本剂量水平,反应接近或超过 H1N1 的参考值,H3N2,B-Vic,IgG HA 剂量 (μ g) rS 剂量 (μ g) 预测 A/bris H1N1 参考文献 A/bris H1N1 预测 a/kans H3N2 预测 b/MD B-Vic reference b/Phu B-Yam reference b/ph B-Yam 预测的 IgG 24 25 126.7 133.9 134.2 145.1 2.4 65.8 61.7 100.8 15778 16,818 25 25 127.5 133.9 136.5 145.1 62.8 62.8 100.8 100.8 15,693 16,818 26 25 128.3 138.7 145.1 62.8 100.8 15,606 16,818 27 25 129.1 133.9 140.8 63.3 100.8 28 25 129.8 133.9 100.8 16,818 28 25 129.8 133.9 143.9 100.8 145.1 64.0 65.8 63.9 100。8 15,428 16,818 29 25 130.6 133.9 144.6 145.1 64.4 65.4 64.4 100.8 15,337 16,818 30 25 131.3 133.9 146.3 145.1 64.9 100.8 15,244 16,818 31 25 133.9 145.1 65.1 65.8 100.8 16,818 32 25 132.7 133.9 133.9 145.1 133.9 145.1 143.9 1415.8 16,818 32 25 132.7 133.9 133.9 145.1 133.9 145.1 143.9 1415.8 16,818 100.9 100.8 15,055 16,818 33 25 133.9 153.9 150.6 145.1 65.8 65.8 66.3 100.8 14958 16,818 34 25 133.9 151.7 145.1 66.1 66.8 100.8 14859 16,818

使用建模来预测 rS 和 HA 的最佳剂量用于剂量优化的实验设计 (DoE) 响应表面建模 25 © 2022 NOVAVAX。版权所有。在最佳剂量组合方面,三种不同的建模方法大致趋同于一组相似的结果,从而提高了总体解释和结论的可靠性:• 作为组合配方的 rS 和 HA 抗原相互之间存在适度干扰,但是,剂量调整可以克服干扰 • 更高的 rS 剂量水平(>20 μg)可以克服 HA 剂量的干扰,并且可以匹配(独立)参考的 rS 疫苗反应水平 • HA 的中等剂量水平(每个菌株 24-40 μg)可以克服以下干扰rS 剂量,可以匹配 H3N2、H1N1、B-Vic 菌株的(独立)参考 HA 反应;但是 B-Yam 菌株的剂量略低

初步调查结果和后续步骤 26 © 2022 NOVAVAX。版权所有。• 第一项证明COVID-流感联合疫苗可行、耐受性良好、免疫原性的研究,这些数据值得继续开发 • 一种基于美国能源部建模的新型剂量查找/优化方法是一种强大的工具,可以:• 对反应表面的免疫反应进行粒度分离,以及 • 精细调整的剂量选择 • 各种 CIC 配方可能诱发与独立的 qniV 和 COVID-19 疫苗相似的抗体反应(适用于 H1N1、H3N2、B-Vic 和 rS)•CIC 所需的 rS 剂量比独立的 rS 剂量高 • CIC 所需的 HA 剂量比独立的 HA 剂量低 • 与独立 rS 和 HA 成分的总和相比,CIC 配方中的总抗原含量最多可降低 50% ——可能会节省剂量

初步调查结果和后续步骤 27 © 2022 NOVAVAX。版权所有。• 本研究评估了含有 50μg Matrix-M 佐剂的 CIC 制剂,该配方低于之前在独立 qNiV 中使用的 75μg Matrix-M。• CIC 中更高 75μg 的 Matrix-M 辅助剂剂量可能会进一步增强抗体反应,进一步节省剂量。将在未来的试验中进行评估。• 预计将有更多关于微中性抗体和CMI反应的免疫原性数据,以及抗体反应的第二剂量和耐久性• 该研究的数据将为计划中的2期剂量确认研究提供信息,该研究将:• 确认组合疫苗剂量/配方 • 评估较低剂量的独立qniV

28 © 2022 NOVAVAX。版权所有。谢谢贡献者 VIVEK SHINDE、WAYNE WOO、SHARON LIU、SUSAN NEAL、JOYCE PLESTED、TIM VINCENT、MINGZHUB ZHU、SHANE CLONEY-CLARK、IKSUNG CHO、LOU FRIES、FILIP DUBOVSKY、GRE

29 © 2022 NOVAVAX。版权所有。备份
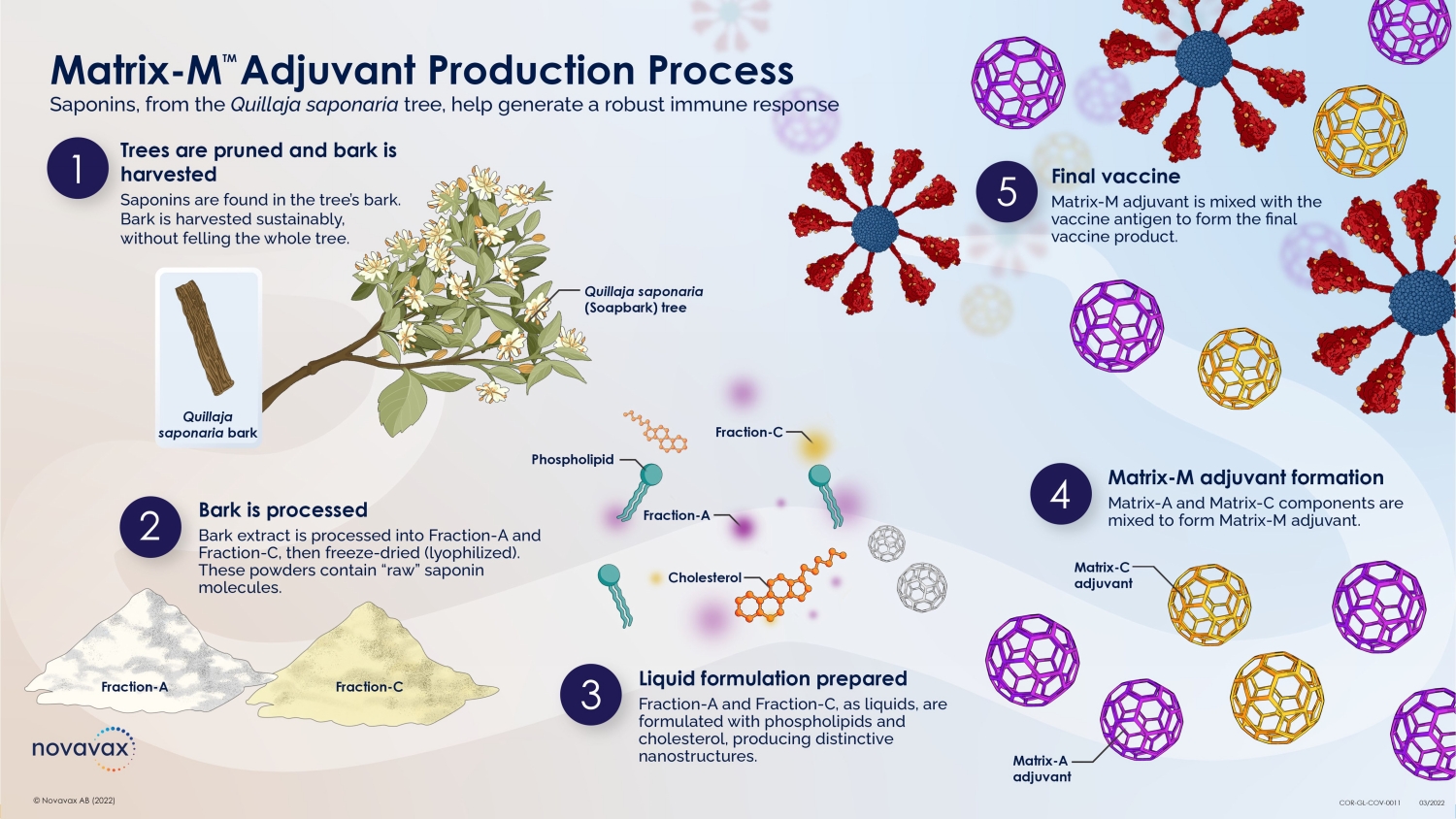
nanoFLU 疫苗 Hemagglutinin 纳米颗粒抗原和 Matrix-M 佐剂 30 © 2022 NOVAVAX。版权所有。重组血凝素 (HA) 纳米颗粒 • 在杆状病毒/Sf9 昆虫细胞系统中产生 • 表现为重组、全长、野生型、未裂解的 HA0,可组装成同型三聚体 • 纯化的同型三聚体形成 20-40 nm 的高阶纳米颗粒结构,含有 PS-80 • 采用快速、高产量、高纯度工艺制造 Matrix-M 佐剂 • 从 Quillaja saponaria Molina 的树皮中以皂苷形式提取的纯化馏分 • 由胆固醇和磷脂配制而成,形成笼状颗粒 •其作用机制包括:• 增强向引流淋巴结的抗原输送 • 增强引流淋巴结中活化 T 细胞、B 细胞和 APC 群体 • 诱导功能性和广泛交叉反应性抗体(例如流感)• 增强抗体反应的峰值和耐久性(例如呼吸道合胞病毒、流感、SARS-CoV-2)• 诱导多功能 T 细胞,包括 CD4+(例如埃博拉、流感)、SARS-CoV-2)和 CD8+(例如埃博拉、SARS-CoV-2)• 在新抗原背景下保存抗原:大流行性流感、埃博拉和严重急性呼吸道综合征-CoV-2 抗原
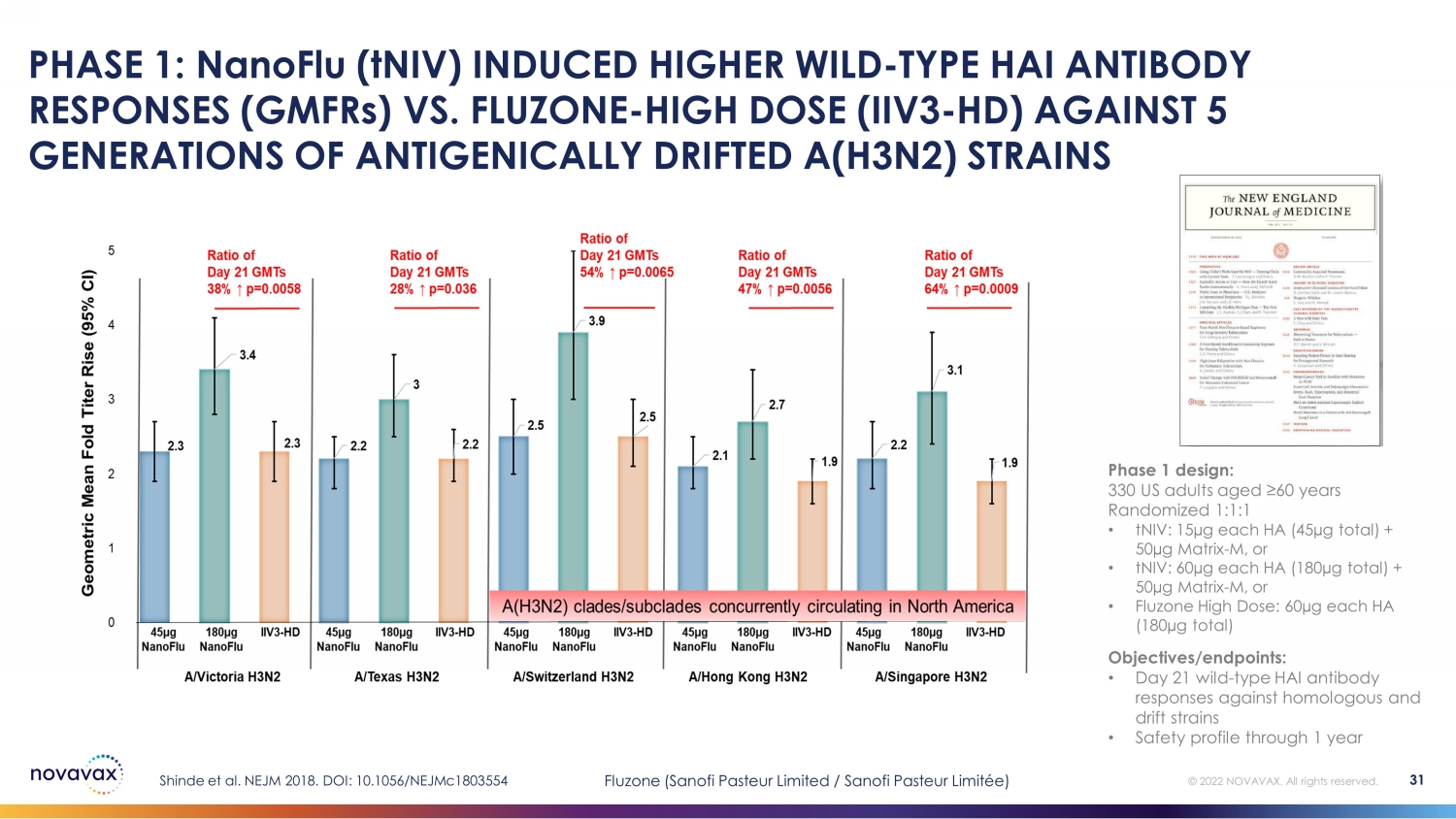
第 1 阶段:与 nanoFLU (tniV) 相比,NanoFLU (tniV) 诱导的野生 HAI 型抗体反应 (gmFRS) 更高FLUZONE——对抗五代抗原漂移 A 型 (H3N2) 菌株的高剂量(IIV3-HD)Shinde 等人。NEJM 2018。DOI:10.1056/nejmc1803554 第 1 阶段设计:330 名年龄在 60 岁以上的美国成年人随机分配 1:1:1 • tniV:每个 HA 15µg(总计 45µg)+ 50µg Matrix-M,或 • Fluzone 高剂量:每个 HA 60µg(共 180 微克)目标/终点:• 第 21 天野生——针对同源和漂移菌株的 HAI 型抗体的反应 • 1 年 31 年的安全概况 © 2022 NOVAVAX。版权所有。Fluzone(赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司)

• 演示 “辅助效应” • 与未辅助配方相比,Matrix-M 辅助剂可显著增强免疫反应 • 与 Fluzone HD 相比,对同源 A/H3N2 和漂移 A/H3N2 菌株的野生型 HAI 抗体反应更高 • 与 Flublok 相比,对同源和漂移菌株的野生型 HAI 抗体反应相似 • 多功能 CD4+ T 细胞的强效诱导反应,均高于 Fluzone HD 和 Flublok • 耐受性良好,安全状况可接受第 2 阶段:摘要 © 2022 NOVAVAX。版权所有。第 2 阶段设计:1375 名年龄在 65 岁以上的成年人随机分为 7 组中的一组 • nanoFlu:床边混合 • nanoFlu:共同配制 • nanoFlu:增加辅助剂量(75µg Matrix-M)• nanoFlu:增加 B 抗原剂量 • nanoFlu:仅限抗原(无矩阵)• Fluzone HD • Flublok 目标/终点:• 主要:演示 “辅助效应” • 第 28 天野生——针对同源菌株和漂移菌株的 HAI 型抗体反应 • 1 年的安全概况 • 探索性:CD4+ T 细胞反应 Shinde 等人2020 年临床感染疾病。DOI:10.1093/ ciaa1673 32 Fluzone(赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司);Flublok(蛋白科学公司)
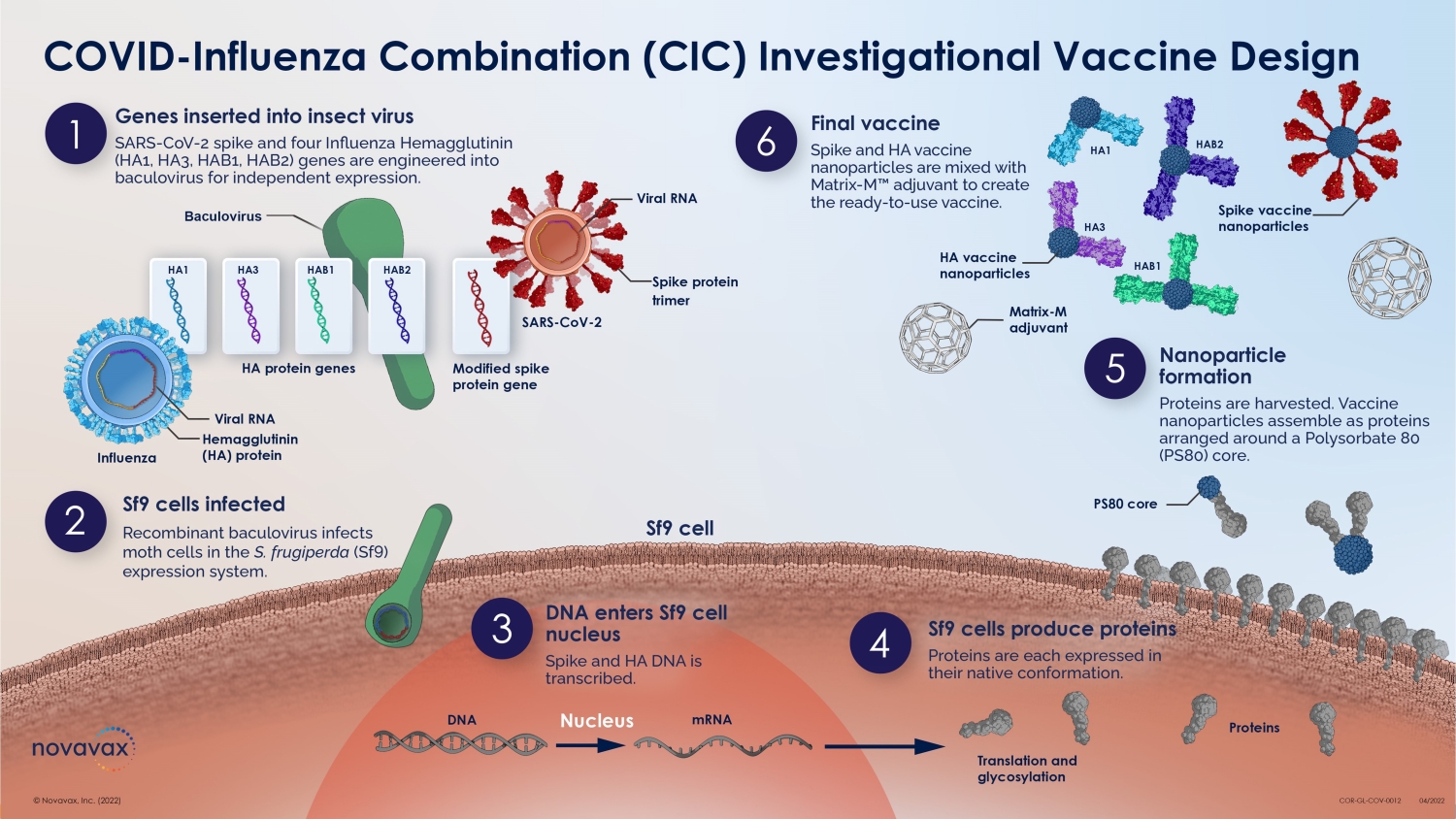

nanoFLU 疫苗 Hemagglutinin 纳米颗粒抗原和 Matrix-M 佐剂 34 © 2022 NOVAVAX。版权所有。重组血凝素 (HA) 纳米颗粒 • 在杆状病毒/Sf9 昆虫细胞系统中产生 • 表现为重组、全长、野生型、未裂解的 HA0,可组装成同型三聚体 • 纯化的同型三聚体形成 20-40 nm 的高阶纳米颗粒结构,含有 PS-80 • 采用快速、高产量、高纯度工艺制造 Matrix-M 佐剂 • 从 Quillaja saponaria Molina 的树皮中以皂苷形式提取的纯化馏分 • 由胆固醇和磷脂配制而成,形成笼状颗粒 •其作用机制包括:• 增强向引流淋巴结的抗原输送 • 增强引流淋巴结中活化 T 细胞、B 细胞和 APC 群体 • 诱导功能性和广泛交叉反应性抗体(例如流感)• 增强抗体反应的峰值和耐久性(例如呼吸道合胞病毒、流感、SARS-CoV-2)• 诱导多功能 T 细胞,包括 CD4+(例如埃博拉、流感)、SARS-CoV-2)和 CD8+(例如埃博拉、SARS-CoV-2)• 在新抗原背景下保存抗原:大流行性流感、埃博拉和严重急性呼吸道综合征-CoV-2 抗原
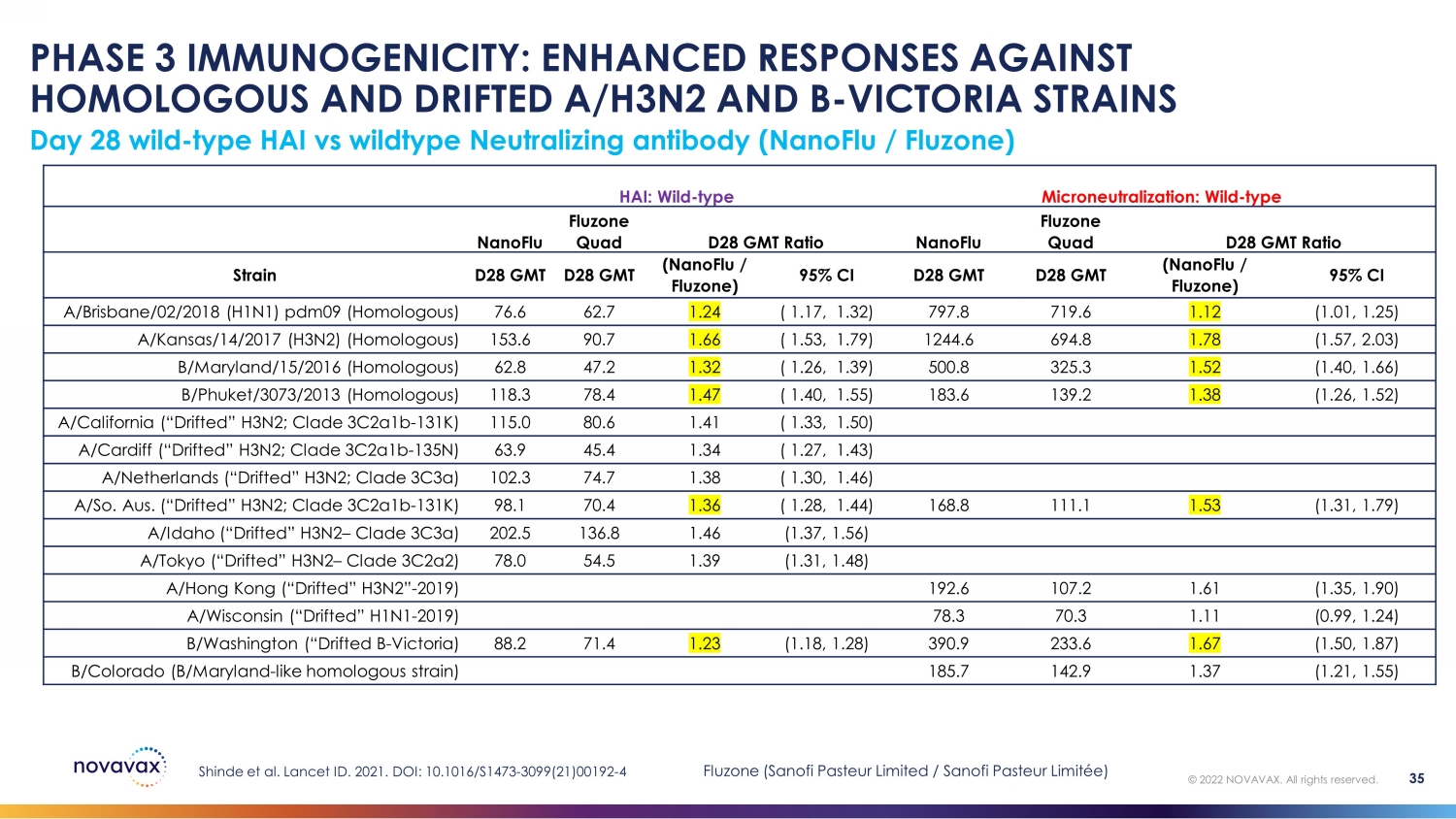
第 28 天野生——HAI 型与野生型中和抗体(nanoFLU /Fluzone)第 3 阶段免疫原性:增强对同源和漂移 A/H3N2 和 B 的反应——维多利亚菌株 Shinde 等人。2021 年《柳叶刀》编号。DOI:10.1016/S1473-3099 (21) 00192-4 HAI:野生型微中和化:野生型 nanoFlu Fluzone Quad D28 GMT 比例 nanoFlu Quad D28 GMT 菌株 D28 GMT (nanoFlu /Fluzone) 95% CI D28 GMT (nanoFlu /Fluzone) 95% CI A/Brisbane/02/2018 (HofLU /Fluzone) 1N1) pdm09(同源)76.6 62.7 1.24 (1.17, 1.32) 797.8 719.6 1.12 (1.01, 1.25) A/Kansas/14/2017 (H3N2) (同源) 153.6 90.7 1.66 (1.53, 1.79) 1244.6 694.8 1.78 (1.57, 2.03) b/Maryland/15/2016 (同源) 62.8 47.2 1.32 (1.26, 1.39) 500.8 325.3 1.52 (1.40, 1.66) B/Phuket/3073/2013 (同源)118.3 78.4 1.47(1.40,1.55)183.6 139.2 1.38(1.26,1.52)A/California(“Drifted” H3N2;Clade 3c2a1b-131K)115.0 80.6 1.41(1.33,1.50)A/Cardift(“漂移” H3N2;Clade 3c2a1b-135N)63.9 45.4 1.34 (1.27,1.43) A/荷兰(“漂移” H3N2;Clade 3c3a)102.3 74.7 1.38(1.30,1.46)A/So.澳大利亚。(“漂移” H3N2;Clade 3c2a1b-131K)98.1 70.4 1.36(1.28,1.44)168.8 111.1 1.53(1.31,1.79)A/爱达荷州(“漂移” H3N2 — Clade 3c3a)202.5 136.8 1.46(1.37,1.56)A/Tokyo(“Drifted” H3N2 — Clade 3c2a2) 78.0 54.5 1.39 (1.31,1.48) A/香港(“Drifted” H3N2”-2019)192.6 107.2 1.61(1.35,1.90)A/威斯康星(“漂移” H1N1-2019)78.3 70.3 1.11(0.99,1.24)b/华盛顿(“Drifted B-Victoria)88.2 71.4 1.23(1.18,1.23)28) 390.9 233.6 1.67 (1.50,1.87) b/Colorado(B/Maryland——比如同源菌株)185.7 142.9 1.37 (1.21,1.55) © 2022 NOVAVAX。版权所有。35 Fluzone(赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司)

COVID-流感联合疫苗开发 2021 年 6 月公布了联合给药子研究的数据** 2021 年 5 月公布了积极的临床前数据* 2021 年 9 月启动 COVID-nanoFlu 联合疫苗的 I/II 期临床试验临床前开发临床概念验证 • 英国 III 期联合给药子研究已证实可行 • 个体疫苗和联合疫苗(HAI)和 ACE2 滴度相当(疫苗)仓鼠和雪貂)•维持临床和病毒学保护,抵御SARS-CoV-2(仓鼠模型)的实验挑战 • 美国常见的抗SARS-CoV-2中和表位的诱导抗体——WA1(原始菌株)和β(B.1.351)变异体临床开发 • 在澳大利亚启动并全面注册——安全性、免疫原性和剂量发现 36 个关键里程碑 © 2022 NOVAVAX。版权所有。36 来源:* Massare 等人 2021;DOI:10.1101/2021.05.05.442782,** Toback 等人 2021;DOI:10.1101/2021.06.09.21258556
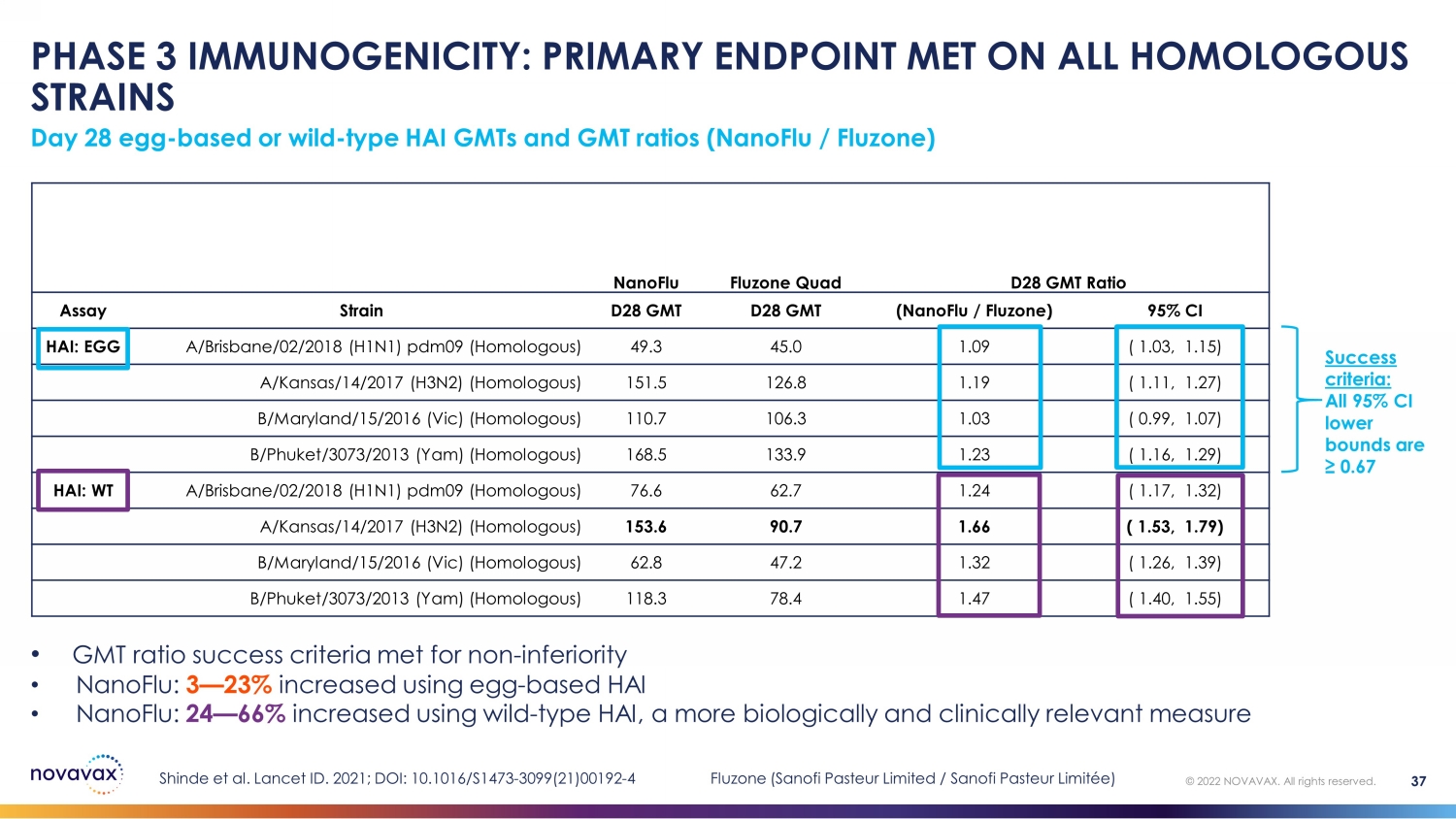
第 3 阶段免疫原性:所有同源菌株均达到主要终点第 28 天蛋基型或野生型 HAI 型 GMT 和 GMT 比率(nanoFLU /Fluzone)© 2022 NOVAVAX。版权所有。37 nanoFLU Fluzone Quad D28 GMT Ratio Strain D28 GMT (nanoFlu /Fluzone) 95% CI HAI: EGG A/Brisbane/02/2018 (H1N1) pdm09 (同源) 49.3 45.0 1.09 (1.03, 1.15) a/Kansas/14/2017 (H3N2)(同源)151.5 126.8 1.19 (1.11, 1.27) b/Maryland/15/2016 (Vic)(同源)110.7 106.3 1.03 (0.99, 1.07) B/Phuket/3073/2013 (Yam) (Yam) (同源) 168.5 133.9 1.23 (1.16, 1.29) HAI: WT A/Brisbane/02/2018 (H1N1) pdm09 (0.99, 1.07) 76.6 62.7 1.24 (1.17, 1.32) A/Kansas/14/2017 (H3N2)(同源)153.6 90.7 1.66 (1.53, 1.79) b/Maryland/15/2016(Vic)(同源)62.8 47.2 1.32(1.26,1.39)B/Phuket/3073/2013(Yam)(同源)118.3 78.4 1.47(1.40,1.55)• 非自卑的格林尼治标准成功率达到 3 — 23% • nanoFlu:使用野生 HAI 增加了 24 — 66%,更具生物学和临床相关性的衡量标准成功标准:所有 95% 置信区间下限均为 ≥ 0.67 Shinde 等人。Lancet ID. 2021;DOI:10.1016/S1473-3099 (21) 00192-4 Fluzone(赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司)
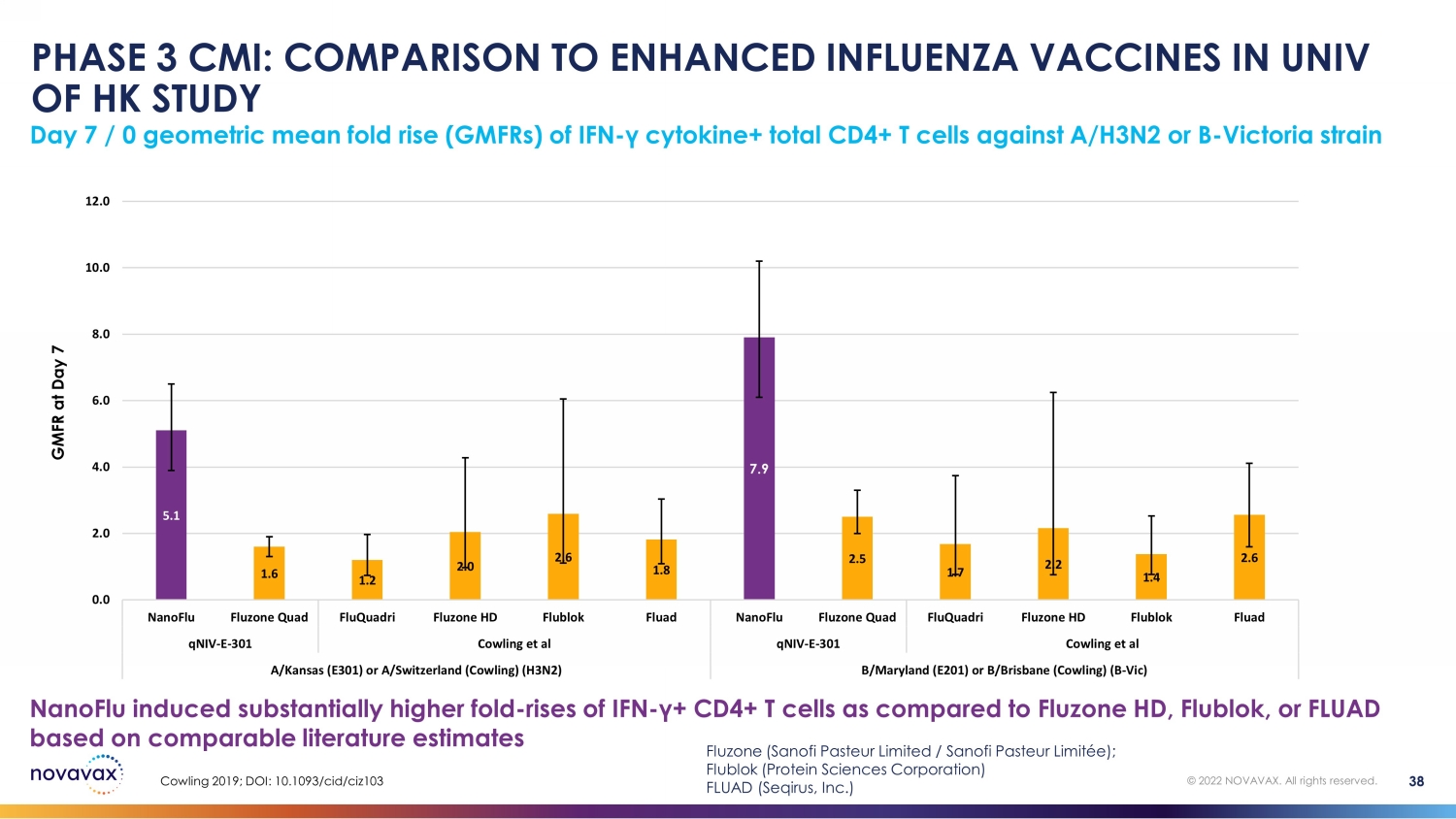
第 3 阶段 CMI:与香港大学强化型流感疫苗的比较研究第 7 天/ 0 与 Fluzone HD、Flublok 或 FLUAD 相比,IFN-γ细胞因子+ 总 CD4+ T 细胞对 A/H3N2 或 B-Victoria 菌株 GMFR 的几何平均倍数上升 (gmFRs) 根据可比文献估计 5.1 1.6 1.2 2.0 2.6 1.8 7.9 2.7 1.7 2.2 1.4 2.6 0.0 4.0 6.0 6.0 8.0 12.0 nanoFLU Quad FluquaDri Fluzone HD Flublok Fluad fluquadRI Fluzone Quad fluquaDri Fluzone HD FluquaDri Fluzone HD301 Cowling 等人 qniv-e-301 Cowling 等人 A/Kansas (E301) 或 a/Switter (Cowling) (H3N2) B/Maryland (E201) 或 b/Brisbane (Cowling) (B-Vic) Cowling 2019;DOI:10.1093/ cid /ciz103 38 © 2022 NOVAVAX。版权所有。Fluzone(赛诺菲巴斯德有限公司/赛诺菲巴斯德有限公司);Flublok(蛋白科学公司)FLUAD(Seqirus, Inc.)
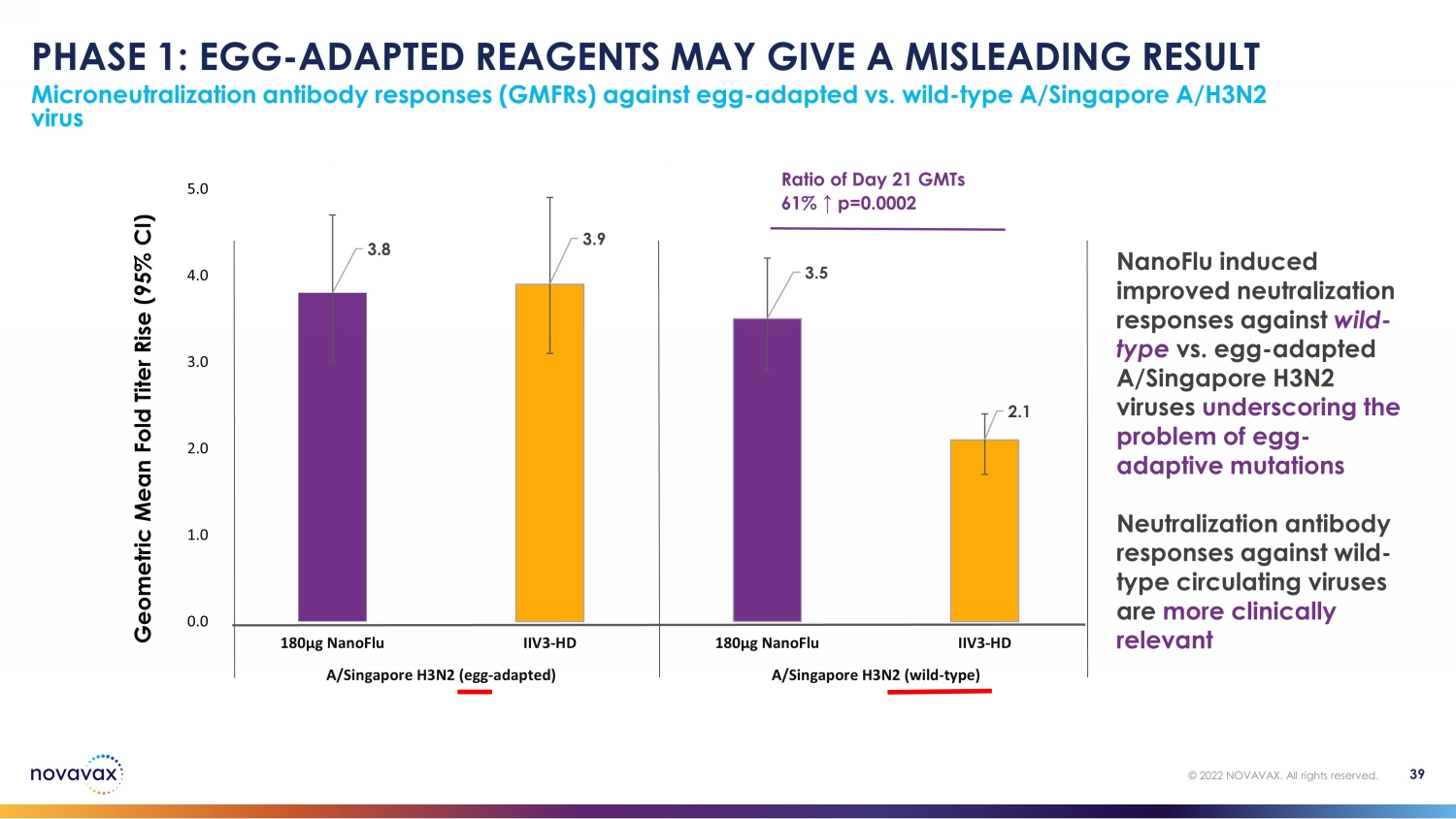
第 1 阶段:鸡蛋——适应性试剂可能会给出误导性结果针对卵子的微量中和抗体反应 (gmFR) ——适应型病毒与野生型 A/新加坡A/H3N2 病毒 39 © 2022 NOVAVAX。版权所有。第 21 天比率 61% ↑ p=0.0002 3.9 3.9 3.5 2.1 0.0 2.0 2.0 2.0 3.0 4.0 4.0 180µg nanoFlu IIV3-HD 180µg nanoFlu IIV3-HD a/新加坡 H3N2(野生型)第 21 天几何平均折叠滴度上升(95% 置信区间)第 21 天比率 61% ↑ p=0.0002 nanoFlu 诱导的中和反应得到改善野生型与卵类适应性A/新加坡H3N2病毒强调卵子适应性突变问题针对野生型循环病毒的中和抗体反应更具临床意义
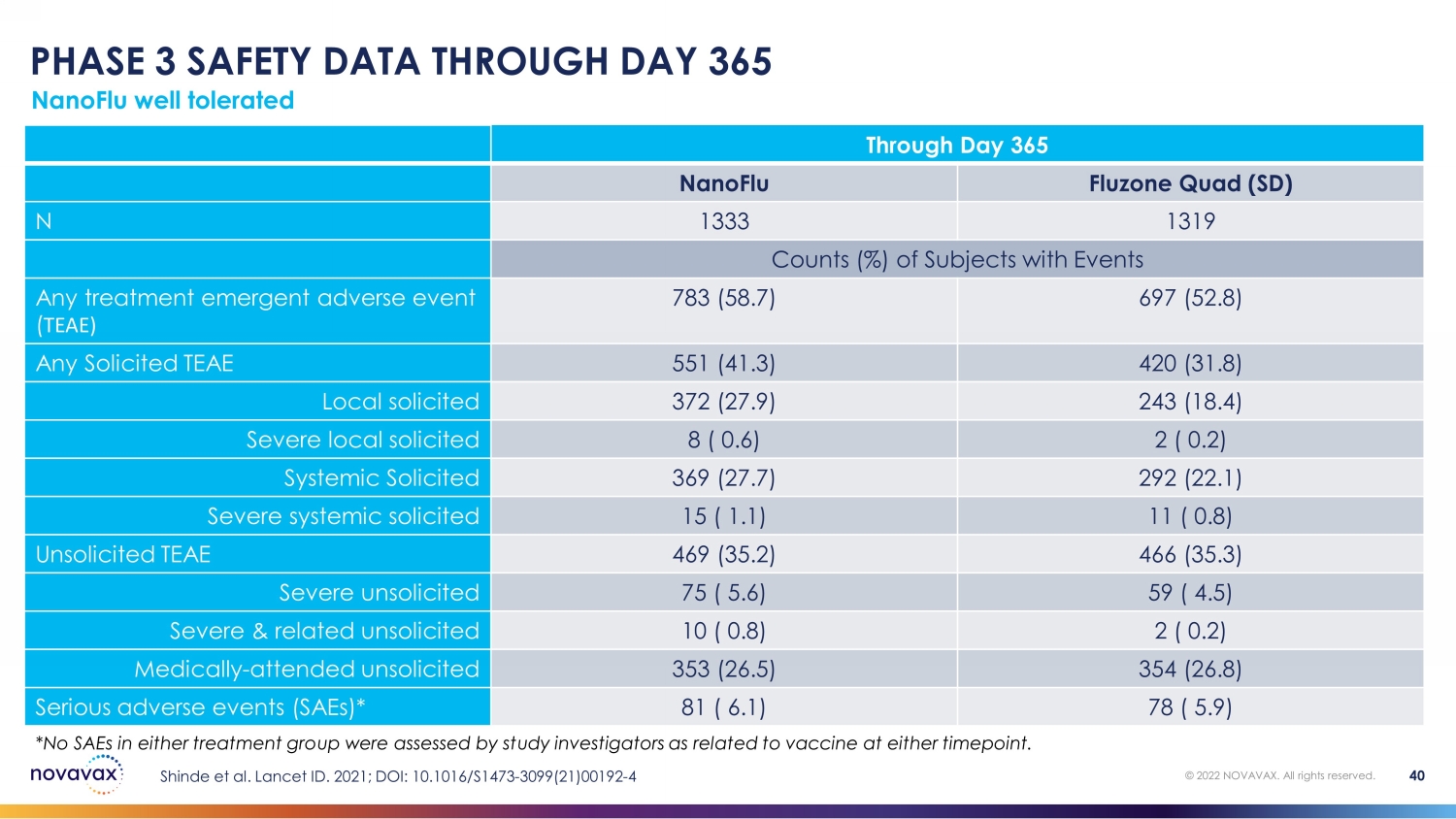
nanoFlu 耐受性良好 © 2022 NOVAVAX。版权所有。40 *研究调查人员在任一时间点均未评估出任一治疗组的SAE与疫苗有关。截至第 365 天 nanoFlu Quad (SD) N 1333 1319 有事件的受试者计数 (%) 任何治疗紧急不良事件 (TEAE) 783 (58.7) 697 (52.8) 任何请求的 TEAE 551 (41.3) 420 (31.8) 本地征集 372 (27.9) 243 (18.4) 严重受试者 8 (0.6) 2 (0.2) 系统性请求 369 (27.7) 292 (22.1) 严重系统性受伤 15 (1.1) 11 (0.8) 未经请求的 TEAE 469 (35.2) 466 (35.3) 未经请求的严重系统性 75 (5.6) 59 (4.5) 未经请求的严重及相关的 10 (0.8) 2 (0.2) 医学上——未经请求就诊 353 (26.5) 354 (26.8) 严重不良事件 (SaeS) * 81 (6.1) 78 (5.9) Shinde 等人Lancet ID. 2021;DOI:101016/S1473-3099 (21) 00192-4 第 365 天的第 3 阶段安全数据