附件99.1

UniQure宣布2021年财务业绩和 重点介绍公司最近的进展
~血友病最大基因疗法研究的数据 B显示18个月后持续的治疗效果,与基线相比,在降低年出血率方面具有统计学优势 FIX预防疗法;2022年上半年提交的营销申请进入正轨~
~正在进行的美国亨廷顿病I/II期临床试验的前4名患者的数据显示,AMT-130耐受性良好,没有观察到明显的安全性问题 ~
~来自美国AMT-130 I/II期低剂量队列所有患者的更多临床数据 ,包括mHTT和NFL生物标志物,预计将于2022年第二季度公布 ~
~开始招募欧洲Ib/II期AMT-130研究 前两名患者服药~
~2022年难治性颞叶癫痫和Fabry 项目进入IND研究~
~2021年底财务状况强劲,现金为5.56亿美元~
马萨诸塞州列克星敦和荷兰阿姆斯特丹(2022年2月25日)-为有严重医疗需求的患者推进变革性疗法的领先基因治疗公司UnQure N.V.(纳斯达克:QURE)今天公布了2021年的财务业绩,并重点介绍了其业务的最新进展。
“2021年,我们在所有战略要务方面都取得了巨大进展,包括推进我们的临床阶段计划,扩大我们的研究渠道,并准备 提交计划于2021年提交的营销申请。第四纪去扎帕沃韦斯2022年上半年,“uniQure首席执行官马特·卡普斯塔(Matt Kapusta)说。“有了HOPE-B关键研究的积极数据,我们期待着与我们的合作伙伴CSL Behring密切合作,为血友病B患者带来这种可能改变生命的基因疗法。”
在2022年期间,我们还密切关注 保持我们的强劲势头,登记两项正在进行的亨廷顿病I/II期研究。重要的是,我们期待着 在2022年第二季度分享来自低剂量队列中所有10名患者的更多安全性和生物标记物数据,包括突变HTT蛋白(MHTT)和神经丝轻链(NFL)。我们还准备将我们针对Fabry病和难治性颞叶癫痫的候选基因治疗产品推进到IND毒理学研究中,我们预计今年将推出至少两个针对肝脏和中枢神经系统的新基因治疗计划。随着我们继续推进和扩大我们的流水线, 我们还通过在阿姆斯特丹的第二个cGMP工厂扩大我们的制造足迹,我们预计该工厂将于2022年上线。“
近期主要成就
| • | 推进第四纪去扎帕沃维克的后期发展 (AMT-061) for the treatment of hemophilia B |
| • | 2021年12月,该公司和CSL Behring宣布,在对重度和中度血友病B患者进行的ETRAACGENE dezparvovec的HOPE-B关键试验中,获得了主要和次要终点。与基线 因子IX(FIX)预防治疗相比,服药18个月后的年出血率(ABR)达到了非劣势的主要终点 ,作为ABR的次要优势终点 。 |
| • | HOPE-B试验的数据 表明第四纪去扎帕沃韦斯输注后6个月的平均FIX活性为正常的39.0%,18个月时为正常的36.9% 。在输液后6个月的引导期后,所有出血的调整后年化出血率(1.51)降低了64%(p=0.0002),所有固定治疗的出血量减少了77%(3.6 5%至0.83;Petranacogene dezparvovec 停止使用预防措施,每位参与者的平均未调整 年化FIX消费量总体减少了97%,从257,338.8 IU/年降至8,486.6 IU/年(从 导入期降至13-18个月)。稳定固定表达后所有出血的ABR值在18个月时评估为1.5,而导入期至少6个月的ABR值为4.19%(p=0.0002)。调查员裁决的FIX治疗出血的ABR为0.83,而导入ABR为3.65(p |
| • | 公司和CSL Behring在准备营销申请方面取得重大进展 第四纪的德扎帕沃韦克,预计将于2022年上半年由CSL Behring在美国和欧盟提交。作为这些努力的一部分, 该公司于2021年12月成功通过了其商业制造流程的认证。 |
| • | 推进AMT-130治疗亨廷顿病的临床研究进展 |
| • | 2021年12月,在AMT-130的美国I/II期双盲随机研究的 低剂量队列中,宣布了对前4名患者的初步观察结果。AMT-130 总体耐受性良好,没有与AMT-130相关的严重不良反应。在接受AMT-130手术后,NFL如预期的那样立即增加了 ,并在两名接受治疗的患者中恢复到基线 。在两名未经治疗的对照组患者中,NFL保持相对稳定。在一年的随访中,结构磁共振成像没有显示任何临床上有意义的安全性发现,无论是治疗组还是对照组患者。 |
| • | 在 2022年第二季度,该公司预计将提供低剂量队列中所有10名患者的临床最新信息,包括安全性、mHTT和NFL生物标志物数据。在两个剂量队列中的所有患者 都解盲后,容积MRI和 功能数据预计在2023年上半年可用。 |
| • | 患者 预计将于2022年下半年开始第三个队列的登记,以探索 使用替代立体定向导航系统来简化AMT-130输液 导管的放置。该队列计划包括多达18名随机患者, 其中约12人将接受较高剂量的6x1013 VG。 |
| • | 2022年2月,前两名患者参加了AMT-130的欧洲开放标签Ib/II期 研究。这项研究将招募15名早期表现为亨廷顿病的患者,其剂量与美国研究中探索的剂量相同。与正在进行的 美国研究一起,欧洲研究旨在确定AMT-130的安全性、概念验证和 最佳剂量,以推进到第三阶段开发,或进入验证性的 研究(如果加速注册路径可行)。 |
| • | In total, 59 patients are expected to be enrolled in the U.S. and European Phase 1/II trials of AMT-130. |
| • | 将我们的研究渠道推向临床 |
| • | 难治性颞叶癫痫(TLE)-该公司预计在2022年下半年启动一项针对非人类灵长类动物的GLP毒理学研究 ,预计将在2023年支持IND提交 。AMT-260采用miRNA沉默技术抑制TLE患者海马中异常表达的Kainite 受体。TLE是一个巨大的未得到满足的临床需求 仅在美国和欧洲就有大约130万人受到影响,其中约80万患者无法通过目前批准的 抗癫痫疗法充分控制急性癫痫发作。 |
| • | Fabry disease-该公司预计在2022年年中启动AMT-191的普洛斯毒理学研究,预计将支持2023年提交IND。AMT-191是一款 一次性给予AAV5基因治疗,并整合α-半乳糖苷酶A(Gla)转基因。在临床前研究中,AMT-191显示了肾脏和心脏交叉校正的潜力,并有可能进入大脑。它 还提供了重新给药的可能性,就像一项对非人类灵长类动物的研究所显示的那样。 |
| • | 公司以优先分配资源和加快我们的难治性TLE和Fabry病项目进入临床的目标为目标,剥夺了AMT-150治疗脊髓小脑性共济失调3型的临床前开发 。 |
| • | 扩展我们的制造能力 |
| • | 公司最近完成了阿姆斯特丹工厂的扩建,为新的研发活动提供了额外的实验室 ,并建造了一个专为生产500升cGMP材料而设计的洁净室 。此扩展现在可提高产品开发的速度和敏捷性 。 |
| • | 强大的 现金状况以推进公司的计划 |
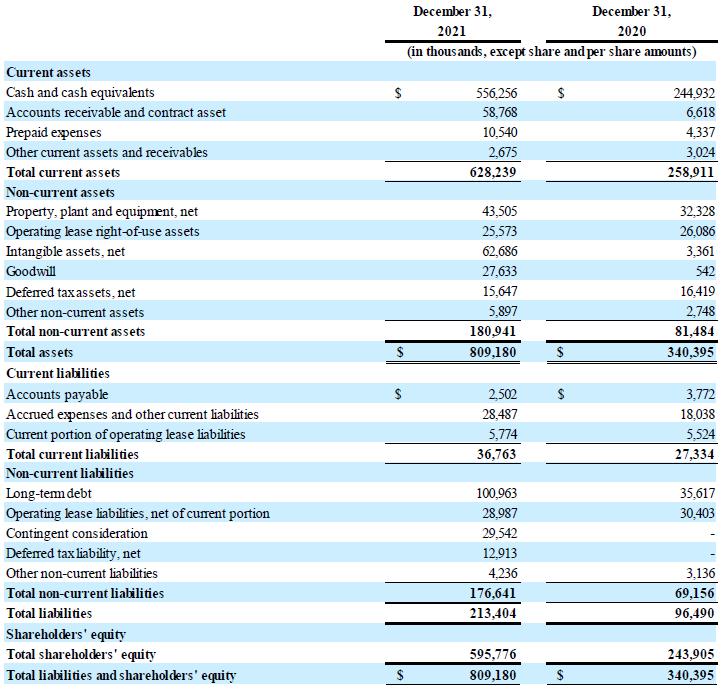
| • | 截至2021年12月31日,该公司的现金和现金等价物为5.563亿美元。 公司预计其现金和现金等价物将足以为2025年上半年的运营提供资金 假设BLA和MAA提交以及 CSL Behring协议下的首批商业销售里程碑实现。 |
即将举行的投资者活动(每个活动都将以虚拟方式进行 )
| • | Cowen 42发送年度医疗保健会议,2022年3月7日至9日 |
| • | Stifel 2022 CNS Days, March 28-29, 2022 |
| • | 古根海姆 基因组药物和罕见病日,2022年3月31日和4月1日 |
财务亮点
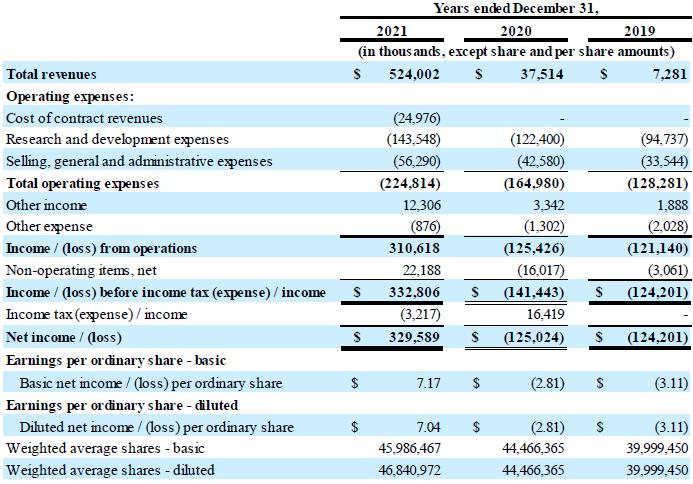
现金状况:截至2021年12月31日,公司持有的现金和现金等价物为5.563亿美元,而截至2020年12月31日的现金及现金等价物为2.449亿美元。CSL Behring协议于2021年5月6日全面生效后,公司收到了4.624亿美元的付款。2021年1月和 12月,本公司和Hercules修订了债务融资协议,根据该协议,本公司于2021年1月额外提取了3500万美元 ,并进一步提取了3000万美元,截至2021年12月31日,该融资项下的未偿还债务总额为1.0亿美元 。该公司还将到期日从2023年6月延长至2025年12月。2021年3月和4月,公司 根据与SVB Leerink LLC的公开市场销售协议,出售了921,730股普通股,总收益约为2960万美元。 2021年7月,公司支付了与收购Corlieve相关的净额4210万欧元(4990万美元)。
收入:截至2021年12月31日的年度收入为5.24亿美元,而2020年同期为3750万美元。这一增长是由于CSL Behring交易于2021年5月完成时确认的4.624亿美元许可收入,以及与CSL Behring在2022年上半年提交生物制品许可申请(“BLA”) 和市场授权申请(“MAA”)后公司预计将收取的里程碑式付款相关的5500万美元许可收入。在2020年,公司确认了 2780万美元的非现金许可收入,截至2020年12月1日,也就是修订后的百时美施贵宝合作和许可协议的生效日期,以及在实现四个合作目标中的一个 的研究里程碑后,于2020年12月确认的收入为440万美元。
研发费用:截至2021年12月31日的一年,研发费用为1.435亿美元,而2020年同期为1.224亿美元。 变化主要涉及招聘人员以支持候选产品的开发、推进公司亨廷顿病基因治疗计划的临床开发 以及增加与临床前产品 候选产品相关的活动,以及增加与因收购Corlieve而记录的或有对价负债相关的公允价值变化。
SG&A费用:截至2021年12月31日的一年中,销售、一般和 管理费用为5630万美元,而2020年同期为4260万美元 。这一变化主要与人员招聘、基于股份的薪酬支出增加以及与CSL Behring的许可交易有关的 财务咨询付款有关。
其他收入净额:截至2021年12月31日的一年,其他收入净额为1,140万美元,而2020年同期其他收入净额为200万美元。 其他收入净额的增加主要与根据美国CARE法案收到的员工留用积分收入有关, 与欧洲当局为补贴荷兰研发工作而支付的款项有关,以及与公司与Vectory B.V.在4月份签订的和解协议有关的收入 。 其他收入净额为1,140万美元,而2020年同期其他收入净额为200万美元。 其他收入净额的增加主要与根据美国CARE法案收到的员工留用积分收入有关, 与公司与Vectory B.V.在4月份达成的和解协议有关
其他非经营性项目,净额:
其他营业外收入,截至2021年12月31日的年度净收入为2220万美元,而2020年同期其他营业外亏损为1600万美元。其他营业外收入的增长主要与本期净外币收益有关,而与2020年同期的净外币亏损 相比。
净收入:
截至2021年12月31日的年度净收益为3.296亿美元,或每股普通股基本净收入7.17美元,每股稀释后净收入7.04美元,而2020年同期亏损1.25亿美元,或每股普通股基本和稀释后亏损2.81美元。
关于uniQure
UnQure正在兑现基因 疗法的承诺--一种具有潜在疗效的单一疗法。我们正在利用我们模块化和经验证的技术平台 快速推进一系列专利基因疗法,用于治疗血友病B、亨廷顿病、难治性颞叶癫痫、Fabry病和其他疾病。Www.uniQure.com
UnQure前瞻性陈述
本新闻稿包含前瞻性 陈述。除历史事实陈述外,其他所有陈述均为前瞻性陈述,通常用术语 表示,如“预期”、“相信”、“可能”、“估计”、“预期”、“目标”、“打算”、“期待”、“可能”、“计划”、“潜在”、“预测”、“项目”、“应该”、“ ”、“将会”和类似的表达方式。前瞻性陈述基于管理层的信念和假设 以及截至本新闻稿发布之日管理层才能获得的信息。这些前瞻性声明包括,但不限于,我们是否会将etranacogene dezparvovec带给患者,我们是否会分享突变的htt蛋白(Mhtt)和神经细丝轻链(Nfl)或来自我们的amt-130临床试验中任何患者的其他安全和生物标志物数据,在2022年第二季度, 2023年上半年或以后,我们是否能够推进我们的Fabry病基因治疗候选产品。无论我们是否会在年内启动任何针对肝脏或中枢神经系统的新基因治疗计划,我们在阿姆斯特丹的第二个cGMP设施是否会在2022年或永远上线,无论etranacogene dezparvovec的营销申请 是否会在2022年上半年或永远在美国或欧盟提交。由于许多原因,公司的实际结果可能与这些前瞻性声明中预期的结果大不相同,包括但不限于,与持续的新冠肺炎疫情对我们公司和更广泛的经济和医疗体系的影响相关的风险, 我们与CSL Behring的商业化和许可协议,我们的临床开发活动,临床结果,合作安排, 监管监督, 产品商业化和知识产权索赔,以及公司定期证券申报文件(包括2022年2月25日提交的Form 10-K年度报告)中“风险因素”项下描述的风险、不确定性和其他因素 。鉴于这些风险、不确定性和其他因素,您不应过度依赖这些前瞻性陈述 ,即使未来有新信息 ,公司也不承担更新这些前瞻性陈述的义务。
UniQure联系人:
| 对于投资者来说: | FOR MEDIA: | |
| 玛丽亚·E·坎托 | 基亚拉·鲁索 | Tom Malone |
| Direct: 339-970-7536 | Direct: 617-306-9137 | Direct: 339-970-7558 |
| Mobile: 617-680-9452 | Mobile: 617-306-9137 | Mobile:339-223-8541 |
| 邮箱:m.cantor@uniQure.com | 邮箱:c.russo@uniQure.com | 邮箱:t.malone@uniQure.com |
UnQure N.V.
未经审计的综合资产负债表
UnQure N.V.
未经审计的合并经营报表