

拉尼治疗公司宣布兰尼皮尔™HC 2022年2月展会99.2

前瞻性陈述本演示文稿和随附的口头陈述包含前瞻性陈述。前瞻性陈述基于作出这些陈述时可获得的信息或管理层截至那时对未来事件的善意信念和假设,受风险和不确定因素的影响,这些风险和不确定因素可能导致实际业绩或结果与前瞻性陈述中表达或建议的情况大不相同。鉴于这些风险和不确定性,本陈述和随附的口头陈述中讨论的前瞻性事件和情况可能不会发生,实际结果可能与前瞻性 陈述中预期或暗示的结果大不相同。这些风险和不确定性包括Rani治疗控股公司(“Rani”、“我们”、“我们”或“我们”)未来的财务表现,包括我们对我们的收入、收入成本、运营费用、产品的市场潜力以及我们实现和保持未来盈利能力的预期、产品开发、临床前和临床前开发过程以及监管批准过程中固有的风险、商业化和获得市场认可的风险和不确定因素、与保护和捍卫我们的专利或我们的专有权可能 不足以保护我们的候选产品的风险,我们无法在需要时以可接受的条款或根本无法获得必要资本的风险,来自其他产品或程序的竞争,我们对第三方进行临床和非临床试验的依赖,我们对单一来源第三方供应商生产临床的依赖, 这些因素包括:我们对候选产品的非临床和任何未来商业供应的预期;我们开发、优化和扩大制造流程的能力 ;新冠肺炎疫情的范围和持续时间;我们对客户对候选产品需求的预期;我们拓展产品潜在市场的能力,以及不断提高的监管要求。本演示文稿中出现的其他公司的商号、 商标和服务标志均为其各自所有者的财产。仅为方便起见,本演示文稿中提及的商标和商号可能不带®和 ™符号出现,但这些引用并不意味着我们不会根据适用法律最大程度地声明我们或适用许可人对这些商标和商号的权利。 前瞻性声明固有地受到风险和不确定性的影响,其中一些风险和不确定性是无法预测或量化的。在某些情况下,您可以通过“预期”、“ ”、“相信”、“思考”、“继续”、“可能”、“估计”、“预期”、“打算”、“可能”、“计划”、“潜在”、“预测”、“ ”、“项目”、“应该”、“目标”、“将”或“将”等术语或其他类似术语的负面含义来识别前瞻性陈述。您不应过度依赖任何前瞻性陈述。 前瞻性陈述不应被解读为对未来业绩或结果的保证,也不一定是对实现此类业绩或结果的时间或时间的准确指示(如果有的话)。除非法律要求 ,否则Rani不承担任何公开更新或修改任何前瞻性陈述的义务,无论这些前瞻性陈述是否因新信息而产生, 未来的发展或其他方面。本演示文稿和随附的口头演示文稿包含 基于独立行业出版物或其他公开信息的统计数据、估计和预测,以及基于我们内部来源的其他信息。此信息涉及许多假设和 限制,提醒您不要过度重视此类信息。我们没有独立验证行业出版物和其他公开提供的信息中包含的信息的准确性或完整性。 因此,我们不对该信息的准确性或完整性做出任何陈述,也不承诺在本演示文稿日期之后更新此类信息。
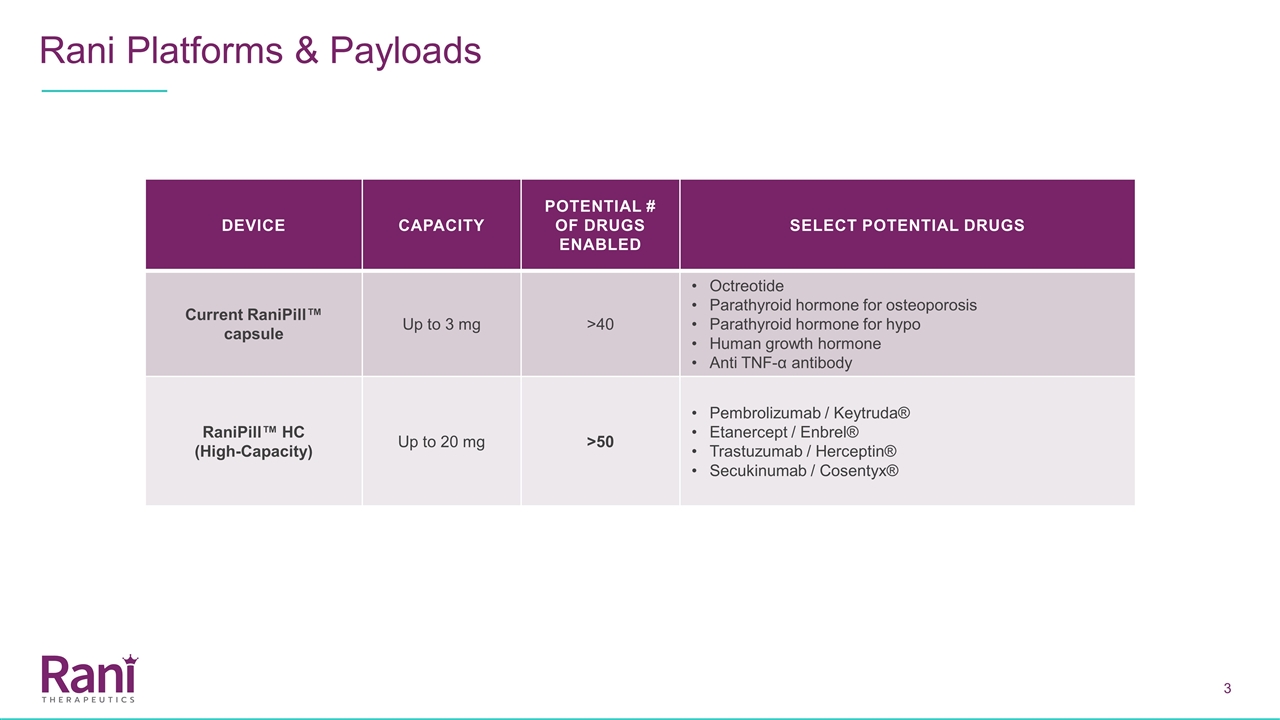
RANI平台和有效载荷设备 容量潜力#可供选择的潜在药物目前兰尼皮尔™胶囊最高3毫克>40奥曲肽甲状旁腺激素治疗骨质疏松症甲状旁腺激素治疗人类生长激素过低抗肿瘤坏死因子-α抗体兰尼皮尔™ HC(高容量)最高20毫克>50培哚珠单抗/Keytruda®Etanercept/Enbrel®Trastuzumab/Herceptin®Secukinab

RANIPILL™HC高有效载荷 RANIPILL™HC将使更多种类的药物成为可能,并可能极大地扩大我们的市场机会

兰尼皮尔™HC研究

高有效负荷系统:研究目标 证明能够在犬体内输送高药物有效负荷(高达20毫克),证实通过Ranipill™HC装置输送的阿达利单抗的吸收曲线与之前建立的与阿达利单抗生物相似的历史对照一致。

Ranipill™HC-Adalimumab: 方案概要测试装置Ranipill™HC装置无肠溶包衣胶囊外壳或化学反应物试验文章和剂量Adalimumab:18 mg/20 mg方案Ranipill™HC装置通过剖腹手术直接插入空肠腔内Ranipill™气囊由外部注射器泵充气(驱动压力与现有Ranipill™装置相似)切口闭合缝合血样采集3mL血样和5天
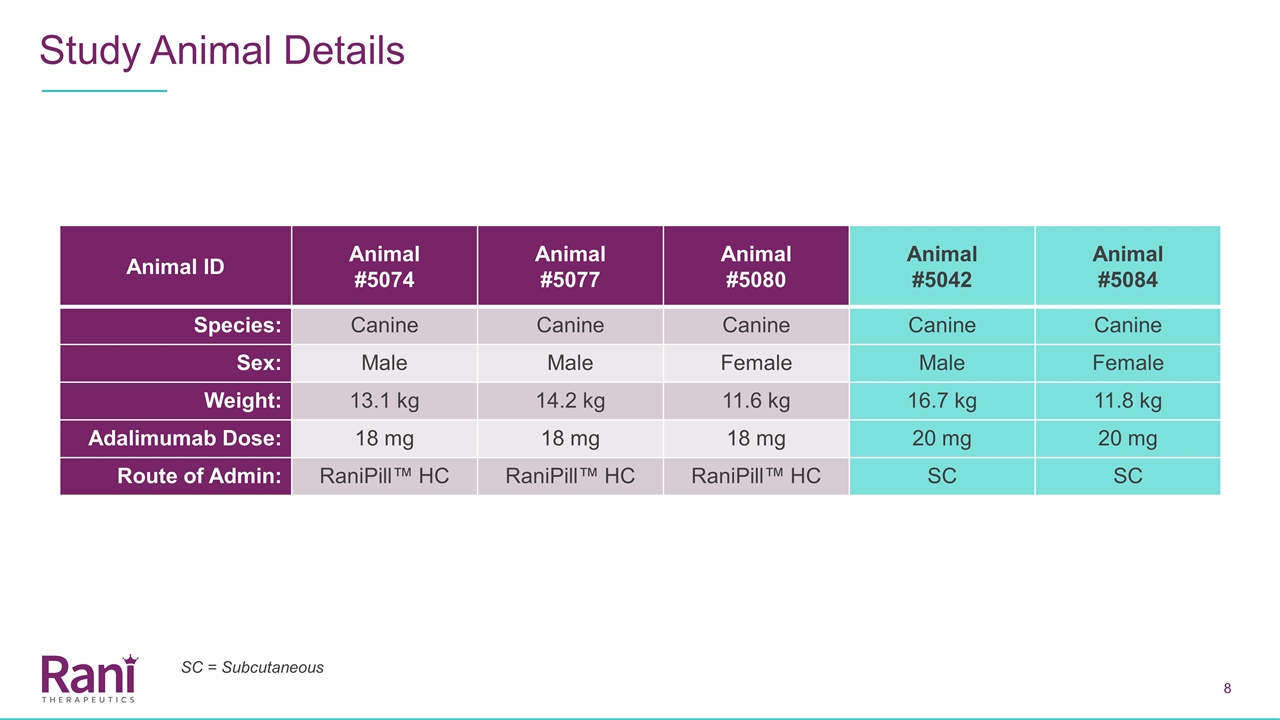
动物ID动物#5074动物#5077动物#5042动物#5084种:犬性别:雄性14.2公斤11.6公斤16.7公斤11.8公斤阿达利单抗剂量:18毫克18毫克18毫克20毫克20毫克给药途径:Ranipill™HC=皮下
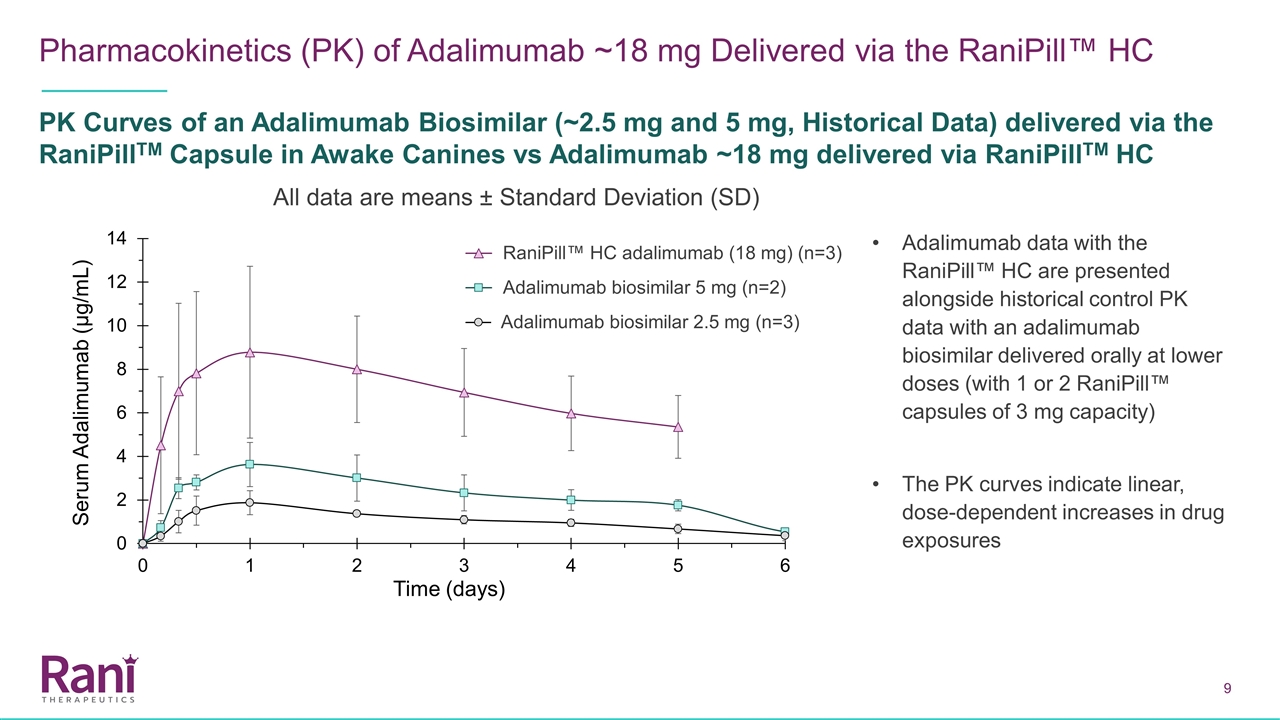
阿达利单抗~18 mg经Ranipill™™HC PK曲线(~2.5 mg和5 mg,历史数据)在清醒犬体内的药代动力学(PK)与Adalimumab~18 mg经RaniPill TM HC给药比较所有数据均为均值±标准差(SD)阿达利单抗数据与历史对照PK数据一起给出Adalimumab生物相似物5毫克(n=2)、Adalimumab生物相似物2.5 mg(n=3)、Ranipill™HC Adalimumab(18毫克)(n=3)(n=3)
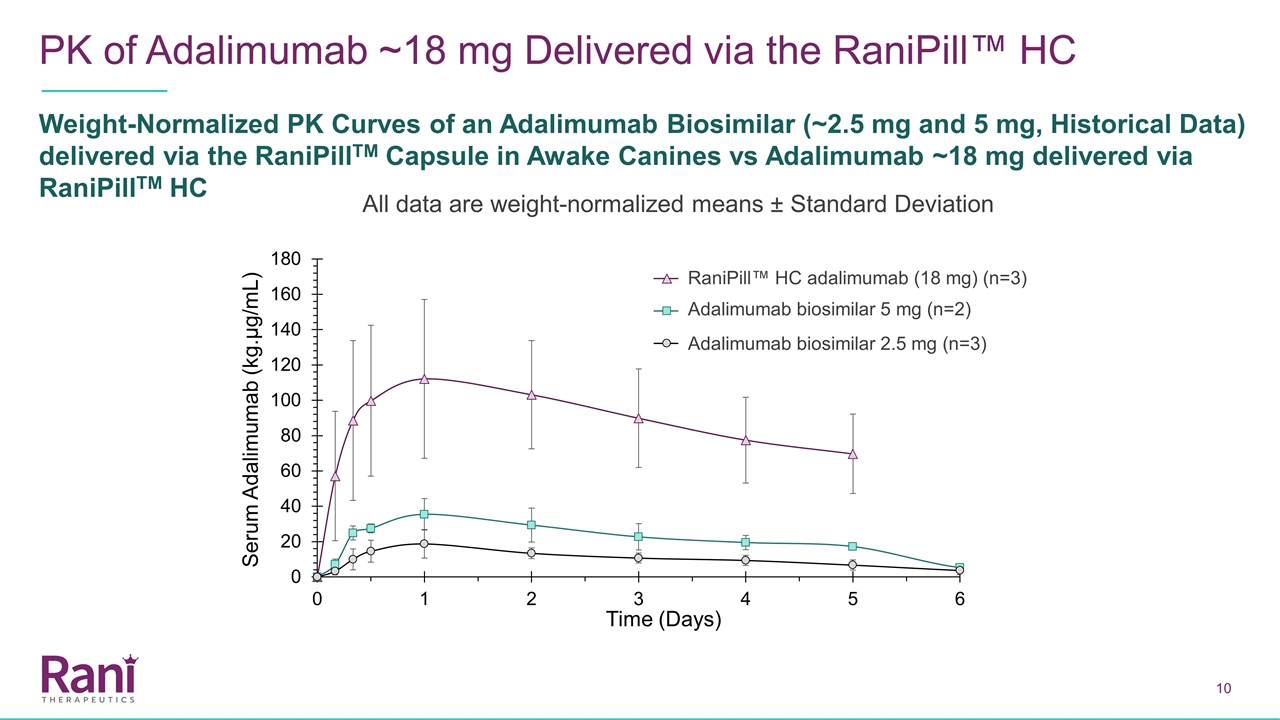
通过Ranipill™HC重量归一化的PK曲线(约2.5mg和5 mg,历史数据)在清醒犬体内注射阿达利单抗~18毫克与通过RanipillTM HC给药的阿达利马单抗~18毫克相比所有数据均为重量归一化平均数±标准差阿达利马单抗生物相似物5毫克(n=2)阿达利姆单抗生物相似物2.5毫克(n=2)阿达利米单抗生物相似物5毫克(n=2)阿达利米单抗生物相似物2.5毫克(n=2)阿达利米单抗生物相似物(n=2)阿达利米单抗生物相似物2.5毫克(n=2)

通过Adalimumab Biosimilar的RaniPill路径剂量和重量归一化PK曲线(2.5毫克和5毫克,历史数据)与通过Ranipill™HC传递的Adalimumab~18 mg相比,使用RaniPill™HC设备产生的Adalimumab的PK曲线与通过3 mg Ranipill™胶囊传递的Adalimumab生物相似物产生的历史PK曲线相似。请注意,由于仅收集了长达5天的数据,因此在这项初步研究中,没有完全捕获RaniPill™HC的消除阶段 Adalimumab Biosimilar 5 mg(n
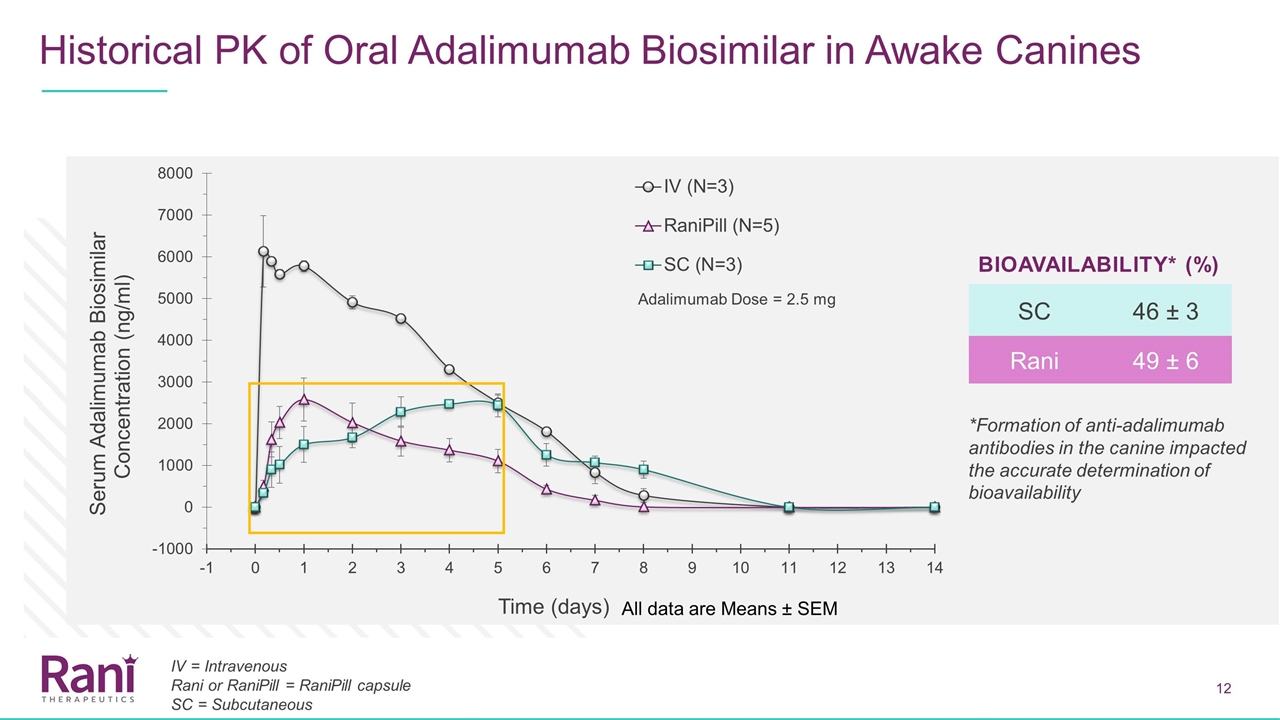
阿达利单抗在清醒犬体内的历史PK 清醒犬的生物相似性所有数据均为平均值±SEM SC 46±3 RANI 49±6生物利用度*(%)*犬体内抗ADALIMumab抗体的形成影响了ADALIMumab剂量=2.5 mg IV =静脉注射Rani或RaniPill=RaniPill胶囊SC=皮下注射的生物利用度的准确测定
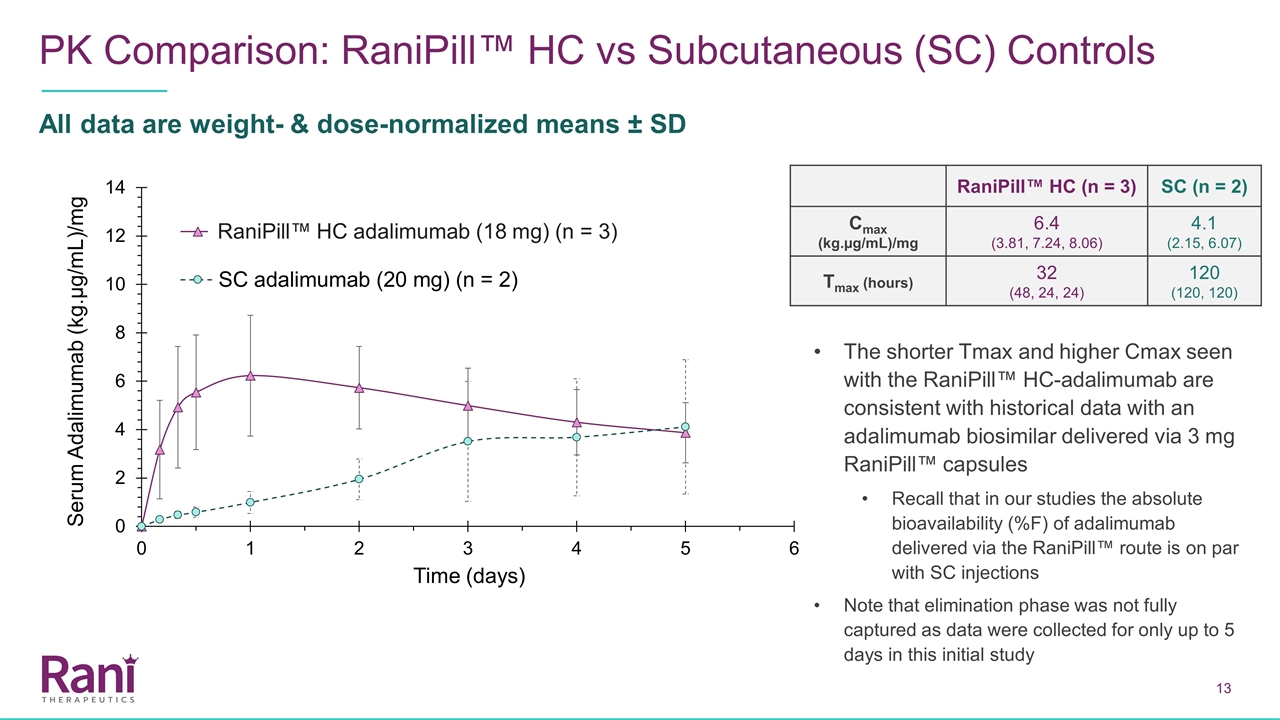
PK比较:Ranipill™HC与 皮下(SC)对照所有数据均为重量和剂量归一化平均值±SD Ranipill™HC(n=3)SC(n=2)Cmax(kg.µg/mL)/mg 6.4(3.81,7.24,8.06)4.1(2.15,6.07)Tmax(小时)32(48,24,24)120(120,使用Ranipill™HC-Adalimumab的较短的Tmax 和较高的Cmax与通过3毫克Ranipill™胶囊传递的Adalimumab生物相似物的历史数据一致记住,在我们的研究中,通过Ranipill™路线传递的Adalimumab 的绝对生物利用度(%F)与SC注射相同。注意,消除阶段没有完全捕获,因为在最初的研究中仅收集了长达5天的数据Ranipill™HC adalimimab

使用Ranipill™HC装置,我们已经证明了高剂量(18毫克)的阿达利单抗在犬体内的成功给药。与历史对照相比,使用Ranipill™HC装置给药18 mg的阿达利单抗的血药浓度呈剂量比例增加(通过目前的Ranipill™胶囊给药)。与SC相比,使用Ranipill™HC装置的低剂量(2.5 mg和5 mg)阿达利单抗的Tmax更短。

市场调研
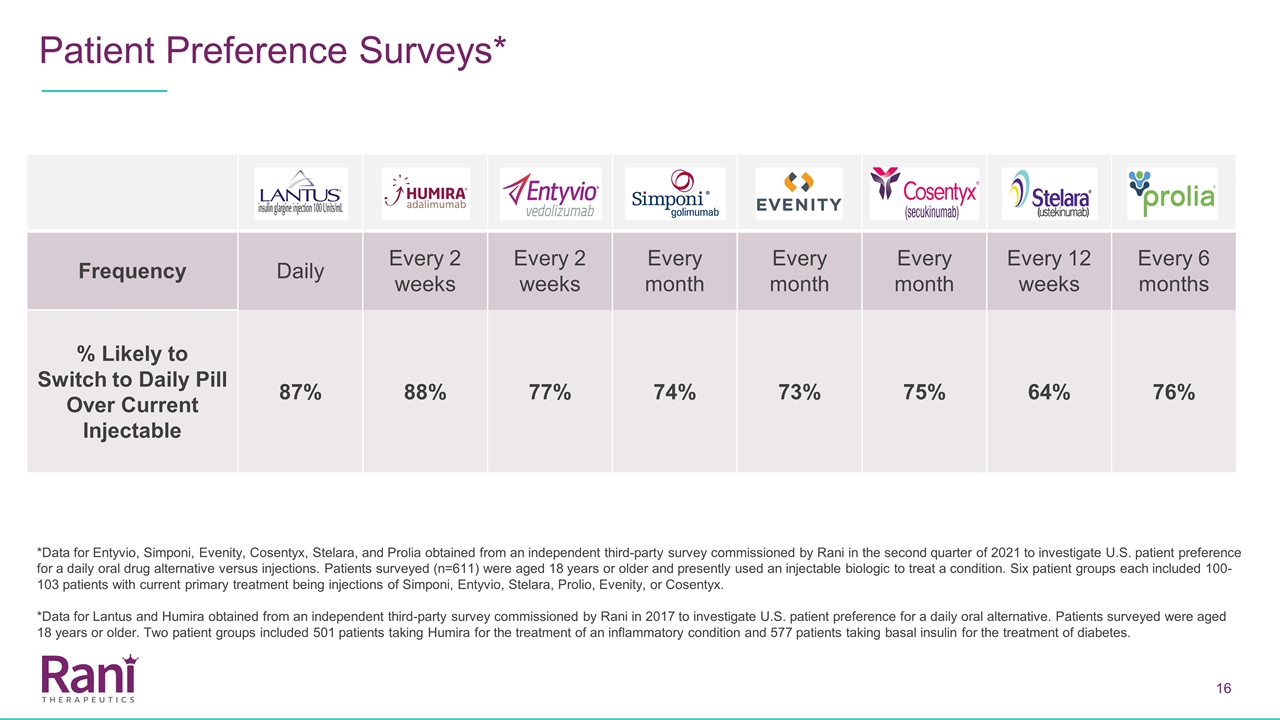
患者偏好调查* 频率每天每2周每月每12周每6个月转换为每日避孕药的可能性超过当前可注射药物87%88%77%74%73%75%64%76%*Entyvio、Simponi、Evenity、Cosentyx、 Stelara和Prolia的数据来自Rani于2021年第二季度委托进行的独立第三方调查,以调查美国患者对每日口服药物替代品的偏好而不是注射。接受调查的患者(n=611)年龄在18岁或以上,目前使用可注射生物制剂治疗某种疾病。6个患者组各包括100-103名患者,目前的主要治疗是注射Simponi、Entyvio、Stelara、Prolio、Evenity或Cosentyx。*Lantus和Humira的数据来自Rani于2017年委托进行的一项独立第三方调查,该调查旨在调查美国患者对每日口服替代品的偏好。接受调查的患者年龄在18岁或以上。两组患者包括501名服用Humira治疗炎症性疾病的患者和577名服用基础胰岛素治疗糖尿病的患者。

模拟兰尼皮尔™吞咽试验概述目的:评价不同年龄患者对模拟兰尼皮尔™胶囊的吞咽易用性患者人群:目前正在接受各种药物注射的患者研究设计3组患者年龄组: 21~50岁,51~65岁,66~75岁,每组50人。试验文章:一种灌装马铃薯淀粉的模拟兰尼皮尔™胶囊(与目前兰尼皮尔™胶囊重量和大小相同)
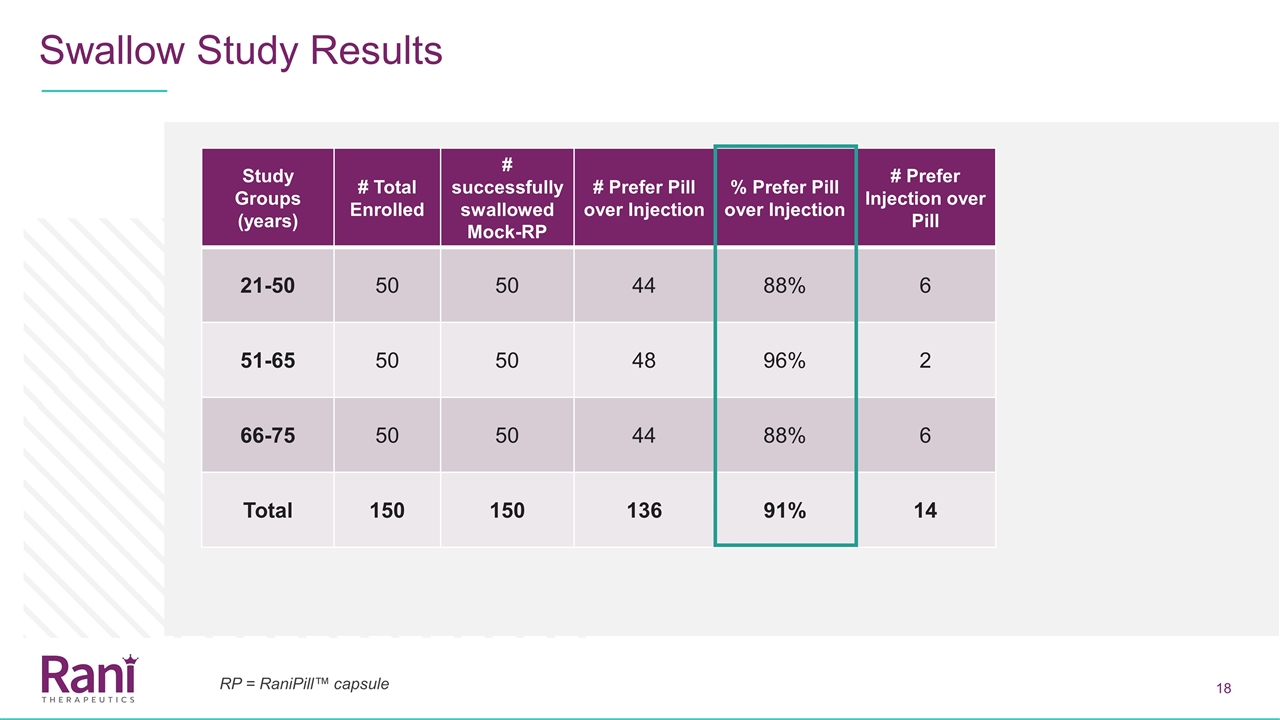
吞咽研究结果研究组 (年)#入选总数#成功吞咽模拟-RP#首选丸剂胜过注射剂#首选丸剂胜过注射剂#6 51-65 50 50 48 96%2 66-75 50 44 88%6总计150 150 136 91%14 RP= RaniPill™胶囊

Adalimumab:每日口服雷尼普利剂量的模拟

每日剂量Adalimumab的剂量为每2周40毫克,我们利用我们的人体内窥镜研究数据(2.5毫克空肠内注射)推测这大约相当于每天2.5毫克的剂量,我们委托稳态模拟 来模拟每天口服一次雷尼皮尔剂量2.5毫克的药物动力学。根据模拟,预计:血清中阿达伊单抗的治疗水平可以40毫克皮下注射或两周每日两次口服)减少达到治疗水平的时间目前正在服用阿达利玛单抗40毫克双周给药方案的患者可以在最后一次SC剂量阿达利单抗之后的任何时候切换到每天的雷尼皮尔方案

Adalimumab空肠内(IJ)数据的稳态PK模拟:从皮下切换,预计目前正在接受adalimumab 40 mg双周给药方案的患者可以在最后一次皮下给药 adalimumab qd=每日剂量之后的任何时间点改用每天的Ranipill™方案
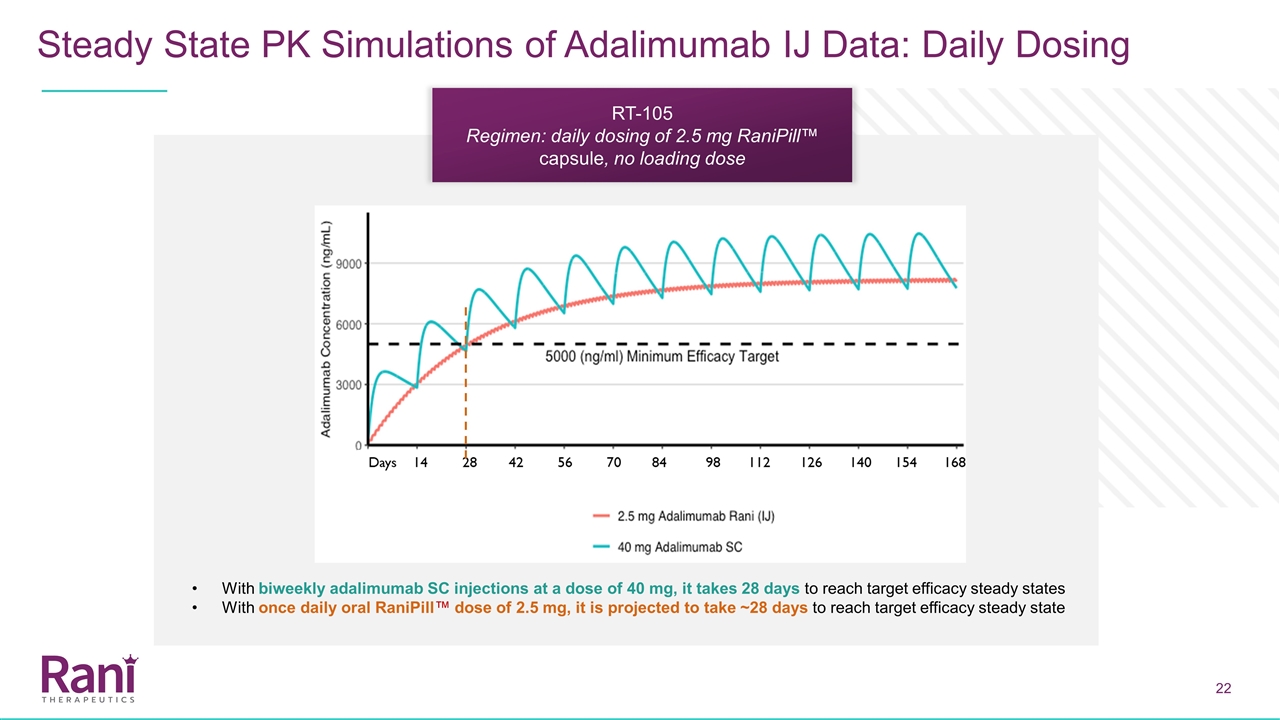
Adalimumab IJ数据的稳态PK模拟:每天给药两周一次,剂量为40 mg,每天口服一次雷尼皮尔™剂量为2.5 mg,需要28天才能达到目标疗效稳定状态,预计需要~28天才能达到目标疗效 稳定状态RT-10 5方案:每天给药2.5 mg雷尼皮尔™胶囊,无负荷量
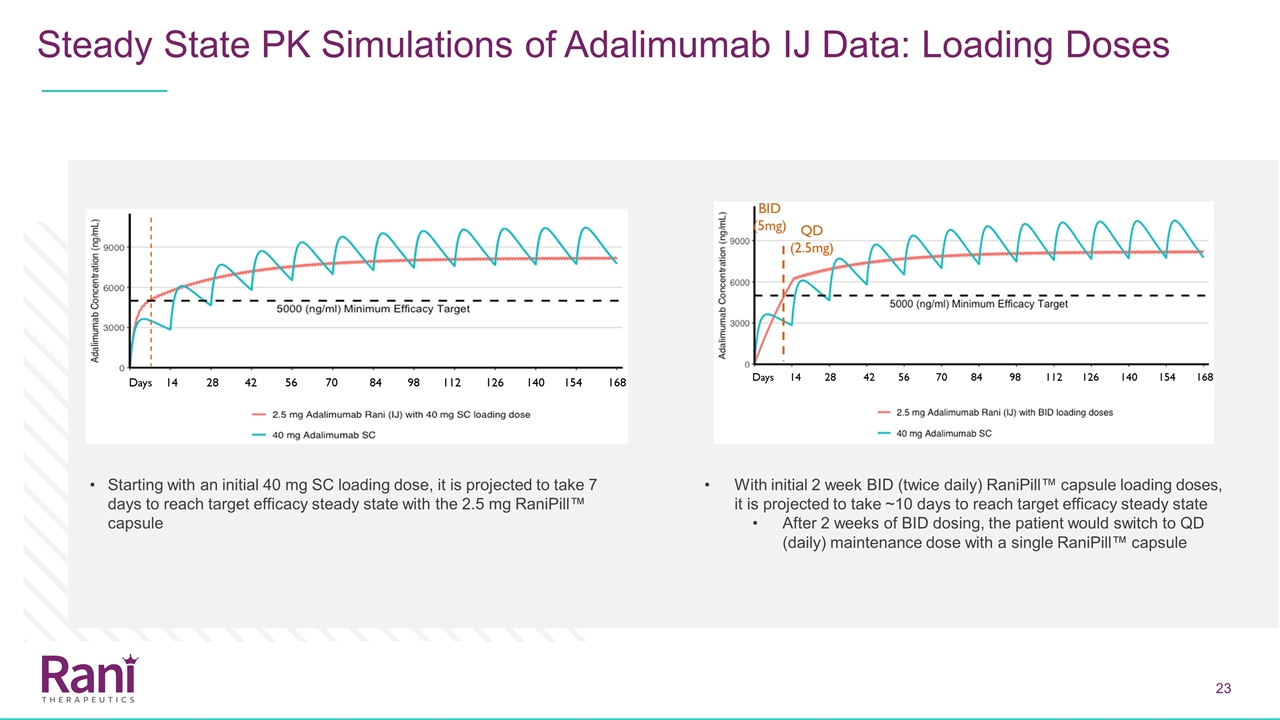
Adalimumab IJ数据的稳态PK模拟:从最初的40 mg SC负荷剂量开始,2.5mgRanipill™胶囊与初始2周Bid(每天两次)Ranipill™胶囊的负荷剂量预计需要7天才能达到目标疗效稳定状态 预计在2周的Bid剂量后达到目标疗效稳定状态需要~10天,患者将用一粒Ranipill™胶囊切换到Qd(每日)维持量

我们的目标是成为一线生物制药公司的适应症启动疗法口服Ranipill®生物制剂标准注射剂2型糖尿病二甲双胍(口服)DPP-4(口服)基础胰岛素和GLP-1(注射剂)基础胰岛素和GLP-1(注射剂)骨质疏松 双膦酸盐(口服)Teriparatide(注射剂)Denosumab(注射剂)甲状旁腺功能减退(注射)克罗恩病类固醇和5-氨基水杨酸酯(口服)肿瘤坏死因子-α,α4-整合素(注射)IL-12/23(注射)

谢谢!