
巴夫加鲁胺(ARV-110):第1阶段剂量升级和临时热切第2阶段剂量扩大试验结果2022年2月17日ASCO泌尿生殖系癌症研讨会,2022年展览99.2

本演示文稿包含 “1995年私人证券诉讼改革法案”中定义的前瞻性声明,这些声明涉及重大风险和不确定性,包括有关 巴伐鲁胺(ARV-110)的潜在优势和治疗益处、巴伐卢胺和我们的其他候选产品的开发和监管状况、临床试验的时间和这些试验的数据以及我们的候选产品的注册计划,以及我们的任何候选产品的 潜在商业化的声明。除有关历史事实的陈述外,本报告中包含的所有陈述,包括有关我们的战略、未来业务、未来财务状况、 未来收入、预计成本、前景、计划和管理目标的陈述,均为前瞻性陈述。“预期”、“相信”、“估计”、“预期”、“打算”、“ ”、“可能”、“计划”、“预测”、“项目”、“目标”、“潜在”、“将会”、“将会”、“可能”、“应该”、“应该”、“继续”等类似表述旨在识别前瞻性表述,尽管并不是所有前瞻性表述都包含这些标识性词语。我们可能无法实际实现我们的前瞻性声明中披露的计划、意图或预期 ,您不应过度依赖我们的前瞻性声明。由于各种风险和不确定性,实际结果或事件可能与我们在前瞻性 声明中披露的计划、意图和预期大不相同,这些风险和不确定性包括但不限于:我们是否能够成功地进行和完成巴伐鲁胺和我们的其他候选产品的开发,包括我们 是否为我们的候选产品启动和完成临床试验, 这些风险因素可能会导致我们的实际结果与我们提交给美国证券交易委员会(SEC)的季度和年度报告中“风险因素”部分讨论的前瞻性陈述中所述的 有所不同,这些因素可能会导致我们的实际结果与前瞻性陈述中所包含的 不同,这些因素都可能导致我们的实际结果与前瞻性陈述中所述的 不同。本演示文稿中包含的前瞻性陈述 反映了截至本演示文稿发布之日我们对未来事件的当前看法,除非适用法律要求,否则我们不承担更新任何前瞻性陈述的义务。这些前瞻性陈述不应被 视为代表公司截至本8-K表格报告日期之后的任何日期的观点。Arvinas的名称和徽标是我们的商标。我们还拥有PROTAC®的服务商标和注册的美国商标 。本演示文稿中出现的商标、商号和服务标志均为其各自所有者的财产。对于本 演示文稿中指定的商标,我们已省略了适用的®和™名称。本演示文稿还包含独立各方和我们对市场规模的估计和其他统计数据,以及有关我们行业的其他数据。此数据涉及许多假设和限制,请您 不要过分重视此类数据和估计。此外,对我们未来业绩和我们经营的市场的未来业绩的预测、假设和估计必然会受到高度的不确定性和风险 的影响。安全港和前瞻性陈述

巴夫德古拉胺1期试验(ARV-110)已经完成,到目前为止,几乎所有参加2期急切试验的患者都登记了数据,显示在所有AR患者中,AR T878X/H875Y突变与肿瘤对巴伐古鲁胺46%PSA50的高反应性相关。在7名RECIST可评估患者中,有2名患者持久确认部分应答,其中2名患者PSA下降,RECIST治疗有效。7名肿瘤减少的患者中,6名患者PSA下降,RECIST治疗无效。无≥4级TRAE由于TRAE,RP2D的停用率或剂量减少率较低 在NHA后患者中,潜在的通过伴随诊断方法加速上市的路径;目标是在2022年年底之前启动关键试验巴伐鲁胺的疗效和可管理耐受性的强健信号支持一条潜在的途径 加速批准AR=雄激素受体;nHA=新型激素剂;PSA=前列腺特异抗原;PSA50=最佳PSA下降≥50
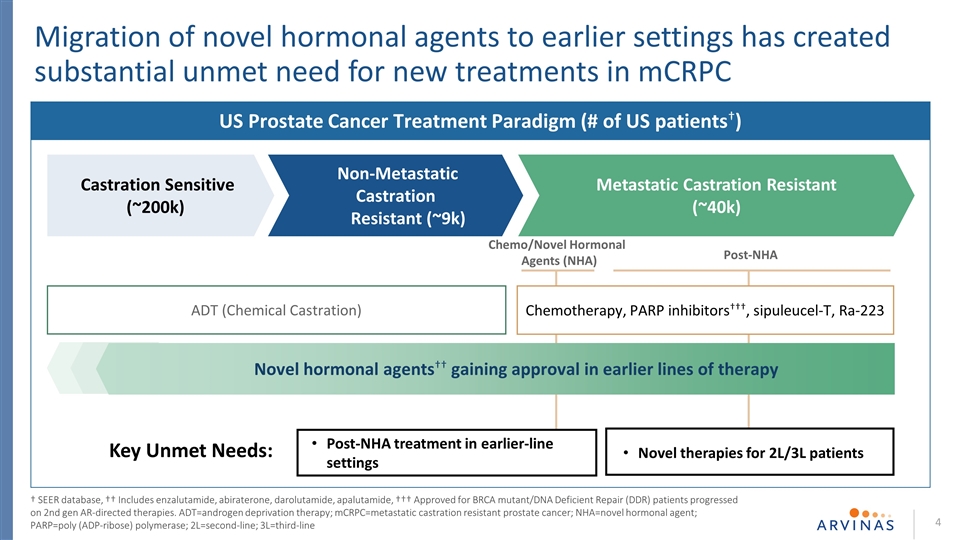
2L/3L患者的新疗法 早期NHA治疗后的关键需求尚未得到满足:新型激素药物向早期环境的迁移在mCRPC去势敏感型(~200k)美国前列腺癌治疗模式(# 美国患者†)转移性去势抵抗(~40k)非转移性去势抵抗(~9k)化疗/新型激素剂(NHA)化疗后PARPC中产生了大量未得到满足的新疗法。RA-223ADT(化学阉割)第二代AR导向疗法††新型激素制剂††在早期系列疗法中获得批准†SEER数据库中,††包括苯扎鲁胺、阿比特龙、达鲁他胺、阿帕鲁胺、†††,被批准用于BRCA突变/脱氧核糖核酸缺陷修复(DDR)患者的第二代AR导向疗法正在进行第二代AR导向疗法。Adt=雄激素剥夺疗法;mCRPC=抗去势转移性前列腺癌;nHA=新型激素剂; PARP=聚(ADP-核糖)聚合酶;2L=二线;3L=三线
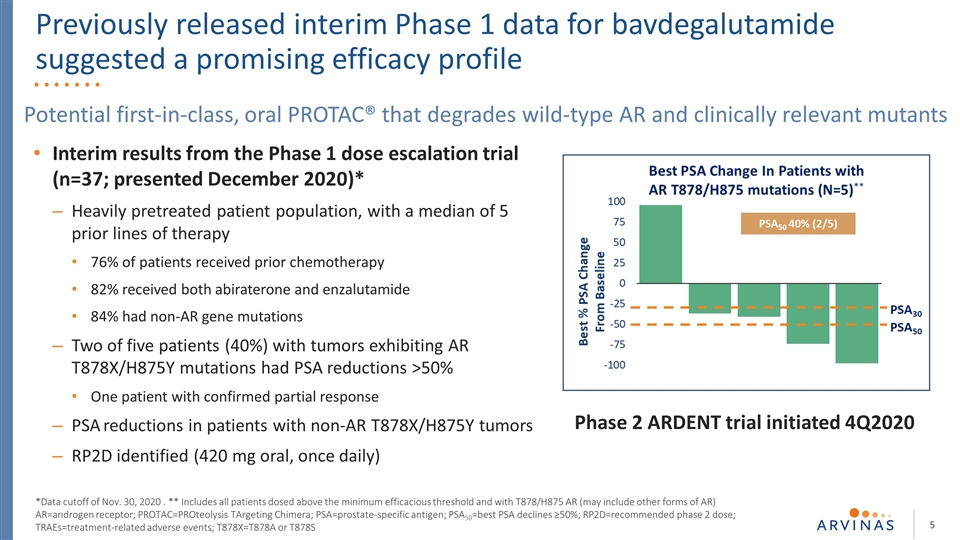
第一阶段剂量升级试验的中期结果(n=37;2020年12月公布)*严重预处理的患者群体,之前接受过5个治疗路线的中位数76%接受过化疗的患者82%同时接受阿比特龙和苯扎鲁胺治疗84%有非AR基因 突变显示AR T878X/H875Y突变的5名肿瘤患者中有2名(40%)PSA下降>50%1名确诊部分应答PSA下降的非AR T878X/H875Y肿瘤患者RP2D(420毫克口服,一旦口服PROTAC®,可降解野生型AR和临床相关突变体*截止日期为2020年11月30日。* 包括所有剂量超过最低有效阈值且使用T878/H875 AR(可能包括其他形式的AR)的患者AR=雄激素受体;PROTAC=针对嵌合体的蛋白水解;PSA=前列腺特异抗原;PSA50=最佳PSA下降≥50%; RP2D=推荐的第二阶段剂量;TRAES=与治疗相关的不良事件;T878X=T878A或T878S第二阶段启动的剧烈试验
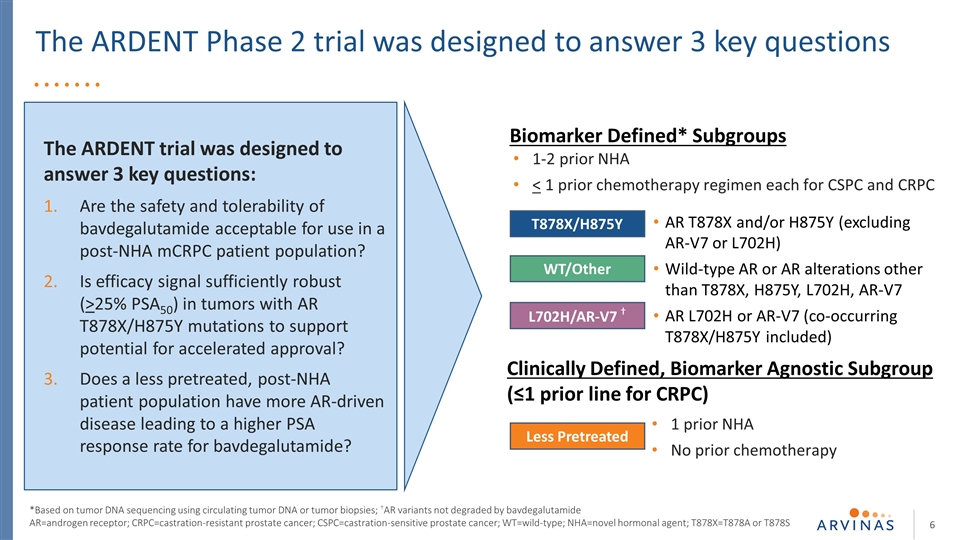
热切2期试验旨在回答3个关键问题。热切试验旨在回答3个关键问题:巴伐鲁胺的安全性和耐受性是否可接受用于NHA后的mCRPC患者?在AR T878X/H875Y突变的肿瘤中,疗效信号是否足够强(>25%PSA50) 以支持加速批准的可能性?接受较少预处理的NHA患者群体是否有更多AR驱动的疾病,从而导致巴伐地高卢胺的PSA应答率更高?NHA之前定义的生物标志物* 亚组1-2
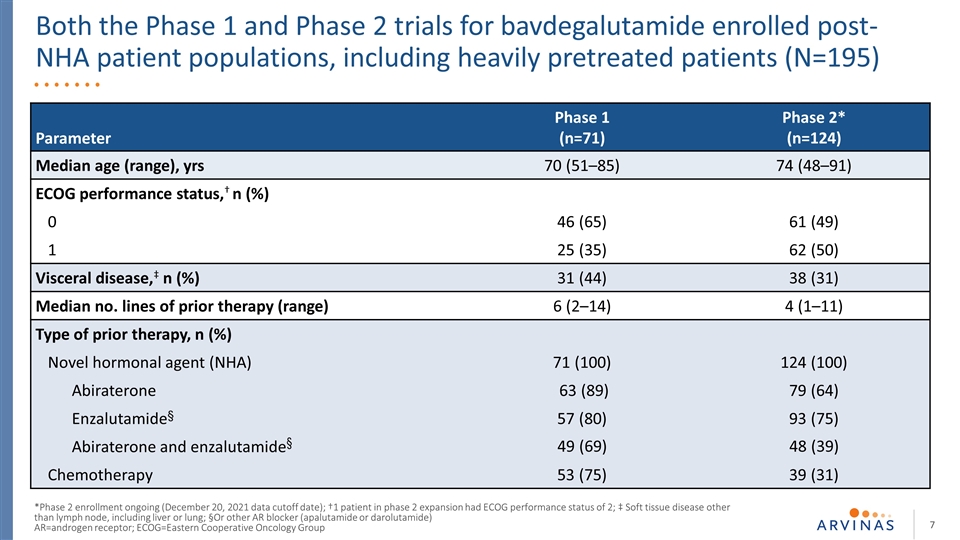
参数1(n=71)2期* (n=12 4)中位年龄(范围),年龄70(51-85)74(48-91)脑电图表现状态,†n(%)0 46(65)61(49)1 25(35)62(50)内脏疾病,‡n(%)31(44)38(31)中位数NO既往治疗路线(范围)6(2-14)4 (1-11)既往治疗类型,n(%)新型激素剂(NHA)71(100)124(100)阿比拉特隆63(89)79(64)恩扎鲁胺§57(80)93(75)阿比拉特隆和苯扎鲁胺§49(69)48(39)化疗§53(75)39(31)巴伐他胺1期 和2期试验†2期扩张期患者1例,COG评分为2分;‡软组织疾病淋巴结以外的疾病,包括肝或肺;§或其他AR阻滞剂(阿帕鲁胺或达鲁他胺)AR=雄激素受体;ECOG=东部合作肿瘤组

热切的2期试验旨在回答3个关键问题:巴伐地高卢胺的安全性和耐受性是否可接受用于NHA后mCRPC患者群体?在AR T878X/H875Y突变的肿瘤中,疗效信号是否足够强(>25%PSA50)以支持加速批准的潜力?接受较少预处理的NHA患者群体是否有更多AR驱动的疾病,从而导致巴伐地高卢胺的PSA应答率更高?AR=雄激素受体;mCRPC=耐去势转移性前列腺癌 ;nHA=新型激素剂;T878X=T878A或T878S
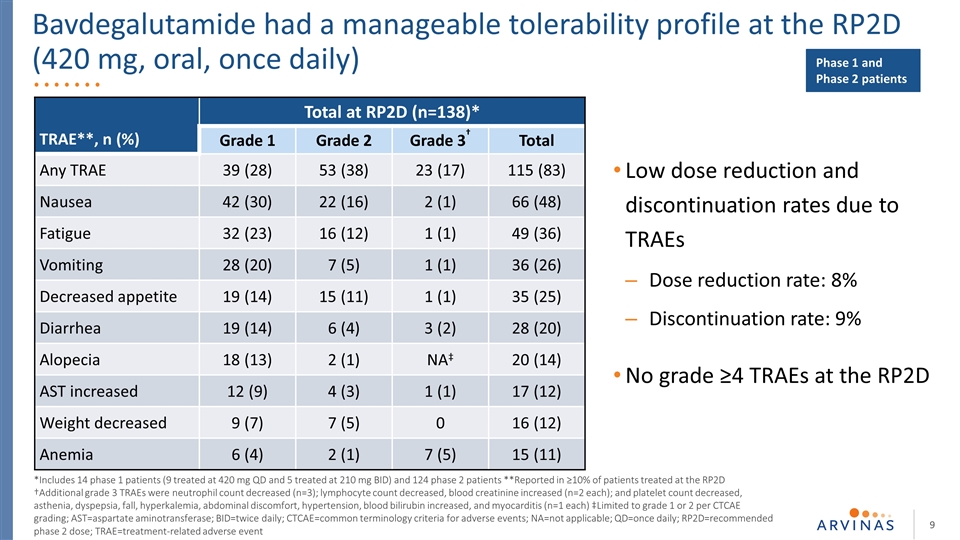
巴伐卢胺在RP2D(420毫克,口服,每天一次)的低剂量减少率和停药率是可控的,这是由于TRAEs的剂量减少率:8%的停用率:9%无等级≥*包括14名第1期患者(9名接受420mgqd治疗,5名接受210mgbid治疗)和124名第2期患者**据≥报告,10%的患者接受了RP2D†额外级别的治疗(9名患者接受420 mg qd治疗,5名患者接受210 mg bid治疗)和124名2期患者**据报道,在RP2D†附加级别接受治疗的患者中,有10%的患者接受了TRAEs的治疗血小板减少,虚弱,消化不良,跌倒,高钾,腹部不适,高血压,血胆红素升高,心肌炎(n=1)‡限制为1级或2级,按CTCAE分级;AST=天冬氨酸转氨酶;BID=每日两次;CTCAE=不良事件的通用术语标准;NA=不适用;QD=每天一次;RP2D=推荐的2期剂量;TRAE=与治疗相关的不良事件TRAE**,N(%)RP2D总计(n=138)*1级2级 3级†总计39(28)53(38)23(17)115(83)恶心42(30)22(16)2(1)66(48)疲劳32(23)16(12)1(1)49(36)呕吐28(20)7(5)1(1)36(26)食欲下降19(14)15(11)1(1)35(25)腹泻Br}(2)28(20)脱发18(13)2(1)NA‡20(14)AST12(9)4(3)1(1)17(12)体重减少9(7)7(5)0 16(12)贫血6(4)2(1)7(5)15(11)1期和2期患者

这项热切的2期试验旨在回答3个关键问题:AR=雄激素受体;mCRPC=耐去势转移性前列腺癌;NHA=新型激素剂;T878X=T878A或T878S。在NHA后的mCRPC患者中使用巴伐他胺的安全性和耐受性是否可以接受 ?在AR T878X/H875Y突变的肿瘤中,疗效信号是否足够强(>25%PSA50),以支持加速批准的可能性?经过较少预处理的NHA患者群体是否有更多AR驱动的疾病,从而导致巴伐地高卢胺的PSA应答率更高?
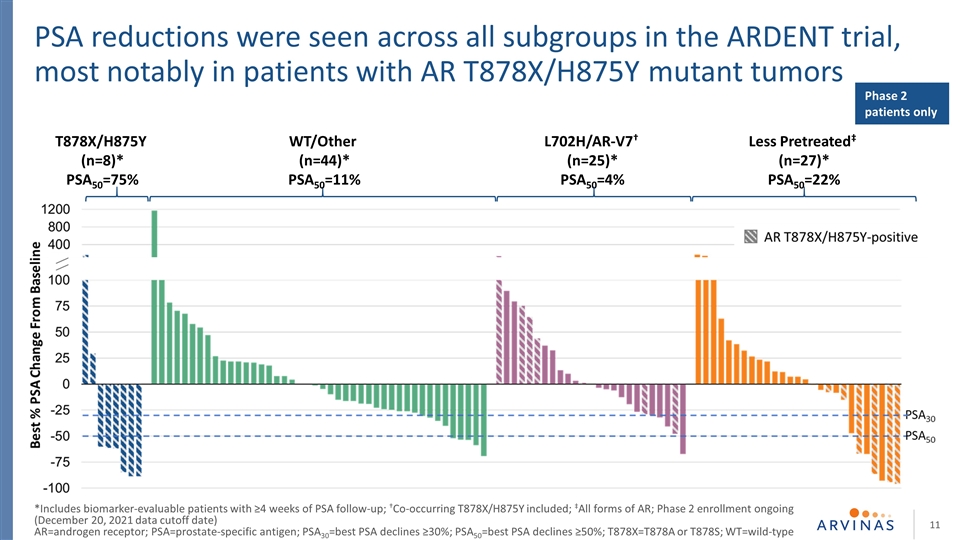
L702H/AR-V7†(n=25)*PSA50=4% T878X/H875Y(n=8)*PSA50=75%在热切试验的所有亚组中均可见PSA降低,尤其是在AR T878X/H875Y突变肿瘤WT/Other(n=44)患者中最明显*PSA50=11%预处理‡(n=27)*PSA50=22%仅2期患者 PSA30=最佳PSA下降≥30%;PSA50=最佳PSA下降≥50%;T878X=T878A或T878S;WT=野生型
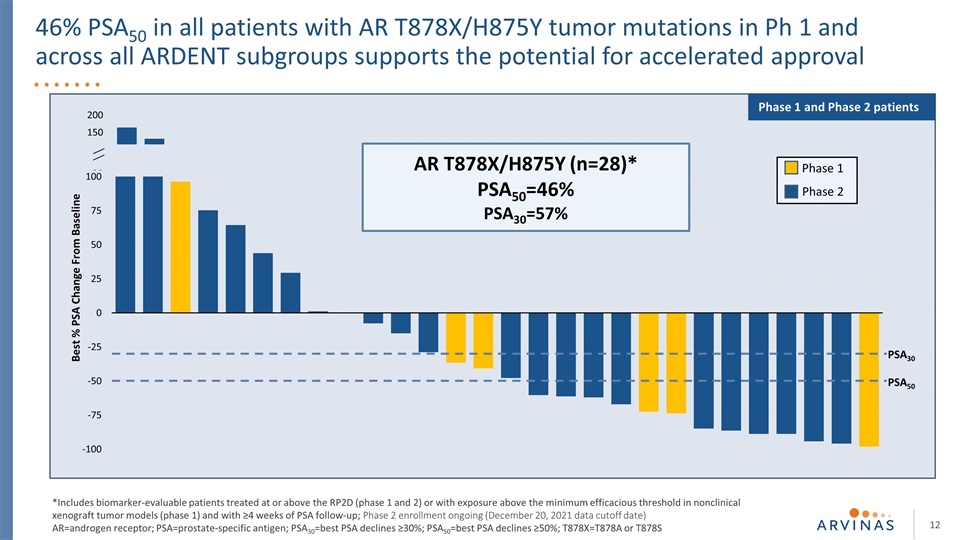
Ph 1中所有AR T878X/H875Y肿瘤突变患者的46%PSA50支持加速批准的可能性从基线PSA50 PSA30 AR T878X/H875Y(n=28)*PSA50=46%PSA30=57%*PSA50=46%PSA30=57%*包括接受RP2D或以上(1和2期)治疗或暴露在最低有效阈值以上的可进行生物标记物评估的患者 PSA50=最佳PSA下降≥50%;T878X=T878A或T878S一期、二期、一期和二期患者
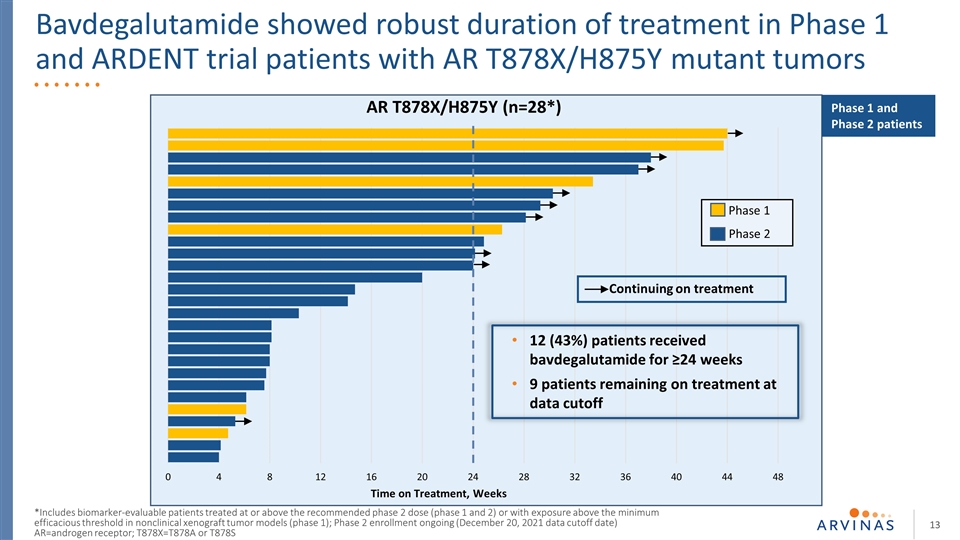
巴夫加鲁胺显示出强劲的1期治疗持续时间和热切试验AR T878X/H875Y突变肿瘤患者持续治疗时间,AR T878X/H875Y(n=28*)继续治疗12例(43%)患者接受≥治疗24周9名患者在数据截止期1期和2期继续治疗 包括在推荐的2期剂量(1期和2期)或以上治疗的可进行生物标记物评估的患者。T878X=T878A或T878S 1期和2期患者
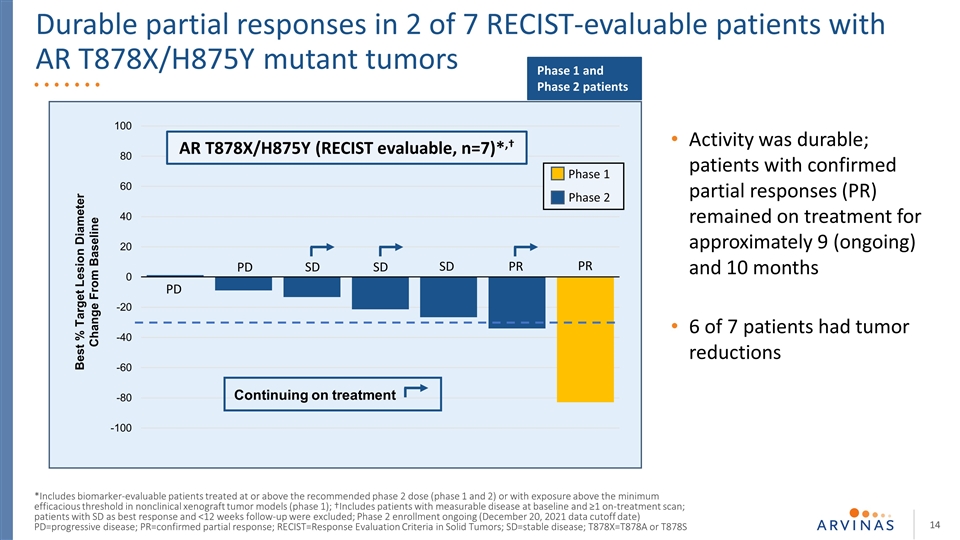
7名可接受RECIST评估的AR T878X/H875Y突变肿瘤患者中有2名出现持久的部分反应 靶区直径较基线PD PD SD PR PR AR T878X/H875Y改变的最佳百分比(RECIST可评估,n=7)*,†继续治疗*包括在非临床异种肿瘤模型中接受推荐的2期剂量(1期和2期)或暴露在最低有效阈值以上的生物标志物可评估患者
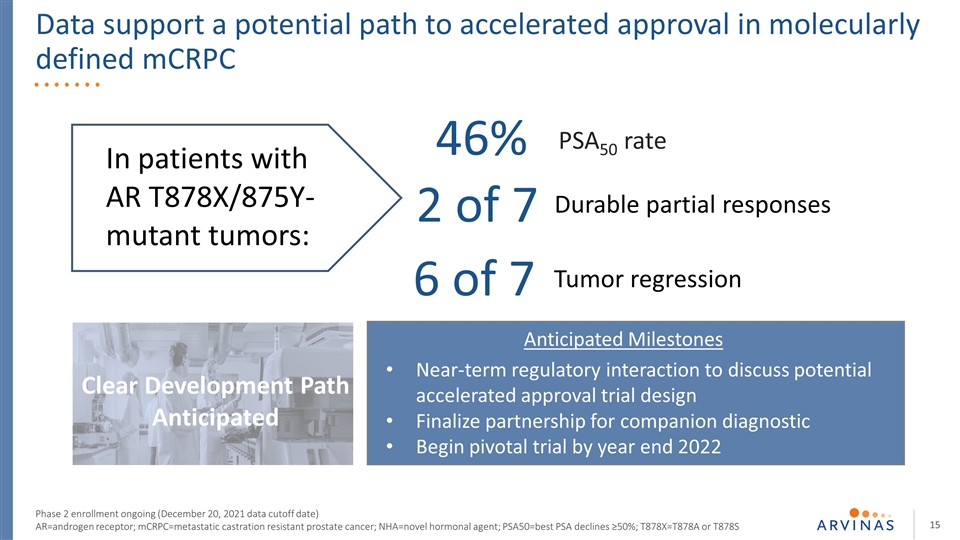
数据支持在分子定义的mCRPC第二阶段登记中加速批准的潜在途径正在进行中(2021年12月20日数据截止日期)AR=雄激素受体;mCRPC=转移性去势耐受前列腺癌;nHA=新型激素剂;PSA50=最佳PSA下降 ≥50%;T878X=T878A或T878S明确的发展路径预期的近期调控相互作用,以讨论可能的加速批准试验设计最终确定伙伴关系诊断开始枢轴

巴夫加鲁胺作为前列腺癌患者精确药物的潜在机会*Ledet等人,肿瘤学家2019年;24 AR=雄激素受体;mCRPC=转移性去势抵抗前列腺癌;CSPC-去势敏感型前列腺癌;NHA=新型激素剂;CTDNA=循环肿瘤DNA选择携带AR T878/H875肿瘤突变的患者可提供“针对患者的正确药物”基于血液的检测(CTDNA)使患者识别变得容易AR T878/875代表了10%的≥患者 前列腺癌患者使用CTDNA检测的情况越来越多,因为越来越多的新诊断(CSPC)患者接受NHAS治疗,巴伐鲁胺作为NHA后治疗的需求和潜在机会也在增加

这项热切的2期试验旨在回答3个关键问题:AR=雄激素受体;mCRPC=耐去势转移性前列腺癌;NHA=新型激素剂;T878X=T878A或T878S。在NHA后的mCRPC患者中使用巴伐他胺的安全性和耐受性是否可以接受 ?在AR T878X/H875Y突变的肿瘤中,疗效信号是否足够强(>25%PSA50),以支持加速批准的可能性?经过较少预处理的NHA患者群体是否有更多AR驱动的疾病,从而导致巴伐地高卢胺的PSA应答率更高?
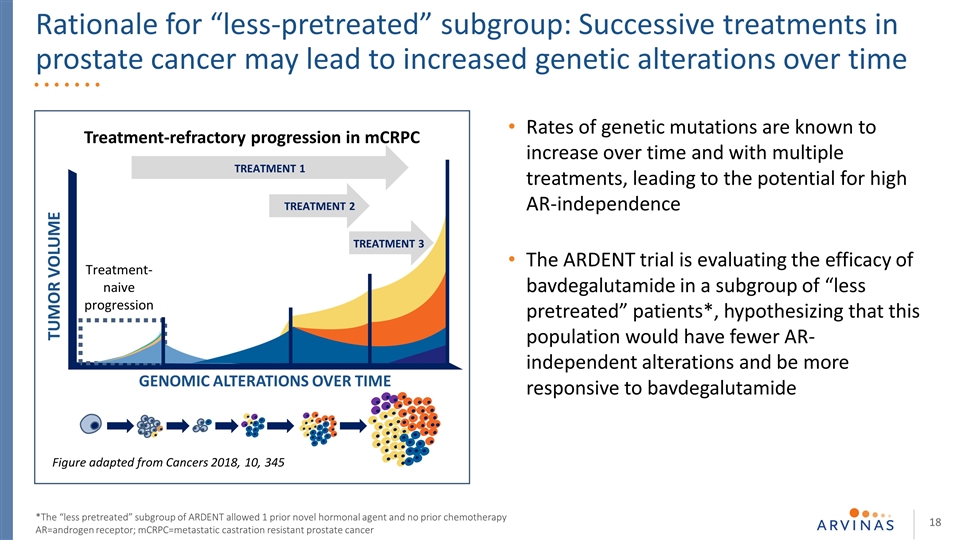
已知基因突变率随着时间的推移和多种治疗的增加而增加,导致高AR独立性的可能性。热切的试验正在评估巴伐鲁胺在一组“较少预处理”患者中的疗效*,假设这一 人群将具有较少的AR非依赖性改变,并且随着时间的推移对巴伐卢胺肿瘤体积的基因组改变更敏感治疗1治疗2治疗3从癌症改编而来的数字2018,10,345治疗-mCRPC治疗的难治性进展-“预处理较少”亚组的幼稚进展原理:前列腺癌的连续治疗可能会导致基因改变随着时间的推移而增加*热情 的“预处理较少”亚组允许1种先前的新激素制剂,而不允许先前的化疗AR=雄激素受体;MCRPC=耐去势转移性前列腺癌
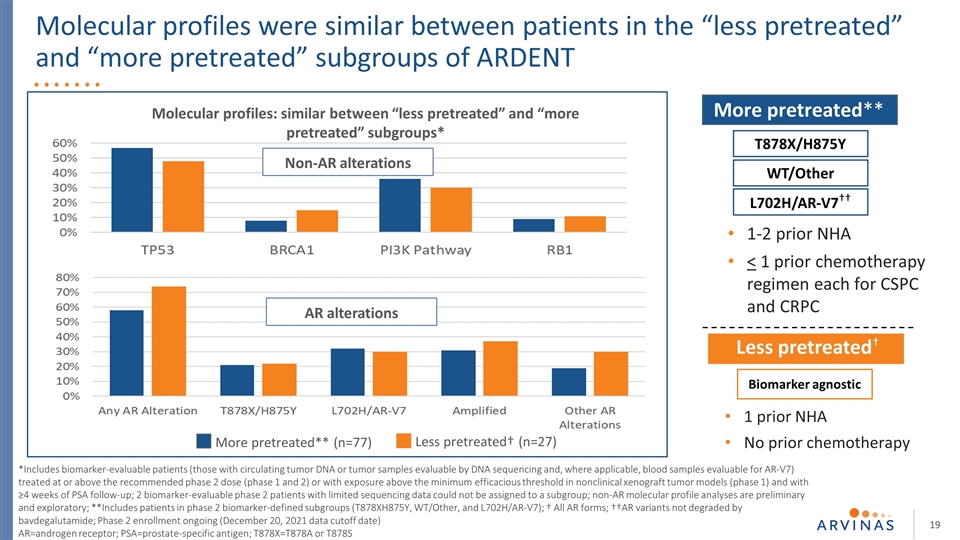
在“较少预处理”和“较多预处理”亚组的患者之间,分子图谱相似 *包括那些生物标志物可评估的患者(那些具有循环肿瘤dna或可通过dna测序评估的肿瘤样本的患者,在适用的情况下, 可评估AR-V7的血液样本),治疗达到或超过推荐的第二期剂量(第1和2期),或在非临床异种肿瘤模型(第1期)中暴露于高于最低有效阈值的情况下,并接受≥4周的前列腺特异性抗原随访;2非AR分子图谱分析是初步的和探索性的;**包括2期生物标记物定义的亚组(T878XH875Y、WT/OTHER和L702H/AR-V7)的患者;†所有AR形式;††AR变体未被巴伐德鲁胺降解;2期登记正在进行(2021年12月20日数据截止日期)AR=雄激素受体;PSA=前列腺特异抗原;T878X=T878A或T878S 预处理较少**(n=77)预处理较少†(n=27)非AR改变AR改变:“预处理较少”和“预处理较多”亚组之间相似**T878X/H875Y WT/其他L702H/AR-V7††生物标记物不可知性预处理较少†1之前NHA之前无化疗1-2之前NHA
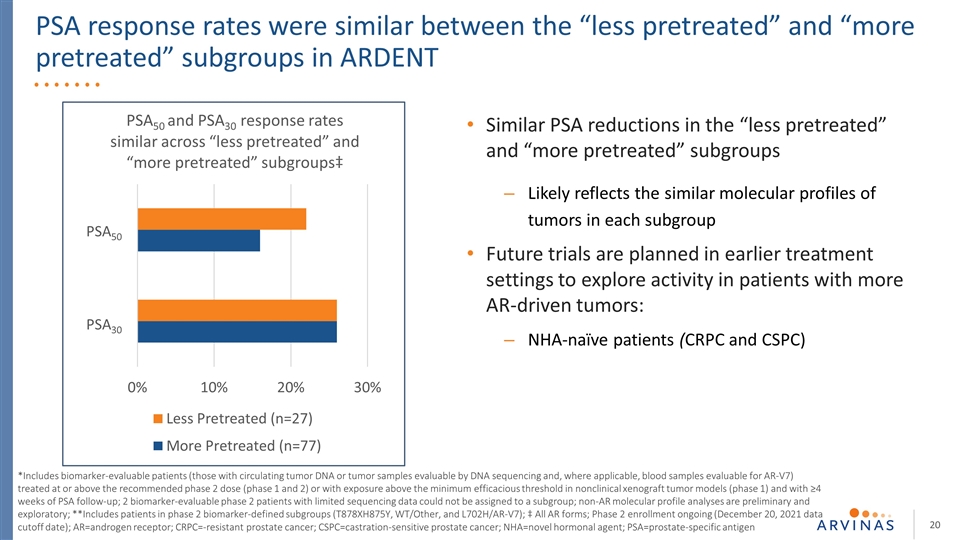
PSA应答率在“较少预处理”和“较多预处理”亚组之间相似 在热切*包括生物标记物可评估的患者(那些循环肿瘤dna或肿瘤样本可通过dna测序和血液样本评估AR-V7的患者),治疗达到或超过推荐的2期剂量(1期和2期),或在非临床异种肿瘤模型(1期)中暴露于最低有效阈值以上,并接受≥4周的PSA随访;2.(2)非临床异种移植瘤模型(第1期)中暴露于最低有效阈值以上的患者*包括接受4周PSA随访的生物标志物可评估的患者(那些具有循环肿瘤dna或可通过dna测序评估的肿瘤样本,以及可评估AR-V7的血液样本)非AR分子图谱分析是初步的和探索性的;**包括第2期生物标记物定义的亚组(T878XH875Y、WT/OTHER和L702H/AR-V7)的患者;‡所有AR形式;正在进行的第2期登记(2021年12月20日数据截止日期);AR=雄激素受体;CRPC=耐药前列腺癌;CSPC=去势敏感型前列腺癌;nHA=新型激素制剂; PSA=前列腺特异性抗原“预处理较少”和“预处理较多”亚组中类似的PSA降低可能反映了每个亚组中肿瘤的相似分子特征未来试验计划在较早的 治疗环境中进行,以探索更多AR驱动的肿瘤患者的活性:无症状患者(CRPC和CSPC)PSA50 PSA30

2022年上半年:与FDA讨论潜在的加速审批路径 最终确定伴随诊断2H 2022启动针对患有AR T878/H875肿瘤突变图谱的患者的关键试验巴伐鲁胺可能在mCRPC AR=雄激素受体;FDA=食品和药物管理局;CSPC=阉割敏感型前列腺癌;mCRPC=转移性阉割抵抗前列腺癌方面支持明确的精确药物机会 ;NHA=新的激素药物预计将在2022年达到里程碑,同时在更广泛的患者群体中探索 机会:CRPC和CSPC在NHA前后的单一治疗或联合治疗(例如阿比特龙)潜在的加速批准途径未满足的需求预计将随着NHAS的早期近期进展而增加, T878/H875阳性mCRPC的精确机会 在T878/H875阳性的mCRPC中,预计未得到满足的需求将随着NHAS的提早而增加。 在T878/H875阳性的mCRPC中, 精确机会

在接受1-2种先前新型激素药物治疗的mCRPC严重预处理患者中,临床活动的强劲信号 支持加速批准AR T878X/H875Y突变肿瘤患者的潜在途径:46%的PSA50率,7名经RECIST评估的患者中有2名有持久的部分反应 ;肿瘤减少的7名患者中有6名43%的患者持续治疗24周或更长时间,肿瘤患者的PSA下降和RECIST反应被认为降低了对AR治疗的反应性 可管理的耐受性概况计划在早期、更广泛的患者群体中探索巴伐鲁胺,预计在2022年年底之前在T878/H875突变肿瘤患者中启动一项关键试验,并 探索结论mCRPC=转移性CAC第2阶段登记 正在进行(2021年12月20日数据截止日期)

附录