
附件99.1

1©2022 Novavax。版权所有。摩根大通第40届年度医疗保健大会纳斯达克:NVAX|2022年1月

2©2022 Novavax。版权所有。安全港声明:某些信息,特别是与诺华公司的未来、经营计划和前景、合作伙伴关系、正在进行的NVX-CoV2373、COVID-NanoFlu TM组合疫苗、奥美康特异性疫苗和其他诺华公司疫苗候选产品的开发有关的信息、临床试验结果的时间、增加NVX-CoV2373剂量以提供对新冠肺炎(包括变种)的保护的可能性、未来监管申报和行动的范围和时间、预期的制造能力、我们全球供应链的准备情况和NVX-CoV 2373在全球范围内的未来供应情况,以及NVX-CoV 2373的商业化和预期交付情况,以及即将到来的关键里程碑,均为前瞻性表述。前瞻性陈述通常可能包含诸如“相信”、“可能”、“可能”、“可以”、“估计”、“继续”、“正在进行”、“考虑”、“打算”、“指示”、“计划”、“项目”、“预期”、“应该”、“将”或“假设”等词语或这些词语或具有相似含义的其他词语的变体。Novavax告诫说,这些前瞻性陈述会受到许多假设、风险和不确定因素的影响,这些假设、风险和不确定性会随着时间的推移而变化,可能会导致实际结果与前瞻性陈述中讨论的结果大不相同。这些风险和不确定性包括:单独或与合作伙伴一起满足各种安全性、有效性和产品表征要求的挑战,包括与工艺鉴定和化验验证相关的要求,以满足适用的监管机构的要求;难以获得稀缺的原材料和供应;资源限制。, 这些风险因素包括人力资本和制造能力,以及在Novavax提交给美国证券交易委员会的截止到2020年12月31日的10-K表格年度报告和随后提交给美国证券交易委员会的10-Q表格季度报告中指出的其他风险因素,包括人力资本和制造能力;与多个商业、政府和其他实体达成协议,满足合同要求所面临的挑战;以及在截至2020年12月31日的10-K表格年度报告和后续提交给美国证券交易委员会的10-Q表格季度报告中确定的其他风险因素,这些风险因素都在Novavax提交给美国证券交易委员会的截止到2020年12月31日的10-K表格年度报告和后续提交给美国证券交易委员会的10-Q表格季度报告中确定。美国证券交易委员会。Gov和www.诺瓦克斯。COM。前瞻性陈述基于当前的预期和假设以及目前可用的数据,既不是对未来事件或业绩的预测,也不是对未来业绩的保证。目前的结果可能不能预测未来的结果。您不应过分依赖前瞻性陈述,这些陈述仅说明截至本新闻稿之日的情况。除非适用法律另有要求,否则公司不承诺在任何前瞻性陈述发表后对其进行更新或修改,无论是由于新信息、未来事件或其他原因。Novavax TM(以及所有相关标识)和NanoFlu TM是Novavax公司的商标。Matrix-M TM是Novavax AB的商标。

3©2022 Novavax。版权所有。我们的重要势头

4诺华AT-A一览表强大的疫苗流水线,针对当今最严重的传染病新冠肺炎(初级疫苗接种、加强免疫和儿科)·流感·呼吸道合胞病毒NVX-CoV2373总体高效90%对中、重度疾病100%对VOI/VOC的变异体93%对VOI/VOC有93%的交叉保护·对Alpha、Beta的交叉保护·对Delta、Omicron和其他公司的强效承诺和2022年的20亿剂以上的制造能力潜在的战略并购*现金包括截至2021年9月30日的现金、现金等价物和限制性现金©2022 Novavax。版权所有。

5©2022 Novavax。版权所有。NVX-CoV2373应对不断演变的大流行NVX-CoV2373疫苗设计·基于重组蛋白技术的创新疫苗纳米颗粒·全长SARS-CoV-2尖峰·采用独特的Matrix-M TM佐剂配制显著的全球容量易于分发和管理耐受良好且高效

全球监管备案情况6©2022 Novavax。版权所有。收到多个紧急使用授权*与血清研究所合作提交监管申请**EUA请求预计2022年1月底*与SK Bioscience合作监管提交生物制品许可证申请(BLA)*与武田COVOVAX TM/NUVAXOVID TM合作监管提交新药申请收到菲律宾食品和药物管理局(FDA)完成的监管提交EUA*印度尼西亚共和国国家药品和食品控制局提交EUA卫生服务管理局韩国食品药品安全部*阿拉伯联合酋长国(阿联酋)卫生与防御部美国FDA**日本卫生部,世界卫生组织对Covovax TM和Nuvaxovid TM的劳工和福利表彰

7©2022 Novavax。版权所有。NVX-CoV2373的全球市场机遇是,通过基于众所周知的同类最佳效力来解决疫苗的迟疑问题,该技术基于对强大保护(包括针对变种)的众所周知的技术需求,推动了对加强剂的持续需求主要疫苗加强剂的疫苗接种效力和安全性状况使儿科人群能够理想地接种儿科疫苗,通过承诺公平分配公平获得机会,根据全球需要提供儿科疫苗

8©2022 Novavax。版权所有。NVX-CoV2373提供初级、强化和儿科疫苗的重大全球市场机遇来源:截至2021年12月的世界银行数据和OWID。每个Novavax管理层的总剂量机会*加权平均部分初始方案接种率(至少一剂COVD-19疫苗)**有数据的国家的加权平均加强疫苗接种率*中上收入国家不包括俄罗斯和中国高收入国家中上收入国家*~48亿总剂量需求中低收入和低收入国家~68亿总剂量需求初级疫苗接种*加强免疫**儿童疫苗接种(12-17)未接种/未加强接种

9©2022 Novavax。版权所有。GAVI/COVAX设施承诺遵守美国政府预购协议许可协议·APA与GAVI·NVAX将提供3.5亿剂·血清研究所将提供7.5亿剂·作为资金承诺的一部分,NVX-CoV2373将在世界各地提供7.5亿剂·SK生物科学在韩国获得独家许可,在泰国和越南获得非独家许可·血清研究所在印度授予独家许可,在UMIC和LMICs授予非独家许可·澳大利亚·新西兰·瑞士·阿拉伯联合酋长国·新加坡承诺在全球范围内提供约20亿剂NVX-CoV2373,确保全球公平和公平地获得高达4亿剂的NVX-CoV2373

制造基础设施支持全球对NVX-CoV2373 10©2022 Novavax的需求。版权所有。X是世界上产量最大的疫苗制造商,在约170个国家和地区使用x为支持全球生产提供重要能力与血清研究所合作生产抗原x在多个地点的显著生物反应器能力x将被添加到协调的监管文件地点的额外地点:Novavax CZ·血清研究所·SK生物科学·武田·Biofabri·生物制品制造中心·Fujifilm·Mabion x确保在Novavax AB和合同制造地点进行大规模生产的原材料x Novavax AB和合同制造地点:Novavax AB·AGC

临床和法规概述11©2022 Novavax。版权所有。

扩大标签和政策适应症©2022 Novavax。版权所有。战略方法初级疫苗接种·在更多市场获得监管授权·分发剂量以确保广泛、公平的准入·收集针对新出现的变种儿科疫苗的更多数据·完成儿科适应症的监管备案(12-17岁)·在年轻人群中启动研究加强疫苗接种·启动额外的强化研究·利用为异源/混合配型强化接种产生的所有数据·追求标签适应症和政策建议正在开发12个额外的临床数据,以支持NVX-CoV2373的扩展建议
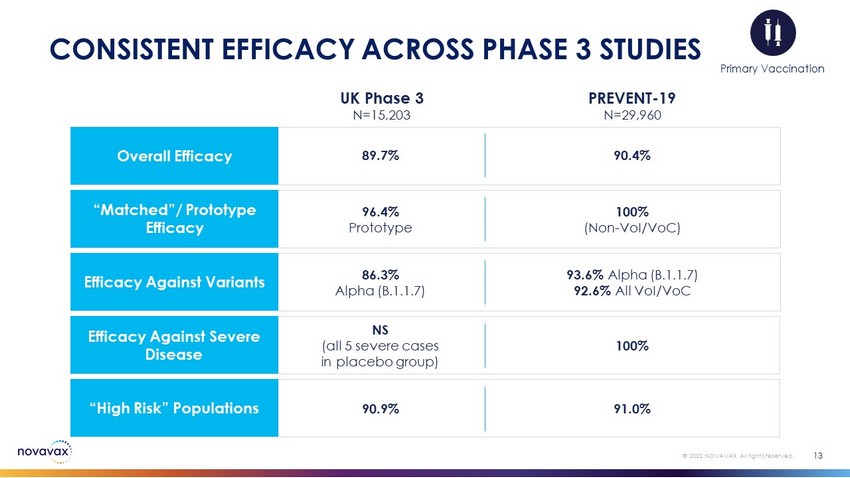
13©2022 Novavax。版权所有。3期研究的一致疗效总体疗效89.7%90.4%“匹配”/原型疗效96.4%原型100%(非VOI/VOC)对变种的有效性86.3%Alpha(B.1.1.7)93.6%Alpha(B.1.1.7)92.6%所有VOI/VOC对重症NS的疗效(安慰剂组全部5例严重病例)100%“高危”人群90.9%91.0%英国第三阶段N=15,203预防-19 N=29,960初级疫苗接种(安慰剂组中的所有5例严重病例)100%“高危”人群90.9%91.0%英国第三阶段N=15,203预防-19 N=29,960

14©2022 Novavax。版权所有。强劲的数据支持NVX-CoV2373作为助推剂接种异源疫苗第二阶段美国和澳大利亚·功能抑制比两剂初级系列疫苗后的峰值反应增加6倍(原型)至19.9倍(Omicron)·中和作用增加,Delta和Omicron滴度与第三阶段研究中的相关保护水平相当COV-Boost(英国)*·mRNA和病毒载体疫苗后功能性抗体滴度大幅增加预计将在2022年第二阶段美国进行的研究中获得更多数据。由英国政府疫苗Tas Kforce(VTF)和卫生和社会保健部2b期支持,南非预防-19
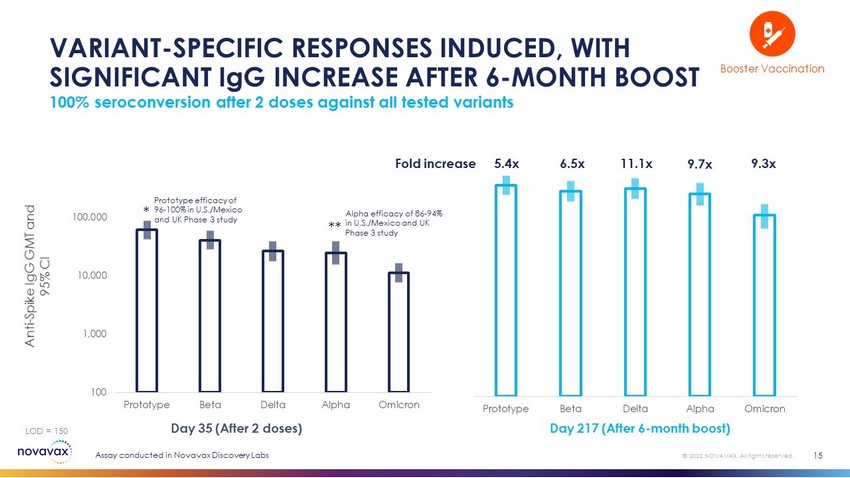
原型Beta Delta Alpha Omicron 100 1,000,000,100,000,000,000原型Beta Delta Alpha Omicron Fold在2剂疫苗后血清转换率提高100%,对抗所有测试变种诱导的变异型特异性反应,6个月后IgG显著增加15 5.4 x 6.5 x 11.1x 9.7x 9.3x第35天(2剂后)217天(6个月加强后)抗峰IgG GMT和95%CI LOD=150*在Novavax Discovery Labs Booster疫苗中进行的检测版权所有。原型有效性在美国/墨西哥和英国的第三阶段研究中为96-100%,在美国/墨西哥和英国的第三阶段研究中的阿尔法效率为86-94%
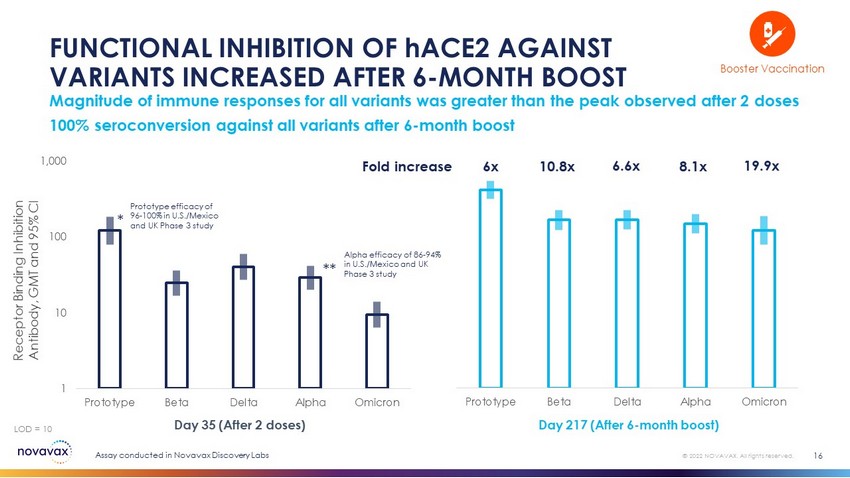
所有变异体的原型Beta Delta Alpha Omicron免疫应答强度大于2剂后观察到的峰值hACE2对变异体的功能抑制率在6个月后增加16倍6x 10.8x 6.6x 8.1x 19.9x第35天(2剂后)第217天(6个月增强后)受体结合抑制抗体,GMT和95%CI=10 1 10 100 1,000原型Beta Delta Alpha Omicron*加强免疫©2022 Novavax。版权所有。在美国/墨西哥和英国进行的原型有效率为96-100%,在美国/墨西哥和英国的第三阶段研究阿尔法有效率为86-94%,在Novavax Discovery实验室进行的第三阶段研究分析表明,在6个月的加强免疫后,对所有变异株的血清转换率为100%
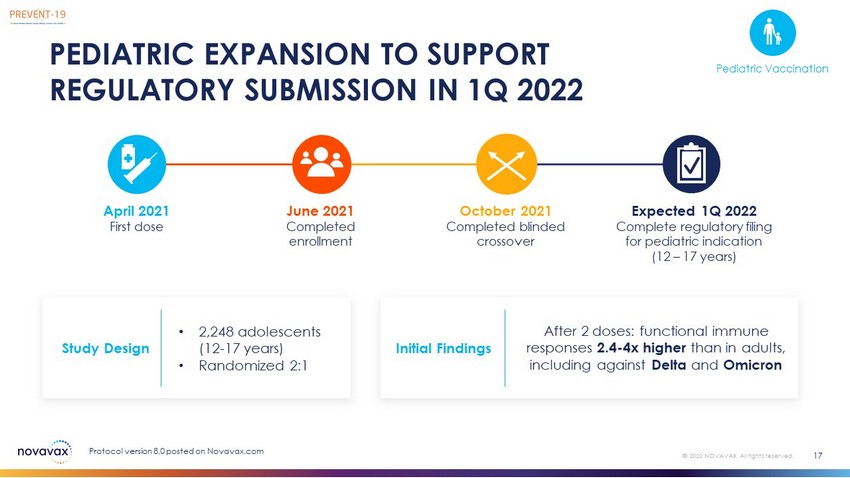
2022年第一季度儿科扩展以支持法规提交17©2022 Novavax。版权所有。协议版本8.0在接种两剂后发布在Novavax.com上:功能性免疫应答比成人高2.4-4倍,包括针对Delta和Omicron的功能免疫应答2021年4月和Omicron第一剂2021年6月完成登记2021年10月完成盲目交叉预计2022年第一季度完成儿科适应症的监管申报(12-17岁)研究设计·2,248名青少年(12-17岁)·随机2:1初步研究结果

18©2022 Novavax。版权所有。Omicron疫苗正在开发中·启动了Omicron特异性疫苗的开发·展示了对两剂NVX-CoV2373初级方案的Omicron变种的交叉反应免疫反应·启动了Omicron特异性疫苗的GMP生产,预计2022年第一季度·启动Omicron特异性疫苗方法的临床研究显示有快速发展和扩大毒株变化的能力

19 COVID、NANOFLU TM和联合疫苗开发领域的领先者对抗这两种疾病的变革性创新©2022 Novavax。版权所有。2021年9月·启动联合疫苗的1/2期临床试验·安全性、免疫原性和剂量发现2021年10月·完成1/2期临床试验的登记·预计2022年~640名50-70岁的成年人·公布1/2期临床试验的数据·启动COVID-NanoFlu联合疫苗和NanoFlu独立疫苗的2期临床试验
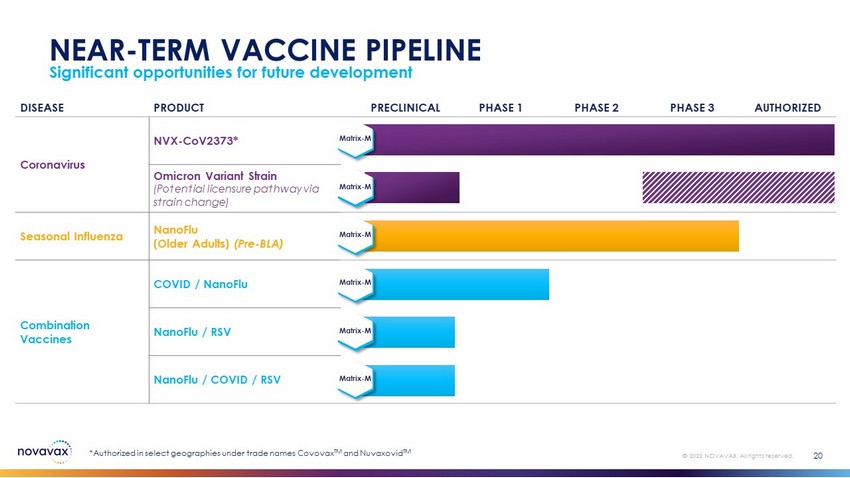
未来发展的重大机遇20©2022 Novavax。版权所有。近期疫苗流水线疾病产品临床前第1阶段第2阶段第3阶段授权冠状病毒NVX-CoV2373*OMICRON变异株(通过菌株变化获得潜在许可途径)季节性流感NanoFlu(老年人)(BLA前)组合疫苗COVID/NanoFlu NanoFlu/RSV NanoFlu/COVID/RSV*在选定地区获得授权,商品名称为Covovax TM和Nuvaxovid TM Matrix-M Matrix

即将到来的关键里程碑©2022 Novavax。版权所有。21 NVX-CoV2373初级疫苗·在其他市场获得监管授权·在授权的地区分发剂量·向美国FDA提交EUA文件,提高疫苗接种效率·启动更多加强研究·追求提高标签适应症和政策建议·完成儿科疫苗适应症的监管备案(12-17岁)·在较年轻的人群中启动临床研究Omicron变异疫苗·启动临床研究COVID-NanoFlu组合疫苗·公布COVID-NanoFlu联合疫苗的数据-NanoFlu联合疫苗和NanoFlu独立疫苗·开发更多的独立和联合呼吸道疫苗

问答©2022 Novavax。版权所有。22