

2020年6月JP Morgan Healthcare 大会2022年1月10日展览99.1

前瞻性陈述本报告 包含1995年“私人证券诉讼改革法”所指的“前瞻性陈述”。前瞻性陈述既不是历史事实,也不是对未来业绩的保证。相反,它们 基于我们目前对业务未来、未来计划和战略、临床结果和其他未来状况的信念、预期和假设。除本演示文稿中包含的历史事实陈述外,其他所有陈述均为前瞻性陈述,包括ATEA制药公司(“本公司”)关于未来运营和财务状况的陈述,包括我们预期的现金跑道;业务战略; 当前和预期的候选产品;预期的里程碑事件;我们候选产品的潜在好处和市场机会;计划中的临床试验,包括但不限于预期的启动、登记、监管 提交和数据读出时间表;临床前活动;产品批准;当前和未来的合作;以及投资者的前景和 机会。在某些情况下,您可以通过“可能”、“将会”、“应该”、“预期”、“计划”、“预期”、“ ”、“可能”、“打算”、“目标”、“项目”、“预期”、“相信”、“估计”、“预测”、“潜在”或“继续”或这些术语或其他类似表述的否定 等术语来识别前瞻性陈述。本演示文稿中的信息,包括但不限于本文中包含的前瞻性陈述,代表了我们截至本篇演示文稿发表之日的观点。这些声明既不是承诺,也不是保证, 但涉及已知和未知的风险、不确定性和其他重要因素,这些风险、不确定性和其他重要因素可能会导致我们的实际结果、业绩或成就与前瞻性表述中明示或暗示的任何预期结果、业绩或 成就大不相同。可能导致实际结果大不相同的风险和不确定因素包括:药物开发过程和监管审批过程中固有的不确定性,特别是针对宾尼福布韦(AT-527)、鲁扎斯韦和AT-752;我们对第三方的依赖(我们可能并不总是完全控制这些第三方);来自新冠肺炎和丙型肝炎治疗以及新冠肺炎和登革热疫苗的竞争;与 新冠肺炎大流行相关的风险。以及我们提交给美国证券交易委员会(“美国证券交易委员会”)的最新10-Q表格季度报告以及我们提交给美国证券交易委员会的其他文件中描述的其他重要风险和不确定性。新的风险因素和不确定因素可能会不时出现,不可能预测到所有的风险因素和不确定因素。因此,谨告诫您不要过度依赖这些前瞻性陈述。除适用法律要求的 外,我们不打算因任何新信息、未来事件、情况变化或其他原因而公开更新或修改本文中包含的任何前瞻性声明。对任何此类前瞻性陈述的准确性不作任何陈述或担保 (明示或暗示)。本演示文稿中使用的行业信息、市场数据和行业信息均基于管理层对行业的了解和对管理层的诚意估计。在可用范围内,我们还依赖于, 根据管理层对一些第三方来源准备的独立行业调查和出版物以及其他可公开获取的信息的审查。 本演示文稿中使用的所有市场数据和行业信息都涉及一些假设和限制,请注意不要过度重视此类估计。虽然我们相信这些来源是可靠的,但我们不能 保证这些信息的准确性或完整性,我们也没有独立核实这些信息。虽然我们认为本演示文稿中包含的估计市场位置、市场机会和市场规模信息总体上是可靠的,但这些信息(部分来自管理层的估计和信念)本质上是不确定和不精确的。本公司或其任何附属公司不对任何此类陈述或预测的准确性 作出任何陈述或保证。由于多种 因素(包括上述因素),对我们的未来业绩和我们所在行业的未来业绩的预测、假设和估计必然会受到高度不确定性和风险的影响。这些因素和其他因素可能导致结果与我们的估计和信念以及独立各方编制的估计中所表达的结果大不相同。免责声明

单链RNA病毒治疗适应症 临床前1期2期3冠状病毒科新冠肺炎宾尼福布韦(AT-527)核苷酸*新冠肺炎联合蛋白酶抑制剂丙型肝炎病毒宾尼福韦核苷酸黄病毒丙型肝炎登革热病毒Ruzasvir**(NS5A抑制剂)AT-752nt副粘病毒截至2025年9月30日,多个适应症的未来18个月现金和现金等价物8.397亿美元现金 跑道突出显示Bemnifosbuvir是AT-527的通用名称*Bemnifosbuvir是一种双前药核苷酸类似物**默克公司所有用途的全球独家许可

对新冠肺炎的综合评价 本尼福布韦(Bemnifosbuvir)

本尼福布韦在新冠肺炎的愿景:首次联合疗法的骨干本尼福布韦(AT-527)解决了新冠肺炎口服核苷酸的关键挑战,该核苷酸具有跨关注/感兴趣的SARS-CoV-2变体针对病毒核糖核酸聚合酶的抗病毒活性,对病毒复制至关重要的高度保守的酶 具有双重靶点产生高耐药性屏障的独特机制:Niran抑制链终止(RdRp)在非临床研究中引入病毒基因组的突变在哺乳动物细胞中不致突变,对高危患者Ph 2的复制和非致畸快速持续抗病毒活性没有影响Bemnifosbuvir Niran RdRp Nsp12功能结构域SARS-CoV-2 N-51 932-Bemnifosbuvir Niran RdRp Nsp12功能性结构域SARS-CoV-2 N-51 932-Bemnifosbuvir Niran RdRp Nsp12功能域SARS-CoV-2 N-51 932-
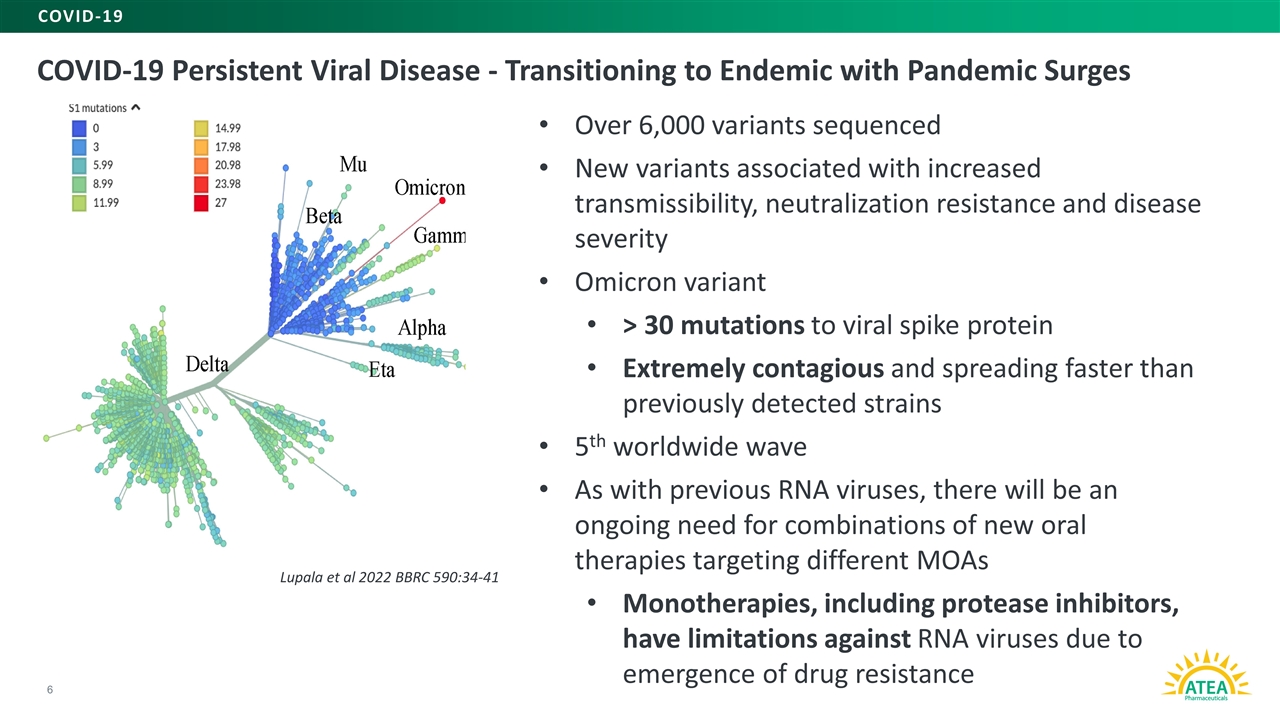
新冠肺炎持续性病毒病-随着大流行激增向地方性转变6新冠肺炎超过6,000个变异株测序了与增加传播性、中和抵抗力和疾病严重性相关的新变异株病毒刺突蛋白的Omicron变异>30个突变极具传染性,传播速度比之前检测到的毒株更快第5次全球浪潮与以前的rna病毒一样,将持续需要针对不同MOA单一疗法的新口服疗法的组合,包括蛋白酶抑制剂,由于出现抗药性,对rna病毒具有局限性。

7 AT-511(苯尼福布韦游离碱) 体外抗所有SARS-CoV-2变异株变异系毒株相对效力*AT-511 EC90[变体/美国-WA-1]原始A美国-WA1/2020年1阿尔法B.1.1.7英格兰/204820464/2020年2.8(n=3)Gamma P.1日本/TY7-503/2021年3.2(n=3)Epsilon B.1.427 美国/CA/VRLC009/2021年1.0(n=2)Delta B.1.617..2美国/PHC658/2021.2(n=3)Omicron B.1.1.529美国/MD-HP20874/2021年**正在处理AT(0.15-1.55µM)抗美国-WA-1在原代HAE细胞中的病毒产量测定 *在同一测定中并列测定EC90值差异在体外测定变异范围内**与其他变异株新冠肺炎相比,Omicron的核糖核酸聚合酶没有新的突变
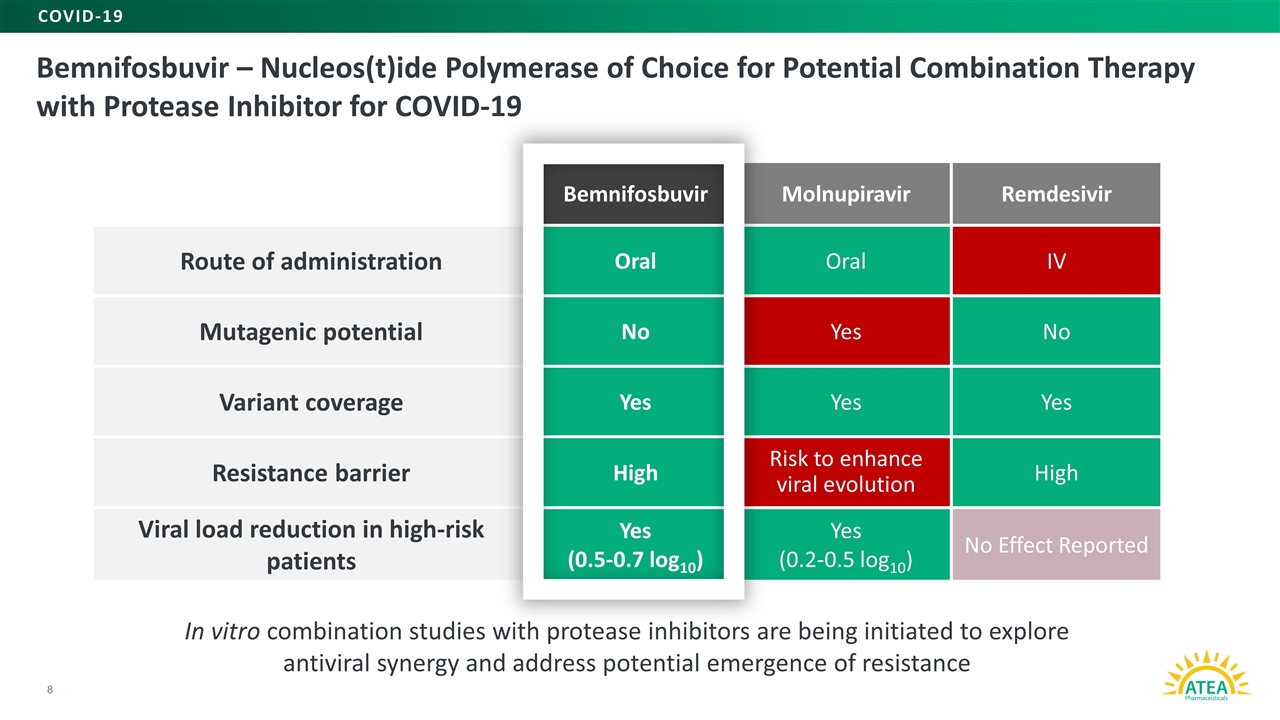
8项与蛋白酶抑制剂的体外联合研究正在启动,以探索抗病毒的协同作用,并解决新冠肺炎与蛋白酶抑制剂潜在联合治疗的抗药性核糖核酸(T)聚合酶的可能出现的选择 苯福昔韦口服IV给药途径诱变潜能否是无变异覆盖是耐药性屏障高风险促进病毒进化高危患者的高病毒载量减少率(Remnupiravir Remdevir)口服IV给药途径否无变异覆盖是耐药屏障高风险促进病毒进化高危患者的高病毒载量减少率(Remnupiravir Remdevir)口服IV给药途径否无变异覆盖是耐药屏障高风险促进病毒进化高危患者的高病毒载量减少

9临床开发最新情况和 计划本尼福布韦(Bemnifosbuvir)

Bemnifosbuvir安全性和抗病毒活性摘要 迄今完成的临床开发要点第一阶段研究显示,超过75%的患者体内药物浓度超过EC90。支气管肺泡灌洗研究证实,药物水平接近气道内的血浆水平 两项第二阶段研究显示,高危患者具有快速和持续的抗病毒活性,与CYP3A为底物的药物联合使用不需要进行剂量调整10新冠肺炎2022年:继续进行丰富阶段的治疗。这些药物通常是安全和耐受性良好的CYP3A底物。 在两项第二阶段研究中显示,高危患者具有快速和持续的抗病毒活性,与通常安全且耐受性良好的CYP3A底物联合给药不需要进行剂量调整
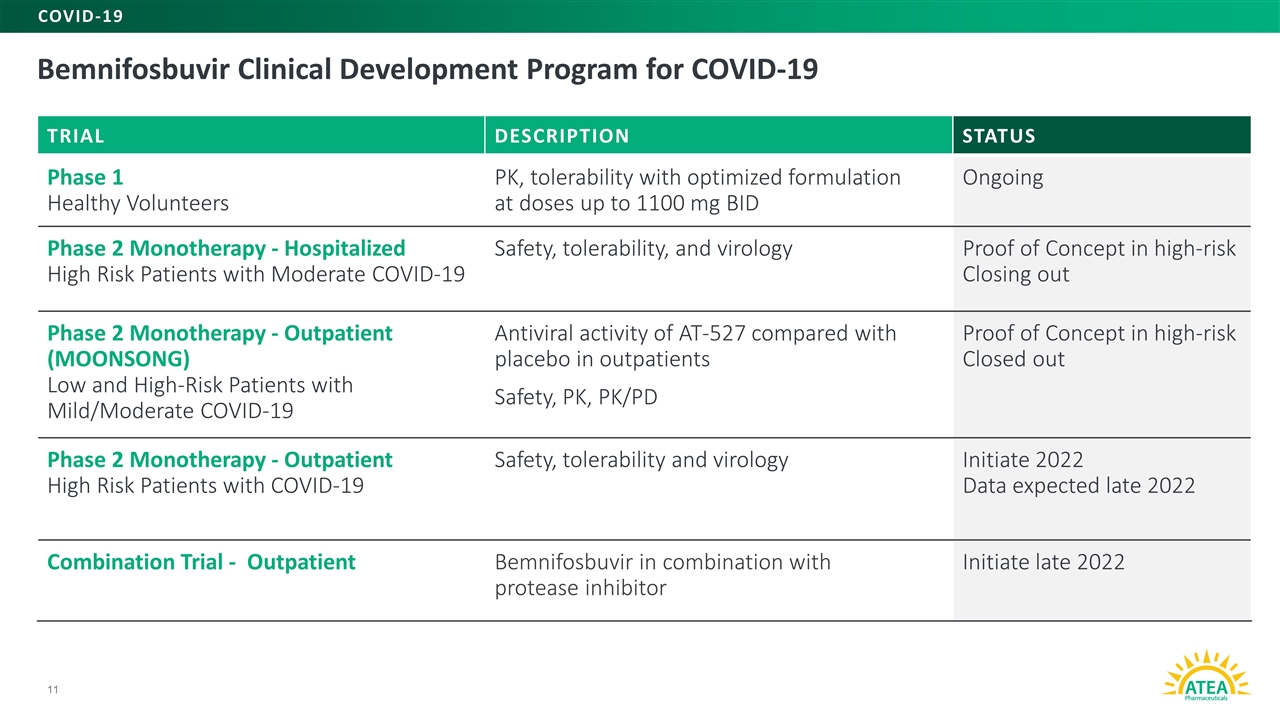
新冠肺炎11试验说明状态第一阶段健康志愿者PK的本尼福布韦临床开发计划,剂量高达1100毫克,每日2次的优化配方的耐受性正在进行的第二阶段单一疗法-住院的具有中度新冠肺炎安全性的高危患者, 耐受性,以及高危关闭第二阶段单一疗法的病毒学概念证据-门诊低风险和高风险患者,新冠肺炎抗病毒活性为AT-527轻/中度,与门诊安慰剂相比耐受性和病毒学启动2022年数据预计2022年末联合试验-门诊本尼福布韦联合蛋白酶抑制剂启动2022年末新冠肺炎
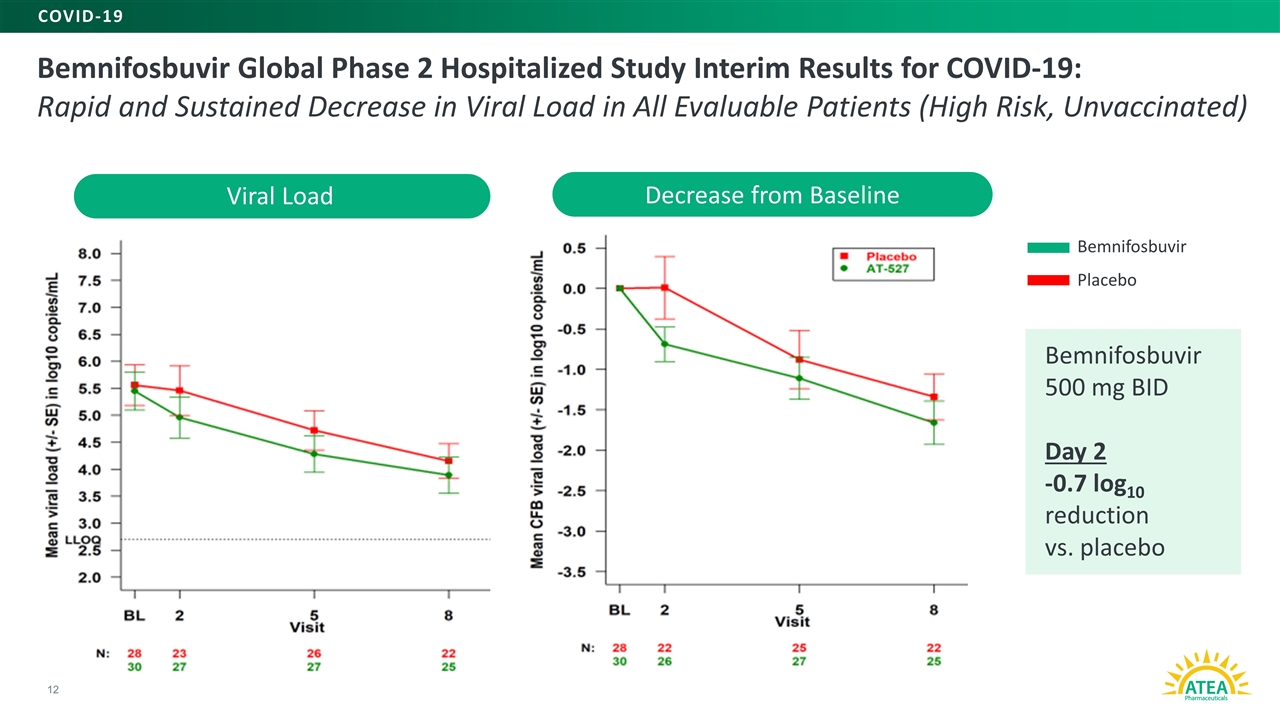
新冠肺炎全球第二阶段住院研究中期结果:所有可评估的患者(未接种疫苗的高危患者)病毒载量迅速持续下降12宾尼福布韦500毫克,每日2次-0.7log10与安慰剂相比病毒载量比基线下降 宾尼福布韦安慰剂新冠肺炎

13 Bemnifosbuvir 2期MOONSONG 探索性分析传染性病毒:高危患者有效且快速的抗病毒活性表明A组和B组之间的感染病毒滴度与基线相比有所变化*A组(550毫克,2次)高风险亚组*基线调整后的 (ANCOVA),考虑到活性药物/安慰剂之间基线病毒滴度的差异。**探索性亚群分析。新冠肺炎在高危患者中有效降低病毒载量在第3天本尼福布韦队列A(550mgBid):-0.3log10与安慰剂 Bemnifosbuvir队列B(1100 Mg Bid):-0.9log10与安慰剂Bemnifosbuvir安慰剂感染病毒滴度从基线变化*队列B(1100 Mg Bid)高危亚组**

新冠肺炎对本尼福布韦的展望:选择第一联合疗法计划的第二阶段门诊试验的核苷酸建立在之前的第二阶段试验中对高风险患者的阳性结果的基础上,多达200名患有轻中度新冠肺炎的高危门诊患者利用 配方,快速溶解和吸收,丰富了高危门诊患者的数据集,同时准备启动联合试验数据,预计2022年末联合试验可能由两种研究药物组成,具有 被证明的安全性和抗病毒活性或以下两种药物的组合

丙型肝炎:全球战略

16丙型肝炎病毒相关死亡率 即使使用有效的DAA组合Approx也有所增加。70%的长期静脉注射吸毒者在美国患有HCV,新一波早期/急性HCV感染需要方便的8周或更短的治疗时间。一流的组合有可能超过10亿美元受阿片类药物危机推动,美国丙型肝炎感染继续增加2020全球HCV市场41亿美元*;2020年美国约占全球DAA销售额的50%*来源:Gilead 2020投资者报告,AbbVie 2020投资者报告,Merck 2020投资者报告

默克许可证获得的17项全球独家许可包括所有人类适应症,下一代泛基因型有效抗病毒活性在微克摩尔范围内的体外研究证实,HCV感染患者的病毒载量下降>3log10,因为单一疗法在体外与bemnifosbuvir有显著的协同作用>1,250名HCV感染患者联合使用Ruzasvir,每日剂量最高180毫克,最长24周。RZR显示出良好的安全性,低潜在的药物相互作用PK 与本尼福布韦联合的理想体外协同作用:用MacSynergy(ImQuest)分析的丙型肝炎病毒GT1b复制子(Huh-Luc/neo-et)进行的检测 AT-511是本诺福布韦丙型肝炎的游离碱基

184.5log10±0.3IU/ml在GT3感染患者中4.6log10±0.5IU/ml在代偿性肝硬化(GT1,2,3)Bemnifosbuvir作为单一疗法在第一阶段和第二阶段临床试验中表现出前所未有的抗病毒活性,安全性良好。最后 剂量Bemnifosbuvir 550 mg qd剂量GT1b与GT3与肝硬化NC=非肝硬化Bemnifosbuvir(SOF)体外活性是索莫布韦(SOF)的10倍,与一组实验室菌株和临床分离的1-5型HCV保持完全有效 安全性和耐受性良好的丙型肝炎患者暴露于550 mg剂量的苯尼福布韦,持续8-12周,并伴有非药物相关的SAEs丙型肝炎

19 Bemnifosbuvir+Ruzasvir:第二阶段 联合就绪资产第二阶段联合计划预计将在2022年下半年启动,以评估:方便和短的8周疗程(对于早期/急性感染可能较短)急性和慢性HCV感染患者,患有代偿性和失代偿性肝病 Bemnifosbuvir是迄今为止正在开发的针对HCV的最有效的核苷酸抑制剂Ruzasvir是一种非常有效的第二阶段就绪药物候选药物,有潜力成为同类中最好的Ruzasvir竞争概况方便且持续时间短,首次无RBV治疗失代偿性疾病的潜力

20登革热AT-752的临床概念验证计划

由4种血清型症状引起的痛苦,衰弱的蚊子传播疾病感染后3-14天高烧2-7天登革热:高死亡率和高度未得到满足的医疗需要21人生活在高危地区*目前扩大的登革热范围内的强大疗效估计 每年感染严重登革热死亡率如果不治疗每年发展成登革热出血热,需要住院治疗(约1,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000)。死亡率2.5%)AT-752:前景看好的产品简介嘌呤核苷酸前药对测试的所有血清型MOA具有强大的体外活性:在登革病毒动物模型中抑制具有体内抗病毒活性的登革热病毒聚合酶成功开发和FDA批准AT-752可能导致美国优先审查*东南亚、西太平洋、东地中海、拉丁美洲和波多黎各的100多个国家;仅在美洲就有230万人死亡,导致≥1200人死亡没有抗病毒治疗,只有支持性治疗(止痛药,明智的液体疗法)登革热®(用于预防)于2017年6月获得批准2021年6月ACIP登革热®疫苗推荐用于9-16岁以前感染过登革热的人,包括波多黎各~4B~400M 12-44%50万 登革热

成功完成AT-752 第1阶段研究1 SAD和3个MAD队列22目标:安全性和PK(嵌入食物效应)第1部分:单次递增剂量队列第2部分:多剂量QD/BID/TID纳入标准:健康志愿者连续剂量递增国家: 澳大利亚AT-752剂量MAD随机安慰剂双盲口服给药:最长7天4Q/21完成AT-752剂量SAD AT-752在健康受试者单剂或多剂后耐受性良好安全性良好,相关实验室参数无 变化无因不良事件或严重不良事件而过早中断大多数不良事件轻度N=64登革热
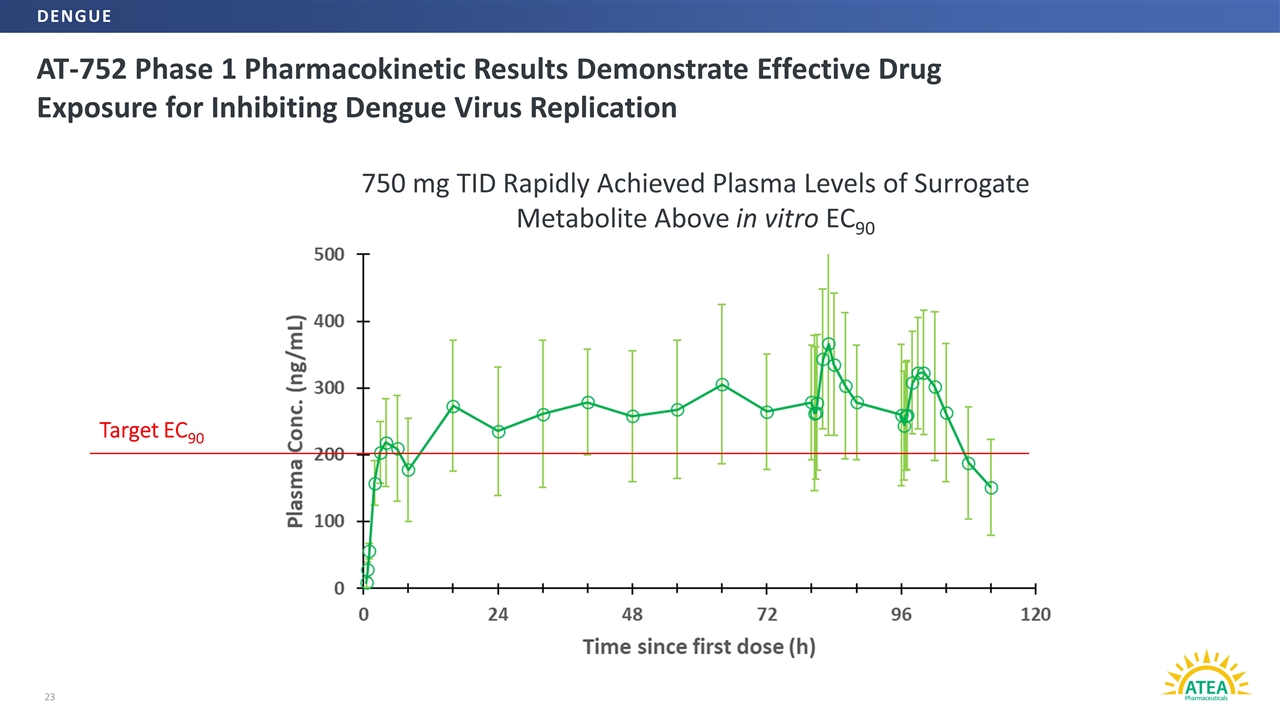
AT-752阶段1药代动力学结果显示有效药物暴露抑制登革热病毒复制23靶EC90 750毫克TID在体外迅速达到EC90登革热替代代谢物的血浆水平

24人群:健康受试者,18-55岁地点:美国设计:第1天:12名受试者随机3:1口服AT-752或匹配的安慰剂第2天:用0.5mL DENV-1-LVHC(6.5×103PFU/mL)AT-752攻击登革热人类挑战感染模型登革热终点:qRT-PCR平均定量病毒载量(峰值、持续时间和AUC),直到病毒接种后28天qRT-PCR开始阳性病毒载量时间
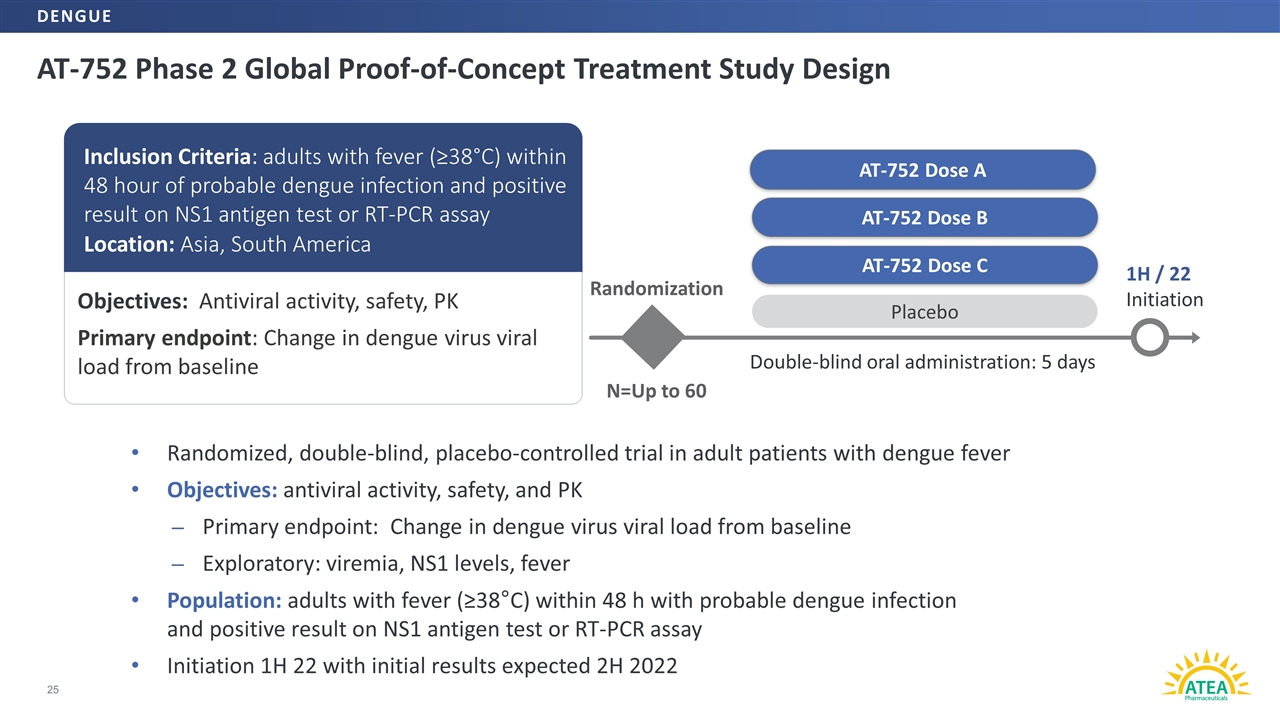
AT-752二期全球概念性治疗研究设计25个AT-752剂B随机N=最多60个安慰剂双盲口服:5天1H/22开始AT-752量AT-752AAT-752量C目标:抗病毒活性、安全性、PK主要终点:登革热病毒载量与基线纳入标准相比的变化:登革热疑似感染后48小时内成人发烧(≥38°C),且NS1抗原检测呈阳性安全性和PK主要终点:从基线开始的登革热病毒载量的变化探索性:病毒血症、ns1水平、发烧人群:成人 在48小时内发烧(≥38°C),疑似登革热感染,ns1抗原检测或RT-PCR检测呈阳性结果启动1H22,初步结果预计为2022年2H22登革热。

结束语26
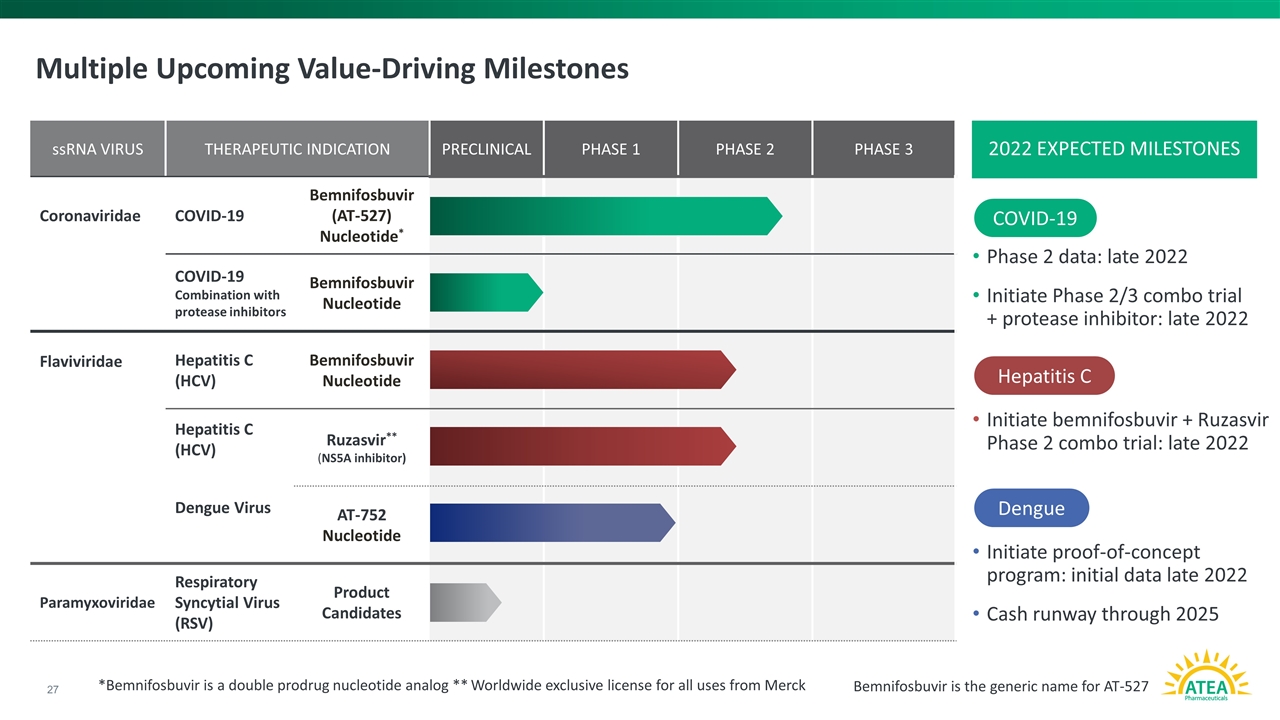
多个即将到来的价值驱动里程碑 第二阶段数据:2022年末启动2/3期联合试验+蛋白酶抑制剂:2022年末启动宾尼福布韦+鲁扎斯韦2期联合试验:2022年末启动概念验证计划:2022年末初始数据到2025年的现金跑道 新冠肺炎丙型肝炎登革热单链RNA病毒治疗适应症临床前1期2期3冠状病毒新冠肺炎Bemnifosbuvir(AT抑制剂)AT-752核苷酸副粘病毒科呼吸道合胞病毒(RSV)候选产品Bemnifosbuvir是AT-527的通用名称*Bemnifosbuvir 是一种双前药核苷酸类似物**默克2022预期里程碑的所有用途的全球独家许可

美国马萨诸塞州波士顿夏日大街125号02110 85728488891 www.ateapharma.com