
1©版权所有2022。阿瓦洛治疗公司。版权所有。Avalo是一家领先的临床阶段生物制药公司,采用精确医学方法在重大未得到满足的临床需求领域发现、开发和商业化高度针对性的治疗药物。由同情心驱动的创新2022年1月投资者日演示文稿

2©版权所有2022。阿瓦洛治疗公司。版权所有。本报告可能包括根据1995年“私人证券诉讼改革法”所作的前瞻性陈述。前瞻性陈述是非历史事实的陈述。此类前瞻性陈述会受到重大风险和不确定因素的影响,这些风险和不确定性可能会因各种因素而发生变化(其中许多因素不在Avalo治疗公司(以下简称“Avalo”或“公司”)的控制范围之内),这可能会导致实际结果与前瞻性陈述大不相同。此类陈述可包括但不限于,关于Avalo的计划、目标、预测、期望和意图的陈述,以及由诸如“项目”、“可能”、“将”、“应该”、“继续”、“寻求”、“目标”、“预测”、“相信”、“期望”、“预期”、“估计”、“打算”等词语标识的其他陈述。“计划”、“潜在的”或类似的表达(包括它们在否定中的用法),或通过讨论未来的事项,如:未来的财务和经营前景;候选产品或产品的开发;候选产品的潜在属性和好处;试验结果和监管审查的时间和成功;候选产品的潜在属性和好处;以及其他非历史性的陈述。这些声明是基于Avalo公司管理层目前的信念和期望,但存在重大风险和不确定性,包括:药物开发成本、时机和其他风险,包括对研究人员的依赖和临床试验受试者的登记, 这些风险和不确定性包括:新冠肺炎疫情可能减缓的风险;监管风险;阿瓦洛的现金状况及其筹集额外资本的需要;与Millipred潜在战略替代方案相关的风险;一般的经济和市场风险及不确定性,包括新冠肺炎疫情造成的风险以及阿瓦洛在提交给美国证券交易委员会的报告中详细描述的其他风险。实际结果可能与前瞻性陈述中陈述的结果不同。除适用法律另有要求外,Avalo明确表示不承担任何义务或承诺公开发布本文中包含的任何前瞻性陈述的任何更新或修订,以反映Avalo对此的预期的任何变化,或任何陈述所基于的事件、条件或环境的任何变化。前瞻性陈述

3©版权所有2022。阿瓦洛治疗公司。版权所有。我们的管理团队参加了今天的演讲迈克·可口可乐首席执行官艾克·可口可乐·加里·A·尼尔、MD首席科学官加里·A·尼尔,DH。首页--期刊主要分类--期刊细介绍--期刊题录与文摘--期刊详细文摘内容

4©版权所有2022。阿瓦洛治疗公司。版权所有。今天的议程主题推介人介绍Schond L.Greenway-CFO执行摘要Mike Cola-CEO AVTX-002·1b期克罗恩病(CD)的初步数据(队列1和2)·新靶标适应症和研究设计的科学基础-非嗜酸性哮喘(NEA)H.Jeffrey Wilkins,MD-CMO AVTX-007·多发性骨髓瘤和成人仍起病(AOSD)-未满足需要;疾病病理学;治疗用途的临床原理-正在进行的1b期概念验证(POC)研究的更新H.Jeffrey Wilkins,MD-CMO AVTX-803·疾病负担和未得到满足的需求;状态更新H.Jeffrey Wilkins,MD-CMO AVTX-006·疾病负担和未得到满足的需求;状态更新H.Jeffrey Wilkins,MD-CMO 22财年的公司目标和闭幕词Mike Cola-CEO问答管理(Mike,Jeff,Garry,Stephen,Schond)

5©版权所有2022。阿瓦洛治疗公司。版权所有。我们开发计划的不同特点新的一流分子靶向作用机制具有增强效益-风险特征的潜力生物标记方法有潜力提高试验效率和监管成功的可能性精密制药公司在财年使用多种临床催化剂

6©版权所有2022。阿瓦洛治疗公司。版权所有。AVTX-002·1b期克罗恩病试验的结果标志着AVTX-002的第二项阳性概念验证研究,并进一步验证了轻型MOA在炎症性疾病中的作用。溃疡性结肠炎信号发现研究正在进行中·令人信服的生物标志物数据表明,光在非嗜酸性哮喘(NEA)的炎症中起着重要作用。POC试验正在进行中,数据预计2022年下半年AVTX-007·对AVTX-007的早期评估表明AOSD患者有潜力。预计到2022年年中,这两个群体的营收数据都将公布。·AVTX-007多发性骨髓瘤研究的数据表明,该疗法总体上是安全的,耐受性良好。没有看到疗效信号,这一适应症的开发将停止AVTX-800S·AVTX-803关键研究正在进行中,预计2022年第三季度完成·正在与FDA就AVTX-801和AVTX-802进行对话,以协调合适的临床研究试验设计AVTX-006·预计2022年年中的主要1b阶段数据执行摘要

7©版权所有2022。阿瓦洛治疗公司。版权所有。AVTX-002抗光单抗AVTX-007抗IL-18单抗免疫学研究

8©版权所有2022。阿瓦洛治疗公司。版权所有。·新型、一流的全人皮下(SQ)单克隆抗体(MAb)·唯一的全人抗光mAb·临床开发中的唯一的抗光mAb AVTX-002:一种新型的一流的抗光(TNFSF14)mAb*Kyowa麒麟有权保留在日本的权利。从Kyowa麒麟Co.获得In-License,所有适应症的全球独家版权*(2021)
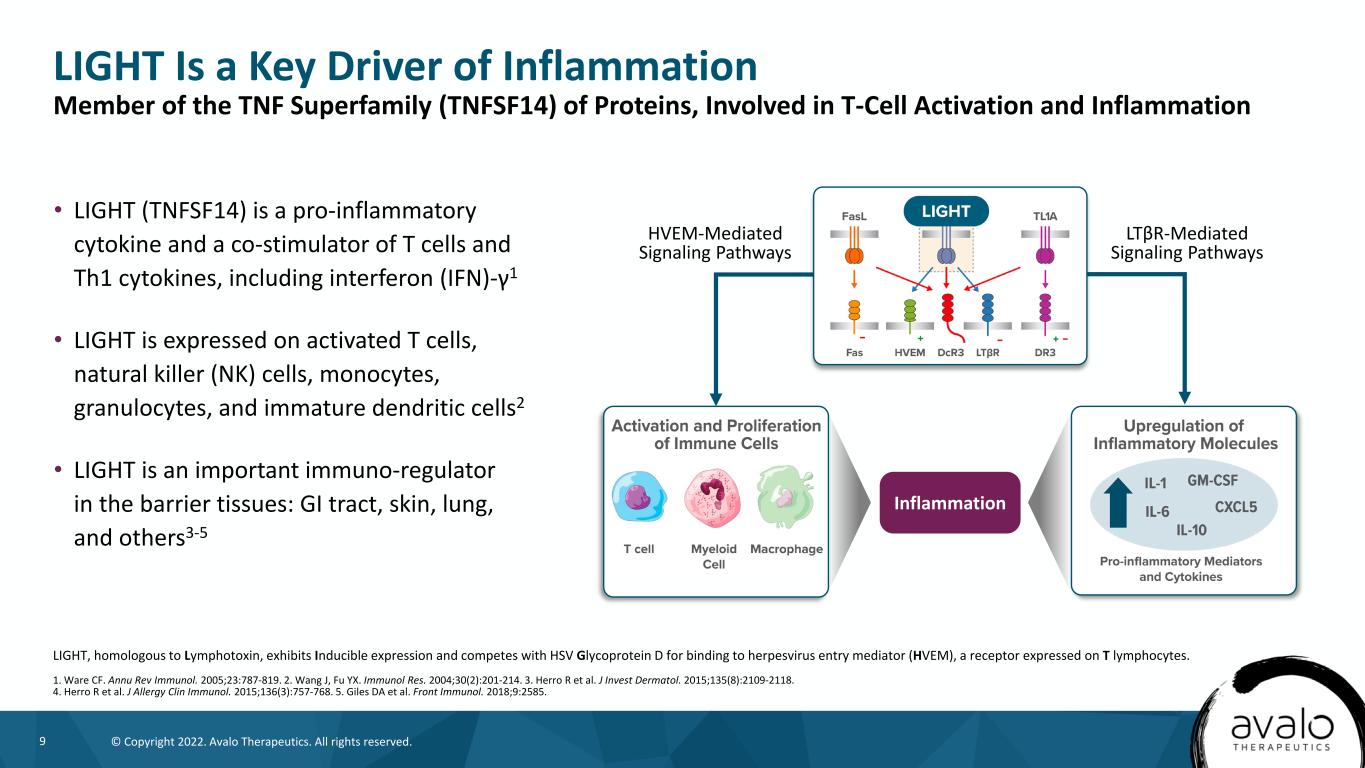
9©版权所有2022。阿瓦洛治疗公司。版权所有。光是炎症光的关键驱动因子,与淋巴毒素同源,具有诱导性表达,并与单纯疱疹病毒糖蛋白D竞争结合T淋巴细胞上表达的受体-疱疹病毒进入介质(HVEM)。1.Ware CF.安努牧师。2005年;23:787-819。2.王静、傅永新。“免疫研究”2004;30(2):201-214。3.Herro R等人。J投资皮肤。2015;135(8):2109-2118。4.Herro R等人。J变态反应,Clin,免疫。2015年;136(3):757-768。5.Giles DA等人。前置免疫系统。2018年;9:2585。LIGHT(TnFSF14)是一种促炎细胞因子,也是T细胞和Th1型细胞因子的共刺激因子,包括干扰素-γ1·LIGHT表达于活化的T细胞、自然杀伤(NK)细胞、单核细胞、粒细胞和未成熟的树突状细胞2·LIGHT是屏障组织中的重要免疫调节因子:胃肠道、皮肤、肺和其他TFSF14蛋白超家族的3-5个成员,参与T细胞

10©版权所有2022。阿瓦洛治疗公司。版权所有。新冠肺炎急性呼吸窘迫综合征患者的2期随机对照试验Met初级终点*·AVTX-002在新冠肺炎急性ARDS患者的第2期临床试验中显著降低了呼吸衰竭和死亡率·AVTX-002耐受性良好,在免疫抑制或其他严重不良事件方面与安慰剂没有明显差异·AVTX-002显著迅速地将血清自由光水平降低了85%·AVTX-002被授予快车道称号ARDS中的†AVTX-002中的新冠肺炎ARDS:最终数据分析*ARDS,急性呼吸窘迫综合征;国防部†国防部;国防威胁减少局;生物医学高级研究和发展局。资料来源:Avalo;Perlin DS等人。人类抗光单抗CERC-002减少住院新冠肺炎急性呼吸窘迫综合征患者(https://medrxiv.org/cgi/content/short/2021.04.03.21254748v1).的呼吸衰竭和死亡
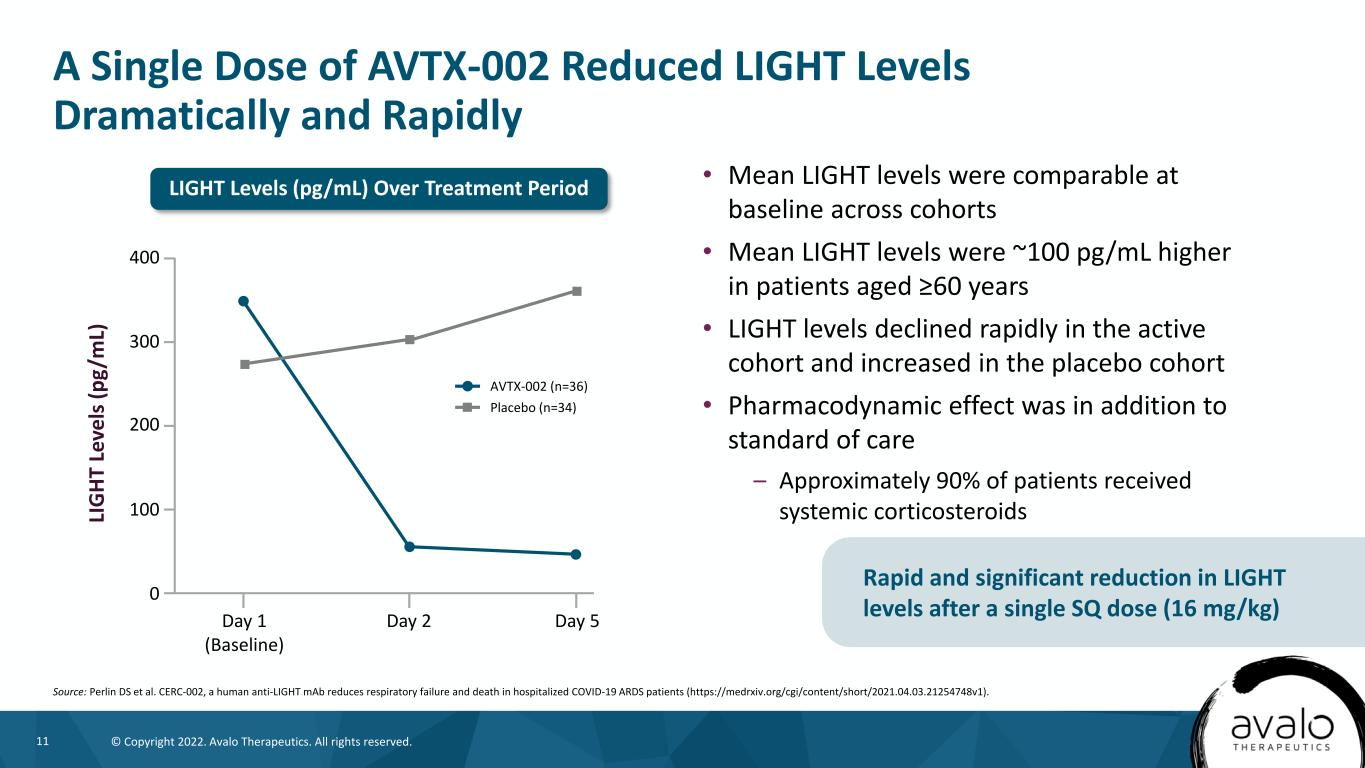
11©版权所有2022。阿瓦洛治疗公司。版权所有。单剂AVTX-002可显著且迅速地降低光照水平·平均光照水平在各队列中的基线水平与基线相当·60岁≥患者的平均光照水平高出约100pg/mL·在积极队列中,光照水平迅速下降,在安慰剂队列中则有所上升·药效学效应是除了标准治疗之外的--大约90%的患者接受了全身皮质类固醇治疗。来源:Perlin DS等人。人类抗光单抗CERC-002减少住院新冠肺炎急性呼吸窘迫综合征患者(https://medrxiv.org/cgi/content/short/2021.04.03.21254748v1).的呼吸衰竭和死亡在单次SQ剂量(16 mg/kg)AVTX-002(n=36)安慰剂(n=34)LI G HT L EV el s(pg/m L)400 300 200 100 0 d1(基线)d2 d治疗期间,光照水平迅速显著降低(pg/mL)

12©版权所有2022。阿瓦洛治疗公司。版权所有。AVTX-002显著减少了呼吸衰竭和死亡率*预先指定的分析。资料来源:阿瓦洛治疗公司的档案数据主要终点:在≥60岁*(n=34,P=0.042)、最易发生严重并发症和死亡的人群中,在第28天存活且无呼吸衰竭的患者百分比最高(n=34,P=0.042)。(%)100 60 40 20 AVTX-002总体(n=62)安慰剂年龄≥60岁(n=34)年龄

13©版权所有2022。阿瓦洛治疗公司。版权所有。仅供讨论,AVTX-002用于炎症性肠病(IBD)、克罗恩病(CD)

14©版权所有2022。阿瓦洛治疗公司。版权所有。·对之前3种或3种以上治疗失败的中到重度克罗恩病患者进行开放式概念验证研究*-均对至少两种生物制剂耐药·50%(4/8)的患者通过结肠镜检查(SES-CDα†)确定有临床意义的粘膜愈合·一名(1/8)患者(1/8)获得缓解(SES-CD=0)·75%(3/4)的患者报告通过结肠镜检查显示粘膜愈合其余应答者的随访正在进行中·8周内快速反应;所有患者的自由光水平降低·耐受性良好,没有观察到与之前研究的AVTX-002临床试验一致的药物相关严重不良事件,单剂量为16毫克/公斤的AVTX-002在1b期研究中显示出疗效信号(队列1/2)*肿瘤坏死因子α,肿瘤坏死因子α;单克隆抗体,单克隆抗体;†SES-CD,克罗恩病的简单内窥镜评分。
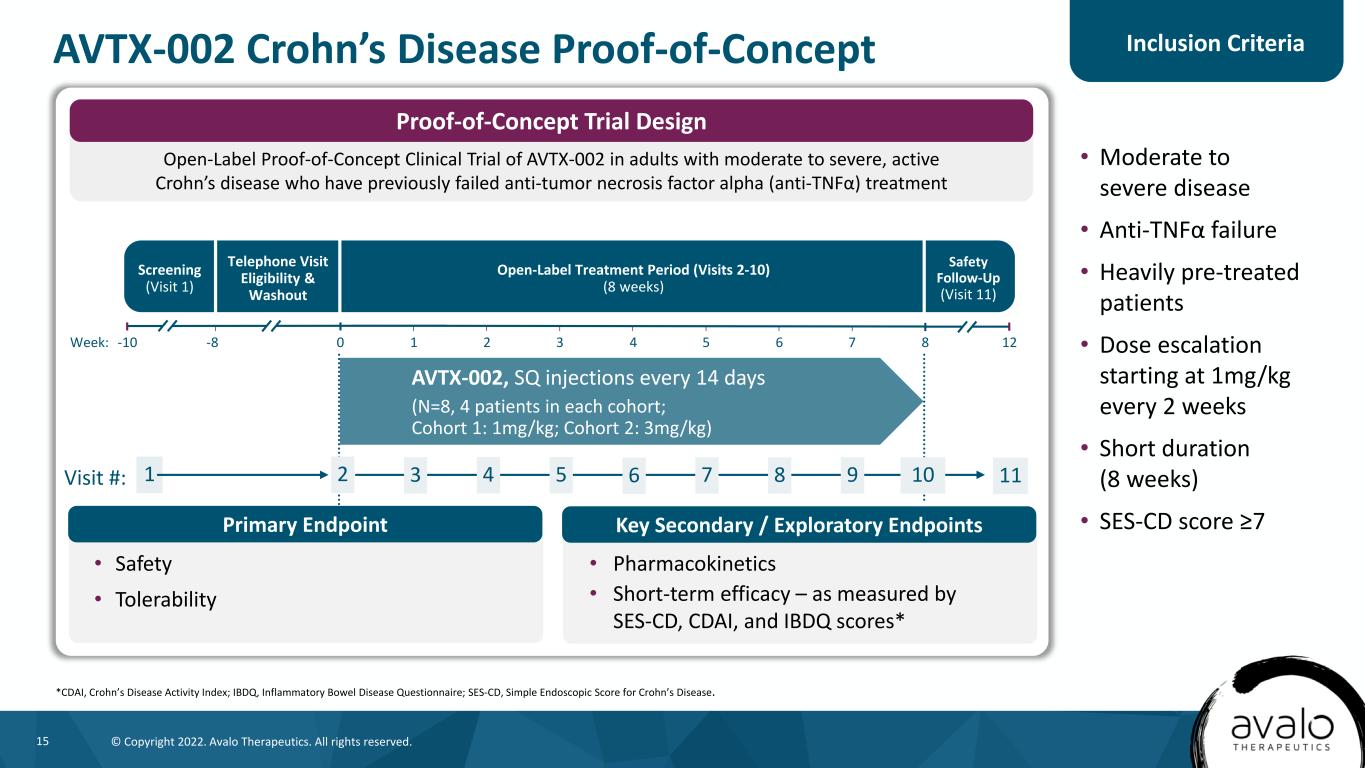
15©版权所有2022。阿瓦洛治疗公司。版权所有。AVTX-002克罗恩病概念验证*CDAI,克罗恩病活动指数;IBDQ,炎症性肠病问卷;SES-CD,克罗恩病简单内窥镜评分。筛查(就诊1次)开放标签治疗周期(就诊2~10次)(8周)安全随访(就诊11次)AVTX-002,SQ注射每14天一次(N=8,每个队列4例;队列1:1 mg/kg;队列2:3 mg/kg)电话访问资格和淘汰周:-10 0 1 2 3 4 5 5 6-8 127 8访问#:1 2 3 4 5 6 7 108 9 11·安全性·耐受性·药代动力学·短期疗效-以SES-CD、CDAI和IBDQ评分衡量*AVTX-002在成人中重度患者中的开放标签概念验证临床试验先前抗肿瘤坏死因子α治疗失败的活动期克罗恩病患者的概念验证试验设计主要终点关键次级/探索性终点·中到重度疾病·抗肿瘤坏死因子α失败·接受大量预处理的患者·剂量从每2周1 mg/kg开始递增·持续时间较短(8周)·SES-CD评分≥7纳入标准

16©版权所有2022。阿瓦洛治疗公司。版权所有。队列#2 23 3 mg/kg Humira,Entyvio 10 0 31 9.6·SES-CD评分下降100%·正在进行的队列#1 41 1 mg/kg Remicade,Entyvio,Stelara 11 4571 27·64%SES-CD评分下降·非正式随访:患者停止治疗后复发,需要半结肠切除队列#1491 mg/kg Remicade,Stelara,Humira,Entyvio停止研究药物队列#224 3 mg/kg Remicade,Humira,Entyvio 12 17 213 21·没有证据表明改善的队列#年龄(YRS)剂量方案治疗前SES-CD光(pg/mL)附加评论基线8周基线8周AVTX-002克罗恩病:1b期数据(队列1/2)中度疾病患者(SES-CD评分7-15)*·3名中度疾病患者经历了有临床意义的应答(SES-CD)·1名患者获得临床缓解(SES-CD=0)·2名患者获得临床缓解(SES-CD=0)根据简单克罗恩病内镜评分(SES-CD)对其余应答者的疾病严重程度进行随访1:缓解:0~2分;轻度:3~6分;中度:7~15分;重度:>15.1分。意大利炎症性肠病研究小组。Https://www.igibdscores.it/en/info-sescd.html.2021年7月19日访问。
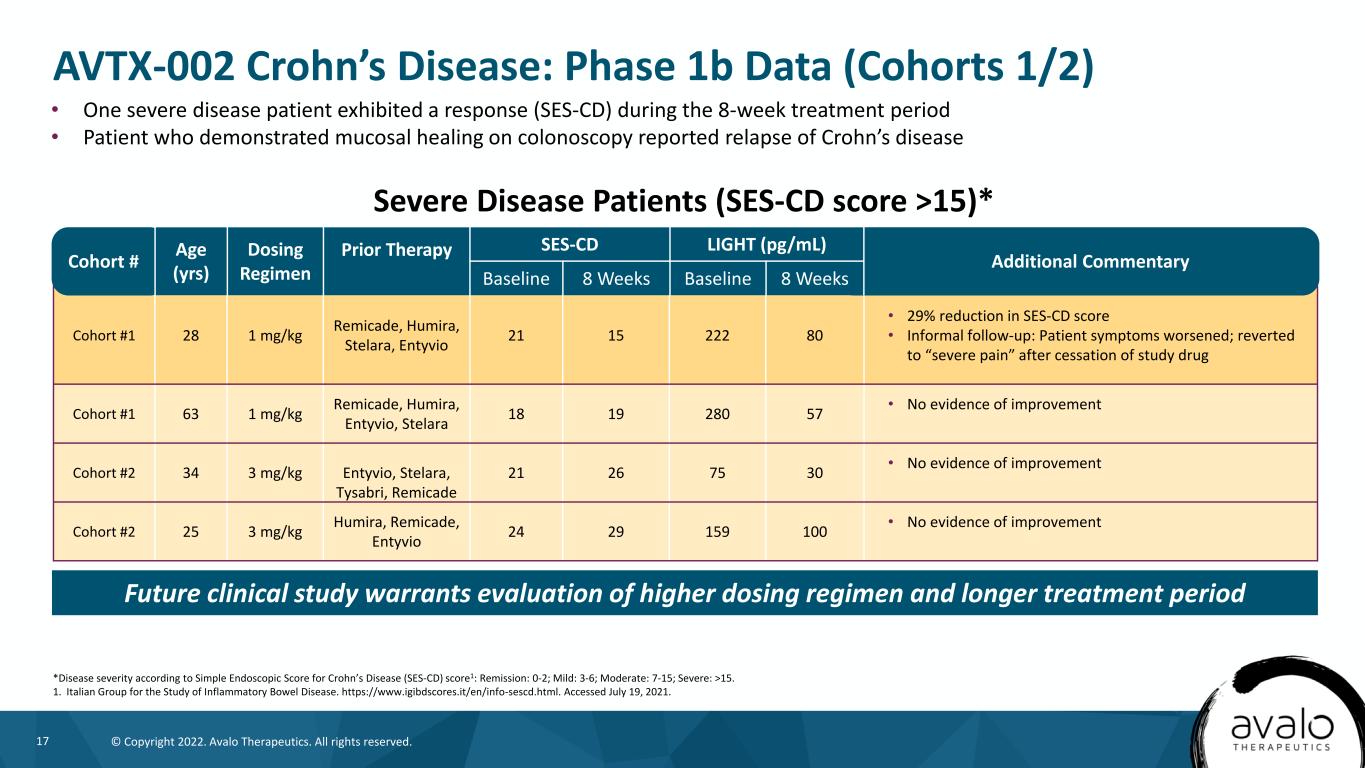
17©版权所有2022。阿瓦洛治疗公司。版权所有。队列#1281 mg/kg Remicade,Humira,Stelara,Entyvio 21,15,222,SES-CD评分下降80%·29%·非正式随访:患者症状恶化;停止研究后恢复为“剧烈疼痛”的药物队列#1 63 1 mg/kg Remicade,Humira,Entyvio,Stelara 18 19 280 57·没有改善的证据队列#2 34 3 mg/kg Entyvio,Stelara,Tysabri,Remicade 21 26 75 30·没有改善的证据队列#2 25 3 mg/kg Humira,Remicade,Entyvio 24 29 159 100·没有证据表明改善的队列#年龄(YRS)给药方案治疗前SES-CD光(Pg/mL)附加评论基线8周基线8周AVTX-002克罗恩病:1b期数据(队列1/2)*根据克罗恩病的简单内窥镜评分(SES-CD)评分1:缓解:0-2;轻度:3-6;中度:7-15;重度:>15.1。意大利炎症性肠病研究小组。Https://www.igibdscores.it/en/info-sescd.html.2021年7月19日访问。未来的临床研究需要评估更高剂量的方案和更长的疗程·一名重症患者在8周的治疗期内出现反应(SES-CD)·结肠镜检查显示粘膜愈合的患者报告克罗恩病重症患者复发(SES-CD评分>15)*
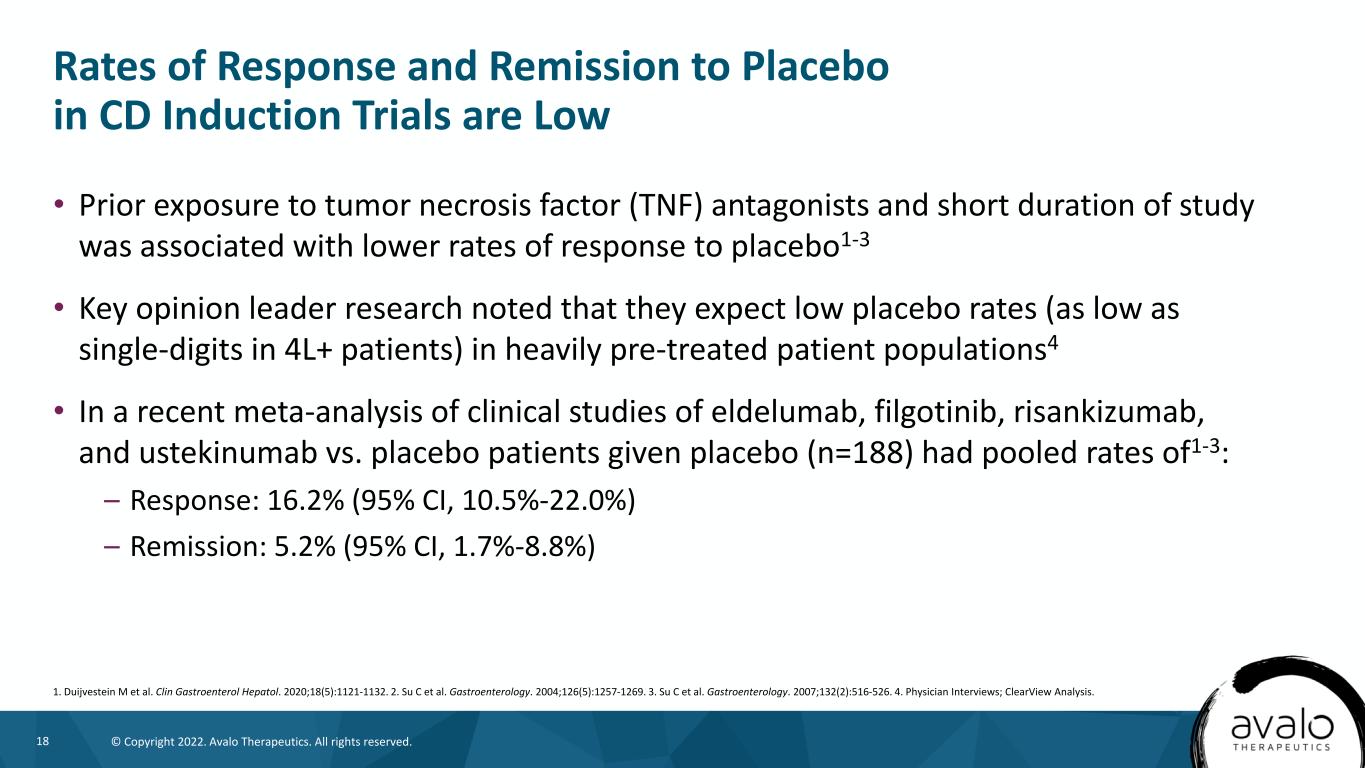
18©版权所有2022。阿瓦洛治疗公司。版权所有。·以前接触肿瘤坏死因子(TNF)拮抗剂和研究持续时间较短与安慰剂1-3的反应率较低有关·关键意见领袖研究指出,他们预计在接受大量预处理的患者群体中,安慰剂率较低(在4L+患者中低至个位数)4·在最近对eldelumab、filgoinib、risankizumab和ustekinumab与服用安慰剂(n=188)的安慰剂患者的临床研究的荟萃分析中CD诱导试验中对安慰剂的反应率和缓解率都很低(1.7%-8.8%)1.Duijvestein M等人。临床胃肠醇肝醇。2020年;18(5):1121-1132。2.苏C等人。胃肠病学。2004年;126(5):1257-1269。3.苏C等人。胃肠病学。2007;132(2):516-526。4.医生访谈;ClearView分析。

19©版权所有2022。阿瓦洛治疗公司。版权所有。·生物标记物-正在对生物标记物数据进行评估·独立初步安全数据结果-没有可归因于与83名患者新冠肺炎急性呼吸窘迫综合征临床试验一致的研究药物引起的严重不良事件1-不良事件性质为轻至中度,最常见的:胃肠道症状与克罗恩病一致-没有证据表明感染增加或不良事件与免疫抑制AVTX-002Crohn病有关:1b期数据(队列1/2)PERLIN DS等人。Https://medrxiv.org/cgi/content/short/2021.04.03.21254748v1.
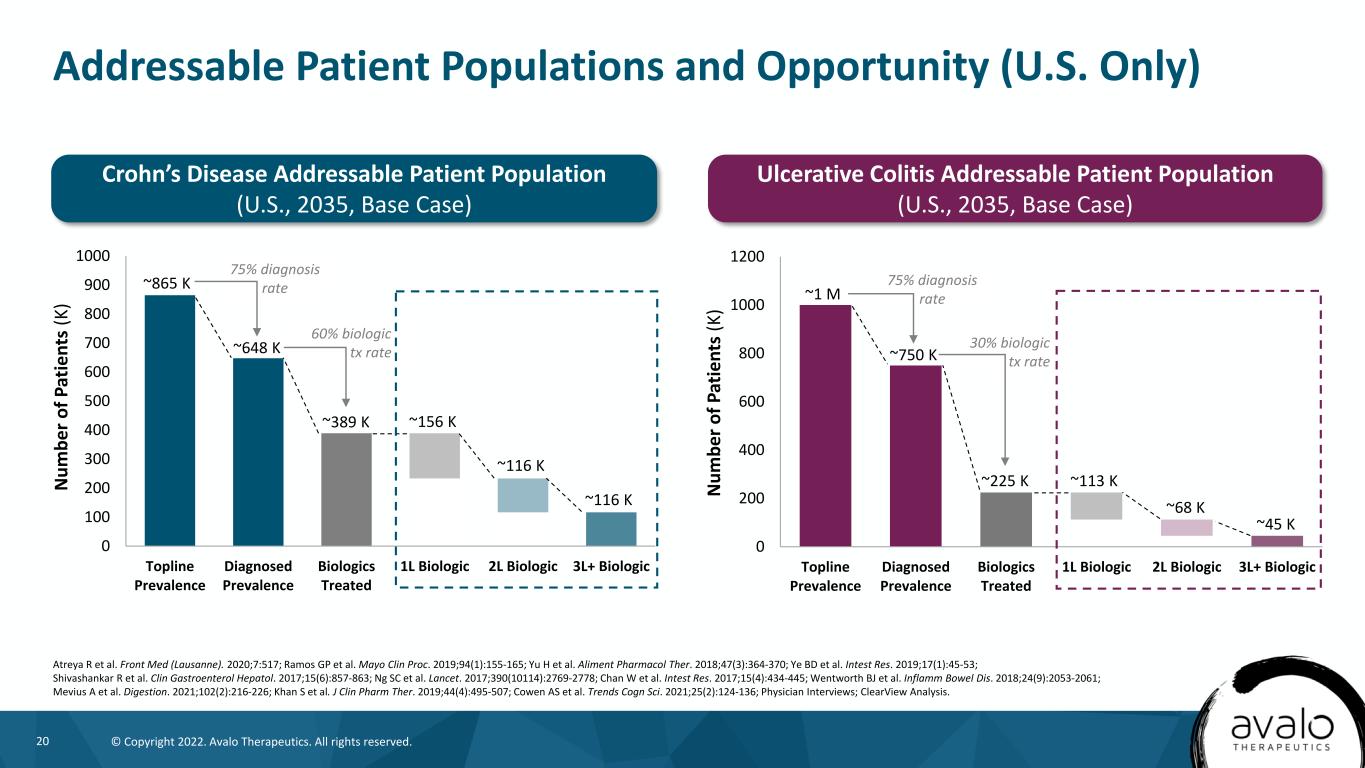
20©版权所有2022。阿瓦洛治疗公司。版权所有。0 100 200 300 400 500 600 700 800 900 1000 TOPLINE确诊流行率生物学治疗1L生物学2L生物学3L+生物学Num Be r f P(K)~648 K~865 K~389 K~156 K~116 K~116 K 75%诊断率60%生物TX率可寻址患者群体和机会(仅美国)Atreya R等。前地中海(洛桑)。2020年;7:517;Ramos GP等人。Mayo Clin Proc.2019年;94(1):155-165;余华等人。食品药剂师。2018年;47(3):364-370;叶必得等人。InTest Res.2019;17(1):45-53;Shivashankar R et al.临床胃肠醇肝醇。2017;15(6):857-863;Ng SC等人。柳叶刀。2017年;第390(10114):2769-2778;陈伟等人。InTest Res.2017;15(4):434-445;Wentworth BJ等人。炎症性肠病。2018年;24(9):2053-2061;Mevius A等人。消化。2021年;102(2):216-226;Khan S等人。J临床药剂师。2019年;44(4):495-507;考恩·阿斯等人。科恩科学的发展趋势。2021年;25(2):124-136;医生访谈;ClearView分析。0200 400 600 800 1000 1200 TOPLINE确诊流行率生物学治疗1L生物学2L生物学3L+生物学Num是P在IENT s(K)~750K~1M~225K~113K~45K~68K 75%诊断率30%生物转化率溃疡性结肠炎可寻址患者群体(美国,2035年,基础病例)克罗恩病可寻址患者群体(美国,2035年,基础病例)

21©版权所有2022。阿瓦洛治疗公司。版权所有。·克罗恩病(CD)-生物标记物数据的完整评估·溃疡性结肠炎(UC)-对抗肿瘤坏死因子α无效的中到重度UC患者的临床研究*正在进行中的-预期22年第三季度的主要数据·来自概念验证CD和UC研究的数据,为随后的中到重度难治患者AVTX002炎症性肠病临床计划*肿瘤坏死因子α,肿瘤坏死因子α的随机对照临床研究提供设计信息。接下来的步骤

22©版权所有2022。阿瓦洛治疗公司。版权所有。仅供讨论之用:新的AVTX-002靶标非嗜酸性哮喘(NEA)

23©版权所有2022。阿瓦洛治疗公司。版权所有。非嗜酸性哮喘(NEA):预后不良的哮喘亚型1。美国哮喘和过敏基金会。哮喘的事实和数据。Https://www.aafa.org/asthma-facts/.访问时间为2022年1月3日。2.McGrath KW等人。我是J RESP危重护理医生。2012年;185(6):612-619。3.姜勇等人。过敏性哮喘临床免疫。2021年;17(1):45。4.疾病控制和预防中心。哮喘统计数据:成人哮喘失控,2016年。Https://www.cdc.gov/asthma/asthma_stats/uncontrolled-asthma-adults.htm.访问时间为2022年1月3日。5.Esteban-Gorgojo I等人。J哮喘过敏。2018年;11:267-281。6.Clearview Healthcare Partners Analysis,2021年6月。7.Hastie AT等人。J变态反应,Clin,免疫。2010年;125(5):1028-1036。8.罗密欧·J等人。J变态反应,Clin,免疫。2013年;131(2个补充):AB203。摘要725。9.科瓦尔·K等人。J变态反应,Clin,免疫。2019年;143(2个补充):ab8。摘要23.治疗方法4·与吸烟、污染、感染和肥胖等环境和/或宿主因素相关·出现喘息、呼吸急促、咳嗽和胸闷等呼吸道症状的患者·许多NEA患者仍未得到现有药物的控制5、6·抗光疗法可能为控制不佳的NEA患者提供治疗选择7-9名患者·美国哮喘患病率估计为25M1·NEA至少占哮喘的47%2,3·根据美国疾病控制与预防中心(CDC)的数据,抗光治疗可能为控制不佳的NEA患者提供一种治疗选择7-9人·美国哮喘患病率估计为25M1·NEA至少占哮喘的47%目前超过50%的哮喘患者患有未得到控制的哮喘4·没有针对NEA的特效治疗方法·常用哮喘药物,如吸入性皮质类固醇(ICS)可能会导致中性粒细胞水平升高,从而加剧NEA疾病概述以气道炎症为特征,但没有嗜酸性粒细胞体征和症状4预后

24©版权所有2022。阿瓦洛治疗公司。版权所有。·哮喘已被证明是异质性的;嗜酸性粒细胞亚型有很多选择·NEA没有被批准的靶向治疗·光升高的有力科学依据被发现与肺功能(FEV1和FVC)、哮喘患者的痰中的肺功能(FEV1和FVC)负相关1-光在中性粒细胞高的患者中总体升高2-光升高与细胞浸润和Th1细胞因子水平增加以及非嗜酸性哮喘的肺功能降低有关32.Hastie AT等人。J变态反应,Clin,免疫。2010年;125(5):1028-1036。3.罗密欧·J等人。J变态反应,Clin,免疫。2013年;131(2个补充):AB203。摘要725。4.科瓦尔·K等人。J变态反应,Clin,免疫。2019年;143(2个补充):ab8。摘要23.以气道炎症为特征,缺乏嗜酸性粒细胞非嗜酸性哮喘(NEA)病理生理学

25©版权所有2022。阿瓦洛治疗公司。版权所有。关键的次要/探索性终点主要终点估计登记人数:n=80AVTX-0028毫克/公斤(最大600毫克)q4wks(n=40)AVTX-002用于治疗非嗜酸性哮喘(NEA)*LABA,长效β-激动剂;†ICS,吸入皮质类固醇;‡FEV1,1秒内用力呼气量;§ACQ,哮喘控制问卷。·加重时间·恶化患者的比例·FEV1ACQ较基线的变化·‡§较基线的变化·LABA(沙美特罗)和ICS†(氟替卡松)对哮喘控制不佳·既往1年内恶化·血嗜酸性粒细胞计数

26©版权所有2022。阿瓦洛治疗公司。版权所有。·在经过严格预处理的CD患者中显示的疗效信号支持对包括生物制剂在内的抗肿瘤坏死因子α治疗无效的IBD进行进一步评估·预计UC将在22年第三季度获得TOPLINE数据·CD和UC概念验证研究的数据为随后的中到重度难治性疾病患者的随机对照临床研究提供设计信息·新冠肺炎ARDS1和CD概念验证研究的阳性AVTX-002结果,除了NEA的生物标记物数据外,还支持新适应症的进一步临床开发·IND人类抗光单抗CERC-002减少住院新冠肺炎急性呼吸窘迫综合征患者(https://medrxiv.org/cgi/content/short/2021.04.03.21254748v1).的呼吸衰竭和死亡产品中的潜在渠道

27©版权所有2022。阿瓦洛治疗公司。版权所有。多发性骨髓瘤和斯蒂尔病(AOSD和sJIA)1b期抗IL-18单克隆抗体AVTX-007

28©版权所有2022。阿瓦洛治疗公司。版权所有。IL-18(%of f b as el in e)150 100 500·in-获得Medimmune/AstraZeneca的许可·有效和持久的IL-18抑制-在第一阶段SAD*中评估用于慢性阻塞性肺疾病†(n=31)-IV剂量10,30,100,300或1000毫克-良好耐受性良好的人类高亲和力抗IL-18单克隆抗体*SAD,单次递增剂量;†慢性阻塞性肺病,慢性阻塞性肺疾病。资料来源:数据存档,阿斯利康(AstraZeneca)。来自第一阶段研究的数据显示良好的药代动力学和安全性:1-10毫克静脉注射队列,2-30毫克静脉注射队列,3-100毫克静脉注射队列,4-300毫克静脉注射队列,3-1000毫克静脉注射安慰剂
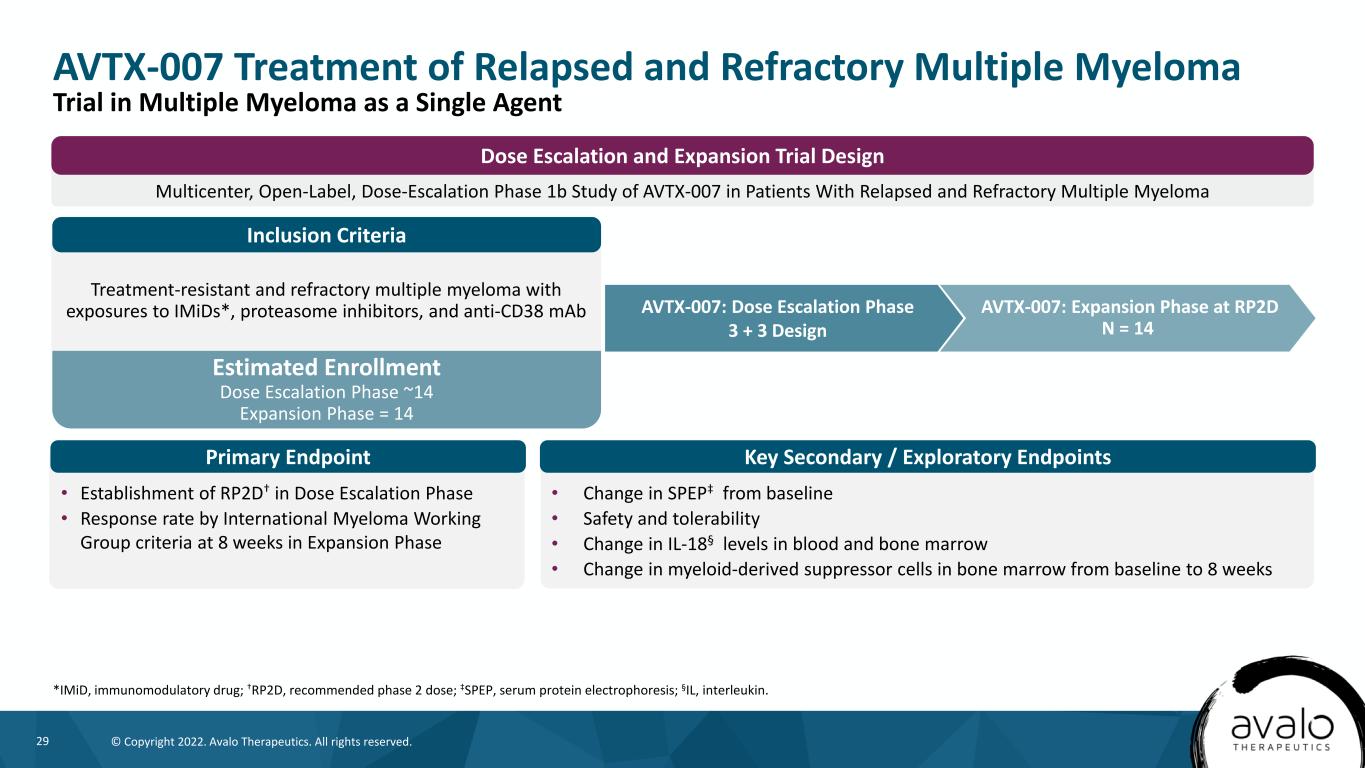
29©版权所有2022。阿瓦洛治疗公司。版权所有。估计登记剂量递增阶段~14扩大阶段=14多中心,开放标签,剂量递增阶段1b研究AVTX-007AVTX-007在复发和难治性多发性骨髓瘤患者中的剂量递增和扩大试验设计AVTX-007治疗复发和难治性多发性骨髓瘤*IMIDD,免疫调节药物;†RP2D,推荐2期剂量;‡SPEP,血清蛋白电泳;§IL,白细胞介素。AVTX-007:RP2DN=14的扩张期难治性和难治性多发性骨髓瘤,暴露于IMIDS*、蛋白酶体抑制剂和抗CD38mAb·在剂量递增阶段建立RP2D†·按国际骨髓瘤工作组标准在扩张期8周的应答率·SPEP‡从基线的变化·安全性和耐受性·IL-18§血液和骨髓中IL-18水平的变化·骨髓髓系抑制细胞从基线到8的变化

30©版权所有2022。阿瓦洛治疗公司。版权所有。·三组完成单药静脉注射(4 mg/kg、9 mg/kg和14 mg/kg)·14 mg/kg的高剂量队列(每名患者约1,000 mg)·接近完成的高剂量扩展阶段·可预测的PK和PD*·没有剂量限制毒性或与药物相关的†‡·在高剂量队列或扩展阶段未检测到疗效信号·良好的AE-SAE曲线有助于在AOSD§试验中将计划剂量降至1,000毫克·结束对多发性骨髓瘤的进一步评估·评估其他生物标记物驱动的适应症执行摘要:AVTX-007作为单一药物治疗复发性和难治性多发性骨髓瘤*PK,药代动力学;PD,药效学;†SAE,严重不良事件;‡AE,不良事件;§AOSD,成人起病的斯蒂尔病。

31©版权所有2022。阿瓦洛治疗公司。版权所有。·药代动力学-静脉滴注可预测的Tmax-评估的药物水平与剂量有关·药效学-血清总IL18水平在剂量后24小时迅速大幅下降-到第8天实现~90%的下降-PD效应通常在整个28天的过程中可见·待定的骨髓评估-血清IL18总水平-MDSC从基线AVTX-007开始的骨髓变化作为单一药物治疗耐药和难治性多发性骨髓瘤:PK和PD来源:文件中的数据

32©版权所有2022。阿瓦洛治疗公司。版权所有。·没有与药物相关的严重不良事件·实验室分析中没有发现安全信号AVTX-007将耐药和难治性多发性骨髓瘤作为单一药物治疗:不良事件概况良好的耐受性和可预测的14毫克/公斤(每名受试者约1000毫克)的PK和PD有助于降低AOSD临床试验建议剂量增加的风险来源:存档数据。受试者ID/剂量级别不良事件等级(最大值)受试者1/剂量级1流感样症状1受试者2/剂量级1流感样症状1受试者3/剂量级3疲劳1受试者4/剂量级3疲劳1受试者5/剂量级3皮疹1

33©版权所有2022。阿瓦洛治疗公司。版权所有。成人起病斯蒂尔病*IL,白细胞介素;†C反应蛋白,C反应蛋白;‡非甾体抗炎药。1.Clearview Healthcare Partner Analysis,2017年5月。2.Gerfaud-Valentin M等人。Autoimmun Rev.2014;13(7):708-722。3.库德拉·H等人(Kudela H et al.)BMC大黄醇。2019年;3:4.治疗方法·症状包括发烧、皮疹、咽炎、关节炎、肝病、铁蛋白升高·没有明确的遗传或感染原因·~40%患有严重的慢性疾病2·有相当一部分慢性AOSD患者尽管接受了治疗,但仍有进展性关节炎1·对快速有效治疗AOSD伴进行性关节破坏的需求很高1·此外,少数患者可能会出现严重症状,如巨噬细胞激活综合征1个患者群体·罕见疾病,估计美国确诊患病率为咽痛、皮疹和关节痛的症状和体征3活动期急性呼吸暂停综合征部分缓解期急性呼吸暂停综合征患者血清IL-18*水平显著升高缓解组CRP†>5组CRP†≤5组IL-18(p g/m L)1000000 100000 10000 100010010*预后比较
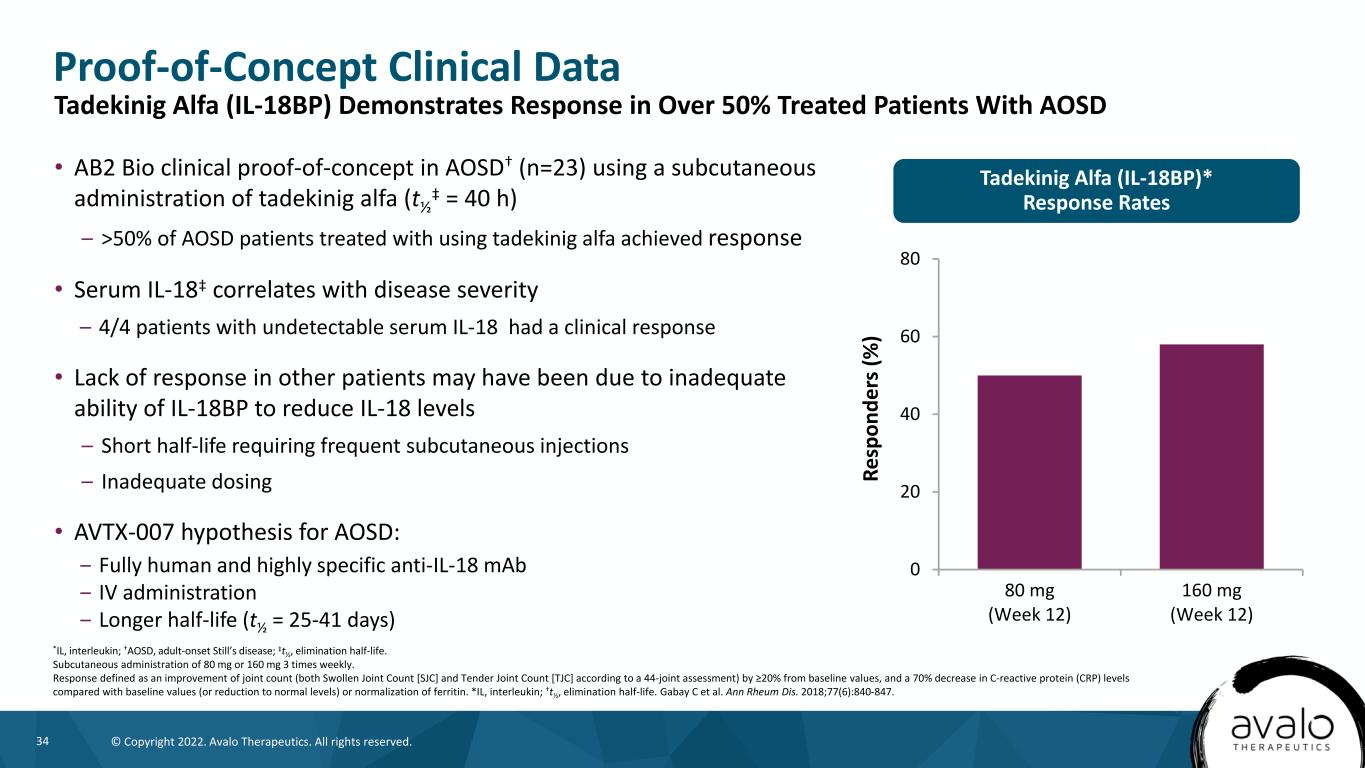
34©版权所有2022。阿瓦洛治疗公司。版权所有。概念验证临床数据*IL,白细胞介素;†AOSD,成人起病斯蒂尔病;‡,消除半衰期。皮下注射80毫克或160毫克,每周3次。响应定义为关节计数的改善(均为肿胀关节计数[澳门博彩股份有限公司]和投标联合计数[TJC]根据44项联合评估(根据≥的联合评估),与基准值(或降至正常水平)或铁蛋白正常化相比,C-反应蛋白水平下降了70%(或较基准值下降了20%),而与基准值(或降至正常水平)相比,C反应蛋白水平下降了70%。*IL,白细胞介素;†,消除半衰期。Gabay C等人。安·大黄·迪斯(Ann Rheum Dis.)2018年;77(6):840-847。0 20 40 60 80 80 mg(12周)16 0 mg(12周)Tadekinig Alfa(IL-18BP)*缓解率Tadekinig Alfa(IL-18BP)治疗的AOSD.AB2生物临床概念验证†(n=23)的有效率超过50%,使用Tadekinig Alfa皮下注射(tü‡=40h)->50%的AOSD患者接受治疗有临床反应·其他患者缺乏反应可能是由于IL-18BP降低IL-18水平的能力不足-需要频繁皮下注射的半衰期短-剂量不足·AOSD的AVTX-007假说:-全人和高度特异性的抗IL-18 mAb-IV给药-更长的半衰期(tü=25-41天)
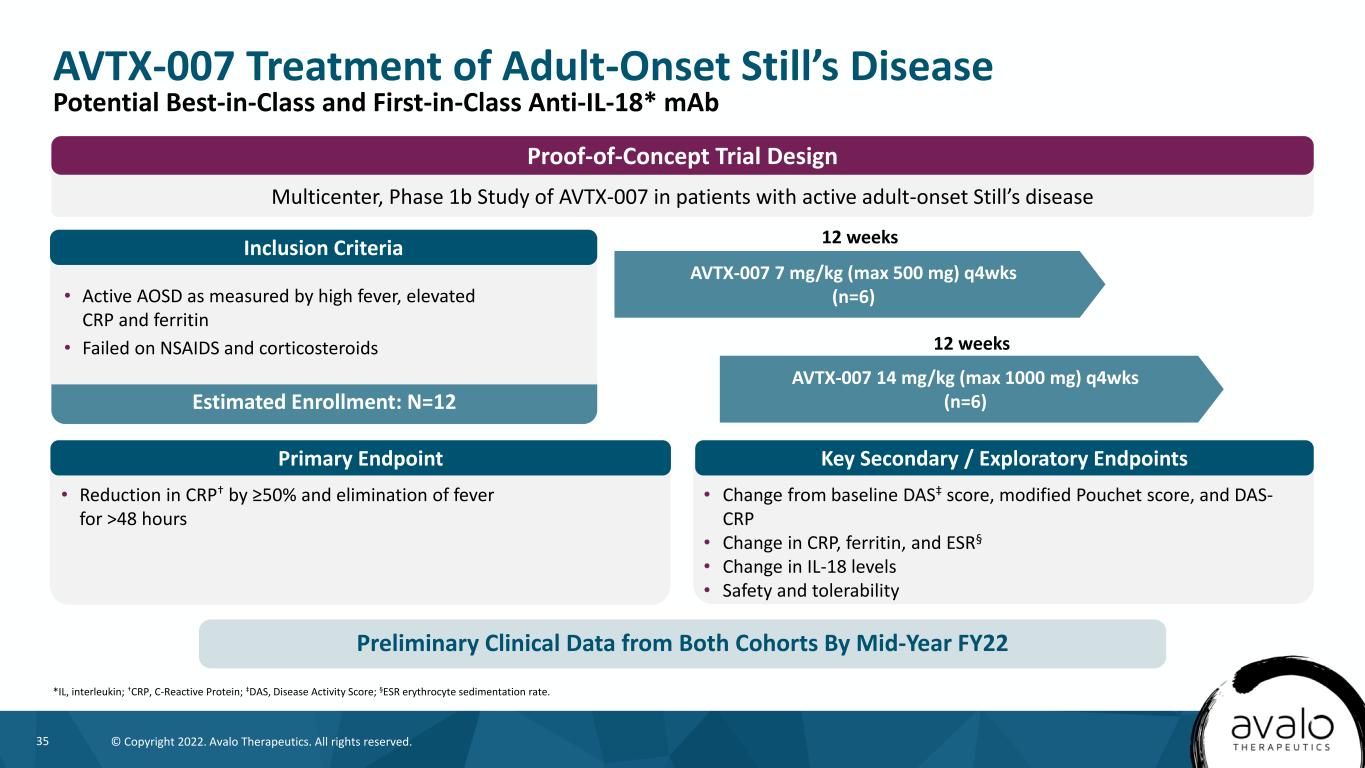
35©版权所有2022。阿瓦洛治疗公司。版权所有。关键的次要/探索性终点主要终点估计登记人数:n=12 AVTX-0077 mg/kg(最大500 mg)q4wks(n=6)AVTX-007治疗成人起病斯蒂尔病*IL,白细胞介素;†C反应蛋白,C反应蛋白;‡DAS,疾病活动性评分;§血沉。12周·crp†降低50%,退烧超过48小时·≥-‡评分、改良Pouchet评分和das-crp基线的变化·CRP、铁蛋白和血沉的变化§·IL-18水平的变化·安全性和耐受性·以高烧、升高的CRP和铁蛋白衡量的活动期AOSD·非甾体抗炎药和皮质类固醇AVTX-007治疗失败14 mg/kg(最大1000 mg),q4周(n=6)12周AVTX-007在活动期成人斯蒂尔病患者中的1b期研究--概念验证性试验设计纳入标准,截至22财年年中两组患者的初步临床数据
36©版权所有2022。阿瓦洛治疗公司。版权所有。AVTX-800S单糖治疗先天性糖基化异常AVTX-006治疗复杂淋巴管畸形罕见病

37©版权所有2022。阿瓦洛治疗公司。版权所有。单糖治疗先天性糖基化紊乱(CDGS)AVTX-800s

38©版权所有2022。阿瓦洛治疗公司。版权所有。先天性糖基化紊乱(CDGS):1.Wong等。珍妮特·梅德。2017;19(11):1226-1235。2.哈姆斯等人。[医]儿科学会(Acta Padiatr.)2002年;91(10):1065-1072。3.MarQuardt等人。血。1991年;94(12):3976-3985。·糖基化对于蛋白质结构和功能是必不可少的,特别是对循环蛋白和酶,如激素和凝血因子·目前已发现约150个CDG·由于基因突变,CDG患者缺乏合成功能性糖蛋白的能力·危及生命的多系统疾病:无法茁壮成长、发育迟缓、低张力、神经异常、肝病和凝血障碍·针对特定CDG的治疗剂量的特定单糖可以部分恢复受损的糖蛋白产生,从而产生有意义的临床益处-PGM1-治疗剂量单糖疗法恢复超罕见遗传病糖蛋白合成和功能

39©版权所有2022。阿瓦洛治疗公司。版权所有。白细胞粘附障碍(LAD)LAD-II(SLC35C1-CGD)病理生理学LAD II型:缺乏E-选择素唾液酸化Lewis X(SLC35C1突变)·3种不同类型的LAD CDG·II型(LAD-II),由SLC35C1基因功能丧失突变引起,导致E-选择素缺失唾液酸化Lewis X·无法将岩藻糖放在正常岩藻糖水平的蛋白质上诊断/评估·反复细菌感染孟买表型·面部畸形是常见的治疗方法·目前没有FDA批准的治疗方案·LAD II~10-20名患者在全球范围内流行·流式细胞术显示使用针对唾液酸路易斯X的mAb缺乏唾液酸路易斯X表达(CD15a)·白细胞增多·中性粒细胞功能测定·H抗原表达(药效学效应)疾病概述体征和症状AVTX-803是一种口服L-岩藻糖制剂,可补充关键代谢中间体以支持糖

40©版权所有2022。阿瓦洛治疗公司。版权所有。关键的次要/探索性终点主要终点AVTX-803(岩藻糖)用于治疗LAD II(SLC35C1-CDG)*100-300 mg/kg,最高可达5x/d(基于临床反应)。·唾液酸刘易斯X·白细胞功能分析·中性粒细胞水平·已知的SLC35C1突变·先前已知的对岩藻糖临床计划单中心、双盲(加开放标签扩展)AVTX-803在LAD II患者中的反应(SLC35C1-CDG)试验设计纳入标准预期试验启动1Q22 AVTX-803*+食品车辆开放标签扩展。AVTX-803*筛查/基线AVTX-803*+食品车辆随机化周期1至6周周期2至6周6个月

41©版权所有2022。阿瓦洛治疗公司。版权所有。AVTX-803(岩藻糖)用于治疗LAD II(SLC35C1-CDG)·正在进行22第一季度的首批患者登记;预计在22财年完成·主要终点将支持临床有意义的益处·NDA计划-毒理学完成-第一阶段PK和PD完成更新
42©版权所有2022。阿瓦洛治疗公司。版权所有。双mTORC 1/2小分子抑制剂治疗复杂淋巴管畸形AVTX-006
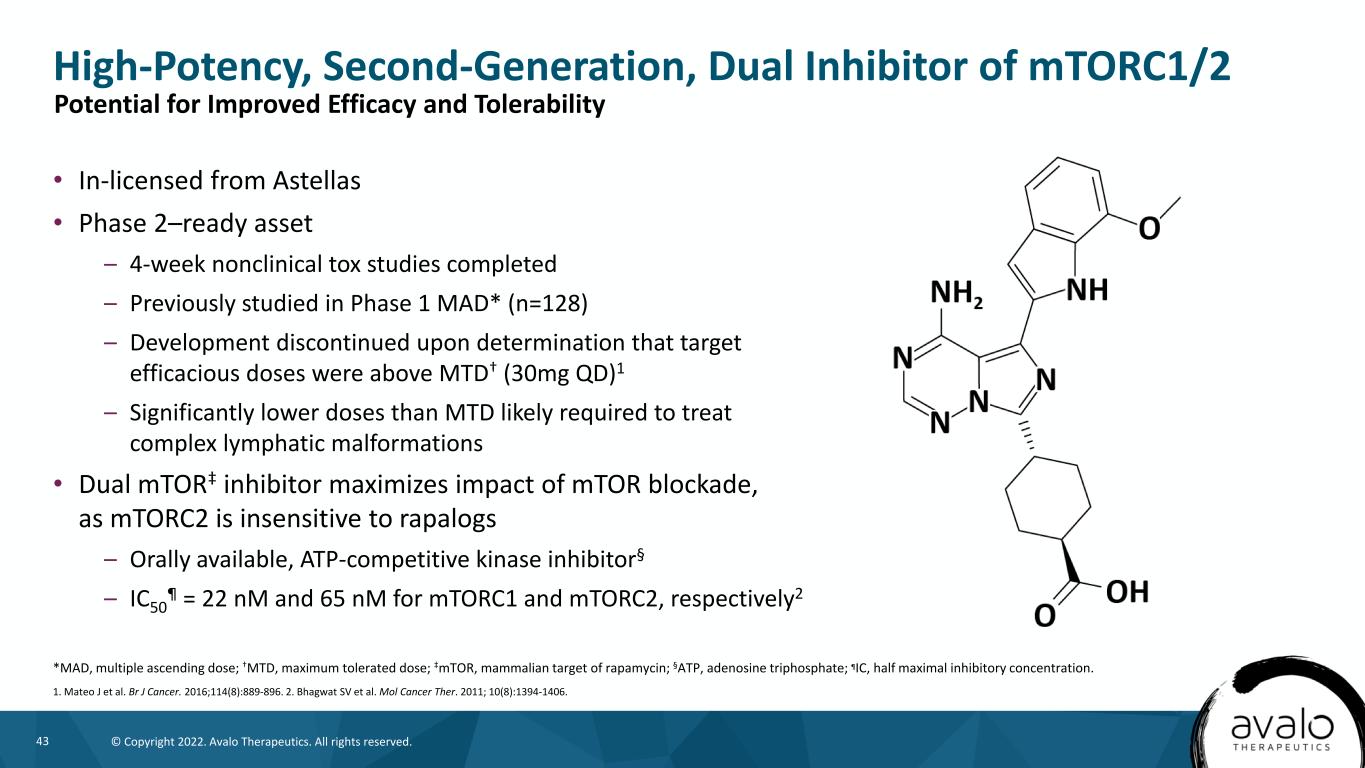
43©版权所有2022。阿瓦洛治疗公司。版权所有。·获得Astellas许可·第2期-READY ASSET-4周非临床毒性研究完成-之前在第1期MAD研究*(n=128)-在确定目标有效剂量超过MTd†(30 Mg Qd)1后停止开发-显著低于治疗复杂淋巴畸形所需的MTD剂量·双MTOR‡抑制剂最大化MTTOR阻断的影响,因为MTORC2对拉帕洛格口服可用、ATP竞争性激酶抑制剂§-IC50不敏感†MTD,最大耐受量;ATPmTOR,雷帕霉素的哺乳动物靶点;§‡,三磷酸腺苷;ÓIC,半数最大抑制浓度。1.马特奥·J等人(Mateo J et al.)BR J癌症。2016年;114(8):889-896。2.Bhagwat SV等人。摩尔癌症医生。2011;10(8):1394-1406。提高疗效和耐受性的潜力
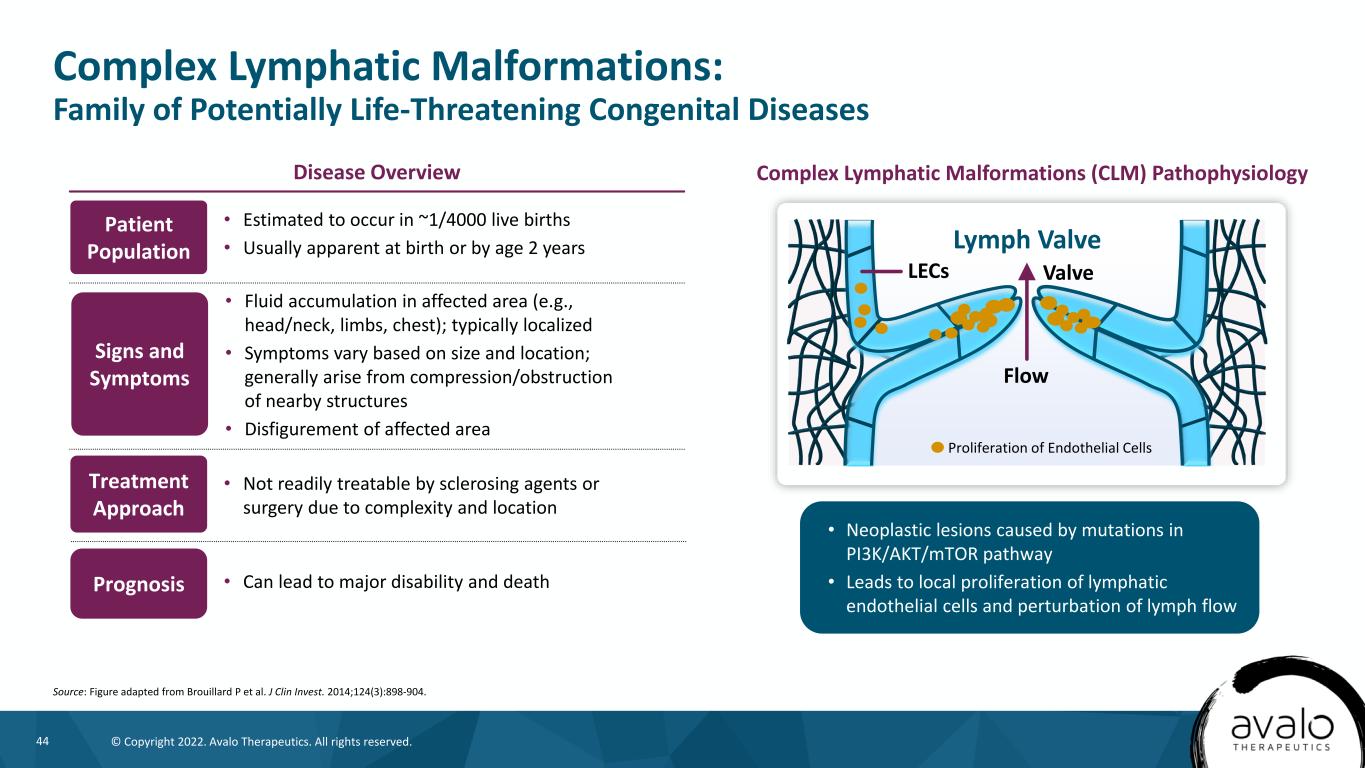
44©版权所有2022。阿瓦洛治疗公司。版权所有。复杂淋巴畸形:潜在威胁生命的先天性疾病家族来源:改编自Brouillard P等人的图。j Clin投资公司。2014年;124(3):898-904。流量阀LECs淋巴阀内皮细胞增殖·PI3K/AKT/mTOR通路突变引起的肿瘤性病变·导致淋巴管内皮细胞局部增殖和淋巴流动紊乱复杂淋巴管畸形(CLM)病理生理治疗方法·受影响区域(如头/颈、四肢、胸部)积液;典型的局限性·症状因大小和位置不同而不同;通常由附近结构的压迫/阻塞引起·受影响区域预后受损·可导致重大残疾和死亡病人·估计发生在约1/4000活产婴儿·通常在出生时或2岁时显现·由于复杂性和部位疾病概述体征和症状不容易用硬化剂或手术治疗

45©版权所有2022。阿瓦洛治疗公司。版权所有。开放标签临床研究支持疗效;使用受到耐受性问题和缺乏FDA批准的限制·II期试验纳入了患有复杂血管异常的患者-纳入了患有不同亚型淋巴畸形的患者,这些患者没有被以前的药物、硬化治疗和/或手术控制-西罗莫斯口服治疗12个疗程,每个疗程28天-在疗程6结束时57名患者的疗效可评估,在疗程12结束时53名患者可评估·安全性和耐受性概况导致依从性低,需要经常监测--医生报告说,西罗莫司导致口腔炎的发生率很高(约60%)--西罗莫司对免疫抑制和恶性肿瘤发出黑匣子警告,在标签外使用mTOR抑制剂西罗莫斯治疗淋巴管畸形。儿科。2016;137(2):e20153257。总反应6个月(n=57)12个月(n=53)2级或>AEs完全反应0血液/骨髓(50%)部分反应47(83%)45(85%)胃肠道(55%)进展性疾病7(12%)8(15%)代谢/实验室(20%)稳定性疾病3(5%)0感染(15%)

46©版权所有2022。阿瓦洛治疗公司。版权所有。关键的次级/探查终点初级终点估计入选:N=10例复杂淋巴畸形的AVTX-006治疗*PI3K,磷脂酰肌醇3-激酶;†AKT,蛋白激酶B.AVTX-006两个剂量组:每日2次,共4周,每次0.5毫克和1毫克·AVTX-006的安全性和耐受性·AVTX-006的PK和PD特征·临床信号利用生活质量和放射学评估的证据·临床和实验室安全性评估·选定的生物标记物18-31岁患有中到重度复杂淋巴畸形的成年人2022年年中1b期研究预期的一线数据设计纳入标准多中心,1b期研究

47©版权所有2022。阿瓦洛治疗公司。版权所有。仅供讨论之用,仅概述22财年公司目标和里程碑

48©版权所有2022。阿瓦洛治疗公司。版权所有。多个有意义的临床催化剂·AVTX-002 2022年第三季度UC队列数据,以帮助设计下一阶段的IBD开发计划·AVTX-002 2022年下半年80名患者第二阶段的NEA数据·AVTX-007两个队列在2022年年中的AOSD数据·AVTX-006复杂淋巴畸形2022年年中的数据·AVTX-803 LAD II(SLC35C1-CDG)2022年第三季度的数据
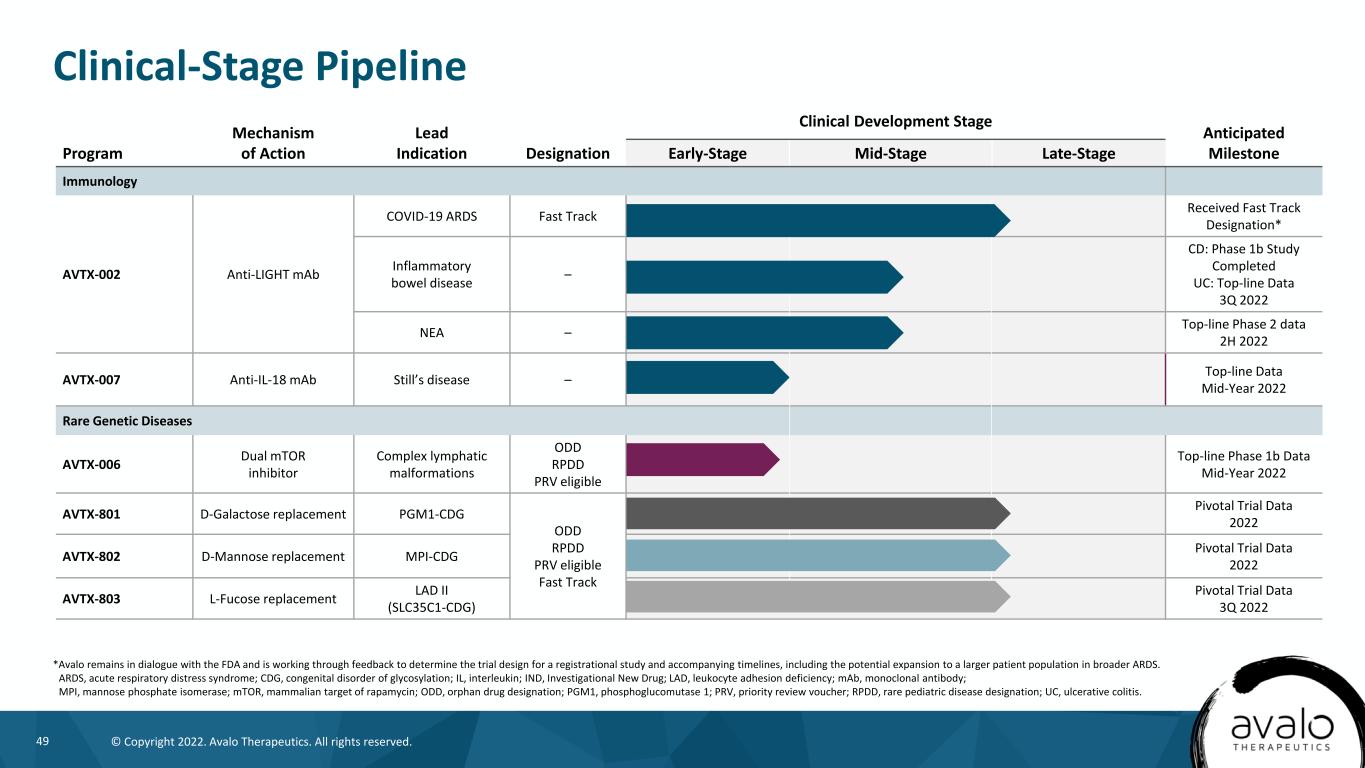
49©版权所有2022。阿瓦洛治疗公司。版权所有。临床阶段管道*Avalo仍在与FDA对话,并正在通过反馈确定注册研究的试验设计和伴随的时间表,包括在更广泛的ARDS中扩大到更大的患者群体的可能性。ARDS,急性呼吸窘迫综合征;CDG,先天性糖基化障碍;IL,白细胞介素;IND,研究新药;LAD,白细胞粘附缺陷;mAb,单克隆抗体;MPI,甘露糖磷酸异构酶;mTOR,雷帕霉素的哺乳动物靶点;ODD,孤儿药物名称;PGM1,磷酸葡萄糖变位酶1;PRV,优先审查凭证;RPDD,罕见的儿科疾病名称;UC,溃疡性结肠炎。行动机制先导适应症指定临床开发阶段预期里程碑早期、中期、晚期免疫学AVTX-002抗光mAb新冠肺炎ARDS快速通道获得快速通道称号*炎症性肠病-CD:1b期研究完成UC:一线数据2022年第三季度NEA-一线2期数据2H 2022AVTX-007抗IL-18mAb斯蒂尔病-2022年年中罕见遗传病AVTX-006双半乳糖替代PGM1-CDG奇数RPDD PRV合格快速通道关键试验数据2022 AVTX-802 D-甘露糖替代MPI-CDG关键试验数据2022 AVTX-803 L-岩藻糖替代LAD II(SLC35C1-CDG)关键试验数据2022第三季度

50©版权所有2022。阿瓦洛治疗公司。版权所有。纳斯达克:AVTX www.avaloTreateutics.com问答