
附件99.1


·本文档可能包括PharmaCyte Biotech的声明,这些声明构成了“前瞻性声明”。这类陈述的特点通常是“可能”、“相信”、“预期”或“预期”,并不反映事实。·前瞻性陈述涉及风险、不确定因素和其他因素,可能导致PharmaCyte及其子公司的实际结果、业绩或成就与此类前瞻性陈述明示或暗示的结果、业绩或成就大不相同。前瞻性陈述仅代表该陈述发表之日的情况。PharmaCyte不承担、也明确拒绝任何更新任何前瞻性陈述的义务。·可能影响前瞻性陈述和PharmaCyte业务的因素,一般包括但不限于:(I)PharmaCyte在提交给证券交易委员会的定期报告(可在www.sec.gov上查阅)中提出的风险因素、警示和其他陈述,以及(Ii)PharmaCyte目前无法确定或量化但未来可能存在的其他因素。2安全港声明和免责声明

·本陈述不应构成出售任何证券的要约或邀请购买任何证券的要约,也不得在任何州或司法管辖区出售此类证券,在任何州或司法管辖区,在根据任何此类州或司法管辖区的证券法注册或获得资格之前,此类要约、招揽或出售都是非法的。3安全港声明和免责声明(续)

微囊化转基因活细胞治疗疾病·癌症:O微囊化的细胞将前体药物从非活性状态转化为杀癌作用;O微囊化的细胞被植入肿瘤附近;低剂量的化疗前体药物被静脉注射。微囊化细胞充当人工肝,在肿瘤部位转化前体药物。我们相信,这项技术可产生最佳的细胞毒性效应,且几乎没有治疗相关副作用·糖尿病:O微囊化细胞可根据体内葡萄糖浓度产生、储存和释放胰岛素,并被植入微囊化细胞,用作生产胰岛素的人工胰腺。4癌症和糖尿病的平台技术
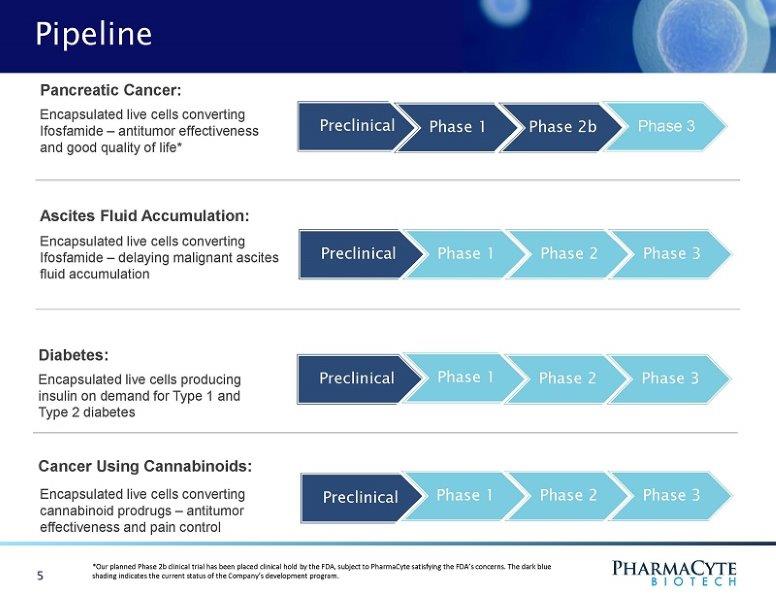
管道precli ni a l期1期2b期3期微囊化转化异环磷酰胺的活细胞-抗肿瘤效果和良好的生活质量*胰腺癌:临床前1期2期3期临床前1期2期3糖尿病:根据需要为1型和2型糖尿病产生胰岛素的微囊化活细胞1期临床前2期3期5使用大麻素的癌症:转化大麻素前体药物的微囊化活细胞-抗肿瘤效果和止痛腹水积聚:微囊化活细胞转化异环磷酰胺深蓝色阴影表示公司开发计划的当前状态。

Platform Technology 6实体肿瘤靶向化疗·使用Cellin-in-a-Box®包裹的活细胞+癌症前体药物异环磷酰胺·“正常剂量”的异环磷酰胺在治疗某些癌症方面显示出成功,但由于严重的毒性而不能以正常剂量使用·含有转基因活细胞的Cellin-in-a-Box®胶囊可产生一种酶,可将异环磷酰胺转化为杀癌形式,植入肿瘤附近的血液供应中·然后在肿瘤附近静脉注射异环磷酰胺异环磷酰胺在肿瘤部位转化。它通常在肝脏中转化·将Cell-in-a-Box®胶囊放置在肿瘤附近,使肿瘤部位产生最佳浓度的“杀癌”异环磷酰胺·异环磷酰胺的杀癌代谢产物半衰期短,我们认为这对身体其他器官或组织几乎没有附带损害·我们认为这大大缩小了肿瘤的大小,几乎没有治疗相关的副作用

Cellin-in-a-Box®胶囊7种独特的封装材料·胶囊由生物惰性材料(纤维素/棉花)制成·胶囊有用于营养和废物转移的孔隙·孔隙太小,免疫系统细胞无法进入或包裹活细胞离开胶囊·封装的活细胞可以长期冷冻(5年以上),当细胞解冻后,它们的存活率约为85%·物流可管理,保质期长·其他活细胞封装技术使用海藻酸盐等物质--所有这些都远没有那么稳健和稳定。不能冻结任何一个来运输封装的活细胞
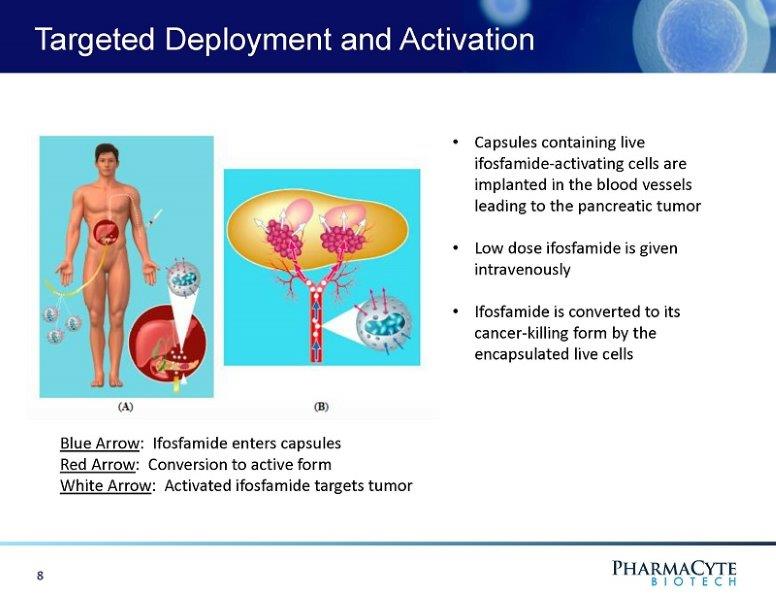
靶向部署和激活·含有异环磷酰胺激活细胞的胶囊植入导致胰腺肿瘤的血管·静脉注射低剂量异环磷酰胺·异环磷酰胺被包裹的活细胞转化为杀癌形式8蓝色箭头:异环磷酰胺进入胶囊红色箭头:转化为活性形式白色箭头:激活的异环磷酰胺靶向肿瘤

免疫系统细胞过大不能进入胶囊的作用机制含异环磷酰胺激活活细胞的单胶囊失活异环磷酰胺“前药”激活异环磷酰胺分子原位杀伤肿瘤9
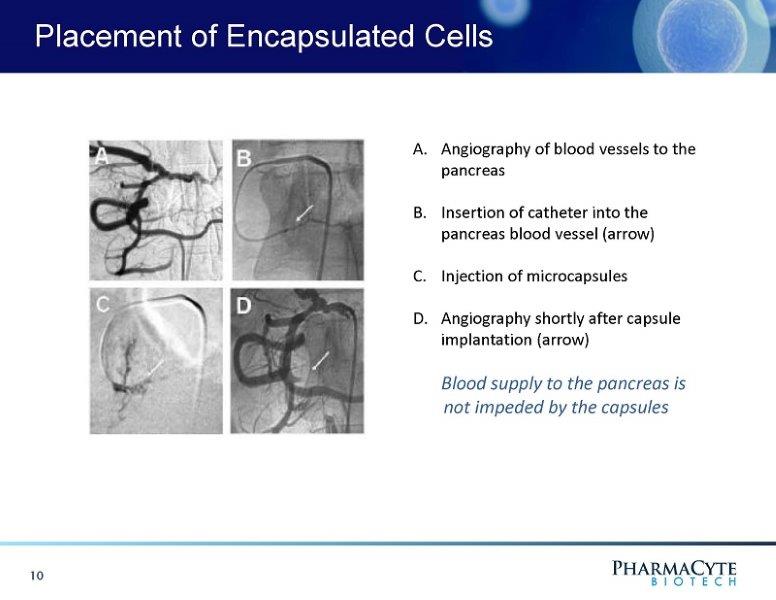
囊化细胞的放置A.胰腺血管的血管造影B.将导管插入胰腺血管(箭头)C.微囊的注射D.胶囊植入后不久的血管造影(箭头)对胰腺的血液供应不受胶囊10的阻碍

胰腺癌预后不良的侵袭性癌症·在大多数工业化国家呈上升趋势·西方世界癌症相关死亡的第三大原因·预计2021年胰腺癌患者:美国>60,430人;48,480人死亡·约80%在确诊的第一年内死亡·4期胰腺癌的五年存活率约为3%·确诊后10年的存活率约为2%·如果不接受治疗,胰腺癌患者还有3-6个月的生命·通常在癌症晚期和无法手术之前不能确诊·除非手术,否则无法治愈只有15%是可手术的·自从1996年第一种药物(吉西他滨)被批准用于胰腺癌以来,已经进行了大约40项关键的3期临床试验·中位生存期和1年存活率几乎没有改善·吉西他滨联合另一种化疗药物取得了最大的成功11

胰腺癌(CONT)12目前的一线疗法Abraxane®+吉西他滨·2013年9月FDA批准的联合疗法·与单独使用吉西他滨相比,中位生存期提高1.8个月·将一年存活率从使用Abraxane®+吉西他滨的22%提高到38%·Abraxane®+吉西他滨治疗的严重副作用FOLFIRINOX·4种药物的组合-亚叶酸、5-氟尿嘧啶、伊立替康从未获得市场批准·只能用于其他健康的患者·FOLFIRINOX疗法的严重副作用

使用我们的产品13候选1/2期临床试验和两个疗程的小剂量异环磷酰胺治疗胰腺癌(1998-1999)·14名患者只接受了两个疗程的异环磷酰胺治疗,剂量是通常用于治疗其他形式癌症的1/3(1g/m)·中位生存期:吉西他滨=5.7个月,Cellin-in-a-Box®+异环磷酰胺=10个月·一年存活率:吉西他滨=18%,Cellon-in-in吉西他滨=显著VS-in-a-a-Box®+异环磷酰胺=无2期临床试验,两个疗程的异环磷酰胺用量是异环磷酰胺的两倍(1999-2000)·13名晚期、不能手术的胰腺癌是在单臂、多部位治疗的(德国有3例[罗斯托克,柏林,慕尼黑],1在瑞士伯尔尼)研究。与1/2期试验唯一不同的是,异环磷酰胺的剂量增加了一倍,达到2g/m2,以获得更好的抗肿瘤效果·将异环磷酰胺的剂量加倍并不会导致更大的抗肿瘤效果,但会导致与治疗相关的副作用两项临床试验结果的总体比较·当与Cell-in-a-Box®胶囊联合使用时,异环磷酰胺应该以较低的剂量给予,以最大限度地发挥抗肿瘤作用并消除副作用

1/2期临床试验。14个试验设计和终点·晚期、不能手术的胰腺癌患者在德国罗斯托克的一个单一研究地点进行单臂(无对照臂)试验·可行性、安全性、耐受性和临床益处为终点·肿瘤对治疗的反应性由应答率、中位生存期和一年存活率确定·结果与吉西他滨的历史数据进行比较·吉西他滨是治疗前胰腺癌治疗的“金标准”,治疗前20周TU M OR

胰腺癌计划试验15解决严重的未得到满足的医疗需求·胰腺癌患者存在严重的未得到满足的医疗需求,这些患者的肿瘤处于局部晚期,非转移性和不可手术,但对Abraxane®+吉西他滨或FOLFIRINOX不再有效·一旦肿瘤对这些联合疗法不再有效,这些患者就没有有效的治疗选择·这些患者最常用的两种治疗方法是5-氟尿嘧啶(5-FU)或卡培他滨(5-FU的前体药物)化疗+放疗或单纯放疗·这两种疗法在治疗肿瘤方面都略微有效,并导致严重的副作用·这是我们计划的2b期临床试验的目标Abraxane®+吉西他滨或FOLFIRINOX,并解决这些胰腺癌患者未得到满足的医疗需求

试验设计16要素试验设计·设计:试验将是双臂的·地点:试验将在美国进行·目标:试验旨在证明Cell-in-a-Box®+小剂量异环磷酰胺可以作为一种有效而安全的巩固化疗,用于治疗4-6个月后对Abraxane®+吉西他滨或FOLFIRINOX无效的肿瘤患者·CRO管理:试验将由Medpace在美国进行·CRO职责:临床开发计划、计划临床管理和数据库开发·放射科医生职责:协调植入Cell-in-a-Box®胶囊和通过CT扫描衡量抗肿瘤疗效的所有措施·开始日期:试验预计在2022年第三季度开始,取决于FDA解除临床限制·资格:只有肿瘤局部晚期、不能手术和未转移的患者才有资格入选

试验设计(续)17·资格:患者必须接受Abraxane®+吉西他滨或FOLFORINOX 4-6个月的治疗,直到他们的肿瘤对该疗法不再有效或该疗法被拒绝·随机:100名患者将被随机分为两组。50名患者将接受PharmaCyte的胰腺癌候选治疗。其余50名患者将接受卡培他滨+体外放射治疗(EBRT)或单独接受立体定向全身放射治疗(SBRT)·PharmaCyte治疗组:接受PharmaCyte治疗的每个患者将接受一次300 Cell-in-a-Box®胶囊植入+多个疗程的低剂量异环磷酰胺,直到患者变得难治或出现不可接受的毒性水平·主要终点:从随机到疾病进展或死亡的无进展生存率

次要终点:·总存活率以从随机化到因任何原因死亡的时间来评估·客观应答率以完全缓解(CR)和部分缓解(PR)的综合发生率来评估·根据患者转为可切除(RO/R1)疾病的比例来评估从随机状态下不能手术到可手术治疗的转换·CA19-9生物标记物水平从筛查/基线到疼痛和疼痛治疗开始的时间的变化·在接受PharmaCycle治疗的同时评估患者的总体生活质量接受PharmaCyte治疗、体检和临床化验结果的患者血清抗体反应18项试验设计(续)

试验设计肿瘤学家带领专家开发治疗胰腺癌的疗法丹尼尔·D·冯·霍夫博士19岁曼努埃尔·伊达尔戈博士马蒂亚斯·勒尔博士

试验设计肿瘤学家(续)20丹尼尔·冯·霍夫博士·治疗胰腺癌药物开发的世界领先肿瘤学家·参与200多种抗癌和生物药物的临床试验·对过去20年美国批准的大多数抗癌药物进行早期临床试验·密切参与治疗胰腺癌的吉西他滨和阿布拉沙尼的临床开发·许多肿瘤学科学期刊的编辑;癌症相关活动的多项获奖者·梅奥诊所的医学教授, 翻译基因组研究所(TGen)主任医师兼杰出教授兼翻译药物开发(TD2)首席开发官曼努埃尔·伊达尔戈博士·国际知名的胰腺和其他癌症肿瘤学家和临床研究员·国际胰腺癌研究团队的联合创始人和主席·协助开发了30多种新型肿瘤学药物;几名胰腺癌患者·马德里西班牙国家癌症研究中心前临床开发主管、约翰·霍普金斯大学药物开发和胃肠肿瘤学联席主任·波士顿贝丝以色列女执事医学中心罗森伯格临床癌症中心前临床主任兼血液肿瘤科主任·血液和内科肿瘤科主任·威尔康奈尔医学和纽约长老会/威尔康奈尔医学中心马蒂亚斯·洛尔博士Cellin-in-a-Box®技术·PharmaCyte胰腺癌治疗先前临床试验的首席研究员·PharmaCyte医学和科学顾问委员会主席·现任瑞典著名的卡罗林斯卡研究所胃肠病和肝病学教授

试验准备21制造能力·GMP设施成功审核并被认为已准备好生产被称为“CypCapsΡ”的GMP临床试验产品·两次错开和背靠背的临床试验顺利完成·FDA要求“释放测试”完成并通过对CypCapsΡ的测试·3、6、9的稳定性研究成功和12个月的时间点·CypCapsΡ预计在需要试验准备时进入美国·与美国食品和药物管理局举行IND前会议(2017年1月)·美国食品和药物管理局确定了许多需要进行的测试和需要开发的数据,以支持成功提交IND·在ASCO年会上与美国/欧盟调查人员会面,以完善试验设计

·曼努埃尔·伊达尔戈(Manuel Hidalgo)博士被选为首席研究人员·方案和研究人员手册定稿,这取决于FDA的意见·保留实用临床以担任临床运营总监·Medpace被选为CRO进行试验。Medpace是全球排名前十的CRO之一,是一家提供全方位服务的CRO,在众多治疗领域拥有专业知识,专注于支持生物技术行业,特别是胰腺癌·准备好血管造影指南·准备好药房手册·供应商药品供应链和储存的选择流程已完成22项试验准备(续)

IND提交给FDA·IND于2020年9月1日向FDA提交,开始局部晚期、无法手术的胰腺癌(LAPC)的2b期临床试验·2020年10月1日,收到FDA已暂停IND临床试验的通知·2020年10月30日,FDA致函PharmaCyte,说明临床搁置的原因,并就我们必须采取哪些措施解除临床搁置提供具体指导·附录A中列出了PharmaCyte必须完成的解除临床搁置的项目清单·组建了一个科学和监管专家团队来解决FDA的担忧·团队正在努力完成FDA要求我们完成的项目清单。在处理这些研究和获取FDA要求的信息的不同阶段。我们的工作总结载于附录A 23研究新药申请

FDA批准胰腺癌治疗的孤儿药物名称·在FDA批准后在美国提供7年的市场独家经营权·EMA批准胰腺癌治疗的孤儿药物指定在欧盟提供10年的市场独家经营权·有资格获得生物制品价格竞争和创新法案·在FDA批准后在美国提供12年的市场独家经营权。欧盟的类似法律提供市场独占性IP组合和IP保护战略·在美国、澳大利亚和加拿大提交的专利申请,以保护将癌症前体药物转化为患者群体的基因工程细胞·使用封装的转基因人类细胞进行癌症治疗和糖尿病治疗的全球独家许可·专利保护Melligen细胞·预计将为每个候选产品申请后续专利·封装过程使用独特的受专利保护的硫酸纤维素·商业秘密和技术诀窍24孤儿药物状态和IP组合

恶性腹水积聚25治疗恶性腹水的靶向化疗·恶性腹水由腹部肿瘤分泌到腹部·含有可在腹部种植并形成新肿瘤的癌细胞·积聚在腹腔内导致腹部肿胀、严重呼吸困难和极度疼痛·必须定期切除-这是痛苦和昂贵的·没有可用的治疗方法阻止或延缓恶性腹水的产生和积聚·翻译药物开发公司(TD2)已经进行了8项临床前研究,以确定PharmaCyte的但这些结论很难确定地解释·PharmaCyte计划在德国进行另一项临床前研究,以确定TD2的结论是否有效·如果成功,计划寻求FDA的批准,在美国进行一项第一阶段研究。

治疗糖尿病的生物人工胰腺·PharmaCyte的糖尿病计划包括封装与患者血糖水平成比例产生胰岛素的转基因细胞(Melligen细胞和干细胞),然后将胶囊植入体内,以治疗1型糖尿病和胰岛素依赖型2型糖尿病·Cell-in-a-Box®胶囊保护细胞免受体内免疫系统的攻击,从而发挥“生物人工胰腺”的作用,以生产胰岛素·PharmaCyte拥有独一无二的世界Melligen细胞对体内葡萄糖浓度的反应储存和释放胰岛素已经证明有能力逆转免疫抑制的糖尿病小鼠的糖尿病状况26糖尿病计划

O过去,PharmaCyte的国际糖尿病联盟遇到了与Melligen细胞稳定性有关的困难。PharmaCyte随后花了两年时间重建稳定版本的Melligen细胞·UTS与PharmaCyte达成协议,创建新的、稳定的高级版本Melligen细胞·还将改进以增加Melligen细胞的胰岛素产量和生产的胰岛素的生物活性·糖尿病计划(CONT)27

大麻计划*大麻素的抗癌作用·大麻素的特性(THC和CBD):o抗增殖:缓慢的肿瘤生长o抗转移:缓慢的肿瘤扩散o抗血管生成:缓慢的血管穿透o促凋亡:启动程序性细胞死亡·体外和体内模型·大麻素的抗癌作用广泛:o肺、脑、甲状腺、淋巴瘤、肝、皮肤、胰腺、子宫、乳腺和前列腺·51项研究综述:“…”由于大麻类化合物能够调节对细胞生长和存活至关重要的细胞信号通路,因此可能对癌症的治疗有用。“*直到:(I)FDA允许我们在我们的IND中描述的LAPC中开始临床试验,FDA已经对其进行了临床搁置;以及(Ii)我们在计划中的LAPC 2b期临床试验中验证了Cell-in-a-Box®封装技术,在此之前,我们不会花费任何进一步的资源来开发这一计划。28

大麻计划(续)*大麻类“前药”生物工程细胞系由Cell-in-a-Box®封装,产生活化酶靶向治疗“活性”大麻素·癌细胞死亡靶向大麻素化疗·PharmaCyte全球许可将Cell-in-a-Box®技术与转基因细胞系结合使用,旨在激活大麻素分子用于治疗疾病及其相关症状·初始目标胶质母细胞瘤(脑癌)-一种难以治疗的癌症+*直到:(I)FDA允许我们在IND中描述的LAPC中开始临床试验,FDA已对其进行临床搁置;并且(Ii)我们在LAPC计划的2b期临床试验中验证了Cell-in-a-Box®封装技术,我们不会再花费任何资源来开发此程序。29=

与北科罗拉多大学的研究计划·最初的目标是开发鉴定、分离和定量大麻成分的方法,这些成分是需要激活的前体药物。大麻方案“这方面的重点是:o确认大麻素的抗癌活性;o开发一种能够将失活的大麻素前体药物转化为其杀癌形式的细胞。UTS现在已经对这样的细胞进行了基因工程·测试转染细胞将大麻素前体药物转化为有效的杀癌形式的效率·基于大麻素的靶向化疗将通过将生物工程细胞植入肿瘤附近并同时给予大麻素前体药物来完成*直到:(I)FDA允许我们在IND中描述的LAPC中开始一项临床试验,FDA已经对其进行了临床搁置;以及(Ii)我们验证了Cell-in-a-a-30大麻计划(续)

疼痛疗法的发展·与行动受限、阿片类药物依赖、焦虑、抑郁和生活质量下降有关的慢性疼痛·美国每年估计有5600亿美元的直接成本、生产力损失和残疾计划·大麻计划的其他目标是利用Cell-in-a-Box®平台提供大麻类终端产品,以提供慢性疼痛缓解计划。大麻计划(续)*31*直到:(I)FDA允许我们在我们的IND中描述的LAPC中开始临床试验,FDA已对其临床搁置;以及(Ii)我们在LAPC计划的2b期临床试验中验证了Cell-in-a-Box®封装技术,我们不会花费任何进一步的资源来开发这一技术

肯尼斯·L·瓦格纳,J.D.-首席执行官、总裁兼总法律顾问·在法律、管理、运营和商业方面拥有40多年的经验·Brobeck,Phleger and Harrison律师事务所的高级合伙人,该律师事务所是全球顶级律师事务所之一,为Chron,Amgen等生物技术客户提供服务,Biogen和IDEC·代表财富100强公司的大部分职业生涯·Gerald W.Crabtree博士-首席科学官·在癌症研究和抗癌药物开发的所有阶段拥有50多年的经验·特别是在抗癌药物的临床前研究和临床试验方面经验丰富·领导紫杉醇-百时美施贵宝(Bristol-Myers Squibb)价值数十亿美元的药物的临床前开发·JoséL.Iglesias博士-胰腺癌临床试验的首席医疗官·礼来公司(Eli Lilly)、安进(Amgen)、Abraxis和注册会计师-首席财务官·在财务、会计和管理方面有36年的经验·在过去的13年里,他一直担任私人持股、上市和跨国公司的首席财务官32个领导团队

医学和科学咨询委员会33 Matthias Löhr博士(主席)·瑞典斯德哥尔摩卡罗林斯卡研究所的一位世界知名的欧洲肿瘤学家/胃肠病学家。治疗胰腺癌和糖尿病的专家·曾担任PharmaCyte胰腺癌疗法1/2期和2期临床试验的首席研究员Manuel Hidalgo博士·国际知名的肿瘤学家和胰腺及其他癌症的临床研究员·国际胰腺癌研究团队的联合创始人和主席·协助开发30多种新型肿瘤学药物·威尔·康奈尔医学和纽约长老会医院血液和内科肿瘤科主任/奥地利·成就卓著的科学家的首席执行官,在科学期刊上发表了120多篇论文

Mark L.Rabe博士·使用大麻治疗疾病及其症状的领导者·曾担任加州最大的医生拥有的大麻评估中心网络的首席医疗官David A.Judd·在大岛生物公司工作了30多年的细胞生物学家,在我们的胰腺癌治疗中使用的细胞系具有特别的专业知识·在细胞培养介质中培养难以生长的细胞和解决细胞生长问题方面有数十年的经验34医学和科学顾问委员会(续

FDA指导解除临床搁置·提供更多测序数据和遗传稳定性研究·对CypCapsΡ和MCB细胞进行稳定性研究·评估给药装置(用于植入CypCapsΡ的预填充注射器和微导管)与我们的候选药物的兼容性·提供更多详细的制造过程说明·提供更多CypCapsΡ释放规格·展示第一代(CapCells®)和第二代(CypCapsΡ)候选药物之间的可比性,并确保两种候选药物之间具有足够和一致的产品性能和安全性交叉引用药物主文件中的制造和控制信息·进行另一项非临床研究,以评估CypCapsΡ35附录A的安全性、活性和分布

·修订调查人员手册,纳入针对临床搁置而进行的临床前研究,并删除任何没有数据支持的陈述·提供FDA要求的新的猪毒理学研究的数据,作为IND的修正案,我们将解决以下问题·提供PC3/2B1质粒的分析证书,其中包括纯度评估测试,安全性和有效性·对CypCaps填充过程进行资格研究,以确保候选药物在此过程中保持无菌和稳定·提交特定批次候选药物的最新批次分析,该批次将用于生产所有未来的候选药物·提供Resufin(CYP2B1)效力和PrestoBlue代谢分析方法的更多详细信息·提供几个符合我们血管造影程序手册中规范的常见微导管示例·澄清“药房手册”中有关正确使用注射器填充的语言动物研究中的CYP2B1蛋白以及在我们的试验人群中诱导自身免疫介导的毒性的可能性36附录A(续)

科学和监管专家团队组建了一个科学和监管专家团队来满足FDA的要求。努力完成FDA要求的项目。根据食品和药物管理局的要求,在解决研究和信息的不同阶段,成功地完成了为期3个月、6个月、9个月和12个月的CypCapsΡ稳定性研究。下一个时间点是18个月·设计并开始了食品和药物管理局要求的研究,包括(I)用于生产CypCapsΡ的母细胞库细胞的稳定性研究;(Ii)CypCapsΡ中CYP2B1基因编码的DNA序列分析;以及(Iii)将母细胞库细胞填充到准备生产CypCapsΡ的小瓶中的重复性和质量·设计并在某些情况下开始了生物相容性研究:(I)急性系统毒性研究;(Ii)AMES测试[遗传毒性细菌和逆转突变试验;(Iii)亚慢性和慢性研究;(Iv)皮肤致敏研究;(V)补体活化试验;(Vi)皮内试验;(Vii)溶血试验;(Viii)体外细胞毒性试验;(Ix)体内微核试验37附录A(续)

·奥地利诺瓦公司制造并向进行生物相容性研究的实验室运送了400支空胶囊注射器·设计并开始了旨在证明CypCapsΡ不受介入放射科医生用于输送CypCapsΡ的导管或在植入CypCapsΡ期间用于显示血管的造影剂的不利影响的研究·设计并开始了研究,以证明临床试验产品在输送和使用过程中有多么坚固,并证明用于输送CypCapsΡ的注射器可以持续、平稳和安全地输送·与我们的研究一起设计并开始了研究,以证明用于输送CypCapsΡ的注射器可以持续、平稳和安全地输送·与我们的合作伙伴一起设计并开始研究,以证明用于输送CypCapsΡ的注射器能够持续、平稳和安全地输送包括自上次在欧洲进行临床试验以来在CypCapsΡ38附录A(续)的重复性和安全性方面对活细胞包裹产品所做改进的信息

·在更新我们的IND提交文件的过程中,包括:(I)更多临床前数据;(Ii)CypCapsΡ释放的额外参数;(Iii)推荐用于输送CypCapsΡ的导管和造影剂;以及讨论针对CYP2B1蛋白的细胞和体液免疫反应的可能性以及在我们的临床试验人群中诱导自身免疫介导的毒性的可能性·设计了一项简短的猪研究,以解决生物相容性和长期植入胶囊的影响·

如需更多信息,请联系投资者关系部(InvestorRelations@PharmaCyte.com)谢谢投资者关系部40