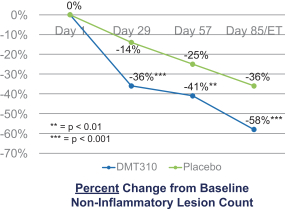
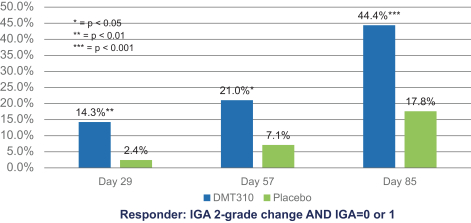
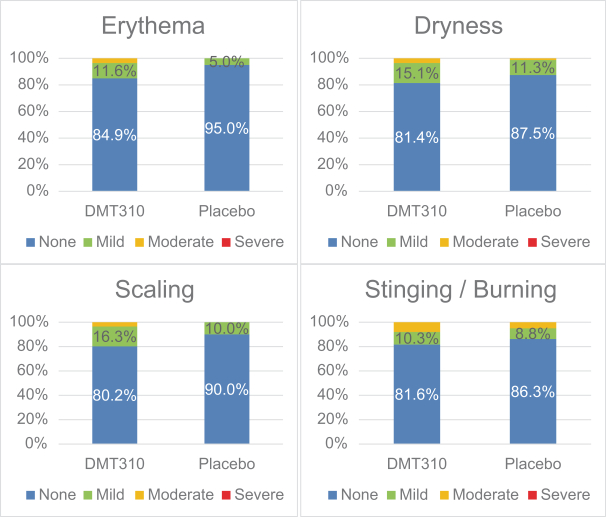
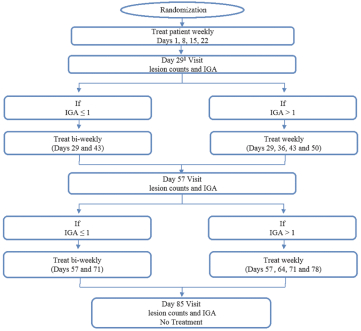
依据第424(B)(4)条提交
注册号码333-256997
注册号码333-258772
2,571,428个单位,包括
2,571,428股普通股和
认股权证将购买最多2,571,428股普通股

皮玛塔治疗公司(Dermata Treateutics,Inc.)
Dermata Treateutics,Inc.正在发售单位,每个单位包括一股我们的普通股和一个认股权证,用于在首次公开募股(IPO)中购买一股我们的普通股,或每个认股权证。我们的普通股或组成这些单位的认股权证目前还没有公开市场。这些单位没有独立权利,也不会作为独立证券进行认证或发行 。普通股和认股权证可以立即分开,并将在此次发行中单独发行。本公司发行的每份认股权证于发行日起立即行使,行使价为每股普通股7.00美元,自发行之日起5年期满。
我们的普通股和权证将分别在纳斯达克资本市场(Nasdaq Capital Market)或纳斯达克(Nasdaq)交易,代码分别为DRMA和DRMAW。
根据2012年的Jumpstart Our Business Startups Act 或JOBS Act,我们是一家新兴的成长型公司,因此,我们已选择遵守本招股说明书和未来备案文件中某些降低的上市公司报告要求。
投资我们的证券 具有高度的投机性和高度的风险。请参见?风险因素?从本招股说明书的第12页开始,讨论在投资我们的证券时应考虑的信息 。
美国证券交易委员会(Securities And Exchange Commission)和任何州证券委员会都没有批准或不批准这些证券,也没有就本招股说明书的准确性或充分性发表意见。任何相反的陈述都是刑事犯罪。
| 人均 单位 |
总计 | |||||||
| 首次公开发行(IPO)价格 |
$ | 7.00 | $ | 17,999,996 | ||||
| 承保折扣和佣金(1) |
$ | 0.56 | $ | 1,440,000 | ||||
| 未扣除费用的收益给我们 |
$ | 6.44 | $ | 16,559,996 | ||||
| (1) | 不包括保险人某些费用的报销。我们建议您访问 \f25 \f25包销?从第151页开始,了解有关承销商赔偿的更多信息。 |
我们已 授予承销商代表可在本招股说明书发布之日起45天内行使的选择权,可按每股6.99美元的价格向我们额外购买最多385,714股普通股和/或最多额外 385,714股认股权证,以购买最多385,714股普通股,每份认股权证的价格为0.01美元,每种情况下均减去承销折扣和佣金,以弥补超额配售(如果有)。如果承销商代表全面行使选择权,则应支付的承保折扣和佣金总额为1,656,000美元,扣除费用前给我们的总收益为19,043,994美元。
我们的某些现有股东及其附属实体与我们的创始人兼首席执行官以及我们的某些现任 董事(包括Proehl Investment Ventures,LLC和Hale BioPharma Ventures,LLC)在此次发行中以首次公开募股(IPO)价格购买了总计约125万美元的单位。承销商将 从这些股东购买的任何单位获得与他们在此次发行中向公众出售的任何其他单位相同的承销折扣和佣金。
承销商预计在2021年8月17日左右交付组成这些单位的证券。
| 唯一图书运行经理 Maxim Group LLC |
| 联席经理 布鲁克林资本市场 阿卡迪亚证券有限责任公司的一个部门 |
本招股说明书的日期为2021年8月12日。