
展覽 99.2 BROADWAY 頂層結果 2024年12月10日

免責聲明 本演示文稿(連同與之相關的口頭陳述,稱爲「演示文稿」)僅用於信息目的。本演示文稿不構成任何證券的銷售要約或買入要約的請求,也不會在任何此類要約、請求或銷售爲非法的州或司法管轄區內銷售任何證券。前瞻性聲明 在本演示文稿中包含的某些陳述並非歷史事實,而是根據1995年美國私人證券訴訟改革法的安全港條款而作出的前瞻性聲明。前瞻性聲明通常伴隨有「相信」、「可能」、「將」、「估計」、「繼續」、「期待」、「打算」、「期望」、「應該」、「會」、「計劃」、「預測」、「潛在」、「似乎」、「尋求」、「未來」、「前景」和類似表達,這些表達預測或指示未來事件或趨勢,或者並非歷史事項的陳述。這些前瞻性聲明包括但不限於,新阿姆斯特丹製藥公司(「新阿姆斯特丹」或「公司」)關於公司對未來MACE收益的預期,對公司正在進行的PREVAIL試驗的預期結果,以及公司對BROADWAY頂層數據不同利益相關者反應的預期等其他非歷史事實的陳述。這些陳述基於各種假設,無論是否在本演示文稿中列出,並基於公司管理層的當前預期,並非對實際表現的預測。這些前瞻性聲明僅供說明目的,並不打算作爲,也不得被視爲保證、確保、預測或確定的事實或概率聲明。實際事件和情況很難或不可能預測,並可能與假設不同。許多實際事件和情況超出了公司的控制範圍。這些前瞻性聲明面臨許多風險和不確定性,包括國內和外國商業、市場、金融、政治和法律條件的變化;與新阿姆斯特丹產品候選人的批准及預計的監管和商業里程碑的時間相關的風險;特定臨床試驗的頂層、初步或初步結果是否會預測該試驗的最終結果,以及早期臨床試驗的結果是否會反映後期臨床試驗的結果,或者預測臨床結果是否會反映未來臨床試驗或臨床使用中我們產品候選人的實際結果(如獲得批准);與潛在客戶談判確定合同安排的能力;競爭產品候選人的影響;獲得足夠原材料供應的能力;全球經濟和政治條件,包括俄羅斯-烏克蘭衝突以及以色列戰爭;競爭對新阿姆斯特丹未來業務的影響;以及在公司截至2023年12月31日的年度報告表格10-k中討論的因素,另有其他文件由公司向SEC提交與此補充。與新阿姆斯特丹業務相關的其他風險包括但不限於:對公司正在進行的臨床試驗結果的不確定性,特別是與其產品候選人的監管審查和潛在批准相關的風險;與公司努力推向市場的產品候選人相關的風險;公司在能夠達成有利條款的確定協議方面的能力,如果有的話;競爭產品候選人對公司業務的影響;與知識產權相關的索賠;公司吸引和留住合格人員的能力;以及公司繼續爲其產品候選人獲取原材料的能力,隨着公司不時向美國證券交易委員會提交的文件中描述的風險。如果這些風險中的任何一個發生,或者新阿姆斯特丹的假設證明不正確,則實際結果可能與這些前瞻性聲明暗示的結果存在重大差異。可能還有公司目前未知的額外風險,或者新阿姆斯特丹當前認爲微不足道的風險,這些風險也可能導致實際結果與前瞻性聲明中包含的結果不同。此外,前瞻性聲明反映了新阿姆斯特丹的預期、計劃或對未來事件的預測,以及在本演示文稿日期時的觀點,並完全符合此處的警示聲明。新阿姆斯特丹預計後續事件和發展將導致公司的評估發生變化。這些前瞻性聲明不應被視爲代表新阿姆斯特丹在本演示文稿日期之後的任何日期的評估。因此,過度依賴這些前瞻性聲明是不應當的。新阿姆斯特丹及其任何附屬公司沒有義務更新這些前瞻性聲明,除非法律要求。市場數據 本演示文稿中包含的某些信息與或基於第三方研究、出版物、調查和新阿姆斯特丹自身的內部估算和研究。此外,本演示文稿中包含的所有市場數據涉及許多假設和侷限性,因此不能保證這些假設的準確性或可靠性。最後,雖然新阿姆斯特丹認爲其內部研究是可靠的,但該研究未經過任何獨立來源的驗證,新阿姆斯特丹不能保證並且不表示或保證其準確性和完整性。商標 本演示文稿包含新阿姆斯特丹及其他公司的商標、服務標記、商號和版權,均爲其各自所有者的財產。本演示文稿中使用或展示第三方的商標、服務標記、商號或產品並不旨在且不暗示與新阿姆斯特丹的關係,或由新阿姆斯特丹的支持或贊助。僅爲方便起見,本演示文稿中提及的商標、服務標記和商號可能帶有Tm或Sm符號,但此類引用並不意在表明新阿姆斯特丹將在適用法律允許的最大範圍內主張其權利或適用許可方對這些商標、服務標記和商號的權利。
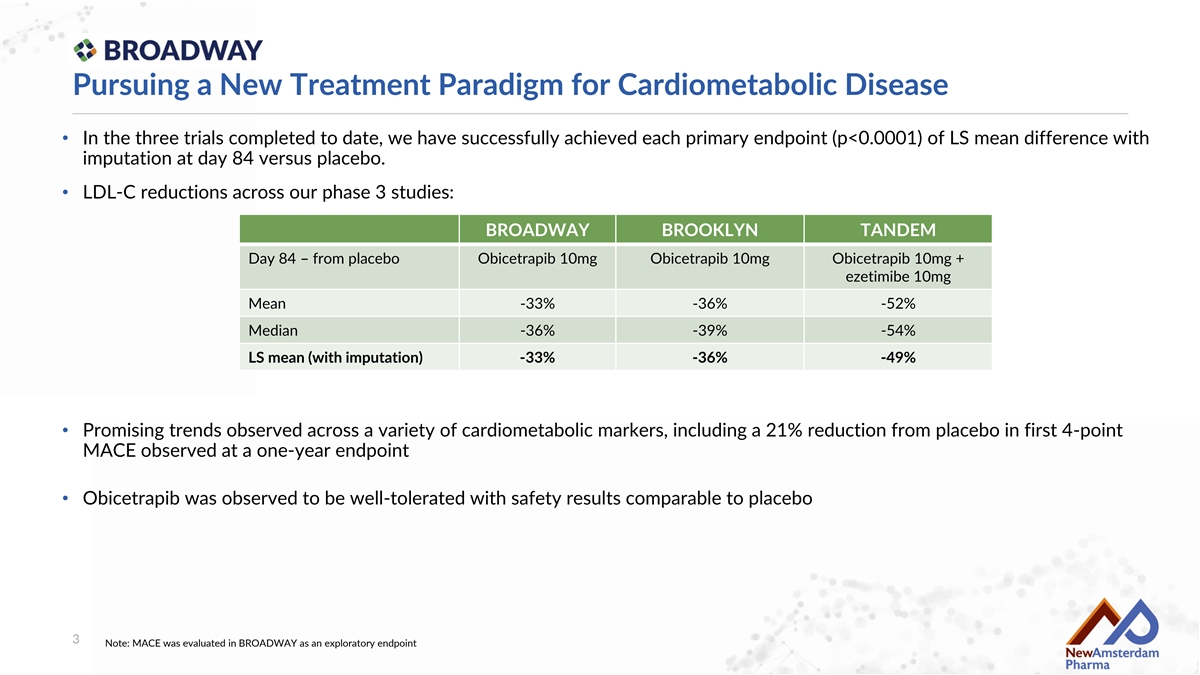
Pursuing a New Treatment Paradigm for Cardiometabolic Disease • In the three trials completed to date, we have successfully achieved each primary endpoint (p<0.0001) of LS mean difference with imputation at day 84 versus placebo. • LDL-C reductions across our phase 3 studies: BROADWAY BROOKLYN TANDEm Day 84 – from placebo Obicetrapib 10mg Obicetrapib 10mg Obicetrapib 10mg + ezetimibe 10mg Mean -33% -36% -52% Median -36% -39% -54% LS mean (with imputation) -33% -36% -49% • Promising trends observed across a variety of cardiometabolic markers, including a 21% reduction from placebo in first 4-point MACE observed at a one-year endpoint • Obicetrapib was observed to be well-tolerated with safety results comparable to placebo 3 Note: MACE was evaluated in BROADWAY as an exploratory endpoint
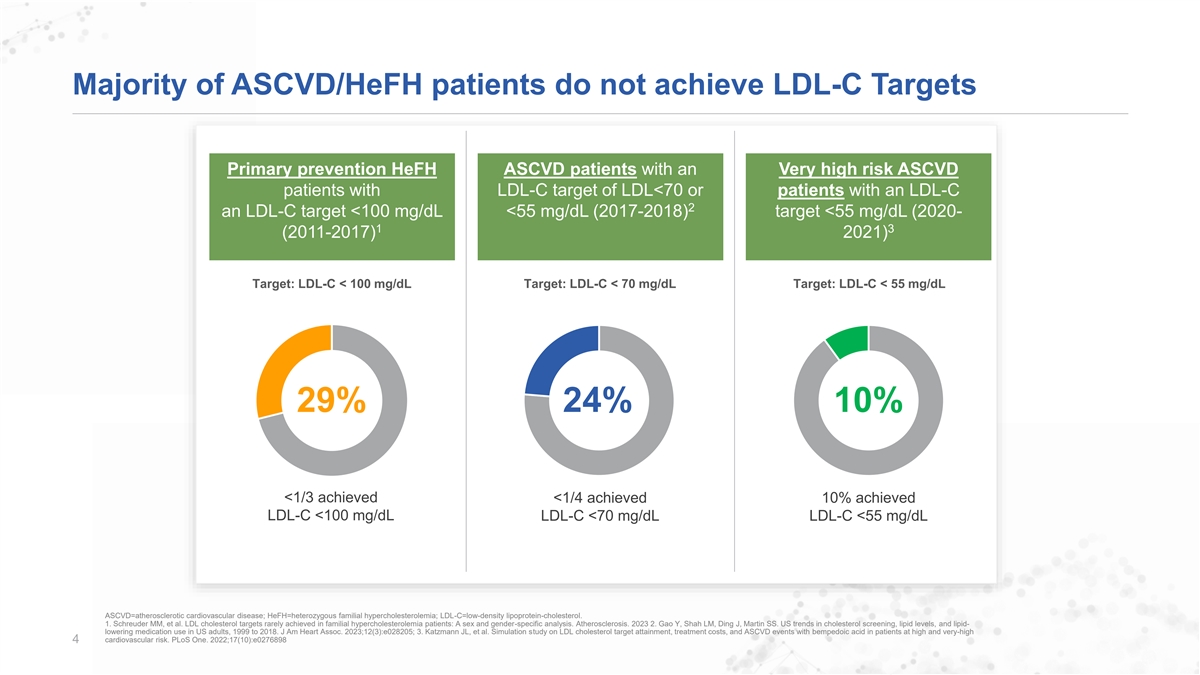
Majority of ASCVD/HeFH patients do not achieve LDL-C Targets Primary prevention HeFH ASCVD patients with an Very high risk ASCVD patients with LDL-C target of LDL<70 or patients with an LDL-C 2 an LDL-C target <100 mg/dL <55 mg/dL (2017-2018) target <55 mg/dL (2020- 1 3 (2011-2017) 2021) Target: LDL-C < 100 mg/dL Target: LDL-C < 70 mg/dL Target: LDL-C < 55 mg/dL 29% 24% 10% <1/3 achieved <1/4 achieved 10% achieved LDL-C <100 mg/dL LDL-C <70 mg/dL LDL-C <55 mg/dL ASCVD=atherosclerotic cardiovascular disease; HeFH=heterozygous familial hypercholesterolemia; LDL-C=low-density lipoprotein-cholesterol. 1. Schreuder Mm, et al. LDL cholesterol targets rarely achieved in familial hypercholesterolemia patients: A sex and gender-specific analysis. Atherosclerosis. 2023 2. Gao Y, Shah Lm, Ding J, Martin SS. US trends in cholesterol screening, lipid levels, and lipid- lowering medication use in US adults, 1999 to 2018. J Am Heart Assoc. 2023;12(3):e028205; 3. Katzmann JL, et al. Simulation study on LDL cholesterol target attainment, treatment costs, and ASCVD events with bempedoic acid in patients at high and very-high cardiovascular risk. PLoS One. 2022;17(10):e0276898 4
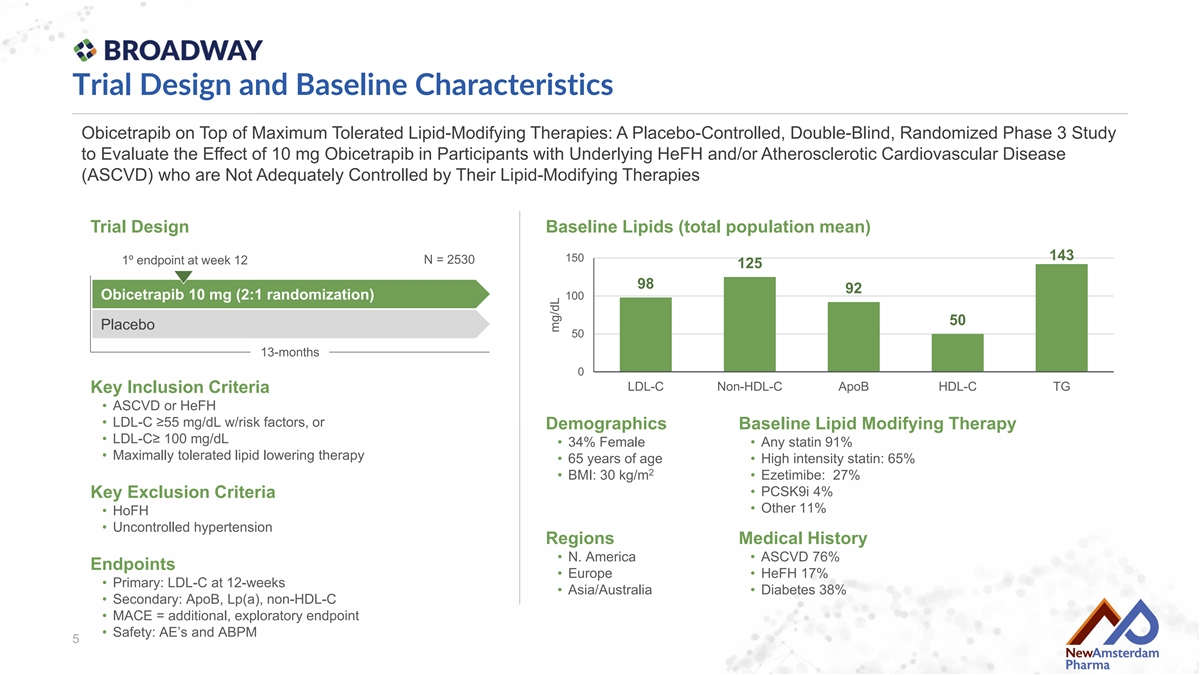
Trial Design and Baseline Characteristics Obicetrapib on Top of Maximum Tolerated Lipid-Modifying Therapies: A Placebo-Controlled, Double-Blind, Randomized Phase 3 Study to Evaluate the Effect of 10 mg Obicetrapib in Participants with Underlying HeFH and/or Atherosclerotic Cardiovascular Disease (ASCVD) who are Not Adequately Controlled by Their Lipid-Modifying Therapies Trial Design Baseline Lipids (total population mean) 143 150 N = 2530 1º endpoint at week 12 125 98 92 Obicetrapib 10 mg (2:1 randomization) 100 50 Placebo 50 13-months 0 LDL-C Non-HDL-C Apob HDL-C TG Key Inclusion Criteria • ASCVD or HeFH • LDL-C ≥55 mg/dL w/risk factors, or Demographics Baseline Lipid Modifying Therapy • LDL-C≥ 100 mg/dL • 34% Female • Any statin 91% • Maximally tolerated lipid lowering therapy • 65 years of age • High intensity statin: 65% 2 • BMI: 30 kg/m • Ezetimibe: 27% • PCSK9i 4% Key Exclusion Criteria • Other 11% • HoFH • Uncontrolled hypertension Regions Medical History • N. America • ASCVD 76% Endpoints • Europe • HeFH 17% • Primary: LDL-C at 12-weeks • Asia/Australia • Diabetes 38% • Secondary: Apob, Lp(a), non-HDL-C • MACE = additional, exploratory endpoint • Safety: AE’s and ABPm 5 mg/dL
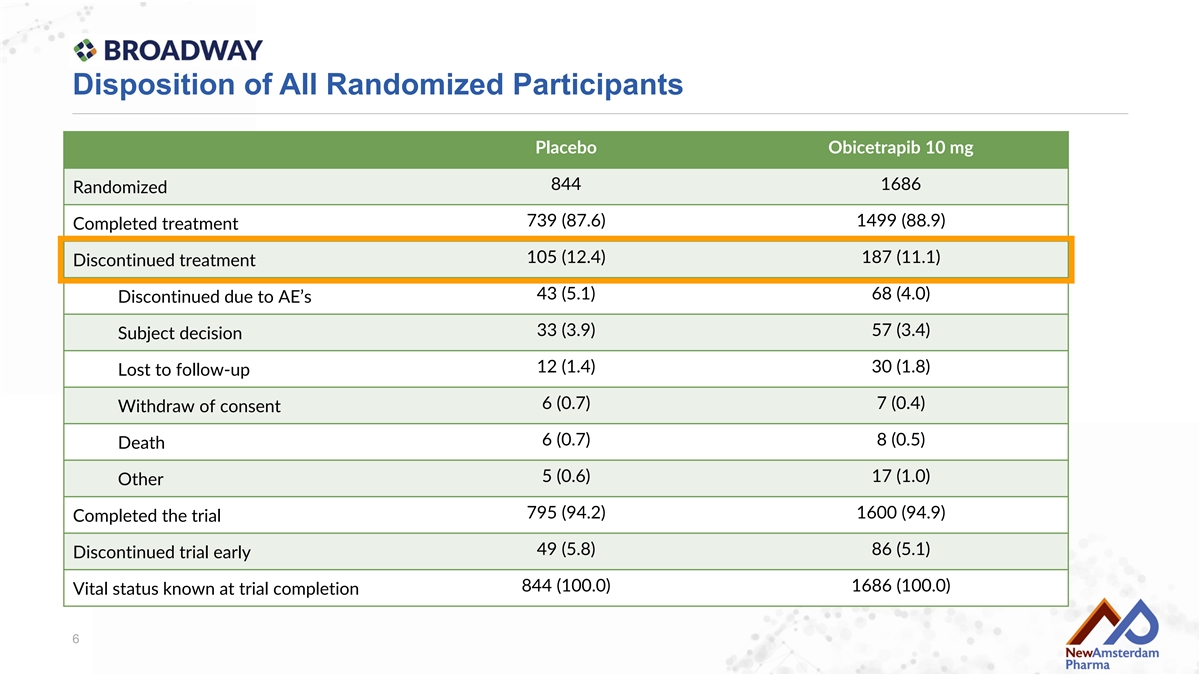
所有隨機參與者的處置 安慰劑 Obicetrapib 10 mg 844 1686 隨機分配 739 (87.6) 1499 (88.9) 完成本次治療 105 (12.4) 187 (11.1) 停止治療 43 (5.1) 68 (4.0) 因不良事件停止 33 (3.9) 57 (3.4) 受試者決定 12 (1.4) 30 (1.8) 丟失隨訪 6 (0.7) 7 (0.4) 撤回同意 6 (0.7) 8 (0.5) 死亡 5 (0.6) 17 (1.0) 其他 795 (94.2) 1600 (94.9) 完成試驗 49 (5.8) 86 (5.1) 早期停止試驗 844 (100.0) 1686 (100.0) 試驗結束時已知生命狀態 6
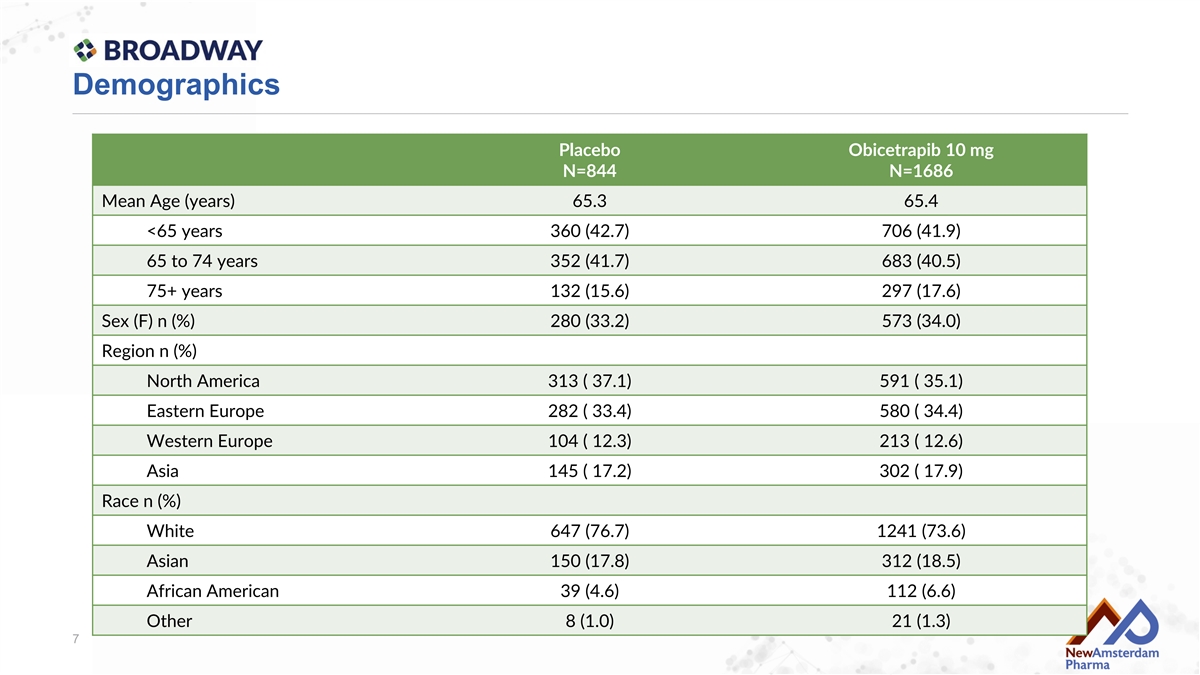
人口統計 安慰劑 Obicetrapib 10 mg N=844 N=1686 平均年齡(歲) 65.3 65.4 <65歲 360 (42.7) 706 (41.9) 65到74歲 352 (41.7) 683 (40.5) 75+歲 132 (15.6) 297 (17.6) 性別(F) n (%) 280 (33.2) 573 (34.0) 地域 n (%) 北美 313 ( 37.1) 591 ( 35.1) 東歐 282 ( 33.4) 580 ( 34.4) 西歐 104 ( 12.3) 213 ( 12.6) 亞洲 145 ( 17.2) 302 ( 17.9) 種族 n (%) 白人 647 (76.7) 1241 (73.6) 亞裔 150 (17.8) 312 (18.5) 非裔美國人 39 (4.6) 112 (6.6) 其他 8 (1.0) 21 (1.3)
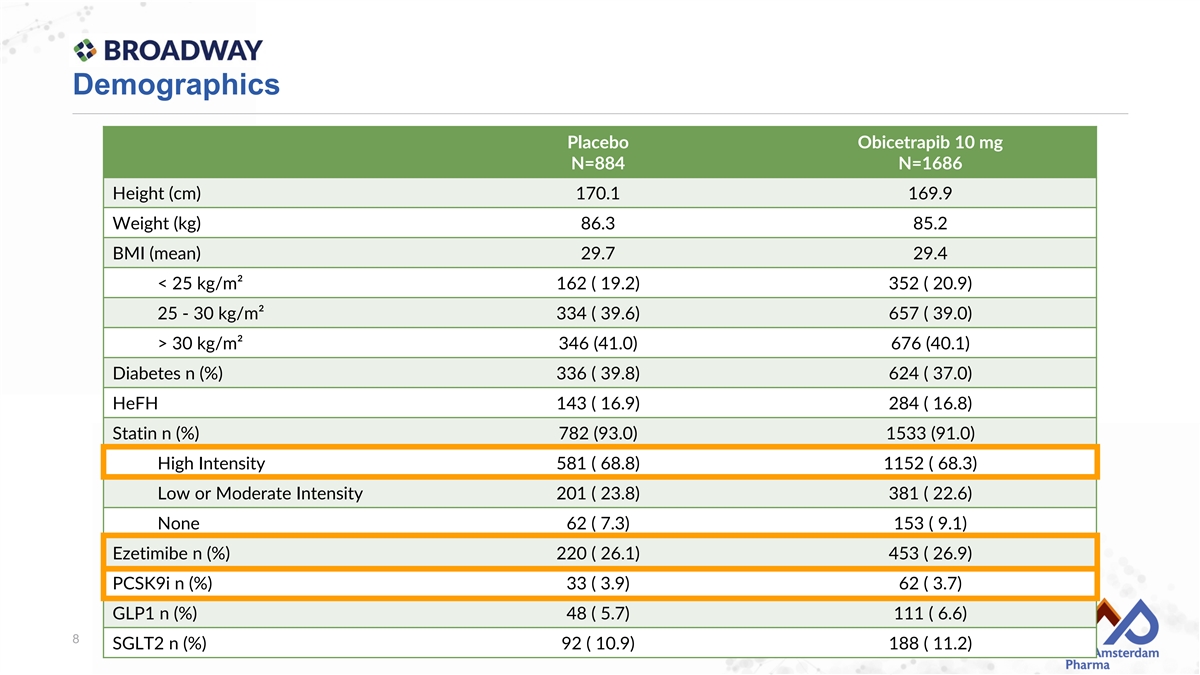
人口統計 安慰劑 Obicetrapib 10 mg N=884 N=1686 身高(cm) 170.1 169.9 體重(kg) 86.3 85.2 BMI(平均值) 29.7 29.4 < 25 kg/m² 162 ( 19.2) 352 ( 20.9) 25 - 30 kg/m² 334 ( 39.6) 657 ( 39.0) > 30 kg/m² 346 (41.0) 676 (40.1) 糖尿病 n (%) 336 ( 39.8) 624 ( 37.0) 家族性高膽固醇血癥 143 ( 16.9) 284 ( 16.8) 他汀類 n (%) 782 (93.0) 1533 (91.0) 高強度 581 ( 68.8) 1152 ( 68.3) 低或中等強度 201 ( 23.8) 381 ( 22.6) 無 62 ( 7.3) 153 ( 9.1) 艾澤米布 n (%) 220 ( 26.1) 453 ( 26.9) PCSK9抑制劑 n (%) 33 ( 3.9) 62 ( 3.7) GLP-1 n (%) 48 ( 5.7) 111 ( 6.6) 8 SGLT2 n (%) 92 ( 10.9) 188 ( 11.2)
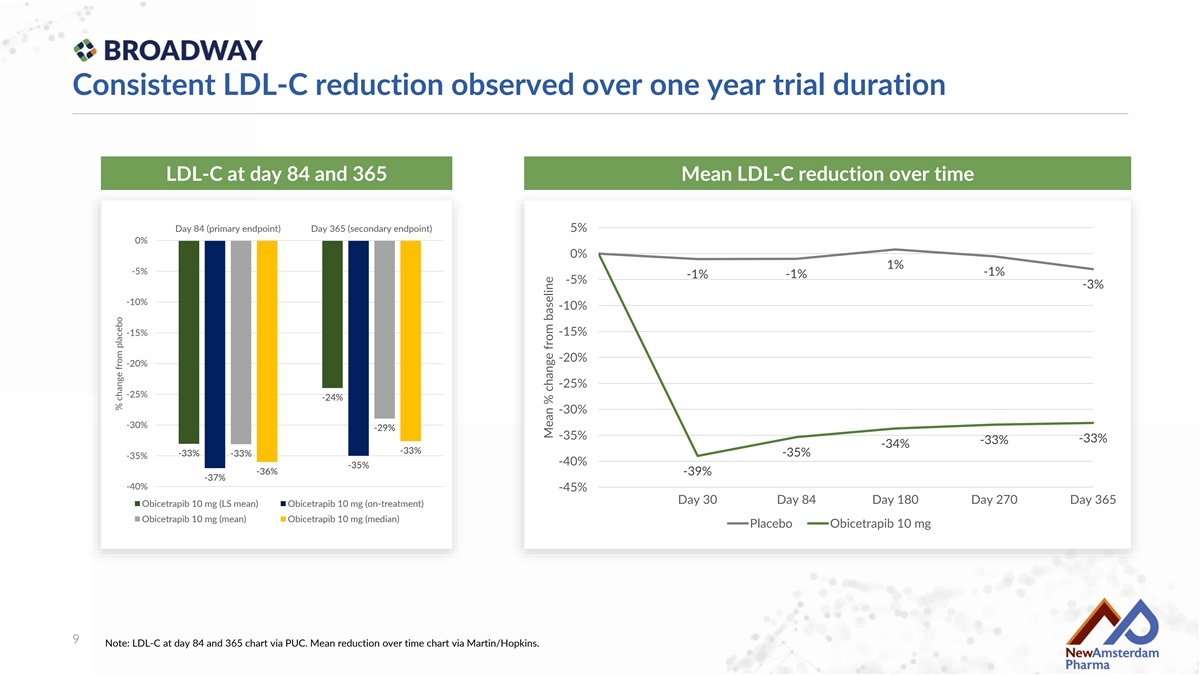
觀察到 LDL-C 在一年試驗期間的持續降低 第 84 天和第 365 天的 LDL-C 隨時間的平均 LDL-C 降低 第 84 天(主要終點) 第 365 天(次要終點) 5% 0% 0% 1% -5% -1% -1% -1% -5% -3% -10% -10% -15% -15% -20% -20% -25% -25% -24% -30% -30% -29% -35% -33% -33% -34% -33% -33% -35% -33% -35% -40% -35% -36% -39% -37% -40% -45% 第 30 天 第 84 天 第 180 天 第 270 天 第 365 天 Obicetrapib 10 mg (LS mean) Obicetrapib 10 mg (on-treatment) Obicetrapib 10 mg (mean) Obicetrapib 10 mg (median) 安慰劑 Obicetrapib 10 mg 9 注意:第 84 天和第 365 天的 LDL-C 通過 PUC 圖表顯示。 隨時間的平均降低通過 Martin/Hopkins 圖表顯示。與安慰劑的百分比變化 平均 % 從基線的變化
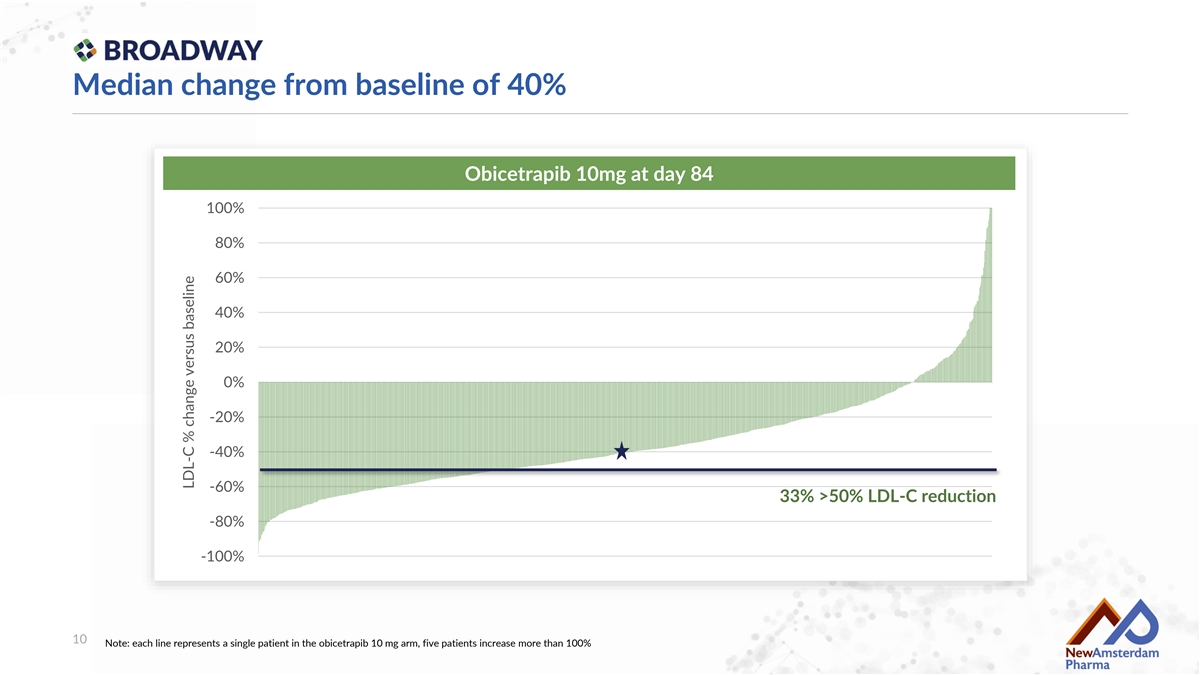
在第84天,Obicetrapib 10mg治療組的基線中位變化爲40%,100% 80% 60% 40% 20% 0% -20% -40% -60% 33% >50% LDL-C降低 -80% -100% 10 注意:每一行代表一個服用Obicetrapib 10 mg的患者,五名患者的LDL-C百分比變化超過基線的100%
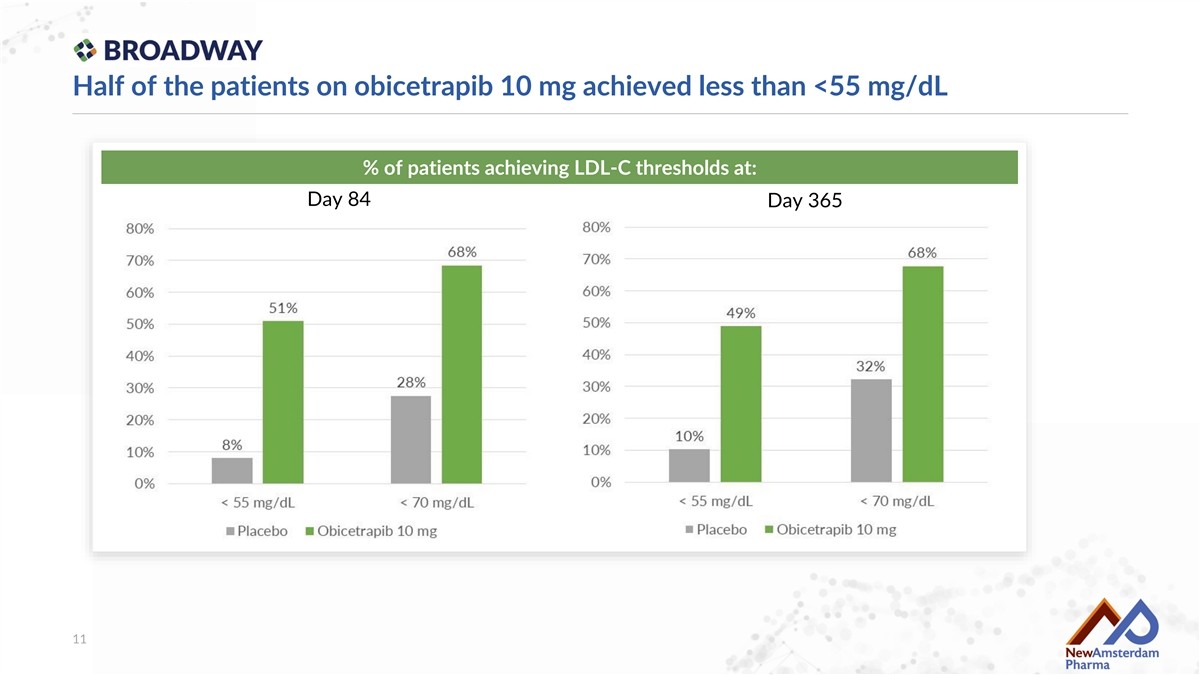
在Obicetrapib 10 mg治療的患者中,半數患者未能達到<55 mg/dL的LDL-C閾值 在第84天和第365天達到的患者比例:11
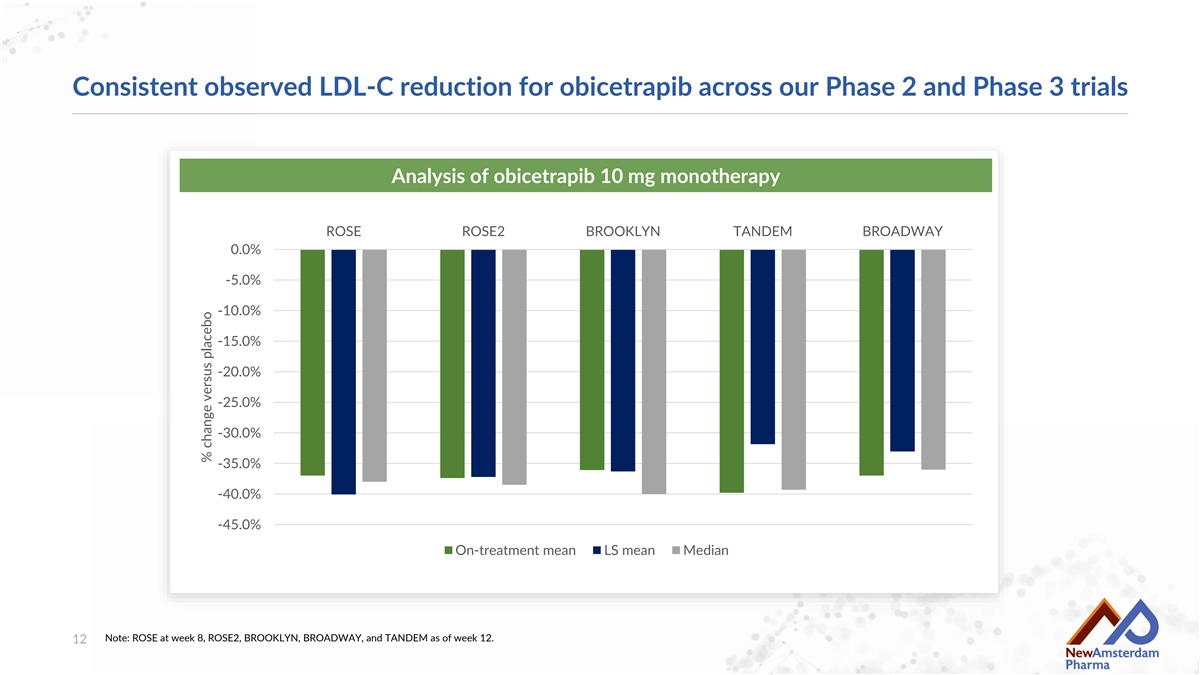
在我們的2期和3期試驗中觀察到Obicetrapib LDL-C下降的一致性分析 Obicetrapib 10 mg單藥治療 ROSE ROSE2 BROOKLYN TANDEm BROADWAY 0.0% -5.0% -10.0% -15.0% -20.0% -25.0% -30.0% -35.0% -40.0% -45.0% 治療中均值 LS均值 中位數 注意:ROSE在第8周,ROSE2,BROOKLYN,BROADWAY和 TANDEm在第12周的數據。與安慰劑相比的百分比變化
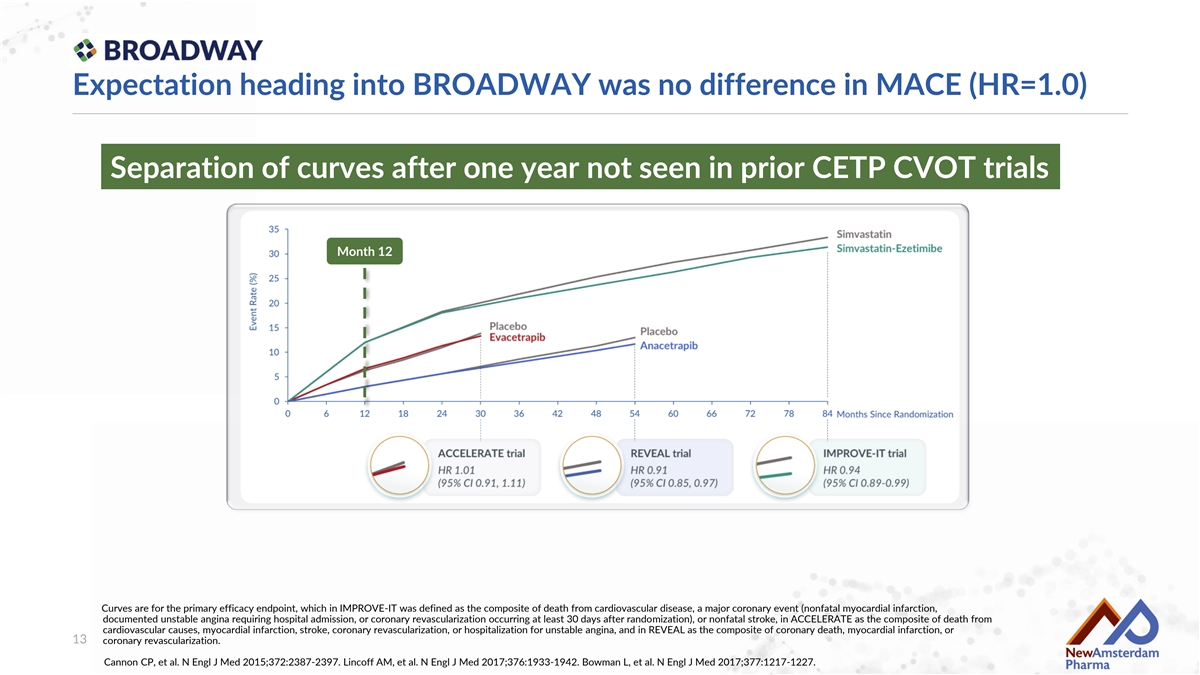
進入BROADWAY的預期是MACE(HR=1.0)無差異 在之前的CETP CVOt試驗中一年後未見曲線分離 第12個月 曲線爲主要有效性終點,在IMPROVE-It中定義爲心血管疾病死亡、主要冠狀事件(非致命性 心肌梗死、需要住院的不穩定型心絞痛或在隨機分組後至少30天發生的冠狀重新血管化)或非致命性中風,在ACCELERATE中定義爲心血管原因死亡、心肌梗死、中風、冠狀重新血管化或因不穩定型心絞痛住院,以及在REVEAL中定義爲冠狀死亡、心肌梗死或 冠狀重新血管化。Cannon CP等人。新英格蘭醫學雜誌 2015;372:2387-2397。Lincoff Am等人。新英格蘭醫學雜誌 2017;376:1933-1942。Bowman L等人。新英格蘭醫學雜誌 2017;377:1217-1227。
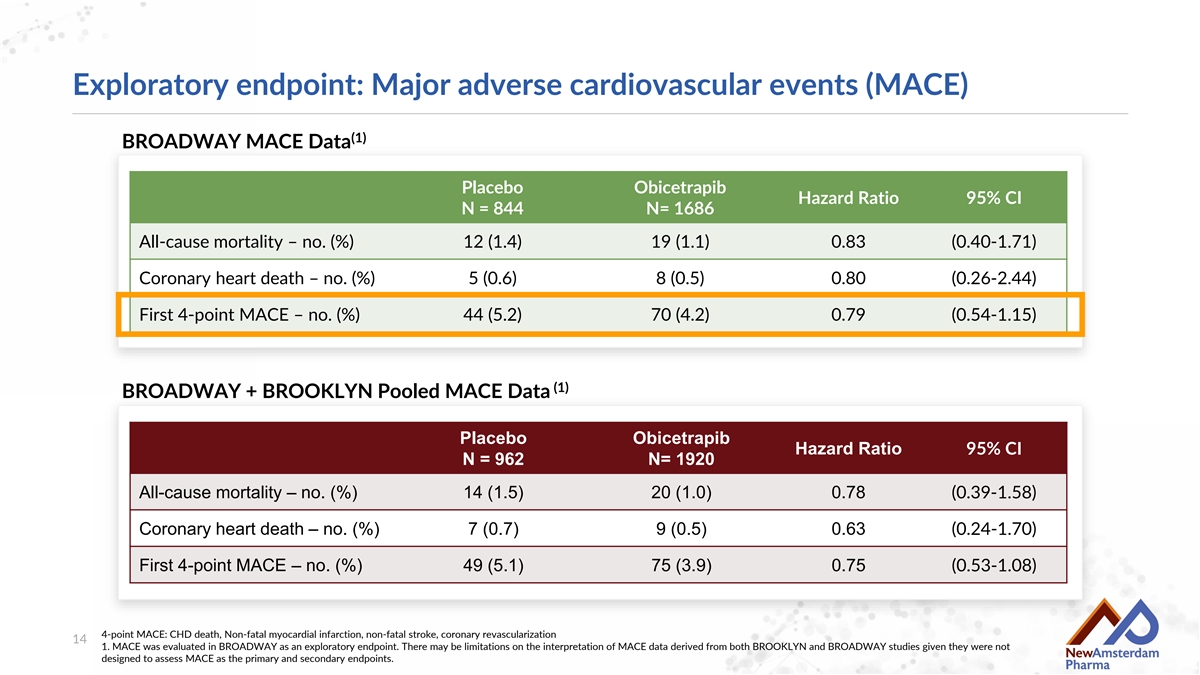
探索性終點:主要不良心血管事件(MACE) (1) BROADWAY MACE數據 安慰劑 Obicetrapib 危險比 95% 置信區間 N = 844 N= 1686 全因死亡 – 數量 (%) 12 (1.4) 19 (1.1) 0.83 (0.40-1.71) 冠心死亡 – 數量 (%) 5 (0.6) 8 (0.5) 0.80 (0.26-2.44) 首次4點MACE – 數量 (%) 44 (5.2) 70 (4.2) 0.79 (0.54-1.15) (1) BROADWAY + BROOKLYN合併MACE數據 安慰劑 Obicetrapib 危險比 95% 置信區間 N = 962 N= 1920 全因死亡 – 數量 (%) 14 (1.5) 20 (1.0) 0.78 (0.39-1.58) 冠心死亡 – 數量 (%) 7 (0.7) 9 (0.5) 0.63 (0.24-1.70) 首次4點MACE – 數量 (%) 49 (5.1) 75 (3.9) 0.75 (0.53-1.08) 4點MACE:冠心病死亡、非致命性心肌梗死、非致命性中風、冠狀重新血管化 14 1. MACE在BROADWAY中被評估爲探索性終點。有鑑於BROADWAY和BROOKLYN研究未設計評估MACE作爲主要和次要終點,因此對MACE數據的解釋可能存在限制。
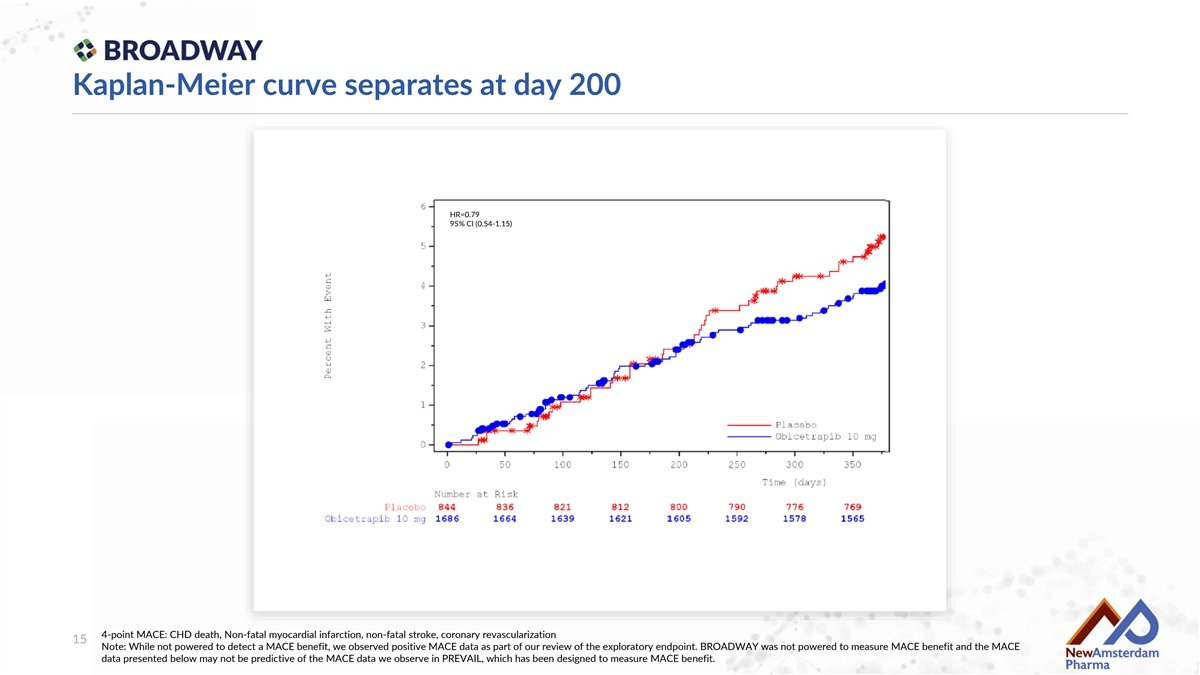
Kaplan-Meier曲線在第200天分離,HR=0.79 95% CI (0.54-1.15) 4點重大不良心血管事件:冠心病死亡、非致命性心肌梗死、非致命性中風、冠狀動脈再血管化 15 注意:雖然未能檢測到重大不良心血管事件的益處,但在我們對探索性終點的審查中觀察到了積極的重大不良心血管事件數據。BROADWAY 並未設計用於測量重大不良心血管事件的益處,下面呈現的重大不良心血管事件數據可能無法預測我們在PREVAIL中觀察到的重大不良心血管事件數據,PREVAIL的設計旨在測量重大不良心血管事件的益處。
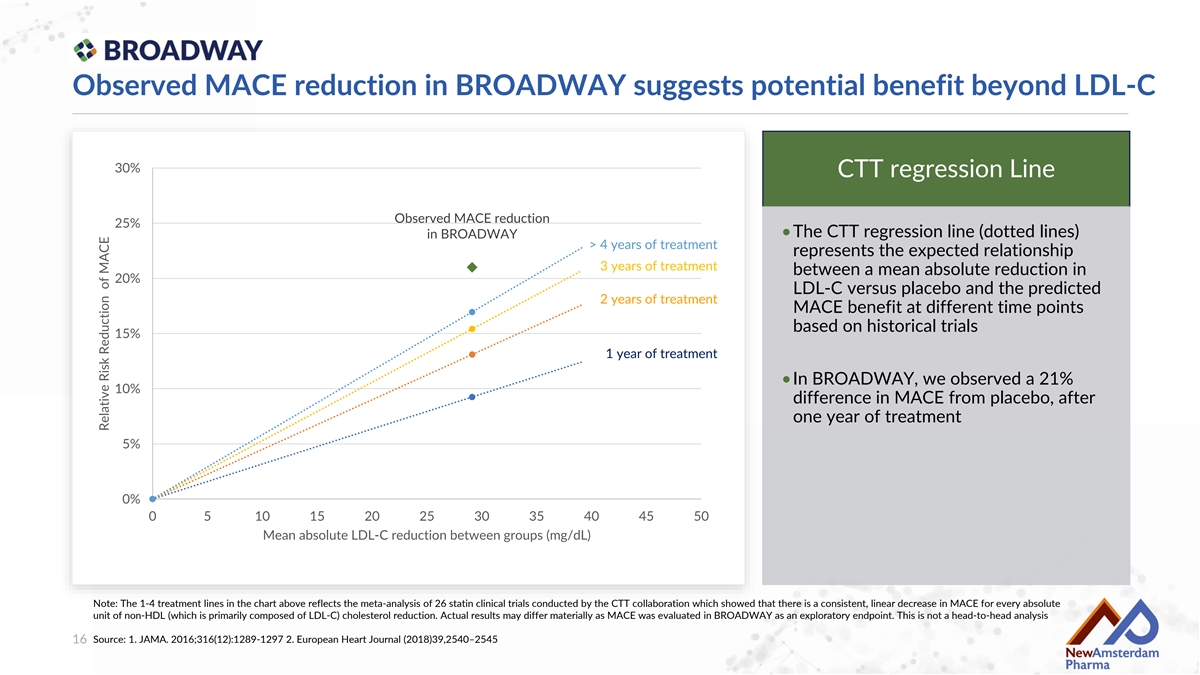
在BROADWAY中觀察到的重大不良心血管事件減少提示潛在益處超出 LDL-C 30%的CTt回歸線 觀察到的重大不良心血管事件減少 25% •BROADWAY中4年的治療的CTt回歸線(虛線)代表在不同時間點,根據歷史試驗預測的LDL-C與安慰劑的平均絕對減少20%之間的期望關係與重大不良心血管事件的益處 15% 1年的治療 •在BROADWAY中,我們觀察到與安慰劑相比,重大不良心血管事件差異爲21%,經過一年的治療後 10% 0% 0 5 10 15 20 25 30 35 40 45 50 組之間的平均絕對LDL-C減少(mg/dL) 注意:上述圖表中的1-4治療線反映了由CTt合作組織進行的26個他汀類藥物臨床試驗的Meta分析,顯示每減少一個非高密度脂蛋白(主要由LDL-C組成)的絕對單位,重大不良心血管事件有一致的線性下降。實際結果可能有重大差異,因爲在BROADWAY中將重大不良心血管事件作爲探索性終點進行評估。此 並非頭對頭分析 來源:1. JAMA. 2016;316(12):1289-1297 2. 歐洲心臟雜誌(2018)39,2540–2545 16 重大不良心血管事件的相對風險降低
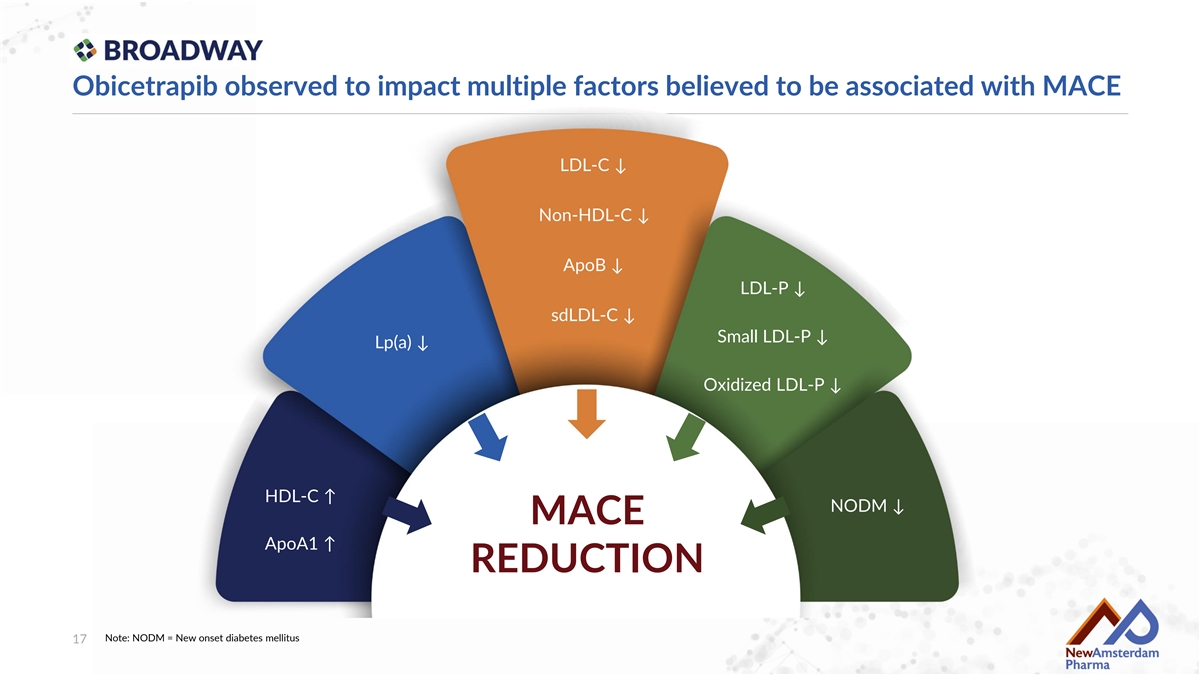
Obicetrapib觀察到對多個被認爲與重大不良心血管事件相關的因素的影響 LDL-C ↓ 非高密度脂蛋白-C ↓ Apob ↓ LDL-P ↓ sdLDL-C ↓ 小型LDL-P ↓ Lp(a) ↓ 氧化LDL-P ↓ 高密度脂蛋白-C ↑ 新發糖尿病 mellitus ↓ 重大不良心血管事件 ApoA1 ↑ 降低 注意:新發糖尿病 mellitus = 新發糖尿病
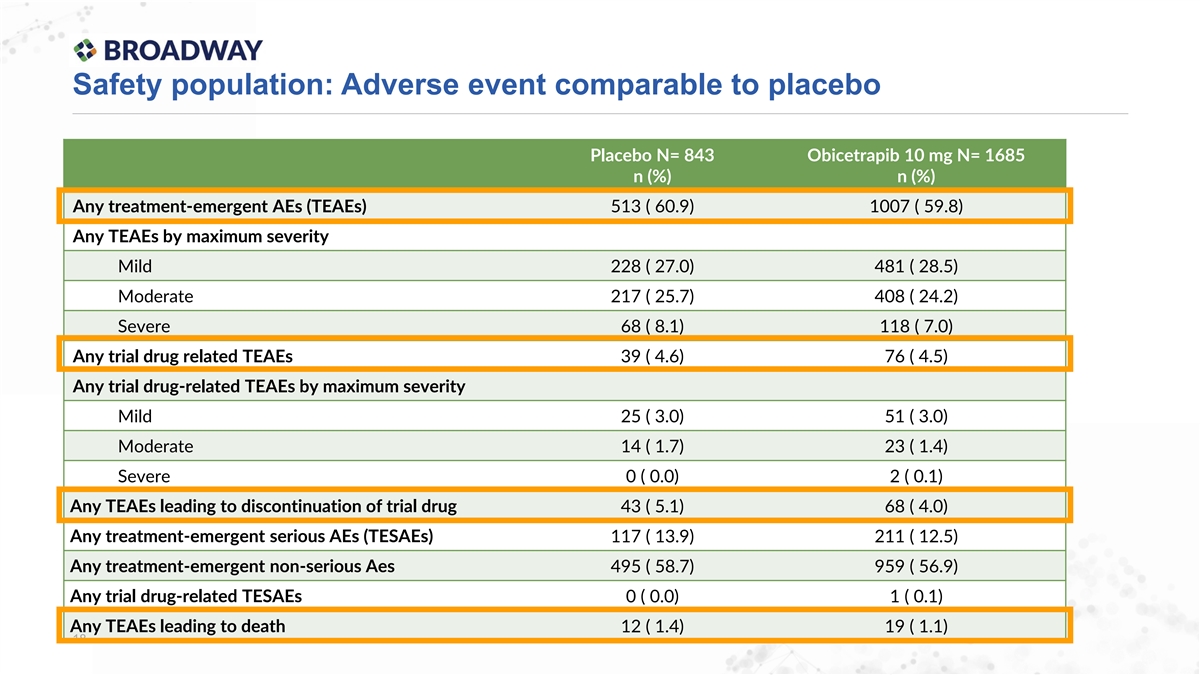
安全人群:不良事件與安慰劑相當 安慰劑N= 843 Obicetrapib 10 mg N= 1685 n (%) n (%) 任何治療出現的不良事件(TEAEs) 513 ( 60.9) 1007 ( 59.8) 任何不良事件按最大嚴重程度分類 輕度 228 ( 27.0) 481 ( 28.5) 中度 217 ( 25.7) 408 ( 24.2) 重度 68 ( 8.1) 118 ( 7.0) 任何試驗藥物相關的不良事件 39 ( 4.6) 76 ( 4.5) 任何試驗藥物相關的不良事件按最大嚴重程度分類 輕度 25 ( 3.0) 51 ( 3.0) 中度 14 ( 1.7) 23 ( 1.4) 重度 0 ( 0.0) 2 ( 0.1) 任何導致停止試驗藥物的不良事件 43 ( 5.1) 68 ( 4.0) 任何治療出現的嚴重 不良事件(TESAEs) 117 ( 13.9) 211 ( 12.5) 任何治療出現的非嚴重不良事件 495 ( 58.7) 959 ( 56.9) 任何試驗藥物相關的TESAEs 0 ( 0.0) 1 ( 0.1) 任何導致死亡的不良事件 12 ( 1.4) 19 ( 1.1) 18
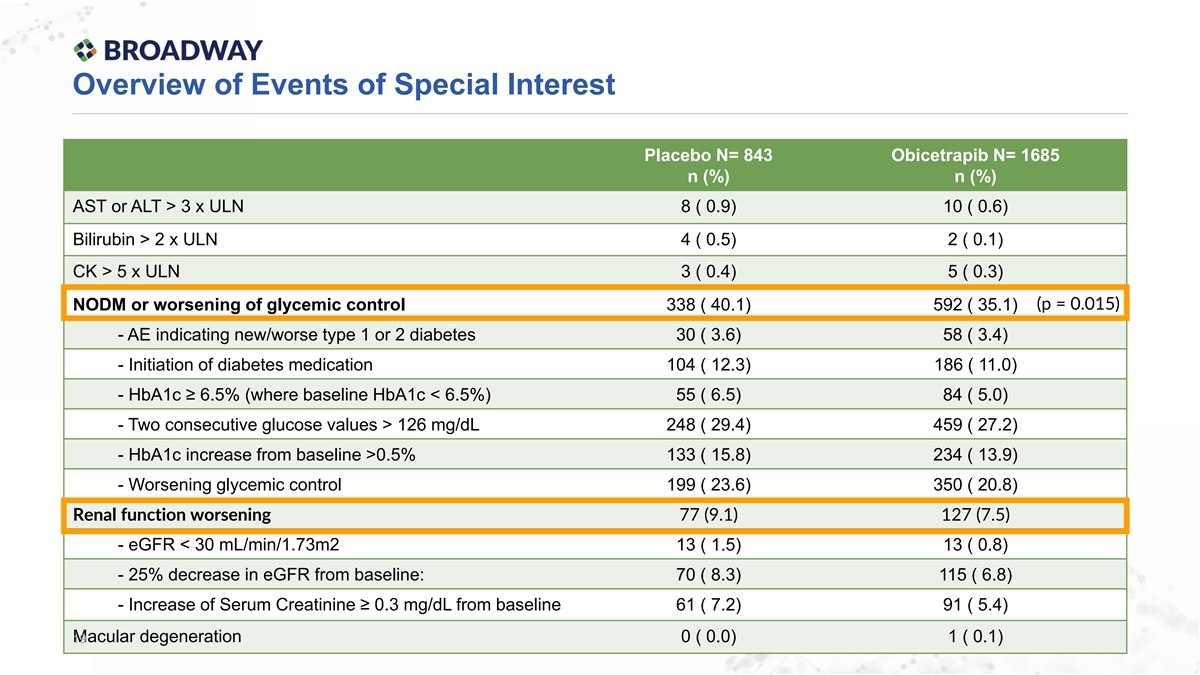
特殊事件概述 安慰劑 N= 843 Obicetrapib N= 1685 n (%) n (%) ASt 或 ALt > 3 倍 ULN 8 (0.9) 10 (0.6) 膽紅素 > 2 倍 ULN 4 (0.5) 2 (0.1) Ck > 5 倍 ULN 3 (0.4) 5 (0.3) (p = 0.015) NODm 或 糖代謝控制惡化 338 (40.1) 592 (35.1) - AE 指示新發/惡化的1型或2型糖尿病 30 (3.6) 58 (3.4) - 開始使用糖尿病藥物 104 (12.3) 186 (11.0) - HbA1c ≥ 6.5% (基線 HbA1c < 6.5%) 55 (6.5) 84 (5.0) - 連續兩次葡萄糖值 > 126 mg/dL 248 (29.4) 459 (27.2) - HbA1c 從基線增加 >0.5% 133 (15.8) 234 (13.9) - 糖代謝控制惡化 199 (23.6) 350 (20.8) 腎功能惡化 77 (9.1) 127 (7.5) - eGFR < 30 mL/min/1.73m2 13 (1.5) 13 (0.8) - eGFR 從基線下降 25%: 70 (8.3) 115 (6.8) - 血清肌酐 ≥ 0.3 mg/dL 增加自基線 61 (7.2) 91 (5.4) 黃斑變性 0 (0.0) 1 (0.1) 19

總體三期項目的關鍵觀察 有效性 •Obicetrapib 單藥治療: 基於 BROOKLYN 和 BROADWAY 數據爲 33-36% •Obicetrapib + ezetimibe 聯合用藥: 基於 TANDEm 數據爲 49% •Obicetrapib 或 obicetrapib+ezetimibe 將大多數患者的 LDL-C 控制在目標範圍內 耐受性 •不良事件、生命體徵和實驗室參數與安慰劑相當 •未觀察到血壓、hs-CRP、肝臟或肌肉酶的增加 •與安慰劑相比,obicetrapib 組的糖代謝和腎臟不良事件較少 比較預後結果 •確認 PREVAIL 爲成功設立 •令人鼓舞的 MACE 發現 - BROADWAY 中減少 21% - 對於在 PREVAIL 中研究的心血管結果 >20% 提供樂觀前景 注意: MACE 在 BROADWAY 中被評估爲探索性終點。由於該試驗並未設計爲評估 MACE 作爲主要或次要終點,因此可能存在對 BROADWAY 試驗得出的 MACE 數據的解釋限制。