
PYX-201 1期劑量遞增研究數據披露 2024年11月

前瞻性聲明 本演示文稿包含前瞻性聲明,旨在遵從1995年《私人證券訴訟改革法》及其他聯邦證券法下的安全港條款。本演示文稿及新聞稿中所有非歷史事實的聲明,包括但不限於有關公司計劃開發、製造及商業化其產品候選者(包括PYX-201);公司的正在進行的臨床試驗的初步結果、時間安排及進展;公司臨床試驗的預期結果;初步及總體臨床數據能夠減少PYX-201的風險並隨著臨床試驗的進展得到確認,包括PYX-201的安全性、耐受性及潛在療效;PYX-201與其他已批准產品或開發中產品的潛在區別、優勢或有效性;PYX-201的劑量及治療潛力;市場的規模及未來;管理層的計劃與目標,以及公司的未來經營結果及財務狀況,均為前瞻性聲明。這些聲明既不是承諾也不是保證,而是涉及已知和未知的風險、不確定性及其他重要因素,這些因素在某些情況下可能超出公司的控制,可能導致實際結果、表現或成就與前述的未來結果、表現或成就在實質上存在重大差異,包括但不限於以下風險:藥物研究和開發中固有的風險;公司預測的資金流及對額外資金的潛在需求;臨床藥物開發的漫長、昂貴及不確定的過程,包括在獲得監管批准過程中的潛在延遲或失敗;公司依賴第三方及合作夥伴進行臨床試驗、製造其產品候選者,及開發與商業化其產品候選者;以及公司是否能夠成功與其他藥物候選者競爭。因此,投資者不應依賴前瞻性聲明來預測未來事件。除非法律要求,公司不承擔任何義務,公開或修訂本文件中的任何前瞻性聲明,無論是因為新信息、未來事件、情況變更或其他原因。

今天的演講者和嘉賓關鍵意見領袖 Lara Sullivan, MD 總裁兼首席執行官 Pam Connealy, MBA 首席財務官和首席運營官 Jan Pinkas, PhD 首席科學官 Pyxis Oncology 高級管理團隊 Glenn Hanna, MD 癌症治療創新中心主任,醫療腫瘤學家,頭頸部腫瘤學中心 達納-法伯癌症研究所 Anthony Tolcher, MD, FRCPC NEXt Oncology 創始人及首席執行官 嘉賓關鍵意見領袖

今天的討論將解決這五個問題 PYX-201 有何新穎之處? 它的穩定性如何? 它的耐受性如何? 我們已經看到了哪些早期反應數據? 它將如何進一步測試? 1 2 3 4 5 首個概念性的 ADC 具有非細胞靶向和細胞外有效成分裂解。 穩定的分子,具有長半衰期,劑量反應 PK,以及在循環中微不足道的自由有效成分。 觀察到良好的耐受性數據,停藥率低,讓早期療法中有潛在的 IO 組合機會。 在 6 種實體腫瘤類型 (n=31) 的確定劑量區間內觀察到的 26% ORR,主要適應症 HNSCC 的 ORR 為 50%。 單藥和組合開發路徑,包括前線機會,計劃在接下來的 6-18 個月內引進多個催化劑。 * HNSCC,卵巢,HR+ 乳腺,TNBC,NSCLC,肉瘤
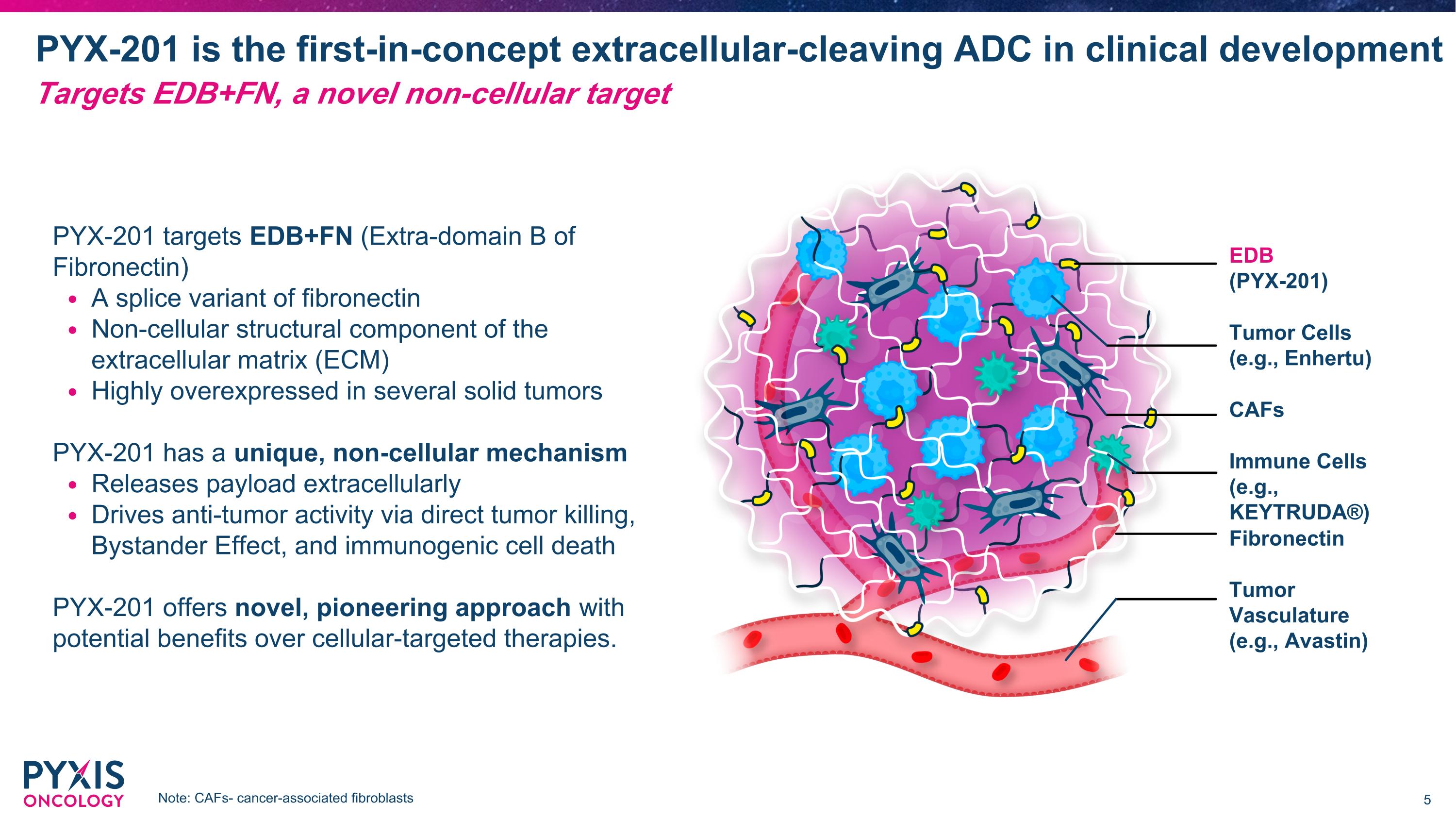
PYX-201 是臨床開發中的首個概念性細胞外裂解 ADC。 PYX-201 針對 EDB+FN(纖維連接蛋白的外域 b)。 纖維連接蛋白的一個拼接變體。 非細胞結構組件,位於細胞外基質(ECM)。 在幾種實體腫瘤中高度過表達。 PYX-201 擁有獨特的非細胞機制, 在細胞外釋放有效成分。 通過直接殺死腫瘤、旁觀者效應和免疫原性細胞死亡驅動抗腫瘤活性。 PYX-201 提供新穎的開創性方法,可能比細胞靶向療法有潛在的優勢。 注意:CAFs - 癌症相關成纖維細胞 腫瘤血管 (例如,Avastin) 纖維連接蛋白 CAFs EDb (PYX-201) 免疫細胞 (例如,KEYTRUDA®) 腫瘤細胞 (例如,Enhertu) 針對 EDB+FN,這是一個新穎的非細胞靶點。
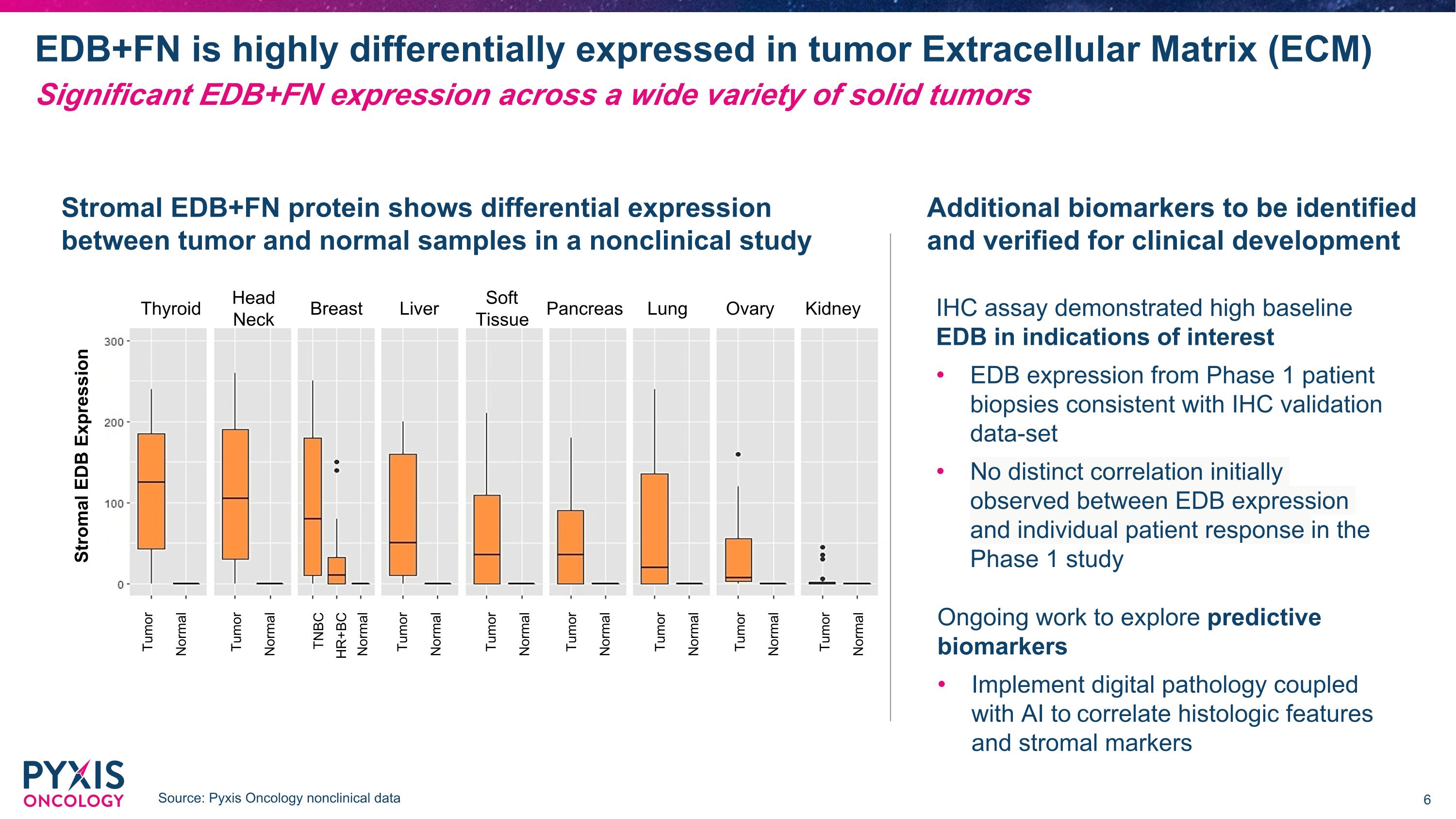
EDB+FN 在腫瘤細胞外基質 (ECM) 中高度差異表達。 來源:Pyxis Oncology 非臨床數據 IHC 測試顯示在感興趣的適應症中基線 EDb 較高。 來自階段 1 患者活檢的 EDb 表達與 IHC 驗證數據集一致。 在階段 1 研究中,最初未觀察到 EDb 表達與個別患者反應之間的明顯相關性。 正在進行的工作旨在探索預測生物標記。 實施數字病理學,結合人工智能以關聯組織學特徵和基質標記。 基質 EDb 表達 腫瘤 正常 腫瘤 正常 TNBC 正常 HR+BC 腫瘤 正常 腫瘤 正常 腫瘤 正常 腫瘤 正常 腫瘤 正常 腫瘤 正常 腫瘤 正常 腫瘤 正常 甲狀腺 頭頸部 乳腺 肝臟 軟組織 肺 卵巢 腎臟 基質 EDB+FN 蛋白在非臨床研究中,在腫瘤和正常樣本之間顯示出差異表達。 胰臟 還需確定和驗證其他生物標記進行臨床開發。 在各種實體腫瘤中表現出顯著的 EDB+FN。
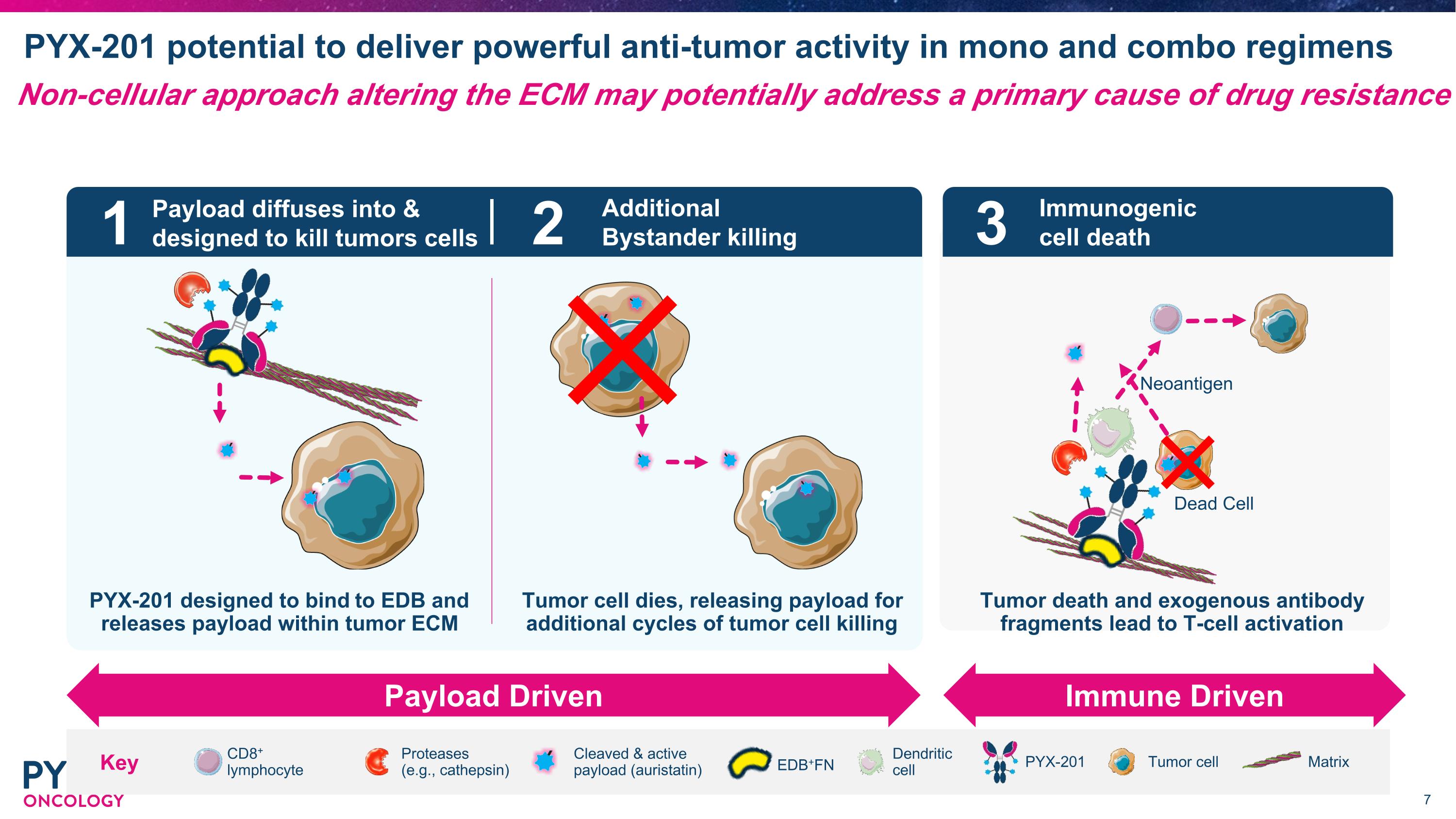
PYX-201在單一及聯合療法中擁有強大的抗腫瘤活性潛力。 PYX-201設計為與EDb結合並在腫瘤ECm中釋放有效載荷。 CD8+淋巴細胞樹突細胞 PYX-201切割&活性載荷(auristatin) 腫瘤細胞基質蛋白酶(例如:半胱天冬酶) 關鍵1 2 3 載荷擴散並設計為殺死腫瘤細胞 額外的旁觀者殺傷 免疫原性細胞死亡 載荷驅動免疫驅動 死亡細胞新抗原 腫瘤細胞死亡,釋放載荷以進行額外的腫瘤細胞殺傷循環。 腫瘤死亡和外源抗體碎片導致T細胞激活。 EDB+FN 非細胞方法改變ECm可能會潛在地解決藥物抗性的一個主要原因。

新的臨床試驗合作評估PYX-201與KEYTRUDA®(pembrolizumab)聯合使用。 PYX-201對ECm的破壞有潛力增強PD-1的抗腫瘤效果,在早期治療中。 FPFV: 首位患者首次就診。 注意:默沙東在美國和加拿大以外地區稱為MSD;KEYTRUDA®是默沙東子公司Merck Sharp&Dohme LLC在新澤西州拉威的註冊商標。 PYXS和默沙東各自保留其化合物的所有商業權利,包括作為單一療法或作為聯合療法。 PYX-201將與默沙東的抗PD-1療法KEYTRUDA®(pembrolizumab)一起評估。 強大的臨床前聯合數據和臨床單藥數據支持機會。 PYX-201新型細胞外MOA提供獨特機會與多種機制和方式結合,包括IO、ADCs和EGFRs。 PYXS在合作夥伴中獲得默沙東(在美國和加拿大以外地區稱為MSD)直接資助的KEYTRUDA供應。 資助KEYTRUDA供應對PYXS具有重大價值。 預計於1月25日啟動的現場。 PYX-201在多種腫瘤類型中觀察到的第一期單藥反應顯示出卓越的耐受性。 PYX-201增強了T細胞的浸潤並在臨床前模型中增加了PD-L1的表達。 結果表明,PXY-201與KEYTRUDA之間可能會提高組合效益的潛力。
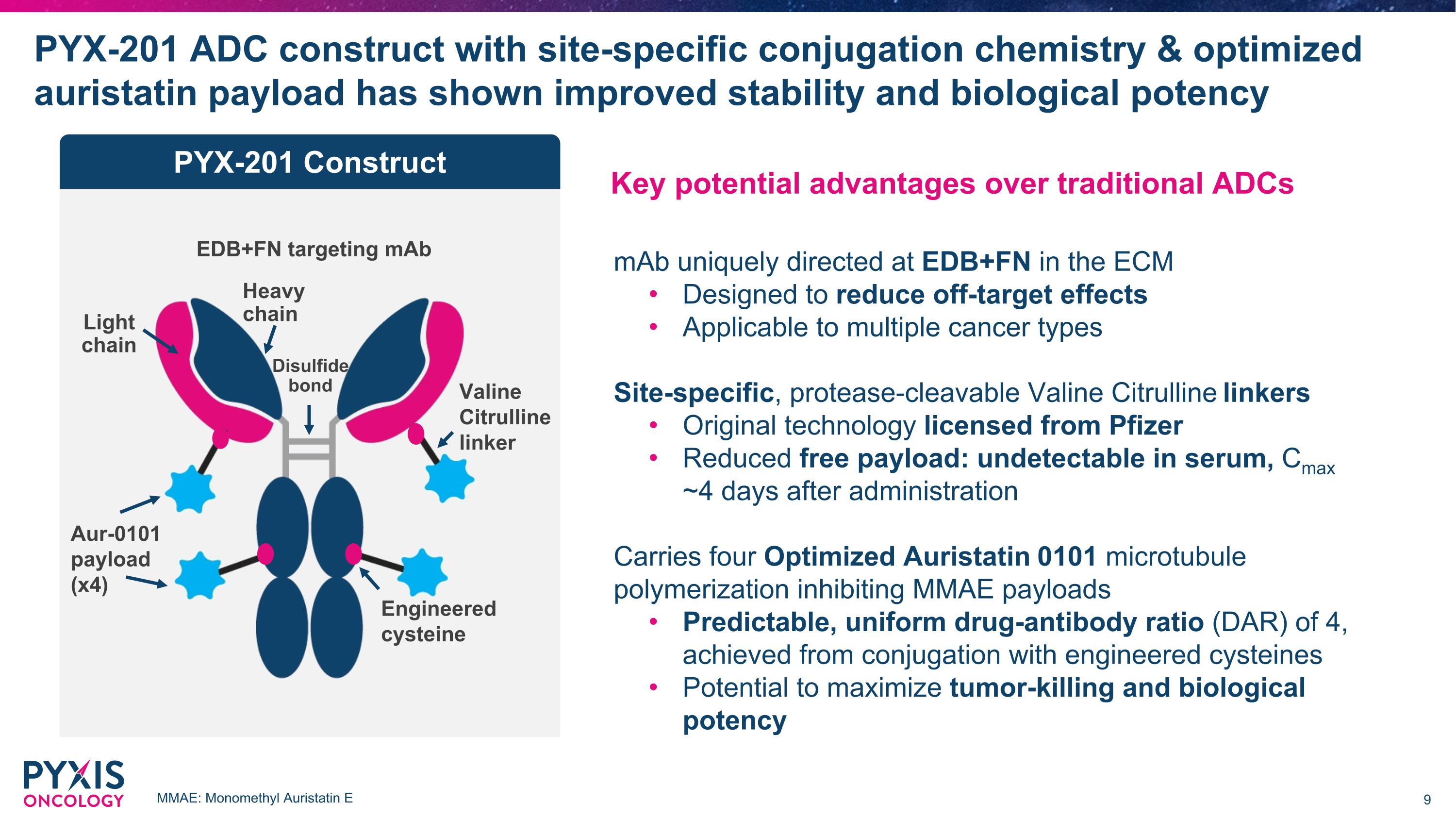
PYX-201 ADC構建具有特定位點偶聯化學及優化的auristatin載量,顯示出更好的穩定性和生物效力,針對EDB+FN的mAb Aur-0101載量(x4) 纈氨酸-瓜氨酸鏈接劑 PYX-201 構建 輕鏈 重鏈 工程化半胱氨酸 二硫鍵 與傳統的ADC相比,具有潛在的關鍵優勢,mAb獨特地導向EDB+FN於ECm中,設計以減少非靶向效應,適用於多種癌症類型,特定位點的蛋白酶可切割纈氨酸-瓜氨酸鏈接劑,原始技術授權自輝瑞,減少自由載量:在血清中不可檢測,Cmax約在給藥後4天,攜帶四個優化的Auristatin 0101微管聚合抑制MMAE載量,預測的、均勻的藥物-抗體比率(DAR)為4,通過與工程化半胱氨酸的偶聯實現,具有最大化腫瘤殺傷和生物效力的潛力。MMAE:單甲基Auristatin E
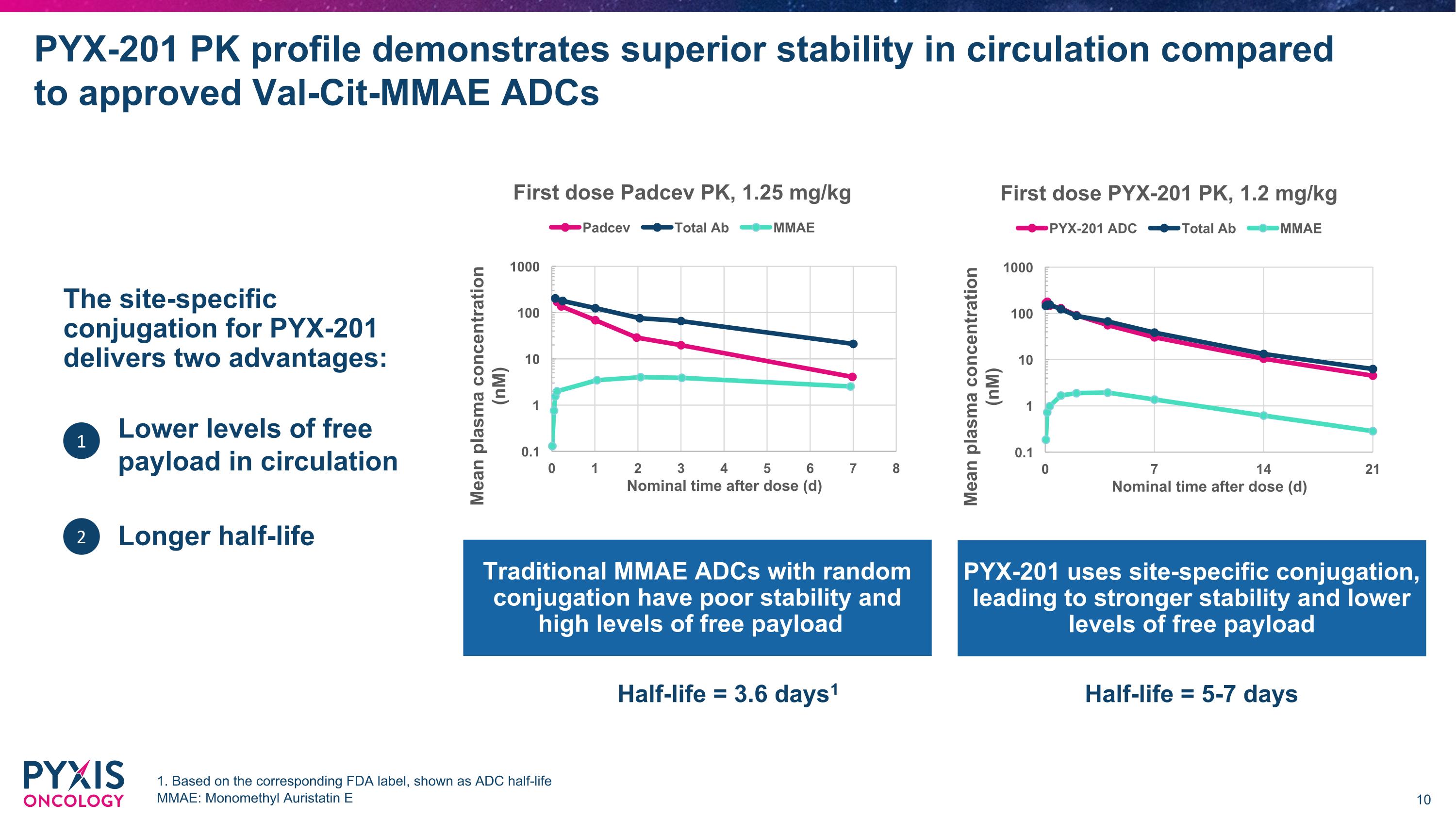
PYX-201 Pk特徵展示在循環中較經批准的Val-Cit-MMAE ADCs更佳的穩定性 1. 基於對應的FDA標籤,顯示為ADC的半衰期。MMAE:單甲基Auristatin E,PYX-201的特定位點偶聯提供兩項優勢:更低水平的自由載量在循環中,更長的半衰期 1 2 傳統的MMAE ADCs隨機偶聯穩定性差且自由載量水平高,PYX-201使用特定位點偶聯,導致穩定性更強且自由載量水平更低,半衰期 = 3.6天1,半衰期 = 5-7天
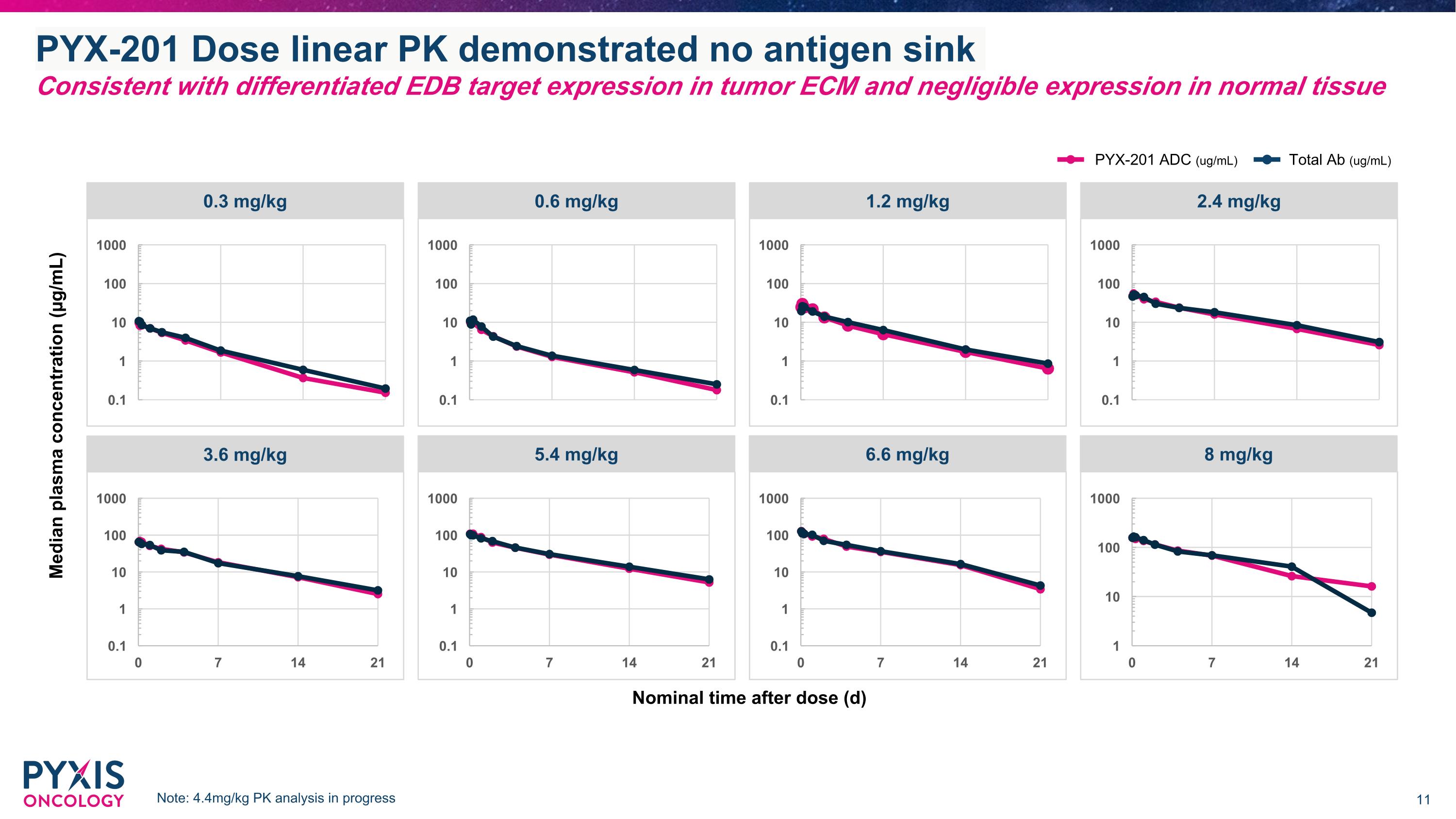
PYX-201劑量線性Pk顯示無抗原沉降 與腫瘤ECm中的差異EDb靶向表達一致,正常組織中表達可忽略 劑量後 nominal 時間(d) 中位血漿濃度(µg/mL) 0.3 mg/kg 0.6 mg/kg 1.2 mg/kg 2.4 mg/kg 3.6 mg/kg 5.4 mg/kg 6.6 mg/kg 8 mg/kg PYX-201 ADC(ug/mL) 總體Ab(ug/mL) 注意:4.4mg/kg的Pk分析正在進行中
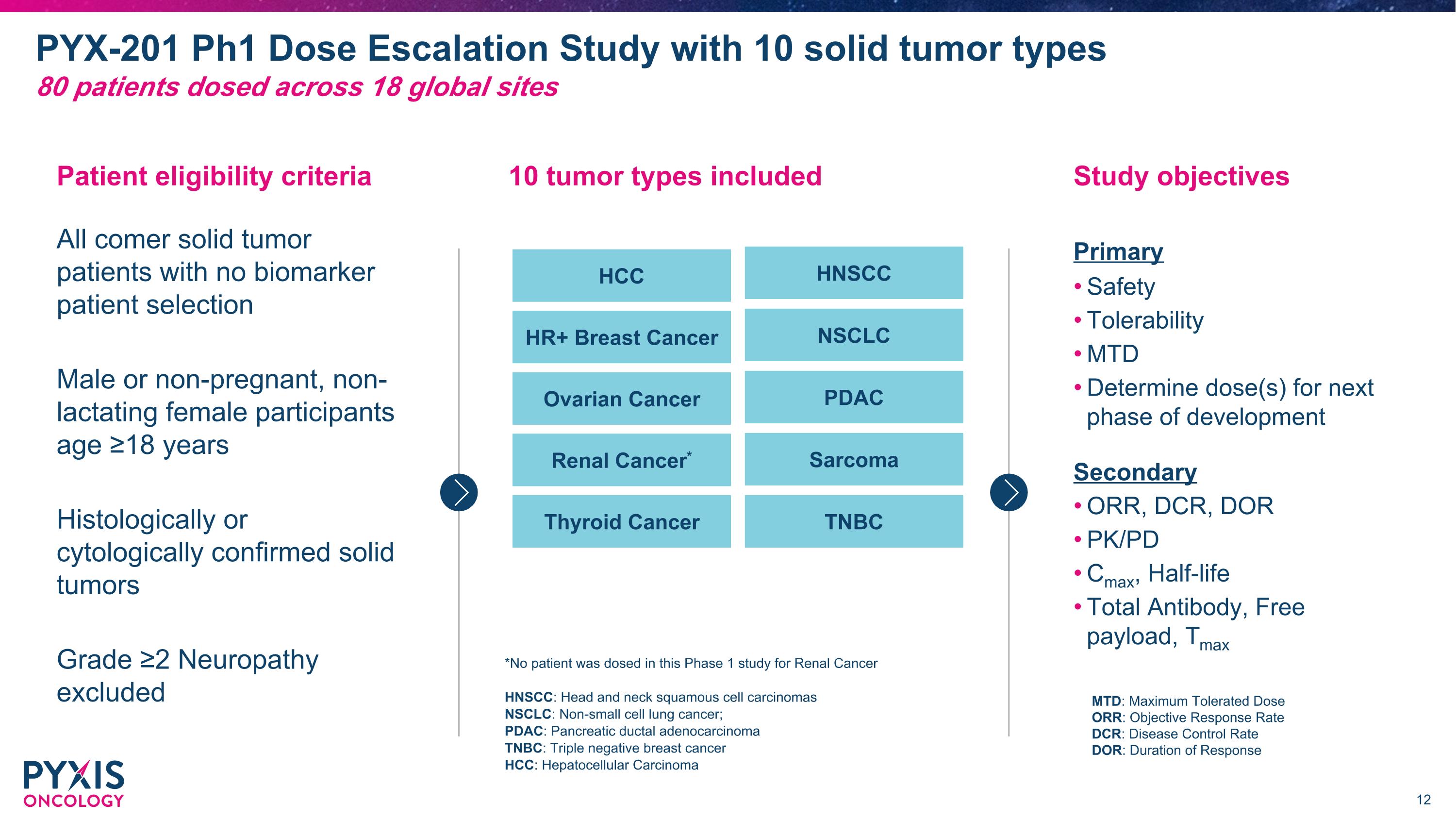
PYX-201 Ph1 劑量遞增研究,涉及10種實體腫瘤類型 *在這項第一階段研究中,沒有患者接受腎癌的給藥 HNSCC:頭頸部鱗狀細胞癌 NSCLC:非小細胞肺癌;PDAC:胰腺導管腺癌 TNBC:三陰性乳腺癌 HCC:肝細胞癌 患者資格標準 所有腫瘤患者,無生物標記選擇,男性或非懷孕、非哺乳的女性參與者,年齡 ≥18歲 組織學或細胞學確認的實體腫瘤 等級 ≥2 神經病變排除 納入10種腫瘤類型,80名患者在全球18個地點接受給藥 研究目標 安全性 耐受性 MTD 判斷下一階段發展的劑量 主要 ORR、DCR、DOR PK/PD Cmax、半衰期 總抗體、自體 載量、Tmax 次要 HCC HNSCC HR+ 乳腺癌 NSCLC 卵巢癌 PDAC 腎癌* 肉瘤 甲狀腺癌 TNBC MTD:最大耐受劑量 ORR:客觀反應率 DCR:疾病控制率 DOR:反應持續時間
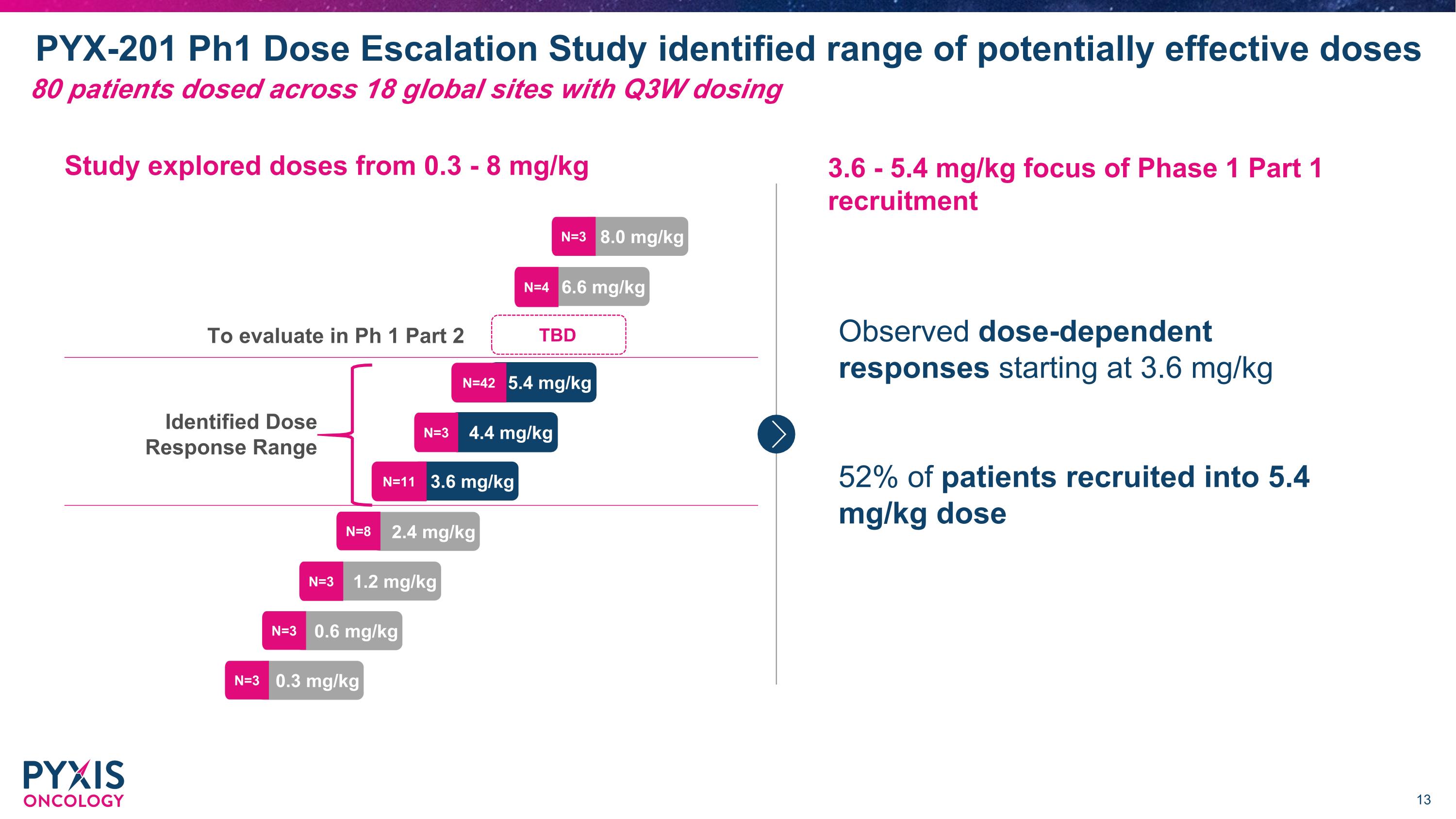
PYX-201 第1期劑量遞增研究確定了潛在有效劑量區間 0.3 mg/kg 0.6 mg/kg 1.2 mg/kg 2.4 mg/kg 3.6 mg/kg 4.4 mg/kg 5.4 mg/kg 6.6 mg/kg 8.0 mg/kg N=3 N=3 N=3 N=8 N=11 N=42 N=3 N=3 N=4 3.6 - 5.4 mg/kg 是第1期第1部分招募的重點 在3.6 mg/kg劑量開始觀察到劑量依賴性反應 52%的患者被招募進入5.4 mg/kg劑量的研究 劑量區間探索從0.3 - 8 mg/kg 待定 確定劑量反應範圍 80名患者在18個全球站點接受了每3周一次的劑量 以評估第1期第2部分
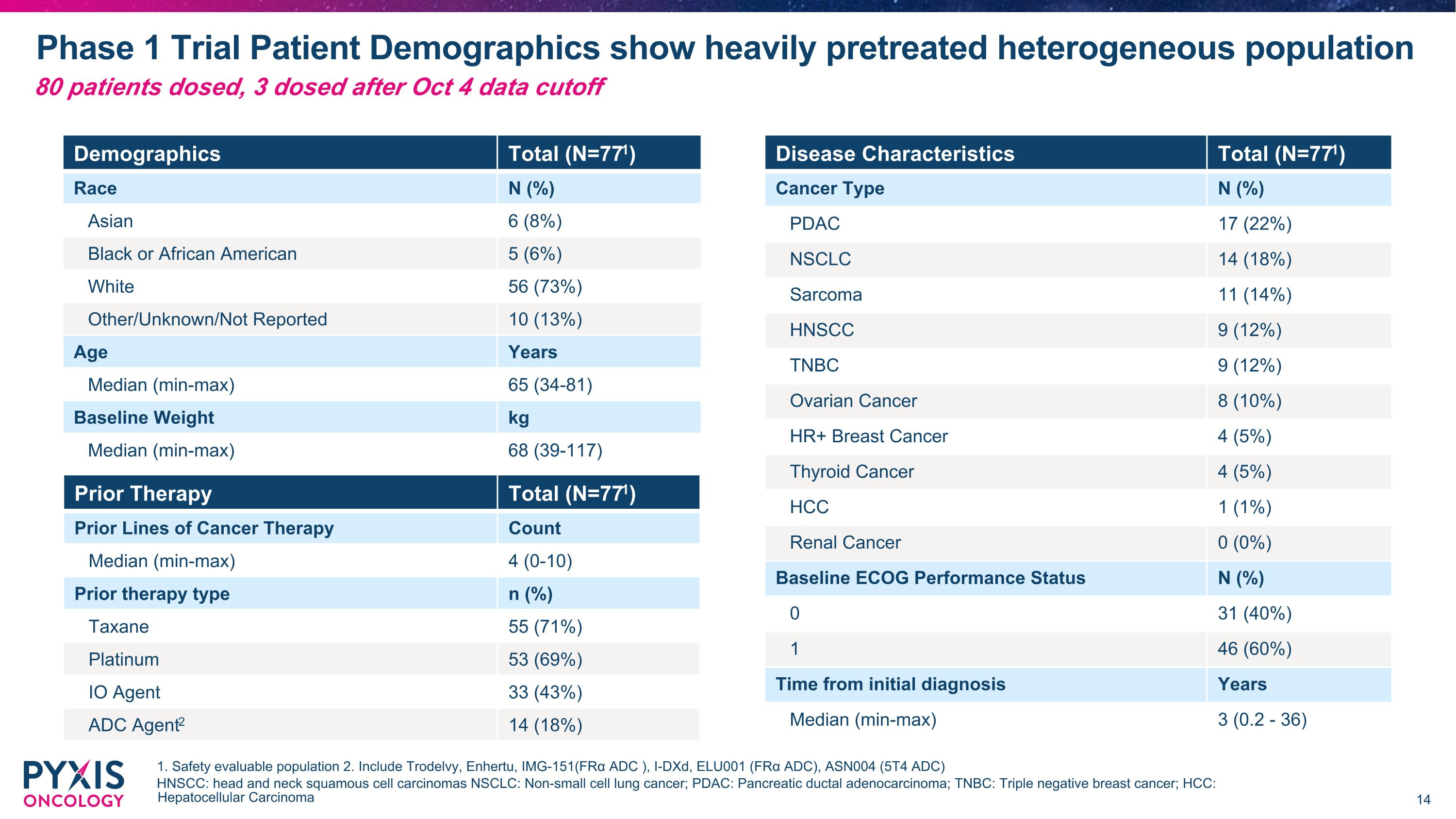
第1期 trial 患者人口統計顯示有重度接受過治療的異質性人群 1. 安全性可評估人群 2. 包括Trodelvy、Enhertu、IMG-151(FRα ADC)、I-DXd、ELU001 (FRα ADC)、ASN004 (5T4 ADC) HNSCC: 頭頸部鱗狀細胞癌 NSCLC: 非小細胞肺癌; PDAC: 胰臟導管腺癌; TNBC: 三陰性乳腺癌; HCC: 肝細胞癌 人口統計總計 (N=771) 種族 N (%) 亞洲人 6 (8%) 黑人或非裔美國人 5 (6%) 白人 56 (73%) 其他/未知/未報告 10 (13%) 年齡 年 Median (min-max) 65 (34-81) 基線體重 kg Median (min-max) 68 (39-117) 先前療法 總計 (N=771) 先前癌症療法劑量 次數 Median (min-max) 4 (0-10) 先前療法類型 n (%) Taxane 55 (71%) 鉑金 53 (69%) IOAgent 33 (43%) ADC Agent2 14 (18%) 疾病特徵 總計 (N=771) 癌症類型 N (%) PDAC 17 (22%) NSCLC 14 (18%) 肉瘤 11 (14%) HNSCC 9 (12%) TNBC 9 (12%) 卵巢癌 8 (10%) HR+ 乳腺癌 4 (5%) 甲狀腺癌 4 (5%) HCC 1 (1%) 腎癌 0 (0%) 基線ECOG表現狀態 N (%) 0 31 (40%) 1 46 (60%) 從初診斷到現在的時間 年 Median (min-max) 3 (0.2 - 36) 80位患者已服藥,3位在10月4日數據截止後服藥
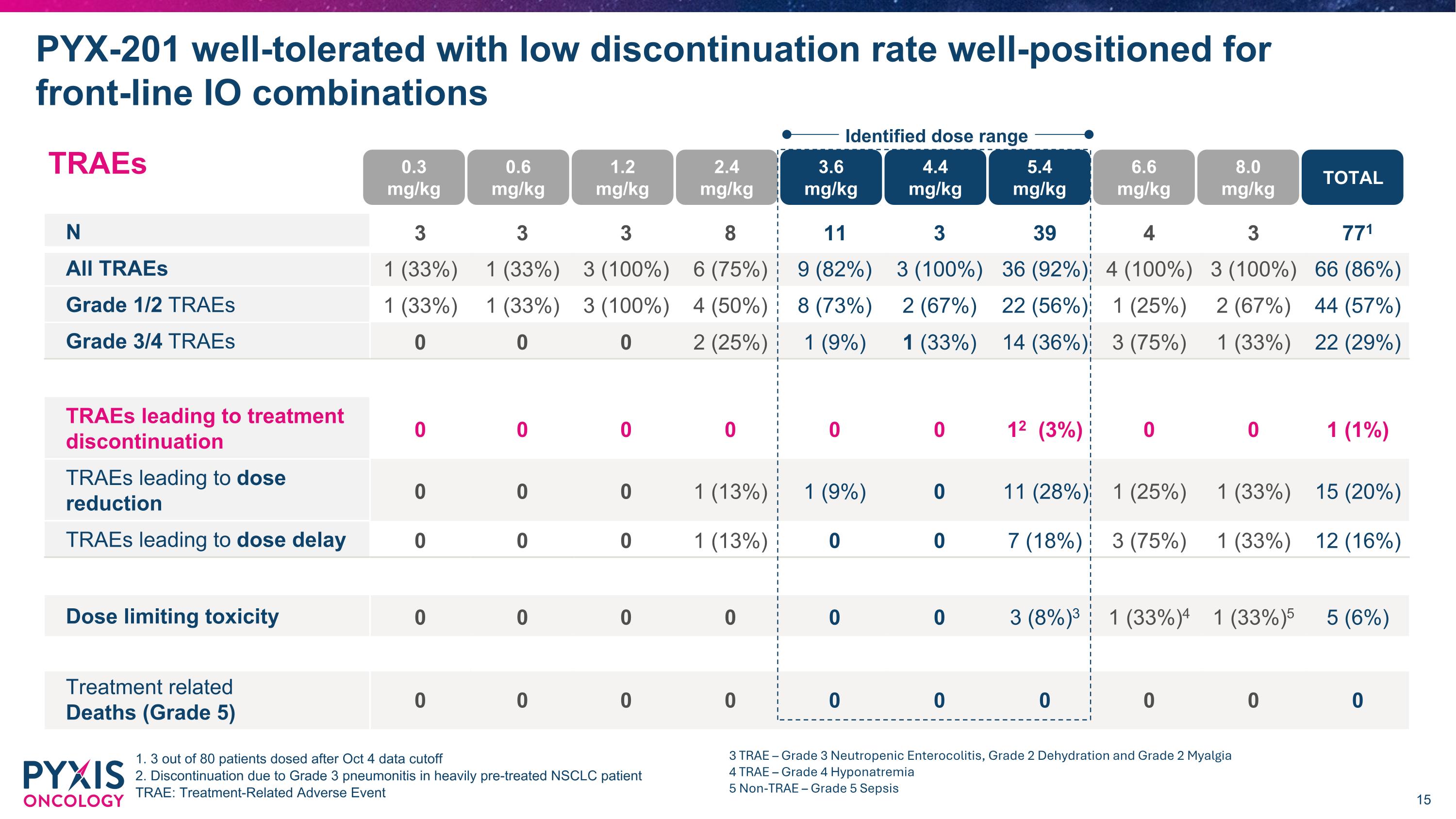
TRAEs N 3 3 3 8 11 3 39 4 3 771 所有TRAEs 1 (33%) 1 (33%) 3 (100%) 6 (75%) 9 (82%) 3 (100%) 36 (92%) 4 (100%) 3 (100%) 66 (86%) 1/2級TRAEs 1 (33%) 1 (33%) 3 (100%) 4 (50%) 8 (73%) 2 (67%) 22 (56%) 1 (25%) 2 (67%) 44 (57%) 3/4級TRAEs 0 0 0 2 (25%) 1 (9%) 1 (33%) 14 (36%) 3 (75%) 1 (33%) 22 (29%) TRAEs導致治療中斷 0 0 0 0 0 0 12 (3%) 0 0 1 (1%) TRAEs導致劑量減少 0 0 0 1 (13%) 1 (9%) 0 11 (28%) 1 (25%) 1 (33%) 15 (20%) TRAEs導致劑量延遲 0 0 0 1 (13%) 0 0 7 (18%) 3 (75%) 1 (33%) 12 (16%) 劑量限制毒性 0 0 0 0 0 0 3 (8%) 3 (33%) 1 (33%) 5 (6%) 治療相關死亡(5級) 0 0 0 0 0 0 0 0 0 0 PYX-201耐受性良好,中斷率低,對前線IO組合的佈局良好 1. 80名患者服藥後,10月4日數據截止 2. 因重度預先治療的NSCLC患者的3級肺炎而中斷治療 TRAE:治療相關不良事件 0.3 mg/kg 0.6 mg/kg 1.2 mg/kg 2.4 mg/kg 3.6 mg/kg 4.4 mg/kg 5.4 mg/kg 6.6 mg/kg 8.0 mg/kg 總體 確定的劑量範圍 3 TRAE – 3級中性粒細胞性腸炎,2級脫水和2級肌肉疼痛 4 TRAE – 4級低鈉血症 5 非TRAE – 5級敗血症
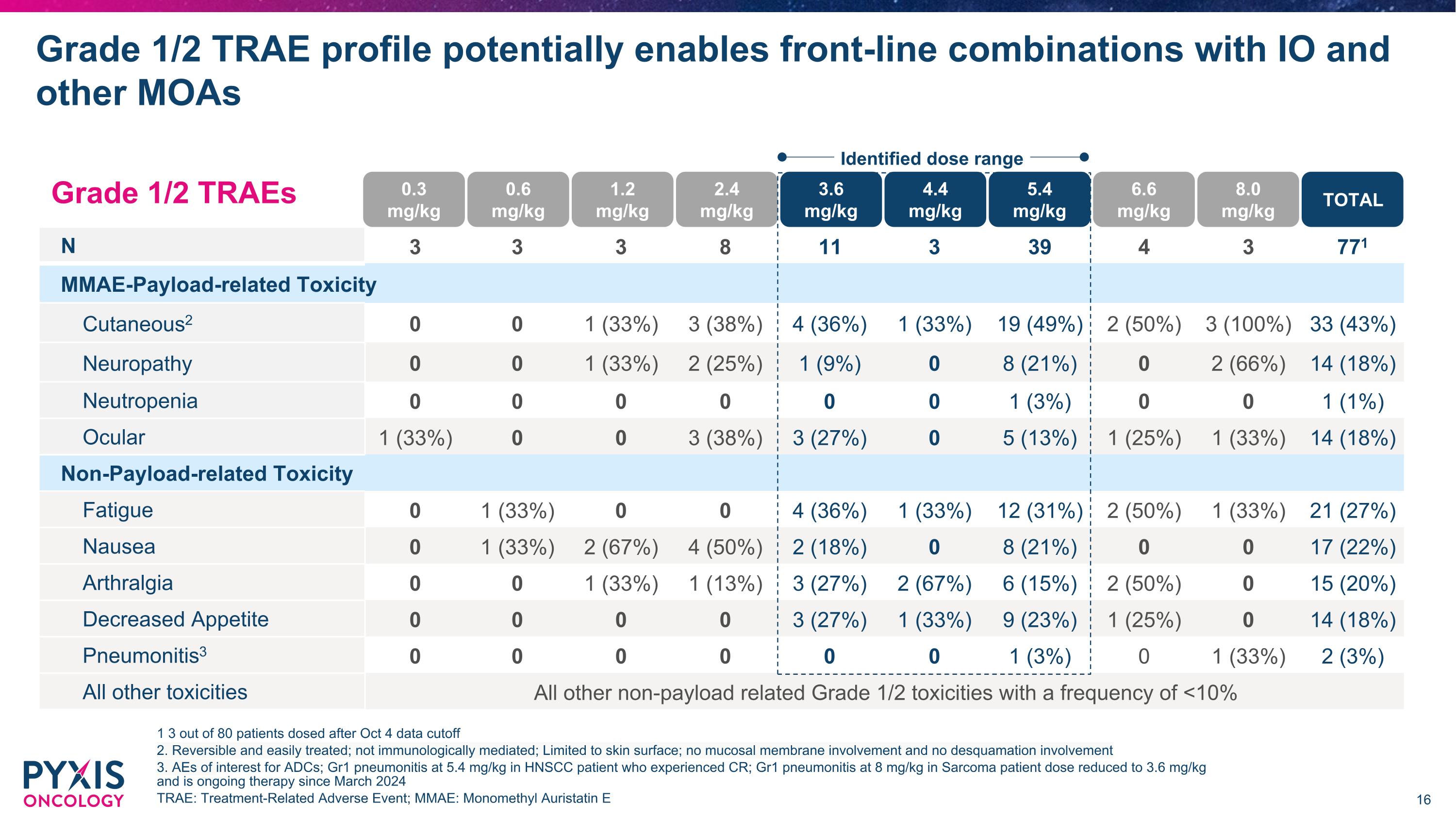
N 3 3 3 8 11 3 39 4 3 771 MMAE-Payload-related Toxicity Cutaneous2 0 0 1 (33%) 3 (38%) 4 (36%) 1 (33%) 19 (49%) 2 (50%) 3 (100%) 33 (43%) Neuropathy 0 0 1 (33%) 2 (25%) 1 (9%) 0 8 (21%) 0 2 (66%) 14 (18%) Neutropenia 0 0 0 0 0 0 1 (3%) 0 0 1 (1%) Ocular 1 (33%) 0 0 3 (38%) 3 (27%) 0 5 (13%) 1 (25%) 1 (33%) 14 (18%) Non-Payload-related Toxicity Fatigue 0 1 (33%) 0 0 4 (36%) 1 (33%) 12 (31%) 2 (50%) 1 (33%) 21 (27%) Nausea 0 1 (33%) 2 (67%) 4 (50%) 2 (18%) 0 8 (21%) 0 0 17 (22%) Arthralgia 0 0 1 (33%) 1 (13%) 3 (27%) 2 (67%) 6 (15%) 2 (50%) 0 15 (20%) Decreased Appetite 0 0 0 0 3 (27%) 1 (33%) 9 (23%) 1 (25%) 0 14 (18%) Pneumonitis3 0 0 0 0 0 0 1 (3%) 0 1 (33%) 2 (3%) All other toxicities All other non-payload related Grade 1/2 toxicities with a frequency of <10% Grade 1/2 TRAE profile potentially enables front-line combinations with IO and other MOAs 1 3 out of 80 patients dosed after Oct 4 data cutoff 2. Reversible and easily treated; not immunologically mediated; Limited to skin surface; no mucosal membrane involvement and no desquamation involvement 3. AEs of interest for ADCs; Gr1 pneumonitis at 5.4 mg/kg in HNSCC patient who experienced CR; Gr1 pneumonitis at 8 mg/kg in Sarcoma patient dose reduced to 3.6 mg/kg and is ongoing therapy since March 2024 TRAE: Treatment-Related Adverse Event; MMAE: Monomethyl Auristatin E 0.3 mg/kg 0.6 mg/kg 1.2 mg/kg 2.4 mg/kg 3.6 mg/kg 4.4 mg/kg 5.4 mg/kg 6.6 mg/kg 8.0 mg/kg TOTAL Identified dose range Grade 1/2 TRAEs
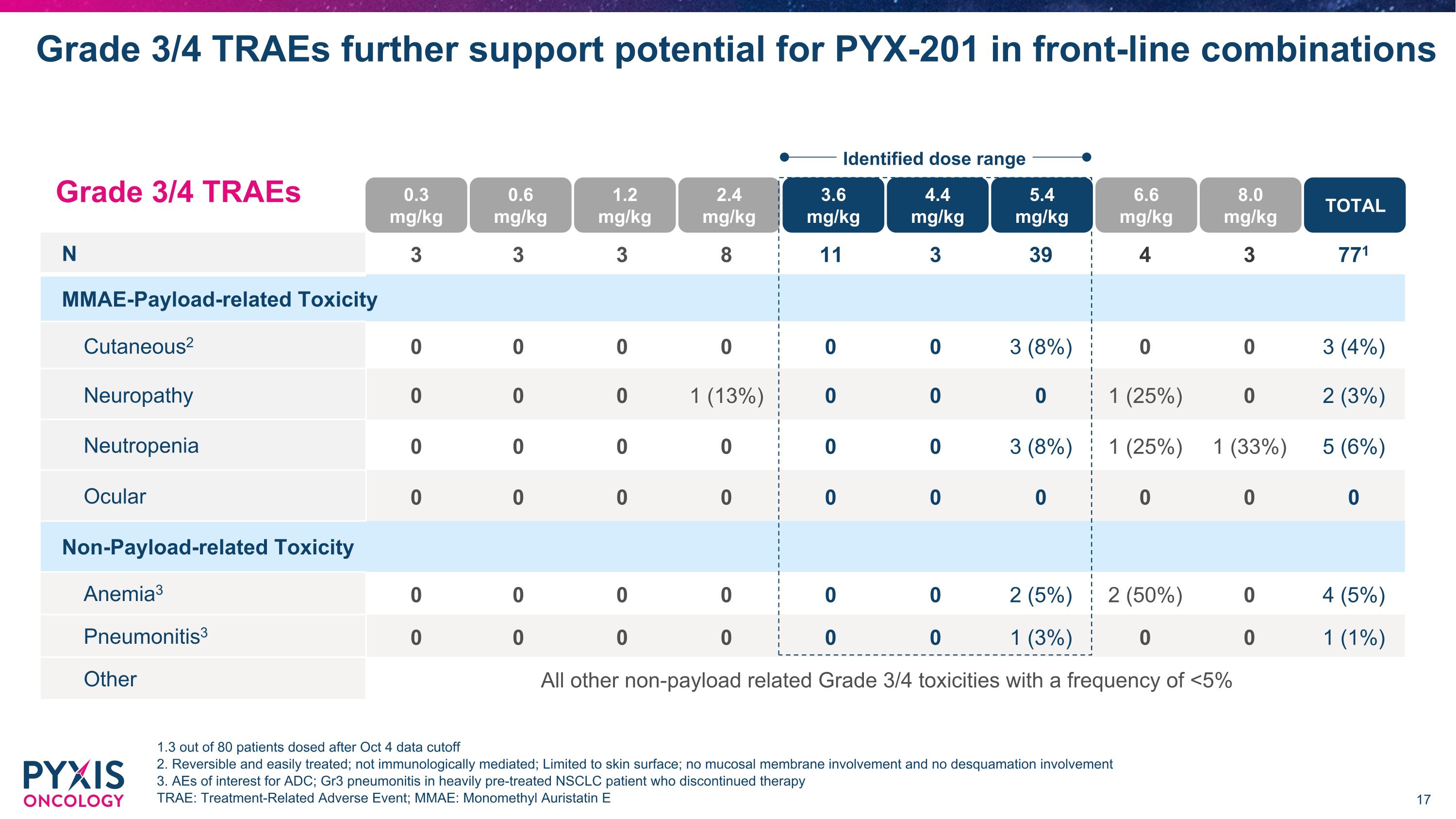
N 3 3 3 8 11 3 39 4 3 771 MMAE-Payload-related Toxicity Cutaneous2 0 0 0 0 0 0 3 (8%) 0 0 3 (4%) Neuropathy 0 0 0 1 (13%) 0 0 0 1 (25%) 0 2 (3%) Neutropenia 0 0 0 0 0 0 3 (8%) 1 (25%) 1 (33%) 5 (6%) Ocular 0 0 0 0 0 0 0 0 0 0 Non-Payload-related Toxicity Anemia3 0 0 0 0 0 0 2 (5%) 2 (50%) 0 4 (5%) Pneumonitis3 0 0 0 0 0 0 1 (3%) 0 0 1 (1%) Other All other non-payload related Grade 3/4 toxicities with a frequency of <5% Grade 3/4 TRAEs further support potential for PYX-201 in front-line combinations 1.3 out of 80 patients dosed after Oct 4 data cutoff 2. Reversible and easily treated; not immunologically mediated; Limited to skin surface; no mucosal membrane involvement and no desquamation involvement 3. AEs of interest for ADC; Gr3 pneumonitis in heavily pre-treated NSCLC patient who discontinued therapy TRAE: Treatment-Related Adverse Event; MMAE: Monomethyl Auristatin E Grade 3/4 TRAEs 0.3 mg/kg 0.6 mg/kg 1.2 mg/kg 2.4 mg/kg 3.6 mg/kg 4.4 mg/kg 5.4 mg/kg 6.6 mg/kg 8.0 mg/kg TOTAL Identified dose range
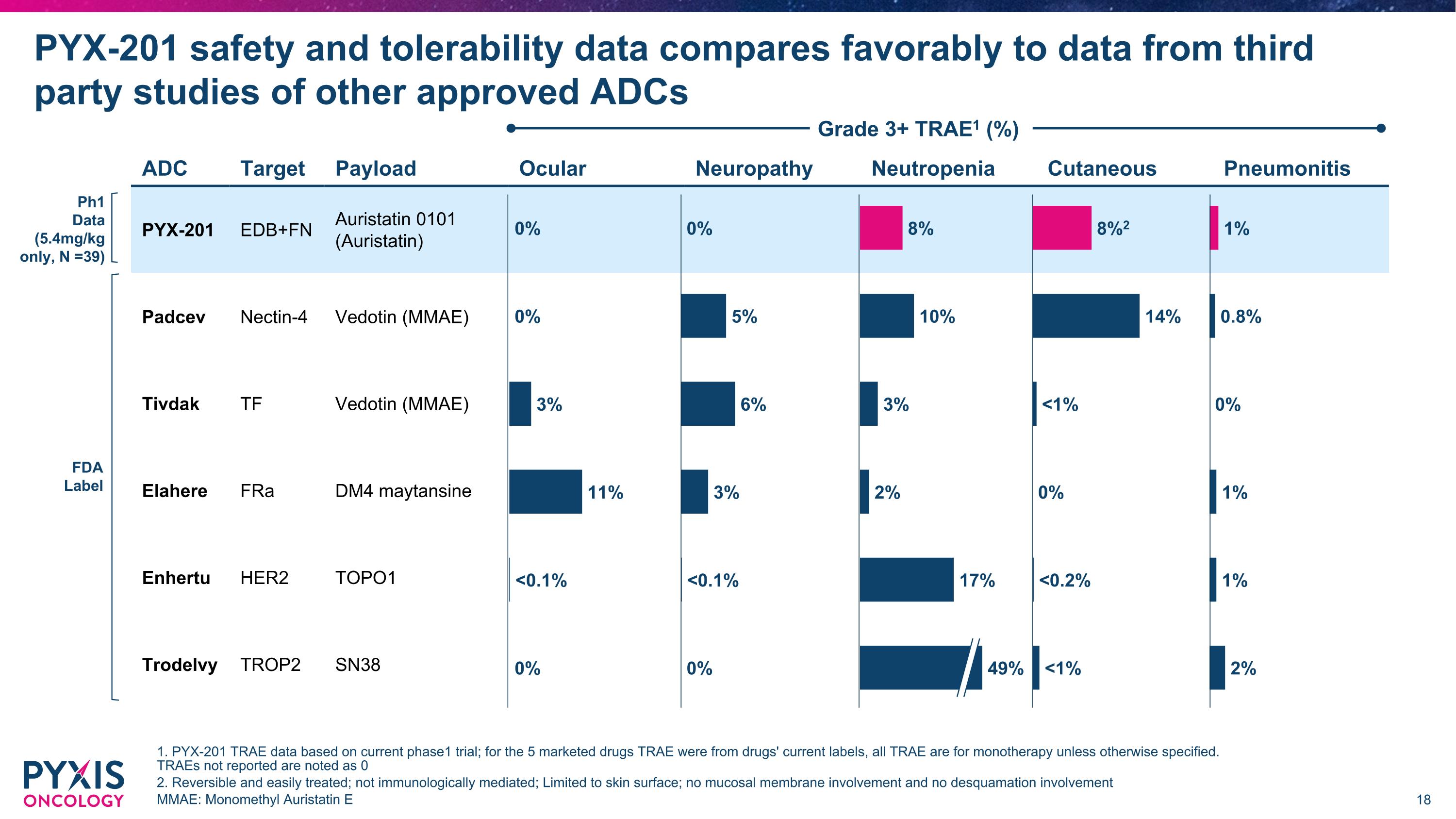
PYX-201的安全性和耐受性數據與來自其他已批准的ADC第三方研究的數據相比,表現良好。 ADC 目標 載藥 眼神經病 中性粒細胞減少症 皮膚性肺炎 PYX-201 EDB+FN Auristatin 0101 (Auristatin) Padcev Nectin-4 Vedotin (MMAE) Tivdak TF Vedotin (MMAE) Elahere FRa DM4 maytansine Enhertu HER2 TOPO1 Trodelvy TROP2 SN38 3級及以上TRAEs(%) 1. PYX-201 TRAE數據基於當前的第一階段試驗;對於5種市場化藥物,TRAEs來自藥物的當前標籤,所有TRAEs均為單藥療法,除非另有說明。未報告的TRAEs標註為0 2. 可逆且易於治療;非免疫介導;限於皮膚表面;無粘膜參與,且無脫屑參與 MMAE:單甲基Auristatin E 8%2 14% <1% 0% <0.2% <1% 0% 5% 6% 3% <0.1% 0% 8% 10% 3% 2% 17% 49% 0% 0% 3% 11% <0.1% 0% 1% 0.8% 0% 1% 1% 2% Ph1數據(僅5.4mg/kg,N=39)FDA標籤
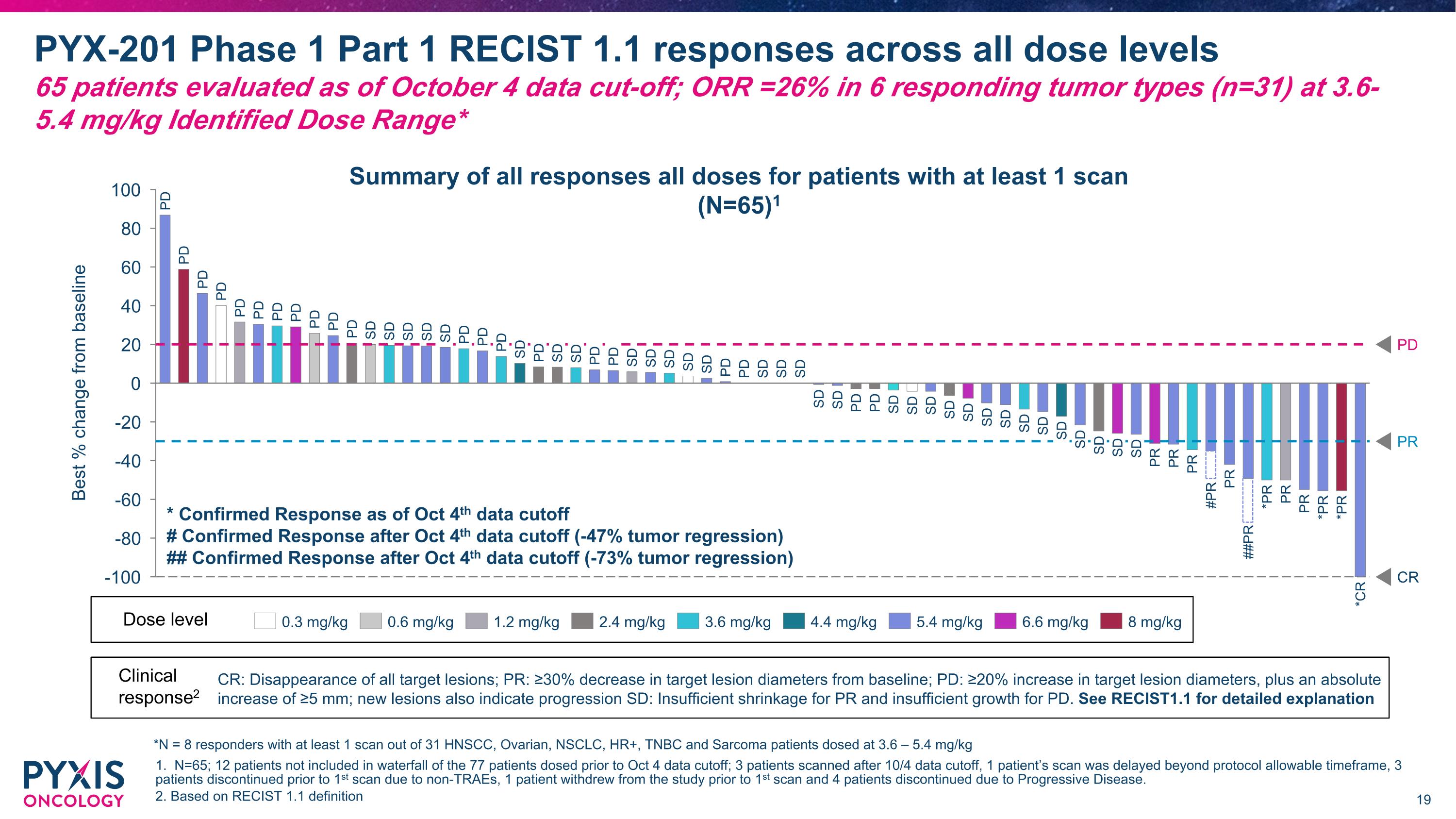
最佳%從基準變化 PR CR PD PD PD PD PD PD PD PD PD PD PD SD SD SD SD SD PD PD PD SD PD SD SD PD PD SD SD SD SD SD PD PD SD SD SD SD SD PD PD SD SD SD SD PD SD SD SD SD SD SD SD SD SD PR SD PR #PR PR ##PR *PR PR PR *PR *PR *CR PR PYX-201 第一階段第一部分 RECISt 1.1在所有劑量水平的反應數據 截至10月4日的數據截止,共評估了65名患者;ORR=26%,在6種回應的腫瘤類型中(n=31)使用3.6-5.4 mg/kg 確定劑量區間* 1. N=65;77名患者中的12名未包括在10月4日數據截止前的瀑布圖中;3名患者在10月4日數據截止後掃描,1名患者的掃描延遲至協議允許的時間範圍之外,3名患者因非TRAEs在首次掃描前退出,1名患者在首次掃描前退出研究,4名患者因疾病進展而退出。 2. 基於RECISt 1.1的定義 0.3 mg/kg 0.6 mg/kg 1.2 mg/kg 2.4 mg/kg 3.6 mg/kg 4.4 mg/kg 5.4 mg/kg 6.6 mg/kg 8 mg/kg 劑量級別 所有劑量下至少有1次掃描的患者的所有反應總結(N=65) 1 臨床反應2 CR:所有靶病變消失;PR:靶病變直徑從基準減少≥30%;PD:靶病變直徑增加≥20%,且絕對增加≥5毫米;新病變也表示進展 SD:對於PR不夠的縮小和對PD不夠的增長。詳細說明參見RECIST1.1 * 截至10月4日數據截止時的確認反應 # 10月4日數據截止後的確認反應(-47%腫瘤退化) ## 10月4日數據截止後的確認反應(-73%腫瘤退化) *N = 8名至少有1次掃描的回應者,來自31名HNSCC、卵巢、NSCLC、HR+、TNBC和肉瘤患者,以3.6 – 5.4 mg/kg劑量進行治療
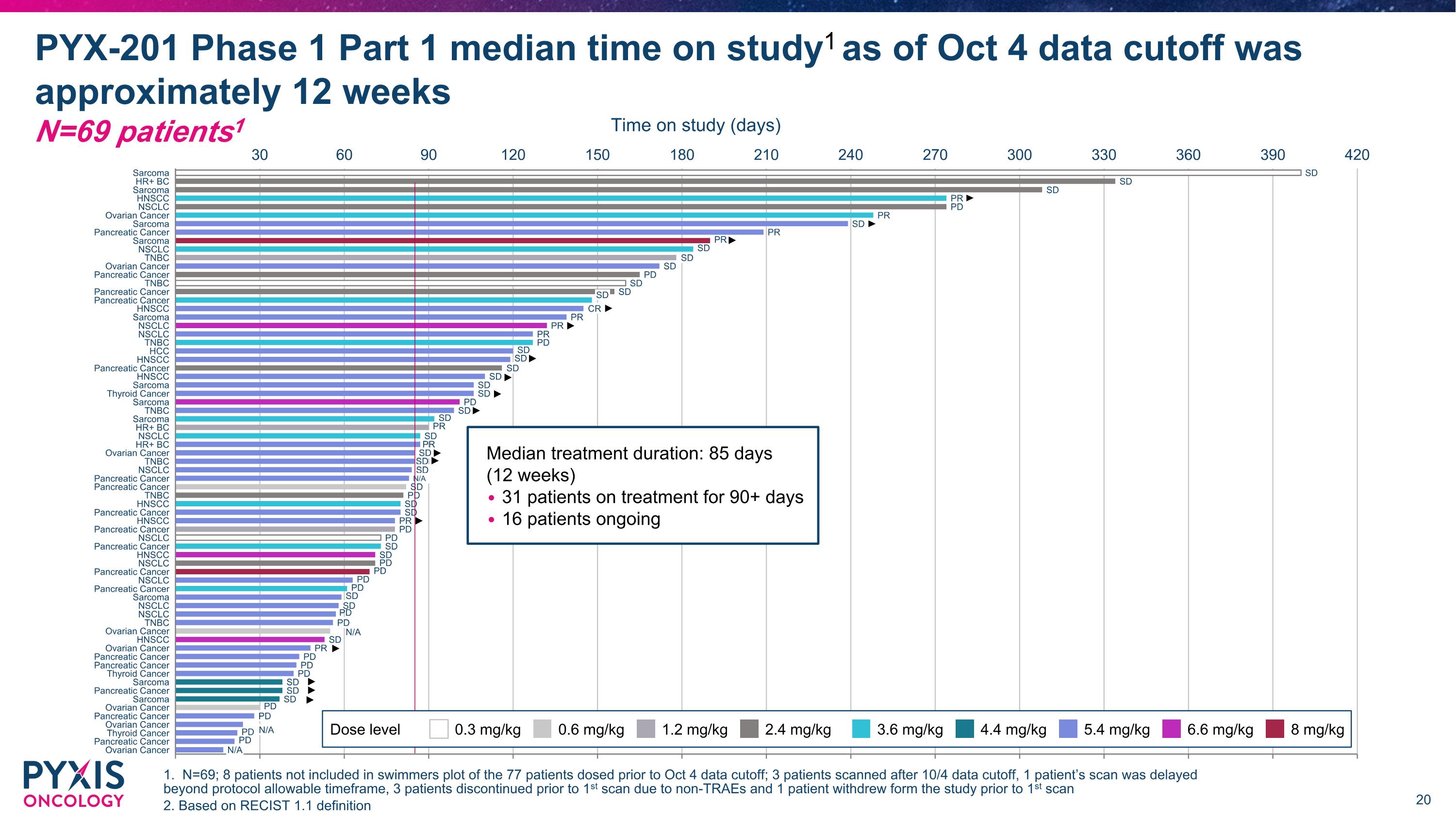

PYX-201在HNSCC患者中顯示出強烈的信號 確認劑量範圍為3.6 - 5.4 mg/kg (n=6) 100% DCR 由RECISt 1.1確認的ORR為50% & 2個PR 1個CR
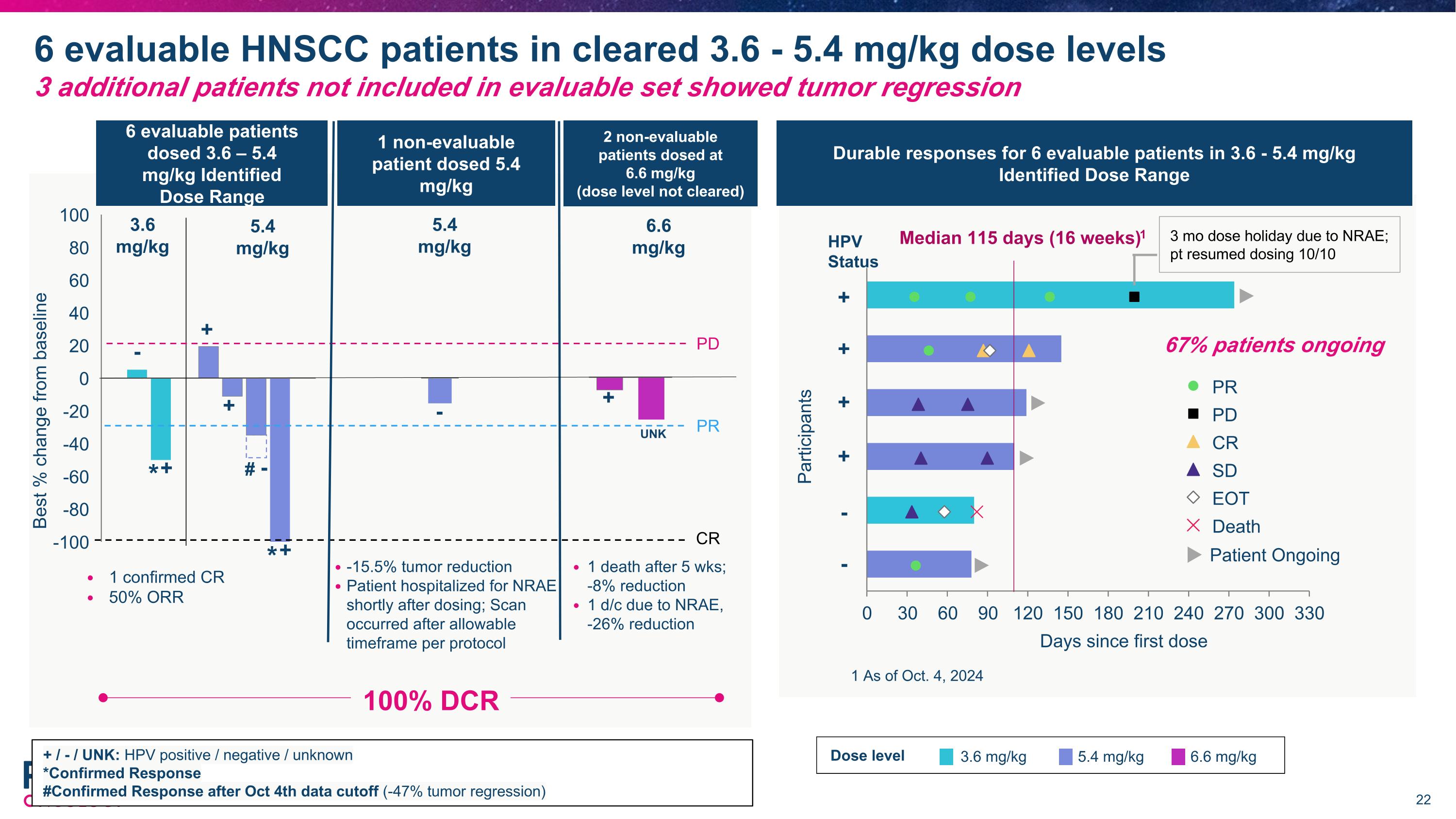
1個確認的CR 50% ORR 參與者 首劑給藥後天數 PR PD CR SD EOt 死亡 中位數115天(16週)1 3.6 - 5.4 mg/kg中對6名可評估患者的耐久性反應 確定的劑量範圍 患者 持續 -100 -80 -60 -40 -20 0 20 40 60 80 100 3.6 mg/kg 5.4 mg/kg + / - / UNK: HPV陽性 / 陰性 / 未知 *確認的反應 #10月4日數據截止後的確認反應 (-47% 腫瘤退縮) #最佳%變化基線 PD PR CR * + + + * + 67%患者持續 6.6 mg/kg + 6名可評估患者給藥3.6 – 5.4 mg/kg 確定的劑量範圍 1名非可評估患者給藥5.4 mg/kg 1 截至2024年10月4日 2名非可評估患者給藥6.6 mg/kg(劑量級別未清除) -15.5%腫瘤縮小 患者於給藥後不久因NRAE住院;掃描在協議允許的時間範圍之後 1名患者於5週後死亡;-8%縮小 1名因NRAE而中止,-26%縮小 5.4 mg/kg 3.6 mg/kg 5.4 mg/kg 劑量級別 6.6 mg/kg 6名可評估的HNSCC患者在3.6 - 5.4 mg/kg劑量級別中獲得批准 另外3名未包含在可評估集中的患者顯示腫瘤退縮 - - UNk - 由於NRAE的3個月劑量假期;患者於10/10重新給藥 - + HPV狀態 + - + + 100% DCR
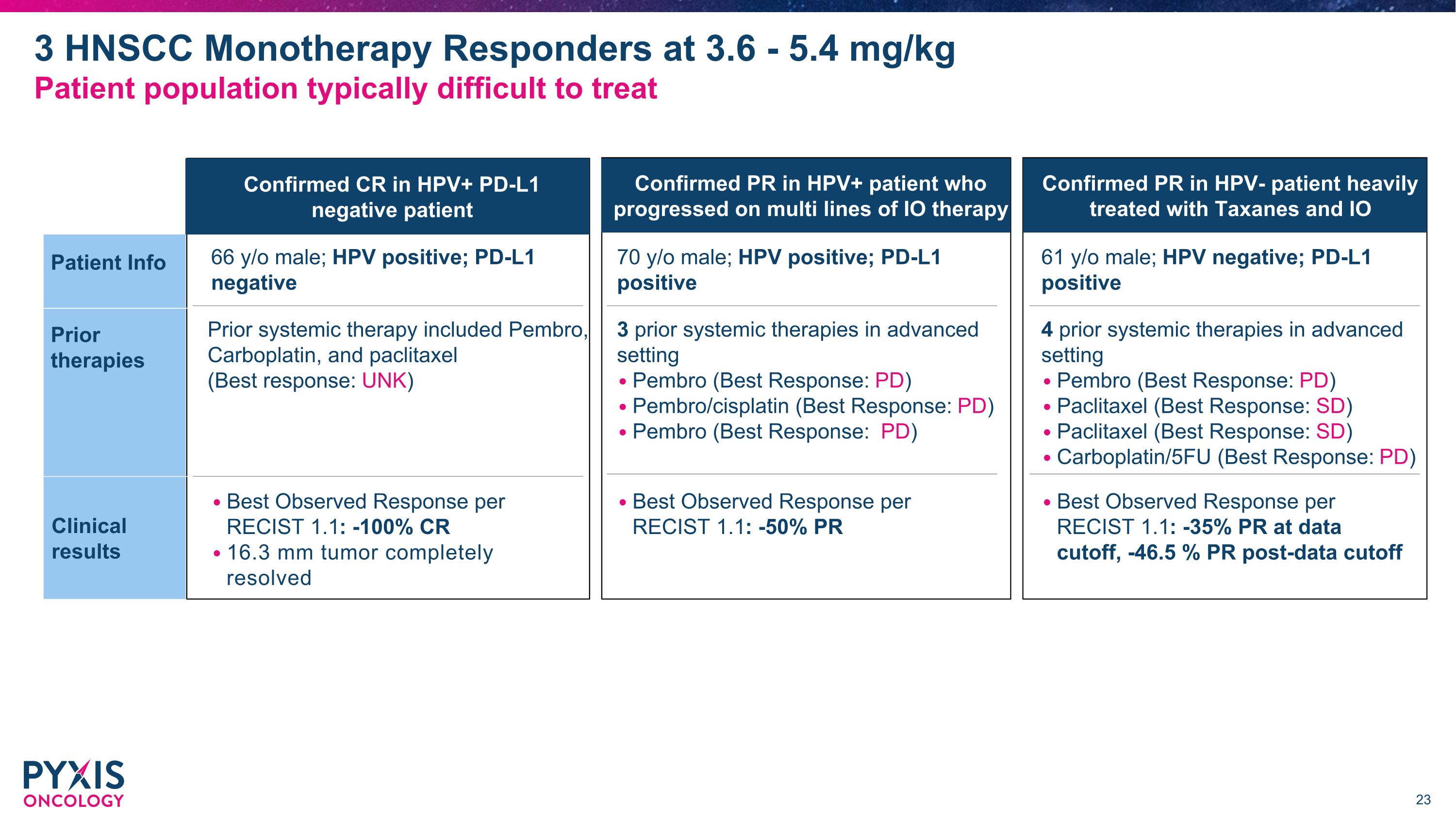
確認HPV陽性PD-L1陰性患者的完全反應 確認HPV陰性患者在經過重度Taxanes和IO治療後的部分反應 確認HPV陽性患者在多條IO療法進展後的部分反應 根據RECISt 1.1的最佳觀察反應: -100% 完全反應 16.3毫米腫瘤完全消失 66歲男性;HPV陽性;PD-L1陰性 根據RECISt 1.1的最佳觀察反應: -50% 部分反應 70歲男性;HPV陽性;PD-L1陽性 61歲男性;HPV陰性;PD-L1陽性 患者信息 之前的 治療 臨床 結果 之前的全身治療包括pembrolizumab、卡鉑和紫杉醇(最佳反應:不明) 在晚期設定下有3次之前的全身治療 pembrolizumab(最佳反應:PD) pembrolizumab/順鉑(最佳反應:PD) pembrolizumab(最佳反應:PD) 在晚期設定下有4次之前的全身治療 pembrolizumab(最佳反應:PD) 紫杉醇(最佳反應:穩定病灶) 紫杉醇(最佳反應:穩定病灶) 卡鉑/5FU(最佳反應:PD) 3名HNSCC單療法反應者在3.6 - 5.4 mg/kg 患者群體通常難以治療 根據RECISt 1.1的最佳觀察反應: -35% 部分反應(截至數據截止), -46.5% 部分反應(截止後數據)
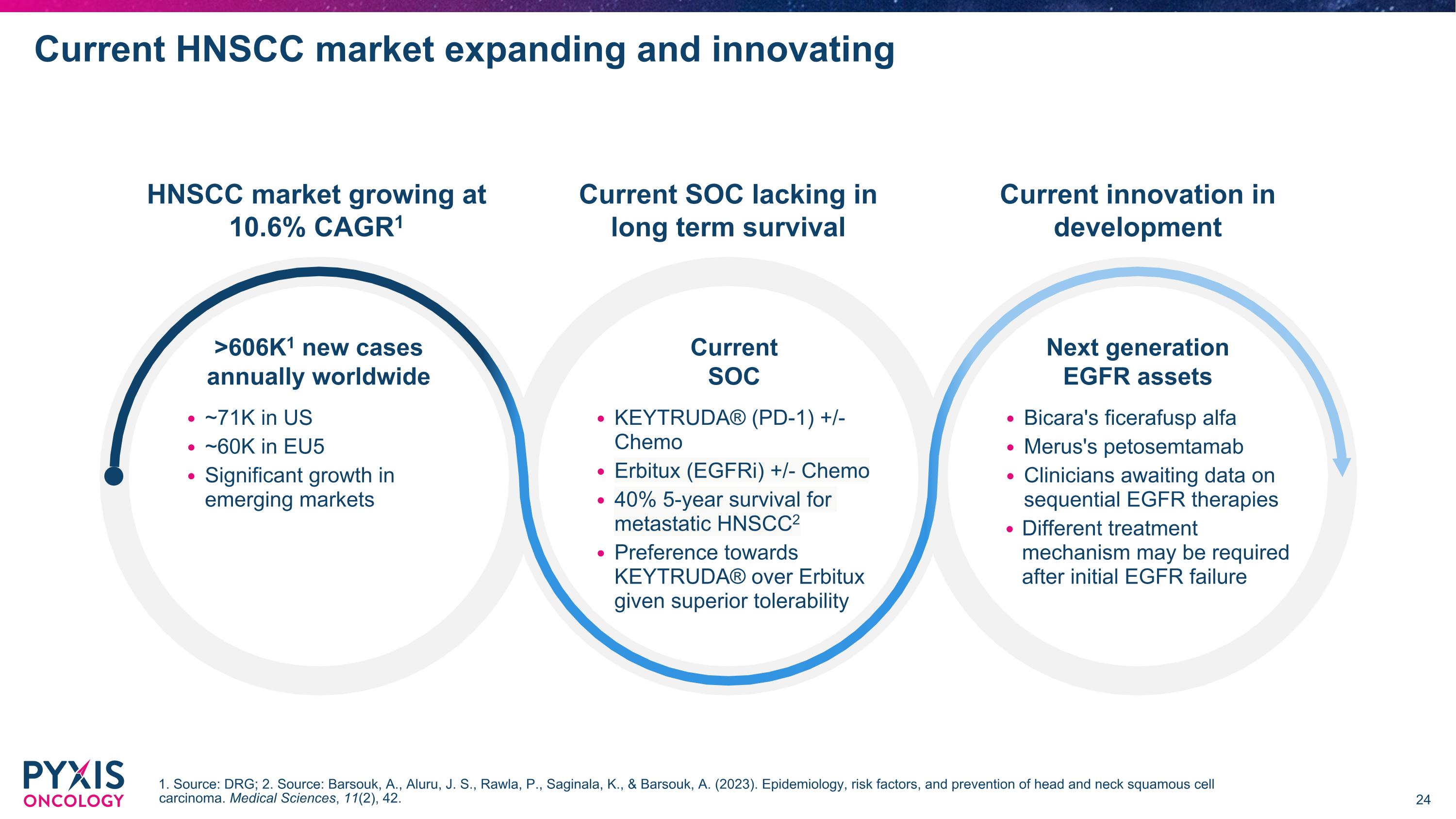
當前的HNSCC市場正在擴展和創新 HNSCC市場以10.6%的年均增長率增長,每年在全球新增超過606K個病例 當前的 標準治療 當前的標準治療缺乏長期生存率 當前的創新正在開發中 下一代 EGFR資產 1. 來源:DRG;2. 來源:Barsouk, A., Aluru, J. S., Rawla, P., Saginala萬., & Barsouk, A. (2023). 頭頸部鱗狀細胞癌的流行病學、風險因素和預防。 醫療科學,11(2),42。 美國約7.1萬 歐盟約6萬 在新興市場中顯著增長 KEYTRUDA®(PD-1)+/- 化學療法 Erbitux(EGFR抑制劑)+/- 化學療法 40% 轉移性HNSCC的5年生存率 相較於Erbitux,患者對KEYTRUDA®的偏好更高,因為其更好的耐受性 Bicara的ficerafusp alfa merus的petosemtamab 臨床醫生在等待有關連續EGFR療法的數據 在初始EGFR失敗後可能需要不同的治療機制
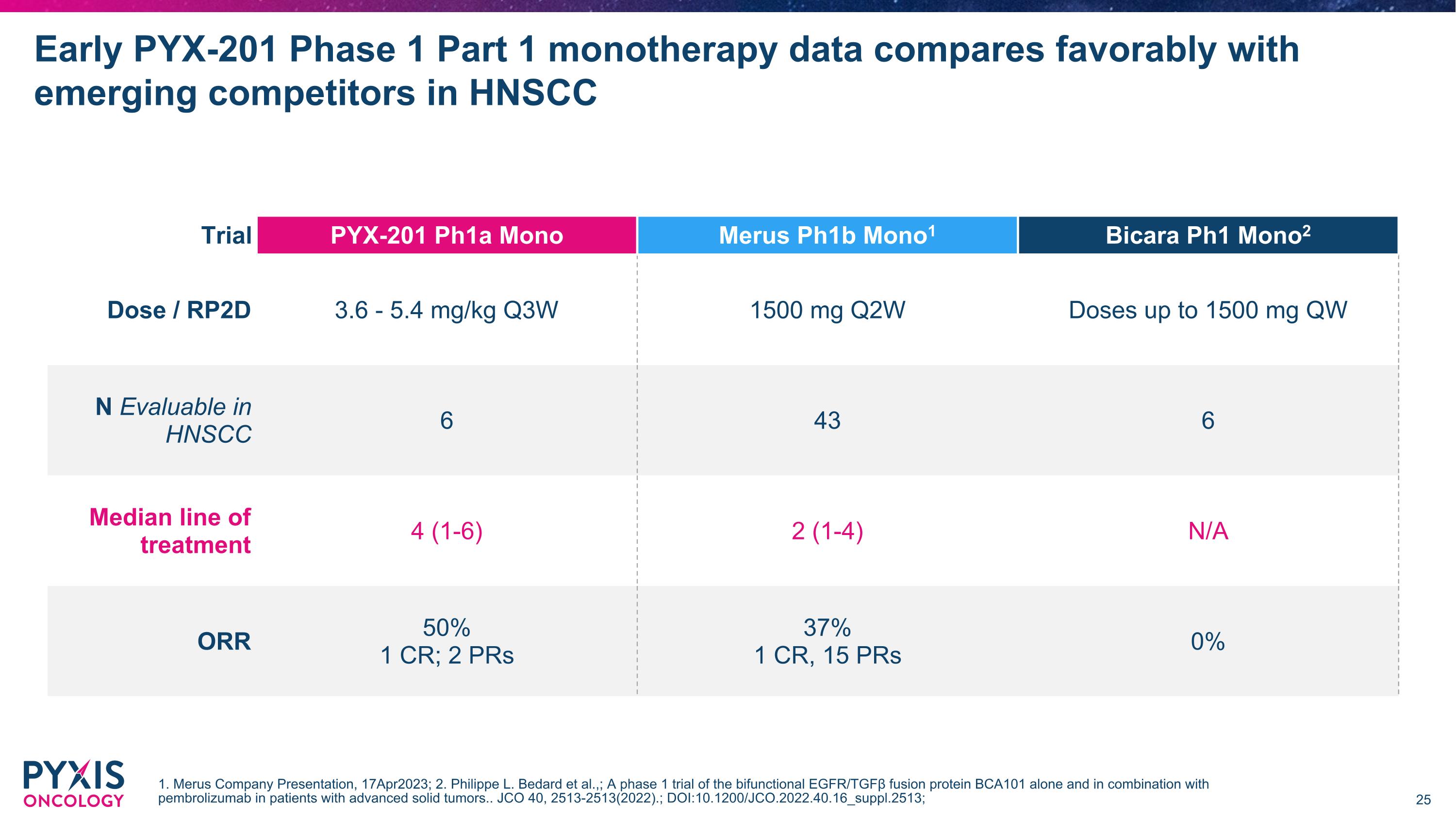
早期PYX-201第一階段單藥數據與HNSCC中的新興競爭對手相比表現良好 1. merus公司簡報,2023年4月17日;2. Philippe L. Bedard等;針對晚期實體腫瘤患者的雙功能EGFR/TGFβ融合蛋白BCA101的第一階段試驗.. JCO 40,2513-2513(2022)。;DOI:10.1200/JCO.2022.40.16_suppl.2513;試驗PYX-201 Ph1a Mono merus Ph10億Mono1 劑量 / RP2D 3.6 - 5.4 mg/kg Q3W 1500 mg Q2W 劑量最高可達1500 mg QW N 在HNSCC中可評估 6 43 6 治療線數中位數 4(1-6) 2(1-4) 不適用 ORR 50% 1 完全反應;2 部分反應 37% 1 完全反應,15 部分反應 0%
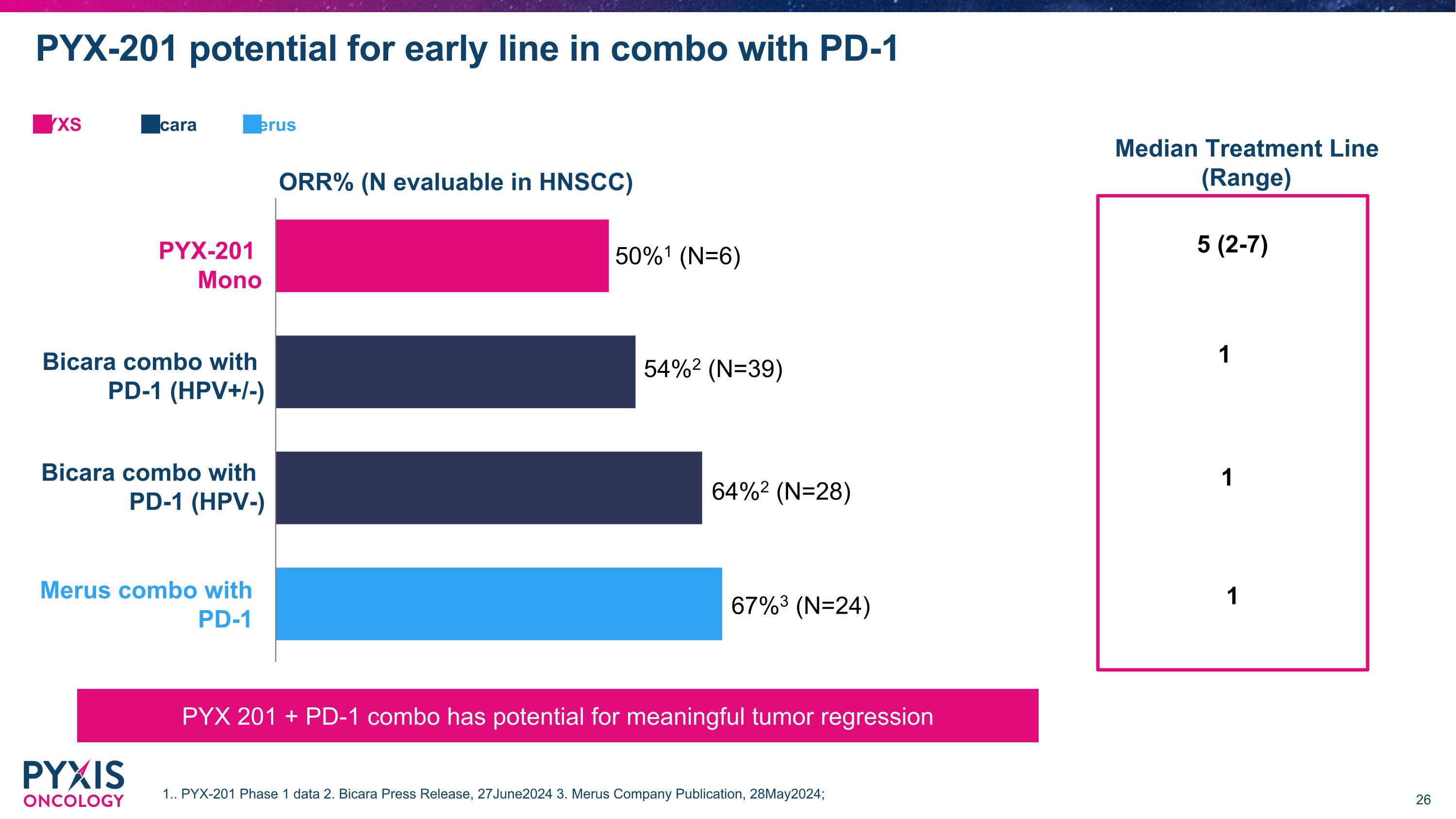
PYX-201在與PD-1聯合療法中的早期線索潛力 PYX-201單藥療法 Merus與PD-1的聯合療法 Bicara與PD-1的聯合療法(HPV-) 客觀反應率(可評估人數於HNSCC) 50%1 (N=6) 67%3 (N=24) 64%2 (N=28) Bicara與PD-1的聯合療法(HPV+/-) Bicara Merus PYXS 1.. PYX-201第1階段數據 2. Bicara新聞稿, 2024年6月27日 3. Merus公司刊物, 2024年5月28日; 中位治療線(區間) 5 (2-7) 1 1 1 PYX 201 + PD-1聯合療法在肿瘤回縮方面潛力重大 54%2 (N=39)
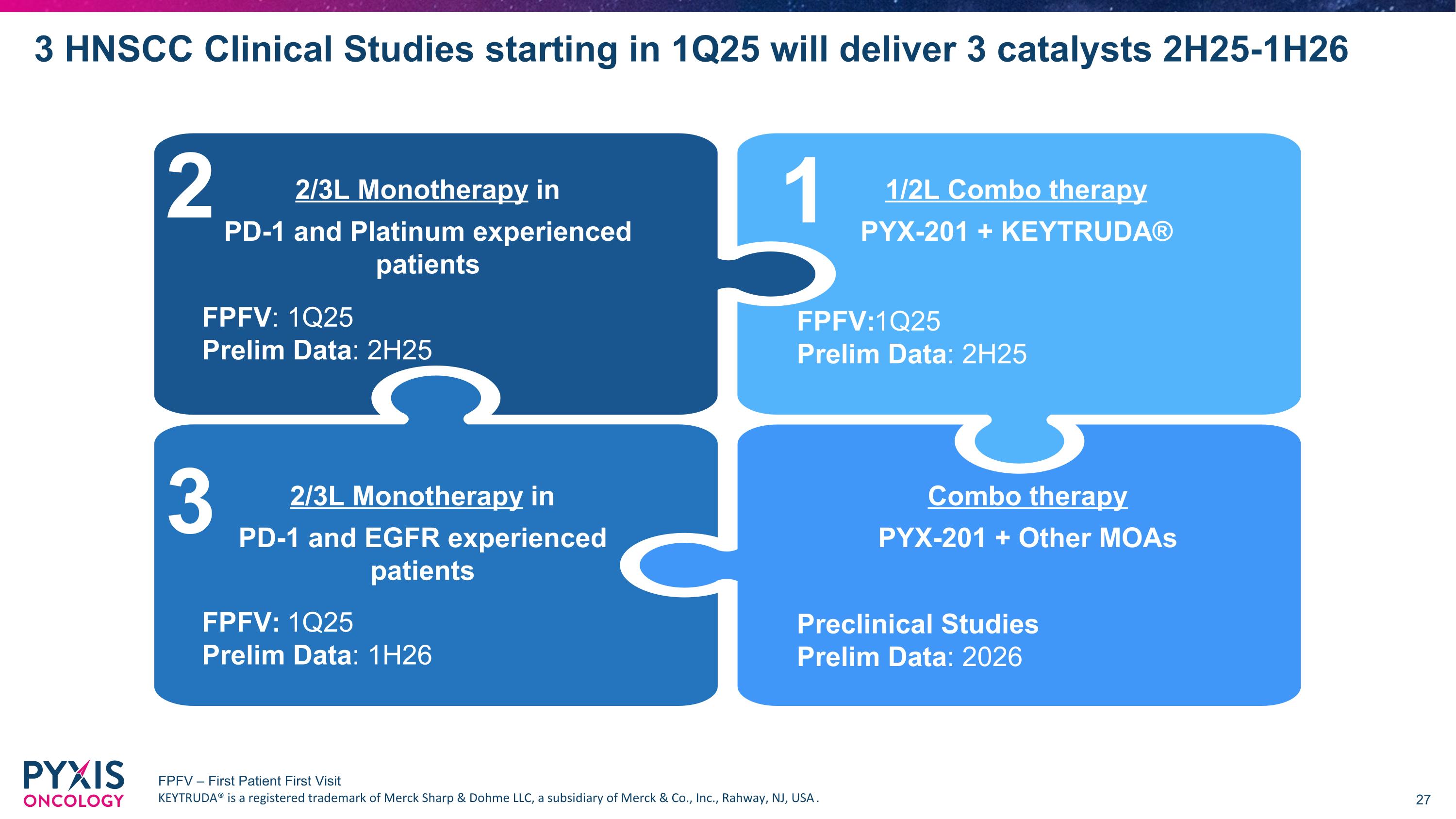
3個HNSCC臨床研究將於2025年第一季度開始,將帶來3個催化劑 2025年第二半-2026年第一半 2/3L單藥療法適用於PD-1和EGFR經驗患者 潛在機會:這些患者在化療之外的下一組選擇有限 1/2L聯合療法PYX-201 + KEYTRUDA® 潛在機會:改善耐受性並增強KEYTRUDA®的影響 2/3L單藥療法適用於PD-1和鉑金經驗患者 潛在機會:聯合療法可能無法長時間耐受 聯合療法PYX-201 + 其他作用機制(前期研究) 潛在機會:細胞外作用機制可能增強當前和新興療法(例如,EGFR,VEGF,鉑金) 2/3L單藥療法適用於PD-1和EGFR經驗患者 1/2L聯合療法PYX-201 + KEYTRUDA® 2/3L單藥療法適用於PD-1和鉑金經驗患者 聯合療法PYX-201 + 其他作用機制 2 3 1 FPFV:2025年第一季度 初步數據:2025年下半年 FPFV:2025年第一季度 初步數據:2026年上半年 前期研究 初步數據:2026年 FPFV:2025年第一季度 初步數據:2025年下半年 FPFV – 首位患者首次就診 KEYTRUDA®是默沙東的商標,屬於默沙東公司,位於美國新澤西州拉威。
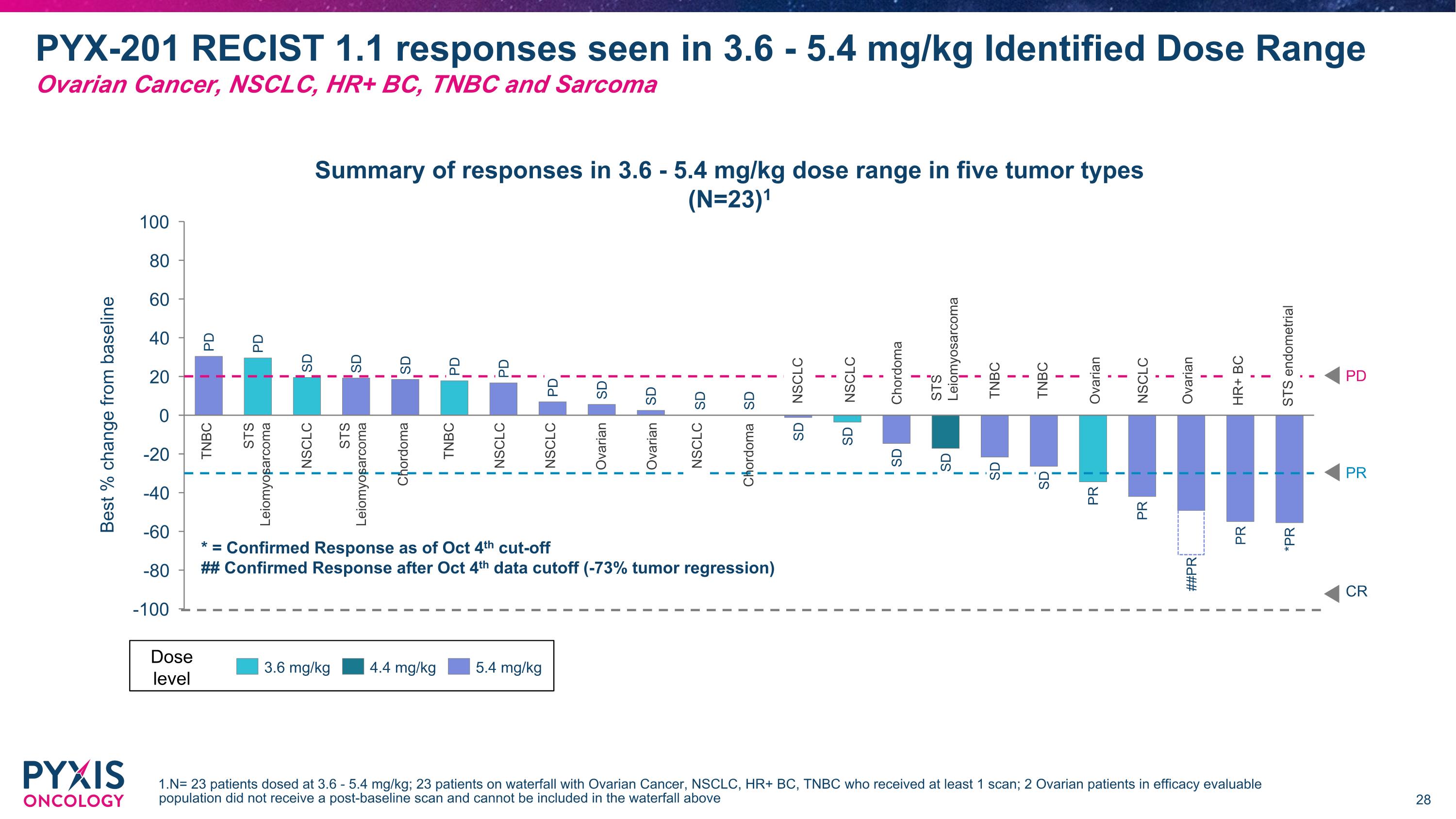
PD PD SD SD SD PD PD 最佳 % 從基線變化 SD SD SD SD SD SD SD SD SD SD PR PR ##PR PR *PR PD PYX-201 RECISt 1.1 在 3.6 - 5.4 mg/kg 的反應 識別劑量區間 卵巢癌,NSCLC,HR+ BC,TNBC 和肉瘤 * = 截至10月4日的確認反應 ## 截至10月4日數據截止後的確認反應 (-73%腫瘤回縮) 3.6 mg/kg 4.4 mg/kg 5.4 mg/kg 劑量水平 在五種腫瘤類型中 3.6 - 5.4 mg/kg 劑量區間的反應總結(N=23)1 CR PD PR TNBC STS 平滑肌肉瘤 NSCLC 腔骨瘤 TNBC NSCLC NSCLC 卵巢 卵巢 腔骨瘤 NSCLC NSCLC TNBC TNBC NSCLC 卵巢 NSCLC 卵巢 HR+ BC STS 子宮內膜 腔骨瘤 STS 平滑肌肉瘤 STS 平滑肌肉瘤 1.N= 23名患者接受3.6 - 5.4 mg/kg劑量;23名接受至少1次掃描的卵巢癌,NSCLC,HR+ BC,TNBC患者;2名卵巢患者在療效可評估人群中未接受基線後的掃描,因此無法計入上述水瀑表。
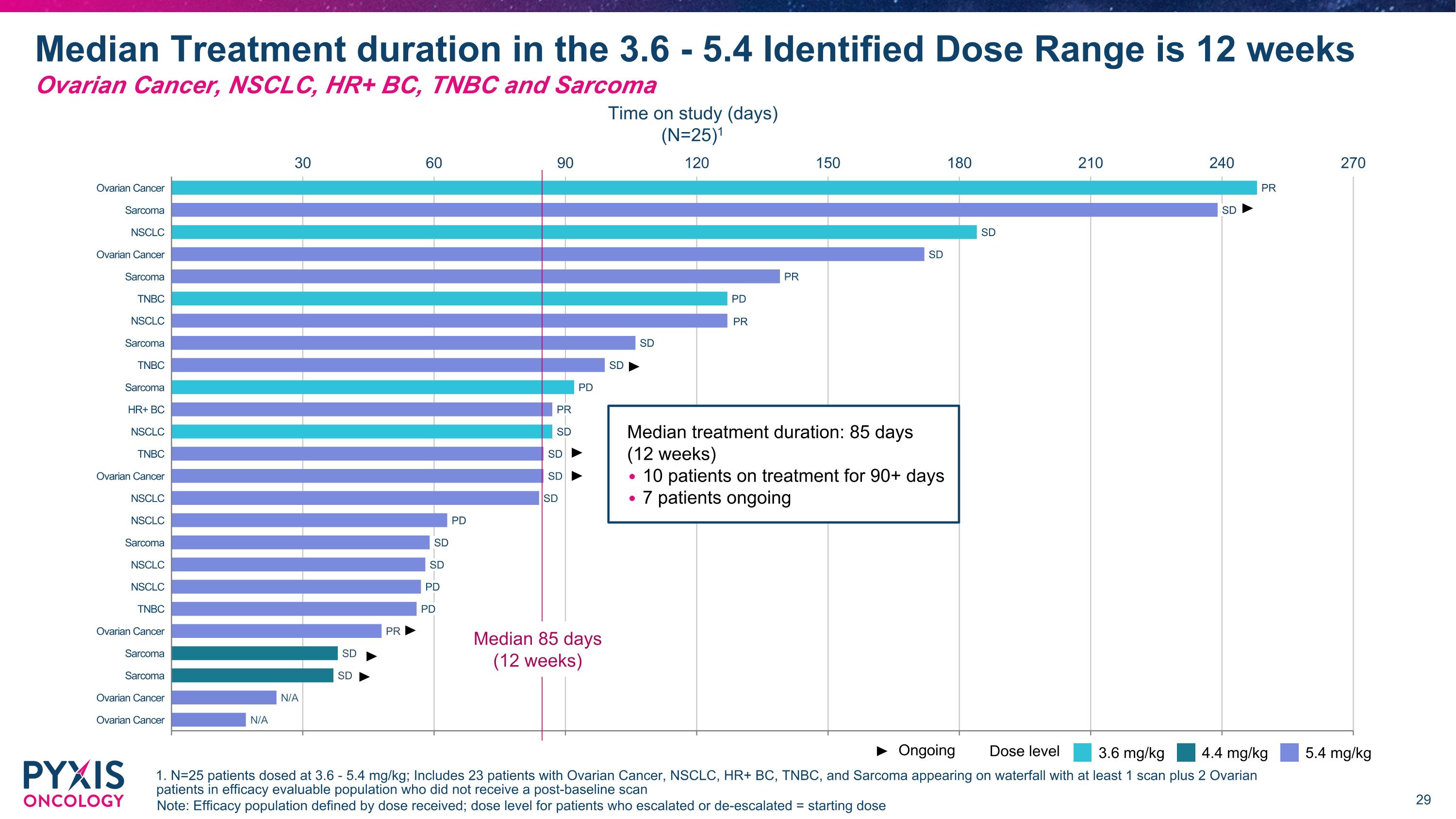
30 60 90 120 150 180 210 240 270 肉瘤 NSCLC 卵巢癌 肉瘤 TNBC NSCLC 肉瘤 TNBC 肉瘤 HR+ BC NSCLC TNBC 卵巢癌 NSCLC NSCLC 肉瘤 NSCLC NSCLC TNBC 卵巢癌 肉瘤 肉瘤 卵巢癌 卵巢癌 PR SD SD SD PR PD SD SD PD PR 卵巢癌 SD SD SD PD SD SD SD PD PR SD SD N/A N/A PD 注意:療效人群根據接受的劑量定義;對於升級或減少劑量的患者 = 開始劑量 協議劑量範圍(3.6 - 5.4)中位數治療時間為 12 週 卵巢癌、NSCLC、HR+ BC、TNBC 和肉瘤 3.6 mg/kg 4.4 mg/kg 5.4 mg/kg 劑量水平 研究期間(天) (N=25) 1 持續中 PR 中位數 85 天 (12 週) 中位數治療時間:85 天 (12 週) 10 名患者接受治療超過 90 天 7 名患者持續中 1. N=25 名接受 3.6 - 5.4 mg/kg 的患者;包括 23 名卵巢癌、NSCLC、HR+ BC、TNBC 和肉瘤患者,並且至少有 1 次掃描加上 2 名未接受基線後掃描的卵巢患者在療效可評估人群中。
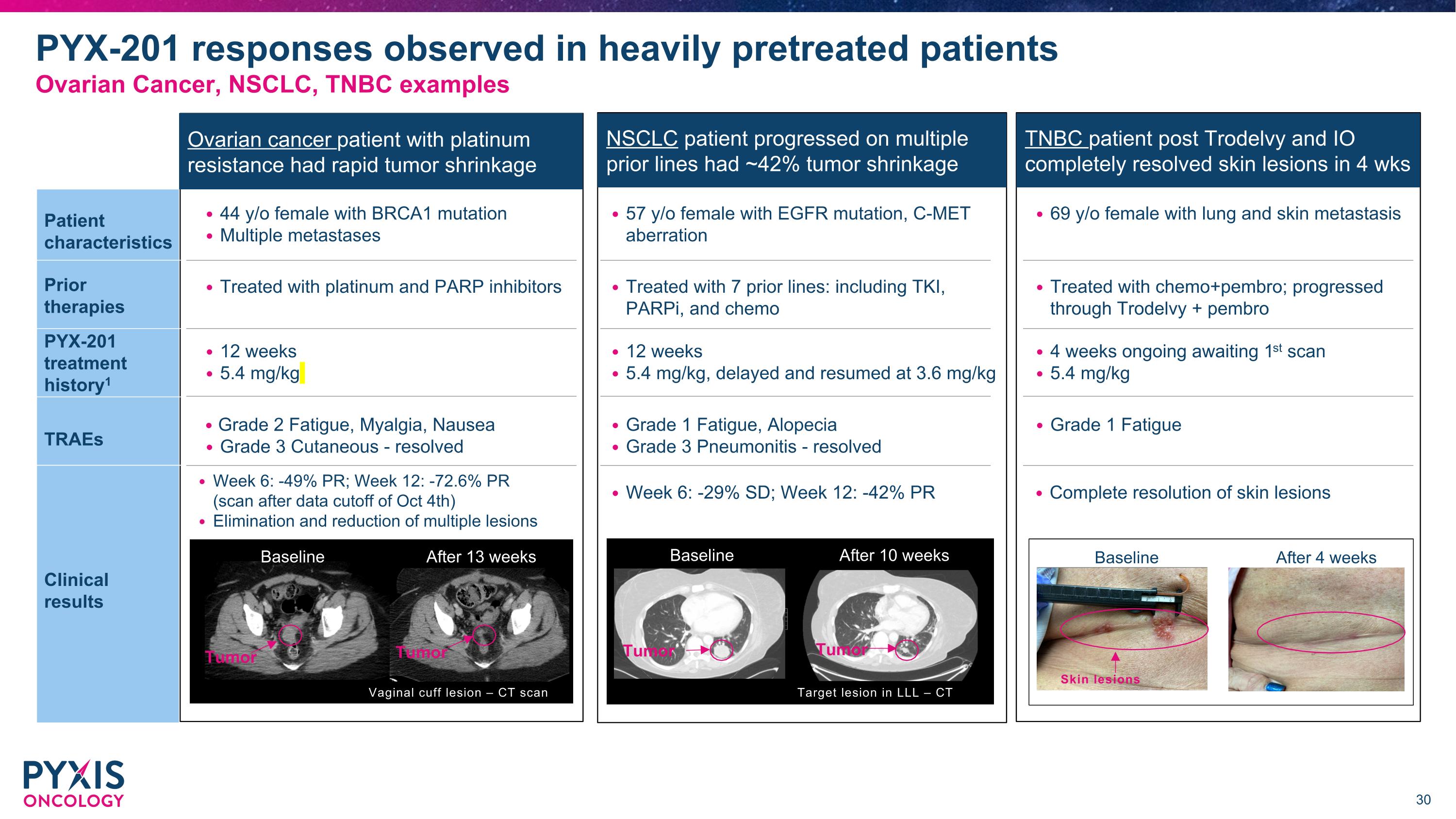
卵巢癌患者對鉑金 抵抗,腫瘤迅速縮小 TNBC 患者接受 Trodelvy 和 IO 後皮膚病變在 4 週內完全解除 NSCLC 患者在多條之前的治療方案上進展,腫瘤縮小約 42% 第 6 週:-49% PR;第 12 週:-72.6% PR (10 月 4 日數據截止後掃描)多個病變的消除和縮小 44 歲女性,BRCA1 突變,多處轉移 12 週 5.4 mg/kg 2 級疲勞,肌肉疼痛,噁心 3 級皮膚 - 康復 第 6 週:-29% SD;第 12 週:-42% PR 57 歲女性,EGFR 突變,C-MEt 異常 12 週 5.4 mg/kg,延遲並在 3.6 mg/kg 恢復 1 級疲勞,脫髮 3 級肺炎 - 恢復 完全解決皮膚病變 69 歲女性,肺部和皮膚轉移 4 週持續中,等待第一次掃描 5.4 mg/kg 1 級疲勞 基線 13 週後 陰道帶病變 – Ct 掃描 腫瘤 腫瘤 基線 4 週後皮膚病變 目標病變在 LLL – Ct 掃描 基線 10 週後 腫瘤 腫瘤 患者特徵 先前 治療 PYX-201 治療 歷史 1 TRAEs 臨床 結果 接受鉑金和 PARP 抑製劑治療 之前接受 7 條治療方案:包括 TKI、PARPi 和化療 接受化療+pembro;通過 Trodelvy + pembro 進展 在重度預處理患者中觀察到 PYX-201 反應 卵巢癌、NSCLC、TNBC 的例子

計劃領域 潛在適應症 臨床前階段 1 FPFV1 下一個里程碑 頭頸部鱗狀細胞癌 (HNSCC) HNSCC – PYX-201 與 KEYTRUDA® 1/2L 2025年第一季 2025年下半年初步數據 HNSCC – PYX-201 單藥 2/3L 鉑金及PD-1經驗者 2025年第一季 2025年下半年初步數據 HNSCC – PYX-201 單藥 2/3L EGFR及PD-1經驗者 2025年第一季 2026年上半年初步數據 組合療法擴展 PYX-201 與 KEYTRUDA HR+/HER2-、TNBC、肉瘤及其他 2025年第一季 2025年下半年/2026年上半年初步數據 其他組合藥物 卵巢癌、NSCLC 待定 2026年初步數據 各種探索性擴展 / ISTs 在接下來的6-18個月內將提供包括2/3L單藥療法及早期組合療法的多個讀數 升級 1 FPFV – 第一位病人首次就診 KEYTRUDA® 是默沙東公司(Merck Sharp & Dohme LLC)註冊商標,為默沙東公司(Merck & Co., Inc.)的子公司,位於美國新澤西州拉威。

KOL觀點:小組討論 拉拉·沙利文醫生 總裁兼首席執行官 主持人:格倫·漢納醫生 癌症治療創新中心主任,頭頸部腫瘤科醫生,達納·法伯癌症研究所 嘉賓關鍵意見領袖 安東尼·托爾切醫生,FRCPC 創始人兼首席執行官,NEXt Oncology
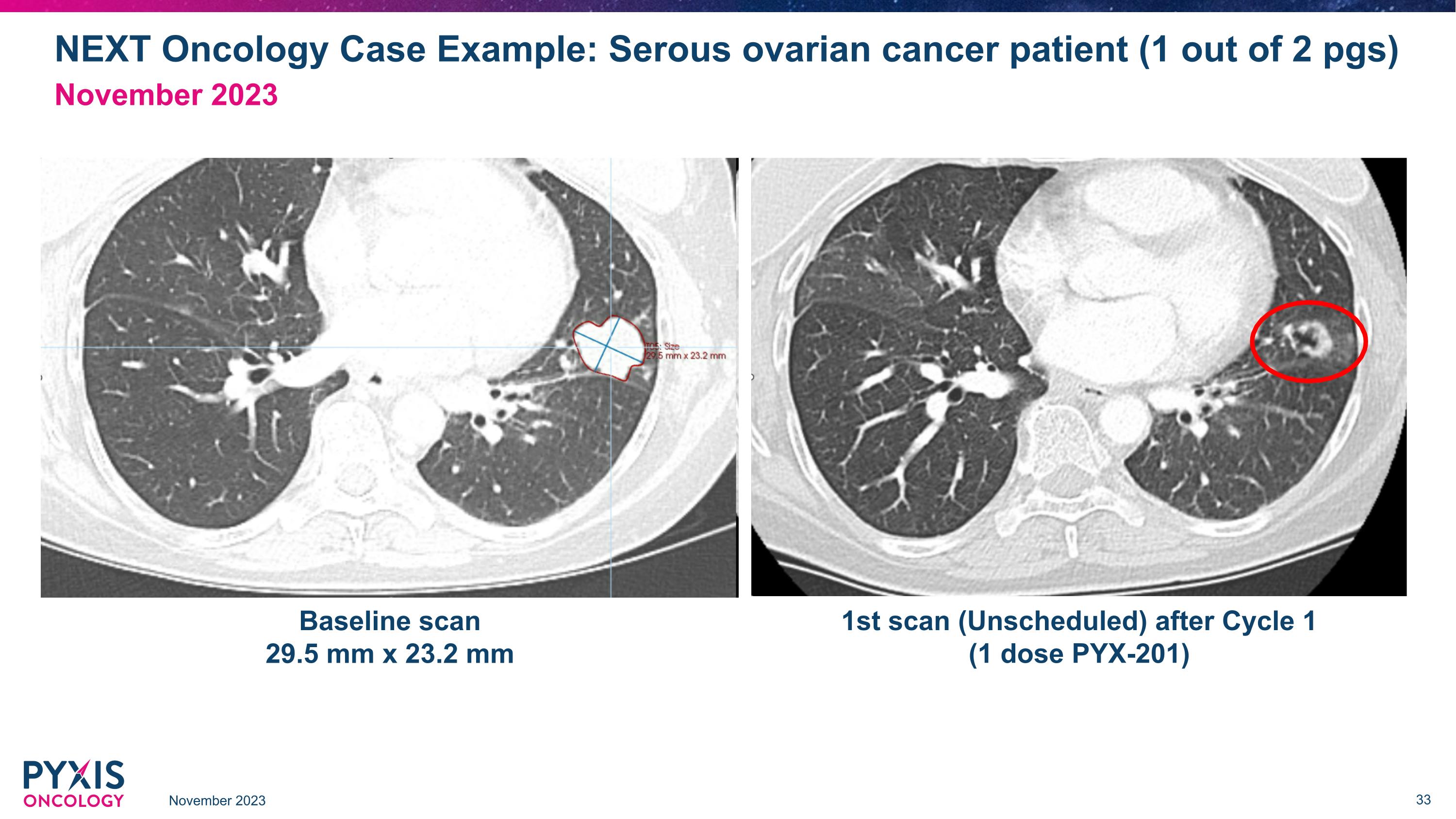
NEXt Oncology案例示例:漿液性卵巢癌患者(2頁中的1頁) 2023年11月 2023年11月 基線掃描 29.5毫米 x 23.2毫米 第一次掃描(無計劃)在第一個療程後(1劑PYX-201)
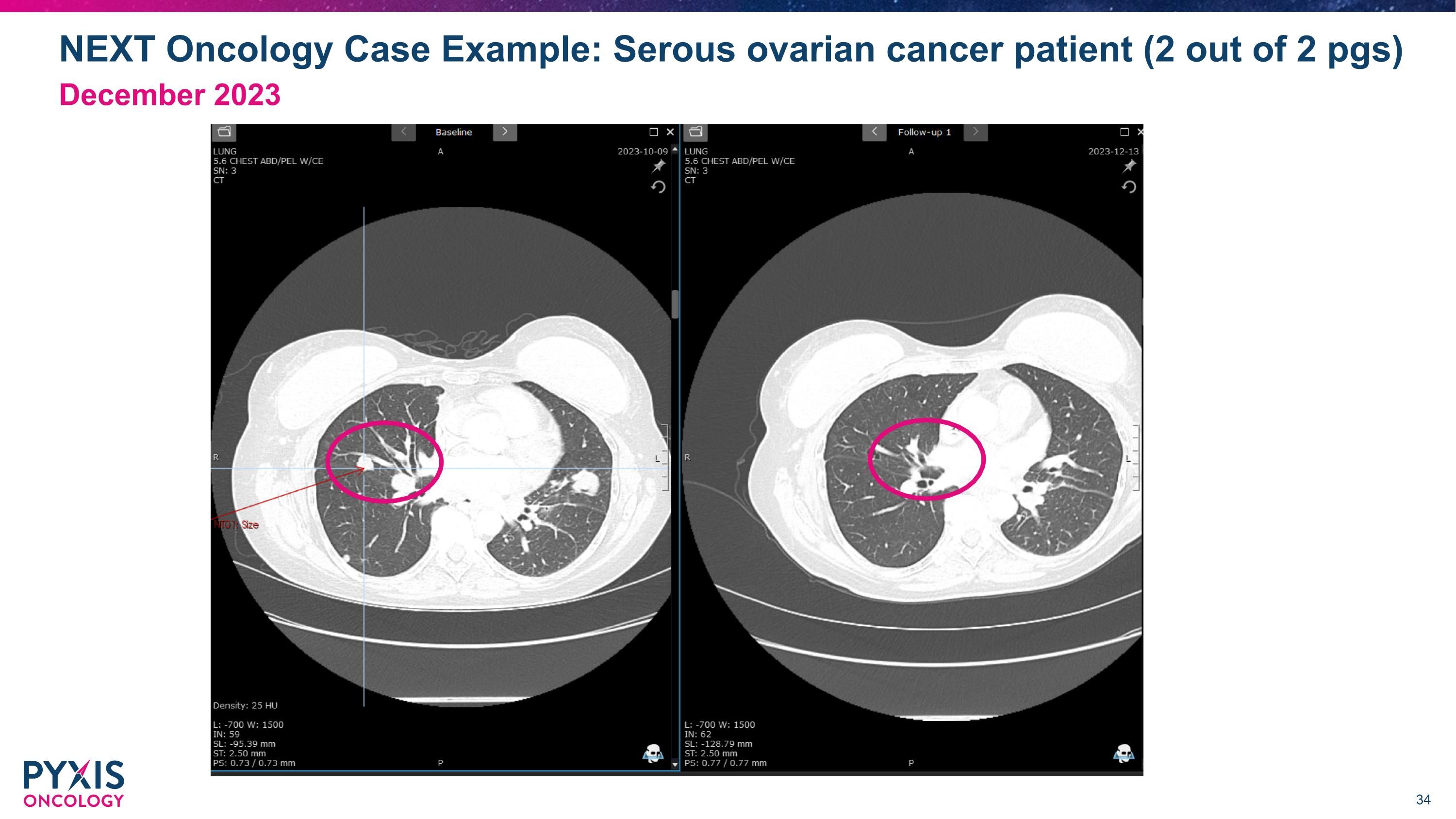
NEXt Oncology案例示例:漿液性卵巢癌患者(2頁中的2頁) 2023年12月

KOL觀點:小組討論 拉拉·沙利文醫生 總裁兼首席執行官 主持人:格倫·漢納醫生 癌症治療創新中心主任,頭頸部腫瘤科醫生,達納·法伯癌症研究所 嘉賓關鍵意見領袖 安東尼·托爾切醫生,FRCPC 創始人兼首席執行官,NEXt Oncology

截至2024年第三季度,現金14600萬美元為2026年下半年提供了資金支持 對PYX-201在接下來的6-18個月內提供多個臨床催化劑 建立一個專注於ADC的領先公司

問與答

附錄
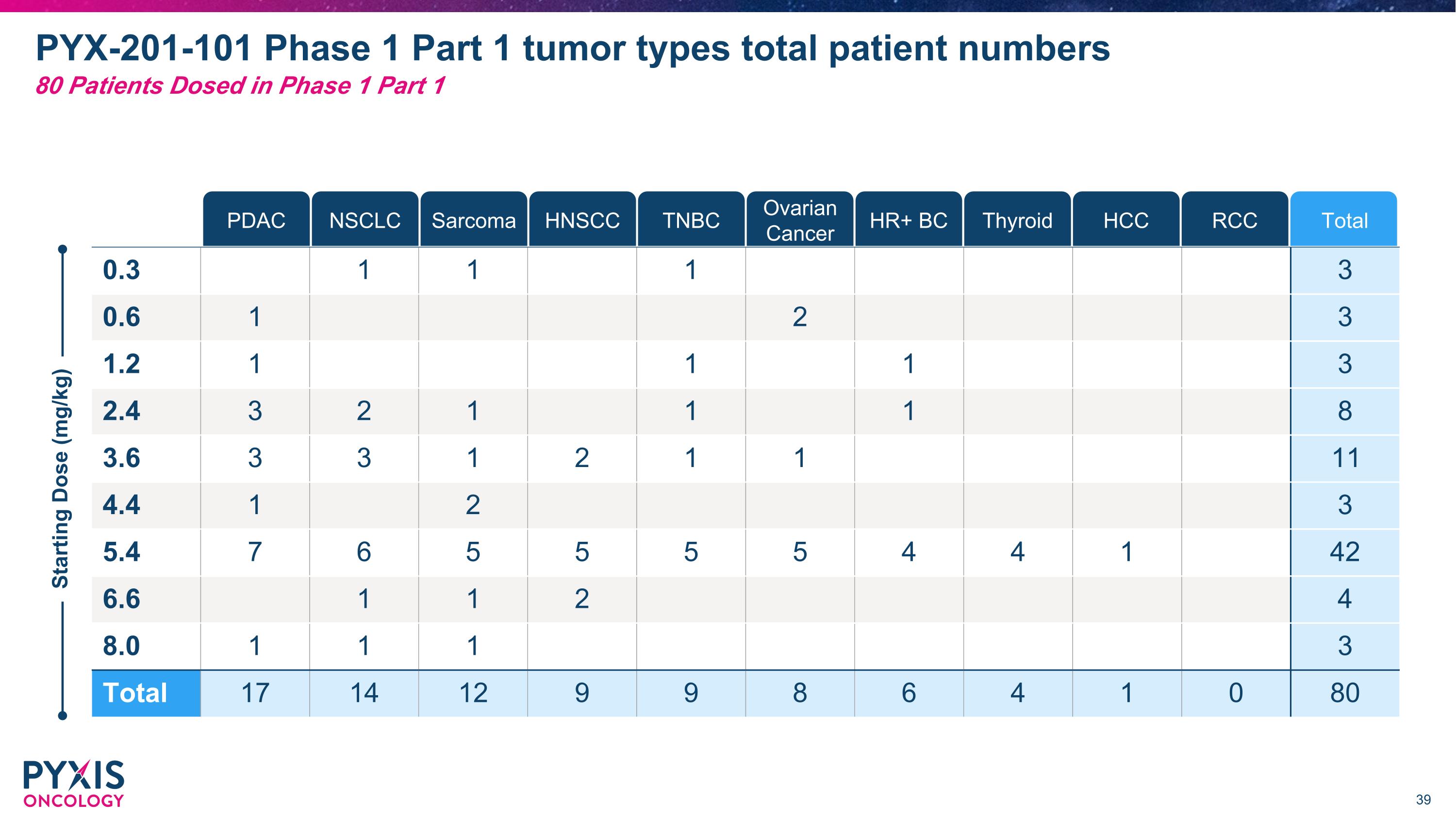
PYX-201-101 第一期 第1部分腫瘤類型總患者數 80名患者於第1期 第1部分給藥 0.3 1 1 1 3 0.6 1 2 3 1.2 1 1 1 3 2.4 3 2 1 1 1 8 3.6 3 3 1 2 1 1 11 4.4 1 2 3 5.4 7 6 5 5 5 5 4 4 1 42 6.6 1 1 2 4 8.0 1 1 1 3 總計 17 14 12 9 9 8 6 4 1 0 80 NSCLC TNBC 肉腫 HNSCC 卵巢癌 PDAC HCC HR+ 乳腺癌 甲狀腺 RCC 總起始劑量 (mg/kg)
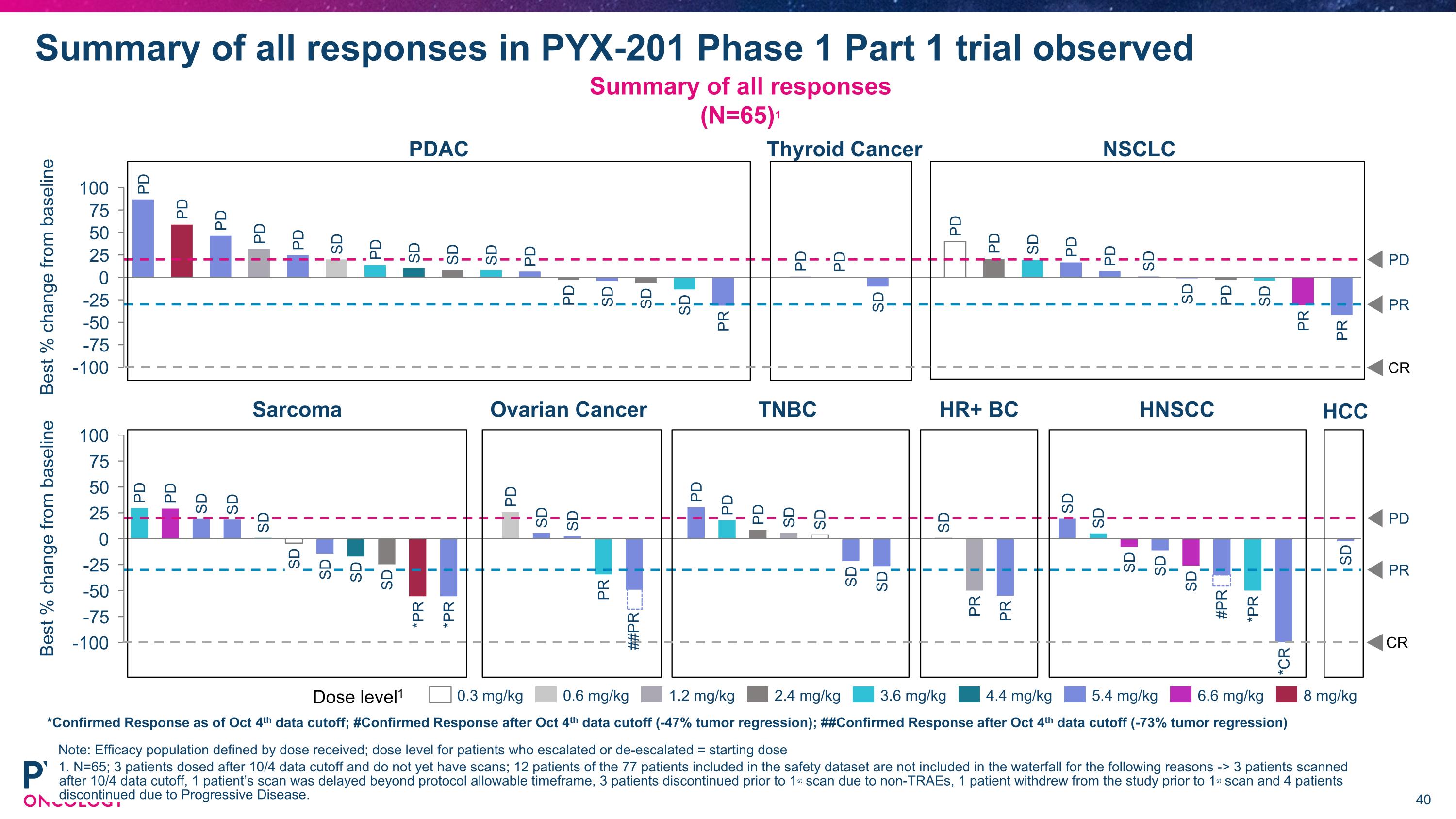
PYX-201 第一期 第1部分試驗所有反應的摘要 注意:療效人群按所接受的劑量定義;對於劑量升高或降低的患者 = 起始劑量 1. N=65;3名患者在10/4數據截止後給藥,尚未進行掃描;77名患者中有12名患者未包括在安全數據集中,原因如下 -> 3名患者在10/4數據截止後進行掃描,1名患者的掃描超過了協議允許的時間範圍,3名患者因非治療相關不良事件於第一次掃描之前退出,1名患者在第一次掃描之前自願退出,4名患者因進展性疾病而中止。所有反應的摘要 (N=65) 1 最佳 % 相對於基線變化 PD PR PD PD PD PD PD SD PD SD SD SD PD PD SD SD SD PR PD PD SD PD PD SD PD PD SD SD PD SD PR PR 劑量水平 1 0.3 mg/kg 0.6 mg/kg 1.2 mg/kg 2.4 mg/kg 3.6 mg/kg 4.4 mg/kg 5.4 mg/kg 6.6 mg/kg 8 mg/kg PDAC 甲狀腺癌 NSCLC CR *截至10月4日數據截止的確認反應;# 截至10月4日數據截止後的確認反應 (-47% 腫瘤縮小);## 截至10月4日數據截止後的確認反應 (-73% 腫瘤縮小) PR 最佳 % 相對於基線 PD PD SD SD SD SD SD SD SD *PR *PR PD SD SD PR PD PD PD SD SD PD SD SD PR PR SD SD SD SD SD *PR *CR SD SD 肉腫 卵巢癌 TNBC HR+ 乳腺癌 HNSCC ##PR #PR CR HCC