
2024 年 11 月 Larimar Therapeutics 公司甲板展覽 99.1

本演示文稿包含前瞻性陳述,這些陳述基於Larimar Therapeutics, Inc.(「公司」)的信念和假設以及管理層目前可獲得的信息。除歷史事實陳述外,本演示文稿中包含的所有陳述均爲前瞻性陳述,包括但不限於Larimar開發和商業化nomlabofusp(CTI-1601)和其他計劃候選產品的能力、Larimar的計劃研發工作,包括其nomlabofusp臨床試驗的時機、對FDA Start試點計劃的預期、與美國食品藥品管理局的互動、對加速批准或加快准入時間的期望市場和整體發展計劃和其他與Larimar的業務戰略、籌集資金的能力、資本的使用、經營業績和財務狀況以及未來運營計劃和目標有關的事項。在某些情況下,你可以通過這些術語或其他類似術語的 「可能」、「將」、「可能」、「應該」、「期望」、「打算」、「預測」、「相信」、「估計」、「預測」、「項目」、「潛在」、「繼續」、「持續」 或否定詞語或其他類似術語來識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些詞語。這些陳述涉及風險、不確定性和其他因素,這些因素可能導致實際業績、業績或成就與這些前瞻性陳述所表達或暗示的信息存在重大差異。這些風險、不確定性和其他因素包括Larimar產品開發活動、非臨床研究和臨床試驗的成功、成本和時機,包括nomlabofusp的臨床里程碑和與美國食品藥品管理局的持續互動;初步臨床試驗結果可能與最終臨床試驗結果不同,早期的非臨床和臨床數據以及nomlabofusp的測試可能無法預測後來的臨床試驗和評估的結果或成功;美國食品藥品管理局最終可能不會同意 Larimar 的觀點nomlabofusp 發展戰略;公共衛生危機對拉里瑪未來臨床試驗、製造、監管、非臨床研究時間表和運營以及總體經濟狀況的潛在影響;Larimar 和第三方製造商 Larimar 參與優化和擴展 nomlabofusp 製造流程的能力;Larimar 獲得 nomlabofusp 和未來候選產品的監管批准的能力;Larimar 發展銷售和營銷能力的能力,無論是單獨還是與潛在的未來合作者一起,以及成功將任何經批准的候選產品商業化;Larimar籌集必要資金以開展其產品開發活動的能力;以及Larimar向美國證券交易委員會(SEC)提交的文件中描述的其他風險,包括但不限於Larimar的定期報告,包括10-k表年度報告、10-Q表季度報告以及向美國證券交易委員會提交或提供並提供給美國證券交易委員會的8-k表最新報告在 www.sec.gov。這些前瞻性陳述是基於Larimar目前已知的事實和因素及其對未來的預測的組合,目前尚無法確定這些事實和因素。因此,前瞻性陳述可能不準確。本演示文稿中的前瞻性陳述僅代表拉里瑪管理層截至本文發佈之日的觀點。除非法律要求,否則Larimar沒有義務出於任何原因更新任何前瞻性陳述。前瞻性陳述

臨床階段的新型蛋白質替代療法平台主要候選人nomlabofusp是一種重組融合蛋白,旨在通過將蛋白質輸送到線粒體來直接解決FA患者的frataxin缺乏問題。獲得孤兒藥(美國和歐盟)、罕見兒科疾病(美國)、快速通道(美國)、PRIME(歐盟)和ILAP(英國MHRA)稱號。Nomlabofusp被美國食品藥品管理局選中參與其Start試點計劃,在完成的爲期4周的安慰劑對照的2期研究和已完成的多次遞增劑量1期研究中,Nomlabofusp總體耐受性良好,表現出皮膚和口腔細胞中frataxin(FXN)水平與基線相比的劑量依賴性升高。截至2026年9月30日,現金和投資約爲2.04億美元。預計第一種增加fratax的療法 in水平一致的第 1 階段和第 2 階段調查結果計劃加快批准 FDA 的先行劑量2024 年第一季度服用 OLE 的成年患者每日攝入 25 mg;所有 7 個 OLE 位點均已激活;繼續招收患者正在進行的 OLE 研究與開發計劃中註冊患者的可用數據預計在 2024 年底前啓動青少年 Pk 試驗;在評估青少年隊列的安全性和暴露數據後將劑量增加到 50 mg 臨床計劃 FDA 財務基礎強大承認 FXN缺乏似乎對 FA 的致病機制至關重要,而且針對潛在疾病病理生理學的治療需求仍未得到滿足。支持加快批准的討論仍在進行中。BLA 的提交目標是在 2025 年下半年提交 Nomlabofusp (CTI-1601);FA:弗裏德賴希的共濟失調
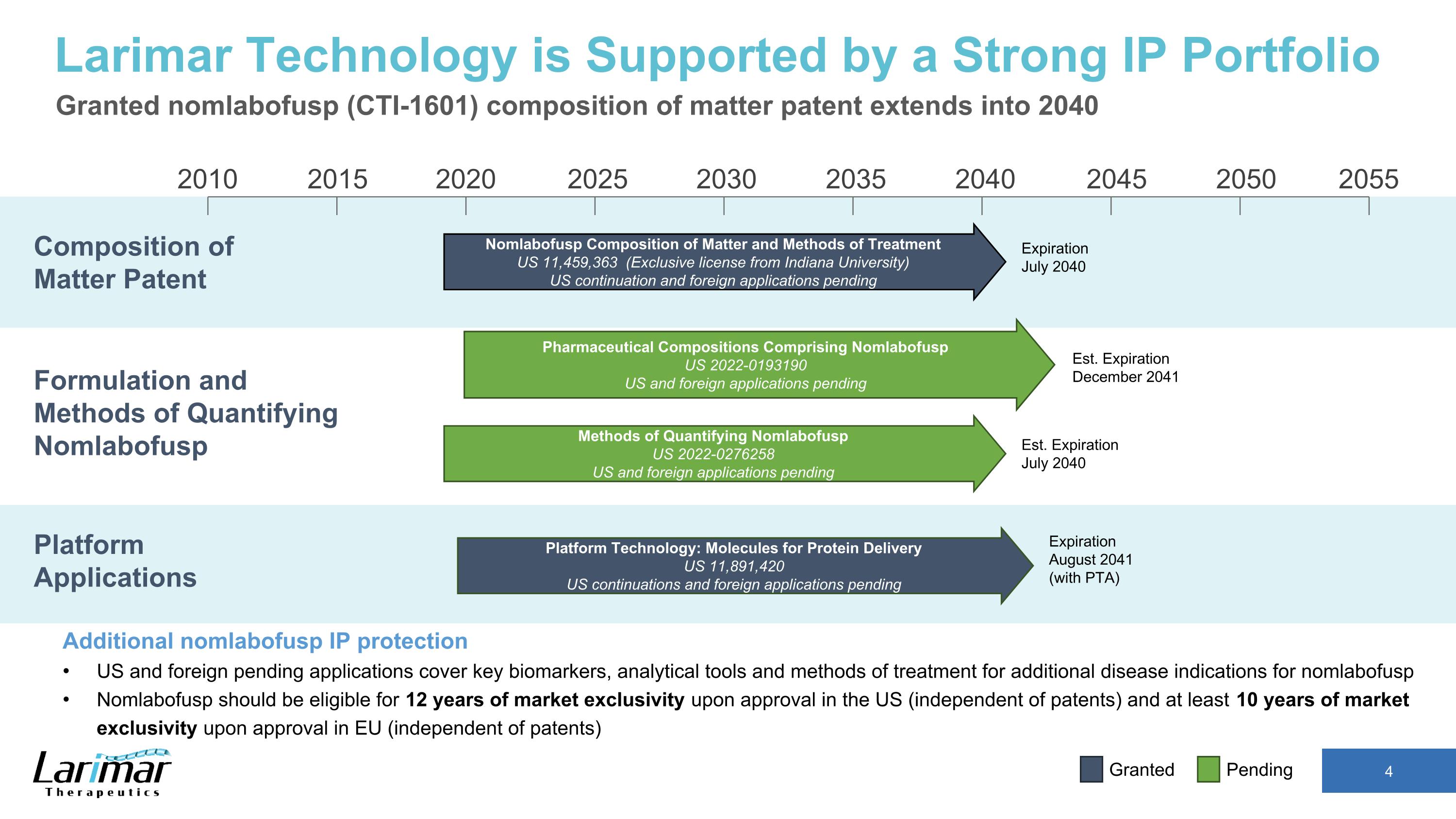
2015 2020 2030 2035 2040 2040 2045 2050 2055 2010 2025 Nomlabofusp 物質成分和處理方法 11,459,363 美元(印第安納大學獨家許可)美國延期申請和外國申請待於 2040 年 7 月到期的物質專利構成 Larimar Technology 由強大的知識產權組合支持 nomlabofusp (CTI-1601) 物質組成專利擴展至 2040 年 nomlabofusp 知識產權保護美國和外國待處理的申請涵蓋其他疾病的關鍵生物標誌物、分析工具和治療方法nomlabofusp 的適應症 Nomlabofusp 在美國獲得批准後應有資格獲得 12 年的市場獨家經營權(獨立於專利),在歐盟獲得批准後應有資格獲得至少 10 年的市場獨家經營權(獨立於專利)平台應用配方和定量方法 Nomlabofusp 平台技術:用於蛋白質輸送的分子美國 11,891,420 美國延續產品和外國申請,包括 Nomlabofusp 美國 2022-0193190 待處理的美國和外國申請量化方法 Nomlabofusp 美國 2022-0276258 美國和外國的申請正在等待美國東部標準時間美國東部標準時間 2041 年 12 月到期2040 年 7 月到期 2041 年 8 月到期(含 PTA)待批准

弗裏德賴希共濟失調(FA):一種罕見的進展性疾病 5 * E.C. Deutsch 等人分子遺傳學與代謝 101 (2010) 238—245。根據組織、採樣技術和所考慮的化驗,大多數FA患者產生的frataxin水平僅爲正常水平的20-40%左右*兩個等位基因的遺傳缺陷都會降低弗拉他辛水平進行性疾病最初的症狀包括姿勢不穩定和經常跌倒,患者最終只能坐在輪椅上 預期壽命爲30-50年,過早死亡通常由心臟病引起。影響全球約20,000名患者,美國約有5,000名患者,其餘大多數患者在歐盟 約 70% 的患者在 14 歲之前就診未獲批准的療法會增加弗拉他辛水平只有獲准的 FA 治療不能解決弗拉他辛缺乏症

與FARA的牢固關係— 作爲行業合作伙伴加入了FARA的Track-FA神經影像學聯盟,致力於進行科學研究,從而爲FA提供治療和治療方法 FARA爲行業提供多個關鍵項目協助患者招募和教育訪問全球患者登記處提供1,000多名FA患者的人口和臨床信息。2017年贊助了一次以患者爲中心的藥物開發會議,該會議產生了一份名爲 「患者之聲」 的出版物 Track-FA 收集了自然史數據以建立可能用於臨床試驗的疾病特異性神經影像學生物標誌物。Larimar將有權訪問所有研究數據,以酌情用於監管文件
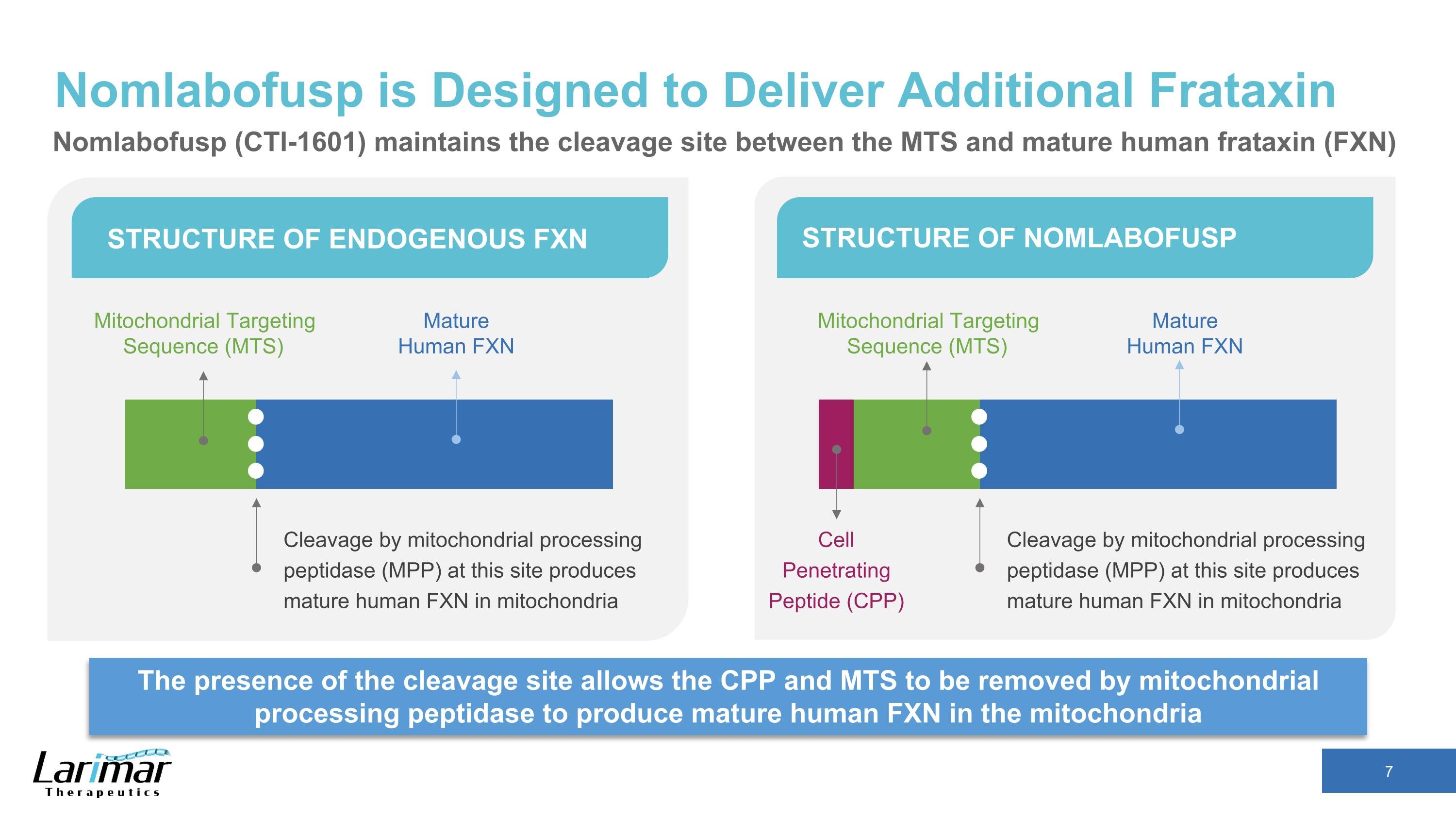
Nomlabofusp 旨在提供額外的 Frataxin 裂解位點的存在允許線粒體處理肽酶去除 CPP 和 MTS,在內源性 FXN 結構的線粒體結構中產生成熟的人類 FXN 通過線粒體處理肽酶 (MPP) 在該位點進行切割 NOMLABOFUSP Cleavage 產生成熟的人類 FXN 線粒體中的線粒體靶向序列 (MTS) 通過線粒體處理肽酶 (MPP) 進行成熟人類 FXN Cleavage 在此位點在線粒體中產生成熟人類 FXN 成熟人類 FXN 細胞穿透肽 (CPP) 線粒體靶向序列 (MTS) Nomlabofusp (CTI-1601) 維持 MTS 和成熟人類 frataxin (FXN) 之間的裂解位點
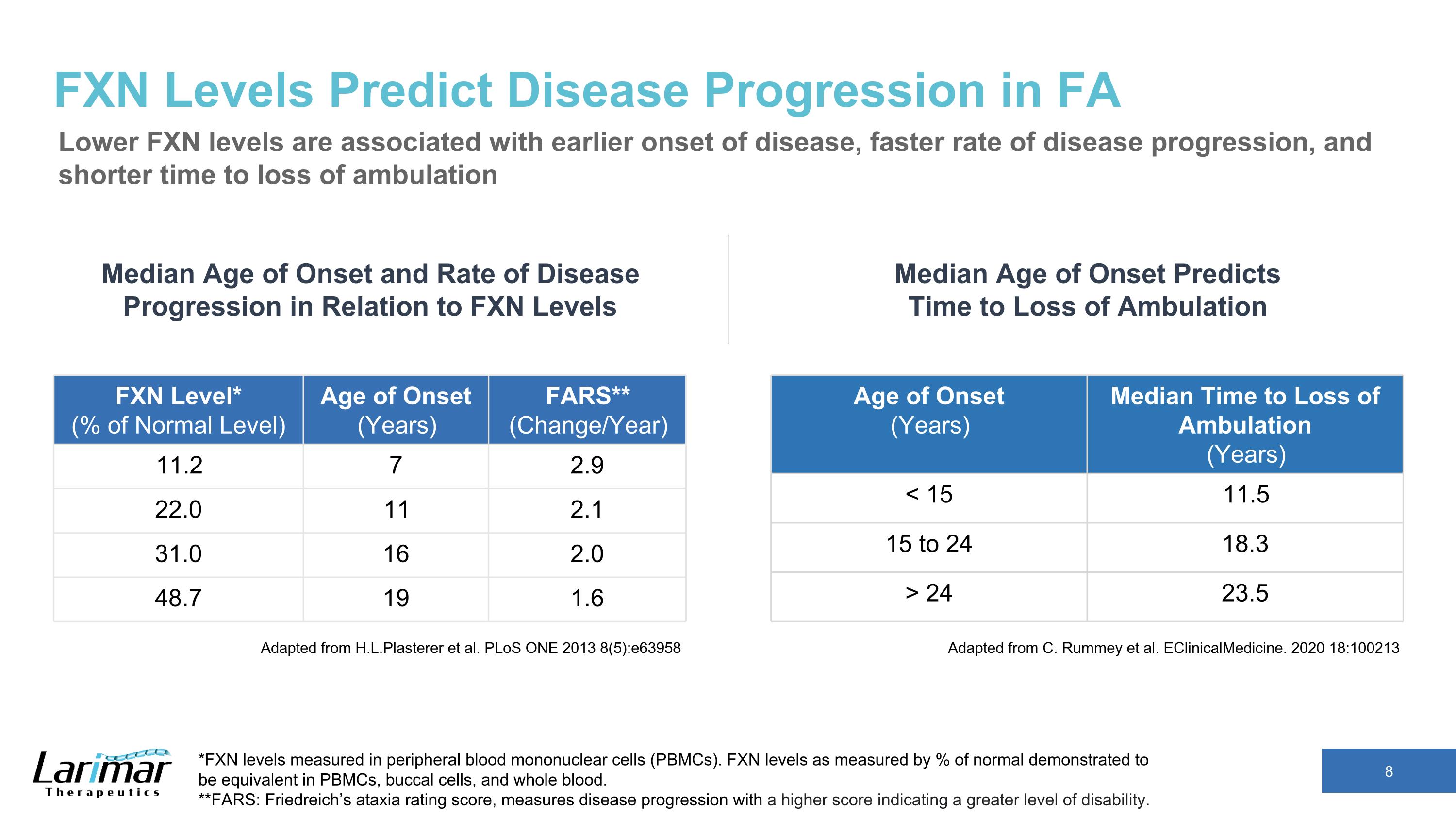
FXN 水平可預測 FA 中的疾病進展較低的 FXN 水平與較早發病、更快的疾病進展速度和更短的喪失行動時間有關。改編自 H.L.Plasterer 等人。PloS ONE 2013 8 (5): e63958 發病年齡(年)中位數無法行走的時間(年)< 15 11.5 15 to 24 18.3 > 24 23.5 發病年齡和疾病進展速度與FXN水平的平均發病年齡和進展速度 *以外周血單核細胞(PBMC)測得的FXN水平。以正常水平的百分比衡量的 FXN 水平被證明在 PBMC、口腔細胞和全血中是相同的。**FARS:弗裏德賴希的共濟失調評級分數用於衡量疾病進展,分數越高表示殘疾程度越高。FXN 級別*(正常水平的百分比)發病年齡(年)FARS**(變化/年)11.2 7 2.9 22.0 11 2.1 2.1 31.0 16 2.0 2.0 16 2.0 2.0 2.0 2.0 2.0 2.0 48.7 19 1.6 改編自 C. Rummey 等人。eClinicalMedicine. 2020 18:100213 發病年齡中位數預測了停止行走的時間

已完成的 Ph 2 劑量探索研究(25 和 50 mg 隊列)目標:進一步表徵 PK/PD 並評估安全性,爲長期劑量和劑量方案 28 天治療期提供信息-nomlabofusp (CTI-1601) 或安慰劑 16 17 18 19 15 20 21 22 23 24 25 26 27 28 2 3 4 5 1 6 7 8 9 10 11 12 13 14 = 皮下給藥 nomlabofusp (CTI-1601) 或安慰劑 = 無給藥研究詳情人群流動和非流動性弗裏德賴希共濟失調患者 ≥18 歲 Nomlabofusp (CTI-1601) 治療天真或參與過(如果符合條件)之前接受過拉利瑪治療研究劑量隊列 1:25 mg 隊列 2:50 mg 關鍵終點 Frataxin 在外周組織中的水平、Pk、安全性和耐受性;其他探索性終點包括脂質和基因表達水平患者人數 1:入組 13 名參與者(9 人服用 nomlabofusp;4 人服用 nomlabofusp)隊列 2:入組 15 名參與者(10 人服用 nomlabofusp;5 人服用安慰劑)主要結果總體耐受性良好; 最常見的不良事件是輕度和中度注射部位反應受試組織(皮膚和口腔細胞)中 frataxin 水平的劑量依賴性增加基線 FXN 水平在50 mg隊列中,皮膚細胞中的比例<健康志願者平均值的17%。每日給藥14天后,FXN水平升至健康志願者平均水平的33%至59%
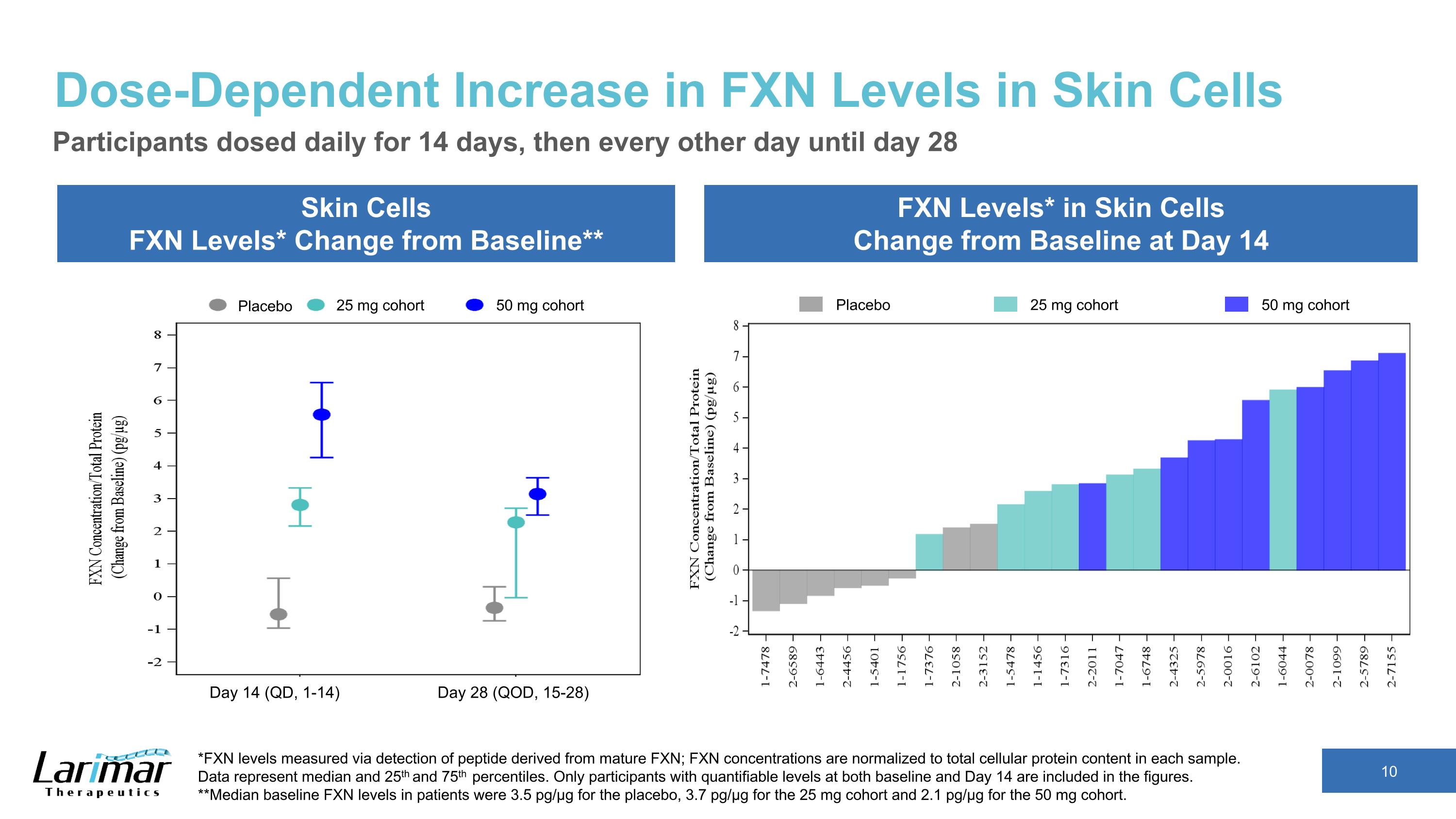
皮膚細胞中FXN水平的劑量依賴性增加皮膚細胞FXN水平*與基線相比的變化*皮膚細胞中的FXN水平*與基線的變化參與者在第14天每天給藥14天,然後每隔一天給藥一次,直到第28天*通過檢測源自成熟FXN的肽測得的FXN水平;FXN濃度標準化爲每個樣本中的細胞蛋白總含量。 數據表示中位數以及第 25 和第 75 個百分位數。數字中僅包括基線和第14天均具有可量化水平的參與者。**安慰劑患者的基線FXN水平中位數爲3.5 pg/µg,25 mg隊列的3.7 pg/µg,50 mg隊列的2.1 pg/µg。安慰劑 25 mg 隊列 50 mg 隊列安慰劑 25 mg 隊列 50 mg 隊列第 14 天(QD,1-14)第 28 天(QD,15-28)
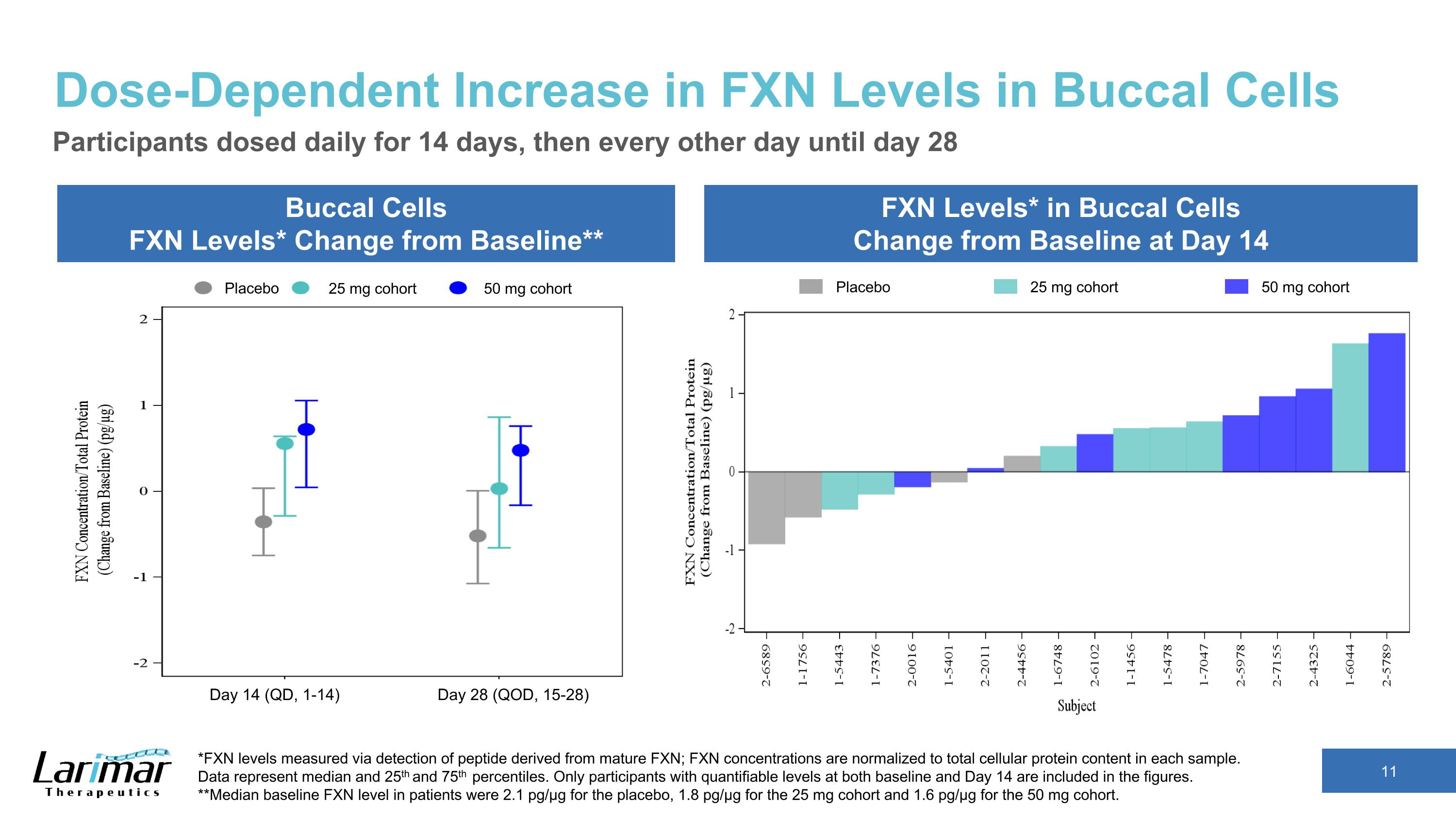
口腔細胞中FXN水平的劑量依賴性增加口腔細胞FXN水平*與基線的變化**口腔細胞中的FXN水平*與基線的變化參與者在第14天每天給藥14天,然後每隔一天給藥直到第28天*通過檢測源自成熟FXN的肽測得的FXN水平;FXN濃度歸一化爲每個樣本中的細胞蛋白總含量。 數據表示中位數以及第 25 和第 75 個百分位數。數字中僅包括基線和第14天均具有可量化水平的參與者。**安慰劑患者的基線FXN水平中位數爲2.1 pg/µg,25 mg隊列的1.8 pg/µg,50 mg隊列的1.6 pg/µg。安慰劑 25 mg 隊列 50 mg 隊列安慰劑 25 mg 隊列 50 mg 隊列第 14 天(QD,1-14)第 28 天(QD,15-28)
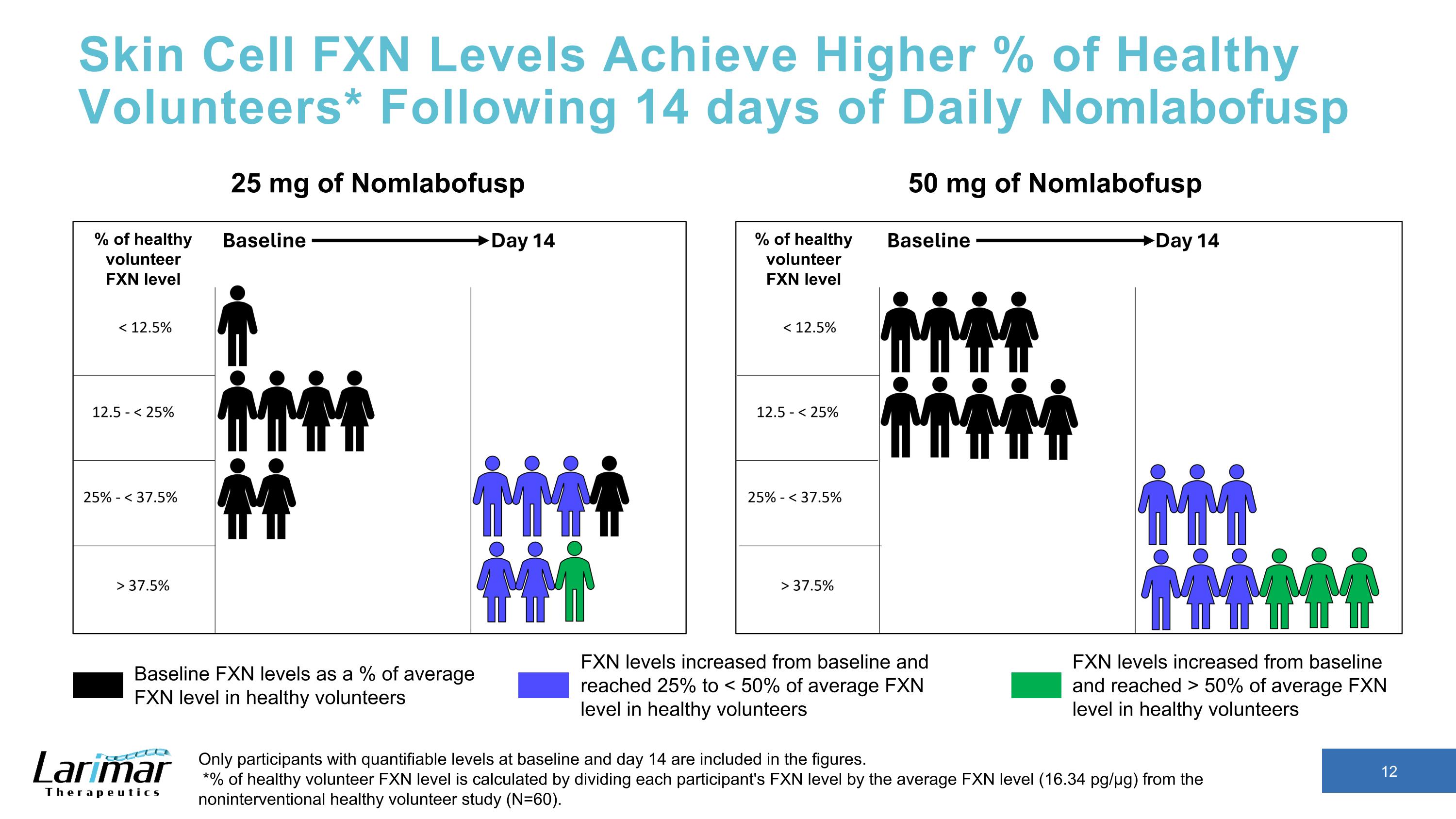
皮膚細胞 FXN 水平達到更高的健康志願者百分比* 每日 Nomlabofusp 14 天后,數字中僅包含基線和第 14 天可量化水平的參與者。*健康志願者 FXN 水平的百分比是通過將每位參與者的 FXN 水平除以非介入性健康志願者研究(N = 60)的平均 FXN 水平(16.34 pg/µg)計算得出。25 mg Nomlabofusp 50 mg 的 Nomlabofusp 基線 FXN 水平佔健康志願者平均 FXN 水平的百分比 FXN 水平高於基線,達到平均 FXN 水平的 50% 以上健康志願者 FXN 水平從基線提高到健康志願者平均 FXN 水平的 25% 至 < 50% 健康志願者 FXN 水平百分比健康志願者 FXN 水平百分比健康志願者 FXN 水平百分比
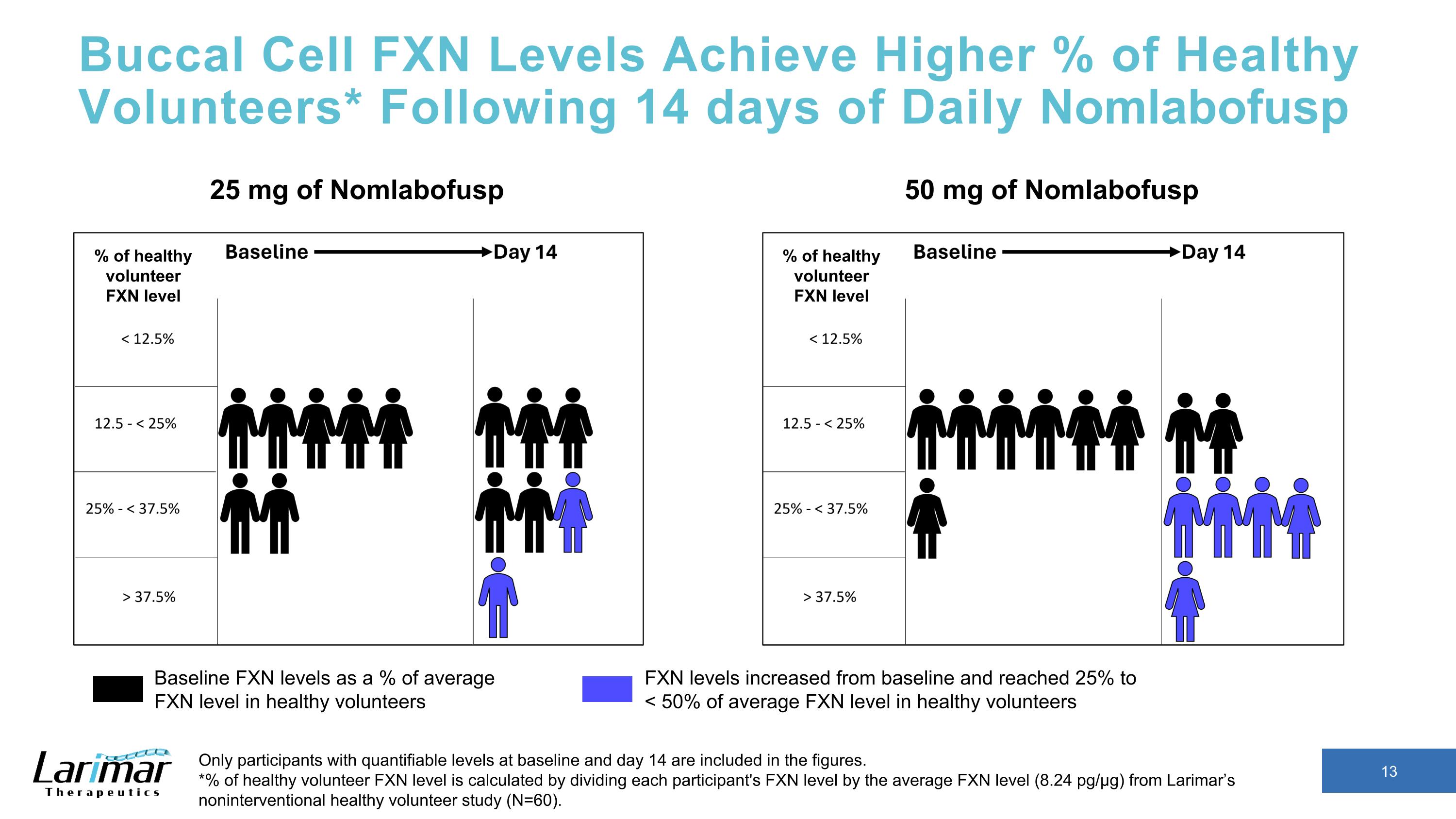
口腔細胞 FXN 水平達到更高的健康志願者百分比* 在每日服用 Nomlabofusp 14 天后,數字中僅包含基線和第 14 天可量化水平的參與者。*健康志願者 FXN 水平的百分比是通過將每位參與者的FXN水平除以拉里瑪非干預性健康志願者研究(N = 60)中的平均FXN水平(8.24 pg/µg)計算得出。50 mg Nomg labofusp 基線 FXN 水平佔健康志願者平均 FXN 水平的百分比 FXN 水平從基線上升到了 25% 至 < 健康志願者平均 FXN 水平的 50% 25 mg Nomlabofusp 百分比健康志願者 FXN 水平健康志願者 FXN 水平的百分比 FXN 水平的百分比

Nomlabofusp:可預測的藥代動力學皮下給藥後快速吸收 1 2 3 觀察到的暴露量與劑量成比例的增加 cc 藥代動力學特徵與 1 期研究一致
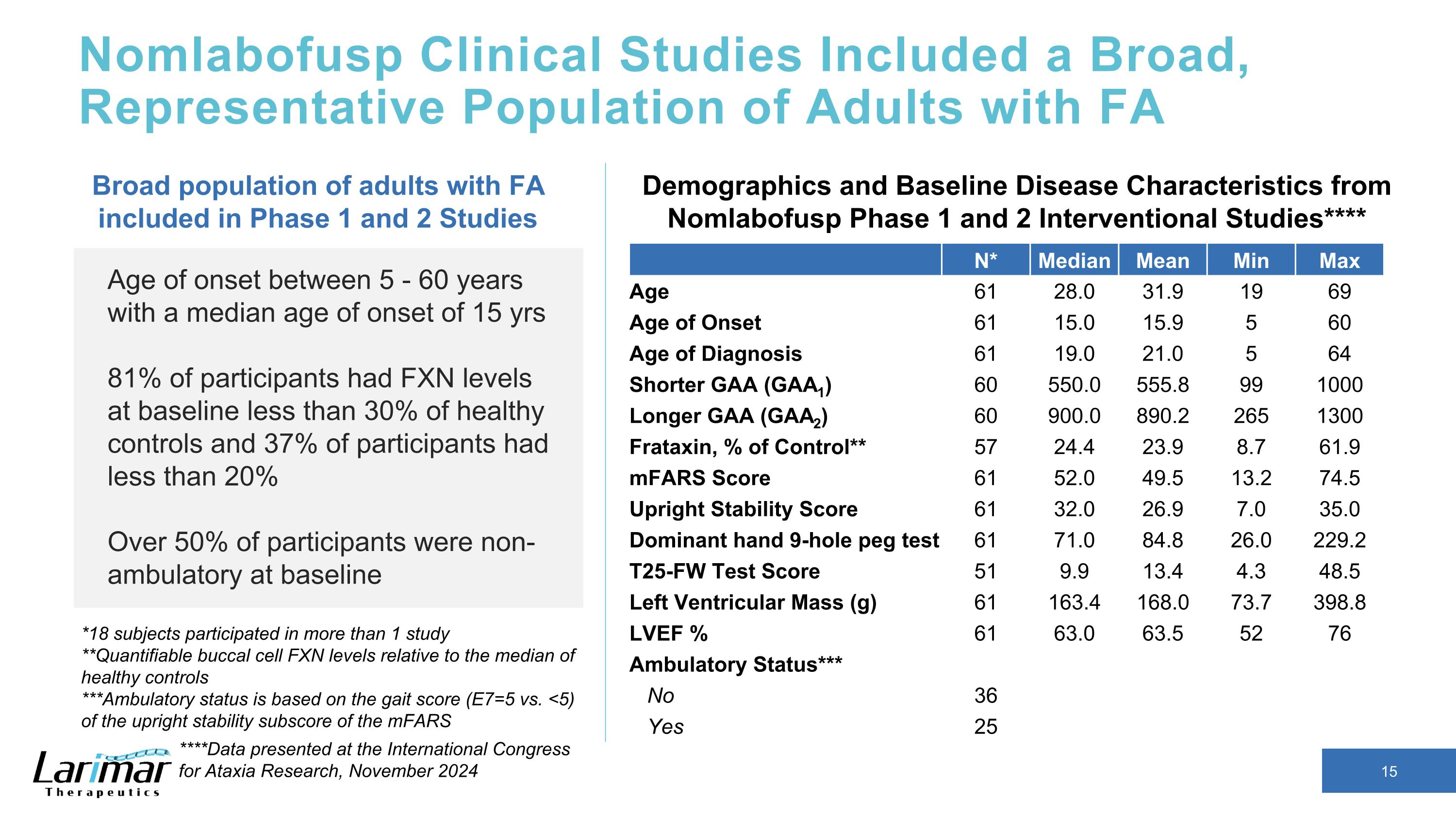
Nomlabofusp 臨床研究包括具有廣泛代表性的 FA N* 成年人群中位數平均最低最大年齡 61 28.0 31.9 19 69 69 發病年齡 61 15.0 15.9 5 60 診斷年齡 61 19.0 21.0 5 64 較短 GAA (GAA1) 60 550.0 555.8 99 1000 更長 GAA (GAA2) 60 900.0 890.2 265 1300 Frataxin,對照百分比** 57 24.4 23.9 8.7 61.9 mFars 分數 61 52.0 49.5 13.2 74.5 直立穩定性分數 61 32.0 26.9 7.0 35.0 主導手牌 9 洞釘子測試 61 71.0 84.8 26.0 229.2 T25-FW 測試分數 51 9.9 13.4 4.3 48.5 48.5 左心室腫塊 (g) 61 163.4 168.0 73.7 398.8 LVEF% 6163.0 63.5 52 76 門診狀態*** 否 36 是 25 發病年齡介於 5-60 歲之間,發病年齡中位數爲 15 歲 81% 的參與者基線的 FXN 水平低於健康對照組的 30%,37% 的參與者基線時非流動性超過 50% 的參與者在基線時非流動性有 FA 的廣大成人群體 Nomlabofusp 第 1 階段研究的人口統計學和基線疾病特徵以及 2 項介入研究**** *18 名受試者參與了超過 1 項研究 **可量化的頰細胞 FXN 水平相對於健康對照組的中位數 ***活動狀態基於 MFARs 直立穩定分數的步態分數(E7=5 對比 <5)****在 2024 年 11 月國際共濟失調研究大會上公佈的數據
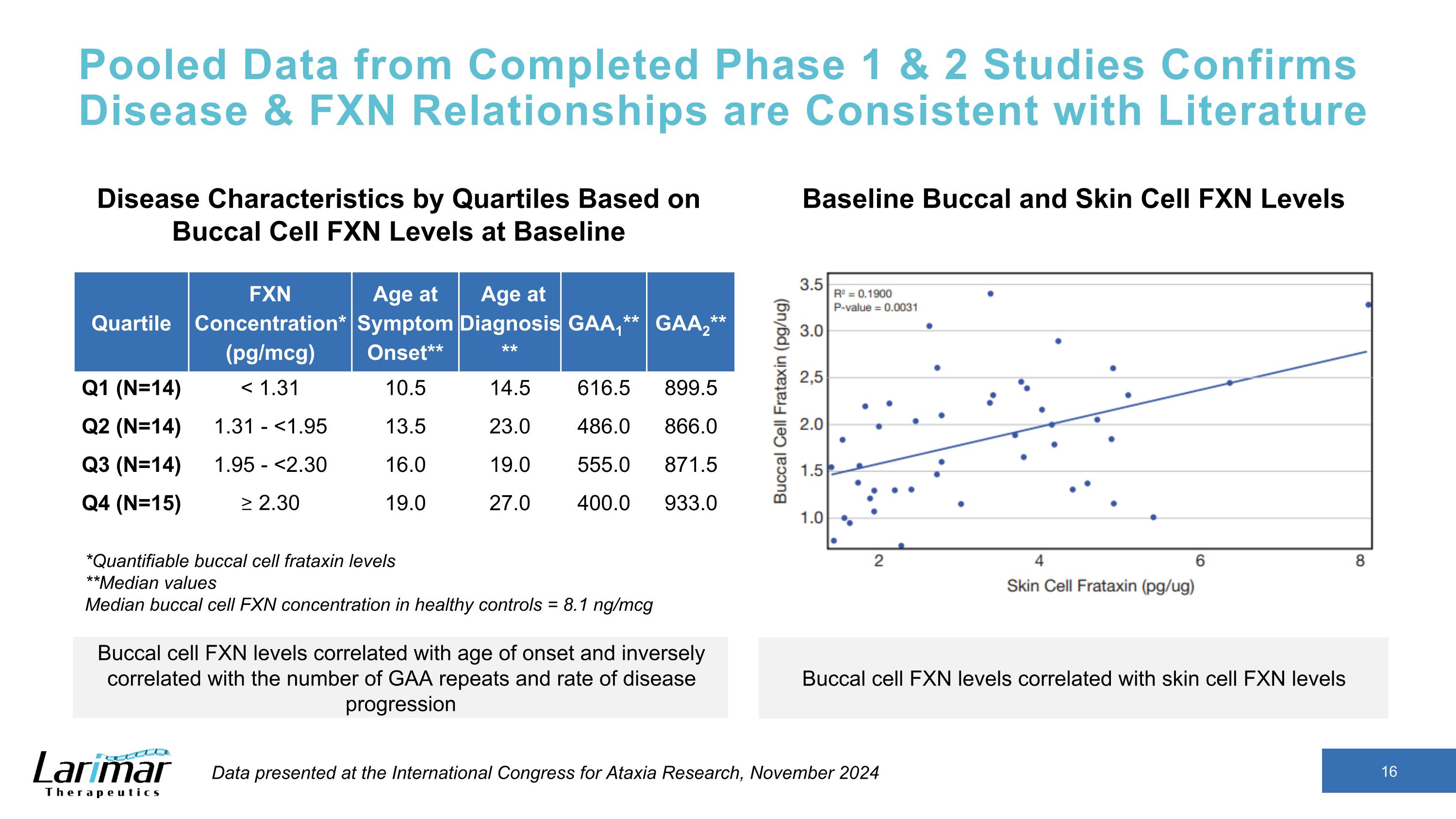
來自已完成的第 1 期和第 2 期研究的彙總數據證實,疾病和 FXN 關係與文獻四分位數 FXN 濃度* (pg/mcg) 症狀出現時的年齡** GAA1** GAA2** 第一季度 (N=14) < 1.31 10.5 14.5 616.5 899.5 Q2 (N=14) 1.31-<1.95 13.5 23.0 866.0 Q3 (N=14) 1.95-<2.30 16.0 19.0 555.0 871.5 Q4 (N=15) ≥ 2.30 19.0 27.0 400.0 933.0 *可量化的口腔細胞 frataxin 水平 **中位數健康對照組中口腔細胞 FXN 濃度中位數 = 8.1 ng/mcg 基於口腔細胞 FXN 的四分位數疾病特徵基線基準口腔和皮膚細胞 FXN 水平的水平口腔細胞 FXN 水平與發病年齡相關,與 GAA 重複次數和疾病進展速度呈反比相關性口腔細胞 FXN 水平與皮膚細胞 FXN 水平相關的數據 2024 年 11 月國際共濟失調研究大會上公佈的數據
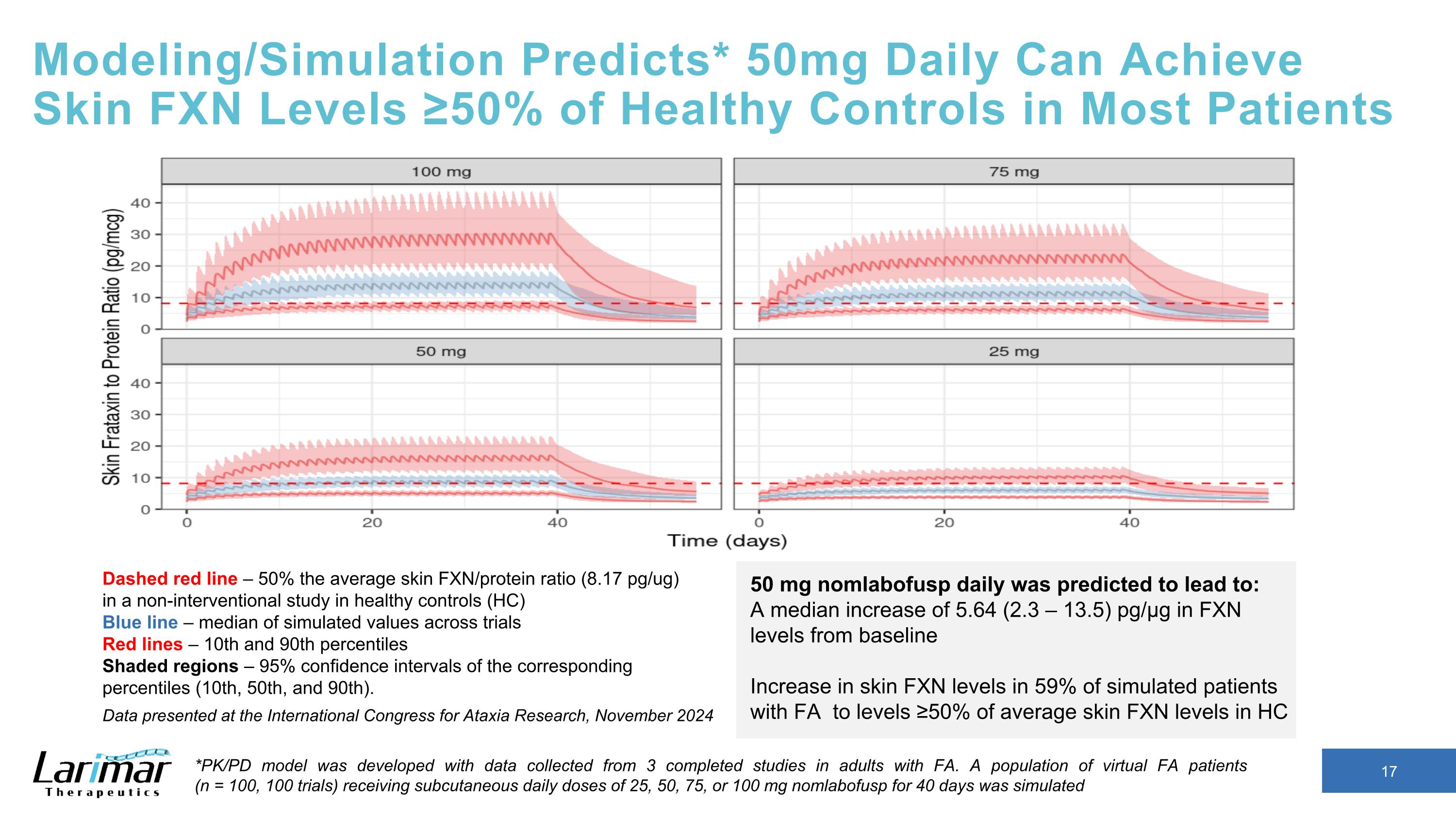
建模/模擬預測*每日50mg可達到大多數患者中皮膚FXN水平≥50%的健康對照組在非干預性研究中,紅線爲平均皮膚FXN/蛋白質比例(8.17 pg/ug)(8.17 pg/ug)的50% 藍線-試驗中模擬值的中位數紅線-第10和第90個百分位陰影區域-相應百分位數(第10、50和90)的95%置信區間. 預計每日 50 mg nomlabofusp 將導致:FXN 水平與基線相比中位數增加 5.64 (2.3 — 13.5) pg/µg 皮膚增加 FXN在HC *PK/PD模型中,59%的FA模擬患者體內的水平達到平均皮膚FXN水平的≥50%,是根據從3項已完成的針對FA的成年研究中收集的數據得出的。虛擬 FA 患者群體 (n = 100,100 項試驗)模擬了在 2024 年 11 月國際共濟失調研究大會上公佈的數據,每日皮下劑量爲 25、50、75 或 100 mg nomlabofusp,持續 40 天
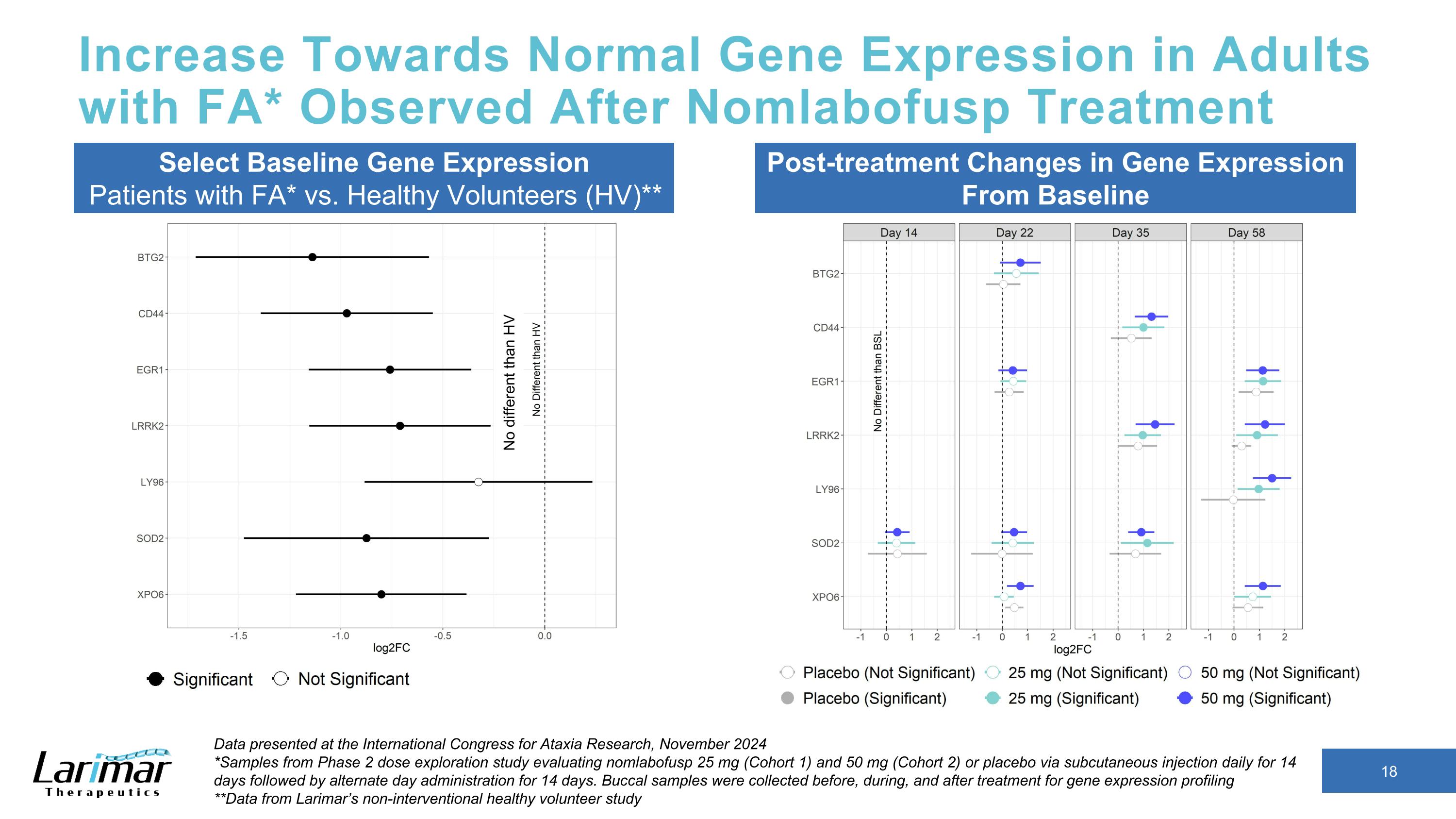
Nomlabofusp 治療後觀察到 FA* 成人中基因表達向正常水平升高選擇基線基因表達 FA*患者與健康志願者(HV)**治療後基因表達的變化來自於2024年11月在國際共濟失調研究大會上公佈的基準數據 *2期劑量探索研究的樣本,該研究評估了nomlabofusp 25 mg(隊列1)和50 mg(隊列2)或安慰劑,每天通過皮下注射持續14天,然後交替給藥,持續14天。在治療前、治療期間和治療後採集了口腔樣本,用於基因表達譜分析 **數據來自Larimar的非介入性健康志願者研究與HV沒有區別
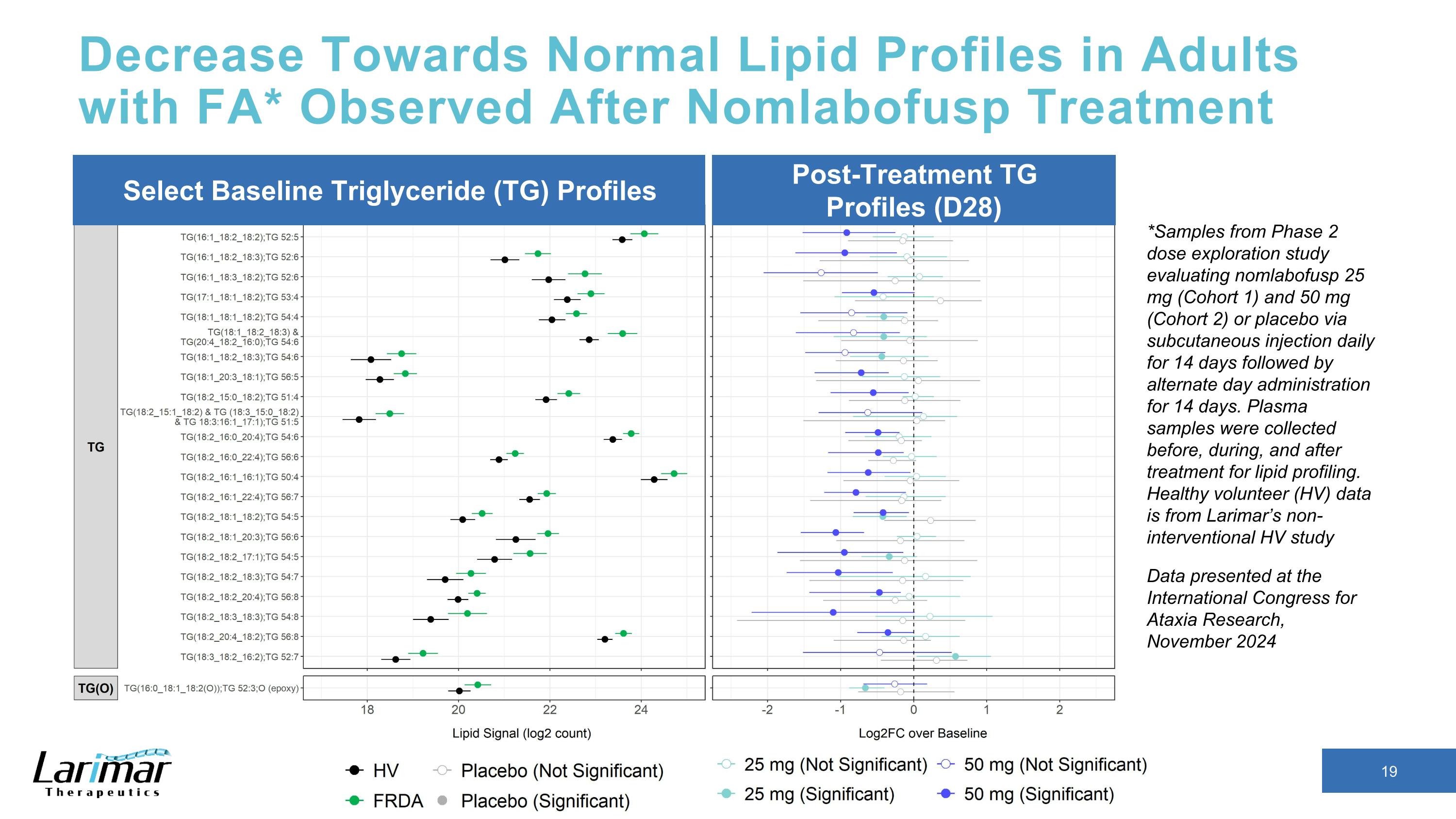
接受Nomlabofusp治療後觀察到的FA成人的血脂水平下降到正常水平*2期劑量探索研究的樣本,該研究評估了nomlabofusp 25 mg(隊列1)和50 mg(隊列2)或安慰劑,每天皮下注射14天,然後隔日給藥,持續14天。在治療之前、治療期間和治療後採集血漿樣本,以進行脂質分析。健康志願者(HV)數據來自Larimar的非介入性HV研究選擇基線甘油三酯(TG)治療後概況 TG 概況 (D28) 在 2024 年 11 月國際共濟失調研究大會上發佈的數據

開放標籤延期研究:2024年第一季度首次給藥的患者正在進行的OLE和開發計劃更新的現有數據預計將於2024年12月中旬更新關鍵資格標準先前參與的1期或2期試驗的關鍵研究目標安全性和耐受性長期Pk劑量升級至50 mg,此前進一步描述了25mg劑量的FXN藥效學,組織FXN濃度以及可能用作替代終點以支持加快審批的臨床療效措施註冊完成後來自FACOMS*數據庫的一組未經治療的患者*FACOMS:弗裏德賴希的共濟失調臨床結果衡量研究。**對於那些至少六個月未接受穩定奧馬維洛索龍療法的研究參與者,預計篩查期可能會延長。篩查期 ≤ 42 天** 治療期計劃 ≥ 1 年所有 7 個地點均已激活首位患者於 2024 年 3 月給藥繼續招收患者研究涵蓋青少年(12-17 歲)和兒童(2-11 歲)在 Pk 磨合研究中確認暴露後的兒童(2-11 歲)潛在延期每日皮下注射 25 mg nomlabofusp;自行給藥或由護理人員計劃將劑量增加至每日 50 mg
Nomlabofusp 臨床開發計劃全球雙盲安慰劑對照的確認/註冊研究計劃於2025年中期啓動* 計劃在2024年年底之前啓動青少年(12-17歲)的Pk試點研究,然後在2025年上半年啓動兒童(2-11歲)的Pk試點研究。打算加快批准途徑,預計在2025年下半年提交BLA被美國食品藥品管理局選中參與其Start試點計劃*公司已開始與美國食品和藥物管理局關於可能使用FXN級別來支持加快批准的消息。此外,該公司正計劃與美國以外的監管機構和調查人員進行討論,將臨床項目擴展到國際地區。正在進行的開放標籤延期研究,針對參與SAD、MAD和/或四周劑量探索研究的符合條件的患者,每日劑量爲25 mg OLE BLA提交的目標是2025年下半年完成Pk磨合研究的參與者在評估了青少年隊列的安全性和暴露數據後有資格過渡到OLE的患者的可用數據預計將於2024年12月中旬提供
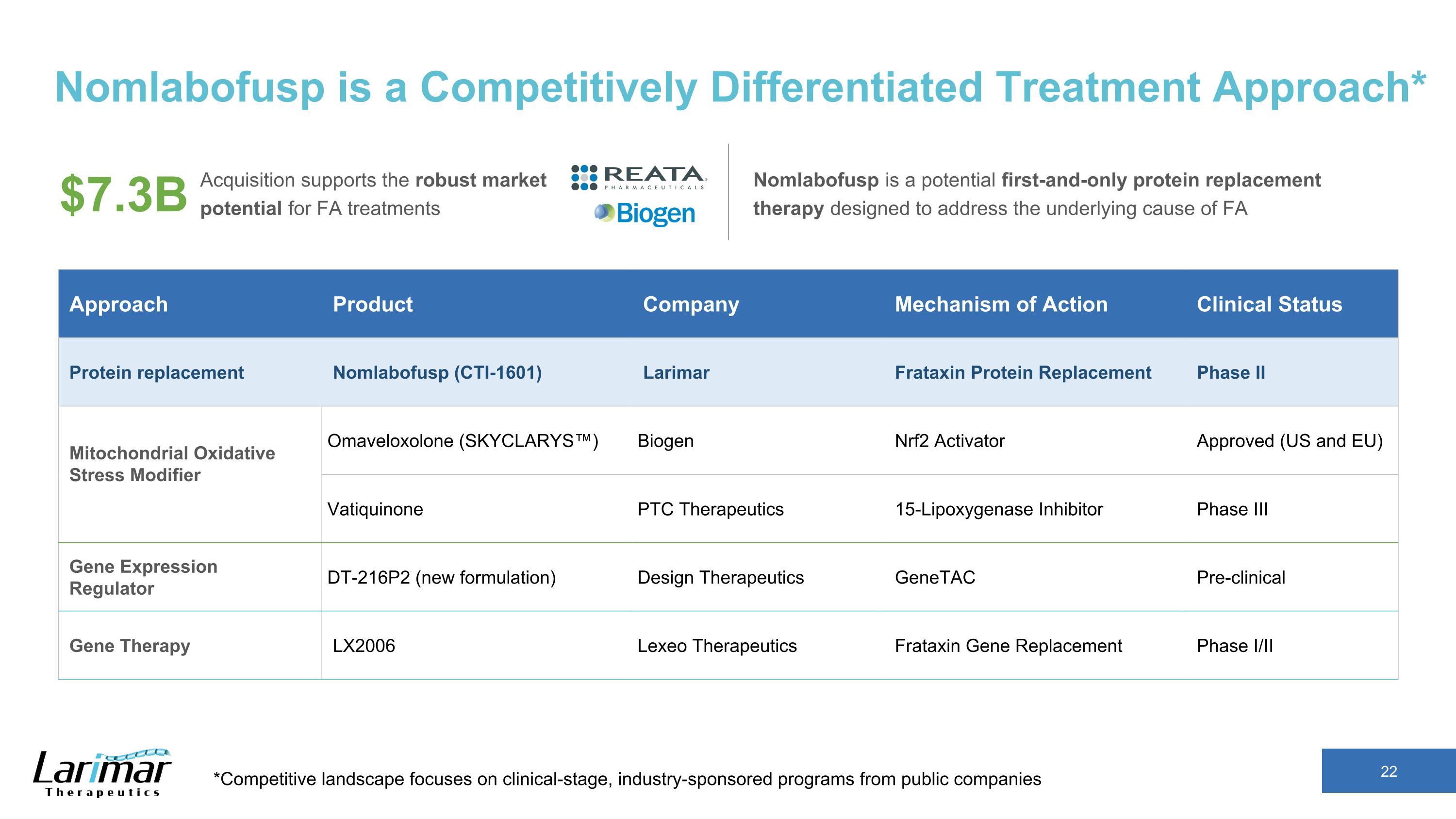
Nomlabofusp 是一種具有競爭力的差異化治療方法* *競爭格局側重於臨床階段,上市公司由行業贊助的項目收購支持了 FA 治療的強勁市場潛力 Nomlabofusp 是潛在的首款也是唯一的蛋白質替代療法,旨在解決 FA 73 億美元方法的根本原因產品公司行動機制臨床現狀蛋白質替代品 Nomlabofusp (CTI-1601) Larimar Frataxin 蛋白質替代品 II 期 Mitax Omaveloxolone (SKYCLARYS) 氧化應激調節劑™) Biogen Nrf2 激活劑獲批(美國和歐盟)Vatiquinone PTC Therapeutics 15-脂氧合酶抑制劑 III 期基因表達調節劑 Dt-216P2(新配方)Design Therapeutics Genetac 臨床前基因療法 LX2006 Lexeo Therapeutics Frataxin 基因置換 I/II 期

2024 年 11 月:在倫敦共濟失調研究國際大會(2024 年 11 月 12 日至 15 日)上發佈了三張關於 Ph 1 和 Ph 2 劑量探索數據的海報 2024 年 12 月中旬:啓動青少年(12 至 17 歲)的 Pk 試驗:啓動兒童(2-11 歲)的 Pk 試驗 2025 年中期:啓動全球確認/註冊研究 2 2025 年下半年:BLA 提交;打算加速批准 2024/2025 年裏程碑 1 期和第 2 期研究結果一致 Nomlabofusp 是在長達4周的測試劑量下,耐受性通常良好。在評估的組織(皮膚和口腔細胞)中,FXN水平比基線的劑量依賴性增加50mg隊列中皮膚細胞中的基準FXN水平<健康志願者平均值的17%。每日給藥14天后,FXN水平升至33%至59%臨床和監管更新計劃在2024年底之前啓動青少年Pk試點研究;在Pk研究後讓青少年轉入OLE在美國、歐洲、英國、加拿大和澳大利亞的臨床研究中心進行計劃啓動針對2025年中期的註冊/確認性研究 FDA選定參與其STart試點計劃啓動與FDA關於使用FXN的討論作爲替代終點,支持加速審批 Ph 2 陽性數據、OLE 更新和在青少年中啓動

臨床階段的新型蛋白質替代療法平台主要候選人nomlabofusp是一種重組融合蛋白,旨在通過將蛋白質輸送到線粒體來直接解決FA患者的frataxin缺乏問題。獲得孤兒藥(美國和歐盟)、罕見兒科疾病(美國)、快速通道(美國)、PRIME(歐盟)和ILAP(英國MHRA)稱號。Nomlabofusp被美國食品藥品管理局選中參與其Start試點計劃,在完成的爲期4周的安慰劑對照的2期研究和已完成的多次遞增劑量1期研究中,Nomlabofusp總體耐受性良好,表現出皮膚和口腔細胞中frataxin(FXN)水平與基線相比的劑量依賴性升高。截至2026年9月30日,現金和投資約爲2.04億美元。預計第一種增加fratax的療法 in水平一致的第 1 階段和第 2 階段調查結果計劃加快批准 FDA 的先行劑量2024 年第一季度服用 OLE 的成年患者每日攝入 25 mg;所有 7 個 OLE 位點均已激活;繼續招收患者正在進行的 OLE 研究與開發計劃中註冊患者的可用數據預計在 2024 年底前啓動青少年 Pk 試驗;在評估青少年隊列的安全性和暴露數據後將劑量增加到 50 mg 臨床計劃 FDA 財務基礎強大承認 FXN缺乏似乎對 FA 的致病機制至關重要,而且針對潛在疾病病理生理學的治療需求仍未得到滿足。支持加快批准的討論仍在進行中。BLA 的提交目標是在 2025 年下半年提交 Nomlabofusp (CTI-1601);FA:弗裏德賴希的共濟失調

謝謝 Larimar Therapeutics 2024 年 11 月公司套餐

附錄 Larimar 療法

Chondrial Therapeutics科學顧問委員會聯合創始人,後來成爲Larimar Therapeutics, Inc.印第安納大學醫學院兒科教授馬克·佩恩,醫學博士費城兒童醫院(CHOP)線粒體醫學前沿項目(CHOP)執行董事賓夕法尼亞大學佩雷爾曼醫學院人類遺傳學系教授 Marni J. Falk,醫學總監兼加州大學舊金山分校(UCSF)運動障礙系主任神經調節中心。卡林和艾倫·維格納爲威爾康奈爾醫學院神經病學教授吉爾·奧斯特雷姆、醫學博士喬瓦尼·曼弗雷迪醫學博士、芬巴博士和瑪麗安·肯尼臨床和研究神經病學教授。威爾康奈爾醫學院神經科學教授。

線粒體定位和臨床前數據
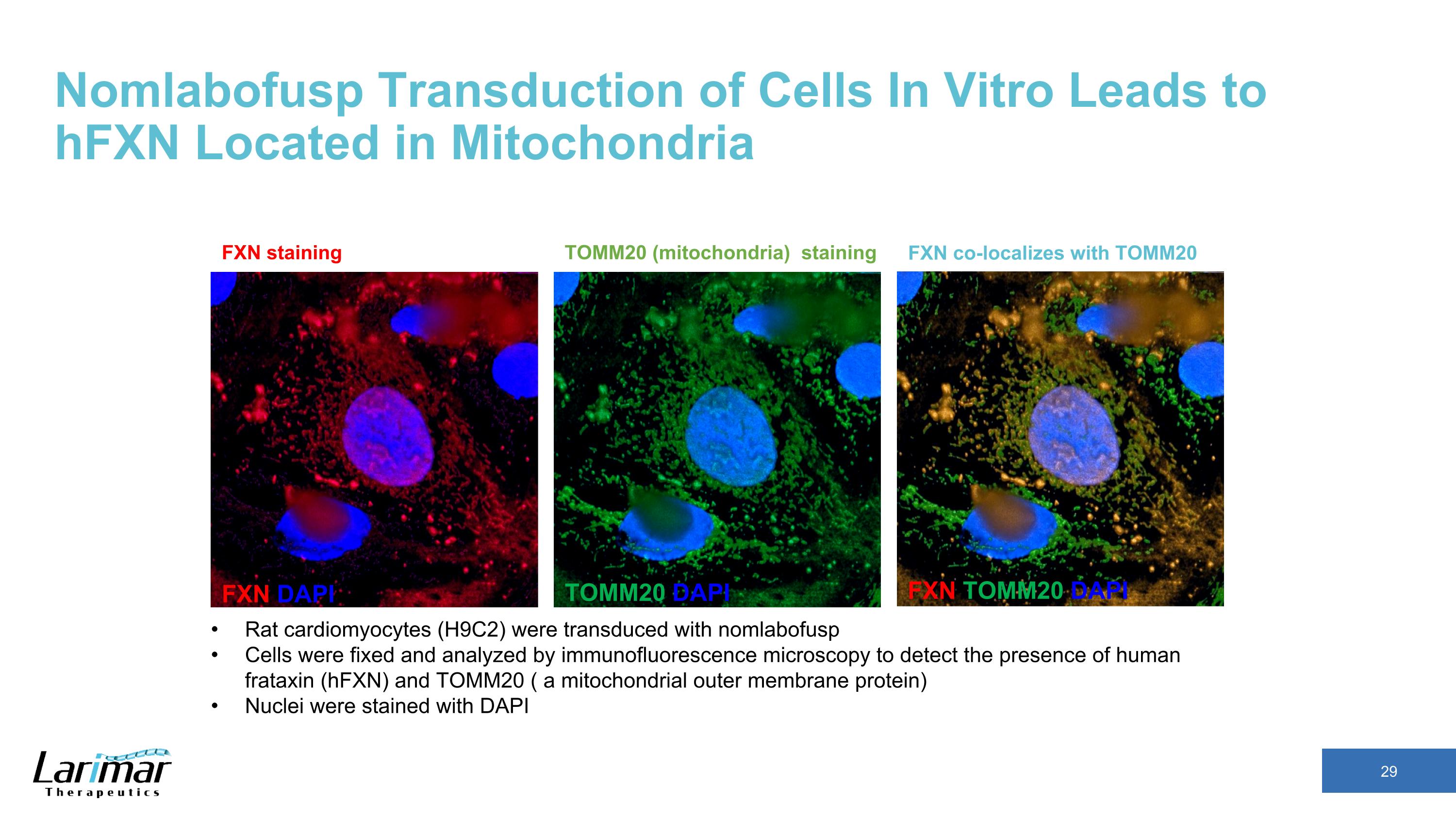
體外細胞的 nomlabofusp 轉導導導導導導導導致 HfxN 位於線粒體中 FXN DAPI TOMM20 DAPI FXN TOMM20 DAPI FXN 與 TOMM20 FXN 染色共定位 TOMM20(線粒體)染色大鼠心肌細胞(H9C2)通過 nomlabofusp 進行轉導,通過免疫熒光顯微鏡對細胞進行固定和分析,以檢測人類弗拉他辛(HfxN)和 TOMM20(用 DAPI 對線粒體外膜蛋白(核蛋白)進行染色
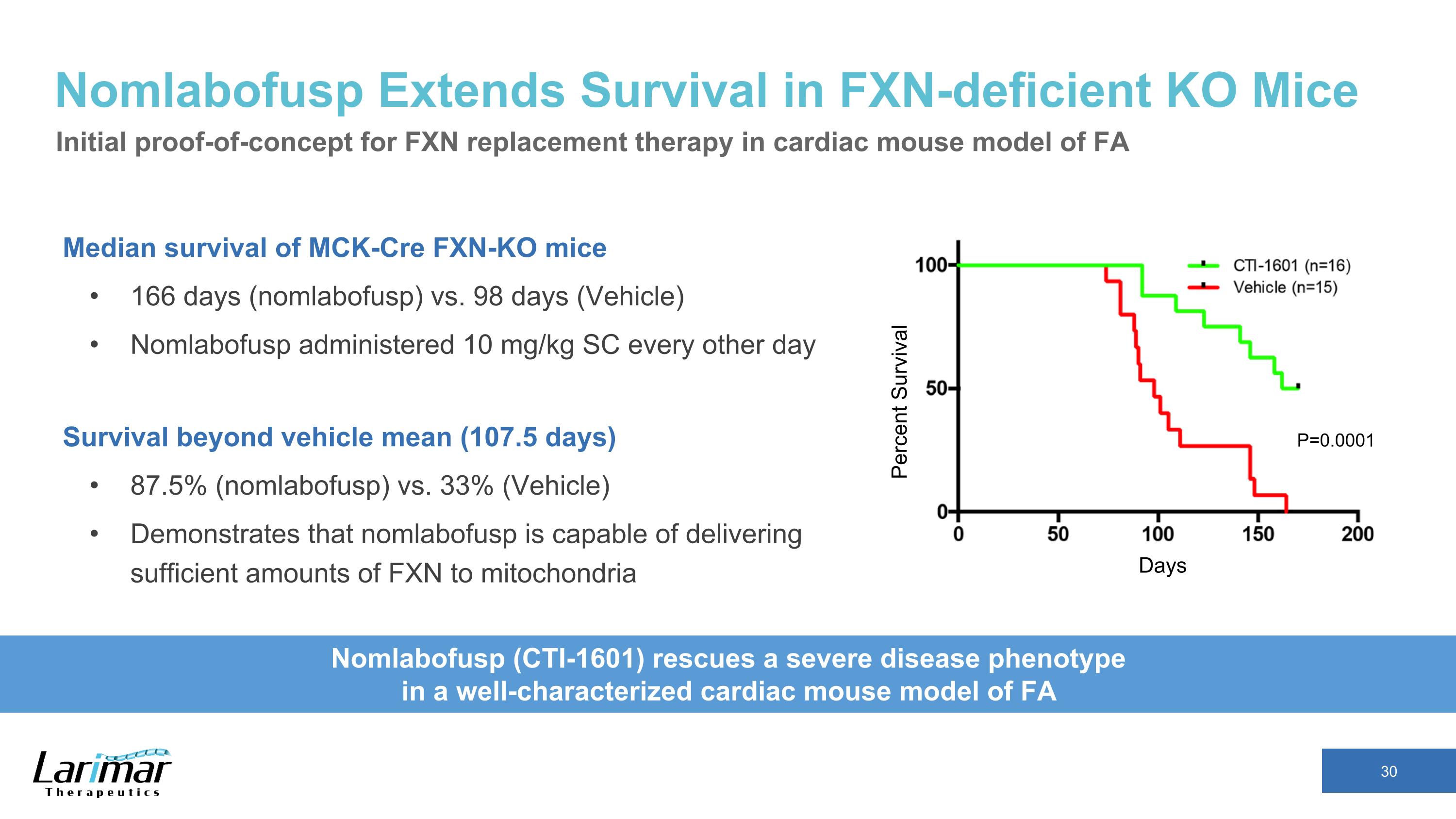
Nomlabofusp 延長 Mck-CRE FXN-KO 小鼠的存活期中位數 166 天(nomlabofusp)與 98 天(載體)Nomlabofusp 每隔一天給藥 10 mg/kg SC 存活率超過載體平均值(107.5 天)87.5%(nomlabofusp)與 33%(車輛)表明 nomlabofusp 能夠向麻省理工學院提供足夠數量的 FXN ochondria Days 存活率百分比 Nomlabofusp (CTI-1601) 拯救了一種嚴重的疾病表型 在特徵明確的心臟小鼠模型中 FA P=0.0001 FA 心臟小鼠模型中 FXN 替代療法的初步概念驗證

Nomlabofusp 阻止開發 神經系統 KO 小鼠模型中的共濟失調步態 Hfxn 替換 nomlabofusp 可防止共濟失調步態的發展 nomlabofusp 治療的小鼠比未經治療的小鼠存活時間更長人類弗拉他辛存在於大腦、背根神經節和脊髓中 Pvalb-Cre FXN-KO 小鼠模型體內療效數據單劑量水平:10 mg/kg nomlabofusp 或載體內給藥載體腹膜每週三次
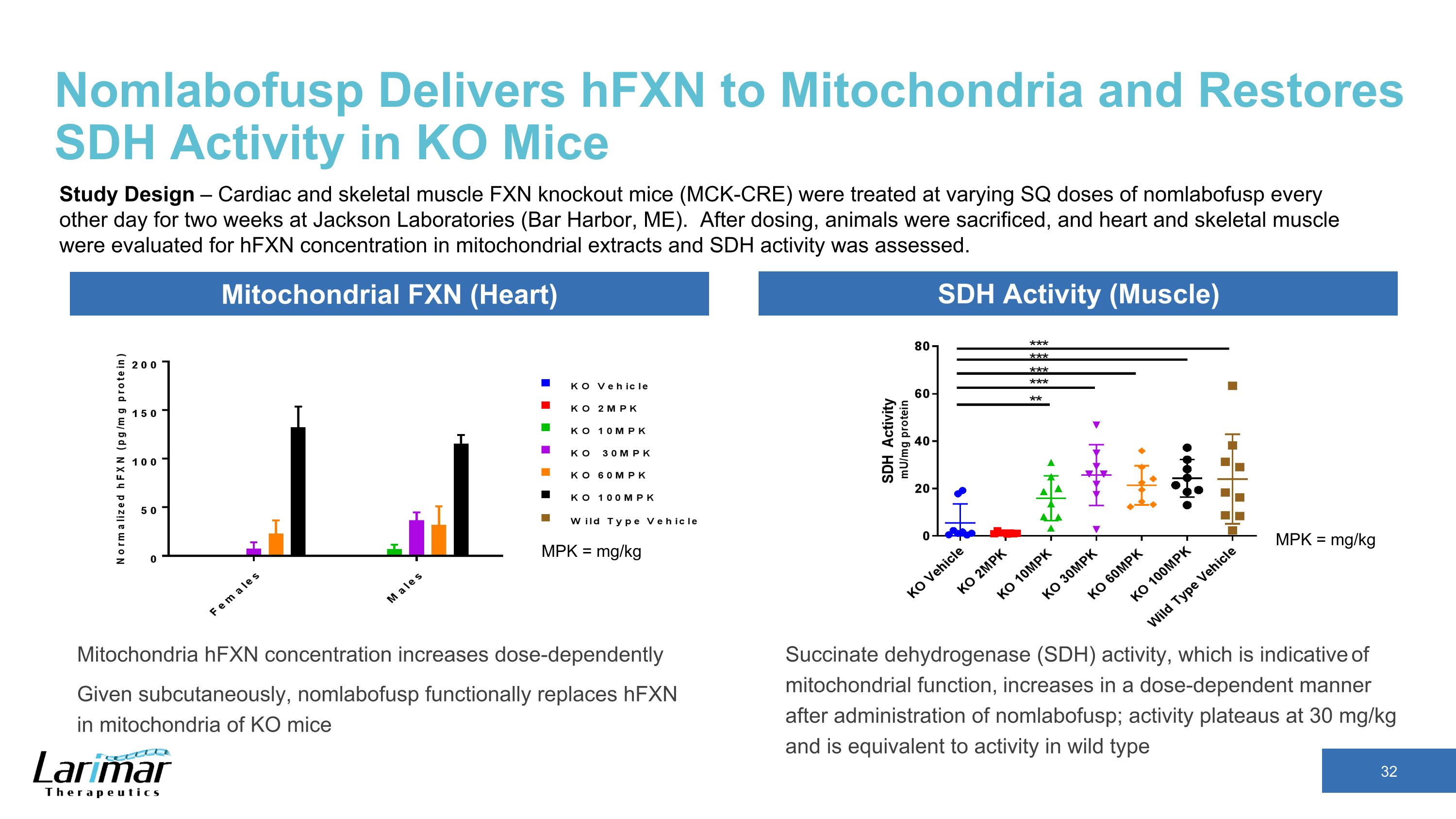
Nomlabofusp 向線粒體輸送 HfxN 並恢復 KO 小鼠的 SDH 活性線粒體 HfxN 濃度增加劑量依賴性皮下給予,nomlabofusp 功能性地取代 KO 小鼠線粒體中的 HfxN mpK = mg/kg mPk = mg/kg 線粒體 FXN(心臟)SDH 活性(肌肉)琥珀酸脫氫酶(SDH)活性是線粒體功能的指標,在給藥 nomlabofusp 後以劑量依賴性方式增加;活性穩定在 30 mg/kg,等同於野生型研究設計——心臟和骨骼中的活性在傑克遜實驗室(緬因州巴爾港),肌肉 FXN 基因敲除小鼠(Mck-CRE)每隔一天接受不同劑量的 nomlabofusp 治療,持續兩週。給藥後,犧牲了動物,評估了心臟和骨骼肌線粒體提取物中的HfxN濃度,並評估了SDH活性。
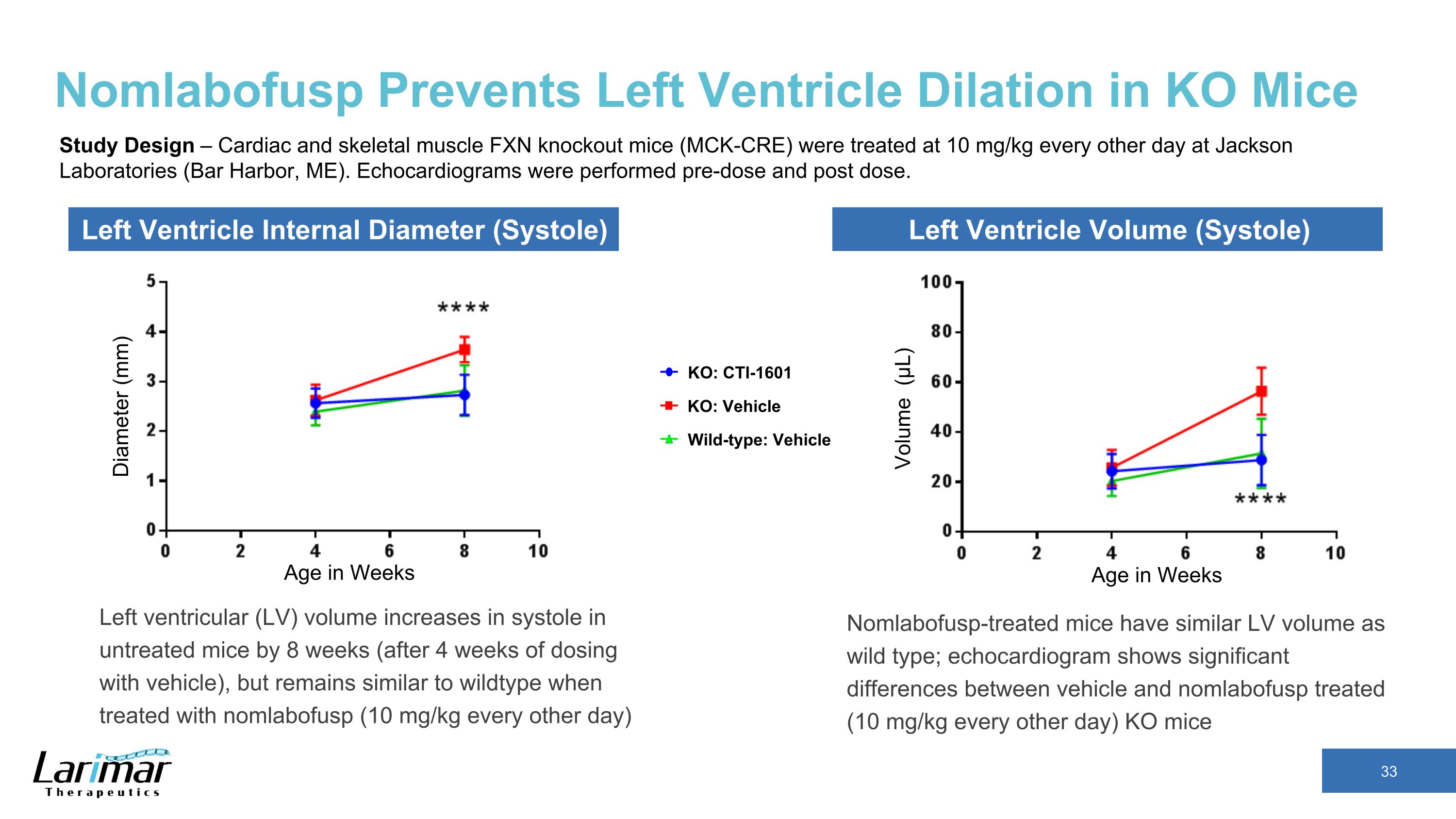
Nomlabofusp 防止 KO 小鼠左心室擴張未經治療的小鼠左心室 (LV) 收縮容量增加 8 周(給藥 4 周後),但在使用 nomlabofusp(每隔一天 10 mg/kg)治療時仍與野生型相似。直徑 (mm) 以周爲單位年齡年齡以周體積 (μL) 計 KO:CTI-1601 野生型:車輛 KO:車輛左心室心肌內徑(收縮)左心室容積(收縮)研究設計——傑克遜實驗室每隔一天對心肌和骨骼肌肉 FXN 敲除小鼠(McK-CRE)進行每隔一天治療 10 mg/kg(緬因州巴爾港)。超聲心動圖是在給藥前和給藥後進行的。接受了 Nomlabofusp 治療的小鼠的心室容量與野生型小鼠相似;超聲心動圖顯示載體和 nomlabofusp 治療(每隔一天 10 mg/kg)KO 小鼠之間存在顯著差異
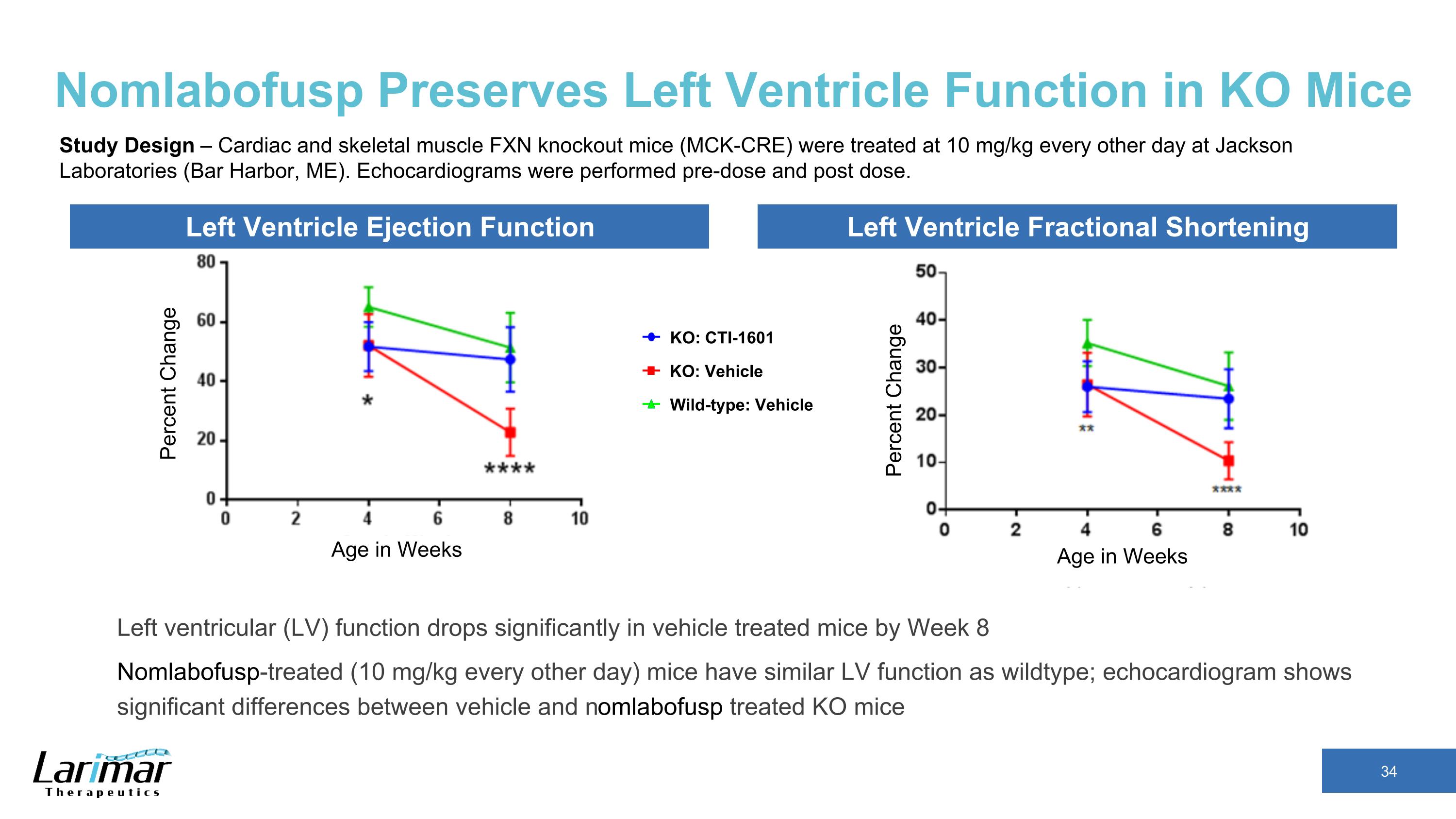
Nomlabofusp 保持 KO 小鼠的左心室功能幾周內的年齡變化百分比左心室射精功能左心室分數縮短几周內的變化年齡 KO:CTI-1601 Wild-Type:載體 KO:載體研究設計 — 傑克遜實驗室(緬因州巴爾港)每隔一天對心肌和骨骼肌FXN敲除小鼠(MCK-CRE)進行每隔一天以10 mg/kg的劑量進行治療。超聲心動圖是在給藥前和給藥後進行的。受過載體治療的小鼠的左心室 (LV) 功能在第 8 周顯著下降 nomlabofusp 治療(每隔一天 10 mg/kg)小鼠的左心室 (LV) 功能與野生型小鼠的左心室 (LV) 功能相似;超聲心動圖顯示載體和 nomlabofusp 治療的 KO 小鼠之間存在顯著差異

第 1 階段臨床數據

CTI-1601:FA患者的1期臨床計劃1期發展計劃針對FA患者給藥的兩項雙盲、安慰劑對照劑量試驗於2019年12月開始,安全審查委員會評估了每個隊列之間的所有盲數據以確保患者安全受試者數量:28 劑量水平:25 mg、50 mg、75 mg和100 mg(皮下給藥)治療持續時間:1 天 1° 終點:安全性和耐受性 2° 終點:PK;PD;FXN 水平;多重探索狀態:完整單一遞增劑量 (SAD) 受試者數量:27 劑量範圍:25 mg、50 mg、100 mg(皮下給藥)治療方案:在 13 天內皮下多次增加劑量 1° 終點:安全性和耐受性 2° 終點:PK;PD;FXN 水平(口腔細胞、血小板、可選皮膚活檢);多種探索狀態:符合多重遞增劑量(MAD)的患者可參加 MAD 試驗計劃,包括雙盲、安慰劑 bo 對照的單劑量和多遞增劑量試驗
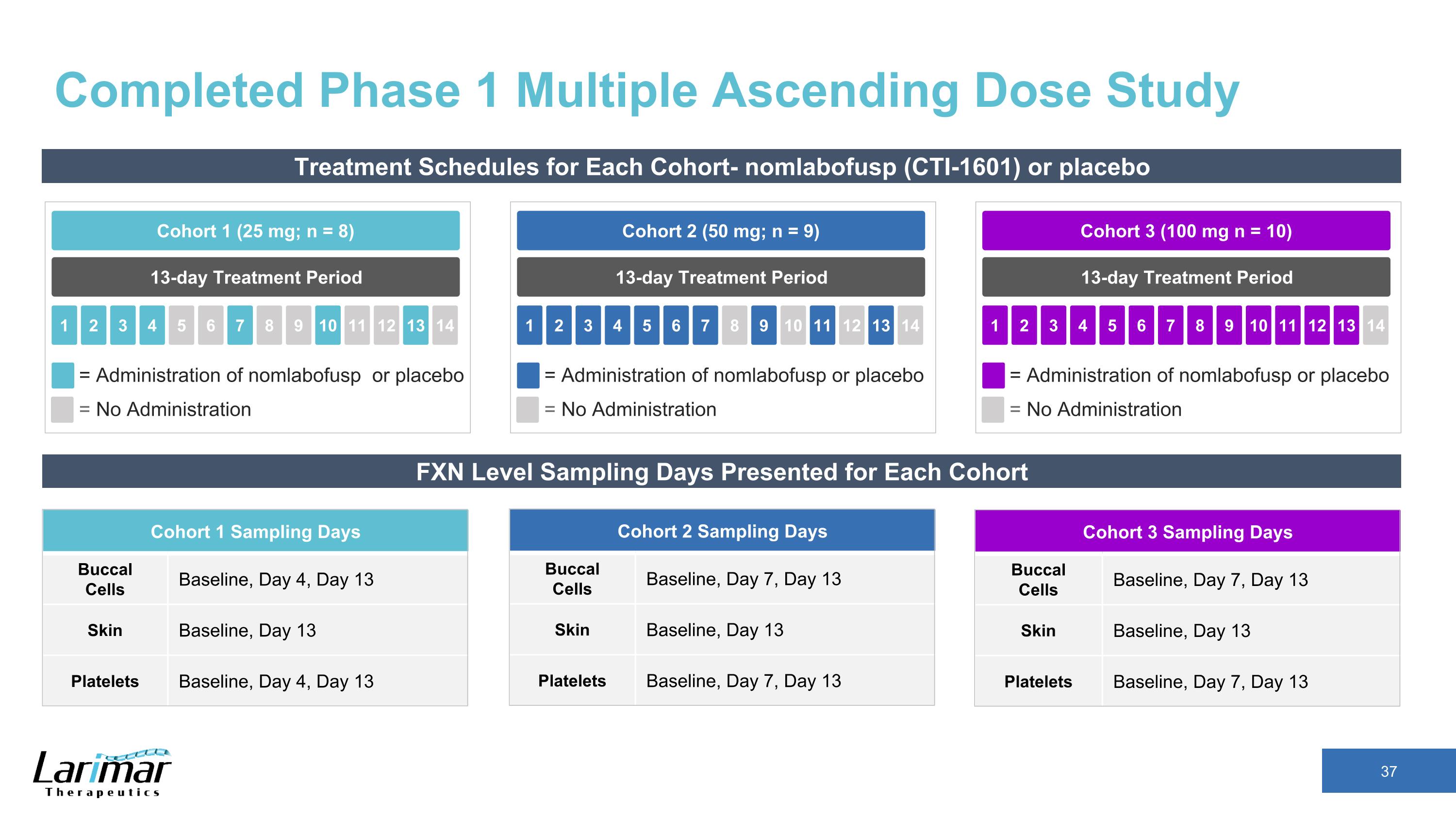
已完成每個隊列的1期多升序劑量研究治療計劃——nomlabofusp(CTI-1601)或安慰劑 13 天治療期隊列 2(50 mg;n = 9)2 3 4 5 1 6 7 8 9 10 11 12 13 14 = 給藥 nomlabofusp 或安慰劑 = 不給藥 13 天治療期隊列 1(25 mg;n = 8)2 3 4 5 1 6 7 8 9 10 11 12 13 14 = 給藥 nomlabofusp 或安慰劑 = 不給藥 13 天治療期隊列 3(100 mg n = 10)2 3 4 5 1 6 7 8 9 10 11 12 13 14 = 給藥 nomlabofusp 或安慰劑 = 不給藥 FXN 水平抽樣每個隊列的天數 1 採樣天數口腔細胞基線、第 4 天、第 13 天皮膚基線、第 13 天血小板基線、第 4 天、第 13 天隊列 2 採樣天口腔細胞基線、第 7 天、第 13 天皮膚基線、第 13 天血小板基線、第 7 天、第 13 天皮膚基線、第 13 天血小板基線、第 7 天 13
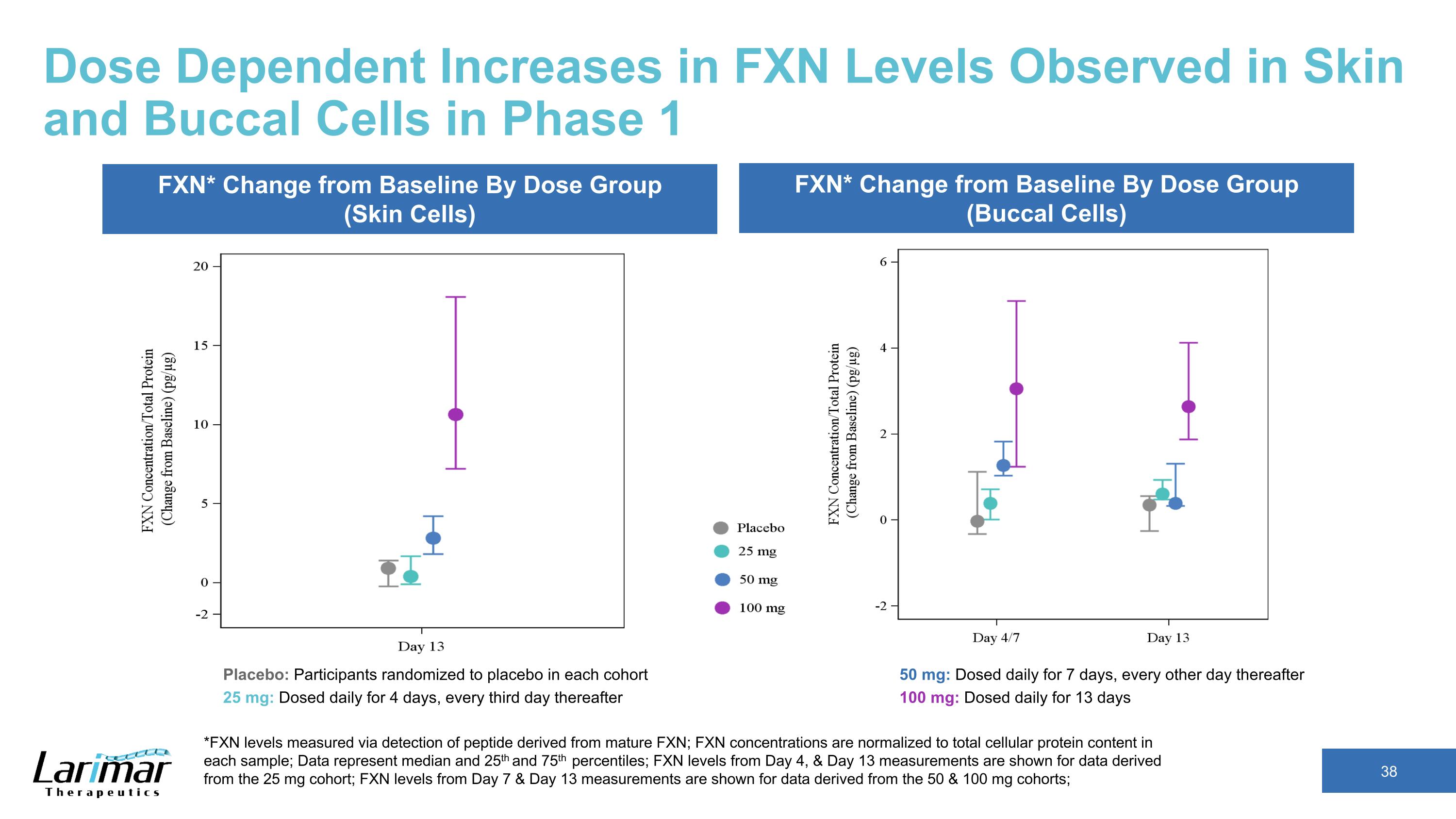
在第 1 階段觀察到皮膚和口腔細胞中 FXN 水平的劑量依賴性增加 *FXN 水平通過檢測源自成熟 FXN 的肽來測量;FXN 濃度歸一化爲每個樣本中的細胞蛋白總含量;數據代表中位數、第 25 和第 75 個百分位數;來自第 25 mg 隊列的數據顯示了第 4 天和第 13 天測量值的 FXN 水平;顯示了第 7 天和第 13 天測量值的 FXN 水平用於源自 50 和 100 mg 隊列的數據;FXN* 按劑量組(皮膚細胞)劃分的與基線的變化 FXN* 與基線的變化依據劑量組(口腔細胞)安慰劑:參與者在每個隊列中隨機使用安慰劑 25 mg:每天給藥,持續 4 天,之後每隔三天給藥 50 mg:每日給藥,持續 7 天,之後每隔一天給藥 100 mg:每天給藥,持續 13 天
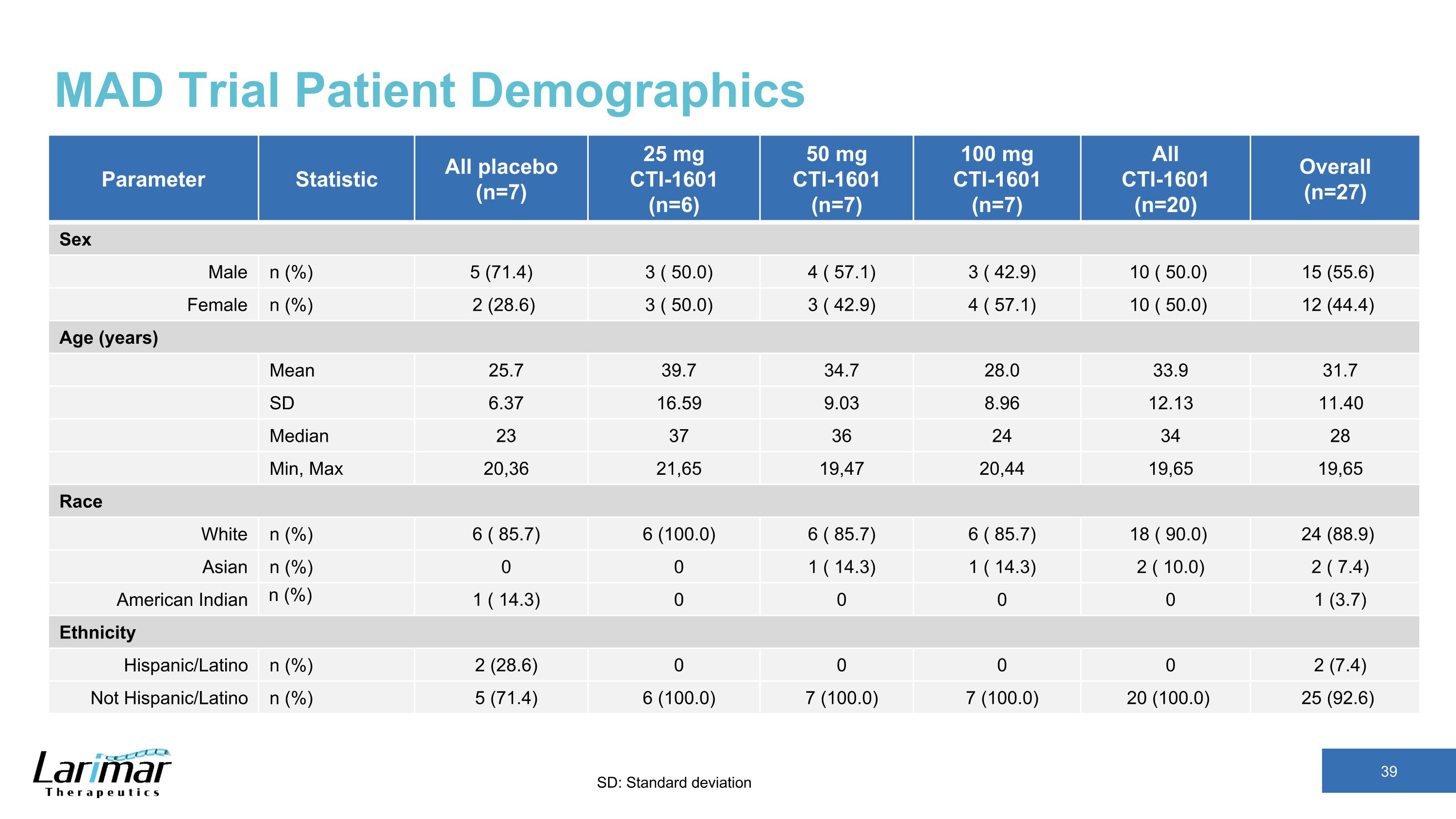
MAD 試驗患者人口統計參數統計數據所有安慰劑 (n=7) 25 mg CTI-1601 (n=6) 50 mg CTI-1601 (n=7) 100 mg CTI-1601 (n=7) 全部 CTI-1601 (n=20) 總體 (n=27) 性別 n (%) 5 (71.4) 3 (50.0) 4 (57.1) 3 (42.9) 10 (50.0) 15 (55.6) 女 n (%) 2 (%) 2 (6) 3 (50.0) 3 (42.9) 4 (57.1) 10 (50.0) 12 (44.4) 年齡(歲)平均值 25.7 39.7 34.7 28.0 33.9 31.7 31.7 31.7 SD 6.37 9.03 8.96 11.13 11.40 中位數 23 37 36 24 34 28 分鐘,最大 20,36 21,47 19,44 19,65 19,65 19,65 種族白人 n (%) 6 (865)) 6 (100.0) 6 (85.7) 6 (85.7) 18 (90.0) 24 (88.9) 亞洲人 n (%) 0 0 1 (14.3) 1 (14.3) 2 (10.0) 2 (7.4) 美洲印第安人 n (%) 1 (14.3) 0 0 0 0 1 (3.7) 種族西班牙裔/拉丁裔 n (%) 2 (28.6) 0 0 0 0 2 (7.4) 非西班牙裔/拉丁裔 n (%) 5 (71.4) 6 (100.0) 7 (100.0) 7 (100.0) 20 (100.0) 25 (100.0) 25 (92.6) SD:標準差
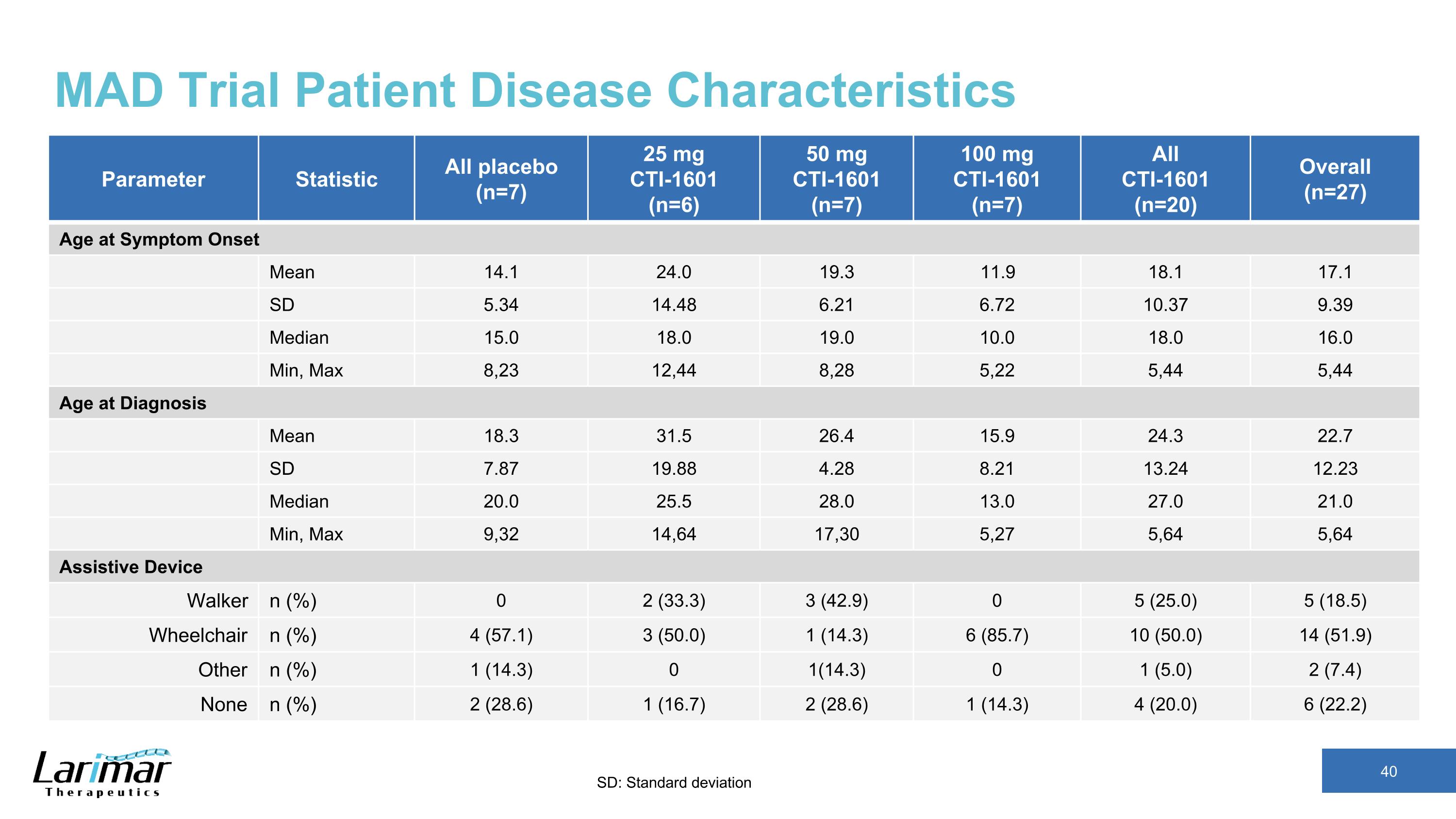
MAD 試驗患者疾病特徵參數統計數據所有安慰劑 (n=7) 25 mg CTI-1601 (n=6) 50 mg CTI-1601 (n=7) 100 mg CTI-1601 (n=7) 全部 CTI-1601 (n=20) 總體 (n=27) 症狀發作時的年齡平均值 14.1 24.0 19.3 11.1 17.1 SD 5.34 14.48 6.21 6.72 10.37 9.39 中位數 15.0 18.0 10.0 16.0 最小,最大 8,23 12,44 8,28 5,22 5,44 5,44 診斷年齡平均值 18.3 31.5 26.4 15.9 24.3 22.7 SD 7.87 19.88 8.21 13.24 12.23 中位數 20.0 25.0 28.0 13.0 27.0 21.0 最小,最大 9,32 14,64 17,30 5,27 5,64 5,64 輔助設備 Walker n (%) 0 2 (33.3) 3 (42.9) 0 5 (25).0) 5 (18.5) 輪椅 n (%) 4 (57.1) 3 (50.0) 1 (14.3) 6 (85.7) 10 (50.0) 14 (51.9) 其他 n (%) 1 (14.3) 0 1 (14.3) 0 1 (5.0) 2 (7.4) 無 n (%) 2 (28.6) 1 (14.3) 4 (14.3) 4 (7.4) 20.0) 6 (22.2) SD:標準差

MAD 試驗摘要 Pk Analyses CTI-1601 在皮下給藥後迅速被吸收劑量成比例增加 CTI-1601 劑量增加血漿中 CTI-1601 的平均半衰期約爲 11 小時 CTI-1601 在每天給藥 100 mg 後,似乎處於或接近穩態暴露狀態,一次 Pk 分析支持評估 CTI-1601 的每日一次和每隔一天的給藥方案

第 2 階段的人口統計/疾病特徵和其他數據
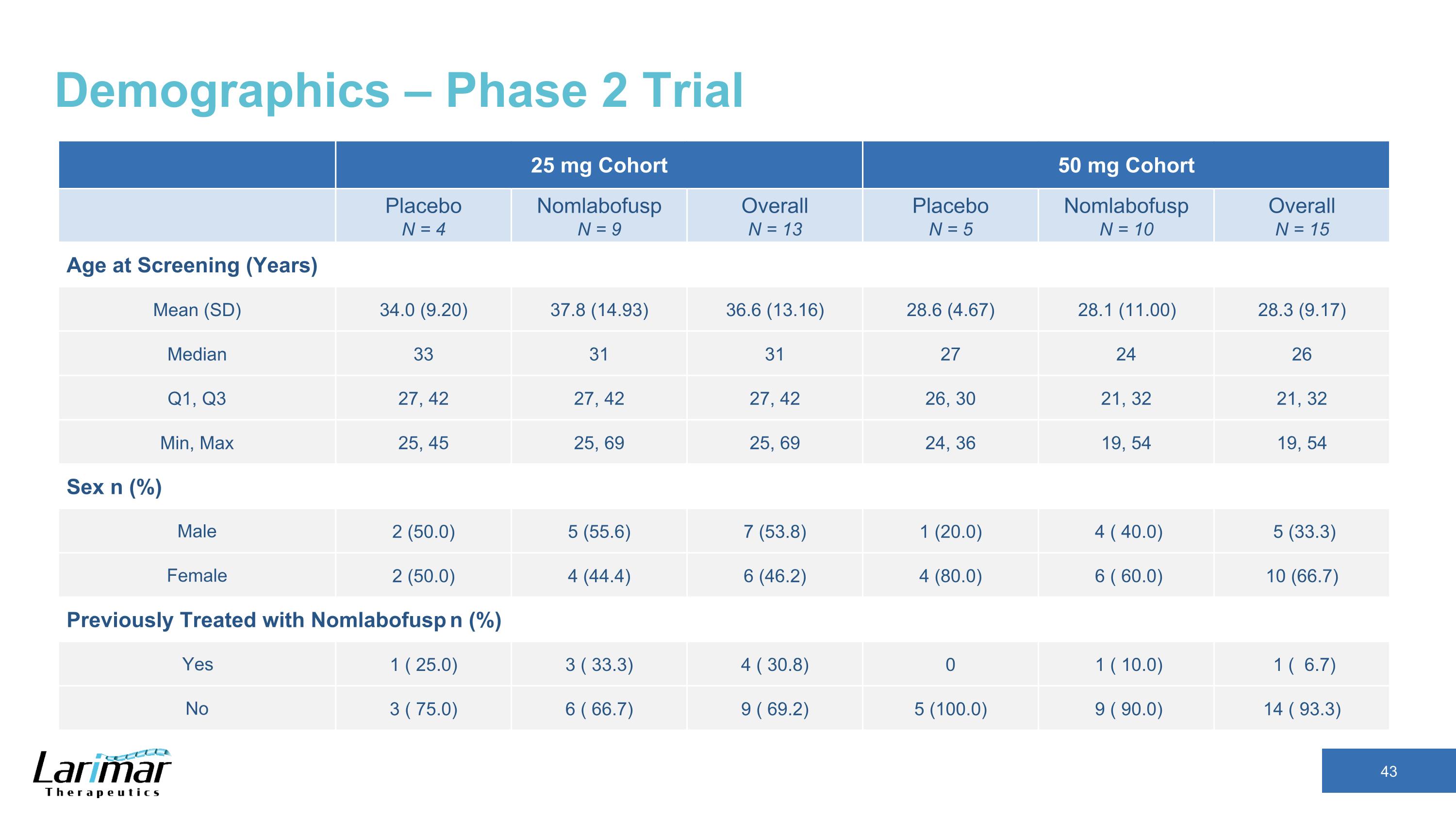
人口統計 — 2 期試驗 25 mg 隊列 50 mg 隊列安慰劑 N = 4 Nomlabofusp N = 9 總體 N = 13 安慰劑 N = 5 Nomlabofusp N = 10 總體 N = 15 總體年齡(年)平均值(SD)34.0(9.20)37.8(14.93)36.6(4.67)28.1(11.00)28.3(9.17)中位數 33 31 31 27 24 26 Q1、Q3 27、42 27、42 27、42 26、30 21、32 min、Max 25、45 25、69 25、69 24、36 19、54 19、54 性別 n (%) 男 2 (50.0) 5 (55.6) 7 (53.8) 1 (20.0) 4 (43.3) 女 2 (50.0) 4 (43.3) 女 2 (50.0) 4 (43.3) 4.4) 6 (46.2) 4 (80.0) 6 (60.0) 10 (66.7) 之前曾接受過 Nomlabofusp n (%) 治療過 Nomlabofusp n (%) 是 1 (25).0) 3 (33.3) 4 (30.8) 0 1 (10.0) 1 (6.7) No 3 (75.0) 6 (66.7) 9 (69.2) 5 (100.0) 9 (100.0) 9 (90.0) 14 (93.3)
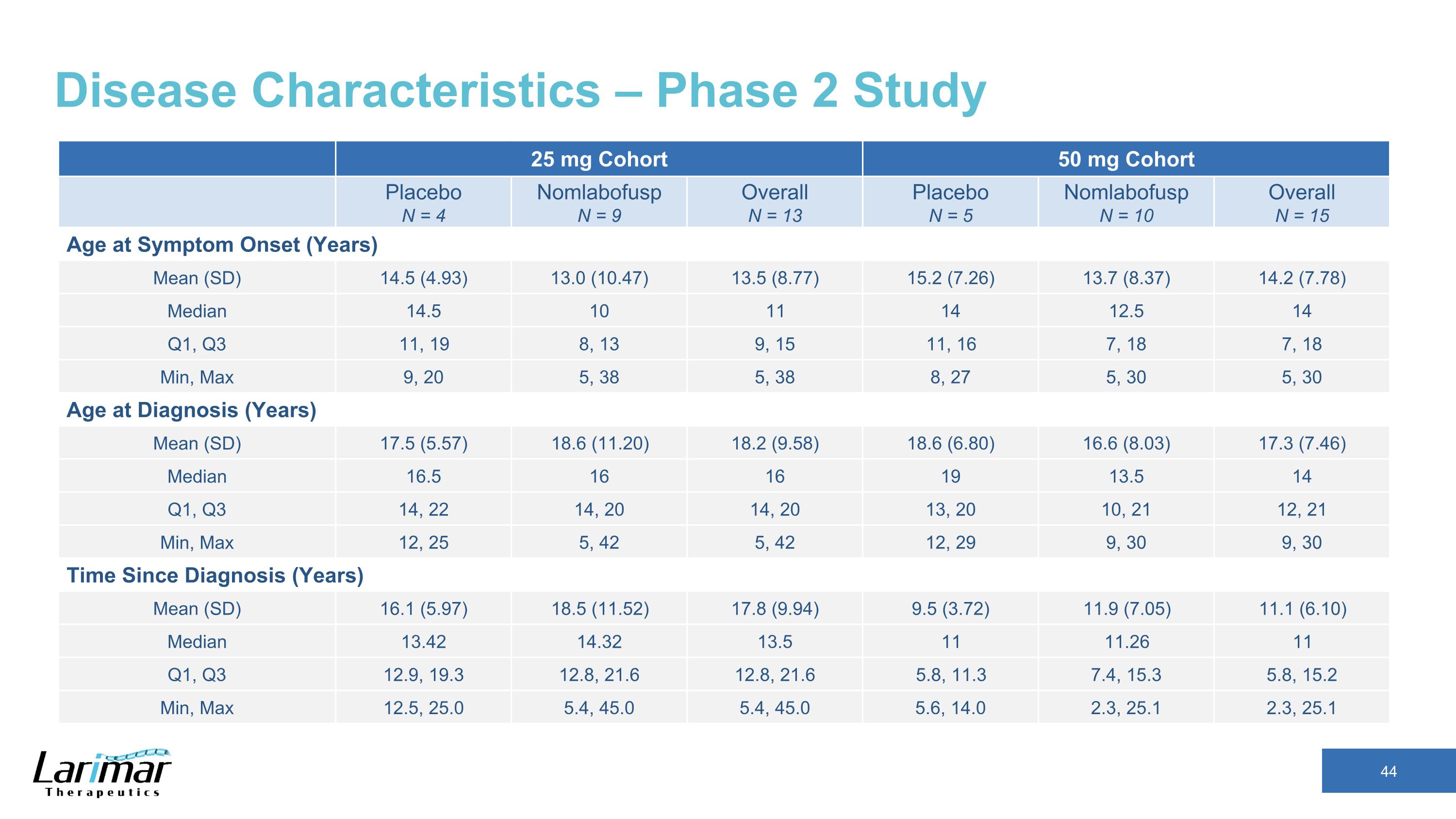
疾病特徵 — 2 期研究 25 mg 隊列 50 mg 隊列安慰劑 N = 4 nomlabofusp N = 9 總體 N = 13 安慰劑 N = 5 Nomlabofusp N = 10 總體年齡 N = 15 症狀發作時的年齡(年)平均值(SD)14.5(4.93)13.5(8.77)15.2(7.26)13.2(8.37)14.2(7.78)中位數 14.5 10 11 14 12.5 14 第一季度、第三季度 11、19 8、13 9、15 11、16 7、18 7、18 分鐘、最大 9、20 5、38 5、38 8、27 5、30 5、30 診斷時年齡(年)平均值(SD)17.5(5.57)18.2(9.58)18.6(6.80)16.6(8.03)17.3 (7.46) 中位數 16.5 16 16 19 13.5 14 第一季度、第三季度 14、22 14、20 14、20 13、20 10、2112、21 分鐘、最大值 12、25 5、42 5、42 12、29 9、30 9、30、30 自診斷(年)平均值(SD)16.1(5.97)18.5(11.52)17.8(9.94)9.5(3.72)11.9(3.72)11.9(7.05)11.1(6.10)中位數 13.42 14.32 13.5 11 11.26 11 第一季度、第三季度 12.9、19.3 12.8、21.6 12.8、21.6 5.8、11.3 7.4、15.3 5.8、15.2 分鐘、最大值 12.5、25.0 5.4、45.0 5.4、45.0 5.4、45.0 5.6、14.0 2.3、25.1
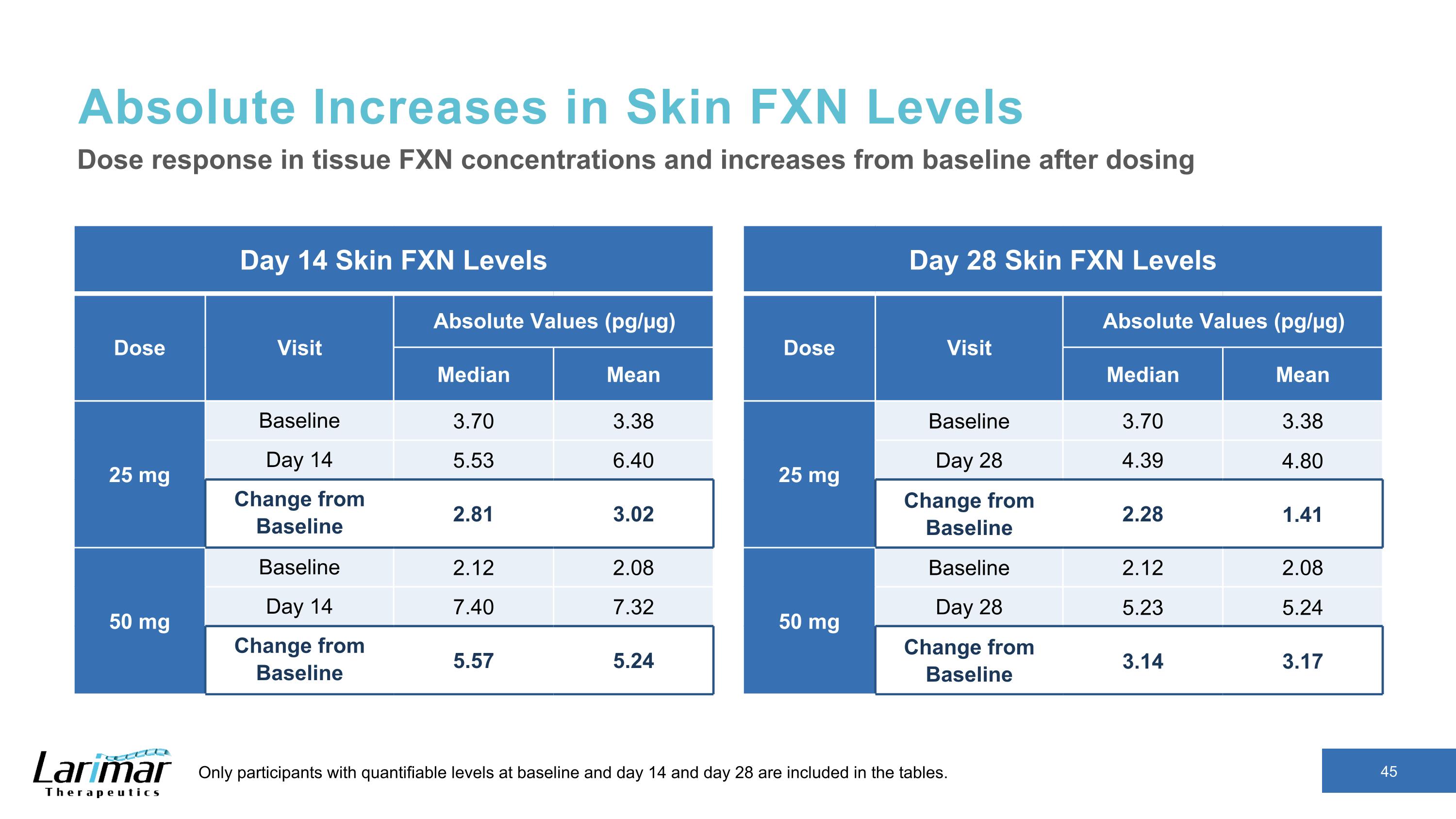
皮膚 FXN 水平的絕對增加第 14 天皮膚 FXN 水平劑量訪問絕對值 (pg/µg) 中位平均值 25 mg 基線 3.70 3.38 天 14 5.53 6.40 與基線的變化 2.81 3.02 50 mg 基線 2.12 2.08 第 14 天 7.40 7.32 與基線的變化 5.57 5.24 組織劑量反應 FXN 濃度以及給藥後與基線相比的增加僅包括在基線、第 14 天和第 28 天具有可量化水平的參與者在表格中。第 28 天皮膚 FXN 水平劑量訪問絕對值 (pg/µg) 中位數平均值 25 mg 基線 3.70 3.38 天 28 4.39 4.80 與基線的變化 2.28 1.41 50 mg 基線 2.12 2.08 天 28 5.23 5.24 與基線的變化 3.14 3.17
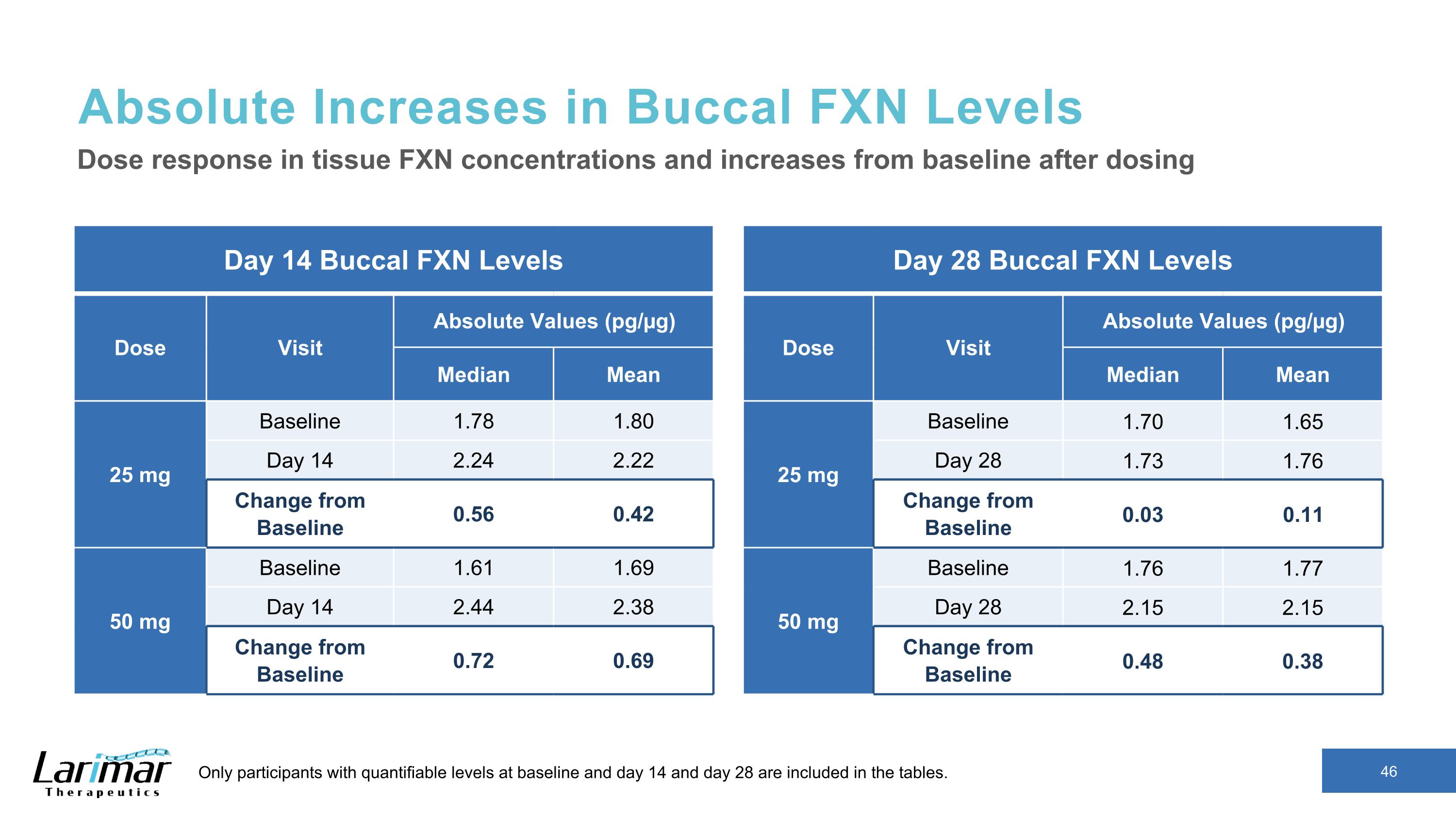
Buccal FXN 水平的絕對增加第 14 天 Buccal FXN 水平劑量訪問絕對值 (pg/µg) 中位數平均值 25 mg 基線 1.78 1.80 天 14 2.24 2.22 與基線的變化 0.56 0.42 50 mg 基線 1.61 1.69 第 14 天 2.44 2.38 與基線相比的變化 0.72 0.69 組織劑量反應以及給藥後與基線相比的增加只有在基線和第 14 天有可量化水平的參與者以及第 28 天包含在表格中。第 28 天 Buccal FXN 水平劑量就診絕對值 (pg/µg) 中位數平均值 25 mg 基線 1.70 1.65 天 28 1.73 1.76 與基線的變化 0.03 0.11 50 mg 基線 1.76 1.77 第 28 天 2.15 2.15 與基線的變化 0.48 0.38

非干預性研究數據
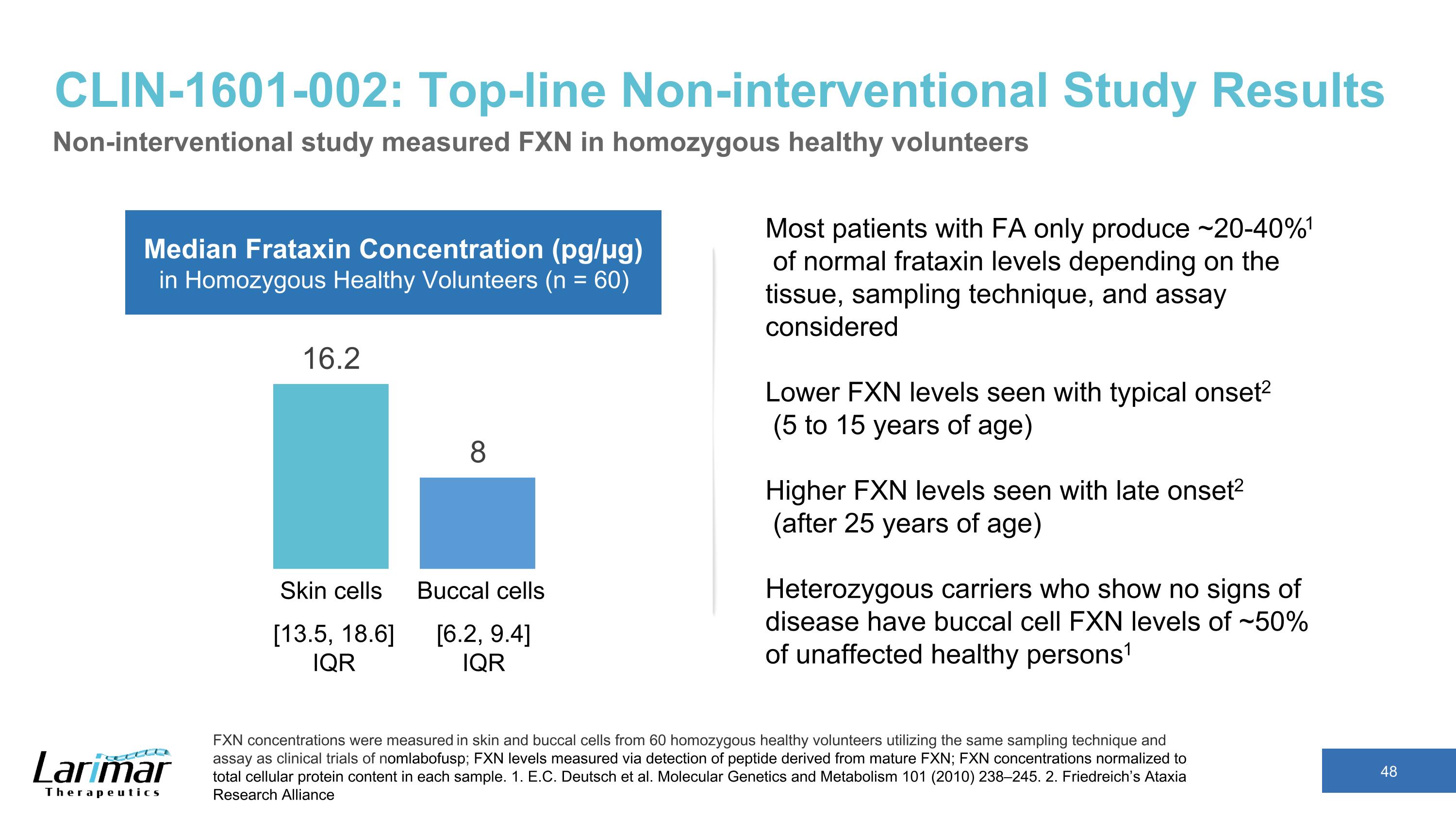
CLIN-1601-002:最重要的非介入性研究結果非介入性研究測量了純合健康志願者的FXN濃度。使用與nomlabofusp臨床試驗相同的採樣技術和測定方法,測量了60名純合健康志願者的皮膚和頰細胞中的FXN濃度;通過檢測源自成熟FXN的肽測定FXN水平;FXN濃度標準化爲每個樣本中的細胞蛋白總含量。1.E.C. Deutsch 等人分子遺傳學與代謝 101 (2010) 238—245. 2.弗裏德賴希的共濟失調研究聯盟皮膚細胞口腔細胞純合健康志願者的中位弗拉他辛濃度(pg/µg)(n = 60)大多數FA患者產生的弗拉他辛水平約爲正常水平的20-40%1%,具體取決於組織、採樣技術和分析的考慮,典型發作時FXN水平較低2(5至15歲)晚期出現較高的FXN水平 set2(25 歲後)沒有疾病跡象的雜合子攜帶者的口腔細胞 FXN 水平約爲未受影響的健康人群的 50% 1 [13.5, 18.6] IQR [6.2, 9.4] IQR [6.2, 9.4] IQR

FDA StarT 試點計劃

Nomlabofusp 被 FDA 選入 StarT 試點計劃,這凸顯了美國食品藥品管理局承諾通過更快的臨時溝通來加強正式會議,以加快罕見病項目的開發 StarT 試點計劃支持推進罕見病療法的臨床試驗 FDA 於 2023 年 9 月啓動了新的里程碑驅動的計劃旨在加速開發旨在解決罕見病未得到滿足的醫療需求的新療法 7 種新藥被 CDER (nomlabofusp) 選中 3 種用於罕見神經的產品退行性疾病 4 個產品CBER 用於細胞和基因療法 FDA:食品藥品監督管理局;CDER:藥物評估與研究中心;CBER:生物製劑評估與研究中心; CMC:化學、製造和控制 CDER 根據已證明的開發計劃準備就緒情況(例如,證明有能力將項目轉向市場應用的贊助商)進行選擇 CDER 有潛力解決罕見神經退行性疾病中嚴重且未得到滿足的醫療需求 CMC 開發時間表與臨床開發計劃保持一致加強溝通可以提高產品開發效率的擬議計劃