
將潛能轉化為現實 天境生物 2024年11月14日

法律聲明。本簡報由天境生物(以下稱「公司」)僅為資訊用途準備。此處包含的某些資訊系從各種來源獲得,包括某些第三方,並未經公司獨立驗證。通過查看或訪問本簡報中包含的信息,您特此確認並同意,本公司或其任何董事、股東、員工、代理、關聯公司、顧問或代表不對本簡報中呈現或包含的任何信息或意見的真實性、準確性、公平性、完整性或合理性作出明示或暗示的陳述、保證或承諾,您不應將其視為有依據。公司及其任何董事、員工、代理、關聯公司、顧問或代表不對本簡報中呈現或包含的任何信息或因本簡報而引起的任何損失(不論是疏忽還是其他方式)承擔任何責任。除非法律要求,否則本簡報中所呈現或包含的信息僅於本日期時為準,並可隨時更改而不另行通知。無要約或徵求。此簡報不構成對購買或出售公司任何證券或工具的要約或徵求,亦不構成參與任何投資活動或交易策略的要約,或其任何部分不得成為任何合同或承諾的基礎或依據。此處的內容不構成在任何州或司法管轄區出售或徵求購買任何證券或工具的要約。此簡報不聲稱也不包含與公司或其證券相關的所有相關信息,特別是在投資於公司證券時涉及的風險和特殊考量方面。本簡報中包含的內容不應被視為對公司過去或未來表現的承諾或陳述。過去的表現並不保證或預測未來的表現。您確認,您可能對公司的評估將獨立於本簡報,您將對自己的市場評估和公司市場地位負全部責任,並將進行自己的分析,對形成自己對公司業務未來潛在表現的觀點負全部責任。本簡報包含的統計數據和其他行業及市場數據,我們來自行業出版物和第三方進行的研究、調查和研究,以及我們自己對潛在市場機會的估算。所有在本簡報中使用的市場數據都涉及多個假設和限制,您被提醒不要過於重視這些數據。行業出版物和第三方的研究、調查和研究通常表明其信息來源被認為是可靠的,儘管不保證該信息的準確性或完整性。我們對產品候選者潛在市場機會的估算包括基於我們行業知識、行業出版物、第三方研究和其他調查的幾個關鍵假設,這些假設可能基於小樣本,並可能無法準確反映市場機會。儘管我們相信我們的內部假設是合理的,但並未有獨立來源驗證這些假設。前瞻性聲明。本簡報包含前瞻性聲明。這些聲明是根據1995年美國私人證券訴訟改革法案的“安全港”條款作出的。這些前瞻性聲明可以通過諸如“未來”、“有前途”、“可能”、“計劃”、“潛在”、“將”、“能夠定位”、“承諾”、“推進”、“目標”、“設計”、“策略”、“管道”和“項目”等術語或其否定形式識別出來。並非所有的聲明都是歷史事實,包括對天境生物的信念和預期的聲明,均為前瞻性聲明。本簡報中的前瞻性聲明包括但不限於以下內容:公司的管道和資本策略;uliledlimab的潛在好處、優勢、承諾、特徵和目標使用;公司組合的預期進展及相關里程碑和時間安排;市場機會以及天境生物對uliledlimab、givastomig和ragistomig的潛在下一步(包括潛在的擴展、差異化或商業化);公司對持續和未來試驗數據影響的預期;剩餘贖回義務的結算時間;公司與開發夥伴合作的好處;公司持續遵守某些審核要求的能力;研究的時間進度(包括與患者招募和劑量的相關性);來自持續研究的數據和信息的可用性;以及公司對其現金流的預期。這些前瞻性聲明涉及內在風險和不確定性,可能導致實際結果與此類前瞻性聲明中表達或暗示的結果存在重大差異。這些風險和不確定性包括但不限於以下內容:天境生物展示其藥物候選者的安全性和有效性的能力;其藥物候選者的臨床結果,可能支持或不支持進一步開發或新藥申請/生物製品許可申請的批准;相關監管當局對天境生物藥物候選者的監管批准所作的決定的內容和時間;天境生物的藥物候選者若獲批准,能否實現商業成功;天境生物是否能獲得並維護對其科技和藥物的知識產權保護;天境生物依賴第三方進行藥物開發、製造和其他服務的狀況;天境生物有限的營運歷史以及其獲得額外資金以維持運營並完成藥物候選者的開發和商業化的能力;以及在天境生物最近的20-F表格年報及隨後向美國證券交易委員會(“SEC”)的提交文件中討論的潛在風險、不確定性和其他重要因素。天境生物也可能在其定期報告、向股東的年報、新聞稿和其他書面材料中,以及其高層、董事或員工與第三方發表的口頭聲明中作出書面或口頭的前瞻性聲明。所有前瞻性聲明均基於天境生物目前可用的信息。天境生物不承擔任何義務公開更新或修訂任何前瞻性聲明,不論是因新信息、未來事件還是其他因素,除非法律要求。免責聲明
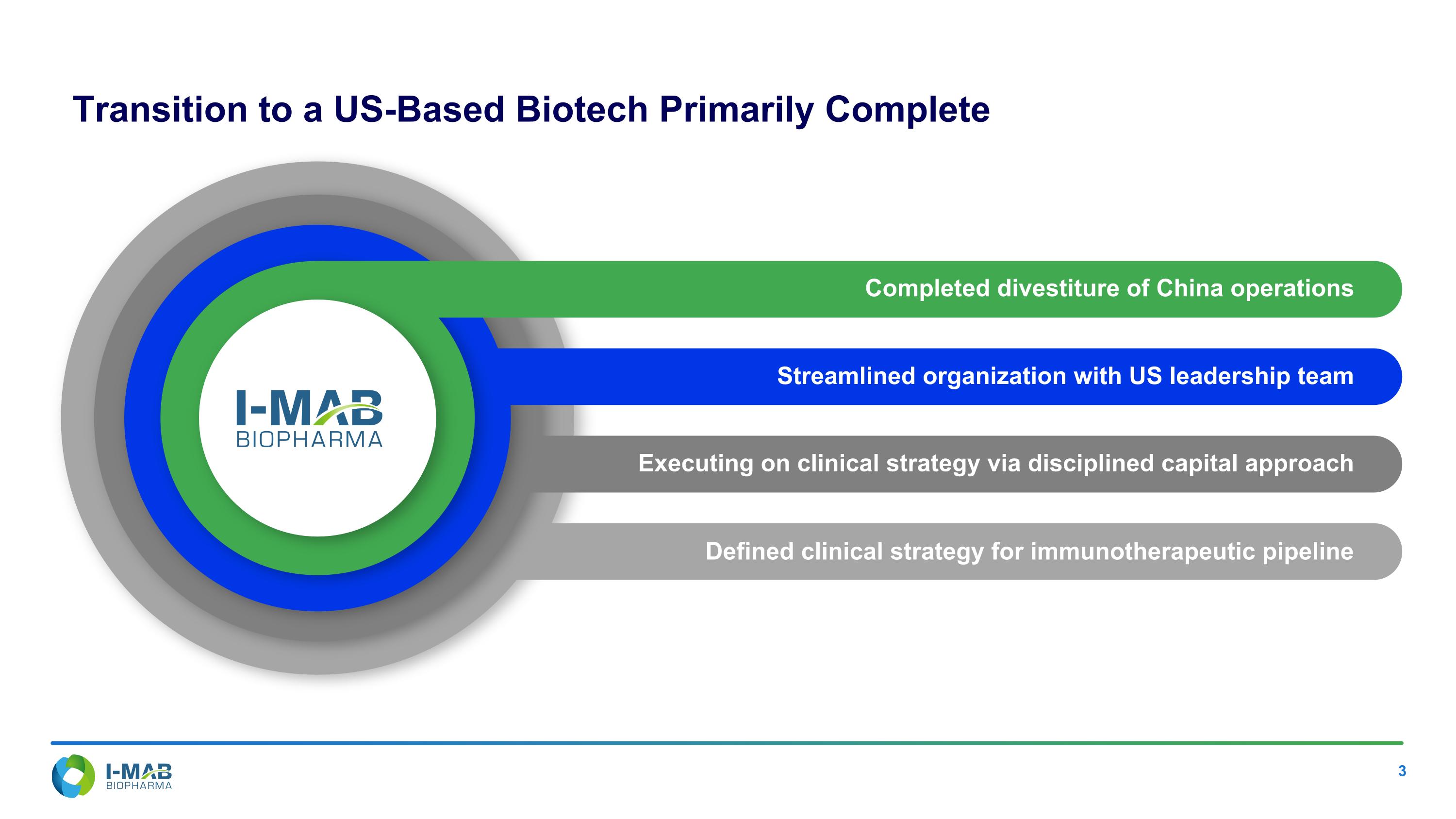
已完成中國業務的剝離 通過美國領導團隊精簡組織 為免疫治療管線確定了臨床策略 通過紀律資本方法執行臨床策略 轉型為以美國為基礎的生物科技公司,主要完成。
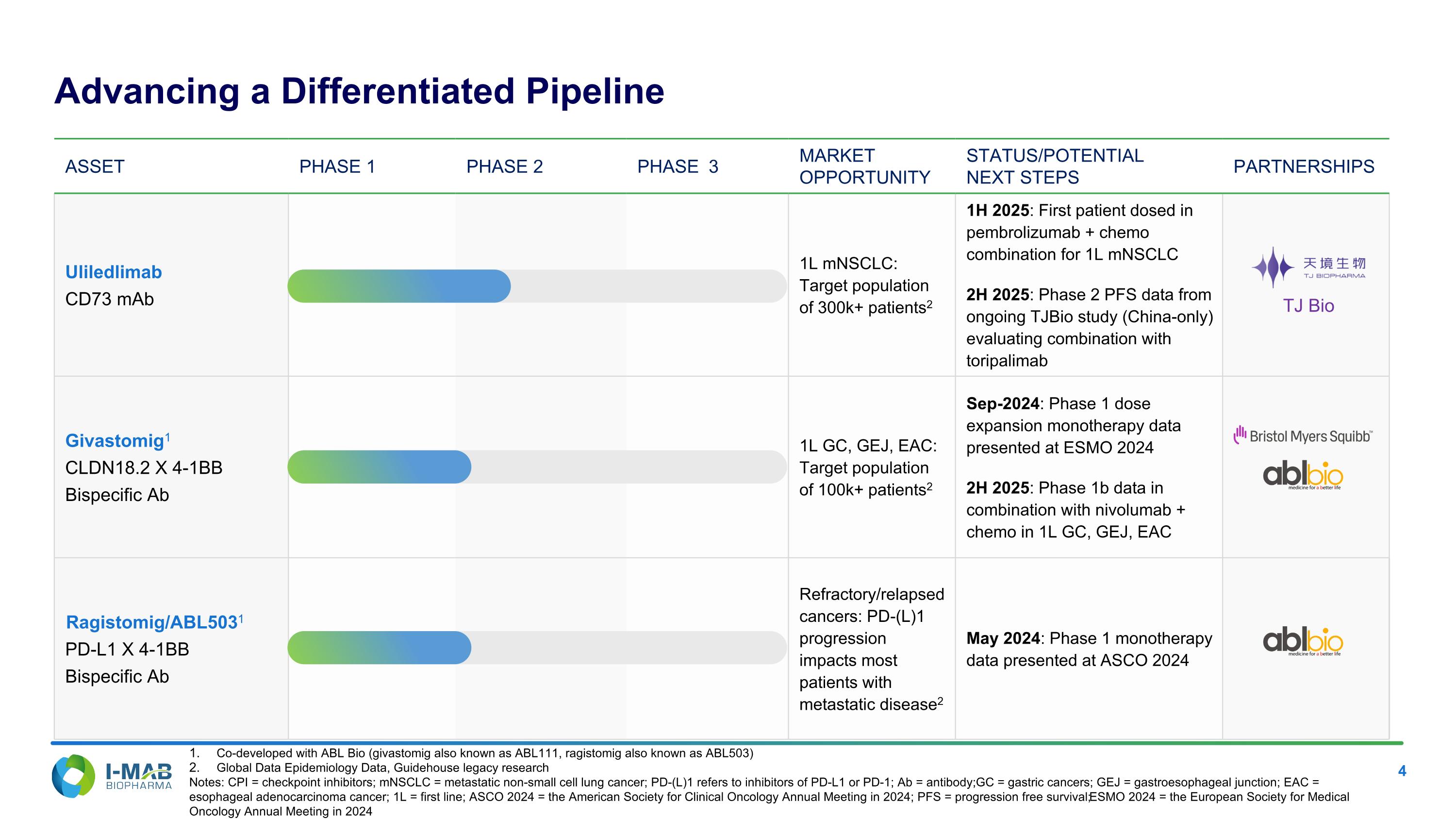
資產 PHASE 1 PHASE 2 PHASE 3 市場機遇 狀態/潛力 下一步合作夥伴 聯合利麗玛单株抗CD73抗体 1L mNSCLC:目標人口逾30萬病患2 2025年上半年:在第一線mNSCLC接受配 pembrolizumab + 化療的第一位患者施藥 2025年下半年:來自進行中TJBio研究(僅限中國)的第2期PFS資料,評估與toripalimab組合 Givastomig1 CLDN18.2 X 4-1Bb雙特異性抗體第一線GC, GEJ, EAC:目標人口逾10億病患2 2024年9月:單獨用藥的第1期劑量擴大資料在ESMO 2024報告 2025年下半年:與nivolumab + 化療在第一線GC, GEJ, EAC中組合的第2期資料 Ragistomig/ABL5031 PD-L1 X 4-1Bb雙特異性抗體難治/復發性癌症:PD-(L)1進展影響大多數轉移性疾病患者2 2024年5月:在ASCO 2024報告中的第1期單獨用藥資料 推進差異化的管線 TJ Bio 與ABL Bio共同開發(Givastomig又稱ABL111,Ragistomig又稱ABL503) 全球資料流行病學資料,Guidehouse傳承研究 註:CPI = 檢查點抑制劑;mNSCLC = 轉移性非小細胞肺癌;PD-(L)1指的是PD-L1或PD-1的抑制劑;Ab = 抗體;GC = 胃癌;GEJ = 胃食道交界;EAC = 食道腺癌;1L = 第一線;ASCO 2024 = 2024年美國臨床腫瘤學會年會;PFS = 進展性無病生存期;ESMO 2024 = 2024年歐洲醫療腫瘤學會年會

AACR 2021備註: mNSCLC = 轉移性非小細胞肺癌; AMP = 腺苷單磷酸 Uliledlimab(針對CD73) 初始開發專注於1L mNSCLC,具潛力擴展至與免疫檢查點抑制劑組合在多個適應症中應用 抗CD73 CD73生物學關鍵優勢 CD73是轉換AMP為免疫抑制腺苷的限速酶 Uliledlimab完全抑制CD73活性和腺苷的生成 阻斷CD73活性導致腺苷途徑完全抑制 Uliledlimab以非競爭性方式針對CD73,沒有“鉤效應”
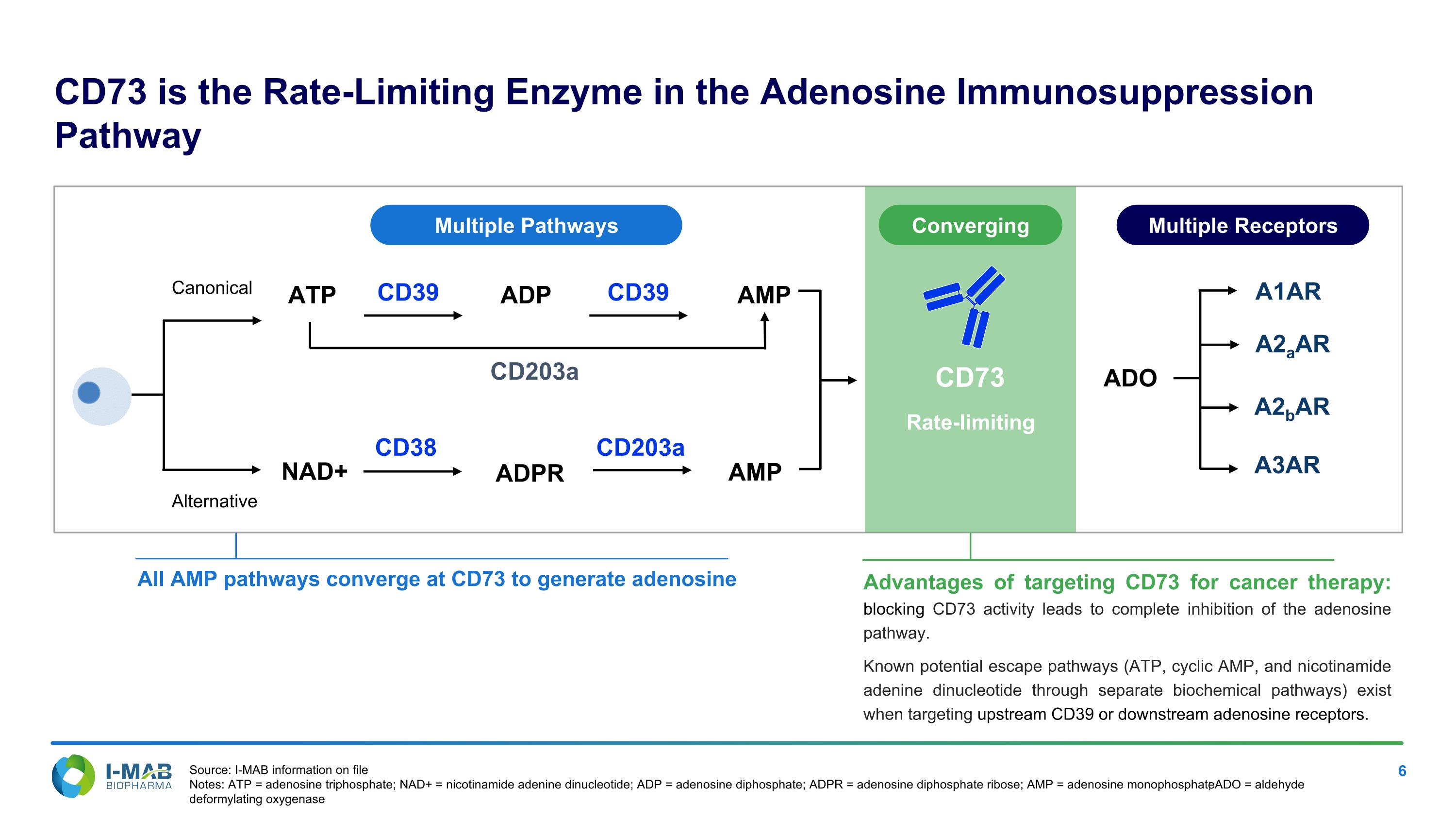
CD73是腺苷免疫抑制途徑中的速率限制酶,所有AMP途徑匯聚在CD73以產生腺苷。針對癌症治療的CD73優勢:阻斷CD73活性導致對腺苷途徑的完全抑制。在針對上游CD39或下游腺苷受體時,已知存在潛在逃逸途徑(ATP、環狀AMP和烟酰胺腺嘌呤二核苷酸透過獨立的生化途徑)。NAD+ ATP CD39 CD203a ADP CD38 ADPR CD39 AMP CD203a AMP ADO A1AR A2aAR A2bAR A3AR 正規替代 多條途徑 多個受體 CD73 速率限制 匯聚來源:天境生物檔案訊息 註:ATP = 腺苷三磷酸;NAD+ = 煙酰胺腺嘌呤二核苷酸;ADP = 腺苷二磷酸;ADPR = 腺苷二磷酸核糖;AMP = 腺苷單磷酸;ADO = 醛類脫甲氧基化酶
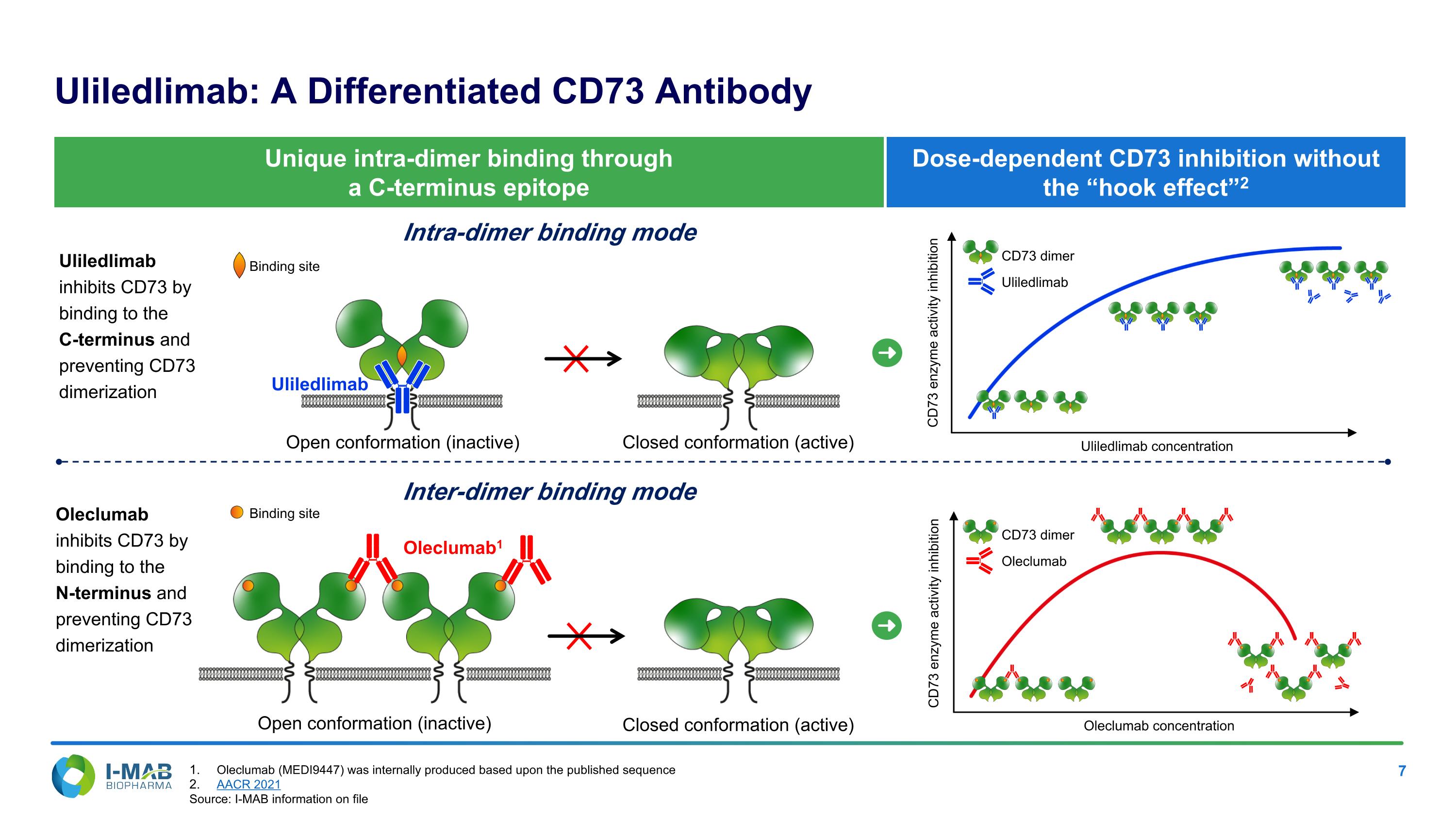
CD73酶活性抑制劑 劑量依賴的CD73抑制,不會出現「鈎狀效應」 天境生物:一種不同的CD73抗體 開放構型(非活性) 閉合構型(活性) 歐力克單抗1 內二聚體結合模式 互作二聚體結合模式 開放構型(非活性) 閉合構型(活性) 通過C-末端異位綁定實現獨特的內二聚體結合 天境生物通過與C-末端結合並阻止CD73二聚化來抑制CD73 歐力克單抗通過與N-末端結合並阻止CD73二聚化來抑制CD73 天境生物CD73酶活性抑制 天境生物濃度 歐力克單抗濃度 天境生物CD73二聚體 歐力克單抗CD73二聚體 結合位點 結合位點 歐力克單抗(MEDI9447)根據發表的序列內部生產 AACR 2021 資料來源:天境生物文件中的I-MAb資訊
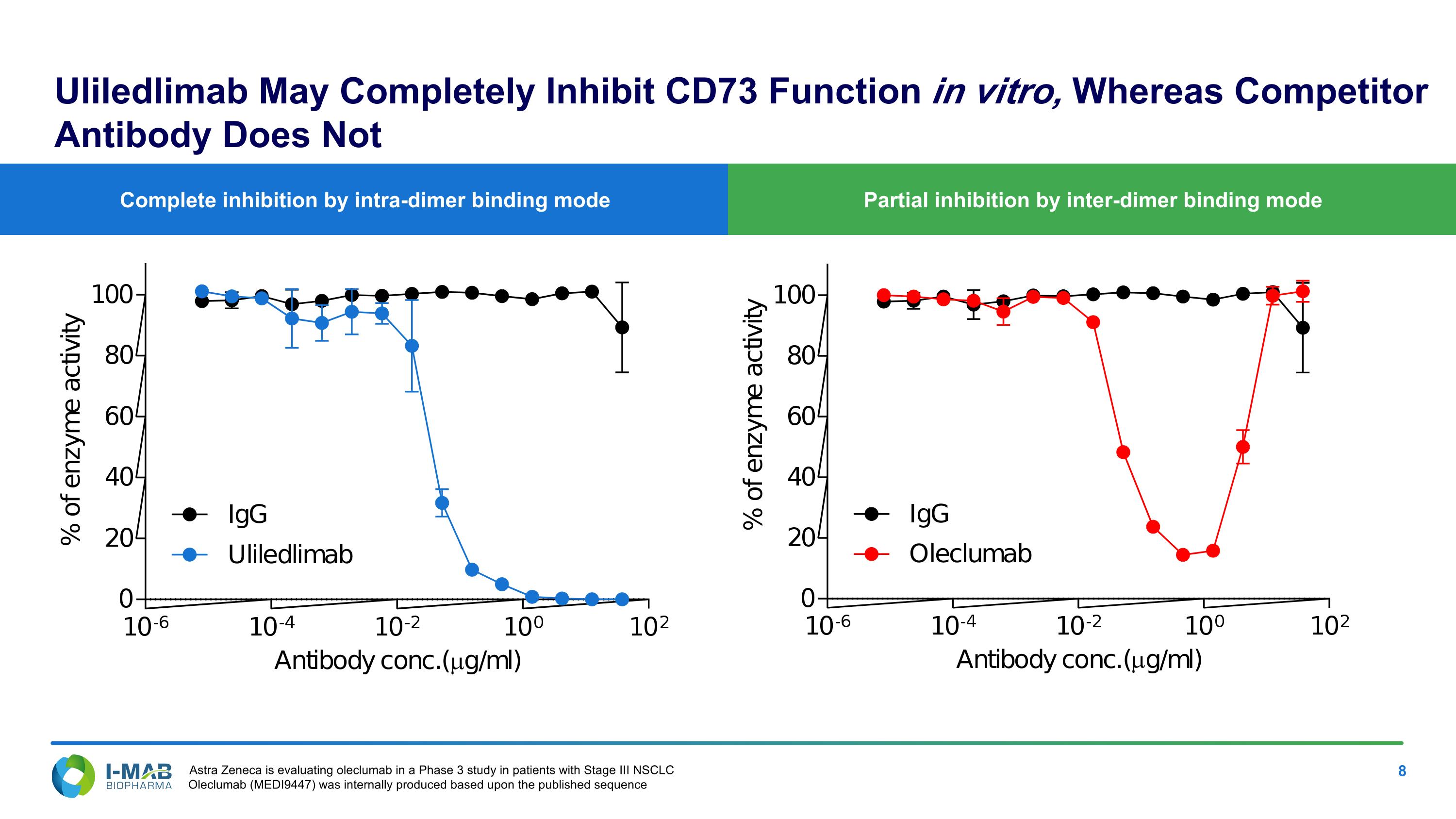
部分通過互二聚體結合模式抑制 完全通過內二聚體結合模式抑制 Uliledlimab可能在體外完全抑制CD73功能,而競爭對手抗體則無法 Astra Zeneca正在評估oleclumab在患有第三期非小細胞肺癌的患者中的3期研究。Oleclumab(MEDI9447)是根據已發表的序列內部生產的。
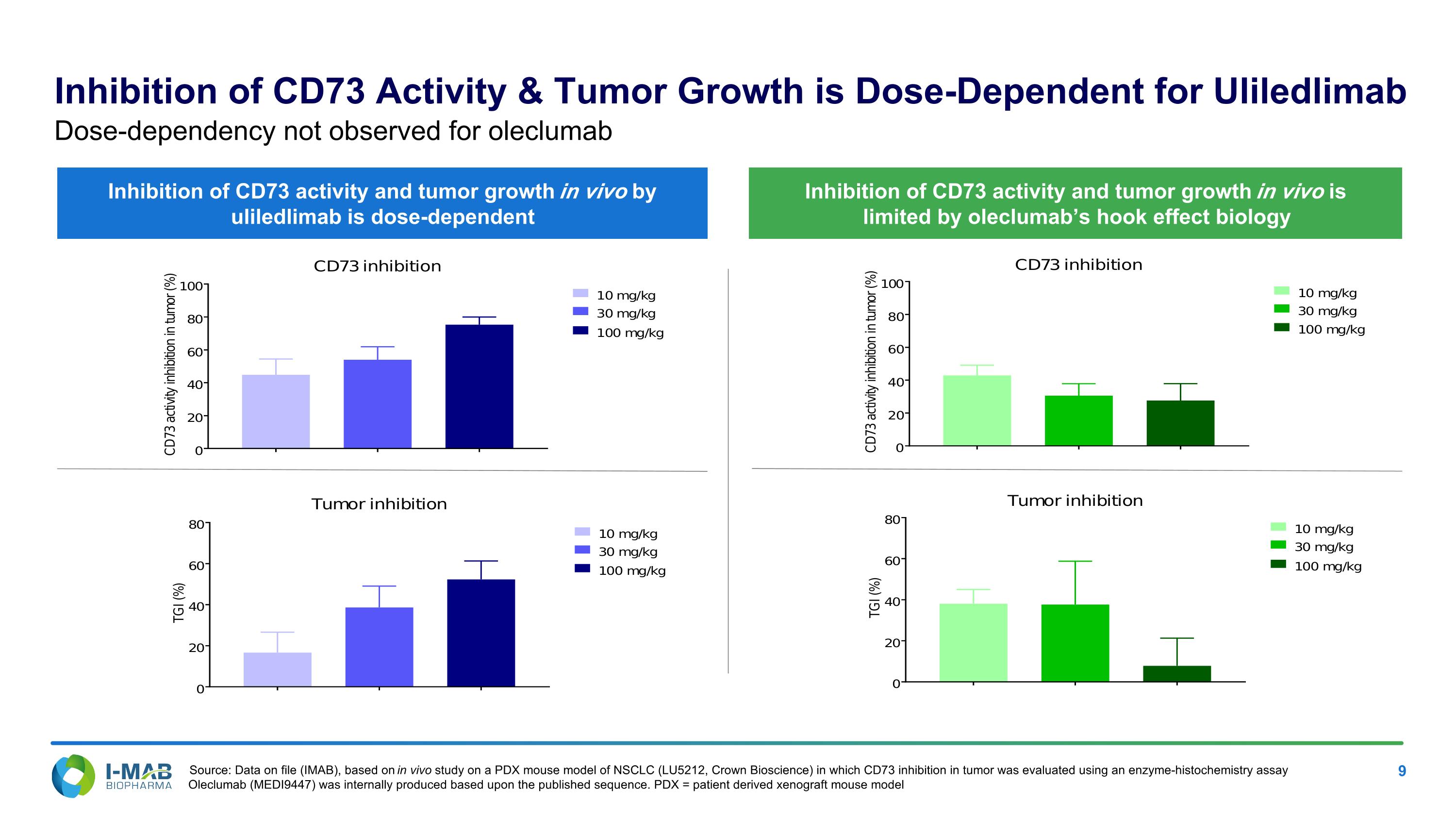
CD73活性的抑制與腫瘤生長對Uliledlimab的劑量依賴性,對CD73活性和腫瘤生長的體內抑制受oleclumab的鉤效應生物學所限制。Uliledlimab對CD73活性和腫瘤生長的體內抑制是劑量依賴性的,而oleclumab則未觀察到劑量依賴性。來源:資料來源檔案(IMAB),基於對NSCLC(LU5212,冠生物科技)的PDX小鼠模型的體內研究,該研究使用酶組織化學分析評估了腫瘤中CD73的抑制作用。根據已發布的序列內部生產了Oleclumab(MEDI9447)。PDX = 來自患者的移植小鼠模型
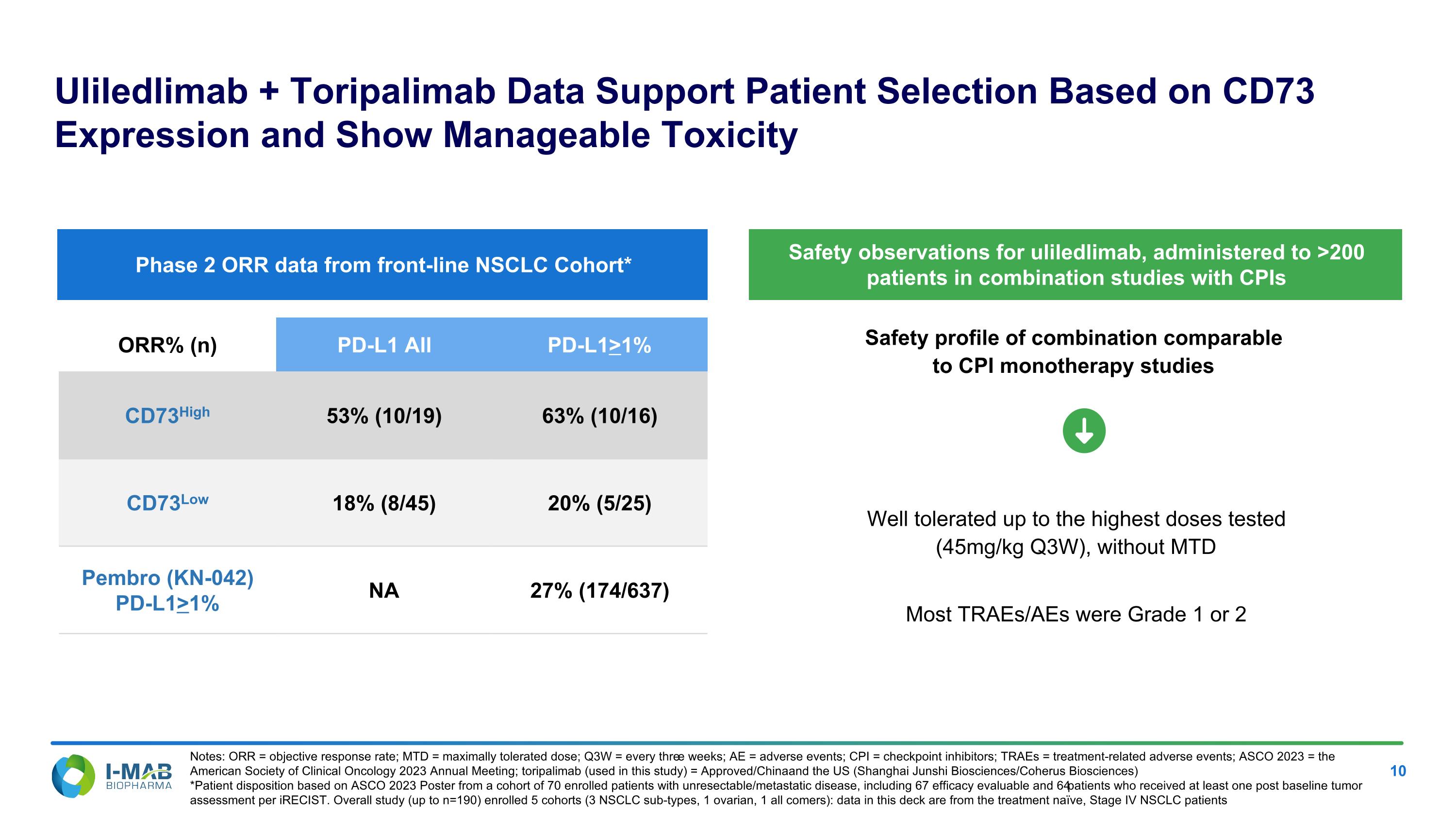
組合的安全資料可與CPI單檔療法研究媲美Uliledlimab + Toripalimab數據支持根據CD73表達進行患者選擇,並顯示可處理的毒性備註:ORR = 有效反應率;MTD = 最大耐受劑量;Q3W = 每三週一次;AE = 不良事件;CPI = 檢查點抑制劑;TRAEs = 與治療相關的不良事件;ASCO 2023 = 2023年美國臨床腫瘤學會年會;toripalimab(本研究使用)= 已在中國和美國(上海君實生物科技/coherus biosciences)獲批*根據ASCO 2023海報,有70名受試病人參與此次研究,患有不可切除/轉移性疾病,包括67名有效性可評估的病人,以及至少接受過一次基線腫瘤評估的64名病人 iRECISt。總體研究(最多n=190)招募了5個群組(3種非小細胞肺癌亞型,1種卵巢癌,1種所有來者):本資料來自於一線治療的晚期非小細胞肺癌患者,已測試最高劑量的耐受性良好(45mg/kg Q3W),無MTD大多數的TRAEs/AEs為1級或2級ORR%(n)PD-L1所有PD-L1>1%CD73High 53%(10/19)63%(10/16)CD73Low 18%(8/45)20%(5/25)Pembro(KN-042)PD-L1>1% NA 27%(174/637)一期2期NSCLC前線組的ORR數據*對於參與與CPIs組合研究的200多名病人的Uliledlimab安全性觀察
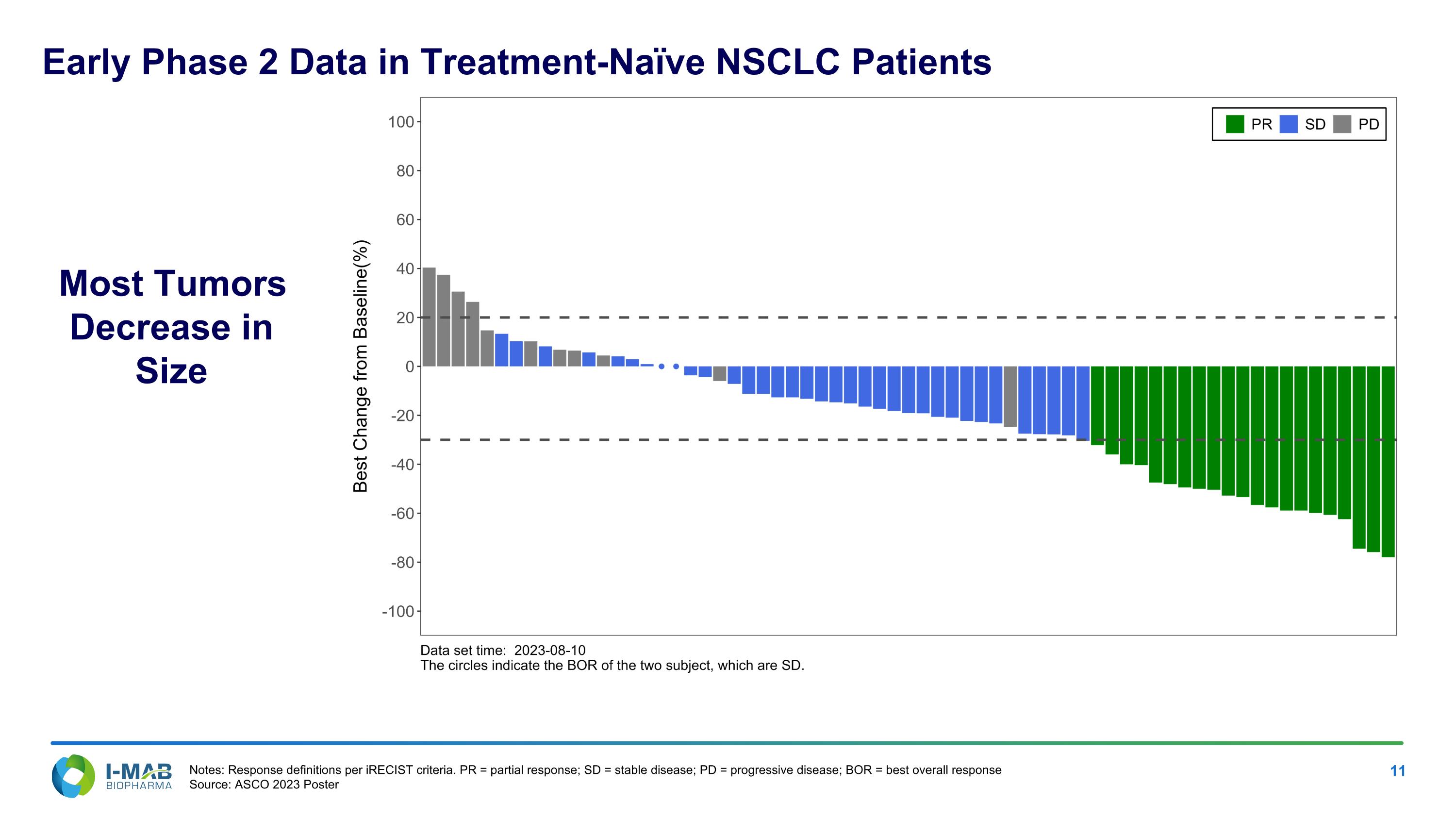
絕大多數腫瘤體積縮小 備註:根據iRECISt標準定義的反應。 PR = 部分反應;SD = 穩定病情;PD = 進展性疾病;BOR = 最佳整體反應 來源:ASCO 2023海報,用於治療未接受治療的非小細胞肺癌患者早期2期數據
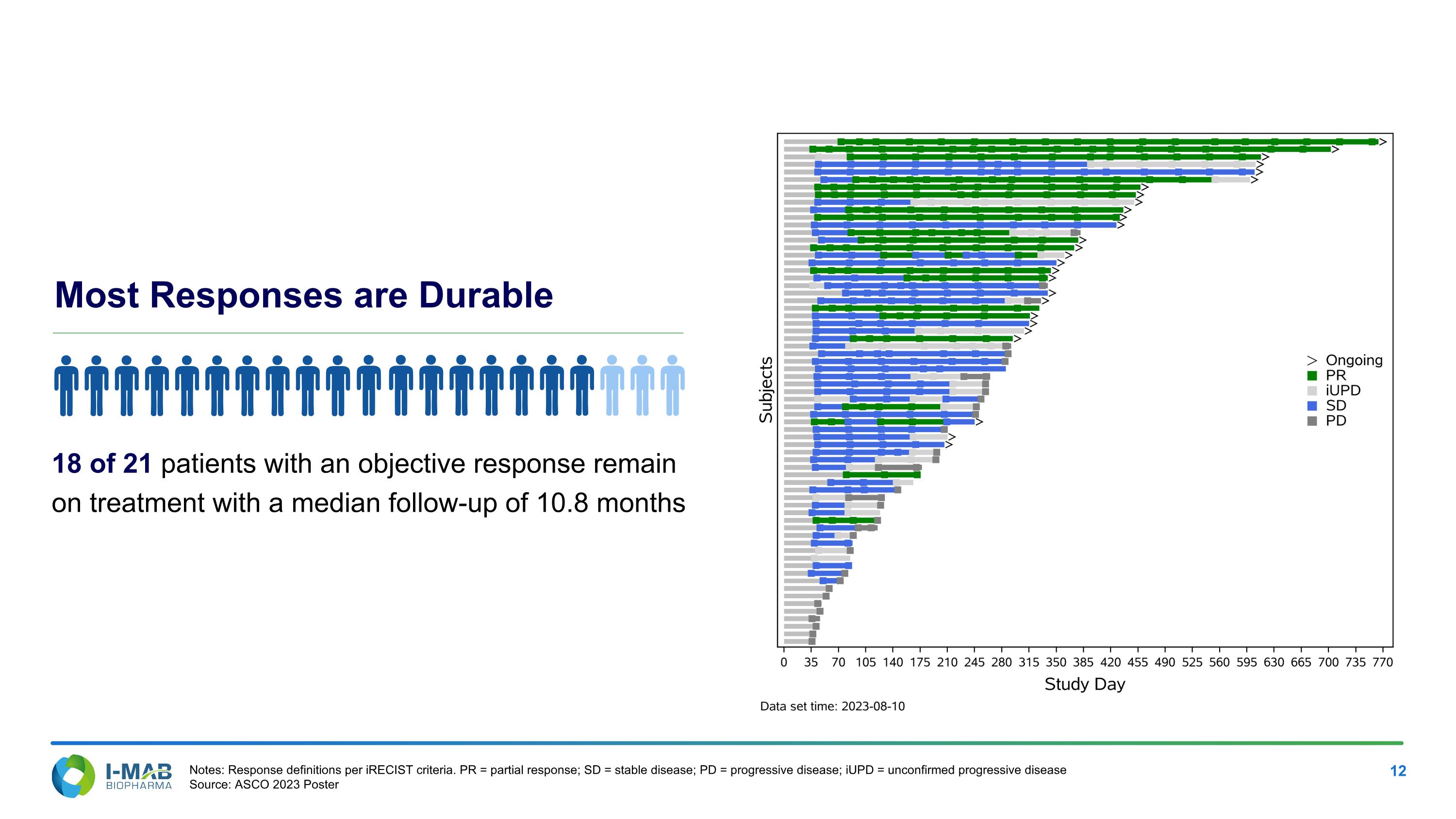
大多數反應持久,21名客觀反應中有18名患者在接受治療,中位隨訪時間為10.8個月 註:根據iRECISt標準定義的反應。 PR=局部反應;SD=穩定疾病;PD=進展性疾病;iUPD=未確定性進展性疾病 資料來源:ASCO 2023年海報

在第一線治療轉移性非小細胞肺癌患者中支持Uliledlimab + Pembro + 化療的原因 萨曼塔D、朴Y、倪XH、塞门扎G。2017年。化療誘導CD47+/CD73+/PDL1+免疫逃避三阴性乳腺癌細胞的富集。美國國家科學院院刊第115卷,第6期。 註:mNSCLC = 轉移性非小細胞肺癌;IO = 免疫腫瘤學 把化療添加到IO單治療方案中擴展了IO的效益至PD-L1表達更低的水平 Uliledlimab與IO劑的組合具有良好的毒副作用配置 化療誘導CD73表達,表明通過將Uliledlimab與帕博利珠单抗+化療組合使用會帶來額外的好處1 基於這個理由,天境生物計劃在2025年上半年將第一名新診斷的mNSCLC患者與Uliledlimab + 帕博利珠单抗 + 化療組合使用
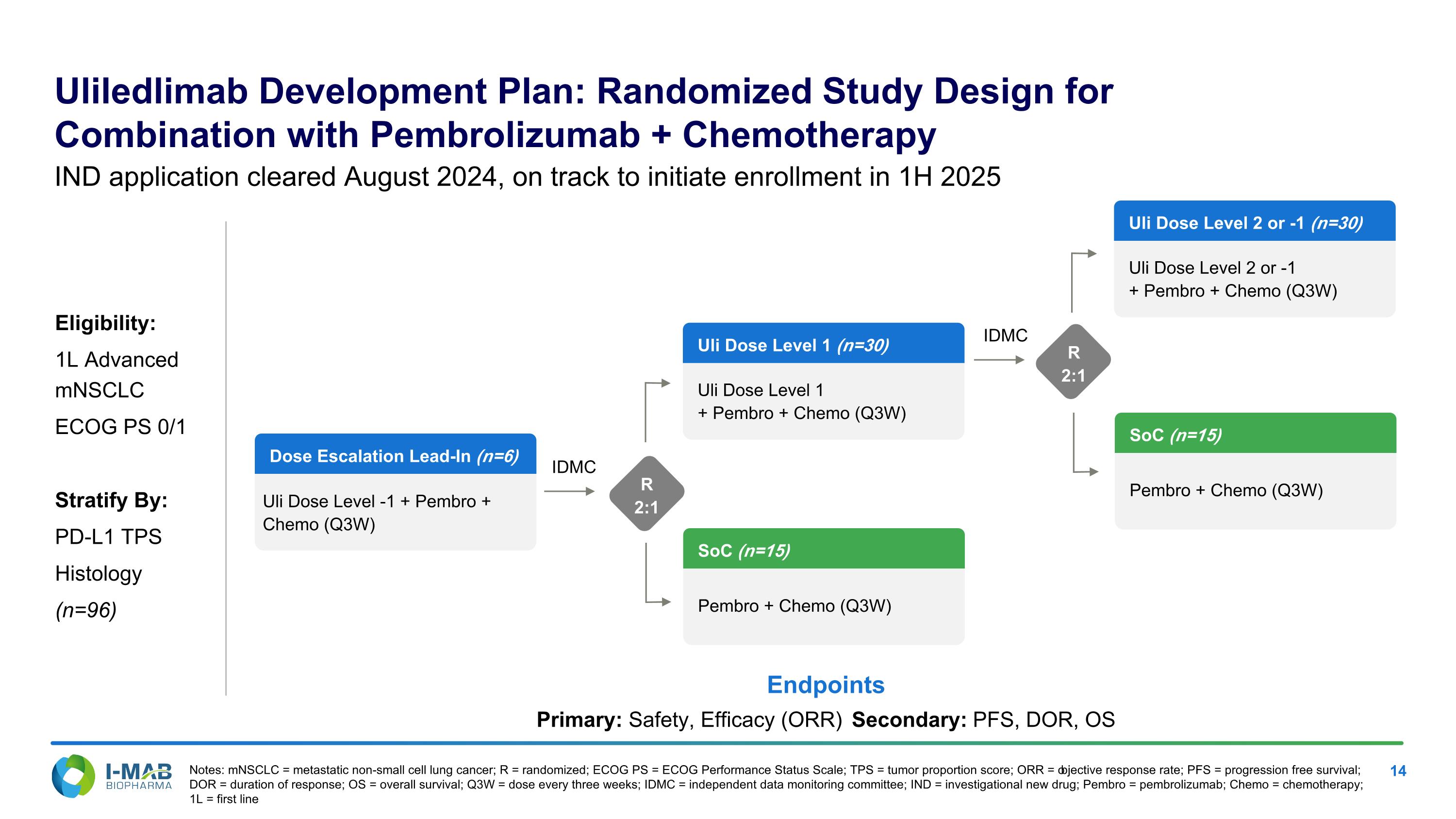
Uliledlimab發展計劃:結合Pembrolizumab+化療的隨機研究設計備註:mNSCLC = 轉移性非小細胞肺癌;R = 隨機分組;ECOG PS = ECOG表現狀態量表;TPS = 腫瘤比例分數;ORR = 客觀反應率;PFS = 無進展存活期;DOR = 反應持續時間;OS = 總體生存率;Q3W = 每三週一劑;IDMC = 獨立數據監測委員會;IND = 新投藥物;Pembro = 佩姆博利祖馬;Chemo = 化療;1L = 第一線IND申請已在2024年8月通過,預計2025年上半年開始招募符合資格者資格:1L愛文思控股mNSCLC ECOG PS 0/1按 PD-L1 TPS組織學進行分層(n=96)終點主要:安全性,有效性(ORR)次要:PFS,DOR,OS IDMC劑量逐步增加引導(n=6)Uli劑量水平-1 + Pembro + Chemo(Q3W)SoC(n=15)Pembro + Chemo(Q3W)Uli劑量水平1(n=30)Uli劑量水平1 + Pembro + Chemo(Q3W)R 2:1 IDMC R 2:1 Uli劑量水平2或-1(n=30)Uli劑量水平2或-1 + Pembro + Chemo(Q3W)SoC(n=15)Pembro + Chemo(Q3W)

分子設計關鍵區別 在各個CLDN18.2表達水平上展示結合活性 即使在表達低的腫瘤細胞上也表現CLDN18.2結合 高親和力結合CLDN18.2,相較於參考抗體Zolbetuximab 定位TME中的t細胞活化以減少4-1Bb介導的肝毒性和全身免疫反應 Givastomig(針對Claudin 18.2和4-1BB) 進行中的組合研究,搭配nivolumab + 化療,涵蓋廣泛的Claudin 18.2水平 獨特的雙特異性抗體整合Claudin 18.2作為腫瘤接受器和4-1Bb作為條件性t細胞激活劑 4-1Bb scFv CLDN18.2 備註:scFv = 單鏈片段可變區;TME = 腫瘤微環境;Ab = 抗體
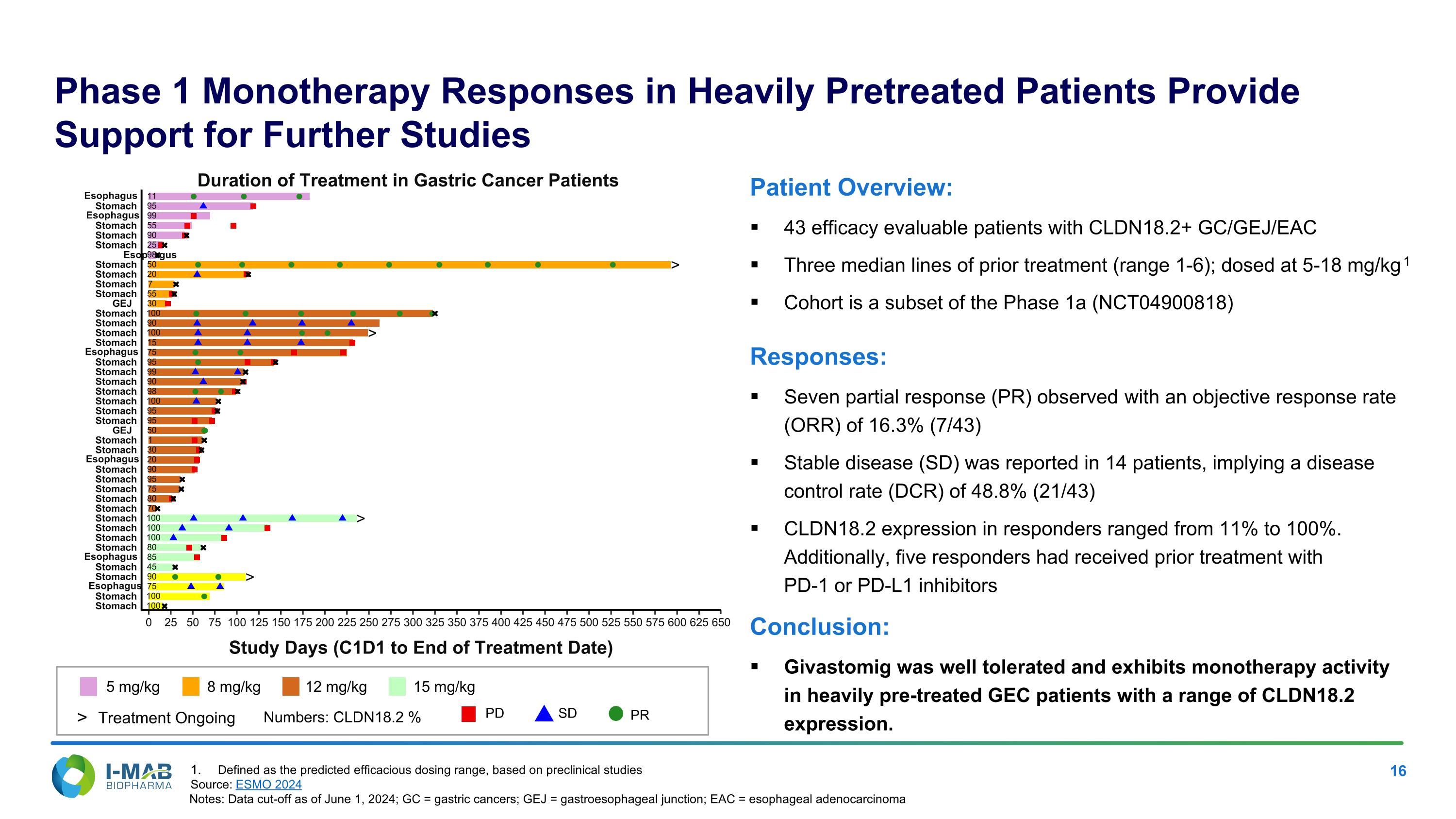
一期單藥療法對重度預治療患者的反應支持了進一步研究的可能性 5 mg/kg 8 mg/kg 12 mg/kg 15 mg/kg 數據:CLDN18.2 %> 治療持續中 PD SD PR 患者概覽:43名具有效果評估的患者帶有CLDN18.2+ GC/GEJ/EAC 三條中位數的前治療(範圍1-6);劑量為5-18 mg/kg1 此研究小組為一期a(NCT04900818)的子集 反應:觀察到七名部分反應(PR),客觀反應率(ORR)為16.3%(7/43)穩定病(SD)在14名患者中報告,意味著病情控制率(DCR)為48.8%(21/43)響應者的CLDN18.2表達範圍為11%到100%。此外,五名響應者曾接受過PD-1或PD-L1抑制劑的前治療 結論:Givastomig耐受性良好,並在重度預治療的GEC患者中展現單藥療法的活性,具有不同的CLDN18.2表達水平。 胃癌患者的治療持續時間 胃 胃 食道 胃 胃 食道 胃 胃 胃 胃 胃 胃 胃 胃 食道 胃 胃 胃 胃 胃 胃 胃 胃 胃 食道 胃 胃 胃 胃 GEJ 胃 胃 胃 胃 食道 胃 胃 胃 食道 胃 食道 > > > > 100 100 75 90 45 85 80 100 100 100 70 80 75 95 90 20 30 1 50 95 95 100 98 90 99 95 75 15 100 90 100 30 55 7 20 50 98 25 90 55 99 95 11 0 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 425 450 475 500 525 550 575 600 625 650 研究天數(C1D1到治療結束日期)GEJ 定義為根據臨床前研究預測的有效劑量區間 來源:ESMO 2024 注:數據截止至2024年6月1日;GC = 胃癌;GEJ = 胃食道交界處;EAC = 食道腺癌
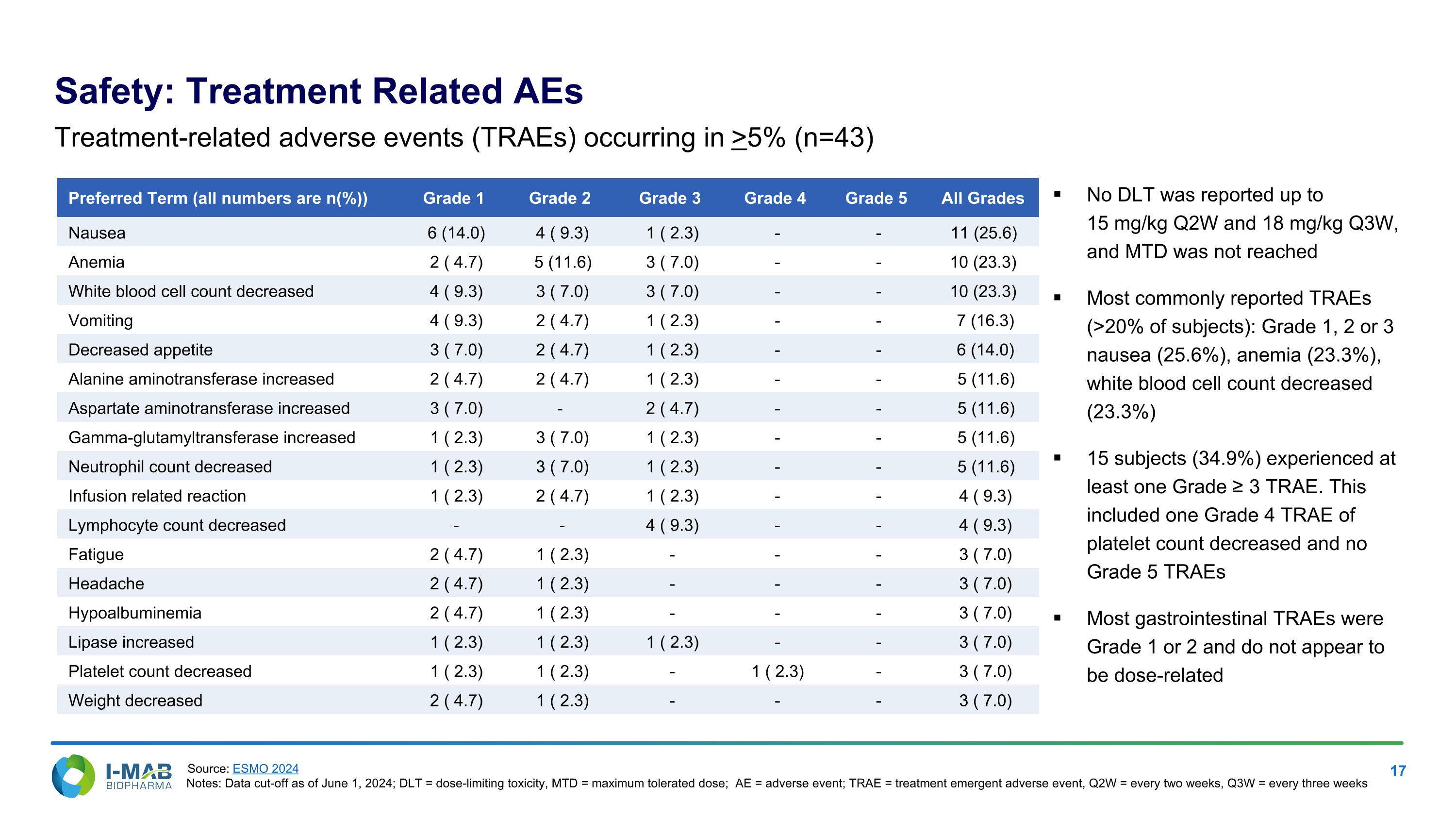
安全性:治療相關的不良事件首選術語(所有數字均為 n (%)) 等級 1 等級 2 等級 3 等級 4 等級 5 所有等級 噁心 6 (14.0) 4 ( 9.3) 1 ( 2.3) - - 11 (25.6) 貧血 2 ( 4.7) 5 (11.6) 3 ( 7.0) - - 10 (23.3) 白血球計數減少 4 ( 9.3) 3 ( 7.0) 3 ( 7.0) - - 10 (23.3) 嘔吐 4 ( 9.3) 2 ( 4.7) 1 ( 2.3) - - 7 (16.3) 食慾減退 3 ( 7.0) 2 ( 4.7) 1 ( 2.3) - - 6 (14.0) 丙氨酸氨基轉移酶增高 2 ( 4.7) 2 ( 4.7) 1 ( 2.3) - - 5 (11.6) 天冬氨酸氨基轉移酶增高 3 ( 7.0) - 2 ( 4.7) - - 5 (11.6) γ-谷氨酰轉移酶增高 1 ( 2.3) 3 ( 7.0) 1 ( 2.3) - - 5 (11.6) 中性粒細胞計數減少 1 ( 2.3) 3 ( 7.0) 1 ( 2.3) - - 5 (11.6) 輸注相關反應 1 ( 2.3) 2 ( 4.7) 1 ( 2.3) - - 4 ( 9.3) 淋巴細胞計數減少 - - 4 ( 9.3) - - 4 ( 9.3) 疲勞 2 ( 4.7) 1 ( 2.3) - - - 3 ( 7.0) 頭痛 2 ( 4.7) 1 ( 2.3) - - - 3 ( 7.0) 低白蛋白血症 2 ( 4.7) 1 ( 2.3) - - - 3 ( 7.0) 脂肪酶增高 1 ( 2.3) 1 ( 2.3) 1 ( 2.3) - - 3 ( 7.0) 血小板計數減少 1 ( 2.3) 1 ( 2.3) - 1 ( 2.3) - 3 ( 7.0) 體重減輕 2 ( 4.7) 1 ( 2.3) - - - 3 ( 7.0) 治療相關的不良事件(TRAEs)出現於 >5%(n=43) 未報告 DLt 直至 15 mg/kg 每兩週一次及 18 mg/kg 每三週一次,且未達到 MTD 最常報告的 TRAEs (>20% 的受試者): 等級 1、2 或 3 噁心 (25.6%),貧血 (23.3%),白血球計數減少 (23.3%) 15 名受試者 (34.9%) 至少經歷過一個等級 ≥ 3 的 TRAE。 這包括一個等級 4 的 TRAE,血小板計數減少,且無等級 5 的 TRAEs 大多數胃腸 TRAEs 為等級 1 或 2,似乎與劑量無關 來源:ESMO 2024 備註:數據截止至 2024 年 6 月 1 日;DLt = 劑量限制毒性,MTD = 最大耐受劑量;AE = 不良事件;TRAE = 治療出現的不良事件,Q2W = 每兩週一次,Q3W = 每三週一次
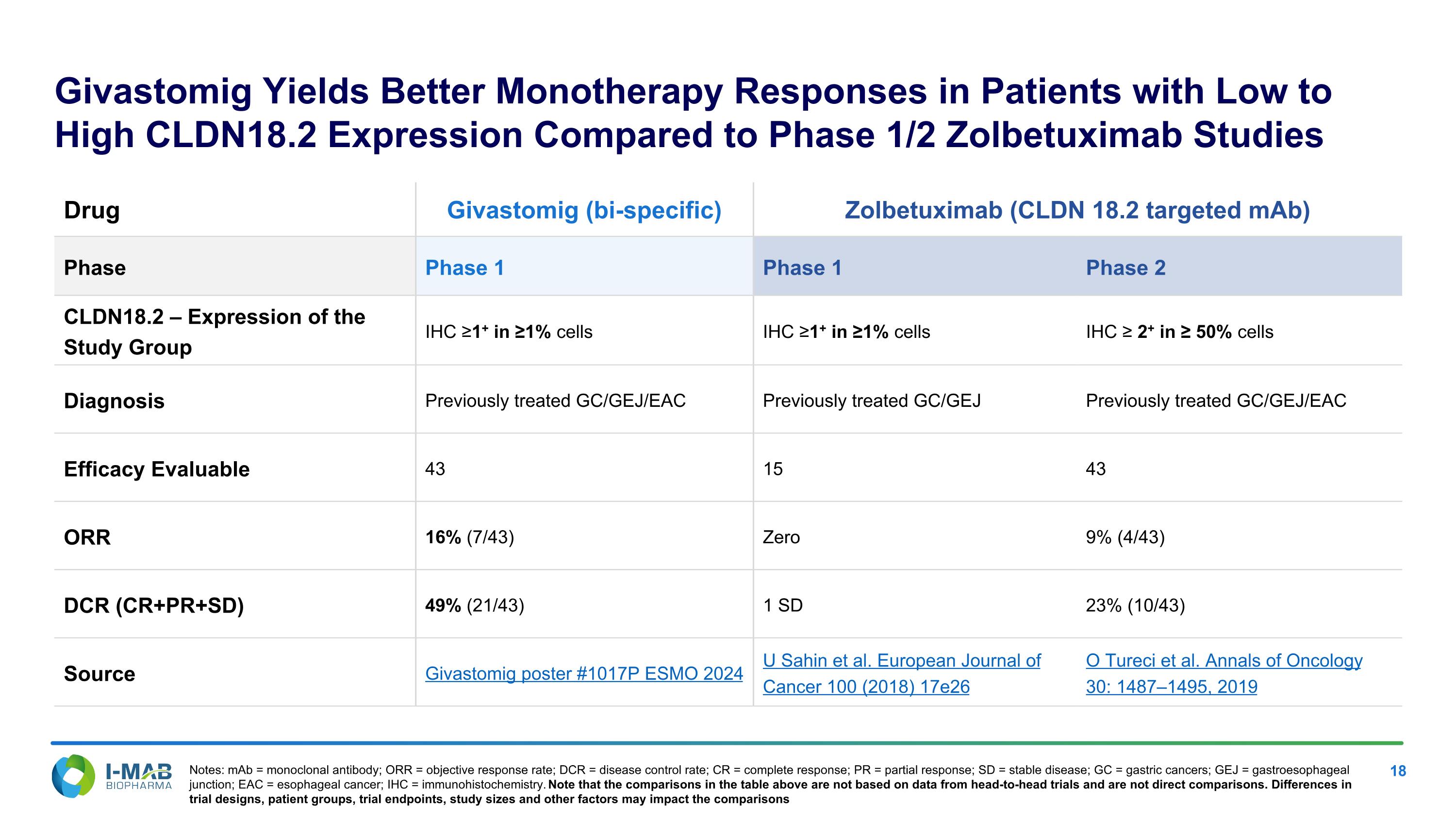
Givastomig在低至高CLDN18.2表達患者中相較於1/2期Zolbetuximab研究中展現了更好的單藥反應 藥物 Givastomig(雙特異性) Zolbetuximab(針對CLDN 18.2的單克隆抗體) 階段 第1階段 第1階段 第2階段 CLDN18.2 – 研究組的表達 IHC ≥1+在≥1%細胞 IHC ≥1+在≥1%細胞 IHC ≥ 2+在≥50%細胞 診斷 先前治療過的GC/GEJ/EAC 先前治療過的GC/GEJ 先前治療過的GC/GEJ/EAC 療效 可評估 43 15 43 ORR 16% (7/43) 零 9% (4/43) DCR (CR+PR+SD) 49% (21/43) 1 SD 23% (10/43) 來源 Givastomig海報 #1017P ESMO 2024 U Sahin等人。歐洲癌症期刊 100 (2018) 17e26 O Tureci等。腫瘤學年鑑 30: 1487–1495, 2019 備註:mAb = 單克隆抗體;ORR = 目標反應率;DCR = 疾病控制率;CR = 完全反應;PR = 部分反應;SD = 穩定疾病;GC = 胃癌;GEJ = 胃食管交界;EAC = 食管癌;IHC = 免疫組織化學。請注意,上表中的比較並非基於直接的比較,並非直接比較。試驗設計、患者群體、試驗終點、研究規模及其他因素可能影響比較結果。

Givastomig與其他靶向Claudin 18.2競爭者的潛在差異化 Givastomig(雙特異性) Zolbetuximab(單克隆抗體)1 CMG901(抗體藥物結合物)2 作用機制 取決於CLDN18.2的t細胞激活 4-1Bb激動劑以增加腫瘤中的t細胞擴展並重新振作疲憊的t細胞 旨在有條件4-1Bb激活的雙特異性抗體 通過ADCC直接殺死CLDN18.2腫瘤細胞,亦可釋放腫瘤抗原 CLDN18.2靶向化療及通過ADCC的直接殺死 通過毒素裂解腫瘤細胞可釋放腫瘤抗原以介導免疫反應 療效 ~16%一線治療CLDN18.2 + GC/GEJ/EAC的客觀反應率 ~10%一線治療CLDN18.2 + GC/GEJ/EAC1 33%一線治療CLDN18.2 + GC/GEJ的客觀反應率 安全性 <5% 3級粒細胞減少症 <5% 3級嘔吐 22% 3級嘔吐1 20% 3級以上粒細胞減少症 10% 3級嘔吐3 Claudin 18.2靶向表達 由於與CLDN18.2的高親和力結合,擴展至低水平表達 限制於靶向表達CLDN較高的腫瘤 可能僅限於靶向表達高CLDN的腫瘤 1. 癌症年鑑,2. CMG901是一種正在全球開發的CLDN18.2抗體藥物結合物,3. ASCO大會2023年講座 註: ORR = 客觀反應率,GC/GEJ/EAC = 胃癌,胃食管交界,EAC = 食道腺癌,CLDN = claudin,ADCC = 抗體依賴性細胞毒性
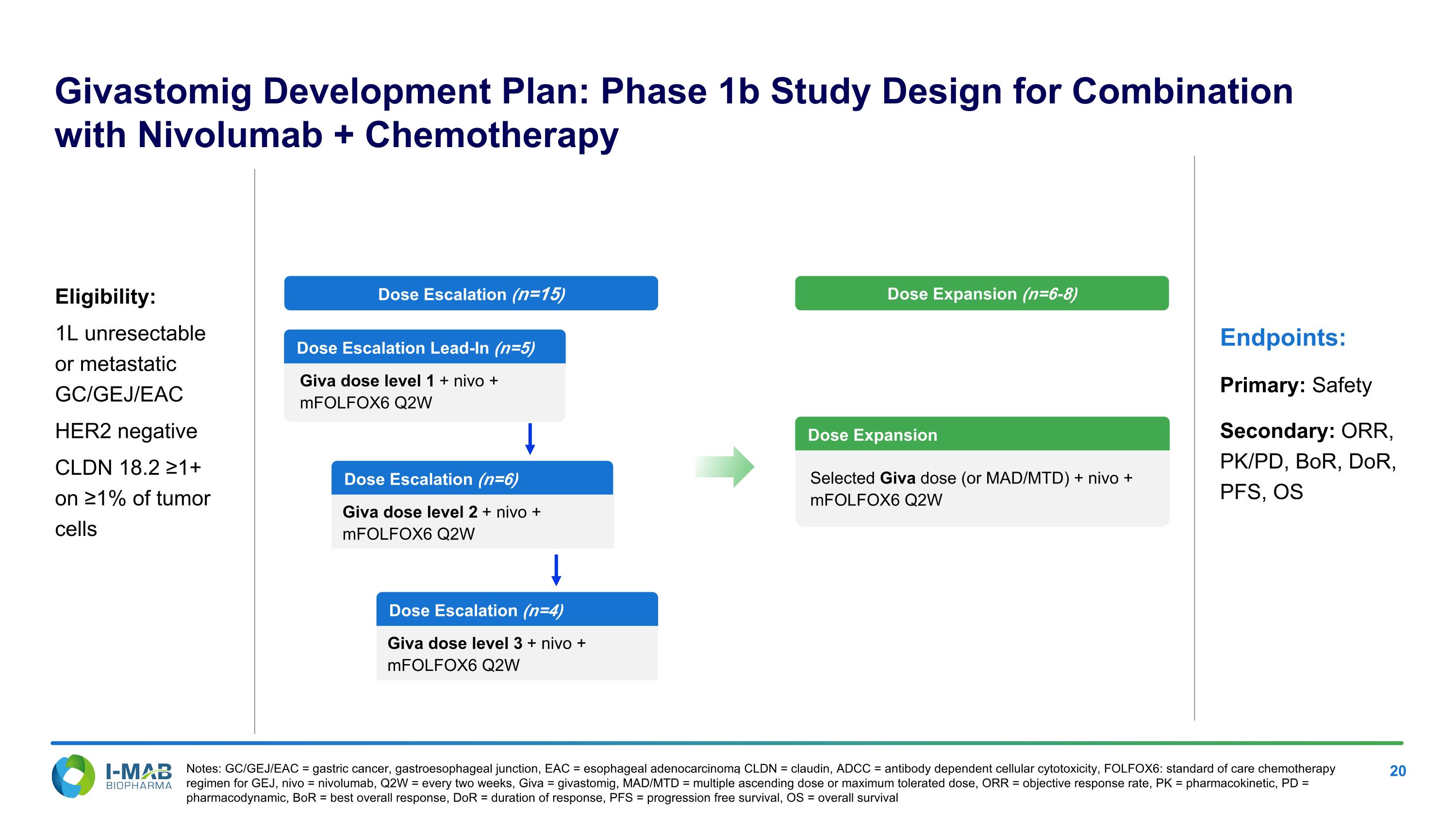
Givastomig發展計劃:第1期10億研究設計,與Nivolumab + 化療的聯合使用 適格條件:1L無法切除或轉移性GC/GEJ/EAC,HER2陰性,CLDN 18.2 ≥1+在≥1%的腫瘤細胞上 研究終點:主要:安全性 次要:ORR,PK/PD,BoR,DoR,PFS,OS 註:GC/GEJ/EAC = 胃癌,胃食管交界,EAC = 食道腺癌,CLDN = claudin,ADCC = 抗體依賴性細胞毒性,FOLFOX6:GEJ的標準化療方案,nivo = nivolumab,Q2W = 每兩週,Giva = givastomig,MAD/MTD = 多重上升劑量或最大耐受劑量,ORR = 客觀反應率,Pk = 藥物動力學,PD = 藥效學,BoR = 最佳總反應,DoR = 反應持續時間,PFS = 無進展生存,OS = 總生存 劑量擴增前導(n=5) Giva劑量水平1 + nivo + mFOLFOX6 Q2W 劑量擴增(n=15) 劑量擴增(n=6-8) 劑量擴增選擇Giva劑量(或MAD/MTD) + nivo + mFOLFOX6 Q2W 劑量擴增(n=6) Giva劑量水平2 + nivo + mFOLFOX6 Q2W 劑量擴增(n=4) Giva劑量水平3 + nivo + mFOLFOX6 Q2W

獨特設計以促進潛在廣泛使用,加上初步的安全性概況令人鼓舞的反應,適用於先前接受過治療的患者,包括那些表達低CLDN18.2的患者。劑量擴展數據及新的nivolumab + 化療聯合研究正在進行中。獨特的雙特異性設計特性及胃癌的單藥數據,可能使Givastomig成為同類最佳的Claudin 18.2雙特異性。對於接受多條先前治療(包括PD-(L)1)且表達低水平CLDN18.2的胃癌和食管癌患者,觀察到客觀反應率。反應率及耐受性支持在1L標準治療方案中的聯合使用。新的劑量擴展伴隨nivolumab + 化療的隊列研究於2024年第一季度在治療未經的胃癌患者中開始。已在ESMO 2024上呈現了CLDN18.2+胃癌患者的單藥劑量擴展數據,這些患者的疾病在之前的治療後進展。雙特異性設計導致CLDN18.2條件性4-1Bb及T細胞活化,可能限制毒性並誘導持久的免疫記憶反應。第一階段劑量遞增達到最高計劃劑量而未遇到劑量限制性毒性或肝毒性信號。註:胃癌 = 胃、胃食管接合部及食管癌;ESMO 2024 = 2024年歐洲醫療腫瘤學會年會;SoC = 標準護理;DLt = 劑量限制性毒性,1L = 首選治療。
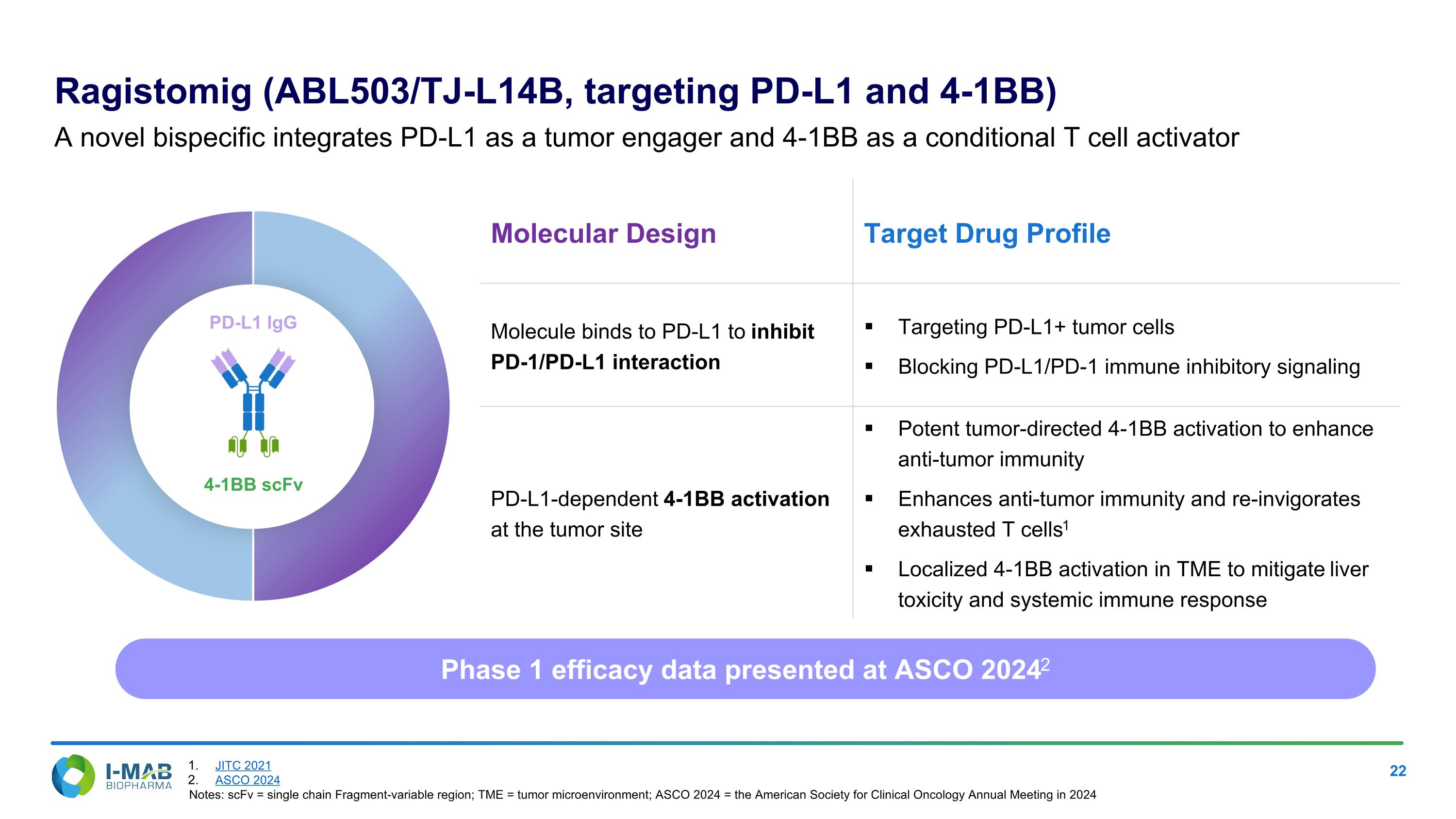
分子設計目標藥物簡介,分子結合PD-L1以抑制PD-1/PD-L1相互作用,針對PD-L1+腫瘤細胞,阻斷PD-L1/PD-1免疫抑制信號。在腫瘤部位依賴於PD-L1的4-1Bb活化,有效的腫瘤導向4-1Bb活化以增強抗腫瘤免疫。增強抗腫瘤免疫並重新振作疲憊的T細胞。局部TME中的4-1Bb活化以減輕肝毒性及全身免疫反應。Ragistomig (ABL503/TJ-L140億,針對PD-L1和4-1BB) 是一種新型雙特異性,將PD-L1整合為腫瘤接合劑並將4-1Bb作為條件性T細胞活化劑。4-1Bb scFv PD-L1 IgG,第一階段療效數據於ASCO 2024上呈現。註:scFv = 單鏈片段變量區;TME = 腫瘤微環境;ASCO 2024 = 2024年美國臨床腫瘤學會年會。
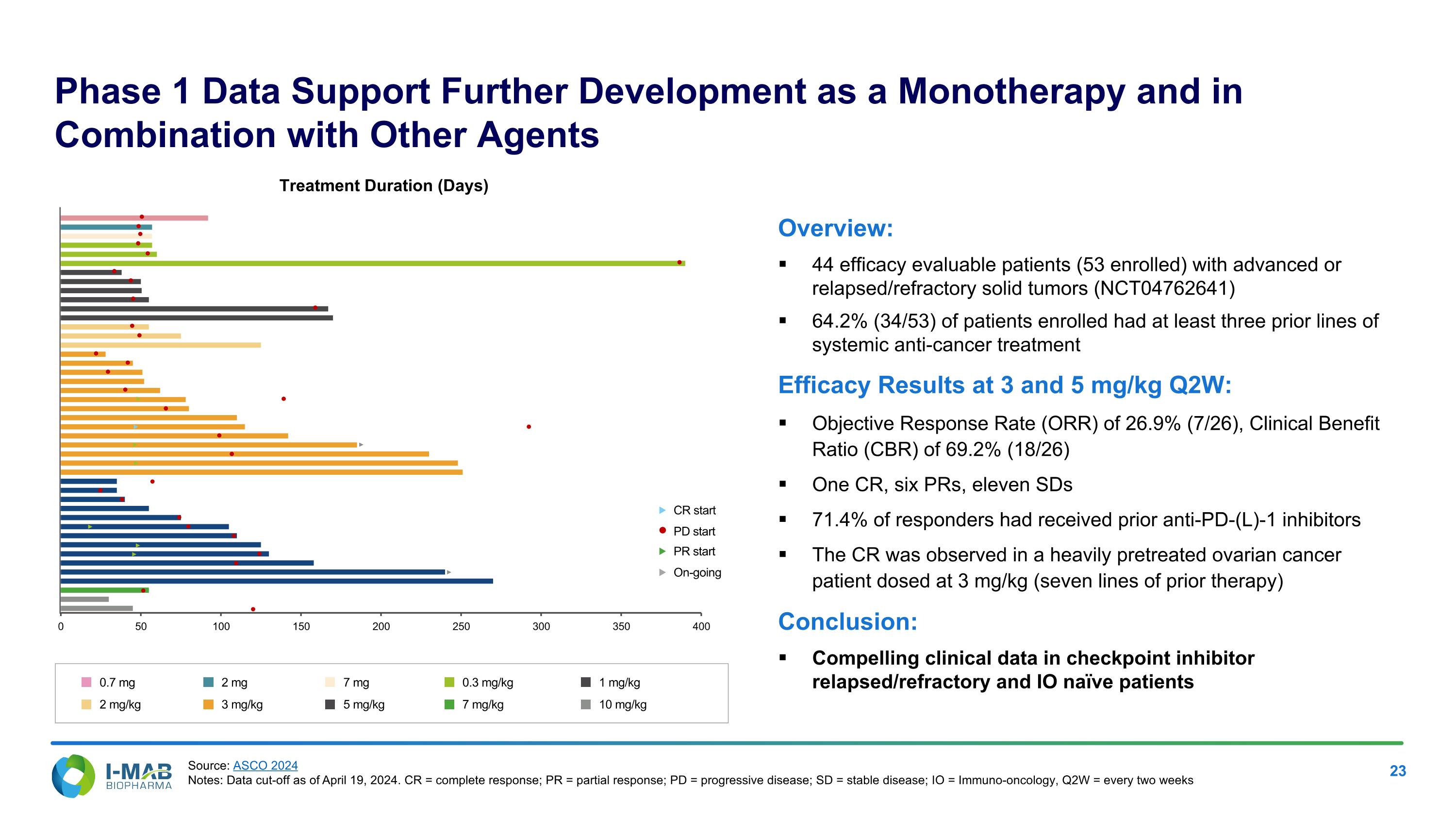
Phase 1 Data Support Further Development as a Monotherapy and in Combination with Other Agents Overview: 44 efficacy evaluable patients (53 enrolled) with advanced or relapsed/refractory solid tumors (NCT04762641) 64.2% (34/53) of patients enrolled had at least three prior lines of systemic anti-cancer treatment Efficacy Results at 3 and 5 mg/kg Q2W: Objective Response Rate (ORR) of 26.9% (7/26), Clinical Benefit Ratio (CBR) of 69.2% (18/26) One CR, six PRs, eleven SDs 71.4% of responders had received prior anti-PD-(L)-1 inhibitors The CR was observed in a heavily pretreated ovarian cancer patient dosed at 3 mg/kg (seven lines of prior therapy) Conclusion: Compelling clinical data in checkpoint inhibitor relapsed/refractory and IO naïve patients Treatment Duration (Days) CR start PR start On-going PD start 0.7 mg 2 mg/kg 2 mg 3 mg/kg 7 mg 5 mg/kg 0.3 mg/kg 7 mg/kg 1 mg/kg 10 mg/kg Source: ASCO 2024 Notes: Data cut-off as of April 19, 2024. CR = complete response; PR = partial response; PD = progressive disease; SD = stable disease; IO = Immuno-oncology, Q2W = every two weeks
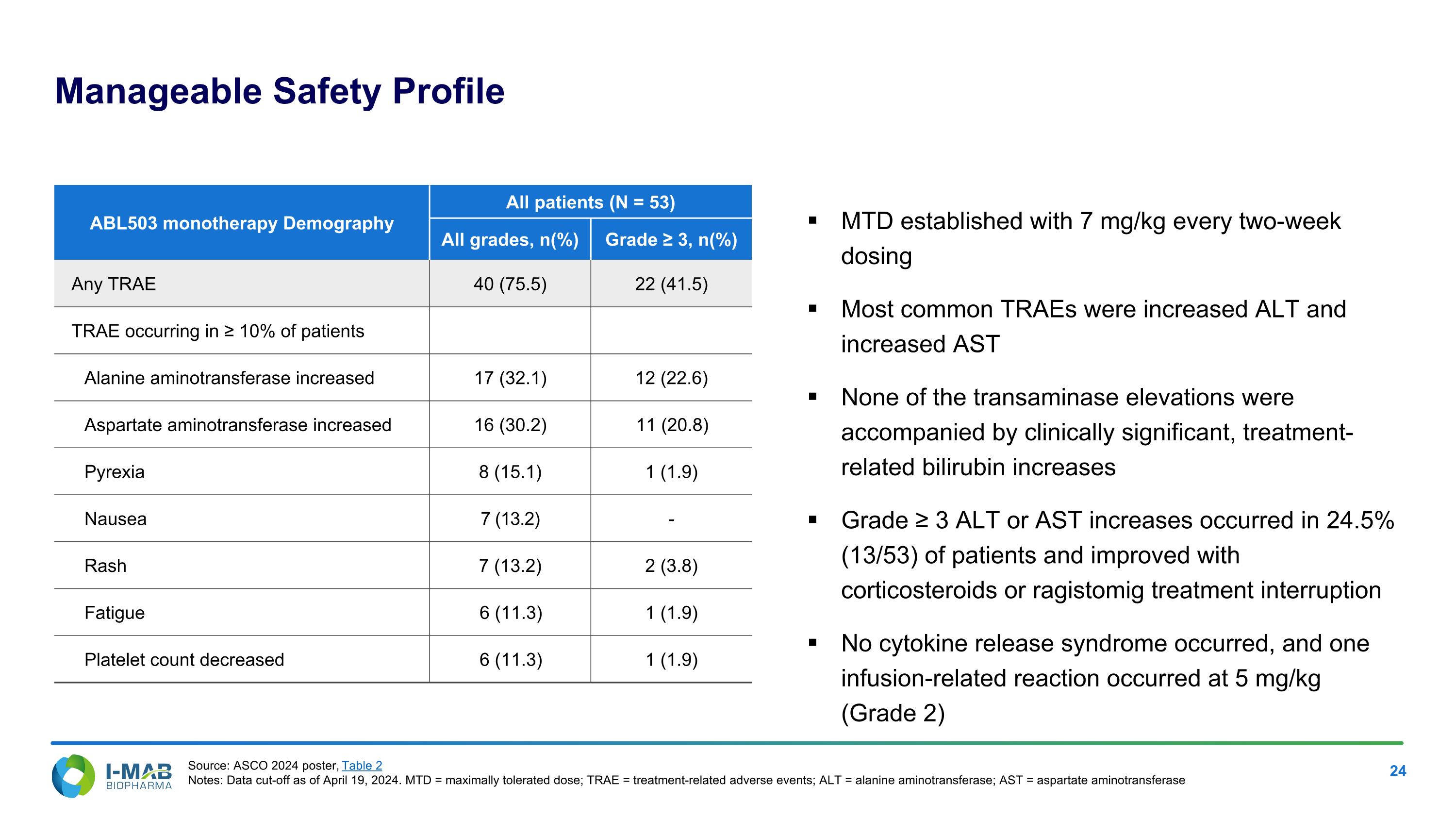
Manageable Safety Profile MTD established with 7 mg/kg every two-week dosing Most common TRAEs were increased ALt and increased ASt None of the transaminase elevations were accompanied by clinically significant, treatment-related bilirubin increases Grade ≥ 3 ALt or ASt increases occurred in 24.5% (13/53) of patients and improved with corticosteroids or ragistomig treatment interruption No cytokine release syndrome occurred, and one infusion-related reaction occurred at 5 mg/kg (Grade 2) ABL503 monotherapy Demography All patients (N = 53) All grades, n(%) Grade ≥ 3, n(%) Any TRAE 40 (75.5) 22 (41.5) TRAE occurring in ≥ 10% of patients Alanine aminotransferase increased 17 (32.1) 12 (22.6) Aspartate aminotransferase increased 16 (30.2) 11 (20.8) Pyrexia 8 (15.1) 1 (1.9) Nausea 7 (13.2) - Rash 7 (13.2) 2 (3.8) Fatigue 6 (11.3) 1 (1.9) Platelet count decreased 6 (11.3) 1 (1.9) Source: ASCO 2024 poster, Table 2 Notes: Data cut-off as of April 19, 2024. MTD = maximally tolerated dose; TRAE = treatment-related adverse events; ALt = alanine aminotransferase; ASt = aspartate aminotransferase
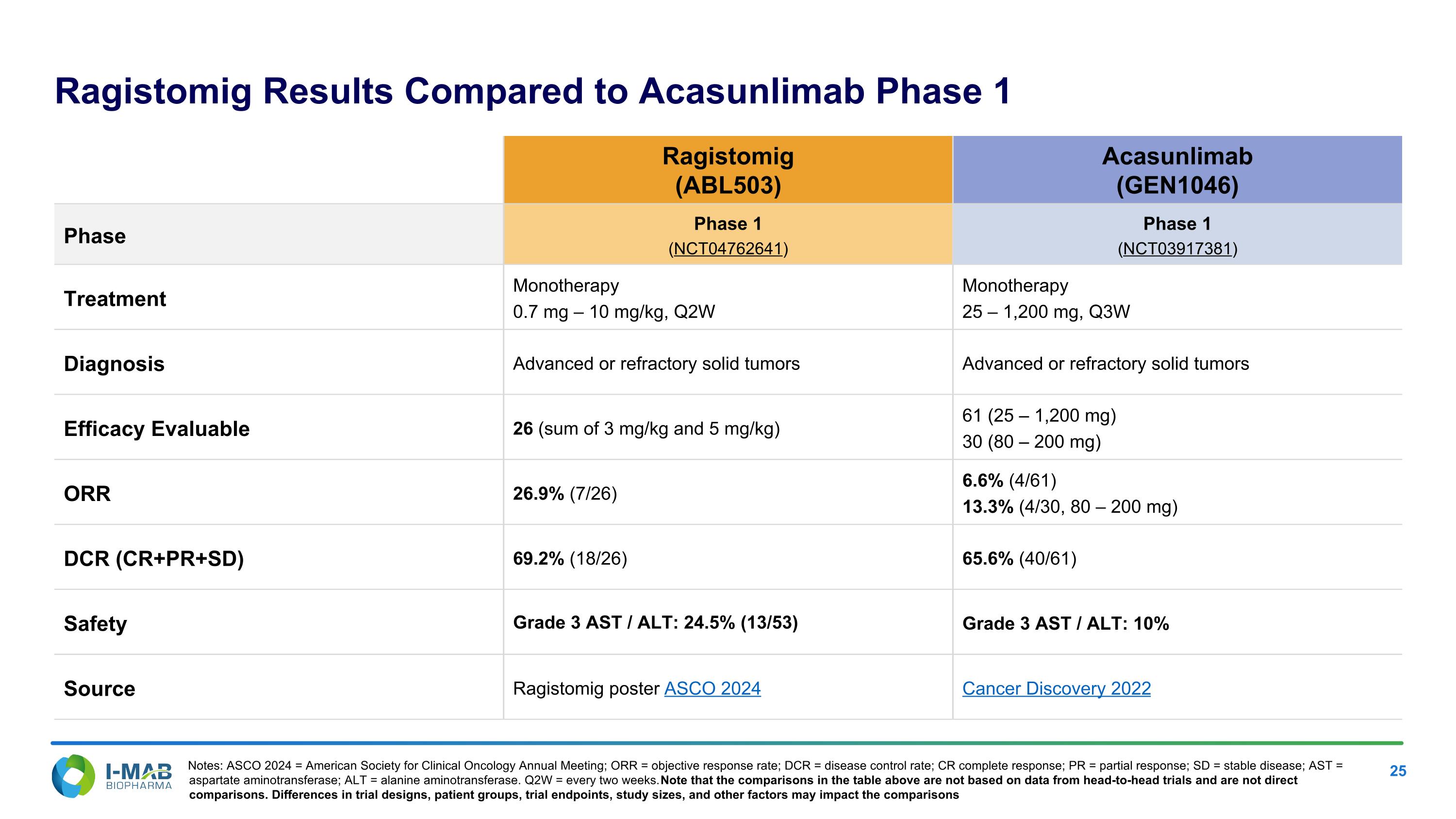
Ragistomig結果與Acasunlimab一期相比 Ragistomig (ABL503) Acasunlimab (GEN1046) 階段 階段1 (NCT04762641) 階段1 (NCT03917381) 治療 單藥治療0.7 mg – 10 mg/kg,Q2W 單藥治療25 – 1,200 mg,Q3W 診斷 晚期或難治性實體腫瘤 晚期或難治性實體腫瘤 療效 可評估26 (3 mg/kg和5 mg/kg的總和) 61 (25 – 1,200 mg) 30 (80 – 200 mg) ORR 26.9% (7/26) 6.6% (4/61) 13.3% (4/30, 80 – 200 mg) DCR (CR+PR+SD) 69.2% (18/26) 65.6% (40/61) 安全性 3級ASt / ALT: 24.5% (13/53) 3級ASt / ALT: 10% 來源 Ragistomig海報 ASCO 2024 Cancer Discovery 2022 註: ASCO 2024 = 美國臨床腫瘤學會年會;ORR = 物客觀響應率;DCR = 疾病控制率;CR 完全響應;PR = 部分響應;SD = 穩定病;ASt = 天冬氨酸轉氨酶;ALt = 丙氨酸轉氨酶。 Q2W = 每兩週一次。請注意,以上表格中的比較並不是基於頭對頭試驗的數據,也不是直接比較。試驗設計、患者群體、試驗終點、研究規模和其他因素的差異可能會影響比較。

截至2024年9月30日,現金、現金等價物及短期投資為18440萬 預期現金賑濟可持續至2027年,支持多個潛在轉折點 已發行及流通的普通股18750萬,等同於8150萬ADS 1 財務信息及即將到來的里程碑 時間表 計劃里程碑 Sep-2024 givastomig 在ESMO 2024上更新一期劑量擴展數據 單藥治療(CLDN18.2+胃癌、GEJ、EAC患者)數據 2025年上半年 uliledlimab 第一名患者加藥於第二期隨機研究,並搭配pembrolizumab + 化療 2025年下半年 uliledlimab 第二期來自uliledlimab + toripalimab隨機研究的PFS數據(TJ Bio中國專屬數據) 2025年下半年 givastomig 階段10億,搭配nivolumab + 化療 201L GC、GEJ、EAC的安全性和ORR數據 選定財務信息 最近及預期即將到來的里程碑 假設將所有普通股轉換為ADS 註: CPI = 檢查點抑制劑;CLDN = Claudin;GC = 胃癌;GEJ = 胃食管交界;EAC = 食管腺癌;ESMO 2024 = 2024年歐洲醫學腫瘤學會年會;PFS = 無進展生存期;ORR = 物客觀響應率

保持聯繫 天境生物 投資者關係 聯絡人 Tyler Ehler 高級董事,投資者關係 IR@imabbio.com